1.本发明涉及医药领域,尤其涉及一种灯盏细辛加生脉有效部位提取物及其制备方法和应用,特别是在制备治疗心脑血管疾病的药物中的应用。
背景技术:
2.近年来,随着我国人口老龄化加速、城市化程度不断加深以及生活方式的逐步改变,疾病谱也发生了重大变化。高血压病、冠心病、糖尿病等慢性非传染性疾病广泛流行,由此导致的血管栓塞引起的各种疾病(包括心脑血管、下肢动脉硬化、血管性痴呆等等的发病率也呈加速上升趋势。
3.本发明治疗心脑血管疾病的处方经筛选优化而形成,是在传统经典方剂生脉散基础上加味,以灯盏细辛、人参、五味子、麦冬为原材料,中成药一般具有民间用药史,但其药效往往因为药味配比的变化而不同,本发明将所有四味原料药经过提取、精制、微粉化处理而制成,该组合属于全新组合物,其中最主要的特征在于富集了现今已知的活性成分,而去除了毒性和非活性成分,使得不增加口服剂量的情况下提高了药效。其中,富集了灯盏细辛中所含的灯盏花素(能扩张微动脉、降低血液粘滞度、改善脑循环)和咖啡酸酯(抗氧化、抗炎、抗病毒抗纤维化、抑制平滑肌收缩、降血脂);五味子中木脂素类成分具有抗炎、抗氧化、抗病毒、舒张血管、保护神经及抑制溃疡等药效作用;麦冬中高异黄酮类化合物具有抗心肌缺血活性;人参中人参皂苷对神经退行性疾病有治疗作用、能改善记忆、保护脑组织等,在心血管系统有抗心律失常、抗心肌肥厚、抗心肌缺血、抗心肌细胞凋亡等作用,在抗肿瘤方面具有诱导细胞凋亡、抑制肿瘤细胞增殖、调控信号通路、调节免疫功能等作用。
技术实现要素:
4.本发明的目的在于提供一种质量可控,稳定性高的灯盏细辛、人参、麦冬、五味子的药用组合物。同时是一种通过各味药的精制得到的各有效成分的组合物。
5.本发明通过下述技术方案予以实施。
6.本发明提供了一种含有灯盏细辛、人参、麦冬和五味子的药用组合物,其特征在于:灯盏细辛药材在该组合物原料中的重量比为,70%《灯盏细辛≤90%,人参、麦冬和五味子在该组合物原料中的重量共计为10-30%。优选地,70%《灯盏细辛≤90%,人参1.5%-7.5%,五味子1.5%-7.5%,麦冬2%-15%;其中,所述人参、麦冬和五味子的重量配比为人参:五味子:麦冬是1:1:2。
7.目前市场上也存在同类的灯盏细辛提取物辅以生脉有效部位的同类技术,但由于其中的工艺与本发明有显著差异,因而导致所得到的有效部位成分及含量差异大。本发明的优势在于由于提取技术升级,能够更好地将四味药中的有效成分群聚集,而去除有害成分和非活性成分,该有效成分组合物对血栓引起的各种疾病尤其是慢性脑缺血性疾病具有较好的效果。
8.在本发明优选实施例中,所述组合物由下列重量配比的原料药制得,灯盏细辛
70.5%-90%,人参3%-7.3%,五味子3%-7.3%,麦冬4%-14.9%。更优选,该组合物由下列重量配比的原料药制得,灯盏细辛71%-85%,人参4.5%-7.2%,五味子4.5%-7.2%,麦冬6-14.6%。
9.更优选,该组合物由下列重量配比的原料药制得,灯盏细辛71.4%-80%,人参5%-7.15%,五味子5%-7.15%,麦冬10-14.3%。
10.更优选,该组合物由下列重量配比的原料药制得,灯盏细辛71.4%-75%,人参6%-7.15%,五味子6%-7.15%,麦冬13-14.3%。
11.本发明的组合物各组分含量的选择应在上述配比范围之内且之和为100%。
12.本发明的药用组合物,该组合物由以下方法制成:
13.取灯盏细辛加水提取,提取液减压浓缩成清膏;清膏加碱调节ph至7-9,滤过,加酸调节ph至1~3,放置过夜,滤过,收集滤液及沉淀,沉淀用乙醇精制,加入碱调节ph至7~8,过滤,喷雾干燥得粉1;酸化的滤液调节ph至7~9,用陶瓷微滤膜进行澄清,澄清后得到的澄清液再用有机纳滤膜进行浓缩,浓缩液通过聚酰胺层析柱,用水洗脱后,用乙醇洗脱,收集乙醇洗脱液,浓缩后调节ph至7~9,过滤,滤液喷雾干燥得粉2;
14.取人参,加乙醇回流提取,滤过,合并滤液,减压浓缩成清膏,人参清膏加3-15倍纯化水配制成人参清液,用陶瓷微滤膜进行澄清,澄清液再用有机纳滤膜进行浓缩,浓缩液备用;
15.取麦冬,加乙醇回流提取,滤过,合并滤液,减压浓缩成浸膏,浸膏加入水沉淀,弃去水层,收集沉淀备用;
16.取五味子,加水煎煮,弃去水溶液,加入乙醇回流提取,滤过,合并滤液,减压浓缩成浸膏,加水后配制成五味子清液用陶瓷微滤膜进行澄清,澄清后得到的澄清液再用有机纳滤膜进行浓缩,得到五味子清膏,清膏用乙酸乙酯萃取,收集乙酸乙酯萃取液,减压浓缩成浸膏备用;
17.将人参浓缩液、麦冬沉淀、五味子浸膏混合溶解,喷雾干燥,得到粉3,将粉1、粉2、粉3合并得到所述的药物组合物。
18.上述工艺方法得到的产品的有益效果与已有的工艺所能达到的效果相比,具有突出的特点和显著的进步。包括灯盏乙素和咖啡酰奎宁酸的灯盏细辛提取物,现有技术提取方法得到的灯盏提取物叶绿素含量高,本发明采用上述工艺后,通过陶瓷微滤膜可以去除大量中性条件下不溶解的大分子杂质叶绿素、鞣质、蛋白质等,使提取液澄清。澄清液再用有机纳滤膜进行浓缩,可以降低浓缩成本,还可以去除大部分焦袂康酸,最大限度地除去了水溶性小分子杂质,和非活性的有关物质;进一步利用柱层析除去了焦袂康酸等难以去除的对人体有害的杂质,保留了活性成分咖啡酸酯,尤其是二咖啡酸酯,提高了有效成分的纯度和得率。
19.本发明具体还提供了上述组合物的制备方法,该方法包括:取灯盏细辛加水提取,提取液减压浓缩成清膏;清膏加碱调节ph至7~9,滤过,加酸调节ph至1~3,放置过夜,滤过,收集滤液及沉淀,沉淀用乙醇精制,加入碱调节ph至7~8,过滤,喷雾干燥得粉1;所述酸化上清液调节ph至7~9,用陶瓷微滤膜进行澄清,澄清后得到的澄清液再用有机纳滤膜进行浓缩,浓缩液通过聚酰胺层析柱,用水洗脱后,用乙醇洗脱,收集乙醇洗脱液,浓缩后调节ph至7~9,喷雾干燥得粉2;取人参,加80-85%乙醇回流提取两次,滤过,合并滤液,减压浓
缩成清膏,人参清膏加3-15倍纯化水配制成人参清液,用陶瓷膜进行澄清,澄清液再用有机纳滤膜进行浓缩,浓缩液备用。取麦冬,加80-85%乙醇回流提取两次,滤过,合并滤液,减压浓缩成浸膏,浸膏加入15倍量水沉淀,弃去水层,收集沉淀备用;
20.取五味子,加水煎煮,弃去水溶液,加入乙醇回流提取,滤过,合并滤液,减压浓缩成浸膏,加水后配制成五味子清液用陶瓷微滤膜进行澄清,澄清后得到的澄清液再用有机纳滤膜进行浓缩,得到五味子清膏,清膏用乙酸乙酯萃取,收集乙酸乙酯萃取液,减压浓缩成浸膏备用;将人参浓缩液、麦冬沉淀、五味子浸膏混合溶解,喷雾干燥,得到粉3,将粉1、粉2、粉3合并得到所述的药物组合物,加入适量辅料,制成所述的口服固体制剂(硬胶囊,软胶囊,片剂,滴丸,口服液或颗粒剂等口服复方药剂)。
21.膜分离技术用于中药和植物水提液直接进行澄清、分级纯化、浓缩,澄清膜可直接去除靴质、胶体、植物纤维、大分子蛋白用细菌等杂质,透过液澄清透、纯度高,浓缩膜可以脱除盐份和水,得到高纯度的浓缩液。其优点是1.降低生产硬件投资建设成本,2.减少工序缩短生产周期,3.物理过程分离无需加热,减少有效成分降解和流失,4.分离精度高,可有效去除悬浮颗粒,菌体,鞣质,胶体,蛋白,淀粉等杂质。而浓缩膜可有效地去除水,无机盐和小分子。
22.根据孔径可分为微滤(孔径大于50nm)、超滤(孔径2~50nm,截留分子量1000-百万)、纳滤(孔径0.5-5nm,截留分子量100-1000)等种类。
23.本专利中澄清膜采用的是陶瓷膜中的微滤膜,陶瓷膜是陶瓷材料经过特殊工艺制备而形成的非对称膜,其优点是可耐强酸碱清洗,也可用蒸汽在线灭菌和高压工作。现在市面上用的陶瓷膜大多数为微滤膜,少数能做到超滤级别。进行分离时,在外力的作用下,小分子物质透过膜,大分子物质被膜截留,从而达到分离、浓缩、纯化、去杂、除菌等目的。陶瓷膜还具有再生费用低,使用寿命长,过程稳定,操作简单等特点,优选孔径为100nm-200nm。
24.本专利所用的浓缩膜为有机纳滤膜,优选300d~400d(d是道尔顿简写)。可以截留≥300d或400d的分子。让水及其他小分子的物质透过,从而达到一定的分离和浓缩效果。
25.本发明的灯盏细辛、人参、麦冬、五味子的药用组合物的制备方法与现有工艺的主要区别为各味药分别提取精制:
26.分别提取精制的主要目的是根据不同类型活性成分的性质,对活性成分进行富集,同时去除有害成分和非活性成分,使进入体内的物质活性更强,治疗效果更佳。而现有提纯方法存在以下技术问题:
27.首先,提出的灯盏花浸膏中叶绿素含量较高,不容易处理干净,不仅影响提取物的颜色,而且即使处理也会影响其他药物提取物的得率和药物效果。
28.然后,也是更主要的,提取物中含有大量有害成分焦袂康酸,需要去除。由于有大量叶绿素存在,上柱时叶绿素附着于树脂上,不易洗脱,并且增加树脂再生的时间和难度。这也是影响药效和安全性的重要原因。
29.现有方法只将灯盏细辛中的黄酮类成分入药,即酸化沉淀物入药,而丢失了其中另一类活性成分咖啡酸酯。
30.因此,单独靠酒精回流来提取,然后碱溶酸化,只将酸化沉淀物入药是一种较粗糙的提取方法,不能很好地将灯盏细辛中的有效成分入药。
31.现有工艺将人参,麦冬,五味子合并提取,正丁醇萃取后入药。正丁醇由于极性较
大,萃取效率低,且沸点高,浓缩不易完全去除,喷干粉中易有残留。影响药品安全性及质量。本发明采用的方法是:
32.取灯盏细辛加水提取,提取液减压浓缩成清膏;清膏加碱调节ph至7~9,滤过,加酸调节ph至1~3,放置过夜,滤过,收集滤液及沉淀,沉淀乙醇精制,加入碱调节ph至7~8,喷雾干燥得粉1。此步骤的目的是提取灯盏细辛中的黄酮成分,主要物质为灯盏花乙素。
33.酸化滤液调节ph至7~9,用陶瓷微滤膜进行澄清,可以去除大量中性条件下不溶解的大分子杂质;澄清后得到的澄清液再用有机纳滤膜进行浓缩,一则可以降低浓缩成本,二则可以去除大部分焦袂康酸,这是由于焦袂康酸的水溶性远高于脂溶性,且分子量较小,仅112。膜浓缩液以1:1柱体积的量上30-60目的酰胺层析柱,吸附过夜后,用水洗脱4个柱体积后,用55-75%乙醇洗脱,收集乙醇洗脱液,浓缩后调节ph至7~9,喷雾干燥得粉2。此步骤是为了进一步去除焦袂康酸,富集所需要的咖啡酸酯类成分,尤其是二咖啡酸酯类成分。这一步很关键,保证了提取物的高药物活性。
34.取人参,加80~85%乙醇回流提取两次,滤过,合并滤液,减压浓缩成清膏,人参清膏加3-15倍纯化水配制成人参清液,用陶瓷微滤膜进行澄清,澄清液再用有机纳滤膜进行浓缩,浓缩液备用。这一步骤有效去除了人参提取液中蛋白淀粉等大分子不溶性杂质及小分子水溶性物质,富集的人参皂苷rg1,rb1和re等成分。取麦冬,加80~85%乙醇回流提取两次,滤过,合并滤液,减压浓缩成浸膏,浸膏加入15倍量水沉淀,弃去水层,收集沉淀备用。富集麦冬中麦冬黄烷酮及皂苷类成分,除多糖类成分,此类成分在后期喷雾干燥影响大,如果多了,喷粉失败。
35.取五味子,加水煎煮一次,弃去水溶液,去除有机酸类成分,加入80~85%乙醇回流提取两次,滤过,合并滤液,减压浓缩成浸膏,加水后配制成五味子清液用陶瓷微滤膜进行澄清,澄清后得到的澄清液再用有机纳滤膜进行浓缩,得到五味子清膏,清膏用乙酸乙酯萃取,收集乙酸乙酯萃取液,减压浓缩成浸膏备用。先用陶瓷膜进行澄清的目的是去除大分子的杂质,例如鞣质,蛋白等,后用有机膜浓缩一是可以降低浓缩成本,二是可以将小分子的水溶性物质去除,例如苹果酸、酒石酸、原儿茶酸、奎宁酸等,用膜浓缩后再萃取,可以提高萃取效率,以达到富集五味子中木脂素类成分的目的。
36.将人参浓缩液,麦冬浸膏,五味子浸膏合并,加水溶解,喷雾干燥得粉3,将粉1,2,3,加入适量辅料,制成硬胶囊,软胶囊,片剂,滴丸,口服液或颗粒剂等口服复方药剂。
37.方法中用倍量水稀释,是以重量计。
38.该组合物中,按重量百分比计算含黄酮的灯盏细辛提取物粉1与含4,5-二-o-咖啡酰奎宁酸的灯盏细辛总咖啡酸酯提取物粉2占50-55%,含人参,麦冬,五味子的提取物粉3占44-49%。
39.在上述的药物组合物的组分制法中,所述的碱调节溶液ph值用的是naoh、na2co3,nahco3、koh、k2co3或者khco3;所述的酸调节溶液ph值用的是hcl、h2so4或者h3po4;所述的聚酰胺层析柱所用乙醇洗脱的乙醇浓度为50-95%。
40.本发明还提供了一种含有上述药用组合物的制剂,该制剂为口服固体制剂,该制剂还含有药学可接受的辅料,药用组合物占该制剂重量百分比的70-99%,余量为辅料。该口服制剂优选为胶囊剂。
41.本发明还提供了一种由以下方法得到的药物组合物:
42.取灯盏细辛加水提取,提取液减压浓缩成清膏;清膏加碱溶解,调节ph至7-9,滤过,加酸调节ph至1~3,放置过夜,滤过,收集滤液及沉淀,沉淀用乙醇精制,加入碱调节ph至7~8,过滤,喷雾干燥得粉1;所述酸化上清液调节ph至7~9,用澄清膜(陶瓷微滤膜)进行澄清,澄清后得到的澄清液再用浓缩膜(有机纳滤膜)进行浓缩,浓缩液通过聚酰胺层析柱,用水洗脱后,用乙醇洗脱,收集乙醇洗脱液,浓缩后调节ph至7~9,喷雾干燥得粉2;
43.取人参,加乙醇回流提取,滤过,合并滤液,减压浓缩成清膏,人参清膏加3-15倍纯化水配制成人参清液,用陶瓷膜进行澄清,澄清液再用有机纳滤膜进行浓缩,浓缩液备用。取麦冬,加乙醇回流提取,滤过,合并滤液,减压浓缩成浸膏,浸膏加入水沉淀,弃去水层,收集沉淀备用;
44.取五味子,加水煎煮,弃去水溶液,加入乙醇回流提取,滤过,合并滤液,减压浓缩成浸膏,加水后配制成五味子清液用陶瓷膜进行澄清,澄清后得到的澄清液再用有机膜进行浓缩,得到五味子清膏,清膏用乙酸乙酯萃取,收集乙酸乙酯萃取液,减压浓缩成浸膏备用将人参浓缩液,麦冬沉淀,五味子浸膏分别溶解,喷雾干燥,得到粉3,将粉1、粉2、粉3合并得到所述的药物组合物。
45.以上原料配比含量优选灯盏细辛70.5%-90%,人参3%-7.3%,五味子3%-7.3%,麦冬4%-14.9%。更优选,灯盏细辛71%-85%,人参4.5%-7.2%,五味子4.5%-7.2%,麦冬6-14.6%。
46.本发明的工艺方法得到的有益效果与已有的工艺所能达到的效果相比,具有显著的特点和进步。灯盏细辛提取物,其中包括灯盏乙素和咖啡酰奎宁酸,现有技术提取方法得到的灯盏提取物叶绿素含量高,叶绿素是非活性物质,而咖啡酸酯部分被弃去,本发明采用水提浸膏碱溶酸化后,酸化沉淀物为黄酮类成分先沉淀下来,再将酸化上清液调节ph至7~9,用陶瓷膜进行澄清,可以去除大量中性条件下不溶解的大分子杂质;澄清后得到的澄清液再用有机膜进行浓缩,一则可以降低浓缩成本,二则可以去除大部分焦袂康酸,这是由于焦袂康酸的水溶性远高于脂溶性。膜浓缩液通过聚酰胺层析柱,用水洗脱后,用乙醇洗脱,收集乙醇洗脱液,进行聚酰胺柱梯度洗脱,最大限度地除去了水溶性杂质,和非活性的有关物质,而保留了活性成分咖啡酸酯,尤其是二咖啡酸酯;由于提取溶媒用水,较大程度提取了有效物质,通过陶瓷膜去除大部分不溶于水的大分子杂质,例如叶绿素、蛋白、鞣质,又通过有机膜去除小分子水溶性成分,尤其是焦袂康酸。进一步利用柱层析除去了焦袂康酸等难以去除的对人体有害的杂质,提高了有效成分的纯度和得率。现有技术提取方法得到的人参、麦冬、五味子提取物,具有如下缺点:所有三味一起提取后再用正丁醇萃取,正丁醇萃取,萃取效率低,由于正丁醇与水的互溶性大,容易乳化,尤其回收后的正丁醇含水量大,萃取效率低,且萃取出来的成分非活性成分多,即杂质多,正丁醇本身由于沸点较高,因而回收时所用能源高,且容易有残留。本发明采用分提法,其中人参采用醇提膜过滤浓缩,主要富集其中人参皂苷类成分;麦冬采用醇提水沉法主要富集高异黄酮类及麦冬皂苷类成分而去除寡糖类成分;五味子采用先水提一次,去除有机酸类物质,然后再醇提,先通过澄清膜去除大分子的成分,有机浓缩膜去除水溶性的酸性成分,再采取乙酸乙酯萃取,主要富集其中木脂素类成分。这样精制过程得到的喷干粉明确有效成分含量得以提高,活性物质的纯度提高,并且很容易控制有效成分的含量,使得批间一致性和药品的稳定性都有了较大提高。
47.本发明还提供了上述药物组合物制得的药物制剂,例如胶囊、片剂、口服液等,参照常规的制剂工艺,加入和适量的辅料,例如胶囊,加入的辅料占胶囊总重的1-30%,经过常规的装胶囊工艺,得到了含有本发明药用组合物的胶囊。
48.本发明还提供了上述药用组合物在制备治疗缺血性心脑血管疾病的药物中的应用,尤其是慢性缺血性心脑血管疾病,这些疾病包括心脑血管疾病、下肢动脉硬化、脑梗塞、中风、冠心病、高血脂、血管型痴呆、其他认知功能障碍等,可以用来防治缺血性心脑血管疾病、下肢动脉硬化闭塞症、血管性认知功能障碍和其他认知障碍。
49.通过改善现有制备工艺(现有工艺给药组-灯盏生脉药典方法和组方(现有工艺),发明工艺给药组-实施例1)
50.1.1实验动物
51.雄性sd大鼠,200只,体重300g
±
25g,购买于北京维通利华实验动物技术有限公司。饲养于中国医学科学院药物研究所无特殊病原体级动物实验中心,12小时光照/黑暗循环,恒温恒湿(23
±
2℃,55
±
5%)条件下饲养,于实验前饲养适应两周。实验动物可自由饮水进食,研究遵守中国医学科学院药物研究所动物实验伦理委员会制定的规程。
52.1.2标准品及试剂
53.水,去离子水,杭州娃哈哈公司产品;戊巴比妥钠,sigma-aldrich公司产品,分析纯;水合氯醛,国药集团化学试剂有限公司,分析纯;甲醛,国药集团化学试剂有限公司,分析纯;超氧化物歧化酶(sod)和丙二醛(mda)测定试剂盒,购自南京建成试剂公司;bca蛋白质定量试剂盒,购自thermo fisher scientific公司;生理盐水,四川科伦药业股份有限公司;灯盏生脉喷干粉(批号:20150110)由云南生物谷药业股份有限公司提供。
54.1.3仪器设备
55.morris水迷宫装置(型号dms-2),由中国医学科学院药物研究所研制;光吸收酶标仪,tecan公司产品;mettler toledo十万分之一电子天平,瑞士梅特勒公司产品。
56.大鼠在适应环境两周后开始动物实验。慢性脑缺血损伤大鼠模型的制备采用双侧颈总动脉结扎(2vo)法。实验用大鼠术前禁食12小时,禁水4小时,麻醉剂为2%戊巴比妥钠水溶液,给药剂量为60mg/kg,腹腔注射麻醉。将麻醉后的大鼠仰卧位固定在鼠板上,酒精棉球消毒后切开颈部正中的皮肤,钝性分离各层组织,尤其避免损伤迷走神经和气管。将双侧颈总动脉暴露并分离,采用5.0号丝线结扎,0号丝线缝合。假手术组只做“颈总动脉暴露并分离”,不进行结扎,之后用0号丝线缝合。手术后3周进行morris水迷宫定位航行训练实验,持续5天,考察模型是否建立成功,并对造模大鼠进行筛选。筛选标准为:(平均潜伏期-参考值)/平均潜伏期》0.2(其中参考值是假手术组大鼠潜伏期的均值,平均潜伏期是指造模大鼠潜伏期的平均值),即认为此大鼠出现认知障碍,造模成功。
57.将造模成功的大鼠随机分为模型组和模型给药两组,加上假手术组共3组。每组大鼠14只,其中10只用于脂质组学和极性小分子代谢组学分析,4只用于病理切片分析。模型给药组持续灌胃给予灯盏生脉喷干粉(0.72g/kg,i.g.)30天,给药期最后5天进行morris水迷宫测试判断灯盏生脉是否产生药效。morris水迷宫测试包括定位航行训练实验进行5天,空间探索实验于最后一天定位航行训练实验结束后进行。
58.morris水迷宫测试
59.采用的morris水迷宫装置为中国医学科学院药物研究所研制,型号为dms-2。水迷
宫直径1.2m,高0.5m,圆筒形,内壁黑色,划分为4个象限,内部有一直径10cm的黑色平台,位于第三象限水下1cm处,内部水温控制在22-25℃。
60.(1)定位航行实验:每天上午、下午分别对实验大鼠训练一次。上午将大鼠置于第一象限边缘1/2处,头朝池壁入水,记录到达平台的时问。若60s后仍未到达,则将其引导至平台并放置20s;自行找到平台的大鼠,让其保持在平台上的状态20s。下午将大鼠置于第四象限边缘1/2处放入,其他实验同上所述。
61.(2)空间探索实验:撤去平台,将大鼠置于第一象限边缘1/2处,头朝池壁入水,记录大鼠第一次到达平台位置的时间。若未到达平台,记录大鼠在60s内在目标象限的停留时间,即有效停留时间,以衡量其空间学习记忆能力。整个实验过程中保持外部环境一致,如实验室内灯光、物品摆放等,并控制实验操作人员不超过2人,以排除外部因素干扰。
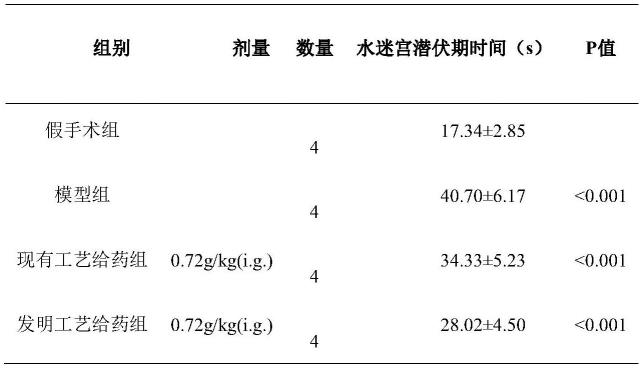
62.在水迷宫定位航行实验中,灯盏生脉对morris水迷宫训练检测后大鼠潜伏期的影响见表1。模型组与假手术组的潜伏期时间比较具有显著性差异(p《0.001),表明造模成功;灯盏生脉给药组与模型组的潜伏期时间比较具有显著性差异(p《0.001),表明灯盏生脉给药组与模型组相比,具有良好的改善大鼠学习和记忆能力的药效。
63.表1.灯盏生脉对morris水迷宫训练检测后大鼠潜伏期的影响
[0064][0065]
注:p值为t检验结果,模型组p值为模型组vs假手术组;给药组p值为灯盏生脉组vs模型组
[0066]
空间探索实验为第6天撤去平台记录大鼠从入水到第一次到达平台位置的时间、穿越平台次数和60s内在目标象限的停留时间,即有效停留时间,作为衡量其空间学习记忆能力的指标,结果见表2。模型组与假手术组的有效停留时间、首次找到平台时间和找到平台次数比较,均具有显著性差异(p《0.01),表明造模成功;灯盏生脉给药组与模型组的有效停留时间、首次找到平台时间和找到平台次数比较均具有显著性差异(p《0.05),表明灯盏生脉给药组与模型组相比具有良好的改善大鼠学习和记忆能力的药效。
[0067]
表2.灯盏生脉胶囊对morris水迷宫检测中撤台后空间探索能力的影响
[0068][0069]
注:p值为t检验结果,模型组p值为vs假手术组;给药组p值为vs模型组
[0070]
查阅相关文献可知,空间航行训练是一种联合型学习,所形成的记忆是空间参考记忆,啮齿类动物在完成空间学习和记忆任务时,涉及了大量脑区和神经传导路径,至少有海马、皮层、纹状体、基底前脑、小脑的参与。海马区细胞在定向航行实验中被认为是空间学习记忆的原始基础,海马齿状回的突触后电位增强(ltp)最长可保持几个星期,这正是学习记忆所需要的,海马区细胞在早期记忆形成过程中发挥重要作用;而在空间探索实验中则更多需要海马区和皮层区等部位细胞联合作用,皮层损伤对长时记忆的储存具有较大影响。在定位航行实验中灯盏生脉给药组和模型组潜伏期时间具有显著性差异,表明药物对于海马区损伤细胞均有一定的修复作用;在空间探索实验中灯盏生脉给药组和模型组数据具有显著性差异,表明其具有良好的药效。
[0071]
生化指标数据分析
[0072]
测试方法
[0073]
将大鼠血浆及脑组织样本于4℃化冻,脑组织样本使用生理盐水匀浆,分别按照说明书进行超氧化物歧化酶(superoxide dismutase,sod)活力和丙二醛(malondialdehyde,mda)含量的测定。sod测定采用的是黄嘌呤氧化酶法,mda测定采用的是硫代巴比妥酸沉淀法,具体操作依据试剂盒说明书进行。
[0074]
慢性脑缺血是一个机制复杂的损伤过程,包括氧化应激反应、炎性反应、能量代谢异常、神经递质紊乱、神经元受损等。氧化应激主要表现为活性氧化物(reactive oxide species,ros)生成增加和清除自由基能力下降,使组织里堆积大量的自由基,造成对组织和细胞的损害。生理状态下,机体氧化和抗氧化系统处于动态平衡。sod是机体内的主要抗氧化酶,能保护细胞免受活性氧化物的损伤,sod含量的高低可反映机体清除自由基和活性氧化物的能力。mda是机体脂质过氧化作用的产物,其含量的高低可反应组织细胞受自由基攻击的损伤程度,因此测定sod和mda可以评价2vo慢性脑缺血大鼠模型以及灯盏生脉的药效。
[0075]
生化指标测定数据(表3)表明,脑组织及血浆的mda含量均以2vo大鼠脑缺血模型组为最高,模型给药组则有下降趋势,模型组与假手术组相比具有显著性差异(p《0.05),模型给药组与模型组相比具有显著性差异(p《0.05)。sod活度值均以模型组为最低,给药后有上升趋势,模型组与假手术组相比具有显著性差异(p《0.05);模型给药组与模型组相比具有显著性差异(p《0.05)。生化指标测定数据表明,双侧颈总动脉永久性结扎造模后,大鼠脑组织产生明显的氧化应激损伤,模型给药后mda含量较模型组降低,sod活性明显升高,表明灯盏生脉具有一定的改善氧化应激损伤的作用。
[0076]
表3.大鼠血浆和脑组织中生化指标结果
[0077][0078][0079]
结论:
[0080]
采用双侧颈总动脉永久性结扎法(2vo)建立慢性脑缺血大鼠模型,将大鼠分为假手术、模型,现有工艺给药和发明工艺给药四组,模型给药组持续灌胃给予灯盏生脉(dzsm)30天后,进行药效学评价。造模后脑组织海马ca1区细胞明显损伤,灯盏生脉给药后细胞损伤明显改善,发明工艺组优于现有工艺组;水迷宫行为学测试数据显示,灯盏生脉具有改善慢性脑缺血损伤大鼠学习和记忆能力的效果,发明工艺组优于现有工艺组;生化指标分析数据表明,大鼠脑缺血损伤后产生一定的氧化应激损伤,灯盏生脉给药后具有一定的改善氧化应激损伤的效果,发明工艺组优于现有工艺组。行为学、生化指标以及病理切片的评价结果表明:模型建立成功且在给药期间保持稳定,灯盏生脉给药后对脑缺血损伤具有显著改善作用,发明工艺组优于现有工艺组。
[0081]
本方法与常规方法相比,即使使用相同配比的组合物,所得到的化学活性成分和杂质的含量也具有很大区别,特别是活性成分,例如野黄芩苷,4,5-二-o-咖啡酰奎宁酸,人参皂苷和五味子醇甲等指标,在总混粉中的含量,均提高率为20%以上,而且,各种杂质,例如叶绿素,焦袂康酸、多糖及鞣质类最低可去除90%以上。而灯盏生脉胶囊的药典工艺所述的灯盏细辛的提取过程与其他三味药分别提取,其中灯盏细辛仅是乙醇提取后,碱溶酸化,得到沉淀。并且只用了沉淀入药,灯盏细辛中另一类有效成分咖啡酸酯类的直接被丢弃,而含量测定中又需要测定4,5-二-o-咖啡酰奎宁酸的含量,也存在不合理的因素。
[0082]
因此使用新技术制备方法所制备的制剂,如胶囊等,富集了活性成分,减少了杂质,能够更好的提高药效,节省了资源,并提高了药品质量的可控性,增加了药品的有效性和安全性。
[0083]
表4.灯盏细辛酸化上清液调ph后膜过滤后成分含量变化表
[0084][0085]
从表4可以看出,灯盏细辛酸化上清液调节ph接近中性后过澄清膜和纳滤浓缩膜后有效物质二咖啡酸酯得到较好地保留,而有害物质焦袂康酸的去除84%。
[0086]
表5.五味子提取液过膜前后五味子醇甲含量变化
[0087]
品名代表量(l)含量(mg/ml)总量(g)五味子提取液1000.2727.00
微滤澄清膜处理后1250.1721.25纳滤浓缩膜处理后32.10.5718.30
[0088]
从表5可以看出,五味子醇甲在过澄清膜和浓缩膜后总含量保持67%以上。
[0089]
表6.人参提取液过膜前后人参皂苷含量变化
[0090][0091]
从表6可以看出,人参提取液中人参皂苷rg1,rb1和re通过膜澄清和浓缩后得到较大程度的保留,分别保留了95%,89%和96%。
具体实施方式:
[0092]
实施例1:原料药提取物制备
[0093]
取灯盏细辛2000g加水煎煮两次,每次2小时,滤过,合并滤液,减压浓缩成清膏,清膏搅拌下加入5%氢氧化钠溶液,调节ph至7.5~8.5,滤过,加10%硫酸溶液调节ph至1~3,放置过夜,滤过,收集滤液及沉淀,沉淀乙醇精制,后加入5%氢氧化钠调节ph至7~8,喷雾干燥得粉1;酸化的滤液调节ph至7~9,用100nm陶瓷膜进行澄清,澄清后得到的澄清液再用350d有机膜进行浓缩,浓缩液通过30-60目聚酰胺层析柱(直径与长度比1:4),用水洗脱3个柱体积后,用65%乙醇洗脱4个柱体积,收集乙醇洗脱液,浓缩后调节ph至7~9,喷雾干燥得粉2;
[0094]
取人参200g,加80~85%乙醇回流提取两次,滤过,合并滤液,减压浓缩成浸膏,加10倍水稀释,用100nm陶瓷膜进行澄清,澄清液用350d有机膜进行浓缩,得浓缩液备用。
[0095]
取麦冬400g,加80~85%乙醇回流提取两次,滤过,合并滤液,减压浓缩成浸膏,浸膏加入12-15倍量水沉淀,弃去水层,收集沉淀备用。
[0096]
取五味子200g,加水煎煮一次,水提一次倒掉为了去掉大部分的有机酸,否则提取物太多,不利于富集木质素,弃去水溶液,加入80~85%乙醇回流提取两次,滤过,合并滤液,减压浓缩成浸膏,加水后配制成五味子清液用100nm陶瓷膜进行澄清,澄清后的澄清液再用350d有机膜进行浓缩,得到五味子清膏,清膏用乙酸乙酯萃取,收集乙酸乙酯萃取液,减压浓缩成浸膏备用。将人参浓缩液,麦冬沉淀,五味子浸膏混合溶解,喷雾干燥后,得粉3,将粉1、2、3混合均匀,得棕色原料提取物144g。
[0097]
所得粉1中野黄芩苷含量为520mg/g,得粉1,34g;粉2中含4,5-二-o-咖啡酰奎宁酸35mg/g,得粉2,43g;粉3含人参皂苷rg1 re 5.5mg/g,五味子醇甲3.8mg/g,得粉3,67g。粉1、2、3混合后野黄芩苷含量在129mg/g,4,5-二-o-咖啡酰奎宁酸12.8mg/g,人参皂苷rg1 re 2.4mg/g,五味子醇甲3.9mg/g。
[0098]
实施例2:原料药提取物制备
[0099]
取灯盏细辛3000g加入水煎煮两次,每次2小时,滤过,合并滤液,减压浓缩成清膏;清膏在搅拌下加入5%氢氧化钠溶液,调节ph至7~9,滤过,加10%盐酸溶液调节ph至1~3,
放置过夜,滤过,收集滤液及沉淀,沉淀乙醇精制,加入5%氢氧化钠调节ph至7~8,喷雾干燥得粉1;
[0100]
酸化的滤液调节ph至7~9,用200nm陶瓷膜进行澄清,澄清后得到的澄清液再用400d有机膜进行浓缩,浓缩液通过30-60目聚酰胺层析柱(直径与长度比1:4),用3个柱体积的水洗脱后,用3个柱体积的70%乙醇洗脱,收集乙醇洗脱液,浓缩后调节ph至7~9,喷雾干燥得粉2;
[0101]
取人参200g,加80~85%乙醇回流提取两次,滤过,合并滤液,减压浓缩成清膏,加6倍水稀释,用200nm陶瓷膜进行澄清,澄清液用400d有机膜进行浓缩,得浓缩液备用。。取麦冬400g,加80~85%乙醇回流提取两次,滤过,合并滤液,减压浓缩成浸膏,浸膏加入15倍量水沉淀,弃去水层,收集沉淀备用。取五味子200g,加水煎煮一次,弃去水溶液,加入80~85%乙醇回流提取两次,滤过,合并滤液,减压浓缩成浸膏,加水后配制成五味子清液用200nm陶瓷膜进行澄清,澄清后的澄清液再用400d有机膜进行浓缩,得到五味子清膏,清膏用乙酸乙酯萃取,收集乙酸乙酯萃取液,减压浓缩成浸膏备用。将人参浓缩液,麦冬沉淀,五味子浸膏加水溶解,喷雾干燥后,得粉3,将粉1,2,3混合均匀,得棕色原料提取物171g。
[0102]
所得粉1中野黄芩苷含量为478mg/g,得粉1,42g;粉2中含4,5-二-o-咖啡酰奎宁酸36mg/g,粉2:53g;粉3含人参皂苷rg1 re 5.1mg/g,五味子醇甲4.2mg/g,得粉3,76g。粉1、2、3混合后,野黄芩苷含量在117mg/g,4,5-二-o-咖啡酰奎宁酸16mg/g,人参皂苷rg1 re2.3mg/g,五味子醇甲1.9mg/g。
[0103]
实施例3:原料药提取物制备
[0104]
取灯盏细辛2500g加水煎煮两次,每次2小时,滤过,合并滤液,减压浓缩成清膏;清膏搅拌下加入5%氢氧化钠溶液,调节ph至7.5~9.0,滤过,加10%硫酸溶液调节ph至1~3,放置过夜,滤过,收集滤液及沉淀,沉淀乙醇精制,加入5%氢氧化钠调节ph至7~8,喷雾干燥得粉1;
[0105]
酸化的滤液调节ph至7~9,用100nm陶瓷膜进行澄清,澄清后得到的澄清液再用300d有机膜进行浓缩,浓缩液通过30-60目聚酰胺层析柱(直径与长度比1:4),用3.5个柱体积水洗脱后,用3个柱体积的75%乙醇洗脱,收集乙醇洗脱液,浓缩后调节ph至7~9,喷雾干燥得粉2;
[0106]
取人参200g,加80~85%乙醇回流提取两次,滤过,合并滤液,减压浓缩成浸膏,加8倍水稀释,用100nm陶瓷膜进行澄清,澄清液用300d有机膜进行浓缩,得浓缩液备用。
[0107]
取麦冬400g,加80~85%乙醇回流提取两次,滤过,合并滤液,减压浓缩成浸膏,浸膏加入15倍量水沉淀,弃去水层,收集沉淀备用。取五味子200g,加水煎煮一次,弃去水溶液,加入80~85%乙醇回流提取两次,滤过,合并滤液,减压浓缩成浸膏,加水后配制成五味子清液用100nm陶瓷膜进行澄清,澄清后的澄清液再用300d有机膜进行浓缩,得到五味子清膏,清膏用乙酸乙酯萃取,收集乙酸乙酯萃取液,减压浓缩成浸膏备用。将人参浸膏,麦冬沉淀,五味子浸膏加水溶解,喷雾干燥后,得粉3,将粉1,2,3混合均匀,得棕色原料提取物166g。所得粉1中野黄芩苷含量:530mg/g,得粉1,38g,粉2中含4,5-二-o-咖啡酰奎宁酸38mg/g,得粉2,47g;粉3含人参皂苷rg1 re 5.2mg/g,五味子醇甲6.3mg/g,得粉3,81g。粉1、2、3混合后,野黄芩苷含量在121mg/g,4,5-二-o-咖啡酰奎宁酸10.8mg/g,人参皂苷rg1 re 2.5mg/g,五味子醇甲3.1mg/g。
[0108]
实施例4:胶囊的制备
[0109]
取实施例1制备的提取物128g,加入淀粉52g,混匀,填充胶囊中,即得。
[0110]
实施例5:胶囊的制备
[0111]
取实施例2制备的提取物151g,加入淀粉29g,混匀,填充胶囊中,即得。
[0112]
实施例6:胶囊的制备
[0113]
取实施例1制备的提取物142g,加入淀粉34g,硬脂酸镁4g混匀,填充胶囊中,即得。
[0114]
实施例7:片剂的制备
[0115]
取实施例2制备的提取物151g,淀粉100g,糊精10g,过14目筛制粒,60-70℃通风干燥,加硬脂酸镁3g。压制成片,包衣即得。
[0116]
实施例8:滴丸的制备
[0117]
取实施例3制备的提取物15g,投入45g,聚乙二醇4000,混合均匀,熔融,滴入低温液体石蜡中,选丸,除液体石蜡,即得。
[0118]
实施例9:口服液的制备
[0119]
取实施例1制备的提取物20g,与蜂蜜300g、蔗糖50g、苯甲酸钠2g及蒸馏水300ml混合,加热溶解,保温过滤,即得。
[0120]
实施例10:颗粒剂的制备
[0121]
取实施例3制备的提取物9g,与40g微晶纤维素混合均匀,加3%聚维酮乙醇溶液制软材,过18目筛制颗粒,600℃干燥30~45分钟,整粒,加入4g滑石粉,混匀,整粒,装袋,即得。
[0122]
实施例11:质量标准试验
[0123]
本药物组合物实施例1,不仅是因为组合物配比的原因,还因为本发明中提供了一种新型的药物制备方法,为进一步证明所述制备方法的高效性,特与常规混合酒精回流,正丁醇萃取方法进行技术对比,所得数据如下:
[0124]
表7.本发明所采用实施例1的配方提取工艺对比
[0125][0126]
因此,根据此类的比较,新方法将总提取物粉减少的同时,有效成分的含量不减少,但更进一步用上了灯盏细辛里的活性成分咖啡酸酯类。由于常规方法不用咖啡酸酯类成分,而具有肝毒性的焦袂康酸是包含在咖啡酸酯类成分中(酸化上清液中),所以常规方法也检测不到焦袂康酸。所述各项活性成分在喷干粉中的占比由于杂质成分的减少均有40%以上的提高,杂质降低了超过30%,具有显著的技术进步,必将提高药效和药品的安全性,获取意想不到的技术效果,本制备方法具有创新性。同样使用相同的中药组合,使用本方法制得的制剂,在制备相同数量制剂的基础上,可以做得更小,增加药品的顺应性。用同
样量的药粉配药则能增加有效成分的占比,使药效更强。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。