1.本技术涉及中药成分测定技术领域,特别是涉及一种测定乌梅中化学成分含量的方法。
背景技术:
2.乌梅,为蔷薇科植物梅(prunus mume(sieb.)sieb.etzuce.)的干燥近成熟果实,具有敛肺、涩肠、生津、安蛔等功效,常用于治疗肺虚久咳、久泻久痢、虚热消渴、蛔厥呕吐腹痛。乌梅在食品领域和药品领域中的应用广泛,其质量会影响其应用的安全性,因此建立一种测定乌梅中多种化学成分含量的方法,以能够更加可信、全面地对乌梅进行质量控制。
技术实现要素:
3.本技术的目的在于提供一种测定乌梅中化学成分含量的方法,能够测定乌梅中16种化学成分的含量,可用于乌梅的质量控制。
4.本技术提供了一种测定乌梅中化学成分含量的方法,其采用超高效液相色谱-质谱联用,测定乌梅中化学成分的含量;所述化学成分包括:琥珀酸、l-苹果酸、原儿茶醛、原儿茶酸、咖啡酸、d-奎宁酸、柠檬酸、阿魏酸、丁香酸、隐绿原酸、新绿原酸、绿原酸、苦杏仁苷、山楂酸、科罗索酸和芦丁;所述方法包括:
5.(1)建立各化学成分的标准曲线:
6.以90-100vol%甲醇为溶剂,配制5-12个含有不同已知浓度的各化学成分的混合对照品溶液;其中,琥珀酸浓度为2.7-3000ng/ml,l-苹果酸浓度为2.5-30000ng/ml,原儿茶醛浓度为0.5-1500ng/ml,原儿茶酸浓度为2.6-3000ng/ml,咖啡酸浓度为0.8-1500ng/ml,d-奎宁酸浓度为9.5-30000ng/ml,柠檬酸浓度为40-60000ng/ml,阿魏酸浓度为0.1-1500ng/ml,丁香酸浓度为0.3-1500ng/ml,隐绿原酸浓度为5-15000ng/ml,新绿原酸浓度为2.2-18000ng/ml,绿原酸浓度为1.6-15000ng/ml,苦杏仁苷浓度为2.9-25000ng/ml,山楂酸浓度为0.2-1500ng/ml,科罗索酸浓度为0.2-1500ng/ml,芦丁浓度为0.3-1500ng/ml;
7.在相同的色谱条件和质谱条件下,将体积为v1的各混合对照品溶液分别注入超高效液相色谱仪中,通过质谱检测,根据各化学成分的特征离子峰确定各化学成分的色谱峰,并获得各化学成分的色谱峰面积;
8.以各化学成分色谱峰的峰面积为纵坐标,以各化学成分的浓度为横坐标,分别建立各化学成分的标准曲线;
9.(2)获得待测样品中各化学成分的色谱峰面积:
10.取质量为m的待测样品,以体积为v2的70-90vol%甲醇为溶剂进行提取,取上清液过滤后得到第一待测样品溶液,其中,m/v2为(1-3):1mg/ml;
11.取第一待测样品溶液,以70-90vol%甲醇为溶剂,稀释n倍,得到第二待测样品溶液,n为40-60;
12.在与步骤(1)中相同的色谱条件和质谱条件下,取体积为v1的第一待测样品溶液
注入超高效液相色谱仪中,通过质谱检测,根据各化学成分的特征离子峰确定各化学成分的色谱峰,并获得除柠檬酸外的各化学成分的色谱峰面积;
13.取体积为v1的第二待测样品溶液注入超高效液相色谱仪中,通过质谱检测,根据柠檬酸的特征离子峰确定柠檬酸的色谱峰,并获得柠檬酸的色谱峰面积;
14.(3)确定待测样品中各化学成分的含量:
15.根据已建立的各化学成分的标准曲线,由待测样品中各化学成分的色谱峰面积,分别获得各化学成分的浓度c1,按照公式c=c1
×
v2/m分别计算出待测样品中除柠檬酸外的各化学成分的含量c,按照公式c’=c1
×n×
v2/m计算出待测样品中柠檬酸的含量c’。
16.本技术提供的一种测定乌梅中化学成分含量的方法,采用超高效液相色谱-质谱联用技术(uhplc-ms/ms),通过合理选择色谱条件和质谱条件,可以测定乌梅中16种化学成分的含量,且所述方法具有简便、灵敏度高、分析速度快、专属性强等优势,从而能够可信、全面、准确地用于乌梅的质量控制。
附图说明
17.为了更清楚地说明本技术实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本技术的一些实施例,对于本领域普通技术人员来讲,还可以根据这些附图获得其他的实施例。
18.图1a为实施例1中第6个混合对照品溶液中16种化学成分的多反应离子监测图;
19.图1b为批次8的乌梅中16种化学成分的多反应离子监测图;
20.图中各数字标号分别代表:1.琥珀酸;2.l-苹果酸;3.原儿茶醛;4.原儿茶酸;5.咖啡酸;6.d-奎宁酸;7.柠檬酸;8.阿魏酸;9.丁香酸;10.隐绿原酸;11.新绿原酸;12.绿原酸;13.苦杏仁苷;14.山楂酸;15.科罗索酸;16.芦丁。
具体实施方式
21.下面将结合本技术实施例中的附图,对本技术实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本技术一部分实施例,而不是全部的实施例。基于本技术中的实施例,本领域普通技术人员基于本技术所获得的所有其他实施例,都属于本技术保护的范围。
22.本技术提供了一种测定乌梅中化学成分含量的方法,其采用超高效液相色谱-质谱联用,测定乌梅中化学成分的含量;所述化学成分包括:琥珀酸、l-苹果酸、原儿茶醛、原儿茶酸、咖啡酸、d-奎宁酸、柠檬酸、阿魏酸、丁香酸、隐绿原酸、新绿原酸、绿原酸、苦杏仁苷、山楂酸、科罗索酸和芦丁;所述方法包括:
23.(1)建立各化学成分的标准曲线:
24.以90-100vol%甲醇为溶剂,配制5-12个含有不同已知浓度的各化学成分的混合对照品溶液;其中,琥珀酸浓度为2.7-3000ng/ml,l-苹果酸浓度为2.5-30000ng/ml,原儿茶醛浓度为0.5-1500ng/ml,原儿茶酸浓度为2.6-3000ng/ml,咖啡酸浓度为0.8-1500ng/ml,d-奎宁酸浓度为9.5-30000ng/ml,柠檬酸浓度为40-60000ng/ml,阿魏酸浓度为0.1-1500ng/ml,丁香酸浓度为0.3-1500ng/ml,隐绿原酸浓度为5-15000ng/ml,新绿原酸浓度为
2.2-18000ng/ml,绿原酸浓度为1.6-15000ng/ml,苦杏仁苷浓度为2.9-25000ng/ml,山楂酸浓度为0.2-1500ng/ml,科罗索酸浓度为0.2-1500ng/ml,芦丁浓度为0.3-1500ng/ml;
25.在相同的色谱条件和质谱条件下,将体积为v1的各混合对照品溶液分别注入超高效液相色谱仪中,通过质谱检测,根据各化学成分的特征离子峰确定各化学成分的色谱峰,并获得各化学成分的色谱峰面积;
26.以各化学成分色谱峰的峰面积为纵坐标,以各化学成分的浓度为横坐标,分别建立各化学成分的标准曲线;
27.(2)获得待测样品中各化学成分的色谱峰面积:
28.取质量为m的待测样品,以体积为v2的70-90vol%甲醇为溶剂进行提取,取上清液过滤后得到第一待测样品溶液,其中,m/v2为(1-3):1mg/ml;
29.取第一待测样品溶液,以70-90vol%甲醇为溶剂,稀释n倍,得到第二待测样品溶液,n为40-60;
30.在与步骤(1)中相同的色谱条件和质谱条件下,取体积为v1的第一待测样品溶液注入超高效液相色谱仪中,通过质谱检测,根据各化学成分的特征离子峰确定各化学成分的色谱峰,并获得除柠檬酸外的各化学成分的色谱峰面积;
31.取体积为v1的第二待测样品溶液注入超高效液相色谱仪中,通过质谱检测,根据柠檬酸的特征离子峰确定柠檬酸的色谱峰,并获得柠檬酸的色谱峰面积;
32.(3)确定待测样品中各化学成分的含量:
33.根据已建立的各化学成分的标准曲线,由待测样品中各化学成分的色谱峰面积,分别获得各化学成分的浓度c1,按照公式c=c1
×
v2/m分别计算出待测样品中除柠檬酸外的各化学成分的含量c,按照公式c’=c1
×n×
v2/m计算出待测样品中柠檬酸的含量c’。
34.本技术中,所述90-100vol%甲醇是指体积分数≥90%的甲醇水溶液或纯甲醇溶液;所述70-90vol%甲醇是指体积分数为70-90%的甲醇水溶液。
35.本技术提供的一种测定乌梅中化学成分含量的方法,采用超高效液相色谱-质谱联用技术,通过合理选择色谱条件和质谱条件,能够实现乌梅中16种化学成分含量的测定。
36.在本技术的一些实施方式中,所述混合对照品溶液中,琥珀酸、原儿茶酸浓度分别为5-2500ng/ml,l-苹果酸、d-奎宁酸浓度分别为50-25000ng/ml,原儿茶醛、咖啡酸、阿魏酸、丁香酸、山楂酸、科罗索酸、芦丁浓度分别为2-1000ng/ml,柠檬酸浓度为100-50000ng/ml,隐绿原酸、绿原酸浓度分别为20-10000ng/ml,新绿原酸浓度为25-12500ng/ml,苦杏仁苷浓度为40-20000ng/ml。
37.本技术对混合对照品溶液的配制方式没有特别的限定,只要能够实现本技术的目的即可,例如可以先配制混合对照品储备液,其中各成分的浓度大于等于所述混合对照品溶液中各化学成分的浓度,然后通过稀释获得所述混合对照品溶液。
38.在本技术的一些实施方式中,在步骤(1)中,以90-100vol%甲醇为溶剂,配制含有各化学成分的混合对照品储备液,所述混合对照品储备液中,琥珀酸、原儿茶酸浓度分别为2500-3000ng/ml,l-苹果酸、d-奎宁酸浓度分别为25000-30000ng/ml,原儿茶醛、咖啡酸、阿魏酸、丁香酸、山楂酸、科罗索酸、芦丁浓度分别为1000-1500ng/ml,柠檬酸浓度为50000-60000ng/ml,隐绿原酸、绿原酸浓度分别为10000-15000ng/ml,新绿原酸浓度为12500-18000ng/ml,苦杏仁苷浓度为20000-25000ng/ml;
39.以90-100vol%甲醇为溶剂稀释所述混合对照品储备液,获得所述5-12个含有不同已知浓度的各化学成分的混合对照品溶液。
40.其中,用于配制所述混合对照品储备液的溶剂和用于稀释所述混合对照品储备液的溶剂可以相同,也可以不同,优选地,用于配制所述混合对照品储备液的溶剂和用于稀释所述混合对照品储备液的溶剂相同,更优选地,用于配制所述混合对照品储备液的溶剂和用于稀释所述混合对照品储备液的溶剂为甲醇。
41.本技术中,所用于建立标准曲线的混合对照品溶液可包括所述混合对照品储备液;本技术对所述混合对照品储备液的配制没有特别的限定,只要能够实现本技术的目的即可,示例性地,可通过优先单独配制各化学成分的储备液,再分别取各化学成分的储备液,配制所述混合对照品储备液。
42.在本技术的一些实施方式中,在步骤(2)中,所述提取为超声提取,提取功率为100-300w,提取频率为30-50khz,提取时间为20-60min。
43.通过采用本技术待测样品溶液的制备方法,实现获得包括16种化学成分的待测样品溶液,使得乌梅中化学成分含量的检测结果更加全面、准确、可信;其中,通过超声提取,获得包括16种化学成分的第一待测样品溶液,用于测定除柠檬酸外的各化学成分含量;基于乌梅中柠檬酸的高含量,将第一待测样品溶液稀释,得到第二待测样品溶液,用于测定柠檬酸的含量,使得柠檬酸含量的检测结果更准确。
44.在本技术的一些实施方式中,所述色谱条件包括:色谱柱:十八烷基硅烷键合硅胶色谱柱;流动相:a相为体积分数为0.05-0.15%的甲酸水溶液,b相为甲醇;采用体积分数17-90%a相,10-83%b相,梯度洗脱;流速:0.1-0.5ml/min;柱温:15-25℃;进样体积v1:1-5μl。
45.优选地,所述色谱条件包括:流动相:a相为体积分数为0.08-0.12%的甲酸水溶液,b相为甲醇;流速:0.2-0.4ml/min;柱温:18-22℃;进样体积v1:1-3μl。
46.发明人在研究中发现,采用本技术的梯度洗脱,能够使乌梅中16种化学成分获得更好的分离效果,优选地,在本技术的一些实施方式中,所述梯度洗脱具体为:0-5min,10-40%b;5-5.5min,40-80%b;5.5-7min,80-83%b;7-14min,83-83%b。
47.本技术中对质谱的种类没有特别的限定,只要能够实现本技术的目的即可,例如可以采用三重四级杆质谱。为了有效获得色谱分离后的各化学成分的特征离子峰,以便于获得更准确的各化学成分的鉴定结果,在本技术的一些实施方式中,所述质谱为三重四级杆质谱,所述质谱条件包括:离子源为电喷雾离子源,检测模式为多反应离子监测(mrm),负离子扫描模式;干燥气温度:250-350℃;干燥气流速:5-10l/min;雾化器压力:30-40psi;鞘气温度:300-400℃;鞘气流速:8-15l/min;毛细管电压:3000-4000v。
48.优选地,所述质谱条件包括:干燥气温度:280-320℃;干燥气流速:6-8l/min;雾化器压力:34-36psi;鞘气温度:330-370℃;鞘气流速:10-12l/min;毛细管电压:3300-3700v。
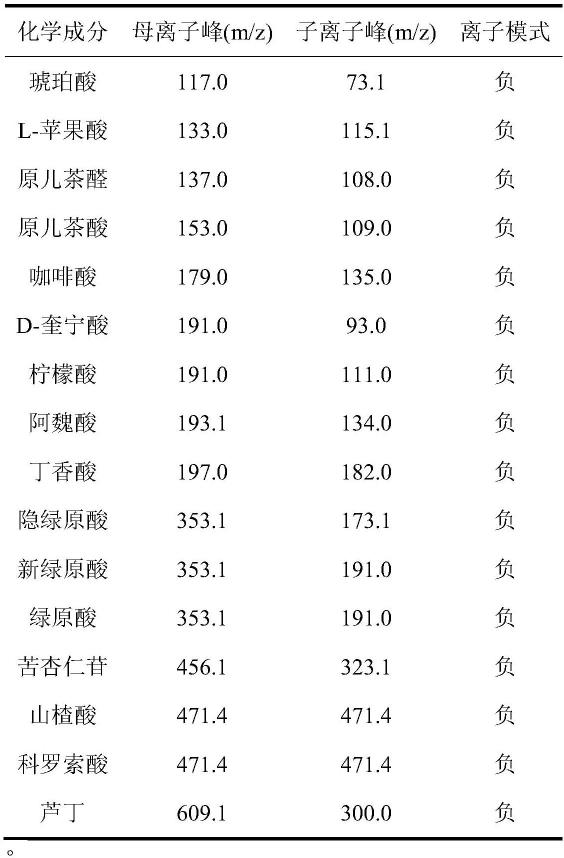
49.在本技术的一些实施方式中,所述各化学成分的特征离子峰包括:
[0050][0051]
下面对本技术所需的仪器和试剂进行说明。
[0052]
仪器:agilent 6470三重四级杆质谱仪(美国agilent公司);agilent 1290超高效液相色谱仪(美国agilent公司);agilent masshunter分析软件(美国agilent公司);as 60/220.r2型十万分之一天平(波兰radwag公司);milli-q-7005超纯水制备仪(millipore公司);5453高速离心机(德国eppendorf公司);s0200涡旋混合器(美国labnet公司);zz-l6dt超声清洗槽(天津知著科技有限公司)。
[0053]
试剂:甲醇(色谱纯)购自美国fisher公司,甲酸(色谱纯)购自美国roe公司,超纯水由milli-q超纯水制备仪制备。
[0054]
材料:对照品:琥珀酸(批号:dstdh002001)、l-苹果酸(批号:dst201124-038)、原儿茶醛(批号:dst200628-080)、原儿茶酸(批号:dstdy008101)、咖啡酸(批号:dst191030-013)、d-奎宁酸(批号:dst200822-045)、柠檬酸(批号:dst200402-031)、阿魏酸(批号:dst191112-001)、丁香酸(批号:dst200927-057)、隐绿原酸(批号:dstdy003501)、新绿原酸(批号:dstdx001501)、绿原酸(批号:dstdl002101)、山楂酸(批号:dst200313-039)、科罗索酸(批号:dst191010-005)、芦丁(批号:dst181101-017)购自成都德思特生物技术有限公司;苦杏仁苷(批号:xgzs-23hh)购自于中国食品药品检定研究院。乌梅分别购自于云南、四川,10个批次乌梅的信息(产地、批号)如表1所示。
[0055]
表1 10个批次乌梅的信息
[0056][0057]
以下实施例中所涉及的试剂与药材如无特殊说明均可来源于市售或按照本领域公知方法取得。
[0058]
实施例1
[0059]
(1)建立各化学成分的标准曲线:
[0060]
精密称取对照品琥珀酸、l-苹果酸、原儿茶酸、d-奎宁酸、柠檬酸各1.0mg,分别加水溶解,配制成浓度均为1mg/ml的各对照品储备液,置于4℃冰箱储存备用;精密称取对照品原儿茶醛、咖啡酸、阿魏酸、丁香酸、隐绿原酸、新绿原酸、绿原酸、苦杏仁苷、山楂酸、科罗索酸、芦丁各1.0mg,分别加甲醇溶解,配制成浓度均为1mg/ml的各对照品储备液,置于4℃冰箱储存备用。
[0061]
精确量取各对照品储备液适量,用甲醇配制成混合对照品储备液,其中,柠檬酸浓度为50000ng/ml,l-苹果酸、d-奎宁酸浓度为25000ng/ml,苦杏仁苷浓度为20000ng/ml,新绿原酸浓度为12500ng/ml,隐绿原酸、绿原酸浓度为10000ng/ml,琥珀酸、原儿茶酸浓度为2500ng/ml,原儿茶醛、咖啡酸、阿魏酸、丁香酸、山楂酸、科罗索酸、芦丁浓度为1000ng/ml;将混合对照品储备液用甲醇依次稀释2、2.5、2、2.5、2、2.5、2、2倍,得到包含混合对照品储备液在内的9个含有不同已知浓度的各化学成分的混合对照品溶液。
[0062]
在相同的色谱条件和质谱条件下,分别取2μl各混合对照品溶液注入超高效液相色谱仪中,通过质谱检测,根据各化学成分的特征离子峰确定各化学成分的色谱峰,并获得各化学成分的色谱峰面积;
[0063]
其中,所述色谱条件包括:色谱柱:acquity uplc beh c18(2.1
×
100mm,1.7μm,waters);流动相:a相为体积分数为0.1%的甲酸水溶液,b相为甲醇;梯度洗脱,梯度为:0-5min,10-40%b;5-5.5min,40-80%b;5.5-7min,80-83%b;7-14min,83-83%b;流速:0.3ml/min;柱温:20℃;进样体积v1:2μl;
[0064]
所述质谱为三重四级杆质谱,所述质谱条件包括:离子源为电喷雾离子源,检测模式为多反应离子监测,负离子扫描模式;干燥气温度:300℃;干燥气流速:7l/min;雾化器压力:35psi;鞘气温度:350℃;鞘气流速:11l/min;毛细管电压:3500v;16种化学成分的特征
离子峰及相应质谱参数如表2所示。
[0065]
表2 16种化学成分的特征离子峰及相应质谱参数
[0066][0067][0068]
以各化学成分色谱峰的峰面积(y)为纵坐标,以各化学成分的浓度(x)为横坐标,用加权最小二乘法进行回归计算,权重系数为1/x,分别建立各化学成分的标准曲线,得到各化学成分的线性方程及相关系数r;将第9个混合对照品溶液逐步稀释,以信噪比s/n=10时各对照品的浓度作为各化学成分的最低定量限(lloq),结果见表3,其中,第6个混合对照品溶液中16种化学成分的多反应离子监测(mrm)图如图1a所示,可见16种化学成分之间互不干扰,各化学成分的色谱峰对称性良好,分离度高。
[0069]
表3 16种化学成分的标准曲线及最低定量限
[0070][0071]
(2)获得待测样品中各化学成分的色谱峰面积:
[0072]
精密称取表1中批次1的50.0mg乌梅粉末(过60目筛,筛孔内径0.3mm)置于锥形瓶中,加入25ml 80vol%甲醇,超声提取40min,提取功率180w,提取频率40khz,超声后取出放至室温,80vol%甲醇补足失重,取1ml该溶液,14000r/min离心10min,取上清液用0.22μm有机微孔滤膜过滤,续滤液即为第一待测样品溶液,置于4℃冰箱储存备用;将第一待测样品溶液用80vol%甲醇稀释50倍,得到第二待测样品溶液。重复制备3份批次1乌梅的第一待测样品溶液和第二待测样品溶液。
[0073]
在与步骤(1)中相同的色谱条件和质谱条件下,取2μl的第一待测样品溶液注入超高效液相色谱仪中,通过质谱检测,根据各化学成分的特征离子峰确定各化学成分的色谱峰,并获得除柠檬酸外的各化学成分的色谱峰面积;
[0074]
在与步骤(1)中相同的色谱条件和质谱条件下,取2μl的第二待测样品溶液注入超高效液相色谱仪中,通过质谱检测,根据柠檬酸的特征离子峰确定柠檬酸的色谱峰,并获得柠檬酸的色谱峰面积;
[0075]
(3)确定待测样品中各化学成分的含量:
[0076]
根据已建立的各化学成分的标准曲线,由待测样品中各化学成分的色谱峰面积,分别获得各化学成分的浓度c1,按照公式c=c1
×
v2/m=c1
×
25ml/50mg分别计算出批次1的乌梅中除柠檬酸外的各化学成分的含量c,按照公式c’=c1
×n×
v2/m=c1
×
50
×
25ml/50mg计算出批次1的乌梅中柠檬酸的含量c’,得到批次1的乌梅中16种化学成分的含量结果如表4所示,基于1ng/mg=1μg/g,将乌梅中各化学成分含量的单位以μg/g表示。
[0077]
实施例2-10
[0078]
除了分别取表1中批次2至批次10的乌梅替换实施例1中批次1的乌梅外,其余与实施例1相同,分别得到批次2至批次10的乌梅中16种化学成分的含量,结果见表4,其中,批次8的乌梅中16种化学成分的多反应离子监测图如图1b所示。
[0079]
表4 10个批次乌梅中16种化学成分的含量(μg/g)(n=3)
[0080][0081][0082]
方法学验证
[0083]
精密度
[0084]
日内精密度:精密称取批次8的乌梅粉末50.0mg,按实施例1的方法制备第一待测样品溶液,按实施例1的色谱条件和质谱条件进样分析,连续进样6次,记录除柠檬酸外的各化学成分的峰面积;按实施例1的方法制备第二待测样品溶液,按实施例1的色谱条件和质谱条件进样分析,连续进样6次,记录柠檬酸的峰面积;分别计算16种化学成分峰面积的平均值及相对标准偏差(rsd)值,结果见表5,可见rsd值均≤5.0%,表明本技术的方法日内精密度良好。
[0085]
日间精密度:精密称取批次8的乌梅粉末50.0mg,按实施例1的方法制备第一待测样品溶液,按实施例1的色谱条件和质谱条件进样分析,重复进样2次,连续进样三天,记录除柠檬酸外的各化学成分的峰面积;按实施例1的方法制备第二待测样品溶液,按实施例1的色谱条件和质谱条件进样分析,重复进样2次,连续进样三天,记录柠檬酸的峰面积;分别
计算16种化学成分峰面积的平均值及rsd值,结果见表6,可见rsd值均≤6.0%,表明本技术的方法日间精密度良好。
[0086]
表5 16种化学成分的日内精密度(n=6)
[0087][0088][0089]
表6 16种化学成分的日间精密度(n=6)
[0090][0091][0092]
重复性
[0093]
精密称取批次8的乌梅粉末6份,每份50.0mg,按实施例1的方法制备第一待测样品溶液,分别按实施例1的色谱条件和质谱条件进样分析,记录除柠檬酸外的各化学成分的峰面积;分别按实施例1的方法制备第二待测样品溶液,按实施例1的色谱条件和质谱条件进样分析,记录柠檬酸的峰面积;根据实施例1中各化学成分的标准曲线,分别计算16种化学成分的浓度,并计算各化学成分浓度的平均值及rsd值,结果见表7,可见rsd值均≤5.9%,表明本技术的方法重复性较好。
[0094]
表7 16种化学成分的重复性(ng/ml,n=6)
[0095][0096][0097]
稳定性
[0098]
精密称取批次8的乌梅粉末50.0mg,按实施例1的方法制备第一待测样品溶液,按实施例1的色谱条件和质谱条件,分别于0、2、4、8、12、24h进样分析,记录除柠檬酸外的各化学成分的峰面积;按实施例1的方法制备第二待测样品溶液,按实施例1的色谱条件和质谱条件,分别于0、2、4、8、12、24h进样分析,记录柠檬酸的峰面积;分别计算16种化学成分峰面积的平均值及rsd值,结果见表8,可见rsd值均≤7.1%,表明乌梅中16种化学成分在室温放置24h条件下稳定性良好。
[0099]
表8 16种化学成分的稳定性(n=6)
[0100][0101]
加样回收率
[0102]
精密称取批次8的乌梅粉末6份,每份25.00mg;配制16种化学成分的各标准品溶液,各化学成分浓度分别为:柠檬酸10mg/ml,l-苹果酸、d-奎宁酸、隐绿原酸、新绿原酸、绿原酸、苦杏仁苷1mg/ml,琥珀酸、原儿茶酸、咖啡酸、山楂酸、科罗索酸、芦丁100μg/ml,原儿茶醛、阿魏酸、丁香酸10μg/ml;分别取各标准品溶液:柠檬酸530μl、l-苹果酸27μl、d-奎宁酸155μl、隐绿原酸68μl、新绿原酸75μl、绿原酸40μl、苦杏仁苷100μl、琥珀酸15μl、原儿茶酸16μl、咖啡酸19μl、山楂酸16μl、科罗索酸36μl、芦丁19μl、原儿茶醛44μl、阿魏酸54μl、丁香酸75μl,加至待测样品中,各化学成分的加入值如表9所示,用80vol%甲醇定容至25ml,按实施例1的方法制备各加标样品的第一待测样品溶液,分别按实施例1的色谱条件和质谱条件进样分析,记录除柠檬酸外的各化学成分的峰面积;分别按实施例1的方法制备各加标样品的第二待测样品溶液,按实施例1的色谱条件和质谱条件进样分析,记录柠檬酸的峰面积;根据实施例1中各化学成分的标准曲线,分别计算各加标样品中16种化学成分的浓度,得到各加标样品中16种化学成分的含量,根据加样回收率(%)=(测得值-原始值)/加入值
×
100%计算各加标样品的加样回收率,并计算各化学成分的加样回收率的平均回收率及rsd值,结果见表9,表9结果显示16种化学成分的平均回收率在88.8%-110.4%之间,可见rsd值均≤6.4%,表明本技术的方法准确度良好。
[0103]
表9 16种化学成分的加样回收率(n=6)
[0104][0105][0106]
稀释效应
[0107]
精密吸取实施例1中浓度均为1mg/ml的各对照品储备液,配制成含柠檬酸浓度500μg/ml,l-苹果酸、d-奎宁酸浓度250μg/ml,苦杏仁苷浓度200μg/ml,新绿原酸浓度125μg/ml,隐绿原酸、绿原酸浓度100μg/ml,琥珀酸、原儿茶酸浓度25μg/ml,原儿茶醛、咖啡酸、阿魏酸、丁香酸、山楂酸、科罗索酸、芦丁浓度10μg/ml的混合对照品储备液;取该混合对照品储备液分别稀释20、50、100倍,每个倍数稀释6份,按实施例1的色谱条件和质谱条件分别进样分析,记录各化学成分的峰面积,根据实施例1中各化学成分的标准曲线,分别计算各稀释倍数下的16种化学成分的浓度,并计算浓度的平均值和rsd值,根据相对误差(re,%)=(平均值-测得值)/测得值
×
100%计算re值,结果见表10,根据表10可知re的绝对值均≤7.3%,rsd值均≤6.9%,进一步表明本技术的方法准确度较好。
[0108]
表10 16种化学成分的稀释效应(n=6)
[0109]
[0110][0111]
综上,本技术建立uhplc-ms/ms分析方法,能够测定不同炮制方法下的乌梅中琥珀酸、l-苹果酸、原儿茶醛、原儿茶酸、咖啡酸、d-奎宁酸、柠檬酸、阿魏酸、丁香酸、隐绿原酸、新绿原酸、绿原酸、苦杏仁苷、山楂酸、科罗索酸、芦丁16种化学成分的含量,此方法简便、灵敏度高、分析速度快、专属性强。
[0112]
以上所述仅为本技术的较佳实施例,并非用于限定本技术的保护范围。凡在本技术的精神和原则之内所作的任何修改、等同替换、改进等,均包含在本技术的保护范围内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。