1.本发明属于食品加工技术领域,具体涉及一种毛酸浆发酵果汁及其制备方法与应用。
背景技术:
2.毛酸浆(physalis pubescens l.)为茄科(solanaceae)酸浆属(physalis l.)一年生草本类植物。该植物起源于拉丁美洲,后传入中国,成为东北地区的季节性特色浆果。由于毛酸浆果实饱满圆润,犹如姑娘的肌肤,宿萼又如同盖住姑娘的面纱,故在东北及山东地区有“菇娘”、“黄菇娘”及“美人果”等别名。毛酸浆营养丰富,功效成分高,生物活性显著。
3.目前益生菌的益生功能研究不断深入,越来越多的益生菌发酵食品被开发出来。由于新鲜的果蔬贮藏期一般较短,因此传统发酵果蔬制品应运而生。多数传统发酵制品都是通过果实表面附着的微生物进行天然发酵,并通过高浓度的盐来抑制其他有害菌的生长,发酵周期往往较长并且过程可控性差。随着对益生菌的认识不断加深,人们开始有意识的筛选具有某些特定益生功能的益生菌对果蔬进行发酵,并通过改善发酵条件缩短发酵周期,以获得目标发酵果蔬制品。不同果蔬所含成分复杂且差异大,益生菌在果蔬中的发酵特性和机理都不同。
4.目前植物乳酸菌饮料在市场中已形成一种流行趋势。可以预测,未来几年植物乳酸菌饮料将迎来井喷式发展。利用益生菌对果蔬汁进行发酵,不仅可以提升果蔬的健康属性,更可以综合提升果蔬的应用价值。
技术实现要素:
5.本发明的目的在于提供一种毛酸浆发酵果汁及其制备方法与应用。本发明毛酸浆发酵果汁具有丰富的多酚、黄酮和多糖,香气层次丰富持久,且具有提高机体免疫力和改善肠道菌群的功效。
6.为实现上述目的,本发明采取的技术方案为:一种毛酸浆发酵果汁的制备方法,包括以下步骤:
7.(1)将毛酸浆果去萼洗净,打浆过滤,得毛酸浆果原汁;
8.(2)在上述毛酸浆果原汁中接种发酵菌剂,于35~40℃发酵55~65小时,得所述毛酸浆发酵果汁。
9.作为本发明所述毛酸浆发酵果汁的制备方法的优选实施方式,所述发酵菌剂为干酪乳杆菌、肠膜明串珠菌、发酵乳杆菌、嗜酸乳杆菌和植物乳杆菌中的至少一种。研究表明,利用益生菌对果蔬进行发酵,能将益生菌的益生功能与果蔬的营养功能有效的结合起来,还能够赋予果蔬新的风味。经过发酵后的果蔬汁会增加不同的风味物质。本技术发明人经过大量的实验筛选,探究干酪乳杆菌、肠膜明串珠菌、发酵乳杆菌、嗜酸乳杆菌和植物乳杆菌作为发酵菌剂对毛酸浆果汁进行发酵,探究其对毛酸浆发酵果汁中的营养成分、活性物质及风味物质的影响。结果表明,上述5中发酵菌使得毛酸浆发酵果汁的营养物质、活性物
质和抗氧化能力都明显增加,并拥有花香、果香和蔬菜香味的不同风味层次。其中发酵乳杆菌和植物乳杆菌效果最佳。
10.作为本发明所述毛酸浆发酵果汁的制备方法的优选实施方式,所述发酵菌剂的添加量为所述毛酸浆果原汁质量的1%。
11.作为本发明所述毛酸浆发酵果汁的制备方法的优选实施方式,所述步骤(1)打浆过滤之后还对毛酸浆果原汁进行消毒灭菌。
12.作为本发明所述毛酸浆发酵果汁的制备方法的优选实施方式,所述消毒灭菌采用巴氏杀菌。
13.本发明还提供一种毛酸浆发酵果汁,所述果汁采用上述毛酸浆发酵果汁的制备方法制备而成。
14.本发明还提供所述毛酸浆发酵果汁在制备具有提高免疫力的食品或保健品中的应用。研究表明,益生菌作为一种对宿主健康有益的活微生物,是天然的免疫调节剂。益生菌通过控制肠道微生物群、免疫参数和肠道通透性发挥其功效;也通过产生生物活性或调控代谢产物来影响其他器官。本技术发明人经过大量的实验发现,本发明的毛酸浆发酵果汁能够促进小肠粘液中分泌型免疫球蛋白siga,刺激血清中免疫球蛋白(iga)和免疫球蛋白g(igg),以及细胞因子白细胞介素2(il-2)和白细胞介素6(il-6)的表达,对机体免疫系统有有效的调节与保护作用。
15.本发明还提供所述的毛酸浆发酵果汁在制备具有修复小肠绒毛损伤的食品或保健品中的应用。本技术发明人经过大量的实验发现,环磷酰胺可使小肠绒毛受到损害,本发明的毛酸浆发酵果汁可修复其对小肠绒毛的损伤。
16.本发明还提供所述的毛酸浆发酵果汁在制备具有改善肠道菌群的食品或保健品中的应用。研究表明,肠道生态系统是具有复杂性和高度特征的微生物群落,肠道菌群的不平衡就会破坏正常的代谢途径,削弱免疫系统。有多项研究发现经乳酸菌发酵后的果蔬制品可调节肠道菌群平衡。而一些乳酸菌能够耐受人体胃肠道环境,定植于人肠道内,改善人体肠道菌群的构成,抑制有害菌,从而发挥其生理功能。本技术发明人经过大量的实验发现,本发明的毛酸浆发酵果汁可显著调节小鼠的肠道菌群环境,使益生菌增多,且能更好地附着于肠道内壁,使宿主可更好地对摄入的食物进行吸收和消化。
17.本发明的有益效果:本发明提供了一种毛酸浆发酵果汁,通过对益生菌及发酵条件的的筛选,获取适宜的发酵参数,使得毛酸浆发酵果汁的营养物质、活性物质和抗氧化能力都明显增加,并拥有花香、果香和蔬菜香味的不同风味层次;本发明的毛酸浆发酵果汁能够促进小肠粘液中分泌型免疫球蛋白siga,刺激血清中免疫球蛋白(iga)和免疫球蛋白g(igg),以及细胞因子白细胞介素2(il-2)和白细胞介素6(il-6)的表达,对机体免疫系统有有效的调节与保护作用;本发明的毛酸浆发酵果汁可显著调节肠道菌群环境,使益生菌增多,且能更好地附着于肠道内壁,使宿主可更好地对摄入的食物进行吸收和消化。
附图说明
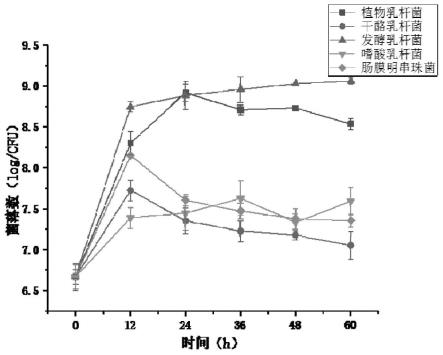
18.图1为不同益生菌发酵毛酸浆果汁过程中菌落数的变化。
19.图2为不同益生菌发酵毛酸浆果汁过程中ph的变化。
20.图3为不同益生菌发酵毛酸浆果汁过程中总酸的变化。
21.图4为不同益生菌发酵毛酸浆果汁过程中总糖含量的变化。
22.图5为不同益生菌发酵毛酸浆果汁过程中胞外多糖含量的变化。
23.图6为不同益生菌发酵毛酸浆果汁过程中多酚含量的变化。
24.图7为毛酸浆发酵果汁总黄酮标准曲线。
25.图8为不同益生菌发酵毛酸浆果汁过程中总黄酮含量的变化。
26.图9为不同益生菌发酵毛酸浆果汁过程中清除dpph自由基能力的变化。
27.图10为不同益生菌发酵毛酸浆果汁过程中abts
·
清除能力的变化。
28.图11为不同益生菌发酵毛酸浆果汁过程中三价铁离子还原能力的变化。
29.图12为各组小鼠体重变化情况。
30.图13为各组小鼠器官的脏器指数。
31.图14为各组小鼠血清中il-2细胞因子含量。
32.图15为各组小鼠血清中il-6细胞因子含量。
33.图16为各组小鼠血清中igg细胞因子含量。
34.图17为各组小鼠小肠组织显微结构。
35.图18为宏基因组dna提取电泳图。
36.图19为各组共有和特有的feature数目花瓣图。
37.图20为alpha多样性指数稀释曲线。
38.图21为60个样品的等级聚类曲线。
39.图22为不同组别物种组成pca分析。
40.图23为pcoa分析2d示意图。
41.图24为各组别pcoa分析的3d示意图。
42.图25为优势物种柱状堆叠图。
43.图26为各组菌群聚类分析。
具体实施方式
44.为更好的说明本发明的目的、技术方案和优点,下面将结合附图和具体实施例对本发明作进一步说明。
45.实施例1
46.本发明实施例的一种毛酸浆发酵果汁的制备方法,包括以下步骤:
47.(1)分别从-80℃冰箱中取出冻存的干酪乳杆菌、肠膜明串珠菌、发酵乳杆菌、嗜酸乳杆菌和植物乳杆菌菌种,取菌液接种于mrs培养基,37℃培养48h。取活化后的单菌落继续接种于mrs肉汤培养基,37℃静置培养12h;
48.(2)选取新鲜成熟完整的毛酸浆果,去萼,清洗,沥干后放入榨汁机中打浆,滤布过滤,得毛酸浆果原汁;
49.(3)分别将上述5株菌以6.5log cfu/ml的接种量接入到毛酸浆果汁中,置于37℃发酵60h,得所述毛酸浆发酵果汁。
50.分别对上述制备得到的五种毛酸浆发酵果汁的理化性质和功能性成分进行检测。具体检测方法如下:
51.(1)菌落数的检测:参考国标gb 4789.35-2016的方法进行益生菌菌落数的测定。
52.(2)ph的测定:取5ml发酵液于烧杯中,使用ph计进行测定,每个样品测定3次。
53.(3)总酸的检测:参考gb 5009.236-2016《食品安全国家标准食品酸度的测定》。
54.(4)可溶性固形物含量测定:取1ml毛酸浆发酵液的上清液,用糖度计测定,每个样品平行测定三次。
55.(5)总糖的检测:使用dns比色法(3,5-二硝基水杨酸比色法)[63]。每个样品平行测定三次。
[0056]
(6)vc的检测:果汁与酸化甲醇溶液按照1:1混合,超声提取20min后,于4℃15000r/min离心20min,取上清液。色谱条件:色谱柱:wondasil c18色谱柱(150mmx
×
4.6mm,5μm),流动相a(0.1mol/l磷酸氢二氨),进样量为10μl,流速1ml/min,检测波长为254nm,柱温35℃。
[0057]
(7)胞外多糖的检测:胞外多糖的提取取适量果汁与30%的三氯乙酸混合,于-20℃冰箱中放置10min,12000r/min离心5min用于去除杂蛋白后,取上清液与适量无水乙醇混合,置于4℃冰箱中过夜,12000r/min离心5min收集多糖沉淀。葡萄糖标准曲线的制作配置葡萄糖标准样品溶液。分别移取1ml的葡萄糖标准溶液于10ml试管中,加入0.5ml 6%苯酚溶液及2.5ml浓硫酸,充分震荡摇匀,室温放置20min后,测定在490nm波长处吸光度。胞外多糖的标注曲线为y=9.6393x 0.0137r2=0.9934。胞外多糖的测定样品中提取的胞外多糖用适量蒸馏水溶解,如上面方法进行显色,在490nm处测定吸光度,结果以葡萄糖计,每个样品平行测定三次。
[0058]
(8)多酚含量的检测:a.功能性成分的提取:果汁与酸化甲醇溶液按照1:1混合,超声提取15min,15000r/min离心20min。b.多酚含量测定:采用folin-ciocalteu检测法。多酚标准曲线为y=20.457x 0.1086r2=0.9960。c.总黄酮含量测定:取1.2ml提取液加入0.2ml 5%nano2,摇匀,放置6min后加入0.2ml 10%al(no3)3溶液,摇匀,放置6min,加入0.8ml 4%naoh溶液,震荡摇匀,45℃水浴10min,于505nm处测定吸光值,每个样品平行测定三次。d.测定样品中单体酚:混标标准曲线的制作将不同单体酚标准品进行定容混匀配成混标,分别移取1ml标准溶液过0.22μm微孔滤膜。色谱条件:色谱柱:wondasil c18色谱柱(150mmx
×
4.6mm,5μm),流动相a(1%甲酸水),流动相b(甲醇);进样量为10μl,流速1ml/min,检测波长为280nm、330nm,柱温35℃。
[0059]
(9)抗氧化活性检测:a.清除dpph自由基能力的测定:取适当稀释后的样品50μl,加入150μl,浓度为0.2mmol/l的dpph溶液,混匀,室温条件下避光反应20min,用酶标仪测定波长517nm处的吸光度。以trolox为标准品,测定不同质量浓度的trolox对dpph自由基的清除率,并绘制标准曲线,实验同时设置无水乙醇空白组、甲醇对照组、无水乙醇样品空白组。样品对dpph自由基清除能力以trolox当量表示,以鲜质量计。dpph清除率按公式(1)计算。
[0060]
b.样品abts
·
能力的测定:取适当稀释后的样品10μl,加入200μl abts溶液,旋涡振荡30s后,在室温条件下避光反应6min,用酶标仪测定波长734nm处吸光度。以trolox为标准品,测定不同质量浓度的trolox对abts .的清除率,绘制标准曲线,实验同时设置无水乙醇空白组、甲醇对照组、无水乙醇样品空白组。样品abts
·
清除率按上述公式计算。c.三价铁离子还原能力的测定:取适当稀释后的样品1ml,加入0.2ml 0.2mol/l pbs(ph 6.6)和1.5ml 0.3%铁氰化钾溶液,混匀,50℃孵育20min,迅
速冷却,加入l ml 10%的三氯乙酸,混匀后3 000r/min离心10min,取上清液2ml,加入0.5ml 0.3%三氯化铁溶液混匀,再加3ml纯水,摇匀,测定波长700nm处的吸光度。标准曲线制作以trolox为标准品,样品的铁离子还原能力以trolox当量表示,以鲜质量计。三价铁离子还原能力标准曲线为:y=0.5385x-0.0018r2=0.9995。
[0061]
实验结果如图1~11、表1~3所示。
[0062]
表1不同益生菌发酵毛酸浆果汁过程中可溶性固形物含量的变化
[0063][0064][0065]
注:同一列不同字母表示同一菌株不同时间组的差异具有显著性意义(p《0.05)。
[0066]
表2不同益生菌发酵毛酸浆果汁vc的变化(mg/l)
[0067][0068]
注:大写字母表示同一发酵时间不同菌株的差异具有显著性意义(p《0.05);小写字母表示同一列不同同一菌株不同时间组的差异具有显著性意义(p《0.05)。
[0069]
表3不同益生菌发酵毛酸浆果汁过程中各类单体酚的变化
[0070][0071][0072]
注:不同大写字母表示同一发酵时间不同菌株的差异具有显著性意义(p《0.05);不同小写字母表示同一列同一菌株不同时间组的差异具有显著性意义(p《0.05)。
[0073]
由图1可知,五株益生菌分别接种至毛酸浆果汁后,生长迅速。发酵乳酸菌的生长最佳,在12h即进入对数期,在发酵第60h达到9.06
±
0.04log/cfu;其次为植物乳杆菌,其在第24h进入稳定期,菌落总数为8.92
±
0.11log/cfu;干酪乳杆菌、嗜酸乳杆菌及肠膜明串珠菌在第12h达到峰值,菌落数分别为7.73
±
0.13log/cfu、7.39
±
0.13log/cfu及8.15
±
0.01log/cfu,而后全部进入稳定期。本实验于第12h发酵乳杆菌即进入稳定期,缩短了所需的发酵时间和接种量,说明发酵乳杆菌更适于毛酸浆果汁的发酵。
[0074]
由图2可知,在益生菌发酵过程中会产酸,降低毛酸浆果汁的ph,其中植物乳杆菌及发酵乳杆菌的下降较为显著,在60h分别降至3.47
±
0.04和3.61
±
0.02;随着菌落生长的延缓,干酪乳杆菌、肠膜明串珠菌及嗜酸乳杆菌ph的下降延缓,第60h时分别下降至4.41
±
0.06、4.35
±
0.12及4.39
±
0.03。
[0075]
由图3可知,5株益生菌均呈现酸度上升的趋势,其中发酵乳杆菌及植物乳杆菌产酸能力最佳,分别在60h和48h达到峰值,分别为17.26
±
0.90g/l和13.07
±
0.39g/l,其次为肠膜明串珠菌、嗜酸乳杆菌和干酪乳杆菌。
[0076]
由表1可知,在发酵第12h五种益生菌发酵液的可溶性固形物全部显著下降(p《0.05),其中肠膜明串珠菌在第48h可溶性固形物下降至12.12
±
0.04。其次下降显著的是干酪乳杆菌及发酵乳杆菌,分别在第36h及第48h,下降至12.31
±
0.08及12.39
±
0.11。
[0077]
由图4可知,毛酸浆果汁发酵过程中,不同益生菌利用糖的能力呈现出显著性差异。嗜酸乳杆菌发酵液的总糖含量在36h即下降至62.51
±
0.51g/l,其消耗糖的能力最佳;截止至48h,5株菌发酵果汁中总糖的含量依次为:干酪乳杆菌(66.18
±
1.63g/l)》植物乳杆菌(65.72
±
2.14g/l)》发酵乳杆菌(65.36
±
2.97g/l)》肠膜明串珠菌(63.73
±
1.05g/l)》嗜酸乳杆菌(61.51
±
3.46g/l),此后,总糖含量稳定。
[0078]
在微生物发酵过程中需要vc促进其繁殖。虽然vc在空气中易被氧化,但酸性条件可对vc发挥一定的保护作用。由表2可知,五株益生菌发酵12h后,毛酸浆果汁中vc含量全部显著下降(p《0.05)。嗜酸乳杆菌在发酵第0h、12h、36h、48h及60h时,发酵液的vc含量显著高于其他四株菌的发酵液,说明嗜酸乳杆菌对vc的保护最佳;其次为植物乳杆菌及发酵乳杆菌,其在发酵第60h,vc含量分别为35.64
±
4.69mg/l和31.60
±
1.59mg/l。
[0079]
胞外多糖具有清除自由基、抗氧化等功效,由部分真菌及乳酸菌产生,是优质的有效发酵产物。本试验中发现,5株乳酸菌发酵后毛酸浆果汁中胞外多糖含量均有不同程度的增加,其增长趋势如图5所示。随着发酵时间的延长,不同菌株分泌胞外多糖的能力呈现出显著的差异性。肠膜明串珠菌发酵液中胞外多糖含量持续上升至第48h开始下降,其分泌胞外多糖的能力最佳;其次是干酪乳杆菌、嗜酸乳杆菌,二者发酵液中胞外多糖含量持续上升至第36h,最高含量分别为0.49
±
0.05g/l及0.34
±
0.01g/l;而发酵乳杆菌和植物乳杆菌的胞外多糖含量峰值分别出现在第48h和12h,含量分别为0.23
±
0.01g/l和0.14
±
0.05g/l。截止到48h内,5株菌发酵果汁中胞外多糖的含量依次为:肠膜明串珠菌(0.69
±
0.04g/l)》干酪乳杆菌(0.31
±
0.03g/l)》嗜酸乳杆菌(0.29
±
0.02g/l)》发酵乳杆菌(0.23
±
0.01g/l)》植物乳杆菌(0.05
±
0.02g/l)。此后,发酵液中胞外多糖含量均明显下降。
[0080]
乳酸菌发酵会水解糖苷水解酶,使水果中与细胞壁上纤维素与蛋白质结合的酚类释放,或由于微生物将复杂的大分子酚类转换成小分子酚类,致使酚类含量变化。由图6可知,多酚含量会随着发酵时间的延长呈先波动趋势,其中发酵乳杆菌发酵的毛酸浆果汁中多酚含量上升至第24h开始下降,其多酚含量峰值达到0.30
±
0.00mg/ml;其次为嗜酸乳杆菌与干酪乳杆菌,二者在对毛酸浆果汁发酵第12h,最高含量分别为0.28
±
0.01mg/ml及0.28
±
0.01mg/ml;而植物乳杆菌及肠膜明串珠菌在第36h出现最高峰值,分别为0.27
±
0.01mg/ml和0.26
±
0.00mg/ml。截止至36h内,五种益生菌发酵果汁的多酚含量依次为:发酵乳杆菌(0.30
±
0.01mg/ml)》嗜酸乳杆菌(0.27
±
0.01mg/ml)》植物乳杆菌(0.27
±
0.01mg/ml)》干酪乳杆菌(0.27
±
0.01mg/ml)》肠膜明串珠菌(0.27
±
0.00mg/ml)。此后,发酵液中的多酚含量开始下降。
[0081]
由图7~8所示,益生菌发酵毛酸浆果汁过程中,总黄酮含量总体呈显著上升趋势(p《0.05)。植物乳杆菌在发酵第12h即达到0.50
±
0.01g/l,其提升总黄酮含量的能力最佳;其次为发酵乳杆菌,在发酵第48h达到0.46
±
0.00g/l;干酪乳杆菌、嗜酸乳杆菌及肠膜明串
珠菌在发酵第36h达到峰值,分别为0.42
±
0.01g/l、0.39
±
0.01g/l及0.31
±
0.01g/l。五株益生菌的发酵液均在达到峰值后呈下降趋势。
[0082]
如表3所示,在前48h,嗜酸乳杆菌发酵果汁中的咖啡酸显著上升,在第60h上升至11.97
±
0.53mg/l。可能是由于咖啡酸在毛酸浆果汁中以游离态及结合态两种形式存在,而嗜酸乳杆菌发酵使结合态的咖啡酸脱离成为游离态咖啡酸,致使咖啡酸含量增多。发酵时间延长,五种发酵液中槲皮素均呈上升趋势。其中以干酪乳杆菌和肠膜明串珠菌发酵液分别在第36h和第24h槲皮素含量最高,分别为279.91
±
1.31mg/l和278.71
±
0.53mg/l。除干酪乳杆菌外,其余四株菌的发酵液中山萘酚含量显著增加。发酵乳杆菌在发酵第48h,山萘酚含量达到了266.95
±
4.75mg/l,为产山萘酚能力最佳的菌株,其次为植物乳杆菌和肠膜明串珠菌,在第48h和第60h达到峰值,分别为203.61
±
0.47mg/l和202.67
±
0.73mg/l。经过益生菌发酵的毛酸浆果汁中芦丁含量有所增加,其中以植物乳杆菌上升最为显著,在发酵第60h达到1.06
±
0.00mg/l,其次为发酵乳杆菌和干酪乳杆菌,在第48h和第24h分别达到1.03
±
0.06mg/l和1.01
±
0.01mg/l;而嗜酸乳杆菌及肠膜明串珠菌则在发酵第60h和第12h达到峰值,分别为0.92
±
0.01mg/l和0.90
±
0.03mg/l。
[0083]
由图9可知,发酵毛酸浆果汁dpph清除能力总体呈先上升趋势,其中发酵乳杆菌发酵液在第48h自由基清除能力最佳,达到74.96
±
1.45%,其次为干酪乳杆菌及植物乳杆菌,在第48h分别达到了67.28
±
1.02%和65.14
±
1.04%,而嗜酸乳杆菌在发酵12h即达到了58.05
±
1.76%。在发酵第60h,五种益生菌发酵的毛酸浆果汁的dpph自由基清除能力大小为:发酵乳杆菌(69.77
±
1.35%)》干酪乳杆菌(63.84
±
0.91%)》植物乳杆菌(62.52
±
0.83%)》肠膜明串珠菌(60.00
±
0.23%)》嗜酸乳杆菌(54.48
±
0.57%)。
[0084]
由图10可知,在毛酸浆果汁发酵过程中,五种乳酸菌发酵液的abts
·
清除力都呈现出上升趋势。干酪乳杆菌在发酵第48h时abts
·
清除力表现最佳,为50.00
±
1.52%;其次为发酵乳杆菌及植物乳杆菌在第48h及第60h分别达到45.51%及46.18%;肠膜明串珠菌在第48h达到36.80
±
0.10%,随后abts
·
清除能力开始下降。
[0085]
由图11可知,发酵乳杆菌发酵的毛酸浆其铁离子还原能力最佳,第60h上升至6.08
±
0.11g/l;其次为植物乳杆菌,在发酵第12h,上升至5.23
±
0.12g/l;而嗜酸乳杆菌在发酵至第48h三价铁离子还原能力显著上升至5.87
±
0.11g/l。截止至发酵第60h,五种益生菌发酵液的三价铁离子还原能力大小:发酵乳杆菌(6.08
±
0.11g/l)》植物乳杆菌(5.21
±
0.07g/l)》嗜酸乳杆菌(5.17
±
0.15g/l)》干酪乳杆菌(4.55
±
0.13g/l)》肠膜明串珠菌(4.32
±
0.12g/l)。
[0086]
实施例2
[0087]
本实施例采用实施例1中制备的毛酸浆发酵果汁对小鼠进行灌胃,研究其对小鼠免疫功能的调剂作用。
[0088]
实验方法:实验动物为spf级,体重为18.0-22.0g的babl/c雄性小鼠及其饲料由广东中医药大学实验动物中心提供。饲养温度保持25
±
1℃,相对湿度60%-70%。正式实验开始前,小鼠在实验动物房进行适应性灌胃处理7d,12h光照与12h黑暗交替模拟昼夜变化;饲养期间小鼠可自由进食进水,监测适应期内小鼠精神状态及健康状况,及时剔除不符合实验条件的小鼠。小鼠饲养分为对照组、模型组、低剂量(0.02ml/g)、中剂量(0.04ml/g)和高剂量(0.08ml/g)发酵果汁组。小鼠在适应性灌胃处理1周后进行正式实验,各组小鼠在正常
进食条件下,分别进行一日两次的灌胃处理。发酵果汁组持续灌胃处理27天;模型组和对照组在1至25天时分别灌胃处理蒸馏水,在第26d到27d时,正常对照组注射等量的生理盐水,模型组和受试样品组将注射环磷酰胺,连续注射2d。第26、27天继续按各组要求灌胃,第27天灌胃后进行24小时禁食不禁水的处理。小鼠体重变化:每天对灌胃前的各组小鼠进行称重并记录,计算小鼠增重并进行统计学分析。饲喂第28天时,对小鼠进行快速脱颈死亡处理,摘眼球取血,3000r/min离心10min,分离血清。脏器指数:无菌解剖后取胸腺和脾脏,剥除周围结缔组织,用冰冻pbs缓冲液冲洗干净,用吸水纸吸干表面水分,立即在电子天平上称重。取小肠:剪取1cm靠近盲肠的回肠组织,用冰冻pbs缓冲溶液冲洗干净之后,放进4%中性多聚甲醛中固定。取肠粘液:剪取5cm靠近盲肠的回肠组织,在5mlpbs缓冲液中迅速冲洗后,5000r/min下离心10min,取上清液,用于siga的检测。
[0089]
实验结果如图12~17、表4~5所示。
[0090]
表4小鼠小肠粘膜分泌型免疫球蛋白siga
[0091][0092]
表5小鼠血清中iga细胞因子含量
[0093][0094]
如图12所示,小鼠体重呈明显上升趋势,由于高剂量组及中剂量组灌胃处理果汁量较多,需要一定的适应期,所以体重增长速度不如前三组。在喂养第25d后,进行了环磷酰胺建模处理,导致体重下降。
[0095]
由图13可知,模型组两个脏器指数均显著低于对照组(p《0.05),说明环磷酰胺对小鼠的胸腺及脾脏等免疫器官造成损害,因此环磷酰胺模型组建模成功。与模型组比较,各处理组的胸腺脏器指数都显著高于模型组,但与对照组无显著差异。中、高剂量组的脾脏脏器指数均明显高于模型组(p《0.05)。这说明该发酵毛酸浆果汁可以在一定程度上修复环磷酰胺损伤的小鼠免疫指标。
[0096]
由表4可知,模型组siga含量相比对照组下降明显(p《0.05),说明建模成功。各处理组与模型组之间均有显著性差异,中、高剂量组与对照组之间无显著差异,说明毛酸浆发酵果汁可以调节小鼠血液中siga的含量,从而提升小鼠免疫力。
[0097]
如图14可知,模型组与对照组相比,il-2的含量显著下降,说明建模成功。中、高剂量组与模型组相比显著提升,与对照组无显著性差异,说明毛酸浆发酵果汁剂量依赖型调节小鼠il-2的分泌,使其恢复至正常水平。
[0098]
由图15可知,模型组的il-6含量显著低于对照组,说明模型组的建模成功。各处理组与模型组之间有显著性差异,说明发酵毛酸浆果汁可以调节小鼠血清中的il-6含量。
[0099]
如表5所示,模型组iga含量显著低于对照组,说明环磷酰胺处理使小鼠血清内的iga含量下降,试验建模成功。各处理组别的iga含量均显著高于模型组,说明毛酸浆发酵果汁对小鼠血清中iga具有正向调节作用。
[0100]
小鼠血清中igg含量如图16所示,各处理的igg含量显著高于模型组(p《0.05),但与对照组之间无显著性差异,说明毛酸浆发酵果汁可使小鼠血清中igg含量恢复至正常水
平。
[0101]
环磷酰胺处理后,各组小肠切片在100倍电镜下的形态如图17所示。对照组小肠的绒毛排列均匀且紧密,而模型组绒毛有疏松状态,绒毛间间隙略变大,绒毛有断裂现象,说明环磷酰胺处理会对小肠绒毛有损害。灌胃后,低、中剂量组的小鼠小肠绒毛状态相对于模型组有所改善,高剂量处理组绒毛状态明显好于模型组,接近对照组。因此,毛酸浆乳酸菌发酵果汁可以修复受环磷酰胺损伤的小肠绒毛。
[0102]
实施例3
[0103]
本实施例采用实施例1中制备的毛酸浆发酵果汁对小鼠进行灌胃,研究其对小鼠肠道菌群的影响。
[0104]
实验方法:实验动物为spf级,体重为18.0-22.0g的babl/c雄性小鼠及其饲料由广东中医药大学实验动物中心提供。饲养温度保持25
±
1℃,相对湿度60%-70%。正式实验开始前,小鼠在实验动物房进行适应性灌胃处理7d,12h光照与12h黑暗交替模拟昼夜变化;饲养期间小鼠可自由进食进水,监测适应期内小鼠精神状态及健康状况,及时剔除不符合实验条件的小鼠。小鼠饲养分为对照组、模型组、低剂量、中剂量和高剂量发酵果汁组。小鼠在适应性灌胃处理1周后进行正式实验,各组小鼠在正常进食条件下,分别进行一日两次的灌胃处理。根据人体推荐量245ml/d,60kg人体推荐量为4ml/kg,设置20ml/kg,80ml/kg,相当于人体推荐量的5倍、10倍和20倍,则为0.02ml/g、0.04ml/g及0.08ml/g,一日两次,每次0.01ml/g,0.02ml/g及0.04ml/g。发酵果汁组持续灌胃处理27天;第27天灌胃后进行24小时禁食不禁水的处理。小鼠肠道菌群检验:于1d、13d及25d取粪便样品。采用e.z.n.a.粪便dna试剂盒提取不同样品的dna。利用无菌水作为空白,使总dna在50μl洗脱液中洗脱,保存与-80℃冰箱中,用于pcr检测。样品在illumina novaseq平台进行测序。按pcr扩增引物和barcode的序列,拆分下机的各样品数据,截去pcr扩增引物和barcode的序列,用flash9拼接每个样品的reads,得原始tags数据(raw tags),根据fqtrim(v0.94),获得高质量的tags数据。嵌合序列使用vsearch软件(v2.3.4)过滤。使用dada2进行反复制,得到特征表和特征序列。将alpha多样性和beta多样性随机归一化为同一序列进行计算,并利用silva(release 132以及nt-16s数据库对feature特征序列做物种分类及进一步分析。
[0105]
实验结果如图18~26所示。
[0106]
表6各样品/分组共有和特有的feature数目统计
[0107][0108]
表7alpha多样性分析
[0109][0110][0111]
(1)在进行小鼠肠道内宏基因组dna提取后,对其进行电泳,电泳图如图18示,dna目的片段大小约为500bp,且条带明显。将目的片段进行胶回收,进行qubit检测,结果显示样品全部为a类样品,且条带均单一无杂质。
[0112]
(2)结合图19和表6,12组样品共有feature数目为213。随着饲养日期的延长,对照组(nc)feature数目从1427逐渐增加到1788,低剂量组(lf)feature数目先降低后增加,从1375增加到1654,中剂量组(nf)feature数目逐渐降低;从1411降低到1177,高剂量组(hf)feature数目逐渐增加,从1135增加到1569。各组小鼠摄入发酵汁剂量与feature数密切相关。
[0113]
(3)通过绘制稀释曲线,统计feature的丰富程度,对比不同样品的稀释曲线就可以直观显示样品间物种多样性的差异。图20(a)、(b)、(c)、(d)、(e)显示,各样品测序数据chao1、observed species、goods_coverage、shannon、simpson指数稀释曲线逐渐平坦,表明数据量趋向合理,随着数据量的增加,仅有极少量新物种产生,可继续进行进一步的数据统计与分析。由表7可知,各组别与对照组相比,物种的数目变化并不显著,p》0.05。goods_coverage该指数实际本实验中12组样本goods_coverage均为1,测序结果可信度高。simpson数值范围在0-1之间,本试验中simpson均大于0.9,shannon指数较大,说明各组别物种丰富度大,多样性高。
[0114]
(4)图21为60个不同样品的等级聚类曲线,所有样品(组)在水平方向上跨度较大,说明小鼠肠道内微生物物种丰富;在垂直方向上曲线较为平滑,说明小鼠肠道内物种分布均匀。
[0115]
(5)采用beta多样性分析对不同组别小鼠肠道物种差异性进行分析。beta多样性分析主要通过主成分分析(principal component analysis,pca)、主坐标分析(principal coordinates analysis,pcoa)、聚类分析(clustering analysis,upgma)、非多维尺度分析(multidimensional scaling,nmds)、相似性分析(analysis of similarities,anosim)、多元方差分析(permanova,又称adonis)等方法,观察样本之间的差异。基于feature丰度表,我们使用r软件vegan包进行了pca分析,由图22可以直观看出生物学重复的组内相似性较高,组间差异性显著(p=0.001)。微生物结构组成相似的样品会聚在一起,通过pcoa分析可观察个体或群体间的差异。图23显示,同时考虑物种组成和丰度时,主成分1(pc1)和主成
分2(pc2)分别代表对于12组样本菌群组成发生偏移的疑似影响因素,pc1的贡献率为37.34%,pc2的贡献率则为22.51%。各组均有部分的重合和个别的离散,各组样品接近,说明它们群落组成相似,但灌胃后各组小鼠肠道菌群微生物在种类和丰度上均有显著差异(p=0.026)。仅考虑物种组成时(unweighted_unifrac_pcoa),pc1和pc2的贡献率分别为8.88%和6.42%,各组间小鼠肠道菌群微生物组成差异极显著(p=0.001)。说明,毛酸浆发酵汁可以改变小鼠肠道菌群组成。图24中,将0天与25天相比,hf组(高剂量组)小鼠肠道微生物种类差异明显。hf0中有一组数据偏离较大,说明其组内差距较大,应剔除。样本离散在群体之外,说明这个样本可能组间相似性不高,作为生物学重复可能会影响整个分组的结果。而0天与25天相比,lf组(高剂量组)小鼠肠道微生物种类差异明显。0天与13天相比,mf组(中剂量组)小鼠肠道微生物种类差异明显。同样,13天、25天相比,mf组(中剂量组)小鼠肠道微生物种类差异性不明显。
[0116]
(6)从图25(a)可以发现,12各组别的优势微生物为细菌,占比均达到99.5%以上。进一步从对这些细菌进行分类,根据物种注释结果,对12组样品分别在门和属水平上前15名最大丰度物种的丰度作出其柱形累加图,显示出12样品在不同的分类水平上的较高丰度的物种及其比例。在门水平上,从图25(b)可知,12组小鼠肠道微生物丰度排名前15的物种是拟杆菌、厚壁菌、ε杆菌、髌骨杆菌、变形菌、疣微菌、放线菌、未知菌门、蓝细菌、脱铁杆菌和无壁菌、酸杆菌、绿弯菌门、梭杆菌门和浮霉菌门。12组小鼠肠道内微生物优势菌群种类相似,主要是拟杆菌与厚壁菌,所占比例约90%,而其他细菌组成基本相似,但是组间各类细菌所占比例有所不同。值得注意的是,灌胃组拟杆菌和厚壁菌的丰度有所下降,而其他菌种丰度有所提高。在属的水平上,如图25(c)所示,各组样品丰度排名前10的细菌差异不大,各组别含量较多的是以下10个属:鼠杆菌属、乳酸杆菌、别样杆菌属、别普雷沃菌、鼠杆菌、毛螺菌科nk4a136、拟杆菌属bacteroides、梭状芽胞杆菌、幽门螺杆菌、毛螺菌。
[0117]
(7)在门水平上的菌群组成方面,图26(a)显示,nc0、lf0、mf0、hf0分支短,聚类近,说明物种组成相近,优势菌门所占比例基本相同,因此丰度相近。低剂量组lf13和lf25聚类相近,组成相近,但二者皆与lf0相距大,因此毛酸浆发酵果汁的摄入引起了小鼠优势菌群组成的改变。中剂量组mf0与mf13、mf25相聚较大,mf13和mf25的分支距离也较大,因此说明此计量下,摄入时间影响小鼠肠道优势菌群组成。高剂量组hf0、hf13、hf25聚类情况与中剂量组相似。在门水平上的菌群丰度变化方面,图26(a)显示,25天时,nc组中拟杆菌、髌骨杆菌、变形菌、放线菌、脱铁杆菌丰度增加;厚壁菌、无壁菌、疣微菌丰度降低。lf组中,髌骨杆菌、变形菌、放线菌、ε杆菌丰度增加;而拟杆菌丰度下降。mf组中,厚壁菌、酸杆菌、ε杆菌、髌骨杆菌、变形菌、放线菌、浮霉菌门丰度增加;拟杆菌、疣微菌、无壁菌、脱铁杆菌丰度下降。hf组中,髌骨杆菌、变形菌、放线菌、疣微菌、蓝细菌丰度增加;而小鼠肠道优势菌群拟杆菌、厚壁菌、ε杆菌丰度下降;但在13天时,厚壁菌、绿弯菌丰度明显增加,继续灌胃则丰度下降。在属水平上的菌群丰度变化方面,图26(b)显示,25天时,nc组中鼠杆菌属、鼠杆菌丰度增加;乳酸杆菌、别普雷沃菌、毛螺菌nk4a136、拟杆菌属、梭状芽胞杆菌丰度降低。lf组中,乳酸杆菌、毛螺菌科nk4a136、梭状芽胞杆菌、幽门螺杆菌丰度增加;而鼠杆菌属、鼠杆菌、拟杆菌属、别样杆菌属、别普雷沃菌丰度下降。mf组中,乳酸杆菌在13天时,尚未有明显变化,但25天时显著增加。厚壁菌在13天时显著增加,但25天时与第0天比较,丰度变化不明显。别样杆菌丰度增加显著;幽门螺杆菌在13天显著下降。梭状芽胞杆菌先增加后下降。鼠杆菌属、
鼠杆菌、别普雷沃菌、毛螺菌丰度下降。hf组中,幽门螺杆菌丰度一直显著下降,而乳酸杆菌显著增加,13天时丰度最大。鼠杆菌属、鼠杆菌丰度有所下降,别样杆菌属13天下降,但25天开始回升。未分类毛螺菌下降。实验表明,高剂量的毛酸浆发酵汁可以改变菌属丰度,可有效提高有益菌属如乳酸菌的丰度,高剂量毛酸浆发酵汁可显著降低有害菌,如幽门螺杆菌的丰度。在属水平上的菌群组成方面,图26(b)显示,对照组nc0、nc13、nc25分支具有一定距离,说明即使不灌胃小鼠发酵果汁,其菌群组成也在变化。hf0、hf25聚类近,但二者与hf13聚类较远,说明灌胃时间可以影响小鼠肠道菌群构成,乳酸杆菌属丰度比例占据最大,丰度变化趋势与物种构成变化趋势一致。lf25和hf13聚类最相近,但高剂量组hf13中有益菌乳酸菌丰度显著高于低剂量组lf13。中剂量组mf0-mf13和mf0-mf25的分支距离较近,说明小鼠肠道中在这三个时间点的物种构成相近,但灌胃25天的剂量组mf25中乳酸菌丰度显著高于其他两个时间。再次表明,毛酸浆益生菌发酵果汁可改善小鼠肠道菌群构成,提高其有益菌群丰度。
[0118]
最后应当说明的是,以上实施例仅用以说明本发明的技术方案,而非对本发明保护范围的限制,尽管参照较佳实施例对本发明作了详细地说明,本领域的普通技术人员应当理解,可以对本发明的技术方案进行修改或者等同替换,而不脱离本发明技术方案的实质和范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
