1.本发明属于疾病诊断领域。具体而言,本发明涉及一种预测或诊断糖尿病或糖尿病肾病患者中的早期动脉粥样硬化的应用。
背景技术:
2.糖尿病(diabetes mellitus,dm)和慢性肾病(chronic kidney disease,ckd)已经成为全球两个重要的慢性病和公共卫生问题。美国第三次全国健康和营养调查队列20年数据分析表明,dm已经成为导致ckd最主要的原因。此外,大量的临床及流行病学调查结果显示,dm患者与非dm患者相比有较高的心血管疾病(cardiovascular disease,cvd)的风险,糖尿病肾病(diabetic nephropathy/diabetic kidney disease,dn/dkd)的cvd发生和死亡的风险进一步增高。动脉硬化是cvd发生的主要致病原因,血管内皮损伤是动脉硬化发生发展的重要病理机制,高密度脂蛋白(high density lipoprotein,hdl)通过抗氧化、抗炎症及对血管内皮细胞本身作用等发挥血管保护作用,抗动脉硬化的形成,最终减少cvd的发生。hdl功能和水平下降是cvd发生和发展的重要原因之一。临床流行病学资料显示,dm无并发症和dn患者hdl水平下降与dn进展相关,hdl功能损伤在dn患者中cvd致病方面可能存在着相关机制。
3.研究发现hdl能够通过多种途径被氧化,进而失去其正常的生理功能。这些氧化剂主要分为两类,一类是金属离子cu
2
,fe
3
等,另外一类是细胞相关酶,主要是mpo。而在体内主要是mpo诱导hdl发生相应的氧化修饰。mpo是血液中髓系细胞(主要是中性粒细胞和单核细胞)内的一种氧化酶,其主要功能是在吞噬细胞内杀灭微生物,利用过氧化氢和氯离子产生次氯酸盐,并形成具有氧化能力的自由基。构成mpo-h2o
2-卤素系统。然而,在特定条件下,mpo催化反应生成过量的氧化剂(hocl、3-氯化酪氨酸、酪氨酰基、硝基酪氨酸等),超过局部抗氧化剂的防御反应时,就会导致氧化应激和氧化性组织损伤。
4.晚期糖基化终产物(advanced glycation end products,ages)是一组在蛋白质、脂肪酸或核酸的氨基基团与还原糖的醛基之间发生非酶性糖基化反应所形成的一系列具有高度活性终产物的总称,其结构具有高度异质性。研究表明在糖尿病患者中,hdl发生无酶糖基化,形成n-甲酰赖氨酸(cml)和n-乙酰赖氨酸(cel)。同时在apoa-i的赖氨酸位点会形成只加入一个葡萄糖的糖基化修饰。糖基化修饰的apoa-i促进κb,iκbα的磷酸化,激活核受体nf-κb的转录,介导炎症的发生。
5.预测或诊断糖尿病或糖尿病肾病患者中的早期动脉粥样硬化风险对于糖尿病或糖尿病肾病患者而言具有重要意义,本发明满足了该需求。
技术实现要素:
6.本发明使用质谱法测量糖尿病无并发症和糖尿病合并肾病患者的hdl糖化水平,发现dn-hdl中的apoa-i糖化水平高于d-hdl,并且dn-hdl严重降低了细胞迁移能力。本发明
结果表明,糖基化会损害hdl功能,而功能失调的hdl可能导致再内皮化能力的降低,解释了dn患者会出现过多的cvd的原因。
7.本发明的一个目的在于提供hdl或apoa-i作为检测对象在制备用于预测或诊断糖尿病或糖尿病肾病患者中的早期动脉粥样硬化的检测试剂或检测试剂盒中的应用。
8.本发明的另一个目的在于提供hdl或apoa-i的检测试剂在制备用于预测或诊断糖尿病或糖尿病肾病患者中的早期动脉粥样硬化的检测试剂盒中的应用。
9.在一个实施方案中,其用于预测或诊断糖尿病或糖尿病肾病患者中的早期动脉粥样硬化的发生或风险。
10.本发明的另一个目的在于提供一种试剂盒,所述试剂盒含有hdl或apoa-i的检测试剂。
11.在一个实施方案中,所述hdl或apoa-i包括hdl糖基化、apoa-i糖基化中的一种或多种。
12.在一个实施方案中,所述hdl或apoa-i包括hdl糖基化水平、apoa-i糖基化位点中的一种或多种。
13.在一个实施方案中,采用蛋白质组学技术质谱方法检测hdl糖基化水平。
14.在一个实施方案中,采用蛋白质组学技术质谱方法检测apoa-i糖基化位点。
15.在一个实施方案中,所述apoa-i糖基化位点选自k23、k96、k107、k118、k133、k182、k195中的一种或多种。
16.在一个实施方案中,所述apoa-i糖基化位点选自k23、k96、k107、k118中的一种或多种。
17.在一个实施方案中,所述试剂盒用于所述试剂盒用于预测或诊断糖尿病或糖尿病肾病患者中的早期动脉粥样硬化。
18.在一个优选的实施方案中,所述试剂盒用于预测或诊断糖尿病或糖尿病肾病患者中的早期动脉粥样硬化的发生或风险。
19.在本文中使用以下缩写:
20.dn:糖尿病肾病;d-hdl:糖尿病高密度脂蛋白;n-hdl:正常高密度脂蛋白;dn-hdl:糖尿病肾病高密度脂蛋白;apoa-i:载脂蛋白a-i;cvd:心血管疾病;dn:糖尿病肾病。
附图说明
21.图1显示了n-hdl、d-hdl和dn-hdl糖基化总量统计结果比较。
22.图2显示了apoa-i中所含赖氨酸位点。
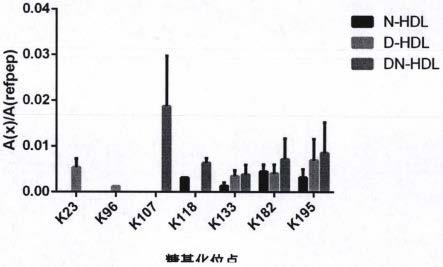
23.图3显示了apoa-i中不同赖氨酸位点糖基化水平。
具体实施方式
24.实施例1.质谱检测hdl糖基化水平
25.既往采用蛋白免疫印记法(western blot)检测糖基化水平,不能定量分析hdl糖基化水平。本发明采用蛋白质组学技术质谱方法检测糖基化水平,可以较准确地定量检测hdl糖基化百分比。
26.1hdl(每泳道30毫克蛋白)在10%sds-page进行凝胶电泳。
27.2将apoa-i条带切下,在包含50%乙腈的25mm nh4hco3的溶液中褪色。
28.3用10mm二硫苏糖醇裂解,50mm碘乙酰胺进行烷基化。
29.4在100%乙腈中吹干后,使用胰蛋白酶(promega)在37℃过夜消化凝胶条带。
30.5将多肽在0.1%甲酸中重悬然后注入nanolc-ms/ms进行分析。
31.6多肽蛋白的流动相采用含有0.1%甲酸,线性梯度从5%到40%的乙腈,使用100um
*
10cm石英填充的c18反相柱,流速为300nl/min。
32.7数据依赖的谱图采集使用装备有纳升电喷雾离子源(thermo fisher scientific)的ltq orbitrap质谱仪(thermo fisher scientific)。
33.本实验结果显示n-hdl、d-hdl和dn-hdl峰面积分别如下:n-hdl为0.007969
±
0.001472%,d-hdl为0.01549
±
0.001499%,dn-hdl为0.04369
±
0.005375%。统计结果显示,d-hdl糖基化水平比n-hdl高1.94倍(p<0.01),dn-hdl糖基化水平与d-hdl相比高2.82倍(p<0.001)。3组hdl的糖基化总量见图1。
34.实施例2.apoa-i糖基化位点
35.n-hdl、d-hdl和dn-hdl中apoa-i糖基化位点测定结果,apoa-i共有263个氨基酸,其中赖氨酸(k)有21个(见图2),是apoa-i有可能发生糖基化的主要部位。通过测定赖氨酸糖基化水平了解不同的hdl的糖基化水平。3组hdl的赖氨酸糖基化位点结果见图3。质谱检测结果可见,apoa-i糖基化位点主要发生在k23、k96、k107、k118、k133、k182和k195。其中n-hdl的apoa-i糖基化位点包括:k118、k133、k182和k195。d-hdl的apoa-i糖基化位点包括:k23、k96、k133、k182和k195。dn-hdl的apoa-i糖基化位点包括:k107、k118、k133、k182和k195)。其中,3组受试者的hdl存在k133、k182、k195糖基化,仅dn-hdl存在k107糖基化,仅d-hdl存在k23、k96糖基化,k118糖基化为仅在d-hdl和dn-hdl中发现。可能在于,apoa-i中的碱性氨基酸包括赖氨酸、精氨酸和半胱氨酸残基可以和α-羰基醛(丙酮醛、乙二醛、3-脱氧葡萄糖酮醛)形成糖基化终产物,从而导致hdl的功能下降。
36.实施例3.通过5
′‑
bromo-2
′‑
deoxyuridine(brdu)免疫组织化学检测细胞增殖
37.huvecs以1000个细胞/孔的密度接种在96孔板中并培养过夜。细胞与hdl共孵育,浓度为100μg/ml apoa-1,浓度为50μg/ml)。然后20μl/孔brdu标记溶液标记细胞,并用200μl/孔fixdenat孵育。100μl/孔抗brdu-pod工作液孵育90min后,pbs洗细胞3次,加入底物tmb溶液。用elisa酶标仪(550型;bio-rad)在450nm处读取吸光度。
38.实施例4.伤口愈合迁移实验
39.将huvec接种在含有5%牛血清的ecm中的24孔板(5
×
105个细胞/孔)中,并培养直至形成细胞单层。然后pbs洗涤之前,用20μi微量移液管尖端手动刮擦。然后将细胞与仅含有1%牛血清的ecm或分别与100μg/ml apoa-1浓度为50μg/ml的hdl一起孵育。然后用甲醇固定huvec,用苏木精-伊红染色,并在倒置显微镜下观察。在10个随机高倍(100x)视野中对迁移到伤口边缘的细胞进行拍照和量化。
40.实施例5.transwell迁移测定
41.除了伤口愈合迁移测定外,还使用改进的boyden室(minicell;millipore,美国)和插入24孔板的8.0μm孔聚碳酸酯过滤器对huvec进行定量迁移测定。下室装有600μl ecm和5%牛血清。将ecm中的huvec(1
×
105个细胞/孔)和1%牛血清接种到上腔室中。将hdl添加到每个孔中并分别孵育5小时(正常hdl为100μg/ml apoa-1,浓度为50μg/ml)。然后用棉
签从transwell膜的上室中取出所有未迁移的细胞,同时将迁移的细胞固定并用苏木精-伊红染色剂染色。用倒置显微镜(尼康)为每个室拍摄20个随机高倍(100倍)视野中的迁移细胞。
42.实施例6.片状伪足的形成实验
43.将无菌盖玻片置于24孔板的孔中,并将huvec接种在盖玻片上。12小时后,将pbs、hdl分别加入每个孔中(正常hdl为100μg/ml apoa-1,浓度为50μg/ml)。15分钟后除去培养基。用甲醇固定细胞,用罗丹明鬼笔环肽(cytoskeleton,usa)染色,并用dapi(beyotime,中国)对细胞核进行复染。然后使用激光扫描共聚焦显微镜(leica tcs sp5,德国)对细胞进行拍照。
44.实施例7.定向迁移分析
45.使用单细胞跟踪测量定向迁移测定。首先玻璃底培养皿(nest biotechnology co.)在室温下用50μg/ml的纤连蛋白(fn,santa cruz biotechnology,inc.)包被1小时,然后用蒸馏水彻底清洗。将细胞接种在fn涂层的玻璃底培养皿上8-12小时。然后通过在无血清培养基中与1μm、5-氯甲基荧光素二乙酸酯(celltracker green cmfda,molecular probes,invitrogen)一起孵育30分钟来标记细胞。用pbs洗涤后,在成像前将细胞与仅含有1%牛血清或与hdl(浓度为100μg/ml apoa-1的正常hdl)的ecm一起孵育。延时显微镜在olympus vivaview fl培养箱荧光显微镜(10x物镜)和nikon biostation im(10x物镜)上进行。使用手动跟踪插件(http://rsbweb.nih.gov/ij/plugins/track/track.html)使用imagej测量细胞速度。
46.实施例8.蛋白质印迹
47.akt磷酸化、erk1/2磷酸化、akt、erk1/2和sr-b1通过蛋白质印迹分析。huvec在12孔板中培养并饥饿过夜。然后用hdl(100μg/ml apoa-1浓度的正常hdl)处理细胞不同时间。然后加入蛋白酶抑制剂和磷酸酶抑制剂(applygen technologies inc.),收集细胞并在放射免疫沉淀测定(ripa)缓冲液(applygen technologies inc.)的混合物中裂解细胞。12,000rpm离心20分钟去除细胞碎片,并使用考马斯亮蓝法测定蛋白质浓度。然后将细胞裂解物(每泳道100μg蛋白质)在10%sds-聚丙烯酰胺凝胶上进行电泳,并根据标准程序转移到硝酸纤维素膜(pall corp.,usa)上。用5%脱脂牛奶封闭2h。将膜与每种一抗(1∶500-1∶2000稀释)在4℃下孵育过夜,然后加入适当的辣根过氧化物酶(hrp)偶联的二抗(1∶1000稀释)。根据制造商的说明,使用supersignal west pico kit(pierce,美国)检测抗体结合。
48.实施例9.电损伤模型和免疫组化
49.通过以3mi/kg的剂量腹膜内注射10%(m/v)水合氯醛来麻醉小鼠。用解剖显微镜(cnmicro,smz-b2)对左侧颈总动脉进行手术。钝性解剖颈部皮肤并通过颈部前部切口暴露左颈总动脉。电损伤部位为颈总动脉远端。为了使血管壁的温度升高标准化,颈动脉被两个鳄鱼夹损伤,铜尖(1毫米宽)位于动脉周围,不对血管施加机械压力。使用与颈动脉平行的塑料尺寸标记,将0.8ma的电流施加到每毫米颈动脉,总长度正好为4mm。每隔一天在颈动脉损伤后通过尾静脉注射总体积为200μl的hdl(100μg/ml apoa-1浓度的正常hdl)。将相同体积的pbs注射到对照小鼠中。在受伤后的特定时间(1、3、7天),给小鼠灌注25ml盐水,然后灌注4%磷酸盐缓冲的福尔马林(ph 7.0)。将受伤的血管段解剖并在4%福尔马林中固定8小时,然后转移到含有20%蔗糖的冷pbs中过夜。之后,将血管段嵌入oct(最佳切割温度)化合
物(tissue-tek;美国)中,在液氮中速冻,并在-80℃下储存以备进一步使用。在受伤的颈动脉(4mm)的每500mm间隔处切割7um厚的切片,并用苏木精-伊红或山羊抗血清对切片中间的切片进行免疫组织化学染色。使用兔抗小鼠cd31抗体(中山金桥生物技术有限公司)和小鼠抗pcna(增殖细胞核抗原)抗体(中山金桥生物技术有限公司)对内皮细胞进行免疫染色,然后进行hrp偶联分别使用抗兔igg聚合物和hrp偶联的抗小鼠igg聚合物(中山金桥生物科技),以及用3,3-二氨基联苯胺(dab)染色。显示了代表性的组织学显微照片(200
×
)。
50.以上实施例结果表明:
51.1.dn-hdl降低了hdl促进huvecs增殖的能力
52.为了确定不同处理对huvecs增殖的影响,进一步应用了brdu细胞增殖试验。与对照相比,hdl显著刺激了huvec增殖26.4%,而dn-hdl与hdl相比显著减少了增殖21.6%。
53.结果显示,与对照相比,hdl可以增加huvecs向伤口区域的迁移142.0%,而dn-hdl与hdl相比显著减少了57.4%。
54.2.dn-hdl抑制huvec中片状伪足的形成
55.为了探索不同的治疗如何影响内皮细胞迁移,我们测试了这些治疗对肌动蛋白细胞骨架的影响。huvec用正常的hdl、dn-hdl处理,浓度为100μg/ml apoa-1。hdl促进片状伪足的产生比对照值高3.1倍,而dn-hdl诱导的片状伪足比正常hdl少64.1%。
56.3.apoa-i的特定残基在dn-hdl中被糖化
57.本发明中质谱结果表明apoa-i的糖基化位点主要发生在k23、k96、k107、k118、k133、k182和k195。n-hdl apoa-i的糖基化位点包括:k118、k133、k182和k195。d-hdl apoa-i糖基化位点包括:k23、k96、k133、k182和k195。dn-hdl apoa-i糖基化位点包括:k107、k118、k133、k182和k195。其中,3组受试者的hdl存在k133、k182、k195糖基化,仅dn-hdl存在k107糖基化,仅d-hdl存在k23、k96糖基化,k118糖基化为仅在d-hdl和dn-hdl中发现。
58.4.与dn-hdl相比,hdl孵育后,内皮细胞中的enos磷酸化显著激活
59.表明enos磷酸化参与导致内皮细胞迁移和增殖。我们之前也证实了enos磷酸化在cl-hdl或no2-hdl参与细胞迁移和增殖中的作用。在本发明中,我们进一步研究hdl是否也可以通过这些途径发挥作用。huvec与各种处理一起孵育5分钟(enos磷酸化检查的最佳时间)。结果表明,与hdl对照相比,erk1/2磷酸化升高了2.5倍。然而,dn-hdl将enos的磷酸化降低了71.2%。
60.在enos磷酸化中观察到类似的结果。hdl刺激的磷酸化水平是对照的2.2倍。与hdl相比,dn-hdl激活enos磷酸化的能力降低了55.7%。
61.5.hdl可促进颈动脉内膜细胞增殖和体内再内皮化
62.为了进一步确定hdl在体内的潜在影响,我们通过小鼠模型中的新内膜形成过程检验了我们的假设。损伤破坏了内侧平滑肌细胞和损伤节段中所有完整的内皮。内皮细胞标记物cd31和标准苏木精-伊红染色揭示了再内皮化的过程,其特征是内皮细胞的重新增殖和内皮细胞在源自未受伤边界的平滑肌细胞的新内膜内的积累、增殖和迁移。电损伤后第1天,不同治疗组间无明显差异。从第3天到第7天,新生内膜随着不同hdl的处理以不同的速度逐渐恢复。
63.此外,通过pcna免疫染色鉴定和评估细胞增殖。在第3天,用hdl处理诱导新生内膜内的早期内皮细胞增殖分别比对照强36.4%,通过该处理,内膜在第7天完全恢复。然而,与
hdl相比,dn-hdl促进内皮细胞的增殖能力明显减弱。
64.总之,在本发明中,我们研究了hdl糖化残基与糖尿病肾病患者细胞迁移影响之间的关系,并探讨了潜在的机制。我们提出了几个新的发现。首先,与d-hdl(k118、k133、k182和k195)相比,发现dn-hdl具有额外的糖化残基(k107)。并且在dn-hdl中糖化残基中apoa-i的糖化水平也显著升高。其次,我们发现dn-hdl比d-hdl在体外和体内降低huvecs迁移能力的作用要大得多。第三,我们发现与d-hdl和n-hdl相比,dn-hdl中的sr-b1表达和enos磷酸化降低最多。
65.由于清道夫受体b1(sr-b1)表达的下调,糖尿病hdl在刺激内皮细胞迁移方面功能失调。我们使用伤口愈合和transwell迁移实验来评估n-hdl、d-hdl和dn-hdl促进的huvec迁移的差异,分别显示dn-hdl在体外和体内比d-hdl更能降低huvecs迁移能力。最近的一项研究表明,即使肾功能有轻微损伤的患者,hdl与较低死亡率之间的关系也消失了,而较高的hdl水平几乎变成了更晚期肾功能衰竭患者的潜在心血管危险因素。这是一个重要的发现,因为dn伴随着甘油三酯的增加和hdl水平的降低,我们现在知道dn中的hdl功能紊乱,但其低水平暗示了为什么dn具有更高的心血管疾病风险的可能解释。
66.蛋白质组学分析的最新进展发现,尿毒症hdl蛋白质组学组成发生变化,伴随着apoa-i、apoa-ii的减少和saa1、白蛋白、apoc-iii和lp-pla2的增加。ages涉及其他原发性肾脏疾病以及动脉粥样硬化的发展和进展。既往研究发现肾脏在ages的清除和代谢中起重要作用,慢性肾功能不全患者血清age浓度升高。与结论一致,我们的数据还表明,糖化残基中apoa-i的糖化水平在dn-hdl中也显著升高,这可能是由于肾功能不全清除所致。先前的研究表明,mpo在a1g0-l203残基上结合apoa-1,在人类促炎环境中通过硝化(tyr18、tyr100和tyr192)和氯化(tyr192)在空间上接近位点特异性氧化修饰动脉粥样硬化斑块。有趣的是,在本发明中,与d-hdl(k118、k133、k182和k195)相比,发现dn-hdl具有额外的糖化残基(k107),这可能表明hdl空间构象在糖尿病肾病患者中发生了改变。
67.颈动脉的再内皮化主要是细胞迁移而来,先前已得到充分证明。这种内皮单层完整性的破坏在动脉粥样硬化的发生和传播中起着至关重要的作用,并且可以通过邻近内皮细胞(ec)和内皮祖细胞(epc)的增殖来缓解。因此,由于迁移抑制而导致的延迟再内皮化可能会显著促进动脉粥样硬化的形成。hdl促进细胞迁移的能力是保护血管免受损伤的机制之一。本发明使用质谱法测量糖尿病无并发症和糖尿病合并肾病患者的hdl糖化水平,发现dn-hdl中的apoa-i糖化水平高于d-hdl,并且dn-hdl严重降低了细胞迁移能力。本发明结果表明,糖基化会损害hdl功能,而功能失调的hdl可能导致再内皮化能力的降低,并可能解释为什么dn患者会出现过多的cvd。因此应更加关注糖尿病肾病患者hdl糖化水平及其对cvd的影响。
68.以上所述,仅是本发明的较佳实施例而已,并非是对本发明作其它形式的限制,任何熟悉本专业的技术人员可能利用上述揭示的技术内容加以变更或改型为等同变化的等效实施例。但是凡是未脱离本发明技术方案内容,依据本发明的技术实质对以上实施例所作的任何简单修改、等同变化与改型,仍属于本发明技术方案的保护范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
