1.本发明涉及生物医药技术领域,具体涉及一种卡拉胶寡糖在制备降血脂药物中的应用。
背景技术:
2.随着社会不断发展,人们生活水平不断提高以及体力劳动的日益减少,全球范围内肥胖患者越来越多。胰脂肪酶是胰腺合成和分泌的主要脂解酶,在甘油三酯的高效消化过程中起着关键的作用。胰脂肪酶负责膳食脂肪总量50-70%的水解,将饮食中的脂肪分解成甘油单酯和脂肪酸后,被人体吸收利用。过多的脂肪堆积容易造成肥胖并引起冠心病、高血糖、心脏病、退化性关节炎、痛风、高血脂、睡眠呼吸终止症、高血压、结肠癌等多种疾病。采用临床抑制剂对胰脂肪酶进行抑制是目前治疗肥胖及其并发症最有效的方法之一。然而,这些临床抑制剂如奥利司他对人体都会产生不同程度的副作用,使得它们的临床应用受到限制。因此,开发新型、低毒、低副作用的胰脂肪酶抑制剂,包括从食品与中草药中提取胰脂肪酶抑制剂,已成为近年来的研究热点之一。
3.卡拉胶寡糖是卡拉胶的降解产物,与卡拉胶相比,具有分子量更低、溶解度更高的优点,同时因其活性基团充分暴露,生物活性显著提高,在生物医药、功能食品等领域表现出良好的应用前景。
4.卡拉胶寡糖具有多种生物活性,目前已经对抗氧化、抗肿瘤、免疫调节、抗凝血、降血压、抗病毒、抗菌、抗炎等多种生物活性进行了研究。但是,用卡拉胶寡糖对胰脂肪酶活性抑制的研究尚未见报道。
技术实现要素:
5.为了解决上述问题,本发明提出一种κ-卡拉胶寡糖在制备降血脂药物中的应用,该κ-卡拉胶寡糖可抑制胰脂肪酶的活性,从而降血脂,以期为卡拉胶资源的高价值利用及卡拉胶寡糖的深度开发提供参考,拓宽卡拉胶寡糖的应用范围。
6.为了实现上述目的,本发明的实施例在一方面提出了κ-卡拉胶寡糖在制备降血脂药物中的应用。
7.根据本发明实施例,κ-卡拉胶寡糖可通过竞争性抑制胰脂肪酶活性,ic
50
=6.25mg/ml,具有潜在的降血脂功效,以期为卡拉胶资源的高价值利用及卡拉胶寡糖的深度开发提供参考,拓宽卡拉胶寡糖的应用范围。
8.另外,根据本发明上述实施例提出的一种κ-卡拉胶寡糖在制备降血脂药物中的应用,还可以具有如下附加的技术特征:
9.可选地,所述κ-卡拉胶寡糖的平均聚合度为6。
10.可选地,所述κ-卡拉胶寡糖的制备包括:
11.向κ-卡拉胶溶液中加入κ-卡拉胶酶,于40℃下反应25min,得到平均聚合度为6的κ-卡拉胶寡糖。
12.可选地,所述κ-卡拉胶寡糖用于抑制胰脂肪酶的活性。
13.可选地,向30mlκ-卡拉胶溶液中加入2mlκ-卡拉胶酶溶液,于40℃下反应25min,得到平均聚合度为6的κ-卡拉胶寡糖。
14.可选地,所述κ-卡拉胶酶的浓度为46.30μg/ml。
15.可选地,所述κ-卡拉胶溶液中还包括质量分数0.5%,50mmol/l nah2po
4-na2hpo4溶液(ph 8.0)。
16.本发明的附加方面和优点将在下面的描述中部分给出,部分将从下面的描述中变得明显,或通过本发明的实践了解到。
附图说明
17.图1为根据本发明实施例的κ-卡拉胶降解曲线;
18.图2为根据本发明实施例的不同平均聚合度的κ-卡拉胶寡糖对胰脂肪酶活力的抑制作用;
19.图3为根据本发明实施例的奥利司他对胰脂肪酶活力的抑制作用;
20.图4为根据本发明实施例的不同浓度的dp6κ-卡拉胶寡糖对胰脂肪酶活力作用的抑制类型;
21.图5为根据本发明实施例的不同浓度的dp6κ-卡拉胶寡糖与胰脂肪酶的lineweaver-burk曲线。
具体实施方式
22.以下通过特定的具体实例说明本发明的技术方案。应理解,本发明提到的一个或多个方法步骤并不排斥在所述组合步骤前后还存在其他方法步骤或在这些明确提到的步骤之间还可以插入其他方法步骤;还应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。而且,除非另有说明,各方法步骤的编号仅为鉴别各方法步骤的便利工具,而非为限制各方法步骤的排列次序或限定本发明可实施的范围,其相对关系的改变或调整,在无实质变更技术内容的情况下,当亦视为本发明可实施的范畴。
23.为了更好的理解上述技术方案,下面更详细地描述本发明的示例性实施例。虽然显示了本发明的示例性实施例,然而应当理解,可以以各种形式实现本发明而不应被这里阐述的实施例所限制。相反,提供这些实施例是为了能够更透彻地理解本发明,并且能够将本发明的范围完整地传达给本领域的技术人员。
24.本发明采用的试材皆为普通市售品,皆可于市场购得。
25.需要说明的是:
26.下面参考具体实施例,对本发明进行描述,需要说明的是,这些实施例仅仅是描述性的,而不以任何方式限制本发明。
27.实施例1κ-卡拉胶寡糖的制备
28.κ-卡拉胶酶的诱导表达与纯化:含紫菜假交替单胞菌κ-卡拉胶酶基因的e.coli bl21工程菌由集美大学海洋食品与生物工程学院食品生物技术团队保存。将含重组质粒pet-28a-car的工程菌接种于50ml lb液体培养基(含50μg/ml卡那霉素),37℃、180rpm过夜培养。取3ml活化菌液接种到300ml lb液体培养基(含50μg/ml卡那霉素)中,37℃、180rpm培
养至od
600
达到0.8-1.0,然后添加终浓度为0.05mmol/l异丙基-β-d-硫代半乳糖苷(iptg),16℃、180rpm诱导表达20h。4℃、6000r/min离心15min,弃上清,收集菌体沉淀,加入10ml缓冲液(50mmol/l nah2po4,300mmol/l nacl,15mmol/l咪唑,ph 8.0)重悬细胞。冰浴条件下进行超声破菌后,4℃、12000r/min离心20min,收集上清,即为粗酶液。参照ge healthcare life sciences公司的金属镍螯合琼脂糖凝胶6ff使用说明书程序进行重组蛋白的分离纯化,获得纯化后的重组κ-卡拉胶酶。
29.不同平均聚合度κ-卡拉胶寡糖的制备:向30mlκ-卡拉胶溶液(底物质量分数0.5%,50mmol/l nah2po
4-na2hpo4溶液,ph 8.0)中加入20uκ-卡拉胶酶(2ml浓度46.30μg/ml的酶溶液),于40℃下反应,每10min取样一次,利用dns法和苯酚-硫酸法分别测定其还原糖和总糖含量,计算平均聚合度(平均聚合度=总糖含量/还原糖含量)。
30.结果如图1,根据κ-卡拉胶降解曲线,选取8、25、50min时间段分别制备dp2、6、10的κ-卡拉胶寡糖,反应完成后,加入反应2倍体积无水乙醇,沉淀未降解的卡拉胶,离心后取上清,样品经旋蒸、冻干后获得κ-卡拉胶寡糖,用于对胰脂肪酶活力的抑制研究。
31.实施例2不同聚合度κ-卡拉胶寡糖对胰脂肪酶的抑制
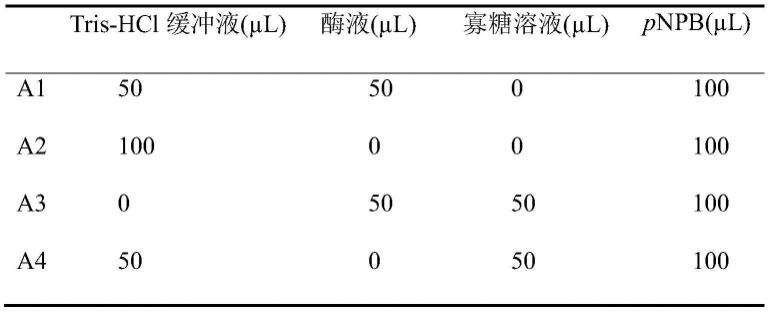
32.配置平均聚合度为2、6、10的κ-卡拉胶寡糖溶液(0、2、4、6、8、10mg/ml),溶于50mmol/l tris-hcl缓冲液(ph 8.0)中;配置胰脂肪酶溶液(100iu/ml),溶于50mmol/l tris-hcl缓冲液(ph 8.0)中。各取50μl不同平均聚合度的κ-卡拉胶寡糖溶液和胰脂肪酶溶液混合,置于37℃水浴锅中温育10min,再向其中添加100μl对硝基苯基丁酸盐(pnpb)底物溶液(1.0mmol/l,溶于二甲亚砜中)起始反应,在37℃下反应10min后,沸水浴10min终止反应,于405nm波长下测定其吸光度值。以未酶解κ-卡拉胶作为对照;奥利司他(orlistat)为阳性对照,溶于含10%二甲亚砜的tris-hcl溶液。每组实验体系设定3个平行实验。实验体系如下表:
33.表1胰脂肪酶抑制实验反应体系表
[0034][0035]
结果如图2所示,在质量浓度0~10mg/ml范围内,κ-卡拉胶寡糖组分dp2、dp6和dp10对胰脂肪酶活力有不同程度的抑制作用,而未酶解κ-卡拉胶对胰脂肪酶活力抑制效果不明显。其中平均聚合度dp6κ-卡拉胶寡糖对胰脂肪酶活力的抑制活性最强,且随着质量浓度增大;当dp6质量浓度为10mg/ml时,抑制率达到78.36%。平均聚合度dp2、6、10对胰脂肪酶活力的ic
50
分别为7.43mg/ml、6.25mg/ml、18.45mg/ml。奥利司他对胰脂肪酶活力的ic
50
为0.35mg/ml(图3)。由于dp6κ-卡拉胶寡糖对胰脂肪酶的抑制活性最强,选择该样品进行寡糖对胰脂肪酶抑制作用的酶促动力学分析。
[0036]
实施例3酶促动力学分析
[0037]
抑制类型分析:
[0038]
取50μl不同浓度(0、20、40、60、80和100iu/ml)的胰脂肪酶溶液与50μl dp6κ-卡拉胶寡糖溶液(4、6、8mg/ml)混匀并于37℃孵育10min,孵育结束后,加入100μl的pnpb溶液(1.0mmol/l),混匀后于37℃反应10min后,沸水浴10min终止反应,于405nm波长下测定各反应体系的吸光度。其中对照组表示不添加dp6寡糖组。计算反应速率(v,mmol/(ml
·
min))。以v为纵坐标,胰脂肪酶浓度为横坐标绘制曲线,根据曲线斜率进行反应的抑制类型分析。
[0039]
抑制机理分析:
[0040]
取50μl胰脂肪酶溶液(50iu/ml)与50μl dp6κ-卡拉胶寡糖溶液(4、6、8mg/ml)混匀并于37℃孵育10min。孵育结束后,加入100μl不同浓度的pnpb溶液(0.125、0.25、0.5、1.0和2.0mmol/l),混匀后于37℃反应10min,终止反应后,计算反应速率(v,mmol/(l
·
min))。以反应速率的倒数(1/v)对底物质量浓度的倒数(1/[s])作图,绘制lineweaver-burk双倒数曲线,计算最大反应速率(v
max
)和米氏常数(km),分析抑制机理。
[0041]
由图4可知,在固定底物浓度(1.0mmol/l)的情况下,有添加dp6和对照组(不添加dp6,空白对照),胰脂肪酶的酶促反应速率(v)均随胰脂肪酶浓度(0~100iu/ml)的增大而增加;添加不同浓度dp6后,v随dp6浓度的增加而降低,曲线斜率变小,并且所有曲线均过原点,表明dp6κ-卡拉胶寡糖对胰脂肪酶活力的抑制类型为可逆性抑制。由图5可知:在固定胰脂肪酶浓度(50iu/ml)的情况下,有添加dp6和对照组(不添加dp6,空白对照),1/v和1/[s]均呈线性正相关;所有曲线相交于y轴上同一点,即添加dp6后,v
max
不变,km增大。由此可判断dp6κ-卡拉胶寡糖对胰脂肪酶活力为竞争性抑制。综上所述,dp6κ-卡拉胶寡糖对胰脂肪酶活力的抑制作用为可逆竞争性抑制。
[0042]
综上,根据本发明的实施例,κ-卡拉胶经酶解获得dp2、dp6、dp10的κ-卡拉胶寡糖。dp6可以有效抑制胰脂肪酶活力(ic
50
=6.25mg/ml)。由此,κ-卡拉胶寡糖可通过竞争性抑制胰脂肪酶活性,具有潜在的降血脂功效。本技术基于酶活力分析模型评价κ-卡拉胶寡糖的潜在降血脂活性,为提升卡拉胶精深加工产业价值和促进卡拉胶寡糖在生物医药、功能食品等领域的应用奠定理论基础。
[0043]
在本说明书的描述中,参考术语“一个实施例”、“一些实施例”、“示例”、“具体示例”、或“一些示例”等的描述意指结合该实施例或示例描述的具体特征、结构、材料或者特点包含于本发明的至少一个实施例或示例中。在本说明书中,对上述术语的示意性表述不应理解为必须针对的是相同的实施例或示例。而且,描述的具体特征、结构、材料或者特点可以在任何的一个或多个实施例或示例中以合适的方式结合。此外,本领域的技术人员可以将本说明书中描述的不同实施例或示例进行接合和组合。
[0044]
尽管上面已经示出和描述了本发明的实施例,可以理解的是,上述实施例是示例性的,不能理解为对本发明的限制,本领域的普通技术人员在本发明的范围内可以对上述实施例进行变化、修改、替换和变型。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。