用于将细胞分类的机器学习方法
相关申请的交叉引用
1.本技术要求于2019年8月30日提交的标题为“用于将细胞分类的机器学习方法(machine learning methods for classifying cells)”的美国临时专利申请62/894,463的优先权,将其内容通过引用以其整体并入。通过引用并入序列表
2.本技术是与电子格式的序列表一起提交的。序列表以2020年8月28日创建的名为735042012340seqlist.txt的文件提供,其大小为22,780字节。将电子格式的序列表中的信息通过引用以其整体并入。
技术领域
3.本公开文本在一些方面涉及使用机器学习方法将细胞如t细胞分类的方法。所述方法可以用于将混合细胞群体中的不同细胞子集或类型分类。
背景技术:
4.过继细胞疗法通常用于治疗各种疾病和病症,所述过继细胞疗法包括使用基因工程化免疫细胞如被工程为表达重组受体(如嵌合抗原受体(car))的t细胞(例如,cd4 t细胞和/或cd8 t细胞)的疗法。用于表征细胞(例如在体外制造期间或在施用细胞疗法之前)的现有方法通常依赖于如通过与可能干扰细胞质量或功能的试剂(例如,磁珠或其他基于免疫亲和力的试剂)一起孵育来直接处理或操纵细胞的方法。此类方法可能是耗时的并且还可能有污染治疗性细胞组合物的风险。需要用于有效分类或表征细胞的改善的方法,所述细胞包括与细胞疗法相关的细胞。本文提供了满足此类需要的方法和设备。
技术实现要素:
5.本文提供了将t细胞分类的方法,所述方法包括:接收与含有t细胞的细胞群体中的第一t细胞相关的图像数据;从所述图像数据确定一个或多个输入特征,所述一个或多个输入特征包括所述图像数据的形态特征、所述图像数据的光学特征、所述图像数据的强度特征、所述图像数据的相位特征、所述图像数据的系统特征或其任何组合;将所述一个或多个输入特征作为输入应用到被配置为基于所述一个或多个输入特征将所述第一t细胞分类为属于第一组或第二组的过程。
6.本文提供了如下方法,所述方法包括接收与含有t细胞的细胞群体中的第一个t细胞相关的图像数据;确定所述第一t细胞属于第一组或第二组的分类;从所述图像数据确定一个或多个输入特征,所述一个或多个输入特征包括所述图像数据的形态特征、所述图像数据的光学特征、所述图像数据的强度特征、所述图像数据的相位特征、所述图像数据的系统特征或其任何组合,以及生成具有一个或多个维度的特征图,其中所述一个或多个维度的每个维度与所述图像数据的形态特征、所述图像数据的光学特征、所述图像数据的强度特征、所述图像数据的相位特征、所述图像数据的系统特征或其任何组合中的一个或多个
相关;基于所述特征图和所确定的分类训练卷积神经网络。
7.在一些实施方案中,所述过程包括应用使用本文所述的方法训练的卷积神经网络,并且将从与所述第一t细胞相关的图像数据确定的所述一个或多个输入特征作为输入应用到所述过程包括将所述一个或多个输入特征应用到所述卷积神经网络。
8.本文提供了将t细胞分类的方法,所述方法包括:接收与含有t细胞的细胞群体的第一t细胞相关的图像数据;从所述图像数据确定一个或多个输入特征,所述一个或多个输入特征包括所述图像数据的形态特征、所述图像数据的光学特征、所述图像数据的强度特征、所述图像数据的相位特征、所述图像数据的系统特征或其任何组合;将所述一个或多个输入特征作为输入应用到过程,所述过程包括在从与已知属于第一组的t细胞和已知属于第二组的t细胞相关的图像数据确定的一个或多个输入特征上训练的卷积神经网络,所述一个或多个输入特征包括所述图像数据的形态特征、所述图像数据的光学特征、所述图像数据的强度特征、所述图像数据的相位特征、所述图像数据的系统特征或其任何组合,从而将所述第一t细胞分类为属于所述第一组或所述第二组。
9.本文提供了如下方法,所述方法包括接收与含有t细胞的细胞群体的第一t细胞相关的图像数据;确定所述第一t细胞属于第一组或第二组的分类;从所述图像数据确定一个或多个输入特征,所述一个或多个输入特征包括所述图像数据的形态特征、所述图像数据的光学特征、所述图像数据的强度特征、所述图像数据的相位特征、所述图像数据的系统特征或其任何组合;在所述输入特征和所确定的分类上训练神经网络。
10.在一些实施方案中,所述过程包括应用根据本文所述的方法训练的神经网络,并且将从与所述第一t细胞相关的图像数据确定的所述一个或多个输入特征作为输入应用到所述过程包括将所述一个或多个输入特征应用到所述神经网络。
11.本文提供了将t细胞分类的方法,所述方法包括:接收与含有t细胞的细胞群体中的第一t细胞相关的图像数据;从所述图像数据确定一个或多个输入特征,所述一个或多个输入特征包括所述图像数据的形态特征、所述图像数据的光学特征、所述图像数据的强度特征、所述图像数据的相位特征、所述图像数据的系统特征或其任何组合;将所述一个或多个输入特征作为输入应用到过程,所述过程包括在从与已知属于第一组的t细胞和已知属于第二组的t细胞相关的图像数据确定的一个或多个输入特征上训练的神经网络,所述一个或多个输入特征包括所述图像数据的形态特征、所述图像数据的光学特征、所述图像数据的强度特征、所述图像数据的相位特征、所述图像数据的系统特征或其任何组合,从而将所述第一t细胞分类为属于所述第一组或所述第二组。
12.本文提供了如下方法,所述方法包括接收与含有t细胞的细胞群体的第一t细胞相关的图像数据;确定所述第一t细胞属于第一组或第二组的分类;以及确定用于支持向量机的超平面,所述超平面指示在所述第一组与所述第二组之间的决策边界,其中所述超平面是基于从所述图像数据确定的一个或多个输入特征确定的,所述一个或多个输入特征包括所述图像数据的形态特征、所述图像数据的光学特征、所述图像数据的强度特征、所述图像数据的相位特征、所述图像数据的系统特征或其任何组合。
13.在一些实施方案中,所述过程包括利用使用本文所述的方法确定的超平面应用支持向量机;并且将从与所述第一t细胞相关的图像数据确定的所述一个或多个输入特征作为输入应用到所述过程包括将所述一个或多个输入特征应用到所述支持向量机。
14.本文提供了将t细胞分类的方法,所述方法包括:接收与含有t细胞的细胞群体中的第一t细胞相关的图像数据;从所述图像数据确定一个或多个输入特征,所述一个或多个输入特征包括所述图像数据的形态特征、所述图像数据的光学特征、所述图像数据的强度特征、所述图像数据的相位特征、所述图像数据的系统特征或其任何组合;将所述一个或多个输入特征作为输入应用到过程,所述过程包括在从与已知属于第一组的t细胞和已知属于第二组的t细胞相关的图像数据确定的一个或多个输入特征上训练的支持向量机,所述一个或多个输入特征包括所述图像数据的形态特征、所述图像数据的光学特征、所述图像数据的强度特征、所述图像数据的相位特征、所述图像数据的系统特征或其任何组合,从而将所述第一t细胞分类为属于所述第一组或所述第二组。
15.本文提供了如下方法,所述方法包括接收与含有t细胞的细胞群体的第一t细胞相关的图像数据;确定所述第一t细胞属于第一组或第二组的分类;以及确定用于分类过程的随机森林,所述随机森林包括一个或多个决策树,所述分类过程将从与所述第一t细胞相关的图像数据确定的一个或多个输入特征与所述第一t细胞属于所述第一组或属于所述第二组的分类相关联,其中所述一个或多个决策树中的决策树是基于所述一个或多个输入特征确定的,所述一个或多个输入特征包括所述图像数据的形态特征、所述图像数据的光学特征、所述图像数据的强度特征、所述图像数据的相位特征、所述图像数据的系统特征或其任何组合。
16.在一些实施方案中,所述过程包括使用本文所述的方法确定的随机森林;并且将从与所述第一t细胞的图像相关的图像数据确定的所述一个或多个输入特征作为输入应用到所述过程包括将所述一个或多个输入特征应用到所述随机森林。
17.本文提供了将t细胞分类的方法,所述方法包括:接收与含有t细胞的细胞群体中的第一t细胞相关的图像数据;从所述图像数据确定一个或多个输入特征,所述一个或多个输入特征包括所述图像数据的形态特征、所述图像数据的光学特征、所述图像数据的强度特征、所述图像数据的相位特征、所述图像数据的系统特征或其任何组合;将所述一个或多个输入特征作为输入应用到过程,所述过程包括涉及从与已知属于第一组的t细胞和已知属于第二组的t细胞相关的图像数据确定的一个或多个输入特征的随机森林分类过程,所述一个或多个输入特征包括所述图像数据的形态特征、所述图像数据的光学特征、所述图像数据的强度特征、所述图像数据的相位特征、所述图像数据的系统特征或其任何组合,从而将所述第一t细胞分类为属于所述第一组或所述第二组。
18.本文提供了如下方法,所述方法包括:接收与含有t细胞的细胞群体的第一t细胞相关的图像数据,所述图像数据包括相位图像数据、强度图像数据和叠加图像数据中的一个或多个;确定所述第一t细胞属于第一组或第二组的分类;从所述图像数据生成具有一个或多个维度的特征图;基于所述特征图和所确定的分类训练卷积神经网络。
19.本文提供了将t细胞分类的方法,所述方法包括:接收与含有t细胞的细胞群体的第一t细胞相关的图像数据,其中所述图像数据包括相位图像数据、强度图像数据和叠加图像数据中的一个或多个;将所述图像数据作为输入应用到过程,所述过程包括在与已知属于第一组的t细胞和已知属于第二组的t细胞相关的图像数据上训练的卷积神经网络,其中所述图像包括图像数据,包括相位图像数据、强度图像数据和叠加图像数据中的一个或多个,从而将所述第一t细胞分类为属于所述第一组或所述第二组。
20.本文提供了将t细胞分类的方法,所述方法包括:接收与包含t细胞的细胞群体的多个t细胞的每个细胞相关的图像数据,其中所述图像数据包括相位图像数据、强度图像数据和叠加图像数据中的一个或多个;将来自所述多个t细胞中每个细胞的图像数据作为输入应用到过程,所述过程包括在与已知属于第一组的t细胞和已知属于第二组的t细胞相关的图像数据上训练的卷积神经网络,其中所述图像数据包括相位图像数据、强度图像数据和叠加图像数据中的一个或多个,从而将所述多个t细胞的每个细胞分类为属于所述第一组或所述第二组。
21.本文提供了用于将t细胞分类的方法,所述方法包括:接收与包含t细胞的细胞群体的多个t细胞的每个细胞相关的图像数据,其中所述图像数据包括相位图像数据、强度图像数据和叠加图像数据中的一个或多个;将来自所述多个t细胞中每个细胞的图像数据作为输入应用到过程,所述过程被配置为基于所述图像数据将所述多个t细胞的每个细胞分类为属于第一组或第二组。
22.本文提供了如下方法,所述方法包括:接收与包含t细胞的细胞群体的多个t细胞的每个细胞相关的图像数据,所述图像数据包括相位图像数据、强度图像数据和叠加图像数据中的一个或多个;确定所述多个t细胞的每个细胞属于第一组或第二组的分类;基于所述图像数据和所确定的分类训练卷积神经网络。
23.在一些实施方案中,所述过程包括应用使用本文所述的方法训练的卷积神经网络;并且将与所述多个t细胞的每个细胞相关的图像数据作为输入应用到所述过程包括将所述图像数据应用到所述卷积神经网络。
24.在一些实施方案中,所述卷积神经网络进一步在与已知属于所述第一组的t细胞和已知属于所述第二组的t细胞相关的图像数据上训练,其中所述图像数据已经通过缩放、偏斜和/或旋转所述图像数据进行操纵。
[0025][0026]
在一些实施方案中,所述过程如本文所述的过程被配置为将含有t细胞的细胞群体中约或至少70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的t细胞分类为属于所述第一组或属于所述第二组。在一些实施方案中,将含有t细胞的细胞群体中的t细胞中的每个细胞通过所述过程进行分类。在一些实施方案中,将含有t细胞的细胞群体中的多个t细胞的每个细胞都通过所述过程进行分类。在一些实施方案中,所述多个t细胞包括含有t细胞的细胞群体中约或至少70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的t细胞。
[0027]
本文提供了生成用于训练机器学习模型的细胞数据集的方法,所述方法包括:(a)提供含有至少第一和第二不同细胞类型的混合细胞群体,其中至少所述第一细胞类型表达不被所述混合细胞群体中的其他细胞类型表达的至少一种表面分子;(b)使所述混合细胞群体与可逆地结合至多个第一结合剂的第一多聚化试剂接触,所述第一结合剂中的每一个包含能够结合由所述第一细胞类型表达的表面分子的单价结合位点;以及(c)通过基于免疫亲和力的色谱法分离与所述第一结合剂结合的第一细胞类型的一个或多个细胞,从而获得第一细胞数据集,其中所述分离是在可逆地从所述第一结合剂解离所述第一多聚化试剂的条件下进行的;其中所述第一细胞数据集基本上不含所述第一多聚化试剂和所述第一结合剂。在一些实施方案中,所述至少一种第一细胞类型表达重组表面分子。在一些实施方案
中,所述重组表面分子是重组受体。在一些实施方案中,所述重组受体是嵌合抗原受体或t细胞受体。在一些实施方案中,在(c)之前,所述方法产生不与所述第一结合剂结合的第二细胞群体,所述第二细胞群体含有不表达由所述第一细胞类型表达的表面分子的细胞,从而获得第二细胞数据集。在一些实施方案中,所述第一细胞类型和所述第二细胞类型中的每一种表达不被所述混合细胞群体中的其他细胞类型表达的至少一种表面分子。
[0028]
在一些实施方案中,所述方法进一步包括(d)使混合细胞群体与可逆地结合至多个第二结合剂的第二多聚化试剂接触,所述第二结合剂中的每一个包含能够结合由所述第二细胞类型表达的表面分子的单价结合位点;以及(e)通过基于免疫亲和力的色谱法分离与所述第二结合剂结合的第二细胞类型的一个或多个细胞,从而获得第二细胞数据集,其中所述分离是在可逆地从所述第二结合剂解离所述第二多聚化试剂的条件下进行的;其中所述第二细胞数据集基本上不含所述第二多聚化试剂和所述第二结合剂。在一些实施方案中,所述混合细胞群体进一步包含第三细胞类型,所述第三细胞类型表达不被所述混合细胞群体中的其他细胞类型表达的至少一种表面分子,并且所述方法进一步包括:(f)使所述混合细胞群体与可逆地结合至多种第三结合剂的第三多聚化试剂接触,所述第三结合剂中的每一种包含能够结合由所述第三细胞类型表达的表面分子的单价结合位点;以及(e)通过基于免疫亲和力的色谱法分离与所述第三结合剂结合的第三细胞类型的一个或多个细胞,从而获得第三细胞数据集,其中所述分离是在可逆地从所述第三结合剂解离所述第三多聚化试剂的条件下进行的;其中所述第三细胞数据集基本上不含所述第三多聚化试剂和所述第三结合剂。在一些实施方案中,这对于一种或多种另外的不同细胞类型是重复的。
[0029]
在一些实施方案中,在(c)之前,所述方法产生不与所述第一结合剂结合的第二细胞群体,所述第二细胞群体含有不表达由所述第一细胞类型表达的表面分子的细胞,并且所述方法进一步包括:(d)使所述第二细胞群体与可逆地结合至多个第二结合剂的第二多聚化试剂接触,所述第二结合剂中的每一个包含能够结合由所述第二细胞类型表达的表面分子的单价结合位点;以及(e)通过基于免疫亲和力的色谱法分离与所述第二结合剂结合的第二细胞类型的一个或多个细胞,从而获得第二细胞数据集,其中所述分离是在可逆地从所述第二结合剂解离所述第二多聚化试剂的条件下进行的;其中所述第二细胞数据集基本上不含所述第二多聚化试剂和所述第二结合剂。在一些实施方案中,在(e)之前,所述方法产生不与所述第二结合剂结合的第三细胞群体,所述第三细胞群体包含不表达由所述第一细胞类型和所述第二细胞类型表达的表面分子的细胞,并且所述方法进一步包括:(d)使所述第三细胞群体与可逆地结合至多种第三结合剂的第三多聚化试剂接触,所述第三结合剂中的每一种包含能够结合由所述第三细胞类型表达的表面分子的单价结合位点;以及(e)通过基于免疫亲和力的色谱法分离与所述第三结合剂结合的第三细胞类型的一个或多个细胞,从而获得第三细胞数据集,其中所述分离是在可逆地从所述第三结合剂解离所述第三多聚化试剂的条件下进行的;其中所述第三细胞数据集基本上不含所述第三多聚化试剂和所述第三结合剂。在一些实施方案中,这对于一种或多种不同的细胞类型是重复的。
[0030]
在一些实施方案中,所述第一细胞类型和所述第二细胞类型是(i)cd4 t细胞和(ii)cd8 t细胞中的一种,并且所述第二细胞类型是(i)cd4 t细胞和(ii)cd8 t细胞中的另一种。
[0031]
在一些实施方案中,所述接触是通过将所述细胞添加至包含固定相的色谱柱进行
的,在所述固定相上固定有与所述结合剂可逆地结合的多聚化试剂(例如,与所述第一结合剂可逆地结合的第一多聚化试剂、与所述第二结合剂可逆地结合的第二多聚化试剂或与所述第三结合剂可逆地结合的第三多聚化试剂)。在一些实施方案中,所述分离包括从所述色谱柱洗脱所述细胞。
[0032]
在一些实施方案中,所述第一结合剂进一步包括能够与所述第一多聚化试剂形成可逆键的结合配偶体,其中:所述结合配偶体包括seq id no:6、7、8、9或10所示的氨基酸序列;并且所述第一多聚化试剂包括链霉亲和素、链霉亲和素突变蛋白、亲和素或亲和素突变蛋白。在一些实施方案中,所述第二结合剂进一步包括能够与所述第二多聚化试剂形成可逆键的结合配偶体,其中:所述结合配偶体包括seq id no:6、7、8、9或10所示的氨基酸序列;并且所述第二多聚化试剂包括链霉亲和素、链霉亲和素突变蛋白、亲和素或亲和素突变蛋白。在一些实施方案中,所述第三结合剂进一步包括能够与所述第三多聚化试剂形成可逆键的结合配偶体,其中:所述结合配偶体包括seq id no:6、7、8、9或10所示的氨基酸序列;并且所述第三多聚化试剂包括链霉亲和素、链霉亲和素突变蛋白、亲和素或亲和素突变蛋白。在一些实施方案中,所述链霉亲和素突变蛋白包括seq id no:12、13、15或16所示的氨基酸序列。在一些实施方案中,所述可逆键具有在约10-2
至约10-13
m的范围内的解离常数(kd)。在一些实施方案中,所述单价结合位点是fab片段、sdab、fv片段或单链fv片段。在一些实施方案中,在所述单价结合位点与所述表面分子之间的键具有在约10-3
至约10-7
m的范围内的解离常数(kd)。在一些实施方案中,在所述单价结合位点与所述表面分子之间的键具有约3x10-5
sec-1
或更大的解离速率常数。在一些实施方案中,所述可逆解离包括添加竞争试剂。在一些实施方案中,所述竞争试剂是生物素或生物素类似物。
[0033]
在一些实施方案中,所述方法进一步包括接收与所述第一细胞数据集的细胞相关的图像数据,所述图像数据包括相位图像数据、强度图像数据和叠加图像数据中的一个或多个。在一些实施方案中,接收与所述第二细胞数据集的细胞相关的图像数据,所述图像数据包括相位图像数据、强度图像数据和叠加图像数据中的一个或多个。在一些实施方案中,所述方法进一步包括接收与所述第三细胞数据集的细胞相关的图像数据,所述图像数据包括相位图像数据、强度图像数据和叠加图像数据中的一个或多个。在一些实施方案中,所述方法进一步包括接收与所述第一细胞数据集的细胞相关的图像数据;从所述图像数据确定一个或多个输入特征,所述一个或多个输入特征包括所述图像数据的形态特征、所述图像数据的光学特征、所述图像数据的强度特征、所述图像数据的相位特征、所述图像数据的系统特征或其任何组合。在一些实施方案中,所述方法进一步包括接收与所述第二细胞数据集的细胞相关的图像数据;从所述图像数据确定一个或多个输入特征,所述一个或多个输入特征包括所述图像数据的形态特征、所述图像数据的光学特征、所述图像数据的强度特征、所述图像数据的相位特征、所述图像数据的系统特征或其任何组合。在一些实施方案中,所述方法进一步包括接收与所述第三细胞数据集的细胞相关的图像数据;从所述图像数据确定一个或多个输入特征,所述一个或多个输入特征包括所述图像数据的形态特征、所述图像数据的光学特征、所述图像数据的强度特征、所述图像数据的相位特征、所述图像数据的系统特征或其任何组合。
[0034]
在一些实施方案中,所述方法进一步包括从所述图像数据生成具有一个或多个维度的特征图;基于所述特征图训练卷积神经网络。在一些实施方案中,所述方法进一步包括
在所述输入特征上训练神经网络。在一些实施方案中,所述方法进一步包括确定与支持向量机相关的超平面,所述确定基于所述一个或多个输入特征。在一些实施方案中,所述方法进一步包括确定随机森林的一个或多个决策树,所述确定基于所述一个或多个输入特征。
[0035]
在一些实施方案中,图像数据是从含有t细胞的细胞群体的约或至少70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的t细胞接收的。在一些实施方案中,所述图像数据包括相位图像数据、强度图像数据和叠加图像数据中的一个或多个。在一些实施方案中,使用差分数字全息显微术(ddhm)获得所述图像数据。在一些实施方案中,使用约20x的物镜获得所述图像数据。在一些实施方案中,使用ccd相机获得所述图像数据。
[0036]
在一些实施方案中,与所述t细胞相关的图像数据用于确定一个或多个输入特征,所述一个或多个输入特征包括所述图像数据的形态特征、所述图像数据的光学特征、所述图像数据的强度特征、所述图像数据的相位特征、所述图像数据的系统特征或其任何组合。在一些实施方案中,所述一个或多个输入特征包括以下中的一个或多个:所述细胞的纵横比、细胞深度、细胞的面积、细胞描述符、细胞标识符、图像标识符、对象标识符、沿x轴的质量中心、沿y轴的质量中心、所述细胞的圆度、所述细胞的紧密度、归一化纵横比、所述细胞的伸长率、所述细胞的直径、峰直径、hu不变矩1、hu不变矩2、hu不变矩3、hu不变矩4、hu不变矩5、hu不变矩6、hu不变矩7、平均强度对比度、平均熵、平均强度、平均强度均匀性、所述细胞的图像的强度对比度、所述细胞的图像的强度相关性、所述细胞的图像的强度熵、所述细胞的图像的强度同质性、所述细胞的最大强度、所述细胞的平均强度、所述细胞的最小强度、所述细胞的图像的强度偏斜度、所述细胞的图像的强度平滑度、所述细胞的图像的强度方差、所述细胞的图像的强度均匀性、所述细胞的强度最大的平面、细胞位于视场边界的指示、折射峰位于视场边界的指示、所述细胞的质量偏心率、以弧度计的所述细胞的最大光学高度、以微米计的所述细胞的最大光学高度、以弧度计的所述细胞的平均光学高度、以微米计的所述细胞的平均光学高度、所述细胞的归一化光学高度、以弧度计的所述细胞的最小光学高度、以微米计的所述细胞的最小光学高度、以弧度计的所述细胞的图像相位的光学高度的方差、以微米计的所述细胞的图像相位的光学高度的方差、所述细胞的光学体积、所述细胞的折射峰面积、通过所述细胞的面积归一化的折射峰面积、所述细胞的折射峰数量、所述细胞的折射峰强度、所述细胞的归一化折射峰高度、周长、所述细胞的相位图像的平均强度对比度、所述细胞的相位图像的平均熵、所述细胞的平均相位、所述细胞的平均相位均匀性、所述细胞的相位强度对比度、所述细胞的相位相关性、所述细胞的相位熵特征、所述细胞的相位同质性、所述细胞的相位偏斜度、所述细胞的相位平滑度、所述细胞的相位均匀性、所述细胞的半径的平均值、所述细胞的半径的方差以及所述细胞的归一化半径方差。在一些实施方案中,所述输入特征包括约或至少70、65、60、55、50、45、40、35、30、25、20、15、10、9、8、7、6、5、4、3、2或1个输入特征。在一些实施方案中,所述输入特征包括约1至约70、约1至约60、约1至约50、约1至约40、约1至约30、约1至约20、约1至约15、约1至约10或约1至约5个输入特征。在一些实施方案中,所述输入特征包括少于或少于约70、65、60、55、50、45、40、35、30、25、20、15、10或5个输入特征。在一些实施方案中,所述输入特征包括少于或少于约20、15、10或5个输入特征。
[0037]
在一些实施方案中,所述一个或多个输入特征是所述图像数据的形态特征,所述
形态特征选自以下中的一个或多个:所述细胞的纵横比、所述细胞的面积、所述细胞的圆度、所述细胞的紧密度、归一化纵横比、所述细胞的伸长率、所述细胞的直径、hu不变矩1、hu不变矩2、hu不变矩3、hu不变矩4、hu不变矩5、hu不变矩6、hu不变矩7、周长、所述细胞的半径的平均值、所述细胞的半径的方差和归一化半径方差。在一些实施方案中,所述一个或多个输入特征是细胞的面积。在一些实施方案中,所述一个或多个输入特征是所述图像数据的光学特征,所述光学特征选自以下中的一个或多个:所述细胞的直径、所述细胞的最大强度、所述细胞的平均强度、所述细胞的最小强度、所述细胞的质量偏心率、以弧度计的所述细胞的最大光学高度、以微米计的所述细胞的最大光学高度、以弧度计的所述细胞的平均光学高度、以微米计的所述细胞的平均光学高度、所述细胞的归一化光学高度、以弧度计的所述细胞的最小光学高度、以微米计的所述细胞的最小光学高度、所述细胞的光学体积、所述细胞的折射峰面积、通过所述细胞的面积归一化的折射峰面积、所述细胞的折射峰数量、所述细胞的折射峰强度和所述细胞的归一化折射峰高度。在一些实施方案中,所述输入特征中的一个或多个是所述图像数据的强度特征,所述强度特征选自以下中的一个或多个:平均强度对比度、平均熵、平均强度、平均强度均匀性、所述细胞的图像的强度对比度、所述细胞的图像的强度相关性、所述细胞的图像的强度熵、所述细胞的图像的强度同质性、所述细胞的图像的强度偏斜度、所述细胞的图像的强度平滑度、所述细胞的图像的强度方差、所述细胞的强度最大的平面和所述细胞的图像的强度均匀性。在一些实施方案中,所述一个或多个输入特征是所述图像数据的相位特征,所述相位特征选自以下中的一个或多个:以弧度计的所述细胞的图像相位的光学高度的方差、以微米计的所述细胞的图像相位的光学高度的方差、所述细胞的相位图像的平均强度对比度、所述细胞的相位图像的平均熵、所述细胞的平均相位、所述细胞的平均相位均匀性、所述细胞的相位强度对比度、所述细胞的相位相关性、所述细胞的相位熵特征、所述细胞的相位同质性、细胞的相位偏斜度、细胞的相位平滑度和所述细胞的相位均匀性。在一些实施方案中,所述一个或多个输入特征是或包括所述细胞的相位相关性。在一些实施方案中,所述一个或多个输入是所述图像数据的系统特征,所述系统特征选自以下中的一个或多个:细胞深度、鉴定的细胞、图像标识符、细胞描述符、沿x轴的质量中心、沿y轴的质量中心、对象标识符、细胞位于视场边界的指示和折射峰位于视场边界的指示。在一些实施方案中,所述一个或多个输入特征是或包括细胞深度。
[0038]
在一些实施方案中,所述第一组和第二组通过选自以下的一种或多种细胞属性来定义:活的、死的、cd4 、cd8 、重组受体阳性或重组受体阴性,其中所述第一组和第二组包含至少一种不同的属性。在一些实施方案中,所述第一组或第二组中的一个包含属性活的并且另一组包含属性死的。在一些实施方案中,属性死的包括非活细胞和碎片。在一些实施方案中,属性活的包括单个活细胞或活细胞集群。在一些实施方案中,所述一个或多个输入特征包括所述细胞的相位相关性、所述细胞的面积、所述细胞的折射峰数量、细胞的相位偏斜度、峰直径、通过所述细胞的面积归一化的折射峰面积、所述细胞的半径的方差、所述细胞的图像的强度均匀性、所述细胞的紧密度、所述细胞的相位强度对比度、归一化半径方差和所述细胞的圆度。在一些实施方案中,所述一个或多个输入特征包括所述细胞的相位相关性。在一些实施方案中,所述一个或多个输入特征包括所述细胞的面积。
[0039]
在一些实施方案中,所述第一组或第二组中的一个包含属性cd4 并且另一组包含
属性cd8 。在一些实施方案中,所述一个或多个输入特征包括所述细胞的平均相位均匀性、峰直径、所述细胞的归一化折射峰高度、所述细胞的平均相位、通过所述细胞的面积归一化的折射峰面积、以微米计的所述细胞的最小光学高度、所述细胞的紧密度、所述细胞的圆度、细胞的相位平滑度、所述细胞的图像的强度同质性、所述细胞的强度最大的平面、所述细胞的折射峰面积、所述细胞的相位相关性、细胞深度、细胞的图像的强度对比度、所述细胞的图像的强度均匀性、归一化半径方差、所述细胞的图像的强度平滑度、所述细胞的相位强度对比度、所述细胞的最大光学高度、所述细胞的平均强度对比度、所述细胞的平均强度均匀性、所述细胞的图像的强度偏斜度、hu不变矩1、所述细胞的图像的强度方差、平均熵和所述细胞的图像的强度相关性。在一些实施方案中,所述一个或多个输入特征包括细胞深度、所述细胞的图像的强度对比度、所述细胞的图像的强度均匀性、归一化半径方差、所述细胞的图像的强度平滑度、所述细胞的相位强度对比度、以微米计的所述细胞的最大光学高度、所述细胞的平均强度对比度、所述细胞的平均强度均匀性、所述细胞的图像的强度偏斜度、hu不变矩1、所述细胞的图像的强度方差、平均熵和所述细胞的图像的强度相关性。在一些实施方案中,所述一个或多个输入特征包括细胞深度。在一些实施方案中,所述一个或多个输入特征包括所述细胞的平均相位均匀性、峰直径、所述细胞的归一化折射峰高度、所述细胞的平均相位、通过所述细胞的面积归一化的折射峰面积、以微米计的所述细胞的最小光学高度、所述细胞的紧密度、所述细胞的圆度、细胞的相位平滑度、所述细胞的图像的强度同质性、所述细胞的强度最大的平面、所述细胞的折射峰面积和所述细胞的相位相关性。
[0040]
在一些实施方案中,所述第一组或第二组中的一个包含属性重组受体阳性并且另一组包含属性重组受体阴性。
[0041]
在一些实施方案中,含有t细胞的细胞群体包括从生物样品或混合t细胞亚型群体富集或纯化的t细胞群体。在一些实施方案中,所述富集或纯化的群体是通过混合从生物样品富集或纯化的t细胞群体获得的。在一些实施方案中,所述生物样品包括全血样品、血沉棕黄层样品、外周血单个核细胞(pbmc)样品、未分级t细胞样品、淋巴细胞样品、白细胞样品、单采术产物或白细胞单采术产物。在一些实施方案中,含有t细胞的细胞群体包括从受试者获得的原代细胞。在一些实施方案中,含有t细胞的细胞群体包括用包含重组受体的载体转导的t细胞的群体。在一些实施方案中,从中对一种或多种t细胞分类的t细胞群体包括经历制造以生成治疗性t细胞组合物的t细胞群体。在一些实施方案中,所述制造包括在用包含重组受体的载体转导所述t细胞群体之后的孵育步骤。在一些实施方案中,所述重组受体是嵌合抗原受体(car)。
[0042]
在一些实施方案中,已知属于第一组的t细胞和已知属于第二组的t细胞是或包括正在经历制造以生成治疗性t细胞组合物的t细胞。在一些实施方案中,已知属于第一组的t细胞和已知属于第二组的t细胞的制造与从中对一种或多种t细胞分类的t细胞群体的制造是相同的或几乎相同的。
[0043]
在一些实施方案中,含有t细胞的细胞群体中的所述一种或多种t细胞是在所述孵育步骤期间的不同时间点进行分类。在一些实施方案中,含有t细胞的细胞群体中的所述一种或多种t细胞是在孵育期的持续时间内进行连续分类。在一些实施方案中,将含有t细胞的细胞群体中的所述一种或多种t细胞分类发生在封闭系统中。在一些实施方案中,所述封
闭系统是无菌的。在一些实施方案中,所述封闭系统是自动化的。
附图说明
[0044]
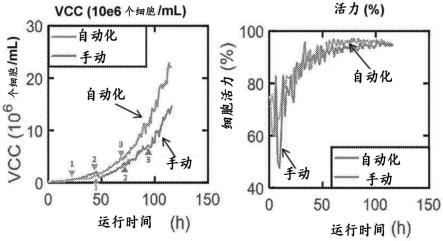
图1a和图1b描绘了在实验运行1(图1a)和运行2(图1b)中使用通过差分dhm的连续监测(“连续”,线)或手动采样(“手动”,点)评估的活细胞计数(vcc;x106个细胞/ml)、细胞活力(%)和细胞直径(μm)。顶图描绘了每一个的测量值,底图描绘了线性回归分析以及r2和斜率,用于比较连续监测和手动采样。
[0045]
图2a-图2d描绘了对于来自实验1供体1(图2a)、实验1供体2(图2b)或实验2供体3(图2c)的cd4 细胞或者来自实验2供体3(图2d)的cd8 细胞,使用通过差分dhm的连续监测(“连续”,线)或手动采样(“手动”,点)评估的活细胞计数(vcc;x106个细胞/ml)、细胞活力(%)和细胞直径(μm)。顶图描绘了每一个的测量值,底图描绘了线性回归分析以及r2和斜率,用于比较连续监测和手动采样。
[0046]
图3描绘了与手动扩增过程相比,在自动扩增过程中使用通过差分dhm的连续监测评估的活细胞计数(vcc;x106个细胞/ml)和细胞活力(%)。
[0047]
图4显示了梯度提升的随机森林分类器使用特征的相对重要性来预测细胞活力。
[0048]
图5a-图5c显示了梯度提升的随机森林分类器在接种时间上重现活力测量的准确性,所述活力测量是通过涉及光学成像的替代活力预测模型预测的,所述替代活力预测模型还使用从细胞图像(例如,全息图)提取的特征通过机器学习方法根据每个细胞的测试数据预测活力。图5a显示了梯度提升的随机森林分类器相对于替代活力预测模型预测随接种时间变化的“活”/“死”分类的准确性。图5b显示了随时间而变的总体“活”百分比的比较,“实际值”:由替代活力预测模型做出的预测;“预测值”:通过梯度提升的随机森林分类器预测的百分比。图5c显示了在替代活力预测模型预测与通过梯度提升的随机森林分类器做出的预测之间的相对差异。
[0049]
图6a显示了被替代活力预测模型分类为“活”但被深度学习模型分类为“死”的对象的两个图像。图6b显示了被替代活力预测模型分类为“集群”但显现为具有附属物的单独活t细胞的对象的两个图像。
[0050]
图7描绘了显示用于预测cd4和cd8 t细胞类型的随机森林模型中14种最常用特征的相对重要性的条形图。
[0051]
图8显示了具有鉴定的细胞的图像分割掩模;框表示来自scikit图像的鉴定的细胞对象。
[0052]
图9显示了提取的细胞图像的3d图。相对z等高线显示在x和y轴上,并且鉴定的帽子显示在z轴上。帽子代表细胞图像表面的峰。
具体实施方式
[0053]
本文提供了用于使用包括机器学习模型的分类过程将细胞群体(例如,包含t细胞的细胞群体)中的单独细胞(例如,t细胞)分类(例如,预测)的方法。在特定实施方案中,所述方法包括使用机器学习模型,所述机器学习模型被训练为将细胞群体(例如,包含t细胞的细胞群体)中的单独细胞(例如,t细胞)分类为属于一个组,其中所述组是通过一种或多种细胞属性定义的。细胞属性包括但不限于细胞健康(例如,活(viable)(活(live))、死)、
细胞周期状态、分化状态、激活状态、细胞亚型(cd4 、cd8 t细胞)和/或工程化状态(例如,t细胞是否表达重组受体(例如,嵌合抗原受体(car)、t细胞受体(tcr))。在一些实施方案中,所述机器学习模型被训练为分类(例如,预测)细胞亚型身份(例如,cd4 、cd8 )。在一些实施方案中,所述机器学习模型被训练为分类(例如,预测)所述细胞是否健康(例如,是活的或非凋亡的)。在一些实施方案中,所述机器学习模型被训练为分类(例如,预测)所述细胞是否被激活。在一些实施方案中,所述机器学习模型被训练为分类(例如,预测)所述细胞是否分化。在一些实施方案中,所述机器学习模型被训练为分类(例如,预测)所述细胞是否已经进入或处于细胞周期中。在一些实施方案中,所述机器学习模型被训练为分类(例如,预测)所述细胞是否表达重组分子(例如,car、tcr)。
[0054]
用于确定或鉴定细胞(例如t细胞)是否属于特定组的现有方法可以使用技术如免疫组织化学、免疫细胞化学或者细胞分选技术如facs、macs或色谱法进行鉴定。然而,这些方法可能会损害或破坏目的细胞。如果所述细胞用于例如治疗性细胞产物中,那么这可能是有问题的。产物例如在制造(其中使用损害性或破坏性方法将细胞分类)期间的重复采样可能会耗尽总治疗性细胞群体并且无意地增加制造持续时间以及增加污染的可能性。
[0055]
所提供的方法涉及其中在不需要例如通过免疫组织化学、免疫细胞化学、细胞分选处理所述细胞的情况下可以将细胞(例如t细胞)分类为属于特定组的方法。所提供的方法是基于在不需要对细胞例如通过免疫组织化学、免疫细胞化学、细胞分选进行另外处理的情况下确定或鉴定来自细胞如细胞群体中的细胞(例如,含有t细胞的细胞群体中的t细胞)的捕获的图像(例如,光学图像)的细胞(例如,t细胞)的差异。因此,在一些实施方案中,可以对细胞群体进行成像(例如,经由显微术技术,如下文所述),并且通过成像过程的图像数据输出可以用作如本文所述的分类过程(例如,机器学习模型)的输入。
[0056]
所提供的方法为其他将细胞分类的方法提供了优点。在本文提供的用于将细胞分类的方法(包括其实施方案)中,可以使用非破坏性、非损害性方法将细胞群体的细胞(例如,含有t细胞的细胞群体的t细胞)分类。例如,在一些实施方案中,成像的细胞在未损害状态中和/或在无菌条件下返回到细胞群体(例如,治疗性细胞产物)。所提供的方法还可以提供用于将细胞分类的客观且公正的方法。这不同于许多可用的方法,包括涉及纯手动(例如,人工)评估图像数据或输入特征以将细胞分类的方法,这些方法既费力、主观又容易出现人为误差。机器学习模型已显示出可用于客观地分类数据。
[0057]
在所提供的方法的方面中,待评估的细胞群体是混合细胞群体,其含有具有各种细胞属性和特征的细胞。在特定实施方案中,所述细胞群体是t细胞群体。在一些实施方案中,所述细胞群体如t细胞群体是混合群体,所述混合群体包含各种亚型的细胞(例如cd4 和cd8 t细胞),其处于各种分化状态(例如,幼稚或记忆)、处于不同激活步骤(静息或非激活的和激活的)、是活的或非活的、凋亡的或非凋亡的、表达(例如经由转导或转染)或不表达重组分子或前述任一种的任何组合。在一些实施方案中,所述混合群体包含cd4 和cd8 t细胞,其中所述混合群体中的一些细胞还表达(例如经由转导)重组分子(例如car)。在一些实施方案中,所述混合群体包含单一t细胞亚型(例如,cd4 或cd8 ),其中一些细胞表达(例如,经由转导)重组分子(例如,car)。在此类实施方案中,当希望知道或确定在含有细胞群体的细胞组合物中存在此类特定属性时,可以使用这些方法。
[0058]
在一些实施方案中,本文提供的方法与制造过程(例如本文所述的过程)结合使
用,以用于生成可用于细胞疗法的治疗性细胞群体(例如,治疗性细胞产物)。本文提供的分类过程可以用于例如优化所述制造过程和/或评估产物质量。例如,本文提供的分类方法可以用于确定所述群体中活细胞的总数和/或细胞的身份,包括所述群体中亚型和/或成功工程化的细胞(例如,car表达细胞)的比率,其可以告知制造步骤的持续时间和/或条件以确保有用的治疗性细胞产物。使用结合用于预测此类值的机器学习模型的分类过程提供了优化治疗性细胞产物制造和改善产物一致性的客观手段。
[0059]
在一些实施方案中,细胞(例如t细胞)所分类的组通过一种细胞属性(例如,活的)来定义。在一些实施方案中,所述组通过至少两种细胞属性(例如,活的和cd4 ;活的、cd4 和car )来定义。在一些实施方案中,所述组是通过一种或多种细胞属性定义的第一组。在一些实施方案中,所述组是通过一种或多种细胞属性定义的第二组,其中至少一种属性不同于定义所述第一组的一种或多种属性。在一些实施方案中,三个或更多个或多个组通过一种或多种细胞属性定义,其中所述三个或更多个或多个组中的每一个中的至少一种属性不同于三个或更多个或多个组中的每个其他组。
[0060]
在一些实施方案中,分类结果(例如,预测)可以用于确定所述细胞群体的特征。例如,可以确定所述细胞群体中第一亚型(例如cd4 )与第二亚型(cd8 )的比率、用重组分子(如重组受体,如car)工程化的细胞的比例(例如,car 与car-细胞的比率,包括细胞身份(例如,cd4 car 、cd4 car-、cd8 car 、cd8 car-))和/或采样群体中的活细胞总数。例如,第一组可以通过cd4 的细胞属性定义,并且第二组可以通过cd8 的细胞属性定义,并且可以通过用于将未知属性的细胞分类为属于所述第一组或所述第二组的训练的机器学习模型来评估具有未知属性的细胞(例如,t细胞)。
[0061]
在所提供的方法中,使用来自细胞(如t细胞)的图像数据训练所述机器学习模型。在一些实施方案中,所述图像数据涉及对细胞成像,如通过使用显微术技术。在一些实施方案中,所述显微术技术是差分数字全息显微术(ddhm)。在一些实施方案中,所述显微术技术产生与细胞(例如,t细胞)相关的图像数据,其包括相位数据、强度数据和/或叠加数据。在一些实施方案中,使用与细胞相关的相位图像数据、强度图像数据和/或叠加图像数据训练所述机器学习模型。在一些实施方案中,使用与细胞相关的相位图像数据和强度图像数据训练所述机器学习模型。在所提供的方法的特定实施方案中,所述细胞是t细胞。
[0062]
在一些实施方案中,使用从与细胞(例如,t细胞)相关的图像数据确定的一个或多个输入特征训练所述机器学习模型。在一些实施方案中,所述一个或多个输入特征包括形态(例如与细胞的大小或形状有关)、光学(例如细胞图像的光学特性,如与细胞的折射有关)、强度(例如强度特性,例如图像的rgb或灰度值)、相位(例如相位图像的特性,如平均值或方差或光学高度)和/或系统特征(例如图像的显示或读出的特性,如细胞沿深度轴的位置)。在一些实施方案中,所述输入特征与细胞属性相关联。在一些实施方案中,在一个或多个输入特征上训练所述机器学习模型。在一些实施方案中,使用一个或多个形态、光学、强度、相位和/或系统特征(如本文所述的)训练所述机器学习模型。
[0063]
在一些实施方案中,使用监督式、半监督式或非监督式方法训练所述机器学习模型。在一些实施方案中,所述训练方法是监督式的。例如,所述机器学习模型在其上训练的图像数据被标记,例如,所述图像数据与细胞(例如,t细胞)相关,所述细胞已知属于某一组,这基于了解所述细胞具有定义所述组的一种或多种细胞属性。
[0064]
训练数据,例如从与细胞数据集的细胞相关的图像数据确定的图像数据(例如,相位、强度、叠加)和/或输入特征可以用作训练所述机器学习模型的输入。在一些实施方案中,细胞数据集是纯细胞群体,其中所述群体的基本上所有细胞如大于85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或更多展现出相同的一种或多种细胞属性(例如亚型,如cd4 或cd8 )。在一些情况下,可以从样品(例如,单采术、白细胞单采术、血液、pbmc样品)分离具有所需细胞属性的纯细胞群体。通过这种方式,已知含有所述纯群体的细胞数据集的细胞属于特定组,其中所述组通过一种或多种细胞属性定义。在一些实施方案中,训练数据可以直接从含有所述纯群体的细胞数据集获得,并且所述训练数据可以用于训练机器学习模型以将具有所述一种或多种细胞属性(例如,属于所述特定组)的细胞分类。因此,当机器学习模型接收与未知细胞属性的细胞相关的输入(例如图像数据、输入特征)时,机器学习模型可以将所述细胞分类。在一些实施方案中,所述纯群体可以经历另外的处理,例如本文所述的制造程序。在一些实施方案中,将含有纯细胞群体的细胞的细胞数据集以与待分类的细胞(例如,具有未知细胞属性的细胞)相同或基本相同的方式处理。
[0065]
本文提供了用于生成可用于训练机器学习模型的细胞数据集的方法。所提供的用于生成细胞数据集的方法是基于本文的观察,即在一些情况下,使用某些纯细胞群体作为用于训练的细胞数据集将混合细胞群体中的细胞分类可能无法准确预测所述混合细胞群体中的属性(例如实施例6)。据信,与完全由纯细胞群体生成的细胞数据集不同,混合细胞群体经受细胞信号传导和/或其他可能在存在多种细胞类型的条件下发生的环境影响(例如,如由于存在由一种细胞类型产生的细胞因子或生长因子,其可能影响混合细胞群体中另一种细胞类型的属性)。然而,与来自纯群体的细胞数据集不同,混合群体不能直接用于获得训练数据,因为混合群体含有属于多个组的细胞(例如,混合群体的细胞并不都具有相同的一种或多种细胞属性)。在所提供的用于生成用于训练的细胞数据集的方法的方面中,通过以下方法生成细胞数据集:基于细胞属性从混合细胞群体分离细胞以提供用于训练的基本上纯的细胞群体。例如,混合细胞群体可以含有cd4 和cd8 细胞和/或被转导或转染以表达重组分子(例如,car、tcr)的cd4 和cd8 细胞,并且所述方法包括选择cd4 或cd8 细胞中的一种(或被转导或转染以表达重组分子的cd4 或cd8 细胞中的一种)。因此,在一些实施方案中,为了从混合群体生成细胞数据集,将具有所需属性的细胞从混合群体分离出。通过分离细胞,可以生成含有具有已知细胞属性(例如,属于特定组)的细胞的细胞数据集。
[0066]
在用于生成细胞数据集的实施方案中,执行所述方法以针对一种或多种所需属性从混合细胞群体选择细胞类型,其中所述选择方法在一定条件下执行,使得在无需过度操纵或处理细胞以去除选择过程中使用的试剂的情况下所得的获得的细胞群体基本上不含所述试剂。提供了此类方法以确保用于训练的细胞数据尽可能接近混合群体中存在的细胞的表现,因为对细胞的某些操纵和/或试剂的存在可能会有损失用于训练的细胞数据集中的细胞的风险或可能改变它们的表型或功能从而改变细胞的潜在输入特征。例如,使用磁珠选择细胞可能需要使用磁铁从细胞取出磁珠,这可能导致额外的孵育或处理,所述额外的孵育或处理可能影响细胞表型或功能,可能导致由于磁场的不完全释放所致的细胞损失和/或可能导致最终选择的细胞群体中存在残留的珠粒从而可能干扰机器学习方法。作为所提供的方法的另一个优点,从混合细胞群体选择或分离细胞的方法不需要对细胞数据集
进行任何另外的处理来匹配混合细胞群体的细胞处理。相反,细胞数据集的细胞是以与待分类的细胞(例如,具有未知细胞属性的细胞)相同或基本相同的方式已经处理、加工或操作的细胞。
[0067]
在特定实施方案中,通过以下方法生成细胞数据集:使用可逆的基于亲和力的选择如通过免疫亲和色谱法分离或选择混合群体的细胞,其中用于选择的亲和试剂可以有效地从细胞解离。在一些方面,可逆的免疫亲和色谱方法包括美国公开专利申请号us2015/0024411和us 2017/0037369中描述的方法,将这两个专利申请通过引用以其整体并入本文。在一些实施方案中,所述方法采用分离基质,其上固定有可逆地结合至单价抗体(例如fab)的链霉亲和素突变蛋白,所述单价抗体对于所需细胞属性如细胞亚型(例如cd4 或cd8 )的标记物(例如表面分子)具有特异性。
[0068]
在一些实施方案中,使用阳性选择生成细胞数据集。在一些实施方案中,使用阴性选择生成细胞数据集。在一些实施方案中,鉴于在混合群体中存在多于一种细胞类型,通过分离混合群体的细胞生成两个或更多个或多个细胞数据集。因此,在一些方面,可以进行多个分离步骤以分离具有特定细胞属性的细胞,从而生成细胞数据集。在一些实施方案中,对阴性级分(例如,未被基于亲和力的方法选择的细胞)进行进一步的分离步骤。在一些实施方案中,对阳性级分(例如,被基于亲和力的方法选择的细胞)进行进一步的分离步骤。预期可以使用任何数量的分离步骤生成用于训练机器学习模型的细胞数据集。
[0069]
在一些实施方案中,含有来自混合群体的细胞子集(例如,属于特定组)的细胞数据集可以用于获得训练数据以训练机器学习模型,以将具有所述一种或多种细胞属性(例如,属于所述特定组)的细胞分类。因此,当机器学习模型接收与未知细胞属性的细胞相关的输入(例如图像数据、输入特征)时,机器学习模型可以将所述细胞分类。在一些实施方案中,所述混合细胞群体可以经历另外的处理,例如本文所述的制造程序。在一些实施方案中,以与待分类的细胞(例如,具有未知细胞属性的细胞)相同或基本相同的方式处理从中生成细胞数据集的混合细胞群体。
[0070]
在一些实施方案中,将细胞分类的方法包括测试所述训练的机器学习模型的准确性。在一些实施方案中,所述方法包括验证所述训练的机器学习模型。在一些实施方案中,使用交叉验证来验证所述模型。
[0071]
在一些实施方案中,将细胞群体的细胞分类的方法包括例如通过使用ddhm接收来自所述群体的细胞的图像数据,以及将所述图像数据的相位图像数据、强度图像数据和/或叠加图像数据中的一个或多个应用到在来自已知属于第一组的细胞和已知属于第二组的细胞的图像数据的相位图像数据、强度图像数据和/或叠加图像数据中的一个或多个上训练的机器学习模型,以将所述群体的细胞分类为属于所述第一组或第二组。在一些实施方案中,将细胞群体的细胞分类的方法包括例如通过使用ddhm接收来自所述群体的细胞的图像数据,以及将所述图像数据的相位图像数据和强度图像数据应用到在来自已知属于第一组的细胞和已知属于第二组的细胞的图像数据的相位图像数据和强度图像数据上训练的机器学习模型,以将所述群体的细胞分类为属于所述第一组或第二组。在一些实施方案中,t细胞可以被分类为多于两个组。例如,可以训练机器学习模型以区分多于三个或多个组。在一些实施方案中,所述机器学习模型是深度学习模型。在一些实施方案中,所述机器学习模型是人工神经网络。在一些实施方案中,所述机器学习模型是卷积神经网络。卷积神经网
络特别适合操作图像数据。卷积神经网络的优点是它们在不影响模型质量的情况下减少了具有许多单元的深度神经网络中的参数数量。因此,卷积神经网络在计算上是高效的。卷积神经网络的另外的优点包括它们在没有人工监督的情况下自动检测对于分类的重要特征以及检测可能无法例如被人检测到的特征的能力。
[0072]
在一些实施方案中,将细胞群体的细胞分类的方法包括例如通过使用ddhm接收来自所述群体的细胞的图像数据,从所述图像数据确定一个或多个输入特征,所述一个或多个输入特征包括所述图像数据的形态特征、所述图像数据的光学特征、所述图像数据的强度特征、所述图像数据的相位特征和/或所述图像数据的系统特征,以及将所述一个或多个输入特征作为输入应用到在从与已知属于第一组的细胞和已知属于第二组的细胞相关的图像数据确定的一个或多个输入特征上训练的机器学习模型,所述一个或多个输入特征包括所述图像数据的形态特征、所述图像数据的光学特征、所述图像数据的强度特征、所述图像数据的相位特征和所述图像数据的系统特征,从而将所述群体的细胞分类为属于所述第一组或所述第二组。在一些实施方案中,将包含t细胞的细胞群体的细胞分类的方法包括例如通过使用ddhm接收来自所述群体的细胞的图像数据,从所述图像数据确定一个或多个输入特征,所述一个或多个输入特征包括所述图像数据的形态特征、所述图像数据的光学特征、所述图像数据的强度特征和/或所述图像数据的相位特征,以及将所述一个或多个输入特征作为输入应用到在从与已知属于第一组的细胞和已知属于第二组的细胞相关的图像数据确定的一个或多个输入特征上训练的机器学习模型,所述一个或多个输入特征包括所述图像数据的形态特征、所述图像数据的光学特征、所述图像数据的强度特征和/或所述图像数据的相位特征,从而将所述群体的细胞分类为属于所述第一组或所述第二组。在一些实施方案中,t细胞可以被分类为多于两个组。在一些实施方案中,所述机器学习模型是人工神经网络。在一些实施方案中,所述机器学习模型是随机森林。在一些实施方案中,所述机器学习模型是支持向量机。在一些实施方案中,所述机器学习模型是深度学习模型。
[0073]
在一些实施方案中,本文提供的用于将细胞分类的方法在一个或多个步骤或用于离体制造或工程化细胞以用作过继细胞疗法的过程(例如本文所述的过程)的持续时间中贯穿使用。在一些实施方案中,本文提供的用于将细胞分类的方法在细胞已经用重组分子如car转导或转染之后的制造过程(例如在如本文所述的过程中)的特定步骤期间,如在孵育工程化t细胞群体的步骤(例如,第ii-c-3节)期间使用。在一些实施方案中,当与制造过程(例如,如本文所述)结合使用时,本文所述的用于将细胞分类的方法可以用于指导孵育条件,包括所述制造过程的刺激条件、工程化条件、培育条件和收获条件中的一种或多种。在一些实施方案中,当与制造过程(例如,如本文所述)结合使用时,本文所述的将细胞分类的方法可用于确定是否需要改变孵育条件(包括刺激条件)或可以用于鉴定何时准备好收获细胞。例如,鉴定细胞类型、细胞健康和活细胞浓度可用于确定灌注和/或进料时间表、在刺激条件下减少或添加细胞因子的需要、检测激活或分化的t细胞的浓度、检测混合群体是否含有适当浓度的待转导或转染的活细胞和/或活细胞亚型、检测成功转导的细胞的浓度和/或检测活细胞、转导/转染的活细胞、转导/转染的活细胞亚型的浓度以测定所述收获。在一些实施方案中,当与制造过程(例如,如本文所述)结合使用时,本文所述的将细胞分类的方法可以支持完全自动化例如不需要手动(例如,人操作员)输入的细胞培养系统。在一些实施方案中,全自动化系统是闭环系统。在一些实施方案中,全自动化闭环系统有效且可
靠地产生用于细胞疗法(例如,过继细胞疗法、自体细胞疗法)的无菌、活的工程化细胞群体,包括特定比率下的特定细胞类型(例如,cd4 、cd8 、car 、tcr )或细胞总数。
[0074]
在一些实施方案中,当与制造过程(例如,如本文所述)结合使用时,本文所述的将细胞分类的方法导致如下制造过程,其以比替代制造过程更快、更有效且导致更一致的产物的方式生成或产生适合于细胞疗法的基因工程化细胞。在某些实施方案中,与使用替代过程可能实现的相比,当与制造过程(例如,如本文所述)结合使用时,本文提供的将细胞分类的方法导致从更广泛的受试者群体生成或产生工程化细胞的组合物的更高成功率。在某些实施方案中,与通过替代方法产生的细胞相比,通过所提供的方法产生或生成的工程化细胞可能具有更多的健康、活力、活性,并且可能具有更高的重组受体表达。因此,在一些方面,与通过一些替代方法可能实现的相比,用于生成用于细胞疗法的工程化细胞的所提供方法的速度和效率允许更容易地针对更广泛的受试者群体计划和协调细胞疗法治疗如自体疗法。
[0075]
本技术中提及的所有出版物(包括专利文献、科学文章和数据库)出于所有目的通过引用以其整体并入,在程度上如同每个单独的出版物通过引用单独并入。如果本文所述的定义与通过引用并入本文的专利、申请、公开的申请和其他出版物中所述的定义相反或在其他方面不一致,则本文所述的定义优先于通过引用并入本文的定义。
[0076]
本文使用的章节标题仅用于组织目的,而不应解释为限制所描述的主题。i.将t细胞分类的方法
[0077]
本文提供的方法允许通过使用结合机器学习模型的分类过程将细胞分类为属于一个组,其中所述组通过一种或多种细胞属性来定义。在一些实施方案中,分类过程可以结合一种或多种类型的机器学习模型,例如如下所述的机器学习模型。包括已经经历制造过程(例如用于将细胞基因工程化)的细胞在内的细胞可以展现出差异,所述差异可以用于将细胞分类为属于第一组而排除属于第二组。例如,t细胞的形态特征可以用于将t细胞分类为cd4 亚型,而不是cd8 亚型。在一些实施方案中,所述细胞是t细胞。在一些实施方案中,所述t细胞用于或已经用于制造过程,例如本文所述的过程。组、类和类别在本文中可以互换使用。
[0078]
本文提供了一种将细胞(例如t细胞)分类的方法,所述方法包括如通过使用成像技术例如数字全息成像接收与细胞群体的一个或多个这样的细胞(例如第一、第二或第三细胞)相关的图像数据;从所述图像数据(也称为“输入特征”)确定由所述图像数据刻画、描绘、表示或推断(例如,通过数学方式)的一个或多个特征;以及将所述一个或多个输入特征作为输入应用到机器学习过程,所述机器学习过程被配置为基于所述一个或多个输入特征将所述细胞分类为属于第一组或第二组。在一些实施方案中,图像数据的一个或多个特征可以是所述图像数据的形态特征、所述图像数据的光学特征、所述图像数据的强度特征、所述图像数据的相位特征、所述图像数据的系统特征或其任何组合中的一个或多个。
[0079]
本文提供了一种将细胞(例如t细胞)分类的方法,所述方法包括如通过使用成像技术例如数字全息成像接收与细胞群体的一个或多个这样的细胞(例如第一、第二或第三细胞)相关的图像数据;以及将所述图像数据作为输入应用到机器学习过程,所述机器学习过程被配置为基于所述一个或多个输入特征将所述细胞分类为属于第一组或第二组。在一些实施方案中,所述图像数据包括相位数据、强度数据、叠加数据或其任何组合中的一个或
多个。在一些实施方案中,所述图像数据包括相位数据和/或强度数据。
[0080]
在特定实施方案中,所提供的方法可以用于将不同组的t细胞分类,如不同子集(例如cd4 或cd8 )、不同活力或健康状态(例如活的或非活的)或不同工程化状态(例如使用或未使用重组分子例如car转导)的t细胞。以下小节描述了所提供的方法的特征。a.细胞成像技术
[0081]
所提供的方法包括对细胞群体的细胞成像。预期与本文提供的将细胞分类的方法结合使用的成像技术包括能够对细胞(例如来自包含t细胞的细胞群体的t细胞)成像的任何和所有显微术技术,其产生图像数据和/或由其确定的信息(例如,输入特征;例如,参见第i-b节),所述信息能够用作分类过程(例如机器学习模型)的输入例如以用于分类或训练目的。在一些实施方案中,所述成像技术包括用于生成图像数据(例如与细胞相关的图像数据)的步骤如图像采集、图像处理(例如,预处理)和/或图像分割。在一些实施方案中,图像处理包括质形心检测。在一些实施方案中,图像处理包括基于失焦时的峰值强度的细胞检测。在一些实施方案中,图像分割包括边缘检测。在一些实施方案中,对相位图像数据进行图像分割。在一些实施方案中,计算机系统用于解释用于生成图像数据的成像技术的输出(例如,结果)。
[0082]
所述成像技术可以使用数字装置来获取和例如记录成像过程的输出(例如,结果)。在一些实施方案中,所述数字装置是电荷耦合设备(例如,ccd相机)。在一些实施方案中,所述数字装置是互补金属氧化物半导体设备(例如,cmos相机)。因此,在一些实施方案中,使用数字装置获得图像数据。在一些实施方案中,所述数字装置与计算机接口以存储和/或分析成像过程的结果(例如,输出)。
[0083]
在一些实施方案中,所述成像技术允许获得来自单个细胞(例如,t细胞)的图像数据。在一些实施方案中,所述成像技术允许同时获得来自两个或更多个或多个细胞(例如,t细胞)的图像数据。例如,所述成像技术可以包括允许一次对多个细胞成像的视场,并且与每个细胞(例如,t细胞)相关的图像数据可以独立于与视场中的其他细胞(例如,t细胞)相关的图像数据而进行存储(例如,在计算机系统上)、分析和/或使用。在一些实施方案中,图像分割用于确定与所述多个细胞中的每个细胞相关的图像数据。在一些实施方案中,所述成像技术包括约320μm x320μm的视场。在一些实施方案中,所述成像技术包括约1μm的水平分辨率。在一些实施方案中,所述成像技术包括120μm的深度。
[0084]
在一些实施方案中,所述成像技术产生含有相位数据的图像数据。在一些实施方案中,所述成像技术产生含有强度数据的图像数据。在一些实施方案中,所述成像技术产生含有相位和强度数据的图像数据。在一些实施方案中,所述成像技术产生含有叠加数据的图像数据。在一些实施方案中,所述成像技术产生含有相位、强度和叠加数据的图像数据。在一些实施方案中,所述成像技术产生全息图。在一些实施方案中,成像技术产生3维信息。例如,所述成像技术可以产生包括x、y和z坐标值的图像。在一些实施方案中,所述图像数据在计算机上存储或处理。
[0085]
为了以非损害性、非破坏性方式获得与细胞(例如,t细胞)相关的图像数据,细胞可以包含在液体如培养基中。在一些实施方案中,所述细胞(例如,t细胞)可以悬浮于液体例如培养基中以用于成像。因此,在一些实施方案中,所述成像技术能够对包含和/或悬浮欲液体中的细胞例如t细胞成像。
[0086]
在一些实施方案中,所述成像技术是亮视野显微术、荧光显微术、差分干涉对比(dic)显微术、相差显微术、数字全息显微术(dhm)、在线差分数字全息显微术、差分数字全息显微术(差分dhm或ddhm)或其组合。在一些实施方案中,所述成像技术是ddhm。1.数字全息显微术
[0087]
与本文所述的分类方法结合使用的示例性显微术技术是数字全息显微术(dhm)、更特别地差分dhm(ddhm)。数字全息显微术能够在不需要标记物或染料的情况下实现对活细胞的研究,并且能够实现对研究对象的量化。数字全息显微镜是一种无需逐层扫描样品即可记录3d样品或对象的技术。在这一方面,dhm是比共聚焦显微术更优的技术。在dhm中,全息再现是由数码相机(如ccd或cmos相机)记录,随后可以在计算机上存储或处理。u.s.2014/0193850、u.s.7,362,449和ep 1631788中描述了不同的dhm技术(包括ddhm)以及显微镜配置和元件,将这些专利通过引用以其整体并入本文。
[0088]
为了制作全息再现或全息图,传统上使用高度相干的光源(如激光)来照亮样品。在最基本的设置中,来自光源的光随后被分成两束,即对象光束和参考光束。对象光束经由光学系统发送到样品并与其相互作用,从而根据对象的光学特性和3d形状改变光的相位和振幅。然后(例如,通过一组镜子和/或分束器)使已在样品上反射或透射过样品的对象光束与参考光束发生干涉,从而产生以数字方式记录的干涉图案。由于当对象光束和参考光束具有可比较的振幅时全息图更准确,因此可以在参考光束中引入吸收元件,将其振幅降低至对象光束的水平,但不改变参考光束的相位或全局地最大地改变相位即不依赖于参考光束在何处以及如何通过所述吸收元件。记录的干涉图案含有关于相位和振幅变化的信息,所述变化取决于对象的光学特性和3d形状。
[0089]
制作全息图的替代方法是通过使用在线全息技术。在线dhm类似于更传统的dhm,但不分裂光束,至少不通过分束器或其他外部光学元件分裂光束。在线dhm最适合用于查看颗粒(例如细胞)在液体中的不太稠密的溶液。因此,至少部分相干的光的一部分将穿过样品而不与颗粒相互作用(参考光束),并和与颗粒相互作用的光(对象光束)发生干涉从而产生干涉图案,所述干涉图案以数字方式记录和处理。在线dhm以透射模式使用,它需要相干长度相对大的光,并且如果样品太厚或太稠密就无法使用。
[0090]
在欧洲专利ep 1 631 788中公开了另一种称为差分dhm(ddhm)的dhm技术,将所述专利通过引用以其整体并入本文。ddhm与其他技术的不同之处在于其并没有真正使用参考光束和对象光束。在ddhm的优选设置中,样品通过照明装置照明,所述照明装置由反射或透射模式中的至少部分相干光组成。反射或透射的样品光束可以通过物镜发送,随后由分束器分成两部分,并在差分干涉仪(例如michelson或mach-zehnder型)中沿不同路径发送。在其中一个路径中,插入了光束弯曲元件或倾斜装置,例如,透明的楔子。然后使两束光束在聚焦透镜的焦平面内相互干涉,并且将该焦平面上的干涉图案以数字方式记录并通过例如连接至计算机的ccd相机存储。因此,由于光束弯曲元件,因此这两束光束以受控制的方式轻微偏移,并且干涉图案取决于偏移量。然后转动光束弯曲元件,从而改变偏移量。新的干涉图案也被记录下来。这可以进行n次,并且根据这些n个干涉图案,可以近似计算聚焦透镜的焦平面中相位的梯度(或空间导数)。这被称为相移法,但还已知其他获得相位梯度的方法,如傅里叶变换数据处理技术。可以对相位的梯度进行积分以给出作为位置的函数的相位。作为位置的函数的光的振幅可以从n个记录的干涉图案的振幅的可能但不一定加权的
平均值计算。由于相位和振幅因此是已知的,因此可以获得与直接全息方法(使用参考和对象光束)中相同的信息,并且可以进行对象的后续3d重建。
[0091]
在ddhm中,照明装置可以包括空间和时间部分相干的光。这与仅使用高度相关激光的其他dhm方法形成对比。空间和时间部分相干光可以通过例如led来产生。led比激光便宜,并且产生以已知波长为中心的光谱,其是在空间和时间上部分相干的,即不像激光那样相干,但仍然足够相干以产生具有目前应用所需的质量的全息图像。led还具有可用于许多不同波长的优点,并且尺寸非常小,并且在必要时易于使用或更换。因此,提供一种可以使用在空间和时间上部分相干的光来获得全息图像的方法将导致用于实施这种方法的更具成本效益的装置。在一些实施方案中,所述照明装置是红色led。
[0092]
可以对图像进行对象分割和进一步分析,以获得定量地描述所成像的对象(例如,培育的细胞、细胞碎片)的多个形态特征。这样,可以使用例如图像采集、图像处理、图像分割和特征提取的步骤,直接从ddhm评估或计算各种特征(例如,细胞形态、细胞活力、细胞浓度)。在一些实施方案中,数字记录装置用于记录全息图像。在一些实施方案中,可以使用包括用于分析全息图像的算法的计算机。在一些实施方案中,监视器和/或计算机可以用于显示全息图像分析的结果。在一些实施方案中,所述分析是自动化的(即,能够在没有用户输入的情况下进行)。ddhm系统的例子包括但不限于ovizio iline f(ovizio imaging systems nv/sa,布鲁塞尔,比利时)。
[0093]
根据本文提供的方法(包括其实施方案)可以使用任何类型的dhm。在一些实施方案中,dhm、在线dhm或差分dhm与其他显微术方法(例如,荧光显微术)组合使用。在一些实施方案中,ddhm与本文提供的方法结合使用。在一些实施方案中,如上所述进行ddhm。在一些实施方案中,所述图像数据是从包括ddhm的成像技术收集的。b.图像数据和输入特征
[0094]
图像数据(如使用上文第i-a节和第i-a-1节所述的成像技术收集的)可以用作分类过程(例如,机器学习模型)的输入以将t细胞分类。在一些实施方案中,可以从所述图像数据确定一个或多个特征。在一些实施方案中,所述一个或多个特征可以用作分类过程(例如,机器学习模型)的输入以将t细胞分类。此类特征在本文中可以被称为“输入特征”。图像数据可以包括强度数据(例如,rgb、rgba、对应于像素的灰度值)、相位数据、叠加数据、空间数据或对应于成像过程(例如,ddhm)的输出的任何其他合适的数据。图像数据可以表示为沿任何合适数量和类型的维度的值的阵列。例如,在一些例子中,图像数据可以表示为二维阵列,其中每个元素保存三个8位值,每个值表示相应像素(或其他图像元素)的rgb强度。图像数据可以表示2d图像、3d体积图像、全息图或任何其他合适的图像。图像数据可以但不必对应于视觉图像。虽然图像数据可以对应于可见光,但在一些例子中,图像数据可以对应于任何合适的光源(例如,红外光或紫外光)。此外,可以使用任何合适的成像方法。
[0095]
在一些实施方案中,使用ddhm收集图像数据。在一些实施方案中,从ddhm接收图像数据。在一些实施方案中,将使用ddhm收集或从ddhm接收的图像数据处理以提取特征,如下文描述的特征。
[0096]
在所提供的方法中,图像数据本身可以用于训练机器学习模型(例如,卷积神经网络),并且来自待分类的细胞的图像数据可以用作所述模型(例如,卷积神经网络模型)的输入。在其他提供的实施方案中,源自所述图像数据的多个输入特征可以用于如通过支持向
量机(svm)、神经网络、随机森林训练机器学习模型,并且来自待分类的细胞的输入特征可以用作所述模型的输入。在一些实施方案中,从所述图像数据确定的输入特征可以包括形态特征、光学特征、强度特征、相位特征或系统特征中的任何一个或多个。
[0097]
在一些实施方案中,可以从对应于细胞的图像数据确定一个或多个形态特征,例如通过对图像数据应用合适的过滤器、统计处理方法和/或信号处理方法。形态特征描述了细胞的物理形状的一个或多个特征。形态特征可以包括例如细胞的纵横比(例如,细胞的第一轴的长度与细胞的第二轴的长度的比率),在一些实施方案中,纵横比可以是归一化的;细胞的面积(例如,表面积或投影表面积);细胞的圆度(例如,细胞面积与细胞周长的比率);细胞的紧密度(例如,细胞面积与细胞轴上对象的方差的比率);细胞的伸长率(例如,包围细胞的矩形的宽度和高度的比率);细胞的直径(例如,与细胞具有相同面积的圆的直径);hu矩(例如,与细胞相关的像素强度的加权平均值(如hu不变矩1-7中的一个));周长(例如,细胞的周长);半径(例如,从细胞质量中心到细胞外缘的距离)的平均值或方差,在一些实施方案中,可以通过将半径的方差除以直径来确定归一化的半径方差。在一些例子中,形态特征(如上所述)可以与细胞的二维图像或细胞的三维图像相关。上述形态特征可以作为输入应用到用于将细胞分类的分类过程(如下所述)。
[0098]
在一些实施方案中,可以从对应于细胞的图像数据确定一个或多个光学特征,例如通过对图像数据应用合适的过滤器、统计处理方法和/或信号处理方法。光学特征描述细胞图像的一个或多个光学特性。光学特征可以包括例如峰直径(例如,具有与细胞的折射峰相同面积的圆的直径);细胞的质量偏心率(例如,细胞的几何中心与细胞的质量中心之间的距离(如以像素计),由光学高度加权);细胞的最小、最大或平均强度(例如,rgb强度值);细胞的最小、最大或平均光学高度(例如,细胞表面上以微米或弧度计的高度);细胞的归一化光学高度(例如,细胞的光学高度(例如,以微米计)除以细胞直径);细胞的光学体积(例如,与细胞的体积及其折射指数成比例的值);细胞的折射峰面积(例如,以微米计);细胞的折射峰数量;通过细胞面积归一化的折射峰面积(例如,峰面积除以例如细胞面积和平均强度的乘积);细胞的归一化折射峰高度(例如,细胞的折射峰强度除以例如细胞的表面和细胞的平均强度的乘积);和/或细胞的折射峰强度。在一些例子中,光学特征(如上所述)可以与细胞的二维图像或细胞的三维图像相关。上述光学特征可以作为输入应用到用于将细胞分类的分类过程(如下所述)。
[0099]
在一些实施方案中,可以从对应于细胞的图像数据确定一个或多个强度特征,例如通过对图像数据应用合适的过滤器、统计处理方法和/或信号处理方法。强度特征描述细胞强度的一个或多个特性。在一些例子中,细胞的强度可以包括细胞的图像的强度值(例如,图像的rgb值)。在一些例子中,细胞的强度可以包括在位置处的存在的指示符(例如,指示细胞是否存在于所述位置处的1或0值)。强度特征可以包括例如细胞图像的强度值(例如,平均强度);细胞图像的强度对比度(例如,图像中像素与相邻像素之间的强度差异),在一些实施方案中,细胞图像的强度对比度是平均强度对比度;细胞图像的强度熵(例如,平均熵);细胞图像的强度均匀性(例如,细胞表面上的强度均匀性的量度),在一些实施方案中,细胞图像的强度均匀性被表示为细胞表面上的强度均匀性的平均量度(例如,平均强度均匀性);细胞图像的强度相关性(例如,图像中像素与相邻像素的强度之间的相关性);细胞图像的强度同质性(例如,在对角线分布的空间接近度);细胞图像的强度偏斜度(例如,
强度的对称性);细胞图像的强度方差(例如,细胞表面上的强度的方差值);细胞的强度最大的平面(例如,以微米计);和/或细胞图像的强度平滑度(例如,平均平滑度)。在一些例子中,强度特征(如上所述)可以与细胞的二维图像或细胞的三维图像相关。上述强度特征可以作为输入应用到用于将细胞分类的分类过程(如下所述)。
[0100]
在一些实施方案中,可以从对应于细胞的图像数据确定一个或多个相位特征,例如通过对图像数据应用合适的过滤器、统计处理方法和/或信号处理方法。相位特征描述细胞的相位图像的一个或多个特性。相位特征可以包括例如细胞的相位图像的光学高度(例如,以微米或弧度计的光学高度的平均值或方差);细胞的相位强度对比度(例如,细胞的相位图像的平均强度对比度或细胞的相位图像的强度对比度,例如在跨细胞表面的像素之间);细胞的相位熵(例如,细胞的相位图像的平均熵);细胞的平均相位(例如,在细胞表面上所取的相位平均值);细胞的相位均匀性(例如,跨细胞表面的相位均匀性的量度),在一些实施方案中,细胞的相位均匀性是细胞表面上的相位均匀性的平均量度(例如,细胞的平均相位均匀性);细胞的相位相关性(例如,像素与其相邻像素在细胞的相位图像中的相关性程度的量度);细胞的相位同质性(例如,在细胞的相位图像中对角线分布的空间接近度的量度);细胞的相位偏斜度(例如,在细胞的相位图像中不对称性的量度);和/或细胞的相位平滑度(例如,在细胞的相位图像中平滑度的量度)。在一些例子中,相位特征(如上所述)可以与细胞的二维图像或细胞的三维图像相关。上述相位特征可以作为输入应用到用于将细胞分类的分类过程(如下所述)。
[0101]
在一些实施方案中,可以从对应于细胞的图像数据确定一个或多个系统特征,例如通过对图像数据应用合适的过滤器、统计处理方法和/或信号处理方法。系统特征描述细胞图像的显示或读出的特性,如细胞图像的一个或多个位置或统计特性。系统特征可以包括例如细胞深度(例如,细胞沿深度轴的位置);细胞标识符(例如,分配给图像中细胞的唯一id号);图像标识符(例如,含有对象的图像的唯一标识符)、对象标识符(例如,图像内对象的唯一标识符)、细胞描述符(例如,分类描述,如活的、死的、碎片、集群、通用、具有峰的碎片);质量中心(例如,图像中沿x或y轴的质量中心坐标);和/或细胞的边界指示(例如,细胞或细胞的折射峰是否位于图像中的边界)。在一些例子中,系统特征(如上所述)可以与细胞的二维图像或细胞的三维图像相关。上述系统特征可以作为输入应用到用于将细胞分类的分类过程(如下所述)。
[0102]
在一些实施方案中,所述输入特征包括70个输入特征中的一个或多个或全部,所述输入特征包括所述细胞的纵横比、细胞深度、细胞的面积、细胞描述符、细胞标识符、图像标识符、对象标识符、沿x轴的质量中心、沿y轴的质量中心、所述细胞的圆度、所述细胞的紧密度、归一化纵横比、所述细胞的伸长率、所述细胞的直径、峰直径、hu不变矩1、hu不变矩2、hu不变矩3、hu不变矩4、hu不变矩5、hu不变矩6、hu不变矩7、平均强度对比度、平均熵、平均强度、平均强度均匀性、所述细胞的图像的强度对比度、所述细胞的图像的强度相关性、所述细胞的图像的强度熵、所述细胞的图像的强度同质性、所述细胞的最大强度、所述细胞的平均强度、所述细胞的最小强度、所述细胞的图像的强度偏斜度、所述细胞的图像的强度平滑度、所述细胞的图像的强度方差、所述细胞的图像的强度均匀性、所述细胞的强度最大的平面、细胞位于视场边界的指示、折射峰位于视场边界的指示、所述细胞的质量偏心率、以弧度计的所述细胞的最大光学高度、以微米计的所述细胞的最大光学高度、以弧度计的所
述细胞的平均光学高度、以微米计的所述细胞的平均光学高度、所述细胞的归一化光学高度、以弧度计的所述细胞的最小光学高度、以微米计的所述细胞的最小光学高度、以弧度计的所述细胞的图像相位的光学高度的方差、以微米计的所述细胞的图像相位的光学高度的方差、所述细胞的光学体积、所述细胞的折射峰面积、通过所述细胞的面积归一化的折射峰面积、所述细胞的折射峰数量、所述细胞的折射峰强度、所述细胞的归一化折射峰高度、周长、所述细胞的相位图像的平均强度对比度、所述细胞的相位图像的平均熵、所述细胞的平均相位、所述细胞的平均相位均匀性、所述细胞的相位强度对比度、所述细胞的相位相关性、所述细胞的相位熵特征、所述细胞的相位同质性、所述细胞的相位偏斜度、所述细胞的相位平滑度、所述细胞的相位均匀性、所述细胞的半径的平均值、所述细胞的半径的方差以及所述细胞的归一化半径方差。
[0103]
在一些实施方案中,所述输入特征中的一个或多个可以作为输入应用到用于将细胞分类的分类过程,如下所述。在一些实施方案中,所述输入特征中的一个或多个可以作为输入应用到被训练用于将细胞分类的机器学习模型。在一些实施方案中,作为输入应用到被训练用于将细胞分类的机器学习模型的所述一个或多个输入特征对应于用于训练机器学习模型的相同的一个或多个输入特征。例如,如果机器学习模型使用来自已知属于某个组的细胞的输入特征的子集进行训练,则对于待分类的细胞应用到机器学习模型的输入特征与所述模型所训练的输入特征相同。
[0104]
在一些情况下,不一定使用从与细胞相关的图像数据确定的所有输入特征来将细胞分类。例如,可以进行初始统计测试以确定哪些输入特征与细胞属性密切相关。然后可以将这些输入特征用作机器学习模型的输入。还可以进行统计测试来鉴定高度相关的输入特征。另外,可以进行统计测试来鉴定显示低方差的输入特征。这些输入特征可以被排除作为机器学习模型的输入。应理解,可以对用作机器学习模型的训练数据的输入特征进行这些或类似的分析。在一些实施方案中,本段中描述的方法被称为数据预处理。在一些情况下,模型创建中的数据预处理步骤避免生成会产生误导性或不准确结果的模型。在一些实施方案中,预处理防止超出范围的值、缺失值、不可能的数据组合、高度相关的变量等被并入模型中。在一些情况下,预处理导致信息特征的鉴定。
[0105]
在一些实施方案中,将至少70、65、60、55、50、45、40、35、30、25、20、15、10、9、8、7、6、5、4、3、2或1个输入特征作为输入应用到所述机器学习模型。在一些实施方案中,将约1至约70、约1至约60、约1至约50、约1至约40、约1至约30、约1至约20、约1至约15、约1至约10或约1至约5个输入特征作为输入应用到所述机器学习模型。在一些实施方案中,将少于或少于约70、65、60、55、50、45、40、35、30、25、20、15、10或5个输入特征应用到所述机器学习模型。在一些实施方案中,将少于或少于约20、15、10或5个输入特征应用到所述机器学习模型。c.机器学习
[0106]
在一些实施方案中,图像数据和/或输入特征(例如在第i-b节中描述的)可以用作机器学习模型的输入以将细胞群体(例如,含有t细胞的细胞群体)的细胞(例如,t细胞)分类。在一些实施方案中,可以将含有t细胞的细胞群体中的每个t细胞分类。在一些实施方案中,可以将含有t细胞的细胞群体中所含的多个t细胞分类。在一些实施方案中,在含有t细胞的细胞群体中的约或至少70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、
96%、97%、98%、99%或100%的t细胞分类。可以通过运行分类过程(如并入了能够将细胞类型分类的机器学习模型的分类过程)的计算机来完成分类。机器学习模型可以包括任何合适的机器学习模型,如下面描述的示例性模型。
[0107]
在一些实施方案中,分类可以包括将细胞鉴定为明确地属于第一类别(例如,cd4 亚型)或第二类别(例如,cd8 亚型)。在一些情况下,分类可以包括将概率分配给某个类别(例如,t细胞属于cd4 亚型的概率为70%);和/或将所述概率与阈值进行比较以确定细胞是否具有足够的概率属于所述类别。
[0108]
在一些实施方案中,所述机器学习模型包括人工神经网络(例如,卷积神经网络)、回归模型、基于实例的模型、正则化模型、决策树、随机森林、贝叶斯模型、聚类模型、关联模型、深度学习模型、降维模型、支持向量机和/或集成模型(例如,提升)中的一个或多个。然而,可以采用任何合适的机器学习模型或模型组合来实施各种实施方案。
[0109]
在一些实施方案中,人工神经网络(这里也称为神经网络或nn)可以用于将细胞分类为属于第一类别(例如,cd4 亚型)或第二类别(例如,cd8 亚型)。神经网络可以利用一个或多个计算单元(例如,感知器)的网络来连接一个或多个输入与一个或多个输出。例如,所述输入可以包括与待分类的候选细胞相关的图像数据和/或输入特征,并且所述输出可以包括候选细胞属于所述第一类别(例如,cd4 )或所述第二类别(例如,cd8 )的指示。在一些例子中,上述输入特征中的一些或全部可以被呈现为神经网络的输入。神经网络计算从输入得出输出的函数;所述函数经由通过一个或多个计算单元的计算得出输出。
[0110]
所述计算单元可以并入中间值(权重)。可以经由训练过程调整权重,其中调整神经网络以从一个或多个输入准确地产生所需的输出。例如,未训练的神经网络可能缺乏将细胞正确分类为cd4 细胞或cd8 细胞的能力。然而,通过连续应用对应于已知输出的已知输入(例如,属于已知为cd4 细胞或cd8 细胞的细胞的图像数据和/或输入特征),可以改变权重以最小化神经网络的输出与期望的输出之间的误差。神经网络随着时间而被相应地细化以更准确地将细胞分类为cd4 细胞或cd8 细胞。在训练后,神经网络能够准确地将未知输入(例如,不知道是cd4 或cd8 的细胞的图像数据和/或输入特征)分类。也就是说,可以将与候选细胞相关的图像数据和/或输入特征(例如,上述光学、形态、强度、相位或系统特征中的一种、一些或全部)呈现给经训练的神经网络,并且神经网络可以准确地提供对应于候选细胞是类型cd4 或cd8 的输出。
[0111]
本领域技术人员将理解,可以在不脱离本发明范围的情况下利用许多类型的神经网络以及那些神经网络的配置(例如,感知器的数量和/或布置,如单层或多层)。类似地,在不脱离本发明范围的情况下,可以采用各种用于训练神经网络的方法。例如,在一些实施方案中,神经网络(如上所述)可以是卷积神经网络(cnn)。在cnn中,卷积层包含一个或多个卷积滤波器。这些卷积滤波器可以应用到输入(例如,图像数据)以生成一个或多个特征图;可以采用训练过程(如下所述)得出特征图,从而最小化在期望输出与预测结果之间的误差,并相应地提高cnn将候选细胞(例如,t细胞)分类的能力。在一些例子中,cnn可以接受与待分类的候选细胞相关的输入图像数据(例如,强度图像数据、相位图像数据、叠加图像数据),并输出(例如,预测)候选细胞属于第一组(例如,cd4 )或第二组(例如,cd8 )。在一些实施方案中,使用图像数据训练cnn。在一些实施方案中,cnn将与未知类型的细胞相关的图像数据分类。
[0112]
在一些实施方案中,卷积神经网络可以用于确定细胞群体中的细胞健康。例如,与群体的细胞相关的图像数据可以用作卷积神经网络的输入以确定所述群体的细胞是活的(活)还是死的和/或所述细胞群体中活的(活)细胞和死细胞的百分比、总数和/或浓度。在一些实施方案中,细胞属性活的包括单个活细胞和/或活细胞集群。在一些实施方案中,细胞属性死的包括非活细胞和/或碎片。在一些实施方案中,所述卷积神经网络能够将单个活细胞、活细胞集群、非活细胞和碎片分类。在一些实施方案中,待分类的细胞是含有t细胞的细胞群体的t细胞。
[0113]
在一些实施方案中,卷积神经网络可以用于确定细胞群体中的细胞亚型身份。在一些实施方案中,与群体的细胞相关的图像数据可以用作卷积神经网络的输入以确定细胞的亚型身份和/或细胞群体中细胞亚型的百分比、总数和/或浓度。例如,与群体的细胞相关的图像数据可以用作卷积神经网络的输入以确定细胞是cd4 或cd8 和/或所述细胞群体中每种亚型的细胞的百分比、浓度或总数。在一些实施方案中,待分类的细胞是含有t细胞的细胞群体的t细胞。在一些实施方案中,所述卷积神经网络能够将cd4 和cd8 t细胞分类。
[0114]
在一些实施方案中,卷积神经网络可以用于确定细胞群体中的细胞是否表达重组分子。在一些实施方案中,所述重组分子是重组受体。在一些实施方案中,所述重组受体是嵌合抗原受体(car)。在一些实施方案中,所述重组受体是t细胞受体(tcr)。在一些实施方案中,与群体的细胞相关的图像数据可以用作卷积神经网络的输入以确定细胞表达重组分子和/或所述细胞群体中表达所述重组分子的细胞的百分比、总数和/或浓度。在一些实施方案中,所述卷积神经网络能够将car 和car-细胞分类。在一些实施方案中,待分类的细胞是含有t细胞的细胞群体的t细胞。
[0115]
在一些实施方案中,卷积神经网络可以用于确定细胞群提中的细胞是否处于激活状态。在一些实施方案中,与群体的细胞相关的图像数据可以用作卷积神经网络的输入以确定细胞被激活和/或所述细胞群体中激活的细胞的百分比、总数和/或浓度。在一些实施方案中,所述卷积神经网络能够将激活的细胞和非激活的细胞分类。在一些实施方案中,待分类的细胞是含有t细胞的细胞群体的t细胞。
[0116]
在一些例子中,支持向量机(svm)可以用于(单独或与其他技术组合)将细胞分类为属于第一类别(例如,cd4 亚型)或第二类别(例如,cd8 亚型)。如本领域技术人员将理解的,svm可以包括用于线性分离数据集的超平面。通过在配置为将第一类别的细胞与第二类别的细胞分开的超平面上测试包含未知类型的细胞的数据集,可以将数据集的候选细胞分类为属于第一类别或第二类别。
[0117]
svm的超平面(如上所述)可以经由训练方法来确定。训练svm的各种方法对于本领域技术人员来说是熟知的并且在本公开文本的范围内。例如,可以提供训练数据集,所述训练数据集包含对应于已知输出的输入(例如,属于已知为cd4 细胞或cd8 细胞的细胞的图像数据和/或输入特征)。可以使用本领域技术人员熟知的各种方法中的任何一种来确定超平面,其进行训练数据集的线性分类。在一些例子中,优选地确定超平面使得几何裕度最大化。在训练后,svm可以使用超平面将未知输入(例如,不知道是cd4 或cd8 的细胞的图像数据和/或输入特征)分类。也就是说,可以将与候选细胞相关的图像数据和/或输入特征(例如,上述光学、形态、强度、相位或系统特征中的一种、一些或全部)呈现给利用确定的超平面的svm,并且svm可以准确地提供对应于候选细胞是类型cd4 或cd8 的输出。
[0118]
在一些例子中,集成机器学习方法可以用于将细胞分类。随机森林是集成学习方法的一个例子,在一些实施方案中,其可以用于将细胞分类为属于第一类别(例如,cd4 亚型)或第二类别(例如,cd8 亚型)。随机森林可以包括多个决策树,将每个决策树应用到一个或多个输入以生成一个或多个相应输出。在一些实施方案中,随机森林中的每个决策树可以接受与候选细胞相关的图像数据和/或输入特征(例如,光学、形态学、强度、相位或系统中的一种、一些或全部)作为输入,并且生成候选细胞的分类作为输出。优选地,单独的决策树是充分不相关的,使得应用到所述多个决策树的共同输入将导致输出的多样性。在实施方案中,将图像数据和/或输入特征(例如,上述光学、形态、强度、相位或系统特征中的一种、一些或全部)应用到所述多个单独决策树中的每一个,并且调节相应的输出以生成随机森林的输出。例如,在一些实施方案中,随机森林的输出可以对应于大多数单独决策树所得到的分类输出。
[0119]
训练随机森林的各种方法对于本领域技术人员来说是熟知的并且在本公开文本的范围内。例如,在一些实施方案中,可以通过将随机采样的输入数据(例如,图像数据、一个或多个输入特征)应用到随机森林的每个单独决策树,在数据集(例如,对应于已知为cd4 细胞或cd8 细胞的细胞的图像数据集)上训练随机森林。
[0120]
在一些情况下,可以通过将随机采样的输入数据(例如,一个或多个输入特征)应用到随机森林的每个单独决策树,在数据集(例如,源自对应于已知为cd4 细胞或cd8 细胞的细胞的图像数据的输入特征)上训练随机森林。这种训练方法促进了单独决策树之间的多样性,从而可以提高随机森林的准确性。本领域技术人员将理解,可以酌情使用许多合适的随机森林配置;本公开文本不限于任何类型或配置的随机森林、其组成决策树、任何训练决策树的方法或任何训练上述任一项的方法。
[0121]
提升分类器提供了集成学习方法的另外的例子,在一些实施方案中,其可以用于将细胞分类为属于第一类别(例如,cd4 亚型)或第二类别(例如,cd8 亚型)。例如,adaboost可以描述为提升分类器,其将“弱”分类器的输出组合成加权和。在一些实施方案中,基于对应于候选细胞的图像数据和/或输入特征,adaboost可以用于将候选细胞分类为属于第一组或第二组。类似地,可以在训练数据上训练adaboost,所述训练数据包括对应于已知具有一种或多种细胞属性的细胞(例如,已知属于由一种或多种细胞属性定义的组的细胞)的图像数据和/或输入特征。类似地,可以以类似的方式训练和应用其他提升方法(如xgboost)以将细胞分类为属于第一类别(例如,cd4 亚型)或第二类别(例如,cd8 亚型)。提升方法(如xgboost)可以与其他机器学习方法组合使用。例如,xgboost可以与随机森林组合使用以将细胞分类。
[0122]
在一些实施方案中,随机森林可以用于确定细胞群体中的细胞健康。例如,从与群体的细胞相关的图像数据确定的输入特征可以用作随机森林的输入以确定所述群体的细胞是活的(活)还是死的和/或所述细胞群体中活的(活)细胞和死细胞的百分比、总数和/或浓度。在一些实施方案中,细胞属性活的包括单个活细胞和/或活细胞集群。在一些实施方案中,细胞属性死的包括非活细胞和/或碎片。在一些实施方案中,所述随机森林能够将单个活细胞、活细胞集群、非活细胞和碎片分类。在一些实施方案中,待分类的细胞是含有t细胞的细胞群体的t细胞。
[0123]
在一些实施方案中,随机森林分类器可以使用一个或多个输入特征将细胞群体中
的细胞(例如,含有t细胞的细胞群体中的t细胞)的健康分类。在一些实施方案中,所述一个或多个输入特征包括所述细胞的相位相关性、所述细胞的面积、所述细胞的折射峰数量、细胞的相位偏斜度、峰直径、通过所述细胞的面积归一化的折射峰面积、半径的方差、所述细胞的图像的强度均匀性、所述细胞的紧密度、所述细胞的相位强度对比度、归一化半径方差和所述细胞的圆度。在一些实施方案中,机器学习模型(如随机森林分类器)可以以任何组合使用选自所述细胞的相位相关性、所述细胞的面积、所述细胞的折射峰数量、细胞的相位偏斜度、峰直径、通过所述细胞的面积归一化的折射峰面积、半径的方差、所述细胞的图像的强度均匀性、所述细胞的紧密度、所述细胞的相位强度对比度、归一化半径方差和所述细胞的圆度的1、2、3、4、5、6、7、8、9、10、11或12个输入特征,以将细胞分类为活的或死的。在一些实施方案中,机器学习模型(如随机森林分类器)可以以任何组合使用选自所述细胞的相位相关性、所述细胞的面积、所述细胞的折射峰数量、细胞的相位偏斜度、峰直径、通过所述细胞的面积归一化的折射峰面积、半径的方差、所述细胞的图像的强度均匀性、所述细胞的紧密度、所述细胞的相位强度对比度、归一化半径方差和所述细胞的圆度的至少1、2、3、4、5、6或所有输入特征,以将细胞分类为活的或死的。在一些实施方案中,机器学习模型(如随机森林分类器)可以以任何组合使用选自相位相关性、细胞面积、折射峰数量、相位偏斜度和峰直径的1、2、3或4种特征,以将细胞分类为活的或死的。在一些实施方案中,所述一个或多个输入特征包括细胞的相位相关性。在一些实施方案中,所述一个或多个输入特征包括细胞的面积。在一些实施方案中,所述一个或多个特征包括细胞的折射峰数量。
[0124]
在一些实施方案中,随机森林可以用于确定细胞群体中的细胞亚型身份。在一些实施方案中,从与群体的细胞相关的图像数据确定的输入特征可以用作随机森林的输入以确定细胞的亚型身份和/或细胞群体中细胞亚型的百分比、总数和/或浓度。例如,从与群体的细胞相关的图像数据确定的输入特征可以用作随机森林的输入以确定细胞是cd4 或cd8 和/或所述细胞群体中每种亚型的细胞的百分比、浓度或总数。在一些实施方案中,待分类的细胞是含有t细胞的细胞群体的t细胞。在一些实施方案中,所述随机森林能够将cd4 和cd8 t细胞分类。
[0125]
在一些实施方案中,随机森林分类器可以使用一个或多个输入特征将细胞群体中的细胞亚型(例如,含有t细胞的细胞群体中的t细胞)分类。在一些实施方案中,所述一个或多个输入特征包括细胞平面上的相位均匀性的平均量度(例如,细胞的平均相位均匀性)、峰直径、所述细胞的归一化折射峰高度、所述细胞的平均相位、通过所述细胞的面积归一化的折射峰面积、所述细胞的最小光学高度、所述细胞的紧密度、所述细胞的圆度、细胞的相位平滑度、所述细胞的图像的强度同质性、所述细胞的强度最大的平面(例如,以微米计)、所述细胞的折射峰面积、所述细胞的相位相关性、细胞深度、细胞的图像的强度对比度、所述细胞的图像的强度均匀性、归一化半径方差、所述细胞的图像的强度平滑度、所述细胞的相位强度对比度、以微米计的所述细胞的最大光学高度、所述细胞的平均强度对比度、所述细胞的平均强度均匀性、所述细胞的图像的强度偏斜度、hu不变矩1、所述细胞的图像的强度方差、平均熵和所述细胞的图像的强度相关性。在一些实施方案中,机器学习模型(如随机森林分类器)可以以任何组合使用选自细胞表面上的相位均匀性的平均量度(例如,细胞的平均相位均匀性)、峰直径、所述细胞的归一化折射峰高度、所述细胞的平均相位、通过所述细胞的面积归一化的折射峰面积、所述细胞的最小光学高度、所述细胞的紧密度、所述细
胞的圆度、细胞的相位平滑度、所述细胞的图像的强度同质性、所述细胞的强度最大的平面(例如,以微米计)、所述细胞的折射峰面积、所述细胞的相位相关性、细胞深度、细胞的图像的强度对比度、所述细胞的图像的强度均匀性、归一化半径方差、所述细胞的图像的强度平滑度、所述细胞的相位强度对比度、以微米计的所述细胞的最大光学高度、所述细胞的平均强度对比度、所述细胞的平均强度均匀性、所述细胞的图像的强度偏斜度、hu不变矩1、所述细胞的图像的强度方差、平均熵和所述细胞的图像的强度相关性的1、2、3、4、5、6、7、8、9、10、11、12、13、14种或更多种或所有输入特征,以将细胞分类为属于特定亚型(例如,cd4或cd8 t细胞)。在一些实施方案中,机器学习模型(如随机森林分类器)可以以任何组合使用选自细胞表面上的相位均匀性的平均量度(例如,细胞的平均相位均匀性)、峰直径、所述细胞的归一化折射峰高度、所述细胞的平均相位、通过所述细胞的面积归一化的折射峰面积、所述细胞的最小光学高度、所述细胞的紧密度、所述细胞的圆度、细胞的相位平滑度、所述细胞的图像的强度同质性、所述细胞的强度最大的平面(例如,以微米计)、所述细胞的折射峰面积、所述细胞的相位相关性、细胞深度、细胞的图像的强度对比度、所述细胞的图像的强度均匀性、归一化半径方差、所述细胞的图像的强度平滑度、所述细胞的相位强度对比度、以微米计的所述细胞的最大光学高度、所述细胞的平均强度对比度、所述细胞的平均强度均匀性、所述细胞的图像的强度偏斜度、hu不变矩1、所述细胞的图像的强度方差、平均熵和所述细胞的图像的强度相关性的至少1、2、3、4、5、6、7、8、9、10、11、12、13、14种或所有输入特征,以将细胞分类为属于特定亚型(例如,cd4或cd8 t细胞)。
[0126]
在一些实施方案中,随机森林分类器可以使用一个或多个输入特征将细胞群体中的细胞亚型(例如,含有t细胞的细胞群体中的t细胞)分类。在一些实施方案中,所述一个或多个输入特征包括细胞深度、所述细胞的图像的强度对比度、所述细胞的图像的强度均匀性、归一化半径方差、所述细胞的图像的强度平滑度、所述细胞的相位强度对比度、以微米计的所述细胞的最大光学高度、平均强度对比度、所述细胞的图像的平均强度均匀性、所述细胞的图像的强度偏斜度、hu不变矩1、所述细胞的图像的强度方差、平均熵和所述细胞的图像的强度相关性。在一些实施方案中,机器学习模型(如随机森林分类器)可以以任何组合使用选自细胞深度、所述细胞的图像的强度对比度、所述细胞的图像的强度均匀性、归一化半径方差、所述细胞的图像的强度平滑度、所述细胞的相位强度对比度、以微米计的所述细胞的最大光学高度、平均强度对比度、所述细胞的图像的平均强度均匀性、所述细胞的图像的强度偏斜度、hu不变矩1、所述细胞的图像的强度方差、平均熵和所述细胞的图像的强度相关性的1、2、3、4、5、6、7、8、9、10、11、12、13、14个输入特征,以将细胞分类为属于特定亚型(例如,cd4或cd8 t细胞)。在一些实施方案中,机器学习模型(如随机森林分类器)可以以任何组合使用选自细胞深度、所述细胞的图像的强度对比度、所述细胞的图像的强度均匀性、归一化半径方差、所述细胞的图像的强度平滑度、所述细胞的相位强度对比度、以微米计的所述细胞的最大光学高度、平均强度对比度、所述细胞的图像的平均强度均匀性、所述细胞的图像的强度偏斜度、hu不变矩1、所述细胞的图像的强度方差、平均熵和所述细胞的图像的强度相关性的至少1、2、3、4、5、6种或所有输入特征,以将细胞分类为属于特定亚型(例如,cd4或cd8 t细胞)。在一些实施方案中,机器学习模型(如随机森林分类器)可以以任何组合使用选自细胞深度、所述细胞的图像的强度对比度、所述细胞的图像的强度均匀性、归一化半径方差、所述细胞的图像的强度平滑度和所述细胞的相位强度对比度的1、2、3、4、
5或6个输入特征,以将细胞分类为属于特定亚型(例如,cd4或cd8 t细胞)。在一些实施方案中,机器学习模型(如随机森林分类器)可以以任何组合使用选自细胞深度、所述细胞的图像的强度对比度、所述细胞的图像的强度均匀性、归一化半径方差、所述细胞的图像的强度平滑度和所述细胞的相位强度对比度的至少1、2、3、4、5或6个输入特征,以将细胞分类为属于特定亚型(例如,cd4或cd8 t细胞)。在一些实施方案中,机器学习模型(如随机森林分类器)可以以任何组合使用选自细胞深度、所述细胞的图像的强度对比度、所述细胞的图像的强度均匀性的一个或多个输入特征,以将细胞分类为属于特定亚型(例如,cd4或cd8 t细胞)。在一些实施方案中,所述一个或多个输入特征包括细胞深度。在一些实施方案中,所述一个或多个特征包括强度对比度。在一些实施方案中,所述一个或多个特征包括强度均匀性。
[0127]
在一些实施方案中,随机森林可以用于确定细胞群体中的细胞是否表达重组分子。在一些实施方案中,所述重组分子是重组受体。在一些实施方案中,所述重组受体是嵌合抗原受体(car)。在一些实施方案中,所述重组受体是t细胞受体(tcr)。在一些实施方案中,从与群体的细胞相关的图像数据确定的输入特征可以用作随机森林的输入以确定细胞表达重组分子和/或所述细胞群体中表达所述重组分子的细胞的百分比、总数和/或浓度。在一些实施方案中,所述随机森林能够将car 和car-细胞分类。在一些实施方案中,待分类的细胞是含有t细胞的细胞群体的t细胞。
[0128]
在一些实施方案中,随机森林可以用于确定细胞群提中的细胞是否处于激活状态。在一些实施方案中,从与群体的细胞相关的图像数据确定的输入特征可以用作随机森林的输入以确定所述细胞被激活和/或细胞群体中激活的细胞的百分比、总数和/或浓度。在一些实施方案中,所述随机森林能够将激活的和未激活的细胞分类。在一些实施方案中,待分类的细胞是含有t细胞的细胞群体的t细胞。
[0129]
在一些实施方案中,预处理阶段可以应用到与细胞(例如,t细胞)相关的图像数据以生成对应于单独输入特征(例如,上述光学、形态、强度、相位或系统特征中的任一种)的参数(例如,值),然后将那些参数作为输入提供给机器学习模型(例如,上述机器学习模型中的任一种)。例如,预处理阶段可以作用于候选细胞的图像数据——例如,rgb或灰度值的3d阵列,其中每个rgb或灰度值对应于该图像的一个像素。在一些实施方案中,预处理包括消除或减少与细胞相关的噪声(例如,背景噪声)图像数据。在一些实施方案中,预处理包括归一化与细胞相关的图像数据。预处理阶段可以从图像计算强度值、光学高度值、对比度值或任何其他合适的参数(如上面描述的那些),然后可以将那些参数应用到机器学习模型。
[0130]
在一些实施方案中,可以使用多于一种类型的机器学习模型将细胞分类。例如,如果待分类的细胞群体经历制造过程(例如本文所述的过程),则可以在制造过程期间的任何时间点或步骤使用分类方法来将所述群体的细胞分类。预期某些机器学习模型可以更好地用于在不同时间点或步骤将细胞分类。在一些实施方案中,可以在不同时间点或在例如制造过程的不同步骤期间使用一种或多种机器学习模型(例如如上所述)。1.训练方法
[0131]
在一些实施方案中,可以使用训练数据来训练机器学习模型。在一些实施方案中,所述训练数据是或包括与细胞(例如,t细胞)相关的图像数据。在一些实施方案中,所述训练数据是或包括从与细胞(例如,t细胞)相关的图像数据确定的输入特征。在一些实施方案
中,所述训练数据与在细胞数据集(例如如下所述)中含有的细胞相关。算法的训练可以通过监督式、非监督式或半监督式训练方法来完成。
[0132]
在一些实施方案中,机器学习模型的训练是监督式的。在这种情况下,用于训练机器学习模型的训练数据(例如,图像数据、输入特征)来自已知具有一种或多种细胞属性的细胞,所述一种或多种细胞属性指示所述细胞属于特定组,其中所述组是通过所述一种或多种细胞属性定义的。例如,所述训练数据可以包括从具有已知细胞属性(例如,cd4 、cd8 、转导的细胞)的细胞(例如,t细胞)采集的图像数据和/或输入特征。通过这种方式,所述模型被训练(例如,学习)使得特定数据(例如,图像数据、输入特征)对应于具有特定细胞属性(例如,cd4 、cd8 、转导的细胞)的细胞(例如,t细胞)。因此,当将来自细胞属性未知的细胞的新数据(例如,图像数据或输入特征)呈现给所述模型时,所述模型可以基于先前的训练将所述细胞分类(例如,预测)为属于通过一种或多种细胞属性定义的组。在一些实施方案中,所述图像数据是通过ddhm获得的。在一些实施方案中,所述输入特征是从通过ddhm获得的图像数据确定的。
[0133]
在一些实施方案中,与具有已知细胞属性的细胞相关的图像数据被操纵以生成用于机器学习模型的监督式训练的另外的数据集。在一些实施方案中,将与具有已知细胞属性的细胞相关的图像数据通过缩放、偏斜和/或旋转来操纵。在处理小的训练数据集或缺乏多样性的训练数据集时,此策略可以用于提升学习能力。在一些实施方案中,所述图像数据是通过ddhm获得的。
[0134]
可替代地,在一些实施方案中,机器学习模型的训练是非监督式的。在这种情况下,用于训练所述模型的训练数据(例如,图像数据、输入特征)来自细胞属性未知的细胞。因此,当将未知来源(例如,未知细胞类型、未知转导成功)的数据(例如,图像数据、输入特征)呈现给所述模型时,所述模型将新数据与通过非监督式数据生成的集群相关联。所述模型可以将新数据分类为由非监督式训练数据生成的现有集群的一部分,或者分类为不同于现有集群的集群的一部分,或者分类为离群值。新数据与集群的关联可以通过所述模型通过使用例如基于形心的聚类技术如k均值聚类等来实现。
[0135]
可在其上训练机器学习模型的数据集可以以任何合适的方式被拆分或划分,以生成用于训练的数据集、用于测试的数据集和/或用于验证的数据集。例如,在一些实施方案中,数据集被拆分或划分使得80%的数据用于训练机器学习模型并且20%用于测试机器学习模型。用于训练和测试机器学习模型的示例性数据拆分或划分可以在下面的第vi节中找到。
[0136]
在一些实施方案中,所述训练数据是平衡的。在一些实施方案中,所述测试数据是平衡的。例如,如果属于第一组的细胞群体大于属于第二组的细胞群体,则可以对第一组随机采样以创建与第二组大小相同的细胞群体。
[0137]
在一些实施方案中,训练机器学习模型以鉴定细胞(例如,t细胞)为属于第一组或第二组,其中所述第一组是通过一种或多种细胞属性定义的,并且所述第二组是通过一种或多种细胞属性定义的,其中至少一种属性不同于定义所述第一组的一种或多种属性。在一些实施方案中,训练机器学习模型以将细胞(例如,t细胞)分类为属于三个或更多个或多个组中的一个,其中所述组是通过一种或多种细胞属性和至少一种属性定义的,并且在所述三个或更多个或多个组中的每一个中的至少一种属性与三个或更多个或多个组中的每
个其他组不同。
[0138]
在一些实施方案中,将机器学习模型在训练数据上训练,所述训练数据包括来自已知具有一种或多种特定细胞属性从而属于两个或更多个组之一的多个细胞的图像数据(例如,相位数据、强度数据和叠加数据中的一个或多个),并且训练机器学习模型以区分所述组的细胞。在一些实施方案中,将机器学习模型在包括相位数据、强度数据和叠加数据的图像数据上训练。在一些实施方案中,将机器学习模型在包括相位数据和强度数据的图像数据上训练。如上所述,在一些实施方案中,通过缩放、偏斜和/或旋转操纵图像数据。因此,在一些情况下,可以例如从现有的图像数据生成另外的训练数据。在一些实施方案中,使用ddhm获得图像数据。在一些实施方案中,使用本文所述的图像数据训练卷积神经网络。
[0139]
在一些实施方案中,将机器学习模型在训练数据上训练,所述训练数据包括从已知具有一种或多种特定细胞属性从而属于两个或更多个组之一的多个细胞的图像数据确定的一个或多个输入特征(例如,上述特征中的一个或多个),并且训练机器学习模型以区分所述组的细胞,并且训练机器学习模型以区分所述组的细胞。
[0140]
在一些实施方案中,机器学习模型可以从较大的一组输入特征选择输入特征子集,其中分类基于所选择的子集。如从特征选择和排序、特征组合或其他过程确定,提取的输入特征的子集可以用于学习。上文描述了可以使用的示例性特征。
[0141]
在一些实施方案中,所述输入特征源自使用ddhm获得的图像数据。在一些实施方案中,进行初始分析以确定哪些输入特征与细胞属性相关。然后可以将这些输入特征用作输入以训练机器学习模型。在一些实施方案中,可以进行统计测试以鉴定高度相关的输入特征。在一些实施方案中,可以进行统计测试来鉴定显示低方差的输入特征。在一些实施方案中,可以进行统计测试以鉴定显示低方差的输入特征并确定相关的输入特征。在一些实施方案中,具有低方差的输入特征被排除作为用于训练机器学习模型的输入。在一些实施方案中,仅使用一对相关的输入特征中的一个输入特征作为输入以训练机器学习模型。在一些实施方案中,使用输入特征训练随机森林模型、神经网络、svm。在一些实施方案中,用于训练和/或分类的输入特征已经经历如本文所述的初始分析。在一些实施方案中,使用已经历初始分析的特征可以提高模型性能。
[0142]
如本文所述的机器学习模型可以用于基于一个或多个输入特征将候选t细胞的分类输出为属于某一类别。此类输入特征可以包括上述输入特征中的一个或多个并且可以源自候选t细胞的图像数据。在一些实施方案中,机器学习模型将至少基于一个或多个或多个输入特征(例如,如上所述)将细胞分类为一个或多个集群之一,其将具有已知分类(例如,cd4 、cd8 、car 、car-)的细胞分组。在一些实施方案中,机器学习模型可以已经通过应用一种或多种基于密度的聚类算法生成多个集群,其将具有已知分类(例如,cd4 、cd8 、car 、car-)的变量分组。d.生成细胞数据集的方法
[0143]
本文还提供了用于生成用于训练机器学习模型的细胞数据集的方法。用于训练机器学习模型的训练数据(例如,图像数据、输入特征)可以源自细胞数据集中含有的细胞。如本文所述,生成细胞数据集以含有具有已知细胞属性的细胞(例如,属于特定组的细胞)。在一些实施方案中,所述细胞数据集包含已知属于特定组的细胞。例如,根据本文所述的方法生成的第一细胞数据集可以含有cd4 细胞,并且根据本文所述的方法生成的第二细胞数据
集可以含有cd8 细胞。这样,所述第一细胞数据集含有属于第一组的细胞,所述第一组是通过表达(例如,表面阳性)cd4的细胞属性定义的,并且所述第二细胞数据集含有属于第二组的细胞,所述第二组是通过表达(例如,表面阳性)cd8的细胞属性定义的。本文提供的用于生成细胞数据集的方法允许生成含有已知属于特定组的细胞群体的细胞数据集,所述组是通过一种或多种细胞属性定义的。如上所示,细胞属性包括但不限于细胞健康(例如,活(viable)(活(live))、死)、细胞周期状态、分化状态、激活状态、细胞亚型(cd4 、cd8 t细胞)和/或工程化状态(例如,t细胞是否表达重组受体(例如,嵌合抗原受体(car)、t细胞受体(tcr))。
[0144]
可以使用不同的技术生成可从中获得训练数据的细胞数据集。用于生成可用于训练机器学习模型的细胞数据集的技术的选择将取决于许多因素,包括但不限于如何处理待分类的细胞群体。例如,在来自细胞数据集中的细胞的训练数据上训练机器学习模型可能是有益的,例如,这可以提高准确性和/或稳健性,这些细胞以与待分类的细胞群体相同的方式进行处理。在一些实施方案中,所述训练数据源自如下细胞数据集,所述细胞数据集以与待分类的细胞群体的处理相同或基本相同的方式进行处理。1.纯细胞群体
[0145]
纯细胞群体可以用作用于训练机器学习模型的细胞数据集。例如,在一些实施方案中,通过基于所需属性从样品(例如,单采术、白细胞单采术、血液、pbmc样品)选择细胞来产生纯群体,从而分离具有相同属性的所选细胞的群体并从而创建细胞数据集。所选细胞的群体可以称为纯群体,因为它仅包含具有所述属性的细胞。
[0146]
含有纯群体的细胞数据集具有如下优点,即已知所述群体的所有细胞都属于一个组,并且可以直接从含有纯群体的细胞数据集获得训练数据(例如,图像数据、输入特征)并将其用于机器学习模型的监督式训练。例如,可以从样品(例如,单采术、白细胞单采术、血液、pbmc样品)中的混合细胞群体分离t细胞亚型(例如,cd4 或cd8 )并将其收集和/或处理(例如,刺激;转导;培育;孵育;制造,例如根据本文使用的方法)。在一些实施方案中,将所述纯群体以与待分类的群体的收集和/或处理相同或基本相同的方式收集和/或处理。
[0147]
可以直接评估(例如,经由本文所述的成像技术成像)含有纯群体的细胞的细胞数据集以获得训练数据(例如,图像数据、输入特征),而无需进一步处理(例如,从纯群体选择、分离、分开细胞)。在一些实施方案中,可以使用ddhm直接评估含有纯群体的细胞的细胞数据集。2.混合细胞群体
[0148]
作为纯群体的替代方案,细胞数据集可以源自混合细胞群体。混合细胞群体与纯群体的不同之处在于混合群体中含有的细胞不一定具有相同的细胞属性。在一些实施方案中,所述混合细胞群体是样品(例如,单采术、白细胞单采术、血液、pbmc样品)。在一些实施方案中,混合细胞群体含有包括一种或多种细胞属性的细胞,其中所述混合群体的每个细胞不一定包括相同的细胞属性。例如,可以从样品(例如,单采术、白细胞单采术、血液、pbmc样品)中的混合细胞群体分离t细胞亚型(例如,cd4 和cd8 ),并且分离的群体以例如特定比率重组以生成混合细胞群体。在一些实施方案中,将所述混合细胞群体以与待分类的群体的收集和/或处理相同或基本相同的方式收集和/或处理。
[0149]
与纯群体不同,从混合群体获得的训练数据不能直接用于监督式训练,因为细胞
的身份(例如,细胞所属的组)是未知的。因此,在一些实施方案中,为了从混合细胞群体获得有用的训练数据,可以从混合群体分离具有相同的一种或多种细胞属性的混合群体的细胞,从而生成细胞数据集。在一些实施方案中,对分离的细胞(例如,细胞数据集的细胞)进行评估(例如,经由本文所述的成像技术成像)以获得训练数据(例如,图像数据、输入特征)。
[0150]
在一些实施方案中,用于从混合细胞群体分离具有一种或多种相同属性的细胞以生成细胞数据集的方法不改变细胞的生理或功能状态。在一些实施方案中,从混合群体分离细胞的方法不会导致细胞保留用于分离细胞的药剂和试剂。此类实施方案以某种方式最小化或降低细胞被改变的能力,这种改变可能发生在用于将细胞从混合群体分离的某些方法中,并且可能导致从细胞数据集获得的训练数据不可用于教导机器学习模型哪些数据(例如,图像数据、输入特征)对分类有用。同样,如果细胞数据集的细胞保留了用于分开(例如,分离)细胞的药剂和试剂,则从细胞数据集获得的训练数据可能无法用于教导机器学习模型哪些数据(例如,图像数据、输入特征)对分类有用。在一些实施方案中,分离的方法不会改变细胞的生理或功能状态。在一些实施方案中,分离的方法导致分离的细胞不含或基本上不含用于实现所述分离的药剂和试剂。在一些实施方案中,基本上不含包括小于或小于约30%、25%、20%、15%、10、9%、8%、7%、6%、5%、4%、3%、2%或1%的用于实现所述分离的药剂和试剂存在于分离的细胞群体中。被认为适用于分离混合群体的分离方法在下文第i-d-2-a节以及美国公布的专利申请号us2015/0024411和us 2017/0037369中进行描述,将这两个专利申请均通过引用以其整体并入本文。
[0151]
当待分类的细胞群体本身是混合群体时,从混合群体生成细胞数据集可以特别用于训练机器学习模型。例如,当待分类的细胞群体含有多种细胞亚型(例如,cd4 和cd8 t细胞)和/或所述细胞已被转导或转染使得待分类的群体中仅一些细胞表达重组分子(例如,car、tcr)时,来自混合群体的细胞数据集可以用于训练机器学习模型。由于不同细胞类型的存在,混合细胞群体中的细胞信号传导和/或其他环境条件可能不同于纯群体。从混合细胞群体生成细胞数据集的能力具有如下优点,即混合群体的细胞经历与待分类的群体所经历的相同的条件。a.基于免疫亲和力的分离
[0152]
在一些实施方案中,所述分离方法包括基于细胞表面上一种或多种特定分子(如表面分子,例如表面蛋白)的表达或存在来分离混合群体的不同细胞类型。在一些实施方案中,表面分子的表达表明细胞对所述分子呈表面阳性。相反,在一些实施方案中,如果细胞不表达表面分子,则细胞对所述分子呈表面阴性。
[0153]
在一些实施方案中,所述分离是基于免疫亲和力的分离。例如,在一些方面,所述分离包括基于所述细胞的表达或一种或多种分子(通常是细胞表面分子)的表达水平分离细胞和细胞群体,例如通过以下方法分离:与特异性结合至此类分子的抗体或结合剂一起孵育,通常随后是洗涤步骤和将结合了所述抗体或结合剂的细胞与那些没有结合所述抗体或结合剂的细胞分离。
[0154]
此类分离步骤可以基于炎性选择,其中保留已结合所述抗体或结合剂的细胞以供进一步使用;和/或阴性选择,其中保留未结合至所述抗体或结合剂的细胞。在一些例子中,保留两种级分以供进一步使用。在一些方面,在没有可用于特异性鉴定异质群体中的细胞
类型的抗体或结合剂的情况下,阴性选择可能特别有用,使得最好基于由除所需群体之外的细胞表达的分子进行分离。
[0155]
所述分离不需要导致100%富集或去除特定细胞群体或表达特定标记物的细胞。例如,对特定类型的细胞(如表达表面分子的那些)的阳性选择或富集是指增加此类细胞的数量或百分比,但不需要使不表达所述表面分子的细胞完全不存在。同样,对特定类型的细胞(如表达表面分子的那些)的阴性选择、去除或耗尽是指减少此类细胞的数量或百分比,但不需要使所有此类细胞完全去除。例如,在一些方面,对cd4 或cd8 群体之一的选择富集了所述群体,即所述cd4 或cd8 群体,但也可以含有一些残留的或小百分比的其他未选择的细胞,在一些情况下,其可以包含仍然存在于富集的群体中的cd4或cd8群体中的另一群体。
[0156]
在一些例子中,进行多轮分离步骤,其中使来自一个步骤的阳性或阴性选择的级分经历另一个分离步骤,如随后的阳性或阴性选择。在一些例子中,单个分离步骤可以同时耗尽表达多种标记物的细胞,如通过将细胞与多种抗体或结合剂(每种抗体或结合配偶体对被靶向用于阴性选择的标记物具有特异性)一起孵育。同样,通过将细胞与在各种细胞类型上表达的多种抗体或结合剂一起孵育,可以同时对多个细胞类型进行阳性选择。
[0157]
在一些实施方案中,所述基于亲和力的选择采用免疫亲和色谱法。在一些方面,免疫亲和色谱法包括一种或多种色谱基质,如美国公布的专利申请号us 2015/0024411中所述。在一些实施方案中,所述色谱法是流体色谱法,通常是液相色谱法。在一些实施方案,色谱可以以流通模式进行,其中在柱的含有色谱基质的一端上例如通过重力流或通过泵施加含有待分离细胞的流体样品,并且其中流体样品在柱的另一端存在于柱中。另外,在一些方面,色谱法可以以“上下(up and down)”模式进行,其中在柱的含有填充在移液器吸头内的色谱基质的一端上例如通过移液器施加含有要分离的细胞的流体样品,并且其中流体样品在柱的另一端进入并存在于色谱基质/移液器吸头中。在一些实施方案中,色谱还可以以分批模式进行,其中将色谱材料(固定相)与含有细胞的样品例如在振荡、旋转或流体样品的重复接触和去除(例如,借助移液管)下一起孵育。
[0158]
在一些实施方案中,所述色谱基质是固定相。在一些实施方案中,所述色谱法是柱色谱法。在一些实施方案中,可以使用任何合适的色谱材料。在一些实施方案中,所述色谱基质具有固相或半固相的形式。在一些实施方案中,所述色谱基质可以包括聚合物树脂或金属氧化物或非金属氧化物。在一些实施方案中,所述色谱基质是非磁性材料或不可磁化材料。在一些实施方案中,所述色谱基质是衍生化二氧化硅或交联凝胶,如天然聚合物形式,例如多糖。在一些实施方案中,所述色谱基质是琼脂糖凝胶。用于色谱基质的琼脂糖凝胶在本领域中是已知的,并且在一些方面包括superflow
tm
琼脂糖或sepharose材料如superflow
tm
它们可以以不同的珠粒和孔径商购得到。在一些实施方案中,所述色谱基质是葡聚糖共价键合的特定交联琼脂糖基质,如本领域已知的任何基质,例如在一些方面,或它们可以以不同的珠粒和孔径获得。
[0159]
在一些实施方案中,色谱基质由合成聚合物制成,如聚丙烯酰胺、苯乙烯-二乙烯基苯凝胶、丙烯酸酯和二醇或丙烯酰胺和二醇的共聚物、多糖和琼脂糖的共聚物,例如聚丙烯酰胺/琼脂糖复合材料、多糖和n,n'-亚甲基双丙烯酰胺或与合成或天然聚合物偶联的衍生化二氧化硅。
[0160]
在一些实施方案中,所述色谱基质,如琼脂糖珠粒或其他基质具有至少或约至少50μm、60μm、70μm、80μm、90μm、100μm、120μm或150μm或更大的大小。尺寸排阻色谱基质的排阻极限被选择为低于样品中靶细胞(例如t细胞)的最大宽度。在一些实施方案中,所述基质的体积为至少0.5ml、1ml、1.5ml、2ml、3ml、4ml、5ml、6ml、7ml、8ml、9ml、10ml或更多。在一些实施方案中,所述色谱基质被填充到柱中。
[0161]
在一些实施方案中,作为免疫亲和色谱基质的色谱基质包括固定于其上的结合剂,如抗体或抗原结合片段,如fab。在一些实施方案中,所述抗体是全长抗体或其抗原结合片段,包括(fab)片段、f(ab')2片段、fab'片段、fv片段、能够特异性结合抗原的可变重链(vh)区、单链抗体片段(包括单链可变片段(scfv)和单结构域抗体(例如,sdab、sdfv、纳米抗体))及其抗原结合片段。在一些实施方案中,所述抗体是fab片段。在一些实施方案中,所述抗体可以是单价的、二价的或多价的。在一些实施方案中,所述结合剂包括单价结合位点。在一些实施方案中,所述单价结合位点是fab片段、sdab、fv片段或单链fv片段。
[0162]
在一些方面,所述抗体或其抗原结合片段可以由如下杂交瘤产生或源自如下杂交瘤:okt3(αcd3)、13b8.2(αcd4)、okt8(αcd8)。在一些实施方案中,任何上述抗体可以在重链和轻链可变区的框架内含有一种或多种突变,而不靶向高度可变cdr区。在一些方面,此类抗体的例子包括如美国专利号7,482,000和bes等人(2003)j.biol.chem.,278:14265-14273中所述的抗cd4抗体。
[0163]
在一些实施方案中,所述抗体或其抗原结合片段是抗独特型抗体或其抗原结合片段(抗id)。在一些实施方案中,所述抗id与靶抗原受体(例如car)结合。
[0164]
在一些实施方案中,所述抗体或其抗原结合片段与替代标记物特异性地结合。替代标记物可以用于检测已引入多核苷酸例如编码重组受体的多核苷酸的细胞。在一些实施方案中,所述替代标记物可以指示或确认细胞的修饰。在一些实施方案中,所述替代标记物是经制备在细胞表面上与重组受体(例如,car)共表达的蛋白质。在特定实施方案中,这种替代标记物是已经修饰以具有极少或无活性的表面蛋白。在一些实施方案中,所述替代标记物是由编码重组受体的相同多核苷酸编码。在一些实施方案中,编码重组受体的核酸序列与编码标记物的核酸序列可操作地连接,任选地通过内部核糖体进入位点(ires)或编码自切割肽或引起核糖体跳跃的肽(例如2a序列,例如t2a、p2a、e2a或f2a)的核酸隔开。在一些情况下,外在标记基因可以结合工程化细胞用于允许检测或选择细胞,并且在一些情况下还可以用于促进细胞自杀。
[0165]
示例性替代标记物可以包括细胞表面多肽的截短形式,如是非功能性的并且不转导或不能转导信号或通常由细胞表面多肽的全长形式转导的信号、和/或不内化或不能内化的截短形式。示例性截短的细胞表面多肽包括生长因子或其他受体的截短形式,例如截短的人表皮生长因子受体2(ther2)、截短的表皮生长因子受体(egfrt,如seq id no:23或24所示的示例性egfrt序列)或前列腺特异性膜抗原(psma)或其修饰形式。egfrt可含有由抗体西妥昔单抗或其他治疗性抗egfr抗体或结合分子识别的表位,其可以用于鉴定或选择已经用egfrt构建体和重组受体(例如嵌合抗原受体(car))工程化的细胞,和/或用于消除或分离表达受体的细胞。参见美国专利号8,802,374和liu等人,nature biotech.2016年4月;34(4):430
–
434。在一些方面,标记物(例如,替代标记物)包括全部或部分(例如,截短形式的)cd34、ngfr、cd19或截短型cd19(例如,截短型非人cd19)或表皮生
长因子受体(例如,tegfr)。在一些实施方案中,编码标记物的核酸可操作地连接至编码接头序列(如可切割接头序列,例如t2a)的多核苷酸。例如,标记物和任选地接头序列可以是如pct公开号wo 2014031687中所披露的任一种。例如,标记物可以是截短的egfr(tegfr),其任选地连接至接头序列,如t2a可切割接头序列。截短的egfr(例如tegfr)的示例性多肽包含seq id no:23或24所示的氨基酸序列或者与seq id no:23或24展现至少85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或更高序列同一性的氨基酸序列。
[0166]
在一些实施方案中,抗原结合片段如fab片段可以使用本领域已知的方法(如在一些方面,重链和轻链的高变序列的扩增以及可允许与编码适当恒定结构域的序列组合的克隆)从此类抗体产生。在一些实施方案中,所述恒定结构域是人亚类igg1/κ。此类抗体可以在羧基末端与肽链霉亲和素结合分子(如seq id no:10所示)融合。此类抗体的例子描述于stemberger等人(2102)plos one,7:35798和国际pct申请号。
[0167]
所述抗体或抗原结合片段如fab可以是如上所述的任何抗体,在一些方面包括本领域已知的抗体、具有特定k
off
速率的抗体和/或具有特定解离常数的抗体。
[0168]
在一些实施方案中,解离常数(kd)在约10-2
m至约10-11
m、或约10-2
m至约10-10
m、或约10-2
m至约10-9
m、或约10-2
m至约10-8
m、或约10-2
m至约10-7
m、或约10-2
m至约10-6
m、或约10-2
m至约10-5
m、或约10-2
m至约10-4
m、或约10-2
m至约10-3
m、或其间的任何数字的范围内。在一些实施方案中,解离常数(kd)在约10-3
m至约10-10
m、或约10-3
m至约10-9
m、或约10-3
m至约10-8
m、或约10-3
m至约10-7
m、或约10-3
m至约10-6
m、或约10-3
m至约10-5
m、或约10-3
m至约10-4
m、或其间的任何数字的范围内。在一些实施方案中,解离常数(kd)在约10-3
m至约10-7
m、或约10-3
m至约0.5x10-7
m、或约10-3
m至约10-6
m、或约10-3
m至约0.5x10-6
m、或约10-3
m至约10-5
m、或约10-3
m至约0.5x10-5
m、或约10-3
m至约10-4
m、或约10-3
m至约0.5x10-4
m、或其间的任何数字的范围内。
[0169]
在一些实施方案中,结合剂经由结合位点与表面分子之间的结合的解离速率常数(k
解离
)可以具有约3
×
10-5
sec-1
或更大的值(此解离速率常数是表征在结合剂的结合位点与靶细胞表面上的表面分子之间形成的复合物的解离反应的常数)。结合剂的结合位点与靶细胞表面上的表面分子之间的缔合反应的缔合速率常数(k
缔合
)可以具有任何值。为了确保表面分子与结合剂之间充分可逆的结合,选择结合平衡的k
off
值以具有以下值是有利的:约3
×
10-5
sec-1
或更大、约5
×
10-5
sec-1
或更大,如约1
×
10-4
sec-1
或更大、约1.5
×
10-4
sec-1
或更大、约2.0
×
10-4
sec-1
或更大、约2.5
×
10-4
sec-1
或更大、约3
×
10-4
sec-1
或更大、约3.5
×
10-4
sec-1
或更大、约4
×
10-4
sec-1
或更大、约5
×
10-4
sec-1
或更大、约7.5
×
10-4
sec-1
或更大、约1
×
10-3
sec-1
或更大、约1.5
×
10-3
sec-1
或更大、约2
×
10-3
sec-1
或更大、约2.5
×
10-3
sec-1
或更大、约3
×
10-3
sec-1
或更大、约4
×
10-3
sec-1
、约5
×
10-3
sec-1
或更大、约7.5
×
10-3
sec-1
或更大、约1
×
10-2
sec-1
或更大、约5
×
10-2
sec-1
或更大、约1
×
10-1
sec-1
或更大、或约5
×
10-1
sec-1
或更大。当在本文中关于k
off
速率、k
on
速率或kd(参见下文)使用时,术语“约”意指包括
±
20.0%的误差范围,包括
±
15.0%、
±
10.0%、
±
8.0%、
±
9.0%、
±
7.0%、
±
6.0%、
±
5.0%、
±
4.5%、
±
4.0.%、
±
3.5%、
±
3.0%、
±
2.8%、
±
2.6%、
±
2,4,%、
±
2.2%、
±
2.0%、
±
1.8,%、
±
1.6%、
±
1.4%、
±
1.2%、
±
1.0、%、
±
0.9%、
±
0.8%、
±
0.7%、
±
0.6%、
±
0.5%、
±
0.4%、
±
0.3%、
±
0.2%、
±
0.1%、或
±
0.01%。此处应注意,如本文所
用的动力学和热力学常数的值是指大气压力(即1.013bar)和室温(即25℃)的条件。在一些实施方案中,不论结合强度如何,意味着不论结合剂经由结合位点与表面分子之间的结合的解离常数(kd)具有低亲和力(例如,kd在约10-3
至约10-7
m的范围内)还是具有高亲和力(例如,kd在约10-7
至约1x10-10
m的范围内),靶细胞都可以进行可逆结合,只要结合剂经由结合位点与表面分子的结合的解离发生得足够快。
[0170]
在一些实施方案中,所述结合剂具有能够与表面分子特异性结合的单个(单价)结合位点。在一些实施方案中,结合剂具有能够与表面分子结合的至少两个(即,多个结合位点,包括三个、四个也或者五个相同的结合位点)。在这些实施方案中的任一个中,表面分子经由一个或多个结合位点(中的每一个)的结合的k
解离
值可能为约3
×
10-5
sec-1
或更大。因此,结合剂可以是单价分子(例如,单价抗体片段或单价人工结合分子(蛋白质性或其他),如基于脂质运载蛋白家族的多肽的突变蛋白(也称为)),或二价分子,如其中保留两个结合位点的抗体或片段,如f(ab')2片段。在一些实施方案中,表面分子可以是多价分子,如五聚ige分子,前提是k
解离
率为3
×
10-5
sec-1
或更大。在一些实施方案中,在分子水平上,并非结合剂经由结合位点与靶细胞上的表面分子的结合的k
解离
率(3
×
10-5
sec-1
或更大)提供通过本文所述的可逆细胞免疫亲和色谱技术进行的(无痕)分离生物材料。相反,并且如例如美国专利7,776,562或国际专利申请wo 02/054065中所述,表面分子与结合剂的结合位点之间的低亲和力结合与通过多聚化试剂介导的亲合力效应一起允许靶细胞的可逆无痕分离。如上文所提及,对于结合剂经由结合位点与靶细胞表面上的表面分子的结合,这种低结合亲和力的特征可以是解离常数(kd)在约1.0
×
10-3
m至约1.0
×
10-7
m的范围内。在这些实施方案中,可以在多聚化试剂的结合位点与包含在至少两种结合剂中的结合配偶体(参见下文)之间形成复合物,从而允许靶细胞在亲和色谱基质上可逆地固定和随后洗脱。
[0171]
在一些实施方案中,竞争试剂的添加可以破坏结合配偶体与多聚化试剂的结合位点之间形成的结合(复合物),这转而导致结合剂从靶细胞解离。
[0172]
在一些实施方案中,可以从混合的细胞群体分离细胞以生成细胞数据集,其中细胞数据集的细胞不含用于分离所述细胞的试剂和药剂。本文提供的分离方法允许生成不含用于从混合群体分开(例如,分离)细胞的药剂和试剂的细胞数据集。
[0173]
在一些实施方案中,所述结合剂是固定化的。在一些实施方案中,所述结合剂与结合配偶体融合或连接,所述结合配偶体与固定在基质上的多聚化试剂相互作用。在一些实施方案中,色谱基质的结合能力足以吸附或能够吸附至少1x107个细胞/ml、5x107个细胞/ml、1x108个细胞/ml、5x108个细胞/ml、1x109个细胞/ml或更多,其中所述细胞是表达由结合剂的结合位点特异性识别的细胞表面分子的细胞。
[0174]
在一些实施方案中,所述多聚化试剂与结合配偶体之间的相互作用形成可逆键,使得结合剂与基质的结合是可逆的。在一些实施方案中,所述可逆结合可以由链霉亲和素突变体结合配偶体和固定在基质上的多聚化试剂介导,所述多聚化试剂是链霉亲和素、链霉亲和素突变蛋白、亲和素或亲和素突变蛋白。
[0175]
在一些实施方案中,结合剂的可逆结合是经由肽配体结合试剂和链霉亲和素突变蛋白相互作用。
[0176]
在一些实施方案中,基于亲和力的选择采用多聚化试剂,包括链霉亲和素突变蛋白,例如strep-或strep-tactin(参见例如美国专利号6,103,493,国际公布的
pct申请号wo/2013011011、wo 2014/076277)。在一些实施方案中,链霉亲和素突变蛋白被功能化、包被和/或固定在基质上。
[0177]
在一些实施方案中,所述链霉亲和素突变蛋白比未修饰的或野生型链霉亲和素(如seq id no:11或seq id no:14所示的未修饰的或野生型链霉亲和素)对含有seq id no:1-6中任一个(例如像seq id no:5和/或seq id no:6(例如strep-tag))所示的氨基酸序列的肽配体展现出更高的结合亲和力。在一些实施方案中,所述链霉亲和素突变体展现出作为亲和力常数的对此类肽的结合亲和力,其比野生型链霉亲和素对相同肽的结合亲和力大超过5倍、10倍、50倍、100倍、200倍或更多。
[0178]
与未修饰的链霉亲和素如野生型链霉亲和素或其片段相比,所述链霉亲和素突变蛋白含有一个或多个氨基酸差异。术语“未修饰的链霉亲和素”是指对其进行一个或多个修饰的起始多肽。在一些实施方案中,所述起始或未修饰的多肽可以是seq id no:11所示的野生型多肽。在一些实施方案中,所述未修饰的链霉亲和素是野生型链霉亲和素的片段,其在n和/或c末端被缩短。这种最小链霉亲和素包括任何如下链霉亲和素:在seq id no:11的氨基酸位置10至16的区域中的n末端开始,并且在seq id no:11的氨基酸位置133至142的区域中的c末端终止。在一些实施方案中,所述未修饰的链霉亲和素具有seq id no:14所示的氨基酸序列。在一些实施方案中,如seq id no:14所示的未修饰的链霉亲和素可以在对应于ala13(其编号如seq id no:11所示)的位置处进一步含有n末端甲硫氨酸。对本文提供的链霉亲和素中的残基数目提及是关于seq id no:11中残基的编号。
[0179]
术语“链霉亲和素突变蛋白”、“链霉亲和素突变体”或其变体是指与未修饰的或野生型链霉亲和素(如seq id no:11或seq id no:14所示的链霉亲和素)相比含有一个或多个氨基酸差异。所述一个或多个氨基酸差异可以是氨基酸突变,如一个或多个氨基酸替代(取代)、插入或缺失。在一些实施方案中,链霉亲和素突变蛋白与野生型或未修饰的链霉亲和素相比可以具有至少1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19或20个氨基酸差异。在一些实施方案中,氨基酸替代(取代)是保守的或非保守的突变。含有所述一个或多个氨基酸差异的链霉亲和素突变蛋白展现出作为亲和力常数的结合亲和力,其对于肽配体(trp arg his pro gln phe gly;也称为strep-seq id no:5所示)为大于2.7x104m-1
。在一些实施方案中,链霉亲和素突变体展现出作为亲和力常数的结合亲和力,其对于肽配体(trp ser his pro gln phe glu lys;也称为strep-ii,seq id no:6所示)为大于1.4x104m-1
。在一些实施方案中,结合亲和力可以通过本领域已知的方法(例如下面描述的任何方法)来确定。
[0180]
在一些实施方案中,链霉亲和素突变蛋白在一个或多个残基44、45、46和/或47处含有突变。在一些实施方案中,链霉亲和素突变体含有残基val44-thr45-ala46-arg47,如seq id no:12或seq id no:15所示的示例性链霉亲和素突变蛋白中所示。在一些实施方案中,链霉亲和素突变蛋白含有残基ile44-gly45-ala-46-arg47,如seq id no:13或16所示的示例性链霉亲和素突变蛋白中所示。在一些实施方案中,链霉亲和素突变蛋白展现出seq id no:12、13、15、16、20、21或22所示的氨基酸序列,或如下氨基酸序列,其展现出与seq id no:12、13、15或16所示的氨基酸序列的至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或更多序列同一性;并且展现出如下结合亲和力,其对于肽配体(trp arg his pro gln phe gly gly;也称为strep-seq id no:5所示)为大于2.7x104m-1
和/或对于
肽配体(trp ser his pro gln phe glu lys;也称为strep-ii,seq id no:6所示)为大于1.4x104m-1
。
[0181]
在一些实施方案中,链霉亲和素突变蛋白是如国际公开的pct申请号wo2014/076277中所述的突变体。在一些实施方案中,参考在seq id no:11中所示的氨基酸位置,链霉亲和素突变蛋白在氨基酸位置44至53的区域中含有至少两个半胱氨酸残基。在一些实施方案中,所述半胱氨酸残基存在于位置45和52,以产生连接这些氨基酸的二硫桥。在这样的实施方案中,氨基酸44通常是甘氨酸或丙氨酸,并且氨基酸46通常是丙氨酸或甘氨酸,并且氨基酸47通常是精氨酸。在一些实施方案中,参考在seq id no:11中所示的氨基酸位置,链霉亲和素突变蛋白在氨基酸残基115至121的区域中含有至少一个突变或氨基酸差异。在一些实施方案中,链霉亲和素突变蛋白含有在氨基酸位置117、120和121处的至少一个突变、和/或氨基酸118和119的缺失以及至少氨基酸位置121的取代。
[0182]
在一些实施方案中,链霉亲和素突变蛋白可以含有任何以上突变的任何组合,只要所得链霉亲和素突变蛋白展现出如下结合亲和力,其对于肽配体(trp arg his pro gln phe gly gly;也称为strep-seq id no:5所示)为大于2.7x104m-1
和/或对于肽配体(trp ser his pro gln phe glu lys;也称为strep-ii,seq id no:6所示)为大于1.4x104m-1
。
[0183]
在一些实施方案中,链霉亲和素突变体对于肽配体结合试剂的结合亲和力是大于5x104m-1
、1x105m-1
、5x105m-1
、1x106m-1
、5x106m-1
或1x107m-1
,但一般小于1x10
13
m-1
、1x10
12
m-1
或1x10
11
m-1
。
[0184]
在一些实施方案中,链霉亲和素突变体还展现与其他链霉亲和素配体(例如但不限于生物素、亚氨基生物素、硫辛酸、脱硫生物素、二氨基生物素、haba(羟基偶氮苯-苯甲酸)或/和二甲基-haba)的结合。在一些实施方案中,链霉亲和素突变蛋白展现出对另一种链霉亲和素配体(如生物素或脱硫生物素)的结合亲和力,其大于链霉亲和素突变蛋白对肽配体(trp arg his pro gln phe gly;也称为strep-seq id no:5所示)或肽配体(trp ser his pro gln phe glu lys;也称为strep-ii,seq id no:6所示)的结合亲和力。
[0185]
在一些实施方案中,链霉亲和素突变蛋白是多聚体。可以使用在本领域中已知的任何方法(如在公布的美国专利申请号us 2004/0082012中描述的任何方法)来生成多聚体。在一些实施方案中,突变蛋白的寡聚物或聚合物可以通过将羧基残基引入多糖(例如葡聚糖)中来制备。在一些此类方面,然后在第二步骤中使用常规碳二亚胺化学将链霉亲和素突变蛋白经由内部赖氨酸残基的伯氨基基团和/或游离n末端与葡聚糖骨架中的羧基基团偶联。在一些实施方案中,偶联反应以每摩尔葡聚糖约60摩尔链霉亲和素突变体的摩尔比进行。在一些实施方案中,寡聚物或聚合物也可以通过经由双功能接头如戊二醛交联或通过本领域已知的其他方法获得。
[0186]
在色谱基质的方面,将基质如琼脂糖珠粒或其他基质用多聚化试剂如链霉亲和素突变蛋白(如上文所述的任一种,例如seq id no:12、13、15、16、20、21或22所示的任一种)功能化或缀合。在一些实施方案中,所述抗体或抗原结合片段如fab直接或间接地与能够结合至链霉亲和素突变体(如上述任一种)的肽配体融合或连接。在一些实施方案中,所述肽
配体是如上所述的任一种,如含有seq id no:1-10或17-19中任一种所示的氨基酸序列的肽。在一些实施方案中,使色谱基质柱与这种结合剂接触以将结合剂固定或可逆地结合至柱。
[0187]
在一些实施方案中,免疫亲和色谱基质可以通过使所述基质与含有待富集或待选择的细胞(例如,混合群体)的样品接触用于本文所述的富集和选择方法。在一些实施方案中,通过破坏结合配偶体/多聚化试剂的相互作用,从基质洗脱或释放所选择的细胞。在一些实施方案中,结合配偶体/多聚化试剂通过肽配体和链霉亲和素突变体相互作用介导,并且由于可逆键的存在可以实现所选择的细胞的释放。例如,在一些实施方案中,肽配体结合配偶体与链霉亲和素突变蛋白结合试剂之间的键是高的,如上文所述,但低于链霉亲和素结合试剂对生物素或生物素类似物的结合亲和力。因此,在一些实施方案中,可以添加生物素(维生素h)或生物素类似物用于竞争结合以破坏基质上的链霉亲和素突变蛋白结合试剂与和特异性结合至表面上的细胞标记物的抗体相关的肽配体结合配偶体之间的结合相互作用。在一些实施方案中,可以在低浓度的生物素或类似物的存在下(例如在0.1mm至10mm、0.5mm至5mm、或1mm至3mm的存在下,例如通常至少或约至少1mm或至少2mm,例如为或约2.5mm)逆转相互作用。在一些实施方案中,在存在竞争试剂如生物素或生物素类似物的情况下的洗脱将所选择的细胞从基质释放。在一些实施方案中,所述竞争试剂是生物素或生物素类似物。
[0188]
在一些实施方案中,所提供的方法中的免疫亲和色谱法是使用至少两个可操作地连接的色谱基质柱进行的。例如,包含能够与cd4或cd8之一结合的单价结合位点的结合剂(如抗体,例如fab)与第一选择柱中的第一色谱基质偶联并且包含能够与cd4或cd8中的另一个结合的单价结合位点的结合剂(如抗体,例如fab)与第二选择柱中的第二色谱基质偶联。在一些实施方案中,所述至少两个色谱基质柱存在于封闭系统或设备(如无菌的封闭系统或设备)中。
[0189]
在一些实施方案中,本文还提供了含有至少两个可操作地连接的色谱基质柱的封闭系统或设备。
[0190]
在一些实施方案中,所述封闭系统是自动化的。在一些实施方案中,与所述系统相关联的组件可以包括集成微型计算机、蠕动泵和各种阀(如夹管阀或旋塞阀),以控制所述系统的各个部件之间的流体流动。在一些方面,集成计算机控制所述仪器的所有部件并指示所述系统按标准化顺序进行重复程序。在一些实施方案中,所述蠕动泵控制整个管组的流速,并与夹管阀一起确保经过系统的缓冲液的受控流动。
[0191]
洗涤缓冲液可以是与细胞相容的任何生理缓冲液,如磷酸盐缓冲盐水。在一些实施方案中,洗涤缓冲液含有牛血清白蛋白、人血清白蛋白或重组人血清白蛋白,如浓度为0.1%至5%或0.2%至1%,如或约0.5%。在一些实施方案中,洗脱液是生物素或生物素类似物,如脱生物素,例如其量为或为约至少0.5mm、1mm、1.5mm、2mm、2.5mm、3mm、4mm、或5mm。
[0192]
在一些实施方案中,根据本文所述的方法从混合群体分离细胞以生成细胞数据集是依序发生的。例如,第一次阳性选择可以发生在第一柱上,并且第二次选择(来自第一次选择的阳性级分或阴性部分)可以发生在第二柱上。在一些实施方案中,根据本文所述的方法从混合群体分离细胞以生成细胞数据集是并行发生的。例如,两个阳性选择可以在两个不同的柱上同时发生。在一些实施方案中,并行选择(例如,分开、分离)可以通过同时或几
乎同时将混合群体应用到两个柱来完成。预期可以使用任何数量的分离步骤生成用于训练机器学习模型的细胞数据集。ii.用于生成工程化t细胞的方法
[0193]
在一些实施方案中,本文提供的将细胞分类的方法可以与包括制造、生成或产生细胞疗法的过程结合使用。在一些实施方案中,细胞疗法包括用重组受体(如嵌合抗原受体(car))工程化的细胞(如t细胞),例如car t细胞。在一些实施方案中,本文提供的将细胞分类的方法与制造、生成或产生细胞疗法结合使用,所述制造、生成或产生细胞疗法可以经由如下过程进行,所述过程包括一个或多个处理步骤,如细胞的分离、分开、选择、激活或刺激、转导、孵育、培育、扩增、洗涤、悬浮、稀释、浓缩和/或配制步骤。在一些实施方案中,所述过程不包括用于扩增的步骤。在一些实施方案中,所述过程不包括用于培育的步骤。例如,在一些实施方案中,所述过程不包括下文第ii-d节中描述的步骤。在一些实施方案中,所述过程包括一个或多个处理步骤,如用于细胞的分离、分开、选择、激活或刺激、转导、孵育、洗涤、悬浮、稀释、浓缩和/或配制的步骤。在一些实施方案中,不包括扩增步骤的制造过程被称为非扩增或最小扩增的过程。“非扩增”过程也可以被称为“最小扩增”过程。在一些实施方案中,虽然过程不包括用于扩增的步骤,但非扩增或最小扩增过程可能得到已经经历扩增的细胞。在一些实施方案中,收获的细胞可能已经经历孵育或培育步骤,所述步骤包括设计用于降低、抑制、最小化或消除细胞群作为群体的扩增的培养基组合物。在一些实施方案中,所述制造过程是非扩增或最小扩增的过程。
[0194]
在一些实施方案中,生成或产生细胞疗法的方法包括从受试者分离细胞,在一种或多种刺激条件下制备、处理、培养。在一些实施方案中,所述方法包括按以下顺序进行的处理步骤,其中:首先将细胞(例如原代细胞)从生物样品分离(如选择或分开);将选择的细胞与病毒载体颗粒一起孵育用于转导,任选地在存在刺激试剂的情况下刺激所分离的细胞的步骤之后;培养所转导的细胞(如用于扩增或不扩增细胞)或孵育所转导的细胞(例如,如在非扩增或最小扩增的过程中那样);以及将所转导的细胞配制在组合物中。在一些实施方案中,在低温保存之前或之后将生成的工程化细胞重新引入同一受试者中。在一些实施方案中,可以在所述步骤中的一个或多个步骤期间,包括在分离、选择、转导和/或培育之前和/或之后,将细胞低温保存,并且随后解冻。
[0195]
在一些实施方案中,所述一个或多个处理步骤可以包括以下中的一个或多个:(a)洗涤含有细胞的生物样品(例如,全血样品、血沉棕黄层样品、外周血单个核细胞(pbmc)样品、未分级的t细胞样品、淋巴细胞样品、白细胞样品、单采术产物、或白细胞单采术产物),(b)从样品分离(例如选择)所希望的细胞子集或群体(例如,cd4 和/或cd8 t细胞),例如,通过将细胞与选择或免疫亲和试剂一起孵育以进行基于免疫亲和的分离;(c)将分离的(如选择的)细胞与病毒载体颗粒一起孵育,(d)使用如所描述的方法来培养、培育、孵育或任选扩增细胞,和(e)例如在药学上可接受的缓冲液、低温保存剂或其他合适的培养基中配制所转导的细胞。在一些实施方案中,所述方法可以进一步包括(e)通过将细胞暴露于刺激条件来刺激细胞,所述刺激可以在将细胞与病毒载体颗粒一起孵育之前、期间和/或之后进行。在一些实施方案中,在任何上述步骤之前或之后也可以进行洗涤或悬浮步骤的一个或多个另外的步骤,如用于细胞的稀释、浓缩和/或缓冲液交换。
[0196]
在一些实施方案中,进行所提供的方法,使得用于临床用途(例如过继细胞疗法
中)的细胞的制备中的一个、多个或所有步骤是在未将细胞暴露于非无菌条件下和不需要使用无菌室或无菌柜的情况下进行。在这个过程的一些实施方案中,将细胞分离、分开或选择、转导、洗涤、任选地激活或刺激并配制,所述步骤都在封闭系统内进行。在一些实施方案中,所述方法是以自动化方式进行的。在一些实施方案中,一个或多个步骤是在封闭系统或装置之外进行的。
[0197]
在一些实施方案中,将封闭系统用于进行用于制造、生成或产生细胞疗法的方法的一个或多个其他处理步骤。在一些实施方案中,一个或多个或所有处理步骤(例如隔离、选择和/或富集、处理、与转导和工程化结合的孵育)和配制步骤是使用集成或自含式系统中的系统、装置或设备进行和/或以自动化或可编程方式进行。在一些方面,所述系统或设备包括与所述系统或设备通信的计算机和/或计算机程序,其允许用户对处理、分离、工程化和配制步骤的各个方面进行编程、控制、评估其结果和/或调整。在一个例子中,该系统是如国际专利申请公开号wo 2009/072003或us 20110003380 a1中所述的系统。在一个例子中,所述系统是如国际公开号wo 2016/073602中所述的系统。在一些实施方案中,如本文所述的将细胞分类的方法与所述系统或设备集成,使得分类过程的结果可以用于控制和/或调整处理、分离、工程化和配制步骤的各个方面。例如,本文描述的将细胞分类的方法可以用于确定细胞健康(活(活的)、死)、细胞类型和/或细胞表达重组分子,如确定(例如,预测)活细胞、细胞类型(例如,cd4 、cd8 )和/或重组分子阳性细胞(例如,car 、car-)的百分比、总数和/或浓度。该信息可以用于告知处理、分离、工程化、配制和/或收获步骤。分类过程的输出可以由操作员(例如,人操作员)使用、与所述系统或设备直接接口、或二者的组合,以编程、控制、评估和/或调整所述处理、分离、工程化、收获和配制步骤的各个方面。
[0198]
在一些实施方案中,在制造过程期间的任何时间进行本文提供的将细胞分类的方法。在一些实施方案中,在制造过程的任何步骤中进行本文提供的将细胞分类的方法。在一些实施方案中,在制造过程的一个或多个步骤期间进行本文提供的将细胞分类的方法。在一些实施方案中,本文提供的分类方法在制造过程的特定步骤(如本文所述的制造过程的步骤)期间进行。在一些实施方案中,本文提供的分类方法在制造过程的孵育、培育或扩增步骤(例如如本文所述的孵育、培育或扩增步骤)期间进行。在一些实施方案中,本文提供的分类方法在孵育步骤期间进行。
[0199]
在一些实施方案中,本文提供的将细胞分类的方法用于引导制造过程的刺激条件、工程化条件、孵育条件和培育条件。在一些实施方案中,本文提供的分类方法可用于确定修改刺激条件、工程化条件、孵育条件和培育条件的需要。例如,确定细胞健康、鉴定细胞类型以及确定活细胞浓度可用于确定灌注和/或进料时间表、在刺激条件下减少或添加细胞因子的需要、检测激活或分化的t细胞的浓度、确定混合群体是否含有适当浓度的待转导或转染的活细胞和/或活细胞亚型、确定成功转导的细胞的浓度和/或确定活细胞、转导/转染的活细胞、转导/转染的活细胞亚型的浓度以测定所述收获。如上所述,如本文所述的将细胞分类的方法可以输出信息,所述信息可由操作员(例如,人操作员)、计算机和/或能够接收分类过程输出或与其接口的系统使用。
[0200]
在一些实施方案中,本文提供的将细胞分类的方法在本文所述的封闭系统中进行。在一些实施方案中,本文提供的将细胞分类的方法在无菌配置中进行。例如,成像设备(例如,ddhm显微镜)可以无菌连接至容纳细胞群体的腔室。在一些实施方案中,所述无菌连
接是成像设备(例如,显微镜)与腔室之间的闭环系统,其中所述群体的细胞被运送至成像设备以用于成像并且随后返回到腔室。在一些实施方案中,所述腔室是孵育腔室。在一些实施方案中,所述腔室是生物反应器。在一些实施方案中,将细胞从腔室转移到成像设备(例如,ddhm显微镜)并返回到腔室是自动的。例如,闭环连接可以使用泵,其允许细胞从腔室到成像设备(例如,ddhm显微镜)并以设定的间隔返回腔室的非损害性循环。在一些实施方案中,将细胞从腔室转移到成像设备(例如,ddhm显微镜)并返回到腔室包括操作员(例如,人操作员)。例如,操作员(例如人操作员)可以确定用于在闭环系统中对细胞成像的时间间隔。在一些实施方案中,操作员(例如人操作员)可以例如在操作员的判断下在一个或多个离散时间点对闭环系统中的细胞成像。
[0201]
在一些实施方案中,本文提供的将细胞分类的方法支持完全自动化的(例如不需要手动(例如,人操作员)输入)制造过程。在一些实施方案中,全自动化系统是闭环系统。在一些实施方案中,全自动化闭环系统有效且可靠地产生用于细胞疗法(例如,过继细胞疗法、自体细胞疗法)的无菌、活的工程化细胞群体,包括特定比率下的特定细胞类型(例如,cd4 、cd8 、car 、tcr )或细胞总数。
[0202]
例如,可以进行分类以确定(例如,测量、量化)细胞健康(细胞活力、细胞死亡)、细胞亚型(cd4 、cd8 t细胞)和/或工程化状态(例如,t细胞是否表达重组受体(例如,嵌合抗原受体(car)、t细胞受体(tcr))。在一些实施方案中,进行分类以确定活细胞的总数、百分比和/或浓度,细胞亚型(例如,cd4 、cd8 )的总数、百分比和/或浓度,和/或表达重组受体的细胞的总数、百分比和/或浓度。在一些实施方案中,本文所述的分类方法包括在自动化系统中。例如,本文所述的将细胞分类的方法可以在计算机上存储和/或执行,所述计算机与成像设备(例如,显微镜)接口,所述成像设备连接至含有所述细胞的培育(例如,孵育)室,如生物反应器。作为另一个例子,含有所述分类方法的计算机可以与用于控制特定步骤的装备或设备接口或能够以其他方式与其通信。这样,所述分类方法的输出可以用于控制所述装备或设备。例如,所述分类方法的输出可以用于确定补料周期、培养基组成(例如,细胞因子浓度)和/或收获时间。所述自动化系统可能需要最少的手动或不需要手动(例如,人操作员)输入来将培育的细胞分类。在一些实施方案中,需要手动(例如,人操作员)输入。
[0203]
在一些实施方案中,所述自动化系统与生物反应器(例如本文所述的生物反应器)兼容,使得细胞可以从生物反应器取出、成像(例如,为了获得如上所述的图像数据和/或输入特征的目的)、以及随后返回至生物反应器。在一些实施方案中,所述分类和培育以闭环配置发生。在一些方面,在闭环配置中,自动化系统和生物反应器保持无菌。在实施方案中,自动化系统是无菌的。在一些实施方案中,自动化系统是在线系统。
[0204]
在一些实施方案中,所述自动化系统包括适合于对液体悬浮液中的细胞成像的成像设备。考虑了适用于对悬浮液中的细胞成像的任何成像技术。有用的成像技术的非限制性例子包括明视野显微术、荧光显微术、差分干涉显微术、相差显微术、数字全息显微术(dhm)、差分数字全息显微术(ddhm)或其组合。在某些实施方案中,自动化系统包括差分数字全息显微镜。在某些实施方案中,自动化系统包括差分数字全息显微镜,包括照明装置(例如,激光、led)。ddhm方法和使用的描述可以例如在以下文献中:us 7,362,449;ep 1,631,788;us 9,904,248;和us 9,684,281,所述申请通过引用以其整体并入本文;以及在第i-a-1节中找到。
[0205]
在一些实施方案中,所述自动化系统包括用于记录成像技术(例如,ddhm)的输出的数字记录装置。在一些实施方案中,所述装置是ccd相机或cmos相机。在一些实施方案中,自动化系统包括计算机,所述计算机包括用于分析图像的算法。在一些实施方案中,所述自动化系统包括计算机,所述计算机包括用于从记录的图像提取图像数据(例如,相位、强度、叠加,如上文第i-b节所述)的算法。在一些实施方案中,所述自动化系统包括用于显示图像的监视器和/或计算机。在一些实施方案中,所述自动化系统包括计算机,所述计算机包括用于从记录的图像和/或图像数据提取输入特征(如上文第i-b节所述)的算法。在一些实施方案中,所述分析是自动化的(即,能够在没有用户输入的情况下进行)。在一些实施方案中,所述自动化系统包括计算机,所述计算机包括如本文所述的机器学习模型,所述机器学习模型能够接收与细胞的图像相关的图像数据和/或输入特征并进行分类。用于在监测细胞的合适的自动化系统的例子包括但不限于ovizio iline f(ovizio imaging systems nv/sa,布鲁塞尔,比利时)。
[0206]
在某些实施方案中,所述分类方法是连续进行的。在一些实施方案中,所述分类方法是实时进行的。在一些实施方案中,所述分类方法在离散时间点进行。在一些实施方案中,在培育步骤持续时间内至少每15分钟进行一次所述分类方法。在一些实施方案中,在培育步骤持续时间内至少每30分钟进行一次所述分类方法。在一些实施方案中,在培育步骤持续时间内至少每45分钟进行一次所述分类方法。在一些实施方案中,所述分类方法在培育步骤持续时间内至少每小时进行一次。在一些实施方案中,在培育步骤持续时间内至少每2小时进行一次所述分类方法。在一些实施方案中,在培育步骤持续时间内至少每4小时进行一次所述分类方法。在一些实施方案中,在培育步骤持续时间内至少每6小时进行一次所述分类方法。在一些实施方案中,在培育步骤持续时间内至少每8小时进行一次所述分类方法。在一些实施方案中,在培育步骤持续时间内至少每10小时进行一次所述分类方法。在一些实施方案中,在培育步骤持续时间内至少每12小时进行一次所述分类方法。在一些实施方案中,在培育步骤持续时间内至少每14小时进行一次所述分类方法。在一些实施方案中,在培育步骤持续时间内至少每16小时进行一次所述分类方法。在一些实施方案中,在培育步骤持续时间内至少每18小时进行一次所述分类方法。在一些实施方案中,在培育步骤持续时间内至少每20小时进行一次所述分类方法。在一些实施方案中,在培育步骤持续时间内至少每22小时进行一次所述分类方法。在一些实施方案中,在培育步骤持续时间内至少每天进行一次所述分类方法。在一些实施方案中,在培育步骤持续时间内至少每两天进行一次所述分类方法。在一些实施方案中,在培育步骤持续时间内至少每三天进行一次所述分类方法。在一些实施方案中,在培育步骤持续时间内至少每四天进行一次所述分类方法。在一些实施方案中,在培育步骤持续时间内至少每五天进行一次所述分类方法。在一些实施方案中,在培育步骤持续时间内至少每六天进行一次所述分类方法。在一些实施方案中,在培育步骤持续时间内至少每七天进行一次所述分类方法。在一些实施方案中,在培育步骤持续时间内至少每八天进行一次所述分类方法。在一些实施方案中,在培育步骤持续时间内至少每九天进行一次所述分类方法。在一些实施方案中,在培育步骤持续时间内至少每十天进行一次所述分类方法。在一些实施方案中,所述分类方法在培育步骤持续时间内至少进行一次。
[0207]
在一些实施方案中,例如在包括扩增步骤的过程中,所述细胞由包括分类方法的
自动化系统监测直到达到扩增阈值。在一些实施方案中,一旦达到扩增阈值,立即收获细胞,如通过自动或手动方法(例如,由人操作员)收获。扩增阈值可能取决于通过自动化系统确定的培养的细胞的总浓度、密度和/或数量。可替代地,扩增阈值可能取决于活细胞浓度、密度和/或数量。a.细胞的分离和选择
[0208]
在一些实施方案中,所述处理步骤包括从生物样品中分离细胞或其组合物,所述生物样品是如获得自或源自受试者(如患有特定疾病或病症或需要细胞疗法或将被施用细胞疗法的受试者)的那些。在一些方面,所述受试者是人,如作为需要特定治疗性干预(如过继细胞疗法,其中分离、处理和/或工程化细胞以用于所述过继细胞疗法)的患者的受试者。因此,在一些实施方案中,细胞是原代细胞,例如原代人细胞。在一些实施方案中,细胞包括cd4 和cd8 t细胞。在一些实施方案中,所述细胞包括cd4 或cd8 t细胞。所述样品包括组织、流体和直接取自受试者的其他样品。生物样品可以是直接从生物来源获得的样品或经过处理的样品。生物样品包括但不限于体液(如血液、血浆、血清、脑脊液、滑液、尿液和汗液)、组织和器官样品,包括源自其的处理样品。
[0209]
在一些方面,样品是血液或血液来源的样品,或者是或源自单采术或白细胞单采术产物。示例性样品包括全血、外周血单个核细胞(pbmc)、白细胞、骨髓、胸腺、组织活检物、肿瘤、白血病、淋巴瘤、淋巴结、肠相关淋巴组织、粘膜相关淋巴组织、脾、其他淋巴组织、肝、肺、胃、肠、结肠、肾、胰腺、乳房、骨、前列腺、子宫颈、睾丸、卵巢、扁桃体或其他器官和/或源自其的细胞。在细胞疗法(例如,过继细胞疗法)的情况下,样品包括来自自体和同种异体来源的样品。
[0210]
在一些例子中,例如通过单采术或白细胞单采术获得来自受试者的循环血液的细胞。在一些方面,样品含有淋巴细胞(包括t细胞、单核细胞、粒细胞、b细胞)、其他有核白细胞、红细胞和/或血小板,并且在一些方面含有除红细胞和血小板之外的细胞。
[0211]
在一些实施方案中,洗涤从受试者收集的血细胞以例如去除血浆级分,并将细胞置于适当缓冲液或介质中以用于后续的处理步骤。在一些实施方案中,用磷酸盐缓冲盐水(pbs)洗涤细胞。在一些实施方案中,洗涤溶液缺乏钙和/或镁和/或许多或所有二价阳离子。在一些方面,根据制造商的说明书,通过半自动“流通式”离心机(例如,cobe 2991细胞处理器,baxter)完成洗涤步骤。在一些方面,根据制造商的说明书,通过切向流过滤(tff)完成洗涤步骤。在一些实施方案中,洗涤后将所述细胞重悬于多种生物相容性缓冲液(例如像不含ca
/mg
的pbs)中。在某些实施方案中,去除血细胞样品的组分并将所述细胞直接重悬于培养基中。
[0212]
在一些实施方案中,制备方法包括在分离、选择和/或富集、和/或用于转导和工程化的孵育之前或之后,和/或在培育和/或收获工程化细胞之后,冷冻(例如低温保存)细胞的步骤。用于生物样品(如t细胞或t细胞组合物)的冷冻、低温保存或低温的保存的示例性方法包括wo 2018170188中描述的那些方法,将其通过引用以其整体并入。在一些实施方案中,冷冻和后续解冻步骤去除细胞群中的粒细胞,并且在一定程度上去除单核细胞。在一些实施方案中,例如在洗涤步骤后将细胞悬浮在冷冻溶液中以去除血浆和血小板。在一些方面,可以使用多种已知的冷冻溶液和参数中的任一种。在一些实施方案中,将所述细胞在具有最终浓度为或为约12.5%、12.0%、11.5%、11.0%、10.5%、10.0%、9.5%、9.0%、
8.5%、8.0%、7.5%、7.0%、6.5%、6.0%、5.5%或5.0%dmso,或在1%与15%之间、在6%与12%之间、在5%与10%之间或在6%与8%之间的dmso的介质和/或溶液中冷冻,例如低温保存或低温保护。在特定实施方案中,将所述细胞在具有最终浓度为或为约5.0%、4.5%、4.0%、3.5%、3.0%、2.5%、2.0%、1.5%、1.25%、1.0%、0.75%、0.5%或0.25%的hsa,或在0.1%与5%之间、在0.25%与4%之间、在0.5%与2%之间或在1%与2%之间的hsa的介质和/或溶液中冷冻,例如低温保存或低温保护。一个例子包括使用含有20%dmso和8%人血清白蛋白(hsa)的pbs,或其他合适的细胞冷冻培养基。然后用培养基将其1:1稀释,使得dmso和hsa的最终浓度分别为10%和4%。然后通常将细胞以等于或约1
°
/分钟的速率冷冻至等于或约-80℃并储存在液氮储罐的气相中。
[0213]
在一些实施方案中,所述细胞或群体的分离包括一个或多个制备和/或基于非亲和力的细胞分离步骤。在一些例子中,将细胞在存在一种或多种试剂的情况下洗涤、离心和/或孵育,例如以去除不需要的组分、针对所需组分进行富集、裂解或去除对特定试剂敏感的细胞。在一些例子中,细胞基于一个或多个特性来分离,所述特性如密度、粘附特性、大小、对特定组分的敏感性和/或耐药性。在一些实施方案中,所述方法包括基于密度的细胞分离方法,如通过裂解红细胞并通过percoll或ficoll梯度离心而从外周血制备白细胞。
[0214]
在一些实施方案中,选择步骤的至少一部分包括将细胞与选择试剂一起孵育。与一种或多种选择试剂一起孵育,例如作为选择方法的一部分可以使用一种或多种选择试剂来进行,以用于基于一种或多种特定分子(如表面标记物(例如表面蛋白)、细胞内标记物或核酸)在细胞中或细胞上的表达或存在来选择一种或多种不同的细胞类型。在一些实施方案中,可以使用任何已知的利用一种或多种选择试剂基于此类标记物进行分离的方法。在一些实施方案中,所述一种或多种选择试剂导致分离,所述分离是基于亲和力或基于免疫亲和力的分离。例如,在一些方面,所述选择包括与一种或多种试剂一起孵育,用于基于一种或多种标记物(通常是细胞表面标记物)的细胞表达或表达水平来分离细胞和细胞群,例如通过以下方式来进行:与特异性地结合至此类标记物的抗体或结合配偶体一起孵育,之后通常进行洗涤步骤并分离已结合所述抗体或结合配偶体的细胞与尚未结合至所述抗体或结合配偶体的那些细胞。在一些实施方案中,所述过程的选择和/或其他方面如国际专利申请公开号wo/2015/164675中所述。
[0215]
在此类过程的一些方面,将一定体积的细胞与一定量的基于亲和力的所需选择试剂混合。基于免疫亲和力的选择可以使用任何系统或方法进行,所述系统或方法使得在分离的细胞与特异性结合至细胞上的标记物的分子(例如,固体表面(例如颗粒)上的抗体或其他结合配偶体)之间产生有利的能量相互作用。在一些实施方案中,方法是使用颗粒如珠粒(例如磁珠)进行,所述颗粒包被有对细胞的标记物具有特异性的选择剂(例如抗体)。可以将颗粒(例如珠粒)与细胞在容器(如管或袋)中一起孵育或混合,同时振荡或混合,其中细胞密度与颗粒(例如,珠粒)的比率是恒定的,以帮助促进能量上有利的相互作用。在其他情形中,所述方法包括选择细胞,其中所述选择的全部或一部分是在离心室的内部空腔中进行,例如在离心旋转下进行。在一些实施方案中,将细胞与选择试剂(如基于免疫亲和力的选择试剂)一起孵育是在离心室中进行。在某些实施方案中,使用在国际专利申请公开号wo 2009/072003或us 20110003380 a1中所述的系统、装置或设备进行分离或分开。在一个例子中,所述系统是如国际公开号wo2016/073602中所述的系统。
[0216]
在一些实施方案中,通过在离心室的空腔中实施此类选择步骤或其部分(例如,与抗体涂覆的颗粒(例如磁珠)一起孵育),用户能够控制某些参数,例如各种溶液的体积、在处理期间溶液的添加及其时间安排,与其他可用方法相比,这可以提供多种优势。例如,在孵育期间减少空腔中液体体积的能力可以增加选择中使用的颗粒(例如珠粒试剂)的浓度,并由此增加溶液的化学势,而不影响空腔中的细胞总数量。这又可以增强正在处理的细胞与用于选择的颗粒之间的成对相互作用。在一些实施方案中,例如,在与如本文所述的系统、电路和控制相关联时,在室中进行孵育步骤,允许用户在孵育期间的一个或多个所需时间实现对溶液的搅动,这也可以改善相互作用。
[0217]
在一些实施方案中,选择步骤的至少一部分是在离心室中进行,其包括将细胞与选择试剂一起孵育。在此类过程的一些方面,将一定体积的细胞与一定量的基于亲和力的所需选择试剂混合,所述量远少于根据制造商的说明书在管或容器中进行类似选择以用于选择相同数量的细胞和/或相同体积的细胞时通常采用的量。在一些实施方案中,所采用的一种或多种选择试剂的量是根据制造商的说明书用于在基于管或容器的孵育中针对相同数量的细胞和/或相同体积的细胞选择细胞的相同的一种或多种选择试剂的量的不超过5%、不超过10%、不超过15%、不超过20%、不超过25%、不超过50%、不超过60%、不超过70%或不超过80%。
[0218]
在一些实施方案中,对于细胞的选择,例如基于免疫亲和力的选择,将细胞在室空腔中在组合物中孵育,所述组合物还含有具有选择试剂的选择缓冲液,所述选择试剂例如特异性地结合至希望富集和/或耗尽的细胞上(而不是组合物中其他细胞上)的表面标记物的分子,例如抗体,其任选地偶联到支架(例如聚合物或表面,例如珠粒,例如磁珠,例如与对cd4和cd8具有特异性的单克隆抗体偶联的磁珠)。在一些实施方案中,如所描述的,将选择试剂添加至室空腔中的细胞,所添加的量与在振荡或旋转的管中进行选择时,对相同数量的细胞或相同体积的细胞实现大致相同或类似的选择效率通常使用或将需要的选择试剂的量相比显著较小(例如不大于所述量的5%、10%、20%、30%、40%、50%、60%、70%或80%)。在一些实施方案中,在向细胞和选择试剂添加选择缓冲液的情况下进行孵育,以实现例如10ml至200ml试剂的孵育的目标体积,如至少或约至少或约或为10ml、20ml、30ml、40ml、50ml、60ml、70ml、80ml、90ml、100ml、150ml或200ml。在一些实施方案中,将选择缓冲液和选择试剂在添加至细胞之前预先混合。在一些实施方案中,将所述选择缓冲液和选择试剂单独添加至所述细胞。在一些实施方案中,选择孵育是在周期性温和混合条件下进行的,这可有助于促进能量上有利的相互作用,从而允许使用较少的总选择试剂来实现高选择效率。
[0219]
在一些实施方案中,与选择试剂一起孵育的总持续时间是从5分钟至6小时或从约5分钟至约6小时,如30分钟至3小时,例如至少或约至少30分钟、60分钟、120分钟或180分钟。
[0220]
在一些实施方案中,所述孵育通常在混合条件下进行,如在旋转存在下进行,通常以相对低的力或速度旋转,如速度低于用于使细胞沉淀的速度,如从600rpm至1700rpm或从约600rpm至约1700rpm(例如,为或约或至少600rpm、1000rpm或1500rpm或1700rpm),如在室或其他容器的样品或壁处的一定rcf下,所述rcf是从80g至100g或从约80g至约100g(例如,为或约或至少80g、85g、90g、95g或100g)。在一些实施方案中,所述旋转是使用以这种低速
旋转和之后的休息时间段的重复间隔来进行,例如旋转和/或休息1、2、3、4、5、6、7、8、9或10秒,例如旋转大约1或2秒,然后休息大约5、6、7或8秒。
[0221]
在一些实施方案中,这种过程是在与所述室为整体的完全封闭的系统内进行的。在一些实施方案中,这个过程(在一些方面,以及一个或多个另外的步骤,如洗涤含有细胞的样品(如单采术样品)的预先洗涤步骤)是以自动化方式进行,使得将细胞、试剂和其他组分在适当时间吸入和推出室并进行离心,以使用自动化程序在单一封闭系统中完成洗涤和结合步骤。
[0222]
在一些实施方案中,在孵育和/或混合细胞和一种和/或多种选择试剂后,使所孵育的细胞经历分离,以基于一种或多种特定试剂的存在或不存在来选择细胞。在一些实施方案中,在同一封闭系统中进行分离,其中将细胞与所述选择试剂一起进行孵育。在一些实施方案中,在与所述选择试剂一起孵育后,将所孵育的细胞(包括其中已经结合选择试剂的细胞)转移到系统中用于基于免疫亲和力来分离细胞。在一些实施方案中,用于基于免疫亲和力的分离的系统是或含有磁分离柱。
[0223]
此类分离步骤可以基于阳性选择(其中保留已经结合试剂(例如抗体或结合配偶体)的细胞以供进一步使用)和/或阴性选择(其中保留尚未结合试剂(例如抗体或结合配偶体)的细胞)。在一些例子中,保留两种级分以供进一步使用。在一些方面,在没有可用于特异性鉴定异质群体中的细胞类型的抗体的情况下,阴性选择可能特别有用,使得最好基于由除所需群体之外的细胞表达的标记物进行分离。
[0224]
在一些实施方案中,过程步骤进一步包括如使用可以进行基于亲和力的选择的系统或设备对孵育的细胞进行阴性和/或阳性选择。在一些实施方案中,通过经由阳性选择富集特定细胞群,或经由阴性选择耗尽特定细胞群来进行分离。在一些实施方案中,通过以下方式完成阳性或阴性选择:将细胞与特异性结合至一种或多种表面标记物的一种或多种抗体或其他结合剂一起孵育,所述一种或多种表面标记物分别在阳性或阴性选择的细胞上表达(标记物 )或以相对较高的水平表达(标记物
高
)。可以进行多轮相同的选择步骤(例如阳性或阴性选择步骤)。在某些实施方案中,使阳性或阴性选择的级分经受选择过程,如通过重复阳性或阴性选择步骤。在一些实施方案中,将选择重复两次、三次、四次、五次、六次、七次、八次、九次或多于九次。在某些实施方案中,相同的选择进行多至五次。在某些实施方案中,相同的选择步骤进行三次。
[0225]
所述分离不需要导致100%富集或去除特定细胞群体或表达特定标记物的细胞。例如,对特定类型的细胞(如表达标记物的那些)的阳性选择或富集是指增加此类细胞的数量或百分比,但不需要使不表达所述标记物的细胞完全不存在。同样,对特定类型的细胞(如表达标记物的那些)的阴性选择、去除或耗尽是指减少此类细胞的数量或百分比,但不需要使所有此类细胞完全去除。
[0226]
在一些例子中,进行多轮分离步骤,其中使来自一个步骤的阳性或阴性选择的级分经历另一个分离步骤,如随后的阳性或阴性选择。在一些例子中,单个分离步骤可以同时耗尽表达多种标记物的细胞,如通过将细胞与多种抗体或结合配偶体(每种抗体或结合配偶体对被靶向用于阴性选择的标记物具有特异性)一起孵育。同样,通过将细胞与在各种细胞类型上表达的多种抗体或结合配偶体一起孵育,可以同时对多个细胞类型进行阳性选择。在某些实施方案中,一个或多个分离步骤重复和/或进行多于一次。在一些实施方案中,
使从分离步骤得到的阳性或阴性选择的级分经受相同的分离步骤,如通过重复阳性或阴性选择步骤。在一些实施方案中,单个分离步骤重复和/或进行多于一次,例如以增加阳性选择细胞的产率,以增加阴性选择细胞的纯度,和/或以进一步从阴性选择的级分去除阳性选择的细胞。在某些实施方案中,一个或多个分离步骤进行和/或重复两次、三次、四次、五次、六次、七次、八次、九次、十次或多于十次。在某些实施方案中,所述一个或多个选择步骤进行和/或重复一次与十次之间、一次与五次之间或三次与五次之间。在某些实施方案中,一个或多个选择步骤重复三次。
[0227]
例如,在一些方面,通过阳性或阴性选择技术来分离t细胞的特定亚群,如对一种或多种表面标记物呈阳性或表达高水平的所述表面标记物的细胞,例如cd28 、cd62l 、ccr7 、cd27 、cd127 、cd4 、cd8 、cd45ra 和/或cd45ro t细胞。在一些实施方案中,通过与特异性结合此类标记物的一种或多种抗体或结合配偶体一起孵育来选择此类细胞。在一些实施方案中,所述抗体或结合配偶体可以与固体支持物或基质(如磁珠或顺磁珠)缀合(如直接或间接地)以实现选择。例如,可以使用抗cd3/抗cd28缀合的磁珠(例如,m-450cd3/cd28 t细胞扩增器和/或珠粒)阳性选择cd3 、cd28 t细胞。
[0228]
在一些实施方案中,通过阴性选择在非t细胞(如b细胞、单核细胞或其他白细胞,如cd14)上表达的标记物,将t细胞与pbmc样品分离。在一些方面,cd4 或cd8 选择步骤用于分离cd4 辅助t细胞和cd8 细胞毒性t细胞。此类cd4 和cd8 群体可以通过针对在一种或多种幼稚t细胞、记忆t细胞和/或效应t细胞子群体上表达或表达至相对较高程度的标记物进行阳性或阴性选择来进一步分选为子群体。
[0229]
在一些实施方案中,如通过基于与相应亚群相关的表面抗原进行阳性或阴性选择,使cd8 t细胞针对幼稚、中枢记忆、效应子记忆和/或中枢记忆干细胞进一步富集或耗尽。在一些实施方案中,针对中枢记忆t(tcm)细胞进行富集以增加功效,如以改善给予后的长期存活、扩增和/或移植,这在一些方面在此类亚群中特别稳健。参见terakura等人,(2012)blood.1:72
–
82;wang等人(2012)j immunother.35(9):689-701。在一些实施方案中,组合富集tcm的cd8 t细胞与cd4 t细胞进一步增强功效。
[0230]
在实施方案中,记忆t细胞存在于cd8 外周血淋巴细胞的cd62l 和cd62l-两个子集中。可以例如使用抗cd8和抗cd62l抗体将pbmc针对cd62l-cd8 和/或cd62l cd8 级分进行富集或耗尽。
[0231]
在一些实施方案中,中枢记忆t(tcm)细胞的富集是基于cd45ro、cd62l、ccr7、cd28、cd3和/或cd 127的阳性或高表面表达;在一些方面,它是基于对表达或高度表达cd45ra和/或颗粒酶b的细胞的阴性选择。在一些方面,通过表达cd4、cd14、cd45ra的细胞的耗尽和表达cd62l的细胞的阳性选择或富集来进行富含tcm细胞的cd8 群体的分离。在一方面,中枢记忆t(tcm)细胞的富集从基于cd4表达所选择阴性细胞级分开始进行,所述阴性细胞级分经受基于cd14和cd45ra的表达的阴性选择以及基于cd62l的阳性选择。
[0232]
此类选择在一些方面是同时进行的,而在其他方面按任何顺序依序进行。在一些方面,用于制备cd8 t细胞群或亚群的相同的基于cd4表达的选择步骤也用于产生cd4 t细胞群或亚群,使得来自基于cd4的分离的阳性和阴性级分二者被保留并用于所述方法的后续步骤中,任选地在一个或多个其他阳性或阴性选择步骤之后。在一些实施方案中,对
cd4 t细胞群体的选择和对cd8 t细胞群体的选择同时进行。在一些实施方案中,以任一顺序依次进行cd4 t细胞群和cd8 t细胞群体的选择。在一些实施方案中,用于选择细胞的方法可以包括公开的美国申请号us20170037369中所述的那些。在一些实施方案中,可以在选择之后将经选择cd4 t细胞群和经选择cd8 t细胞群合并。在一些方面,可以将经选择cd4 t细胞群和经选择cd8 t细胞群在容器或袋(如生物反应器袋)中合并。在一些实施方案中,如根据所提供的方法,单独处理经选择cd4 t细胞群和经选择cd8 t细胞群,由此使经选择cd4 t细胞群富集cd4 t细胞并且将其与刺激试剂(例如抗cd3/抗cd28磁珠)一起孵育,用编码重组蛋白(例如car)的病毒载体转导并且在扩增t细胞的条件下培育;并且使经选择cd8 t细胞群富集cd8 t细胞并且将其与刺激试剂(例如抗cd3/抗cd28磁珠)一起孵育,用编码重组蛋白(例如car,即与用于工程化来自同一供体的cd4 t细胞相同的重组蛋白)的病毒载体转导,并且在扩增t细胞的条件下培育。
[0233]
在特定实施方案中,使生物样品(例如pbmc或其他白细胞的样品)经历cd4 t细胞的选择,其中同时保留阴性和阳性级分。在某些实施方案中,cd8 t细胞选自阴性级分。在一些实施方案中,使生物样品经历cd8 t细胞的选择,其中同时保留阴性和阳性级分。在某些实施方案中,cd4 t细胞选自阴性级分。
[0234]
在特定例子中,使pbmc样品或其他白细胞样品经历cd4 t细胞的选择,其中保留了阴性和阳性级分二者。然后阴性级分基于cd14和cd45ra或cd19的表达进行阴性选择,并基于中枢记忆t细胞(如cd62l或ccr7)的标记物特征进行阳性选择,其中按任何顺序进行阳性和阴性选择。
[0235]
通过鉴定具有细胞表面抗原的细胞群,可以将cd4 t辅助细胞分选为幼稚、中枢记忆和效应细胞。cd4 淋巴细胞可以通过标准方法获得。在一些实施方案中,幼稚cd4 t淋巴细胞是cd45ro-、cd45ra 、cd62l 或cd4 t细胞。在一些实施方案中,中枢记忆cd4 t细胞是cd62l 和cd45ro 。在一些实施方案中,效应cd4 t细胞是cd62l-和cd45ro-。
[0236]
在一个例子中,为了通过阴性选择富集cd4 t细胞,单克隆抗体混合剂通常包括针对cd14、cd20、cd11b、cd16、hla-dr和cd8的抗体。在一些实施方案中,抗体或结合配偶体结合至固体支持物或基质(如磁珠或顺磁珠),以允许分离细胞用于阳性和/或阴性选择。例如,在一些实施方案中,使用免疫磁性(或亲和磁性)分离技术来分开或分离细胞和细胞群(综述于以下文献中:methods in molecular medicine,第58卷:metastasis research protocols,第2卷:cell behavior in vitro and in vivo,第17-25页s.a.brooks和u.schumacher编辑humana press inc.,totowa,nj)。
[0237]
在一些方面,将待分离的所孵育的细胞样品或组合物与含有小的可磁化或磁响应材料(如磁响应颗粒或微粒,如顺磁珠(例如dynabeads或珠粒))的选择试剂一起孵育。磁响应材料(例如,颗粒)通常直接或间接地附着于结合配偶体(例如,抗体),所述结合配偶体与希望分离(例如,希望阴性地或阳性地选择)的一个细胞、多个细胞或细胞群上存在的分子(例如,表面标记物)特异性结合。
[0238]
在一些实施方案中,磁性颗粒或珠粒包含与特异性结合成员(如抗体或其他结合配偶体)结合的磁响应材料。用于磁分离方法中的许多熟知的磁响应材料是已知的,例如molday,美国专利号4,452,773和欧洲专利说明书ep 452342b中所述的那些,将所述专利通过引用特此并入。胶体大小的颗粒(例如在owen美国专利号4,795,698;和liberti等人的美
国专利号5,200,084中所述的那些。
[0239]
孵育通常在如下条件下进行,由此抗体或结合配偶体或者与附着于磁性颗粒或珠粒的此类抗体或结合配偶体特异性结合的分子(如二抗或其他试剂)与细胞表面分子(如果存在于所述样品内的细胞上的话)特异性结合。
[0240]
在某些实施方案中,磁响应颗粒被包被在一抗或其他结合配偶体、二抗、凝集素、酶或链霉亲和素中。在某些实施方案中,磁性颗粒通过对一种或多种标记物具有特异性的一抗的包被而附着于细胞。在某些实施方案中,用一抗或结合配偶体标记细胞而不是珠粒,然后添加细胞类型特异性二抗或其他结合配偶体(例如,链霉亲和素)包被的磁性颗粒。在某些实施方案中,链霉亲和素包被的磁粒是与生物素化的一抗或二抗结合使用。
[0241]
在一些方面,在其中将样品置于磁场中的过程中实现分离,并且具有附着至其上的磁响应或可磁化颗粒的那些细胞将被吸引至磁体并与未标记的细胞分离。对于阳性选择,保留被磁铁吸引的细胞;对于阴性选择,保留未被吸引的细胞(未标记的细胞)。在一些方面,在同一选择步骤期间进行阳性和阴性选择的组合,其中保留阳性和阴性级分并进一步处理或经历另外的分离步骤。
[0242]
在一些实施方案中,基于亲和力的选择是经由磁激活细胞分选(macs)(miltenyi biotec,加利福尼亚州奥本)进行的。磁激活细胞分选(macs)(例如,clinimacs系统)能够对具有附着于其上的磁化颗粒的细胞进行高纯度选择。在某些实施方案中,macs以如下模式操作,其中在施加外部磁场之后依序洗脱非靶标和靶标种类。也就是说,附着于磁化颗粒的细胞保持在适当的位置,而未附着的种类被洗脱。然后,在完成第一次洗脱步骤之后,以某种方式释放被捕获在磁场中并被阻止洗脱的种类,使得它们可以被洗脱和回收。在某些实施方案中,非靶细胞被标记并从异质细胞群中耗尽。
[0243]
在一些实施方案中,磁响应颗粒保持附着于细胞,所述细胞随后被孵育,培养和/或工程化;在一些方面,颗粒保持附着于细胞以用于施用至患者。在一些实施方案中,从细胞中去除可磁化或磁响应颗粒。用于从细胞中去除可磁化颗粒的方法是已知的,并且包括例如使用竞争性非标记抗体、与可切割接头缀合的可磁化颗粒或抗体等。在一些实施方案中,可磁化颗粒是可生物降解的。b.细胞的激活和刺激
[0244]
在一些实施方案中,所述一个或多个处理步骤包括刺激分离的细胞(如选择的细胞群体)的步骤。孵育可以在基因工程化之前或与基因工程化(如来源于上述转导方法的实施方案的基因工程化)结合。在一些实施方案中,所述刺激导致例如在转导之前细胞的激活和/或增殖。
[0245]
在一些实施方案中,处理步骤包括孵育细胞(如选择的细胞),其中孵育步骤可以包括细胞的培养、培育、刺激、激活和/或繁殖。在一些实施方案中,在存在刺激条件或刺激剂的情况下孵育组合物或细胞。此类条件包括针对以下而设计的那些条件:诱导群体中的细胞的增殖、激活和/或存活,模拟抗原暴露,和/或引发细胞用于基因工程化(如用于引入重组抗原受体)。
[0246]
在一些实施方案中,用于刺激和/或激活的条件可以包括以下中的一种或多种:特定介质、温度、氧含量、二氧化碳含量、时间、药剂(例如,营养素、氨基酸、抗生素、离子和/或刺激因子(如细胞因子、趋化因子、抗原、结合配偶体、融合蛋白、重组可溶性受体和任何其
他被设计用于激活细胞的药剂))。
[0247]
在一些实施方案中,刺激条件或刺激剂包括能够刺激或激活tcr复合物的细胞内信号传导结构域的一种或多种药剂(例如,配体)。在一些方面,药剂在t细胞中开启或启动tcr/cd3细胞内信号传导级联。此类药剂可以包括适合于递送初级信号,例如以启动itam诱导的信号的激活的药剂,如抗体,如对tcr具有特异性的那些,例如抗cd3。在一些实施方案中,刺激条件包括能够刺激共刺激受体的一种或多种药剂(例如配体),例如抗cd28或抗4-1bb。在一些实施方案中,此类药剂和/或配体可以与固体支持物(如珠粒)和/或一种或多种细胞因子结合。所述刺激剂包括抗cd3/抗cd28珠粒(例如,m-450cd3/cd28 t细胞扩增剂和/或珠粒)。任选地,扩增方法还可以包括向培养基中(例如,以至少约0.5ng/ml的浓度)添加抗cd3和/或抗cd28抗体的步骤。在一些实施方案中,所述刺激剂包括il-2、il-7和/或il-15,例如,il-2浓度为至少约10单位/ml、至少约50单位/ml、至少约100单位/ml或至少约200单位/ml。
[0248]
所述条件可以包括以下中的一种或多种:特定培养基、温度、氧含量、二氧化碳含量、时间、药剂(例如,营养素、氨基酸、抗生素、离子和/或刺激因子(如细胞因子、趋化因子、抗原、结合配偶体、融合蛋白、重组可溶受体和设计为激活细胞的任何其他药剂))。
[0249]
在一些方面,孵育是根据多种技术,如以下文献中所述的那些技术来进行:授予riddell等人的美国专利号6,040,177;klebanoff等人(2012)j immunother.35(9):651
–
660,terakura等人(2012)blood.1:72
–
82和/或wang等人(2012)j immunother.35(9):689-701。
[0250]
在一些实施方案中,在一种或多种刺激条件或刺激剂存在下进行的孵育的至少一部分是在离心室的内部空腔中进行,例如在离心旋转下进行,如国际公开号wo2016/073602中所述的。在一些实施方案中,在离心室中进行的孵育的至少一部分包括与一种或多种试剂混合以诱导刺激和/或激活。在一些实施方案中,将细胞(如选择的细胞)与刺激条件或刺激剂在离心室中混合。在此类过程的一些方面,将一定体积的细胞与一定量的一种或多种刺激条件或刺激剂混合,所述量远小于在细胞培养板或其他系统中进行类似刺激时通常使用的量。
[0251]
在一些实施方案中,将所述刺激剂以一定的量添加至室空腔中的细胞,所述一定的量与例如在周期性振荡或旋转的管或袋中进行选择而不在离心室中混合时,对相同细胞数量或相同细胞体积实现大致相同或类似的选择效率通常使用或将需要的刺激剂的量相比显著较小(例如不大于所述量的5%、10%、20%、30%、40%、50%、60%、70%或80%)。在一些实施方案中,在向细胞和刺激剂中添加孵育缓冲液的情况下进行孵育,以实现孵育例如约10ml至约200ml或约20ml至约125ml(如至少或至少约或约10ml、20ml、30ml、40ml、50ml、60ml、70ml、80ml、90ml、100ml、105ml、110ml、115ml、120ml、125ml、130ml、135ml、140ml、145ml、150ml、160ml、170ml、180ml、190ml、或200ml)试剂的目标体积。在一些实施方案中,在添加细胞之前预先混合孵育缓冲液和刺激剂。在一些实施方案中,将所述孵育缓冲液和刺激剂单独添加至所述细胞中。在一些实施方案中,在周期性温和混合条件下进行刺激孵育,这可能有助于促进能量上有利的相互作用,并且从而允许在实现细胞的刺激和激活的同时使用较少的总体刺激剂。
[0252]
在一些实施方案中,所述孵育通常在混合条件下进行,如在旋转存在下进行,通常
以相对低的力或速度旋转,如速度低于用于使细胞沉淀的速度,如从600rpm至1700rpm或从约600rpm至约1700rpm(例如,为或约或至少600rpm、1000rpm或1500rpm或1700rpm),如在室或其他容器的样品或壁处的一定rcf下,所述rcf是从80g至100g或从约80g至约100g(例如,为或约或至少80g、85g、90g、95g或100g)。在一些实施方案中,所述旋转是使用以这种低速旋转和之后的休息时间段的重复间隔来进行,例如旋转和/或休息1、2、3、4、5、6、7、8、9或10秒,例如旋转大约1或2秒,然后休息大约5、6、7或8秒。
[0253]
在一些实施方案中,例如与刺激剂一起孵育的总持续时间在或在约1小时与96小时之间、1小时与72小时之间、1小时与48小时之间、4小时与36小时之间、8小时与30小时之间、18小时与30小时之间、或12小时与24小时之间,如为至少或为至少约或为约6小时、12小时、18小时、24小时、36小时或72小时。在一些实施方案中,进一步孵育进行如下时间:在或约在1小时与48小时之间、4小时与36小时之间、8小时与30小时之间或12小时与24小时之间并包含端值。c.基因工程化
[0254]
在一些实施方案中,处理步骤包括引入编码重组蛋白的核酸分子。此类重组蛋白包括重组受体,如第iii节所述的任何一种。将编码重组蛋白(如重组受体)的核酸分子引入细胞中可以使用许多已知载体中的任何一种进行。此类载体包括病毒和非病毒系统,包括慢病毒和γ逆转录病毒系统,以及基于转座子的系统,如基于piggybac或sleeping beauty的基因转移系统。示例性方法包括用于转移编码受体的核酸的那些,包括通过病毒(如逆转录病毒或慢病毒)、转导、转座子和电穿孔来进行。
[0255]
在某些实施方案中,当包括培育和/或扩增作为制造步骤时,在例如在促进增殖和/或扩增的条件下培育细胞之前,对细胞的组合物进行工程化,例如转导或转染。在一些实施方案中,如通过转化或转导将所述细胞基因工程化发生在孵育所述细胞(例如在第ii-c-3节所述)之前。在特定实施方案中,在已经在刺激条件下刺激、激活和/或孵育组合物之后,对细胞的组合物进行工程化。在特定实施方案中,所述组合物是经刺激组合物。在特定实施方案中,刺激的组合物已经预先低温保存和储存,并在工程化之前解冻。
[0256]
在一些实施方案中,通过以下方式完成基因转移:首先刺激所述细胞,如通过将其与诱导应答(如增殖、存活和/或激活,例如如通过细胞因子或激活标记物的表达所测量的)的刺激物进行组合,然后转导激活的细胞,并且在培养中扩增至足以用于临床应用的数量。
[0257]
在一些实施方案中,使用重组感染性病毒颗粒(如例如源自猿猴病毒40(sv40)、腺病毒、腺相关病毒(aav)的载体和人免疫缺陷病毒(hiv))将重组核酸转移至细胞中。
[0258]
在一些实施方案中,经由电穿孔将重组核酸转移到t细胞中(参见例如,chicaybam等人,(2013)plos one 8(3):e60298和van tedeloo等人(2000)gene therapy7(16):1431-1437)。在一些实施方案中,经由转座将重组核酸转移到t细胞中(参见例如,manuri等人(2010)hum gene ther 21(4):427-437;sharma等人(2013)molec ther nucl acids 2,e74;以及huang等人(2009)methods mol biol 506:115-126)。在免疫细胞中引入和表达遗传物质的其他方法包括磷酸钙转染(例如,如在current protocols in molecular biology,john wiley&sons,new york.n.y.中所述)、原生质体融合、阳离子脂质体介导的转染;钨粒子促进的微粒轰击(johnston,nature,346:776-777(1990));以及磷酸锶dna共沉淀(brash等人,mol.cell biol.,7:2031-2034(1987))。
[0259]
用于转移编码重组产物的核酸的其他方法和载体是例如在国际专利申请公开号wo 2014055668和美国专利号7,446,190中所述的那些。
[0260]
在一些实施方案中,可以在扩增期间或之后例如用t细胞受体(tcr)或嵌合抗原受体(car)对细胞(例如,t细胞)进行转染。例如,用于引入所需受体的基因的该转染可以用任何合适的逆转录病毒载体进行。然后可以使遗传修饰的细胞群摆脱初始刺激物(例如cd3/cd28刺激物),并且随后用第二种类型的刺激物(例如经由从头引入的受体)进行刺激。这第二种类型的刺激物可以包括呈肽/mhc分子形式的抗原刺激物、基因引入的受体的同源(交联)配体(例如,car的天然配体)或在新受体的框架内直接结合(例如,通过识别受体内的恒定区)的任何配体(如抗体)。参见例如,cheadle等人,“chimeric antigen receptors for t-cell based therapy”methods mol biol.2012;907:645-66或barrett等人,chimeric antigen receptor therapy for cancer annual review of medicine第65卷:333-347(2014)。
[0261]
在一些情况下,可以使用不需要激活细胞(例如,t细胞)的载体。在一些此类情况下,可以在激活之前选择和/或转导细胞。因此,可以在培养细胞之前或之后将细胞工程化,并且在一些情况下在所述培养的至少一部分的同时或期间将所述细胞工程化。
[0262]
在一些方面,对细胞进一步工程化以促进细胞因子或其他因子的表达。另外的核酸(例如,用于引入的基因)包括:用于改善治疗功效的那些,如通过促进所转移细胞的活力和/或功能;用来提供用于选择和/或评价细胞(如用于评估体内存活或定位)的遗传标记物的基因;用于改善安全性的基因,例如通过使细胞对体内阴性选择易感,如以下文献中所述:lupton s.d.等人,mol.and cell biol.,11:6(1991);和riddell等人,human gene therapy 3:319-338(1992);还参见lupton等人的pct/us91/08442和pct/us94/05601的公开案,所述公开案描述了使用通过将显性的阳性选择标记物与阴性选择标记物融合而获得的双功能选择融合基因。参见例如riddell等人,美国专利号6,040,177,第14-17栏。
[0263]
在一些实施方案中,所述引入是通过使组合物的一个或多个细胞与编码重组蛋白(例如,重组受体)的核酸分子接触来进行。在一些实施方案中,所述接触可以通过离心如旋转接种(例如离心接种)来实现。此类方法包括如国际公开号wo 2016/073602中所述的那些方法中的任一种。示例性离心室包括由biosafe sa生产和销售的那些,包括用于和2系统的那些,包括a-200/f和a-200离心室以及用于此类系统的各种试剂盒。示例性室、系统和处理仪器和机柜描述于例如以下文献中:美国专利号6,123,655、美国专利号6,733,433和公开的美国专利申请公开号us 2008/0171951,以及公开的国际专利申请公开号wo 00/38762,将其各自的内容通过引用以其全文并入本文。用于此类系统的示例性试剂盒包括但不限于由biosafe sa以产品名cs-430.1、cs-490.1、cs-600.1或cs-900.2销售的一次性试剂盒。
[0264]
在一些实施方案中,将系统与其他仪器一起包括和/或置于与其他仪器相关联,所述其他仪器包括用于操作、自动化、控制和/或监测转导步骤以及在系统中进行的一个或多个各种其他处理步骤(例如,可以使用或结合如本文或在国际公开号wo 2016/073602中所述的离心室系统进行的一个或多个处理步骤)的方面的仪器。在一些实施方案中,这种仪器容纳于机柜中。在一些实施方案中,所述仪器包括机柜,所述机柜包括外壳,所述外壳含有控制电路、离心机、罩、电机、泵、传感器、显示器和用户界面。示例性装置描述于美国专利号
6,123,655、美国专利号6,733,433和us 2008/0171951中。
[0265]
在一些实施方案中,所述系统包含一系列容器,例如袋、管路、旋塞、夹子、连接器和离心室。在一些实施方案中,所述容器(如袋子)包括一个或多个容器(例如袋子),其在同一容器或单独容器(例如同一袋子或单独袋子)中含有要转导的细胞和病毒载体颗粒。在一些实施方案中,所述系统进一步包括一个或多个容器(如袋),所述容器含有介质,例如稀释剂和/或洗涤溶液,在所述方法期间将所述介质抽入室和/或其他部件中以稀释、重悬和/或洗涤组分和/或组合物。所述容器可以连接在系统中的一个或多个位置,例如连接在对应于输入管线、稀释剂管线、洗涤管线、废液管线和/或输出管线的位置。
[0266]
在一些实施方案中,所述室与离心机相关联,离心机能够实现所述室的旋转,例如围绕其旋转轴旋转。可以在与细胞转导结合的孵育之前、期间和/或之后和/或在一个或多个其他处理步骤中,进行旋转。因此,在一些实施方案中,多个处理步骤中的一个或多个在旋转下(例如在特定力下)进行。所述室通常能够垂直或大致垂直地旋转,使得所述室在离心期间垂直放置,并且侧壁和轴是垂直或大致垂直的,且一个或多个端壁是水平或大致水平的。
[0267]
在一些实施方案中,可以使含有细胞、病毒颗粒和试剂的组合物旋转,通常以相对较低的力或速度旋转,如速度低于用于沉淀细胞的速度,如从600rpm至1700rpm或从约600rpm至约1700rpm(例如,为或为约或至少600rpm、1000rpm或1500rpm或1700rpm)。在一些实施方案中,旋转是以从100g至3200g或从约100g至约3200g(例如为或约或至少或至少约100g、200g、300g、400g、500g、1000g、1500g、2000g、2500g、3000g或3200g)的力(例如,相对离心力)来进行,所述力如例如在室或空腔的内壁或外壁处所测量。术语“相对离心力”或rcf通常被理解为在如与旋转轴相比在空间的特定点处,相对于地球的重力,施加在物体或物质(例如细胞、样品或团粒和/或所旋转的室或其他容器中的点)上的有效力。所述值可以使用熟知的公式来确定,所述公式考虑到重力、旋转速度和旋转半径(与旋转轴的距离以及测量rcf的物体、物质或颗粒)。
[0268]
在一些实施方案中,在基因工程化(例如转导)的至少一部分期间,和/或在基因工程化之后,将细胞转移到容器(如袋,例如生物反应器袋组件)中,以用于培养经基因工程化的细胞,如用于培育或扩增细胞,如上所述。在一些实施方案中,用于培育或扩增细胞的容器是生物反应器袋,如灌注袋。1.载体和方法
[0269]
在一些实施方案中,处理步骤包括将编码重组蛋白的核酸分子引入细胞中,并且可以使用许多已知载体中的任何一种进行。在一些实施方案中,载体含有编码重组受体的核酸。在特定实施方案中,载体是病毒载体、非病毒载体。在一些情况下,载体是病毒载体,如逆转录病毒载体,例如慢病毒载体或γ逆转录病毒载体。
[0270]
在一些情况下,编码重组受体(例如,嵌合抗原受体(car))的核酸序列含有编码信号肽的信号序列。信号肽的非限制性示例性例子包括,例如,gmcsfrα链信号肽、cd8α信号肽或cd33信号肽。
[0271]
在一些实施方案中,所述载体包括病毒载体,例如逆转录病毒或慢病毒、非病毒载体或转座子,例如睡美人转座子系统;源自猿猴病毒40(sv40)、腺病毒、腺相关病毒(aav)的载体;慢病毒载体或逆转录病毒载体,如γ-逆转录病毒载体,源自莫洛尼(moloney)鼠白血
1)、hiv-2、猿猴免疫缺陷病毒(siv)、人嗜t淋巴细胞病毒1(htlv-1)、htlv-2或马感染贫血病毒(e1av)。例如,已经通过多次减弱hiv毒力基因生成慢病毒载体,例如,使基因env、vif、vpr、vpu和nef缺失,使得载体对于治疗目的更安全。慢病毒载体是本领域已知的,参见naldini等人,(1996和1998);zufferey等人,(1997);dull等人,1998,美国专利号6,013,516;以及5,994,136)。在一些实施方案中,这些病毒载体是基于质粒的或基于病毒的,并且被配置为携带用于掺入外来核酸的基本序列,用于选择和用于将核酸转移到宿主细胞中。已知的慢病毒可以容易地从保管机构或保藏中心例如美国典型培养物保藏中心(“atcc”;10801university blvd.,马纳萨斯,维吉尼亚州20110-2209)获得,或使用常用技术从已知来源分离。
[0279]
所述病毒载体基因组通常以质粒形式构建,其可以转染到包装细胞系或生产细胞系中。在任何此类例子中,将编码重组蛋白(如重组受体)的核酸插入或定位在病毒载体的区域中,例如通常在病毒基因组的非必需区域中。在一些实施方案中,将核酸插入病毒基因组的某些病毒序列的位置中以产生具有复制缺陷的病毒。
[0280]
可以使用多种已知方法中的任何一种来产生逆转录病毒颗粒,其基因组含有病毒载体基因组的rna拷贝。在一些实施方案中,至少两种组分参与制备基于病毒的基因递送系统:第一,包装质粒,包括结构蛋白以及产生病毒载体颗粒所必需的酶,第二,病毒载体本身,即,要转移的遗传物质。可以在设计这些组分之一或两者时引入生物安全保护措施。
[0281]
在一些实施方案中,包装质粒可以含有除了包膜蛋白以外的所有逆转录病毒(如hiv-1)蛋白(naldini等人,1998)。在其他实施方案中,病毒载体可能缺少另外的病毒基因(例如与毒力有关的那些,例如vpr、vif、vpu和nef和/或tat(hiv的主要反式激活因子))。在一些实施方案中,慢病毒载体(例如基于hiv的慢病毒载体)仅包含三种亲本病毒的基因:gag、pol和rev,这减少或消除了野生型病毒通过重组而重构的可能性。
[0282]
在一些实施方案中,将病毒载体基因组引入包装细胞系中,所述细胞系含有将从病毒载体基因组转录的病毒基因组rna包装至病毒颗粒中所需的所有组分。可替代地,除了所述一种或多种目的序列(例如重组核酸)以外,病毒载体基因组可包含一种或多种编码病毒组分的基因。然而,在一些方面,为了防止基因组在靶细胞中复制,将复制所需的内源病毒基因去除,并且在包装细胞系中单独提供。
[0283]
在一些实施方案中,用含有产生颗粒所必需的组分的一种或多种质粒载体转染包装细胞系。在一些实施方案中,用含有病毒载体基因组(包括ltr、顺式作用包装序列和目的序列,即编码抗原受体(例如car)的核酸)的质粒;以及编码病毒酶和/或结构组分(例如gag、pol和/或rev)的一种或多种辅助质粒转染包装细胞系。在一些实施方案中,利用多个载体分离产生逆转录病毒载体颗粒的各种遗传组分。在一些此类实施方案中,向包装细胞提供单独的载体减少了原本可能生成有复制能力的病毒的重组事件的机会。在一些实施方案中,可以使用具有所有逆转录病毒组分的单个质粒载体。
[0284]
在一些实施方案中,将逆转录病毒载体颗粒(例如慢病毒载体颗粒)假型化以增加宿主细胞的转导效率。例如,在一些实施方案中,将逆转录病毒载体颗粒(例如慢病毒载体颗粒)用vsv-g糖蛋白假型化,其提供宽细胞宿主范围,从而扩展可以转导的细胞类型。在一些实施方案中,用编码非天然包膜糖蛋白的质粒或多核苷酸转染包装细胞系,以例如包括嗜异性、多嗜性或双嗜性包膜,如辛德比斯病毒包膜、galv或vsv-g。
[0285]
在一些实施方案中,包装细胞系提供将病毒基因组rna包装至慢病毒载体颗粒中反式作用所需的组分,包括病毒调节蛋白和结构蛋白。在一些实施方案中,包装细胞系可以是能够表达慢病毒蛋白并产生功能性慢病毒载体颗粒的任何细胞系。在一些方面,合适的包装细胞系包括293(atcc ccl x)、293t、hela(atcc ccl 2)、d17(atcc ccl 183)、mdck(atcc ccl 34)、bhk(atcc ccl-10)和cf2th(atcc crl 1430)细胞。
[0286]
在一些实施方案中,包装细胞系稳定地表达一种或多种病毒蛋白质。例如,在一些方面,可以构建含有gag、pol、rev和/或其他结构基因但没有ltr和包装组分的包装细胞系。在一些实施方案中,可以用编码一种或多种病毒蛋白的核酸分子以及含有编码异源蛋白的核酸分子的病毒载体基因组和/或编码包膜糖蛋白的核酸对包装细胞系进行瞬时转染。
[0287]
在一些实施方案中,将病毒载体和包装质粒和/或辅助质粒通过转染或感染引入包装细胞系中。包装细胞系产生含有病毒载体基因组的病毒载体颗粒。用于转染或感染的方法是众所周知的。非限制性例子包括磷酸钙、deae-葡聚糖和脂质转染方法、电穿孔和显微注射。
[0288]
在将重组质粒和逆转录病毒ltr和包装序列引入特殊细胞系(例如,通过磷酸钙沉淀)中时,包装序列可以允许要包装至病毒颗粒中的重组质粒的rna转录,然后所述病毒颗粒可能会被分泌到培养基中。在一些实施方案中,随后收集含有重组逆转录病毒的培养基,任选地将其浓缩,并用于基因转移。例如,在一些方面,在将包装质粒和转移载体共转染至包装细胞系后,从培养基回收病毒载体粒子,并通过本领域技术人员使用的标准方法进行滴定。
[0289]
在一些实施方案中,可以通过引入质粒以允许产生慢病毒颗粒,而在包装细胞系(例如示例性hek 293t细胞系)中产生逆转录病毒载体,例如慢病毒载体。在一些实施方案中,包装细胞被转染和/或含有编码gag和pol的多核苷酸,以及编码重组受体(例如抗原受体,例如car)的多核苷酸。在一些实施方案中,包装细胞系被任选地和/或另外用编码rev蛋白的多核苷酸转染和/或含有所述多核苷酸。在一些实施方案中,包装细胞系被任选地和/或另外用编码非天然包膜糖蛋白(例如vsv-g)的多核苷酸转染和/或含有所述多核苷酸。在一些此类实施方案中,在转染细胞(例如hek 293t细胞)后大约两天,细胞上清液含有可以回收并滴定的重组慢病毒载体。
[0290]
所回收和/或产生的逆转录病毒载体颗粒可以用于使用如所述的方法转导靶细胞。一旦进入靶细胞中,病毒rna就被逆转录,进入细胞核中并稳定整合到宿主基因组中。在病毒rna整合后一天或两天,可以检测到重组蛋白(例如抗原受体,例如car)的表达。3.孵育细胞
[0291]
在一些实施方案中,将已经工程化(例如转导或转染)的细胞的组合物孵育。在一些实施方案中,所述孵育是在高于室温的温度下实现的,所述温度为例如高于或高于约25℃,例如通常高于或高于约32℃、35℃或37℃。在一些实施方案中,所述孵育是在或在约37℃
±
2℃的温度下,例如在或在约37℃的温度下实现的。在一些实施方案中,所述孵育的持续时间在或约在12小时与96小时之间,如至少或至少约12小时、24小时、36小时、48小时、72小时或96小时。
[0292]
在一些实施方案中,所述孵育发生在封闭系统中。在一些实施方案中,所述孵育在为或约37℃
±
2℃的温度下发生,持续时间在或约在1小时与48小时之间、4小时与36小时之
间、8小时与30小时之间或12小时与24小时之间,包含端值。在某些实施方案中,所述孵育的总持续时间为、为约或为至少12小时、18小时、24小时、30小时、36小时、42小时、48小时、54小时、60小时、72小时、84小时、96小时、108小时或120小时。在某些实施方案中,所述孵育的总持续时间为、为约或为至少一天、2天、3天、4天、或5天。在特定实施方案中,所述孵育在以下时间、在约以下时间或在以下时间内完成:120小时、108小时、96小时、84小时、72小时、60小时、54小时、48小时、42小时、36小时、30小时、24小时、18小时、或12小时。在特定实施方案中,所述孵育在以下时间、在约以下时间或在以下时间内完成:一天、2天、3天、4天、或5天。在一些实施方案中,所述孵育的总持续时间在或在约12小时与120小时之间、18小时与96小时之间、24小时与72小时之间、或24小时与48小时之间,包含端值。在一些实施方案中,所述孵育的总持续时间在或约在1小时与48小时之间、4小时与36小时之间、8小时与30小时之间或12小时与24小时之间,包含端值。在特定实施方案中,所述孵育分别进行或进行约24小时、48小时或72小时,或者进行或进行约1天、2天或3天。在特定实施方案中,所述孵育进行24小时
±
6小时、48小时
±
6小时或72小时
±
6小时。在特定实施方案中,所述孵育进行或进行约72小时或者进行或进行约3天。d.细胞的培育和/或扩增
[0293]
在一些实施方案中,在基因工程化(例如通过转导或转染将重组多肽引入细胞)的步骤后在促进增殖和/或扩增的条件下培育工程化细胞。在特定实施方案中,在刺激条件下孵育细胞并用重组多核苷酸(例如编码重组受体的多核苷酸)转导或转染细胞之后培育细胞。在一些实施方案中,所述培育产生一种或多种富集t细胞的培育组合物。在一些实施方案中,此类条件可以经设计以诱导群体中的细胞的增殖、扩增、激活和/或存活。在特定实施方案中,刺激条件可以包括以下中的一种或多种:特定培养基、温度、氧含量、二氧化碳含量、时间、药剂(例如,营养素、氨基酸、抗生素、离子和/或刺激因子(如细胞因子、趋化因子、抗原、结合配偶体、融合蛋白、重组可溶性受体和任何其他被设计成促进细胞的生长、分裂和/或扩增的药剂))。
[0294]
在一些实施方案中,将所述工程化细胞在容器中培养,所述容器可以例如经由补料端口填充细胞培养基和/或细胞以用于培养所添加细胞。所述细胞可以来自需要培养细胞(例如,用于扩增和/或增殖细胞)的任何细胞来源。
[0295]
在一些方面,所述培养基是支持细胞(如t细胞)的生长、培育、扩增或增殖的适应性培养基。在一些方面,培养基可以是含有盐、氨基酸、维生素、糖或其任何组合的混合物的液体。在一些实施方案中,所述培养基还含有一种或多种刺激条件或刺激剂,例如在孵育期间刺激细胞的培育、扩增或增殖。在一些实施方案中,刺激条件是或包括如选自il-2、il-7或il-15的一种或多种细胞因子。在一些实施方案中,细胞因子是重组细胞因子。在特定实施方案中,所述一种或多种细胞因子是人重组细胞因子。在某些实施方案中,所述一种或多种细胞因子结合和/或能够结合由t细胞表达的和/或对t细胞而言内源的受体。在特定实施方案中,所述一种或多种细胞因子是或包括细胞因子的4-α-螺旋束家族的成员。在一些实施方案中,细胞因子的4-α-螺旋束家族的成员包括但不限于白介素2(il-2)、白介素4(il-4)、白介素7(il-7)、白介素9(il-9)、白介素12(il-12)、白介素15(il-15)、粒细胞集落刺激因子(g-csf)和粒细胞巨噬细胞集落刺激因子(gm-csf)。在一些实施方案中,所述一种或多种细胞因子是或包括il-15。在特定实施方案中,所述一种或多种细胞因子是或包括il-7。
在特定实施方案中,所述一种或多种细胞因子是或包括重组il-2。
[0296]
在一些实施方案中,在培养或孵育期间在培养基中的一种或多种细胞因子的浓度独立地是从为或约1iu/ml至1500iu/ml,例如从为或约1iu/ml至100iu/ml、2iu/ml至50iu/ml、5iu/ml至10iu/ml、10iu/ml至500iu/ml、50iu/ml至250iu/ml或100iu/ml至200iu/ml、50iu/ml至1500iu/ml、100iu/ml至1000iu/ml或200iu/ml至600iu/ml。在一些实施方案中,所述一种或多种细胞因子的浓度独立地为至少或至少约1iu/ml、5iu/ml、10iu/ml、50iu/ml、100iu/ml、200iu/ml、500iu/ml、1000iu/ml或1500iu/ml。
[0297]
在一些方面,在转移工程化细胞和培养基之后,将细胞孵育至少一部分时间。在一些实施方案中,所述刺激条件通常包括适合于初级免疫细胞如人t淋巴细胞生长的温度,例如至少约25摄氏度,通常至少约30摄氏度,并且通常为或约37摄氏度。在一些实施方案中,在25℃至38℃(如30℃至37℃,例如为或约37℃
±
2℃)的温度下孵育富集的t细胞的组合物。在一些实施方案中,将孵育进行一段时间直至培养(例如培育或扩增)产生所需或阈值密度、浓度、数量或剂量的细胞。在一些实施方案中,将孵育进行一段时间直至培养(例如培育或扩增)产生所需或阈值密度、浓度、数量或剂量的活细胞。在一些实施方案中,所述孵育是大于或大于约或持续约或24小时、48小时、72小时、96小时、5天、6天、7天、8天、9天或更长时间。
[0298]
在一些实施方案中,在维持细胞培养中目标量的二氧化碳的条件下孵育细胞。在一些方面,这确保了细胞在生长期间的最佳培育、扩增和增殖。在一些方面,二氧化碳(co2)的量在所述气体的10%与0%(v/v)之间,如在所述气体的8%与2%(v/v)之间,例如,为或约5%(v/v)co2的量。
[0299]
在特定实施方案中,在封闭系统中进行培育。在某些实施方案中,在无菌条件下在封闭系统中进行培育。在特定实施方案中,在与所提供系统的一个或多个步骤相同的封闭系统中进行培育。在一些实施方案中,将富集的t细胞的组合物从封闭系统中去除并且置于用于培育的生物反应器中和/或与其连接。合适的用于培育的生物反应器的例子包括但不限于ge xuri w25、ge xuri w5、sartorius biostat rm 20|50、finesse smartrocker生物反应器系统和pall xrs生物反应器系统。在一些实施方案中,在培育步骤的至少一部分期间,使用生物反应器灌注和/或混合细胞。
[0300]
在一些实施方案中,在密闭的、连接的生物反应器中和/或在生物反应器的控制下培育的细胞在培育期间比没有生物反应器的情况下培育的细胞(例如在静态条件下(例如在没有混合、摇摆、运动和/或灌注的情况下)培育的细胞)经历更快的扩增。在一些实施方案中,在封闭、连接和/或在生物反应器的控制下的同时培育的细胞在14天、10天、9天、8天、7天、6天、5天、4天、3天、2天、60小时、48小时、36小时、24小时或12小时内达到或实现阈值扩增、细胞计数和/或密度。在一些实施方案中,在封闭、连接的生物反应器中和/或在生物反应器的控制下培育的细胞达到或实现的阈值扩增、细胞计数和/或密度是在示例性和/或替代性过程(其中细胞未在封闭、连接的生物反应器中和/或在生物反应器的控制下培育)中培育的细胞的至少50%、至少60%、至少70%、至少80%、至少90%、至少95%、至少100%、至少150%、至少1倍、至少2倍、至少3倍、至少4倍、至少5倍。
[0301]
在一些实施方案中,混合是或包括摇摆和/或运动。在一些实施方案中,使用与生物反应器结合使用的容器(例如,袋子)孵育细胞。在一些情况下,生物反应器可以经历运动
或摇摆,其在一些方面可以增加氧气传递。使生物反应器运动可以包括但不限于沿着水平轴线旋转、沿着竖直轴线旋转、沿着生物反应器的倾斜(tilted或inclined)的水平轴线的摇摆运动、或其任何组合。在一些实施方案中,在摇摆的情况下进行孵育的至少一部分。可以调整摇摆速度和摇摆角度以实现所需的搅动。在一些实施方案中,所述摇摆角度为或为约20
°
、19
°
、18
°
、17
°
、16
°
、15
°
、14
°
、13
°
、12
°
、11
°
、10
°
、9
°
、8
°
、7
°
、6
°
、5
°
、4
°
、3
°
、2
°
或1
°
。在某些实施方案中,所述摇摆角度在6-16
°
之间。在其他实施方案中,所述摇摆角度在7-16
°
之间。在其他实施方案中,所述摇摆角度在8-12
°
之间。在一些实施方案中,所述摇摆速率为1、2、3、4、5、6、7、8、9、10、11、1 12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40rpm。在一些实施方案中,所述摇摆速率在4rpm与12rpm之间,例如在4rpm与6rpm之间并包含端值。在摇摆运动下进行细胞培养扩增的至少一部分,如以在5
°
与10
°
之间(如6
°
)的角度,以恒定摇摆速度(如在5rpm与15rpm之间,如6rmp或10rpm的速度)摇摆。
[0302]
在一些实施方案中,将包含细胞(如工程化t细胞,例如工程化cd4 t细胞或工程化cd8 t细胞)的组合物在表面活性剂的存在下进行培育。在特定实施方案中,培育组合物的细胞减少了例如由于混合、摇摆、运动和/或灌注而在培育过程中可能发生的剪切应力的量。在特定实施方案中,用表面活性剂培育所述细胞,如工程化t细胞(例如工程化cd4 t细胞或工程化cd8 t细胞)的组合物,并且培育期间或在培育完成后至少1天、2天、3天、4天、5天、6天、7天或超过7天,至少50%、至少60%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少99%或至少99.9%的t细胞存活,例如是有活力的并且/或者未经历坏死、程序性细胞死亡或细胞凋亡。在特定实施方案中,在表面活性剂存在下培育所述细胞,如工程化t细胞(例如工程化cd4 t细胞或工程化cd8 t细胞)的组合物,并且少于50%、少于40%、少于30%、少于25%、少于20%、少于15%、少于10%、少于5%、少于1%、少于0.1%或少于0.01%的细胞经历细胞死亡,例如程序性细胞死亡、细胞凋亡和/或坏死,如由于剪切或剪切诱导的应力所致的细胞死亡。
[0303]
在特定实施方案中,在以下的存在下培育细胞(如工程化t细胞,例如工程化cd4 t细胞或工程化cd8 t细胞)的组合物:在0.1μl/ml与10.0μl/ml之间、在0.2μl/ml与2.5μl/ml之间、在0.5μl/ml与5μl/ml之间、在1μl/ml与3μl/ml之间或在2μl/ml与4μl/ml之间的表面活性剂。在一些实施方案中,在以下的存在下培育细胞(如工程化t细胞,例如工程化cd4 t细胞或工程化cd8 t细胞)的组合物:为、为约、或至少0.1μl/ml、0.2μl/ml、0.4μl/ml、0.6μl/ml、0.8μl/ml、1μl/ml、1.5μl/ml、2.0μl/ml、2.5μl/ml、5.0μl/ml、10μl/ml、25μl/ml、或50μl/ml的表面活性剂。在某些实施方案中,在为或为约2μl/ml的表面活性剂的存在下培育细胞的组合物。
[0304]
在一些实施方案中,表面活性剂是或包括降低液体和/或固体的表面张力的试剂。例如,表面活性剂包括脂肪醇(例如,甾基醇)、聚氧乙二醇辛基酚醚(例如triton x-100)或聚氧乙二醇脱水山梨糖醇烷基酯(例如聚山梨醇酯20、40、60)。在某些实施方案中,表面活性剂选自聚山梨醇酯80(ps80)、聚山梨醇酯20(ps20)、泊洛沙姆188(p188)。在示例性实施方案中,化学确定的进料培养基中的表面活性剂的浓度为约0.0025%至约0.25%(v/v)的ps80;约0.0025%至约0.25%(v/v)的ps20;或约0.1%至约5.0%(w/v)的p188。
[0305]
在一些实施方案中,表面活性剂是或包括添加到其中的阴离子表面活性剂、阳离
子表面活性剂、两性离子表面活性剂或非离子表面活性剂。合适的阴离子表面活性剂包括但不限于烷基磺酸盐、烷基磷酸盐、烷基膦酸盐、月桂酸钾、硬脂酸三乙醇胺、月桂基硫酸钠、十二烷基硫酸钠、烷基聚氧乙烯硫酸盐、海藻酸钠、二辛基磺基琥珀酸钠、磷脂酰甘油、磷脂酰肌苷、磷脂酰肌醇、双磷脂酰甘油、磷脂酰丝氨酸、磷脂酸及其盐、羧甲基纤维素钠、胆酸和其他胆汁酸(例如胆酸、脱氧胆酸、甘氨胆酸、牛磺胆酸、甘氨脱氧胆酸)及其盐(例如脱氧胆酸钠)。
[0306]
在一些实施方案中,合适的非离子表面活性剂包括:甘油酯、聚氧乙烯脂肪醇醚、聚氧乙烯脱水山梨糖醇脂肪酸酯(聚山梨酯)、聚氧乙烯脂肪酸酯、脱水山梨糖醇酯、单硬脂酸甘油酯、聚乙二醇、聚丙二醇、鲸蜡醇、鲸蜡基硬脂醇、硬脂醇、芳基烷基聚醚醇、聚氧乙烯-聚氧丙烯共聚物(泊洛沙姆)、泊洛沙胺、甲基纤维素、羟甲基纤维素、羟丙基纤维素、羟丙基甲基纤维素、非结晶纤维素、多糖(包括淀粉和淀粉衍生物,如羟乙基淀粉(hes))、聚乙烯醇和聚乙烯吡咯烷酮。在某些实施方案中,非离子表面活性剂是聚氧乙烯和聚氧丙烯共聚物,并且优选是丙二醇和乙二醇的嵌段共聚物。此类聚合物以商标名泊洛沙姆出售,有时也被称为f68或p188。聚氧乙烯脂肪酸酯包括具有短烷基链的那些。这种表面活性剂的一个例子是hs 15,即聚乙烯-660-羟基硬脂酸酯。
[0307]
在一些实施方案中,合适的阳离子表面活性剂可以包括但不限于天然磷脂、合成磷脂、季铵化合物、苯扎氯铵、十六烷基三甲基溴化铵、壳聚糖、月桂基二甲基苄基氯化铵、酰基肉碱盐酸、二甲基双十八烷基溴化铵(ddab)、二油酰基三甲基铵丙烷(dotap)、双十四酰基三甲基铵丙烷(dmtap)、二甲基氨基乙烷氨基甲酰基胆固醇(dc-chol)、1,2-二酰基甘油-3-(o-烷基)磷酸胆碱、o-烷基磷脂酰胆碱、烷基吡啶鎓卤化物或长链烷基胺(例如正辛胺和油酰胺)。
[0308]
两性离子表面活性剂是电中性的,但在同一分子内具有局部正电荷和负电荷。合适的两性离子表面活性剂包括但不限于两性离子磷脂。合适的磷脂包括磷脂酰胆碱、磷脂酰乙醇胺、二酰基-甘油-磷酸乙醇胺(如双十四酰基-甘油-磷酸乙醇胺(dmpe)、二棕榈酰基-甘油-磷酸乙醇胺(dppe)、二硬脂酰基-甘油-磷酸乙醇胺(dspe)和二油酰基-甘油-磷酸乙醇胺(dope))。在本发明中可以使用磷脂(包括阴离子磷脂和两性离子磷脂)的混合物。此类混合物包括但不限于溶血磷脂、卵磷脂或大豆磷脂或其任何组合。磷脂(无论是阴离子的磷脂、两性离子磷脂还是磷脂的混合物)可以被盐化或脱盐、氢化或部分氢化或者是天然半合成的或合成的。
[0309]
在某些实施方案中,表面活性剂是泊洛沙姆,例如,泊洛沙姆188。在一些实施方案中,在以下的存在下培育细胞的组合物:0.1μl/ml与10.0μl/ml之间、0.2μl/ml与2.5μl/ml之间、0.5μl/ml与5μl/ml之间、1μl/ml与3μl/ml之间或2μl/ml与4μl/ml之间的泊洛沙姆。在一些实施方案中,在以下的存在下培育细胞的组合物:为、为约或至少0.1μl/ml、0.2μl/ml、0.4μl/ml、0.6μl/ml、0.8μl/ml、1μl/ml、1.5μl/ml、2.0μl/ml、2.5μl/ml、5.0μl/ml、10μl/ml、25μl/ml或50μl/ml的表面活性剂。在某些实施方案中,在为或为约2μl/ml的泊洛沙姆的存在下培育细胞的组合物。
[0310]
在一些方面,cd4 和cd8 细胞各自单独扩增或一起扩增,直至它们各自达到阈值量或细胞密度。在特定实施方案中,当细胞实现阈值量、浓度和/或扩增时,培育结束,如通过收获细胞来结束。在特定实施方案中,当例如关于和/或相对于培育开始或起始时细胞密
度的量,细胞实现或实现约或至少1.5倍扩增、2倍扩增、2.5倍扩增、3倍扩增、3.5倍扩增、4倍扩增、4.5倍扩增、5倍扩增、6倍扩增、7倍扩增、8倍扩增、9倍扩增、10倍扩增或大于10倍扩增时,培育结束。在一些实施方案中,阈值扩增是例如关于和/或相对于培养开始或起始时的细胞密度的量的4倍扩增。在一些实施方案中,当细胞实现阈值总细胞量(例如阈值细胞计数)时,培育结束,如通过收获细胞来结束。在一些实施方案中,当细胞实现阈值总有核细胞(tnc)计数时,培育结束。在一些实施方案中,当细胞实现阈值活细胞量(例如阈值活细胞计数)时,培育结束。在一些实施方案中,阈值细胞计数为或为约或为至少50x106个细胞、100x106个细胞、200x106个细胞、300x106个细胞、400x106个细胞、600x106个细胞、800x106个细胞、1000x106个细胞、1200x106个细胞、1400x106个细胞、1600x106个细胞、1800x106个细胞、2000x106个细胞、2500x106个细胞、3000x106个细胞、4000x106个细胞、5000x106个细胞、10,000x106个细胞、12,000x106个细胞、15,000x106个细胞或20,000x106个细胞,或前述活细胞阈值中的任一项。
[0311]
在特定实施方案中,当细胞实现阈值细胞计数时,培育结束。在一些实施方案中,在实现阈值细胞计数后的以下时间、在约以下时间或在以下时间内,培育结束:6小时、12小时、24小时、36小时、1天、2天、3天、4天、5天、6天或7天或更多天。在特定实施方案中,在实现阈值细胞计数后1天或约1天,培育结束。在某些实施方案中,阈值密度为、为约或为至少0.1x106个细胞/ml、0.5x106个细胞/ml、1x106个细胞/ml、1.2x106个细胞/ml、1.5x106个细胞/ml、1.6x106个细胞/ml、1.8x106个细胞/ml、2.0x106个细胞/ml、2.5x106个细胞/ml、3.0x106个细胞/ml、3.5x106个细胞/ml、4.0x106个细胞/ml、4.5x106个细胞/ml、5.0x106个细胞/ml、6x106个细胞/ml、8x106个细胞/ml、或10x106个细胞/ml,或前述活细胞阈值中的任一项。在特定实施方案中,当细胞实现阈值密度时,培育结束。在一些实施方案中,在实现阈值密度后的以下时间、在约以下时间或在以下时间内,培育结束:6小时、12小时、24小时、36小时、1天、2天、3天、4天、5天、6天或7天或更多天。在特定实施方案中,在实现阈值密度后1天或约1天,培育结束。
[0312]
在一些实施方案中,在静态条件下进行至少一部分的孵育。在一些实施方案中,在灌注(例如在培养期间灌注出用过的培养基并灌注入新鲜培养基)的情况下进行孵育的至少一部分。在一些实施方案中,所述方法包括将新鲜培养基灌注到细胞培养物中(如通过补料端口)的步骤。在一些实施方案中,在灌注期间添加的培养基含有所述一种或多种刺激剂,例如,一种或多种重组细胞因子,如il-2、il-7和/或il-15。在一些实施方案中,在灌注期间添加的培养基是在静态孵育期间使用的相同培养基。
[0313]
在一些实施方案中,在孵育之后,将容器(例如,袋子)与进行用于制造、生成或产生细胞疗法的一个或多个其他处理步骤的系统重新连接,如与含有离心室的系统重新连接。在一些方面,将培养的细胞从所述袋子转移到室的内腔中用于配制培养的细胞。e.收获和配制
[0314]
在一些实施方案中,收获或配制包含用重组抗原受体(例如,car或tcr)工程化的细胞的细胞剂量以作为组合物或配制品(如药物组合物或配制品)提供。此类组合物可以根据过继细胞疗法方法(包括用于预防或治疗疾病、病症和障碍的方法)使用,或在检测、诊断和预后方法中使用。
[0315]
在一些情况下,在用于制造、生成或产生细胞疗法和/或工程化细胞的一个或多个
步骤(例如在离心室和/或封闭系统中进行的)中处理细胞,可以包括在培养(例如培育和扩增)和/或如所述的一个或多个其他处理步骤之前或之后配制细胞,例如配制由所提供的转导处理步骤产生的基因工程化细胞。在一些实施方案中,在用于制造、生成或产生细胞疗法和/或工程化细胞的一个或多个步骤(例如在离心室和/或封闭系统中进行的)中处理细胞,可以包括配制细胞,如配制由在孵育(如第ii-c-3节所述)之前或之后所提供的转导处理步骤产生的基因工程化细胞。例如,可以配制非扩增或最小扩增过程的工程化细胞。在一些情况下,可以以用于剂量施用(如用于单一单位剂量施用或多剂量施用)的量配制细胞。在一些实施方案中,所提供的与细胞的配制相关的方法包括在封闭系统中处理转导的细胞,如使用上述处理步骤转导和/或扩增的细胞。
[0316]
在某些实施方案中,配制细胞(如工程化和培育的t细胞)的一种或多种组合物。在特定实施方案中,在已经工程化和/或培育所述一种或多种组合物之后,配制细胞(如工程化和培育的t细胞)的一种或多种细胞组合物。
[0317]
在一些实施方案中,配制通过一个或多个处理步骤生成的t细胞(如cd4 和/或cd8 t细胞)。在一些方面,单独地制造、产生或生成多种组合物,每种组合物含有来自受试者的不同细胞群和/或细胞亚型,如用于任选地在一定时间段内分开地或独立地给予。例如,含有不同细胞群或细胞亚型的工程化细胞的单独配制品可以分别包括cd8 和cd4 t细胞,和/或分别包括富含cd8 和cd4 的群体,例如,cd4 和/或cd8 t细胞,其各自单独地包括经基因工程化以表达重组受体的细胞。在一些实施方案中,至少一种组合物经配制具有经基因工程化以表达重组受体的cd4 t细胞。在一些实施方案中,至少一种组合物经配制具有经基因工程化以表达重组受体的cd8 t细胞。在一些实施方案中,所述剂量的施用包括施用第一组合物,其包含一定剂量的cd8 t细胞或一定剂量的cd4 t细胞;以及施用第二组合物,其包含另一剂量的cd4 t细胞和cd8 t细胞。在一些实施方案中,包含cd8 t细胞的剂量或cd4 t细胞的剂量的第一组合物在包含cd4 t细胞和cd8 t细胞的剂量中的另一者的第二组合物之前给予。在一些实施方案中,所述剂量的给予包括给予包含cd8 t细胞的剂量和cd4 t细胞的剂量两者的组合物。
[0318]
在某些实施方案中,细胞(如工程化和培育的t细胞)的所述一种或多种组合物是或包括细胞的两种单独组合物,例如单独的工程化和/或培育的组合物。在特定实施方案中,单独地配制细胞的两种单独组合物,例如从同一生物样品选择、分离和/或富集的cd4 t细胞和cd8 t细胞的两种单独组合物。在某些实施方案中,所述两种单独组合物包括cd4 t细胞的组合物,如工程化和/或经培育cd4 t细胞的组合物。在特定实施方案中,所述两种单独组合物包括cd8 t细胞的组合物,如工程化和/或经培育cd8 t细胞的组合物。在一些实施方案中,将cd4 t细胞和cd8 t细胞的两种单独组合物(如工程化和经培育cd4 t细胞和工程化和经培育cd8 t细胞的单独组合物)单独配制。在一些实施方案中,对细胞的单一组合物进行配制。在某些实施方案中,所述单一组合物是cd4 t细胞的组合物,如工程化和/或经培育cd4 t细胞的组合物。在一些实施方案中,所述单一组合物是在配制之前已从单独组合物合并的cd4 和cd8 t细胞的组合物。
[0319]
在一些实施方案中,将cd4 和cd8 t细胞的单独组合物(如工程化和培育的cd4 和cd8 t细胞的单独组合物)组合成单一组合物并配制。在某些实施方案中,在已经进行和/或完成配制后,将cd4 和cd8 t细胞的单独配制的组合物组合成单一组合物。在特定实
施方案中,将cd4 和cd8 t细胞的单独组合物(如工程化和经培育cd4 和cd8 t细胞的单独组合物)单独配制为单独组合物。
[0320]
在一些实施方案中,在细胞达到在培育期间已经实现阈值细胞计数、密度和/或扩增后0天与10天之间、0与5天之间、2天与7天之间、0.5天与4天之间或1天与3天之间,配制细胞。在某些实施方案中,在培育期间已经实现阈值细胞计数、密度和/或扩增后为或为或约12小时、18小时、24小时、1天、2天或3天或在12小时、18小时、24小时、1天、2天或3天内,配制细胞。在一些实施方案中,在培育期间已经实现阈值细胞计数、密度和/或扩增后为或约1天内,配制细胞。
[0321]
在所述过程是非扩增或最小扩增过程的情况下,在一些实施方案中,在孵育(例如,参见第ii-c-3节)之后0天与10天之间、0与5天之间、2天与7天之间、0.5天与4天之间,或1天与3天之间配制细胞。在某些实施方案中,在孵育之后为或为或约12小时、18小时、24小时、1天、2天或3天或者在12小时、18小时、24小时、1天、2天或3天内配制细胞。在一些实施方案中,在孵育之后1天内或约1天内配制细胞。
[0322]
在一些实施方案中,将细胞配制在药学上可接受的缓冲液中,所述药学上可接受的缓冲液在一些方面可以包括药学上可接受的载体或赋形剂。在一些实施方案中,处理包括将介质交换成药学上可接受的或施用至受试者所需的介质或配制缓冲液。在一些实施方案中,处理步骤可以涉及洗涤转导的和/或扩增的细胞以替代药学上可接受的缓冲液中的细胞,所述药学上可接受的缓冲液可以包括一种或多种任选的药学上可接受的载体或赋形剂。包括药学上可接受的载体或赋形剂的此类药物形式的例子可以是下文与将细胞和组合物施用至受试者可接受的形式结合描述的任何形式。在一些实施方案中,药物组合物以有效治疗或预防疾病或病症的量(如治疗有效量或预防有效量)含有细胞。
[0323]“药学上可接受的载体”是指药物配制品中除了活性成分之外对受试者无毒的成分。药学上可接受的载体包括但不限于缓冲剂、赋形剂、稳定剂或防腐剂。
[0324]
在一些方面,载体的选择部分取决于特定细胞和/或施用方法。因此,存在多种合适的配制品。例如,药物组合物可以含有防腐剂。合适的防腐剂可以包括例如对羟基苯甲酸甲酯、对羟基苯甲酸丙酯、苯甲酸钠和苯扎氯铵。在一些方面,使用两种或更多种防腐剂的混合物。防腐剂或其混合物通常以按总组合物的重量计约0.0001%至约2%的量存在。载体描述于例如remington’s pharmaceutical sciences第16版,osol,a.编辑(1980).药学上可接受的载体在所用的剂量和浓度下通常对接受者无毒,并且包括但不限于:缓冲剂,如磷酸盐、柠檬酸盐和其他有机酸;抗氧化剂,包括抗坏血酸和甲硫氨酸;防腐剂(如十八烷基二甲基苄基氯化铵;六甲氯铵;苯扎氯铵;苄索氯铵;苯酚、丁醇或苄醇;烷基对羟基苯甲酸酯,如对羟基苯甲酸甲酯或对羟基苯甲酸丙酯;儿茶酚;间苯二酚;环己醇;3-戊醇;和间甲酚);低分子量(少于约10个残基)多肽;蛋白质,如血清白蛋白、明胶或免疫球蛋白;亲水性聚合物,如聚乙烯吡咯烷酮;氨基酸,如甘氨酸、谷氨酰胺、天冬酰胺、组氨酸、精氨酸或赖氨酸;单糖、二糖和其他碳水化合物,包括葡萄糖、甘露糖或糊精;螯合剂,如edta;糖类,如蔗糖、甘露醇、海藻糖或山梨糖醇;成盐抗衡离子,如钠;金属络合物(例如锌-蛋白质络合物);和/或非离子表面活性剂,如聚乙二醇(peg)。
[0325]
在一些方面,在组合物中包括缓冲剂。合适的缓冲剂包括例如柠檬酸、柠檬酸钠、磷酸、磷酸钾以及各种其他酸和盐。在一些方面,使用两种或更多种缓冲剂的混合物。缓冲
剂或其混合物通常以按总组合物的重量计约0.001%至约4%的量存在。用于制备可施用的药物组合物的方法是已知的。示例性方法更详细地描述于例如remington:the science and practice of pharmacy,lippincott williams&wilkins;21st ed.(2005年5月1日)中。
[0326]
所述配制品可以包括水溶液。所述配制品或组合物还可含有可用于用细胞治疗的特定适应症、疾病或病症的多于一种活性成分,优选具有与所述细胞互补的活性的那些成分,其中各自的活性不会相互产生不利影响。此类活性成分以有效用于既定目的的量以合适的方式组合存在。因此,在一些实施方案中,药物组合物进一步包括其他药物活性药剂或药物,例如化学治疗剂,例如天冬酰胺酶、白消安、卡铂、顺铂、柔红霉素、多柔比星、氟尿嘧啶、吉西他滨、羟基脲、甲氨蝶呤、紫杉醇、利妥昔单抗、长春碱和/或长春新碱。
[0327]
在一些实施方案中,组合物作为无菌液体制剂提供,例如等渗水溶液、悬浮液、乳液、分散体或粘性组合物,其在一些方面可以缓冲至选择的ph。液体组合物可以包含载体,所述载体可以是溶剂或分散介质,所述溶剂或分散介质含有例如水、盐水、磷酸盐缓冲盐水、多元醇(例如,甘油、丙二醇、液体聚乙二醇)及其合适的混合物。无菌可注射溶液可以通过在溶剂中掺入细胞来制备,所述溶剂如与合适的载体、稀释剂或赋形剂(如无菌水、生理盐水、葡萄糖、右旋糖等)混合。组合物可以含有辅助物质,如润湿剂、分散剂或乳化剂(例如,甲基纤维素)、ph缓冲剂、胶凝或粘度增强添加剂、防腐剂、调味剂和/或颜料,这取决于施用途径和所需的制剂。在一些方面,可以参考标准文本来制备合适的制剂。
[0328]
可以添加各种增强所述组合物的稳定性和无菌性的添加剂,包括抗微生物防腐剂、抗氧化剂、螯合剂和缓冲剂。可以通过各种抗细菌和抗真菌剂(例如对羟基苯甲酸酯、氯丁醇、苯酚和山梨酸)来确保防止微生物的作用。通过使用延迟吸收的药剂(例如单硬脂酸铝和明胶)可以实现可注射药物形式的延长吸收。
[0329]
在一些实施方案中,配制缓冲液含有低温保存剂。在一些实施方案中,用低温保存剂溶液配制细胞,所述低温保存剂溶液含有1.0%至30%的dmso溶液,如5%至20%的dmso溶液或5%至10%的dmso溶液。在一些实施方案中,低温保存剂溶液是或含有例如含有20%dmso和8%人血清白蛋白(hsa)的pbs、或其他合适的细胞冷冻介质。在一些实施方案中,低温保存剂溶液是或含有例如至少或约7.5%dmso。在一些实施方案中,处理步骤可以涉及洗涤转导的和/或扩增的细胞以交换在低温保存剂溶液中的细胞。在一些实施方案中,将所述细胞在具有最终浓度为或为约12.5%、12.0%、11.5%、11.0%、10.5%、10.0%、9.5%、9.0%、8.5%、8.0%、7.5%、7.0%、6.5%、6.0%、5.5%或5.0%dmso,或在1%与15%之间、在6%与12%之间、在5%与10%之间或在6%与8%之间的dmso的介质和/或溶液中冷冻,例如低温保存或低温保护。在特定实施方案中,将细胞在具有终浓度为或为约5.0%、4.5%、4.0%、3.5%、3.0%、2.5%、2.0%、1.5%、1.25%、1.0%、0.75%、0.5%、或0.25%的hsa,或在0.1%与5%之间、在0.25%与4%之间、在0.5%与2%之间、或在1%与2%之间的hsa的培养基和/或溶液中冷冻(例如低温保存或低温保护)。
[0330]
在特定实施方案中,将富集的t细胞(例如已经进行刺激、工程化和/或培育的t细胞)的组合物配制,低温保存,然后储存一定时间量。在某些实施方案中,储存配制的低温保存的细胞,直至释放细胞用于输注。在特定实施方案中,将配制的低温保存的细胞储存1天与6个月之间、1个月与3个月之间、1天与14天之间、1天与7天之间、3天与6天之间、6个月与
12个月之间、或长于12个月。在一些实施方案中,将细胞低温保存并储存以下时间、大约以下时间或少于以下时间:1天、2天、3天、4天、5天、6天或7天。在某些实施方案中,在储存后,将细胞解冻并施用至受试者。在某些实施方案中,将细胞储存持续或持续约5天。
[0331]
在一些实施方案中,使用一个或多个处理步骤进行配制,所述步骤包括洗涤、稀释或浓缩细胞,如培养或扩增的细胞。在一些实施方案中,处理可以包括将细胞稀释或浓缩至所需浓度或数量,如包括用于以给定剂量或其部分用的细胞数量的单位剂型组合物。在一些实施方案中,处理步骤可以包括减小体积,从而根据需要增加细胞的浓度。在一些实施方案中,处理步骤可以包括增加体积,从而根据需要减小细胞的浓度。在一些实施方案中,处理包括向转导的和/或扩增的细胞添加一定体积的配制缓冲液。在一些实施方案中,配制缓冲液的体积为从10ml至1000ml或从约10ml至约1000ml,如至少或至少约或约50ml、100ml、200ml、300ml、400ml、500ml、600ml、700ml、800ml、900ml或1000ml。
[0332]
在一些实施方案中,在容器(例如袋或离心室)中培养,如刺激、工程化和/或培育细胞。在一些方面,所述容器是第一容器,并且将培养的细胞从第一容器(例如袋或离心室)的第一容器中压出或转移至可操作地连接至第一容器的第二容器。
[0333]
在一些实施方案中,用于配制细胞组合物的此类处理步骤在封闭系统中进行。此类处理步骤的例子可以使用与跟细胞处理系统相关的一个或多个系统或套件结合的离心室(例如由biosafe sa生产和出售的离心室,包括用于与或sepax细胞处理系统一起使用的那些)来进行。在国际公开号wo 2016/073602中描述了示例性系统和过程。在一些实施方案中,方法包括从离心室的内腔中挤压或转移配制的组合物,所述配制的组合物是在如上所述的实施方案中在配制缓冲液(如药学上可接受的缓冲液)中配制得到的细胞组合物。在一些实施方案中,将所配制的组合物输送或转移到容器,所述容器作为封闭系统的一部分与离心室可操作地连接。
[0334]
在一些方面,可以将细胞以用于剂量施用(如用于单一单位剂量施用或多剂量施用)的量输送或转移到多个容器中的一个或多个中。
[0335]
在一些实施方案中,每个输出容器单独地包含单位剂量的细胞。因此,在一些实施方案中,每个容器包含相同或大致或基本相同数量的细胞。在一些实施方案中,每个单位剂量含有至少或至少约1x106、2x106、5x106、1x107、5x107、1x108、2.5x108、或5x108个工程化细胞、总细胞、t细胞或pbmc。在一些实施方案中,每个单位剂量含有至少或至少约2.5x107、至少或至少约5.0x107、至少或至少约1.5x108、至少或至少约3.0x108、至少或至少约4.5x108、至少或至少约8.0x108或至少或至少约1.2x109个工程化细胞、总细胞、t细胞或pbmc。在一些实施方案中,每个单位剂量含有不超过或不超过约2.5x107、不超过或不超过约5.0x107、不超过或不超过约1.5x108、不超过或不超过约3.0x108、不超过或不超过约4.5x108、不超过或不超过约8.0x108或不超过或不超过约1.2x109个工程化细胞、总细胞、t细胞或pbmc。在一些方面,可以包含在容器中的细胞的示例性剂量包括本文所述的任何剂量。
[0336]
在一些实施方案中,每个容器中的经配制细胞组合物的体积为10ml至100ml,如至少或约至少或约20ml、30ml、40ml、50ml、60ml、70ml、80ml、90ml或100ml。在一些实施方案中,可以将容器中的细胞低温保存。在一些实施方案中,所述容器可以在液氮中储存,直到进一步使用。
[0337]
在一些实施方案中,将通过所述方法产生的此类细胞或包含此类细胞的组合物施
用至受试者以治疗疾病或病症。iii.重组受体
[0338]
在各种实施方案中,提供工程化、转化、转导或转染的细胞,如免疫细胞,如t细胞,所述细胞表达一种或多种重组蛋白。在特定实施方案中,所述一种或多种重组蛋白中的至少一种是重组受体,例如,抗原受体和含有其一种或多种组分的受体。在一些实施方案中,重组蛋白是或包括重组受体,例如抗原受体。抗原受体可以包括功能性非tcr抗原受体,包括嵌合抗原受体(car)和其他抗原结合受体,例如转基因t细胞受体(tcr)。受体还可以包括其他受体,如其他嵌合受体,如与特定配体结合并且具有与car中存在的那些类似的跨膜和/或细胞内信号传导结构域的受体。在一些实施方案中,本文提供的将细胞分类的方法可以用于将来自已成功工程化、转化、转导或转染以表达(例如,呈表面阳性)重组蛋白(如重组受体)的细胞群体的细胞分类(例如,预测)。
[0339]
示例性抗原受体(包括car)以及将此类受体工程化并引入细胞的方法包括例如以下文献中所述的那些:国际专利申请公开号wo 200014257、wo 2013126726、wo2012/129514、wo 2014031687、wo 2013/166321、wo 2013/071154、wo 2013/123061;美国专利申请公开号us 2002131960、us 2013287748、us 20130149337;美国专利号6,451,995、7,446,190、8,252,592、8,339,645、8,398,282、7,446,179、6,410,319、7,070,995、7,265,209、7,354,762、7,446,191、8,324,353和8,479,118;以及欧洲专利申请号ep2537416;和/或以下文献中所述的那些:sadelain等人,cancer discov.2013年4月;3(4):388-398;davila等人(2013)plos one 8(4):e61338;turtle等人,curr.opin.immunol.,2012年10月;24(5):633-39;wu等人,cancer,2012年3月18(2):160-75。在一些方面,抗原受体包括如美国专利号7,446,190中描述的car,以及国际专利申请公开号wo/2014055668a1中描述的那些。car的例子包括如在任何上述出版物中披露的car,所述出版物例如wo2014031687、us 8,339,645、us 7,446,179、us 2013/0149337、美国专利号7,446,190、美国专利号8,389,282;kochenderfer等人,2013,nature reviews clinical oncology,10,267-276(2013);wang等人(2012)j.immunother.35(9):689-701;以及brentjens等人,sci transl med.2013 5(177)。还参见wo 2014031687、us 8,339,645、us 7,446,179、us2013/0149337、美国专利号7,446,190和美国专利号8,389,282。
[0340]
在一些实施方案中,编码重组蛋白的一个或多个核酸进一步编码一种或多种标记物,例如用于确认要表达受体的细胞的转导或工程化和/或对表达由多核苷酸编码的一种或多种分子的细胞的选择和/或靶向的目的。在一些方面,这种标记物可以由不同的核酸或多核苷酸编码,所述核酸或多核苷酸也可以在基因工程化过程期间被引入,通常通过相同的方法(例如通过本文提供的任何方法转导,例如通过相同的载体或相同类型的载体转导)被引入。
[0341]
在一些方面,标记物(例如,转导标记物)是蛋白质和/或是细胞表面分子。示例性标记物是天然存在的(例如,内源)标记物(如天然存在的细胞表面分子)的截短的变体。在一些方面,与天然或内源细胞表面分子相比,变体具有降低的免疫原性、降低的运输功能和/或降低的信号传导功能。在一些实施方案中,所述标记物是细胞表面受体的截短形式,例如截短的egfr(tegfr)。在一些方面,标记物包括cd34、ngfr或表皮生长因子受体的全部或部分(例如截短形式)(例如tegfr)。在一些实施方案中,编码所述标记物的核酸与编码接
头序列(如可切割接头序列)的多核苷酸可操作地连接。参见例如wo 2014/031687。在一些实施方案中,单一启动子可以指导rna的表达,所述rna在单个开放阅读框(orf)中含有两个或三个基因(例如,编码参与调节代谢途径的分子和编码重组受体),所述基因由编码自切割肽(例如2a序列)或蛋白酶识别位点(例如弗林蛋白酶(furin))的序列彼此分开。因此,orf编码单一多肽,其在翻译期间(在2a的情况下)或翻译后被处理成单独蛋白质。在一些情况下,肽(如t2a)可以引起核糖体跳过2a元件c末端处肽键的合成(核糖体跳跃),导致2a序列末端与相邻下游肽之间分开(参见例如,de felipe.genetic vaccines and ther.2:13(2004)和defelipe等人traffic 5:616-626(2004))。许多2a元件是已知的。可以用于本文公开的方法和核酸中的2a序列的例子包括但不限于来自口蹄疫病毒的2a序列(f2a)、来自马甲型鼻炎病毒的2a序列(e2a)、来自明脉扁刺蛾β四体病毒(thosea asigna virus)的2a序列(t2a)和来自猪捷申病毒-1的2a序列(p2a),如美国专利公开号20070116690中所述。
[0342]
在一些实施方案中,所述标记物是并非在t细胞上天然发现的或并非在t细胞表面上天然发现的分子(例如,细胞表面蛋白)或其部分。
[0343]
在一些实施方案中,分子是非自身分子,例如非自身蛋白,即不被将被过继转移细胞的宿主免疫系统识别为“自身”的分子。
[0344]
在一些实施方案中,所述标记物不提供任何治疗功能和/或不产生除了用作基因工程化标记物(例如,用于选择成功工程化的细胞)以外的作用。在其他实施方案中,标记物可以是治疗性分子或以其他方式发挥一些所需作用的分子,如在体内会遇到的细胞的配体,如用于在过继转移和遇到配体时增强和/或减弱细胞反应的共刺激或免疫检查点分子。a.嵌合抗原受体
[0345]
在一些实施方案中,car通常是基因工程化受体,其具有细胞外配体结合结构域,例如含有抗体或其片段的细胞外部分,所述细胞外配体结合结构域与一种或多种细胞内信号传导组分连接。在一些实施方案中,嵌合抗原受体包括将细胞外结构域与细胞内信号传导结构域连接的跨膜结构域和/或细胞内结构域。此类分子通常模拟或接近通过天然抗原受体发出的信号和/或通过这样的受体与共刺激受体的组合发出的信号。
[0346]
在一些实施方案中,car被构建具有对特定标记物的特异性,例如在过继疗法所靶向的特定细胞类型中表达的标记物,例如癌症标记物和/或任何所述抗原。因此,car通常包括抗体的一个或多个抗原结合片段、结构域或部分,或一个或多个抗体可变结构域和/或抗体分子。在一些实施方案中,car包括抗体分子的一个或多个抗原结合部分,如可变重链(vh)或其抗原结合部分、或衍生自单克隆抗体(mab)的可变重链(vh)和可变轻链(vl)的单链抗体片段(scfv)。
[0347]
在一些实施方案中,car含有抗体或抗原结合片段(例如scfv),其特异性地识别在细胞表面上表达的抗原(如完整抗原)。
[0348]
在一些实施方案中,抗原是或包括αvβ6整联蛋白(avb6整联蛋白)、b细胞成熟抗原(bcma)、b7-h3、b7-h6、碳酸酐酶9(ca9,也称为caix或g250)、癌症-睾丸抗原、癌症/睾丸抗原1b(ctag,也称为ny-eso-1和lage-2)、癌胚抗原(cea)、细胞周期蛋白、细胞周期蛋白a2、c-c基序趋化因子配体1(ccl-1)、cd19、cd20、cd22、cd23、cd24、cd30、cd33、cd38、cd44、cd44v6、cd44v7/8、cd123、cd133、cd138、cd171、硫酸软骨素蛋白聚糖4(cspg4)、表皮生长因子蛋白(egfr)、表皮生长因子受体iii型突变体(egfr viii)、上皮糖蛋白2(epg-2)、上皮糖
蛋白40(epg-40)、肝配蛋白b2、肝配蛋白受体a2(epha2)、雌激素受体、fc受体样蛋白5(fcrl5;也称为fc受体同源物5或fcrh5)、胎儿乙酰胆碱受体(胎儿achr)、叶酸结合蛋白(fbp)、叶酸受体α、神经节苷脂gd2、o-乙酰化gd2(ogd2)、神经节苷脂gd3、糖蛋白100(gp100)、磷脂酰肌醇蛋白聚糖-3(gpc3)、g蛋白偶联受体5d(gprc5d)、her2/neu(受体酪氨酸激酶erb-b2)、her3(erb-b3)、her4(erb-b4)、erbb二聚体、人高分子量黑色素瘤相关抗原(hmw-maa)、乙型肝炎表面抗原、人白细胞抗原a1(hla-a1)、人白细胞抗原a2(hla-a2)、il-22受体α(il-22rα)、il-13受体α2(il-13rα2)、激酶插入结构域受体(kdr)、κ轻链、l1细胞粘附分子(l1-cam)、l1-cam的ce7表位、含有富亮氨酸重复序列的蛋白8家族成员a(lrrc8a)、路易斯y、黑色素瘤相关抗原(mage)-a1、mage-a3、mage-a6、mage-a10、间皮素(msln)、c-met、鼠类巨细胞病毒(cmv)、粘蛋白1(muc1)、muc16、自然杀伤细胞2族成员d(nkg2d)配体、黑色素a(mart-1)、神经细胞粘附分子(ncam)、癌胚胎抗原、黑色素瘤优先表达抗原(prame)、孕酮受体、前列腺特异性抗原、前列腺干细胞抗原(psca)、前列腺特异性膜抗原(psma)、受体酪氨酸激酶样孤儿受体1(ror1)、存活蛋白、滋养层糖蛋白(tpbg,也称为5t4)、肿瘤相关糖蛋白72(tag72)、酪氨酸酶相关蛋白1(trp1,也称为tyrp1或gp75)、酪氨酸酶相关蛋白2(trp2,也称为多巴色素互变异构酶、多巴色素δ异构酶或dct)、血管内皮生长因子受体(vegfr)、血管内皮生长因子受体2(vegfr2)、肾母细胞瘤1(wt-1)、病原体特有的或病原体表达的抗原、或与通用标签相关的抗原、和/或生物素化的分子、和/或由hiv、hcv、hbv或其他病原体表达的分子。在一些实施方案中,由所述受体靶向的抗原包括与b细胞恶性肿瘤相关的抗原,如许多已知b细胞标记物中的任一种。在一些实施方案中,所述抗原是或包括cd20、cd19、cd22、ror1、cd45、cd21、cd5、cd33、igκ、igλ、cd79a、cd79b或cd30。
[0349]
在一些实施方案中,抗原是或包括病原体特异性抗原或病原体表达的抗原。在一些实施方案中,所述抗原是病毒抗原(如来自hiv、hcv、hbv等的病毒抗原)、细菌抗原和/或寄生虫抗原。
[0350]
在一些实施方案中,car含有tcr样抗体,如抗体或抗原结合片段(例如scfv),其特异性地识别作为mhc-肽复合物存在于细胞表面上的细胞内抗原(如肿瘤相关抗原)。在一些实施方案中,识别mhc-肽复合物的抗体或其抗原结合部分可以作为重组受体(如抗原受体)的部分在细胞上表达。所述抗原受体包括功能性非tcr抗原受体,如嵌合抗原受体(car)。通常,含有针对肽-mhc复合物表现出tcr样特异性的抗体或抗原结合片段的car也可以称为tcr样car。
[0351]
在一些实施方案中,car的细胞外部分(如其抗体部分)进一步包括间隔子,如抗原识别组分(例如scfv)与跨膜结构域之间的间隔子区。间隔子可以是或包括免疫球蛋白恒定区或其变体或经修饰形式的至少一部分,例如铰链区(例如igg4铰链区)、和/或ch1/c
l
和/或fc区。在一些实施方案中,恒定区或部分是人igg如igg4或igg1的。与不存在间隔子的情况下相比,间隔子的长度可以提供抗原结合后增强的细胞反应性。在一些例子中,间隔子具有为或约12个氨基酸的长度或者具有不超过12个氨基酸的长度。示例性间隔子包括具有以下的那些:至少约10至229个氨基酸、约10至200个氨基酸、约10至175个氨基酸、约10至150个氨基酸、约10至125个氨基酸、约10至100个氨基酸、约10至75个氨基酸、约10至50个氨基酸,约10至40个氨基酸、约10至30个氨基酸、约10至20个氨基酸或约10至15个氨基酸,并且包括任何列出的范围的端点之间的任何整数。在一些实施方案中,间隔子区具有约12个或更少
的氨基酸、约119个或更少的氨基酸或约229个或更少的氨基酸。示例性间隔子包括单独的igg4铰链、与ch2和ch3结构域连接的igg4铰链或与ch3结构域连接的igg4铰链。示例性间隔子包括但不限于以下文献中所述的那些:hudecek等人(2013)clin.cancer res.,19:3153或国际专利申请公开号wo 2014/031687。
[0352]
细胞外配体结合结构域(例如抗原识别结构域)通常与一个或多个细胞内信号传导组分连接,所述一个或多个细胞内信号传导组分例如为在car的情况下模拟通过抗原受体复合物(例如tcr复合物)进行激活和/或通过另一细胞表面受体传导信号的信号传导组分。在一些实施方案中,跨膜结构域连接细胞外配体结合结构域与细胞内信号传导结构域。在一些实施方案中,car包含与胞外结构域融合的跨膜结构域。在一个实施方案中,使用与受体(例如,car)中的一个结构域天然地缔合的跨膜结构域。在一些情形下,通过氨基酸取代选择或修饰跨膜结构域,以避免此类结构域与相同或不同表面膜蛋白的跨膜结构域结合,以使与受体复合物的其他成员的相互作用最小化。
[0353]
在一些实施方案中,跨膜结构域源自天然或合成来源。当来源是天然的时,在一些方面,所述结构域可以源自任何膜结合蛋白或跨膜蛋白。跨膜区包括源自以下的那些(即,包含以下的至少一个或多个跨膜区):t细胞受体的α、β或ζ链,cd28,cd3ε,cd45,cd4,cd5,cd8,cd9,cd16,cd22,cd33,cd37,cd64,cd80,cd86,cd134,cd137或cd154。在一些实施方案中,跨膜结构域是合成的。在一些方面,合成跨膜结构域主要包含疏水性残基,例如亮氨酸和缬氨酸。在一些方面,将在合成跨膜结构域的每个末端发现苯丙氨酸、色氨酸和缬氨酸的三联体。在一些实施方案中,所述连接是通过接头、间隔子和/或一个或多个跨膜结构域来实现。
[0354]
在一些实施方案中,存在短的寡肽或多肽接头,例如具有在2与10个氨基酸之间的长度的接头(如含有甘氨酸和丝氨酸的接头,例如甘氨酸-丝氨酸双联体),并且在car的跨膜结构域与胞质信号传导结构域之间形成连接。
[0355]
重组受体(例如car)通常包括至少一种或多种细胞内信号传导组分。在一些实施方案中,所述受体包括tcr复合物的细胞内组分,如介导t细胞激活和细胞毒性的tcr cd3链,例如cd3ζ链。因此,在一些方面,所述抗原结合部分连接至一个或多个细胞信号传导模块。在一些实施方案中,细胞信号传导模块包括cd3跨膜结构域、cd3细胞内信号传导结构域和/或其他cd跨膜结构域。在一些实施方案中,所述受体(例如,car)进一步包括一种或多种另外的分子(如fc受体γ、cd8、cd4、cd25或cd16)的一部分。例如,在一些方面,car或其他嵌合受体包括cd3-zeta(cd3-ζ)或fc受体γ与cd8、cd4、cd25或cd16之间的嵌合分子。
[0356]
在一些实施方案中,在连接car或其他嵌合受体后,所述受体的胞质结构域或细胞内信号传导结构域激活免疫细胞(例如工程化以表达所述car的t细胞)的正常效应子功能或应答中的至少一种。例如,在一些情境下,car诱导t细胞的功能,如细胞溶解活性或t辅助活性,如细胞因子或其他因子的分泌。在一些实施方案中,使用抗原受体组分或共刺激分子的细胞内信号传导结构域的截短部分(例如,如果其转导效应子功能信号的话)代替完整的免疫刺激链。在一些实施方案中,所述一个或多个细胞内信号传导结构域包括t细胞受体(tcr)的胞质序列,并且在一些方面还包括共受体(其在天然背景下与此类受体并行起作用以在抗原受体接合后启动信号转导)和/或此类分子的任何衍生物或变体的那些,和/或具有相同功能能力的任何合成序列。
[0357]
在天然tcr的情况下,完全激活通常不仅需要经由tcr进行信号传导,还需要共刺激信号。因此,在一些实施方案中,为了促进完全激活,用于生成次级或共刺激信号的组分也被包括在所述car中。在其他实施方案中,所述car不包括用于生成共刺激信号的组分。在一些方面,另外的car在同一细胞中表达,并且提供用于生成次级或共刺激信号的组分。
[0358]
t细胞激活在一些方面被描述为由至少如下两类胞质信号传导序列介导:通过tcr启动抗原依赖性初级激活的那些(初级胞质信号传导序列),以及以非抗原依赖性方式起作用以提供次级或共刺激信号的那些(次级胞质信号传导序列)。在一些方面,car包括此类信号传导组分中的一种或两种。
[0359]
在一些方面,car包括调节tcr复合物的初级激活的初级胞质信号传导序列。以刺激方式起作用的初级胞质信号传导序列可以含有信号传导基序(其称为免疫受体酪氨酸激活基序或itam)。含有itam的初级胞质信号传导序列的例子包括源自以下项的那些:tcrζ、fcrγ、fcrβ、cd3γ、cd3δ、cd3ε、cd8、cd22、cd79a、cd79b和cd66d。在一些实施方案中,所述car中的胞质信号传导分子含有源自cd3ζ的胞质信号传导结构域、其部分或序列。
[0360]
在一些实施方案中,car包括共刺激受体(例如cd28、4-1bb、ox40、cd27、dap10和icos)的信号传导结构域和/或跨膜部分。在一些方面,相同的car包括激活组分和共刺激组分两者。
[0361]
在一些实施方案中,激活结构域包括于一个car内,而共刺激组分是由识别另一种抗原的另一种car提供。在一些实施方案中,car包括在同一细胞上表达的激活或刺激car和共刺激car(参见wo 2014/055668)。在一些方面,car是刺激或激活car;在其他方面,它是共刺激car。在一些实施方案中,细胞进一步包括抑制性car(icar,参见fedorov等人,sci.transl.medicine,5(215)(2013年12月),如识别不同抗原的car,其中通过识别第一抗原的car递送的激活信号通过抑制性car与其配体的结合而被减少或抑制,例如,以减少脱靶效应。
[0362]
在一些实施方案中,cd8 细胞毒性t细胞的细胞内信号传导结构域与cd4 辅助t细胞的细胞内信号传导结构域相同。在一些实施方案中,cd8 细胞毒性t细胞的细胞内信号传导结构域与cd4 辅助t细胞的细胞内信号传导结构域不同。
[0363]
在某些实施方案中,所述细胞内信号传导区包含连接至cd3(例如,cd3-ζ)细胞内结构域的cd28跨膜和信号传导结构域。在一些实施方案中,所述细胞内信号传导区包含与cd3ζ细胞内结构域连接的嵌合cd28和cd137(4-1bb,tnfrsf9)共刺激结构域。
[0364]
在一些实施方案中,所述car涵盖在胞质部分中的一个或多个(例如,两个或更多个)共刺激结构域和激活结构域(例如,初级激活结构域)。示例性car包括cd3ζ、cd28和4-1bb的细胞内组分。
[0365]
在一些情况下,car被称为第一代、第二代和/或第三代car。在一些方面,第一代car是在抗原结合后仅提供cd3链诱导的信号的car;在一些方面,第二代car是提供这种信号和共刺激信号的car,例如包括来自共刺激受体(如cd28或cd137)的细胞内信号传导结构域的car;在一些方面,第三代car在一些方面包含不同共刺激受体的多个共刺激结构域的car。
[0366]
在一些实施方案中,嵌合抗原受体包括细胞外配体结合部分(如抗原结合部分,如抗体或其片段)和细胞内结构域。在一些实施方案中,所述抗体或片段包括scfv或单结构域
vh抗体,并且细胞内结构域含有itam。在一些方面,细胞内信号传导结构域包括cd3-zeta(cd3ζ)链的ζ链的信号传导结构域。在一些实施方案中,嵌合抗原受体包括连接细胞外结构域和细胞内信号传导结构域的跨膜结构域。在一些方面,跨膜结构域含有cd28的跨膜部分。细胞外结构域和跨膜可以直接或间接连接。在一些实施方案中,细胞外结构域和跨膜通过间隔子(如本文所述的任何间隔子)连接。在一些实施方案中,嵌合抗原受体含有t细胞共刺激分子的细胞内结构域,如在跨膜结构域与细胞内信号传导结构域之间。在一些方面,t细胞共刺激分子是cd28或4-1bb。
[0367]
在一些实施方案中,所述car含有抗体(例如,抗体片段)、跨膜结构域(其是或含有cd28的跨膜部分或其功能变体)以及含有cd28的信号传导部分或其功能变体和cd3ζ的信号传导部分或其功能变体的细胞内信号传导结构域。在一些实施方案中,car含有抗体(例如,抗体片段)、跨膜结构域(其是或含有cd28的跨膜部分或其功能变体)以及细胞内信号传导结构域(含有4-1bb的信号传导部分或其功能变体和cd3ζ的信号传导部分或其功能变体)。在一些此类实施方案中,受体进一步包括含有ig分子(如人ig分子)的一部分(如ig铰链,例如igg4铰链)的间隔子,如仅铰链间隔子。
[0368]
在一些实施方案中,受体(例如car)的跨膜结构域是人cd28的跨膜结构域或其变体,例如人cd28的27个氨基酸的跨膜结构域(登录号:p10747.1)。在一些实施方案中,细胞内结构域包含人cd28的细胞内共刺激信号传导结构域或其功能变体,如其41个氨基酸的结构域,和/或在天然cd28蛋白的位置186-187处具有ll至gg取代的这样的结构域。在一些实施方案中,所述细胞内结构域包含4-1bb的细胞内共刺激信号传导结构域或其功能变体,如人4-1bb的42个氨基酸的胞质结构域(登录号q07011.1)。在一些实施方案中,所述细胞内信号传导结构域包含人cd3ζ刺激信号传导结构域或其功能变体,如人cd3ζ(登录号:p20963.2)的同种型3的112个aa的胞质结构域或如美国专利号7,446,190中所述的cd3ζ信号传导结构域。在一些方面,间隔子仅含有igg的铰链区,如仅igg4或igg1的铰链。在其他实施方案中,间隔子是与ch2和/或ch3结构域连接的ig铰链,例如igg4铰链。在一些实施方案中,间隔子是与ch2和ch3结构域连接的ig铰链,例如igg4铰链。在一些实施方案中,间隔子是仅与ch3结构域连接的ig铰链,例如igg4铰链。在一些实施方案中,间隔子是或包含富甘氨酸-丝氨酸的序列或其他柔性接头,如已知的柔性接头。
[0369]
例如,在一些实施方案中,car包括:细胞外配体结合部分,例如抗原结合部分,例如抗体或其片段,包括sdab和scfv,其特异性结合抗原,例如本文所述的抗原;间隔子,例如任何含有ig铰链的间隔子;跨膜结构域,其是cd28的一部分或其变体;细胞内信号传导结构域,其含有cd28的信号传导部分或其功能变体;以及cd3ζ信号传导结构域的信号传导部分或其功能变体。在一些实施方案中,car包括:细胞外配体结合部分(如抗原结合部分,如抗体或其片段,包括sdab和scfv),其特异性结合抗原,例如本文所述的抗原;间隔子,如任何含有ig铰链的间隔子;跨膜结构域,其是cd28的一部分或其变体;细胞内信号传导结构域,其含有4-1bb的信号传导部分或其功能变体;以及cd3ζ信号传导结构域的信号传导部分或其功能变体。在一些实施方案中,此类car构建体进一步包括例如car下游的t2a核糖体跳跃元件和/或截短的egfr(例如tegfr)序列。b.t细胞受体(tcr)
[0370]
在一些实施方案中,重组蛋白是或包括重组t细胞受体(tcr)。在一些实施方案中,
重组tcr对抗原具特异性,所述抗原通常是存在于靶细胞上的抗原(如肿瘤特异性抗原)、在与自身免疫性或炎性疾病关联的特定细胞类型上表达的抗原或衍生自病毒病原体或细菌病原体的抗原。
[0371]
在一些实施方案中,tcr是从天然存在的t细胞克隆的tcr。在一些实施方案中,从患者中鉴定并分离针对靶抗原(例如,癌抗原)的高亲和力t细胞克隆。在一些实施方案中,已经在用人免疫系统基因(例如,人白细胞抗原系统或hla)工程化的转基因小鼠中产生针对靶抗原的tcr克隆。参见,例如,肿瘤抗原(参见,例如,parkhurst等人(2009)clin cancer res.15:169-180和cohen等人(2005)j immunol.175:5799-5808。在一些实施方案中,使用噬菌体展示来分离针对靶抗原的tcr(参见,例如,varela-rohena等人(2008)nat med.14:1390-1395和li(2005)nat biotechnol.23:349-354。在一些实施方案中,在获得t细胞克隆之后,将tcrα和β链分离并克隆到基因表达载体中。在一些实施方案中,tcrα和β基因经由小核糖核酸病毒2a核糖体跳跃肽连接,使得两条链共表达。在一些实施方案中,编码tcr的核酸进一步包括标记物以确认细胞经转导或工程化而表达受体。iv.定义
[0372]
除非另有定义,否则本文使用的所有技术术语、符号以及其他技术和科学术语或用辞意图具有与所要求保护的主题所属领域的普通技术人员通常理解的含义相同的含义。在一些情形中,为了清楚和/或为了便于引用而在本文中定义具有通常理解的含义的术语,并且本文中包含此类定义不一定应当被解释为代表与本领域通常所理解的含义有实质性差异。
[0373]
除非上下文另有明确规定,否则如本文所用,单数形式“一个/一种(a)”、“一个/一种(an)”和“所述(the)”包括复数指代物。例如,“一个/一种(a)”或“一个/一种(an)”意指“至少一个/至少一种”或“一个或多个/一种或多种”。应理解,本文描述的方面和变化包括“由方面和变化组成”和/或“基本上由方面和变化组成”。
[0374]
在整个本公开文本中,要求保护的主题的各个方面以范围形式呈现。应当理解的是,范围形式的描述仅仅是为了方便和简洁,并且不应当被解释为对所要求保护的主题的范围的不能转变的限制。因此,应当认为范围的描述具体公开了所有可能的子范围以及该范围内的各个数值。例如,在提供值的范围的情况下,应理解,在该范围的上限和下限之间的每个中间值以及在所陈述范围内的任何其他所述值或中间值都涵盖在所要求保护的主题内。这些较小范围的上限和下限可以独立地被包括在所述较小范围内,并且也涵盖在所要求保护的主题内,受制于在所陈述范围内任何确切排除的限制。在所陈述范围包括所述限值中的之一或两者的情况下,排除那些所包括限值中的任何一个或两个的范围也被包括在所要求保护的主题内。无论范围的宽度如何,这都适用。
[0375]
如本文所用的术语“约”是指本技术领域的技术人员容易知道的相应值的常用误差范围。本文提及“约”某一值或参数时包括(并描述)涉及该值或参数本身的实施方案。例如,涉及“约x”的描述包括“x”的描述。
[0376]
如本文所用,叙述核苷酸或氨基酸位置“对应于”所公开序列中的核苷酸或氨基酸位置(如序列表所示)是指,在使用标准比对算法(例如,gap算法)与所公开序列比对以使同一性最大化之后,所鉴定的核苷酸或氨基酸位置。通过比对序列,本领域技术人员可以例如
使用保守和相同的氨基酸残基作为指导,鉴定相应的残基。通常,为了鉴定对应位置,比对氨基酸序列使得获得最高阶匹配(参见例如:computational molecular biology,lesk,a.m.编辑,oxford university press,纽约,1988;biocomputing:informatics and genome projects,smith,d.w.编辑,academic press,纽约,1993;computer analysis of sequence data,part i,griffin,a.m.和griffin,h.g.编辑,humana press,新泽西州,1994;sequence analysis in molecular biology,von heinje,g.,academic press,1987;和sequence analysis primer,gribskov,m.和devereux,j.编辑,m stockton press,纽约,1991;carrillo等人(1988)siam j applied math 48:1073)。
[0377]
如本文所用,术语“载体”是指能够传播与其连接的另一核酸的核酸分子。所述术语包括作为自我复制核酸结构的载体以及掺入已将其引入的宿主细胞基因组中的载体。某些载体能够引导与它们操作性地连接的核酸的表达。此类载体在本文中称为“表达载体”。载体包括病毒载体,如逆转录病毒(例如,γ逆转录病毒和慢病毒)载体。
[0378]
术语“宿主细胞”、“宿主细胞系”和“宿主细胞培养物”可互换使用,并且是指已引入外源核酸的细胞,包括此类细胞的后代。宿主细胞包括“转化体”和“转化细胞”,其包括原代转化细胞和源自其的后代,不考虑传代次数。后代的核酸含量可能与亲代细胞不完全相同,但可能含有突变。本文包括如在初始转化细胞中所筛选或选择的具有相同功能或生物活性的突变体后代。
[0379]
如本文所用,细胞或细胞群体针对特定标记物呈“阳性”的陈述是指,特定标记物(通常是表面标记物)在细胞上或细胞中的可检测存在。当提及表面标记物时,所述术语是指如通过流式细胞术检测到的,表面表达的存在,例如通过用与所述标记物特异性结合的抗体进行染色并检测所述抗体,其中所述染色通过流式细胞术以如下水平是可检测的,所述水平基本上高于在其他方面相同的条件下用同种型匹配对照进行相同程序检测到的染色,和/或所述水平基本上与已知对所述标记物呈阳性的细胞的水平相似,和/或所述水平基本上高于已知对所述标记物呈阴性的细胞的水平。
[0380]
如本文所用,细胞或细胞群体对特定标记物呈“阴性”的陈述是指,特定标记物(通常是表面标记物)在细胞上或细胞中不存在基本上可检测的存在。当提及表面标记物时,所述术语是指如通过流式细胞术检测到的,表面表达的不存在,例如通过用与所述标记物特异性结合的抗体进行染色并检测所述抗体,其中所述染色通过流式细胞术以如下水平没有检测到,所述水平基本上高于在其他方面相同的条件下用同种型匹配对照进行相同程序检测到的染色,和/或所述水平基本上低于已知对所述标记物呈阳性的细胞的水平,和/或所述水平与已知对所述标记物呈阴性的细胞的水平相比是基本上相似的。
[0381]
如本文所用,在关于氨基酸序列(参考多肽序列)使用时,“氨基酸序列同一性百分比(%)”和“同一性百分比”定义为,在比对序列并在必要时引入空位以实现最大序列同一性百分比并且不将任何保守取代视作序列同一性的一部分之后,候选序列(例如,主题抗体或片段)中与参考多肽序列中的氨基酸残基相同的氨基酸残基的百分比。用于确定氨基酸序列同一性百分比的比对可以以本领域熟知的多种方式来实现,例如,使用公众可获得的计算机软件,如blast、blast-2、align或megalign(dnastar)软件。本领域技术人员可以确定用于比对序列的适当参数,包括在所比较序列的全长中实现最大比对所需的任何算法。
[0382]
氨基酸取代可以包括用另一种氨基酸替代多肽中的一个氨基酸。所述取代可以是
保守氨基酸取代或非保守氨基酸取代。可以将氨基酸取代引入感兴趣的结合分子(例如抗体)、和针对所希望的活性(例如保留/改进的抗原结合、降低的免疫原性或改进的adcc或cdc)筛选的产物中。
[0383]
通常可以根据以下常见的侧链特性将氨基酸进行分组:(1)疏水性:正亮氨酸、met、ala、val、leu、ile;(2)中性亲水性:cys、ser、thr、asn、gln;(3)酸性:asp、glu;(4)碱性:his、lys、arg;(5)影响链取向的残基:gly、pro;(6)芳香族的:trp、tyr、phe。
[0384]
在一些实施方案中,保守取代可能涉及将这些类别之一的成员交换为同一类别的另一个成员。在一些实施方案中,非保守氨基酸取代可能涉及将这些类别之一的成员交换为另一个类别。
[0385]
如本文所用,组合物是指两种或更多种产物、物质或化合物(包括细胞)的任何混合物。其可以是溶液、悬浮液、液体、粉末、糊剂、水性、非水性或其任何组合。
[0386]
如本文所用,“受试者”是哺乳动物,如人或其他动物,并且通常是人。
[0387]
除非另有定义,否则本文使用的所有技术术语、符号以及其他技术和科学术语或用辞意图具有与所要求保护的主题所属领域的普通技术人员通常理解的含义相同的含义。在一些情形中,为了清楚和/或为了便于引用而在本文中定义具有通常理解的含义的术语,并且本文中包含此类定义不一定应当被解释为代表与本领域通常所理解的含义有实质性差异。v.示例性实施方案
[0388]
所提供的实施方案包括:1.一种将t细胞分类的方法,所述方法包括:接收与包含t细胞的细胞群体的第一t细胞相关的图像数据;从所述图像数据确定一个或多个输入特征,所述一个或多个输入特征包括所述图像数据的形态特征、所述图像数据的光学特征、所述图像数据的强度特征、所述图像数据的相位特征、所述图像数据的系统特征或其任何组合;将所述一个或多个输入特征作为输入应用到被配置为基于所述一个或多个输入特征将所述第一t细胞分类为属于第一组或第二组的过程。2.一种方法,所述方法包括:接收与包含t细胞的细胞群体的第一t细胞相关的图像数据;确定所述第一t细胞属于第一组或第二组的分类;从所述图像数据确定一个或多个输入特征,所述一个或多个输入特征包括所述图像数据的形态特征、所述图像数据的光学特征、所述图像数据的强度特征、所述图像数据的相位特征、所述图像数据的系统特征或其任何组合,以及生成具有一个或多个维度的特征图,其中所述一个或多个维度的每个维度与所述图像数据的形态特征、所述图像数据的光学特征、所述图像数据的强度特征、所述图像数据的相位特征、所述图像数据的系统特征或其任何组合中的一个或多个相关;
基于所述特征图和所确定的分类训练卷积神经网络。3.根据实施方案1所述的方法,其中:所述过程包括应用使用根据实施方案2所述的方法训练的卷积神经网络;并且将从与所述第一t细胞相关的图像数据确定的所述一个或多个输入特征作为输入应用到所述过程包括将所述一个或多个输入特征应用到所述卷积神经网络。4.一种将t细胞分类的方法,所述方法包括:接收与包含t细胞的细胞群体的第一t细胞相关的图像数据;从所述图像数据确定一个或多个输入特征,所述一个或多个输入特征包括所述图像数据的形态特征、所述图像数据的光学特征、所述图像数据的强度特征、所述图像数据的相位特征、所述图像数据的系统特征或其任何组合;将所述一个或多个输入特征作为输入应用到过程,所述过程包括在从与已知属于第一组的t细胞和已知属于第二组的t细胞相关的图像数据确定的一个或多个输入特征上训练的卷积神经网络,所述一个或多个输入特征包括所述图像数据的形态特征、所述图像数据的光学特征、所述图像数据的强度特征、所述图像数据的相位特征、所述图像数据的系统特征或其任何组合,从而将所述第一t细胞分类为属于所述第一组或所述第二组。5.一种方法,所述方法包括:接收与包含t细胞的细胞群体的第一t细胞相关的图像数据;确定所述第一t细胞属于第一组或第二组的分类;从所述图像数据确定一个或多个输入特征,所述一个或多个输入特征包括所述图像数据的形态特征、所述图像数据的光学特征、所述图像数据的强度特征、所述图像数据的相位特征、所述图像数据的系统特征或其任何组合;在所述输入特征和所确定的分类上训练神经网络。6.根据实施方案1所述的方法,其中:所述过程包括应用使用根据实施方案5所述的方法训练的神经网络;并且将从与所述第一t细胞相关的图像数据确定的所述一个或多个输入特征作为输入应用到所述过程包括将所述一个或多个输入特征应用到所述神经网络。7.一种将t细胞分类的方法,所述方法包括:接收与包含t细胞的细胞群体的第一t细胞相关的图像数据;从所述图像数据确定一个或多个输入特征,所述一个或多个输入特征包括所述图像数据的形态特征、所述图像数据的光学特征、所述图像数据的强度特征、所述图像数据的相位特征、所述图像数据的系统特征或其任何组合;将所述一个或多个输入特征作为输入应用到过程,所述过程包括在从与已知属于第一组的t细胞和已知属于第二组的t细胞相关的图像数据确定的一个或多个输入特征上训练的神经网络,所述一个或多个输入特征包括所述图像数据的形态特征、所述图像数据的光学特征、所述图像数据的强度特征、所述图像数据的相位特征、所述图像数据的系统特征或其任何组合,从而将所述第一t细胞分类为属于所述第一组或所述第二组。8.一种方法,所述方法包括:接收与包含t细胞的细胞群体的第一t细胞相关的图像数据;确定所述第一t细胞属于第一组或第二组的分类;以及
确定用于支持向量机的超平面,所述超平面指示在所述第一组与所述第二组之间的决策边界,其中所述超平面是基于从所述图像数据确定的一个或多个输入特征确定的,所述一个或多个输入特征包括所述图像数据的形态特征、所述图像数据的光学特征、所述图像数据的强度特征、所述图像数据的相位特征、所述图像数据的系统特征或其任何组合。9.根据实施方案1所述的方法,其中:所述过程包括利用使用根据实施方案8所述的方法确定的超平面应用支持向量机;并且将从与所述第一t细胞相关的图像数据确定的所述一个或多个输入特征作为输入应用到所述过程包括将所述一个或多个输入特征应用到所述支持向量机。10.一种将t细胞分类的方法,所述方法包括:接收与包含t细胞的细胞群体的第一t细胞相关的图像数据;从所述图像数据确定一个或多个输入特征,所述一个或多个输入特征包括所述图像数据的形态特征、所述图像数据的光学特征、所述图像数据的强度特征、所述图像数据的相位特征、所述图像数据的系统特征或其任何组合;将所述一个或多个输入特征作为输入应用到过程,所述过程包括在从与已知属于第一组的t细胞和已知属于第二组的t细胞相关的图像数据确定的一个或多个输入特征上训练的支持向量机,所述一个或多个输入特征包括所述图像数据的形态特征、所述图像数据的光学特征、所述图像数据的强度特征、所述图像数据的相位特征、所述图像数据的系统特征或其任何组合,从而将所述第一t细胞分类为属于所述第一组或所述第二组。11.一种方法,所述方法包括:接收与包含t细胞的细胞群体的第一t细胞相关的图像数据;确定所述第一t细胞属于第一组或第二组的分类;以及确定用于分类过程的随机森林,所述随机森林包括一个或多个决策树,所述分类过程将从与所述第一t细胞相关的图像数据确定的一个或多个输入特征与所述第一t细胞属于所述第一组或属于所述第二组的分类相关联,其中所述一个或多个决策树中的决策树是基于所述一个或多个输入特征确定的,所述一个或多个输入特征包括所述图像数据的形态特征、所述图像数据的光学特征、所述图像数据的强度特征、所述图像数据的相位特征、所述图像数据的系统特征或其任何组合。12.根据实施方案1所述的方法,其中:所述过程包括使用根据实施方案11所述的方法确定的随机森林;并且将从与所述第一t细胞的图像相关的图像数据确定的所述一个或多个输入特征作为输入应用到所述过程包括将所述一个或多个输入特征应用到所述随机森林。13.一种将t细胞分类的方法,所述方法包括:接收与包含t细胞的细胞群体的第一t细胞相关的图像数据;从所述图像数据确定一个或多个输入特征,所述一个或多个输入特征包括所述图像数据的形态特征、所述图像数据的光学特征、所述图像数据的强度特征、所述图像数据的相位特征、所述图像数据的系统特征或其任何组合;将所述一个或多个输入特征作为输入应用到过程,所述过程包括涉及从与已知属
于第一组的t细胞和已知属于第二组的t细胞相关的图像数据确定的一个或多个输入特征的随机森林分类过程,所述一个或多个输入特征包括所述图像数据的形态特征、所述图像数据的光学特征、所述图像数据的强度特征、所述图像数据的相位特征、所述图像数据的系统特征或其任何组合,从而将所述第一t细胞分类为属于所述第一组或所述第二组。14.一种方法,所述方法包括:接收与包含t细胞的细胞群体的第一t细胞相关的图像数据,所述图像数据包括相位图像数据、强度图像数据和叠加图像数据中的一个或多个;确定所述第一t细胞属于第一组或第二组的分类;从所述图像数据生成具有一个或多个维度的特征图;基于所述特征图和所确定的分类训练卷积神经网络。15.一种将t细胞分类的方法,所述方法包括:接收与包含t细胞的细胞群体的第一t细胞相关的图像数据,其中所述图像数据包括相位图像数据、强度图像数据和叠加图像数据中的一个或多个;将图像数据作为输入应用到过程,所述过程包括在与已知属于第一组的t细胞和已知属于第二组的t细胞相关的图像数据上训练的卷积神经网络,其中所述图像包括图像数据,所述图像数据包括相位图像数据、强度图像数据和叠加图像数据中的一个或多个,从而将所述第一t细胞分类为属于所述第一组或所述第二组。16.根据实施方案1、3、4、6、7、9、10和12-15中任一项所述的方法,其中所述过程被配置为将包含t细胞的细胞群体中约或至少70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的t细胞分类为属于所述第一组或属于所述第二组。17.一种生成用于训练机器学习模型的细胞数据集的方法,所述方法包括:(a)提供包含至少第一和第二不同细胞类型的混合细胞群体,其中至少所述第一细胞类型表达不被所述混合细胞群体中的其他细胞类型表达的至少一种表面分子;(b)使所述混合细胞群体与可逆地结合至多个第一结合剂的第一多聚化试剂接触,所述第一结合剂中的每一个包含能够结合由所述第一细胞类型表达的表面分子的单价结合位点;以及(c)通过基于免疫亲和力的色谱法分离与所述第一结合剂结合的第一细胞类型的一个或多个细胞,从而获得第一细胞数据集,其中所述分离是在可逆地从所述第一结合剂解离所述第一多聚化试剂的条件下进行的;其中所述第一细胞数据集基本上不含所述第一多聚化试剂和所述第一结合剂。18.根据实施方案17所述的方法,其中所述至少一种第一细胞类型表达重组表面分子。19.根据实施方案18所述的方法,其中所述重组表面分子是重组受体。20.根据实施方案19所述的方法,其中所述重组受体是嵌合抗原受体或t细胞受体。21.根据实施方案17-20中任一项所述的方法,其中在(c)之前,所述方法产生不与所述第一结合剂结合的第二细胞群体,所述第二细胞群体包含不表达由所述第一细胞类型表达的表面分子的细胞,从而获得第二细胞数据集。
22.根据实施方案17-21中任一项所述的方法,其中所述第一细胞类型和所述第二细胞类型中的每一种表达不被所述混合细胞群体中的其他细胞类型表达的至少一种表面分子。23.根据实施方案17-22中任一项所述的方法,所述方法进一步包括:(d)使所述混合细胞群体与可逆地结合至多个第二结合剂的第二多聚化试剂接触,所述第二结合剂中的每一个包含能够结合由所述第二细胞类型表达的表面分子的单价结合位点;以及(e)通过基于免疫亲和力的色谱法分离与所述第二结合剂结合的第二细胞类型的一个或多个细胞,从而获得第二细胞数据集,其中所述分离是在可逆地从所述第二结合剂解离所述第二多聚化试剂的条件下进行的;其中所述第二细胞数据集基本上不含所述第二多聚化试剂和所述第二结合剂。24.根据实施方案23所述的方法,其中所述混合细胞群体进一步包含第三细胞类型,所述第三细胞类型表达不被所述混合细胞群体中的其他细胞类型表达的至少一种表面分子,并且所述方法进一步包括:(f)使所述混合细胞群体与可逆地结合至多个第三结合剂的第三多聚化试剂接触,所述第三结合剂中的每一个包含能够结合由所述第三细胞类型表达的表面分子的单价结合位点;以及(e)通过基于免疫亲和力的色谱法分离与所述第三结合剂结合的第三细胞类型的一个或多个细胞,从而获得第三细胞数据集,其中所述分离是在可逆地从所述第三结合剂解离所述第三多聚化试剂的条件下进行的;其中所述第三细胞数据集基本上不含所述第三多聚化试剂和所述第三结合剂。25.根据实施方案17-23中任一项所述的方法,对一种或多种另外的不同细胞类型重复所述方法。26.根据实施方案17-22中任一项所述的方法,其中在(c)之前,所述方法产生不与所述第一结合剂结合的第二细胞群体,所述第二细胞群体包含不表达由所述第一细胞类型表达的表面分子的细胞,并且所述方法进一步包括:(d)使所述第二细胞群体与可逆地结合至多个第二结合剂的第二多聚化试剂接触,所述第二结合剂中的每一个包含能够结合由所述第二细胞类型表达的表面分子的单价结合位点;以及(e)通过基于免疫亲和力的色谱法分离与所述第二结合剂结合的第二细胞类型的一个或多个细胞,从而获得第二细胞数据集,其中所述分离是在可逆地从所述第二结合剂解离所述第二多聚化试剂的条件下进行的;其中所述第二细胞数据集基本上不含所述第二多聚化试剂和所述第二结合剂。27.根据实施方案26所述的方法,其中在(e)之前,所述方法产生不与所述第二结合剂结合的第三细胞群体,所述第三细胞群体包含不表达由所述第一细胞类型和所述第二细胞类型表达的表面分子的细胞,并且所述方法进一步包括:(d)使所述第三细胞群体与可逆地结合至多个第三结合剂的第三多聚化试剂接触,所述第三结合剂中的每一个包含能够结合由所述第三细胞类型表达的表面分子的单价结合位点;以及
(e)通过基于免疫亲和力的色谱法分离与所述第三结合剂结合的第三细胞类型的一个或多个细胞,从而获得第三细胞数据集,其中所述分离是在可逆地从所述第三结合剂解离所述第三多聚化试剂的条件下进行的;其中所述第三细胞数据集基本上不含所述第三多聚化试剂和所述第三结合剂。28.根据实施方案17-22、26和27中任一项所述的方法,对一种或多种另外的不同细胞类型重复所述方法。29.根据实施方案17-28中任一项所述的方法,其中所述第一细胞类型和所述第二细胞类型是(i)cd4 t细胞和(ii)cd8 t细胞中的一种,并且所述第二细胞类型是(i)cd4 t细胞和(ii)cd8 t细胞中的另一种。30.根据实施方案17-29中任一项所述的方法,其中所述接触是通过将所述细胞添加至包含固定相的色谱柱进行的,在所述固定相上固定有与所述结合剂可逆地结合的多聚化试剂(例如,与所述第一结合剂可逆地结合的第一多聚化试剂、与所述第二结合剂可逆地结合的第二多聚化试剂或与所述第三结合剂可逆地结合的第三多聚化试剂)。31.根据实施方案17-30中任一项所述的方法,其中所述分离包括从所述色谱柱洗脱所述细胞。32.根据实施方案17-31中任一项所述的方法,其中所述第一结合剂进一步包含能够与所述第一多聚化试剂形成可逆键的结合配偶体,其中:所述结合配偶体包含seq id no:6、7、8、9或10所示的氨基酸序列;并且所述第一多聚化试剂包括链霉亲和素、链霉亲和素突变蛋白、亲和素或亲和素突变蛋白。33.根据实施方案23-32中任一项所述的方法,其中所述第二结合剂进一步包含能够与所述第二多聚化试剂形成可逆键的结合配偶体,其中:所述结合配偶体包含seq id no:6、7、8、9或10所示的氨基酸序列;并且所述第二多聚化试剂包括链霉亲和素、链霉亲和素突变蛋白、亲和素或亲和素突变蛋白。34.根据实施方案24-33中任一项所述的方法,其中所述第三结合剂进一步包含能够与所述第三多聚化试剂形成可逆键的结合配偶体,其中:所述结合配偶体包含seq id no:6、7、8、9或10所示的氨基酸序列;并且所述第三多聚化试剂包括链霉亲和素、链霉亲和素突变蛋白、亲和素或亲和素突变蛋白。35.根据实施方案32-34中任一项所述的方法,其中所述链霉亲和素突变蛋白包含seq id no:12、13、15或16所示的氨基酸序列。36.根据实施方案17-35中任一项所述的方法,其中所述可逆键具有在约10-2
至约10-13
m范围内的解离常数(kd)。37.根据实施方案17-36中任一项所述的方法,其中所述单价结合位点是fab片段、sdab、fv片段或单链fv片段。38.根据实施方案17-37中任一项所述的方法,其中在所述单价结合位点与所述表面分子之间的键具有在约10-3
至约10-7
m范围内的解离常数(kd)。39.根据实施方案17-37中任一项所述的方法,其中在所述单价结合位点与所述表
面分子之间的键具有约3x10-5
sec-1
或更大的解离速率常数。40.根据实施方案17-39中任一项所述的方法,其中所述可逆解离包括添加竞争试剂。41.根据实施方案40所述的方法,其中所述竞争试剂是生物素或生物素类似物。42.根据实施方案17-41中任一项所述的方法,所述方法进一步包括:接收与所述第一细胞数据集的细胞相关的图像数据,所述图像数据包括相位图像数据、强度图像数据和叠加图像数据中的一个或多个。43.根据实施方案18-42中任一项所述的方法,所述方法进一步包括:接收与所述第二细胞数据集的细胞相关的图像数据,所述图像数据包括相位图像数据、强度图像数据和叠加图像数据中的一个或多个。44.根据实施方案26-43中任一项所述的方法,所述方法进一步包括:接收与所述第三细胞数据集的细胞相关的图像数据,所述图像数据包括相位图像数据、强度图像数据和叠加图像数据中的一个或多个。45.根据实施方案17-44中任一项所述的方法,所述方法进一步包括:接收与所述第一细胞数据集的细胞相关的图像数据;从所述图像数据确定一个或多个输入特征,所述一个或多个输入特征包括所述图像数据的形态特征、所述图像数据的光学特征、所述图像数据的强度特征、所述图像数据的相位特征、所述图像数据的系统特征或其任何组合。46.根据实施方案18-45中任一项所述的方法,所述方法进一步包括:接收与所述第二细胞数据集的细胞相关的图像数据;从所述图像数据确定一个或多个输入特征,所述一个或多个输入特征包括所述图像数据的形态特征、所述图像数据的光学特征、所述图像数据的强度特征、所述图像数据的相位特征、所述图像数据的系统特征或其任何组合。47.根据实施方案23-46中任一项所述的方法,所述方法进一步包括:接收与所述第三细胞数据集的细胞相关的图像数据;从所述图像数据确定一个或多个输入特征,所述一个或多个输入特征包括所述图像数据的形态特征、所述图像数据的光学特征、所述图像数据的强度特征、所述图像数据的相位特征、所述图像数据的系统特征或其任何组合。48.根据实施方案42、43或44中任一项所述的方法,所述方法进一步包括从所述图像数据生成具有一个或多个维度的特征图;基于所述特征图训练卷积神经网络。50.根据实施方案45、46或47中任一项所述的方法,所述方法进一步包括在所述输入特征上训练神经网络。51.根据实施方案45、46或47中任一项所述的方法,所述方法进一步包括确定与支持向量机相关的超平面,所述确定基于所述一个或多个输入特征。52.根据实施方案45、46或47中任一项所述的方法,所述方法进一步包括确定随机森林的一个或多个决策树,所述确定基于所述一个或多个输入特征。53.根据实施方案2、5、8、11和14中任一项所述的方法,其中图像数据是从包含t细胞的细胞群体的约或至少70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、
97%、98%、99%或100%的t细胞接收的。54.根据实施方案1-16和53中任一项所述的方法,其中所述图像数据包括相位图像数据、强度图像数据和叠加图像数据中的一个或多个。55.根据实施方案1-16和42-54中任一项所述的方法,其中所述图像数据是使用差分数字全息显微术(ddhm)获得的。56.根据实施方案1-16和42-55中任一项所述的方法,其中所述图像数据是使用约20x的物镜获得的。57.根据实施方案1-16和42-56中任一项所述的方法,其中所述图像数据是使用ccd相机获得的。58.根据实施方案15所述的方法,其中与所述t细胞相关的图像数据用于确定一个或多个输入特征,所述一个或多个输入特征包括所述图像数据的形态特征、所述图像数据的光学特征、所述图像数据的强度特征、所述图像数据的相位特征、所述图像数据的系统特征或其任何组合。59.根据实施方案1-14、16、45-47和50-58中任一项所述的方法,其中所述一个或多个输入特征包括以下中的一个或多个:所述细胞的纵横比、细胞深度、细胞的面积、细胞描述符、细胞标识符、图像标识符、对象标识符、沿x轴的质量中心、沿y轴的质量中心、所述细胞的圆度、所述细胞的紧密度、归一化纵横比、所述细胞的伸长率、所述细胞的直径、峰直径、hu不变矩1、hu不变矩2、hu不变矩3、hu不变矩4、hu不变矩5、hu不变矩6、hu不变矩7、平均强度对比度、平均熵、平均强度、平均强度均匀性、所述细胞的图像的强度对比度、所述细胞的图像的强度相关性、所述细胞的图像的强度熵、所述细胞的图像的强度同质性、所述细胞的最大强度、所述细胞的平均强度、所述细胞的最小强度、所述细胞的图像的强度偏斜度、所述细胞的图像的强度平滑度、所述细胞的图像的强度方差、所述细胞的图像的强度同质性、所述细胞的强度最大的平面、细胞位于视场边界的指示、折射峰位于视场边界的指示、所述细胞的质量偏心率、以弧度计的所述细胞的最大光学高度、以微米计的所述细胞的最大光学高度、以弧度计的所述细胞的平均光学高度、以微米计的所述细胞的平均光学高度、所述细胞的归一化光学高度、以弧度计的所述细胞的最小光学高度、以微米计的所述细胞的最小光学高度、以弧度计的所述细胞的图像相位的光学高度的方差、以微米计的所述细胞的图像相位的光学高度的方差、所述细胞的光学体积、所述细胞的折射峰面积、通过所述细胞的面积归一化的折射峰面积、所述细胞的折射峰数量、所述细胞的折射峰强度、所述细胞的归一化折射峰高度、周长、所述细胞的相位图像的平均强度对比度、所述细胞的相位图像的平均熵、所述细胞的平均相位、所述细胞的平均相位均匀性、所述细胞的相位强度对比度、所述细胞的相位相关性、所述细胞的相位熵特征、所述细胞的相位同质性、所述细胞的相位偏斜度、所述细胞的相位平滑度、所述细胞的相位均匀性、所述细胞的半径的平均值、所述细胞的半径的方差以及所述细胞的归一化半径方差。60.根据实施方案1-14、16、45-47和50-59中任一项所述的方法,其中所述输入特征包括约或至少70、65、60、55、50、45、40、35、30、25、20、15、10、9、8、7、6、5、4、3、2或1个输入特征。61.根据实施方案1-14、16、45-47和50-60中任一项所述的方法,其中所述输入特征包括约1至约70、约1至约60、约1至约50、约1至约40、约1至约30、约1至约20、约1至约15、
约1至约10或约1至约5个输入特征。62.根据实施方案1-14、16、45-47和50-61中任一项所述的方法,其中所述输入特征包括少于或少于约70、65、60、55、50、45、40、35、30、25、20、15、10或5个输入特征。63.根据实施方案1-14、16、45-47和50-62中任一项所述的方法,其中所述输入特征包括少于或少于约20、15、10或5个输入特征。64.根据实施方案1-14、16、45-47和50-63中任一项所述的方法,其中所述一个或多个输入特征是所述图像数据的形态特征,所述形态特征选自以下中的一个或多个:所述细胞的纵横比、所述细胞的面积、所述细胞的圆度、所述细胞的紧密度、归一化纵横比、所述细胞的伸长率、所述细胞的直径、hu不变矩1、hu不变矩2、hu不变矩3、hu不变矩4、hu不变矩5、hu不变矩6、hu不变矩7、周长、所述细胞的半径的平均值、所述细胞的半径的方差和归一化半径方差。65.根据实施方案1-14、16、45-47和50-64中任一项所述的方法,其中所述一个或多个输入特征是所述细胞的面积。66.根据实施方案1-14、16、45-47和50-65中任一项所述的方法,其中所述一个或多个输入特征是所述图像数据的光学特征,所述光学特征选自以下中的一个或多个:所述细胞的直径、所述细胞的最大强度、所述细胞的平均强度、所述细胞的最小强度、所述细胞的质量偏心率、以弧度计的所述细胞的最大光学高度、以微米计的所述细胞的最大光学高度、以弧度计的所述细胞的平均光学高度、以微米计的所述细胞的平均光学高度、所述细胞的归一化光学高度、以弧度计的所述细胞的最小光学高度、以微米计的所述细胞的最小光学高度、所述细胞的光学体积、所述细胞的折射峰面积、通过所述细胞的面积归一化的折射峰面积、所述细胞的折射峰数量、所述细胞的折射峰强度和所述细胞的归一化折射峰高度。67.根据实施方案1-14、16、45-47和50-66中任一项所述的方法,其中所述输入特征中的一个或多个是所述图像数据的强度特征,所述强度特征选自以下中的一个或多个:平均强度对比度、平均熵、平均强度、平均强度均匀性、所述细胞的图像的强度对比度、所述细胞的图像的强度相关性、所述细胞的图像的强度熵、所述细胞的图像的强度同质性、所述细胞的图像的强度偏斜度、所述细胞的图像的强度平滑度、所述细胞的图像的强度方差、所述细胞的强度最大的平面和所述细胞的图像的强度均匀性。68.根据实施方案1-14、16、45-47和50-67中任一项所述的方法,其中所述一个或多个输入特征是所述图像数据的相位特征,所述相位特征选自以下中的一个或多个:以弧度计的所述细胞的图像相位的光学高度的方差、以微米计的所述细胞的图像相位的光学高度的方差、所述细胞的相位图像的平均强度对比度、所述细胞的相位图像的平均熵、所述细胞的平均相位、所述细胞的平均相位均匀性、所述细胞的相位强度对比度、所述细胞的相位相关性、所述细胞的相位熵特征、所述细胞的相位同质性、细胞的相位偏斜度、细胞的相位平滑度和所述细胞的相位均匀性。69.根据实施方案1-14、16、45-47和50-58中任一项所述的方法,其中所述一个或多个输入特征是或包括所述细胞的相位相关性。70.根据实施方案1-14、16、45-47和50-69中任一项所述的方法,其中所述一个或多个输入是所述图像数据的系统特征,所述系统特征选自以下中的一个或多个:细胞深度、鉴定的细胞、图像标识符、细胞描述符、沿x轴的质量中心、沿y轴的质量中心、对象标识符、
细胞位于视场边界的指示和折射峰位于视场边界的指示。71.根据实施方案1-14、16、45-47和50-70中任一项所述的方法,其中所述一个或多个输入特征是或包括细胞深度。72.根据实施方案1-16和53-71中任一项所述的方法,其中所述第一组和第二组通过选自以下的一种或多种细胞属性来定义:活的、死的、cd4 、cd8 、重组受体阳性或重组受体阴性,其中所述第一组和第二组包含至少一种不同的属性。73.根据实施方案1-16和53-72中任一项所述的方法,其中所述第一组或第二组中的一个包含属性活的并且另一组包含属性死的。74.根据实施方案72或实施方案73所述的方法,其中所述属性死的包括非活细胞和碎片。75.根据实施方案72或实施方案73所述的方法,其中所述属性活的包括单个活细胞或活细胞集群。76.根据实施方案1-16、45-47和50-75中任一项所述的方法,其中所述一个或多个输入特征包括所述细胞的相位相关性、所述细胞的面积、所述细胞的折射峰数量、细胞的相位偏斜度、峰直径、通过所述细胞的面积归一化的折射峰面积、所述细胞的半径的方差、所述细胞的图像的强度均匀性、所述细胞的紧密度、所述细胞的相位强度对比度、归一化半径方差和所述细胞的圆度。77.根据实施方案1-16、45-47和50-76中任一项所述的方法,其中所述一个或多个输入特征包括所述细胞的相位相关性。78.根据实施方案1-16、45-47和50-77中任一项所述的方法,其中所述一个或多个输入特征包括所述细胞的面积。79.根据实施方案1-16和53-72中任一项所述的方法,其中所述第一组或第二组中的一个包含属性cd4 并且另一组包含属性cd8 。80.根据实施方案1-16、45-47、50-72和79中任一项所述的方法,其中所述一个或多个输入特征包括所述细胞的平均相位均匀性、峰直径、所述细胞的归一化折射峰高度、所述细胞的平均相位、通过所述细胞的面积归一化的折射峰面积、以微米计的所述细胞的最小光学高度、所述细胞的紧密度、所述细胞的圆度、细胞的相位平滑度、所述细胞的图像的强度同质性、所述细胞的强度最大的平面、所述细胞的折射峰面积、所述细胞的相位相关性、细胞深度、细胞的图像的强度对比度、所述细胞的图像的强度均匀性、归一化半径方差、所述细胞的图像的强度平滑度、所述细胞的相位强度对比度、所述细胞的最大光学高度、所述细胞的平均强度对比度、所述细胞的平均强度均匀性、所述细胞的图像的强度偏斜度、hu不变矩1、所述细胞的图像的强度方差、平均熵和所述细胞的图像的强度相关性。81.根据实施方案1-16、45-47、50-72、79和80中任一项所述的方法,其中所述一个或多个输入特征包括细胞深度、所述细胞的图像的强度对比度、所述细胞的图像的强度均匀性、归一化半径方差、所述细胞的图像的强度平滑度、所述细胞的相位强度对比度、以微米计的所述细胞的最大光学高度、所述细胞的平均强度对比度、所述细胞的平均强度均匀性、所述细胞的图像的强度偏斜度、hu不变矩1、所述细胞的图像的强度方差、平均熵和所述细胞的图像的强度相关性。82.根据实施方案1-16、45-47、50-72和79-81中任一项所述的方法,其中所述一个
或多个输入特征包括细胞深度。83.根据实施方案1-16、45-47、50-72、79和80中任一项所述的方法,其中所述一个或多个输入特征包括所述细胞的平均相位均匀性、峰直径、所述细胞的归一化折射峰高度、所述细胞的平均相位、通过所述细胞的面积归一化的折射峰面积、以微米计的所述细胞的最小光学高度、所述细胞的紧密度、所述细胞的圆度、细胞的相位平滑度、所述细胞的图像的强度同质性、所述细胞的强度最大的平面、所述细胞的折射峰面积和所述细胞的相位相关性。84.根据实施方案1-16和53-72中任一项所述的方法,其中所述第一组或第二组中的一个包含属性重组受体阳性并且另一组包含属性重组受体阴性。85.根据实施方案1-84中任一项所述的方法,其中所述包含t细胞的细胞群体包括从生物样品富集或纯化的t细胞群体或任选地通过混合从生物样品富集或纯化的t细胞群体获得的混合t细胞亚型群体。86.根据实施方案85所述的方法,其中所述生物样品包括全血样品、血沉棕黄层样品、外周血单个核细胞(pbmc)样品、未分级t细胞样品、淋巴细胞样品、白细胞样品、单采术产物或白细胞单采术产物。87.根据实施方案1-86中任一项所述的方法,其中所述包含t细胞的细胞群体包含从受试者获得的原代细胞。88.根据实施方案1-87中任一项所述的方法,其中所述包含t细胞的细胞群体包括用包含重组受体的载体转导的t细胞群体。89.根据实施方案1-88中任一项所述的方法,其中从中对一种或多种t细胞分类的t细胞群体包括经历制造以生成治疗性t细胞组合物的t细胞群体。90.根据实施方案89所述的方法,其中所述制造包括在用包含重组受体的载体转导所述t细胞群体之后的孵育步骤。91.根据实施方案72、84和88-90中任一项所述的方法,其中所述重组受体是嵌合抗原受体(car)。92.根据实施方案90或实施方案91所述的方法,其中包含t细胞的细胞群体的所述一种或多种t细胞是在所述孵育步骤期间的不同时间点进行分类。93.根据实施方案90或实施方案91所述的方法,其中包含t细胞的细胞群体的所述一种或多种t细胞是在所述孵育期的持续时间内进行连续分类。94.根据实施方案1-16和53-93中任一项所述的方法,其中将包含t细胞的细胞群体的所述一种或多种t细胞分类发生在封闭系统中。95.根据实施方案94所述的方法,其中所述封闭系统是无菌的。96.根据实施方案94或实施方案95所述的方法,其中所述封闭系统是自动化的。vi.实施例
[0389]
以下实施例仅出于说明性目的而被包括,并且不意图限制本发明的范围。实施例1:在用于生成工程化抗bcma car-t细胞的过程中的培育期间用于确定细胞活力和直径的连续在线成像
[0390]
使用在线差分数字全息显微术(dhm)获得了进行工程化以表达重组受体的过程中的t细胞的各种光学参数。差分dhm允许以用于对象分割的高对比度图像对细胞进行无标签
成像,并获得定量描述成像对象的多个光学或形态特征,例如以用于确定细胞计数、活力和形态特征(例如直径)。
[0391]
使用示例性工程化过程将来自健康人供体的原代t细胞工程化以表达抗bcma嵌合抗原受体(car),所述示例性工程化过程包括从样品单独地选择cd4 和cd8 t细胞,然后将所选择的细胞以规定的比率组合以用于后续处理步骤。从来自人白细胞单采术样品的分离的pbmc选择cd4 和cd8 细胞的单独组合物,并且将所选择的细胞组合物低温冷冻。随后将所选择的cd4 和cd8 t细胞组合物解冻,并以1:1的活cd4 t细胞与活cd8 t细胞的比率混合,然后进行刺激、转导和扩增步骤。在无血清培养基中存在重组il-2、il-7和il-15的情况下,将混合的cd4 /cd8 t细胞组合物在存在附着有抗cd3和抗cd28抗体的顺磁性聚苯乙烯包被的珠粒的情况下以1:1珠粒与细胞比率进行刺激。通过孵育将刺激进行18至30小时之间。通过旋转接种60分钟用编码抗bcma car的慢病毒载体转导细胞,随后在约37℃下孵育约18至30小时。所述car含有对bcma具有特异性的scfv抗原结合结构域、cd28跨膜区、4-1bb共刺激信号传导区和源自cd3-ζ的细胞内信号传导结构域。然后将转导的细胞通过转移到生物反应器(例如摇摆运动生物反应器)的无血清培养基中培育以进行扩增,所述无血清培养基含有的il-2、il-7和il-15浓度是孵育和转导步骤中所用浓度的两倍;并且将转导的细胞最初在稳定的摇摆条件(非灌注)下孵育,然后进行培育,所述培育包括使用半连续灌注和连续混合进行的培养基更换。在达到所需的阈值扩增后收获细胞。在收获后,通过暴露于磁场将抗cd3和抗cd28抗体缀合的珠粒从细胞组合物去除。然后配制细胞,将其等分至用于施用的冷冻袋(例如cryostore冷冻袋)和用于进一步分析的小瓶中,并低温冷冻。进行了七次实验运行(运行1-运行7)。
[0392]
在培养的长达大约120小时内使用在线差分dhm成像系统(“连续”),例如ovizio iline f(ovizio imaging systems nv/sa,布鲁塞尔,比利时)连续捕获细胞的全息图像和光学参数。在线差分dhm系统包括连接至生物反应器的一次性管路系统,使得样品可以从生物反应器流经管路系统,其中成像系统捕获行进穿过的细胞的全息图像和光学参数,并且使样品返回到生物反应器。从图像确定细胞活力、活细胞计数(vcc)和细胞直径。还将工程化细胞的活力与通过手动采样(“手动”)和使用自动化细胞计数器进行细胞计数(在培养的长达大约120小时内的各个时间点采样)的结果进行比较。基于时程分析和线性回归比较了这两种方法。
[0393]
图1a和图1b显示了使用通过差分dhm的连续监测或手动采样评估的在实验运行1(图1a)和运行2(图1b)中活细胞计数(vcc)、活力和细胞直径的比较。所有七次运行的比较的r2和斜率如下表e1所示。如使用这两种方法所测量的vcc的差异落在手动采样方法的预期方差之内。表e1.采样方法之间的比较的r2和斜率。
[0394]
结果表明,在连续监测和手动采样时的vcc和活力高度相关。连续监测与手动监测之间细胞直径的较低相关性可以通过连续监测期间采用的自动化聚焦步骤来解释。由于手动监测期间的手动图像聚焦步骤,因此在手动监测期间获得的细胞直径测量值可能根据操作员技术而变化。使用自动化图像聚焦消除了操作员偏差。此外,物镜的差异(对于手动为4x相比于对于连续为20x)可能会导致降低的相关性。此外,如手动采样所做的那样使用明场进行细胞分割可能由于细胞与图像背景之间的对比度差而导致细胞边界不清晰。通过连续监测期间使用的差分dhm产生的高对比度图像可以更能代表细胞直径。所述结果与在细胞工程化过程中的用于扩增细胞的培育期间通过差分dhm连续监测的效用一致。实施例2:在用于生成工程化抗cd19 car-t细胞的过程中的培育期间用于确定细胞活力和细胞直径的连续在线成像
[0395]
基本上如实施例1中所述进行差分dhm,不同之处在于在用于工程化car-t细胞的替代过程中的培育期间培养的长达约120小时内使用在线差分dhm成像系统(“连续”)例如ovizio iline f(ovizio imaging systems nv/sa,布鲁塞尔,比利时)连续捕获细胞的全息图像和光学参数。
[0396]
所述替代car-t细胞过程包括涉及使cd4 和cd8 群体单独进行处理步骤的过程。从分离自人白细胞单采术样品的pbmc选择cd4 和cd8 细胞的单独组合物并将其低温冷冻。随后将所选择的cd4 和cd8 组合物解冻,并分别经历刺激、转导和扩增的步骤。将解冻的cd4 和cd8 细胞分别在存在附着有抗cd3和抗cd28抗体的聚苯乙烯包被的顺磁珠的情况下以1:1珠粒与细胞的比率进行刺激。在含有il-2、il-15和n-乙酰半胱氨酸(nac)的培养基中刺激细胞。cd4 细胞培养基还包含il-7。引入所述珠粒之后,用编码相同抗cd19 car的慢病毒载体分别转导cd4 和cd8 细胞。car含有源自鼠抗体的抗cd19 scfv、免疫球蛋白间隔子、源自cd28的跨膜结构域、源自4-1bb的共刺激区和cd3-ζ细胞内信号传导结构域。所述载体还编码截短的受体,其用作car表达的替代标记物,所述替代标记物通过t2a序列连接至car构建体。在存在10μg/ml硫酸鱼精蛋白的情况下转导细胞。转导后,通过暴露于磁场将所述珠粒从所述细胞组合物去除。然后通过生物反应器(xuri w25生物反应器),在连续混合和氧气转移的情况下,分别培育cd4 和cd8 细胞以进行扩增。将泊洛沙姆添加到培养基中。在存在il-2和il-15的情况下培育两种细胞组合物。cd4 细胞培养基还包含il-7。在收获之前,将cd4 和cd8 细胞各自培育至约4倍扩增。分别收获、配制和低温冷冻来自每种组合物的细胞。
[0397]
进行了两个实验:实验1用来自两个不同健康供体(供体1或供体2)的cd4 细胞进行两次实验运行,以及实验2使用来自第三供体(供体3)的cd4 细胞和cd8 细胞中的每一种
进行实验运行。
[0398]
图2a-图2d显示了在来自实验1供体1(图2a)、实验1供体2(图2b)或实验2供体3(图2c)的cd4 细胞或者来自实验2供体3(图2d)的cd8 细胞中,使用通过差分dhm的连续监测或手动采样评估的活细胞计数(vcc)、活力和细胞直径的比较。比较的r2和斜率示于下表e2中。表e2.采样方法之间的比较的r2和斜率。
[0399]
结果显示,对于cd4 和cd8 细胞以及来自不同供体的细胞,作为连续监测和手动采样的vcc和活力高度相关。可以如实施例1中所述解释连续监测与手动监测之间细胞直径的较低相关性。所述结果与在细胞工程化过程中的用于扩增细胞的培育期间通过差分dhm连续监测的效用一致。实施例3:使用连续在线成像比较手动扩增和自动化扩增
[0400]
将通过在线成像和自动化灌注来连续监测细胞的完全自动化、无需操作员的细胞扩增方法与手动扩增方法进行比较。
[0401]
使用示例性工程化过程,将来自健康人供体的原代t细胞激活并用载体转导,以表达示例性嵌合抗原受体(car)。转导后,将细胞汇集并接种以进行两种不同的培养,一种是基于使用差分dhm的连续在线成像的自动化扩增,并且另一种是手动扩增方法。
[0402]
在自动化扩增培养中,在摇摆运动生物反应器中培育细胞,其中如实施例1中所述使用半连续灌注和连续混合进行培养基更换。大体上如以上实施例1中所述,使用自动化差分dhm成像系统监测细胞活力、活细胞计数(vcc)和细胞直径。对于两种培养,在接种时的初始vcc是相似的(对于自动化培养0.12x106个细胞/ml,对于手动培养为0.14x106个细胞/ml)。自动化扩增中的灌注是基于通过软件算法计算的vcc的四小时滚动平均值,其中所述方法的进展要求vcc平均值大于目标vcc。对于1个qs和2个灌注步骤,目标vcc为0.6x106个细胞/ml、1x106个细胞/ml和4x106个细胞/ml。接种后不发生另外的操作员干预。
[0403]
在手动扩增培养中,大体上如以上实施例1中所述进行灌注,每天进行一次采样。
[0404]
还通过流式细胞术评估细胞的细胞表面标记物表达。
[0405]
如图3中所示,使用自动化扩增系统观察到在培养中t细胞随时间的更高生长,如通过vcc所确定的。如通过连续差分dhm成像评估的细胞活力和如通过流式细胞术评估的细胞表型在自动化扩增过程与手动扩增过程之间相似。例如,自动化和手动系统产生几乎相同频率的cd3 、cd4 和cd8 细胞。总之,这些结果表明自动化扩增对t细胞生长动力学有积极影响,而细胞活力值仅有极小差异。
[0406]
所述结果与无需人操作员的用于在t细胞工程化过程期间培育和监测细胞的连续dhm成像和自动化扩增过程的效用一致。在一些方面,这种方法可以用于确定原代t细胞的生长动力学,并确定收获细胞以施用工程化的时间。
实施例4:用于预测细胞活力的机器学习方法
[0407]
使用与机器学习方法组合的在线差分数字全息显微术(ddhm)成像系统例如ovizio iline f(ovizio imaging systems nv/sa,布鲁塞尔,比利时)在用于产生用重组受体工程化的t细胞组合物的离体过程期间在t细胞上评估t细胞活力。
[0408]
大体上如以上实施例1中所述,将t细胞工程化的过程是通过从同一个健康供体单独分离cd4 和cd8 t细胞群体来进行的。然后将分离的cd4 和cd8 t细胞以1:1比率混合,然后用抗cd3/抗cd28抗体刺激。将混合的cd4 和cd8 t细胞接种到生物反应器中,并在制造过程的扩增步骤期间使用在线ddhm进行连续监测。
[0409]
为了比较,如以上所述的过程那样将cd4 和cd8 t细胞的单独群体从同一个健康供体分离出,但分别用抗cd3/抗cd28抗体刺激,用抗bcma car转导,并在用于扩增的条件下作为几乎纯的群体而不是混合群体接种。刺激、t转导、接种和扩增步骤的过程类似于用于混合群体的过程。将cd4 或cd8 t细胞接种到单独的生物反应器中,并在扩增步骤期间使用单独的在线ddhm进行连续监测。
[0410]
同时对来自同一个健康供体的细胞进行两次上述过程以用于在预测t细胞活力的方法中作为重复实验进行比较的目的。在扩增期的期间的5天过程中,通过在线自动化ddhm独立评估cd4 、cd8 和混合cd4/cd8 t细胞培养物,所述在线自动化ddhm捕获细胞的全息图像,来自其的对象图像(相位、强度和叠加)可以通过数值重建算法计算。每小时拍摄大约20张图像。根据失焦时细胞的峰值强度检测细胞。使用相位图像进行细胞图像分割(产生细胞周围的边界),从而根据强度阈值描绘细胞轮廓。然后对分割边界内的图像进行分析,并在单个细胞的基础上计算70个特征,包括形态(例如,直径圆度、聚集体大小等)、光学(例如,光学体积、聚集体大小等)、强度、相位和系统特征(例如,参见上文第i-b节)。提取的特征或原始图像用于机器学习方法中以检测细胞活力。a.用梯度提升的随机森林分类器进行活力预测
[0411]
将梯度提升的随机森林分类器(经由r中的“xgboost”包)应用到扩增步骤期间的细胞的特征。细胞包括来自混合群体的样品。
[0412]
被认为对于此任务不提供信息的特征包括例如细胞的边界指示(例如,细胞或细胞的折射峰是否位于图像中的边界)、细胞的质量中心(例如,质量中心坐标在图像中的x或y轴)并且从数据集中去除。因此,去除高度相关(皮尔逊系数》=0.97)和低方差(方差=0)特征,留下以下48个特征以用于分类:细胞的纵横比、细胞的面积(例如,表面积或投影表面积)、细胞的圆度(例如,细胞面积与细胞周长的比率)、细胞的紧密度(例如,细胞面积与细胞轴上对象的方差的比率)、细胞的归一化纵横比、细胞的伸长率(例如,包围细胞的矩形的宽度和高度的比率)、细胞的直径(例如,与细胞具有相同面积的圆的直径)、峰直径(例如,与细胞的折射峰具有相同面积的圆的直径)、hu不变矩1、hu不变矩2、hu不变矩3、细胞的平均强度对比度、细胞的平均强度熵、细胞的强度平均值、细胞表面上的强度均匀性的平均量度(例如,平均强度均匀性)、细胞图像的强度对比度、细胞图像的强度相关性(例如,图像中像素与相邻像素的强度之间的相关性)、细胞图像的强度同质性(例如,在对角线分布的空间接近度)、细胞的最小和最大强度、细胞图像的强度偏斜度(例如,强度的对称性)、细胞图像的强度平滑度(例如,平均平滑度)、细胞图像的强度方差(例如,细胞表面上的强度方差值)、细胞图像的强度均匀性(例如,在细胞表面上的强度均匀性的量度)、细胞的质量偏心
率(例如,细胞的几何中心与细胞的质量中心的中心之间的距离(如以像素计),通过光学高度加权)、细胞的最大、最小、平均、方差和归一化(例如,细胞的光学高度(例如,以微米计)除以细胞直径)光学高度(例如,以弧度计)、细胞的光学体积(例如,与细胞的体积及其折射指数成比例的值)、细胞的折射峰面积(例如,以微米计)、通过细胞面积归一化的折射峰面积(例如,峰面积除以例如细胞面积和平均强度的乘积)、细胞的折射峰数量、细胞的折射峰强度、细胞的归一化折射峰高度(例如,细胞的折射峰强度除以例如细胞表面和细胞平均强度的乘积)、细胞强度最大的平面(例如,以微米计)、细胞的相位图像的平均熵、细胞表面上的相位均匀性的平均量度(例如,细胞的平均相位均匀性)、细胞的相位强度对比度(例如,细胞的相位图像的强度对比度,例如,在细胞表面上的像素之间)、细胞的相位相关性(例如,细胞的相位图像中像素与其相邻像素相关性的量度)、细胞的相位同质性(例如,在细胞的相位图像中在对角线分布的空间接近度的量度)、细胞的相位偏斜度(例如,细胞的相位图像中不对称性的量度)、细胞的相位均匀性(例如,细胞表面上的相位均匀性的量度)以及细胞半径的方差或归一化方差。
[0413]
使用了默认的“xgboost”参数(eta=0.3;最大深度=6;γ=1)并应用了200个训练回合。对于全局评估,所述模型在来自混合细胞群体的随机选择的80%细胞上进行训练,并在其余20%上进行测试。
[0414]
分类器实现了如通过涉及光学成像的替代活力预测方法预测的“活”/“死”分类的》99%的平衡准确性,所述替代活力预测方法还通过机器学习方法使用从细胞图像(例如,全息图)提取的特征在测试数据上在每个细胞基础上预测活力。这包括与替代方法的预测相比“活”细胞的分类率差异为约0.13%且“死”细胞的分类率差异为约0.36%。
[0415]
每个特征在所有树分割上的总信息增益的默认“增益”量度用于评估特征重要性。图4显示了分类器预测细胞活力所用的特征的相对重要性。两个特征即相位相关性和细胞面积(其衡量相位图像中细胞表面的“平滑度”)以及细胞的总大小分别显现出对分类最为重要(图4)。
[0416]
由于许多特征的分布可能会随着接种时间的变化而改变,因此测试了随着时间的推移活力预测的准确性。对于每个时间点,去除训练集中的所有细胞特征,重新训练分类器,并针对用于移取的细胞的替代活力预测方法测试活细胞预测准确性。图5a-图5c显示了与替代活力预测方法相比,使用梯度提升的随机森林分类器在接种时间内预测的活力测量值的准确性。图5a显示了分类器相对于替代活力预测方法预测随接种时间变化的“活”/“死”分类的准确性。图5b显示了随时间而变的总体“活”百分比预测的比较(“实际值”:通过替代活力预测方法预测的百分比;“预测值”:通过随机森林分类器预测的百分比)。图5c显示了随机森林分类器与替代活力预测方法之间预测的相对差异。尽管随机森林分类器与替代活力预测方法相比的准确性随时间波动,但对于任何给定时间点,其变化不超过约2%(图5a)。此外,总vcc预测与替代活力预测方法保持一致,在所有时间点均《1%(图5b-图5c)。这些结果支持使用随机森林分类器从提取的特征预测细胞活力。b.经由将深度学习应用于原始图像进行细胞活力预测
[0417]
深度学习分类器用于使用由ddhm产生的原始图像预测对象分类(例如,活/死/集群/碎片)。
[0418]
原始图像包括“相位”(3-d全息)和光学图像,并且将深度学习方法应用于每个细
胞的双通道图像。使用大约200,000个细胞图像,每个图像的尺寸为48x48像素。将图像随机分成80%/20%,分别用于训练/测试。
[0419]
深度学习模型即三层卷积神经网络(cnn)应用了“elu”激活函数、批量归一化和每层之间的丢弃(dropout)、馈入最终的密集“softmax”分类层。自由参数的总数是在100,000数量级上。为了进行优化,将分类交叉熵损失函数与adagrad优化器结合使用,并使用64的批量大小对模型进行了优化。应用轻微的旋转、翻转和移位来补充训练数据。
[0420]
深度cnn模型在训练和测试数据上都达到了97.8%的准确性,概括了使用从细胞图像(例如,全息图)提取的特征预测活力的替代活力预测方法的对象类别(例如,活的、死的、碎片、集群)结果。因为类别(例如活的、死的、碎片和集群)在数据集中的表示并不相同(例如,数据集中的活细胞可能比死细胞多),因此评估每个类别的预测准确性更具代表性(参见表e3)。预测“碎片”的准确性最高,并且预测“集群”的准确性最低。
[0421]
表e3:来自使用cnn在原始iline f图像上的细胞对象分类的对于四个对象类别中每一个的准确性。活的死的碎片集群0.940.950.980.91
[0422]
对不同分类的对象的图像进行可视化显示,对一些对象类别的准确性稍低可能部分地由于在替代活力预测模型中的错误分类。错误分类的例子可以在图6a和图6b中看到。图6a显示了被替代活力预测模型分类为“活”但被深度学习模型分类为“死”的对象的两个图像。类似地,图6b显示了被替代活力预测模型分类为“集群”但显现为具有附属物的单独活t细胞的对象的两个图像。这些结果支持在原始图像上使用深度学习来准确地预测细胞活力。实施例5:用于预测t细胞亚型的机器学习方法
[0423]
使用与机器学习方法组合的在线差分数字全息显微术(ddhm)例如ovizio iline f(ovizio imaging systems nv/sa,布鲁塞尔,比利时)预测t细胞亚型(例如,cd4 或cd8 )。
[0424]
使用用于捕获培养的细胞的全息图像的ddhm对来自如实施例4中所述的用于产生工程化t细胞组合物的过程的t细胞(纯cd4或纯cd8)进行t细胞亚型评估,从所述全息图像可以在单个细胞基础上提取70个特征(参见例如,上文第i-b节)。在机器学习方法中使用提取的特征、其子集或原始图像来预测细胞亚型(例如,cd4或cd8)。a.使用支持向量机进行t细胞亚型预测
[0425]
支持向量机(svm)模型被设计为评估特征数据并学习特征中的哪些趋势与cd4或cd8亚型对应。表e4显示了svm模型规格。从整个实验中超过200,000个单独细胞图像评估特征数据,其中一个组具有纯cd4细胞并且另一个组具有纯cd8细胞。对于每个单独的组,将svm在与形态、光学、强度和相位特征相关的特征数据上训练(参见上文第i-b节);系统功能被排除在外。数据分为80%用于训练,且其余20%用于测试模型有效性。每个图像的亚型身份是已知的。
[0426]
表e4:svm模型规格。内核径向基函数γ(内核系数)1/(n标准*标准差)
c(错误标签分配的惩罚)1决策函数形状用于二元分类的一对一(“ovo”)
[0427]
在测试数据集上的模型准确性为约75%。这些结果支持在特征数据上使用svm来预测细胞亚型。b.使用神经网络进行t细胞亚型预测
[0428]
神经网络(nn)模型用于预测细胞亚型(例如,cd4 或cd8 )。nn包含等于特征数x特征数x特征数的隐藏层尺寸,激活通过整流线性单位函数(relu)建模,并且α设置为0.0001以指定节点之间的惩罚。将所述模型在单独的cd4和cd8群体数据上进行训练,其中90%用于训练且其余10%用于测试。分析中包含的特征数据与对于上述svm模型所描述的相同。
[0429]
在测试数据上的nn预测准确性为约91%。这些结果支持在特征数据上使用nn来预测细胞亚型。
[0430]
t检验用于鉴定与细胞亚型(例如cd4或cd8)高度相关的特征。估计以下特征与预测细胞亚型(例如cd4 或cd8 )高度相关,所述特征包括细胞的平均相位均匀性、峰直径(例如,与细胞的折射峰具有相同面积的圆的直径)、细胞的归一化折射峰高度(例如,细胞的折射峰强度除以例如细胞表面与细胞平均强度的乘积)、细胞表面上的平均相位(例如,细胞的平均相位)、通过细胞面积归一化的折射峰面积(例如,峰面积除以例如细胞面积和平均强度的乘积)、细胞的最小光学高度、细胞的紧密度(例如,细胞面积与细胞轴上的对象方差的比率)、细胞的圆度(例如,细胞面积与细胞周长的比率)、细胞的相位平滑度(例如,细胞相位图像中平滑度的量度)、细胞图像的强度同质性(例如,在对角线分布的空间接近度)、细胞强度最大的平面(例如,以微米计)、细胞的折射峰面积以及细胞的相位相关性(例如,细胞的相位图像中像素与其相邻像素的相关性的量度)。nn使用来自源自单独cd4和cd8群体的数据的上述特征重新训练。c.使用随机森林进行t细胞亚型预测
[0431]
为了确定提取的特征(参见例如,上文第i-b节)与t细胞亚型(例如,cd4 或cd8 )之间的关系,使用来自cd4 和cd8 几乎纯群体的80%可用数据训练随机森林监督式机器学习算法。将cd4 和cd8 数据集在计算上混合以创建一个数据集,其中数据集的每个细胞的细胞身份都是已知的。使用来自在计算上混合的数据集的其余数据测试模型性能。所述模型包括100棵树,其中最大树深度为3,学习率为0.01并且具有平衡的类权重。
[0432]
将训练的随机森林模型应用到用于cd4/cd8分类的测试集(其余20%的在计算上混合的数据集)。为了确保模型不会过度拟合至训练数据,比较了在训练和测试数据上的模型性能。
[0433]
随机森林模型使用62个特征在区分cd4与cd8 t细胞方面达到了89%准确性。分析中不包括以下特征:细胞描述符、细胞的边界指示(例如,细胞或细胞的折射峰是否位于图像中的边界)、折射峰数量、以微米计的最小光学高度、细胞标识符、图像标识符和对象标识符。另外,发现模型中最常用的特征是描述细胞沿垂直z轴的位置(例如,细胞沿深度轴的位置(细胞深度);图7)的特征。不希望受理论束缚,这可能是由于cd8t细胞中细胞毒性颗粒的丰度导致的cd4和cd8 t细胞密度迥然不同所致。
[0434]
汇集了在197个和253个时间点用于训练随机森林模型的数据,其中采样分别用于cd4 和cd8 实验。在122小时14分钟或118小时53分钟的时间段内,每30分钟收集一次样品。
为了确定时间对特征的影响,分别在所有时间点对cd4和cd8细胞的特征值进行可视化。
[0435]
被鉴定为在细胞亚型预测中发挥重要作用的特征即细胞深度随着时间的推移显示出不同的模式。例如,大约前20个时间点显示出对于cd4和cd8细胞的每个时间点几乎难以区分的细胞深度特征值,而最后20个时间点完全不重叠。随着时间的推移,观察到不同特征的不同模式,这表明特征依赖于对细胞进行分析的特定时间点。
[0436]
鉴于特征值的潜在波动,进行了另一个预测实验以确定所述模型是否能够更好地预测50%的最早或最晚时间点。将数据分为前半部分和后半部分,其中时间点截断值为大约60小时的时间点。然后将每一半的数据分成训练(80%)和测试(20%)数据集,并且将随机森林模型在前半部分或后半部分数据集上进行训练和测试。与在数据集的后半部分上训练和测试的模型相比,在数据集的前半部分上训练的模型显示出对于预测在最早一半的时间点收集的细胞的细胞亚型的较差准确性(83%相比于100%准确性)。
[0437]
这些结果和与用于预测cd4 和cd8 t细胞亚型的随机森林分类器组合的在线ddhm成像和特征检测的效用是一致的。d.使用深度学习进行t细胞亚型预测
[0438]
上述模型使用特定特征来预测细胞亚型(例如,cd4 或cd8 )。代替使用从全息图像提取的特征来预测细胞亚型,开发了一种能够在原始图像上训练以预测细胞亚型的计算模型。所述模型被设计为卷积和汇集层的组合,其允许模型在其遇到更多图像时不断学习。随着图像通过层的进展,节点数量减少以将要训练的参数总数保持在约35-50千个参数。节点层的大小取决于输入图像尺寸,其中层的大小分别除以2、4和8以减少参数。在卷积层和汇集层之后,密度层决定了预测的二元分类的概率。
[0439]
原始3d图像数据(以x、y、z格式)经过图像分割以捕获单独细胞的图像。例如,对原始图像进行过滤,使得去除小于0.7(以微米计)的z值以减少背景噪声。在边缘检测之前,将图像针对1000归一化。scikit-image用于鉴定处理的数据上的单独细胞对象(图8),并且那些边缘用于创建掩码以单独分离每个细胞对象。将提取的细胞图像存储在阵列中以供以后分析(图9)。
[0440]
通过查询返回的细胞图像池中的cd4和cd8图像的计数来平衡数据集。对具有最多图像的细胞亚型(cd4或cd8)随机采样以生成一组图像,其数量与其他亚型的图像计数相同。
[0441]
为了提升模型的学习能力,通过修改单独图像的缩放、偏斜和旋转来创建另外一组图像。
[0442]
将数据集分为训练集(90%)和测试集(10%),然后使用keras将深度学习(dl)模型以至少25次迭代拟合至训练数据集。使用测试数据集,生成模型每次训练迭代的准确性得分。随着在整个过程中重新训练图像,准确性应该会继续增长和稳定。
[0443]
对于预测细胞亚型的模型性能为约80%。这些数据支持使用与深度学习方法组合的原始图像来预测细胞类别。实施例6:用于预测混合cd4 cd8 群体中t细胞亚型比率的机器学习方法
[0444]
实施例1中描述的制造过程包括在进行刺激、转导和扩增步骤之前,以1:1的活cd4 t细胞与活cd8 t细胞的比率混合所选择的cd4 和cd8 t细胞组合物。机器学习方法用于预测这种混合细胞群体的细胞属性,如细胞亚型。如实施例5中所述,在几乎纯的cd4和
cd8 t细胞群体上训练以预测细胞亚型的svm和nn模型用于预测cd4和cd8t细胞的混合群体中的cd4/cd8比率。模型比率不能准确地预测使用流式细胞术检测套组确定的观察比率。不希望受到理论的束缚,认为此类结果可能是由于当cd4和cd8群体一起培养时可能发生的变化所致,使得用来自未在混合群体中类似培养的纯群体的细胞进行训练可能不会进行最佳预测。
[0445]
将机器学习方法(如实施例5中描述的那些)在选自cd4和cd8细胞混合群体的cd4和cd8 t细胞上进行训练。训练的模型用于预测类似处理的细胞的混合群体中细胞亚型的比率。实施例7:用于预测t细胞属性的机器学习方法
[0446]
机器学习方法可以用于预测t细胞属性,包括但不限于工程化(例如转导的)细胞(例如表达嵌合抗原受体(car)的t细胞)的百分比或数量;t细胞激活状态;t细胞分化状态;和/或细胞周期状态。属性预测实验是在通过实施例1中所述的方法产生的cd4 和cd8 t细胞上进行的。使用在线ddhm成像系统(例如ovizio iline f(ovizio imaging systems nv/sa,布鲁塞尔,比利时))连续监测来自每个实验过程的细胞。如实施例4中所述,可以从培养的细胞的全息图像在单个细胞的基础上提取70个特征(参见上文第i-b节)。提取的特征、其子集或原始图像可以用于机器学习方法中以预测细胞属性(例如,car 、激活状态、分化状态、细胞周期状态)。a.从特征预测细胞属性
[0447]
监督式机器学习模型用于对从全息图像提取的特征(参见上文第i-b节)与细胞属性(例如,car阳性)之间的关系进行建模。确定每个特征对于模型的必要性,因为一些特征可能彼此高度相关。通过在特征集群中选择显著相关(ρ》0.7)的独立特征来去除多余特征。其余的连续特征(例如,表示为未分组的数值的特征)被聚集和缩放。
[0448]
测试了以下机器学习算法:逻辑回归、支持向量机、随机森林和随机梯度提升。为了评价算法选择对模型性能的影响,对超参数进行粗调,进行十倍嵌套交叉验证,并比较在验证集上的模型性能。特定模型的性能被测量为每个倍数的平衡准确性的平均值。选择产生最高平均平衡准确性的算法来进行超参数的微调。
[0449]
如果发现细胞属性依赖于供体,则每一个交叉验证回合都在独立供体上进行训练和测试(留出一组),以便更准确地测量模型的性能。b.从原始图像预测细胞属性
[0450]
作为基于特征预测t细胞属性(例如car阳性细胞)的替代方案,应用机器学习以从原始图像预测属性。开发了一种模型(例如,mask rcnn模型),所述模型接受相位和强度图像作为输入,对这些图像中的单独细胞进行分割和分类,并提供对于测试属性的总计数,如活car阳性细胞、活car阴性细胞、死细胞、碎片和细胞集群作为输出。来自未混合(纯)的car阳性和未混合(纯)的car阴性级分的图像用于训练分类器,其中每个细胞的属性都是已知的。通过比较从未混合和通过经验混合的级分获得的图像中的预测car阳性细胞分数与已知的car阳性频率来评价模型准确性。c.预测性能
[0451]
若干个标准统计量度用于确定模型的预测性能。正确的预测被报告为真阳性和真阴性,而错误的预测被报告为假阳性和假阴性。使用这些指标,计算模型的敏感性(也称为
真阳性率)和专一性(真阴性率)。此外,敏感性和专一性用于建立接受者操作特征(roc)曲线,使得对于生成敏感性高于专一性或反之亦然的模型的权衡可以可视化。roc曲线还允许测量曲线下面积(auc),其作为模型性能的汇总统计。auc得分范围为从0.5到1.0,并且解释如下:接近0.5的得分指示模型的预测并不好于随机猜测细胞对于特定属性的阳性,而auc得分为1.0指示完美的预测性能。
[0452]
本发明并不旨在限于具体公开的实施方案的范围,所提供的实施方案例如是为了说明本发明的各个方面。根据本文的描述和传授,对所述组合物和方法的各种修改将变得清楚。可以在不脱离本公开文本的真实范围和精神的情况下实践这些变化,并且这些变化旨在落入本公开文本的范围内。序列
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。