1.本公开涉及一种延迟释放的药物组合物,属于制药领域。
背景技术:
2.昼夜节律是大约24小时周期内的身体,心理和行为变化,主要是对生物体环境中的光明和黑暗做出反应。昼夜节律是由体内自然因素产生的,但也受到环境信号的影响。在诸如哮喘、关节炎、癫痫病、偏头痛、过敏性鼻炎、心血管疾病(心肌梗塞,心绞痛,中风)、慢性炎症和疼痛(例如类风湿关节炎)等疾病中,各种昼夜节律依赖模式已得到充分证明,风湿性多肌痛和消化性溃疡疾病,在特定时期症状更明显和/或加剧。治疗这些疾病需要在特定时间使用不同量的药物,这可以同步昼夜节律周期并提供足够的缓解。
3.为了满足依赖于昼夜节律性的此类疾病的特定治疗需求,需要新的药物递送系统以按时间程序性地释放活性成分。例如,在晚上能够以适当的速率在几个小时后开始释放剂量的剂型的假设,可能是所有表现出夜间症状复发的疾病的合适治疗方案。脉冲式给药是根据时晨药理学和时晨治疗学的原理设计的新型控释给药系统,kulwinder kaur等对此类的技术做了详细的总结(kulwinder kaur et al/j.pharm.sci.&res.vol.11(5),2019,1984-1989),其中是一种通过压片包衣使得药物释放产生时滞,时滞结束后药物快速或者缓慢释放的技术。
技术实现要素:
4.本公开提供一种延迟释放的药物组合物,所述药物组合物包含以下组分:
5.1)含药核心,包含活性物质及至少一种赋形剂;
6.2)包覆于含药核心周围的外包层;
7.所述外包层包含至少一种基质材料,至少一种疏水性的增塑剂和至少一种亲水凝胶骨架材料,所述的基质材料为不溶于水或难溶于水的赋形剂,其中疏水性的增塑剂的含量为外包层总重的0.1%-15%(质量百分比),所述活性物质不是非布司他。
8.本公开中所述的赋形剂可选固体制剂常用的辅料,例如填充剂、崩解剂、润滑剂等。
9.本公开提供的延迟释放的药物组合物,可以提供在适当的延迟时间内释放药物,例如1-10小时内,或者2-6小时内。
10.本公开中所述的适当的延迟时间内释放药物是指药物在该时间段之前不释放,或者基本不释放,例如,含量核心中活性物质的释放量小于10%可认为不释放或者基本不释放。
11.本公开中药物溶出度的测试方法如下:按照溶出度与释放度测定法(中国药典2015年版四部通则0931第二法),以2.5%hpmc k100lv-ph6.0磷酸盐缓冲液500ml为溶出介质,温度为37
±
0.5℃,转速为每分钟150转,加沉降篮。依法操作经1h、2h、4h分别取溶出液5ml,滤过,取续滤液作为供试品溶液,1h、2h同时补充相同温度相同体积的溶出介质。4h后
弃去上述各溶出杯中的介质,随即在各溶出杯中加入900ml预热至37
±
0.5℃的ph6.8磷酸盐缓冲液,转速不变,继续依法操作,经0.5h、1h、2h、3h分别取溶出液5ml,滤过,取续滤液作为供试品溶液,并同时补充相同温度相同体积的溶出介质,高效液相色谱法测定累积溶出量(%)。
12.本公开中提供的延迟释放的药物组合物,其中包覆于含药核心周围的外包层的重量选自140mg-500mg。
13.可选的实施方案中,包覆于含药核心周围的外包层的重量选自180mg-440mg。
14.可选的实施方案中,包覆为含药核心周围的外包层的重量选自220mg-400mg。
15.本公开提供延迟释放的药物组合物,外包层中疏水性的增塑剂的添加,保证了批次生产中得到的延迟释放的药物组合物的含药核心中的活性物质的初始释放时间差小于1小时,可选的方案中,小于50分钟,显著地提高了释药的均一性。
16.本公开可选的实施方案中,所述的疏水性的增塑剂可选液状石蜡、玉米油、蓖麻油、椰子油、氢化植物油、甘油三醋酸酯、甘油单醋酸酯、二丁基癸二酸酯、邻苯二甲酸二丁酯、长链脂肪醇、长链脂肪酸及其酯或其盐类(例如硬脂酸甘油酯,包括三硬脂酸甘油酯)或山嵛酸甘油酯。
17.可选的实施方案中,所述的疏水性的增塑剂选自氢化植物油、三硬脂酸甘油酯或山嵛酸甘油酯。
18.可选的实施方案中,所述的疏水性的增塑剂为山嵛酸甘油酯。
19.本公开提供的延迟释放的药物组合物,外包层中疏水性的增塑剂含量为外包层总重的0.5%-8%(质量百分比),可选的实施方案中,外包层中疏水性的增塑剂含量为外包层总重的1%-7%(质量百分比),可选的实施方案中,外包层中疏水性的增塑剂含量为外包层总重的1.2%-6%(质量百分比)。
20.本公开提供的延迟释放的药物组合物,外包层中的基质材料可选自聚丙烯酸树脂、乙基纤维素、羟丙甲基纤维素、无水磷酸氢钙及kollidon sr或其混合物。
21.可选的实施方案中,外包层中不溶于水或难溶于水的赋形剂的含量选自5%-99%。
22.可选的实施方案中,外包层中不溶于水或难溶于水的赋形剂的含量选自60%-95%。
23.可选的实施方案中,所述的基质材料为尤特奇rlpo、尤特奇rspo和任选kollidon sr的组合。
24.可选的实施方案中,所述的基质材料为乙基纤维素和kollidon sr的组合。
25.可选的实施方案中,所述的基质材料为无水磷酸氢钙和kollidon sr的组合。
26.本公开提供的延迟释放的药物组合物,所述亲水凝胶骨架材料选自甲基纤维素、羟乙基纤维素、羟丙基纤维素、羟丙基甲基纤维素、羟甲基纤维素、羟甲基纤维素钠、壳多糖、脱乙酰壳多糖、半乳糖甘露聚糖、果胶、海藻酸钠、海藻酸钾、琼脂、角叉菜胶、刺槐豆胶等。
27.可选的实施方案中,所述的亲水凝胶骨架材料为羟丙甲基纤维素。
28.可选的实施方案中,所述的亲水凝胶骨架材料,其含量为外包层总重的1%-30%(质量百分比)。
29.可选的实施方案中,所述的亲水凝胶骨架材料,其含量为外包层总重的3%-20%(质量百分比)。
30.可选的实施方案中,所述的亲水凝胶骨架材料,其含量为外包层总重的5%-15%(质量百分比)。
31.本公开中,为适应制备工艺的需求,可选的亲水凝胶骨架材料也可以做为粘合剂。
32.可选的实施方案中,本公开提供的延迟释放的药物组合物,所述药物组合物包含以下组分:
33.1)含药核心,包含活性物质及至少一种赋形剂;
34.2)包覆于含药核心周围的外包层;
35.所述外包层包含至少一种基质材料,所述基质材料选自以下组i)尤特奇rlpo、尤特奇rspo和任选kollidon sr;ii)乙基纤维素和kollidon sr;iii)无水磷酸氢钙和kollidon sr;
36.至少一种疏水性的增塑剂,其中疏水性的增塑剂的含量为外包层总重的0.1%-15%(质量百分比);
37.和至少一种亲水凝胶骨架材料。
38.可选的实施方案中,本公开提供的延迟释放的药物组合物,所述药物组合物包含以下组分:
39.1)含药核心,包含活性物质及至少一种赋形剂;
40.2)包覆于含药核心周围的外包层;
41.所述外包层包含至少一种基质材料,所述基质材料选自尤特奇rspo、尤特奇rlpo和任选kollidon sr;
42.其中尤特奇rspo含量为外包层总重的10%-30%(质量百分比),尤特奇rlpo的含量为外包层总重的20%-70%;kollidon sr的含量为外包层总重的0%-40%(质量百分比);
43.至少一种疏水性的增塑剂,其选自氢化植物油、三硬脂酸甘油酯或山嵛酸甘油酯,其中疏水性的增塑剂的含量为外包层总重的1%-7%(质量百分比);
44.和至少一种亲水凝胶骨架材料,所述亲水凝胶骨架材料为羟丙基甲基纤维素,其含量为外包层总重的5%-15%(质量百分比)。
45.可选的实施方案中,本公开提供的延迟释放的药物组合物,所述药物组合物包含以下组分:
46.1)含药核心,包含活性物质及至少一种赋形剂;
47.2)包覆于含药核心周围的外包层;
48.所述外包层包含至少一种基质材料,所述基质材料选自尤特奇rspo、尤特奇rlpo和kollidon sr;
49.其中尤特奇rspo含量为外包层总重的15%-25%(质量百分比),尤特奇rlpo的含量为外包层总重的30%-60%;kollidon sr的含量为外包层总重的20%-30%(质量百分比);
50.至少一种疏水性的增塑剂,其选自氢化植物油、三硬脂酸甘油酯或山嵛酸甘油酯,其中疏水性的增塑剂的含量为外包层总重的1%-7%(质量百分比);
51.和至少一种亲水凝胶骨架材料,所述亲水凝胶骨架材料为羟丙基甲基纤维素,其含量为外包层总重的5%-15%(质量百分比)。
52.可选的实施方案中,本公开提供的延迟释放的药物组合物,所述药物组合物包含以下组分:
53.1)含药核心,包含活性物质及至少一种赋形剂;
54.2)包覆于含药核心周围的外包层;
55.所述外包层包含至少一种基质材料,所述基质材料选自无水磷酸氢钙和kollidon sr;其中无水磷酸氢钙的含量为外包层总重的30%-70%(质量百分比),kollidon sr的含量为外包层总重的10%-40%(质量百分比);
56.至少一种疏水性的增塑剂,其为山嵛酸甘油酯,其中山嵛酸甘油酯的含量为外包层总重的1%-7%(质量百分比);
57.和至少一种亲水凝胶骨架材料,所述亲水凝胶骨架材料为羟丙基甲基纤维素,其含量为外包层总重的5%-15%(质量百分比)。
58.可选的实施方案中,本公开提供的延迟释放的药物组合物,所述药物组合物包含以下组分:
59.1)含药核心,包含活性物质及至少一种赋形剂;
60.2)包覆于含药核心周围的外包层;
61.所述外包层包含至少一种基质材料,所述基质材料选自乙基纤维素和kollidon sr;其中乙基纤维素的含量为外包层总重的45%-70%(质量百分比),kollidon sr的含量为外包层总重的10%-40%(质量百分比);
62.至少一种疏水性的增塑剂,其为山嵛酸甘油酯,其中山嵛酸甘油酯的含量为外包层总重的1%-7%(质量百分比);
63.和至少一种亲水凝胶骨架材料,所述亲水凝胶骨架材料为羟丙基甲基纤维素,其含量为外包层总重的5%-15%(质量百分比)。
64.本公开提供的延迟释放的药物组合物,含药核心中的赋形剂为崩解剂,所述的崩解剂可以选自交联羧甲基纤维素钠、干淀粉、低取代羟丙甲基纤维素、羧甲基淀粉钠及交联聚维酮等中的至少一种,其含量可为含药核心总重的2%-35%(质量百分比),具体可选自5%-25%,8%-15%。本公开提供的延迟释放的药物组合物置于水性环境时,水分通过基质材料的孔道进入含药核心,崩解剂提供了外包层破裂的必要力量。
65.可选的实施方案中,所述的崩解剂为交联羧甲基纤维素钠。
66.本公开提供的延迟释放的药物组合物,含药核心还可以含有药学上可接受的填充剂,所述的填充剂可选水溶性填充剂和/或水不溶性填充剂,所述水溶性填充剂包括乳糖、甘露醇、蔗糖、山梨醇等,水不溶性填充剂包括淀粉、微晶纤维素、硫酸钙、无水磷酸氢钙等,填充剂的含量可以是含药核心总重的1%-99%(质量百分比)。
67.可选的实施方案中,含药核芯中填充剂的含量是含药核心总重的10%-90%。
68.本公开提供的延迟释放的药物组合物,含药核心还可以含有药学上可接受的润滑剂,例如胶态二氧化硅、滑石粉、硬脂酸、硬脂酸镁、硬脂酸钙、硬脂酸富马酸钠、聚乙二醇或十二烷基硫酸钠,含药核心中润滑剂的含量为含药核心总重的0.5%-10%(质量百分比)。
69.可选的实施方案中,含药核芯中润滑剂的含量是含药核心总重的1%-5%。
70.本公开提供的延迟释放的药物组合物,含药核心还可以含有药学上可接受的粘合剂,所述粘合剂可以选自羟丙基纤维素、羟丙基甲基纤维素、聚乙烯吡咯烷酮、甲基纤维素、羧甲基纤维素、羧甲基纤维素钠、海藻糖和支链淀粉中的至少一种,但不限于此,粘合剂的含量可以为含药核心总重的0.1%-20%(质量百分比)。
71.可选的实施方案中,本公开提供的延迟释放的药物组合物其为丸或者片。
72.可选的实施方案中,本公开提供的延迟释放的药物组合物,其为片,直径选自6-13mm,可选的实施方案中,直径为8-12mm,具体可选自6mm、7mm、8mm、9mm、10mm、11mm、12mm或13mm。
73.可选的实施方案中,本公开提供的延迟释放的药物组合物,外包层上通过公知的技术手段形成速释部分,从而可以使得本公开提供的延时释放的药物组合物形成双脉冲。本公开提供的延迟释放组合物的药物的活性物质可选自治疗哮喘、心血管疾病(心肌梗塞、心绞痛)、类风湿关节炎、过敏性鼻炎、丛集性偏头痛、充血性心脏、睡眠紊乱、癫痫症、窒息、抑郁症、帕金森综合征、溃疡、高血压等疾病的药物。另外,通过胞色细胞p450代谢的药物是适合本公开的延迟释放组合物的药物。可选的活性物质可以是阿密曲替林、咖啡因、氯米帕明、氯氮平、氟伏沙明、氟哌丁苯、丙咪嗪、雌(甾)二醇、奥氮平、扑热息痛、心得安、四氢氨基吖啶、茶碱、华法林、安非他酮、环磷酰胺、塞来昔布、双氯芬酸、氟比洛芬、布洛芬、格列美脲、吲哚美辛、甲氧萘丙酸、二苯乙内酰脲、吡诺昔康、替诺昔康、西酞普兰、安定、兰索拉唑、奥美拉唑、潘他拉唑、普萘洛尔、托吡酯、阿普洛尔、氯丙嗪、氯米帕明、可待因、去甲丙咪嗪、右美沙芬、苯海拉明、盐酸多奈哌齐、氟卡尼、氟西汀、柳胺苄心定、美沙酮、美托洛尔、米安色林、诺曲林、恩丹西酮、烯丙氧心安、羟考酮、帕罗西汀、双环己哌啶、哌角替啶、异丙嗪、利培酮、甲硫哒嗪、噻氯匹啶、噻吗心安、三甲丙咪嗪、万拉法新、扑热息痛、阿普唑仑、乙胺碘呋酮、布地奈德、似普罗啡、丁螺旋酮、钙通道阻断剂、卡巴咪嗪、西沙必利、克拉霉素、氯硝安定、可卡因、氢化可的松、环孢霉素、地塞米松、红霉素、芬太奴、酮康唑、氯沙坦、咪康唑、咪达唑仑、奎纳定、舍曲林、他克莫司、三苯氧胺、三唑仑、唑吡坦或它们的混合物。
74.适于本公开提供的延迟释放组合物的药物的活性物质可选自:
75.抗组胺剂,例如:马来酸阿扎他定、溴苯吡丙胺、卡比沙明马来酸盐、氯苯吡胺马来酸盐、马来酸右氯苯那敏、盐酸苯海拉明、琥珀酸杜克西拉明、盐酸甲地嗪、异丙嗪、异丁嗪酒石酸盐、苄吡二胺柠檬酸盐、盐酸苄吡二胺以及头孢匹罗;抗生素,例如:青霉素v钾、邻氯青霉素钠、双氯青霉素钠、乙氧萘青霉素钠、苯甲异噁唑青霉素钠、羧苄青霉素茚满基钠、盐酸土霉素、盐酸四环素、磷酸氯洁霉素、盐酸氯洁霉素、棕榈酸氯洁霉素、林肯霉素、新生霉素钠、呋喃咀啶钠、盐酸甲硝唑;抗结核剂,例如:异烟肼;胆碱能剂,例如:安贝氯铵、氯化甲酰甲胆碱、溴化新斯的明、溴化3-二甲氨基甲酰氧基-1-甲基吡啶;抗蕈毒碱,例如:甲溴辛托品、溴奎环二苯酯、盐酸双环胺、格隆溴胺、甲硫己环铵、甲基溴化后马托品、硫酸天仙子胺、溴化美生舍灵、天仙子碱溴氢酸盐、溴化羟苯乙铵、溴化普洛盘舍啉、氯化环己基羟苯丙基三乙胺;类交感神经剂,例如:甲磺酸比托特罗、麻黄素、盐酸麻黄素、硫酸麻黄素、硫酸间羟异丙肾上腺素、盐酸苯丙醇胺、盐酸假麻黄碱、盐酸羟苄羟麻黄碱、硫酸羟甲叔丁肾上腺素、硫酸间羟叔丁肾上腺素;抗交感神经剂,例如:盐酸苯氧苯扎明;铁制剂,例如:葡萄糖酸铁、硫酸亚铁;止血剂,例如:氨基己酸;强心剂,例如:盐酸醋丁酰心安、双异丙吡胺磷酸盐、醋酸氟卡尼、盐酸普鲁卡因胺、盐酸普奈洛尔、葡萄糖酸奎尼定、马来酸噻吗心安、盐酸妥卡
尼、盐酸戊脉安;抗高血压药物,例如:巯甲丙脯氨酸、盐酸可乐亭、盐酸肼苯哒嗪、盐酸四甲双环庚胺、酒石酸甲氧乙心安;血管扩张剂,例如:盐酸罂粟碱;非甾体抗炎药,例如:水杨酸胆碱、布洛芬、酮丙酸、水杨酸镁、甲氯胺苯酸钠、甲氧萘丙酸钠、甲苯酰吡酸钠;镇静促效药,例如:盐酸可待因、磷酸可待因、硫酸可待因、右旋吗酰胺酒石酸盐、重酒石酸二氢可待因酮、盐酸二氢吗啡酮、盐酸派替啶、美舍东盐酸盐、硫酸吗啡、醋酸吗啡、乳酸吗啡、袂康酸吗啡、硝酸吗啡、磷酸一代吗啡、酒石酸吗啡、戊酸吗啡、氢溴酸吗啡、盐酸吗啡、盐酸丙氧芬);抗痉挛药物,例如:苯巴比妥钠、苯妥英钠、三甲双酮、乙琥胺、2-丙基戊酸钠);镇静剂,例如:马来酸乙酰奋乃静、盐酸氯丙嗪、盐酸氟非那嗪、乙二磺酸丙氯拉嗪、盐酸异丙嗪、盐酸甲硫哒嗪、盐酸三氟甲哌丙嗪、柠檬酸锂、盐酸莫林酮;化疗药;降脂剂,例如:吉非罗齐、降固醇酸、hmg-coa(3-羟基-3-甲基戊二酰辅酶a)还原酶抑制剂比如:阿伐他汀、西立伐他汀、氟伐他汀、洛伐他汀、普伐他汀、辛伐他汀;h2对抗剂(例如:甲腈咪胺、法莫替丁、对氨基苯、盐酸雷尼替丁;抗凝结剂和抗血小板剂,例如:华法林、cipyridamole、噻氯匹定;支气管扩张药,例如:舒喘宁、异丙(去甲)肾上腺素、间羟异丙肾上腺素、特布他林;兴奋剂,例如:硫酸右旋安非他命、磷酸右旋安非他命、二乙基丙酸盐酸盐、盐酸氟苯丙胺、盐酸甲基苯丙胺、盐酸哌醋甲酯、酒石酸苯甲曲秦、盐酸苯甲吗啉、柠檬酸咖啡因;止吐药,例如:盐酸苯奎酰胺、盐酸灭吐灵、盐酸三甲苯甲酰胺;类固醇,例如:氢化波尼松、甲基强的松龙、强的松、可的松、氢化可的松、甲基强的松龙、倍他米松、地塞米松、氟羟强的松龙。
76.本公开另一方面提供一种制备延迟释放的药物组合物的方法,包括以下步骤:1)将活性物质与至少一种赋形剂混合后压制成含药核心;2)将外包层材料压制包覆于含药核心周围,所述的外包层材料选自基质材料、疏水性的增塑剂和亲水凝胶骨架材料的至少一种。
77.可选的实施方案中,本公开提供的制备延迟释放的药物组合物的方法,含药核心为含药片芯,采用湿法制粒、干法制粒、流化制粒或粉末直压得到含药片芯。
78.可选的实施方案中,本公开提供的制备延迟释放的药物组合物的方法,其中外包层材料通过直接压片的方式压制包覆于含药核心周围。
79.可选的实施方案中,本公开提供的制备延迟释放的药物组合物的方法,其中外包层材料先流化制粒,后压制包覆于含药核心周围。
80.可选的实施方案中,本公开提供的制备延迟释放的药物组合物的方法,包括以下步骤:
81.1)将活性物质与至少一种赋形剂混合后压制成含药核心;
82.2)将亲水凝胶骨架材料羟丙甲基纤的第一部分作为粘合剂,与基质材料尤特奇rspo、尤特奇rlpo,疏水性的增塑剂一起流化制粒得颗粒组分1;
83.3)将kollidon sr和亲水凝胶骨架材料羟丙基甲基纤的第二部分与步骤2)的颗粒组分1混合得到颗粒组分2;
84.4)将颗粒组分2包覆于含药核心周围。
85.可选的实施方案中,本公开提供的制备延迟释放的药物组合物的方法,包括以下步骤:
86.1)将活性物质与至少一种赋形剂混合后压制成含药核心;
87.2)将基质材料尤特奇rspo、尤特奇rlpo及kollidon sr,疏水性的增塑剂,亲水凝
胶骨架材料羟丙基甲基纤混合得到颗粒组分1;
88.3)将步骤2)的颗粒组分1压制包覆于含药核心周围。
89.可选的实施方案中,本公开提供的制备延迟释放的药物组合物的方法,包括以下步骤:
90.1)将活性物质与至少一种赋形剂混合后压制成含药核心;
91.2)将基质材料乙基纤维素、kollidon sr,疏水性的增塑剂,亲水凝胶骨架材料羟丙基甲基纤混合得到颗粒组分1;
92.3)将步骤2)的颗粒组分1压制包覆于含药核心周围。
93.可选的实施方案中,本公开提供的制备延迟释放的药物组合物的方法,包括以下步骤:
94.1)将活性物质与至少一种赋形剂混合后压制成含药核心;
95.2)将基质材料无水磷酸氢钙、kollidon sr,疏水性的增塑剂,亲水凝胶骨架材料羟丙甲基纤混合得到颗粒组分1;
96.3)将步骤2)的颗粒组分1压制包覆于含药核心周围。
97.本公开另一方面提供一种控制药物释放的方法,使用上述延迟释放的药物组合物。如本领域技术人员所知道的,通过合理调整本公开提供的延迟释放的药物组合物中包覆于含药核心周围的外包层的重量,或者任选的外包层中基质材料和亲水凝胶骨架材料的种类或含量,可以有效控制含药核心开始释放的时间,具体可以为1h,1.5h,2h,2.5h,3h,3.5h,4h,4.5h,5h,5.5h,6h,6.5h,7h,7.5h,8h,8.5h,9h,9.5h或者10h。、
98.本公开中所述的“批次生产”是指批次中生产的延迟释放的药物组合物的个数至少为6个。
附图说明
99.图1.布地奈德处方二溶出曲线图;
100.图2.布地奈德处方五溶出曲线图;
101.图3.布地奈德处方六溶出曲线图;
102.图4.左旋多巴处方一溶出曲线图;
103.图5.左旋多巴处方二溶出曲线图。
具体实施方式
104.以下通过具体实施例对本公开的内容作进一步的详细说明,但不应将此理解为本公开上述主题的范围仅局限于以下的实例。
105.1.制备速释片芯
106.采用粉末直压工艺,称取处方量的api(活性物质)、微晶纤维素和交联羧甲基纤维素钠,50rpm混合30分钟。后加入处方量硬脂酸镁,50rpm混合5分钟。采用上海祥顺旋转式压片机,用直径为5.5mm的浅凹冲压制。理论片重60mg,硬度控制范围为20-40n。
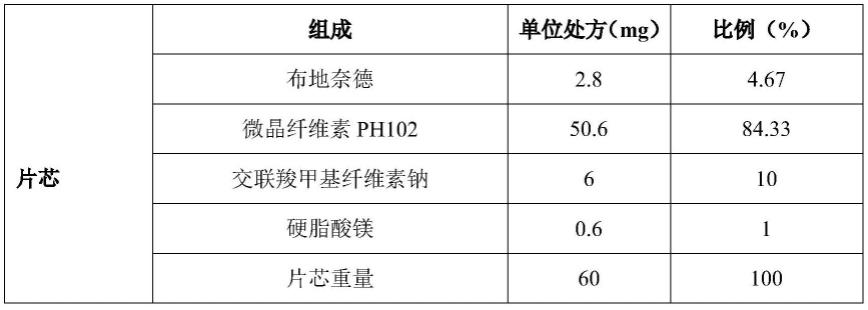
107.2.制备外包层和包芯片
108.外包层可使用流化制粒或粉末直压的方法进行制备。
109.流化制粒:称取处方量的羟丙甲纤维素e5lv搅拌下加入纯化水,配置成5%的水溶
液,将处方量骨架基质材料和增塑剂置于流化床中以hpmc e5lv的5%溶液作为粘合剂,制粒、干燥,按收率折算后将外加辅料kollidon sr、hpmc e5lv加入混合罐中进行总混。
110.粉末直压:称取处方量骨架基质材料、增塑剂、kollidon sr、hpmc e5lv,50rpm混合30分钟,即得。使用上海祥顺旋转式压片机,10.0mm圆形浅凹冲模制备包芯片。控制硬度在150-200n。
111.3.包芯片体外开盖时间考察
112.为保证包芯片在体内在一定时间内开盖,进行体外开盖时间中控。包芯片开盖时间受片芯吸水速度影响,所以介质粘性对开盖时间影响较大,在水性介质中开盖较快,在粘性介质中开盖较慢。为防止包芯片过早开盖达不到延缓释放目的,考察在水性介质ph4.5pbs-0.5%sds中开盖时间。
113.4.包芯片溶出度考察
114.按照溶出度与释放度测定法(中国药典2015年版四部通则0931第二法),以2.5%hpmc k100lv-ph6.0磷酸盐缓冲液500ml为溶出介质,温度为37
±
0.5℃,转速为每分钟150转,加沉降篮。依法操作经1h、2h、4h分别取溶出液5ml,滤过,取续滤液作为供试品溶液,1h、2h同时补充相同温度相同体积的溶出介质。4h后弃去上述各溶出杯中的介质,随即在各溶出杯中加入900ml预热至37
±
0.5℃的ph6.8磷酸盐缓冲液,转速不变,继续依法操作,经0.5h、1h、2h、3h分别取溶出液5ml,滤过,取续滤液作为供试品溶液,并同时补充相同温度相同体积的溶出介质,高效液相色谱法测定累积溶出量(%)。
115.实施例1.布地奈德包芯片(规格2.8mg)
116.依据表2中处方一、处方二制备得到布地奈德包芯片,考察开盖时间(外包层打开)及溶出。
117.1)片芯采用粉末直压工艺,处方见表1。
118.表1.布地奈德包芯片片芯处方
[0119][0120]
2)考察外包层中山嵛酸甘油酯加入的作用,片芯组成如表1,分别采用a)流化制粒b)粉末直压的方式制备下列处方(各6片)。
[0121]
表2.外包层流化制粒
[0122][0123]
表3.外包层粉末直压
[0124][0125][0126]
3)在ph4.5pbs-0.5%sds中观察处方批次的片子外包层破裂现象并统计破裂时间。
[0127]
表4.ph4.5pbs-0.5%sds中溶出现象
[0128]
处方一6片均在1.5h以内开盖处方二2h,2h,2.5h,2.5h,3h,3h处方三2h44min,3h10min,3h45min,3h48min,4h15min,4h20min处方四4h30min,5h,5h,5h,5h15min,5h15min
[0129]
外包层采用流化制粒时,处方一的6片包芯片均在1.5h以内开盖,由于开盖时间过早,无法对比均一性。实施例二处方符合要求,在2-3h开盖,第一片与最后一片开盖时间相差0.5小时。当采用粉末直压的方式制备外包层时,处方三第一片和最后一片开盖时间相差1h36min,处方四第一片和最后一片开盖时间只相差45min,处方中加入山嵛酸甘油酯后,均一性显著提高。
[0130]
4)考察包芯片溶出度,结果见表5。
[0131]
表5.布地奈德包芯片处方二溶出结果
[0132][0133]
实施例2.布地奈德包芯片(规格2.8mg)
[0134]
将山嵛酸甘油酯替换为其他增塑剂材料三硬脂酸甘油酯和氢化植物油,依据实表6中处方五、处方六制备得到布地奈德包芯片,考察开盖时间及溶出。
[0135]
表6.布地奈德包芯片处方五及处方六
[0136][0137][0138]
1)在ph4.5pbs-0.5%sds中观察处方批次的片子外包层破裂现象并统计破裂时间,结果见表7。
[0139]
表7.布地奈德包芯片处方五及处方六开盖时间
[0140]
处方五2h,2h,2h,2h10min,2h27min,3h处方六4h,4h10min,4h27min,4h35min,4h40min,4h56min
[0141]
将山嵛酸甘油酯替换为其他增塑剂后,开盖时间均一性符合要求,第一片和最后一片开盖时间相差在1h以内。
[0142]
2)考察包芯片溶出度,结果见表8。
[0143]
表8.布地奈德包芯片处方五及处方六溶出
[0144][0145]
实施例3.布地奈德包芯片(规格2.8mg)将尤特奇rspo、尤特奇rlpo替换成乙基纤维素或磷酸氢钙,粉末直压制备布地奈德包芯片,片芯如实施例1。
[0146]
表9.布地奈德包芯片处方七及处方八
[0147][0148]
在ph4.5 pbs-0.5%sds中考察开盖时间,结果见表10。
[0149]
表10.布地奈德包芯片处方七及处方八开盖时间
[0150]
处方七5h30min,5h40min,5h40min,5h45min,5h30min,5h30min,处方八1.5h,1.5h,1.5h,2h,2h,1.5h
[0151]
处方七在5h30min-5h45min开盖释放药物。由于无水磷酸氢钙可微溶于盐酸,因而在考察处方八的开盖时间前,先考察了其耐酸情况。先将处方八的包芯片在0.1m hcl中耐酸15min,再转移至ph4.5 pbs-0.5%sds中,处方八在1.5-2h开盖,处方七和处方八的开盖时间均符合要求。
[0152]
实施例4.左旋多巴包芯片(规格56mg)
[0153]
片芯采用粉末直压工艺。外包层采用流化制粒。通过外加辅料的用量,控制处方一在体外4-4.5h释放,处方二在体外4.5-5h释放,具体处方见表11。
[0154]
表11.左旋多巴包芯片处方
[0155][0156][0157]
2)溶出结果见表12
[0158]
表12.左旋多巴包芯片溶出
[0159]
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。