囊性纤维化跨膜传导调节因子的调节剂
1.本技术要求2019年8月14日提交的美国临时申请第62/886,611号和2019年8月14日提交的美国临时申请第62/886,739号的权益,所述美国临时申请的公开内容以全文引用的方式并入。
2.本发明涉及囊性纤维化跨膜传导调节因子(cftr)的调节剂、含有该调节剂的药物组合物、使用此类调节剂和药物组合物治疗囊性纤维化的方法以及用于制备此类调节剂的方法。
3.囊性纤维化(cf)是一种隐性遗传疾病,在全球范围内有约70,000名儿童及成人受到影响。尽管cf的治疗取得一定进展,但仍无法治愈。
4.在cf患者中,呼吸道上皮中内源性表达的cftr突变导致顶端阴离子分泌减少,使得离子和液体转运失衡。由此引起的阴离子转运减少导致肺中粘液累积增加,并且伴随微生物感染,最终导致cf患者死亡。除呼吸系统疾病之外,cf患者通常患有胃肠道问题和胰腺功能不全,如果不治疗,则会导致死亡。另外,大多数患有囊性纤维化的男性不育,并且患有囊性纤维化的女性的生育力降低。
5.关于cftr基因的序列分析已揭露出多种引起疾病的突变(cutting,g.r.等人(1990)nature 346:366-369;dean,m.等人(1990)cell 61:863:870;以及kerem,b-s.等人(1989)science 245:1073-1080;kerem,b-s等人(1990)proc.natl.acad.sci.usa 87:8447-8451)。迄今为止,已识别出cf基因中超过2000个突变;目前,cftr2数据库仅包含关于这些已识别突变中的432个的信息,有足够的证据将352个突变定义为致病性的。最普遍的致病突变是cftr氨基酸序列508位的苯丙氨酸缺失,并且通常称为f508del突变。该突变出现在许多囊性纤维化病例中,并且与严重疾病相关。
6.cftr中残基508的缺失阻止新生蛋白质正确地折叠。这导致突变蛋白无法离开内质网(er)并运输至质膜。因此,存在于膜中的用于阴离子转运的cftr通道的数目远低于在表达野生型cftr,即不含突变的cftr的细胞中观察到的数目。除了运输受损之外,突变导致缺陷性通道门控。膜中通道数目的减少和门控缺陷一起导致阴离子和流体跨上皮转运减少。(quinton,p.m.(1990),faseb j.4:2709-2727)。由于f508del突变而存在缺陷的通道仍是功能性的,尽管其功能小于野生型cftr通道。(dalemans等人(1991),nature lond.354:526-528;pasyk和foskett(1995),j.cell.biochem.270:12347-50)。除f508del之外,cftr中导致缺陷性运输、合成和/或通道门控的其他致病突变可以上调或下调以改变阴离子分泌并改变疾病进展和/或严重程度。
7.cftr是在包括吸收性和分泌性上皮细胞的各种细胞类型中表达的camp/atp介导的阴离子通道,其中它调控跨膜阴离子通量以及其他离子通道和蛋白质的活性。在上皮细胞中,cftr的正常功能对于维持电解质在全身(包括呼吸和消化组织)的转运至关重要。cftr由编码蛋白质的1480个氨基酸构成,所述蛋白质由跨膜结构域的串联重复序列组成,每个跨膜结构域含有六个跨膜螺旋和一个核苷酸结合结构域。两个跨膜结构域通过大的极性调控(r)结构域与多个磷酸化位点连接,从而调控通道活性和细胞运输。
8.氯离子转运通过存在于顶端膜上的enac和cftr以及细胞基底外侧表面上表达的
na
-k
-atp酶泵和cl-通道的协调活性进行。氯离子从内腔侧的次级主动转运导致细胞内氯离子积累,接着其可经由cl-通道被动地离开细胞,从而导致媒介物转运。na
/2cl-/k
共转运蛋白、na
-k
-atp酶泵和基底外侧表面上的基底外侧膜k
通道以及在内腔侧上cftr的布置经由内腔侧上cftr协调氯离子分泌。由于水自身可能无法主动转运,因此其跨上皮的流动取决于由钠和氯离子大量流动产生的微小跨上皮渗透梯度。
9.最近已鉴定出多种cftr调节性化合物。然而,仍需要可治疗囊性纤维化和其他cftr介导的疾病(特别是这些疾病的更严重形式)或减轻其严重程度的化合物。
10.本发明的一个方面提供新颖化合物,包括式(i)化合物;式(ii)、(ii-ai)、(ii-aii)、(ii-aiii)、(ii-aiv)、(ii-av)、(ii-avi)、(ii-bi)、(ii-bii)、(ii-biii)、(ii-biv)、(ii-bv)、(ii-bvi)、(ii-ci)、(ii-cii)、(ii-ciii)、(ii-civ)、(ii-cv)和(ii-cvi)的化合物;化合物1-298;式(iii)、(iii-ai)、(iii-aii)、(iii-aiii)、(iii-aiv)、(iii-av)、(iii-avi)、(iii-avii)、(iii-aviii)、(iii-bi)、(iii-bii)、(iii-biii)、(iii-biv)、(iii-bv)、(iii-bvi)、(iii-ci)、(iii-cii)、(iii-ciii)、(iii-civ)、(iii-cv)和(iii-cvi)的化合物;化合物299至397;化合物398-436;其互变异构体;那些化合物和互变异构体的氘化衍生物;以及前述任一者的药学上可接受的盐。
11.式(i)涵盖在以下结构范围内的化合物:
[0012][0013]
并且包括那些化合物的互变异构体、所述化合物和互变异构体中任一者的氘化衍生物,以及前述任一者的药学上可接受的盐,其中:
[0014]-环a是苯基、吲哚、5元杂芳基环或6元杂芳基环;
[0015]-环b是苯基、吡啶基或嘧啶基环;
[0016]-x是o、nh或n(c
1-c6烷基);
[0017]-每个r1独立地选自c
1-c6烷基、c
1-c6烷氧基、c
1-c6卤代烷基、c
1-c6卤代烷氧基、卤素、氰基和羟基,或两个r1基团连同其所连接的原子一起形成5至6元杂芳基或6元芳基环;
[0018]-m是0、1、2、3或4;
[0019]-每个r2独立地选自任选地被苯基或5元或6元杂芳基取代的c
1-c6烷基、c
1-c6烷氧基、c
1-c6卤代烷基、c
1-c6卤代烷氧基、卤素、氰基和羟基;
[0020]-r0是r
11
或
[0021]-环d是苯基环、5元杂环基环、6元杂环基环、5元杂芳基环、6元杂芳基环、3至8元环烷基环或3至8元环烯基;
[0022]-每个r4独立地选自卤素、氧代基、羟基、氰基和-(y)
k-r7基团,或任选地两个r4连同其所连接的原子一起形成5至6元环烷基或杂环基环,其任选独立地被一个或多个选自以下的基团取代:卤素、c
1-c6烷基、卤代烷基、羟基、c
1-c6烷氧基和c
1-c6卤代烷氧基;其中:
[0023]-k是0、1、2、3、4、5或6;
[0024]-每个y独立地选自c(r5)(r6)基团、
–o–
和
–
nra–
基团,其中-(y)
k-r7中的杂原子不键结至-(y)
k-r7中的另一个杂原子,其中:
[0025]-每个r5和r6独立地选自氢、卤素、羟基、c
1-c6烷基和c
3-5
环烷基,或同一碳上的r5和r6一起形成c
3-5
环烷基或氧代基;
[0026]-r5和r6各自任选独立地被一个或多个选自以下的基团取代:c
1-c6烷基、c
1-c6卤代烷基、卤素、羟基、c
1-c6烷氧基和c
1-c6卤代烷氧基;并且
[0027]-每个ra独立地选自氢和c
1-c6烷基;并且
[0028]-r7选自氢、卤素、氰基和任选地被一个或多个选自以下的基团取代的c
3-c
10
环烷基:c
1-c6烷基、c
1-c6卤代烷基和卤素;
[0029]-q是1、2、3或4;
[0030]-r
11
选自氢、卤素、c
1-c6烷基、c
1-c6烷氧基、c
1-c6卤代烷基、c
1-c6卤代烷氧基、c
2-c6烯基、c
2-c6炔基、苄基、-o-(c
3-c6环烷基)和氰基,其各自被0、1、2或3个r
12
基团取代,或任选地一个r2和r
11
连同其所连接的原子一起形成5至6元环烷基、5至6元杂环基或6元芳基环,其被以下取代:苯基环、5元杂环基环、6元杂环基环、5元杂芳基环、6元杂芳基环、3至8元环烷基环、3至8元环烯基,或0、1、2、3或4个r2基团;
[0031]-每个r
12
独立地选自卤素、羟基、氰基、c
1-c6烷基、c
2-c6烯基、c
2-c6炔基、-(c
1-c6烷基)-o(c
1-c6烷基)、-(c
1-c6烷基)-co2(c
1-c6烷基)、-(c
1-c6烷基)-n(r
x
)(ry)、-(c
1-c6烷基)-co2h、c
1-c6烷氧基、-n(r
x
)(ry)、-co-n(r
x
)(ry)、co2h、-co2(c
1-c6烷基)、-co2bn、-co(c
1-c6烷基)、苯基、5至6元杂芳基、4至6元杂环基和c
3-c
10
环烷基,其各自任选独立地被一个或多个选自以下的基团取代:卤素、氰基、c
1-c6烷基、卤代烷基、羟基、c
1-c6烷氧基、c
1-c6卤代烷氧基和-co2(c
1-c6烷基);
[0032]-n是0、1或2;
[0033]-每个r3是被0、1、2、3、4、5或6个3至8元环烷基环或5元或6元芳基取代的c
1-c6烷基,或两个r3接合形成c
3-c6环烷基环;
[0034]-z是式(l)r的二价连接基团,其中:
[0035]-r是1、2、3、4、5或6;
[0036]-每个l独立地选自c(r8)(r9)基团、
–o–
和
–
nrb–
基团,其中z中的杂原子不键结到z中的另一个杂原子,并且其中是5或6元杂环基、或5或6元杂芳基,其各自被0、1、2、3或4个r
10
基团取代;并且其中:
[0037]-r8和r9各自独立地选自氢、卤素、c
1-c6卤代烷基、c
1-c6烷基、c
2-c6烯基、c
2-c6炔基、羟基、c
1-c6烷氧基、c
1-c6卤代烷氧基、co2h、c(o)n(r
x
)(ry)、苯基、3至8元环烷基、5至6元杂芳基和5至6元杂环基,其各自被0、1、2、3、4或5个r
10
基团取代;
[0038]-每个r
10
独立地选自卤素、羟基氰基、c
1-c6烷基、c
2-c6烯基、c
2-c6炔基、-(c
1-c6烷基)-o(c
1-c6烷基)、-(c
1-c6烷基)-co2(c
1-c6烷基)、-(c
1-c6烷基)-n(r
x
)(ry)、-(c
1-c6烷基)-co2h、c
1-c6烷氧基、-n(r
x
)(ry)、-co-n(r
x
)(ry)、co2h、-co2(c
1-c6烷基)、-co2bn、-co(c
1-c6烷基)、苯基、5至6元杂芳基、4至6元杂环基和c
3-c
10
环烷基,其各自任选独立地被一个或多个选自以下的基团取代:卤素、氰基、c
1-c6烷基、卤代烷基、羟基、c
1-c6烷氧基、c
1-c6卤代烷氧基和-co2(c
1-c6烷基),
[0039]
或同一碳上的r8和r9一起形成氧代基;
[0040]-每个rb独立地选自氢、卤素、c
1-c6卤代烷基、c
1-c6烷基、c
2-c6烯基、c
2-c6炔基、羟基、c
1-c6烷氧基、c
1-c6卤代烷氧基、-co2h、-c(o)n(r
x
)(ry)、苯基、3至8元环烷基、5至6元杂芳基和5至6元杂环基,其各自被0、1、2、3、4或5个r
10
基团取代,并且任选地一个r1和一个rb连同其所连接的原子一起形成5至6元杂环烷基、或5至6元杂芳基环,其各自被0、1、2、3或4个r
10
基团取代;并且
[0041]-每个r
x
和ry独立地选自氢、c
1-c6烷基、c
1-c6卤代烷基、c
4-c9杂环基、3至6元环烷基、5至6元杂芳基、苄基、-co2(c
1-c6烷基)、-co(c
1-c6烷基),其中所述c
1-c6烷基任选地被-nme2取代,并且其中所述c
4-c9杂环基任选地被-(c
1-c6烷基)-o(c
1-c6烷基)或-co2(c
1-c6烷基)取代。
[0042]
式(i)包括式(ii)的化合物:
[0043][0044]
那些化合物的互变异构体、所述化合物和互变异构体中任一者的氘化衍生物,以及前述任一者的药学上可接受的盐,其中:
[0045]-环a是苯基、吲哚、5元杂芳基环或6元杂芳基环;
[0046]-环b是苯基、吡啶基或嘧啶基环;
[0047]-x是o、nh或n(c
1-c6烷基);
[0048]-每个r1独立地选自c
1-c6烷基、c
1-c6烷氧基、c
1-c6卤代烷基、c
1-c6卤代烷氧基、卤素、氰基和羟基,或两个r1基团连同其所连接的原子一起形成5至6元杂芳基或6元芳基环;
[0049]-m是0、1、2、3或4;
[0050]-每个r2独立地选自任选地被苯基或5元或6元杂芳基取代的c
1-c6烷基、c
1-c6烷氧基、c
1-c6卤代烷基、c
1-c6卤代烷氧基、卤素、氰基和羟基;
[0051]-r
11
选自氢、卤素、c
1-c6烷基、c
1-c6烷氧基、c
1-c6卤代烷基、c
1-c6卤代烷氧基、c
2-c6烯基、c
2-c6炔基、苄基、-o-(c
3-c6环烷基)和氰基,其各自被0、1、2或3个r
12
基团取代,或任选地一个r2和r
11
连同其所连接的原子一起形成5至6元环烷基、5至6元杂环基或6元芳基环,其被以下取代:苯基环、5元杂环基环、6元杂环基环、5元杂芳基环、6元杂芳基环、3至8元环烷基环、3至8元环烯基,或0、1、2、3或4个r2基团;
[0052]-每个r
12
独立地选自卤素、羟基、氰基、c
1-c6烷基、c
2-c6烯基、c
2-c6炔基、-(c
1-c6烷基)-o(c
1-c6烷基)、-(c
1-c6烷基)-co2(c
1-c6烷基)、-(c
1-c6烷基)-n(r
x
)(ry)、-(c
1-c6烷基)-co2h、c
1-c6烷氧基、-n(r
x
)(ry)、-co-n(r
x
)(ry)、co2h、-co2(c
1-c6烷基)、-co2bn、-co(c
1-c6烷基)、苯基、5至6元杂芳基、4至6元杂环基和c
3-c
10
环烷基,其各自任选独立地被一个或多个选自以下的基团取代:卤素、氰基、c
1-c6烷基、卤代烷基、羟基、c
1-c6烷氧基、c
1-c6卤代烷氧基和-co2(c
1-c6烷基);
[0053]-n是0、1或2;
[0054]-每个r3是被0、1、2、3、4、5或6个3至8元环烷基环或5元或6元芳基取代的c
1-c6烷基,或两个r3接合形成c
3-c6环烷基环;
[0055]-z是式(l)r的二价连接基团,其中:
[0056]-r是1、2、3、4、5或6;
[0057]-每个l独立地选自c(r8)(r9)基团、
–o–
和
–
nrb–
基团,其中z中的杂原子不键结到z中的另一个杂原子,并且其中是5或6元杂环基、或5或6元杂芳基,其各自被0、1、2、3或4个r
10
基团取代;并且其中:
[0058]-r8和r9各自独立地选自氢、卤素、c
1-c6卤代烷基、c
1-c6烷基、c
2-c6烯基、c
2-c6炔基、羟基、c
1-c6烷氧基、c
1-c6卤代烷氧基、co2h、c(o)n(r
x
)(ry)、苯基、3至8元环烷基、5至6元杂芳基和5至6元杂环基,其各自被0、1、2、3、4或5个r
10
基团取代;
[0059]-每个r
10
独立地选自卤素、羟基氰基、c
1-c6烷基、c
2-c6烯基、c
2-c6炔基、-(c
1-c6烷基)-o(c
1-c6烷基)、-(c
1-c6烷基)-co2(c
1-c6烷基)、-(c
1-c6烷基)-n(r
x
)(ry)、-(c
1-c6烷基)-co2h、c
1-c6烷氧基、-n(r
x
)(ry)、-co-n(r
x
)(ry)、co2h、-co2(c
1-c6烷基)、-co2bn、-co(c
1-c6烷基)、苯基、5至6元杂芳基、4至6元杂环基和c
3-c
10
环烷基,其各自任选独立地被一个或多个选自以下的基团取代:卤素、氰基、c
1-c6烷基、卤代烷基、羟基、c
1-c6烷氧基、c
1-c6卤代烷氧基和-co2(c
1-c6烷基),
[0060]
或同一碳上的r8和r9一起形成氧代基;
[0061]-每个rb独立地选自氢、卤素、c
1-c6卤代烷基、c
1-c6烷基、c
2-c6烯基、c
2-c6炔基、羟
基、c
1-c6烷氧基、c
1-c6卤代烷氧基、-co2h、-c(o)n(r
x
)(ry)、苯基、3至8元环烷基、5至6元杂芳基和5至6元杂环基,其各自被0、1、2、3、4或5个r
10
基团取代,并且任选地一个r1和一个rb连同其所连接的原子一起形成5至6元杂环烷基、或5至6元杂芳基环,其各自被0、1、2、3或4个r
10
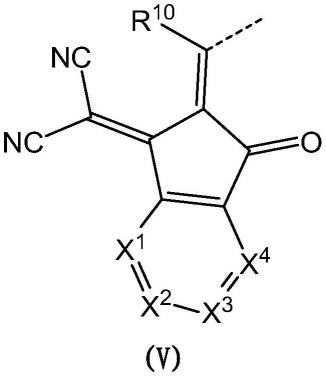
基团取代;并且
[0062]-每个r
x
和ry独立地选自氢、c
1-c6烷基、c
1-c6卤代烷基、c
4-c9杂环基、3至6元环烷基、5至6元杂芳基、苄基、-co2(c
1-c6烷基)、-co(c
1-c6烷基),其中所述c
1-c6烷基任选地被-nme2取代,并且其中所述c
4-c9杂环基任选地被-(c
1-c6烷基)-o(c
1-c6烷基)或-co2(c
1-c6烷基)取代。
[0063]
式(i)还包括式(iii)的化合物:
[0064][0065]
那些化合物的互变异构体、所述化合物和互变异构体中任一者的氘化衍生物,以及前述任一者的药学上可接受的盐,其中:
[0066]-环a是苯基、吲哚、5元杂芳基环或6元杂芳基环;
[0067]-环b是苯基、吡啶基或嘧啶基环;
[0068]-环d是苯基环、5元杂环基环、6元杂环基环、5元杂芳基环、6元杂芳基环、3至8元环烷基环或3至8元环烯基;
[0069]-x是o、nh或n(c
1-c6烷基);
[0070]-每个r1独立地选自c
1-c6烷基、c
1-c6烷氧基、c
1-c6卤代烷基、c
1-c6卤代烷氧基、卤素、氰基和羟基,或两个r1基团连同其所连接的原子一起形成5至6元杂芳基或6元芳基环;
[0071]-m是0、1、2、3或4;
[0072]-每个r2独立地选自视情况被苯基或5元或6元杂芳基取代的c
1-c6烷基、c
1-c6烷氧基、c
1-c6卤代烷基、c
1-c6卤代烷氧基、卤素、氰基和羟基,或任选地两个r2连同其所连接的原子一起形成苯基或6元杂芳基环,其任选独立地被一个或多个选自以下的基团取代:卤素、c
1-c6烷基、卤代烷基、羟基、c
1-c6烷氧基和c
1-c6卤代烷氧基;
[0073]-n是0、1或2;
[0074]-每个r3是被0、1、2、3、4、5或6个3至8元环烷基环或5元或6元芳基取代的c
1-c6烷基,或两个r3接合形成c
3-c6环烷基环;
[0075]-每个r4独立地选自卤素、氧代基、羟基、氰基和-(y)
k-r7基团,或任选地两个r4连同其所连接的原子一起形成5至6元环烷基或杂环基环,其任选独立地被一个或多个选自以下的基团取代:卤素、c
1-c6烷基、卤代烷基、羟基、c
1-c6烷氧基和c
1-c6卤代烷氧基;其中:
[0076]-k是0、1、2、3、4、5或6;
[0077]-每个y独立地选自c(r5)(r6)基团、
–o–
和
–
nra–
基团,其中-(y)
k-r7中的杂原子不键结至-(y)
k-r7中的另一个杂原子,其中:
[0078]-每个r5和r6独立地选自氢、卤素、羟基、c
1-c6烷基和c
3-5
环烷基,或同一碳上的r5和r6一起形成c
3-5
环烷基或氧代基;
[0079]-r5和r6各自任选独立地被一个或多个选自以下的基团取代:c
1-c6烷基、c
1-c6卤代烷基、卤素、羟基、c
1-c6烷氧基和c
1-c6卤代烷氧基;并且
[0080]-每个ra独立地选自氢和c
1-c6烷基;并且
[0081]-r7选自氢、卤素、氰基和任选地被一个或多个选自以下的基团取代的c
3-c
10
环烷基:c
1-c6烷基、c
1-c6卤代烷基和卤素;
[0082]-q是1、2、3或4;并且
[0083]-z是式(l)r的二价连接基团,其中:
[0084]-r是1、2、3、4、5或6;
[0085]-每个l独立地选自c(r8)(r9)基团、
–o–
和
–
nrb–
基团,其中z中的杂原子不键结到z中的另一个杂原子,并且其中是5或6元杂环基、或5或6元杂芳基,其各自被0、1、2、3或4个r
10
基团取代;并且其中:
[0086]-r8和r9各自独立地选自氢、卤素、c
1-c6卤代烷基、c
1-c6烷基、c
2-c6烯基、c
2-c6炔基、羟基、c
1-c6烷氧基、c
1-c6卤代烷氧基、co2h、c(o)n(r
x
)(ry)、苯基、3至8元环烷基、5至6元杂芳基和5至6元杂环基,其各自被0、1、2、3、4或5个r
10
基团取代;
[0087]
每个r
10
独立地选自卤素、羟基、氰基、c
1-c6烷基、c
2-c6烯基、c
2-c6炔基、-(c
1-c6烷基)-o(c
1-c6烷基)、-(c
1-c6烷基)-co2(c
1-c6烷基)、-(c
1-c6烷基)-n(r
x
)(ry)、-(c
1-c6烷基)-co2h、c
1-c6烷氧基、-n(r
x
)(ry)、-co-n(r
x
)(ry)、co2h、-co2(c
1-c6烷基)、-co2bn、-co(c
1-c6烷基)、苯基、5至6元杂芳基、4至6元杂环基和c
3-c
10
环烷基,其各自任选独立地被一个或多个选自以下的基团取代:卤素、氰基、c
1-c6烷基、卤代烷基、羟基、c
1-c6烷氧基、c
1-c6卤代烷氧基和-co2(c
1-c6烷基),
[0088]
或同一碳上的r8和r9一起形成氧代基;并且
[0089]-每个rb独立地选自氢、苯基和c
1-c6烷基,其中所述c
1-c6烷基任选独立地被一个或多个选自以下的基团取代:羟基、-c(o)n(r
x
)(ry)、氰基、4至6元杂环基、视情况被c
1-c6烷基取代的5元杂芳基;
[0090]-每个r
x
和ry独立地选自氢、c
1-c6烷基、c
1-c6卤代烷基、c
4-c9杂环基、3至6元环烷基、5至6元杂芳基、苄基、-co2(c
1-c6烷基)、-co(c
1-c6烷基),其中所述c
1-c6烷基任选地被-nme2取代,并且其中所述c
4-c9杂环基任选地被-(c
1-c6烷基)-o(c
1-c6烷基)或-co2(c
1-c6烷基)取代;
[0091]
条件是r8和r9中的至少一者独立地选自c
3-c6卤代烷基、c
3-c6烷基、c
2-c6烯基、c
2-c6炔基、c
3-c6烷氧基、c
3-c6卤代烷氧基、苯基、5至6元杂芳基和5至6元杂环基,或至少一个r3是被0、1、2、3、4、5或6个3至8元环烷基环或5元或6元芳基取代的c
2-c6烷基,或被1、2、3、4、5或6个3至8元环烷基环或5元或6元芳基取代的c1烷基,或两个r3接合形成c
3-c6环烷基环。
[0092]
本发明的另一个方面提供药物组合物,其包含至少一种选自本文公开的新颖化合
物、其药学上可接受的盐和前述任一者的氘化衍生物的化合物,以及至少一种药学上可接受的载体,所述组合物可进一步包含至少一种另外的活性药物成分。因此,本发明的另一个方面提供治疗cftr介导的疾病囊性纤维化的方法,所述方法包括向有需要的受试者施用至少一种选自本文公开的新颖化合物、其药学上可接受的盐和前述任一者的氘化衍生物的化合物,以及至少一种药学上可接受的载体,任选地包含至少一种另外的组分作为药物组合物的一部分。
[0093]
在某些实施方案中,本发明的药物组合物包含至少一种选自以下的化合物:式(i)的化合物;式(ii)、(ii-ai)、(ii-aii)、(ii-aiii)、(ii-aiv)、(ii-av)、(ii-avi)、(ii-bi)、(ii-bii)、(ii-biii)、(ii-biv)、(ii-bv)、(ii-bvi)、(ii-ci)、(ii-cii)、(ii-ciii)、(ii-civ)、(ii-cv)和(ii-cvi)的化合物;化合物1-298;式(iii)、(iii-ai)、(iii-aii)、(iii-aiii)、(iii-aiv)、(iii-av)、(iii-avi)、(iii-avii)、(iii-aviii)、(iii-bi)、(iii-bii)、(iii-biii)、(iii-biv)、(iii-bv)、(iii-bvi)、(iii-ci)、(iii-cii)、(iii-ciii)、(iii-civ)、(iii-cv)和(iii-cvi)的化合物;化合物299至397;化合物398-436;其互变异构体;那些化合物和互变异构体的氘化衍生物;以及前述任一者的药学上可接受的盐。在一些实施方案中,包含至少一种选自以下的化合物的组合物可以任选还包含(a)至少一种选自替扎卡托(tezacaftor)以及其药学上可接受的盐和氘化衍生物的化合物;(b)至少一种选自依伐卡托(ivacaftor)以及其药学上可接受的盐和氘化衍生物的化合物,诸如d-依伐卡托;以及/或至少一种选自鲁玛卡托(lumacaftor)以及其药学上可接受的盐和氘化衍生物的化合物:式(i)的化合物;式(ii)、(ii-ai)、(ii-aii)、(ii-aiii)、(ii-aiv)、(ii-av)、(ii-avi)、(ii-bi)、(ii-bii)、(ii-biii)、(ii-biv)、(ii-bv)、(ii-bvi)、(ii-ci)、(ii-cii)、(ii-ciii)、(ii-civ)、(ii-cv)和(ii-cvi)的化合物;化合物1-298;式(iii)、(iii-ai)、(iii-aii)、(iii-aiii)、(iii-aiv)、(iii-av)、(iii-avi)、(iii-avii)、(iii-aviii)、(iii-bi)、(iii-bii)、(iii-biii)、(iii-biv)、(iii-bv)、(iii-bvi)、(iii-ci)、(iii-cii)、(iii-ciii)、(iii-civ)、(iii-cv)和(iii-cvi)的化合物;化合物299至397;化合物398-436;其互变异构体;那些化合物和互变异构体的氘化衍生物;以及前述任一者的药学上可接受的盐。
[0094]
本发明的另一个方面提供治疗cftr介导的疾病囊性纤维化的方法,所述方法包括向有需要的患者施用至少一种选自本文公开的新颖化合物、其药学上可接受的盐和前述任一者的氘化衍生物的化合物,并且任选地进一步施用一种或多种选自以下的另外的cftr调节剂:(r)-1-(2,2-二氟苯并[d][1,3]二氧杂环戊烯-5-基)-n-(1-(2,3-二羟丙基)-6-氟-2-(1-羟基-2-甲基丙-2-基)-1h-吲哚-5-基)环丙烷甲酰胺(替扎卡托)、n-[2,4-双(1,1-二甲基乙基)-5-羟基苯基]-1,4-二氢-4-氧代基喹啉-3-甲酰胺(依伐卡托)或n-(2-(叔丁基)-5-羟基-4-(2-(甲基-d3)丙-2-基-1,1,1,3,3,3-d6)苯基)-4-氧代-1,4-二氢喹啉-3-甲酰胺(d-依伐卡托)和3-(6-(1-(2,2-二氟苯并[d][1,3]二氧杂环戊烯-5-基)环丙烷甲酰胺基)-3-甲基吡啶-2-基)苯甲酸(鲁玛卡托)。
[0095]
定义
[0096]
如本文所使用,「替扎卡托」是指(r)-1-(2,2-二氟苯并[d][1,3]二氧杂环戊烯-5-基)-n-(1-(2,3-二羟丙基)-6-氟-2-(1-羟基-2-甲基丙-2-基)-1h-吲哚-5-基)环丙烷甲酰胺,其可用以下结构描绘:
[0097][0098]
替扎卡托可以呈药学上可接受的盐形式。替扎卡托以及制备和使用替扎卡托的方法公开于wo 2010/053471、wo 2011/119984、wo 2011/133751、wo 2011/133951、wo 2015/160787和us 2009/0131492中,其各自以引用的方式并入本文。
[0099]
如本公开通篇所使用,「依伐卡托」是指n
‑‑
(5-羟基-2,4-二-叔丁基-苯基)-4-氧代-1h-喹啉-3-甲酰胺,其结构描绘如下:
[0100][0101]
依伐卡托也可以呈药学上可接受的盐形式。依伐卡托以及制备和使用依伐卡托的方法公开于wo 2006/002421、wo 2007/079139、wo 2010/108162和wo 2010/019239中,其各自以引用的方式并入本文。
[0102]
在一些实施方案中,将依伐卡托的氘化衍生物(d-依伐卡托)用于本文所公开之组合物和方法中。d-依伐卡托的化学名称是n-(2-(叔丁基)-5-羟基-4-(2-(甲基-d3)丙-2-基-1,1,1,3,3,3-d6)苯基)-4-氧代-1,4-二氢喹啉-3-甲酰胺,其结构描绘如下:
[0103][0104]
d-依伐卡托可以呈药学上可接受的盐形式。d-依伐卡托以及制备和使用d-依伐卡托的方法公开于wo 2012/158885、wo 2014/078842和美国专利第8,865,902号中,其以引用方式并入本文。
[0105]
如本文所使用,「鲁玛卡托」是指3-(6-(1-(2,2-二氟苯并[d][1,3]二氧杂环戊烯-5-基)环丙烷甲酰胺基)-3-甲基吡啶-2-基)苯甲酸,其化学结构描绘如下:
[0106][0107]
鲁玛卡托可以呈药学上可接受的盐形式。鲁玛卡托以及制备和使用鲁玛卡托的方法公开于wo 2007/056341、wo 2009/073757和wo 2009/076142中,其以引用方式并入本文。
civ)、(ii-cv)和(ii-cvi)的化合物;化合物1-298;式(iii)、(iii-ai)、(iii-aii)、(iii-aiii)、(iii-aiv)、(iii-av)、(iii-avi)、(iii-avii)、(iii-aviii)、(iii-bi)、(iii-bii)、(iii-biii)、(iii-biv)、(iii-bv)、(iii-bvi)、(iii-ci)、(iii-cii)、(iii-ciii)、(iii-civ)、(iii-cv)和(iii-cvi)的化合物;化合物299至397;化合物398-436;其互变异构体;那些化合物和互变异构体的氘化衍生物;以及前述任一者的药学上可接受的盐,结合该组合提及的“依伐卡托或d-依伐卡托”意指,该组合中包括依伐卡托或d-依伐卡托而非两者。
[0122]
如本文所使用,术语“活性药物成分”或“治疗剂”(“api”)是指生物活性化合物。
[0123]
术语“患者”和“受试者”可互换使用并且指包括人的动物。
[0124]
术语“有效剂量”和“有效量”在本文中可互换使用,并且指产生施用化合物所期望的效果(例如,cf或cf的症状改善,或或cf或cf症状的严重程度减轻)的化合物的量。有效剂量的确切量将取决于治疗目的,并且将由本领域技术人员使用已知技术确定(参见例如lloyd(1999)the art,science and technology of pharmaceutical compounding)。
[0125]
如本文所使用,术语“治疗(treatment/treating)”等通常意指改善受试者的cf的一种或多种症状,或减轻cf或cf的一种或多种症状的严重程度。如本文所使用,“治疗”包括但不限于以下:受试者的生长增加、体重增益增加、肺粘液减少、胰腺和/或肝功能改善、胸部感染减轻和/或咳嗽或呼吸急促减轻。可以根据本领域已知的标准方法和技术容易地评估这些症状中任一者的改善或其严重程度的减轻。
[0126]
如本文所使用,当提及两种或更多种化合物、药剂或另外的药物活性成分时,术语“与
……
组合”意指在彼此之前、与其同时或在其之后向患者施用两种或更多种化合物、药剂或药物活性成分。
[0127]
当与组合物或剂型的成分的剂量、量或重量百分比结合使用时,术语“约”和“大约”包括包括本领域的普通技术人员认为可提供与自指定剂量、量或重量百分比所获得的药理学作用等效的药理学作用的指定剂量、量或重量百分比的值、或该剂量、量或重量百分比的范围。术语“约”和“大约”可以指由本领域技术人员确定的特定值的可接受误差,其部分取决于如何测量或确定所述值。在一些实施方案中,术语“约”和“大约”意指给定值或范围的20%、15%、10%、5%、4%、3%、2%、1%或0.5%以内。
[0128]
如本文所使用,术语“溶剂”是指可至少部分溶解产物(产物溶解度>1g/l)的任何液体。
[0129]
如本文所使用,术语“室温”或“环境温度”意指15℃至30℃。
[0130]
应理解,本发明的某些化合物可以单独立体异构体或对映异构体和/或那些立体异构体或对映异构体的混合物形式存在。
[0131]
本文公开的某些化合物可以互变异构体形式存在,并且两种互变异构形式都是预期的,即使仅描绘单一互变异构结构。例如,化合物a的描述应理解为包括其互变异构体化合物b,且反之亦然,以及其混合物:
[0132][0133]
如本文所使用,“最低功能(mf)突变”是指与最低cftr功能相关的cftr基因突变(极低至无功能cftr蛋白),并且包括例如与cftr通道打开和关闭能力的严重缺乏相关的突变,称为缺陷型通道门控或“门控突变”;与cftr细胞加工及其向细胞表面的递送的严重缺乏相关的突变;与没有(或最少)cftr合成相关的突变;以及与通道传导的严重缺陷相关的突变。
[0134]
如本文所使用,术语“药学上可接受的盐”是指本公开的化合物的盐形式,其中盐是无毒的。本公开的化合物的药学上可接受的盐包括衍生自合适的无机和有机酸和碱的那些盐。例如,化合物的“游离碱”形式不含离子键结的盐。
[0135]
关于本发明的一种或多种化合物或式,短语“以及其药学上可接受的盐和氘化衍生物”与“以及其药学上可接受的盐和前述任一者的氘化衍生物”可互换使用。这些短语旨在涵盖所提及的化合物中任一者的药学上可接受的盐、所提及的化合物中任一者的氘化衍生物和那些氘化衍生物的药学上可接受的盐。
[0136]
本领域的普通技术人员将认识到,当公开“化合物或其药学上可接受的盐”的量时,化合物的药学上可接受的盐形式的量是等于化合物的游离碱的浓度的量。应注意,本文所公开的化合物或其药学上可接受的盐的量是以其游离碱形式计。
[0137]
合适的药学上可接受的盐是例如s.m.berge等人j.pharmaceutical sciences,1977,
66
,1-19中所公开的那些盐。例如,该文章的表1提供以下药学上可接受的盐:
[0138]
表1:
[0139]
[0140][0141]
药学上可接受的酸加成盐的非限制性实例包括:与无机酸形成的盐,所述无机酸诸如盐酸、氢溴酸、磷酸、硫酸或高氯酸;与有机酸形成的盐,所述有机酸诸如乙酸、草酸、马来酸、酒石酸、柠檬酸、琥珀酸或丙二酸;以及通过使用本领域中使用的其他方法诸如离子交换形成的盐。药学上可接受的盐的非限制性实例包括己二酸盐、褐藻酸盐、抗坏血酸、天冬氨酸盐、苯磺酸盐、苯甲酸盐、硫酸氢盐、硼酸盐、丁酸盐、樟脑酸盐、樟脑磺酸盐、柠檬酸盐、环戊烷丙酸盐、二葡萄糖酸盐、十二烷基硫酸、乙烷磺酸盐、甲酸盐、富马酸盐、葡庚糖酸盐、甘油磷酸盐、葡糖酸盐、半硫酸盐、庚酸盐、己酸盐、氢碘酸盐、2-羟基-乙烷磺酸盐、乳糖醛酸盐、乳酸盐、月桂酸盐、月桂基硫酸盐、苹果酸盐、马来酸盐、丙二酸盐、甲烷磺酸盐、2-萘磺酸盐、烟酸盐、硝酸盐、油酸盐、草酸盐、棕榈酸盐、双羟萘酸盐、果胶酸盐、过硫酸盐、3-苯基丙酸盐、磷酸盐、苦味酸盐、特戊酸盐、丙酸盐、硬脂酸盐、琥珀酸盐、硫酸盐、酒石酸盐、硫氰酸盐、对甲苯磺酸盐、十一烷酸盐和戊酸盐。衍生自适当碱的药学上可接受的盐包括碱金属、碱土金属、铵和n
(c
1-4
烷基)4盐。本公开还设想本文公开的化合物的任何碱性含氮基
团的季铵化。碱金属和碱土金属盐的合适非限制性实例包括钠、锂、钾、钙和镁。药学上可接受的盐的其他非限制性实例包括铵、季铵以及使用抗衡离子诸如卤离子、氢氧根、羧酸根、硫酸根、磷酸根、硝酸根、低碳数烷基磺酸根和芳基磺酸根形成的胺阳离子。药学上可接受的盐的其他合适的非限制性实例包括苯磺酸盐和葡糖胺盐。
[0142]
实施方案的详细描述
[0143]
除了式(ii)的化合物、其互变异构体、那些化合物和互变异构体的氘化衍生物以及前述任一者的药学上可接受的盐之外,本发明提供式(ii-ai)、(ii-aii)、(ii-aiii)、(ii-aiv)、(ii-av)、(ii-avi)、(ii-bi)、(ii-bii)、(ii-biii)、(ii-biv)、(ii-bv)、(ii-bvi)、(ii-ci)、(ii-cii)、(ii-ciii)、(ii-civ)、(ii-cv)和(ii-cvi)的化合物、化合物1-298、其互变异构体、那些化合物和互变异构体的氘化衍生物以及前述任一者的药学上可接受的盐。
[0144]
例如,在一些实施方案中,式(ii)的化合物是式(ii-ai)的化合物:
[0145][0146]
其互变异构体、所述化合物或所述互变异构体的氘化衍生物、或前述任一者的药学上可接受的盐,其中:
[0147]-环a是苯基、吲哚、5元杂芳基环或6元杂芳基环;-x是o、nh或n(c
1-c6烷基);
[0148]-每个r1独立地选自c
1-c6烷基、c
1-c6烷氧基、c
1-c6卤代烷基、c
1-c6卤代烷氧基、卤素、氰基和羟基,或两个r1基团连同其所连接的原子一起形成5至6元杂芳基或6元芳基环;
[0149]-m是0、1、2、3或4;
[0150]-每个r2独立地选自任选地被苯基或5元或6元杂芳基取代的c
1-c6烷基、c
1-c6烷氧基、c
1-c6卤代烷基、c
1-c6卤代烷氧基、卤素、氰基和羟基;
[0151]-r
11
选自氢、卤素、c
1-c6烷基、c
1-c6烷氧基、c
1-c6卤代烷基、c
1-c6卤代烷氧基、c
2-c6烯基、c
2-c6炔基、苄基、-o-(c
3-c6环烷基)和氰基,其各自被0、1、2或3个r
12
基团取代,或任选地一个r2和r
11
连同其所连接的原子一起形成5至6元环烷基、5至6元杂环基或6元芳基环,其被以下取代:苯基环、5元杂环基环、6元杂环基环、5元杂芳基环、6元杂芳基环、3至8元环烷基环、3至8元环烯基,或0、1、2、3或4个r2基团;
[0152]-每个r
12
独立地选自卤素、羟基、氰基、c
1-c6烷基、c
2-c6烯基、c
2-c6炔基、-(c
1-c6烷基)-o(c
1-c6烷基)、-(c
1-c6烷基)-co2(c
1-c6烷基)、-(c
1-c6烷基)-n(r
x
)(ry)、-(c
1-c6烷基)-co2h、c
1-c6烷氧基、-n(r
x
)(ry)、-co-n(r
x
)(ry)、co2h、-co2(c
1-c6烷基)、-co2bn、-co(c
1-c6烷基)、苯基、5至6元杂芳基、4至6元杂环基和c
3-c
10
环烷基,其各自任选独立地被一个或多个选自以下的基团取代:卤素、氰基、c
1-c6烷基、卤代烷基、羟基、c
1-c6烷氧基、c
1-c6卤代烷氧
基和-co2(c
1-c6烷基),
[0153]-n是0、1或2;
[0154]-每个r3是被0、1、2、3、4、5或6个3至8元环烷基环或5元或6元芳基取代的c
1-c6烷基,或两个r3接合形成c
3-c6环烷基环;
[0155]-z是式(l)r的二价连接基团,其中:
[0156]-r是1、2、3、4、5或6;
[0157]-每个l独立地选自c(r8)(r9)基团、
–o–
和
–
nrb–
基团,其中z中的杂原子不键结到z中的另一个杂原子,并且其中是5或6元杂环基、或5或6元杂芳基,其各自被0、1、2、3或4个r
10
基团取代;并且其中:
[0158]-r8和r9各自独立地选自氢、卤素、c
1-c6卤代烷基、c
1-c6烷基、c
2-c6烯基、c
2-c6炔基、羟基、c
1-c6烷氧基、c
1-c6卤代烷氧基、co2h、c(o)n(r
x
)(ry)、苯基、3至8元环烷基、5至6元杂芳基和5至6元杂环基,其各自被0、1、2、3、4或5个r
10
基团取代;
[0159]-每个r
10
独立地选自卤素、羟基氰基、c
1-c6烷基、c
2-c6烯基、c
2-c6炔基、-(c
1-c6烷基)-o(c
1-c6烷基)、-(c
1-c6烷基)-co2(c
1-c6烷基)、-(c
1-c6烷基)-n(r
x
)(ry)、-(c
1-c6烷基)-co2h、c
1-c6烷氧基、-n(r
x
)(ry)、-co-n(r
x
)(ry)、co2h、-co2(c
1-c6烷基)、-co2bn、-co(c
1-c6烷基)、苯基、5至6元杂芳基、4至6元杂环基和c
3-c
10
环烷基,其各自任选独立地被一个或多个选自以下的基团取代:卤素、氰基、c
1-c6烷基、卤代烷基、羟基、c
1-c6烷氧基、c
1-c6卤代烷氧基和-co2(c
1-c6烷基),
[0160]
或同一碳上的r8和r9一起形成氧代基;
[0161]-每个rb独立地选自氢、卤素、c
1-c6卤代烷基、c
1-c6烷基、c
2-c6烯基、c
2-c6炔基、羟基、c
1-c6烷氧基、c
1-c6卤代烷氧基、-co2h、-c(o)n(r
x
)(ry)、苯基、3至8元环烷基、5至6元杂芳基和5至6元杂环基,其各自被0、1、2、3、4或5个r
10
基团取代,并且任选地一个r1和一个rb连同其所连接的原子一起形成5至6元杂环烷基、或5至6元杂芳基环,其各自被0、1、2、3或4个r
10
基团取代;并且
[0162]-每个r
x
和ry独立地选自氢、c
1-c6烷基、c
1-c6卤代烷基、c
4-c9杂环基、3至6元环烷基、5至6元杂芳基、苄基、-co2(c
1-c6烷基)、-co(c
1-c6烷基),其中所述c
1-c6烷基任选地被-nme2取代,并且其中所述c
4-c9杂环基任选地被-(c
1-c6烷基)-o(c
1-c6烷基)或-co2(c
1-c6烷基)取代。
[0163]
在一些实施方案中,式(ii)的化合物是式(ii-aii)、(ii-aiii)或(ii-aiv)的化合物:
[0164][0165]
其互变异构体、所述化合物或所述互变异构体的氘化衍生物、或前述任一者的药学上可接受的盐,其中:
[0166]-环a是苯基、吲哚、5元杂芳基环或6元杂芳基环;
[0167]-每个r1独立地选自c
1-c6烷基、c
1-c6烷氧基、c
1-c6卤代烷基、c
1-c6卤代烷氧基、卤素、氰基和羟基,或两个r1基团连同其所连接的原子一起形成5至6元杂芳基或6元芳基环;
[0168]-m是0、1、2、3或4;
[0169]-每个r2独立地选自任选地被苯基或5元或6元杂芳基取代的c
1-c6烷基、c
1-c6烷氧基、c
1-c6卤代烷基、c
1-c6卤代烷氧基、卤素、氰基和羟基;
[0170]-r
11
选自氢、卤素、c
1-c6烷基、c
1-c6烷氧基、c
1-c6卤代烷基、c
1-c6卤代烷氧基、c
2-c6烯基、c
2-c6炔基、苄基、-o-(c
3-c6环烷基)和氰基,其各自被0、1、2或3个r
12
基团取代,或任选地一个r2和r
11
连同其所连接的原子一起形成5至6元环烷基、5至6元杂环基或6元芳基环,其被以下取代:苯基环、5元杂环基环、6元杂环基环、5元杂芳基环、6元杂芳基环、3至8元环烷基环、3至8元环烯基,或0、1、2、3或4个r2基团;
[0171]-每个r
12
独立地选自卤素、羟基、氰基、c
1-c6烷基、c
2-c6烯基、c
2-c6炔基、-(c
1-c6烷基)-o(c
1-c6烷基)、-(c
1-c6烷基)-co2(c
1-c6烷基)、-(c
1-c6烷基)-n(r
x
)(ry)、-(c
1-c6烷基)-co2h、c
1-c6烷氧基、-n(r
x
)(ry)、-co-n(r
x
)(ry)、co2h、-co2(c
1-c6烷基)、-co2bn、-co(c
1-c6烷基)、苯基、5至6元杂芳基、4至6元杂环基和c
3-c
10
环烷基,其各自任选独立地被一个或多个选自以下的基团取代:卤素、氰基、c
1-c6烷基、卤代烷基、羟基、c
1-c6烷氧基、c
1-c6卤代烷氧基和-co2(c
1-c6烷基),
[0172]-n是0、1或2;
[0173]-每个r3是被0、1、2、3、4、5或6个3至8元环烷基环或5元或6元芳基取代的c
1-c6烷基,或两个r3接合形成c
3-c6环烷基环;
[0174]-z是式(l)r的二价连接基团,其中:
[0175]-r是1、2、3、4、5或6;
[0176]-每个l独立地选自c(r8)(r9)基团、
–o–
和
–
nrb–
基团,其中z中的杂原子不键结到z中的另一个杂原子,并且其中是5或6元杂环基、或5或6元杂芳基,其各自被0、1、2、3或4个r
10
基团取代;并且其中:
[0177]-r8和r9各自独立地选自氢、卤素、c
1-c6卤代烷基、c
1-c6烷基、c
2-c6烯基、c
2-c6炔基、羟基、c
1-c6烷氧基、c
1-c6卤代烷氧基、co2h、c(o)n(r
x
)(ry)、苯基、3至8元环烷基、5至6元杂芳基和5至6元杂环基,其各自被0、1、2、3、4或5个r
10
基团取代;
[0178]-每个r
10
独立地选自卤素、羟基氰基、c
1-c6烷基、c
2-c6烯基、c
2-c6炔基、-(c
1-c6烷基)-o(c
1-c6烷基)、-(c
1-c6烷基)-co2(c
1-c6烷基)、-(c
1-c6烷基)-n(r
x
)(ry)、-(c
1-c6烷基)-co2h、c
1-c6烷氧基、-n(r
x
)(ry)、-co-n(r
x
)(ry)、co2h、-co2(c
1-c6烷基)、-co2bn、-co(c
1-c6烷基)、苯基、5至6元杂芳基、4至6元杂环基和c
3-c
10
环烷基,其各自任选独立地被一个或多个选自以下的基团取代:卤素、氰基、c
1-c6烷基、卤代烷基、羟基、c
1-c6烷氧基、c
1-c6卤代烷氧基和-co2(c
1-c6烷基),
[0179]
或同一碳上的r8和r9一起形成氧代基;
[0180]-每个rb独立地选自氢、卤素、c
1-c6卤代烷基、c
1-c6烷基、c
2-c6烯基、c
2-c6炔基、羟基、c
1-c6烷氧基、c
1-c6卤代烷氧基、-co2h、-c(o)n(r
x
)(ry)、苯基、3至8元环烷基、5至6元杂芳基和5至6元杂环基,其各自被0、1、2、3、4或5个r
10
基团取代,并且任选地一个r1和一个rb连同其所连接的原子一起形成5至6元杂环烷基、或5至6元杂芳基环,其各自被0、1、2、3或4个r
10
基团取代;并且
[0181]-每个r
x
和ry独立地选自氢、c
1-c6烷基、c
1-c6卤代烷基、c
4-c9杂环基、3至6元环烷基、5至6元杂芳基、苄基、-co2(c
1-c6烷基)、-co(c
1-c6烷基),其中所述c
1-c6烷基任选地被-nme2取代,并且其中所述c
4-c9杂环基任选地被-(c
1-c6烷基)-o(c
1-c6烷基)或-co2(c
1-c6烷基)取代。
[0182]
在一些实施方案中,式(ii)的化合物是式(ii-av)的化合物:
[0183][0184]
其互变异构体、所述化合物或所述互变异构体的氘化衍生物、或前述任一者的药学上可接受的盐,其中:
[0185]-由*表示的碳具有s-立体化学或r-立体化学;
[0186]-环a是苯基、吲哚、5元杂芳基环或6元杂芳基环;
[0187]-每个r1独立地选自c
1-c6烷基、c
1-c6烷氧基、c
1-c6卤代烷基、c
1-c6卤代烷氧基、卤素、氰基和羟基,或两个r1基团连同其所连接的原子一起形成5至6元杂芳基或6元芳基环;
[0188]-m是0、1、2、3或4;
[0189]-每个r2独立地选自任选地被苯基或5元或6元杂芳基取代的c
1-c6烷基、c
1-c6烷氧基、c
1-c6卤代烷基、c
1-c6卤代烷氧基、卤素、氰基和羟基;
[0190]-r
11
选自氢、卤素、c
1-c6烷基、c
1-c6烷氧基、c
1-c6卤代烷基、c
1-c6卤代烷氧基、c
2-c6烯基、c
2-c6炔基、苄基、-o-(c
3-c6环烷基)和氰基,其各自被0、1、2或3个r
12
基团取代,或任选地一个r2和r
11
连同其所连接的原子一起形成5至6元环烷基、5至6元杂环基或6元芳基环,其被以下取代:苯基环、5元杂环基环、6元杂环基环、5元杂芳基环、6元杂芳基环、3至8元环烷基环、3至8元环烯基,或0、1、2、3或4个r2基团;
[0191]-每个r
12
独立地选自卤素、羟基、氰基、c
1-c6烷基、c
2-c6烯基、c
2-c6炔基、-(c
1-c6烷基)-o(c
1-c6烷基)、-(c
1-c6烷基)-co2(c
1-c6烷基)、-(c
1-c6烷基)-n(r
x
)(ry)、-(c
1-c6烷基)-co2h、c
1-c6烷氧基、-n(r
x
)(ry)、-co-n(r
x
)(ry)、co2h、-co2(c
1-c6烷基)、-co2bn、-co(c
1-c6烷基)、苯基、5至6元杂芳基、4至6元杂环基和c
3-c
10
环烷基,其各自任选独立地被一个或多个选自以下的基团取代:卤素、氰基、c
1-c6烷基、卤代烷基、羟基、c
1-c6烷氧基、c
1-c6卤代烷氧基和-co2(c
1-c6烷基),
[0192]-n是0、1或2;
[0193]-每个r3是被0、1、2、3、4、5或6个3至8元环烷基环或5元或6元芳基取代的c
1-c6烷基,或两个r3接合形成c
3-c6环烷基环;
[0194]-z是式(l)r的二价连接基团,其中:
[0195]-r是1、2、3、4、5或6;
[0196]-每个l独立地选自c(r8)(r9)基团、
–o–
和
–
nrb–
基团,其中z中的杂原子不键结到z中的另一个杂原子,并且其中是5或6元杂环基、或5或6元杂芳基,其各自
烯基、c
2-c6炔基、苄基、-o-(c
3-c6环烷基)和氰基,其各自被0、1、2或3个r
12
基团取代,或任选地一个r2和r
11
连同其所连接的原子一起形成5至6元环烷基、5至6元杂环基或6元芳基环,其被以下取代:苯基环、5元杂环基环、6元杂环基环、5元杂芳基环、6元杂芳基环、3至8元环烷基环、3至8元环烯基,或0、1、2、3或4个r2基团;
[0210]-每个r
12
独立地选自卤素、羟基、氰基、c
1-c6烷基、c
2-c6烯基、c
2-c6炔基、-(c
1-c6烷基)-o(c
1-c6烷基)、-(c
1-c6烷基)-co2(c
1-c6烷基)、-(c
1-c6烷基)-n(r
x
)(ry)、-(c
1-c6烷基)-co2h、c
1-c6烷氧基、-n(r
x
)(ry)、-co-n(r
x
)(ry)、co2h、-co2(c
1-c6烷基)、-co2bn、-co(c
1-c6烷基)、苯基、5至6元杂芳基、4至6元杂环基和c
3-c
10
环烷基,其各自任选独立地被一个或多个选自以下的基团取代:卤素、氰基、c
1-c6烷基、卤代烷基、羟基、c
1-c6烷氧基、c
1-c6卤代烷氧基和-co2(c
1-c6烷基),
[0211]-n是0、1或2;
[0212]-每个r3是被0、1、2、3、4、5或6个3至8元环烷基环或5元或6元芳基取代的c
1-c6烷基,或两个r3接合形成c
3-c6环烷基环;
[0213]-z是式(l)r的二价连接基团,其中:
[0214]-r是1、2、3、4、5或6;
[0215]-每个l独立地选自c(r8)(r9)基团、
–o–
和
–
nrb–
基团,其中z中的杂原子不键结到z中的另一个杂原子,并且其中是5或6元杂环基、或5或6元杂芳基,其各自被0、1、2、3或4个r
10
基团取代;并且其中:
[0216]-r8和r9各自独立地选自氢、卤素、c
1-c6卤代烷基、c
1-c6烷基、c
2-c6烯基、c
2-c6炔基、羟基、c
1-c6烷氧基、c
1-c6卤代烷氧基、co2h、c(o)n(r
x
)(ry)、苯基、3至8元环烷基、5至6元杂芳基和5至6元杂环基,其各自被0、1、2、3、4或5个r
10
基团取代;
[0217]-每个r
10
独立地选自卤素、羟基氰基、c
1-c6烷基、c
2-c6烯基、c
2-c6炔基、-(c
1-c6烷基)-o(c
1-c6烷基)、-(c
1-c6烷基)-co2(c
1-c6烷基)、-(c
1-c6烷基)-n(r
x
)(ry)、-(c
1-c6烷基)-co2h、c
1-c6烷氧基、-n(r
x
)(ry)、-co-n(r
x
)(ry)、co2h、-co2(c
1-c6烷基)、-co2bn、-co(c
1-c6烷基)、苯基、5至6元杂芳基、4至6元杂环基和c
3-c
10
环烷基,其各自任选独立地被一个或多个选自以下的基团取代:卤素、氰基、c
1-c6烷基、卤代烷基、羟基、c
1-c6烷氧基、c
1-c6卤代烷氧基和-co2(c
1-c6烷基),
[0218]
或同一碳上的r8和r9一起形成氧代基;
[0219]-每个rb独立地选自氢、卤素、c
1-c6卤代烷基、c
1-c6烷基、c
2-c6烯基、c
2-c6炔基、羟基、c
1-c6烷氧基、c
1-c6卤代烷氧基、-co2h、-c(o)n(r
x
)(ry)、苯基、3至8元环烷基、5至6元杂芳基和5至6元杂环基,其各自被0、1、2、3、4或5个r
10
基团取代,并且任选地一个r1和一个rb连同其所连接的原子一起形成5至6元杂环烷基、或5至6元杂芳基环,其各自被0、1、2、3或4个r
10
基团取代;并且
[0220]-每个r
x
和ry独立地选自氢、c
1-c6烷基、c
1-c6卤代烷基、c
4-c9杂环基、3至6元环烷基、5至6元杂芳基、苄基、-co2(c
1-c6烷基)、-co(c
1-c6烷基),其中所述c
1-c6烷基任选地被-nme2取代,并且其中所述c
4-c9杂环基任选地被-(c
1-c6烷基)-o(c
1-c6烷基)或-co2(c
1-c6烷
基)取代。
[0221]
在一些实施方案中,式(ii)的化合物是式(ii-bi)、(ii-bii)、(ii-biii)或(ii-biv)的化合物:
[0222]
[0223]
其互变异构体、所述化合物或所述互变异构体的氘化衍生物、或前述任一者的药学上可接受的盐,其中:
[0224]-每个r1独立地选自c
1-c6烷基、c
1-c6烷氧基、c
1-c6卤代烷基、c
1-c6卤代烷氧基、卤素、氰基和羟基,或两个r1基团连同其所连接的原子一起形成5至6元杂芳基或6元芳基环;
[0225]-m是0、1、2、3或4;
[0226]-每个r2独立地选自任选地被苯基或5元或6元杂芳基取代的c
1-c6烷基、c
1-c6烷氧基、c
1-c6卤代烷基、c
1-c6卤代烷氧基、卤素、氰基和羟基;
[0227]-r
11
选自氢、卤素、c
1-c6烷基、c
1-c6烷氧基、c
1-c6卤代烷基、c
1-c6卤代烷氧基、c
2-c6烯基、c
2-c6炔基、苄基、-o-(c
3-c6环烷基)和氰基,其各自被0、1、2或3个r
12
基团取代,或任选地一个r2和r
11
连同其所连接的原子一起形成5至6元环烷基、5至6元杂环基或6元芳基环,其被以下取代:苯基环、5元杂环基环、6元杂环基环、5元杂芳基环、6元杂芳基环、3至8元环烷基环、3至8元环烯基,或0、1、2、3或4个r2基团;
[0228]-每个r
12
独立地选自卤素、羟基、氰基、c
1-c6烷基、c
2-c6烯基、c
2-c6炔基、-(c
1-c6烷基)-o(c
1-c6烷基)、-(c
1-c6烷基)-co2(c
1-c6烷基)、-(c
1-c6烷基)-n(r
x
)(ry)、-(c
1-c6烷基)-co2h、c
1-c6烷氧基、-n(r
x
)(ry)、-co-n(r
x
)(ry)、co2h、-co2(c
1-c6烷基)、-co2bn、-co(c
1-c6烷基)、苯基、5至6元杂芳基、4至6元杂环基和c
3-c
10
环烷基,其各自任选独立地被一个或多个选自以下的基团取代:卤素、氰基、c
1-c6烷基、卤代烷基、羟基、c
1-c6烷氧基、c
1-c6卤代烷氧基和-co2(c
1-c6烷基),
[0229]-n是0、1或2;
[0230]-每个r3是被0、1、2、3、4、5或6个3至8元环烷基环或5元或6元芳基取代的c
1-c6烷基,或两个r3接合形成c
3-c6环烷基环;
[0231]-z是式(l)r的二价连接基团,其中:
[0232]-r是1、2、3、4、5或6;
[0233]-每个l独立地选自c(r8)(r9)基团、
–o–
和
–
nrb–
基团,其中z中的杂原子不键结到z中的另一个杂原子,并且其中是5或6元杂环基、或5或6元杂芳基,其各自被0、1、2、3或4个r
10
基团取代;并且其中:
[0234]-r8和r9各自独立地选自氢、卤素、c
1-c6卤代烷基、c
1-c6烷基、c
2-c6烯基、c
2-c6炔基、羟基、c
1-c6烷氧基、c
1-c6卤代烷氧基、co2h、c(o)n(r
x
)(ry)、苯基、3至8元环烷基、5至6元杂芳基和5至6元杂环基,其各自被0、1、2、3、4或5个r
10
基团取代;
[0235]-每个r
10
独立地选自卤素、羟基氰基、c
1-c6烷基、c
2-c6烯基、c
2-c6炔基、-(c
1-c6烷基)-o(c
1-c6烷基)、-(c
1-c6烷基)-co2(c
1-c6烷基)、-(c
1-c6烷基)-n(r
x
)(ry)、-(c
1-c6烷基)-co2h、c
1-c6烷氧基、-n(r
x
)(ry)、-co-n(r
x
)(ry)、co2h、-co2(c
1-c6烷基)、-co2bn、-co(c
1-c6烷基)、苯基、5至6元杂芳基、4至6元杂环基和c
3-c
10
环烷基,其各自任选独立地被一个或多个选自以下的基团取代:卤素、氰基、c
1-c6烷基、卤代烷基、羟基、c
1-c6烷氧基、c
1-c6卤代烷氧基和-co2(c
1-c6烷基),
[0236]
或同一碳上的r8和r9一起形成氧代基;
[0237]-每个rb独立地选自氢、卤素、c
1-c6卤代烷基、c
1-c6烷基、c
2-c6烯基、c
2-c6炔基、羟基、c
1-c6烷氧基、c
1-c6卤代烷氧基、-co2h、-c(o)n(r
x
)(ry)、苯基、3至8元环烷基、5至6元杂芳基和5至6元杂环基,其各自被0、1、2、3、4或5个r
10
基团取代,并且任选地一个r1和一个rb连同其所连接的原子一起形成5至6元杂环烷基、或5至6元杂芳基环,其各自被0、1、2、3或4个r
10
基团取代;并且
[0238]-每个r
x
和ry独立地选自氢、c
1-c6烷基、c
1-c6卤代烷基、c
4-c9杂环基、3至6元环烷基、5至6元杂芳基、苄基、-co2(c
1-c6烷基)、-co(c
1-c6烷基),其中所述c
1-c6烷基任选地被-nme2取代,并且其中所述c
4-c9杂环基任选地被-(c
1-c6烷基)-o(c
1-c6烷基)或-co2(c
1-c6烷基)取代。
[0239]
在一些实施方案中,式(ii)的化合物是式(ii-bv)的化合物:
[0240][0241]
其互变异构体、所述化合物或所述互变异构体的氘化衍生物、或前述任一者的药学上可接受的盐,其中:
[0242]-由*表示的碳具有s-立体化学或r-立体化学;
[0243]-每个r1独立地选自c
1-c6烷基、c
1-c6烷氧基、c
1-c6卤代烷基、c
1-c6卤代烷氧基、卤素、氰基和羟基,或两个r1基团连同其所连接的原子一起形成5至6元杂芳基或6元芳基环;
[0244]-m是0、1、2、3或4;
[0245]-每个r2独立地选自任选地被苯基或5元或6元杂芳基取代的c
1-c6烷基、c
1-c6烷氧基、c
1-c6卤代烷基、c
1-c6卤代烷氧基、卤素、氰基和羟基;
[0246]-r
11
选自氢、卤素、c
1-c6烷基、c
1-c6烷氧基、c
1-c6卤代烷基、c
1-c6卤代烷氧基、c
2-c6烯基、c
2-c6炔基、苄基、-o-(c
3-c6环烷基)和氰基,其各自被0、1、2或3个r
12
基团取代,或任选地一个r2和r
11
连同其所连接的原子一起形成5至6元环烷基、5至6元杂环基或6元芳基环,其被以下取代:苯基环、5元杂环基环、6元杂环基环、5元杂芳基环、6元杂芳基环、3至8元环烷基环、3至8元环烯基,或0、1、2、3或4个r2基团;
[0247]-每个r
12
独立地选自卤素、羟基、氰基、c
1-c6烷基、c
2-c6烯基、c
2-c6炔基、-(c
1-c6烷基)-o(c
1-c6烷基)、-(c
1-c6烷基)-co2(c
1-c6烷基)、-(c
1-c6烷基)-n(r
x
)(ry)、-(c
1-c6烷基)-co2h、c
1-c6烷氧基、-n(r
x
)(ry)、-co-n(r
x
)(ry)、co2h、-co2(c
1-c6烷基)、-co2bn、-co(c
1-c6烷基)、苯基、5至6元杂芳基、4至6元杂环基和c
3-c
10
环烷基,其各自任选独立地被一个或多个选自以下的基团取代:卤素、氰基、c
1-c6烷基、卤代烷基、羟基、c
1-c6烷氧基、c
1-c6卤代烷氧基和-co2(c
1-c6烷基),
[0248]-n是0、1或2;
[0249]-每个r3是被0、1、2、3、4、5或6个3至8元环烷基环或5元或6元芳基取代的c
1-c6烷基,或两个r3接合形成c
3-c6环烷基环;
[0250]-z是式(l)r的二价连接基团,其中:
[0251]-r是1、2、3、4、5或6;
[0252]-每个l独立地选自c(r8)(r9)基团、
–o–
和
–
nrb–
基团,其中z中的杂原子不键结到z中的另一个杂原子,并且其中是5或6元杂环基、或5或6元杂芳基,其各自被0、1、2、3或4个r
10
基团取代;并且其中:
[0253]-r8和r9各自独立地选自氢、卤素、c
1-c6卤代烷基、c
1-c6烷基、c
2-c6烯基、c
2-c6炔基、羟基、c
1-c6烷氧基、c
1-c6卤代烷氧基、co2h、c(o)n(r
x
)(ry)、苯基、3至8元环烷基、5至6元杂芳基和5至6元杂环基,其各自被0、1、2、3、4或5个r
10
基团取代;
[0254]-每个r
10
独立地选自卤素、羟基氰基、c
1-c6烷基、c
2-c6烯基、c
2-c6炔基、-(c
1-c6烷基)-o(c
1-c6烷基)、-(c
1-c6烷基)-co2(c
1-c6烷基)、-(c
1-c6烷基)-n(r
x
)(ry)、-(c
1-c6烷基)-co2h、c
1-c6烷氧基、-n(r
x
)(ry)、-co-n(r
x
)(ry)、co2h、-co2(c
1-c6烷基)、-co2bn、-co(c
1-c6烷基)、苯基、5至6元杂芳基、4至6元杂环基和c
3-c
10
环烷基,其各自任选独立地被一个或多个选自以下的基团取代:卤素、氰基、c
1-c6烷基、卤代烷基、羟基、c
1-c6烷氧基、c
1-c6卤代烷氧基和-co2(c
1-c6烷基),
[0255]
或同一碳上的r8和r9一起形成氧代基;
[0256]-每个rb独立地选自氢、卤素、c
1-c6卤代烷基、c
1-c6烷基、c
2-c6烯基、c
2-c6炔基、羟基、c
1-c6烷氧基、c
1-c6卤代烷氧基、-co2h、-c(o)n(r
x
)(ry)、苯基、3至8元环烷基、5至6元杂芳基和5至6元杂环基,其各自被0、1、2、3、4或5个r
10
基团取代,并且任选地一个r1和一个rb连同其所连接的原子一起形成5至6元杂环烷基、或5至6元杂芳基环,其各自被0、1、2、3或4个r
10
基团取代;并且
[0257]-每个r
x
和ry独立地选自氢、c
1-c6烷基、c
1-c6卤代烷基、c
4-c9杂环基、3至6元环烷基、5至6元杂芳基、苄基、-co2(c
1-c6烷基)、-co(c
1-c6烷基),其中所述c
1-c6烷基任选地被-nme2取代,并且其中所述c
4-c9杂环基任选地被-(c
1-c6烷基)-o(c
1-c6烷基)或-co2(c
1-c6烷基)取代。
[0258]
在一些实施方案中,式(ii)的化合物是式(ii-bvi)的化合物:
[0259]
[0260]
其互变异构体、所述化合物或所述互变异构体的氘化衍生物、或前述任一者的药学上可接受的盐,其中:
[0261]-每个r1独立地选自c
1-c6烷基、c
1-c6烷氧基、c
1-c6卤代烷基、c
1-c6卤代烷氧基、卤素、氰基和羟基,或两个r1基团连同其所连接的原子一起形成5至6元杂芳基或6元芳基环;
[0262]-m是0、1、2、3或4;
[0263]-每个r2独立地选自任选地被苯基或5元或6元杂芳基取代的c
1-c6烷基、c
1-c6烷氧基、c
1-c6卤代烷基、c
1-c6卤代烷氧基、卤素、氰基和羟基;
[0264]-r
11
选自氢、卤素、c
1-c6烷基、c
1-c6烷氧基、c
1-c6卤代烷基、c
1-c6卤代烷氧基、c
2-c6烯基、c
2-c6炔基、苄基、-o-(c
3-c6环烷基)和氰基,其各自被0、1、2或3个r
12
基团取代,或任选地一个r2和r
11
连同其所连接的原子一起形成5至6元环烷基、5至6元杂环基或6元芳基环,其被以下取代:苯基环、5元杂环基环、6元杂环基环、5元杂芳基环、6元杂芳基环、3至8元环烷基环、3至8元环烯基,或0、1、2、3或4个r2基团;
[0265]-每个r
12
独立地选自卤素、羟基、氰基、c
1-c6烷基、c
2-c6烯基、c
2-c6炔基、-(c
1-c6烷基)-o(c
1-c6烷基)、-(c
1-c6烷基)-co2(c
1-c6烷基)、-(c
1-c6烷基)-n(r
x
)(ry)、-(c
1-c6烷基)-co2h、c
1-c6烷氧基、-n(r
x
)(ry)、-co-n(r
x
)(ry)、co2h、-co2(c
1-c6烷基)、-co2bn、-co(c
1-c6烷基)、苯基、5至6元杂芳基、4至6元杂环基和c
3-c
10
环烷基,其各自任选独立地被一个或多个选自以下的基团取代:卤素、氰基、c
1-c6烷基、卤代烷基、羟基、c
1-c6烷氧基、c
1-c6卤代烷氧基和-co2(c
1-c6烷基),
[0266]-n是0、1或2;
[0267]-每个r3是被0、1、2、3、4、5或6个3至8元环烷基环或5元或6元芳基取代的c
1-c6烷基,或两个r3接合形成c
3-c6环烷基环;
[0268]-z是式(l)r的二价连接基团,其中:
[0269]-r是1、2、3、4、5或6;
[0270]-每个l独立地选自c(r8)(r9)基团、
–o–
和
–
nrb–
基团,其中z中的杂原子不键结到z中的另一个杂原子,并且其中是5或6元杂环基、或5或6元杂芳基,其各自被0、1、2、3或4个r
10
基团取代;并且其中:
[0271]-r8和r9各自独立地选自氢、卤素、c
1-c6卤代烷基、c
1-c6烷基、c
2-c6烯基、c
2-c6炔基、羟基、c
1-c6烷氧基、c
1-c6卤代烷氧基、co2h、c(o)n(r
x
)(ry)、苯基、3至8元环烷基、5至6元杂芳基和5至6元杂环基,其各自被0、1、2、3、4或5个r
10
基团取代;
[0272]-每个r
10
独立地选自卤素、羟基氰基、c
1-c6烷基、c
2-c6烯基、c
2-c6炔基、-(c
1-c6烷基)-o(c
1-c6烷基)、-(c
1-c6烷基)-co2(c
1-c6烷基)、-(c
1-c6烷基)-n(r
x
)(ry)、-(c
1-c6烷基)-co2h、c
1-c6烷氧基、-n(r
x
)(ry)、-co-n(r
x
)(ry)、co2h、-co2(c
1-c6烷基)、-co2bn、-co(c
1-c6烷基)、苯基、5至6元杂芳基、4至6元杂环基和c
3-c
10
环烷基,其各自任选独立地被一个或多个选自以下的基团取代:卤素、氰基、c
1-c6烷基、卤代烷基、羟基、c
1-c6烷氧基、c
1-c6卤代烷氧基和-co2(c
1-c6烷基),
[0273]
或同一碳上的r8和r9一起形成氧代基;
[0274]-每个rb独立地选自氢、卤素、c
1-c6卤代烷基、c
1-c6烷基、c
2-c6烯基、c
2-c6炔基、羟基、c
1-c6烷氧基、c
1-c6卤代烷氧基、-co2h、-c(o)n(r
x
)(ry)、苯基、3至8元环烷基、5至6元杂芳基和5至6元杂环基,其各自被0、1、2、3、4或5个r
10
基团取代,并且任选地一个r1和一个rb连同其所连接的原子一起形成5至6元杂环烷基、或5至6元杂芳基环,其各自被0、1、2、3或4个r
10
基团取代;并且
[0275]-每个r
x
和ry独立地选自氢、c
1-c6烷基、c
1-c6卤代烷基、c
4-c9杂环基、3至6元环烷基、5至6元杂芳基、苄基、-co2(c
1-c6烷基)、-co(c
1-c6烷基),其中所述c
1-c6烷基任选地被-nme2取代,并且其中所述c
4-c9杂环基任选地被-(c
1-c6烷基)-o(c
1-c6烷基)或-co2(c
1-c6烷基)取代。
[0276]
在一些实施方案中,式(ii)的化合物是式(ii-ci)、(ii-cii)、(ii-ciii)或(ii-civ)的化合物:
[0277]
[0278][0279]
其互变异构体、所述化合物或所述互变异构体的氘化衍生物、或前述任一者的药学上可接受的盐,其中:
[0280]-每个r1独立地选自c
1-c6烷基、c
1-c6烷氧基、c
1-c6卤代烷基、c
1-c6卤代烷氧基、卤素、氰基和羟基,或两个r1基团连同其所连接的原子一起形成5至6元杂芳基或6元芳基环;
[0281]-m是0、1、2、3或4;
[0282]-每个r2独立地选自任选地被苯基或5元或6元杂芳基取代的c
1-c6烷基、c
1-c6烷氧基、c
1-c6卤代烷基、c
1-c6卤代烷氧基、卤素、氰基和羟基;
[0283]-r
11
选自氢、卤素、c
1-c6烷基、c
1-c6烷氧基、c
1-c6卤代烷基、c
1-c6卤代烷氧基、c
2-c6烯基、c
2-c6炔基、苄基、-o-(c
3-c6环烷基)和氰基,其各自被0、1、2或3个r
12
基团取代,或任选地一个r2和r
11
连同其所连接的原子一起形成5至6元环烷基、5至6元杂环基或6元芳基环,其被以下取代:苯基环、5元杂环基环、6元杂环基环、5元杂芳基环、6元杂芳基环、3至8元环烷基环、3至8元环烯基,或0、1、2、3或4个r2基团;
[0284]-每个r
12
独立地选自卤素、羟基、氰基、c
1-c6烷基、c
2-c6烯基、c
2-c6炔基、-(c
1-c6烷基)-o(c
1-c6烷基)、-(c
1-c6烷基)-co2(c
1-c6烷基)、-(c
1-c6烷基)-n(r
x
)(ry)、-(c
1-c6烷基)-co2h、c
1-c6烷氧基、-n(r
x
)(ry)、-co-n(r
x
)(ry)、co2h、-co2(c
1-c6烷基)、-co2bn、-co(c
1-c6烷基)、苯基、5至6元杂芳基、4至6元杂环基和c
3-c
10
环烷基,其各自任选独立地被一个或多个选自以下的基团取代:卤素、氰基、c
1-c6烷基、卤代烷基、羟基、c
1-c6烷氧基、c
1-c6卤代烷氧基和-co2(c
1-c6烷基),
[0285]-n是0、1或2;
[0286]-每个r3是被0、1、2、3、4、5或6个3至8元环烷基环或5元或6元芳基取代的c
1-c6烷基,或两个r3接合形成c
3-c6环烷基环;
[0287]-r是1、2、3、4、5或6;
[0288]-r8和r9各自独立地选自氢、卤素、c
1-c6卤代烷基、c
1-c6烷基、c
2-c6烯基、c
2-c6炔基、羟基、c
1-c6烷氧基、c
1-c6卤代烷氧基、co2h、c(o)n(r
x
)(ry)、苯基、3至8元环烷基、5至6元杂芳基和5至6元杂环基,其各自被0、1、2、3、4或5个r
10
基团取代;
[0289]-每个r
10
独立地选自卤素、羟基氰基、c
1-c6烷基、c
2-c6烯基、c
2-c6炔基、-(c
1-c6烷基)-o(c
1-c6烷基)、-(c
1-c6烷基)-co2(c
1-c6烷基)、-(c
1-c6烷基)-n(r
x
)(ry)、-(c
1-c6烷基)-co2h、c
1-c6烷氧基、-n(r
x
)(ry)、-co-n(r
x
)(ry)、co2h、-co2(c
1-c6烷基)、-co2bn、-co(c
1-c6烷基)、苯基、5至6元杂芳基、4至6元杂环基和c
3-c
10
环烷基,其各自任选独立地被一个或多个选自以下的基团取代:卤素、氰基、c
1-c6烷基、卤代烷基、羟基、c
1-c6烷氧基、c
1-c6卤代烷氧
基和-co2(c
1-c6烷基),
[0290]
或同一碳上的r8和r9一起形成氧代基;
[0291]-每个rb独立地选自氢、卤素、c
1-c6卤代烷基、c
1-c6烷基、c
2-c6烯基、c
2-c6炔基、羟基、c
1-c6烷氧基、c
1-c6卤代烷氧基、-co2h、-c(o)n(r
x
)(ry)、苯基、3至8元环烷基、5至6元杂芳基和5至6元杂环基,其各自被0、1、2、3、4或5个r
10
基团取代,并且任选地一个r1和一个rb连同其所连接的原子一起形成5至6元杂环烷基、或5至6元杂芳基环,其各自被0、1、2、3或4个r
10
基团取代;并且
[0292]-每个r
x
和ry独立地选自氢、c
1-c6烷基、c
1-c6卤代烷基、c
4-c9杂环基、3至6元环烷基、5至6元杂芳基、苄基、-co2(c
1-c6烷基)、-co(c
1-c6烷基),其中所述c
1-c6烷基任选地被-nme2取代,并且其中所述c
4-c9杂环基任选地被-(c
1-c6烷基)-o(c
1-c6烷基)或-co2(c
1-c6烷基)取代。
[0293]
在一些实施方案中,式(ii)的化合物是式(ii-cv)的化合物:
[0294][0295]
其互变异构体、所述化合物或所述互变异构体的氘化衍生物、或前述任一者的药学上可接受的盐,其中:
[0296]-由*表示的碳具有s-立体化学或r-立体化学;
[0297]-每个r1独立地选自c
1-c6烷基、c
1-c6烷氧基、c
1-c6卤代烷基、c
1-c6卤代烷氧基、卤素、氰基和羟基,或两个r1基团连同其所连接的原子一起形成5至6元杂芳基或6元芳基环;
[0298]-m是0、1、2、3或4;
[0299]-每个r2独立地选自任选地被苯基或5元或6元杂芳基取代的c
1-c6烷基、c
1-c6烷氧基、c
1-c6卤代烷基、c
1-c6卤代烷氧基、卤素、氰基和羟基;
[0300]-r
11
选自氢、卤素、c
1-c6烷基、c
1-c6烷氧基、c
1-c6卤代烷基、c
1-c6卤代烷氧基、c
2-c6烯基、c
2-c6炔基、苄基、-o-(c
3-c6环烷基)和氰基,其各自被0、1、2或3个r
12
基团取代,或任选地一个r2和r
11
连同其所连接的原子一起形成5至6元环烷基、5至6元杂环基或6元芳基环,其被以下取代:苯基环、5元杂环基环、6元杂环基环、5元杂芳基环、6元杂芳基环、3至8元环烷基环、3至8元环烯基,或0、1、2、3或4个r2基团;
[0301]-每个r
12
独立地选自卤素、羟基、氰基、c
1-c6烷基、c
2-c6烯基、c
2-c6炔基、-(c
1-c6烷基)-o(c
1-c6烷基)、-(c
1-c6烷基)-co2(c
1-c6烷基)、-(c
1-c6烷基)-n(r
x
)(ry)、-(c
1-c6烷基)-co2h、c
1-c6烷氧基、-n(r
x
)(ry)、-co-n(r
x
)(ry)、co2h、-co2(c
1-c6烷基)、-co2bn、-co(c
1-c6烷基)、苯基、5至6元杂芳基、4至6元杂环基和c
3-c
10
环烷基,其各自任选独立地被一个或多个选自以下的基团取代:卤素、氰基、c
1-c6烷基、卤代烷基、羟基、c
1-c6烷氧基、c
1-c6卤代烷氧
基和-co2(c
1-c6烷基),
[0302]-n是0、1或2;
[0303]-每个r3是被0、1、2、3、4、5或6个3至8元环烷基环或5元或6元芳基取代的c
1-c6烷基,或两个r3接合形成c
3-c6环烷基环;
[0304]-r是1、2、3、4、5或6;
[0305]-r8和r9各自独立地选自氢、卤素、c
1-c6卤代烷基、c
1-c6烷基、c
2-c6烯基、c
2-c6炔基、羟基、c
1-c6烷氧基、c
1-c6卤代烷氧基、co2h、c(o)n(r
x
)(ry)、苯基、3至8元环烷基、5至6元杂芳基和5至6元杂环基,其各自被0、1、2、3、4或5个r
10
基团取代;
[0306]-每个r
10
独立地选自卤素、羟基氰基、c
1-c6烷基、c
2-c6烯基、c
2-c6炔基、-(c
1-c6烷基)-o(c
1-c6烷基)、-(c
1-c6烷基)-co2(c
1-c6烷基)、-(c
1-c6烷基)-n(r
x
)(ry)、-(c
1-c6烷基)-co2h、c
1-c6烷氧基、-n(r
x
)(ry)、-co-n(r
x
)(ry)、co2h、-co2(c
1-c6烷基)、-co2bn、-co(c
1-c6烷基)、苯基、5至6元杂芳基、4至6元杂环基和c
3-c
10
环烷基,其各自任选独立地被一个或多个选自以下的基团取代:卤素、氰基、c
1-c6烷基、卤代烷基、羟基、c
1-c6烷氧基、c
1-c6卤代烷氧基和-co2(c
1-c6烷基),
[0307]
或同一碳上的r8和r9一起形成氧代基;
[0308]-每个rb独立地选自氢、卤素、c
1-c6卤代烷基、c
1-c6烷基、c
2-c6烯基、c
2-c6炔基、羟基、c
1-c6烷氧基、c
1-c6卤代烷氧基、-co2h、-c(o)n(r
x
)(ry)、苯基、3至8元环烷基、5至6元杂芳基和5至6元杂环基,其各自被0、1、2、3、4或5个r
10
基团取代,并且任选地一个r1和一个rb连同其所连接的原子一起形成5至6元杂环烷基、或5至6元杂芳基环,其各自被0、1、2、3或4个r
10
基团取代;并且
[0309]-每个r
x
和ry独立地选自氢、c
1-c6烷基、c
1-c6卤代烷基、c
4-c9杂环基、3至6元环烷基、5至6元杂芳基、苄基、-co2(c
1-c6烷基)、-co(c
1-c6烷基),其中所述c
1-c6烷基任选地被-nme2取代,并且其中所述c
4-c9杂环基任选地被-(c
1-c6烷基)-o(c
1-c6烷基)或-co2(c
1-c6烷基)取代。
[0310]
在一些实施方案中,式(ii)的化合物是式(ii-cvi)的化合物:
[0311][0312]
其互变异构体、所述化合物或所述互变异构体的氘化衍生物、或前述任一者的药学上可接受的盐,其中:
[0313]-每个r1独立地选自c
1-c6烷基、c
1-c6烷氧基、c
1-c6卤代烷基、c
1-c6卤代烷氧基、卤素、氰基和羟基,或两个r1基团连同其所连接的原子一起形成5至6元杂芳基或6元芳基环;
[0314]-m是0、1、2、3或4;
[0315]-每个r2独立地选自任选地被苯基或5元或6元杂芳基取代的c
1-c6烷基、c
1-c6烷氧基、c
1-c6卤代烷基、c
1-c6卤代烷氧基、卤素、氰基和羟基;
[0316]-r
11
选自氢、卤素、c
1-c6烷基、c
1-c6烷氧基、c
1-c6卤代烷基、c
1-c6卤代烷氧基、c
2-c6烯基、c
2-c6炔基、苄基、-o-(c
3-c6环烷基)和氰基,其各自被0、1、2或3个r
12
基团取代,或任选地一个r2和r
11
连同其所连接的原子一起形成5至6元环烷基、5至6元杂环基或6元芳基环,其被以下取代:苯基环、5元杂环基环、6元杂环基环、5元杂芳基环、6元杂芳基环、3至8元环烷基环、3至8元环烯基,或0、1、2、3或4个r2基团;
[0317]-每个r
12
独立地选自卤素、羟基、氰基、c
1-c6烷基、c
2-c6烯基、c
2-c6炔基、-(c
1-c6烷基)-o(c
1-c6烷基)、-(c
1-c6烷基)-co2(c
1-c6烷基)、-(c
1-c6烷基)-n(r
x
)(ry)、-(c
1-c6烷基)-co2h、c
1-c6烷氧基、-n(r
x
)(ry)、-co-n(r
x
)(ry)、co2h、-co2(c
1-c6烷基)、-co2bn、-co(c
1-c6烷基)、苯基、5至6元杂芳基、4至6元杂环基和c
3-c
10
环烷基,其各自任选独立地被一个或多个选自以下的基团取代:卤素、氰基、c
1-c6烷基、卤代烷基、羟基、c
1-c6烷氧基、c
1-c6卤代烷氧基和-co2(c
1-c6烷基),
[0318]-n是0、1或2;
[0319]-每个r3是被0、1、2、3、4、5或6个3至8元环烷基环或5元或6元芳基取代的c
1-c6烷基,或两个r3接合形成c
3-c6环烷基环;
[0320]-r是1、2、3、4、5或6;
[0321]-r8和r9各自独立地选自氢、卤素、c
1-c6卤代烷基、c
1-c6烷基、c
2-c6烯基、c
2-c6炔基、羟基、c
1-c6烷氧基、c
1-c6卤代烷氧基、co2h、c(o)n(r
x
)(ry)、苯基、3至8元环烷基、5至6元杂芳基和5至6元杂环基,其各自被0、1、2、3、4或5个r
10
基团取代;
[0322]-每个r
10
独立地选自卤素、羟基氰基、c
1-c6烷基、c
2-c6烯基、c
2-c6炔基、-(c
1-c6烷基)-o(c
1-c6烷基)、-(c
1-c6烷基)-co2(c
1-c6烷基)、-(c
1-c6烷基)-n(r
x
)(ry)、-(c
1-c6烷基)-co2h、c
1-c6烷氧基、-n(r
x
)(ry)、-co-n(r
x
)(ry)、co2h、-co2(c
1-c6烷基)、-co2bn、-co(c
1-c6烷基)、苯基、5至6元杂芳基、4至6元杂环基和c
3-c
10
环烷基,其各自任选独立地被一个或多个选自以下的基团取代:卤素、氰基、c
1-c6烷基、卤代烷基、羟基、c
1-c6烷氧基、c
1-c6卤代烷氧基和-co2(c
1-c6烷基),
[0323]
或同一碳上的r8和r9一起形成氧代基;
[0324]-每个rb独立地选自氢、卤素、c
1-c6卤代烷基、c
1-c6烷基、c
2-c6烯基、c
2-c6炔基、羟基、c
1-c6烷氧基、c
1-c6卤代烷氧基、-co2h、-c(o)n(r
x
)(ry)、苯基、3至8元环烷基、5至6元杂芳基和5至6元杂环基,其各自被0、1、2、3、4或5个r
10
基团取代,并且任选地一个r1和一个rb连同其所连接的原子一起形成5至6元杂环烷基、或5至6元杂芳基环,其各自被0、1、2、3或4个r
10
基团取代;并且
[0325]-每个r
x
和ry独立地选自氢、c
1-c6烷基、c
1-c6卤代烷基、c
4-c9杂环基、3至6元环烷基、5至6元杂芳基、苄基、-co2(c
1-c6烷基)、-co(c
1-c6烷基),其中所述c
1-c6烷基任选地被-nme2取代,并且其中所述c
4-c9杂环基任选地被-(c
1-c6烷基)-o(c
1-c6烷基)或-co2(c
1-c6烷基)取代。
[0326]
在一些实施方案中,式(ii)的化合物是除化合物1、43、216、223、242、251、257、258、266、270和271以外的化合物。
[0327]
本文还公开具有表3a中所示的结构式的化合物、其互变异构体、那些化合物和互
变异构体的氘化衍生物,以及前述任一者的药学上可接受的盐。
[0328]
除式(iii)的化合物、其互变异构体、那些化合物和互变异构体的氘化衍生物以及前述任一者的药学上可接受的盐以外,本发明还提供式(iii-ai)、(iii-aii)、(iii-aiii)、(iii-aiv)、(iii-av)、(iii-avi)、(iii-avii)、(iii-aviii)、(iii-bi)、(iii-bii)、(iii-biii)、(iii-biv)、(iii-bv)、(iii-bvi)、(iii-ci)、(iii-cii)、(iii-ciii)、(iii-civ)、(iii-cv)和(iii-cvi)的化合物、化合物299至397、化合物398-436、其互变异构体、那些化合物和互变异构体的氘化衍生物、及前述任一者的药学上可接受的盐。
[0329]
例如,在一些实施方案中,式(iii)的化合物是式(iii-ai)、(iii-aii)或(iii-aiii)的化合物:
[0330][0331]
其互变异构体、所述化合物或所述互变异构体的氘化衍生物、或前述任一者的药学上可接受的盐,其中:
[0332]-环a是苯基、吲哚、5元杂芳基环或6元杂芳基环;
[0333]-环d是苯基环、5元杂环基环、6元杂环基环、5元杂芳基环、6元杂芳基环、3至8元环烷基环或3至8元环烯基;
[0334]-x是o、nh或n(c
1-c6烷基);
[0335]-每个r1独立地选自c
1-c6烷基、c
1-c6烷氧基、c
1-c6卤代烷基、c
1-c6卤代烷氧基、卤素、氰基和羟基,或两个r1基团连同其所连接的原子一起形成5至6元杂芳基或6元芳基环;
[0336]-m是0、1、2、3或4;
[0337]-每个r2独立地选自视情况被苯基或5元或6元杂芳基取代的c
1-c6烷基、c
1-c6烷氧基、c
1-c6卤代烷基、c
1-c6卤代烷氧基、卤素、氰基和羟基,或任选地两个r2连同其所连接的原子一起形成苯基或6元杂芳基环,其任选独立地被一个或多个选自以下的基团取代:卤素、c
1-c6烷基、卤代烷基、羟基、c
1-c6烷氧基和c
1-c6卤代烷氧基;
[0338]-n是0、1或2;
[0339]-每个r3是被0、1、2、3、4、5或6个3至8元环烷基环或5元或6元芳基取代的c
1-c6烷基,或两个r3接合形成c
3-c6环烷基环;
[0340]-每个r4独立地选自卤素、氧代基、羟基、氰基和-(y)
k-r7基团,或任选地两个r4连同其所连接的原子一起形成5至6元环烷基或杂环基环,其任选独立地被一个或多个选自以下的基团取代:卤素、c
1-c6烷基、卤代烷基、羟基、c
1-c6烷氧基和c
1-c6卤代烷氧基;其中:
[0341]-k是0、1、2、3、4、5或6;
[0342]-每个y独立地选自c(r5)(r6)基团、
–o–
和
–
nra–
基团,其中-(y)
k-r7中的杂原子不键结至-(y)
k-r7中的另一个杂原子,其中:
[0343]-每个r5和r6独立地选自氢、卤素、羟基、c
1-c6烷基和c
3-5
环烷基,或同一碳上的r5和r6一起形成c
3-5
环烷基或氧代基;
[0344]-r5和r6各自任选独立地被一个或多个选自以下的基团取代:c
1-c6烷基、c
1-c6卤代烷基、卤素、羟基、c
1-c6烷氧基和c
1-c6卤代烷氧基;并且
[0345]-每个ra独立地选自氢和c
1-c6烷基;并且
[0346]-r7选自氢、卤素、氰基和任选地被一个或多个选自以下的基团取代的c
3-c
10
环烷基:c
1-c6烷基、c
1-c6卤代烷基和卤素;
[0347]-q是1、2、3或4;并且
[0348]-z是式(l)r的二价连接基团,其中:
[0349]-r是1、2、3、4、5或6;
[0350]-每个l独立地选自c(r8)(r9)基团、
–o–
和
–
nrb–
基团,其中z中的杂原子不键结到z中的另一个杂原子,并且其中是5或6元杂环基、或5或6元杂芳基,其各自被0、1、2、3或4个r
10
基团取代;并且其中:
[0351]-r8和r9各自独立地选自氢、卤素、c
1-c6卤代烷基、c
1-c6烷基、c
2-c6烯基、c
2-c6炔基、羟基、c
1-c6烷氧基、c
1-c6卤代烷氧基、co2h、c(o)n(r
x
)(ry)、苯基、3至8元环烷基、5至6元杂芳基和5至6元杂环基,其各自被0、1、2、3、4或5个r
10
基团取代;
[0352]
每个r
10
独立地选自卤素、羟基、氰基、c
1-c6烷基、c
2-c6烯基、c
2-c6炔基、-(c
1-c6烷基)-o(c
1-c6烷基)、-(c
1-c6烷基)-co2(c
1-c6烷基)、-(c
1-c6烷基)-n(r
x
)(ry)、-(c
1-c6烷基)-co2h、c
1-c6烷氧基、-n(r
x
)(ry)、-co-n(r
x
)(ry)、co2h、-co2(c
1-c6烷基)、-co2bn、-co(c
1-c6烷基)、苯基、5至6元杂芳基、4至6元杂环基和c
3-c
10
环烷基,其各自任选独立地被一个或多个
选自以下的基团取代:卤素、氰基、c
1-c6烷基、卤代烷基、羟基、c
1-c6烷氧基、c
1-c6卤代烷氧基和-co2(c
1-c6烷基),
[0353]
或同一碳上的r8和r9一起形成氧代基;并且
[0354]-每个rb独立地选自氢、苯基和c
1-c6烷基,其中所述c
1-c6烷基任选独立地被一个或多个选自以下的基团取代:羟基、-c(o)n(r
x
)(ry)、氰基、4至6元杂环基、视情况被c
1-c6烷基取代的5元杂芳基;
[0355]-每个r
x
和ry独立地选自氢、c
1-c6烷基、c
1-c6卤代烷基、c
4-c9杂环基、3至6元环烷基、5至6元杂芳基、苄基、-co2(c
1-c6烷基)、-co(c
1-c6烷基),其中所述c
1-c6烷基任选地被-nme2取代,并且其中所述c
4-c9杂环基任选地被-(c
1-c6烷基)-o(c
1-c6烷基)或-co2(c
1-c6烷基)取代;
[0356]
条件是r8和r9中的至少一者独立地选自c
3-c6卤代烷基、c
3-c6烷基、c
2-c6烯基、c
2-c6炔基、c
3-c6烷氧基、c
3-c6卤代烷氧基、苯基、5至6元杂芳基和5至6元杂环基,或至少一个r3是被0、1、2、3、4、5或6个3至8元环烷基环或5元或6元芳基取代的c
2-c6烷基,或被1、2、3、4、5或6个3至8元环烷基环或5元或6元芳基取代的c1烷基,或两个r3接合形成c
3-c6环烷基环。
[0357]
在一些实施方案中,式(iii)的化合物是式(iii-aiv)、(iii-av)或(iii-avi)的化合物:
[0358]
[0359][0360]
其互变异构体、所述化合物或所述互变异构体的氘化衍生物、或前述任一者的药学上可接受的盐,其中:
[0361]-由*表示的碳具有s-立体化学或r-立体化学;
[0362]-环a是苯基、吲哚、5元杂芳基环或6元杂芳基环;
[0363]-环d是苯基环、5元杂环基环、6元杂环基环、5元杂芳基环、6元杂芳基环、3至8元环烷基环或3至8元环烯基;
[0364]-每个r1独立地选自c
1-c6烷基、c
1-c6烷氧基、c
1-c6卤代烷基、c
1-c6卤代烷氧基、卤素、氰基和羟基,或两个r1基团连同其所连接的原子一起形成5至6元杂芳基或6元芳基环;
[0365]-m是0、1、2、3或4;
[0366]-每个r2独立地选自视情况被苯基或5元或6元杂芳基取代的c
1-c6烷基、c
1-c6烷氧基、c
1-c6卤代烷基、c
1-c6卤代烷氧基、卤素、氰基和羟基,或任选地两个r2连同其所连接的原子一起形成苯基或6元杂芳基环,其任选独立地被一个或多个选自以下的基团取代:卤素、c
1-c6烷基、卤代烷基、羟基、c
1-c6烷氧基和c
1-c6卤代烷氧基;
[0367]-n是0、1或2;
[0368]-每个r3是被0、1、2、3、4、5或6个3至8元环烷基环或5元或6元芳基取代的c
1-c6烷基,或两个r3接合形成c
3-c6环烷基环;
[0369]-每个r4独立地选自卤素、氧代基、羟基、氰基和-(y)
k-r7基团,或任选地两个r4连同其所连接的原子一起形成5至6元环烷基或杂环基环,其任选独立地被一个或多个选自以下的基团取代:卤素、c
1-c6烷基、卤代烷基、羟基、c
1-c6烷氧基和c
1-c6卤代烷氧基;其中:
[0370]-k是0、1、2、3、4、5或6;
[0371]-每个y独立地选自c(r5)(r6)基团、
–o–
和
–
nra–
基团,其中-(y)
k-r7中的杂原子不键结至-(y)
k-r7中的另一个杂原子,其中:
[0372]-每个r5和r6独立地选自氢、卤素、羟基、c
1-c6烷基和c
3-5
环烷基,或同一碳上的r5和r6一起形成c
3-5
环烷基或氧代基;
[0373]-r5和r6各自任选独立地被一个或多个选自以下的基团取代:c
1-c6烷基、c
1-c6卤代烷基、卤素、羟基、c
1-c6烷氧基和c
1-c6卤代烷氧基;并且
[0374]-每个ra独立地选自氢和c
1-c6烷基;并且
[0375]-r7选自氢、卤素、氰基和任选地被一个或多个选自以下的基团取代的c
3-c
10
环烷基:c
1-c6烷基、c
1-c6卤代烷基和卤素;
[0376]-q是1、2、3或4;并且
[0377]-z是式(l)r的二价连接基团,其中:
[0378]-r是1、2、3、4、5或6;
[0379]-每个l独立地选自c(r8)(r9)基团、
–o–
和
–
nrb–
基团,其中z中的杂原子不键结到z中的另一个杂原子,并且其中是5或6元杂环基、或5或6元杂芳基,其各自被0、1、2、3或4个r
10
基团取代;并且其中:
[0380]-r8和r9各自独立地选自氢、卤素、c
1-c6卤代烷基、c
1-c6烷基、c
2-c6烯基、c
2-c6炔基、羟基、c
1-c6烷氧基、c
1-c6卤代烷氧基、co2h、c(o)n(r
x
)(ry)、苯基、3至8元环烷基、5至6元杂芳基和5至6元杂环基,其各自被0、1、2、3、4或5个r
10
基团取代;
[0381]
每个r
10
独立地选自卤素、羟基、氰基、c
1-c6烷基、c
2-c6烯基、c
2-c6炔基、-(c
1-c6烷基)-o(c
1-c6烷基)、-(c
1-c6烷基)-co2(c
1-c6烷基)、-(c
1-c6烷基)-n(r
x
)(ry)、-(c
1-c6烷基)-co2h、c
1-c6烷氧基、-n(r
x
)(ry)、-co-n(r
x
)(ry)、co2h、-co2(c
1-c6烷基)、-co2bn、-co(c
1-c6烷基)、苯基、5至6元杂芳基、4至6元杂环基和c
3-c
10
环烷基,其各自任选独立地被一个或多个选自以下的基团取代:卤素、氰基、c
1-c6烷基、卤代烷基、羟基、c
1-c6烷氧基、c
1-c6卤代烷氧基和-co2(c
1-c6烷基),
[0382]
或同一碳上的r8和r9一起形成氧代基;并且
[0383]-每个rb独立地选自氢、苯基和c
1-c6烷基,其中所述c
1-c6烷基任选独立地被一个或多个选自以下的基团取代:羟基、-c(o)n(r
x
)(ry)、氰基、4至6元杂环基、视情况被c
1-c6烷基取代的5元杂芳基;
[0384]-每个r
x
和ry独立地选自氢、c
1-c6烷基、c
1-c6卤代烷基、c
4-c9杂环基、3至6元环烷基、5至6元杂芳基、苄基、-co2(c
1-c6烷基)、-co(c
1-c6烷基),其中所述c
1-c6烷基任选地被-nme2取代,并且其中所述c
4-c9杂环基任选地被-(c
1-c6烷基)-o(c
1-c6烷基)或-co2(c
1-c6烷基)取代;
[0385]
条件是r8和r9中的至少一者独立地选自c
3-c6卤代烷基、c
3-c6烷基、c
2-c6烯基、c
2-c6炔基、c
3-c6烷氧基、c
3-c6卤代烷氧基、苯基、5至6元杂芳基和5至6元杂环基,或至少一个r3是被0、1、2、3、4、5或6个3至8元环烷基环或5元或6元芳基取代的c
2-c6烷基,或被1、2、3、4、5或6个3至8元环烷基环或5元或6元芳基取代的c1烷基,或两个r3接合形成c
3-c6环烷基环。
[0386]
在一些实施方案中,式(iii)的化合物是式(iii-avii)或(iii-aviii)的化合物:
[0387][0388]
其互变异构体、所述化合物或所述互变异构体的氘化衍生物、或前述任一者的药学上可接受的盐,其中:
[0389]-由*表示的碳具有s-立体化学或r-立体化学;
[0390]-环a是苯基、吲哚、5元杂芳基环或6元杂芳基环;
[0391]-每个r1独立地选自c
1-c6烷基、c
1-c6烷氧基、c
1-c6卤代烷基、c
1-c6卤代烷氧基、卤素、氰基和羟基,或两个r1基团连同其所连接的原子一起形成5至6元杂芳基或6元芳基环;
[0392]-m是0、1、2、3或4;
[0393]-每个r2独立地选自视情况被苯基或5元或6元杂芳基取代的c
1-c6烷基、c
1-c6烷氧基、c
1-c6卤代烷基、c
1-c6卤代烷氧基、卤素、氰基和羟基,或任选地两个r2连同其所连接的原子一起形成苯基或6元杂芳基环,其任选独立地被一个或多个选自以下的基团取代:卤素、c
1-c6烷基、卤代烷基、羟基、c
1-c6烷氧基和c
1-c6卤代烷氧基;
[0394]-n是0、1或2;
[0395]-每个r3是被0、1、2、3、4、5或6个3至8元环烷基环或5元或6元芳基取代的c
1-c6烷基,或两个r3接合形成c
3-c6环烷基环;
[0396]-每个r4独立地选自卤素、氧代基、羟基、氰基和-(y)
k-r7基团,或任选地两个r4连同其所连接的原子一起形成5至6元环烷基或杂环基环,其任选独立地被一个或多个选自以下的基团取代:卤素、c
1-c6烷基、卤代烷基、羟基、c
1-c6烷氧基和c
1-c6卤代烷氧基;其中:
[0397]-k是0、1、2、3、4、5或6;
[0398]-每个y独立地选自c(r5)(r6)基团、
–o–
和
–
nra–
基团,其中-(y)
k-r7中的杂原子不键结至-(y)
k-r7中的另一个杂原子,其中:
[0399]-每个r5和r6独立地选自氢、卤素、羟基、c
1-c6烷基和c
3-5
环烷基,或同一碳上的r5和r6一起形成c
3-5
环烷基或氧代基;
[0400]-r5和r6各自任选独立地被一个或多个选自以下的基团取代:c
1-c6烷基、c
1-c6卤代烷基、卤素、羟基、c
1-c6烷氧基和c
1-c6卤代烷氧基;并且
[0401]-每个ra独立地选自氢和c
1-c6烷基;并且
[0402]-r7选自氢、卤素、氰基和任选地被一个或多个选自以下的基团取代的c
3-c
10
环烷基:c
1-c6烷基、c
1-c6卤代烷基和卤素;
[0403]-q是1、2、3或4;并且
[0404]-z是式(l)r的二价连接基团,其中:
[0405]-r是1、2、3、4、5或6;
[0406]-每个l独立地选自c(r8)(r9)基团、
–o–
和
–
nrb–
基团,其中z中的杂原子不键结到z中的另一个杂原子,并且其中是5或6元杂环基、或5或6元杂芳基,其各自被0、1、2、3或4个r
10
基团取代;并且其中:
[0407]-r8和r9各自独立地选自氢、卤素、c
1-c6卤代烷基、c
1-c6烷基、c
2-c6烯基、c
2-c6炔基、羟基、c
1-c6烷氧基、c
1-c6卤代烷氧基、co2h、c(o)n(r
x
)(ry)、苯基、3至8元环烷基、5至6元杂芳基和5至6元杂环基,其各自被0、1、2、3、4或5个r
10
基团取代;
[0408]
每个r
10
独立地选自卤素、羟基、氰基、c
1-c6烷基、c
2-c6烯基、c
2-c6炔基、-(c
1-c6烷基)-o(c
1-c6烷基)、-(c
1-c6烷基)-co2(c
1-c6烷基)、-(c
1-c6烷基)-n(r
x
)(ry)、-(c
1-c6烷基)-co2h、c
1-c6烷氧基、-n(r
x
)(ry)、-co-n(r
x
)(ry)、co2h、-co2(c
1-c6烷基)、-co2bn、-co(c
1-c6烷基)、苯基、5至6元杂芳基、4至6元杂环基和c
3-c
10
环烷基,其各自任选独立地被一个或多个选自以下的基团取代:卤素、氰基、c
1-c6烷基、卤代烷基、羟基、c
1-c6烷氧基、c
1-c6卤代烷氧基和-co2(c
1-c6烷基),
[0409]
或同一碳上的r8和r9一起形成氧代基;并且
[0410]-每个rb独立地选自氢、苯基和c
1-c6烷基,其中所述c
1-c6烷基任选独立地被一个或多个选自以下的基团取代:羟基、-c(o)n(r
x
)(ry)、氰基、4至6元杂环基、视情况被c
1-c6烷基取代的5元杂芳基;
[0411]-每个r
x
和ry独立地选自氢、c
1-c6烷基、c
1-c6卤代烷基、c
4-c9杂环基、3至6元环烷基、5至6元杂芳基、苄基、-co2(c
1-c6烷基)、-co(c
1-c6烷基),其中所述c
1-c6烷基任选地被-nme2取代,并且其中所述c
4-c9杂环基任选地被-(c
1-c6烷基)-o(c
1-c6烷基)或-co2(c
1-c6烷基)取代;
[0412]
条件是r8和r9中的至少一者独立地选自c
3-c6卤代烷基、c
3-c6烷基、c
2-c6烯基、c
2-c6炔基、c
3-c6烷氧基、c
3-c6卤代烷氧基、苯基、5至6元杂芳基和5至6元杂环基,或至少一个r3是被0、1、2、3、4、5或6个3至8元环烷基环或5元或6元芳基取代的c
2-c6烷基,或被1、2、3、4、5或6个3至8元环烷基环或5元或6元芳基取代的c1烷基,或两个r3接合形成c
3-c6环烷基环。
[0413]
在一些实施方案中,式(iii)的化合物是式(iii-bi)、(iii-bii)、(iii-biii)或(iii-biv)的化合物:
[0414][0415][0416]
其互变异构体、所述化合物或所述互变异构体的氘化衍生物、或前述任一者的药学上可接受的盐,其中:
[0417]-由*表示的碳具有s-立体化学或r-立体化学;
[0418]-环d是苯基环、5元杂环基环、6元杂环基环、5元杂芳基环、6元杂芳基环、3至8元环烷基环或3至8元环烯基;
[0419]-每个r1独立地选自c
1-c6烷基、c
1-c6烷氧基、c
1-c6卤代烷基、c
1-c6卤代烷氧基、卤
素、氰基和羟基,或两个r1基团连同其所连接的原子一起形成5至6元杂芳基或6元芳基环;
[0420]-m是0、1、2、3或4;
[0421]-每个r2独立地选自视情况被苯基或5至6元杂芳基取代的c
1-c6烷基、c
1-c6烷氧基、c
1-c6卤代烷基、c
1-c6卤代烷氧基、卤素、氰基和羟基,或任选地两个r2连同其所连接的原子一起形成苯基或6元杂芳基环,其任选独立地被一个或多个选自以下的基团取代:卤素、c
1-c6烷基、卤代烷基、羟基、c
1-c6烷氧基和c
1-c6卤代烷氧基;
[0422]-n是0、1或2;
[0423]-每个r3是被0、1、2、3、4、5或6个3至8元环烷基环或5元或6元芳基取代的c
1-c6烷基,或两个r3接合形成c
3-c6环烷基环;
[0424]-每个r4独立地选自卤素、氧代基、羟基、氰基和-(y)
k-r7基团,或任选地两个r4连同其所连接的原子一起形成5至6元环烷基或杂环基环,其任选独立地被一个或多个选自以下的基团取代:卤素、c
1-c6烷基、卤代烷基、羟基、c
1-c6烷氧基和c
1-c6卤代烷氧基;其中:
[0425]-k是0、1、2、3、4、5或6;
[0426]-每个y独立地选自c(r5)(r6)基团、
–o–
和
–
nra–
基团,其中-(y)
k-r7中的杂原子不键结至-(y)
k-r7中的另一个杂原子,其中:
[0427]-每个r5和r6独立地选自氢、卤素、羟基、c
1-c6烷基和c
3-5
环烷基,或同一碳上的r5和r6一起形成c
3-5
环烷基或氧代基;
[0428]-r5和r6各自任选独立地被一个或多个选自以下的基团取代:c
1-c6烷基、c
1-c6卤代烷基、卤素、羟基、c
1-c6烷氧基和c
1-c6卤代烷氧基;并且
[0429]-每个ra独立地选自氢和c
1-c6烷基;并且
[0430]-r7选自氢、卤素、氰基和任选地被一个或多个选自以下的基团取代的c
3-c
10
环烷基:c
1-c6烷基、c
1-c6卤代烷基和卤素;
[0431]-q是1、2、3或4;并且
[0432]-z是式(l)r的二价连接基团,其中:
[0433]-r是1、2、3、4、5或6;
[0434]-每个l独立地选自c(r8)(r9)基团、
–o–
和
–
nrb–
基团,其中z中的杂原子不键结到z中的另一个杂原子,并且其中是5或6元杂环基、或5或6元杂芳基,其各自被0、1、2、3或4个r
10
基团取代;并且其中:
[0435]-r8和r9各自独立地选自氢、卤素、c
1-c6卤代烷基、c
1-c6烷基、c
2-c6烯基、c
2-c6炔基、羟基、c
1-c6烷氧基、c
1-c6卤代烷氧基、co2h、c(o)n(r
x
)(ry)、苯基、3至8元环烷基、5至6元杂芳基和5至6元杂环基,其各自被0、1、2、3、4或5个r
10
基团取代;
[0436]
每个r
10
独立地选自卤素、羟基、氰基、c
1-c6烷基、c
2-c6烯基、c
2-c6炔基、-(c
1-c6烷基)-o(c
1-c6烷基)、-(c
1-c6烷基)-co2(c
1-c6烷基)、-(c
1-c6烷基)-n(r
x
)(ry)、-(c
1-c6烷基)-co2h、c
1-c6烷氧基、-n(r
x
)(ry)、-co-n(r
x
)(ry)、co2h、-co2(c
1-c6烷基)、-co2bn、-co(c
1-c6烷基)、苯基、5至6元杂芳基、4至6元杂环基和c
3-c
10
环烷基,其各自任选独立地被一个或多个选自以下的基团取代:卤素、氰基、c
1-c6烷基、卤代烷基、羟基、c
1-c6烷氧基、c
1-c6卤代烷氧基和-co2(c
1-c6烷基),
[0437]
或同一碳上的r8和r9一起形成氧代基;并且
[0438]-每个rb独立地选自氢、苯基和c
1-c6烷基,其中所述c
1-c6烷基任选独立地被一个或多个选自以下的基团取代:羟基、-c(o)n(r
x
)(ry)、氰基、4至6元杂环基、视情况被c
1-c6烷基取代的5元杂芳基;
[0439]-每个r
x
和ry独立地选自氢、c
1-c6烷基、c
1-c6卤代烷基、c
4-c9杂环基、3至6元环烷基、5至6元杂芳基、苄基、-co2(c
1-c6烷基)、-co(c
1-c6烷基),其中所述c
1-c6烷基任选地被-nme2取代,并且其中所述c
4-c9杂环基任选地被-(c
1-c6烷基)-o(c
1-c6烷基)或-co2(c
1-c6烷基)取代;
[0440]
条件是r8和r9中的至少一者独立地选自c
3-c6卤代烷基、c
3-c6烷基、c
2-c6烯基、c
2-c6炔基、c
3-c6烷氧基、c
3-c6卤代烷氧基、苯基、5至6元杂芳基和5至6元杂环基,或至少一个r3是被0、1、2、3、4、5或6个3至8元环烷基环或5元或6元芳基取代的c
2-c6烷基,或被1、2、3、4、5或6个3至8元环烷基环或5元或6元芳基取代的c1烷基,或两个r3接合形成c
3-c6环烷基环。
[0441]
在一些实施方案中,式(iii)的化合物是式(iii-bv)或(iii-bvi)的化合物:
[0442][0443]
其互变异构体、所述化合物或所述互变异构体的氘化衍生物、或前述任一者的药学上可接受的盐,其中:
[0444]-由*表示的碳具有s-立体化学或r-立体化学;
[0445]-每个r1独立地选自c
1-c6烷基、c
1-c6烷氧基、c
1-c6卤代烷基、c
1-c6卤代烷氧基、卤素、氰基和羟基,或两个r1基团连同其所连接的原子一起形成5至6元杂芳基或6元芳基环;
[0446]-m是0、1、2、3或4;
[0447]-每个r2独立地选自视情况被苯基或5至6元杂芳基取代的c
1-c6烷基、c
1-c6烷氧基、c
1-c6卤代烷基、c
1-c6卤代烷氧基、卤素、氰基和羟基,或任选地两个r2连同其所连接的原子一起形成苯基或6元杂芳基环,其任选独立地被一个或多个选自以下的基团取代:卤素、c
1-c6烷基、卤代烷基、羟基、c
1-c6烷氧基和c
1-c6卤代烷氧基;
nme2取代,并且其中所述c
4-c9杂环基任选地被-(c
1-c6烷基)-o(c
1-c6烷基)或-co2(c
1-c6烷基)取代;
[0466]
条件是r8和r9中的至少一者独立地选自c
3-c6卤代烷基、c
3-c6烷基、c
2-c6烯基、c
2-c6炔基、c
3-c6烷氧基、c
3-c6卤代烷氧基、苯基、5至6元杂芳基和5至6元杂环基,或至少一个r3是被0、1、2、3、4、5或6个3至8元环烷基环或5元或6元芳基取代的c
2-c6烷基,或被1、2、3、4、5或6个3至8元环烷基环或5元或6元芳基取代的c1烷基,或两个r3接合形成c
3-c6环烷基环。
[0467]
在一些实施方案中,式(iii)的化合物是式(iii-ci)、(iii-cii)、(iii-ciii)或(iii-civ)的化合物:
[0468]
[0469][0470]
其互变异构体、所述化合物或所述互变异构体的氘化衍生物、或前述任一者的药学上可接受的盐,其中:
[0471]-环d是苯基环、5元杂环基环、6元杂环基环、5元杂芳基环、6元杂芳基环、3至8元环烷基环或3至8元环烯基;
[0472]-每个r1独立地选自c
1-c6烷基、c
1-c6烷氧基、c
1-c6卤代烷基、c
1-c6卤代烷氧基、卤素、氰基和羟基,或两个r1基团连同其所连接的原子一起形成5至6元杂芳基或6元芳基环;
[0473]-m是0、1、2、3或4;
[0474]-每个r2独立地选自视情况被苯基或5元或6元杂芳基取代的c
1-c6烷基、c
1-c6烷氧基、c
1-c6卤代烷基、c
1-c6卤代烷氧基、卤素、氰基和羟基,或任选地两个r2连同其所连接的原子一起形成苯基或6元杂芳基环,其任选独立地被一个或多个选自以下的基团取代:卤素、c
1-c6烷基、卤代烷基、羟基、c
1-c6烷氧基和c
1-c6卤代烷氧基;
[0475]-n是0、1或2;
[0476]-每个r3是被0、1、2、3、4、5或6个3至8元环烷基环或5元或6元芳基取代的c
1-c6烷基,或两个r3接合形成c
3-c6环烷基环;
[0477]-每个r4独立地选自卤素、氧代基、羟基、氰基和-(y)
k-r7基团,或任选地两个r4连同其所连接的原子一起形成5至6元环烷基或杂环基环,其任选独立地被一个或多个选自以下的基团取代:卤素、c
1-c6烷基、卤代烷基、羟基、c
1-c6烷氧基和c
1-c6卤代烷氧基;其中:
[0478]-k是0、1、2、3、4、5或6;
[0479]-每个y独立地选自c(r5)(r6)基团、
–o–
和
–
nra–
基团,其中-(y)
k-r7中的杂原子不键结至-(y)
k-r7中的另一个杂原子,其中:
[0480]-每个r5和r6独立地选自氢、卤素、羟基、c
1-c6烷基和c
3-5
环烷基,或同一碳上的r5和r6一起形成c
3-5
环烷基或氧代基;
[0481]-r5和r6各自任选独立地被一个或多个选自以下的基团取代:c
1-c6烷基、c
1-c6卤代烷基、卤素、羟基、c
1-c6烷氧基和c
1-c6卤代烷氧基;并且
[0482]-每个ra独立地选自氢和c
1-c6烷基;并且
[0483]-r7选自氢、卤素、氰基和任选地被一个或多个选自以下的基团取代的c
3-c
10
环烷基:c
1-c6烷基、c
1-c6卤代烷基和卤素;
[0484]-q是1、2、3或4;
[0485]-r8和r9各自独立地选自氢、卤素、c
1-c6卤代烷基、c
1-c6烷基、c
2-c6烯基、c
2-c6炔基、羟基、c
1-c6烷氧基、c
1-c6卤代烷氧基、co2h、c(o)n(r
x
)(ry)、苯基、3至8元环烷基、5至6元杂芳基和5至6元杂环基,其各自被0、1、2、3、4或5个r
10
基团取代;
[0486]
每个r
10
独立地选自卤素、羟基、氰基、c
1-c6烷基、c
2-c6烯基、c
2-c6炔基、-(c
1-c6烷基)-o(c
1-c6烷基)、-(c
1-c6烷基)-co2(c
1-c6烷基)、-(c
1-c6烷基)-n(r
x
)(ry)、-(c
1-c6烷基)-co2h、c
1-c6烷氧基、-n(r
x
)(ry)、-co-n(r
x
)(ry)、co2h、-co2(c
1-c6烷基)、-co2bn、-co(c
1-c6烷基)、苯基、5至6元杂芳基、4至6元杂环基和c
3-c
10
环烷基,其各自任选独立地被一个或多个选自以下的基团取代:卤素、氰基、c
1-c6烷基、卤代烷基、羟基、c
1-c6烷氧基、c
1-c6卤代烷氧基和-co2(c
1-c6烷基),
[0487]
或同一碳上的r8和r9一起形成氧代基;并且
[0488]-每个rb独立地选自氢、苯基和c
1-c6烷基,其中所述c
1-c6烷基任选独立地被一个或多个选自以下的基团取代:羟基、-c(o)n(r
x
)(ry)、氰基、4至6元杂环基、视情况被c
1-c6烷基取代的5元杂芳基;
[0489]-每个r
x
和ry独立地选自氢、c
1-c6烷基、c
1-c6卤代烷基、c
4-c9杂环基、3至6元环烷基、5至6元杂芳基、苄基、-co2(c
1-c6烷基)、-co(c
1-c6烷基),其中所述c
1-c6烷基任选地被-nme2取代,并且其中所述c
4-c9杂环基任选地被-(c
1-c6烷基)-o(c
1-c6烷基)或-co2(c
1-c6烷基)取代;
[0490]
条件是r8和r9中的至少一者独立地选自c
3-c6卤代烷基、c
3-c6烷基、c
2-c6烯基、c
2-c6炔基、c
3-c6烷氧基、c
3-c6卤代烷氧基、苯基、5至6元杂芳基和5至6元杂环基,或至少一个r3是被0、1、2、3、4、5或6个3至8元环烷基环或5元或6元芳基取代的c
2-c6烷基,或被1、2、3、4、5或6个3至8元环烷基环或5元或6元芳基取代的c1烷基,或两个r3接合形成c
3-c6环烷基环。
[0491]
在一些实施方案中,式(iii)的化合物是式(iii-cv)或(iii-cvi)的化合物:
[0492][0493]
其互变异构体、所述化合物或所述互变异构体的氘化衍生物、或前述任一者的药学上可接受的盐,其中:
[0494]-每个r1独立地选自c
1-c6烷基、c
1-c6烷氧基、c
1-c6卤代烷基、c
1-c6卤代烷氧基、卤素、氰基和羟基,或两个r1基团连同其所连接的原子一起形成5至6元杂芳基或6元芳基环;
[0495]-m是0、1、2、3或4;
[0496]-每个r2独立地选自视情况被苯基或5元或6元杂芳基取代的c
1-c6烷基、c
1-c6烷氧基、c
1-c6卤代烷基、c
1-c6卤代烷氧基、卤素、氰基和羟基,或任选地两个r2连同其所连接的原子一起形成苯基或6元杂芳基环,其任选独立地被一个或多个选自以下的基团取代:卤素、c
1-c6烷基、卤代烷基、羟基、c
1-c6烷氧基和c
1-c6卤代烷氧基;
[0497]-n是0、1或2;
[0498]-每个r3是被0、1、2、3、4、5或6个3至8元环烷基环或5元或6元芳基取代的c
1-c6烷基,或两个r3接合形成c
3-c6环烷基环;
[0499]-每个r4独立地选自卤素、氧代基、羟基、氰基和-(y)
k-r7基团,或任选地两个r4连同其所连接的原子一起形成5至6元环烷基或杂环基环,其任选独立地被一个或多个选自以下的基团取代:卤素、c
1-c6烷基、卤代烷基、羟基、c
1-c6烷氧基和c
1-c6卤代烷氧基;其中:
[0500]-k是0、1、2、3、4、5或6;
[0501]-每个y独立地选自c(r5)(r6)基团、
–o–
和
–
nra–
基团,其中-(y)
k-r7中的杂原子不键结至-(y)
k-r7中的另一个杂原子,其中:
[0502]-每个r5和r6独立地选自氢、卤素、羟基、c
1-c6烷基和c
3-5
环烷基,或同一碳上的r5和r6一起形成c
3-5
环烷基或氧代基;
[0503]-r5和r6各自任选独立地被一个或多个选自以下的基团取代:c
1-c6烷基、c
1-c6卤代烷基、卤素、羟基、c
1-c6烷氧基和c
1-c6卤代烷氧基;并且
[0504]-每个ra独立地选自氢和c
1-c6烷基;并且
[0505]-r7选自氢、卤素、氰基和任选地被一个或多个选自以下的基团取代的c
3-c
10
环烷基:c
1-c6烷基、c
1-c6卤代烷基和卤素;
[0506]-q是1、2、3或4;
[0507]-r8和r9各自独立地选自氢、卤素、c
1-c6卤代烷基、c
1-c6烷基、c
2-c6烯基、c
2-c6炔基、羟基、c
1-c6烷氧基、c
1-c6卤代烷氧基、co2h、c(o)n(r
x
)(ry)、苯基、3至8元环烷基、5至6元杂芳基和5至6元杂环基,其各自被0、1、2、3、4或5个r
10
基团取代;
[0508]
每个r
10
独立地选自卤素、羟基、氰基、c
1-c6烷基、c
2-c6烯基、c
2-c6炔基、-(c
1-c6烷基)-o(c
1-c6烷基)、-(c
1-c6烷基)-co2(c
1-c6烷基)、-(c
1-c6烷基)-n(r
x
)(ry)、-(c
1-c6烷基)-co2h、c
1-c6烷氧基、-n(r
x
)(ry)、-co-n(r
x
)(ry)、co2h、-co2(c
1-c6烷基)、-co2bn、-co(c
1-c6烷基)、苯基、5至6元杂芳基、4至6元杂环基和c
3-c
10
环烷基,其各自任选独立地被一个或多个选自以下的基团取代:卤素、氰基、c
1-c6烷基、卤代烷基、羟基、c
1-c6烷氧基、c
1-c6卤代烷氧基和-co2(c
1-c6烷基),
[0509]
或同一碳上的r8和r9一起形成氧代基;并且
[0510]-每个rb独立地选自氢、苯基和c
1-c6烷基,其中所述c
1-c6烷基任选独立地被一个或多个选自以下的基团取代:羟基、-c(o)n(r
x
)(ry)、氰基、4至6元杂环基、视情况被c
1-c6烷基取代的5元杂芳基;
[0511]-每个r
x
和ry独立地选自氢、c
1-c6烷基、c
1-c6卤代烷基、c
4-c9杂环基、3至6元环烷基、5至6元杂芳基、苄基、-co2(c
1-c6烷基)、-co(c
1-c6烷基),其中所述c
1-c6烷基任选地被-nme2取代,并且其中所述c
4-c9杂环基任选地被-(c
1-c6烷基)-o(c
1-c6烷基)或-co2(c
1-c6烷基)取代;
[0512]
条件是r8和r9中的至少一者独立地选自c
3-c6卤代烷基、c
3-c6烷基、c
2-c6烯基、c
2-c6炔基、c
3-c6烷氧基、c
3-c6卤代烷氧基、苯基、5至6元杂芳基和5至6元杂环基,或至少一个r3是被0、1、2、3、4、5或6个3至8元环烷基环或5元或6元芳基取代的c
2-c6烷基,或被1、2、3、4、5或6个3至8元环烷基环或5元或6元芳基取代的c1烷基,或两个r3接合形成c
3-c6环烷基环。
[0513]
本文还公开具有表3b中所示的结构式的化合物、其互变异构体、那些化合物和互变异构体的氘化衍生物,以及前述任一者的药学上可接受的盐。
[0514]
治疗方法
[0515]
本文公开的新颖化合物中的任一种,例如式(i)的化合物;式(ii)、(ii-ai)、(ii-aii)、(ii-aiii)、(ii-aiv)、(ii-av)、(ii-avi)、(ii-bi)、(ii-bii)、(ii-biii)、(ii-biv)、(ii-bv)、(ii-bvi)、(ii-ci)、(ii-cii)、(ii-ciii)、(ii-civ)、(ii-cv)和(ii-cvi)的化合物;化合物1-298;式(iii)、(iii-ai)、(iii-aii)、(iii-aiii)、(iii-aiv)、(iii-av)、(iii-avi)、(iii-avii)、(iii-aviii)、(iii-bi)、(iii-bii)、(iii-biii)、(iii-biv)、(iii-bv)、(iii-bvi)、(iii-ci)、(iii-cii)、(iii-ciii)、(iii-civ)、(iii-cv)和(iii-cvi)的化合物;化合物299至397;化合物398-436;其互变异构体;那些化合物和互变异构体的氘化衍生物;以及前述任一者的药学上可接受的盐,可充当cftr调节剂,即,其调节体内cftr活性。编码cftr的基因中发生突变的个体可以受益于接受cftr调节剂。cftr突变可能影响cftr的数量,即细胞表面处cftr通道的数量,或者其可以影响cftr功能,即每个通道打开和转运离子的功能。影响cftr数量的突变包括导致合成缺陷(i类缺陷)的突变、导致加工和运输缺陷(ii类缺陷)的突变、导致cftr合成减少(v类缺陷)的突变以及降低cftr的表面稳定性(vi类
缺陷)的突变。影响cftr功能的突变包括导致门控缺陷(iii类缺陷)的突变和导致传导缺陷(iv类缺陷)的突变。一些cftr突变表现出多种类别的特征。cftr基因中的某些突变导致囊性纤维化。
[0516]
因此,在一些实施方案中,本发明提供治疗患者的囊性纤维化、减轻囊性纤维化的严重程度或对症治疗囊性纤维化的方法,所述方法包括单独或与另一种活性成分(诸如一或多种cftr调节剂)组合向患者施用有效量的本文所公开的任一新颖化合物,例如式(i)的化合物;式(ii)、(ii-ai)、(ii-aii)、(ii-aiii)、(ii-aiv)、(ii-av)、(ii-avi)、(ii-bi)、(ii-bii)、(ii-biii)、(ii-biv)、(ii-bv)、(ii-bvi)、(ii-ci)、(ii-cii)、(ii-ciii)、(ii-civ)、(ii-cv)和(ii-cvi)的化合物;化合物1-298;式(iii)、(iii-ai)、(iii-aii)、(iii-aiii)、(iii-aiv)、(iii-av)、(iii-avi)、(iii-avii)、(iii-aviii)、(iii-bi)、(iii-bii)、(iii-biii)、(iii-biv)、(iii-bv)、(iii-bvi)、(iii-ci)、(iii-cii)、(iii-ciii)、(iii-civ)、(iii-cv)和(iii-cvi)的化合物;化合物299至397;化合物398-436;其互变异构体;那些化合物和互变异构体的氘化衍生物;以及前述任一者的药学上可接受的盐。在一些实施方案中,一或多种cftr调节剂选自依伐卡托、d-依伐卡托、鲁玛卡托和替扎卡托。在一些实施方案中,患者具有f508del/最小功能(mf)基因型、f508del/f508del基因型(针对f508del突变为同型接合的)、f508del/门控基因型,或f508del/残余功能(rf)基因型。在一些实施方案中,患者是异型接合的并且具有一个f508del突变。在一些实施方案中,患者针对n1303k突变是同型接合的。
[0517]
在一些实施方案中,每天施用5mg至500mg的本文所公开的化合物、其互变异构体、该化合物和互变异构体的氘化衍生物、或前述任一者的药学上可接受的盐。
[0518]
在一些实施方案中,患者是异型接合的,并且在选自表2的一个等位基因上具有f508del突变并且在另一个等位基因上具有突变:
[0519]
表2:cftr突变
[0520]
[0521][0522]
在一些实施方案中,本公开还涉及使用前述化合物的同位素标记的化合物或其药学上可接受的盐的治疗方法,其中此类化合物和盐的化学式和变量各自独立地如上文或上述任何其他实施方案所描述,前提条件是,其中一个或多个原子被原子质量或质量数不同于通常天然存在的原子的原子质量或质量数的原子置换(被同位素标记)。可商购并且适用于本公开的同位素的实例包括氢、碳、氮、氧、磷、氟和氯的同位素,分别例如2h、3h、
13
c、
14
c、
15
n、
18
o、
17
o、
31
p、
32
p、
35
s、
18
f和
36
cl。
[0523]
同位素标记的化合物和盐可以多种有益的方式使用。它们可适用于药物和/或各种类型的测定,诸如底物组织分布测定。例如,氚(3h)和/或碳-14(
14
c)标记的化合物因制备相对简单和可侦测性优良而特别适用于各种类型的测定,诸如底物组织分布测定。例如,氘(2h)标记的化合物在治疗上可用并且相较于非2h标记的化合物具有潜在的治疗优点。一般来说,相较于非同位素标记的化合物和盐,氘(2h)标记的化合物和盐可以由于以下所述的动力学同位素效应而具有较高的代谢稳定性。更高的代谢稳定性直接转化为增加的体内半衰期或较低的剂量,这可为所期望的。同位素标记的化合物和盐通常可以通过进行本文的合成方案和相关描述中、实例部分和制备部分中所公开的程序,用容易获得的同位素标记的反应物置换非同位素标记的反应物来制备。
[0524]
在一些实施方案中,同位素标记的化合物和盐是氘(2h)标记的化合物和盐。在一些具体实施方案中,同位素标记的化合物和盐被氘(2h)标记,其中一个或多个氢原子已被氘置换。在化学结构中,氘表示为“d”。
[0525]
当发现和开发治疗剂时,本领域技术人员尝试优化药物动力学参数,同时保留期望的体外特性。可以合理地假设,药物动力学特性较差的许多化合物容易发生氧化代谢。
[0526]
氘(2h)标记的化合物和盐可以通过一级动力学同位素效应来操纵化合物的氧化代谢。一级动力学同位素效应是由同位素核交换引起的化学反应速率的变化,这继而又由该同位素交换后形成共价键所必需的基态能量的变化引起。较重同位素的交换通常导致化学键的基态能量降低,并且因此导致限速键断裂的减少。如果沿着多产物反应的坐标在鞍点区域中或附近发生键断裂,则产物分布比率可以显著改变。解释:如果氘键结至在不可交换位置处的碳原子,则k
m/
kd=2-7的速率差异是典型的。关于进一步讨论,参见s.l.harbeson和r.d.tung,deuterium in drug discovery and development,ann.rep.med.chem.2011,46,403-417,其以引用的方式并入本文。
[0527]
并入到本公开的同位素标记的化合物和盐中的同位素(例如氘)的浓度可以由同位素富集因子界定。如本文所使用,术语“同位素富集因子”意指指定同位素之同位素丰度与天然丰度之间的比率。在一些实施方案中,如果本公开的化合物中的取代基表示为氘,则此类化合物对于每个指定氘原子具有的同位素富集因子为至少3500(在每个指定氘原子处的52.5%氘并入量)、至少4000(60%氘并入量)、至少4500(67.5%氘并入量)、至少5000(75%氘并入量)、至少5500(82.5%氘并入量)、至少6000(90%氘并入量)、至少6333.3(95%氘并入量)、至少6466.7(97%氘并入量)、至少6600(99%氘并入量)或至少6633.3(99.5%氘并入量)。
[0528]
组合疗法
[0529]
本文所公开的一个方面提供使用本文所公开的新颖化合物中的任一种,例如式(i)的化合物;式(ii)、(ii-ai)、(ii-aii)、(ii-aiii)、(ii-aiv)、(ii-av)、(ii-avi)、(ii-bi)、(ii-bii)、(ii-biii)、(ii-biv)、(ii-bv)、(ii-bvi)、(ii-ci)、(ii-cii)、(ii-ciii)、(ii-civ)、(ii-cv)和(ii-cvi)的化合物;化合物1-298;式(iii)、(iii-ai)、(iii-aii)、(iii-aiii)、(iii-aiv)、(iii-av)、(iii-avi)、(iii-avii)、(iii-aviii)、(iii-bi)、(iii-bii)、(iii-biii)、(iii-biv)、(iii-bv)、(iii-bvi)、(iii-ci)、(iii-cii)、(iii-ciii)、(iii-civ)、(iii-cv)和(iii-cvi)的化合物;化合物299至397;化合物398-436;其互变异构体;那些化合物和互变异构体的氘化衍生物;以及前述任一者的药学上可接受的盐,与至少
ai)、(iii-aii)、(iii-aiii)、(iii-aiv)、(iii-av)、(iii-avi)、(iii-avii)、(iii-aviii)、(iii-bi)、(iii-bii)、(iii-biii)、(iii-biv)、(iii-bv)、(iii-bvi)、(iii-ci)、(iii-cii)、(iii-ciii)、(iii-civ)、(iii-cv)和(iii-cvi)的化合物;化合物299至397;化合物398-436;其互变异构体;那些化合物和互变异构体的氘化衍生物;以及前述任一者的药学上可接受的盐;(b)至少一种选自替扎卡托和其药学上可接受的盐的化合物;以及(c)至少一种选自依伐卡托或d-依伐卡托和其药学上可接受的盐的化合物。
[0537]
在一些实施方案中,至少一种选自以下的化合物与至少一种选自替扎卡托和其药学上可接受的盐的化合物组合施用:式(i)的化合物;式(ii)、(ii-ai)、(ii-aii)、(ii-aiii)、(ii-aiv)、(ii-av)、(ii-avi)、(ii-bi)、(ii-bii)、(ii-biii)、(ii-biv)、(ii-bv)、(ii-bvi)、(ii-ci)、(ii-cii)、(ii-ciii)、(ii-civ)、(ii-cv)和(ii-cvi)的化合物;化合物1-298;式(iii)、(iii-ai)、(iii-aii)、(iii-aiii)、(iii-aiv)、(iii-av)、(iii-avi)、(iii-avii)、(iii-aviii)、(iii-bi)、(iii-bii)、(iii-biii)、(iii-biv)、(iii-bv)、(iii-bvi)、(iii-ci)、(iii-cii)、(iii-ciii)、(iii-civ)、(iii-cv)和(iii-cvi)的化合物;化合物299至397;化合物398-436;其互变异构体;那些化合物和互变异构体的氘化衍生物;以及前述任一者的药学上可接受的盐。在一些实施方案中,至少一种选自以下的化合物与至少一种选自依伐卡托和其药学上可接受的盐的化合物组合施用:式(i)的化合物;式(ii)、(ii-ai)、(ii-aii)、(ii-aiii)、(ii-aiv)、(ii-av)、(ii-avi)、(ii-bi)、(ii-bii)、(ii-biii)、(ii-biv)、(ii-bv)、(ii-bvi)、(ii-ci)、(ii-cii)、(ii-ciii)、(ii-civ)、(ii-cv)和(ii-cvi)的化合物;化合物1-298;式(iii)、(iii-ai)、(iii-aii)、(iii-aiii)、(iii-aiv)、(iii-av)、(iii-avi)、(iii-avii)、(iii-aviii)、(iii-bi)、(iii-bii)、(iii-biii)、(iii-biv)、(iii-bv)、(iii-bvi)、(iii-ci)、(iii-cii)、(iii-ciii)、(iii-civ)、(iii-cv)和(iii-cvi)的化合物;化合物299至397;化合物398-436;其互变异构体;那些化合物和互变异构体的氘化衍生物;以及前述任一者的药学上可接受的盐。在一些实施方案中,至少一种选自以下的化合物与至少一种选自d-依伐卡托和其药学上可接受的盐的化合物组合施用:式(i)的化合物;式(ii)、(ii-ai)、(ii-aii)、(ii-aiii)、(ii-aiv)、(ii-av)、(ii-avi)、(ii-bi)、(ii-bii)、(ii-biii)、(ii-biv)、(ii-bv)、(ii-bvi)、(ii-ci)、(ii-cii)、(ii-ciii)、(ii-civ)、(ii-cv)和(ii-cvi)的化合物;化合物1-298;式(iii)、(iii-ai)、(iii-aii)、(iii-aiii)、(iii-aiv)、(iii-av)、(iii-avi)、(iii-avii)、(iii-aviii)、(iii-bi)、(iii-bii)、(iii-biii)、(iii-biv)、(iii-bv)、(iii-bvi)、(iii-ci)、(iii-cii)、(iii-ciii)、(iii-civ)、(iii-cv)和(iii-cvi)的化合物;化合物299至397;化合物398-436;其互变异构体;那些化合物和互变异构体的氘化衍生物;以及前述任一者的药学上可接受的盐。在一些实施方案中,至少一种选自以下的化合物与替扎卡托或其药学上可接受的盐以及至少一种选自依伐卡托和其药学上可接受的盐的化合物组合施用:式(i)的化合物;式(ii)、(ii-ai)、(ii-aii)、(ii-aiii)、(ii-aiv)、(ii-av)、(ii-avi)、(ii-bi)、(ii-bii)、(ii-biii)、(ii-biv)、(ii-bv)、(ii-bvi)、(ii-ci)、(ii-cii)、(ii-ciii)、(ii-civ)、(ii-cv)和(ii-cvi)的化合物;化合物1-298;式(iii)、(iii-ai)、(iii-aii)、(iii-aiii)、(iii-aiv)、(iii-av)、(iii-avi)、(iii-avii)、(iii-aviii)、(iii-bi)、(iii-bii)、(iii-biii)、(iii-biv)、(iii-bv)、(iii-bvi)、(iii-ci)、(iii-cii)、(iii-ciii)、(iii-civ)、(iii-cv)和(iii-cvi)的化合物;化合物299至397;化合物398-436;其互变异构体;那些化合物和互变
异构体的氘化衍生物;以及前述任一者的药学上可接受的盐。在一些实施方案中,至少一种选自以下的化合物与至少一种选自替扎卡托和其药学上可接受的盐的化合物以及至少一种选自d-依伐卡托和其药学上可接受的盐的化合物组合施用:式(i)的化合物;式(ii-ai)、(ii-aii)、(ii-aiii)、(ii-aiv)、(ii-av)、(ii-avi)、(ii-bi)、(ii-bii)、(ii-biii)、(ii-biv)、(ii-bv)、(ii-bvi)、(ii-ci)、(ii-cii)、(ii-ciii)、(ii-civ)、(ii-cv)和(ii-cvi)的化合物;化合物1-298;式(iii)、(iii-ai)、(iii-aii)、(iii-aiii)、(iii-aiv)、(iii-av)、(iii-avi)、(iii-avii)、(iii-aviii)、(iii-bi)、(iii-bii)、(iii-biii)、(iii-biv)、(iii-bv)、(iii-bvi)、(iii-ci)、(iii-cii)、(iii-ciii)、(iii-civ)、(iii-cv)和(iii-cvi)的化合物;化合物299至397;化合物398-436;其互变异构体;那些化合物和互变异构体的氘化衍生物;以及前述任一者的药学上可接受的盐。
[0538]
式(i)的化合物;式(ii)、(ii-ai)、(ii-aii)、(ii-aiii)、(ii-aiv)、(ii-av)、(ii-avi)、(ii-bi)、(ii-bii)、(ii-biii)、(ii-biv)、(ii-bv)、(ii-bvi)、(ii-ci)、(ii-cii)、(ii-ciii)、(ii-civ)、(ii-cv)和(ii-cvi)的化合物;化合物1-298;式(iii)、(iii-ai)、(iii-aii)、(iii-aiii)、(iii-aiv)、(iii-av)、(iii-avi)、(iii-avii)、(iii-aviii)、(iii-bi)、(iii-bii)、(iii-biii)、(iii-biv)、(iii-bv)、(iii-bvi)、(iii-ci)、(iii-cii)、(iii-ciii)、(iii-civ)、(iii-cv)和(iii-cvi)的化合物;化合物299至397;化合物398-436;其互变异构体;那些化合物和互变异构体的氘化衍生物;以及前述任一者的药学上可接受的盐各自可独立地每天一次、每天两次或每天三次施用。在一些实施方案中,每天一次施用至少一种选自以下的化合物:式(i)的化合物;式(ii)、(ii-ai)、(ii-aii)、(ii-aiii)、(ii-aiv)、(ii-av)、(ii-avi)、(ii-bi)、(ii-bii)、(ii-biii)、(ii-biv)、(ii-bv)、(ii-bvi)、(ii-ci)、(ii-cii)、(ii-ciii)、(ii-civ)、(ii-cv)和(ii-cvi)的化合物;化合物1-298;式(iii)、(iii-ai)、(iii-aii)、(iii-aiii)、(iii-aiv)、(iii-av)、(iii-avi)、(iii-avii)、(iii-aviii)、(iii-bi)、(iii-bii)、(iii-biii)、(iii-biv)、(iii-bv)、(iii-bvi)、(iii-ci)、(iii-cii)、(iii-ciii)、(iii-civ)、(iii-cv)和(iii-cvi)的化合物;化合物299至397;化合物398-436;其互变异构体;那些化合物和互变异构体的氘化衍生物;以及前述任一者的药学上可接受的盐。在一些实施方案中,每天两次施用至少一种选自以下的化合物:式(i)的化合物;式(ii)、(ii-ai)、(ii-aii)、(ii-aiii)、(ii-aiv)、(ii-av)、(ii-avi)、(ii-bi)、(ii-bii)、(ii-biii)、(ii-biv)、(ii-bv)、(ii-bvi)、(ii-ci)、(ii-cii)、(ii-ciii)、(ii-civ)、(ii-cv)和(ii-cvi)的化合物;化合物1-298;式(iii)、(iii-ai)、(iii-aii)、(iii-aiii)、(iii-aiv)、(iii-av)、(iii-avi)、(iii-avii)、(iii-aviii)、(iii-bi)、(iii-bii)、(iii-biii)、(iii-biv)、(iii-bv)、(iii-bvi)、(iii-ci)、(iii-cii)、(iii-ciii)、(iii-civ)、(iii-cv)和(iii-cvi)的化合物;化合物299至397;化合物398-436;其互变异构体;那些化合物和互变异构体的氘化衍生物;以及前述任一者的药学上可接受的盐。在一些实施方案中,每天一次施用至少一种选自以下的化合物以及至少一种选自替扎卡托和其药学上可接受的盐的化合物:式(ii)、(ii-ai)、(ii-aii)、(ii-aiii)、(ii-aiv)、(ii-av)、(ii-avi)、(ii-bi)、(ii-bii)、(ii-biii)、(ii-biv)、(ii-bv)、(ii-bvi)、(ii-ci)、(ii-cii)、(ii-ciii)、(ii-civ)、(ii-cv)和(ii-cvi)的化合物;化合物1-298;式(iii)、(iii-ai)、(iii-aii)、(iii-aiii)、(iii-aiv)、(iii-av)、(iii-avi)、(iii-avii)、(iii-aviii)、(iii-bi)、(iii-bii)、(iii-biii)、(iii-biv)、(iii-bv)、(iii-bvi)、
(iii-ci)、(iii-cii)、(iii-ciii)、(iii-civ)、(iii-cv)和(iii-cvi)的化合物;化合物299至397;化合物398-436;其互变异构体;那些化合物和互变异构体的氘化衍生物;以及前述任一者的药学上可接受的盐。在一些实施方案中,每天两次施用至少一种选自以下的化合物以及至少一种选自替扎卡托和其药学上可接受的盐的化合物:式(ii)、(ii-ai)、(ii-aii)、(ii-aiii)、(ii-aiv)、(ii-av)、(ii-avi)、(ii-bi)、(ii-bii)、(ii-biii)、(ii-biv)、(ii-bv)、(ii-bvi)、(ii-ci)、(ii-cii)、(ii-ciii)、(ii-civ)、(ii-cv)和(ii-cvi)的化合物;化合物1-298;式(iii)、(iii-ai)、(iii-aii)、(iii-aiii)、(iii-aiv)、(iii-av)、(iii-avi)、(iii-avii)、(iii-aviii)、(iii-bi)、(iii-bii)、(iii-biii)、(iii-biv)、(iii-bv)、(iii-bvi)、(iii-ci)、(iii-cii)、(iii-ciii)、(iii-civ)、(iii-cv)和(iii-cvi)的化合物;化合物299至397;化合物398-436;其互变异构体;那些化合物和互变异构体的氘化衍生物;以及前述任一者的药学上可接受的盐。在一些实施方案中,每天一次施用至少一种选自以下的化合物以及至少一种选自依伐卡托或d-依伐卡托和其药学上可接受的盐的化合物:式(ii)、(ii-ai)、(ii-aii)、(ii-aiii)、(ii-aiv)、(ii-av)、(ii-avi)、(ii-bi)、(ii-bii)、(ii-biii)、(ii-biv)、(ii-bv)、(ii-bvi)、(ii-ci)、(ii-cii)、(ii-ciii)、(ii-civ)、(ii-cv)和(ii-cvi)的化合物;化合物1-298;式(iii)、(iii-ai)、(iii-aii)、(iii-aiii)、(iii-aiv)、(iii-av)、(iii-avi)、(iii-avii)、(iii-aviii)、(iii-bi)、(iii-bii)、(iii-biii)、(iii-biv)、(iii-bv)、(iii-bvi)、(iii-ci)、(iii-cii)、(iii-ciii)、(iii-civ)、(iii-cv)和(iii-cvi)的化合物;化合物299至397;化合物398-436;其互变异构体;那些化合物和互变异构体的氘化衍生物;以及前述任一者的药学上可接受的盐。在一些实施方案中,每天两次施用至少一种选自以下的化合物以及至少一种选自依伐卡托或d-依伐卡托和其药学上可接受的盐的化合物:式(ii)、(ii-ai)、(ii-aii)、(ii-aiii)、(ii-aiv)、(ii-av)、(ii-avi)、(ii-bi)、(ii-bii)、(ii-biii)、(ii-biv)、(ii-bv)、(ii-bvi)、(ii-ci)、(ii-cii)、(ii-ciii)、(ii-civ)、(ii-cv)和(ii-cvi)的化合物;化合物1-298;式(iii)、(iii-ai)、(iii-aii)、(iii-aiii)、(iii-aiv)、(iii-av)、(iii-avi)、(iii-avii)、(iii-aviii)、(iii-bi)、(iii-bii)、(iii-biii)、(iii-biv)、(iii-bv)、(iii-bvi)、(iii-ci)、(iii-cii)、(iii-ciii)、(iii-civ)、(iii-cv)和(iii-cvi)的化合物;化合物299至397;化合物398-436;其互变异构体;那些化合物和互变异构体的氘化衍生物;以及前述任一者的药学上可接受的盐。
[0539]
在一些实施方案中,每天一次施用至少一种选自以下的化合物、至少一种选自替扎卡托和其药学上可接受的盐的化合物以及至少一种选自依伐卡托或d-依伐卡托和其药学上可接受的盐的化合物:式(i)的化合物;式(ii)、(ii-ai)、(ii-aii)、(ii-aiii)、(ii-aiv)、(ii-av)、(ii-avi)、(ii-bi)、(ii-bii)、(ii-biii)、(ii-biv)、(ii-bv)、(ii-bvi)、(ii-ci)、(ii-cii)、(ii-ciii)、(ii-civ)、(ii-cv)和(ii-cvi)的化合物;化合物1-298;式(iii)、(iii-ai)、(iii-aii)、(iii-aiii)、(iii-aiv)、(iii-av)、(iii-avi)、(iii-avii)、(iii-aviii)、(iii-bi)、(iii-bii)、(iii-biii)、(iii-biv)、(iii-bv)、(iii-bvi)、(iii-ci)、(iii-cii)、(iii-ciii)、(iii-civ)、(iii-cv)和(iii-cvi)的化合物;化合物299至397;化合物398-436;其互变异构体;那些化合物和互变异构体的氘化衍生物;以及前述任一者的药学上可接受的盐。在一些实施方案中,每天一次施用至少一种选自以下的化合物、至少一种选自依伐卡托或d-依伐卡托和其药学上可接受的盐的化合物以及至少一种选自
cvi)的化合物;化合物1-298;式(iii)、(iii-ai)、(iii-aii)、(iii-aiii)、(iii-aiv)、(iii-av)、(iii-avi)、(iii-avii)、(iii-aviii)、(iii-bi)、(iii-bii)、(iii-biii)、(iii-biv)、(iii-bv)、(iii-bvi)、(iii-ci)、(iii-cii)、(iii-ciii)、(iii-civ)、(iii-cv)和(iii-cvi)的化合物;化合物299至397;化合物398-436;其互变异构体;那些化合物和互变异构体的氘化衍生物;以及前述任一者的药学上可接受的盐,与至少一种选自d-依伐卡托和其药学上可接受的盐的化合物是每天两次施用。
[0541]
式(i)的化合物;式(ii)、(ii-ai)、(ii-aii)、(ii-aiii)、(ii-aiv)、(ii-av)、(ii-avi)、(ii-bi)、(ii-bii)、(ii-biii)、(ii-biv)、(ii-bv)、(ii-bvi)、(ii-ci)、(ii-cii)、(ii-ciii)、(ii-civ)、(ii-cv)和(ii-cvi)的化合物;化合物1-298;式(iii)、(iii-ai)、(iii-aii)、(iii-aiii)、(iii-aiv)、(iii-av)、(iii-avi)、(iii-avii)、(iii-aviii)、(iii-bi)、(iii-bii)、(iii-biii)、(iii-biv)、(iii-bv)、(iii-bvi)、(iii-ci)、(iii-cii)、(iii-ciii)、(iii-civ)、(iii-cv)和(iii-cvi)的化合物;化合物299至397;化合物398-436;其互变异构体、那些化合物和互变异构体的氘化衍生物以及前述任一者的药学上可接受的盐、替扎卡托、(依伐卡托或d-依伐卡托)和其药学上可接受的盐以及其氘化衍生物可以单一药物组合物或以独立药物组合物施用。此类药物组合物可以每天一次或每天多次,诸如每天两次施用。如本文所使用,短语给定量的api(例如替扎卡托、(依伐卡托或d-依伐卡托)或其药学上可接受的盐)每天一次或两次或每天施用意指,所述给定量每天给药一次或两次来施用。
[0542]
在一些实施方案中,至少一种选自以下的化合物以第一药物组合物施用:式(i)的化合物;式(ii)、(ii-ai)、(ii-aii)、(ii-aiii)、(ii-aiv)、(ii-av)、(ii-avi)、(ii-bi)、(ii-bii)、(ii-biii)、(ii-biv)、(ii-bv)、(ii-bvi)、(ii-ci)、(ii-cii)、(ii-ciii)、(ii-civ)、(ii-cv)和(ii-cvi)的化合物;化合物1-298;式(iii)、(iii-ai)、(iii-aii)、(iii-aiii)、(iii-aiv)、(iii-av)、(iii-avi)、(iii-avii)、(iii-aviii)、(iii-bi)、(iii-bii)、(iii-biii)、(iii-biv)、(iii-bv)、(iii-bvi)、(iii-ci)、(iii-cii)、(iii-ciii)、(iii-civ)、(iii-cv)和(iii-cvi)的化合物;化合物299至397;化合物398-436;其互变异构体、那些化合物和互变异构体的氘化衍生物以及前述任一者的药学上可接受的盐;至少一种选自替扎卡托和其药学上可接受的盐的化合物以第二药物组合物施用;并且至少一种选自依伐卡托和其药学上可接受的盐的化合物以第三药物组合物施用。
[0543]
在一些实施方案中,至少一种选自以下的化合物以第一药物组合物施用:式(i)的化合物;式(ii)、(ii-ai)、(ii-aii)、(ii-aiii)、(ii-aiv)、(ii-av)、(ii-avi)、(ii-bi)、(ii-bii)、(ii-biii)、(ii-biv)、(ii-bv)、(ii-bvi)、(ii-ci)、(ii-cii)、(ii-ciii)、(ii-civ)、(ii-cv)和(ii-cvi)的化合物;化合物1-298;式(iii)、(iii-ai)、(iii-aii)、(iii-aiii)、(iii-aiv)、(iii-av)、(iii-avi)、(iii-avii)、(iii-aviii)、(iii-bi)、(iii-bii)、(iii-biii)、(iii-biv)、(iii-bv)、(iii-bvi)、(iii-ci)、(iii-cii)、(iii-ciii)、(iii-civ)、(iii-cv)和(iii-cvi)的化合物;化合物299至397;化合物398-436;其互变异构体、那些化合物和互变异构体的氘化衍生物以及前述任一者的药学上可接受的盐;至少一种选自替扎卡托和其药学上可接受的盐的化合物以第二药物组合物施用;至少一种选自d-依伐卡托和其药学上可接受的盐的化合物以第三药物组合物施用。
[0544]
在一些实施方案中,至少一种选自以下的化合物以第一药物组合物施用:式(i)的
bvi)、(iii-ci)、(iii-cii)、(iii-ciii)、(iii-civ)、(iii-cv)和(iii-cvi)的化合物;化合物299至397;化合物398-436;替扎卡托、依伐卡托、d-依伐卡托、鲁玛卡托和其互变异构体、那些化合物和互变异构体的氘化衍生物以及前述任一者的药学上可接受的盐。用于替扎卡托和其药学上可接受的盐的一些示例性药物组合物可见于wo 2011/119984和wo 2014/014841中,其以引用的方式并入本文。用于依伐卡托和其药学上可接受的盐的一些示例性药物组合物可见于wo 2007/134279、wo 2010/019239、wo 2011/019413、wo 2012/027731和wo 2013/130669,并且用于d-依伐卡托和其药学上可接受的盐的一些示例性药物组合物可见于us 8,865,902、us 9,181,192、us 9,512,079、wo 2017/053455和wo 2018/080591,其全部以引用的方式并入本文。用于鲁玛卡托和其药学上可接受的盐的一些示例性药物组合物可见于wo 2010/037066、wo 2011/127421和wo 2014/071122中,其以引用的方式并入本文。
[0548]
药物组合物
[0549]
本发明的另一个方面提供一种药物组合物,其包含至少一种选自以下的化合物和至少一种药学上可接受的载体:式(i)的化合物;式(ii)、(ii-ai)、(ii-aii)、(ii-aiii)、(ii-aiv)、(ii-av)、(ii-avi)、(ii-bi)、(ii-bii)、(ii-biii)、(ii-biv)、(ii-bv)、(ii-bvi)、(ii-ci)、(ii-cii)、(ii-ciii)、(ii-civ)、(ii-cv)和(ii-cvi)的化合物;化合物1-298;式(iii)、(iii-ai)、(iii-aii)、(iii-aiii)、(iii-aiv)、(iii-av)、(iii-avi)、(iii-avii)、(iii-aviii)、(iii-bi)、(iii-bii)、(iii-biii)、(iii-biv)、(iii-bv)、(iii-bvi)、(iii-ci)、(iii-cii)、(iii-ciii)、(iii-civ)、(iii-cv)和(iii-cvi)的化合物;化合物299至397;化合物398-436;其互变异构体、那些化合物和互变异构体的氘化衍生物以及前述任一者的药学上可接受的盐。
[0550]
在一些实施方案中,本发明提供药物组合物,其包含至少一种选自以下的化合物与至少一种另外的活性药物成分的组合:式(i)的化合物;式(ii)、(ii-ai)、(ii-aii)、(ii-aiii)、(ii-aiv)、(ii-av)、(ii-avi)、(ii-bi)、(ii-bii)、(ii-biii)、(ii-biv)、(ii-bv)、(ii-bvi)、(ii-ci)、(ii-cii)、(ii-ciii)、(ii-civ)、(ii-cv)和(ii-cvi)的化合物;化合物1-298;式(iii)、(iii-ai)、(iii-aii)、(iii-aiii)、(iii-aiv)、(iii-av)、(iii-avi)、(iii-avii)、(iii-aviii)、(iii-bi)、(iii-bii)、(iii-biii)、(iii-biv)、(iii-bv)、(iii-bvi)、(iii-ci)、(iii-cii)、(iii-ciii)、(iii-civ)、(iii-cv)和(iii-cvi)的化合物;化合物299至397;化合物398-436;其互变异构体、那些化合物和互变异构体的氘化衍生物以及前述任一者的药学上可接受的盐。在一些实施方案中,至少一种另外的活性药物成分是cftr调节剂。在一些实施方案中,至少一种另外的活性药物成分是cftr校正剂。在一些实施方案中,至少一种另外的活性药物成分是cftr增效剂。在一些实施方案中,药物组合物包含至少一种选自以下的化合物核至少两种另外的活性药物成分:式(i)的化合物;式(ii)、(ii-ai)、(ii-aii)、(ii-aiii)、(ii-aiv)、(ii-av)、(ii-avi)、(ii-bi)、(ii-bii)、(ii-biii)、(ii-biv)、(ii-bv)、(ii-bvi)、(ii-ci)、(ii-cii)、(ii-ciii)、(ii-civ)、(ii-cv)和(ii-cvi)的化合物;化合物1-298;式(iii)、(iii-ai)、(iii-aii)、(iii-aiii)、(iii-aiv)、(iii-av)、(iii-avi)、(iii-avii)、(iii-aviii)、(iii-bi)、(iii-bii)、(iii-biii)、(iii-biv)、(iii-bv)、(iii-bvi)、(iii-ci)、(iii-cii)、(iii-ciii)、(iii-civ)、(iii-cv)和(iii-cvi)的化合物;化合物299至397;化合物398-436;其互变异构体、那些化合物和互变
异构体的氘化衍生物以及前述任一者的药学上可接受的盐,所述至少两种另外的活性药物成分之一是cftr校正剂并且其中另一种是cftr增效剂。
[0551]
在一些实施方案中,本发明提供一种药物组合物,其包含(a)至少一种选自以下的化合物:式(i)的化合物;式(ii)、(ii-ai)、(ii-aii)、(ii-aiii)、(ii-aiv)、(ii-av)、(ii-avi)、(ii-bi)、(ii-bii)、(ii-biii)、(ii-biv)、(ii-bv)、(ii-bvi)、(ii-ci)、(ii-cii)、(ii-ciii)、(ii-civ)、(ii-cv)核(ii-cvi)的化合物;化合物1-298;式(iii)、(iii-ai)、(iii-aii)、(iii-aiii)、(iii-aiv)、(iii-av)、(iii-avi)、(iii-avii)、(iii-aviii)、(iii-bi)、(iii-bii)、(iii-biii)、(iii-biv)、(iii-bv)、(iii-bvi)、(iii-ci)、(iii-cii)、(iii-ciii)、(iii-civ)、(iii-cv)和(iii-cvi)的化合物;化合物299至397;化合物398-436;其互变异构体、那些化合物和互变异构体的氘化衍生物以及及前述任一者的药学上可接受的盐;(b)至少一种选自替扎卡托和其药学上可接受的盐的化合物;以及(c)至少一种药学上可接受的载体。
[0552]
在一些实施方案中,本公开提供一种药物组合物,其包含(a)至少一种选自以下的化合物:式(i)的化合物;式(ii)、(ii-ai)、(ii-aii)、(ii-aiii)、(ii-aiv)、(ii-av)、(ii-avi)、(ii-bi)、(ii-bii)、(ii-biii)、(ii-biv)、(ii-bv)、(ii-bvi)、(ii-ci)、(ii-cii)、(ii-ciii)、(ii-civ)、(ii-cv)核(ii-cvi)的化合物;化合物1-298;式(iii)、(iii-ai)、(iii-aii)、(iii-aiii)、(iii-aiv)、(iii-av)、(iii-avi)、(iii-avii)、(iii-aviii)、(iii-bi)、(iii-bii)、(iii-biii)、(iii-biv)、(iii-bv)、(iii-bvi)、(iii-ci)、(iii-cii)、(iii-ciii)、(iii-civ)、(iii-cv)和(iii-cvi)的化合物;化合物299至397;化合物398-436;其互变异构体、那些化合物和互变异构体的氘化衍生物以及及前述任一者的药学上可接受的盐;(b)至少一种选自依伐卡托、d-依伐卡托和其药学上可接受的盐的化合物;以及(c)至少一种药学上可接受的载体。
[0553]
在一些实施方案中,本公开提供一种药物组合物,其包含(a)至少一种选自以下的化合物:式(i)的化合物;式(ii)、(ii-ai)、(ii-aii)、(ii-aiii)、(ii-aiv)、(ii-av)、(ii-avi)、(ii-bi)、(ii-bii)、(ii-biii)、(ii-biv)、(ii-bv)、(ii-bvi)、(ii-ci)、(ii-cii)、(ii-ciii)、(ii-civ)、(ii-cv)和(ii-cvi)的化合物;化合物1-298;式(iii)、(iii-ai)、(iii-aii)、(iii-aiii)、(iii-aiv)、(iii-av)、(iii-avi)、(iii-avii)、(iii-aviii)、(iii-bi)、(iii-bii)、(iii-biii)、(iii-biv)、(iii-bv)、(iii-bvi)、(iii-ci)、(iii-cii)、(iii-ciii)、(iii-civ)、(iii-cv)和(iii-cvi)的化合物;化合物299至397;化合物398-436;其互变异构体、那些化合物和互变异构体的氘化衍生物以及前述任一者的药学上可接受的盐;(b)至少一种选自替扎卡托和其药学上可接受的盐的化合物;(c)至少一种选自依伐卡托和其药学上可接受的盐的化合物;以及(d)至少一种药学上可接受的载体。
[0554]
在一些实施方案中,本公开提供一种药物组合物,其包含(a)至少一种选自以下的化合物:式(i)的化合物;式(ii)、(ii-ai)、(ii-aii)、(ii-aiii)、(ii-aiv)、(ii-av)、(ii-avi)、(ii-bi)、(ii-bii)、(ii-biii)、(ii-biv)、(ii-bv)、(ii-bvi)、(ii-ci)、(ii-cii)、(ii-ciii)、(ii-civ)、(ii-cv)和(ii-cvi)的化合物;化合物1-298;式(iii)、(iii-ai)、(iii-aii)、(iii-aiii)、(iii-aiv)、(iii-av)、(iii-avi)、(iii-avii)、(iii-aviii)、(iii-bi)、(iii-bii)、(iii-biii)、(iii-biv)、(iii-bv)、(iii-bvi)、(iii-ci)、(iii-cii)、(iii-ciii)、(iii-civ)、(iii-cv)和(iii-cvi)的化合物;化合物299至397;化合物
398-436;其互变异构体、那些化合物和互变异构体的氘化衍生物以及前述任一者的药学上可接受的盐;(b)至少一种选自替扎卡托和其药学上可接受的盐的化合物;(c)至少一种选自d-依伐卡托和其药学上可接受的盐的化合物;以及(d)至少一种药学上可接受的载体。
[0555]
在一些实施方案中,本公开提供一种药物组合物,其包含(a)至少一种选自以下的化合物:式(i)的化合物;式(ii)、(ii-ai)、(ii-aii)、(ii-aiii)、(ii-aiv)、(ii-av)、(ii-avi)、(ii-bi)、(ii-bii)、(ii-biii)、(ii-biv)、(ii-bv)、(ii-bvi)、(ii-ci)、(ii-cii)、(ii-ciii)、(ii-civ)、(ii-cv)和(ii-cvi)的化合物;化合物1-298;式(iii)、(iii-ai)、(iii-aii)、(iii-aiii)、(iii-aiv)、(iii-av)、(iii-avi)、(iii-avii)、(iii-aviii)、(iii-bi)、(iii-bii)、(iii-biii)、(iii-biv)、(iii-bv)、(iii-bvi)、(iii-ci)、(iii-cii)、(iii-ciii)、(iii-civ)、(iii-cv)和(iii-cvi)的化合物;化合物299至397;化合物398-436;其互变异构体、那些化合物和互变异构体的氘化衍生物以及前述任一者的药学上可接受的盐;(b)至少一种选自依伐卡托或d-依伐卡托和其药学上可接受的盐的化合物;(c)至少一种选自鲁玛卡托和其药学上可接受的盐的化合物;以及(d)至少一种药学上可接受的载体。
[0556]
本文公开的任何药物组合物可以包含至少一种药学上可接受的载体。在一些实施方案中,至少一种药学上可接受的载体选自药学上可接受的媒介物和药学上可接受的佐剂。在一些实施方案中,至少一种药学上可接受的选自药学上可接受的填充剂、崩解剂、表面活性剂、粘合剂、润滑剂。
[0557]
本文所述的药物组合物可用于治疗囊性纤维化和其他cftr介导的疾病。
[0558]
如上所述,本文公开的药物组合物可以任选地还包含至少一种药学上可接受的载体。至少一种药学上可接受的载体可选自佐剂和媒介物。如本文所使用,至少一种药学上可接受的载体包括适合于所需的特定剂型的任何和所有溶剂、稀释剂、其他液体媒介物、分散助剂、悬浮助剂、表面活性剂、等渗剂、增稠剂、乳化剂、防腐剂、固体粘合剂和润滑剂。remington:the science and practice of pharmacy,第21版,2005,d.b.troy编辑,lippincott williams&wilkins,philadelphia和encyclopedia of pharmaceutical technology,j.swarbrick和j.c.boylan编辑,1988-1999,marcel dekker,new york公开用于配制药物组合物的各种载体和用于制备其的已知技术。除非任何常规载体与本公开的化合物不相容,诸如通过产生任何不合需要的生物作用或另外以有害方式与药物组合物的任何其他组分相互作用,否则预期其使用在本公开的范围内。合适的药学上可接受的载体的非限制性实例包括但不限于离子交换剂、氧化铝、硬脂酸铝、卵磷脂、血清蛋白(例如人血清白蛋白)、缓冲物质(例如磷酸盐、甘氨酸、山梨酸和山梨酸钾)、饱和植物脂肪酸偏甘油酯混合物、水盐和电解质(诸如硫酸鱼精蛋白、磷酸氢二钠、磷酸氢钾、氯化钠和锌盐)、胶体二氧化硅、三硅酸镁、聚乙烯吡咯烷酮、聚丙烯酸酯,、蜡、聚乙烯-聚氧丙烯嵌段聚合物、羊毛脂、糖(诸如乳糖、葡萄糖和蔗糖)、淀粉(诸如玉米淀粉和马铃薯淀粉)、纤维素和其衍生物(诸如羧甲基纤维素钠、乙基纤维素和乙酸纤维素)、粉状黄蓍胶、麦芽、明胶、滑石、赋形剂(诸如可可脂和栓剂蜡)、油类(诸如花生油、棉籽油、红花油、芝麻油、橄榄油、玉米油和大豆油)、二醇类(诸如丙二醇和聚乙二醇)、酯类(诸如油酸乙酯和月桂酸乙酯)、琼脂、缓冲剂(诸如氢氧化镁和氢氧化铝)、海藻酸、无热原质水、等渗盐水、林格氏溶液(ringer's solution)、乙醇、磷酸盐缓冲液、无毒相容润滑剂(诸如月桂基硫酸钠和硬脂酸镁)、着色
剂、脱模剂、包覆剂、甜味剂、调味剂、芳香剂、防腐剂和抗氧化剂。
[0559]
另外的实施方案包括:
[0560]
1.一种式(i)化合物:
[0561][0562]
或其互变异构体、所述化合物或所述互变异构体的氘化衍生物、或前述任一者的药学上可接受的盐,其中:
[0563]-环a是苯基、吲哚、5元杂芳基环或6元杂芳基环;
[0564]-环b是苯基、吡啶基或嘧啶基环;
[0565]-x是o、nh或n(c
1-c6烷基);
[0566]-每个r1独立地选自c
1-c6烷基、c
1-c6烷氧基、c
1-c6卤代烷基、c
1-c6卤代烷氧基、卤素、氰基和羟基,或两个r1基团连同其所连接的原子一起形成5至6元杂芳基或6元芳基环;
[0567]-m是0、1、2、3或4;
[0568]-每个r2独立地选自任选地被苯基或5元或6元杂芳基取代的c
1-c6烷基、c
1-c6烷氧基、c
1-c6卤代烷基、c
1-c6卤代烷氧基、卤素、氰基和羟基;
[0569]-r0是r
11
或
[0570]-环d是苯基环、5元杂环基环、6元杂环基环、5元杂芳基环、6元杂芳基环、3至8元环烷基环或3至8元环烯基;
[0571]-每个r4独立地选自卤素、氧代基、羟基、氰基和-(y)
k-r7基团,或任选地两个r4连同其所连接的原子一起形成5至6元环烷基或杂环基环,其任选独立地被一个或多个选自以下的基团取代:卤素、c
1-c6烷基、卤代烷基、羟基、c
1-c6烷氧基和c
1-c6卤代烷氧基;其中:
[0572]-k是0、1、2、3、4、5或6;
[0573]-每个y独立地选自c(r5)(r6)基团、
–o–
和
–
nra–
基团,其中-(y)
k-r7中的杂原子不键结至-(y)
k-r7中的另一个杂原子,其中:
[0574]-每个r5和r6独立地选自氢、卤素、羟基、c
1-c6烷基和c
3-5
环烷基,或同一碳上的r5和r6一起形成c
3-5
环烷基或氧代基;
[0575]-r5和r6各自任选独立地被一个或多个选自以下的基团取代:c
1-c6烷基、c
1-c6卤代
烷基、卤素、羟基、c
1-c6烷氧基和c
1-c6卤代烷氧基;并且
[0576]-每个ra独立地选自氢和c
1-c6烷基;并且
[0577]-r7选自氢、卤素、氰基和任选地被一个或多个选自以下的基团取代的c
3-c
10
环烷基:c
1-c6烷基、c
1-c6卤代烷基和卤素;
[0578]-q是1、2、3或4;
[0579]-r
11
选自氢、卤素、c
1-c6烷基、c
1-c6烷氧基、c
1-c6卤代烷基、c
1-c6卤代烷氧基、c
2-c6烯基、c
2-c6炔基、苄基、-o-(c
3-c6环烷基)和氰基,其各自被0、1、2或3个r
12
基团取代,或任选地一个r2和r
11
连同其所连接的原子一起形成5至6元环烷基、5至6元杂环基或6元芳基环,其被以下取代:苯基环、5元杂环基环、6元杂环基环、5元杂芳基环、6元杂芳基环、3至8元环烷基环、3至8元环烯基,或0、1、2、3或4个r2基团;
[0580]-每个r
12
独立地选自卤素、羟基、氰基、c
1-c6烷基、c
2-c6烯基、c
2-c6炔基、-(c
1-c6烷基)-o(c
1-c6烷基)、-(c
1-c6烷基)-co2(c
1-c6烷基)、-(c
1-c6烷基)-n(r
x
)(ry)、-(c
1-c6烷基)-co2h、c
1-c6烷氧基、-n(r
x
)(ry)、-co-n(r
x
)(ry)、co2h、-co2(c
1-c6烷基)、-co2bn、-co(c
1-c6烷基)、苯基、5至6元杂芳基、4至6元杂环基和c
3-c
10
环烷基,其各自任选独立地被一个或多个选自以下的基团取代:卤素、氰基、c
1-c6烷基、卤代烷基、羟基、c
1-c6烷氧基、c
1-c6卤代烷氧基和-co2(c
1-c6烷基);
[0581]-n是0、1或2;
[0582]-每个r3是被0、1、2、3、4、5或6个3至8元环烷基环或5元或6元芳基取代的c
1-c6烷基,或两个r3接合形成c
3-c6环烷基环;
[0583]-z是式(l)r的二价连接基团,其中:
[0584]-r是1、2、3、4、5或6;
[0585]-每个l独立地选自c(r8)(r9)基团、
–o–
和
–
nrb–
基团,其中z中的杂原子不键结到z中的另一个杂原子,并且其中是5或6元杂环基、或5或6元杂芳基,其各自被0、1、2、3或4个r
10
基团取代;并且其中:
[0586]-r8和r9各自独立地选自氢、卤素、c
1-c6卤代烷基、c
1-c6烷基、c
2-c6烯基、c
2-c6炔基、羟基、c
1-c6烷氧基、c
1-c6卤代烷氧基、co2h、c(o)n(r
x
)(ry)、苯基、3至8元环烷基、5至6元杂芳基和5至6元杂环基,其各自被0、1、2、3、4或5个r
10
基团取代;
[0587]-每个r
10
独立地选自卤素、羟基氰基、c
1-c6烷基、c
2-c6烯基、c
2-c6炔基、-(c
1-c6烷基)-o(c
1-c6烷基)、-(c
1-c6烷基)-co2(c
1-c6烷基)、-(c
1-c6烷基)-n(r
x
)(ry)、-(c
1-c6烷基)-co2h、c
1-c6烷氧基、-n(r
x
)(ry)、-co-n(r
x
)(ry)、co2h、-co2(c
1-c6烷基)、-co2bn、-co(c
1-c6烷基)、苯基、5至6元杂芳基、4至6元杂环基和c
3-c
10
环烷基,其各自任选独立地被一个或多个选自以下的基团取代:卤素、氰基、c
1-c6烷基、卤代烷基、羟基、c
1-c6烷氧基、c
1-c6卤代烷氧基和-co2(c
1-c6烷基),
[0588]
或同一碳上的r8和r9一起形成氧代基;
[0589]-每个rb独立地选自氢、卤素、c
1-c6卤代烷基、c
1-c6烷基、c
2-c6烯基、c
2-c6炔基、羟基、c
1-c6烷氧基、c
1-c6卤代烷氧基、-co2h、-c(o)n(r
x
)(ry)、苯基、3至8元环烷基、5至6元杂
芳基和5至6元杂环基,其各自被0、1、2、3、4或5个r
10
基团取代,并且任选地一个r1和一个rb连同其所连接的原子一起形成5至6元杂环烷基、或5至6元杂芳基环,其各自被0、1、2、3或4个r
10
基团取代;并且
[0590]-每个r
x
和ry独立地选自氢、c
1-c6烷基、c
1-c6卤代烷基、c
4-c9杂环基、3至6元环烷基、5至6元杂芳基、苄基、-co2(c
1-c6烷基)、-co(c
1-c6烷基),其中所述c
1-c6烷基任选地被-nme2取代,并且其中所述c
4-c9杂环基任选地被-(c
1-c6烷基)-o(c
1-c6烷基)或-co2(c
1-c6烷基)取代。
[0591]
2.如实施方案1所述的化合物,其中所述式(i)的化合物是式(ii)的化合物:
[0592][0593]
其互变异构体、所述化合物或所述互变异构体的氘化衍生物、或前述任一者的药学上可接受的盐,其中:
[0594]-环a是苯基、吲哚、5元杂芳基环或6元杂芳基环;
[0595]-环b是苯基、吡啶基或嘧啶基环;
[0596]-x是o、nh或n(c
1-c6烷基);
[0597]-每个r1独立地选自c
1-c6烷基、c
1-c6烷氧基、c
1-c6卤代烷基、c
1-c6卤代烷氧基、卤素、氰基和羟基,或两个r1基团连同其所连接的原子一起形成5至6元杂芳基或6元芳基环;
[0598]-m是0、1、2、3或4;
[0599]-每个r2独立地选自任选地被苯基或5元或6元杂芳基取代的c
1-c6烷基、c
1-c6烷氧基、c
1-c6卤代烷基、c
1-c6卤代烷氧基、卤素、氰基和羟基;
[0600]-r
11
选自氢、卤素、c
1-c6烷基、c
1-c6烷氧基、c
1-c6卤代烷基、c
1-c6卤代烷氧基、c
2-c6烯基、c
2-c6炔基、苄基、-o-(c
3-c6环烷基)和氰基,其各自被0、1、2或3个r
12
基团取代,或任选地一个r2和r
11
连同其所连接的原子一起形成5至6元环烷基、5至6元杂环基或6元芳基环,其被以下取代:苯基环、5元杂环基环、6元杂环基环、5元杂芳基环、6元杂芳基环、3至8元环烷基环、3至8元环烯基,或0、1、2、3或4个r2基团;
[0601]-每个r
12
独立地选自卤素、羟基、氰基、c
1-c6烷基、c
2-c6烯基、c
2-c6炔基、-(c
1-c6烷基)-o(c
1-c6烷基)、-(c
1-c6烷基)-co2(c
1-c6烷基)、-(c
1-c6烷基)-n(r
x
)(ry)、-(c
1-c6烷基)-co2h、c
1-c6烷氧基、-n(r
x
)(ry)、-co-n(r
x
)(ry)、co2h、-co2(c
1-c6烷基)、-co2bn、-co(c
1-c6烷基)、苯基、5至6元杂芳基、4至6元杂环基和c
3-c
10
环烷基,其各自任选独立地被一个或多个选自以下的基团取代:卤素、氰基、c
1-c6烷基、卤代烷基、羟基、c
1-c6烷氧基、c
1-c6卤代烷氧基和-co2(c
1-c6烷基);
[0602]-n是0、1或2;
[0603]-每个r3是被0、1、2、3、4、5或6个3至8元环烷基环或5元或6元芳基取代的c
1-c6烷
基,或两个r3接合形成c
3-c6环烷基环,或两个r3接合形成c
3-c6环烷基环;
[0604]-z是式(l)r的二价连接基团,其中:
[0605]-r是1、2、3、4、5或6;
[0606]-每个l独立地选自c(r8)(r9)基团、
–o–
和
–
nrb–
基团,其中z中的杂原子不键结到z中的另一个杂原子,并且其中是5或6元杂环基、或5或6元杂芳基,其各自被0、1、2、3或4个r
10
基团取代;并且其中:
[0607]-r8和r9各自独立地选自氢、卤素、c
1-c6卤代烷基、c
1-c6烷基、c
2-c6烯基、c
2-c6炔基、羟基、c
1-c6烷氧基、c
1-c6卤代烷氧基、co2h、c(o)n(r
x
)(ry)、苯基、3至8元环烷基、5至6元杂芳基和5至6元杂环基,其各自被0、1、2、3、4或5个r
10
基团取代;
[0608]-每个r
10
独立地选自卤素、羟基氰基、c
1-c6烷基、c
2-c6烯基、c
2-c6炔基、-(c
1-c6烷基)-o(c
1-c6烷基)、-(c
1-c6烷基)-co2(c
1-c6烷基)、-(c
1-c6烷基)-n(r
x
)(ry)、-(c
1-c6烷基)-co2h、c
1-c6烷氧基、-n(r
x
)(ry)、-co-n(r
x
)(ry)、co2h、-co2(c
1-c6烷基)、-co2bn、-co(c
1-c6烷基)、苯基、5至6元杂芳基、4至6元杂环基和c
3-c
10
环烷基,其各自任选独立地被一个或多个选自以下的基团取代:卤素、氰基、c
1-c6烷基、卤代烷基、羟基、c
1-c6烷氧基、c
1-c6卤代烷氧基和-co2(c
1-c6烷基),
[0609]
或同一碳上的r8和r9一起形成氧代基;
[0610]-每个rb独立地选自氢、卤素、c
1-c6卤代烷基、c
1-c6烷基、c
2-c6烯基、c
2-c6炔基、羟基、c
1-c6烷氧基、c
1-c6卤代烷氧基、-co2h、-c(o)n(r
x
)(ry)、苯基、3至8元环烷基、5至6元杂芳基和5至6元杂环基,其各自被0、1、2、3、4或5个r
10
基团取代,并且任选地一个r1和一个rb连同其所连接的原子一起形成5至6元杂环烷基、或5至6元杂芳基环,其各自被0、1、2、3或4个r
10
基团取代;并且
[0611]-每个r
x
和ry独立地选自氢、c
1-c6烷基、c
1-c6卤代烷基、c
4-c9杂环基、3至6元环烷基、5至6元杂芳基、苄基、-co2(c
1-c6烷基)、-co(c
1-c6烷基),其中所述c
1-c6烷基任选地被-nme2取代,并且其中所述c
4-c9杂环基任选地被-(c
1-c6烷基)-o(c
1-c6烷基)或-co2(c
1-c6烷基)取代。
[0612]
3.如实施方案2所述的化合物,其中所述式(i)的化合物是式(ii-ai)的化合物:
[0613][0614]
其互变异构体、所述化合物或所述互变异构体的氘化衍生物、或前述任一者的药学上可接受的盐,其中:
[0615]-环a是苯基、吲哚、5元杂芳基环或6元杂芳基环;
[0616]-x是o、nh或n(c
1-c6烷基);
[0617]-每个r1独立地选自c
1-c6烷基、c
1-c6烷氧基、c
1-c6卤代烷基、c
1-c6卤代烷氧基、卤素、氰基和羟基,或两个r1基团连同其所连接的原子一起形成5至6元杂芳基或6元芳基环;
[0618]-m是0、1、2、3或4;
[0619]-每个r2独立地选自任选地被苯基或5元或6元杂芳基取代的c
1-c6烷基、c
1-c6烷氧基、c
1-c6卤代烷基、c
1-c6卤代烷氧基、卤素、氰基和羟基;
[0620]-r
11
选自氢、卤素、c
1-c6烷基、c
1-c6烷氧基、c
1-c6卤代烷基、c
1-c6卤代烷氧基、c
2-c6烯基、c
2-c6炔基、苄基、-o-(c
3-c6环烷基)和氰基,其各自被0、1、2或3个r
12
基团取代,或任选地一个r2和r
11
连同其所连接的原子一起形成5至6元环烷基、5至6元杂环基或6元芳基环,其被以下取代:苯基环、5元杂环基环、6元杂环基环、5元杂芳基环、6元杂芳基环、3至8元环烷基环、3至8元环烯基,或0、1、2、3或4个r2基团;
[0621]-每个r
12
独立地选自卤素、羟基、氰基、c
1-c6烷基、c
2-c6烯基、c
2-c6炔基、-(c
1-c6烷基)-o(c
1-c6烷基)、-(c
1-c6烷基)-co2(c
1-c6烷基)、-(c
1-c6烷基)-n(r
x
)(ry)、-(c
1-c6烷基)-co2h、c
1-c6烷氧基、-n(r
x
)(ry)、-co-n(r
x
)(ry)、co2h、-co2(c
1-c6烷基)、-co2bn、-co(c
1-c6烷基)、苯基、5至6元杂芳基、4至6元杂环基和c
3-c
10
环烷基,其各自任选独立地被一个或多个选自以下的基团取代:卤素、氰基、c
1-c6烷基、卤代烷基、羟基、c
1-c6烷氧基、c
1-c6卤代烷氧基和-co2(c
1-c6烷基),
[0622]-n是0、1或2;
[0623]-每个r3是被0、1、2、3、4、5或6个3至8元环烷基环或5元或6元芳基取代的c
1-c6烷基,或两个r3接合形成c
3-c6环烷基环;
[0624]-z是式(l)r的二价连接基团,其中:
[0625]-r是1、2、3、4、5或6;
[0626]-每个l独立地选自c(r8)(r9)基团、
–o–
和
–
nrb–
基团,其中z中的杂原子不键结到z中的另一个杂原子,并且其中是5或6元杂环基、或5或6元杂芳基,其各自被0、1、2、3或4个r
10
基团取代;并且其中:
[0627]-r8和r9各自独立地选自氢、卤素、c
1-c6卤代烷基、c
1-c6烷基、c
2-c6烯基、c
2-c6炔基、羟基、c
1-c6烷氧基、c
1-c6卤代烷氧基、co2h、c(o)n(r
x
)(ry)、苯基、3至8元环烷基、5至6元杂芳基和5至6元杂环基,其各自被0、1、2、3、4或5个r
10
基团取代;
[0628]-每个r
10
独立地选自卤素、羟基氰基、c
1-c6烷基、c
2-c6烯基、c
2-c6炔基、-(c
1-c6烷基)-o(c
1-c6烷基)、-(c
1-c6烷基)-co2(c
1-c6烷基)、-(c
1-c6烷基)-n(r
x
)(ry)、-(c
1-c6烷基)-co2h、c
1-c6烷氧基、-n(r
x
)(ry)、-co-n(r
x
)(ry)、co2h、-co2(c
1-c6烷基)、-co2bn、-co(c
1-c6烷基)、苯基、5至6元杂芳基、4至6元杂环基和c
3-c
10
环烷基,其各自任选独立地被一个或多个选自以下的基团取代:卤素、氰基、c
1-c6烷基、卤代烷基、羟基、c
1-c6烷氧基、c
1-c6卤代烷氧基和-co2(c
1-c6烷基),
[0629]
或同一碳上的r8和r9一起形成氧代基;
[0630]-每个rb独立地选自氢、卤素、c
1-c6卤代烷基、c
1-c6烷基、c
2-c6烯基、c
2-c6炔基、羟基、c
1-c6烷氧基、c
1-c6卤代烷氧基、-co2h、-c(o)n(r
x
)(ry)、苯基、3至8元环烷基、5至6元杂芳基和5至6元杂环基,其各自被0、1、2、3、4或5个r
10
基团取代,并且任选地一个r1和一个rb连同其所连接的原子一起形成5至6元杂环烷基、或5至6元杂芳基环,其各自被0、1、2、3或4个r
10
基团取代;并且
[0631]-每个r
x
和ry独立地选自氢、c
1-c6烷基、c
1-c6卤代烷基、c
4-c9杂环基、3至6元环烷基、5至6元杂芳基、苄基、-co2(c
1-c6烷基)、-co(c
1-c6烷基),其中所述c
1-c6烷基任选地被-nme2取代,并且其中所述c
4-c9杂环基任选地被-(c
1-c6烷基)-o(c
1-c6烷基)或-co2(c
1-c6烷基)取代。
[0632]
4.如实施方案2所述的化合物,其中所述式(ii)的化合物是式(ii-aii)、(ii-aiii)或(ii-aiv)的化合物:
[0633][0634]
其互变异构体、所述化合物或所述互变异构体的氘化衍生物、或前述任一者的药学上可接受的盐,其中:
[0635]-环a是苯基、吲哚、5元杂芳基环或6元杂芳基环;
[0636]-每个r1独立地选自c
1-c6烷基、c
1-c6烷氧基、c
1-c6卤代烷基、c
1-c6卤代烷氧基、卤
素、氰基和羟基,或两个r1基团连同其所连接的原子一起形成5至6元杂芳基或6元芳基环;
[0637]-m是0、1、2、3或4;
[0638]-每个r2独立地选自任选地被苯基或5元或6元杂芳基取代的c
1-c6烷基、c
1-c6烷氧基、c
1-c6卤代烷基、c
1-c6卤代烷氧基、卤素、氰基和羟基;
[0639]-r
11
选自氢、卤素、c
1-c6烷基、c
1-c6烷氧基、c
1-c6卤代烷基、c
1-c6卤代烷氧基、c
2-c6烯基、c
2-c6炔基、苄基、-o-(c
3-c6环烷基)和氰基,其各自被0、1、2或3个r
12
基团取代,或任选地一个r2和r
11
连同其所连接的原子一起形成5至6元环烷基、5至6元杂环基或6元芳基环,其被以下取代:苯基环、5元杂环基环、6元杂环基环、5元杂芳基环、6元杂芳基环、3至8元环烷基环、3至8元环烯基,或0、1、2、3或4个r2基团;
[0640]-每个r
12
独立地选自卤素、羟基、氰基、c
1-c6烷基、c
2-c6烯基、c
2-c6炔基、-(c
1-c6烷基)-o(c
1-c6烷基)、-(c
1-c6烷基)-co2(c
1-c6烷基)、-(c
1-c6烷基)-n(r
x
)(ry)、-(c
1-c6烷基)-co2h、c
1-c6烷氧基、-n(r
x
)(ry)、-co-n(r
x
)(ry)、co2h、-co2(c
1-c6烷基)、-co2bn、-co(c
1-c6烷基)、苯基、5至6元杂芳基、4至6元杂环基和c
3-c
10
环烷基,其各自任选独立地被一个或多个选自以下的基团取代:卤素、氰基、c
1-c6烷基、卤代烷基、羟基、c
1-c6烷氧基、c
1-c6卤代烷氧基和-co2(c
1-c6烷基),
[0641]-n是0、1或2;
[0642]-每个r3是被0、1、2、3、4、5或6个3至8元环烷基环或5元或6元芳基取代的c
1-c6烷基,或两个r3接合形成c
3-c6环烷基环;
[0643]-z是式(l)r的二价连接基团,其中:
[0644]-r是1、2、3、4、5或6;
[0645]-每个l独立地选自c(r8)(r9)基团、
–o–
和
–
nrb–
基团,其中z中的杂原子不键结到z中的另一个杂原子,并且其中是5或6元杂环基、或5或6元杂芳基,其各自被0、1、2、3或4个r
10
基团取代;并且其中:
[0646]-r8和r9各自独立地选自氢、卤素、c
1-c6卤代烷基、c
1-c6烷基、c
2-c6烯基、c
2-c6炔基、羟基、c
1-c6烷氧基、c
1-c6卤代烷氧基、co2h、c(o)n(r
x
)(ry)、苯基、3至8元环烷基、5至6元杂芳基和5至6元杂环基,其各自被0、1、2、3、4或5个r
10
基团取代;
[0647]-每个r
10
独立地选自卤素、羟基氰基、c
1-c6烷基、c
2-c6烯基、c
2-c6炔基、-(c
1-c6烷基)-o(c
1-c6烷基)、-(c
1-c6烷基)-co2(c
1-c6烷基)、-(c
1-c6烷基)-n(r
x
)(ry)、-(c
1-c6烷基)-co2h、c
1-c6烷氧基、-n(r
x
)(ry)、-co-n(r
x
)(ry)、co2h、-co2(c
1-c6烷基)、-co2bn、-co(c
1-c6烷基)、苯基、5至6元杂芳基、4至6元杂环基和c
3-c
10
环烷基,其各自任选独立地被一个或多个选自以下的基团取代:卤素、氰基、c
1-c6烷基、卤代烷基、羟基、c
1-c6烷氧基、c
1-c6卤代烷氧基和-co2(c
1-c6烷基),
[0648]
或同一碳上的r8和r9一起形成氧代基;
[0649]-每个rb独立地选自氢、卤素、c
1-c6卤代烷基、c
1-c6烷基、c
2-c6烯基、c
2-c6炔基、羟基、c
1-c6烷氧基、c
1-c6卤代烷氧基、-co2h、-c(o)n(r
x
)(ry)、苯基、3至8元环烷基、5至6元杂芳基和5至6元杂环基,其各自被0、1、2、3、4或5个r
10
基团取代,并且任选地一个r1和一个rb连同其所连接的原子一起形成5至6元杂环烷基、或5至6元杂芳基环,其各自被0、1、2、3或4个r
10
基团取代;并且
[0650]-每个r
x
和ry独立地选自氢、c
1-c6烷基、c
1-c6卤代烷基、c
4-c9杂环基、3至6元环烷基、5至6元杂芳基、苄基、-co2(c
1-c6烷基)、-co(c
1-c6烷基),其中所述c
1-c6烷基任选地被-nme2取代,并且其中所述c
4-c9杂环基任选地被-(c
1-c6烷基)-o(c
1-c6烷基)或-co2(c
1-c6烷基)取代。
[0651]
5.如实施方案2所述的化合物,其中所述式(ii)的化合物是式(ii-av)的化合物:
[0652][0653]
其互变异构体、所述化合物或所述互变异构体的氘化衍生物、或前述任一者的药学上可接受的盐,其中:
[0654]-由*表示的碳具有s-立体化学或r-立体化学;
[0655]-环a是苯基、吲哚、5元杂芳基环或6元杂芳基环;
[0656]-每个r1独立地选自c
1-c6烷基、c
1-c6烷氧基、c
1-c6卤代烷基、c
1-c6卤代烷氧基、卤素、氰基和羟基,或两个r1基团连同其所连接的原子一起形成5至6元杂芳基或6元芳基环;
[0657]-m是0、1、2、3或4;
[0658]-每个r2独立地选自任选地被苯基或5元或6元杂芳基取代的c
1-c6烷基、c
1-c6烷氧基、c
1-c6卤代烷基、c
1-c6卤代烷氧基、卤素、氰基和羟基;
[0659]-r
11
选自氢、卤素、c
1-c6烷基、c
1-c6烷氧基、c
1-c6卤代烷基、c
1-c6卤代烷氧基、c
2-c6烯基、c
2-c6炔基、苄基、-o-(c
3-c6环烷基)和氰基,其各自被0、1、2或3个r
12
基团取代,或任选地一个r2和r
11
连同其所连接的原子一起形成5至6元环烷基、5至6元杂环基或6元芳基环,其被以下取代:苯基环、5元杂环基环、6元杂环基环、5元杂芳基环、6元杂芳基环、3至8元环烷基环、3至8元环烯基,或0、1、2、3或4个r2基团;
[0660]-每个r
12
独立地选自卤素、羟基、氰基、c
1-c6烷基、c
2-c6烯基、c
2-c6炔基、-(c
1-c6烷基)-o(c
1-c6烷基)、-(c
1-c6烷基)-co2(c
1-c6烷基)、-(c
1-c6烷基)-n(r
x
)(ry)、-(c
1-c6烷基)-co2h、c
1-c6烷氧基、-n(r
x
)(ry)、-co-n(r
x
)(ry)、co2h、-co2(c
1-c6烷基)、-co2bn、-co(c
1-c6烷基)、苯基、5至6元杂芳基、4至6元杂环基和c
3-c
10
环烷基,其各自任选独立地被一个或多个选自以下的基团取代:卤素、氰基、c
1-c6烷基、卤代烷基、羟基、c
1-c6烷氧基、c
1-c6卤代烷氧基和-co2(c
1-c6烷基),
[0661]-n是0、1或2;
[0662]-每个r3是被0、1、2、3、4、5或6个3至8元环烷基环或5元或6元芳基取代的c
1-c6烷基,或两个r3接合形成c
3-c6环烷基环;
[0663]-z是式(l)r的二价连接基团,其中:
[0664]-r是1、2、3、4、5或6;
[0665]-每个l独立地选自c(r8)(r9)基团、
–o–
和
–
nrb–
基团,其中z中的杂原子不键结到z中的另一个杂原子,并且其中是5或6元杂环基、或5或6元杂芳基,其各自被0、1、2、3或4个r
10
基团取代;并且其中:
[0666]-r8和r9各自独立地选自氢、卤素、c
1-c6卤代烷基、c
1-c6烷基、c
2-c6烯基、c
2-c6炔基、羟基、c
1-c6烷氧基、c
1-c6卤代烷氧基、co2h、c(o)n(r
x
)(ry)、苯基、3至8元环烷基、5至6元杂芳基和5至6元杂环基,其各自被0、1、2、3、4或5个r
10
基团取代;
[0667]-每个r
10
独立地选自卤素、羟基氰基、c
1-c6烷基、c
2-c6烯基、c
2-c6炔基、-(c
1-c6烷基)-o(c
1-c6烷基)、-(c
1-c6烷基)-co2(c
1-c6烷基)、-(c
1-c6烷基)-n(r
x
)(ry)、-(c
1-c6烷基)-co2h、c
1-c6烷氧基、-n(r
x
)(ry)、-co-n(r
x
)(ry)、co2h、-co2(c
1-c6烷基)、-co2bn、-co(c
1-c6烷基)、苯基、5至6元杂芳基、4至6元杂环基和c
3-c
10
环烷基,其各自任选独立地被一个或多个选自以下的基团取代:卤素、氰基、c
1-c6烷基、卤代烷基、羟基、c
1-c6烷氧基、c
1-c6卤代烷氧基和-co2(c
1-c6烷基),
[0668]
或同一碳上的r8和r9一起形成氧代基;
[0669]-每个rb独立地选自氢、卤素、c
1-c6卤代烷基、c
1-c6烷基、c
2-c6烯基、c
2-c6炔基、羟基、c
1-c6烷氧基、c
1-c6卤代烷氧基、-co2h、-c(o)n(r
x
)(ry)、苯基、3至8元环烷基、5至6元杂芳基和5至6元杂环基,其各自被0、1、2、3、4或5个r
10
基团取代,并且任选地一个r1和一个rb连同其所连接的原子一起形成5至6元杂环烷基、或5至6元杂芳基环,其各自被0、1、2、3或4个r
10
基团取代;并且
[0670]-每个r
x
和ry独立地选自氢、c
1-c6烷基、c
1-c6卤代烷基、c
4-c9杂环基、3至6元环烷基、5至6元杂芳基、苄基、-co2(c
1-c6烷基)、-co(c
1-c6烷基),其中所述c
1-c6烷基任选地被-nme2取代,并且其中所述c
4-c9杂环基任选地被-(c
1-c6烷基)-o(c
1-c6烷基)或-co2(c
1-c6烷基)取代。
[0671]
6.如实施方案2所述的化合物,其中所述式(ii)的化合物是式(ii-avi)的化合物:
[0672][0673]
其互变异构体、所述化合物或所述互变异构体的氘化衍生物、或前述任一者的药学上可接受的盐,其中:
[0674]-环a是苯基、吲哚、5元杂芳基环或6元杂芳基环;
[0675]-每个r1独立地选自c
1-c6烷基、c
1-c6烷氧基、c
1-c6卤代烷基、c
1-c6卤代烷氧基、卤素、氰基和羟基,或两个r1基团连同其所连接的原子一起形成5至6元杂芳基或6元芳基环;
[0676]-m是0、1、2、3或4;
[0677]-每个r2独立地选自任选地被苯基或5元或6元杂芳基取代的c
1-c6烷基、c
1-c6烷氧基、c
1-c6卤代烷基、c
1-c6卤代烷氧基、卤素、氰基和羟基;
[0678]-r
11
选自氢、卤素、c
1-c6烷基、c
1-c6烷氧基、c
1-c6卤代烷基、c
1-c6卤代烷氧基、c
2-c6烯基、c
2-c6炔基、苄基、-o-(c
3-c6环烷基)和氰基,其各自被0、1、2或3个r
12
基团取代,或任选地一个r2和r
11
连同其所连接的原子一起形成5至6元环烷基、5至6元杂环基或6元芳基环,其被以下取代:苯基环、5元杂环基环、6元杂环基环、5元杂芳基环、6元杂芳基环、3至8元环烷基环、3至8元环烯基,或0、1、2、3或4个r2基团;
[0679]-每个r
12
独立地选自卤素、羟基、氰基、c
1-c6烷基、c
2-c6烯基、c
2-c6炔基、-(c
1-c6烷基)-o(c
1-c6烷基)、-(c
1-c6烷基)-co2(c
1-c6烷基)、-(c
1-c6烷基)-n(r
x
)(ry)、-(c
1-c6烷基)-co2h、c
1-c6烷氧基、-n(r
x
)(ry)、-co-n(r
x
)(ry)、co2h、-co2(c
1-c6烷基)、-co2bn、-co(c
1-c6烷基)、苯基、5至6元杂芳基、4至6元杂环基和c
3-c
10
环烷基,其各自任选独立地被一个或多个选自以下的基团取代:卤素、氰基、c
1-c6烷基、卤代烷基、羟基、c
1-c6烷氧基、c
1-c6卤代烷氧基和-co2(c
1-c6烷基),
[0680]-n是0、1或2;
[0681]-每个r3是被0、1、2、3、4、5或6个3至8元环烷基环或5元或6元芳基取代的c
1-c6烷基,或两个r3接合形成c
3-c6环烷基环;
[0682]-z是式(l)r的二价连接基团,其中:
[0683]-r是1、2、3、4、5或6;
[0684]-每个l独立地选自c(r8)(r9)基团、
–o–
和
–
nrb–
基团,其中z中的杂原子不键结到z中的另一个杂原子,并且其中是5或6元杂环基、或5或6元杂芳基,其各自被0、1、2、3或4个r
10
基团取代;并且其中:
[0685]-r8和r9各自独立地选自氢、卤素、c
1-c6卤代烷基、c
1-c6烷基、c
2-c6烯基、c
2-c6炔基、羟基、c
1-c6烷氧基、c
1-c6卤代烷氧基、co2h、c(o)n(r
x
)(ry)、苯基、3至8元环烷基、5至6元杂芳基和5至6元杂环基,其各自被0、1、2、3、4或5个r
10
基团取代;
[0686]-每个r
10
独立地选自卤素、羟基氰基、c
1-c6烷基、c
2-c6烯基、c
2-c6炔基、-(c
1-c6烷基)-o(c
1-c6烷基)、-(c
1-c6烷基)-co2(c
1-c6烷基)、-(c
1-c6烷基)-n(r
x
)(ry)、-(c
1-c6烷基)-co2h、c
1-c6烷氧基、-n(r
x
)(ry)、-co-n(r
x
)(ry)、co2h、-co2(c
1-c6烷基)、-co2bn、-co(c
1-c6烷基)、苯基、5至6元杂芳基、4至6元杂环基和c
3-c
10
环烷基,其各自任选独立地被一个或多个选自以下的基团取代:卤素、氰基、c
1-c6烷基、卤代烷基、羟基、c
1-c6烷氧基、c
1-c6卤代烷氧基和-co2(c
1-c6烷基),
[0687]
或同一碳上的r8和r9一起形成氧代基;
[0688]-每个rb独立地选自氢、卤素、c
1-c6卤代烷基、c
1-c6烷基、c
2-c6烯基、c
2-c6炔基、羟基、c
1-c6烷氧基、c
1-c6卤代烷氧基、-co2h、-c(o)n(r
x
)(ry)、苯基、3至8元环烷基、5至6元杂
芳基和5至6元杂环基,其各自被0、1、2、3、4或5个r
10
基团取代,并且任选地一个r1和一个rb连同其所连接的原子一起形成5至6元杂环烷基、或5至6元杂芳基环,其各自被0、1、2、3或4个r
10
基团取代;并且
[0689]-每个r
x
和ry独立地选自氢、c
1-c6烷基、c
1-c6卤代烷基、c
4-c9杂环基、3至6元环烷基、5至6元杂芳基、苄基、-co2(c
1-c6烷基)、-co(c
1-c6烷基),其中所述c
1-c6烷基任选地被-nme2取代,并且其中所述c
4-c9杂环基任选地被-(c
1-c6烷基)-o(c
1-c6烷基)或-co2(c
1-c6烷基)取代。
[0690]
7.如实施方案2所述的化合物,其中所述式(ii)的化合物是式(ii-bi)、(ii-bii)、(ii-biii)或(ii-biv)的化合物:
[0691]
[0692][0693]
其互变异构体、所述化合物或所述互变异构体的氘化衍生物、或前述任一者的药学上可接受的盐,其中:
[0694]-每个r1独立地选自c
1-c6烷基、c
1-c6烷氧基、c
1-c6卤代烷基、c
1-c6卤代烷氧基、卤素、氰基和羟基,或两个r1基团连同其所连接的原子一起形成5至6元杂芳基或6元芳基环;
[0695]-m是0、1、2、3或4;
[0696]-每个r2独立地选自任选地被苯基或5元或6元杂芳基取代的c
1-c6烷基、c
1-c6烷氧基、c
1-c6卤代烷基、c
1-c6卤代烷氧基、卤素、氰基和羟基;
[0697]-r
11
选自氢、卤素、c
1-c6烷基、c
1-c6烷氧基、c
1-c6卤代烷基、c
1-c6卤代烷氧基、c
2-c6烯基、c
2-c6炔基、苄基、-o-(c
3-c6环烷基)和氰基,其各自被0、1、2或3个r
12
基团取代,或任选地一个r2和r
11
连同其所连接的原子一起形成5至6元环烷基、5至6元杂环基或6元芳基环,其被以下取代:苯基环、5元杂环基环、6元杂环基环、5元杂芳基环、6元杂芳基环、3至8元环烷基环、3至8元环烯基,或0、1、2、3或4个r2基团;
[0698]-每个r
12
独立地选自卤素、羟基、氰基、c
1-c6烷基、c
2-c6烯基、c
2-c6炔基、-(c
1-c6烷基)-o(c
1-c6烷基)、-(c
1-c6烷基)-co2(c
1-c6烷基)、-(c
1-c6烷基)-n(r
x
)(ry)、-(c
1-c6烷基)-co2h、c
1-c6烷氧基、-n(r
x
)(ry)、-co-n(r
x
)(ry)、co2h、-co2(c
1-c6烷基)、-co2bn、-co(c
1-c6烷基)、苯基、5至6元杂芳基、4至6元杂环基和c
3-c
10
环烷基,其各自任选独立地被一个或多个选自以下的基团取代:卤素、氰基、c
1-c6烷基、卤代烷基、羟基、c
1-c6烷氧基、c
1-c6卤代烷氧基和-co2(c
1-c6烷基),
[0699]-n是0、1或2;
[0700]-每个r3是被0、1、2、3、4、5或6个3至8元环烷基环或5元或6元芳基取代的c
1-c6烷基,或两个r3接合形成c
3-c6环烷基环;
[0701]-z是式(l)r的二价连接基团,其中:
[0702]-r是1、2、3、4、5或6;
[0703]-每个l独立地选自c(r8)(r9)基团、
–o–
和
–
nrb–
基团,其中z中的杂原子不键结到z中的另一个杂原子,并且其中是5或6元杂环基、或5或6元杂芳基,其各自被0、1、2、3或4个r
10
基团取代;并且其中:
[0704]-r8和r9各自独立地选自氢、卤素、c
1-c6卤代烷基、c
1-c6烷基、c
2-c6烯基、c
2-c6炔基、羟基、c
1-c6烷氧基、c
1-c6卤代烷氧基、co2h、c(o)n(r
x
)(ry)、苯基、3至8元环烷基、5至6元
杂芳基和5至6元杂环基,其各自被0、1、2、3、4或5个r
10
基团取代;
[0705]-每个r
10
独立地选自卤素、羟基氰基、c
1-c6烷基、c
2-c6烯基、c
2-c6炔基、-(c
1-c6烷基)-o(c
1-c6烷基)、-(c
1-c6烷基)-co2(c
1-c6烷基)、-(c
1-c6烷基)-n(r
x
)(ry)、-(c
1-c6烷基)-co2h、c
1-c6烷氧基、-n(r
x
)(ry)、-co-n(r
x
)(ry)、co2h、-co2(c
1-c6烷基)、-co2bn、-co(c
1-c6烷基)、苯基、5至6元杂芳基、4至6元杂环基和c
3-c
10
环烷基,其各自任选独立地被一个或多个选自以下的基团取代:卤素、氰基、c
1-c6烷基、卤代烷基、羟基、c
1-c6烷氧基、c
1-c6卤代烷氧基和-co2(c
1-c6烷基),
[0706]
或同一碳上的r8和r9一起形成氧代基;
[0707]-每个rb独立地选自氢、卤素、c
1-c6卤代烷基、c
1-c6烷基、c
2-c6烯基、c
2-c6炔基、羟基、c
1-c6烷氧基、c
1-c6卤代烷氧基、-co2h、-c(o)n(r
x
)(ry)、苯基、3至8元环烷基、5至6元杂芳基和5至6元杂环基,其各自被0、1、2、3、4或5个r
10
基团取代,并且任选地一个r1和一个rb连同其所连接的原子一起形成5至6元杂环烷基、或5至6元杂芳基环,其各自被0、1、2、3或4个r
10
基团取代;并且
[0708]-每个r
x
和ry独立地选自氢、c
1-c6烷基、c
1-c6卤代烷基、c
4-c9杂环基、3至6元环烷基、5至6元杂芳基、苄基、-co2(c
1-c6烷基)、-co(c
1-c6烷基),其中所述c
1-c6烷基任选地被-nme2取代,并且其中所述c
4-c9杂环基任选地被-(c
1-c6烷基)-o(c
1-c6烷基)或-co2(c
1-c6烷基)取代。
[0709]
8.如实施方案2所述的化合物,其中所述式(ii)的化合物是式(ii-bv)的化合物:
[0710][0711]
其互变异构体、所述化合物或所述互变异构体的氘化衍生物、或前述任一者的药学上可接受的盐,其中:
[0712]-由*表示的碳具有s-立体化学或r-立体化学;
[0713]-每个r1独立地选自c
1-c6烷基、c
1-c6烷氧基、c
1-c6卤代烷基、c
1-c6卤代烷氧基、卤素、氰基和羟基,或两个r1基团连同其所连接的原子一起形成5至6元杂芳基或6元芳基环;
[0714]-m是0、1、2、3或4;
[0715]-每个r2独立地选自任选地被苯基或5元或6元杂芳基取代的c
1-c6烷基、c
1-c6烷氧基、c
1-c6卤代烷基、c
1-c6卤代烷氧基、卤素、氰基和羟基;
[0716]-r
11
选自氢、卤素、c
1-c6烷基、c
1-c6烷氧基、c
1-c6卤代烷基、c
1-c6卤代烷氧基、c
2-c6烯基、c
2-c6炔基、苄基、-o-(c
3-c6环烷基)和氰基,其各自被0、1、2或3个r
12
基团取代,或任选地一个r2和r
11
连同其所连接的原子一起形成5至6元环烷基、5至6元杂环基或6元芳基环,其被以下取代:苯基环、5元杂环基环、6元杂环基环、5元杂芳基环、6元杂芳基环、3至8元环烷基环、3至8元环烯基,或0、1、2、3或4个r2基团;
[0717]-每个r
12
独立地选自卤素、羟基、氰基、c
1-c6烷基、c
2-c6烯基、c
2-c6炔基、-(c
1-c6烷基)-o(c
1-c6烷基)、-(c
1-c6烷基)-co2(c
1-c6烷基)、-(c
1-c6烷基)-n(r
x
)(ry)、-(c
1-c6烷基)-co2h、c
1-c6烷氧基、-n(r
x
)(ry)、-co-n(r
x
)(ry)、co2h、-co2(c
1-c6烷基)、-co2bn、-co(c
1-c6烷基)、苯基、5至6元杂芳基、4至6元杂环基和c
3-c
10
环烷基,其各自任选独立地被一个或多个选自以下的基团取代:卤素、氰基、c
1-c6烷基、卤代烷基、羟基、c
1-c6烷氧基、c
1-c6卤代烷氧基和-co2(c
1-c6烷基),
[0718]-n是0、1或2;
[0719]-每个r3是被0、1、2、3、4、5或6个3至8元环烷基环或5元或6元芳基取代的c
1-c6烷基,或两个r3接合形成c
3-c6环烷基环;
[0720]-z是式(l)r的二价连接基团,其中:
[0721]-r是1、2、3、4、5或6;
[0722]-每个l独立地选自c(r8)(r9)基团、
–o–
和
–
nrb–
基团,其中z中的杂原子不键结到z中的另一个杂原子,并且其中是5或6元杂环基、或5或6元杂芳基,其各自被0、1、2、3或4个r
10
基团取代;并且其中:
[0723]-r8和r9各自独立地选自氢、卤素、c
1-c6卤代烷基、c
1-c6烷基、c
2-c6烯基、c
2-c6炔基、羟基、c
1-c6烷氧基、c
1-c6卤代烷氧基、co2h、c(o)n(r
x
)(ry)、苯基、3至8元环烷基、5至6元杂芳基和5至6元杂环基,其各自被0、1、2、3、4或5个r
10
基团取代;
[0724]-每个r
10
独立地选自卤素、羟基氰基、c
1-c6烷基、c
2-c6烯基、c
2-c6炔基、-(c
1-c6烷基)-o(c
1-c6烷基)、-(c
1-c6烷基)-co2(c
1-c6烷基)、-(c
1-c6烷基)-n(r
x
)(ry)、-(c
1-c6烷基)-co2h、c
1-c6烷氧基、-n(r
x
)(ry)、-co-n(r
x
)(ry)、co2h、-co2(c
1-c6烷基)、-co2bn、-co(c
1-c6烷基)、苯基、5至6元杂芳基、4至6元杂环基和c
3-c
10
环烷基,其各自任选独立地被一个或多个选自以下的基团取代:卤素、氰基、c
1-c6烷基、卤代烷基、羟基、c
1-c6烷氧基、c
1-c6卤代烷氧基和-co2(c
1-c6烷基),
[0725]
或同一碳上的r8和r9一起形成氧代基;
[0726]-每个rb独立地选自氢、卤素、c
1-c6卤代烷基、c
1-c6烷基、c
2-c6烯基、c
2-c6炔基、羟基、c
1-c6烷氧基、c
1-c6卤代烷氧基、-co2h、-c(o)n(r
x
)(ry)、苯基、3至8元环烷基、5至6元杂芳基和5至6元杂环基,其各自被0、1、2、3、4或5个r
10
基团取代,并且任选地一个r1和一个rb连同其所连接的原子一起形成5至6元杂环烷基、或5至6元杂芳基环,其各自被0、1、2、3或4个r
10
基团取代;并且
[0727]-每个r
x
和ry独立地选自氢、c
1-c6烷基、c
1-c6卤代烷基、c
4-c9杂环基、3至6元环烷基、5至6元杂芳基、苄基、-co2(c
1-c6烷基)、-co(c
1-c6烷基),其中所述c
1-c6烷基任选地被-nme2取代,并且其中所述c
4-c9杂环基任选地被-(c
1-c6烷基)-o(c
1-c6烷基)或-co2(c
1-c6烷基)取代。
[0728]
9.如实施方案1所述的化合物,其中所述式(ii)的化合物是式(ii-bvi)化合物:
[0729][0730]
其互变异构体、所述化合物或所述互变异构体的氘化衍生物、或前述任一者的药学上可接受的盐,其中:
[0731]-每个r1独立地选自c
1-c6烷基、c
1-c6烷氧基、c
1-c6卤代烷基、c
1-c6卤代烷氧基、卤素、氰基和羟基,或两个r1基团连同其所连接的原子一起形成5至6元杂芳基或6元芳基环;
[0732]-m是0、1、2、3或4;
[0733]-每个r2独立地选自任选地被苯基或5元或6元杂芳基取代的c
1-c6烷基、c
1-c6烷氧基、c
1-c6卤代烷基、c
1-c6卤代烷氧基、卤素、氰基和羟基;
[0734]-r
11
选自氢、卤素、c
1-c6烷基、c
1-c6烷氧基、c
1-c6卤代烷基、c
1-c6卤代烷氧基、c
2-c6烯基、c
2-c6炔基、苄基、-o-(c
3-c6环烷基)和氰基,其各自被0、1、2或3个r
12
基团取代,或任选地一个r2和r
11
连同其所连接的原子一起形成5至6元环烷基、5至6元杂环基或6元芳基环,其被以下取代:苯基环、5元杂环基环、6元杂环基环、5元杂芳基环、6元杂芳基环、3至8元环烷基环、3至8元环烯基,或0、1、2、3或4个r2基团;
[0735]-每个r
12
独立地选自卤素、羟基、氰基、c
1-c6烷基、c
2-c6烯基、c
2-c6炔基、-(c
1-c6烷基)-o(c
1-c6烷基)、-(c
1-c6烷基)-co2(c
1-c6烷基)、-(c
1-c6烷基)-n(r
x
)(ry)、-(c
1-c6烷基)-co2h、c
1-c6烷氧基、-n(r
x
)(ry)、-co-n(r
x
)(ry)、co2h、-co2(c
1-c6烷基)、-co2bn、-co(c
1-c6烷基)、苯基、5至6元杂芳基、4至6元杂环基和c
3-c
10
环烷基,其各自任选独立地被一个或多个选自以下的基团取代:卤素、氰基、c
1-c6烷基、卤代烷基、羟基、c
1-c6烷氧基、c
1-c6卤代烷氧基和-co2(c
1-c6烷基),
[0736]-n是0、1或2;
[0737]-每个r3是被0、1、2、3、4、5或6个3至8元环烷基环或5元或6元芳基取代的c
1-c6烷基,或两个r3接合形成c
3-c6环烷基环;
[0738]-z是式(l)r的二价连接基团,其中:
[0739]-r是1、2、3、4、5或6;
[0740]-每个l独立地选自c(r8)(r9)基团、
–o–
和
–
nrb–
基团,其中z中的杂原子不键结到z中的另一个杂原子,并且其中是5或6元杂环基、或5或6元杂芳基,其各自被0、1、2、3或4个r
10
基团取代;并且其中:
[0741]-r8和r9各自独立地选自氢、卤素、c
1-c6卤代烷基、c
1-c6烷基、c
2-c6烯基、c
2-c6炔
基、羟基、c
1-c6烷氧基、c
1-c6卤代烷氧基、co2h、c(o)n(r
x
)(ry)、苯基、3至8元环烷基、5至6元杂芳基和5至6元杂环基,其各自被0、1、2、3、4或5个r
10
基团取代;
[0742]-每个r
10
独立地选自卤素、羟基氰基、c
1-c6烷基、c
2-c6烯基、c
2-c6炔基、-(c
1-c6烷基)-o(c
1-c6烷基)、-(c
1-c6烷基)-co2(c
1-c6烷基)、-(c
1-c6烷基)-n(r
x
)(ry)、-(c
1-c6烷基)-co2h、c
1-c6烷氧基、-n(r
x
)(ry)、-co-n(r
x
)(ry)、co2h、-co2(c
1-c6烷基)、-co2bn、-co(c
1-c6烷基)、苯基、5至6元杂芳基、4至6元杂环基和c
3-c
10
环烷基,其各自任选独立地被一个或多个选自以下的基团取代:卤素、氰基、c
1-c6烷基、卤代烷基、羟基、c
1-c6烷氧基、c
1-c6卤代烷氧基和-co2(c
1-c6烷基),
[0743]
或同一碳上的r8和r9一起形成氧代基;
[0744]-每个rb独立地选自氢、卤素、c
1-c6卤代烷基、c
1-c6烷基、c
2-c6烯基、c
2-c6炔基、羟基、c
1-c6烷氧基、c
1-c6卤代烷氧基、-co2h、-c(o)n(r
x
)(ry)、苯基、3至8元环烷基、5至6元杂芳基和5至6元杂环基,其各自被0、1、2、3、4或5个r
10
基团取代,并且任选地一个r1和一个rb连同其所连接的原子一起形成5至6元杂环烷基、或5至6元杂芳基环,其各自被0、1、2、3或4个r
10
基团取代;并且
[0745]-每个r
x
和ry独立地选自氢、c
1-c6烷基、c
1-c6卤代烷基、c
4-c9杂环基、3至6元环烷基、5至6元杂芳基、苄基、-co2(c
1-c6烷基)、-co(c
1-c6烷基),其中所述c
1-c6烷基任选地被-nme2取代,并且其中所述c
4-c9杂环基任选地被-(c
1-c6烷基)-o(c
1-c6烷基)或-co2(c
1-c6烷基)取代。
[0746]
10.如实施方案2所述的化合物,其中所述式(ii)的化合物是式(ii-ci)、(ii-cii)、(ii-ciii)或(ii-civ)的化合物:
[0747][0748][0749]
其互变异构体、所述化合物或所述互变异构体的氘化衍生物、或前述任一者的药学上可接受的盐,其中:
[0750]-每个r1独立地选自c
1-c6烷基、c
1-c6烷氧基、c
1-c6卤代烷基、c
1-c6卤代烷氧基、卤素、氰基和羟基,或两个r1基团连同其所连接的原子一起形成5至6元杂芳基或6元芳基环;
[0751]-m是0、1、2、3或4;
[0752]-每个r2独立地选自任选地被苯基或5元或6元杂芳基取代的c
1-c6烷基、c
1-c6烷氧
基、c
1-c6卤代烷基、c
1-c6卤代烷氧基、卤素、氰基和羟基;
[0753]-r
11
选自氢、卤素、c
1-c6烷基、c
1-c6烷氧基、c
1-c6卤代烷基、c
1-c6卤代烷氧基、c
2-c6烯基、c
2-c6炔基、苄基、-o-(c
3-c6环烷基)和氰基,其各自被0、1、2或3个r
12
基团取代,或任选地一个r2和r
11
连同其所连接的原子一起形成5至6元环烷基、5至6元杂环基或6元芳基环,其被以下取代:苯基环、5元杂环基环、6元杂环基环、5元杂芳基环、6元杂芳基环、3至8元环烷基环、3至8元环烯基,或0、1、2、3或4个r2基团;
[0754]-每个r
12
独立地选自卤素、羟基、氰基、c
1-c6烷基、c
2-c6烯基、c
2-c6炔基、-(c
1-c6烷基)-o(c
1-c6烷基)、-(c
1-c6烷基)-co2(c
1-c6烷基)、-(c
1-c6烷基)-n(r
x
)(ry)、-(c
1-c6烷基)-co2h、c
1-c6烷氧基、-n(r
x
)(ry)、-co-n(r
x
)(ry)、co2h、-co2(c
1-c6烷基)、-co2bn、-co(c
1-c6烷基)、苯基、5至6元杂芳基、4至6元杂环基和c
3-c
10
环烷基,其各自任选独立地被一个或多个选自以下的基团取代:卤素、氰基、c
1-c6烷基、卤代烷基、羟基、c
1-c6烷氧基、c
1-c6卤代烷氧基和-co2(c
1-c6烷基),
[0755]-n是0、1或2;
[0756]-每个r3是被0、1、2、3、4、5或6个3至8元环烷基环或5元或6元芳基取代的c
1-c6烷基,或两个r3接合形成c
3-c6环烷基环;
[0757]-r是1、2、3、4、5或6;
[0758]-r8和r9各自独立地选自氢、卤素、c
1-c6卤代烷基、c
1-c6烷基、c
2-c6烯基、c
2-c6炔基、羟基、c
1-c6烷氧基、c
1-c6卤代烷氧基、co2h、c(o)n(r
x
)(ry)、苯基、3至8元环烷基、5至6元杂芳基和5至6元杂环基,其各自被0、1、2、3、4或5个r
10
基团取代;
[0759]-每个r
10
独立地选自卤素、羟基氰基、c
1-c6烷基、c
2-c6烯基、c
2-c6炔基、-(c
1-c6烷基)-o(c
1-c6烷基)、-(c
1-c6烷基)-co2(c
1-c6烷基)、-(c
1-c6烷基)-n(r
x
)(ry)、-(c
1-c6烷基)-co2h、c
1-c6烷氧基、-n(r
x
)(ry)、-co-n(r
x
)(ry)、co2h、-co2(c
1-c6烷基)、-co2bn、-co(c
1-c6烷基)、苯基、5至6元杂芳基、4至6元杂环基和c
3-c
10
环烷基,其各自任选独立地被一个或多个选自以下的基团取代:卤素、氰基、c
1-c6烷基、卤代烷基、羟基、c
1-c6烷氧基、c
1-c6卤代烷氧基和-co2(c
1-c6烷基),
[0760]
或同一碳上的r8和r9一起形成氧代基;
[0761]-每个rb独立地选自氢、卤素、c
1-c6卤代烷基、c
1-c6烷基、c
2-c6烯基、c
2-c6炔基、羟基、c
1-c6烷氧基、c
1-c6卤代烷氧基、-co2h、-c(o)n(r
x
)(ry)、苯基、3至8元环烷基、5至6元杂芳基和5至6元杂环基,其各自被0、1、2、3、4或5个r
10
基团取代,并且任选地一个r1和一个rb连同其所连接的原子一起形成5至6元杂环烷基、或5至6元杂芳基环,其各自被0、1、2、3或4个r
10
基团取代;并且
[0762]-每个r
x
和ry独立地选自氢、c
1-c6烷基、c
1-c6卤代烷基、c
4-c9杂环基、3至6元环烷基、5至6元杂芳基、苄基、-co2(c
1-c6烷基)、-co(c
1-c6烷基),其中所述c
1-c6烷基任选地被-nme2取代,并且其中所述c
4-c9杂环基任选地被-(c
1-c6烷基)-o(c
1-c6烷基)或-co2(c
1-c6烷基)取代。
[0763]
11.如实施方案2所述的化合物,其中所述式(ii)的化合物是式(ii-cv)的化合物:
[0764][0765]
其互变异构体、所述化合物或所述互变异构体的氘化衍生物、或前述任一者的药学上可接受的盐,其中:
[0766]-由*表示的碳具有s-立体化学或r-立体化学;
[0767]-每个r1独立地选自c
1-c6烷基、c
1-c6烷氧基、c
1-c6卤代烷基、c
1-c6卤代烷氧基、卤素、氰基和羟基,或两个r1基团连同其所连接的原子一起形成5至6元杂芳基或6元芳基环;
[0768]-m是0、1、2、3或4;
[0769]-每个r2独立地选自任选地被苯基或5元或6元杂芳基取代的c
1-c6烷基、c
1-c6烷氧基、c
1-c6卤代烷基、c
1-c6卤代烷氧基、卤素、氰基和羟基;
[0770]-r
11
选自氢、卤素、c
1-c6烷基、c
1-c6烷氧基、c
1-c6卤代烷基、c
1-c6卤代烷氧基、c
2-c6烯基、c
2-c6炔基、苄基、-o-(c
3-c6环烷基)和氰基,其各自被0、1、2或3个r
12
基团取代,或任选地一个r2和r
11
连同其所连接的原子一起形成5至6元环烷基、5至6元杂环基或6元芳基环,其被以下取代:苯基环、5元杂环基环、6元杂环基环、5元杂芳基环、6元杂芳基环、3至8元环烷基环、3至8元环烯基,或0、1、2、3或4个r2基团;
[0771]-每个r
12
独立地选自卤素、羟基、氰基、c
1-c6烷基、c
2-c6烯基、c
2-c6炔基、-(c
1-c6烷基)-o(c
1-c6烷基)、-(c
1-c6烷基)-co2(c
1-c6烷基)、-(c
1-c6烷基)-n(r
x
)(ry)、-(c
1-c6烷基)-co2h、c
1-c6烷氧基、-n(r
x
)(ry)、-co-n(r
x
)(ry)、co2h、-co2(c
1-c6烷基)、-co2bn、-co(c
1-c6烷基)、苯基、5至6元杂芳基、4至6元杂环基和c
3-c
10
环烷基,其各自任选独立地被一个或多个选自以下的基团取代:卤素、氰基、c
1-c6烷基、卤代烷基、羟基、c
1-c6烷氧基、c
1-c6卤代烷氧基和-co2(c
1-c6烷基),
[0772]-n是0、1或2;
[0773]-每个r3是被0、1、2、3、4、5或6个3至8元环烷基环或5元或6元芳基取代的c
1-c6烷基,或两个r3接合形成c
3-c6环烷基环;
[0774]-r是1、2、3、4、5或6;
[0775]-r8和r9各自独立地选自氢、卤素、c
1-c6卤代烷基、c
1-c6烷基、c
2-c6烯基、c
2-c6炔基、羟基、c
1-c6烷氧基、c
1-c6卤代烷氧基、co2h、c(o)n(r
x
)(ry)、苯基、3至8元环烷基、5至6元杂芳基和5至6元杂环基,其各自被0、1、2、3、4或5个r
10
基团取代;
[0776]-每个r
10
独立地选自卤素、羟基氰基、c
1-c6烷基、c
2-c6烯基、c
2-c6炔基、-(c
1-c6烷基)-o(c
1-c6烷基)、-(c
1-c6烷基)-co2(c
1-c6烷基)、-(c
1-c6烷基)-n(r
x
)(ry)、-(c
1-c6烷基)-co2h、c
1-c6烷氧基、-n(r
x
)(ry)、-co-n(r
x
)(ry)、co2h、-co2(c
1-c6烷基)、-co2bn、-co(c
1-c6烷基)、苯基、5至6元杂芳基、4至6元杂环基和c
3-c
10
环烷基,其各自任选独立地被一个或多个选自以下的基团取代:卤素、氰基、c
1-c6烷基、卤代烷基、羟基、c
1-c6烷氧基、c
1-c6卤代烷氧
基和-co2(c
1-c6烷基),
[0777]
或同一碳上的r8和r9一起形成氧代基;
[0778]-每个rb独立地选自氢、卤素、c
1-c6卤代烷基、c
1-c6烷基、c
2-c6烯基、c
2-c6炔基、羟基、c
1-c6烷氧基、c
1-c6卤代烷氧基、-co2h、-c(o)n(r
x
)(ry)、苯基、3至8元环烷基、5至6元杂芳基和5至6元杂环基,其各自被0、1、2、3、4或5个r
10
基团取代,并且任选地一个r1和一个rb连同其所连接的原子一起形成5至6元杂环烷基、或5至6元杂芳基环,其各自被0、1、2、3或4个r
10
基团取代;并且
[0779]-每个r
x
和ry独立地选自氢、c
1-c6烷基、c
1-c6卤代烷基、c
4-c9杂环基、3至6元环烷基、5至6元杂芳基、苄基、-co2(c
1-c6烷基)、-co(c
1-c6烷基),其中所述c
1-c6烷基任选地被-nme2取代,并且其中所述c
4-c9杂环基任选地被-(c
1-c6烷基)-o(c
1-c6烷基)或-co2(c
1-c6烷基)取代。
[0780]
12.如实施方案2所述的化合物,其中所述式(ii)的化合物是式(ii-cvi)的化合物:
[0781][0782]
其互变异构体、所述化合物或所述互变异构体的氘化衍生物、或前述任一者的药学上可接受的盐,其中:
[0783]-每个r1独立地选自c
1-c6烷基、c
1-c6烷氧基、c
1-c6卤代烷基、c
1-c6卤代烷氧基、卤素、氰基和羟基,或两个r1基团连同其所连接的原子一起形成5至6元杂芳基或6元芳基环;
[0784]-m是0、1、2、3或4;
[0785]-每个r2独立地选自任选地被苯基或5元或6元杂芳基取代的c
1-c6烷基、c
1-c6烷氧基、c
1-c6卤代烷基、c
1-c6卤代烷氧基、卤素、氰基和羟基;
[0786]-r
11
选自氢、卤素、c
1-c6烷基、c
1-c6烷氧基、c
1-c6卤代烷基、c
1-c6卤代烷氧基、c
2-c6烯基、c
2-c6炔基、苄基、-o-(c
3-c6环烷基)和氰基,其各自被0、1、2或3个r
12
基团取代,或任选地一个r2和r
11
连同其所连接的原子一起形成5至6元环烷基、5至6元杂环基或6元芳基环,其被以下取代:苯基环、5元杂环基环、6元杂环基环、5元杂芳基环、6元杂芳基环、3至8元环烷基环、3至8元环烯基,或0、1、2、3或4个r2基团;
[0787]-每个r
12
独立地选自卤素、羟基、氰基、c
1-c6烷基、c
2-c6烯基、c
2-c6炔基、-(c
1-c6烷基)-o(c
1-c6烷基)、-(c
1-c6烷基)-co2(c
1-c6烷基)、-(c
1-c6烷基)-n(r
x
)(ry)、-(c
1-c6烷基)-co2h、c
1-c6烷氧基、-n(r
x
)(ry)、-co-n(r
x
)(ry)、co2h、-co2(c
1-c6烷基)、-co2bn、-co(c
1-c6烷基)、苯基、5至6元杂芳基、4至6元杂环基和c
3-c
10
环烷基,其各自任选独立地被一个或多个选自以下的基团取代:卤素、氰基、c
1-c6烷基、卤代烷基、羟基、c
1-c6烷氧基、c
1-c6卤代烷氧基和-co2(c
1-c6烷基),
[0788]-n是0、1或2;
[0789]-每个r3是被0、1、2、3、4、5或6个3至8元环烷基环或5元或6元芳基取代的c
1-c6烷基,或两个r3接合形成c
3-c6环烷基环;
[0790]-r是1、2、3、4、5或6;
[0791]-r8和r9各自独立地选自氢、卤素、c
1-c6卤代烷基、c
1-c6烷基、c
2-c6烯基、c
2-c6炔基、羟基、c
1-c6烷氧基、c
1-c6卤代烷氧基、co2h、c(o)n(r
x
)(ry)、苯基、3至8元环烷基、5至6元杂芳基和5至6元杂环基,其各自被0、1、2、3、4或5个r
10
基团取代;
[0792]-每个r
10
独立地选自卤素、羟基氰基、c
1-c6烷基、c
2-c6烯基、c
2-c6炔基、-(c
1-c6烷基)-o(c
1-c6烷基)、-(c
1-c6烷基)-co2(c
1-c6烷基)、-(c
1-c6烷基)-n(r
x
)(ry)、-(c
1-c6烷基)-co2h、c
1-c6烷氧基、-n(r
x
)(ry)、-co-n(r
x
)(ry)、co2h、-co2(c
1-c6烷基)、-co2bn、-co(c
1-c6烷基)、苯基、5至6元杂芳基、4至6元杂环基和c
3-c
10
环烷基,其各自任选独立地被一个或多个选自以下的基团取代:卤素、氰基、c
1-c6烷基、卤代烷基、羟基、c
1-c6烷氧基、c
1-c6卤代烷氧基和-co2(c
1-c6烷基),
[0793]
或同一碳上的r8和r9一起形成氧代基;
[0794]-每个rb独立地选自氢、卤素、c
1-c6卤代烷基、c
1-c6烷基、c
2-c6烯基、c
2-c6炔基、羟基、c
1-c6烷氧基、c
1-c6卤代烷氧基、-co2h、-c(o)n(r
x
)(ry)、苯基、3至8元环烷基、5至6元杂芳基和5至6元杂环基,其各自被0、1、2、3、4或5个r
10
基团取代,并且任选地一个r1和一个rb连同其所连接的原子一起形成5至6元杂环烷基、或5至6元杂芳基环,其各自被0、1、2、3或4个r
10
基团取代;并且
[0795]-每个r
x
和ry独立地选自氢、c
1-c6烷基、c
1-c6卤代烷基、c
4-c9杂环基、3至6元环烷基、5至6元杂芳基、苄基、-co2(c
1-c6烷基)、-co(c
1-c6烷基),其中所述c
1-c6烷基任选地被-nme2取代,并且其中所述c
4-c9杂环基任选地被-(c
1-c6烷基)-o(c
1-c6烷基)或-co2(c
1-c6烷基)取代。
[0796]
13.如实施方案2或3所述的化合物、盐或氘化衍生物,其中x是o。
[0797]
14.如实施方案2至6中任一项所述的化合物、互变异构体、氘化衍生物或药学上可接受的盐,其中环a选自苯基、吡啶、吡嗪和吡唑。
[0798]
15.如实施方案2至7中任一项所述的化合物、互变异构体、氘化衍生物或药学上可接受的盐,其中:
[0799]-环a是苯基;并且
[0800]-一个r1和一个rb连同其所连接的原子一起形成吡咯或吡啶。
[0801]
16.如实施方案2或4所述的化合物、互变异构体、氘化衍生物或药学上可接受的盐,其中环b是吡啶基环。
[0802]
17.如实施方案2至12中任一项所述的化合物、互变异构体、氘化衍生物或药学上可接受的盐,其中r1选自氢和羟基。
[0803]
18.如实施方案2至12中任一项所述的化合物、互变异构体、氘化衍生物或药学上可接受的盐,其中r3是被苯基取代的c1-c6烷基。
[0804]
19.如实施方案2至12中任一项所述的化合物、互变异构体、氘化衍生物或药学上可接受的盐,其中r3是苄基。
[0805]
20.如实施方案2至12中任一项所述的化合物、互变异构体、氘化衍生物或药学上
可接受的盐,其中rb选自h、ch3、苯基和异丁基。
[0806]
21.如实施方案2至12中任一项所述的化合物、互变异构体、氘化衍生物或药学上可接受的盐,其中每个c(r8)(r9)基团独立地选自-ch
2-、-co-、、
[0807]
[0808]
[0809]
[0810][0811]
22.如实施方案2至9中任一项所述的化合物、互变异构体、氘化衍生物或药学上可接受的盐,其中是
[0812]
23.如实施方案2至12中任一项所述的化合物、互变异构体、氘化衍生物或药学上可接受的盐,其中r
11
选自氢、卤素、氰基、和t-bu。
[0813]
24.如实施方案2至12中任一项所述的化合物、互变异构体、氘化衍生物或药学上可接受的盐,其中r
11
是t-bu。
[0814]
25.如实施方案2至12中任一项所述的化合物、互变异构体、氘化衍生物或药学上可接受的盐,其中:
[0815]-一个r2和r
11
连同其所连接的原子一起形成苯基、四氢吡喃或环己基环,所述环己
基环被以下取代:苯基环、5元杂环基环、6元杂环基环、5元杂芳基环、6元杂芳基环、3至8元环烷基环、3至8元环烯基,或0、1、2、3或4个r2基团;并且
[0816]-每个r2独立地选自c
1-c6烷基、c
1-c6烷氧基、c
1-c6卤代烷基、c
1-c6卤代烷氧基、卤素、氰基和羟基。
[0817]
26.一种选自化合物1-298(表3a)、其互变异构体、所述化合物和互变异构体的氘化衍生物以及前述任一者的药学上可接受的盐的化合物。
[0818]
27.一种药物组合物,其包含如实施方案1至26中任一项所述的化合物、互变异构体、氘化衍生物或药学上可接受的盐以及药学上可接受的载体。
[0819]
28.如实施方案27所述的药物组合物,其还包含一种或多种另外的治疗剂。
[0820]
29.如实施方案28所述的药物组合物,其中所述一种或多种另外的治疗剂选自替扎卡托、依伐卡托、d-依伐卡托、鲁玛卡托和其药学上可接受的盐。
[0821]
30.如实施方案29所述的药物组合物,其中所述组合物包含替扎卡托和依伐卡托。
[0822]
31.如实施方案29所述的药物组合物,其中所述组合物包含替扎卡托和d-依伐卡托。
[0823]
32.一种药物组合物,其包含:
[0824]
(a)至少一种如实施方案1至26中任一项所述的化合物、互变异构体、氘化衍生物或药学上可接受的盐;
[0825]
(b)至少一种药学上可接受的载体;以及
[0826]
任选地,以下中的一种或多种:
[0827]
(c)(i)选自替扎卡托:
[0828][0829]
和其药学上可接受的盐和氘化衍生物的化合物;以及
[0830]
(ii)选自依伐卡托d-依伐卡托和其药学上可接受的盐和氘化衍生物的化合物。
[0831]
33.一种治疗囊性纤维化的方法,其包括向有需要的患者施用如实施方案1至26中任一项所述的化合物、互变异构体、氘化衍生物或药学上可接受的盐或如实施方案27至32中任一项所述的药物组合物。
[0832]
34.如实施方案33所述的方法,其还包括在所述化合物或所述药物组合物之前、与其同时或在其之后向所述患者施用一种或多种另外的治疗剂。
[0833]
35.如实施方案33所述的方法,其中所述一种或多种另外的治疗剂包含选自以下的化合物:替扎卡托、依伐卡托、d-依伐夫托、鲁玛卡托和其药学上可接受的盐。
[0834]
36.如实施方案35所述的方法,其中所述一种或多种另外的治疗剂包含替扎卡托
和依伐卡托。
[0835]
37.如实施方案35所述的方法,其中所述一种或多种另外的治疗剂包含替扎卡托和d-依伐卡托。
[0836]
38.如实施方案1至26中任一项所述的化合物、盐或氘化衍生物或如实施方案27至32中任一项所述的药物组合物,其用于治疗囊性纤维化。
[0837]
39.如实施方案1至26中任一项所述的化合物、互变异构体、氘化衍生物或药学上可接受的盐或如实施方案27至32中任一项所述的药物组合物,其用于制造用于治疗囊性纤维化的药物。
[0838]
40.如实施方案1所述的化合物,其中所述式(i)的化合物是式(iii)的化合物:
[0839][0840]
其互变异构体、所述化合物或所述互变异构体的氘化衍生物、或前述任一者的药学上可接受的盐,
[0841]
其中:
[0842]-环a是苯基、吲哚、5元杂芳基环或6元杂芳基环;
[0843]-环b是苯基、吡啶基或嘧啶基环;
[0844]-环d是苯基环、5元杂环基环、6元杂环基环、5元杂芳基环、6元杂芳基环、3至8元环烷基环或3至8元环烯基;
[0845]-x是o、nh或n(c
1-c6烷基);
[0846]-每个r1独立地选自c
1-c6烷基、c
1-c6烷氧基、c
1-c6卤代烷基、c
1-c6卤代烷氧基、卤素、氰基和羟基,或两个r1基团连同其所连接的原子一起形成5至6元杂芳基或6元芳基环;
[0847]-m是0、1、2、3或4;
[0848]-每个r2独立地选自视情况被苯基或5元或6元杂芳基取代的c
1-c6烷基、c
1-c6烷氧基、c
1-c6卤代烷基、c
1-c6卤代烷氧基、卤素、氰基和羟基,或任选地两个r2连同其所连接的原子一起形成苯基或6元杂芳基环,其任选独立地被一个或多个选自以下的基团取代:卤素、c
1-c6烷基、卤代烷基、羟基、c
1-c6烷氧基和c
1-c6卤代烷氧基;
[0849]-n是0、1或2;
[0850]-每个r3是被0、1、2、3、4、5或6个3至8元环烷基环或5元或6元芳基取代的c
1-c6烷基,或两个r3接合形成c
3-c6环烷基环;
[0851]-每个r4独立地选自卤素、氧代基、羟基、氰基和-(y)
k-r7基团,或任选地两个r4连同其所连接的原子一起形成5至6元环烷基或杂环基环,其任选独立地被一个或多个选自以下的基团取代:卤素、c
1-c6烷基、卤代烷基、羟基、c
1-c6烷氧基和c
1-c6卤代烷氧基;其中:
[0852]-k是0、1、2、3、4、5或6;
[0853]-每个y独立地选自c(r5)(r6)基团、
–o–
和
–
nra–
基团,其中-(y)
k-r7中的杂原子不键
结至-(y)
k-r7中的另一个杂原子,其中:
[0854]-每个r5和r6独立地选自氢、卤素、羟基、c
1-c6烷基和c
3-5
环烷基,或同一碳上的r5和r6一起形成c
3-5
环烷基或氧代基;
[0855]-r5和r6各自任选独立地被一个或多个选自以下的基团取代:c
1-c6烷基、c
1-c6卤代烷基、卤素、羟基、c
1-c6烷氧基和c
1-c6卤代烷氧基;并且
[0856]-每个ra独立地选自氢和c
1-c6烷基;并且
[0857]-r7选自氢、卤素、氰基和任选地被一个或多个选自以下的基团取代的c
3-c
10
环烷基:c
1-c6烷基、c
1-c6卤代烷基和卤素;
[0858]-q是1、2、3或4;并且
[0859]-z是式(l)r的二价连接基团,其中:
[0860]-r是1、2、3、4、5或6;
[0861]-每个l独立地选自c(r8)(r9)基团、
–o–
和
–
nrb–
基团,其中z中的杂原子不键结到z中的另一个杂原子,并且其中是5或6元杂环基、或5或6元杂芳基,其各自被0、1、2、3或4个r
10
基团取代;并且其中:
[0862]-r8和r9各自独立地选自氢、卤素、c
1-c6卤代烷基、c
1-c6烷基、c
2-c6烯基、c
2-c6炔基、羟基、c
1-c6烷氧基、c
1-c6卤代烷氧基、co2h、c(o)n(r
x
)(ry)、苯基、3至8元环烷基、5至6元杂芳基和5至6元杂环基,其各自被0、1、2、3、4或5个r
10
基团取代;
[0863]-每个r
10
独立地选自卤素、羟基、氰基、c
1-c6烷基、c
2-c6烯基、c
2-c6炔基、-(c
1-c6烷基)-o(c
1-c6烷基)、-(c
1-c6烷基)-co2(c
1-c6烷基)、-(c
1-c6烷基)-n(r
x
)(ry)、-(c
1-c6烷基)-co2h、c
1-c6烷氧基、-n(r
x
)(ry)、-co-n(r
x
)(ry)、co2h、-co2(c
1-c6烷基)、-co2bn、-co(c
1-c6烷基)、苯基、5至6元杂芳基、4至6元杂环基和c
3-c
10
环烷基,其各自任选独立地被一个或多个选自以下的基团取代:卤素、氰基、c
1-c6烷基、卤代烷基、羟基、c
1-c6烷氧基、c
1-c6卤代烷氧基和-co2(c
1-c6烷基),
[0864]
或同一碳上的r8和r9一起形成氧代基;并且
[0865]-每个rb独立地选自氢、苯基和c
1-c6烷基,其中所述c
1-c6烷基任选独立地被一个或多个选自以下的基团取代:羟基、-c(o)n(r
x
)(ry)、氰基、4至6元杂环基、视情况被c
1-c6烷基取代的5元杂芳基;
[0866]-每个r
x
和ry独立地选自氢、c
1-c6烷基、c
1-c6卤代烷基、c
4-c9杂环基、3至6元环烷基、5至6元杂芳基、苄基、-co2(c
1-c6烷基)、-co(c
1-c6烷基),其中所述c
1-c6烷基任选地被-nme2取代,并且其中所述c
4-c9杂环基任选地被-(c
1-c6烷基)-o(c
1-c6烷基)或-co2(c
1-c6烷基)取代;
[0867]
条件是r8和r9中的至少一者独立地选自c
3-c6卤代烷基、c
3-c6烷基、c
2-c6烯基、c
2-c6炔基、c
3-c6烷氧基、c
3-c6卤代烷氧基、苯基、5至6元杂芳基和5至6元杂环基,或至少一个r3是被0、1、2、3、4、5或6个3至8元环烷基环或5元或6元芳基取代的c
2-c6烷基,或被1、2、3、4、5或6个3至8元环烷基环或5元或6元芳基取代的c1烷基,或两个r3接合形成c
3-c6环烷基环。
[0868]
41.如实施方案40所述的化合物,其中所述式(iii)的化合物是式(iii-ai)、(iii-aii)或(iii-aiii)的化合物:
[0869][0870][0871]
其互变异构体、所述化合物或所述互变异构体的氘化衍生物、或前述任一者的药学上可接受的盐,其中:
[0872]-环a是苯基、吲哚、5元杂芳基环或6元杂芳基环;
[0873]-环d是苯基环、5元杂环基环、6元杂环基环、5元杂芳基环、6元杂芳基环、3至8元环烷基环或3至8元环烯基;
[0874]-x是o、nh或n(c
1-c6烷基);
[0875]-每个r1独立地选自c
1-c6烷基、c
1-c6烷氧基、c
1-c6卤代烷基、c
1-c6卤代烷氧基、卤素、氰基和羟基,或两个r1基团连同其所连接的原子一起形成5至6元杂芳基或6元芳基环;
[0876]-m是0、1、2、3或4;
[0877]-每个r2独立地选自视情况被苯基或5元或6元杂芳基取代的c
1-c6烷基、c
1-c6烷氧基、c
1-c6卤代烷基、c
1-c6卤代烷氧基、卤素、氰基和羟基,或任选地两个r2连同其所连接的原子一起形成苯基或6元杂芳基环,其任选独立地被一个或多个选自以下的基团取代:卤素、c
1-c6烷基、卤代烷基、羟基、c
1-c6烷氧基和c
1-c6卤代烷氧基;
[0878]-n是0、1或2;
[0879]-每个r3是被0、1、2、3、4、5或6个3至8元环烷基环或5元或6元芳基取代的c
1-c6烷基,或两个r3接合形成c
3-c6环烷基环;
c6炔基、c
3-c6烷氧基、c
3-c6卤代烷氧基、苯基、5至6元杂芳基和5至6元杂环基,或至少一个r3是被0、1、2、3、4、5或6个3至8元环烷基环或5元或6元芳基取代的c
2-c6烷基,或被1、2、3、4、5或6个3至8元环烷基环或5元或6元芳基取代的c1烷基,或两个r3接合形成c
3-c6环烷基环。
[0897]
42.如实施方案40所述的化合物,其中所述式(iii)的化合物是式(iii-aiv)、(iii-av)或(iii-avi)的化合物:
[0898][0899]
其互变异构体、所述化合物或所述互变异构体的氘化衍生物、或前述任一者的药学上可接受的盐,其中:
[0900]-由*表示的碳具有s-立体化学或r-立体化学;
[0901]-环a是苯基、吲哚、5元杂芳基环或6元杂芳基环;
[0902]-环d是苯基环、5元杂环基环、6元杂环基环、5元杂芳基环、6元杂芳基环、3至8元环烷基环或3至8元环烯基;
[0903]-每个r1独立地选自c
1-c6烷基、c
1-c6烷氧基、c
1-c6卤代烷基、c
1-c6卤代烷氧基、卤素、氰基和羟基,或两个r1基团连同其所连接的原子一起形成5至6元杂芳基或6元芳基环;
[0904]-m是0、1、2、3或4;
[0905]-每个r2独立地选自视情况被苯基或5元或6元杂芳基取代的c
1-c6烷基、c
1-c6烷氧基、c
1-c6卤代烷基、c
1-c6卤代烷氧基、卤素、氰基和羟基,或任选地两个r2连同其所连接的原子一起形成苯基或6元杂芳基环,其任选独立地被一个或多个选自以下的基团取代:卤素、c
1-c6烷基、卤代烷基、羟基、c
1-c6烷氧基和c
1-c6卤代烷氧基;
[0906]-n是0、1或2;
[0907]-每个r3是被0、1、2、3、4、5或6个3至8元环烷基环或5元或6元芳基取代的c
1-c6烷基,或两个r3接合形成c
3-c6环烷基环;
[0908]-每个r4独立地选自卤素、氧代基、羟基、氰基和-(y)
k-r7基团,或任选地两个r4连同其所连接的原子一起形成5至6元环烷基或杂环基环,其任选独立地被一个或多个选自以下的基团取代:卤素、c
1-c6烷基、卤代烷基、羟基、c
1-c6烷氧基和c
1-c6卤代烷氧基;其中:
[0909]-k是0、1、2、3、4、5或6;
[0910]-每个y独立地选自c(r5)(r6)基团、
–o–
和
–
nra–
基团,其中-(y)
k-r7中的杂原子不键结至-(y)
k-r7中的另一个杂原子,其中:
[0911]-每个r5和r6独立地选自氢、卤素、羟基、c
1-c6烷基和c
3-5
环烷基,或同一碳上的r5和r6一起形成c
3-5
环烷基或氧代基;
[0912]-r5和r6各自任选独立地被一个或多个选自以下的基团取代:c
1-c6烷基、c
1-c6卤代烷基、卤素、羟基、c
1-c6烷氧基和c
1-c6卤代烷氧基;并且
[0913]-每个ra独立地选自氢和c
1-c6烷基;并且
[0914]-r7选自氢、卤素、氰基和任选地被一个或多个选自以下的基团取代的c
3-c
10
环烷基:c
1-c6烷基、c
1-c6卤代烷基和卤素;
[0915]-q是1、2、3或4;并且
[0916]-z是式(l)r的二价连接基团,其中:
[0917]-r是1、2、3、4、5或6;
[0918]-每个l独立地选自c(r8)(r9)基团、
–o–
和
–
nrb–
基团,其中z中的杂原子不键结到z中的另一个杂原子,并且其中是5或6元杂环基、或5或6元杂芳基,其各自被0、1、2、3或4个r
10
基团取代;并且其中:
[0919]-r8和r9各自独立地选自氢、卤素、c
1-c6卤代烷基、c
1-c6烷基、c
2-c6烯基、c
2-c6炔基、羟基、c
1-c6烷氧基、c
1-c6卤代烷氧基、co2h、c(o)n(r
x
)(ry)、苯基、3至8元环烷基、5至6元杂芳基和5至6元杂环基,其各自被0、1、2、3、4或5个r
10
基团取代;
[0920]
每个r
10
独立地选自卤素、羟基、氰基、c
1-c6烷基、c
2-c6烯基、c
2-c6炔基、-(c
1-c6烷基)-o(c
1-c6烷基)、-(c
1-c6烷基)-co2(c
1-c6烷基)、-(c
1-c6烷基)-n(r
x
)(ry)、-(c
1-c6烷基)-co2h、c
1-c6烷氧基、-n(r
x
)(ry)、-co-n(r
x
)(ry)、co2h、-co2(c
1-c6烷基)、-co2bn、-co(c
1-c6烷基)、苯基、5至6元杂芳基、4至6元杂环基和c
3-c
10
环烷基,其各自任选独立地被一个或多个选自以下的基团取代:卤素、氰基、c
1-c6烷基、卤代烷基、羟基、c
1-c6烷氧基、c
1-c6卤代烷氧基和-co2(c
1-c6烷基),
[0921]
或同一碳上的r8和r9一起形成氧代基;并且
[0922]-每个rb独立地选自氢、苯基和c
1-c6烷基,其中所述c
1-c6烷基任选独立地被一个或
多个选自以下的基团取代:羟基、-c(o)n(r
x
)(ry)、氰基、4至6元杂环基、视情况被c
1-c6烷基取代的5元杂芳基;
[0923]-每个r
x
和ry独立地选自氢、c
1-c6烷基、c
1-c6卤代烷基、c
4-c9杂环基、3至6元环烷基、5至6元杂芳基、苄基、-co2(c
1-c6烷基)、-co(c
1-c6烷基),其中所述c
1-c6烷基任选地被-nme2取代,并且其中所述c
4-c9杂环基任选地被-(c
1-c6烷基)-o(c
1-c6烷基)或-co2(c
1-c6烷基)取代;
[0924]
条件是r8和r9中的至少一者独立地选自c
3-c6卤代烷基、c
3-c6烷基、c
2-c6烯基、c
2-c6炔基、c
3-c6烷氧基、c
3-c6卤代烷氧基、苯基、5至6元杂芳基和5至6元杂环基,或至少一个r3是被0、1、2、3、4、5或6个3至8元环烷基环或5元或6元芳基取代的c
2-c6烷基,或被1、2、3、4、5或6个3至8元环烷基环或5元或6元芳基取代的c1烷基,或两个r3接合形成c
3-c6环烷基环。
[0925]
43.如实施方案40所述的化合物,其中所述式(iii)的化合物是式(iii-avii)或(iii-aviii)的化合物:
[0926][0927][0928]
其互变异构体、所述化合物或所述互变异构体的氘化衍生物、或前述任一者的药学上可接受的盐,其中:
[0929]-由*表示的碳具有s-立体化学或r-立体化学;
[0930]-环a是苯基、吲哚、5元杂芳基环或6元杂芳基环;
[0931]-每个r1独立地选自c
1-c6烷基、c
1-c6烷氧基、c
1-c6卤代烷基、c
1-c6卤代烷氧基、卤素、氰基和羟基,或两个r1基团连同其所连接的原子一起形成5至6元杂芳基或6元芳基环;
[0932]-m是0、1、2、3或4;
[0933]-每个r2独立地选自视情况被苯基或5元或6元杂芳基取代的c
1-c6烷基、c
1-c6烷氧基、c
1-c6卤代烷基、c
1-c6卤代烷氧基、卤素、氰基和羟基,或任选地两个r2连同其所连接的原子一起形成苯基或6元杂芳基环,其任选独立地被一个或多个选自以下的基团取代:卤素、c
1-c6烷基、卤代烷基、羟基、c
1-c6烷氧基和c
1-c6卤代烷氧基;
[0934]-n是0、1或2;
[0935]-每个r3是被0、1、2、3、4、5或6个3至8元环烷基环或5元或6元芳基取代的c
1-c6烷基,或两个r3接合形成c
3-c6环烷基环;
[0936]-每个r4独立地选自卤素、氧代基、羟基、氰基和-(y)
k-r7基团,或任选地两个r4连同其所连接的原子一起形成5至6元环烷基或杂环基环,其任选独立地被一个或多个选自以下的基团取代:卤素、c
1-c6烷基、卤代烷基、羟基、c
1-c6烷氧基和c
1-c6卤代烷氧基;其中:
[0937]-k是0、1、2、3、4、5或6;
[0938]-每个y独立地选自c(r5)(r6)基团、
–o–
和
–
nra–
基团,其中-(y)
k-r7中的杂原子不键结至-(y)
k-r7中的另一个杂原子,其中:
[0939]-每个r5和r6独立地选自氢、卤素、羟基、c
1-c6烷基和c
3-5
环烷基,或同一碳上的r5和r6一起形成c
3-5
环烷基或氧代基;
[0940]-r5和r6各自任选独立地被一个或多个选自以下的基团取代:c
1-c6烷基、c
1-c6卤代烷基、卤素、羟基、c
1-c6烷氧基和c
1-c6卤代烷氧基;并且
[0941]-每个ra独立地选自氢和c
1-c6烷基;并且
[0942]-r7选自氢、卤素、氰基和任选地被一个或多个选自以下的基团取代的c
3-c
10
环烷基:c
1-c6烷基、c
1-c6卤代烷基和卤素;
[0943]-q是1、2、3或4;并且
[0944]-z是式(l)r的二价连接基团,其中:
[0945]-r是1、2、3、4、5或6;
[0946]-每个l独立地选自c(r8)(r9)基团、
–o–
和
–
nrb–
基团,其中z中的杂原子不键结到z中的另一个杂原子,并且其中是5或6元杂环基、或5或6元杂芳基,其各自被0、1、2、3或4个r
10
基团取代;并且其中:
[0947]-r8和r9各自独立地选自氢、卤素、c
1-c6卤代烷基、c
1-c6烷基、c
2-c6烯基、c
2-c6炔基、羟基、c
1-c6烷氧基、c
1-c6卤代烷氧基、co2h、c(o)n(r
x
)(ry)、苯基、3至8元环烷基、5至6元杂芳基和5至6元杂环基,其各自被0、1、2、3、4或5个r
10
基团取代;
[0948]-每个r
10
独立地选自卤素、羟基、氰基、c
1-c6烷基、c
2-c6烯基、c
2-c6炔基、-(c
1-c6烷基)-o(c
1-c6烷基)、-(c
1-c6烷基)-co2(c
1-c6烷基)、-(c
1-c6烷基)-n(r
x
)(ry)、-(c
1-c6烷基)-co2h、c
1-c6烷氧基、-n(r
x
)(ry)、-co-n(r
x
)(ry)、co2h、-co2(c
1-c6烷基)、-co2bn、-co(c
1-c6烷基)、苯基、5至6元杂芳基、4至6元杂环基和c
3-c
10
环烷基,其各自任选独立地被一个或多个选自以下的基团取代:卤素、氰基、c
1-c6烷基、卤代烷基、羟基、c
1-c6烷氧基、c
1-c6卤代烷氧基和-co2(c
1-c6烷基),
[0949]
或同一碳上的r8和r9一起形成氧代基;并且
[0950]-每个rb独立地选自氢、苯基和c
1-c6烷基,其中所述c
1-c6烷基任选独立地被一个或多个选自以下的基团取代:羟基、-c(o)n(r
x
)(ry)、氰基、4至6元杂环基、视情况被c
1-c6烷基取代的5元杂芳基;
[0951]-每个r
x
和ry独立地选自氢、c
1-c6烷基、c
1-c6卤代烷基、c
4-c9杂环基、3至6元环烷基、5至6元杂芳基、苄基、-co2(c
1-c6烷基)、-co(c
1-c6烷基),其中所述c
1-c6烷基任选地被-nme2取代,并且其中所述c
4-c9杂环基任选地被-(c
1-c6烷基)-o(c
1-c6烷基)或-co2(c
1-c6烷
基)取代;
[0952]
条件是r8和r9中的至少一者独立地选自c
3-c6卤代烷基、c
3-c6烷基、c
2-c6烯基、c
2-c6炔基、c
3-c6烷氧基、c
3-c6卤代烷氧基、苯基、5至6元杂芳基和5至6元杂环基,或至少一个r3是被0、1、2、3、4、5或6个3至8元环烷基环或5元或6元芳基取代的c
2-c6烷基,或被1、2、3、4、5或6个3至8元环烷基环或5元或6元芳基取代的c1烷基,或两个r3接合形成c
3-c6环烷基环。
[0953]
44.如实施方案40所述的化合物,其中所述式(iii)的化合物是式(iii-bi)、(iii-bii)、(iii-biii)或(iii-biv)的化合物:
[0954][0955]
其互变异构体、所述化合物或所述互变异构体的氘化衍生物、或前述任一者的药
学上可接受的盐,其中:
[0956]-由*表示的碳具有s-立体化学或r-立体化学;
[0957]-环d是苯基环、5元杂环基环、6元杂环基环、5元杂芳基环、6元杂芳基环、3至8元环烷基环或3至8元环烯基;
[0958]-每个r1独立地选自c
1-c6烷基、c
1-c6烷氧基、c
1-c6卤代烷基、c
1-c6卤代烷氧基、卤素、氰基和羟基,或两个r1基团连同其所连接的原子一起形成5至6元杂芳基或6元芳基环;
[0959]-m是0、1、2、3或4;
[0960]-每个r2独立地选自视情况被苯基或5元或6元杂芳基取代的c
1-c6烷基、c
1-c6烷氧基、c
1-c6卤代烷基、c
1-c6卤代烷氧基、卤素、氰基和羟基,或任选地两个r2连同其所连接的原子一起形成苯基或6元杂芳基环,其任选独立地被一个或多个选自以下的基团取代:卤素、c
1-c6烷基、卤代烷基、羟基、c
1-c6烷氧基和c
1-c6卤代烷氧基;
[0961]-n是0、1或2;
[0962]-每个r3是被0、1、2、3、4、5或6个3至8元环烷基环或5元或6元芳基取代的c
1-c6烷基,或两个r3接合形成c
3-c6环烷基环;
[0963]-每个r4独立地选自卤素、氧代基、羟基、氰基和-(y)
k-r7基团,或任选地两个r4连同其所连接的原子一起形成5至6元环烷基或杂环基环,其任选独立地被一个或多个选自以下的基团取代:卤素、c
1-c6烷基、卤代烷基、羟基、c
1-c6烷氧基和c
1-c6卤代烷氧基;其中:
[0964]-k是0、1、2、3、4、5或6;
[0965]-每个y独立地选自c(r5)(r6)基团、
–o–
和
–
nra–
基团,其中-(y)
k-r7中的杂原子不键结至-(y)
k-r7中的另一个杂原子,其中:
[0966]-每个r5和r6独立地选自氢、卤素、羟基、c
1-c6烷基和c
3-5
环烷基,或同一碳上的r5和r6一起形成c
3-5
环烷基或氧代基;
[0967]-r5和r6各自任选独立地被一个或多个选自以下的基团取代:c
1-c6烷基、c
1-c6卤代烷基、卤素、羟基、c
1-c6烷氧基和c
1-c6卤代烷氧基;并且
[0968]-每个ra独立地选自氢和c
1-c6烷基;并且
[0969]-r7选自氢、卤素、氰基和任选地被一个或多个选自以下的基团取代的c
3-c
10
环烷基:c
1-c6烷基、c
1-c6卤代烷基和卤素;
[0970]-q是1、2、3或4;并且
[0971]-z是式(l)r的二价连接基团,其中:
[0972]-r是1、2、3、4、5或6;
[0973]-每个l独立地选自c(r8)(r9)基团、
–o–
和
–
nrb–
基团,其中z中的杂原子不键结到z中的另一个杂原子,并且其中是5或6元杂环基、或5或6元杂芳基,其各自被0、1、2、3或4个r
10
基团取代;并且其中:
[0974]-r8和r9各自独立地选自氢、卤素、c
1-c6卤代烷基、c
1-c6烷基、c
2-c6烯基、c
2-c6炔基、羟基、c
1-c6烷氧基、c
1-c6卤代烷氧基、co2h、c(o)n(r
x
)(ry)、苯基、3至8元环烷基、5至6元杂芳基和5至6元杂环基,其各自被0、1、2、3、4或5个r
10
基团取代;
[0975]-每个r
10
独立地选自卤素、羟基、氰基、c
1-c6烷基、c
2-c6烯基、c
2-c6炔基、-(c
1-c6烷
基)-o(c
1-c6烷基)、-(c
1-c6烷基)-co2(c
1-c6烷基)、-(c
1-c6烷基)-n(r
x
)(ry)、-(c
1-c6烷基)-co2h、c
1-c6烷氧基、-n(r
x
)(ry)、-co-n(r
x
)(ry)、co2h、-co2(c
1-c6烷基)、-co2bn、-co(c
1-c6烷基)、苯基、5至6元杂芳基、4至6元杂环基和c
3-c
10
环烷基,其各自任选独立地被一个或多个选自以下的基团取代:卤素、氰基、c
1-c6烷基、卤代烷基、羟基、c
1-c6烷氧基、c
1-c6卤代烷氧基和-co2(c
1-c6烷基),
[0976]
或同一碳上的r8和r9一起形成氧代基;并且
[0977]-每个rb独立地选自氢、苯基和c
1-c6烷基,其中所述c
1-c6烷基任选独立地被一个或多个选自以下的基团取代:羟基、-c(o)n(r
x
)(ry)、氰基、4至6元杂环基、视情况被c
1-c6烷基取代的5元杂芳基;
[0978]-每个r
x
和ry独立地选自氢、c
1-c6烷基、c
1-c6卤代烷基、c
4-c9杂环基、3至6元环烷基、5至6元杂芳基、苄基、-co2(c
1-c6烷基)、-co(c
1-c6烷基),其中所述c
1-c6烷基任选地被-nme2取代,并且其中所述c
4-c9杂环基任选地被-(c
1-c6烷基)-o(c
1-c6烷基)或-co2(c
1-c6烷基)取代;
[0979]
条件是r8和r9中的至少一者独立地选自c
3-c6卤代烷基、c
3-c6烷基、c
2-c6烯基、c
2-c6炔基、c
3-c6烷氧基、c
3-c6卤代烷氧基、苯基、5至6元杂芳基和5至6元杂环基,或至少一个r3是被0、1、2、3、4、5或6个3至8元环烷基环或5元或6元芳基取代的c
2-c6烷基,或被1、2、3、4、5或6个3至8元环烷基环或5元或6元芳基取代的c1烷基,或两个r3接合形成c
3-c6环烷基环。
[0980]
45.如实施方案40所述的化合物,其中所述式(iii)的化合物是式(iii-bv)或(iii-bvi)的化合物:
[0981][0982][0983]
其互变异构体、所述化合物或所述互变异构体的氘化衍生物、或前述任一者的药学上可接受的盐,其中:
[0984]-由*表示的碳具有s-立体化学或r-立体化学;
[0985]-每个r1独立地选自c
1-c6烷基、c
1-c6烷氧基、c
1-c6卤代烷基、c
1-c6卤代烷氧基、卤
素、氰基和羟基,或两个r1基团连同其所连接的原子一起形成5至6元杂芳基或6元芳基环;
[0986]-m是0、1、2、3或4;
[0987]-每个r2独立地选自视情况被苯基或5元或6元杂芳基取代的c
1-c6烷基、c
1-c6烷氧基、c
1-c6卤代烷基、c
1-c6卤代烷氧基、卤素、氰基和羟基,或任选地两个r2连同其所连接的原子一起形成苯基或6元杂芳基环,其任选独立地被一个或多个选自以下的基团取代:卤素、c
1-c6烷基、卤代烷基、羟基、c
1-c6烷氧基和c
1-c6卤代烷氧基;
[0988]-n是0、1或2;
[0989]-每个r3是被0、1、2、3、4、5或6个3至8元环烷基环或5元或6元芳基取代的c
1-c6烷基,或两个r3接合形成c
3-c6环烷基环;
[0990]-每个r4独立地选自卤素、氧代基、羟基、氰基和-(y)
k-r7基团,或任选地两个r4连同其所连接的原子一起形成5至6元环烷基或杂环基环,其任选独立地被一个或多个选自以下的基团取代:卤素、c
1-c6烷基、卤代烷基、羟基、c
1-c6烷氧基和c
1-c6卤代烷氧基;其中:
[0991]-k是0、1、2、3、4、5或6;
[0992]-每个y独立地选自c(r5)(r6)基团、
–o–
和
–
nra–
基团,其中-(y)
k-r7中的杂原子不键结至-(y)
k-r7中的另一个杂原子,其中:
[0993]-每个r5和r6独立地选自氢、卤素、羟基、c
1-c6烷基和c
3-5
环烷基,或同一碳上的r5和r6一起形成c
3-5
环烷基或氧代基;
[0994]-r5和r6各自任选独立地被一个或多个选自以下的基团取代:c
1-c6烷基、c
1-c6卤代烷基、卤素、羟基、c
1-c6烷氧基和c
1-c6卤代烷氧基;并且
[0995]-每个ra独立地选自氢和c
1-c6烷基;并且
[0996]-r7选自氢、卤素、氰基和任选地被一个或多个选自以下的基团取代的c
3-c
10
环烷基:c
1-c6烷基、c
1-c6卤代烷基和卤素;
[0997]-q是1、2、3或4;并且
[0998]-z是式(l)r的二价连接基团,其中:
[0999]-r是1、2、3、4、5或6;
[1000]-每个l独立地选自c(r8)(r9)基团、
–o–
和
–
nrb–
基团,其中z中的杂原子不键结到z中的另一个杂原子,并且其中是5或6元杂环基、或5或6元杂芳基,其各自被0、1、2、3或4个r
10
基团取代;并且其中:
[1001]-r8和r9各自独立地选自氢、卤素、c
1-c6卤代烷基、c
1-c6烷基、c
2-c6烯基、c
2-c6炔基、羟基、c
1-c6烷氧基、c
1-c6卤代烷氧基、co2h、c(o)n(r
x
)(ry)、苯基、3至8元环烷基、5至6元杂芳基和5至6元杂环基,其各自被0、1、2、3、4或5个r
10
基团取代;
[1002]
每个r
10
独立地选自卤素、羟基、氰基、c
1-c6烷基、c
2-c6烯基、c
2-c6炔基、-(c
1-c6烷基)-o(c
1-c6烷基)、-(c
1-c6烷基)-co2(c
1-c6烷基)、-(c
1-c6烷基)-n(r
x
)(ry)、-(c
1-c6烷基)-co2h、c
1-c6烷氧基、-n(r
x
)(ry)、-co-n(r
x
)(ry)、co2h、-co2(c
1-c6烷基)、-co2bn、-co(c
1-c6烷基)、苯基、5至6元杂芳基、4至6元杂环基和c
3-c
10
环烷基,其各自任选独立地被一个或多个选自以下的基团取代:卤素、氰基、c
1-c6烷基、卤代烷基、羟基、c
1-c6烷氧基、c
1-c6卤代烷氧基和-co2(c
1-c6烷基),
[1003]
或同一碳上的r8和r9一起形成氧代基;并且
[1004]-每个rb独立地选自氢、苯基和c
1-c6烷基,其中所述c
1-c6烷基任选独立地被一个或多个选自以下的基团取代:羟基、-c(o)n(r
x
)(ry)、氰基、4至6元杂环基、视情况被c
1-c6烷基取代的5元杂芳基;
[1005]-每个r
x
和ry独立地选自氢、c
1-c6烷基、c
1-c6卤代烷基、c
4-c9杂环基、3至6元环烷基、5至6元杂芳基、苄基、-co2(c
1-c6烷基)、-co(c
1-c6烷基),其中所述c
1-c6烷基任选地被-nme2取代,并且其中所述c
4-c9杂环基任选地被-(c
1-c6烷基)-o(c
1-c6烷基)或-co2(c
1-c6烷基)取代;
[1006]
条件是r8和r9中的至少一者独立地选自c
3-c6卤代烷基、c
3-c6烷基、c
2-c6烯基、c
2-c6炔基、c
3-c6烷氧基、c
3-c6卤代烷氧基、苯基、5至6元杂芳基和5至6元杂环基,或至少一个r3是被0、1、2、3、4、5或6个3至8元环烷基环或5元或6元芳基取代的c
2-c6烷基,或被1、2、3、4、5或6个3至8元环烷基环或5元或6元芳基取代的c1烷基,或两个r3接合形成c
3-c6环烷基环。
[1007]
46.如实施方案40所述的化合物,其中所述式(iii)的化合物是式(iii-ci)、(iii-cii)、(iii-ciii)或(iii-civ)的化合物:
[1008]
[1009][1010]
其互变异构体、所述化合物或所述互变异构体的氘化衍生物、或前述任一者的药学上可接受的盐,其中:
[1011]-环d是苯基环、5元杂环基环、6元杂环基环、5元杂芳基环、6元杂芳基环、3至8元环烷基环或3至8元环烯基;
[1012]-每个r1独立地选自c
1-c6烷基、c
1-c6烷氧基、c
1-c6卤代烷基、c
1-c6卤代烷氧基、卤素、氰基和羟基,或两个r1基团连同其所连接的原子一起形成5至6元杂芳基或6元芳基环;
[1013]-m是0、1、2、3或4;
[1014]-每个r2独立地选自视情况被苯基或5元或6元杂芳基取代的c
1-c6烷基、c
1-c6烷氧基、c
1-c6卤代烷基、c
1-c6卤代烷氧基、卤素、氰基和羟基,或任选地两个r2连同其所连接的原子一起形成苯基或6元杂芳基环,其任选独立地被一个或多个选自以下的基团取代:卤素、c
1-c6烷基、卤代烷基、羟基、c
1-c6烷氧基和c
1-c6卤代烷氧基;
[1015]-n是0、1或2;
[1016]-每个r3是被0、1、2、3、4、5或6个3至8元环烷基环或5元或6元芳基取代的c
1-c6烷基,或两个r3接合形成c
3-c6环烷基环;
[1017]-每个r4独立地选自卤素、氧代基、羟基、氰基和-(y)
k-r7基团,或任选地两个r4连同其所连接的原子一起形成5至6元环烷基或杂环基环,其任选独立地被一个或多个选自以下的基团取代:卤素、c
1-c6烷基、卤代烷基、羟基、c
1-c6烷氧基和c
1-c6卤代烷氧基;其中:
[1018]-k是0、1、2、3、4、5或6;
[1019]-每个y独立地选自c(r5)(r6)基团、
–o–
和
–
nra–
基团,其中-(y)
k-r7中的杂原子不键结至-(y)
k-r7中的另一个杂原子,其中:
[1020]-每个r5和r6独立地选自氢、卤素、羟基、c
1-c6烷基和c
3-5
环烷基,或同一碳上的r5和r6一起形成c
3-5
环烷基或氧代基;
[1021]-r5和r6各自任选独立地被一个或多个选自以下的基团取代:c
1-c6烷基、c
1-c6卤代烷基、卤素、羟基、c
1-c6烷氧基和c
1-c6卤代烷氧基;并且
[1022]-每个ra独立地选自氢和c
1-c6烷基;并且
[1023]-r7选自氢、卤素、氰基和任选地被一个或多个选自以下的基团取代的c
3-c
10
环烷基:c
1-c6烷基、c
1-c6卤代烷基和卤素;
[1024]-q是1、2、3或4;
[1025]-r8和r9各自独立地选自氢、卤素、c
1-c6卤代烷基、c
1-c6烷基、c
2-c6烯基、c
2-c6炔基、羟基、c
1-c6烷氧基、c
1-c6卤代烷氧基、co2h、c(o)n(r
x
)(ry)、苯基、3至8元环烷基、5至6元杂芳基和5至6元杂环基,其各自被0、1、2、3、4或5个r
10
基团取代;
[1026]-每个r
10
独立地选自卤素、羟基、氰基、c
1-c6烷基、c
2-c6烯基、c
2-c6炔基、-(c
1-c6烷基)-o(c
1-c6烷基)、-(c
1-c6烷基)-co2(c
1-c6烷基)、-(c
1-c6烷基)-n(r
x
)(ry)、-(c
1-c6烷基)-co2h、c
1-c6烷氧基、-n(r
x
)(ry)、-co-n(r
x
)(ry)、co2h、-co2(c
1-c6烷基)、-co2bn、-co(c
1-c6烷基)、苯基、5至6元杂芳基、4至6元杂环基和c
3-c
10
环烷基,其各自任选独立地被一个或多个选自以下的基团取代:卤素、氰基、c
1-c6烷基、卤代烷基、羟基、c
1-c6烷氧基、c
1-c6卤代烷氧基和-co2(c
1-c6烷基),
[1027]
或同一碳上的r8和r9一起形成氧代基;并且
[1028]-每个rb独立地选自氢、苯基和c
1-c6烷基,其中所述c
1-c6烷基任选独立地被一个或多个选自以下的基团取代:羟基、-c(o)n(r
x
)(ry)、氰基、4至6元杂环基、视情况被c
1-c6烷基取代的5元杂芳基;
[1029]-每个r
x
和ry独立地选自氢、c
1-c6烷基、c
1-c6卤代烷基、c
4-c9杂环基、3至6元环烷基、5至6元杂芳基、苄基、-co2(c
1-c6烷基)、-co(c
1-c6烷基),其中所述c
1-c6烷基任选地被-nme2取代,并且其中所述c
4-c9杂环基任选地被-(c
1-c6烷基)-o(c
1-c6烷基)或-co2(c
1-c6烷基)取代;
[1030]
条件是r8和r9中的至少一者独立地选自c
3-c6卤代烷基、c
3-c6烷基、c
2-c6烯基、c
2-c6炔基、c
3-c6烷氧基、c
3-c6卤代烷氧基、苯基、5至6元杂芳基和5至6元杂环基,或至少一个r3是被0、1、2、3、4、5或6个3至8元环烷基环或5元或6元芳基取代的c
2-c6烷基,或被1、2、3、4、5或6个3至8元环烷基环或5元或6元芳基取代的c1烷基,或两个r3接合形成c
3-c6环烷基环。
[1031]
47.如实施方案40所述的化合物,其中所述式(iii)的化合物是式(iii-cv)或(iii-cvi)的化合物:
[1032][1033][1034]
其互变异构体、所述化合物或所述互变异构体的氘化衍生物、或前述任一者的药学上可接受的盐,其中:
[1035]-每个r1独立地选自c
1-c6烷基、c
1-c6烷氧基、c
1-c6卤代烷基、c
1-c6卤代烷氧基、卤
素、氰基和羟基,或两个r1基团连同其所连接的原子一起形成5至6元杂芳基或6元芳基环;
[1036]-m是0、1、2、3或4;
[1037]-每个r2独立地选自视情况被苯基或5元或6元杂芳基取代的c
1-c6烷基、c
1-c6烷氧基、c
1-c6卤代烷基、c
1-c6卤代烷氧基、卤素、氰基和羟基,或任选地两个r2连同其所连接的原子一起形成苯基或6元杂芳基环,其任选独立地被一个或多个选自以下的基团取代:卤素、c
1-c6烷基、卤代烷基、羟基、c
1-c6烷氧基和c
1-c6卤代烷氧基;
[1038]-n是0、1或2;
[1039]-每个r3是被0、1、2、3、4、5或6个3至8元环烷基环或5元或6元芳基取代的c
1-c6烷基,或两个r3接合形成c
3-c6环烷基环;
[1040]-每个r4独立地选自卤素、氧代基、羟基、氰基和-(y)
k-r7基团,或任选地两个r4连同其所连接的原子一起形成5至6元环烷基或杂环基环,其任选独立地被一个或多个选自以下的基团取代:卤素、c
1-c6烷基、卤代烷基、羟基、c
1-c6烷氧基和c
1-c6卤代烷氧基;其中:
[1041]-k是0、1、2、3、4、5或6;
[1042]-每个y独立地选自c(r5)(r6)基团、
–o–
和
–
nra–
基团,其中-(y)
k-r7中的杂原子不键结至-(y)
k-r7中的另一个杂原子,其中:
[1043]-每个r5和r6独立地选自氢、卤素、羟基、c
1-c6烷基和c
3-5
环烷基,或同一碳上的r5和r6一起形成c
3-5
环烷基或氧代基;
[1044]-r5和r6各自任选独立地被一个或多个选自以下的基团取代:c
1-c6烷基、c
1-c6卤代烷基、卤素、羟基、c
1-c6烷氧基和c
1-c6卤代烷氧基;并且
[1045]-每个ra独立地选自氢和c
1-c6烷基;并且
[1046]-r7选自氢、卤素、氰基和任选地被一个或多个选自以下的基团取代的c
3-c
10
环烷基:c
1-c6烷基、c
1-c6卤代烷基和卤素;
[1047]-q是1、2、3或4;
[1048]-r8和r9各自独立地选自氢、卤素、c
1-c6卤代烷基、c
1-c6烷基、c
2-c6烯基、c
2-c6炔基、羟基、c
1-c6烷氧基、c
1-c6卤代烷氧基、co2h、c(o)n(r
x
)(ry)、苯基、3至8元环烷基、5至6元杂芳基和5至6元杂环基,其各自被0、1、2、3、4或5个r
10
基团取代;
[1049]-每个r
10
独立地选自卤素、羟基、氰基、c
1-c6烷基、c
2-c6烯基、c
2-c6炔基、-(c
1-c6烷基)-o(c
1-c6烷基)、-(c
1-c6烷基)-co2(c
1-c6烷基)、-(c
1-c6烷基)-n(r
x
)(ry)、-(c
1-c6烷基)-co2h、c
1-c6烷氧基、-n(r
x
)(ry)、-co-n(r
x
)(ry)、co2h、-co2(c
1-c6烷基)、-co2bn、-co(c
1-c6烷基)、苯基、5至6元杂芳基、4至6元杂环基和c
3-c
10
环烷基,其各自任选独立地被一个或多个选自以下的基团取代:卤素、氰基、c
1-c6烷基、卤代烷基、羟基、c
1-c6烷氧基、c
1-c6卤代烷氧基和-co2(c
1-c6烷基),
[1050]
或同一碳上的r8和r9一起形成氧代基;并且
[1051]-每个rb独立地选自氢、苯基和c
1-c6烷基,其中所述c
1-c6烷基任选独立地被一个或多个选自以下的基团取代:羟基、-c(o)n(r
x
)(ry)、氰基、4至6元杂环基、视情况被c
1-c6烷基取代的5元杂芳基;
[1052]-每个r
x
和ry独立地选自氢、c
1-c6烷基、c
1-c6卤代烷基、c
4-c9杂环基、3至6元环烷基、5至6元杂芳基、苄基、-co2(c
1-c6烷基)、-co(c
1-c6烷基),其中所述c
1-c6烷基任选地被-nme2取代,并且其中所述c
4-c9杂环基任选地被-(c
1-c6烷基)-o(c
1-c6烷基)或-co2(c
1-c6烷
基)取代;
[1053]
条件是r8和r9中的至少一者独立地选自c
3-c6卤代烷基、c
3-c6烷基、c
2-c6烯基、c
2-c6炔基、c
3-c6烷氧基、c
3-c6卤代烷氧基、苯基、5至6元杂芳基和5至6元杂环基,或至少一个r3是被0、1、2、3、4、5或6个3至8元环烷基环或5元或6元芳基取代的c
2-c6烷基,或被1、2、3、4、5或6个3至8元环烷基环或5元或6元芳基取代的c1烷基,或两个r3接合形成c
3-c6环烷基环。
[1054]
48.如实施方案40或41所述的化合物、互变异构体、氘化衍生物或药学上可接受的盐,其中x是o。
[1055]
49.如实施方案40至43或48中任一项所述的化合物、互变异构体、氘化衍生物或药学上可接受的盐,其中环a选自苯基、吡啶、吡嗪和吡唑。
[1056]
50.如实施方案40至43或48中任一项所述的化合物、互变异构体、氘化衍生物或药学上可接受的盐,其中:
[1057]-环a是苯基;并且
[1058]-一个r1和一个rb连同其所连接的原子一起形成吡咯或吡啶。
[1059]
51.如实施方案40或48至50中任一项所述的化合物、互变异构体、氘化衍生物或药学上可接受的盐,其中环b是吡啶基环。
[1060]
52.如实施方案40至42、44、46或48至51中任一项所述的化合物、互变异构体、氘化衍生物或药学上可接受的盐,其中环d选自吡啶基、吡咯基、环己基、环己烯基、咪唑啉酮基、环丁基和苯基,其各自被q个r4取代。
[1061]
53.如实施方案40至42、44、46或48至51中任一项所述的化合物、互变异构体、氘化衍生物或药学上可接受的盐,其中环d选自
[1062]
54.如实施方案53所述的化合物、盐或氘化衍生物,其中环d选自54.如实施方案53所述的化合物、盐或氘化衍生物,其中环d选自
[1063]
55.如实施方案40至47中任一项所述的化合物、互变异构体、氘化衍生物或药学上可接受的盐,其中r4选自卤素、氧代基和-(y)
k-r7基团。
[1064]
56.如实施方案40至54中任一项所述的化合物、互变异构体、氘化衍生物或药学上可接受的盐,其中r4选自卤素和-(y)
k-r7基团。
[1065]
57.如实施方案40至56中任一项所述的化合物、互变异构体、氘化衍生物或药学上可接受的盐,其中r4选自f、cl、—ch3、
[1066][1067]
58.如实施方案40至57中任一项所述的化合物、互变异构体、氘化衍生物或药学上可接受的盐,其中m是0。
[1068]
59.如实施方案40至57中任一项所述的化合物、互变异构体、氘化衍生物或药学上可接受的盐,其中r1是羟基。
[1069]
60.如实施方案40至59中任一项所述的化合物、互变异构体、氘化衍生物或药学上可接受的盐,其中r3是被苯基取代的c
1-c6烷基。
[1070]
61.如实施方案60所述的化合物、互变异构体、氘化衍生物或药学上可接受的盐,其中r3是苄基。
[1071]
62.如实施方案40至59中任一项所述的化合物、互变异构体、氘化衍生物或药学上可接受的盐,其中每个r3是c1烷基。
[1072]
63.如实施方案40至62中任一项所述的化合物、互变异构体、氘化衍生物或药学上可接受的盐,其中n是0。
[1073]
64.如实施方案40至45或48至63中任一项所述的化合物、互变异构体、氘化衍生物或药学上可接受的盐,其中z选自学上可接受的盐,其中z选自其中表示z与环c的连接点并且表示z与环a的连接点。
[1074]
65.如实施方案40至45或48至63中任一项所述的化合物、互变异构体、氘化衍生物或药学上可接受的盐,其中z选自或药学上可接受的盐,其中z选自其中表
示z与环c的连接点并且表示z与环a的连接点。
[1075]
66.如实施方案40至45或48至63中任一项所述的化合物、互变异构体、氘化衍生物或药学上可接受的盐,其中rb选自h、-ch3、苯基、、苯基、
[1076]
67.如实施方案40至66中任一项所述的化合物、互变异构体、氘化衍生物或药学上可接受的盐,其中每个c(r8)(r9)基团独立地选自-ch
2-、-co-、、
[1077]
[1078]
[1079]
[1080]
[1081][1082]
68.如实施方案40至67中任一项所述的化合物、互变异构体、氘化衍生物或药学上可接受的盐,其中每个c(r8)(r9)基团独立地选自-ch
2-、、
[1083]
69.如实施方案40至68中任一项所述的化合物、互变异构体、氘化衍生物或药学上可接受的盐,其中选自选自
[1084]
70.一种选自化合物299-397(表3b)、其互变异构体、所述化合物和互变异构体的氘化衍生物以及前述任一者的药学上可接受的盐的化合物。
[1085]
71.一种药物组合物,其包含如实施方案40至70中任一项所述的化合物、互变异构体、氘化衍生物或药学上可接受的盐以及药学上可接受的载体。
[1086]
72.如实施方案71所述的药物组合物,其还包含一种或多种另外的治疗剂。
[1087]
73.如实施方案72所述的药物组合物,其中所述一种或多种另外的治疗剂包含选自以下的化合物:替扎卡托、依伐卡托、d-依伐夫托和其药学上可接受的盐。
[1088]
74.如实施方案72所述的药物组合物,其中所述组合物包含替扎卡托和依伐卡托。
[1089]
75.如实施方案72所述的药物组合物,其中所述组合物包含替扎卡托和d-依伐卡
托。
[1090]
76.一种药物组合物,其包含:
[1091]
(a)至少一种如实施方案40至70中任一项所述的化合物、互变异构体、氘化衍生物或药学上可接受的盐;
[1092]
(b)至少一种药学上可接受的载体;以及
[1093]
任选地,以下中的一种或多种:
[1094]
(c)(i)选自替扎卡托:
[1095][1096]
和其药学上可接受的盐和氘化衍生物的化合物;以及
[1097]
(ii)选自依伐卡托d-依伐卡托和其药学上可接受的盐和氘化衍生物的化合物。
[1098]
77.一种治疗囊性纤维化的方法,其包括向有需要的患者施用如实施方案40至70中任一项所述的化合物、互变异构体、氘化衍生物或药学上可接受的盐或如实施方案71至76中任一项所述的药物组合物。
[1099]
78.如实施方案77所述的方法,其还包括在所述化合物或所述药物组合物之前、与其同时或在其之后向所述患者施用一种或多种另外的治疗剂。
[1100]
79.如实施方案78所述的方法,其中所述一种或多种另外的治疗剂包含选自以下的化合物:替扎卡托、依伐卡托、d-依伐夫托、鲁玛卡托和其药学上可接受的盐。
[1101]
80.如实施方案79所述的方法,其中所述一种或多种另外的治疗剂包含替扎卡托和依伐卡托。
[1102]
81.如实施方案79所述的方法,其中所述一种或多种另外的治疗剂包含依伐卡托和d-依伐卡托。
[1103]
82.如实施方案40至70中任一项所述的化合物、互变异构体、氘化衍生物或药学上可接受的盐或如实施方案71至76中任一项所述的药物组合物,其用于治疗囊性纤维化。
[1104]
83.如实施方案40至70中任一项所述的化合物、互变异构体、氘化衍生物或药学上可接受的盐或如实施方案71至76中任一项所述的药物组合物,其用于制造用于治疗囊性纤维化的药物。
[1105]
84.一种选自化合物398-436(表4)、其互变异构体、所述化合物和互变异构体的氘化衍生物以及前述任一者的药学上可接受的盐的化合物。
[1106]
85.一种药物组合物,其包含如实施方案84所述的化合物、互变异构体、氘化衍生物或药学上可接受的盐以及药学上可接受的载体。
[1107]
86.如实施方案85所述的药物组合物,其还包含一种或多种另外的治疗剂。
[1108]
87.如实施方案86所述的药物组合物,其中所述一种或多种另外的治疗剂选自替扎卡托、依伐卡托、d-依伐卡托、鲁玛卡托和其药学上可接受的盐。
[1109]
88.如实施方案87所述的药物组合物,其中所述组合物包含替扎卡托和依伐卡托。
[1110]
89.如实施方案87所述的药物组合物,其中所述组合物包含替扎卡托和d-依伐卡托。
[1111]
90.一种药物组合物,其包含:
[1112]
(a)至少一种如实施方案84所述的化合物、互变异构体、氘化衍生物或药学上可接受的盐;
[1113]
(b)至少一种药学上可接受的载体;以及
[1114]
任选地,以下中的一种或多种:
[1115]
(c)(i)选自替扎卡托:
[1116][1117]
和其药学上可接受的盐和氘化衍生物的化合物;以及
[1118]
(ii)选自依伐卡托d-依伐卡托和其药学上可接受的盐和氘化衍生物的化合物。
[1119]
91.一种治疗囊性纤维化的方法,其包括向有需要的患者施用如实施方案84所述的化合物、互变异构体、氘化衍生物或药学上可接受的盐或如实施方案85所述的药物组合物。
[1120]
92.如实施方案91所述的方法,其还包括在所述化合物或所述药物组合物之前、与其同时或在其之后向所述患者施用一种或多种另外的治疗剂。
[1121]
93.如实施方案91所述的方法,其中所述一种或多种另外的治疗剂包含选自以下的化合物:替扎卡托、依伐卡托、d-依伐夫托、鲁玛卡托和其药学上可接受的盐。
[1122]
94.如实施方案93所述的方法,其中所述一种或多种另外的治疗剂包含替扎卡托和依伐卡托。
[1123]
95.如实施方案93所述的方法,其中所述一种或多种另外的治疗剂包含替扎卡托和d-依伐卡托。
[1124]
96.如实施方案84所述的化合物、互变异构体、氘化衍生物或药学上可接受的盐或如实施方案85所述的药物组合物,其用于治疗囊性纤维化。
[1125]
97.如实施方案84所述的化合物、互变异构体、氘化衍生物或药学上可接受的盐或如实施方案85所述的药物组合物,其用于制造用于治疗囊性纤维化的药物。
实施例:
[1126]
缩写列表:
[1127]
acn:乙腈
[1128]
boc酸酐((boc)2o):二碳酸二叔丁酯
[1129]
cdi:碳基二咪唑
[1130]
comu:(1-氰基-2-乙氧基-2-氧代亚乙基氨基氧基)二甲基氨基-吗啉基-碳鎓六氟磷酸盐
[1131]
dabco:1,4-二氮杂双环[2.2.2]辛烷
[1132]
dbu:1,8-二氮杂双环(5.4.0)十一碳-7-烯
[1133]
dcm:二氯甲烷
[1134]
di:去离子
[1135]
diad:偶氮二甲酸二异丙酯
[1136]
deia:(dipea;n,n-二异丙基乙胺)
[1137]
dma:n,n-二甲基乙酰胺
[1138]
dmap:4-二甲基氨基吡啶
[1139]
dmf:n,n-二甲基甲酰胺
[1140]
dmso:二甲基亚砜
[1141]
ea:乙酸乙酯
[1142]
edc:1-乙基-3-(3-二甲基氨基丙基)碳化二亚胺
[1143]
elsd:蒸发光散射检测器
[1144]
et2o:乙醚
[1145]
etoac:乙酸乙酯
[1146]
etoh:乙醇
[1147]
hotu:1-[双(二甲基氨基)亚甲基]-1h-1,2,3-三唑并[4,5-b]吡啶鎓3-氧化物六氟磷酸盐
[1148]
hplc:高效液相色谱法
[1149]
hmpa:六甲基磷酰胺
[1150]
hoveyda-grubbs第2代催化剂:(1,3-双-(2,4,6-三甲基苯基)-2-咪唑烷基亚基)二氯(邻异丙氧基苯基亚甲基)钌,二氯[1,3-双(2,4,6-三甲基苯基)-2-咪唑烷基亚基](2-异丙氧基苯基亚甲基)钌(ii)
[1151]
ipa:异丙醇
[1152]
[ir{df(cf3)ppy}2(dtbpy)]pf6:[4,4
′‑
双(1,1-二甲基乙基)-2,2
′‑
联吡啶-n1,n1
′
]双[3,5-二氟-2-[5-(三氟甲基)-2-吡啶基-n]苯基-c]铱(iii)六氟磷酸盐
[1153]
lah:氢化铝锂
[1154]
lc:液相色谱法
[1155]
lda:二异丙基氨基锂
[1156]
mecn:乙腈
[1157]
meoh:甲醇
[1158]
mtbe:甲基叔丁基醚
[1159]
methf或2-methf:2-甲基四氢呋喃
[1160]
nmp:n-甲基-2-吡咯烷酮
[1161]
nmm:n-甲基吗啉
[1162]
pd(dppf)cl2:[1,1
′‑
双(二苯基膦基)二茂铁]二氯钯(ii)
[1163]
ptfe:聚四氟乙烯
[1164]
rt:室温
[1165]
sfc:超临界流体色谱法
[1166]
tbs-cl:叔丁基二甲基氯硅烷
[1167]
tea:三乙胺
[1168]
tfa:三氟乙酸
[1169]
thf:四氢呋喃
[1170]
tms:三甲基甲硅烷基
[1171]
tmscl:三甲基氯硅烷
[1172]
tppo-diad复合物:三苯膦氧化物与偶氮二甲酸二异丙酯的复合物
[1173]
p-tsoh:对甲苯磺酸
[1174]
uplc:超高效液相色谱法
[1175]
一般方法
[1176]
除非另有说明,否则通过商业来源获得试剂和起始物质,并且在不纯化的情况下使用。
[1177]
在分别以400mhz和100mhz的1h和
13
c共振频率操作的bruker biospin drx 400mhz ftnmr光谱仪上或在300mhz nmr光谱仪上获得质子和碳nmr光谱。使用broadband observe(bbfo)探针,在20hz样品旋转下,分别以0.1834和0.9083hz/pt数字分辨率获取一维质子和碳谱。使用标准、先前公布的脉冲序列和常规处理参数,在30℃的温度控制下获取所有质子和碳谱。
[1178]
nmr(1d和2d)光谱也记录于分别在400mhz和100mhz下操作的配备有5mm多核iprobe的bruker avneo 400mhz光谱仪上。
[1179]
还在varian mercury nmr仪器上使用45度脉冲角度、4800hz谱宽和28860个采集点,在300mhz下记录1h nmr光谱。将fid零填充至32k个点,并且在傅立叶变换之前应用0.3hz谱线增宽。使用30度脉冲角度、100khz谱宽和59202个采集点在282mhz下记录
19
f nmr光谱。将fid零填充至64k个点,并且在傅立叶变换之前应用0.5hz谱线增宽。
[1180]
还在bruker avance iii hd nmr仪器上使用30度脉冲角、8000hz的光谱宽度和128k采集点,在400mhz下记录1h nmr光谱。将fid零填充至256k个点,并且在傅立叶变换之前应用0.3hz谱线增宽。使用30度脉冲角度、89286hz谱宽和128k个采集点在377mhz下记录
19
f nmr光谱。将fid零填充至256k个点,并且在傅立叶变换之前应用0.3hz谱线增宽。
[1181]
nmr光谱也记录在配备有:5mm qnp(h1/c13/f19/p31)探针(类型:250-sb,s#23055/0020)的bruker ac 250mhz仪器上或配备有id pfg,5mm,50-202/500mhz探针(型号/部件编号99337300)的varian 500mhz仪器上。
[1182]
化合物的最终纯度通过反相uplc使用waters制造的acquity uplc beh c
18
柱(50
×
2.1mm,1.7μm颗粒)(pn:186002350)和在3.0分钟内从1-99%流动相b运行的双梯度来测
定。流动相a=h2o(0.05%cf3co2h)。流动相b=ch3cn(0.035%cf3co2h)。流速=1.2ml/min,进样体积=1.5μl并且柱温=60℃。通过两个uv迹线(220nm、254nm)的曲线下面积(auc)求平均值来计算最终纯度。低分辨率质谱报道为使用配备有电喷雾电离(esi)源的单四极杆质谱仪获得的[m 1]
物质,该esi源能够在整个检测范围内实现0.1da的质量准确度和1000的最小分辨率(分辨率无单位)。(2s)-2,4-二甲基-4-硝基-戊酸甲酯的光学纯度是使用手性气体色谱法(gc)分析,在agilent 7890a/msd 5975c仪器上使用restek rt-βdexcst(30m
×
0.25mm
×
0.25μm_df)柱以2.0ml/min流速(h2载气)在220℃进样温度和120℃烘箱温度下进行15分钟来测定的。
[1183]
一般uplc/hplc分析方法
[1184]
lc方法a:使用waters制造的acquity uplc beh c
18
柱(50
×
2.1mm,1.7μm颗粒)(pn:186002350)和在2.9分钟内从1-99%流动相b运行的双梯度进行的分析型反相uplc。流动相a=h2o(0.05%cf3co2h)。流动相b=ch3cn(0.035%cf3co2h)。流速=1.2ml/min,进样体积=1.5μl,并且柱温=60℃。
[1185]
lc方法b:merckmillipore chromolith speedrod c
18
柱(50x4.6mm)和在6分钟内从5-100%流动相b运行的双梯度。流动相a=水(0.1%cf3co2h)。流动相b=乙腈(0.1%cf3co2h)。
[1186]
lc方法c:merckmillipore chromolith speedrod c
18
柱(50x4.6mm)和在12分钟内从5-100%流动相b运行的双梯度。流动相a=水(0.1%cf3co2h)。流动相b=乙腈(0.1%cf3co2h)。
[1187]
lc方法d:由waters制造的acquity uplc beh c
18
柱(30
×
2.1mm,1.7μm颗粒)(pn:186002349)和在1.0分钟内从1-99%流动相b运行的双梯度。流动相a=h2o(0.05%cf3co2h)。流动相b=ch3cn(0.035%cf3co2h)。流速=1.5ml/min,进样体积=1.5μl,并且柱温=60℃。
[1188]
lc方法e:luna柱c
18
(2)50x3mm,3μm。运行:2.5min。流动相:含有0.1%甲酸的初始95%h2o/含有0.1%甲酸的5%mecn,在1.3min内线性梯度至含有0.1%甲酸的95%mecn,在含有0.1%甲酸的95%mecn下保持1.2min。温度:45℃,流速:1.5ml/min。
[1189]
lc方法f:sunfire柱c
18 75x4.6mm 3.5μm,运行:6min。流动相条件:初始95%h2o 0.1%甲酸/5%mecn 0.1%甲酸,线性梯度至95%mecn持续4min,在95%mecn下保持2min。t:45℃,流速:1.5ml/min。
[1190]
lc方法g:使用waters制造的acquity uplc beh c
18
柱(50
×
2.1mm,1.7μm颗粒)(pn:186002350)和在2.9分钟内从30-99%流动相b运行的双梯度进行的分析型反相uplc。流动相a=h2o(0.05%cf3co2h)。流动相b=mecn(0.035%cf3co2h)。流速=1.2ml/min,进样体积=1.5μl,并且柱温=60℃。
[1191]
lc方法h:water cortex 2.7μc
18
(3.0mm x 50mm)柱,温度:55℃;流速:1.2ml/min;流动相:100%水/0.1%三氟乙酸(tfa),然后100%乙腈/0.1%tfa酸,在4min内梯度为5%至100%b,在100%b下保持0.5min,在1.5min内平衡至5%b。
[1192]
lc方法i:使用由waters制造的acquity uplc beh c
18
柱(30
×
2.1mm,1.7μm颗粒)(pn:186002349)和在1.0分钟内从30-99%流动相b运行的双梯度进行的反相uplc。流动相a=h2o(0.05%cf3co2h)。流动相b=ch3cn(0.035%cf3co2h)。流速=1.5ml/min,进样体积=
7644)和在1.2min内从1-99%流动相b运行的双梯度进行的hplc-ms。流动相a=h2o(0.05%cf3co2h)。流动相b=ch3cn(0.035%cf3co2h)。流速=12ml/min,进样体积=50μl,并且柱温=25℃。
[1204]
lc方法u:使用由waters制造的acquity uplc beh c
18
柱(30
×
2.1mm,1.7μm颗粒)(pn:186002349)和在1.0分钟内从50-99%流动相b运行的双梯度进行的uplc。流动相a=h20(0.05%cf3co2h)。流动相b=ch3cn(0.035%cf3co2h)。流速=1.5ml/min,进样体积=1.5μl,并且柱温=60℃。
[1205]
lc方法v:最终纯度通过反相uplc使用waters制造的acquity uplc beh c
18
柱(50
×
2.1mm,1.7μm颗粒)(pn:186002350)和在2.9分钟内从1-99%流动相b运行的双梯度来测定。流动相a=h20(0.05%nh4hco2)。流动相b=ch3cn。流速=1.2ml/min,进样体积=1.5μl,并且柱温=60℃。
[1206]
实施例1:2,6-二氯吡啶-3-甲酸叔丁酯的制备
[1207][1208]
将2,6-二氯吡啶-3-甲酸(10g,52.08mmol)在四氢呋喃(210ml)中的溶液依次用二碳酸二叔丁酯(17g,77.89mmol)和4-(二甲基氨基)吡啶(3.2g,26.19mmol)处理,并在室温下搅拌过夜。此时,添加1n盐酸(400ml),并将混合物剧烈搅拌约10分钟。将产物用乙酸乙酯(2x300ml)萃取,并将合并的有机层用水(300ml)和盐水(150ml)洗涤并经硫酸钠干燥,过滤并减压浓缩,得到12.94g(96%产率)呈无色油状的2,6-二氯吡啶-3-甲酸叔丁酯。1h nmr(300mhz,cdcl3)δ1.60(s,9h),7.30(d,j=7.9hz,1h),8.05(d,j=8.2hz,1h)。esi-ms m/z计算值247.02,实验值248.1(m 1)
;保留时间:1.79分钟(lc方法a)。
[1209]
实施例2:6-氟吡啶-2-磺酰胺的制备
[1210][1211]
步骤1:2-苄基硫基-6-氟-吡啶
[1212][1213]
在配备有顶置式搅拌器、温度探针和加料漏斗的5l三颈圆底烧瓶中,将2,6-二氟吡啶(200g,1.738mol)溶解于二甲基亚砜(2l)中。添加碳酸铯(572.4g,1.757mol)。通过加料漏斗逐滴添加苯甲硫醇(206ml,1.755mol)。在添加过程中观察到放热。温度升高至约40℃。将反应物在室温下搅拌过夜。将反应物倒入水中并用二氯甲烷萃取。将萃取物用水洗涤两次,并经由小硅胶塞过滤。将硅胶塞用二氯甲烷洗脱,并真空蒸发滤液,得到呈桃红色油状的2-苄基硫基-6-氟-吡啶(366g,96%),使其在真空下凝固成大块状片。1h nmr(400mhz,氯仿-d)δ7.58(q,j=7.9hz,1h),7.48-7.41(m,2h),7.36-7.25(m,3h),7.06(dd,j=7.6,2.1hz,1h),6.62(dd,j=7.9,2.6hz,1h),4.43(s,2h)。
[1214]
步骤2:6-氟吡啶-2-磺酰胺
[1215][1216]
在配备有顶置式搅拌器和温度探针的12l三颈圆底烧瓶中,将2-苄基硫基-6-氟-吡啶(303.2g,1.383mol)溶解于氯仿(2.0l)中。添加水(1.5l),并将混合物在冰浴中冷却至0℃并剧烈搅拌。通过插入穿过在烧瓶第三颈上的隔垫的pasteur移液管将气阀瓶中的氯气剧烈鼓入反应物中。迅速形成白色沉淀。在添加过程中观察到放热。当温度升高至20℃时,停止添加氯。使反应物再次冷却,然后添加更多氯气。继续加料直到反应物变为黄绿色,并且在搅拌30min后保持该状态。此时,未观察到进一步的放热。将反应物倒入40%亚硫酸氢钠水溶液中。分离有机层,并用另一部分的氯仿萃取水溶液。将有机层合并,经硫酸镁干燥,过滤并真空蒸发,得到浅黄色油状物。在配备有顶置式搅拌器、温度探针和加料漏斗的12l三颈圆底烧瓶中,将油状物溶解于二氯甲烷(1.5l)中,并逐滴添加到氢氧化铵(1.5l,40%w/v,17.12mol)中。在添加之前,将氢氧化铵溶液在冰浴中冷却至0℃。调整添加速率,使得反应温度保持在10℃以下。将所得的绿黄色溶液搅拌一小时并倒入冰中。分离各层(有机层为深绿色),并用更多二氯甲烷萃取水层。丢弃有机层。将水层在冰浴中冷却,并且将浓缩的盐酸水溶液分分批添加到水层中直到ph为强酸性。在添加每个部分时搅拌所得混合物。将所得水溶液用乙酸乙酯萃取两次。将有机层合并,经硫酸镁干燥,过滤并真空蒸发,得到浅棕色固体。将固体与二氯甲烷(约500ml)混合,并用磁力搅拌棒搅拌,直到大部分大团块破碎为止。添加约1.5l戊烷,其沉淀出大量浅棕色固体。短暂搅拌所得混合物,并且然后过滤。将滤饼用戊烷洗涤并真空干燥,得到呈浅棕色固体状的6-氟吡啶-2-磺酰胺(204.1g,84%)。1h nmr(300mhz,二甲基亚砜-d6)δ8.52-8.11(m,1h),7.89(dd,j=7.8,2.7hz,1h),7.67(s,2h),7.57-7.44(m,1h)。
[1217]
实施例3:(4s)-4-(3-羟丙基)-2,2-二甲基-吡咯烷-1-甲酸叔丁酯的制备
[1218]
步骤1:(e)-(2-氧代四氢吡喃-3-亚基)甲醇盐(钠盐)
[1219][1220]
使5l、3颈圆底烧瓶配备有机械搅拌器、加热套、加料漏斗、j-kem温度探针/控制器和氮气入口/出口。在氮气气氛下,向容器中装入氢化钠(59.91g,60%w/w,1.498mol),随后装入庚烷(1.5l),得到灰色悬浮液。开始搅拌,并记录锅温为19℃。然后向容器中装入经由注射器添加的乙醇(3.451g,74.91mmol),其导致气体逸出。向加料漏斗中装入四氢吡喃-2-酮(150g,1.498mol)和甲酸乙酯(111g,1.50mol)的澄清浅黄色溶液。在1小时内逐滴添加溶液,其导致气体逸出并逐渐放热至45℃。然后将所得的浓稠白色悬浮液加热至65℃持续2小
时,并且然后使其冷却至室温。将混合物在室温下继续搅拌过夜(约10小时)。将反应混合物在氮气流下通过玻璃料布氏漏斗(中等孔隙度)真空过滤。将滤饼用庚烷(2x250ml)置换洗涤并抽吸几分钟。将略带庚烷的湿滤饼转移到玻璃托盘中,并且在真空烘箱中于45℃下干燥15小时,得到作为所需产物(e)-(2-氧代四氢吡喃-3-亚基)甲醇盐(钠盐)的白色固体(205g,1.36mol,91%产率)。
[1221]
步骤2:3-亚甲基四氢吡喃-2-酮
[1222][1223]
使5l、3颈圆底烧瓶配备有机械搅拌器、加热套、加料漏斗、j-kem温度探针/控制器和氮气入口/出口。在氮气气氛下,向容器中装入(e)-(2-氧代四氢吡喃-3-亚基)甲醇盐(钠盐)(205g,1.366mol)(205g,1.366mol)和四氢呋喃(1640ml),得到白色悬浮液。开始搅拌,并记录锅温为19℃。然后向容器中装入多聚甲醛(136.6g,4.549mol),其以固体形式整份添加。将所得悬浮液加热至63℃,并将条件保持15小时。在加热后,反应混合物变成略带明胶状。将白色明胶状混合物减压浓缩以去除大部分四氢呋喃。将剩余残留物在分液漏斗中用乙酸乙酯(1000ml)、饱和氯化钠(500ml)和饱和碳酸钠(500ml)分配。移除有机物,并用乙酸乙酯(5x300ml)萃取残余水。将合并的有机物经硫酸钠(500g)干燥,并且然后通过带有20mm硅藻土层的玻璃料布氏漏斗真空过滤。将滤饼用乙酸乙酯(250ml)置换洗涤。将澄清滤液减压浓缩,得到作为所需粗产物的澄清浅黄色油状物(135g)。材料通过硅胶柱快速色谱法(液体装载),用在1小时内100%己烷至60%乙酸乙酯/己烷的梯度洗脱进行纯化,收集到450ml级分。通过tlc分析在硅胶上用3:1己烷/乙酸乙酯洗脱来检测产物,并且在uv下可视化。将产物级分合并并且减压浓缩,得到作为所需产物3-亚甲基四氢吡喃-2-酮的澄清无色油状物(132g,1.18mol,72%产率,由nmr测定含有16重量%残留乙酸乙酯)。1h nmr(400mhz,二甲基亚砜-d6)δ6.18(q,j=1.9hz,1h),5.60(q,j=1.9hz,1h),4.40-4.26(m,2h),2.61(ddt,j=7.0,6.3,2.0hz,2h),1.90-1.75(m,2h)。
[1224]
步骤3:3-(2-甲基-2-硝基-丙基)四氢吡喃-2-酮
[1225][1226]
使5000ml、3颈圆底烧瓶配备有机械搅拌器、用作二级防护的冷却浴、j-kem温度探针、加料漏斗和氮气入口/出口。在氮气气氛下,向容器中装入2-硝基丙烷(104.9g,1.177mol)。开始搅拌,并记录锅温为19℃。然后向容器中装入整份添加的纯1,8-二氮杂双环[5.4.0]十一碳-7-烯(22.41g,147.2mmol),得到澄清浅黄色溶液。未观察到放热。向加料漏斗中装入3-亚甲基四氢吡喃-2-酮(110g,981.0mmol)于乙腈(1100ml)中的溶液,在1小时内逐滴添加,得到澄清浅黄色溶液和逐渐放热至24℃。将反应混合物在室温下继续搅拌3.5小时,并且然后减压浓缩。将剩余的残留物溶解于二氯甲烷(1000ml)中,并用500ml的1摩尔柠檬酸溶液/饱和氯化钠溶液的3:2混合物分配。所得有机相为澄清浅蓝色溶液,并且水相为略浑浊的极淡蓝色溶液。移除有机物,并用二氯甲烷(300ml)萃取残余水溶液。将合并的有机物用饱和氯化钠溶液(300ml)洗涤,经硫酸钠(250g)干燥,并且然后通过玻璃料布氏漏
二甲基-吡咯烷-2-酮(100g,566.5mmol),得到呈灰白色固体状的(3s)-3-(3-羟丙基)-5,5-二甲基-吡咯啶-2-酮(47g,48%)作为洗脱的第一对映异构体。1h nmr(400mhz,二甲基亚砜-d6)δ7.63(s,1h),4.38(t,j=5.1hz,1h),3.39(t,j=5.6hz,2h),2.37(ddt,j=13.9,9.6,4.4hz,1h),2.02(dd,j=12.3,8.6hz,1h),1.78-1.64(m,1h),1.42(td,j=12.8,12.3,8.4hz,3h),1.16(d,j=17.9hz,7h)。esi-ms m/z计算值171.12593,实验值172.0(m 1)
;保留时间:0.61min(lc方法a)。
[1233]
步骤6:3-[(3s)-5,5-二甲基吡咯烷-3-基]丙-1-醇
[1234][1235]
使5l、3颈圆底烧瓶配备有机械搅拌器、加热套、加料漏斗、j-kem温度探针/控制器和氮气入口/出口。在氮气气氛下,向容器中装入氢化铝锂粒料(46.53g,1.226mol)。然后向容器中装入四氢呋喃(500ml,20ml/g)。开始搅拌,并记录锅温为20℃。使混合物在室温下搅拌0.5小时以允许粒料溶解。记录所得灰色悬浮液的锅温为24℃。向加料漏斗中装入(3s)-3-(3-羟丙基)-5,5-二甲基-吡咯烷-2-酮(60g,350.4mmol)于四氢呋喃(600ml)中的溶液,并且在90分钟内逐滴添加澄清浅黄色溶液。需要略微加热以进入溶液中。在完成添加后,记录所得灰色悬浮液的锅温为24℃。然后将混合物加热到65℃的锅温,并将条件保持72小时。此时,对反应混合物的分析表明,仍然保留一些残余的起始物质,并且产物形成没有变化。随后,反应在此时停止。移除加热套,并且使容器配备有冷却浴。将悬浮液用碎冰/水冷却浴冷却至0℃,并且然后通过极缓慢逐滴添加水(46.53ml),随后添加15重量%的氢氧化钠溶液(46.53ml),最后用水(139.59ml)淬灭。记录所得白色悬浮液的锅温为5℃。移除冷却浴,并且再次使容器配备有加热套。将悬浮液温热至60℃,并将条件保持30分钟。将热悬浮液通过带有25mm硅藻土层的玻璃料布氏漏斗进行真空过滤。然后将滤饼用60℃四氢呋喃(2x350ml)置换洗涤,并且然后抽吸30分钟。将澄清滤液减压浓缩,得到(55g,0.349mol,99%产率)作为所需产物3-[(3s)-5,5-二甲基吡咯烷-3-基]丙-1-醇的澄清浅黄色粘性油状物(55g,100%)。1h nmr(400mhz,二甲基亚砜-d6)δ3.36(t,j=6.3hz,3h),2.95(dd,j=10.6,7.6hz,1h),2.40(dd,j=10.6,7.7hz,1h),2.12-1.97(m,1h),1.69(dd,j=12.1,8.2hz,1h),1.47-1.25(m,5h),1.08(s,3h),1.02(s,3h)。
[1236]
步骤7:(4s)-4-(3-羟丙基)-2,2-二甲基-吡咯烷-1-甲酸叔丁酯
[1237][1238]
使1l、3颈圆底烧瓶配备有机械搅拌器、冷却浴、加料漏斗、j-kem温度探针和氮气入口/出口。在氮气气氛下,向容器中装入3-[(3s)-5,5-二甲基吡咯烷-3-基]丙-1-醇(25g,159.0mmol)和二氯甲烷(250ml),得到澄清浅黄色溶液。开始搅拌,并记录锅温为19℃。向冷却浴中装入碎冰/水并将锅温降低至0℃。向加料漏斗中装入三乙胺(22.16ml,159.0mmol),随后在5分钟内逐滴添加纯品。未观察到放热。然后向加料漏斗中装入溶解于二氯甲烷(150ml)中的二碳酸二叔丁酯(31.32g,143.5mmol)。然后在30分钟内逐滴添加澄清浅黄色
溶液,从而导致缓慢气体逸出。未观察到放热。移除冷却浴,并且使所得的澄清浅黄色溶液温热至室温,并在室温下继续搅拌3小时。将反应混合物转移到分液漏斗中并用水(75ml)分配。将有机物移除并用饱和氯化钠溶液(75ml)洗涤,经硫酸钠(150g)干燥,并且然后通过玻璃料布氏漏斗过滤。将滤液减压浓缩,得到(45g)作为所需粗产物的澄清浅黄色油状物。该材料通过硅胶柱快速色谱法(液体负载用二氯甲烷进行),在60分钟内用100%二氯甲烷至10%甲醇/二氯甲烷的梯度洗脱进行纯化,从而收集50ml级分。将所需产物级分合并并减压浓缩,得到(4s)-4-(3-羟丙基)-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(39g,95%)。1h nmr(400mhz,二甲基亚砜-d6)δ4.35(t,j=5.2hz,1h),3.54(dt,j=12.2,6.3hz,1h),3.38(t,j=5.8hz,2h),2.76(q,j=10.2hz,1h),1.47(s,3h),1.44-1.28(m,18h),1.24(s,3h)。esi-ms m/z计算值257.1991,实验值258.1(m 1)
;保留时间:1.55分钟(lc方法a)。
[1239]
实施例4:(4s)-2,2-二甲基-4-[3-[(6-氨磺酰基-2-吡啶基)氨基]丙基]吡咯烷-1-甲酸叔丁酯的制备
[1240][1241]
步骤1:4-(3-羟丙基)-2,2-二甲基-吡咯烷-1-甲酸叔丁酯
[1242][1243]
使1l、3颈圆底烧瓶配备有机械搅拌器、冷却浴、加料漏斗、j-kem温度探针和氮气入口/出口。在氮气气氛下,向容器中装入3-(5,5-二甲基吡咯烷-3-基)丙-1-醇(15g,95.39mmol)和二氯甲烷(225ml,15ml/g),得到澄清浅黄色溶液。开始搅拌,并记录锅温为19℃。向冷却浴中装入碎冰/水并将锅温降低至0℃。向加料漏斗中装入三乙胺(12.55g,124.0mmol),随后在5分钟内逐滴添加纯品。未观察到放热。然后向加料漏斗中装入溶解于二氯甲烷(225ml)中的二碳酸二叔丁酯(22.89g,104.9mmol)。然后在30分钟内逐滴添加澄清浅黄色溶液,从而导致缓慢气体逸出。未观察到放热。移除冷却浴,并且使所得的澄清浅黄色溶液温热至室温,并在室温下继续搅拌3小时。将反应混合物转移到分液漏斗中并用水(75ml)分配。将有机物移除并用饱和氯化钠溶液(75ml)洗涤,经硫酸钠(150g)干燥,并且然后通过玻璃料布氏漏斗过滤。将滤液减压浓缩,得到(30g)作为所需粗产物的澄清浅黄色油状物。该材料通过硅胶柱快速色谱法(液体负载用二氯甲烷进行),在60分钟内用100%二氯甲烷至10%甲醇/二氯甲烷的梯度洗脱进行纯化,从而收集50ml级分。将所需产物级分合并并减压浓缩,得到呈澄清浅黄色粘性油状物的4-(3-羟丙基)-2,2-二甲基-吡咯烷-1-甲酸
100%乙酸乙酯/己烷洗脱来纯化不纯级分,总共得到2,2-二甲基-4-[3-[(6-亚氨基甲酰基-2-吡啶基)氨基]丙基]吡咯烷-1-甲酸叔丁酯(10.0g,69%)。1h nmr(400mhz,二甲基亚砜-d6)δ7.52(dd,j=8.5,7.2hz,1h),7.07(s,2h),6.95(dd,j=7.2,0.7hz,2h),6.61(d,j=8.5hz,1h),3.55(q,j=9.1hz,1h),3.32-3.24(m,2h),2.79(q,j=10.0hz,1h),2.13(d,j=16.1hz,1h),1.96-1.82(m,1h),1.51(dt,j=18.0,9.3hz,2h),1.37(dd,j=12.9,10.6hz,15h),1.24(s,3h)。esi-ms m/z计算值412.21442,实验值413.1(m 1)
;保留时间:2.34min(lc方法k)。
[1253]
步骤5:(4s)-2,2-二甲基-4-[3-[(6-氨磺酰基-2-吡啶基)氨基]丙基]吡咯烷-1-甲酸叔丁酯
[1254][1255]
通过sfc色谱法,使用使用chiralpak ig(250x21.2mm柱,5μm粒度)和40%甲醇/60%二氧化碳流动相,以70ml/min在11.0分钟内(进样体积=500μl的32mg/ml于甲醇中的溶液)对外消旋2,2-二甲基-4-[3-[(6-氨磺酰基-2-吡啶基)氨基]丙基]吡咯烷-1-甲酸叔丁酯(7g,16.97mmol)进行手性分离,得到作为第一个洗脱峰的(4s)-2,2-二甲基-4-[3-[(6-氨磺酰基-2-吡啶基)氨基]丙基]吡咯烷-1-甲酸叔丁酯(3.4481g,99%)。esi-ms m/z计算值412.21442,实验值413.2(m 1)
;保留时间0.63分钟(lc方法j)。
[1256]
实施例5:3-二乙氧基磷酰基-1-[(4-甲氧基苯基)甲基]-5,5-二甲基-吡咯烷-2-酮的制备
[1257][1258]
步骤1:1-[(4-甲氧基苯基)甲基]-5,5-二甲基-吡咯烷-2-酮
[1259][1260]
反应分两批进行。
[1261]
批次1:将5,5-二甲基吡咯烷-2-酮(121g,1.069mol)于dmf(1.8l)中的溶液在冰水浴中冷却至3℃,然后在大约三十分钟时间内分批添加含60%nah的矿物油(64.150g,1.604mol)。将混合物在冰水浴中再搅拌三十分钟,然后在室温下搅拌1.5小时。将所得灰白色浆液在冰水浴中再次冷却至3℃,然后添加1-(氯甲基)-4-甲氧基-苯(251.19g,1.604mol)。在添加后移除冰水浴,并将混合物搅拌过夜。用水(100ml)小心地淬灭反应混合
物,并储存在冰箱中过夜。在后处理和纯化之前,将混合物与第二批材料合并。
[1262]
批次2:将5,5-二甲基吡咯烷-2-酮(484g,4.277mol)于dmf(7.2l)中的溶液在20l夹套反应器中冷却至3℃,然后在四小时内分批添加含60%nah的矿物油(256.61g,6.416mol)。将所得混合物在3℃下再搅拌一小时,然后在室温下搅拌两小时。将所得浆液再次冷却至3℃,然后添加1-(氯甲基)-4-甲氧基-苯(1.0048kg,6.416mol)。在添加完成后停用冷却系统,并且将所得浆液搅拌过夜,同时使其温热至室温。用水(500ml)小心地淬灭反应混合物,与批次1反应混合物合并,并分成两等份。每个部分按以下方式处理:将其用饱和氯化铵(10l)稀释,然后用乙酸乙酯(4x2l)萃取。丢弃水相,并且然后将合并的有机相用己烷(2l)稀释,并用饱和氯化铵(2x2l)萃取,然后用水(2l)萃取。丢弃水相,并将有机相经硫酸钠干燥。将来自两次后处理的合并的有机相真空浓缩,得到呈棕色油状物的粗1-[(4-甲氧基苯基)甲基]-5,5-二甲基-吡咯烷-2-酮(1.5kg)。将一千克粗产物通过硅胶色谱法(0-100%乙酸乙酯:己烷)纯化,得到呈黄色油状物的纯1-[(4-甲氧基苯基)甲基]-5,5-二甲基-吡咯烷-2-酮(608g,58%)。esi-ms m/z计算值233.1416,实验值234.3(m 1)
;保留时间:3.97分钟(lc方法c)。
[1263]
步骤2:3-二乙氧基磷酰基-1-[(4-甲氧基苯基)甲基]-5,5-二甲基-吡咯烷-2-酮
[1264][1265]
将二异丙胺(529.14g,732.88ml,5.23mol)于四氢呋喃(3.5l)中的溶液在干冰-丙酮浴中冷却至-75℃,然后以缓慢流添加正丁基锂(2.092l,2.5m于己烷中,5.2292mol)。在添加过程中将温度保持在-70℃以下。将所得黄色溶液搅拌三十分钟,然后以缓慢流添加1-[(4-甲氧基苯基)甲基]-5,5-二甲基-吡咯烷-2-酮(488g,2.0917mol)于四氢呋喃(1.5l)中的溶液,并且然后再搅拌一小时。在添加过程中,温度不得超过-70℃。将1-[氯(乙氧基)磷酰基]氧基乙烷(541.38g,451.15ml,3.1376mol)逐滴添加到反应混合物中,确保在添加过程中温度保持在-70℃以下。将所得混合物搅拌十六小时,同时使其解冻至室温。然后将反应物用1m盐酸(3l)淬灭,并用乙酸乙酯(2x2.4l)萃取。丢弃水相,并且用水(3x2.4l)萃取合并的有机相。丢弃水相,并将有机相经硫酸钠干燥,并且通过硅胶色谱法(0-100%乙酸乙酯/己烷)纯化,并且然后真空浓缩,得到3-二乙氧基磷酰基-1-[(4-甲氧基苯基)甲基]-5,5-二甲基-吡咯烷-2-酮(677g,81%)。esi-ms m/z计算值369.1705,实验值370.1(m 1)
;保留时间:4.2分钟(lc方法c)
[1266]
实施例6:3,3-二环丙基丙-1-醇的制备
[1267][1268]
步骤-1:(1-环丙基-2-甲氧基-乙烯基)环丙烷
[1269][1270]
使5000ml圆底烧瓶配备有机械搅拌器、用作二级防护的冷却浴、j-kem温度探针、加料漏斗、水冷却回流冷凝器和氮气入口/出口。在氮气气氛下,向容器中装入氯化(甲氧基甲基)三苯基鏻(97.3g,284mmol)和四氢呋喃(375ml),得到白色悬浮液。开始搅拌,并记录锅温为19℃。然后向容器中装入叔丁醇钾(31.85g,0.2838mol),其在10分钟内以固体形式分批添加,得到红橙色溶液并放热至21℃。将混合物在室温下继续搅拌30分钟。向加料漏斗中装入二环丙基酮(二环丙基甲酮)(25.0g,227.0mmol),随后在25分钟内逐滴添加纯品,导致逐渐放热至35℃。使所得红橙色溶液逐渐冷却至室温,并且然后在室温下继续搅拌4小时。然后用在25分钟内逐滴添加的冷水(375ml)淬灭反应物。将所得双相混合物转移到分液漏斗中并使其静置5分钟。将水沥干,并将剩余的有机物用饱和氯化钠溶液(375ml)洗涤。将有机物移除并减压浓缩,得到仍含有一些水的浅黄色油状物。将混合物用乙酸乙酯(500ml)稀释,并且然后转移到分液漏斗中并用水(150ml)分配。将有机物去除,经硫酸钠(150g)干燥并且然后通过玻璃料布氏漏斗过滤。将滤液减压浓缩,得到含有一些悬浮固体(氧化三苯膦)的浅黄色油状物。将混合物用己烷(500ml)稀释,并且然后通过带有40mm硅胶层的玻璃料布氏漏斗过滤。将滤饼用己烷(2x500ml)置换洗涤。将滤液减压浓缩,得到呈澄清浅黄色油状物的(1-环丙基-2-甲氧基-乙烯基)环丙烷(27g,0.1953mol,86%产率)。esi-ms m/z计算值138.10446,实验值138.0(m 1)
;保留时间1.73分钟(lc方法b)。
[1271]
步骤-2:2,2-二环丙基乙醛
[1272][1273]
向(1-环丙基-2-甲氧基-乙烯基)环丙烷(128g,709.4mmol)于四氢呋喃(700ml)中的溶液中添加盐酸水溶液(250ml,3m,750.0mmol),并且将混合物在环境温度下搅拌16小时,然后在55℃下搅拌4小时,并且然后使其在12小时内冷却到环境温度。将混合物用500ml盐水稀释,并分离水相。将水相用500ml mtbe萃取,并合并有机相。将有机相用500ml盐水洗涤,经硫酸镁干燥,过滤并真空浓缩。将所得油状物用250ml mtbe稀释,并使用分液漏斗去除残余水。将有机相经硫酸镁干燥,过滤并真空浓缩,得到呈浅橙色油状物的2,2-二环丙基乙醛(99.2g,96%)。1h nmr(400mhz,氯仿-d)δ9.74(d,j=2.9hz,1h),1.06(td,j=8.9,2.9hz,1h),0.94-0.81(m,2h),0.64-0.49(m,4h),0.32-0.20(m,4h)。
[1274]
步骤-3:[(e)-1-环丙基-3-甲氧基-烯丙基]环丙烷
[1275][1276]
使5000ml圆底烧瓶配备有机械搅拌器、加热套、j-kem温度探针、加料漏斗、水冷却回流冷凝器和氮气入口/出口。在氮气气氛下,向容器中装入氯化(甲氧基甲基)三苯基鏻(116.8g,340.7mmol)和四氢呋喃(423ml),得到白色悬浮液。开始搅拌,并记录锅温为19℃。然后向容器中装入叔丁醇钾(38.22g,340.6mmol),其在30分钟内以固体形式分批添加(每10分钟每份添加12.74g),产生红橙色溶液并放热至40℃。将混合物在室温下继续搅拌30分钟。此时的锅温记录为36℃。然后向加料漏斗中装入2,2-二环丙基乙醛(47g,60%w/w,混有来自前一步骤的氧化三苯膦,227.1mmol),随后在25分钟内逐滴添加纯品,导致逐渐放热至47℃。使所得红橙色溶液逐渐冷却至室温,并且然后在室温下继续搅拌15小时。然后用冷水(1000ml)淬灭反应混合物(锅温=19℃),从而导致放热至22℃。将混合物继续搅拌10分钟。将所得双相混合物转移到分液漏斗中并使其静置5分钟。移除有机物,并用乙酸乙酯(2x300ml)萃取残余水溶液。将合并的有机层减压浓缩,得到仍含有一些水的深琥珀色油状物。将混合物用乙酸乙酯(500ml)稀释,并且然后转移到分液漏斗中并用水(150ml)分配。将有机物移除,用饱和氯化钠溶液(200ml)洗涤,经硫酸钠(200g)干燥,并且然后通过玻璃料布氏漏斗过滤。将滤液减压浓缩,得到含有一些悬浮固体(氧化三苯膦)的浅琥珀色油状物。将混合物用庚烷(500ml)稀释,并且然后使其在室温下静置30分钟。将悬浮液通过玻璃料布氏漏斗过滤,并将滤饼用庚烷(2x100ml)置换洗涤。将滤液减压浓缩至约200ml的体积。将浅琥珀色溶液在碎冰/水冷却浴中冷却至0℃,持续30分钟,在此期间,更多固体沉淀。将悬浮液通过玻璃料布氏漏斗过滤,并将滤饼用庚烷(2x50ml)置换洗涤。将滤液减压浓缩,得到[(e)-1-环丙基-3-甲氧基-烯丙基]环丙烷(30g,87%)。1h nmr(400mhz,氯仿-d)δ6.31(dd,j=12.7,1.1hz,1h),4.68(dd,j=12.7,7.6hz,1h),3.51(s,3h),0.77(qt,j=8.1,5.0hz,2h),0.54-0.32(m,2h),0.28-0.12(m,5h),0.08(ddd,j=9.3,5.3,4.1hz,2h)。
[1277]
步骤-4:3,3-二环丙基丙醛
[1278][1279]
向[(e)-1-环丙基-3-甲氧基-烯丙基]环丙烷(141g,555.7mmol)于四氢呋喃(500ml)中的溶液中添加盐酸水溶液(100ml,3m,300.0mmol),并将混合物升温至50℃,持续2小时。将混合物冷却至环境温度,并且真空移除四氢呋喃。将残留物用二氯甲烷(700ml)稀释,并且分离水相(轻微乳液)。将有机相用500ml盐水洗涤,经硫酸镁干燥并过滤。向滤液中添加mgcl2(50g,525.1mmol),并且将混合物在环境温度下搅拌12小时。浆液经硅藻土过滤(硅藻土变暗并且需要刮除)。滤液略微浑浊并用盐水洗涤,经硫酸镁干燥,过滤并浓缩,得到3,3-二环丙基丙醛(76.8g,100%),1h nmr(400mhz,氯仿-d)δ9.83(t,j=2.7hz,1h),2.71-2.39(m,2h),0.73(ddt,j=5.5,4.2,2.9hz,3h),0.56-0.47(m,2h),0.42(dddd,j=9.2,7.6,4.0,2.6hz,2h),0.28-0.21(m,2h),0.11-0.04(m,2h)。
[1280]
步骤-5:3,3-二环丙基丙-1-醇
[1281][1282]
向氢化铝锂(10.4g,266.9mmol)于四氢呋喃(500ml)中的浆液中逐滴添加3,3-二环丙基丙醛(76g,549.9mmol)于四氢呋喃(150ml)中的溶液,使其温和回流。将混合物在环境温度下搅拌2小时。将反应物用冰浴冷却,并且通过缓慢添加水(10.4ml,577.3mmol),随后添加氢氧化钠水溶液(10.4ml,4m,41.60mmol),然后添加水(31.2ml,1.732mol)淬灭。浆液经硅藻土过滤,用四氢呋喃洗涤并真空浓缩,得到3,3-二环丙基丙-1-醇(112g,73%),1h nmr(400mhz,氯仿-d)δ3.81(t,j=6.9hz,2h),1.76(q,j=6.9hz,2h),0.63(dtt,j=8.8,8.0,5.1hz,2h),0.50-0.34(m,4h),0.27-0.14(m,3h),0.14-0.02(m,2h)。
[1283]
实施例7:4-苄氧基-6-氟-吡啶-2-磺酰胺的制备
[1284][1285]
步骤1:4-苄氧基-2-氯-6-氟-吡啶
[1286][1287]
向2-氯-6-氟-吡啶-4-醇(4.62g,31.315mmol)于乙腈(90ml)中的溶液中添加碳酸铯(15.3g,46.959mmol)和苄基溴(4.1ml,34.472mmol)。将反应物在室温下搅拌过夜。将溶液溶解于乙酸乙酯(350ml)和水(100ml)中。移除水相,并将有机相用水(100ml)和盐水(75ml)洗涤。有机相经硫酸钠干燥,过滤并浓缩。通过硅胶色谱法,用0%至10%乙酸乙酯/己烷的梯度洗脱来纯化粗产物,得到呈白色固体状的4-苄氧基-2-氯-6-氟-吡啶(7.01g,94%)。esi-ms m/z计算值237.0357,实验值238.1(m 1)
;保留时间:2.38分钟(lc方法n)。
[1288]
步骤2:3-[(4-苄氧基-6-氟-2-吡啶基)硫基]丙酸2-乙基己酯
[1289]
[1290]
将4-苄氧基-2-氯-6-氟-吡啶(6.77g,28.486mmol)和二异丙基乙胺(7.4200g,10ml,57.411mmol)于甲苯(250ml)中的溶液通过鼓泡氮气脱气5分钟。添加三(二亚芐基丙酮)二钯(0)(783mg,0.8551mmol)、xantphos(990mg,1.7110mmol)和3-硫基丙酸2-乙基己酯(6.5280g,6.8ml,29.896mmol),并且将混合物在125℃下加热过夜。将反应混合物减压浓缩。通过硅胶色谱法,使用0%-10%乙酸乙酯/庚烷的梯度来纯化残余物,得到呈橙色油状物的3-[(4-苄氧基-6-氟-2-吡啶基)硫基]丙酸2-乙基己酯(12.06g,定量产率)。1h nmr(300mhz,cdcl3)δ0.80-0.95(m,6h),1.19-1.43(m,8h),1.51-1.63(m,1h),2.77(t,j=7.0hz,2h),3.37(t,j=6.9hz,2h),4.02(dd,j=5.9,1.2hz,2h),5.07(s,2h),6.18(d,j=1.8hz,1h),6.65(d,j=1.2hz,1h),7.28-7.49(m,5h)。
19
f nmr(282mhz,cdcl3)δ-65.7(s,1f)。esi-ms m/z计算值419.193,实验值420.2(m 1)
;保留时间:2.8分钟(lc方法o)。
[1291]
步骤3:3-[(4-苄氧基-6-氟-2-吡啶基)磺酰基]丙酸2-乙基己酯
[1292][1293]
在0℃下,将间氯过苯甲酸(12.9g,57.561mmol)缓慢添加到3-[(4-苄氧基-6-氟-2-吡啶基)硫基]丙酸2-乙基己酯(12.06g,28.745mmol)于二氯甲烷(150ml)中的溶液中。将混合物在此温度下搅拌过夜。添加乙酸乙酯(150ml)并用饱和碳酸氢钠溶液(100ml)和0.5m氢氧化钠溶液(2x100ml)洗涤。有机相经无水硫酸钠干燥,过滤并减压浓缩,得到呈无色油状物的3-[(4-苄氧基-6-氟-2-吡啶基)磺酰基]丙酸2-乙基己酯(12.05g,93%)。esi-ms m/z计算值451.1829,实验值452.2(m 1)
;保留时间:2.54分钟(lc方法o)。
[1294]
步骤4:4-苄氧基-6-氟-吡啶-2-磺酰胺
[1295][1296]
向3-[(4-苄氧基-6-氟-2-吡啶基)磺酰基]丙酸2-乙基己酯(10.69g,23.674mmol)于二甲基亚砜(60ml)中的溶液中添加1,8-二氮杂双环[5.4.0]十一碳-7-烯(7.0700g,7ml,46.441mmol)。将反应物在室温下搅拌1小时,并且在10℃下添加羟胺-o-磺酸(13.3g,117.60mmol)和乙酸钠(7.7g,93.864mmol)于水(40ml)中的溶液。将反应物在室温下搅拌1小时,用水(300ml)稀释,并用乙酸乙酯(2x300ml)萃取。将合并的有机层用盐水(300ml)洗涤,经无水硫酸钠干燥,过滤并减压浓缩。用庚烷:乙酸乙酯9:1的混合物(100ml)研磨粗物质过夜。通过过滤分离产物。将产物再溶解于乙酸乙酯中,并且经硅胶垫过滤,用乙酸乙酯(500ml)洗脱并浓缩,得到4-苄氧基-6-氟-吡啶-2-磺酰胺(5.56g,83%)。1h nmr(300mhz,二甲基亚砜-d6)δ5.34(s,2h),7.15(d,j=2.1hz,1h),7.30-7.54(m,6h),7.62(s,2h)。
19
f nmr(282mhz,二甲基亚砜-d6)δ-66.0(s,1f)。esi-ms m/z计算值282.0474,实验值283.1(m 1)
;保留时间:1.75分钟(lc方法o)。
[1297]
实施例8:2,2-二甲基-4-[2-[(6-氨磺酰基-2-吡啶基)氨基]乙氧基]吡咯烷-1-甲酸叔丁酯的制备
[1298][1299]
步骤1:2,2-二甲基-4-氧代-吡咯烷-1-甲酸叔丁酯
[1300][1301]
将二碳酸二叔丁酯(22.9g,24.11ml,104.9mmol)添加到5,5-二甲基吡咯烷-3-酮(盐酸盐)(13.08g,87.42mmol)、三乙胺(17.71g,24.4ml,175.0mmol)和dmap(1.1g,9.004mmol)于二氯甲烷(325ml)中的溶液中,并将反应混合物在室温下搅拌过夜。将反应混合物用1n盐酸(300ml)洗涤,并将水层用二氯甲烷(2x250ml)萃取。将有机层合并,用5%碳酸氢钠(250ml)和盐水(150ml)洗涤,经硫酸钠干燥,过滤并减压浓缩,得到呈白色固体状的2,2-二甲基-4-氧代-吡咯啶-1-甲酸叔丁酯(18.5g,99%)。1h nmr(300mhz,cdcl3)δ1.33-1.66(m,15h),2.51(s,2h),3.85(br.s.,2h)。esi-ms m/z计算值213.27,实验值158.2(m-c4h8)
;比率时间:1.91分钟(lc方法o)。
[1302]
步骤2:4-羟基-2,2-二甲基-吡咯烷-1-甲酸叔丁酯
[1303][1304]
将2,2-二甲基-4-氧代-吡咯烷-1-甲酸叔丁酯(150mg,0.7033mmol)溶解于无水甲醇(2.5ml)中并在冰浴中冷却。小心地添加nabh4(30mg,0.7930mmol),并将反应混合物在0℃下搅拌1.5小时。将反应混合物用水(25ml)和1m盐酸水溶液(0.5ml)稀释。将水层用乙酸乙酯(2x25ml)萃取,并将有机层合并,用盐水(10ml)洗涤,用硫酸钠干燥,过滤并真空浓缩,得到直接用于后续步骤的4-羟基-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(150mg,99%)。esi-ms m/z计算值215.15215,实验值216.2(m 1)
;保留时间:0.48分钟(lc方法j)。
[1305]
步骤3:4-(2-羟基乙氧基)-2,2-二甲基-吡咯烷-1-甲酸叔丁酯
[1306][1307]
在250ml烧瓶中,将4-羟基-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(3g,13.93mmol)在0℃下溶解于n,n-二甲基甲酰胺(15ml)中,并且小心地添加氢化钠(1.8g,60%w/w于矿物油中,45.00mmol)。将混合物在0℃下搅拌15分钟,并且然后在0℃下逐滴添加2-溴乙氧基-叔
丁基-二甲基-硅烷(9ml,41.95mmol),并将混合物升温至室温。将混合物搅拌16小时。然后将混合物冷却至0℃,用水淬灭并用乙醚萃取。将有机萃取物用水洗涤、干燥(硫酸钠)、过滤并真空浓缩。通过硅胶色谱法,用0-30%乙酸乙酯/己烷的梯度洗脱来纯化所得橙色油状物,得到叔丁基(二甲基)甲硅烷基保护的中间体,所述中间体溶解于四氢呋喃(20ml)中,用tbaf的四氢呋喃溶液(28ml,1m,28.00mmol)处理并在室温下搅拌2小时。浓缩混合物,并将残余物溶解于二氯甲烷中,用水洗涤,经硫酸钠干燥,过滤并真空蒸发。通过硅胶色谱法,用0-20%甲醇/二氯甲烷的梯度洗脱来纯化所得粗物质,得到4-(2-羟基乙氧基)-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(1.6g,44%产率)。1h nmr(400mhz,氯仿-d)δ3.97(d,j=4.0hz,1h),3.80-3.34(m,6h),2.05(t,j=6.1hz,1h),1.97(d,j=16.4hz,2h),1.52-1.30(m,15h)。esi-ms m/z计算值259.17834,实验值260.17(m 1)
;保留时间:0.55分钟(lc方法j)。
[1308]
步骤4:4-(2-叠氮基乙氧基)-2,2-二甲基-吡咯烷-1-甲酸叔丁酯
[1309][1310]
在0℃下,向4-(2-羟基乙氧基)-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(1.6g,6.169mmol)于二氯甲烷(20ml)中的溶液中添加三乙胺(5.2ml,37.31mmol),随后添加甲磺酰氯(1.4ml,18.09mmol)。将反应混合物在室温下搅拌20小时。将反应混合物用冰水和二氯甲烷淬灭,并且分离所得层,并且有机层经硫酸钠干燥,过滤并真空浓缩,得到粗甲磺酸盐,其与叠氮化钠(1.2g,18.46mmol)合并于n,n-二甲基甲酰胺(10ml)中,并将混合物在50℃下搅拌2小时。将反应物用水淬灭,并用乙醚萃取。有机萃取物经硫酸钠干燥,真空蒸发,并且通过硅胶色谱法,用0-50%乙酸乙酯/己烷的梯度洗脱来纯化残余物,得到4-(2-叠氮基乙氧基)-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(1.33g,76%)。1h nmr(400mhz,氯仿-d)δ3.96(q,j=4.6hz,1h),3.69-3.31(m,6h),2.06-1.91(m,2h),1.53-1.32(m,15h)。
[1311]
步骤5:4-(2-氨基乙氧基)-2,2-二甲基-吡咯烷-1-甲酸叔丁酯
[1312][1313]
向4-(2-叠氮基乙氧基)-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(1.33g,4.677mmol)于甲醇(20ml)中的溶液中添加钯/碳(500mg,10%w/w,0.470mmol)。将混合物用氢气饱和,并在室温下搅拌,同时将氢气吹扫穿过反应混合物,持续2小时。将混合物过滤并真空蒸发,得到4-(2-氨基乙氧基)-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(1.188g,98%)。1h nmr(400mhz,氯仿-d)δ4.00-3.87(m,1h),3.69-3.35(m,4h),2.94-2.71(m,2h),2.07-1.83(m,2h),1.47(q,j=9.4,8.4hz,15h)。
[1314]
步骤6:2,2-二甲基-4-[2-[(6-氨磺酰基-2-吡啶基)氨基]乙氧基]吡咯烷-1-甲酸叔丁酯
[1315][1316]
在密封的20ml微波小瓶中,在150℃下,将4-(2-氨基乙氧基)-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(1.188g,4.598mmol)、6-氟吡啶-2-磺酰胺(810mg,4.598mmol)和二异丙基乙胺(4ml,22.96mmol)于n-buoh(10ml)中的溶液搅拌16小时。在真空中移除溶剂,并将残余物溶解于二氯甲烷中并用水洗涤。有机萃取物经硫酸钠干燥,蒸发并通过硅胶色谱,用0-40%乙酸乙酯/己烷的梯度洗脱来纯化,得到2,2-二甲基-4-[2-[(6-氨磺酰基-2-吡啶基)氨基]乙氧基]吡咯烷-1-甲酸叔丁酯(1.500g,66%)。esi-ms m/z计算值414.1937,实验值415.3(m 1)
;保留时间:0.61分钟(lc方法j)。
[1317]
实施例9:(4s)-2,2-二甲基-4-[3-(2-吡啶基)-3-[(6-氨磺酰基-2-吡啶基)氨基]丙基]吡咯烷-1-甲酸叔丁酯的制备
[1318][1319]
步骤1:(4s)-2,2-二甲基-4-(3-氧代丙基)吡咯烷-1-甲酸叔丁酯
[1320][1321]
通过将碳酸氢钠(5.61g,66.78mmol)溶解于次氯酸钠(1.47m于水中)(87ml,127.89mmol)中来制备漂白剂的缓冲溶液,并且将该溶液在冰浴中冷却。然后将溶液逐滴添加到机械搅拌的第二溶液中,所述溶液预先通过将溴化钠(640mg,6.22mmol)(溶解于水(3.6ml)中)以及接着tempo(42mg,0.2688mmol)添加到维持在-13℃下的含(4s)-4-(3-羟丙基)-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(30g,116.56mmol)的dcm(400ml)中来制备。在将缓冲的漂白剂溶液添加到底物溶液中期间,内部温度维持在-10℃以下,并且在添加完成之后,将反应混合物在-14℃下维持15分钟。然后将过量的漂白剂用乙醇(3ml,51.38mmol)淬灭。将反应混合物在25℃下减压浓缩。将所得残余物在乙酸乙酯(300ml)和水(100ml)之间
分配。将水相分离并用乙酸乙酯(100ml)洗涤。将有机物合并,用盐水(50ml)洗涤,用硫酸钠干燥,过滤并减压浓缩,得到呈澄清油状物的纯(4s)-2,2-二甲基-4-(3-氧代丙基)吡咯烷-1-甲酸叔丁酯(27.9g,89%);1h nmr(400mhz,cdcl3)δ9.78(s,1h),3.81-3.57(m,1h),2.99-2.81(m,1h),2.46(t,j=6.8hz,2h),2.19-2.04(m,1h),1.89(td,j=12.2,5.9hz,1h),1.75-1.60(m,2h),1.59-1.21(m,16h)。esi-ms m/z计算值255.1834,实验值200.2(m-99)
;保留时间:1.86分钟(lc方法e)。
[1322]
步骤2:(4s)-4-[(3e)-3-[(s)-叔丁基亚磺酰基]亚氨基丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯
[1323][1324]
将(4s)-2,2-二甲基-4-(3-氧代丙基)吡咯烷-1-甲酸叔丁酯(12.02g,44.72mmol)溶解于dcm(170ml)中。依序添加(s)-2-甲基丙烷-2-亚磺酰胺(11.10g,89.75mmol)、硫酸镁(32.96g,272.46mmol)和对甲苯磺酸吡啶鎓(6.93g,27.02mmol)。将混合物在氮气下在室温下剧烈搅拌18小时,通过硅藻土垫过滤,用dcm(2x250ml)洗涤。将合并的滤液真空浓缩。对粗产物(28.57g,黄白色固体)进行快速色谱(预吸附到sio2上)(330g sio2,在65分钟内用0至30%etoac/己烷洗脱)。收集适当的级分并真空浓缩。(4s)-4-[(3e)-3-[(s)-叔丁基亚磺酰基]亚氨基丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(14.8g,88%)。esi-ms m/z计算值358.229,实验值359.6(m 1)
;保留时间:3.23分钟(lc方法b)。
[1325]
步骤3:(4s)-4-[3-[[(s)-叔丁基亚磺酰基]氨基]-3-(2-吡啶基)丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯
[1326][1327]-78℃下在氮气下,在剧烈搅拌下,向2-溴吡啶(3.81g,2.3ml,24.12mmol)于无水thf(72ml)中的混合物中逐滴添加正丁基锂(9.5ml,2.5m于己烷中,23.750mmol)。将混合物在-78℃下剧烈搅拌0.5小时,并且逐滴添加(4s)-4-[(3e)-3-[(s)-叔丁基亚磺酰基]亚氨基丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(4.50g,11.923mmol)于无水thf(20ml)中的溶液。将反应物在-78℃下搅拌30分钟。将反应物用饱和nh4cl水溶液(200ml)淬灭,并且使反应物升温至室温。添加h2o(200ml)并用etoac(3x250ml)萃取混合物。将合并的有机层用饱和nacl水溶液(200ml)洗涤,经无水硫酸钠干燥,过滤并真空浓缩,得到呈橙色泡沫油状物的粗物质。(4s)-4-[3-[[(s)-叔丁基亚磺酰基]氨基]-3-(2-吡啶基)丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(6.1350g,106%)。esi-ms m/z计算值437.2712,实验值438.0(m 1)
;
保留时间:2.42分钟(lc方法b)。
[1328]
步骤4:(4s)-4-[3-氨基-3-(2-吡啶基)丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯
[1329][1330]
将(4s)-4-[3-[[(s)-叔丁基亚磺酰基]氨基]-3-(2-吡啶基)丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(13.5g,26.22mmol)溶解于thf(180ml)和水(36ml)中。添加分子碘(2g,7.88mmol)。将混合物在35℃下搅拌16小时。然后将其冷却至室温,并使其在etoac(300ml)和含na2s2o3(50g)的饱和碳酸氢钠水溶液(300ml)之间分配。分离各层,并将水层用etoac(200ml)萃取一次。浓缩有机层,并将残余物溶解于1m hcl(500ml)中,并用乙醚(300ml)萃取。将水层通过2.5m naoh碱化并用etoac(2x300ml)萃取。将有机层用盐水洗涤,经无水na2so4干燥,过滤并浓缩,得到(4s)-4-[3-氨基-3-(2-吡啶基)丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(8.5g,92%)。esi-ms m/z计算值333.2416,实验值334.6(m 1)
;保留时间:2.55分钟(lc方法b)。
[1331]
步骤5:(4s)-2,2-二甲基-4-[3-(2-吡啶基)-3-[(6-氨磺酰基-2-吡啶基)氨基]丙基]吡咯烷-1-甲酸叔丁酯
[1332][1333]
向(4s)-4-[3-氨基-3-(2-吡啶基)丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(8.5g,24.215mmol)和6-氟吡啶-2-磺酰胺(8g,43.140mmol)于dmso(22ml)中的混合物中添加diea(12ml,68.893mmol)。将混合物在115℃下搅拌20小时。然后使其冷却至室温,并在etoac(300ml)和饱和碳酸氢钠(300ml)之间分配。用更多etoac(300ml)萃取水层。将合并的etoac溶液用盐水(2x500ml)洗涤,经无水na2so4干燥,过滤并浓缩。通过硅胶色谱法,使用5%-100%etoac/己烷来纯化残余物,得到呈固体状的(4s)-2,2-二甲基-4-[3-(2-吡啶基)-3-[(6-氨磺酰基-2-吡啶基)氨基]丙基]吡咯烷-1-甲酸叔丁酯(10.41g,83%)。1h nmr(500mhz,dmso-d6)δ8.54(d,j=4.6hz,1h),7.72(td,j=7.7,7.6,1.8hz,1h),7.57
–
7.42(m,3h),7.28
–
7.20(m,1h),7.06(s,2h),6.96(d,j=7.2hz,1h),6.76
–
6.68(m,1h),5.19(s,1h),3.58
–
3.48(m,1h),2.83
–
2.69(m,1h),2.14
–
2.02(m,1h),1.95
–
1.78(m,3h),1.42
–
1.30(m,15h),1.22(s,3h)。esi-ms m/z计算值489.241,实验值490.3(m 1) ;保留时间:1.82分钟(lc方法h)。
[1334]
实施例10:(14s,17r)-8-溴-12,12-二甲基-17-(吡啶-2-基)-2λ
6-硫杂-3,9,11,
18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮,化合物246(极性较小的异构体),和(14s,17s)-8-溴-12,12-二甲基-17-(吡啶-2-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮,化合物247(极性较大的异构体)的制备
[1335][1336]
步骤1:(4s)-4-[3-[[6-[(6-溴-2-氯-吡啶-3-羰基)氨磺酰基]-2-吡啶基]氨基]-3-(2-吡啶基)丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯
[1337][1338]
将6-溴-2-氯-吡啶-3-甲酸(2.9g,12.26mmol)和cdi(2.0g,12.33mmol)溶解于thf(18ml)中,并且将混合物在60℃下搅拌45分钟,然后添加(4s)-2,2-二甲基-4-[3-(2-吡啶基)-3-[(6-氨磺酰基-2-吡啶基)氨基]丙基]吡咯烷-1-甲酸叔丁酯(3000mg,6.127mmol),随后添加dbu(4.12ml,27.55mmol),并且将所得混合物在室温下搅拌2小时。将混合物用etoac稀释,并用1n hcl水溶液、水、盐水洗涤,干燥(mgso4),并浓缩。将残余物纯化(快速色谱法:80g sio2,50%-100%etoac/己烷),得到所需产物(4s)-4-[3-[[6-[(6-溴-2-氯-吡啶-3-羰基)氨磺酰基]-2-吡啶基]氨基]-3-(2-吡啶基)丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(4.11g,95%)。esi-ms m/z计算值706.134,实验值706.9(m 1)
;保留时间:0.59分钟(lc方法i)。
[1339]
步骤2:6-溴-2-氯-n-[[6-[[3-[(3r)-5,5-二甲基吡咯烷-3-基]-1-(2-吡啶基)丙基]氨基]-2-吡啶基]磺酰基]吡啶-3-甲酰胺
[1340][1341]
向(4s)-4-[3-[[6-[(6-溴-2-氯-吡啶-3-羰基)氨磺酰基]-2-吡啶基]氨基]-3-(2-吡啶基)丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(1123mg,1.586mmol)于dcm(7.9ml)中的溶液中添加tfa(3.7ml,48.03mmol),并且将混合物在室温下搅拌1小时。将溶液减压浓缩至干燥,然后与甲苯(2x5ml)共蒸发,然后在高真空下在室温下干燥16小时,得到6-溴-2-氯-n-[[6-[[3-[(3r)-5,5-二甲基吡咯烷-3-基]-1-(2-吡啶基)丙基]氨基]-2-吡啶基]磺酰基]吡啶-3-甲酰胺(三氟乙酸盐)(1600mg,106%)。1h nmr(500mhz,dmso-d6)δ8.68(s,1h),8.63(d,j=5.3hz,1h),8.02(t,j=7.8hz,1h),7.91(s,1h),7.80(s,2h),7.73-7.65(m,2h),7.51(t,j=6.5hz,1h),6.93(d,j=8.5hz,1h),5.07(s,1h),3.44-3.32(m,1h),2.82(ddt,j=17.9,11.4,6.1hz,1h),2.39(dt,j=9.8,6.1hz,1h),2.04-1.81(m,3h),1.63-1.39(m,2h),1.36(d,j=4.3hz,4h),1.27(d,j=2.8hz,3h)。esi-ms m/z计算值606.08154,实验值607.0(m 1)
;保留时间:0.3分钟(lc方法d)。
[1342]
步骤3:(14s,17r)-8-溴-12,12-二甲基-17-(吡啶-2-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮,化合物246(极性较小的异构体),和(14s,17s)-8-溴-12,12-二甲基-17-(吡啶-2-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮,化合物247(极性较大的异构体)
[1343][1344]
将6-溴-2-氯-n-[[6-[[3-[(3r)-5,5-二甲基吡咯烷-3-基]-1-(2-吡啶基)丙基]氨基]-2-吡啶基]磺酰基]吡啶-3-甲酰胺(三氟乙酸盐)(3.62g,3.810mmol)和碳酸钾(2.63g,19.03mmol)于在dma(38ml)中的混合物在140℃下加热5小时,通过冰浴冷却,添加38ml水,并且然后添加38ml的1m hcl,使混合物《ph 2。向该泡沫混合物中添加10ml的1m碳酸氢钠,使大部分泡沫破裂并将混合物转化成ph 7。在搅拌下使混合物的温度升至室温后,泡沫状物已转化为棕褐色颗粒状固体。通过过滤收集固体并且在抽吸下干燥,得到700mg的棕褐色固体。将滤液用etoac(4x120ml)萃取。产物保留在水层中,并且因此通过添加3ml的1m hcl将其转化为ph 4。然后将其用etoac(2x120ml)萃取。将合并的有机萃取物干燥(mgso4)并蒸发成油状物,将油状物转移到100ml烧瓶中并在50c/4托下旋转蒸发,得到1.7g
呈胶状物的产物。通过uplc获得的固体沉淀和胶状物均含有约1:1产物异构体混合物。在加热下,以100mg/ml的浓度将两种样品溶解于1:1acn/meoh中。这些溶液通过制备型sfc,通过21.2x250mm od-3柱、5μm颗粒和一系列333μl进样,用5mm nh3/甲醇至co2(在10分钟50%-80%)的梯度洗脱来纯化这些溶液,得到呈白色固体状的第一极性较小的异构体(14s,17r)-8-溴-12,12-二甲基-17-(吡啶-2-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮(546mg,25%)(在蒸发收集到的级份之后)。1h nmr(400mhz,氯仿-d)δ8.52(d,j=4.8hz,1h),7.66(t,j=7.6hz,1h),7.62(d,j=7.9hz,1h),7.57(t,j=7.8hz,1h),7.45(d,j=7.2hz,1h),7.33(d,j=7.8hz,1h),7.24-7.16(m,1h),6.77(d,j=7.9hz,1h),6.68(d,j=8.4hz,1h),5.62(d,j=8.7hz,1h),5.39(q,j=8.0hz,1h),3.45-3.33(m,1h),2.95(t,j=10.5hz,1h),2.56(s,1h),2.00(dd,j=12.2,6.8hz,1h),1.91(s,2h),1.62(s,3h),1.61-1.57(m,2h),1.56(s,3h),1.54-1.46(m,2h)。esi-ms m/z计算值570.10486,实验值572.8(m 3)
;保留时间:1.17分钟(lc方法a)。
[1345]
然后,洗脱得到极性较大的异构体:(14s,17s)-8-溴-12,12-二甲基-17-(吡啶-2-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮(830mg,38%)。1h nmr(400mhz,氯仿-d)δ8.58(s,1h),7.86(d,j=8.1hz,1h),7.71(t,j=7.7hz,1h),7.59(s,2h),7.30(d,j=7.9hz,1h),7.24(d,j=6.7hz,1h),7.00(s,1h),6.74(s,1h),6.63(s,1h),4.86(s,1h),3.63-3.53(m,1h),3.32-3.17(m,1h),2.42-2.25(m,2h),2.11-1.80(m,5h),1.72(t,j=12.0hz,1h),1.60(s,3h),1.53(s,3h)。esi-ms m/z计算值570.10486,实验值572.8(m 3)
;保留时间:1.14分钟(lc方法a)。
[1346]
实施例11:(14s)-8-叔丁基-17-(4-叔丁基吡啶-2-基)-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5(10),6,8,19(23),20-六烯-2,2,4-三酮,化合物76(非对映异构体1)和化合物75(非对映异构体2)的制备
[1347][1348]
步骤1:4-叔丁基-1-氧代-吡啶-1-鎓
[1349][1350]
在2l圆底烧瓶中,将4-叔丁基吡啶(73.030g,81ml,529.34mmol)添加到冰乙酸(600ml)中。接着,添加过氧化氢(30%于水中,450ml),并将反应混合物在空气下回流4小时。再添加过氧化氢(30%于水中,450ml),并继续回流过夜(16小时)。在旋转蒸发仪中移除溶剂,并将剩余溶液用饱和碳酸钠溶液中和,并且然后用二氯甲烷(2x500ml)加上氯仿/异丙醇混合物(3:1v:v,3x200ml)萃取。合并的有机物经mgso4干燥,过滤并浓缩,得到粗制的4-叔丁基-1-氧化-吡啶-1-鎓(89g,100%)。esi-ms m/z计算值151.0997,实验值152.4(m 1)
;保留时间:1.92分钟(lc方法b)。
[1351]
步骤2:4-叔丁基-2-氯-吡啶
[1352]
[1353]
将4-叔丁基-1-氧代-吡啶-1-鎓(50.6g,301.18mmol)置于反应烧瓶中,并在冰浴中冷却。将pocl3(250ml)缓慢添加到反应烧瓶中,以获得混合物。将混合物在回流下加热20小时。此后,将温度缓慢降低至20℃,通过真空蒸发从混合物中移除溶剂,添加碳酸钠水溶液用于中和,并且使用乙酸乙酯(2x800ml)萃取内容物。将有机层通过盐水洗涤,经硫酸钠干燥并浓缩。通过硅胶柱色谱法,使用0至30%乙酸乙酯/己烷来纯化粗残余物,得到呈琥珀色液体状的4-叔丁基-2-氯-吡啶(38.6g,72%)。1h nmr(500mhz,dmso-d6)δ8.32(dd,j=5.3,0.7hz,1h),7.48
–
7.40(m,2h),1.27(s,9h)。esi-ms m/z计算值169.0658,实验值170.3(m 1)
;保留时间:3.11分钟(lc方法b)。
[1354]
步骤3:2-溴-4-叔丁基-吡啶
[1355][1356]
将4-叔丁基-2-氯-吡啶(27.07g,151.58mmol)和三甲基溴硅烷(170.52g,150ml,1.092mol)于丙腈(450ml)中的溶液在回流下搅拌21小时。将反应烧瓶抽真空以移除溶剂,添加碳酸钠水溶液用于中和,并使用乙酸乙酯(2x800ml)萃取反应烧瓶中的内容物。将有机层通过盐水洗涤,经硫酸钠干燥并浓缩。通过硅胶柱色谱法,使用0%至30%乙酸乙酯/己烷来纯化粗残余物,得到呈琥珀色液体状的2-溴-4-叔丁基-吡啶(34.2g,100%)。1h nmr(500mhz,dmso-d6)δ8.29(d,j=5.3hz,1h),7.58(s,1h),7.46(dd,j=5.2,1.7hz,1h),1.27(s,9h)。esi-ms m/z计算值213.0153,实验值214.3(m 1)
;保留时间:5.01分钟(lc方法c)。
[1357]
步骤4:(4s)-4-[3-(4-叔丁基-2-吡啶基)-3-(叔丁基亚磺酰基氨基)丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯
[1358][1359]
将2-溴-4-叔丁基-吡啶(6g,26.623mmol)溶解于乙醚(60ml)中,并且将溶液在氮气气球下在干冰丙酮浴(《-70℃)中冷却。逐滴添加n-buli(12ml,2.5m于己烷中,30.00mmol)。将混合物在此温度下搅拌40分钟。添加(4s)-4-[(3z)-3-叔丁基亚磺酰基亚氨基丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(4.45g,11.79mmol)于thf(5ml)中的溶液。将混合物在-78℃至-40℃下搅拌45分钟。添加饱和nh4cl水溶液(80ml)。使混合物升温至室温,并在水(80ml)和etoac(100ml)之间分配。将该淬灭的混合物分成两层,并将水层用etoac(100ml)萃取一次。将合并的有机物用盐水洗涤,经无水na2so4干燥,过滤并浓缩。通过硅胶柱色谱法,使用0至20%乙酸乙酯/己烷来纯化残余物,得到(4s)-4-[3-(4-叔丁基-2-吡啶基)-3-(叔丁基亚磺酰基氨基)丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(4.87g,79%)。esi-ms m/z计算值493.3338,实验值494.6(m 1)
;保留时间:3.01分钟(lc方法b)。
[1360]
步骤5:(4s)-4-[3-氨基-3-(4-叔丁基-2-吡啶基)丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯
[1361][1362]
将(4s)-4-[3-(4-叔丁基-2-吡啶基)-3-(叔丁基亚磺酰基氨基)丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(4.87g,9.37mmol)溶解于thf(43ml)和水(8.3ml)中。添加分子碘(750mg,2.95mmol)。将混合物在52℃下搅拌3小时。然后将其冷却至室温,并使其在etoac(200ml)和含na2s2o3(60g)的饱和碳酸氢钠水溶液(200ml)之间分配。分离各层,并将水层用etoac(100ml)萃取一次。将有机层用盐水洗涤,经无水na2so4干燥,过滤并浓缩,得到(4s)-4-[3-氨基-3-(4-叔丁基-2-吡啶基)丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(3.9g,102%)。esi-ms m/z计算值389.3042,实验值390.7(m 1)
;保留时间:2.94分钟(lc方法b)。
[1363]
步骤6:(4s)-4-[3-(4-叔丁基-2-吡啶基)-3-[(6-氨磺酰基-2-吡啶基)氨基]丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯
[1364][1365]
向(4s)-4-[3-氨基-3-(4-叔丁基-2-吡啶基)丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(3.9g,9.510mmol)和6-氟吡啶-2-磺酰胺(3g,16.178mmol)于dmso(10ml)中的混合物中添加diea(5ml,28.706mmol)。将混合物在115℃下搅拌24小时。将反应混合物冷却至室温,并且然后用水(100ml)和etoac(100ml)稀释。分离各层,并将有机层用盐水(2x100ml)洗涤,经无水na2so4干燥,并浓缩。通过硅胶色谱法(120g柱),使用0-80%etoac/己烷来纯化残余物,得到呈浅色固体状的(4s)-4-[3-(4-叔丁基-2-吡啶基)-3-[(6-氨磺酰基-2-吡啶基)氨基]丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(3.66g,67%)。1h nmr(500mhz,dmso-d6)δ8.43(d,j=5.2hz,1h),7.55
–
7.48(m,2h),7.44(d,j=9.5hz,1h),7.24(dd,j=5.2,1.9hz,1h),7.07(s,2h),6.95(d,j=7.2hz,1h),6.73(d,j=8.5hz,1h),5.22(s,1h),3.57-3.43(m,1h),2.81-2.65(m,1h),2.10-2.01(m,1h),1.94
–
1.73(m,3h),1.48
–
1.35(m,11h),1.35-1.29(m,4h),1.26(s,9h),1.21(s,3h)。esi-ms m/z计算值545.3036,实验值546.1(m 1)
;保留时间:2.19分钟(lc方法h)。
[1366]
步骤7:6-叔丁基-2-氟-吡啶-3-甲酸
[1367][1368]
制备2-氟吡啶-3-甲酸(300g,2.126mol)、戊酸(651.5g,6.379mol)和硝酸银(54.2g,319.06mmol)于水(2.4l)中的浆液。在十分钟内逐滴添加硫酸(208.5g,113.32ml,2.126mol):内部温度升高至31℃。然后以足以将内部温度维持在45℃至51℃之间的速率逐滴添加过硫酸铵(970.4g,4.252mol)于水(2.4l)中的溶液。将反应混合物在室温下搅拌过夜,然后在冰水浴中冷却,并且使用naoh水溶液(50%w/v)将ph调节至3-4。将混合物用dcm(2.5l)稀释并通过硅藻土垫过滤。丢弃固体,并分离相:将水相用dcm(1.7l)萃取,并且然后丢弃。合并的有机相经硫酸钠干燥并真空浓缩,得到深色油状物,通过硅胶色谱法使用3%甲醇/二氯甲烷来纯化所述深色油状物,得到呈浅黄色固体状的6-叔丁基-2-氟-吡啶-3-甲酸(148g,34%)。1h nmr(500mhz,dmso-d6)δ8.33(dd,j=10.0,7.8hz,1h),7.49(dd,j=7.9,2.0hz,1h),1.30(s,9h)。esi-ms m/z计算值197.0852,实验值198.1(m 1)
;保留时间:1.92分钟(lc方法h)。
[1369]
步骤8:(4s)-4-[3-[[6-[(6-叔丁基-2-氟-吡啶-3-羰基)氨磺酰基]-2-吡啶基]氨基]-3-(4-叔丁基-2-吡啶基)丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯
[1370][1371]
在1-l圆底烧瓶中,将6-叔丁基-2-氟-吡啶-3-甲酸(13.8g,69.98mmol)溶解于thf(300ml)中,向其中添加cdi(11g,67.84mmol)。将所得混合物在室温下搅拌26小时。此后,添加(4s)-4-[3-(4-叔丁基-2-吡啶基)-3-[(6-氨磺酰基-2-吡啶基)氨基]丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(20.0g,35.04mmol)和dbu(22ml,147.1mmol),并将所得混合物在室温下搅拌24小时。此后,将混合物真空浓缩。然后,将混合物倒入乙酸乙酯(1l)中。然后将该混合物用饱和碳酸氢钠水溶液(500ml)、hcl水溶液(0.1n,500ml)和饱和氯化钠水溶液(500ml)洗涤,接着经硫酸钠干燥,过滤并真空蒸发。将所得棕色油状物通过硅胶塞(200g二氧化硅;用3:1乙酸乙酯:己烷洗脱)纯化,并且真空蒸发,得到米色泡沫状物:(4s)-4-[3-[[6-[(6-叔丁基-2-氟-吡啶-3-羰基)氨磺酰基]-2-吡啶基]氨基]-3-(4-叔丁基-2-吡啶基)丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(25.49g,100%)。esi-ms m/z计算值724.37823,实验值725.4(m 1)
;保留时间:1.89分钟(lc方法a)。
[1372]
步骤9:(14s)-8-叔丁基-17-(4-叔丁基吡啶-2-基)-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5(10),6,8,19(23),20-六烯-2,2,4-三酮,化合物76(非对映异构体1)和(14s)-8-叔丁基-17-(4-叔丁基吡啶-2-基)-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四
碳-1(22),5(10),6,8,19(23),20-六烯-2,2,4-三酮,化合物75(非对映异构体2)
[1373][1374]
阶段1:在1-l圆底烧瓶中,将(4s)-4-[3-[[6-[(6-叔丁基-2-氟-吡啶-3-羰基)氨磺酰基]-2-吡啶基]氨基]-3-(4-叔丁基-2-吡啶基)丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(25.49g,35.16mmol)溶解于二氯甲烷(400ml)中。添加tfa(50ml,649.0mmol),并使所得溶液在室温下静置4小时。然后将混合物真空蒸发,用二噁烷稀释,并再次真空蒸发。这得到橙色油状物,约45g(>100%产率)。
[1375]
阶段2:在1-l圆底烧瓶中,将来自步骤1的粗产物溶解于nmp(400ml)中,向其中添加k2co3(40.72g,294.6mmol)。将所得混合物用氮气冲洗,然后在150℃下搅拌17小时。在冷却至室温之后,将反应混合物真空浓缩到原始体积的约1/4。将所得混合物倒入含有冷水(400ml)的2-l烧瓶中。[注意:沸腾。]然后将其与hcl水溶液(1n;700ml)混合,然后用乙酸乙酯(2
×
800ml)萃取。将合并的有机萃取物用水(1l)和饱和氯化钠水溶液(1l)洗涤,接着经硫酸钠干燥,过滤并真空蒸发。获得作为粗产物的棕色胶状物(约30g)。通过硅胶色谱法进行的若干次纯化,得到两种单独的产物,将所述产物通过从乙醇/水中沉淀进一步纯化。
[1376]
非对映异构体1:“峰1”,(14s)-8-叔丁基-17-(4-叔丁基吡啶-2-基)-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5(10),6,8,19(23),20-六烯-2,2,4-三酮(3.6701g,17%);1h nmr(400mhz,dmso-d6)δ12.23(s,1h),8.44(d,j=5.2hz,1h),7.68(d,j=8.1hz,1h),7.62(t,j=7.9hz,1h),7.55(s,1h),7.49(d,j=7.5hz,1h),7.25(d,j=4.4hz,1h),7.21(d,j=7.1hz,1h),6.86(d,j=8.5hz,1h),6.63(d,j=7.9hz,1h),5.11-4.77(m,1h),3.22-3.00(m,2h),2.37-2.24(m,1h),2.18-2.07(m,1h),1.85(dd,j=11.9,5.9hz,1h),1.75-1.65(m,1h),1.60(s,3h),1.52(s,3h),1.51-1.38(m,1h),1.27(s,9h),1.23(s,9h),1.20-1.07(m,1h)。[注意:1h从产物(c33h44n6o3s)中的总计数44中缺失]。esi-ms m/z计算值604.3196,实验值605.4(m 1)
;保留时间:1.72分钟(lc方法a)。
[1377]
非对映异构体2:“峰2”,(14s)-8-叔丁基-17-(4-叔丁基吡啶-2-基)-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5(10),6,8,19(23),20-六烯-2,2,4-三酮(4.7440g,22%);1h nmr(400mhz,dmso-d6)δ12.41(s,1h),8.40(d,j=5.2hz,1h),7.69-7.57(m,3h),7.51-7.43(m,1h),7.23(dd,j=5.3,1.9hz,1h),7.09(d,j=7.2hz,1h),6.87(d,j=8.4hz,1h),6.66(d,j=8.0hz,1h),5.32-5.22(m,1h),3.28-3.19(m,1h),2.76(t,j=10.5hz,1h),2.28-2.15(m,1h),1.96-1.87(m,2h),1.84(dd,j=11.8,5.3hz,1h),1.77-1.67(m,1h),1.65(s,3h),1.57(t,j=12.4hz,1h),1.51(s,3h),1.49-1.41(m,1h),1.28(s,9h),1.23(s,9h)。esi-ms m/z计算值604.3196,实验值605.3(m 1)
;保留时间:1.76分钟(lc方法a)。
[1378]
实施例12:(14s)-8-叔丁基-12,12-二甲基-17-(吡啶-2-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮,化合物293(非对映异构体1)和化合物292(非对映异构体2)的制备
[1379][1380]
步骤1:(4s)-4-[3-[[(s)-叔丁基亚磺酰基]氨基]-3-(2-吡啶基)丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯
[1381][1382]
将2-溴吡啶(0.8ml,8.223mmol)溶解于thf(24ml)中,并且将溶液在氮气球下在干冰丙酮浴(《-70℃)中冷却。添加n-buli(3ml,2.5m于己烷中,7.500mmol)。将淡红色混合物在此温度下搅拌15分钟。添加(4s)-4-[(3z)-3-[(s)-叔丁基亚磺酰基]亚氨基丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯;甲烷(1.5g,3.9745mmol)于thf(4ml)中的溶液。将混合物在-78℃至-40℃下搅拌30分钟。添加饱和nh4cl水溶液(20ml)。使混合物升温至室温,并在水(80ml)和etoac(100ml)之间分配。分离各层,并用更多etoac(100ml)萃取水层。将合并的有机层用盐水洗涤,经浓缩硫酸钠干燥,得到(4s)-4-[3-[[(s)-叔丁基亚磺酰基]氨基]-3-(2-吡啶基)丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(2.5g,101%)。esi-ms m/z计算值
437.2712,实验值438.6(m 1)
;保留时间:2.67分钟(lc方法b)。
[1383]
步骤2:(4s)-4-[3-氨基-3-(2-吡啶基)丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯
[1384][1385]
将(4s)-4-[3-[[(s)-叔丁基亚磺酰基]氨基]-3-(2-吡啶基)丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(13.5g,26.220mmol)溶解于thf(180ml)和水(36ml)中。添加分子碘(2g,7.880mmol)。将混合物在35℃下搅拌16小时。然后将其冷却至室温,并使其在etoac(300ml)和含na2s2o3(50g)的饱和碳酸氢钠水溶液(300ml)之间分配。分离各层,并将水层用etoac(200ml)萃取一次。浓缩有机层。将残余物溶解于1m hcl(500ml)中,并用乙醚(300ml)萃取。将水层通过2.5m naoh碱化并用etoac(2x300ml)萃取。将有机层用盐水洗涤,经无水na2so4干燥,过滤并浓缩,得到(4s)-4-[3-氨基-3-(2-吡啶基)丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(8.5g,92%)。esi-ms m/z计算值333.2416,实验值334.6(m 1)
;保留时间:2.55分钟(lc方法b)。
[1386]
步骤3:(4s)-2,2-二甲基-4-[3-(2-吡啶基)-3-[(6-氨磺酰基-2-吡啶基)氨基]丙基]吡咯烷-1-甲酸叔丁酯
[1387][1388]
向(4s)-4-[3-氨基-3-(2-吡啶基)丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(8.5g,24.215mmol)和6-氟吡啶-2-磺酰胺(8g,43.140mmol)于dmso(22ml)中的混合物中添加diea(12ml,68.893mmol)。将混合物在115℃下搅拌20小时。然后使其冷却至室温,并在etoac(300ml)和饱和碳酸氢钠(300ml)之间分配。用更多etoac(300ml)萃取水层。将合并的etoac溶液用盐水(2x500ml)洗涤,经无水na2so4干燥,过滤并浓缩。通过硅胶色谱法,使用5%-100%etoac/己烷来纯化残余物,得到呈固体状的(4s)-2,2-二甲基-4-[3-(2-吡啶基)-3-[(6-氨磺酰基-2-吡啶基)氨基]丙基]吡咯烷-1-甲酸叔丁酯(10.41g,83%)。1h nmr(500mhz,dmso-d6)δ8.54(d,j=4.6hz,1h),7.72(td,j=7.7,7.6,1.8hz,1h),7.57
–
7.42(m,3h),7.28
–
7.20(m,1h),7.06(s,2h),6.96(d,j=7.2hz,1h),6.76
–
6.68(m,1h),5.19(s,1h),3.58
–
3.48(m,1h),2.83
–
2.69(m,1h),2.14
–
2.02(m,1h),1.95
–
1.78(m,3h),1.42
–
1.30(m,15h),1.22(s,3h)。esi-ms m/z计算值489.241,实验值490.3(m 1)
;保留时间:1.82分钟(lc方法h)。
[1389]
步骤4:(4s)-4-[3-[[6-[(6-叔丁基-2-氯-吡啶-3-羰基)氨磺酰基]-2-吡啶基]氨
基]-3-(2-吡啶基)丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯
[1390][1391]
向6-叔丁基-2-氯-吡啶-3-甲酸(400mg,1.872mmol)于thf(10ml)中的溶液中添加cdi(310mg,1.912mmol)(从thf再结晶),并将混合物在室温下搅拌3小时,然后添加(4s)-2,2-二甲基-4-[3-(2-吡啶基)-3-[(6-氨磺酰基-2-吡啶基)氨基]丙基]吡咯烷-1-甲酸叔丁酯(555mg,1.134mmol),随后添加dbu(550μl,3.678mmol),并且将所得混合物在室温下搅拌16小时。将反应物用乙酸乙酯稀释,并用饱和碳酸氢钠水溶液洗涤。将有机层进一步用10%柠檬酸溶液洗涤,随后用盐水洗涤。将有机物分离,经硫酸钠干燥,蒸发,并且然后通过硅胶色谱法(80克柱),使用100%己烷至100%乙酸乙酯的梯度纯化,得到呈灰白色固体状的(4s)-4-[3-[[6-[(6-叔丁基-2-氯-吡啶-3-羰基)氨磺酰基]-2-吡啶基]氨基]-3-(2-吡啶基)丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(450mg,58%)。esi-ms m/z计算值684.2861,实验值685.2(m 1)
;保留时间:1.76分钟(lc方法a)。
[1392]
步骤5:(14s)-8-叔丁基-12,12-二甲基-17-(吡啶-2-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮,化合物293(非对映异构体1),和(14s)-8-叔丁基-12,12-二甲基-17-(吡啶-2-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮,化合物292(非对映异构体2)
[1393][1394]
阶段1:将(4s)-4-[3-[[6-[(6-叔丁基-2-氯-吡啶-3-羰基)氨磺酰基]-2-吡啶基]氨基]-3-(2-吡啶基)丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(450.2mg,0.6569mmol)溶解于dcm(20ml)中,并且向混合物中添加hcl(5ml,4m于二噁烷中,20.00mmol),并且将反应物在室温下搅拌。在2小时后,反应完成。将反应物用碳酸钠水溶液碱化,直到ph约8。然后用乙酸乙酯稀释,并用饱和碳酸氢钠水溶液洗涤。将有机层萃取,并且然后用盐水进一步洗涤。将有机物分离,经硫酸钠干燥,蒸发,并且然后置于高真空泵上1小时,得到呈灰白色固体状的中间体6-叔丁基-2-氯-n-[[6-[[3-[(3s)-5,5-二甲基吡咯烷-3-基]-1-(2-吡啶基)
丙基]氨基]-2-吡啶基]磺酰基]吡啶-3-甲酰胺(盐酸盐)。esi-ms m/z计算值584.23364,实验值585.2(m 1)
;保留时间:1.07分钟(lc方法a)。
[1395]
阶段2:来自阶段1的材料与k2co3(1g,7.236mmol)、分子筛和dmso(20ml)合并于小瓶中,用氮气吹扫,封盖,加热至155℃并搅拌72小时。将混合物冷却至环境温度,过滤并在氮气流下浓缩,得到残余物,将所述残余物通过利用c
18
柱的反相制备型色谱法和使用25-60%乙腈/水( 5mm hcl,30分钟)梯度的hplc-ms方法纯化,得到两个产物峰,分离出非对映异构体:
[1396]
非对映异构体1,极性较大,灰白色固体:(14s)-8-叔丁基-12,12-二甲基-17-(吡啶-2-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮(盐酸盐)(3.8mg,3%)。esi-ms m/z计算值548.25696,实验值549.2(m 1)
;保留时间:1.55分钟(lc方法a)。
[1397]
非对映异构体2,极性较低,灰白色固体:(14s)-8-叔丁基-12,12-二甲基-17-(吡啶-2-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮(盐酸盐)(36.85mg,27%)。1h nmr(500mhz,dmso-d6)δ12.50(s,1h),8.85(d,j=5.8hz,1h),8.57(t,j=7.9hz,1h),8.24(d,j=8.5hz,1h),8.16(d,j=8.2hz,1h),7.94(t,j=6.7hz,1h),7.74(t,j=7.9hz,1h),7.63(d,j=8.0hz,1h),7.21(d,j=7.2hz,1h),7.01(d,j=8.4hz,1h),6.65(d,j=7.9hz,1h),5.57(d,j=7.5hz,1h),3.39(t,j=8.5hz,1h),2.66(t,j=10.1hz,1h),2.50-2.38(m,2h),2.07(s,2h),1.89-1.73(m,2h),1.65(s,3h),1.55(t,j=12.3hz,1h),1.50(s,3h),1.27(s,9h)。esi-ms m/z计算值548.25696,实验值549.2(m 1)
;保留时间:1.63分钟(lc方法a)。
[1398]
以下是可商购获得的烷基、芳基和杂芳基卤化物试剂的列表:
[1399]
3-溴吡啶
[1400]
3-溴-1-甲基-吡唑
[1401]
4-碘吡啶
[1402]
5-溴嘧啶
[1403]
2-溴嘧啶
[1404]
2-溴-6-(三氟甲基)吡啶
[1405]
2-溴-4-(三氟甲基)吡啶
[1406]
1-溴-3-叔丁基-苯
[1407]
1-溴-4-叔丁基-苯
[1408]
2-溴-5-(三氟甲基)吡啶
[1409]
2-溴-3-氯-吡啶
[1410]
使用上表中给出的可商购获得的烷基、芳基和杂芳基卤化物试剂,以与上文所述类似的方式制备下表中的化合物。
[1411]
对于化合物279和化合物278的制备,步骤1中的锂化剂是t-buli。对于化合物217和化合物216的制备,步骤1中的锂化剂是lda。对于化合物285和化合物284的制备,通过使n-buli与1-甲基吡唑在-70℃下反应来生成步骤1中的锂化剂。
[1412]
对于化合物245和化合物244的制备,步骤1中的锂化剂是可商购获得的t-buli。
[1413]
除非另有说明,否则对于每个制备的非对映异构体对,非对映异构体1是在分离程
序期间洗脱的第一异构体。非对映异构体2是待洗脱的第二异构体。
[1414]
下表中的非对映异构体通过以下方法分离:
[1415][1416]
[1417][1418]
[1419]
[1420]
[1421]
[1422]
[1423][1424]
[1425]
[1426]
[1427]
[1428]
[1429]
[1430]
[1431]
[1432][1433]
实施例13:(14s)-8-叔丁基-17-(5-氯吡啶-2-基)-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮异构物,化合物209(非对映异构体1)和化合物208(非对映异构体2)的制备
[1434][1435]
步骤1:(4s)-4-[3-(叔丁基亚磺酰基氨基)-3-(5-氯-2-吡啶基)丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯
[1436][1437]
将2-溴-5-氯-吡啶(8.8g,44.814mmol)溶解于乙醚(250ml)中,并且在氮气球下在干冰丙酮浴(<-70℃)中冷却。将混合物搅拌15分钟。快速逐滴添加n-buli(18ml,2.5m于己烷中,45.00mmol)。将混合物在此温度下搅拌30分钟。整份添加含(4s)-4-[(3e)-3-叔丁基亚磺酰基亚氨基丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(4g,10.599mmol)的thf(5ml加1ml冲洗液)。在添加后,将混合物再搅拌15分钟。添加nh4cl(20ml,饱和水溶液)。将混合物从干冰丙酮浴中取出,并用etoac(200ml)和水(100ml)稀释。分离各层,并且通过无水na2so4垫过滤有机层。将滤液浓缩,并且通过硅胶色谱法(120g柱),使用10%-80%etoac/己烷来
纯化残余物,得到呈白色泡沫状的(4s)-4-[3-(叔丁基亚磺酰基氨基)-3-(5-氯-2-吡啶基)丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(2.31g,45%)。esi-ms m/z计算值471.2322,实验值472.7(m 1)
;保留时间:3.8分钟(lc方法b)。
[1438]
步骤2:(4s)-4-[3-氨基-3-(5-氯-2-吡啶基)丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯
[1439][1440]
将(4s)-4-[3-(叔丁基亚磺酰基氨基)-3-(5-氯-2-吡啶基)丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(8.95g,18.011mmol)溶解于thf(100ml)和水(20ml)的溶剂混合物中。一次性添加分子碘(1.38g,5.437mmol)。将混合物置于50℃油浴中,并在氮气球下搅拌3小时。然后将其冷却至室温,用na2s2o3(5g于20ml饱和碳酸氢钠水溶液中)和etoac(50ml)稀释。分离各层,并将有机层用盐水(约30ml)洗涤,经无水mgso4干燥,过滤并浓缩。该粗物质不经进一步纯化即用于下一步。esi-ms m/z计算值367.20267,实验值368.5(m 1)
;保留时间:2.91分钟(lc方法b)。
[1441]
步骤3:(4s)-4-[3-(5-氯-2-吡啶基)-3-[(6-氨磺酰基-2-吡啶基)氨基]丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯
[1442][1443]
将(4s)-4-[3-氨基-3-(5-氯-2-吡啶基)丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(4.73g,12.213mmol)溶解于dmso(6ml)中。添加6-氟吡啶-2-磺酰胺(2.5g,14.191mmol),然后添加na2co3(3.7g,34.910mmol)。在氮气球下,将混合物在110℃油浴中加热20小时。然后将其冷却至室温,并用etoac(50ml)和水(40ml)稀释。分离各层,并用更多水(40ml)和盐水(30ml)洗涤有机层。然后将其用无水na2so4干燥,过滤并浓缩。通过硅胶色谱法(80g柱),使用5%-80%etoac/己烷来纯化残余物,得到呈白色泡沫状的(4s)-4-[3-(5-氯-2-吡啶基)-3-[(6-氨磺酰基-2-吡啶基)氨基]丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(3.88g,58%)。1h nmr(500mhz,dmso-d6)δ8.57(d,j=2.5hz,1h),7.83(dd,j=8.4,2.6hz,1h),7.63
–
7.45(m,3h),7.06(s,2h),6.97(d,j=7.2hz,1h),6.70(d,j=8.5hz,1h),5.18(s,1h),3.54(dd,j=18.9,10.0hz,1h),2.84
–
2.67(m,1h),2.08(d,j=6.0hz,1h),1.94
–
1.74
(m,3h),1.45
–
1.30(m,15h),1.23(s,3h)。esi-ms m/z计算值523.202,实验值524.5(m 1)
;保留时间:2.69分钟(lc方法h)。
[1444]
步骤4:(4s)-4-[3-[[6-[(6-叔丁基-2-氟-吡啶-3-羰基)氨磺酰基]-2-吡啶基]氨基]-3-(5-氯-2-吡啶基)丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯
[1445][1446]
向6-叔丁基-2-氟-吡啶-3-甲酸(773mg,3.920mmol)于thf(15ml)中的溶液中添加cdi(642mg,3.959mmol),并且将混合物在室温下搅拌16小时,然后添加(4s)-4-[3-(5-氯-2-吡啶基)-3-[(6-氨磺酰基-2-吡啶基)氨基]丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(1.7g,3.244mmol),随后添加dbu(1.5ml,10.03mmol),并且将所得混合物在室温下搅拌2小时。将反应物用饱和氯化铵和盐水溶液的1:1混合物淬灭,然后用乙酸乙酯萃取。将合并的有机层用盐水洗涤,经硫酸钠干燥,过滤并蒸发。所得残余物用于下一步中。
[1447]
步骤5:(4s)-4-[3-[[6-[(6-叔丁基-2-氟-吡啶-3-羰基)氨磺酰基]-2-吡啶基]氨基]-3-(5-氯-2-吡啶基)丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯,非对映异构体1,和(4s)-4-[3-[[6-[(6-叔丁基-2-氟-吡啶-3-羰基)氨磺酰基]-2-吡啶基]氨基]-3-(5-氯-2-吡啶基)丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯,非对映异构体2
[1448][1449]
(4s)-4-[3-[[6-[(6-叔丁基-2-氟-吡啶-3-羰基)氨磺酰基]-2-吡啶基]氨基]-3-(5-氯-2-吡啶基)丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(2.38g,3.384mmol)通过反相色谱法,用20%乙腈/水至100%水梯度(每次进样约500mg于2.5ml中,共5次进样)来纯化,得到呈白色固体状的两种异构体:
[1450]
非对映异构体1:(4s)-4-[3-[[6-[(6-叔丁基-2-氟-吡啶-3-羰基)氨磺酰基]-2-吡啶基]氨基]-3-(5-氯-2-吡啶基)丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(662mg,56%)esi-ms m/z计算值702.2767,实验值703.2(m 1)
;保留时间:2.29分钟(lc方法a)
[1451]
非对映异构体2:(4s)-4-[3-[[6-[(6-叔丁基-2-氟-吡啶-3-羰基)氨磺酰基]-2-吡啶基]氨基]-3-(5-氯-2-吡啶基)丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(472mg,40%)esi-ms m/z计算值702.2767,实验值703.5(m 1)
;保留时间:2.3分钟(lc方法a)。
[1452]
步骤6:(14s)-8-叔丁基-17-(5-氯吡啶-2-基)-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮,化合物209(非对映异构体1)
[1453][1454]
将(4s)-4-[3-[[6-[(6-叔丁基-2-氟-吡啶-3-羰基)氨磺酰基]-2-吡啶基]氨基]-3-(5-氯-2-吡啶基)丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(662mg,0.9413mmol)(非对映异构体1)溶解于dcm(13.5ml)中,并且向混合物中添加tfa(3.25ml,42.18mmol),并且将反应物在室温下搅拌。在1小时后,将混合物蒸发至干燥,然后用乙醚(30ml x 2)稀释,并浓缩。然后将材料置于高真空泵上2小时,得到呈灰白色固体状的中间体6-叔丁基-n-[[6-[[1-(5-氯-2-吡啶基)-3-[(3s)-5,5-二甲基吡咯烷-3-基]丙基]氨基]-2-吡啶基]磺酰基]-2-氟-吡啶-3-甲酰胺。esi-ms m/z计算值602.22424,实验值603.2(m 1)
;保留时间:1.37分钟。将中间体与k2co3(1.4g,10.13mmol)、分子筛和nmp(12ml)合并于小瓶中,用氮气吹扫,封盖,加热至150℃并搅拌3小时,然后加热至170℃并搅拌1小时。将混合物用乙酸乙酯和水稀释。将有机层萃取(2x)并用10%柠檬酸溶液进一步洗涤,随后用盐水洗涤。将有机物分离,经硫酸钠干燥,蒸发至浅棕色油状物。残余物独立地通过利用c
18
柱的反相制备型色谱法,和使用历经15分钟30%-99%乙腈/水( 5mm hcl)梯度的hplc-ms方法进行纯化,得到呈白色固体状的非对映异构体产物:(14s)-8-叔丁基-17-(5-氯吡啶-2-基)-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮,非对映异构体1(214.1mg,39%)。1h nmr(500mhz,dmso-d6)δ12.30(s,1h),8.69-8.53(m,1h),7.90(d,j=8.6hz,1h),7.78(s,1h),7.66-7.57(m,2h),7.50(s,1h),7.23(d,j=7.2hz,1h),6.87(d,j=8.5hz,1h),6.64(d,j=8.0hz,1h),4.99(s,1h),3.91(s,2h),3.11(s,1h),2.32(s,1h),2.14(d,j=17.2hz,1h),1.85(dd,j=11.9,5.9hz,1h),1.77-1.69(m,1h),1.60(s,3h),1.53(s,4h),1.28(s,9h),1.17(d,j=17.0hz,1h)。esi-ms m/z计算值582.218,实验值583.4(m 1)
;保留时间:2.21分钟(lc方法a)。
[1455]
步骤7:(14s)-8-叔丁基-17-(5-氯吡啶-2-基)-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮,化合物208(非对映异构体2)
[1456][1457]
将(4s)-4-[3-[[6-[(6-叔丁基-2-氟-吡啶-3-羰基)氨磺酰基]-2-吡啶基]氨基]-3-(5-氯-2-吡啶基)丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(472mg,0.6712mmol)(非对映异构体2)溶解于dcm(10ml)中,并且向混合物中添加tfa(2.5ml,32.45mmol),并且将反应物在室温下搅拌。在1小时后,将混合物蒸发至干燥,然后用乙醚(30ml x 2)稀释,并浓缩。然后将材料置于高真空泵上2小时,得到呈灰白色固体状的中间体6-叔丁基-n-[[6-[[1-(5-氯-2-吡啶基)-3-[(3s)-5,5-二甲基吡咯烷-3-基]丙基]氨基]-2-吡啶基]磺酰基]-2-氟-吡啶-3-甲酰胺。esi-ms m/z计算值602.22424,实验值603.3(m 1)
;保留时间:1.4分钟。将中间体与k2co3(1.0g,7.236mmol)、分子筛和nmp(12ml)合并于小瓶中,用氮气吹扫,封盖,加热至150℃并搅拌3小时,然后加热至170℃并搅拌1小时。将混合物用乙酸乙酯和水稀释。将有机层萃取(2x)并用10%柠檬酸溶液进一步洗涤,随后用盐水洗涤。将有机物分离,经硫酸钠干燥,蒸发至浅棕色油状物。残余物独立地通过利用c
18
柱和历经15分钟30%-99%乙腈/水( 5mm hcl)梯度的反相制备型色谱法进行纯化,得到呈白色固体状的非对映异构体产物:(14s)-8-叔丁基-17-(5-氯吡啶-2-基)-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮,非对映异构体2(134.2mg,34%)。1h nmr(500mhz,dmso-d6)δ12.50(s,1h),8.58(d,j=2.5hz,1h),7.89(dd,j=8.5,2.5hz,1h),7.72(d,j=9.1hz,1h),7.69-7.59(m,2h),7.48(d,j=8.4hz,1h),7.12(d,j=7.2hz,1h),6.88(d,j=8.4hz,1h),6.66(d,j=8.0hz,1h),5.39-5.14(m,1h),3.20(dd,j=10.2,6.8hz,1h),2.76(t,j=10.5hz,1h),2.23(s,1h),1.99-1.88(m,2h),1.85(dd,j=11.7,5.2hz,1h),1.75(d,j=13.8hz,1h),1.65(s,3h),1.58(t,j=12.3hz,1h),1.51(s,3h),1.49-1.40(m,1h),1.29(s,9h)。esi-ms m/z计算值582.218,实验值583.6(m 1)
;保留时间:2.15分钟(lc方法a)。
[1458]
在步骤1中使用4-溴-1-甲基吡唑或苯基锂作为试剂,以与上文所述类似的方式制备下表中的化合物。对于每个制备的非对映异构体对,非对映异构体1源自步骤5中的分离程序期间洗脱的第一异构体。非对映异构体2源自步骤5中的分离程序期间洗脱的第二异构体。
[1459]
[1460][1461]
实施例14:(14s)-8-叔丁基-12,12-二甲基-17-(丙-2-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮,化合物287(非对映异构体1)和化合物286(非对映异构体2)的制备
[1462][1463]
步骤1:(4s)-4-[3-(叔丁基亚磺酰基氨基)-4-甲基-戊基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯
[1464][1465]
将(4s)-4-[(3e)-3-叔丁基亚磺酰基亚氨基丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(10g,26.50mmol)溶解于thf(150ml)中。在氮气球下,使用干冰丙酮浴将溶液冷却至-78℃,并搅拌5分钟。逐滴添加异丙基氯化镁(1.3m于thf中)(125ml,1.3m,162.50mmol)。使混合物升温至约-35℃并搅拌1小时。添加饱和nh4cl水溶液(80ml)。将混合物升温至室温。添加etoac(200ml)和水(100ml)。分离各层,并将水层用etoac(200ml)萃取一次。将合并的有机物用盐水洗涤,经无水na2so4干燥,过滤并浓缩,得到粗制(4s)-4-[3-(叔丁基亚磺酰基氨基)-4-甲基-戊基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(12.5g,100%)。esi-ms m/z计算值402.2916,实验值403.6(m 1)
;保留时间:4.02分钟(lc方法b)。
[1466]
步骤2:(4s)-4-(3-氨基-4-甲基-戊基)-2,2-二甲基-吡咯烷-1-甲酸叔丁酯
[1467][1468]
将(4s)-4-[3-(叔丁基亚磺酰基氨基)-4-甲基-戊基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(12.5g,26.389mmol)溶解于thf(180ml)和水(36ml)的混合溶剂中。一次性添加分子碘(2g,7.864mmol)。将混合物在35℃下搅拌18小时。然后将其冷却至室温,并使其在etoac(300ml)和含na2s2o3(50g)的饱和碳酸氢钠水溶液(300ml)之间分配。分离各层,并将
水层用etoac(200ml)萃取一次。浓缩合并的有机层。将残余物溶解于1m hcl(500ml)中,并用乙醚(300ml)萃取。将水层通过2.5m naoh碱化并用etoac(2x300ml)萃取。将合并的有机层用盐水洗涤,经无水na2so4干燥,过滤并浓缩,得到(4s)-4-(3-氨基-4-甲基-戊基)-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(6.8g,82%)。esi-ms m/z计算值298.262,实验值299.7(m 1)
;保留时间:2.69分钟(lc方法b)。
[1469]
步骤3:(4s)-2,2-二甲基-4-[4-甲基-3-[(6-氨磺酰基-2-吡啶基)氨基]戊基]吡咯烷-1-甲酸叔丁酯
[1470][1471]
向(4s)-4-(3-氨基-4-甲基-戊基)-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(6.8g,21.644mmol)和6-氟吡啶-2-磺酰胺(7.5g,40.444mmol)于dmso(20ml)中的混合物中添加diea(12ml,68.893mmol)。将混合物在115℃下搅拌20小时。然后使其冷却至室温,并在etoac(300ml)和饱和碳酸氢钠(500ml)之间分配。用更多etoac(300ml)萃取水层。将合并的etoac溶液用盐水(2x500ml)洗涤,经无水na2so4干燥,过滤并浓缩。通过硅胶色谱法,使用0-70%etoac/己烷来纯化残余物,得到呈固体状的(4s)-2,2-二甲基-4-[4-甲基-3-[(6-氨磺酰基-2-吡啶基)氨基]戊基]吡咯烷-1-甲酸叔丁酯(8.1g,79%)。1h nmr(500mhz,dmso-d6)δ7.48(t,j=7.8,7.8hz,1h),7.03(s,2h),6.90(d,j=7.1hz,1h),6.72(d,j=9.1hz,1h),6.65(d,j=8.3hz,1h),4.01
–
3.87(m,1h),3.59
–
3.47(m,1h),2.80
–
2.69(m,1h),2.13
–
2.01(m,1h),1.92
–
1.73(m,2h),1.58
–
1.44(m,1h),1.44
–
1.26(m,17h),1.23(d,j=2.9hz,3h),0.91
–
0.84(m,6h)。esi-ms m/z计算值454.2614,实验值455.2(m 1)
;保留时间:2.77分钟(lc方法h)。
[1472]
步骤4:(4s)-4-[3-[[6-[(6-叔丁基-2-氯-吡啶-3-羰基)氨磺酰基]-2-吡啶基]氨基]-4-甲基-戊基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯
[1473][1474]
向6-叔丁基-2-氯-吡啶-3-甲酸(175mg,0.819mmol)于thf(6ml)中的溶液中添加cdi(135mg,0.833mmol)(从thf再结晶),并且将混合物在室温下搅拌3小时。然后添加(4s)-2,2-二甲基-4-[4-甲基-3-[(6-氨磺酰基-2-吡啶基)氨基]戊基]吡咯烷-1-甲酸丁酯(266mg,0.585mmol),随后添加dbu(300μl,2.01mmol),并将所得混合物在室温下搅拌16小时。将反应物用乙酸乙酯稀释,并用饱和碳酸氢钠水溶液洗涤。将有机层进一步用10%柠檬酸溶液洗涤,随后用盐水洗涤。将有机物分离,经硫酸钠干燥,蒸发并且然后通过硅胶色谱法(80克柱),使用100%己烷至70%乙酸乙酯/己烷梯度,随后通过第二硅胶柱(24克柱),使
用100%二氯甲烷至15%甲醇/二氯甲烷梯度进行纯化,得到呈灰白色固体状的(4s)-4-[3-[[6-[(6-叔丁基-2-氯-吡啶-3-羰基)氨磺酰基]-2-吡啶基]氨基]-4-甲基-戊基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(123mg,32%)。esi-ms m/z计算值649.30646,实验值650.2(m 1)
;保留时间:1.99分钟(lc方法a)。
[1475]
步骤5:(14s)-8-叔丁基-12,12-二甲基-17-(丙-2-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮,化合物287(非对映异构体1),和(14s)-8-叔丁基-12,12-二甲基-17-(丙-2-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮,化合物286(非对映异构体2)
[1476][1477]
阶段1:将(4s)-4-[3-[[6-[(6-叔丁基-2-氯-吡啶-3-羰基)氨磺酰基]-2-吡啶基]氨基]-4-甲基-戊基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(120mg,0.1845mmol)溶解于dcm(3.0ml)中,并且向混合物中添加hcl(1.75ml,4m于二噁烷中,7.00mmol),并且将所得混合物在室温下搅拌。在2小时后,将混合物蒸发至干燥,然后用乙醚(5ml x 2)稀释,并再浓缩。然后将材料放置在高真空泵上2小时,得到呈灰白色固体状的中间物6-叔丁基-2-氯-n-[[6-[[1-[2-[(3s)-5,5-二甲基吡咯烷-3-基]乙基]-2-甲基-丙基]氨基]-2-吡啶基]磺酰基]吡啶-3-甲酰胺(盐酸盐)。esi-ms m/z计算值549.254,实验值550.2(m 1)
;保留时间:1.49分钟。保留时间:1.76分钟(lc方法a)。
[1478]
阶段2:将来自阶段1的材料与k2co3(300mg,2.171mmol)、分子筛和dmso(4ml)合并于小瓶中。将所得混合物用氮气吹扫,封盖,加热至155℃并搅拌36小时。将混合物冷却至室温,过滤并在氮气流下浓缩,得到残余物,所述残余物通过反相制备型色谱法,利用c
18
柱和历经15分钟30%-99%乙腈/水( 5mm hcl)梯度进行纯化,得到两种产物:
[1479]
非对映异构体1:峰1,极性较大,灰白色固体:(14s)-8-叔丁基-12,12-二甲基-17-(丙-2-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮(11.85mg,25%)。1h nmr(500mhz,dmso-d6)δ12.42(s,1h),7.62(d,j=7.9hz,1h),7.55(t,j=7.9hz,1h),7.02(d,j=7.2hz,1h),6.94(d,j=9.1hz,1h),6.74(d,j=8.5hz,1h),6.65(d,j=8.0hz,1h),3.96(s,1h),3.09(d,j=9.7hz,1h),2.65(d,j=10.5hz,1h),2.13-1.98(m,1h),1.89-1.74(m,1h),1.65(d,j=5.7hz,1h),1.62(s,3h),1.53(d,j=13.0hz,2h),1.49(s,3h),1.48-1.42(m,1h),1.28(s,11h),0.87(t,j=7.2hz,6h)。esi-ms m/z计算值513.27734,实验值514.2(m 1)
;保留时间:2.24分钟(lc方法a)。
[1480]
非对映异构体2:峰2,极性较低,灰白色固体:(14s)-8-叔丁基-12,12-二甲基-17-(丙-2-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮(7.86mg,17%)。1h nmr(500mhz,dmso-d6)δ12.40(s,1h),7.56(t,j=7.9hz,1h),7.42(d,j=7.9hz,1h),7.21-7.04(m,2h),6.76(d,j=
8.6hz,1h),6.60(d,j=7.9hz,1h),3.10(s,1h),2.81(s,1h),2.29-2.17(m,1h),2.07-1.96(m,1h),1.87-1.76(m,1h),1.64-1.61(m,1h),1.54(d,j=15.1hz,8h),1.26(s,11h),1.18(s,1h),0.89-0.87(m,6h)。esi-ms m/z计算值513.27734,实验值514.2(m 1)
;保留时间:2.27分钟(lc方法a)。
[1481]
下表包含用于制备各种有机镁试剂的方法的列表:
[1482][1483][1484]
使用在上表中给出的步骤1中有机镁试剂,以与上文所述类似的方式制备下表中
的化合物。
[1485]
对于化合物235和化合物234的制备,步骤1中使用的有机镁试剂是可购商获得的环己基氯化镁,并且在步骤4进行非对映异构体的分离。
[1486]
除非另有说明,否则对于每个制备的非对映异构体对,非对映异构体1是在分离程序期间洗脱的第一异构体。非对映异构体2是待洗脱的第二异构体。
[1487]
下表中的非对映异构体通过以下方法分离:
[1488]
[1489][1490]
[1491]
[1492]
[1493][1494]
[1495][1496]
实施例15:(14s)-8-叔丁基-12,12-二甲基-17-(嘧啶-5-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮,化合物298(非对映异构体1)和化合物297(非对映异构体2)的制备
[1497][1498]
步骤1:2,2,2-三氟-1-[(4s)-4-(3-羟丙基)-2,2-二甲基-吡咯烷-1-基]乙烯酮
[1499][1500]
将3-[(3s)-5,5-二甲基吡咯烷-3-基]丙-1-醇(8.3g,50.142mmol)溶解于dcm(100ml)中。添加net3(14ml,100.44mmol),并将混合物在氮气球下在冰水浴中搅拌5分钟。在5分钟内经由注射器逐滴添加三氟乙酸酐(11ml,78.036mmol)。将混合物在室温下搅拌2小时。然后将其浓缩,并将残余物溶解于溶剂meoh/thf(各20ml)的混合物。添加含lioh(1g,41.757mmol)的水(20ml)。将混合物在室温下搅拌2小时。将混合物浓缩,并且然后在水和
dcm(各50ml)之间分配。分离各层,并将水层用dcm(50ml x 2)进一步萃取。合并的有机物经无水mgso4干燥,过滤并真空浓缩,得到2,2,2-三氟-1-[(4s)-4-(3-羟丙基)-2,2-二甲基-吡咯烷-1-基]乙酮(10.3g,77%)。esi-ms m/z计算值253.129,实验值254.3(m 1)
;保留时间:2.41分钟(lc方法b)。
[1501]
步骤2:3-[(3s)-5,5-二甲基-1-(2,2,2-三氟乙酰基)吡咯烷-3-基]丙醛
[1502][1503]
将2,2,2-三氟-1-[(4s)-4-(3-羟丙基)-2,2-二甲基-吡咯烷-1-基]乙酮(7g,26.26mmol)溶解于dcm(100ml)中。将溶液在冰水浴中冷却。在1分钟内以小份添加戴斯-马丁过碘烷(dess-martin seaminane)(12.895g,28.88mmol)。将混合物在氮气(气球)下搅拌,同时移除冰浴。在2小时后,添加nas2o3(约10g)于饱和碳酸氢钠水溶液(50ml)中的溶液。将混合物搅拌30分钟。分离各层。将dcm层进一步用碳酸氢钠(饱和水溶液50ml x 2)洗涤,经无水na2so4干燥,过滤并浓缩。通过硅胶色谱法(rf:0.48 3/1己烷/etoac),使用0-50%etoac/己烷来纯化油状物残余物,得到3-[(3s)-5,5-二甲基-1-(2,2,2-三氟乙酰基)吡咯烷-3-基]丙醛(5.58g,80%)。esi-ms m/z计算值251.1133,实验值252.5(m 1)
;保留时间:3.54分钟(lc方法b)。
[1504]
步骤3:n-[3-[(3s)-5,5-二甲基-1-(2,2,2-三氟乙酰基)吡咯烷-3-基]亚丙基]-2-甲基-丙烷-2-亚磺酰胺
[1505][1506]
在室温下,将3-[(3s)-5,5-二甲基-1-(2,2,2-三氟乙酰基)吡咯烷-3-基]丙醛(7.5g,28.36mmol)溶解于dcm(70ml)中。添加2-甲基丙烷-2-亚磺酰胺(3.45g,27.896mmol),随后添加硫酸镁(18g,148.79mmol)和对甲苯磺酸吡啶鎓(358mg,1.40mmol)。将混合物在氮气球下搅拌18小时。然后将其过滤通过硅藻土垫,用dcm洗涤。将合并的滤液浓缩,并且通过硅胶色谱法,使用5%-60%etoac/己烷来纯化残余物,得到n-[3-[(3s)-5,5-二甲基-1-(2,2,2-三氟乙酰基)吡咯烷-3-基]亚丙基]-2-甲基-丙烷-2-亚磺酰胺(9.8g,93%)。esi-ms m/z计算值354.1589,实验值355.5(m 1)
;保留时间:3.12分钟(lc方法b)。
[1507]
步骤4:n-[3-[(3s)-5,5-二甲基-1-(2,2,2-三氟乙酰基)吡咯烷-3-基]-1-嘧啶-5-基-丙基]-2-甲基-丙烷-2-亚磺酰胺
[1508][1509]
将5-溴嘧啶(3.2g,19.725mmol)溶解于thf(90ml)中。将混合物在乙醇液氮浴中冷却,直至浴温《-100℃,并将溶液搅拌10分钟。沿着反应烧瓶的内壁快速滴加n-buli(8ml,2.5m于己烷中,20.000mmol)。几分钟后停止搅拌。使混合物在冷浴中保持不搅拌20分钟,然后在3分钟内沿着烧瓶的内壁添加含(ne)-n-[3-[(3s)-5,5-二甲基-1-(2,2,2-三氟乙酰基)吡咯烷-3-基]亚丙基]-2-甲基-丙烷-2-亚磺酰胺(2.4g,6.4328mmol)的thf(10ml)。使混合物在同一浸浴中升温,并且当浴温达到约-85℃时,再次开始搅拌。在低于-70℃下继续反应15分钟。一次性全部添加饱和nh4cl(20ml)。使混合物升温至室温并浓缩。将残余物在水与etoac(各30ml)之间分配。将水层用etoac洗涤一次。将etoac混合物浓缩,并通过短硅胶柱,使用100%etoac作为洗脱剂来纯化,得到n-[3-[(3s)-5,5-二甲基-1-(2,2,2-三氟乙酰基)吡咯烷-3-基]-1-嘧啶-5-基-丙基]-2-甲基-丙烷-2-亚磺酰胺(1g,34%)。esi-ms m/z计算值434.1963,实验值435.6(m 1)
;保留时间:2.61分钟(lc方法b)。
[1510]
步骤5:1-[(4s)-4-(3-氨基-3-嘧啶-5-基-丙基)-2,2-二甲基-吡咯烷-1-基]-2,2,2-三氟-乙酮
[1511][1512]
将n-[3-[(3s)-5,5-二甲基-1-(2,2,2-三氟乙酰基)吡咯烷-3-基]-1-嘧啶-5-基-丙基]-2-甲基-丙烷-2-亚磺酰胺(1.2g,2.6236mmol)溶解于meoh(10ml)中。添加含hcl(4ml,4m,16.000mmol)溶液的二噁烷。将混合物在室温下搅拌1小时。对其进行浓缩,并且将残余物在dcm和碳酸氢钠水溶液(各20ml)之间分配。将水层用dcm萃取一次(20ml)。将合并的dcm溶液用盐水洗涤,经无水na2so4干燥,过滤并浓缩,得到1-[(4s)-4-(3-氨基-3-嘧啶-5-基-丙基)-2,2-二甲基-吡咯烷-1-基]-2,2,2-三氟-乙酮(900mg,99%)。esi-ms m/z计算值330.1667,实验值331.4(m 1)
;保留时间:1.91分钟(lc方法b)。
[1513]
步骤6:6-[[3-[(3s)-5,5-二甲基-1-(2,2,2-三氟乙酰基)吡咯烷-3-基]-1-嘧啶-5-基-丙基]氨基]吡啶-2-磺酰胺
[1514][1515]
将1-[(4s)-4-(3-氨基-3-嘧啶-5-基-丙基)-2,2-二甲基-吡咯烷-1-基]-2,2,2-三氟-乙酮(900mg,2.588mmol)溶解于dmso(2ml)中。添加6-氟吡啶-2-磺酰胺(768mg,4.359mmol)和na2co3(868mg,8.190mmol)。在氮气球下,将混合物在110℃油浴中加热18小时。然后将其冷却至室温,并在etoac和水(各20ml)之间分配。将有机层用水(10ml x 2)、盐水洗涤,经无水na2so4干燥,过滤并浓缩。通过硅胶色谱法,使用5%-80%etoac/己烷来纯化残余物,得到6-[[3-[(3s)-5,5-二甲基-1-(2,2,2-三氟乙酰基)吡咯烷-3-基]-1-嘧啶-5-基-丙基]氨基]吡啶-2-磺酰胺(0.504g,38%)。1h nmr(500mhz,dmso-d6)δ9.03(s,1h),8.89(s,2h),7.65(d,j=8.2hz,1h),7.54(dd,j=8.4,7.2hz,1h),7.11(s,2h),6.98(d,j=7.2hz,1h),6.66(d,j=8.4hz,1h),5.18-5.03(m,1h),3.87-3.76(m,1h),3.15(q,j=11.3hz,1h),2.34-2.21(m,1h),2.05-1.76(m,3h),1.59-1.48(m,1h),1.47-1.42(m,4h),1.34(s,3h),1.33-1.25(m,1h)。esi-ms m/z计算值486.1661,实验值487.3(m 1)
;保留时间:1.9分钟(lc方法h)。rf:约0.4,在100%etoac中。
[1516]
步骤7:6-叔丁基-2-氯-n-[[6-[[3-[(3s)-5,5-二甲基-1-(2,2,2-三氟乙酰基)吡咯烷-3-基]-1-嘧啶-5-基-丙基]氨基]-2-吡啶基]磺酰基]吡啶-3-甲酰胺
[1517][1518]
向6-叔丁基-2-氯-吡啶-3-甲酸(255mg,1.193mmol)于thf(12ml)中的溶液中添加cdi(199mg,1.227mmol)(从thf再结晶),并且将混合物在室温下搅拌2小时,然后添加6-[[3-[(3s)-5,5-二甲基-1-(2,2,2-三氟乙酰基)吡咯烷-3-基]-1-嘧啶-5-基-丙基]氨基]吡啶-2-磺酰胺(350mg,0.719mmol),随后添加dbu(350μl,2.340mmol),并且将所得混合物在室温下搅拌16小时。将反应物用乙酸乙酯稀释,并用饱和碳酸氢钠水溶液洗涤,并且然后将有机相用盐水洗涤。将有机物分离,经硫酸钠干燥,蒸发并且通过硅胶色谱法(80克柱),使用100%己烷至100%乙酸乙酯的梯度,随后通过第二硅胶柱(40克柱),使用100%二氯甲烷至15%甲醇的梯度进行纯化,得到呈灰白色固体状的6-叔丁基-2-氯-n-[[6-[[3-[(3s)-5,5-二甲基-1-(2,2,2-三氟乙酰基)吡咯烷-3-基]-1-嘧啶-5-基-丙基]氨基]-2-吡啶基]磺酰基]吡啶-3-甲酰胺(376mg,77%)。esi-ms m/z计算值681.2112,实验值682.2(m 1)
;
保留时间:1.83分钟(lc方法a)。
[1519]
步骤8:6-叔丁基-2-氯-n-[[6-[[3-[(3s)-5,5-二甲基吡咯烷-3-基]-1-嘧啶-5-基-丙基]氨基]-2-吡啶基]磺酰基]吡啶-3-甲酰胺
[1520][1521]
在回流和氮气氛围下,将6-叔丁基-2-氯-n-[[6-[[3-[(3s)-5,5-二甲基-1-(2,2,2-三氟乙酰基)吡咯烷-3-基]-1-嘧啶-5-基-丙基]氨基]-2-吡啶基]磺酰基]吡啶-3-甲酰胺(376mg,0.551mmol)和k2co3(800mg,5.788mmol)于甲醇(17ml):水(7ml)中的混合物在90℃下加热4小时。将混合物冷却至室温,真空浓缩,并且将残与物在水与etoac之间分配。将混合物用1n hcl缓慢酸化,直至ph=4。然后将混合物用etoac进一步稀释,分离有机层,并用乙酸乙酯重新萃取水层。将合并的有机层用盐水洗涤,经硫酸钠干燥并蒸发至干燥,得到灰白色固体6-叔丁基-2-氯-n-[[6-[[3-[(3s)-5,5-二甲基吡咯烷-3-基]-1-嘧啶-5-基-丙基]氨基]-2-吡啶基]磺酰基]吡啶-3-甲酰胺(盐酸盐)(201mg,59%)。esi-ms m/z计算值585.2289,实验值586.2(m 1)
;保留时间:1.23分钟(lc方法a)。
[1522]
步骤9:(14s)-8-叔丁基-12,12-二甲基-17-(嘧啶-5-基)-5λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮,化合物298(非对映异构体1),和(14s)-8-叔丁基-12,12-二甲基-17-(嘧啶-2-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮,化合物297(非对映异构体2)
[1523][1524]
将6-叔丁基-2-氯-n-[[6-[[3-[(3s)-5,5-二甲基吡咯烷-3-基]-1-嘧啶-5-基-丙基]氨基]-2-吡啶基]磺酰基]吡啶-3-甲酰胺(盐酸盐)(181.1mg,0.2908mmol)、k2co3(400mg,2.894mmol)、分子筛和dmso(4.5ml)溶解于20ml微波小瓶中。将所得混合物用氮气吹扫,封盖,加热至165℃并搅拌40小时。将混合物冷却至环境温度,并且过滤并在氮气流下浓缩,得到残余物。该混合物通过反相制备型色谱法,利用c
18
柱和历经30分钟20%-80%乙腈/水( 5mm hcl)梯度进行处,得到两个产物峰,分离出非对映异构体:
[1525]
非对映异构体1:极性较大,灰白色固体:(14s)-8-叔丁基-12,12-二甲基-17-(嘧啶-5-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),
5,7,9,19(23),20-六烯-2,2,4-三酮(60mg,38%)。esi-ms m/z计算值549.2522,实验值550.2(m 1)
;1.82分钟(lc方法a)。
[1526]
非对映异构体2:极性较低,灰白色固体:(14s)-8-叔丁基-12,12-二甲基-17-(嘧啶-5-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮(盐酸盐)(16.16mg,18%)。1h nmr(500mhz,dmso-d6)δ12.53(s,1h),9.12(s,1h),8.96(s,2h),8.03(s,1h),7.69-7.60(m,2h),7.11(dd,j=7.2,2.4hz,1h),6.85(d,j=8.6hz,1h),6.65(dd,j=8.0,2.4hz,1h),5.24(d,j=11.3hz,1h),3.24(t,j=8.6hz,1h),2.75(t,j=10.3hz,1h),2.28(s,1h),2.14-2.06(m,1h),1.82(d,j=7.3hz,1h),1.78-1.69(m,2h),1.63(s,3h),1.55(t,j=12.3hz,1h),1.49(d,j=2.7hz,3h),1.48-1.36(m,1h),1.26(d,j=2.6hz,9h)。esi-ms m/z计算值549.2522,实验值550.2(m 1)
;保留时间:1.89分钟(lc方法a)。
[1527]
实施例16:4-[(14s)-8-叔丁基-12,12-二甲基-2,2,4-三氧代-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-17-基]苯甲酸,化合物291(非对映异构体1)和化合物290(非对映异构体2)的制备
[1528][1529]
步骤1:4-[1-(叔丁基亚磺酰基氨基)-3-[(3s)-5,5-二甲基-1-(2,2,2-三氟乙酰基)吡咯烷-3-基]丙基]苯甲酸甲酯
[1530][1531]
将4-碘苯甲酸甲酯(5.1g,19.073mmol)溶解于thf(75ml)中,并且在氮气球下,将澄清溶液在干冰/丙酮浴(-23℃至-19℃)中冷却。然后在3分钟内经由注射器分批添加异丙基氯化镁(14.8ml,1.3m于thf中,19.240mmol)。将所得混合物(浅棕色)在相同温度范围内搅拌100分钟。然后将其冷却至-30℃。在5分钟内缓慢添加(ne)-n-[3-[(3s)-5,5-二甲基-1-(2,2,2-三氟乙酰基)吡咯烷-3-基]亚丙基]-2-甲基-丙烷-2-亚磺酰胺(2.37g,6.3524mmol)于dcm(20ml)中的溶液。将混合物在此温度范围内进一步搅拌2小时。一次性添加饱和nh4cl水溶液(30ml),并且使混合物从冷却浴中升温至室温。蒸发大部分挥发物,并且将残余物在etoac与水(各50ml)之间分配。分离各层,并将水层用etoac(20ml)萃取一次。合并的有机物经无水mgso4干燥,过滤并浓缩。通过硅胶柱,使用5%-100%etoac/己烷来纯化残余物,得到4-[1-(叔丁基亚磺酰基氨基)-3-[(3s)-5,5-二甲基-1-(2,2,2-三氟乙酰基)吡咯烷-3-基]丙基]苯甲酸甲酯(2.66g,81%)。esi-ms m/z计算值490.2113,实验值491.6(m 1)
;保留时间:3.32分钟(lc方法b)。
[1532]
步骤2:4-[1-氨基-3-[(3s)-5,5-二甲基-1-(2,2,2-三氟乙酰基)吡咯烷-3-基]丙基]苯甲酸甲酯
[1533][1534]
在室温下,将4-[1-(叔丁基亚磺酰基氨基)-3-[(3s)-5,5-二甲基-1-(2,2,2-三氟乙酰基)吡咯烷-3-基]丙基]苯甲酸甲酯(2.6g,5.0349mmol)溶解于meoh(30ml)中。通过移液管添加含hcl(12ml,4m,48.000mmol)的二噁烷。将混合物在室温下搅拌1小时。将混合物真空浓缩以移除大多数挥发物。将残余物在dcm与饱和碳酸氢钠水溶液(各40ml)之间分配。分离各层,并将水层用dcm(15ml)萃取一次。合并的有机物经无水na2so4干燥,过滤并浓缩,得到4-[1-氨基-3-[(3s)-5,5-二甲基-1-(2,2,2-三氟乙酰基)吡咯烷-3-基]丙基]苯甲酸甲酯(1.9g,93%)。esi-ms m/z计算值386.1817,实验值387.5(m 1)
;保留时间:2.43分钟(lc方法b)。
[1535]
步骤3:4-[3-[(3s)-5,5-二甲基-1-(2,2,2-三氟乙酰基)吡咯烷-3-基]-1-[(6-氨磺酰基-2-吡啶基)氨基]丙基]苯甲酸甲酯
二甲基-1-(2,2,2-三氟乙酰基)吡咯烷-3-基]丙基]苯甲酸甲酯(282.7mg,65%)。esi-ms m/z计算值737.2262,实验值738.1(m 1)
;保留时间:0.79分钟(lc方法d)。
[1541]
步骤5:4-[1-[[6-[(6-叔丁基-2-氯-吡啶-3-羰基)氨磺酰基]-2-吡啶基]氨基]-3-[(3s)-5,5-二甲基吡咯烷-3-基]丙基]苯甲酸
[1542][1543]
将4-[1-[[6-[(6-叔丁基-2-氯-吡啶-3-羰基)氨磺酰基]-2-吡啶基]氨基]-3-[(3s)-5,5-二甲基-1-(2,2,2-三氟乙酰基)吡咯烷-3-基]丙基]苯甲酸甲酯(280mg,0.3793mmol)和碳酸钾(1.048g,7.583mmol)与异丙醇(2.8ml)、水(2.8ml)和甲醇(230.5μl,5.690mmol)合并于小瓶中。将所得混合物封盖,加热至100℃并搅拌过夜。将其冷却至室温,添加甲醇(2ml,49.37mmol),然后将混合物封盖,加热至100℃并搅拌6天。将其冷却至室温,用水(50ml)和1n hcl(50ml)稀释,然后用etoac萃取(3x,每次萃取时添加痕量的meoh以增加溶解度)。合并的有机层经硫酸钠干燥,过滤并浓缩,得到白色固体4-[1-[[6-[(6-叔丁基-2-氯-吡啶-3-羰基)氨磺酰基]-2-吡啶基]氨基]-3-[(3s)-5,5-二甲基吡咯烷-3-基]丙基]苯甲酸(238.3mg,100%)。esi-ms m/z计算值627.2282,实验值628.2(m 1)
;保留时间:0.52分钟(lc方法d)。
[1544]
步骤6:4-[(14s)-8-叔丁基-12,12-二甲基-2,2,4-三氧代-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-17-基]苯甲酸
[1545][1546]
向4-[1-[[6-[(6-叔丁基-2-氯-吡啶-3-羰基)氨磺酰基]-2-吡啶基]氨基]-3-[(3s)-5,5-二甲基吡咯烷-3-基]丙基]苯甲酸(238.3mg,0.3793mmol)于nmp(14.3ml)中的溶液中添加碳酸钾(367.1mg,2.656mmol)。将混合物用氮气吹扫5分钟。将混合物在165℃下加热2天。将混合物冷却至室温,用1n hcl稀释并用etoac(2x)萃取。将有机相合并,干燥(硫酸钠),过滤并浓缩,得到棕色油状物,将所述棕色油状物过滤并使用反相hplc-ms方法,使用由phenomenex销售的luna c
18
柱(75
×
30mm,5μm粒度)(pn:00c-4252-u0-ax),和在15.0分钟内从1%-99%流动相b运行的双梯度(流动相a=h2o(5mm hcl),流动相b=乙腈,流速=
基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5,7,9,19,21-六烯-2,2,4-三酮,化合物42(非对映异构物2)和化合物43(非对映异构体1)的制备
[1551][1552][1553]
步骤1:3-(2-甲基-2-硝基-丙基)四氢呋喃-2-酮
[1554][1555]
将溶解于乙腈(1.1l)中的3-亚甲基四氢呋喃-2-酮(99.61g,974.78mmol)的溶液以缓慢流添加到dbu(22ml,147.11mmol)和2-硝基丙烷(105ml,1.169mol)的混合物中。反应是放热的:添加速率使得在添加过程中内部温度保持低于35℃。将所得溶液在室温下搅拌过夜,然后真空浓缩,得到浅黄色固体。将粗产物在乙醚(500ml)中搅拌过夜,然后过滤。丢弃滤液,并将所得浅黄色固体真空干燥。lcms检测到一些dbu残余物。将粗产物合并以进行进一步纯化。将固体在乙醚(500ml)中再搅拌,然后过滤。将固体溶解于dcm(500ml)中,并用3.0m hcl水溶液(2x500ml)、h2o(500ml)、饱和碳酸氢钠水溶液(500ml)和饱和nacl水溶液(500ml)洗涤。dcm层经无水硫酸镁干燥,过滤并真空浓缩,得到3-(2-甲基-2-硝基-丙基)四氢呋喃-2-酮(144.69g,77%)。1h nmr(500mhz,dmso-d6)δ4.28(td,j=8.6,1.5hz,1h),4.14-4.05(m,1h),2.69(dddd,j=11.5,9.9,8.6,2.9hz,1h),2.44(dd,j=14.8,2.9hz,1h),2.34-2.25(m,1h),2.11-2.00(m,1h),1.86(qd,j=11.7,8.6hz,1h),1.60(s,3h),1.58(s,3h)。esi-ms m/z计算值187.0845,实验值210.1(m na) ;保留时间:1.34分钟(lc方法b)。
[1556]
步骤2:(3r)-3-(2-甲基-2-硝基-丙基)四氢呋喃-2-酮和(3s)-3-(2-甲基-2-硝基-丙基)四氢呋喃-2-酮
[1557][1558]
使用chiralpak ig(250x21.2mm),5μm;柱;温度:在32%meoh(无改性剂)、68%co2和70ml/min的流速下为40℃;浓度:约32mg/ml于meoh(无改性剂)中,进样体积500μl对外消旋3-(2-甲基-2-硝基-丙基)四氢呋喃-2-酮(118.56g,633.4mmol)进行制备型手性sfc。分离出两种异构体:
[1559]
峰1:(3r)-3-(2-甲基-2-硝基-丙基)四氢呋喃-2-酮(55.8g,94%)。1h nmr(400mhz,dmso-d6)δ4.27(s,1h),4.09(d,j=6.2hz,1h),2.69(d,j=9.9hz,1h),2.43(d,j=17.4hz,1h),2.29(d,j=6.3hz,1h),2.06(d,j=10.0hz,1h),1.85(d,j=20.3hz,1h),1.59(s,3h),1.58(s,3h)。
[1560]
峰2:(3s)-3-(2-甲基-2-硝基-丙基)四氢呋喃-2-酮(56.8g,96%)。1h nmr(400mhz,dmso-d6)δ4.27(s,1h),4.10(d,j=16.5hz,1h),2.68(d,j=10.0hz,1h),2.43(d,j=14.8hz,1h),2.29(s,1h),2.10
–
1.97(m,1h),1.92
–
1.77(m,1h),1.59(s,3h),1.58(s,3h)。
[1561]
步骤3:(3r)-3-(2-羟乙基)-5,5-二甲基-吡咯烷-2-酮
[1562]
[1563]
将(3r)-3-(2-甲基-2-硝基-丙基)四氢呋喃-2-酮(35.7g,184.99mmol)、雷尼镍(5.0g,57.019mmol)和etoh(350ml)的混合物在80℃下于3巴氢下在parr反应器中搅拌24小时。添加硅藻土(10g),并过滤所得浆液。将固体用乙醇(2x150ml)洗涤并丢弃。将合并的滤液真空浓缩,得到浅棕色固体。将所得固体溶解于dcm(400ml)和1m hcl水溶液(100ml)中。分离各层。将水层饱和并用氯化钾搅拌,然后用dcm(300ml x 3)萃取。合并的dcm层经硫酸钠干燥,过滤并真空浓缩。将粗制浅棕色固体(28.67g)与乙醚(200ml)一起研磨过夜并过滤,得到白色固体。(3r)-3-(2-羟乙基)-5,5-二甲基-吡咯烷-2-酮(26.36g,86%)。esi-ms m/z计算值157.1103,实验值158.0(m 1)
;保留时间:1.48分钟(lc方法b)。
[1564]
步骤4:2-[(3r)-5,5-二甲基吡咯烷-3-基]乙醇
[1565][1566]
在0℃下,在搅拌下向溶解于无水thf(280ml)中的(3r)-3-(2-羟乙基)-5,5-二甲基-吡咯烷-2-酮(26.36g,159.29mmol)的溶液中逐份添加lah(39.19g,42.737ml,980.93mmol),以防止形成过量气体。移除冰浴,并将所得灰色浆液在60℃下搅拌17小时。在允许冷却至室温之后,将反应物冷却至0℃。缓慢添加h2o(50ml)以防止形成过量气体,并且缓慢添加含15%naoh的h2o(50ml)。再添加120ml的h2o。将淬灭的混合物用乙醚(300ml)稀释。移除冰浴;使混合物升温至室温并搅拌30分钟。混合物经由小硅藻土柱过滤。将固体用乙醚(2x300ml)洗涤,并将合并的滤液真空浓缩,得到2-[(3r)-5,5-二甲基吡咯烷-3-基]乙醇(22.59g,94%)。1h nmr(250mhz,dmso-d6)δ3.39-3.32(m,2h),2.98-2.88(m,1h),2.46-2.34(m,1h),2.23-2.01(m,1h),1.68(dd,j=12.1,8.2hz,1h),1.45(qd,j=6.9,2.0hz,2h),1.11-0.92(m,7h)。esi-ms m/z计算值143.131,实验值144.0(m 1)
;保留时间:1.15分钟(lc方法b)。
[1567]
步骤5:(4r)-4-(2-羟乙基)-2,2-二甲基-吡咯烷-1-甲酸叔丁酯
[1568][1569]
向在0℃下搅拌的2-[(3r)-5,5-二甲基吡咯烷-3-基]乙醇(9.7462g,64.645mmol)于二噁烷(100ml)中的溶液中依次添加naoh水溶液(100ml,1m,100.00mmol)和碳酸叔丁氧羰基叔丁酯(17.55g,18.474ml,78.001mmol)。将反应物升温至室温并在室温下搅拌2小时。将混合物用h2o(200ml)稀释,并用etoac(3x250ml)萃取。有机层经无水硫酸钠干燥,过滤并真空浓缩。对粗制油状物进行快速色谱(以dcm装载)(220g sio2,在60分钟内以0至50%etoac/己烷洗脱),得到(4r)-4-(2-羟乙基)-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(11.781g,73%)。1h nmr(250mhz,dmso-d6)δ4.48-4.39(m,1h),3.65-3.44(m,1h),2.86-2.67(m,1h),2.14(s,1h),1.94-1.79(m,1h),1.53-1.10(m,20h)。esi-ms m/z计算值243.1834,实验值
244.1(m 1)
;保留时间:2.48分钟(lc方法b)。
[1570]
步骤6:(4r)-4-(2-碘乙基)-2,2-二甲基-吡咯烷-1-甲酸叔丁酯
[1571][1572]
将(4r)-4-(2-羟乙基)-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(2g,7.808mmol)溶解于醚(15ml)和乙腈(5ml)的溶剂混合物中,并在冰水浴中冷却。添加三苯基膦(6.15g,23.448mmol),随后添加咪唑(1.6g,23.503mmol)和分子碘(5.95g,23.443mmol)。将混合物在此冰水浴下搅拌1小时,并缓慢升温至室温并搅拌4小时。然后将其在醚和水之间分配。有机层经无水mgso4干燥,过滤并浓缩至其体积的1/4。添加己烷(40ml)。使混合物在室温下静置15小时。然后将其倾析。将残余物用醚/己烷的溶剂混合物(1:3,v:v,总共20ml)洗涤数次。浓缩合并的洗涤液。将残余物装载于40g柱上,并使用0-30%etoac/己烷梯度来纯化,得到(4r)-4-(2-碘乙基)-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(2g,69%)。esi-ms m/z计算值353.0852,实验值354.5(m 1)
;保留时间:4.29分钟,呈浅黄色油状物(lc方法b)。
[1573]
步骤7:2-(2,2,6,6-四甲基四氢吡喃-4-基)乙酸甲酯
[1574][1575]
将2-二乙氧基磷酰乙酸甲酯(5g,23.315mmol)溶解于thf(80ml)中,并且在氮气球下在冰水浴中冷却。以小份添加nah(918mg,60%w/w,22.952mmol)。将混合物在此温度下搅拌30分钟。添加2,2,6,6-四甲基四氢吡喃-4-酮(2.8g,17.565mmol)于thf(5ml)中的溶液。移除冷却浴。将混合物在室温下搅拌3小时,然后将混合物置于55℃油浴中并搅拌15小时。将混合物冷却至室温。添加nh4cl(10ml,饱和水溶液)。将混合物用etoac(80ml)和水(100ml)萃取。将有机层用盐水洗涤,经无水mgso4干燥,过滤并浓缩。将残余物溶解于meoh(10ml)中。添加pd/c(10%w:w,400mg,0.3759mmol)。将混合物用氮气吹扫,并在parr振荡器上在50psi氢压力下氢化24小时。将催化剂滤出,并浓缩滤液,并且通过硅胶色谱法(80g柱),使用0-40%etoac/己烷来纯化残余物,得到2-(2,2,6,6-四甲基四氢吡喃-4-基)乙酸甲酯(4g,96%)。1h nmr(250mhz,氯仿-d)δ3.69(s,3h),2.21(d,j=6.5hz,2h),1.66
–
1.52(m,2h),1.27(s,6h),1.19(s,6h),1.15
–
0.85(m,3h)。
[1576]
步骤8:(4s)-4-[4-甲氧基-4-氧代-3-(2,2,6,6-四甲基四氢吡喃-4-基)丁基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯
[1577][1578]
将2-(2,2,6,6-四甲基四氢吡喃-4-基)乙酸甲酯(4g,16.799mmol)溶解于thf(60ml)中,并将混合物在氮气球下在干冰丙酮浴中冷却并搅拌15分钟。添加lda(9.5ml,2m于thf/庚烷/乙苯中,19.00mmol)。将混合物在干冰丙酮浴中搅拌1小时。然后添加含(4r)-4-(2-碘乙基)-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(2g,5.379mmol)的thf(5ml)。将混合物搅拌30分钟,并且然后使其升温至0℃。lc/ms显示几乎没有反应。再将混合物在干冰丙酮浴中冷却。添加lda(0.8ml,2m于thf/庚烷/乙苯中,1.41mmol)。使混合物在搅拌下升温至室温持续15小时。添加nh4cl(10ml,饱和水溶液)。然后使混合物在etoac(50ml)和水(50ml)之间分配。分离各层,并用etoac(30ml)萃取水层。合并的有机物经无水mgso4干燥,过滤并浓缩。通过硅胶色谱法(40g柱),使用0-40%etoac/己烷来纯化残余物,得到(4s)-4-[4-甲氧基-4-氧代-3-(2,2,6,6-四甲基四氢吡喃-4-基)丁基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(2g,76%)。esi-ms m/z计算值439.3298,实验值440.6(m 1)
;保留时间:4.56分钟,呈无色油状物(lc方法b)。
[1579]
步骤9:4-[(3s)-1-叔丁氧基羰基-5,5-二甲基-吡咯烷-3-基]-2-(2,2,6,6-四甲基四氢吡喃-4-基)丁酸
[1580][1581]
将(4s)-4-[4-甲氧基-4-氧代-3-(2,2,6,6-四甲基四氢吡喃-4-基)丁基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(2g,4.094mmol)溶解于thf(15ml)中。添加含lioh(1.72g,40.988mmol)的水(5ml),随后添加meoh(5ml)。将混合物在45℃油浴中加热24小时。然后将其冷却至室温,用1n hcl(50ml)酸化并用醚萃取。将合并的醚溶液用盐水洗涤,过滤并浓缩,得到粗制4-[(3s)-1-叔丁氧基羰基-5,5-二甲基-吡咯烷-3-基]-2-(2,2,6,6-四甲基四氢吡喃-4-基)丁酸(1.5g,77%)。esi-ms m/z计算值425.3141,实验值426.6(m 1)
;保留时间:3.97分钟(lc方法b)。
[1582]
步骤10:(4s)-4-[3-氨基-3-(2,2,6,6-四甲基四氢吡喃-4-基)丙基]-2,2-二甲
基-吡咯烷-1-甲酸叔丁酯
[1583][1584]
在室温下,将4-[(3s)-1-叔丁氧基羰基-5,5-二甲基-吡咯烷-3-基]-2-(2,2,6,6-四甲基四氢哌喃-4-基)丁酸(1.5g,3.1720mmol)溶解于甲苯(40ml)中。添加tea(544.50mg,0.75ml,5.3810mmol),随后添加dppa(0.70ml,3.093mmol)。将混合物置于90℃油浴中并加热2小时。然后将其冷却至室温,并在etoac(40ml)和水(40ml)之间分配。将有机层用水(30ml)和盐水洗涤。然后将其浓缩。将残余物溶解于thf(20ml)中,然后添加koh(623mg,11.104mmol)于水(10ml)中的溶液。将混合物在室温下搅拌30分钟。在真空下移除大多数挥发物。将残余物溶解于dcm(30ml)中,并且用水(20ml x 3)洗涤。然后dcm溶液经无水mgso4干燥,过滤并浓缩。粗物质不经进一步纯化即用于下一步。(4s)-4-[3-氨基-3-(2,2,6,6-四甲基四氢吡喃-4-基)丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(600mg,43%)。esi-ms m/z计算值396.3352,实验值397.6(m 1)
;保留时间:3.14分钟(lc方法b)。
[1585]
步骤11:(4s)-2,2-二甲基-4-[3-[(6-氨磺酰基-2-吡啶基)氨基]-3-(2,2,6,6-四甲基四氢吡喃-4-基)丙基]吡咯烷-1-甲酸叔丁酯
[1586][1587]
将(4s)-4-[3-氨基-3-(2,2,6,6-四甲基四氢吡喃-4-基)丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯溶解(600mg,1.437mmol)于dmso(2ml)中。添加6-氟吡啶-2-磺酰胺(355mg,2.015mmol),然后添加na2co3(503mg,4.746mmol)。将混合物置于预热的110℃油浴中,并在氮气球下搅拌24小时。然后将其冷却至室温,并用etoac/水(各20ml)稀释。分离各层,并用etoac(20ml)萃取水层。合并的有机物经无水mgso4干燥,过滤并浓缩。通过硅胶色谱法(40g柱),使用0-50%etoac/己烷来纯化残余物,得到(4s)-2,2-二甲基-4-[3-[(6-氨磺酰基-2-吡啶基)氨基]-3-(2,2,6,6-四甲基四氢吡喃-4-基)丙基]吡咯烷-1-甲酸叔丁酯(500mg,60%)。esi-ms m/z计算值552.3345,实验值553.5(m 1)
;保留时间:4.03分钟(lc方法b)。
[1588]
步骤12:(4s)-4-[3-[[6-[(6-叔丁基-2-氟-吡啶-3-羰基)氨磺酰基]-2-吡啶基]
氨基]-3-(2,2,6,6-四甲基四氢吡喃-4-基)丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯,非对映异构体1,和(4s)-4-[3-[[6-[(6-叔丁基-2-氟-吡啶-3-羰基)氨磺酰基]-2-吡啶基]氨基]-3-(2,2,6,6-四甲基四氢吡喃-4-基)丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯,非对映异构体2
[1589][1590]
在室温下,将6-叔丁基-2-氟吡啶-3-甲酸(688mg,3.489mmol)溶解于thf(2ml)中。一次性添加cdi(564mg,3.478mmol)。将混合物在氮气球下搅拌15小时。然后添加(4s)-2,2-二甲基-4-[3-[(6-氨磺酰基-2-吡啶基)氨基]-3-(2,2,6,6-四甲基四氢吡喃-4-基)丙基]吡咯烷-1-甲酸叔丁酯(500mg,0.859mmol),随后立即添加dbu(0.52ml,3.4772mmol)。将反应物用饱和nh4cl和盐水(各5ml)的1/1混合物淬灭,并用etoac萃取。合并的有机层经无水mgso4干燥,过滤并浓缩。通过反相hplc(varian c
18
柱100mm x 30mm,从40%-100%流动相b运行的双梯度,流动相a=水(0.1%tfa),流动相b=乙腈(0.1%tfa))纯化残余物,得到两种分离的异构体:
[1591]
非对映异构体1:(4s)-4-[3-[[6-[(6-叔丁基-2-氟-吡啶-3-羰基)氨磺酰基]-2-吡啶基]氨基]-3-(2,2,6,6-四甲基四氢吡喃-4-基)丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(230mg,36%)。esi-ms m/z计算值731.4092,实验值732.9(m 1)
;保留时间:4.69分钟(lc方法b)。
[1592]
非对映异构体2:(4s)-4-[3-[[6-[(6-叔丁基-2-氟-吡啶-3-羰基)氨磺酰基]-2-吡啶基]氨基]-3-(2,2,6,6-四甲基四氢吡喃-4-基)丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(290mg,44%)。esi-ms m/z计算值731.4092,实验值732.9(m 1)
;保留时间:4.83分钟(lc方法b)。
[1593]
步骤13:6-叔丁基-n-[[6-[[3-[(3s)-5,5-二甲基吡咯烷-3-基]-1-(2,2,6,6-四甲基四氢吡喃-4-基)丙基]氨基]-2-吡啶基]磺酰基]-2-氟-吡啶-3-甲酰胺,非对映异构体2
[1594][1595]
在室温下,将(4s)-4-[3-[[6-[(6-叔丁基-2-氟-吡啶-3-羰基)氨磺酰基]-2-吡啶基]氨基]-3-(2,2,6,6-四甲基四氢吡喃-4-基)丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯,非对映异构体2(290mg,0.3811mmol)溶解于dcm(3ml)中。一次性添加tfa(1ml,12.980mmol)。将混合物在室温下搅拌30分钟。然后将其真空浓缩,得到呈白色泡沫状的6-叔丁基-n-[[6-[[3-[(3s)-5,5-二甲基吡咯烷-3-基]-1-(2,2,6,6-四甲基四氢吡喃-4-基)丙基]氨基]-2-吡啶基]磺酰基]-2-氟-吡啶-3-甲酰胺(三氟乙酸(1))(380mg,127%)。esi-ms m/z计算值631.3568,实验值632.7(m 1)
;保留时间:3.45分钟(lc方法b)。
[1596]
步骤14:(14s)-8-叔丁基-12,12-二甲基-17-(2,2,6,6-四甲基四氢吡喃-4-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5,7,9,19,21-六烯-2,2,4-三酮,化合物42(非对映异构物2)
[1597][1598]
将6-叔丁基-n-[[6-[[3-[(3s)-5,5-二甲基吡咯烷-3-基]-1-(2,2,6,6-四甲基四氢吡喃-4-基)丙基]氨基]-2-吡啶基]磺酰基]-2-氟-吡啶-3-甲酰胺(三氟乙酸(1))(380mg,0.4840mmol)溶解于dmf(6ml)中。添加k2co3(535mg,3.8710mmol)。在氮气球下,将混合物在140℃油浴中加热15小时。将混合物冷却至室温,用水(20ml)稀释,并用etoac(20ml x 2)萃取。将合并的有机物浓缩并通过硅胶色谱法(40g柱),使用0-40%etoac/己烷进行纯化,得到呈白色固体状的(14s)-8-叔丁基-12,12-二甲基-17-(2,2,6,6-四甲基四氢吡喃-4-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5,7,9,19,21-六烯-2,2,4-三酮,非对映异构体2(145mg,48%)。1h nmr(500mhz,dmso-d6)δ12.46(s,1h),7.62(d,j=8.0hz,1h),7.59
–
7.53(m,1h),7.03(d,j=7.2hz,1h),6.88(d,j=9.1hz,1h),6.73(d,j=8.5hz,1h),6.64(d,j=8.0hz,1h),3.90(s,1h),3.08
–
2.94(m,1h),2.61(t,j=10.5,10.5hz,1h),2.16
–
1.99(m,1h),1.85
–
1.70(m,2h),1.70
–
1.56(m,7h),1.55
–
1.45(m,5h),1.28(s,9h),1.26
–
1.23(m,1h),1.14(d,j=7.9hz,6h),1.12
–
1.07(m,1h),1.04(d,j=8.7hz,6h),0.96(t,j=12.7,12.7hz,h)。esi-ms m/z计算值611.3505,实验值612.5(m 1)
;保留时间:3.41分钟(lc方法h)。
[1599]
使用(4s)-4-[3-[[6-[(6-叔丁基-2-氟-吡啶-3-羰基)氨磺酰基]-2-吡啶基]氨基]-3-(2,2,6,6-四甲基四氢吡喃-4-基)丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯,非对
映异构体1作为起始物质,以类似于上述方式制备下表中的化合物:
[1600][1601]
[1602]
实施例18:(14s,17r)-17-(6-溴吡啶-2-基)-8-叔丁基-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮,化合物215,和(14s,17s)-17-(6-溴吡啶-2-基)-8-叔丁基-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮,化合物214的制备
[1603][1604]
步骤1:(4s)-4-[3-(6-溴-2-吡啶基)-3-(叔丁基亚磺酰基氨基)丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯
[1605][1606]
将2,6-二溴吡啶(12g,50.656mmol)溶解于thf(100ml)中。将溶液在干冰丙酮浴中冷却,并且在氮气球下搅拌20分钟。快速逐滴添加n-buli(20ml,2.5m于己烷中,50.00mmol)(放热反应)。将混合物在干冰丙酮浴中搅拌45分钟。添加含(4s)-4-[(3e)-3-叔丁基亚磺酰基亚氨基丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(8g,22.313mmol)的thf(20ml加上5ml冲洗液)。在15分钟后,添加nh4cl(30ml,饱和水溶液),随后添加水(100ml)和etoac(100ml)。使混合物升温至室温。将各层分离,并浓缩有机层,并且通过硅胶色谱法(120g柱),使用5%-50%etoac/己烷来纯化残余物,得到(4s)-4-[3-(6-溴-2-吡啶基)-3-(叔丁基亚磺酰基氨基)丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(8g,62%)。esi-ms m/z计算值515.1817,实验值518.5(m 1)
;保留时间:3.86分钟(lc方法b)。
[1607]
步骤2:(4s)-4-[3-氨基-3-(6-溴-2-吡啶基)丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯
[1608][1609]
将(4s)-4-[3-(6-溴-2-吡啶基)-3-(叔丁基亚磺酰基氨基)丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(8g,13.939mmol)溶解于thf(100ml)和水(20ml)的溶剂混合物中。添加分子碘(980mg,0.1988ml,3.8612mmol)。然后将混合物在50℃油浴中加热3小时。将其冷却至室温,并用etoac(100ml)和nas2o3(10g于50ml饱和碳酸氢钠水溶液中)稀释。分离各层。将有机层用盐水(50ml)洗涤,经无水na2so4干制,过滤并浓缩。粗棕色油状物不经进一步纯化即用于下一步。(4s)-4-[3-氨基-3-(6-溴-2-吡啶基)丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(7g,110%)。esi-ms m/z计算值411.1521,实验值414.5(m 1)
;保留时间:2.86分钟(lc方法b)。
[1610]
步骤3:(4s)-4-[3-(6-溴-2-吡啶基)-3-[(6-氨磺酰基-2-吡啶基)氨基]丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯
[1611][1612]
向(4s)-4-[3-氨基-3-(6-溴-2-吡啶基)丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(6.28g,12.945mmol)和6-氟吡啶-2-磺酰胺(4.5g,24.266mmol)于dmso(13ml)中的混合物中添加diea(6.5ml,37.317mmol)。将混合物在115℃下搅拌20小时。将反应混合物冷却至室温,并且然后用水(200ml)和etoac(100ml)稀释。分离各层,并将有机层用盐水(2 x100ml)洗涤,经无水na2so4干燥,并浓缩。通过硅胶色谱法(120g柱),使用0-80%etoac/己烷来纯化残余物,得到浅色固体(7.8g,纯度约60%),将所述固体溶解于dmso(约30ml)中用于进行制备型hplc(柱:varian c
18 10μm 5x30cm;流速:60ml/min;流动相a:水 0.1%tfa;流动相b:乙腈 0.1%tfa;方法:立历经60分钟0-45%b)。将纯级分合并,并用饱和碳酸氢钠碱化,并且移除乙腈。将产物用dcm萃取,并将有机相用盐水洗涤,经硫酸钠干燥并浓缩,得到呈白色粉末状的(4s)-4-[3-(6-溴-2-吡啶基)-3-[(6-氨磺酰基-2-吡啶基)氨基]丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(4.15g,54%)。1h nmr(500mhz,dmso-d6)δ7.67(t,j=7.7,7.7hz,1h),7.62
–
7.50(m,3h),7.48(d,j=7.7hz,1h),7.08(s,2h),6.97(d,j=7.2hz,1h),6.72(d,j=10.1hz,1h),5.15(bs,1h),3.59
–
3.47(m,1h),2.84
–
2.68(m,1h),2.15
–
2.02(m,1h),1.96
–
1.77(m,3h),1.46
–
1.31(m,15h),1.23(s,3h)。esi-ms m/z计算值567.1515,实验值568.3(m 1)
;保留时间:2.72分钟(lc方法h)。
2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮,化合物214
[1620][1621]
向n-[[6-[[1-(6-溴-2-吡啶基)-3-[(3s)-5,5-二甲基吡咯烷-3-基]丙基]氨基]-2-吡啶基]磺酰基]-6-叔丁基-2-氟吡啶-3-甲酰胺(三氟乙酸盐)(188.4mg,0.2474mmol)于nmp(11.31ml)中的溶液中添加碳酸钾(239.5mg,1.733mmol)。将混合物用氮气吹扫5分钟。将混合物在165℃下加热16小时。将混合物冷却至室温,用1n hcl稀释并用etoac(1x)萃取。将有机相用盐水(1x)洗涤,干燥(硫酸钠),过滤并浓缩,得到棕色油状物,将所述棕色油状物过滤并使用反相hplc-ms方法,使用由phenomenex销售的luna c
18
柱(75
×
30mm,5μm粒度)(pn:00c-4252-u0-ax),和在15.0分钟内从50%-99%流动相b运行的双梯度(流动相a=h2o(5mm hcl),流动相b=乙腈,流速=50ml/min,进样体积=950μl,并且柱温=25℃)进行纯化,得到待洗脱的第一非对映异构体,呈白色固体状的(14s,17r)-17-(6-溴吡啶-2-基)-8-叔丁基-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮(37.3mg,46%)。esi-ms m/z计算值626.1675,实验值629.5(m 1)
;保留时间:2.24分钟,和待洗脱的第二非对映异构体,呈白色固体状的(14s,17s)-17-(6-溴吡啶-2-基)-8-叔丁基-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮(35mg,45%)。esi-ms m/z计算值626.1675,实验值629.5(m 1)
;保留时间:2.27分钟。
[1622]
非对映异构体1:(14s,17r)-17-(6-溴吡啶-2-基)-8-叔丁基-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮,1h nmr(500mhz,dmso-d6)δ12.47(s,1h),7.77-7.61(m,4h),7.52-7.47(m,2h),7.13(dd,j=7.2,0.7hz,1h),6.90(dd,j=8.5,0.8hz,1h),6.66(d,j=8.0hz,1h),5.29-5.16(m,1h),3.17(dd,j=10.8,6.2hz,1h),2.79-2.68(m,1h),2.22(s,1h),1.92(d,j=6.0hz,2h),1.85(dd,j=11.6,5.2hz,1h),1.75(d,j=14.3hz,1h),1.66(s,3h),1.58(t,j=12.4hz,1h),1.51(s,3h),1.49-1.40(m,1h),1.29(s,9h),esi-ms m/z计算值626.1675,实验值629.5(m 1)
;保留时间:2.24分钟(lc方法a)。
[1623]
非对映异构体2:(14s,17s)-17-(6-溴吡啶-2-基)-8-叔丁基-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮,1h nmr(500mhz,dmso-d6)δ12.30(s,1h),7.79(s,1h),7.72(t,j=7.8hz,1h),7.63(dt,j=16.0,7.8hz,2h),7.52(d,j=7.9hz,2h),7.23(d,j=7.2hz,1h),6.86(d,j=8.5hz,1h),6.64(d,j=7.8hz,1h),4.93(s,1h),3.12(s,1h),2.98(s,1h),2.33(s,1h),2.20
–
2.08(m,1h),1.87(dd,j=12.0,6.0hz,1h),1.75(d,j=12.6hz,1h),1.60(s,3h),1.53(s,3h),1.51(s,1h),1.37
–
1.30(m,1h),1.28(s,9h),1.16(d,j=11.9hz,1h)。
esi-ms m/z计算值626.1675,实验值629.5(m 1)
;保留时间:2.27分钟(lc方法a)。
[1624]
实施例19:(14s,17r)-8-叔丁基-12,12-二甲基-17-{1',2',3',6'-四氢-[2,4'-联吡啶]-6-基}-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮,化合物142的制备
[1625][1626]
将(14s,17r)-17-(6-溴吡啶-2-基)-8-叔丁基-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮(30.2mg,0.0456mmol)、4-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)-3,6-二氢-2h-吡啶-1-甲酸叔丁酯(21.16mg,0.0684mmol)、碳酸钾(31.97mg,0.231mmol)、pd(dppf)cl2(3.7mg,0.0045mmol)、dmso(867μl)和水(114μl)合并于小瓶中,并且然后使氮气鼓泡穿过该混合物,持续2分钟。将反应物封盖并加热至120℃,持续2小时。冷却至室温,用1n hcl稀释并用etoac(3x)萃取。将有机级分合并,干燥(硫酸钠),过滤并浓缩,得到残余物,将所述残余物过滤并使用反相hplc-ms方法使用由phenomenex销售的luna c
18
柱(75
×
30mm,5μm粒度)(pn:00c-4252-u0-ax),以及在15.0分钟内从30%-99%流动相b运行的双梯度(流动相a=h2o(5mm hcl),流动相b=乙腈,流速=50ml/min,进样体积=950μl并且柱温=25℃)进行纯化,得到白色固体,将所述白色固体溶解于二氯甲烷(573μl)中,随后添加tfa(208mg,1.825mmol)。将所得混合物搅拌1小时,然后通过旋转蒸发移除挥发物。将所得残余物过滤,并使用反相hplc-ms方法,使用由phenomenex销售的luna c
18
柱(75
×
30mm,5μm粒度)(pn:00c-4252-u0-ax),以及在15.0分钟内从30%-99%流动相b运行的双梯度(流动相a=h2o(5mm hcl),流动相b=乙腈,流速=50ml/min,进样体积=950μl并且柱温=25℃)进行纯化,得到呈白色固体状的(14s,17r)-8-叔丁基-12,12-二甲基-17-{1',2',3',6'-四氢-[2,4'-联吡啶]-6-基}-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮(盐酸盐)(9.9mg,33%)。esi-ms m/z计算值629.3148,实验值630.7(m 1)
;保留时间:1.73分钟(lc方法a)。
[1627]
实施例20:(14s,17r)-8-叔丁基-12,12-二甲基-17-[6-(哌啶-4-基)吡啶-2-基]-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮,化合物132的制备
[1628][1629]
步骤1:6-[(14s,17r)-8-叔丁基-12,12-二甲基-2,2,4-三氧代-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-17-基]-1',2',3',6'-四氢-[2,4'-联吡啶]-1'-甲酸叔丁酯
[1630][1631]
将(14s,17r)-17-(6-溴吡啶-2-基)-8-叔丁基-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮(20.5mg,0.0310mmol)、4-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)-3,6-二氢-2h-吡啶-1-甲酸叔丁酯(14.37mg,0.0465mmol)、碳酸钾(21.7mg,0.157mmol)、pd(dppf)cl2(2.5mg,0.0031mmol)、dmso(589μl)和水(78μl)合并于小瓶中,并且然后使氮气鼓泡穿过该混合物,持续2分钟。将反应物封盖并加热至120℃,持续2小时。冷却至室温,用1n hcl稀释并用etoac(3x)萃取。将有机级分合并,干燥(硫酸钠),过滤并浓缩,得到残余物,将所述残余物过滤并使用反相hplc-ms方法,使用由phenomenex销售的luna c
18
柱(75
×
30mm,5μm粒度)(pn:00c-4252-u0-ax),和在15.0分钟内从30%-99%流动相b运行的双梯度(流动相a=h2o(5mm hcl),流动相b=乙腈,流速=50ml/min,进样体积=950μl并且柱温=25℃)进行纯化,得到呈白色固体状的6-[(14s,17r)-8-叔丁基-12,12-二甲基-2,2,4-三氧代-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-17-基]-1',2',3',6'-四氢-[2,4'-联吡啶]-1'-甲酸叔丁酯(盐酸盐)(22.1mg,93%)。esi-ms m/z计算值729.36725,实验值730.9(m 1)
;保留时间:0.86分钟(lc方法d)。
[1632]
步骤2:(14s,17r)-8-叔丁基-12,12-二甲基-17-[6-(哌啶-4-基)吡啶-2-基]-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮,化合物132
[1633][1634]
将6-[(14s,17r)-8-叔丁基-12,12-二甲基-2,2,4-三氧代-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-17-基]-1',2',3',6'-四氢-[2,4'-联吡啶]-1'-甲酸叔丁酯(盐酸盐)(22.1mg,0.0288mmol)和10%钯/碳(15.35mg,0.01442mmol)的混合物溶解于乙醇(1ml)中并使氮气鼓泡穿过该混合物,持续2分钟。使氢气鼓泡穿过该混合物,持续2分钟,然后用氢气球封盖并搅拌3小时。将反应容器用氮气吹扫,然后经硅藻土垫过滤,随后通过0.2μm玻璃料微过滤。将滤液浓缩,得到残余物,然后将所述残基溶解于dcm(500μl)中,并且添加tfa(89μl,1.154mmol)。将所得混合物搅拌1小时,然后通过选自蒸发移除挥发物。将残余物溶解于dmso中,过滤并使用反相hplc-ms方法,使用由phenomenex销售的luna c
18
柱(75
×
30mm,5μm粒度)(pn:00c-4252-u0-ax),以及在15.0分钟内从30%-99%流动相b运行的双梯度(流动相a=h2o(5mm hcl),流动相b=乙腈,流速=50ml/min,进样体积=950μl并且柱温=25℃)进行纯化,得到呈白色固体状的(14s,17r)-8-叔丁基-12,12-二甲基-17-[6-(哌啶-4-基)吡啶-2-基]-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮(盐酸盐)(6mg,31%)。1h nmr(400mhz,dmso-d6)δ12.49(s,1h),8.84(s,1h),8.49(s,1h),7.73(d,j=10.0hz,1h),7.69-7.59(m,3h),7.31(s,1h),7.14(t,j=7.1hz,2h),6.92(d,j=8.5hz,1h),6.65(d,j=8.0hz,1h),5.20(s,1h),3.36(d,j=12.6hz,2h),3.15(s,1h),3.06-2.92(m,3h),2.75(t,j=10.5hz,1h),2.28-2.08(m,2h),2.02(dd,j=20.1,10.5hz,2h),1.89(dtd,j=25.2,13.1,5.1hz,4h),1.74(d,j=14.5hz,1h),1.66(s,3h),1.59(t,j=12.3hz,1h),1.51(s,3h),1.49-1.39(m,1h),1.28(s,9h)。esi-ms m/z计算值631.33044,实验值632.7(m 1)
;保留时间:1.5分钟(lc方法a)。
[1635]
以下是可商购获得的硼试剂的列表:
[1636]
(二甲基氨基)甲基-三氟-硼酸钾,钾盐1h-吡唑-3-基硼酸
[1637]
2-(3,6-二氢-2h-吡喃-4-基)-4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷
[1638]
4-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)-1h-吡唑
[1639]
3-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)丙腈
[1640]
3-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)氮杂环丁烷-1-甲酸叔丁酯
[1641]
n-[2-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)乙基]氨基甲酸叔丁酯
[1642]
使用在上表中给出的可商购获得的硼试剂,以与上文所述类似的方式制备下表中的化合物。
[1643]
[1644][1645]
[1646][1647]
实施例21:(14s,17r)-17-[6-(3-氨基丙基)吡啶-2-基]-8-叔丁基-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮,化合物134的制备
[1648][1649]
在4ml小瓶中,将3-{6-[(14s)-8-叔丁基-12,12-二甲基-2,2,4-三氧代-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-17-基]吡啶-2-基}丙腈(24mg,0.0395mmol)溶解于etoh(2ml)中,并用氮气吹扫5分钟。向混合物中添加雷尼镍(8mg,50%w/w,0.0681mmol),随后添加氢气球。将混合物密封并在60℃下加热14小时。冷却至室温。移除氢气球,并且用氮气使容器快速脱气。添加2滴浓
缩hcl,搅拌1分钟,然后用甲醇洗脱。将滤液浓缩,溶解于少量dmso中,然后将混合物过滤,并且通过反相制备型色谱法,利用c
18
柱和在15分钟内1%-70%乙腈/水( 5mm hcl)的梯度进行纯化,得到(14s,17r)-17-[6-(3-氨基丙基)吡啶-2-基]-8-叔丁基-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮(盐酸盐)(17.7mg,68%)。1h nmr(400mhz,dmso-d6)δ12.42(s,1h),8.30(s,1h),8.06(s,3h),7.80(s,1h),7.69(d,j=7.8hz,1h),7.64(d,j=8.0hz,1h),7.17(d,j=7.2hz,1h),6.93(d,j=8.4hz,1h),6.66(d,j=8.0hz,1h),5.53(s,1h),3.94(s,1h),3.45(s,1h),3.14(s,2h),2.83(q,j=6.2hz,2h),2.68(t,j=10.3hz,1h),2.37(s,1h),2.03(p,j=7.4hz,4h),1.84(dd,j=11.6,5.1hz,1h),1.77(d,j=14.3hz,1h),1.65(s,3h),1.57(t,j=12.4hz,2h),1.51(s,3h),1.28(s,9h)。esi-ms m/z计算值605.3148,实验值606.5(m 1)
;保留时间:1.38分钟(lc方法a)。
[1650]
实施例22:(14s,17r)-8-叔丁基-12,12-二甲基-17-[6-(4-甲基哌嗪-1-基)吡啶-2-基]-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮,化合物195的制备
[1651][1652]
在小瓶中,将(14s,17r)-17-(6-溴吡啶-2-基)-8-叔丁基-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮(16mg,0.02417mmol)和1-甲基哌嗪(5μl,0.04834mmol)合并于thf(300μl)中,封盖,加热至70℃并搅拌30分钟,然后在微波辐射下于100℃下搅拌30分钟,然后在微波辐射下于125℃下搅拌30分钟。添加1-甲基哌嗪(54μl,0.4834mmol),并在微波辐射下加热至150℃,持续8小时。将化合物浓缩以移除thf,然后溶解于dmso中,过滤并使用反相hplc-ms方法使用由phenomenex销售的luna c
18
柱(75
×
30mm,5μm粒度)(pn:00c-4252-u0-ax),以及在15.0分钟内从1%-99%流动相b运行的双梯度(流动相a=h2o(5mm hcl),流动相b=乙腈,流速=50ml/min,进样体积=950μl并且柱温=25℃)进行纯化。与副产物共洗脱。将含有产物的级分分离,溶解于dmso中,过滤并使用反相hplc-ms方法,使用由phenomenex销售的luna c
18
柱(75
×
30mm,5μm粒度)(pn:00c-4252-u0-ax),以及在15.0分钟内从25%-75%流动相b运行的双梯度(流动相a=h2o(5mm hcl),流动相b=乙腈,流速=50ml/min,进样体积=950μl并且柱温=25℃)进行纯化,得到呈白色固体状的(14s,17r)-8-叔丁基-12,12-二甲基-17-[6-(4-甲基哌嗪-1-基)吡啶-2-基]-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮(盐酸盐)(4.77mg,28%)。esi-ms m/z计算值646.3414,实验值647.7(m 1)
;保留时间:1.67分钟(lc方法a)。
[1653]
以下是可商购获得的胺试剂的列表:
[1654]
吗啉
[1655]
哌啶
[1656]
n',n'-二甲基乙烷-1,2-二胺
[1657]
使用在上表中给出的胺试剂,以与上文所述类似的方式制备下表中的化合物。
[1658][1659]
[1660][1661]
实施例23:6-[(14s,17r)-8-叔丁基-12,12-二甲基-2,2,4-三氧代-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-17-基]吡啶-2-甲腈,化合物211的制备
[1662][1663]
步骤1:6-[(14s,17r)-8-叔丁基-12,12-二甲基-2,2,4-三氧代-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-17-基]吡啶-2-甲腈,化合物211
[1664][1665]
向含(14s,17r)-17-(6-溴吡啶-2-基)-8-叔丁基-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮(24mg,0.0362mmol)的dmf(227μl)中添加二氰基锌(2.8μl,0.0435mmol),随后添加pd(pph3)4(5mg,0.00435mmol)。使反应混合物在氮气下于150℃下搅拌30分钟。过滤并使用反相hplc-ms方法,使用由phenomenex销售的luna c
18
柱(75
×
30mm,5μm粒度)(pn:00c-4252-u0-ax),以及在15.0分钟内从30%-99%流动相b运行的双梯度(流动相a=h2o(5mm hcl),流动相b=乙腈,流速=50ml/min,进样体积=950μl并且柱温=25℃)进行纯化,得到呈白色固体状的6-[(14s,17r)-8-叔丁基-12,12-二甲基-2,2,4-三氧代-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-17-基]吡啶-2-甲腈(15.6mg,75%)。esi-ms m/z计算值573.2522,实验值574.6(m 1)
;保留时间:2.12分钟(lc方法a)。
[1666]
步骤2:6-[(14s,17r)-8-叔丁基-12,12-二甲基-2,2,4-三氧代-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-17-基]吡啶-2-甲腈,化合物211,和6-[(14s,17r)-8-叔丁基-12,12-二甲基-2,2,4-三氧代-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-17-基]吡啶-2-甲酰胺,化合物70
[1667][1668]
向含(14s,17r)-17-(6-溴吡啶-2-基)-8-叔丁基-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮(107.5mg,0.1713mmol)的dmf(1ml)中添加二氰基锌(13μl,0.206mmol),随后添加pd(pph3)4(24mg,0.0206mmol)。使反应混合物在氮气下于150℃下搅拌2小时。过滤并使用反相hplc-ms方法,使用由phenomenex销售的luna c
18
柱(75
×
30mm,5μm粒度)(pn:00c-4252-u0-ax),以及在15.0分钟内从30%-99%流动相b运行的双梯度(流动相a=h2o(5mm hcl),流动相b=乙腈,流速=50ml/min,进样体积=950μl并且柱温=25℃)进行纯化,得到呈白色固体状的6-[(14s,17r)-8-叔丁基-12,12-二甲基-2,2,4-三氧代-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-17-基]吡啶-2-甲腈(60.5mg,62%)。esi-ms m/z计算值573.2522,实验值574.6(m 1)
,保留时间:0.81分钟(lc方法d)。
[1669]
分离出呈白色固体状的副产物,6-[(14s,17r)-8-叔丁基-12,12-二甲基-2,2,4-三氧代-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-17-基]吡啶-2-甲酰胺(8.5mg,8%)(化合物70),esi-ms m/z计算值591.26276,实验值592.6(m 1)
;保留时间:1.95分钟(lc方法a)。
[1670]
步骤3:(14s,17r)-17-[6-(氨基甲基)吡啶-2-基]-8-叔丁基-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮,化合物203
[1671][1672]
将6-[(14s,17r)-8-叔丁基-12,12-二甲基-2,2,4-三氧代-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-17-基]吡啶-2-甲腈(12.9mg,0.0225mmol)溶解于乙醇(1ml)中,并在氮气气氛下添加湿雷尼镍(1.3mg,0.0229mmol)使氮气鼓泡穿过搅拌的悬浮液2分钟,接着使氢气鼓泡2分钟。使混合物配备有氢气球并搅拌过夜。移除氢气球,并且用氮气使容器快速脱气。添加2滴浓缩hcl,搅拌1分钟,然后用甲醇洗脱。将滤液浓缩,溶解于少量dmso中,过滤并使用反相hplc-ms方法,使用由phenomenex销售的luna c
18
柱(75
×
30mm,5μm粒度)(pn:00c-4252-u0-ax),以及在15.0分钟内从30%-99%流动相b运行的双梯度(流动相a=h2o(5mm hcl),流动相b=乙腈,流速=50ml/min,进样体积=950μl并且柱温=25℃)进行纯化,得到呈白色固体状的(14s,17r)-17-[6-(氨基甲基)吡啶-2-基]-8-叔丁基-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮(盐酸盐)(5.1mg,37%)。1h nmr(500mhz,dmso-d6)δ12.55(s,1h),8.53(s,3h),7.81(t,j=7.8hz,2h),7.69-7.60(m,2h),7.41(d,j=7.8hz,1h),7.36(d,j=7.7hz,1h),7.12(d,j=7.2hz,1h),6.99(d,j=8.5hz,1h),6.65(d,j=8.0hz,1h),5.26(t,j=10.1hz,1h),4.17(d,j=5.8hz,2h),3.22(t,j=8.7hz,1h),2.79(t,j=10.4hz,1h),2.30(s,1h),2.13(t,j=12.9hz,1h),1.86(dd,j=12.2,5.4hz,2h),1.74(d,j=12.7hz,1h),1.67(s,3h),1.60(d,j=12.5hz,1h),1.51(s,3h),1.48(s,1h),1.28(s,9h)。esi-ms m/z计算值577.2835,实验值578.6(m 1)
;保留时间:1.61分钟(lc方法a)。
[1673]
步骤4:n-({6-[(14s,17r)-8-叔丁基-12,12-二甲基-2,2,4-三氧代-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-17-基]吡啶-2-基}甲基)氨基甲酸甲酯,化合物101
[1674][1675]
将(14s,17r)-17-[6-(氨基甲基)吡啶-2-基]-8-叔丁基-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮(22.5mg,0.03894mmol)溶解于dcm(2ml)中,然后添加tea(22μl,0.156mmol),随后添加氯甲酸甲酯(3μl,0.0389mmol)并且将所得混合物在室温下搅拌13分钟,然后添加氯甲酸甲酯(3μl,0.03896mmol)和tea(21.72μl,0.1558mmol),搅拌5分钟,加热至60℃,搅拌3分钟,然后冷却至室温并添加氯甲酸甲酯(9μl,0.1168mmol)并搅拌5分钟,然后添加tea(21.72μl,0.1558mmol)和氯甲酸甲酯(15μl,0.1947mmol)并搅拌10分钟。将反应混合物冷却至0℃并添加tea(54μl,0.3894mmol),随后添加氯甲酸甲酯(60μl,0.7787mmol)并在0℃下继续搅拌3小时。用1n hcl稀释,用dcm萃取,然后用etoac萃取。将有机相合并,干燥(mgso4),过滤并浓缩,得到残余物,将所述残余物溶解于dmso中,过滤并使用反相hplc-ms方法,使用由phenomenex销售的luna c
18
柱(75
×
30mm,5μm粒度)(pn:00c-4252-u0-ax),和在15.0分钟内从30%-99%流动相b运行的双梯度(流动相a=h2o(5mm hcl),流动相b=乙腈,流速=50ml/min,进样体积=950μl并且柱温=25℃)进行纯化,得到呈白色固体状的n-({6-[(14s,17r)-8-叔丁基-12,12-二甲基-2,2,4-三氧代-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-17-基]吡啶-2-基}甲基)氨基甲酸甲酯(1.29mg,4%)。esi-ms m/z计算值635.289,实验值636.7(m 1)
;保留时间:1.76分钟(lc方法a)。
[1676]
步骤5:n-({6-[(14s,17r)-8-叔丁基-12,12-二甲基-2,2,4-三氧代-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-17-基]吡啶-2-基}甲基)乙酰胺,化合物100
[1677][1678]
在0℃下,向(14s,17r)-17-[6-(氨基甲基)吡啶-2-基]-8-叔丁基-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮(22.5mg,0.03894mmol)于dcm(22ml)中的搅拌溶液中添加tea(109μl,0.7792mmol),随后添加乙酰氯(17μl,0.2336mmol),并且将所得混合物在0℃下搅拌3小时。用1n hcl稀释,用dcm萃取,然后用etoac萃取。将有机相合并,干燥(mgso4),过滤
3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮的类似物,化合物214的制备
[1683][1684]
使用(14s,17s)-17-(6-溴吡啶-2-基)-8-叔丁基-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮,化合物214作为起始物质,以与上述类似的方式制备下表中的化合物。
[1685][1686]
[1687]
[1688]
[1689]
[1690][1691]
实施例25:(14s)-8-叔丁基-12,12-二甲基-17-[5-(4-甲基哌嗪-1-基)吡啶-2-基]-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮,化合物201的制备
[1692]
在微波小瓶中,将(14s)-8-叔丁基-17-(5-氯吡啶-2-基)-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮(非对映异构体1,化合物209,20mg,0.0343mmol)溶解于1,4-二噁烷(750μl)中,并且向混合物添加叔丁醇钾(6mg,0.05347mmol),随后添加1-甲基哌嗪(5mg,0.0499mmol)和(1,3-双(2,6-二异丙基苯基)咪唑亚基)(3-氯吡啶基)二氯化钯(ii)(peppsi-sipr)(3mg,0.0044mmol)。将混合物用氮气吹扫,密封并加热至100℃,持续4小时。
冷却至室温,并且将混合物过滤,并通过反相制备型色谱法,利用c
18
柱和在15分钟内1%-70%乙腈/水( 5mm hcl)的梯度进行纯化,得到(14s)-8-叔丁基-12,12-二甲基-17-[5-(4-甲基哌嗪-1-基)吡啶-2-基]-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮(盐酸盐)(4.6mg,19%)。esi-ms m/z计算值646.3414,实验值647.3(m 1)
;保留时间:1.28分钟(lc方法a)。
[1693]
实施例26:(14s)-8-叔丁基-12,12-二甲基-17-[5-(2-甲基丙基)吡啶-2-基]-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮,化合物181的制备
[1694][1695]
步骤1:(14s)-8-叔丁基-12,12-二甲基-17-[5-(2-甲基丙-1-烯-1-基)吡啶-2-基]-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮,化合物183
[1696][1697]
在微波小瓶中,将(14s)-8-叔丁基-17-(5-氯吡啶-2-基)-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮(非对映异构体1,化合物209,72mg,0.1235mmol)和4,4,5,5-四甲基-2-(2-甲基丙-1-烯基)-1,3,2-二氧杂环戊硼烷(125mg,0.6866mmol)合并于dmso(1.5ml)中。向混合物中添加[1,1'-双(二苯基膦基)二茂铁]二氯钯(ii)(10mg,0.01367mmol)和碳酸钾水溶液(300μl,2m,0.600mmol),并且使氮气鼓泡穿过悬浮液,持续1分钟。将反应物封盖并加热至105℃,持续20小时。将混合物过滤,并且通过反相制备型色谱法,利用c
18
柱和在30分钟内的20%-80%乙腈/水( 5mm hcl)的梯度进行纯化,得到(14s)-8-叔丁基-12,12-二甲基-17-[5-(2-甲基丙-1-烯-1-基)吡啶-2-基]-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮(33mg,44%)。esi-ms m/z计算值602.3039,实验值603.2(m 1)
;保留时间:1.76分钟(lc方法a)。
[1698]
步骤2:(14s)-8-叔丁基-12,12-二甲基-17-[5-(2-甲基丙基)吡啶-2-基]-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮,化合物181
[1699][1700]
在氮气冲洗的20ml小瓶中,将(14s)-8-叔丁基-12,12-二甲基-17-[5-(2-甲基丙-1-烯-1-基)吡啶-2-基]-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮(混合物183,35mg,0.05748mmol)溶解于meoh(1.5ml)中。向氮气吹扫的反应溶液中添加钯/碳(5mg,10%w/w,0.0047mmol)并且连接含有氢气的气球。在室温下于氢气球下搅拌4小时之前,使氢气吹扫穿过该溶液1分钟。粗物质经由whatman滤盘过滤,并在氮气流下浓缩,得到粘性残余物。将该混合物用1.5ml dmso稀释,并且然后通过反相制备型色谱法,利用c
18
柱和在30分钟内20%-80%乙腈/水( 5mm hcl)的梯度进行纯化,得到白色固体(14s)-8-叔丁基-12,12-二甲基-17-[5-(2-甲基丙基)吡啶-2-基]-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮(18.3mg,52%)。1h nmr(400mhz,dmso-d6)δ12.52(s,1h),8.63(d,j=2.1hz,1h),8.32(d,j=8.3hz,1h),8.11(d,j=9.3hz,2h),7.73(dd,j=8.5,7.3hz,1h),7.43(d,j=7.9hz,1h),7.35(d,j=7.3hz,1h),6.97(d,j=8.5hz,1h),6.62(d,j=7.9hz,1h),5.09(s,1h),3.93(s,2h),2.68(s,1h),2.64(d,j=7.2hz,2h),2.29(q,j=10.2,9.4hz,1h),2.22
–
2.08(m,1h),1.88(ddd,j=21.7,12.6,6.2hz,2h),1.82
–
1.70(m,1h),1.54(d,j=2.5hz,6h),1.50
–
1.38(m,1h),1.26(s,9h),1.21
–
1.08(m,1h),0.86(dd,j=6.6,2.0hz,6h)。esi-ms m/z计算值604.3196,实验值605.4(m 1)
;保留时间:1.78分钟(lc方法a)。
[1701]
实施例27:与(14s)-8-叔丁基-17-(5-氯吡啶-2-基)-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮,非对映异构体1,化合物209相关的类似物的制备
[1702][1703]
以下是可商购获得的胺试剂的列表:
[1704]
哌啶
[1705]
吗啉
[1706]
以下是可商购获得的硼试剂的列表:
[1707]
1-甲基-3-(4,4,5,5-三甲基-1,3,2-二氧杂环戊硼烷-2-基)吡唑
[1708]
(2-甲基吡唑-3-基)硼酸
[1709]
使用上表中给出的胺和硼试剂,并使用(14s)-8-叔丁基-17-(5-氯吡啶-2-基)-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮,非对映异构体1,化合物209作为起始物质,以与上述类似的方式制备下表中的化合物。
[1710]
[1711]
实施例28:(14s)-17-[5-(氨基甲基)吡啶-2-基]-8-叔丁基-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮,化合物197的制备
[1712][1713]
步骤1:6-[(14s)-8-叔丁基-12,12-二甲基-2,2,4-三氧代-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-17-基]吡啶-3-甲腈,化合物205
[1714][1715]
在微波小瓶中,将(14s)-8-叔丁基-17-(5-氯吡啶-2-基)-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮(非对映异构体1,混合物209,25mg,0.0429mmol)溶解于dmf(500μl):水(5μl)(99:1v:v)中,并且向混合物中添加二氰基锌(4μl,0.0630mmol),随后添加二环己基-[2-(2,6-二甲氧基苯基)苯基]膦(2mg,0.00487mmol)和pd2dba3(2mg,0.00218mmol)。将混合物用氮气吹扫,封盖,并在微波加热下于150℃下在微波中照射30分钟。冷却至室温,并且将混合物过滤,并通过反相制备型色谱法,利用c
18
柱和在15分钟内30%-99%乙腈/水( 5mm hcl)的梯度进行纯化,得到6-[(14s)-8-叔丁基-12,12-二甲基-2,2,4-三氧代-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-17-基]吡啶-3-甲腈(12.9mg,52%)。esi-ms m/z计算值573.2522,实验值574.5(m 1)
;保留时间:2.05分钟(lc方法a)。
[1716]
步骤2:(14s)-17-[5-(氨基甲基)吡啶-2-基]-8-叔丁基-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮,化合物197
[1717][1718]
在微波小瓶中,将6-[(14s)-8-叔丁基-12,12-二甲基-2,2,4-三氧代-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-17-基]吡啶-3-甲腈(化合物205(非对映异构体1),9.2mg,0.01604mmol)溶解于etoh(750μl)中,并用氮气吹扫5分钟。向混合物中添加雷尼镍(3mg,50%w/w,0.0256mmol),随后添加氢气球。将混合物密封并加热至60℃,持续4小时。冷却至室温,并将混合物过滤,并且通过反相制备型色谱法,利用c
18
柱和在15分钟内1%-70%乙腈/水( 5mm hcl)的梯度进行纯化,得到(14s)-17-[5-(氨基甲基)吡啶-2-基]-8-叔丁基-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮(盐酸盐)(3.7mg,37%)。esi-ms m/z计算值577.2835,实验值578.2(m 1)
;保留时间:1.34分钟(lc方法a)。
[1719]
实施例29:与(14s)-8-叔丁基-17-(5-氯吡啶-2-基)-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮,非对映异构体2,化合物208相关的类似物的制备
[1720][1721]
使用(14s)-8-叔丁基-17-(5-氯吡啶-2-基)-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮(非对映异构体2,化合物208)作为起始物质,以与上述类似的方式制备下表中的化合物。
[1722]
[1723]
[1724][1725]
[1726][1727]
实施例30:(14s)-17-(5-溴吡啶-2-基)-8-叔丁基-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮,化合物172(非对映异构体1)和化合物171(非对映异构体2)的制备
[1728][1729]
步骤1:(4s)-4-[3-(5-溴-2-吡啶基)-3-(叔丁基亚磺酰基氨基)丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯
[1730][1731]
将5-溴-2-碘-吡啶(11.6g,39.63mmol)溶解于乙醚(360ml)中,并且在干冰丙酮浴中冷却溶液。出现沉淀并调整搅拌以使悬浮液充分地分散。快速逐滴添加n-buli(16ml,2.5m于己烷中,40.00mmol)。将深棕色悬浮液在-70℃下搅拌45分钟。添加含(4s)-4-[(3e)-3-叔丁基亚磺酰基亚氨基丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(7.2g,20.081mmol)的thf(15ml 3ml冲洗液)。添加nh4cl(饱和水溶液20ml)以淬灭反应物,随后添加水(150ml)和etoac(200ml)。在升温至室温之后,分离各层。合并的有机物经无水mgso4干燥,过滤并浓缩。通过硅胶色谱法(120g柱),使用5%-80%etoac/己烷来纯化残余物,得到呈浅棕色泡沫状的(4s)-4-[3-(5-溴-2-吡啶基)-3-(叔丁基亚磺酰基氨基)丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(9.8g,90%)。esi-ms m/z计算值517.1797,实验值518.6(m 1)
;保留时间:3.93分钟(lc方法b)。
[1732]
步骤2:(4s)-4-[3-氨基-3-(5-溴-2-吡啶基)丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯
[1733][1734]
在环境条件下,在室温下向(4s)-4-[3-(5-溴-2-吡啶基)-3-(叔丁基亚磺酰基氨基)丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(12.526g,24.250mmol)于thf(125ml)和水(32ml)的混合物中的搅拌溶液中添加碘(2.172g,8.5576mmol)。将反应混合物加热至55℃,持续2小时。在冷却至室温之后,将反应混合物倒入饱和碳酸氢钠水溶液(230ml)和饱和na2s2o3水溶液(60ml)的混合物中。在真空下移除挥发物,并用乙酸乙酯(3x200ml)萃取残余水层。将合并的有机层用盐水(120ml)洗涤,经无水硫酸钠干燥并浓缩,得到呈琥珀色油状物的(4s)-4-[3-氨基-3-(5-溴-2-吡啶基)丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(11.353g,100%)。产物不经进一步纯化即用于下一步。esi-ms m/z计算值411.1521,实验值412.3(m 1)
;保留时间:4.5分钟(lc方法c)。
[1735]
步骤3:(4s)-4-[3-(5-溴-2-吡啶基)-3-[(6-氨磺酰基-2-吡啶基)氨基]丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯
[1736][1737]
在氮气下,在室温下向(4s)-4-[3-氨基-3-(5-溴-2-吡啶基)丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(11.353g,24.778mmol)和6-氟吡啶-2-磺酰胺(6.565g,37.265mmol)于无水dmso(40ml)中的搅拌溶液中添加diea(14ml,80.376mmol)。将反应混合物加热至125℃,持续24小时。在冷却至室温之后,将反应混合物倒入水(200ml)和盐水(300ml)的混合物中。将产物用乙酸乙酯(3x250ml)萃取。将合并的有机层用盐水(150ml)洗涤,经无水硫酸钠干燥并浓缩。通过硅胶色谱法,使用0-25%丙酮/己烷的梯度,随后通过反相hplc,使用50%-100%乙腈/水(0.15%tfa缓冲液;c
18
varian柱;60ml/min)的梯度纯化粗产物。将含有纯化产物的所有级分合并,并用饱和碳酸氢钠水溶液碱化至ph约8。在真空下移除挥发物,并用乙酸乙酯(3x250ml)萃取残余水层。将合并的有机层用盐水(150ml)洗涤,经无水硫酸钠干燥并浓缩,得到呈浅黄色固体状的(4s)-4-[3-(5-溴-2-吡啶基)-3-[(6-氨磺酰基-2-吡啶基)氨基]丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(9.124g,61%)。1h nmr(500mhz,dmso-d6)δ8.64(d,j=2.4hz,1h),7.94(dd,j=8.4,2.4hz,1h),7.55-7.45(m,3h),7.02(s,
2h),6.96(d,j=7.2hz,1h),6.70(d,j=8.4hz,1h),5.14(s,1h),3.59-3.45(m,1h),2.82-2.67(m,1h),2.15-2.01(m,1h),1.94-1.75(m,3h),1.41-1.34(m,11h),1.29-1.24(m,4h),1.22(s,3h)。esi-ms m/z计算值567.1515,实验值568.3(m 1)
;保留时间:2.74分钟(lc方法b)。
[1738]
步骤4:(4s)-4-[3-(5-溴-2-吡啶基)-3-[[6-[(6-叔丁基-2-氟-吡啶-3-羰基)氨磺酰基]-2-吡啶基]氨基]丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯
[1739][1740]
向6-叔丁基-2-氟-吡啶-3-甲酸(1.95g,9.888mmol)于thf(45ml)中的溶液中添加cdi(1.56g,9.621mmol),并且将混合物在室温下搅拌20小时。然后添加(4s)-4-[3-(5-溴-2-吡啶基)-3-[(6-氨磺酰基-2-吡啶基)氨基]丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(3.0g,5.277mmol),随后添加dbu(3.23ml,21.60mmol),并将所得混合物在室温下搅拌20小时。将反应物用乙酸乙酯稀释,并用饱和碳酸氢钠水溶液洗涤。将有机层进一步用10%柠檬酸溶液洗涤,随后用盐水洗涤。将有机物分离,经硫酸钠干燥并蒸发。然后通过硅胶色谱法(220克柱),使用10%乙酸乙酯/己烷至100%乙酸乙酯的梯度来纯化粗产物,得到残余物,将所述残余物在高真空泵下放置3小时,得到呈灰白色固体状的(4s)-4-[3-(5-溴-2-吡啶基)-3-[[6-[(6-叔丁基-2-氟-吡啶-3-羰基)氨磺酰基]-2-吡啶基]氨基]丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(非对映异构体混合物,3.5g,89%)。esi-ms m/z计算值746.22614,实验值747.6(m 1)
;保留时间:2.35分钟(lc方法a)。
[1741]
步骤5:(14s)-17-(5-溴吡啶-2-基)-8-叔丁基-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮,化合物172(非对映异构体1),和(14s)-17-(5-溴吡啶-2-基)-8-叔丁基-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮,化合物171(非对映异构体2)
[1742][1743]
阶段1:将(4s)-4-[3-(5-溴-2-吡啶基)-3-[[6-[(6-叔丁基-2-氟-吡啶-3-羰基)氨磺酰基]-2-吡啶基]氨基]丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(2.22g,2.969mmol)溶解于dcm(60ml)中,并且向混合物中添加tfa(7ml,90.86mmol)并在室温下搅拌。在30分钟
后,将混合物蒸发至干燥,然后用乙醚(30ml x 2)稀释,并再浓缩。然后将材料放置在高真空泵上2小时,得到中间体n-[[6-[[1-(5-溴-2-吡啶基)-3-[(3s)-5,5-二甲基吡咯烷-3-基]丙基]氨基]-2-吡啶基]磺酰基]-6-叔丁基-2-氟吡啶-3-甲酰胺,esi-ms m/z计算值646.1737,实验值647.2(m 1)
;保留时间:1.51分钟(lc方法a),呈灰白色固体状。阶段2:来自阶段1的材料与k2co3(4.35g,31.47mmol)、分子筛和nmp(50ml)合并于小瓶中,用氮气吹扫,封盖,加热至150℃并搅拌20小时。冷却至室温,并将混合物用乙酸乙酯和水稀释。将有机层萃取(2x)并用10%柠檬酸溶液进一步洗涤,随后用盐水洗涤。将有机物分离,经硫酸钠干燥,蒸发至浅棕色油状物。通过硅胶色谱法(220克柱),使用10%乙酸乙酯/己烷至100%乙酸乙酯的梯度来纯化该残余物,得到两种产物,非对映异构体分离成两种单一对映异构体。
[1744]
非对映异构体1:极性较小,白色固体,(14s)-17-(5-溴吡啶-2-基)-8-叔丁基-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮(601.6mg,63%)。1h nmr(400mhz,dmso-d6)δ12.28(s,1h),8.68(d,j=2.4hz,1h),8.05-7.94(m,1h),7.75(d,j=7.9hz,1h),7.63(t,j=7.9hz,1h),7.52(d,j=8.5hz,2h),7.21(d,j=7.3hz,1h),6.85(d,j=8.5hz,1h),6.63(d,j=7.9hz,1h),5.14-4.75(m,1h),3.10(s,2h),2.29(d,j=8.9hz,1h),2.15(s,1h),1.85(dd,j=11.9,5.9hz,1h),1.76-1.68(m,1h),1.60(s,3h),1.53(s,5h),1.27(s,9h),1.23(t,j=3.8hz,1h)。esi-ms m/z计算值626.1675,实验值627.3(m 1)
;保留时间:2.28分钟(lc方法a)。
[1745]
非对映异构体2:极性较大,白色固体,(14s)-17-(5-溴吡啶-2-基)-8-叔丁基-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮(561.3mg,59%)。1h nmr(400mhz,dmso-d6)δ12.49(s,1h),8.73-8.58(m,1h),8.00(dd,j=8.4,2.4hz,1h),7.75-7.59(m,3h),7.42(d,j=8.4hz,1h),7.11(d,j=7.2hz,1h),6.87(d,j=8.5hz,1h),6.65(d,j=8.0hz,1h),5.24(q,j=8.8hz,1h),3.19(t,j=8.5hz,1h),2.75(t,j=10.4hz,1h),2.27-2.15(m,1h),1.90(d,j=10.0hz,2h),1.84(dd,j=11.7,5.1hz,1h),1.73(d,j=14.7hz,1h),1.64(s,3h),1.57(t,j=12.3hz,1h),1.51(s,3h),1.28(s,9h),1.23(s,1h)。esi-ms m/z计算值626.1675,实验值627.2(m 1)
;保留时间:2.22分钟(lc方法a)。
[1746]
实施例31:(14s)-8-叔丁基-12,12-二甲基-17-[5-(哌啶-4-基)吡啶-2-基]-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮,化合物154的制备
[1747][1748]
步骤1:6-[(14s)-8-叔丁基-12,12-二甲基-2,2,4-三氧代-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-17-基]-1',2',3',6'-四氢-[3,4'-联吡啶]-1'-甲酸叔丁酯
[1749][1750]
在微波小瓶中,将(14s)-17-(5-溴吡啶-2-基)-8-叔丁基-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮(化合物172(非对映异构体1),30mg,0.0468mmol)和4-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)-3,6-二氢-2h-吡啶-1-甲酸叔丁酯(23mg,0.0744mmol)合并于dmso(1000μl)中。向混合物中添加[1,1'-双(二苯基膦基)二茂铁]二氯钯(ii)
(4.5mg,0.0061mmol)和碳酸钾水溶液(200μl,2m,0.400mmol),并且使氮气鼓泡穿过悬浮液,持续1分钟。将反应物封盖并加热至110℃持续20小时。将混合物过滤,并通过反相制备型色谱法,利用c
18
柱和在30分钟内20%-80%乙腈/水( 5mm hcl)的梯度进行纯化,得到6-[(14s)-8-叔丁基-12,12-二甲基-2,2,4-三氧代-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-17-基]-1',2',3',6'-四氢-[3,4'-联吡啶]-1'-甲酸叔丁酯(21.0mg,61%)。esi-ms m/z计算值729.36725,实验值730.2(m 1)
;保留时间:1.97分钟(lc方法a)。
[1751]
步骤2:4-{6-[(14s)-8-叔丁基-12,12-二甲基-2,2,4-三氧代-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-17-基]吡啶-3-基}哌啶-1-甲酸叔丁酯
[1752][1753]
在氮气吹扫过的20ml小瓶中,将6-[(14s)-8-叔丁基-12,12-二甲基-2,2,4-三氧代-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-17-基]-1',2',3',6'-四氢-[3,4'-联吡啶]-1'-甲酸叔丁酯(21.0mg,0.02848mmol)(源自化合物172(非对映异构体1))溶解于乙醇(1000μl)中。向氮气吹扫的反应溶液中添加钯/碳(10%w/w,5mg,0.0047mmol)并且连接含有氢气的气球。在室温下于氢气球下搅拌3小时之前,使氢气吹扫穿过该溶液1分钟。粗物质经由whatman滤盘过滤,并在氮气流下浓缩,得到粘性残余物4-{6-[(14s)-8-叔丁基-12,12-二甲基-2,2,4-三氧代-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-17-基]吡啶-3-基}哌啶-1-甲酸叔丁酯(20.5mg,98%)。esi-ms m/z计算值731.3829,实验值732.2(m 1)
;保留时间:1.42分钟(lc方法a)。
[1754]
步骤3:(14s)-8-叔丁基-12,12-二甲基-17-[5-(哌啶-4-基)吡啶-2-基]-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮,化合物154
[1755][1756]
将来自峰1的4-{6-[(14s)-8-叔丁基-12,12-二甲基-2,2,4-三氧代-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-17-基]吡啶-3-基}哌啶-1-甲酸叔丁酯(源自化合物172(非对映异构体1),23mg,0.0314mmol)溶解于dcm(1.0ml)中,并向混合物中添加tfa(1.5ml,19.47mmol),并在室温下搅拌。在30分钟之后,将混合物蒸发至干燥,并且然后通过反相制备型色谱法,使用c
18
柱和在15分钟内1%-70%乙腈/水( 5mm hcl)的梯度来纯化残余物,得到呈白色固体状的所需产物(14s)-8-叔丁基-12,12-二甲基-17-[5-(哌啶-4-基)吡啶-2-基]-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮(盐酸盐)(19.0mg,90%)。1h nmr(400mhz,dmso-d6)δ12.43(s,1h),9.19-8.72(m,2h),8.62(d,j=12.2hz,1h),8.40-7.78(m,3h),7.71(q,j=5.5,3.3hz,1h),7.63(d,j=8.0hz,1h),7.18(d,j=7.2hz,1h),6.95(dd,j=10.3,5.4hz,1h),6.66(d,j=8.0hz,1h),5.45(s,1h),3.36(d,j=12.7hz,3h),2.99(d,j=14.2hz,1h),2.93(d,j=12.1hz,1h),2.71(s,1h),2.46-2.32(m,1h),2.06-1.95(m,4h),1.93-1.73(m,4h),1.66(s,3h),1.57(t,j=12.4hz,1h),1.51(s,3h),1.45(d,j=11.4hz,1h),1.28(s,9h)。esi-ms m/z计算值631.33044,实验值632.2(m 1)
;保留时间:1.42分钟(lc方法a)。
[1757]
以下是可商购获得的硼试剂的列表:
[1758]
3-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)氮杂环丁烷-1-甲酸叔丁酯
[1759]
2-(3,6-二氢-2h-吡喃-4-基)-4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷环丙基硼酸
[1760]
3-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)丙腈
[1761]
4-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)-1h-吡唑1h-吡唑-3-基硼酸
[1762]
n-[2-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)乙基]氨基甲酸叔丁酯
[1763]
2-(2-甲氧基乙基)-4,4,5,5-三甲基-1,3,2-二氧杂环戊硼烷(二甲基氨基)甲基-三氟-硼酸钾(钾盐)
[1764]
3-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)丙酸甲酯
[1765]
使用上表中给出的硼试剂并使用(14)-17-(5-溴吡啶-2-基)-8-叔丁基-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮,非对映异构体1,化合物172作为起始物质,以与上述类似的方式制备下表中的化合物。
[1766]
[1767]
[1768]
[1769][1770]
[1771]
[1772][1773]
实施例32:(14s)-8-叔丁基-12,12-二甲基-17-[5-(吡咯烷-1-基)吡啶-2-基]-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮,化合物164的制备
[1774][1775]
在微波小瓶中,将(14s)-17-(5-溴吡啶-2-基)-8-叔丁基-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮(化合物172(非对映异构体1),30mg,0.0468mmol)溶解于二噁烷(650μl)和dmf(600μl)中,并且向混合物中添加碳酸铯(81mg,0.249mmol),随后添加吡咯烷(25μl,0.299mmol)、xantphos(8.6mg,0.0149mmol)和pd2(dba)3(11mg,0.0120mmol)。将混合物用氮气吹扫,密封并在130℃下加热18小时。冷却至室温,并且将混合物过滤,并通过反相制备型色谱法,利用c
18
柱以及使用15分钟运行的在15分钟内20%-80%乙腈/水( 5mm hcl)的梯度进行纯化,得到(14s)-8-叔丁基-12,12-二甲基-17-[5-(吡咯啶-1-基)吡啶-2-基]-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮(19.22mg,64%)。esi-ms m/z计算值617.3148,实验值618.2(m 1)
;保留时间:1.84分钟(lc方法a)。
[1776]
实施例33:(14s)-17-(5-氨基吡啶-2-基)-8-叔丁基-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮,化合物64的制备
[1777][1778]
阶段1:在微波小瓶中,将(14s)-17-(5-溴吡啶-2-基)-8-叔丁基-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮(化合物172(非对映异构体1),30mg,0.04780mmol)溶解于dmf(750μl)中,并且向混合物中添加碳酸铯(95mg,0.2916mmol),随后添加氨基甲酸叔丁酯(30mg,0.2561mmol)、xantphos(9.5mg,0.0164mmol)和pd2(dba)3(11.5mg,0.0126mmol)。将混合物用氮气吹扫,密封并在110℃下加热20小时。冷却至室温,并且将混合物过滤,并通过反相制备型色谱法,利用c
18
柱和在30分钟内1%-70%乙腈/水( 5mm hcl)的梯度进行纯化,得到n-{6-[(14s)-8-叔丁基-12,12-二甲基-2,2,4-三氧代-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-17-基]吡啶-3-基}氨基甲酸叔丁酯。esi-ms m/z计算值663.3203,实验值664.2(m 1)
;保留时间:1.79分钟(lc方
法a)。
[1779]
阶段2:将来自步骤1的混合物溶解于dcm(750μl)中,并且向其中添加tfa(200μl,2.596mmol),并将混合物搅拌30分钟。将样品浓缩并通过反相制备型色谱法,利用c
18
柱和在30分钟内1%-50%乙腈/水( 5mm hcl)的梯度进行纯化,得到(14s)-17-(5-氨基吡啶-2-基)-8-叔丁基-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮(8.5mg,30%)。esi-ms m/z计算值563.2679,实验值564.2(m 1)
;保留时间:1.53分钟(lc方法a)。
[1780]
实施例34:3-{6-[(14s)-8-叔丁基-12,12-二甲基-2,2,4-三氧代-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-17-基]吡啶-3-基}丙酸甲酯,化合物91的制备
[1781][1782]
将3-{6-[(14s)-8-叔丁基-12,12-二甲基-2,2,4-三氧代-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-17-基]吡啶-3-基}丙酸(化合物98,15mg,0.02392mmol)溶解于meoh(500μl)中,并且将溶液冷却至0℃。向混合物中添加亚硫酰氯(20μl,0.2742mmol),并且然后移除冷却浴,并将反应混合物在室温下搅拌4小时。通过反相制备型色谱法,利用c
18
柱和在30分钟内1%-70%乙腈/水( 5mm hcl)的梯度来纯化混合物,得到3-{6-[(14s)-8-叔丁基-12,12-二甲基-2,2,4-三氧代-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-17-基]吡啶-3-基}丙酸甲酯(10.1mg,63%)。1h nmr(400mhz,dmso-d6)δ12.43(s,1h),8.63(s,1h),8.20(s,1h),8.01-7.76(m,2h),7.70(t,j=8.0hz,1h),7.45(d,j=7.8hz,1h),7.31(d,j=6.5hz,1h),6.96-6.89(m,1h),6.63(t,j=7.2hz,1h),5.02(s,1h),3.58(s,2h),2.94(dd,j=11.6,7.2hz,3h),2.74(t,j=7.5hz,2h),2.64(d,j=7.5hz,1h),2.34-2.21(m,1h),2.10(s,1h),1.85(dd,j=11.8,5.7hz,1h),1.80-1.71(m,1h),1.65(t,j=9.5hz,1h),1.55(d,j=8.7hz,6h),1.44(dd,j=34.1,14.5hz,2h),1.26(d,j=2.4hz,9h),1.22-1.09(m,1h)。esi-ms m/z计算值634.29376,实验值635.2(m 1)
;保留时间:1.58分钟(lc方法a)。
[1783]
实施例35:(14s)-17-[5-(3-氨基丙基)吡啶-2-基]-8-叔丁基-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮,化合物138的制备
[1784][1785]
在4ml小瓶中,将3-{6-[(14s)-8-叔丁基-12,12-二甲基-2,2,4-三氧代-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-17-基]吡啶-3-基}丙腈(化合物146,13.0mg,0.02139mmol)溶解于etoh(1.2ml)中,并用氮气吹扫5分钟。向混合物中添加雷尼镍(4mg,50%w/w,0.03408mmol),随后添加氢气球。将混合物密封并加热至60℃,持续14小时。冷却至室温,并移除氢气球,并且用氮气使容器快速脱气。添加2滴浓缩hcl,搅拌1分钟,然后用甲醇洗脱。将滤液浓缩,溶解于少量dmso中,然后将混合物过滤,并且通过反相制备型色谱法,利用c
18
柱和在15分钟内10%-60%乙腈/水( 5mm hcl)的梯度进行纯化,得到(14s)-17-[5-(3-氨基丙基)吡啶-2-基]-8-叔丁基-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮(盐酸盐)(8.2mg,59%)。esi-ms m/z计算值605.3148,实验值606.4(m 1)
;保留时间:1.38分钟(lc方法a)。
[1786]
实施例36:与6-[(14s)-8-叔丁基-12,12-二甲基-2,2,4-三氧代-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-17-基]吡啶-3-甲腈(化合物205)相关的类似物的制备
[1787][1788]
步骤1:(14s)-17-[5-(氨基甲基)吡啶-2-基]-8-叔丁基-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮,化合物197,和6-[(14s)-8-叔丁基-12,12-二甲基-2,2,4-三氧代-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-17-基]吡啶-3-甲醛
[1789][1790]
在微波小瓶中,将6-[(14s)-8-叔丁基-12,12-二甲基-2,2,4-三氧代-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-17-基]吡啶-3-甲腈(化合物205(非对映异构体1),88mg,0.1534mmol)溶解于etoh(4ml)中并用氮气吹扫5分钟。向混合物中添加雷尼镍(35mg,50%w/w,0.2982mmol),随后添加氢气球。将混合物密封并加热至60℃,持续4小时。将混合物过滤,并且通过反相制备型色谱法,利用c
18
柱和在15分钟内1%-70%乙腈/水( 5mm hcl)的梯度进行纯化,得到(14s)-17-[5-(氨基甲基)吡啶-2-基]-8-叔丁基-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮(盐酸盐)(10.7mg,11%)。esi-ms m/z计算值577.2835,实验值578.2(m 1)
;保留时间:1.34分钟(lc
方法a)。
[1791]
还分离出6-[(14s)-8-叔丁基-12,12-二甲基-2,2,4-三氧代-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-17-基]吡啶-3-甲醛(4.2mg,5%)。esi-ms m/z计算值576.2519,实验值577.2(m 1)
;保留时间:1.95分钟(lc方法a)。
[1792]
步骤2:(14s)-8-叔丁基-17-[5-(羟甲基)吡啶-2-基]-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮,化合物79
[1793][1794]
在氮气下,向6-[(14s)-8-叔丁基-12,12-二甲基-2,2,4-三氧代-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-17-基]吡啶-3-甲醛(源自化合物205(非对映异构体1),4.5mg,0.0078mmol)于甲醇(250μl)中的搅拌溶液中添加nabh4(2.0mg,0.0529mmol),同时使起泡程度最小。在完成添加后,反应物是溶液,并且在搅拌5分钟后,将混合物过滤,并且通过反相制备型色谱法,利用c
18
柱和在15分钟内1%-70%乙腈/水( 5mm hcl)的梯度进行纯化,得到呈白色固体状的(14s)-8-叔丁基-17-[5-(羟甲基)吡啶-2-基]-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮(1.5mg,33%)。esi-ms m/z计算值578.2675,实验值579.2(m 1)
;保留时间:1.54分钟(lc方法a)。
[1795]
步骤3:n-({6-[(14s)-8-叔丁基-12,12-二甲基-2,2,4-三氧代-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-17-基]吡啶-3-基}甲基)乙酰胺,化合物72
[1796][1797]
在氮气气氛下,将(14s)-17-[5-(氨基甲基)吡啶-2-基]-8-叔丁基-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮(盐酸盐)(化合物197(非对映异构体1),26mg,0.04233mmol)峰1(极性较大)溶解于无水dcm(1.0ml)中,并且向其中添加tea(25μl,0.179mmol),并将反
应物搅拌5分钟,随后添加乙酸酐(5μl,0.053mmol)。将反应物在室温下搅拌18小时。再添加乙酸酐(5μl,0.05299mmol),并且将反应物在室温下搅拌3小时。将混合物过滤,并且通过反相制备型色谱法,利用c
18
柱和在30分钟内1%-70%乙腈/水( 5mm hcl)的梯度进行纯化,得到呈白色固体状的n-({6-[(14s)-8-叔丁基-12,12-二甲基-2,2,4-三氧代-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-17-基]吡啶-3-基}甲基)乙酰胺(20.5mg,77%)。1h nmr(400mhz,dmso-d6)δ12.49(s,1h),8.65-8.58(m,2h),8.32-8.19(m,1h),8.05(d,j=18.9hz,2h),7.72(t,j=7.9hz,1h),7.45(d,j=7.9hz,1h),7.34(d,j=7.3hz,1h),6.95(d,j=8.5hz,1h),6.62(d,j=7.9hz,1h),5.13(s,1h),4.37(d,j=5.8hz,2h),3.21(s,1h),2.72(d,j=5.3hz,1h),2.35-2.25(m,1h),2.11(s,1h),1.88(s,3h),1.84(t,j=5.8hz,1h),1.81-1.72(m,1h),1.61(d,j=20.0hz,1h),1.54(s,5h),1.47(d,j=11.6hz,1h),1.26(s,10h),1.22-1.10(m,1h)。esi-ms m/z计算值619.29407,实验值620.8(m 1)
;保留时间:1.44分钟(lc方法a)。
[1798]
步骤4:n-({6-[(14s)-8-叔丁基-12,12-二甲基-2,2,4-三氧代-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-17-基]吡啶-3-基}甲基)氨基甲酸甲酯,化合物89
[1799][1800]
在氮气气氛下,将(14s)-17-[5-(氨基甲基)吡啶-2-基]-8-叔丁基-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮(盐酸盐)(化合物197(非对映异构体1),10.7mg,0.01742mmol)溶解于无水dcm(750μl)中,并且向其中添加tea(15μl,0.1076mmol),并将反应物搅拌5分钟,随后添加氯甲酸甲酯(2μl,0.02588mmol)。使反应物在室温下搅拌4小时。将混合物过滤,并且通过反相制备型色谱法,利用c
18
柱和在30分钟内1%-70%乙腈/水( 5mm hcl)的梯度进行纯化,得到呈白色固体状的n-({6-[(14s)-8-叔丁基-12,12-二甲基-2,2,4-三氧代-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-17-基]吡啶-3-基}甲基)氨基甲酸甲酯(2.1mg,18%)。esi-ms m/z计算值635.289,实验值636.4(m 1)
;保留时间:1.52分钟(lc方法a)。
[1801]
实施例37:(14s)-8-叔丁基-12,12-二甲基-17-[5-(氧杂环丁烷-3-基)吡啶-2-基]-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮,化合物29的制备
[1802][1803]
将4-叔丁基-2-(4-叔丁基-2-吡啶基)吡啶(2mg,0.007452mmol)、[ir{df(cf3)ppy}2(dtbpy)]pf6(.8mg,7.131e-4mmol)和氯化镍(ii),1,2-二甲氧基乙烷错合物(1mg,0.004780mmol)添加到1打兰小瓶中。用隔垫对该小瓶封盖并利用真空/氮气回填循环吹扫3次。添加dme(300μl)和2,6-二甲基吡啶(25μl,0.2159mmol),并将反应物搅拌10分钟以形成连接镍(变成蓝色)。将(14s)-17-(5-溴吡啶-2-基)-8-叔丁基-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮(化合物172(非对映异构体1))(30mg,0.04780mmol)溶解于dme(600μl)中。添加3-溴氧杂环丁烷(20mg,0.1460mmol)和双(三甲基甲硅烷基)甲硅烷基-三甲基-硅烷(45μl,0.1459mmol)。在merck光反应器(100%功率,4700rpm风扇,1700rpm搅拌)中照射反应物2小时。并且然后将其用dcm稀释,并用饱和氯化铵溶液洗涤。蒸发挥发物,随后在硅胶上纯化粗残余物(制备型tlc,100%etoac流动相rt约0.6)。得到(14s)-8-叔丁基-12,12-二甲基-17-[5-(氧杂环丁烷-3-基)吡啶-2-基]-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮(9.3mg,32%)。esi-ms m/z计算值604.2832,实验值605.5(m 1)
;保留时间:1.49分钟,呈白色固体状(lc方法a)。
[1804]
实施例38:(14s)-17-(5-溴吡啶-2-基)-8-叔丁基-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮,化合物171(非对映异构体2)的类似物的制备
[1805][1806]
使用(14s)-17-(5-溴吡啶-2-基)-8-叔丁基-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮,化合物171(非对映异构体2)作为起始物质,以与上述类似的方式制备下表中的化合物。
[1807]
使用3-溴氧杂环丁烷和3-溴-1,1-二氟-环丁烷作为起始物质,以与上述的基于光氧化还原的化合物29的制备类似的方式制备化合物39和化合物21。
[1808]
[1809]
[1810]
[1811]
[1812]
[1813][1814]
[1815]
[1816]
[1817]
[1818]
[1819]
[1820][1821]
实施例39:(14s)-8-叔丁基-17-(4-氯吡啶-2-基)-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5(10),6,8,19(23),20-六烯-2,2,4-三酮,化合物128(非对映异构体1),和(14s)-8-叔丁基-17-(4-氯吡啶-2-基)-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5(10),6,8,19(23),20-六烯-2,2,4-三酮,化合物127(非对映异构体2)的制备
[1822][1823]
步骤1:(4s)-4-[3-(叔丁基亚磺酰基氨基)-3-(4-氯-2-吡啶基)丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯
[1824][1825]
将2-溴-4-氯-吡啶(6.96g,35.444mmol)溶解于甲苯(150ml)中,并且将溶液在氮气球下在干冰丙酮浴中冷却。然后快速逐滴添加n-buli(14.5ml,2.5m于己烷中,36.250mmol)。将混合物在低于-70℃下搅拌45分钟。快速逐滴添加含(4s)-4-[(3e)-3-叔丁基亚磺酰基亚氨基丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(6.45g,17.090mmol)的thf(5ml加上2ml冲洗液)。使反应继续进行15分钟,并且添加nh4cl(30ml,饱和水溶液),随后添加etoac(150ml)和水(200ml)。使混合物升温至室温。分离各层,并将有机层用盐水洗涤,经无水mgso4干燥,过滤并浓缩。通过硅胶色谱法(120g柱),使用5%-60%etoac/己烷来纯化残余物,得到呈浅黄色泡沫状的(4s)-4-[3-(叔丁基亚磺酰基氨基)-3-(4-氯-2-吡啶基)丙
基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(8g,94%)。esi-ms m/z计算值471.2322,实验值472.7(m 1)
;保留时间:3.57分钟(lc方法b)。
[1826]
步骤2:(4s)-4-[3-氨基-3-(4-氯-2-吡啶基)丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯
[1827][1828]
将(4s)-4-[3-(叔丁基亚磺酰基氨基)-3-(4-氯-2-吡啶基)丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(8g,16.099mmol)溶解于thf(50ml)和水(10ml)的溶剂混合物中。添加分子碘(1.23g,4.8462mmol)。将深棕色溶液在50℃油浴中加热3小时。然后将其冷却至室温,用na2s2o3(5g于40ml饱和碳酸氢钠水溶液中)处理并用etoac(40ml)萃取。将有机层用盐水(30ml)洗涤,经无水na2so4干制,过滤并浓缩。通过硅胶色谱法(80g柱),使用0-10%meoh/dcm来纯化残余物,得到呈浅棕色泡沫状的(4s)-4-[3-氨基-3-(4-氯-2-吡啶基)丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(4.33g,69%)。esi-ms m/z计算值367.2027,实验值368.5(m 1)
;保留时间:2.89分钟(lc方法b)。
[1829]
步骤3:(4s)-4-[3-(4-氯-2-吡啶基)-3-[(6-氨磺酰基-2-吡啶基)氨基]丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯
[1830][1831]
向(4s)-4-[3-氨基-3-(4-氯-2-吡啶基)丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(4.12g,10.638mmol)和6-氟吡啶-2-磺酰胺(3.5g,18.874mmol)于dmso(10ml)中的混合物中添加diea(6ml,34.447mmol)。将混合物在110℃下搅拌27小时。然后使混合物冷却至室温,并在etoac(200ml)和饱和碳酸氢钠(400ml)之间分配。用更多etoac(200ml)萃取水层。将合并的etoac溶液用盐水(2x300ml)洗涤,经无水硫酸钠干燥,过滤并浓缩。通过硅胶色谱法,使用0-100%etoac/己烷来纯化残余物,得到呈米色粉末状的(4s)-4-[3-(4-氯-2-吡啶基)-3-[(6-氨磺酰基-2-吡啶基)氨基]丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(4.08g,70%)。1h nmr(500mhz,dmso-d6)δ8.51(d,j=5.3hz,1h),7.68
–
7.61(m,1h),7.55
–
7.52(m,1h),7.39(dd,j=5.3,2.1hz,1h),7.08(s,2h),6.98(d,j=7.4hz,1h),6.72(d,j=8.4hz,1h),5.21(bs,1h),3.60
–
3.46(m,1h),2.83
–
2.69(m,1h),2.17
–
2.01(m,1h),1.94
–
1.76(m,3h),1.42
–
1.28(m,16h),1.23(s,3h)。esi-ms m/z计算值523.202,实验值524.5(m 1)
;保留时间:2.27分钟(lc方法h)。
[1832]
步骤4:(4s)-4-[3-[[6-[(6-叔丁基-2-氟-吡啶-3-羰基)氨磺酰基]-2-吡啶基]氨基]-3-(4-氯-2-吡啶基)丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯
[1833][1834]
向6-叔丁基-2-氟-吡啶-3-甲酸(1.84g,9.330mmol)于thf(10ml)中的溶液中添加cdi(1.56g,9.621mmol),并且将混合物在室温下搅拌16小时,然后添加(4s)-4-[3-(4-氯-2-吡啶基)-3-[(6-氨磺酰基-2-吡啶基)氨基]丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(4g,7.632mmol),随后添加dbu(3ml,20.06mmol),并且将所得混合物在室温下搅拌2小时。将反应物用饱和氯化铵和盐水溶液的1:1混合物淬灭,然后用乙酸乙酯萃取。将合并的有机层用盐水洗涤,经硫酸钠干燥,过滤并蒸发。通过反相色谱法,使用在20.0分钟内从20%-100%流动相b运行的双梯度(流动相a=h2o(5mm hcl),流动相b=ch3cn)来纯化所得残余物,得到非对映异构体混合物形式的(4s)-4-[3-[[6-[(6-叔丁基-2-氟-吡啶-3-羰基)氨磺酰基]-2-吡啶基]氨基]-3-(4-氯-2-吡啶基)丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(3.24g,60%)。esi-ms m/z计算值702.2767,实验值703.3(m 1)
;保留时间:3.4分钟(lc方法r)。
[1835]
步骤5:(14s)-8-叔丁基-17-(4-氯吡啶-2-基)-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5(10),6,8,19(23),20-六烯-2,2,4-三酮
[1836][1837]
在室温下,搅拌(4s)-4-[3-[[6-[(6-叔丁基-2-氟-吡啶-3-羰基)氨磺酰基]-2-吡啶基]氨基]-3-(4-氯-2-吡啶基)丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(200mg,0.2844mmol)于(1:4tfa-dcm预混合溶液)tfa(250μl,3.245mmol)和dcm(750μl)中的溶液,并移除溶剂。将残余物溶解于nmp(2ml)中,并且添加碳酸钾(454mg,3.285mmol)。将混合物在140℃下加热16小时。将混合物冷却至室温,用1n hcl稀释并用etoac(1x)萃取。将有机相用盐水(1x)洗涤,干燥(硫酸钠),过滤并浓缩,得到棕色油状物,将所述棕色油状物过滤并使用反相hplc-ms方法,使用在15.0分钟内从30%-99%流动相b运行的双梯度(流动相a=h2o(5mm hcl),流动相b=乙腈)进行纯化,得到呈非对映异构体混合物形式的(14s)-8-叔丁基-17-(4-氯吡啶-2-基)-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5(10),6,8,19(23),20-六烯-2,2,4-三酮(72mg,43%)。esi-ms m/z计算值582.218,实验值583.3(m 1)
;保留时间:0.62分钟(lc方法i)。
[1838]
步骤6:(14s)-8-叔丁基-17-(4-氯吡啶-2-基)-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5(10),6,8,19(23),20-六烯-2,2,4-三酮,化合物128(非对映异构体1),和(14s)-8-叔丁基-17-(4-氯吡啶-2-基)-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5(10),6,8,19(23),20-六烯-2,2,4-三酮,化合物127(非对映异构体2)
[1839][1840]
(14s)-8-叔丁基-17-(4-氯吡啶-2-基)-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5(10),6,8,19(23),20-六烯-2,2,4-三酮的非对映异构体混合物(30mg,0.05145mmol)通过手性sfc,用od-3手性柱,使用50%-80%meoh-nh3和32ml/分钟流速来分离,得到呈白色固体状的两种异构体:
[1841]
洗脱的第一异构体:非对映异构体1(peak-1):(14s)-8-叔丁基-17-(4-氯吡啶-2-基)-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5(10),6,8,19(23),20-六烯-2,2,4-三酮(10.2mg,66%)。1h nmr(400mhz,dmso-d6)δ12.48(s,1h),8.50(d,j=5.3hz,1h),7.62(d,j=8.0hz,3h),7.54-7.50(m,1h),7.40(dt,j=5.3,2.2hz,1h),7.10(d,j=9.5hz,1h),6.88(s,1h),6.65(s,1h),5.27(s,1h),3.19(d,j=19.9hz,1h),2.75(s,1h),2.22(s,1h),1.91(s,2h),1.83(d,j=10.1hz,2h),1.72(d,j=13.6hz,1h),1.64(s,3h),1.50(s,3h),1.44(d,j=9.6hz,1h),1.28(s,9h)。esi-ms m/z计算值582.218,实验值583.3(m 1)
;保留时间:1.49分钟(lc方法g)。
[1842]
洗脱的第二异构体:非对映异构体2(peak-2):(14s)-8-叔丁基-17-(4-氯吡啶-2-基)-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5(10),6,8,19(23),20-六烯-2,2,4-三酮(8.0mg,52%)。1h nmr(400mhz,dmso-d6)δ12.49(s,1h),8.51(d,j=5.3hz,1h),7.74-7.57(m,3h),7.53(d,j=2.0hz,1h),7.40(dd,j=5.3,2.0hz,1h),7.12(d,j=7.2hz,1h),6.89(d,j=8.5hz,1h),6.66(d,j=8.0hz,1h),5.26(q,j=8.6hz,1h),3.20(t,j=8.6hz,1h),2.75(t,j=10.4hz,1h),2.23(s,1h),1.91(t,j=5.0hz,2h),1.84(dd,j=11.8,5.2hz,1h),1.73(d,j=14.9hz,1h),1.65(s,3h),1.62-1.52(m,2h),1.51(s,3h),1.28(s,9h)。esi-ms m/z计算值582.218,实验值583.3(m 1)
;保留时间:1.54分钟(lc方法g)。
[1843]
实施例40:2'-[(14s)-8-叔丁基-12,12-二甲基-2,2,4-三氧代-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-17-基]-1,2,3,6-四氢-[4,4'-联吡啶]-1-甲酸叔丁酯,非对映异构体1、非对映异构体2的制备
[1844][1845]
步骤1:2'-[(14s)-8-叔丁基-12,12-二甲基-2,2,4-三氧代-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-17-基]-1,2,3,6-四氢-[4,4'-联吡啶]-1-甲酸叔丁酯,非对映异构体1,和2'-[(14s)-8-叔丁基-12,12-二甲基-2,2,4-三氧代-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-17-基]-1,2,3,6-四氢-[4,4'-联吡啶]-1-甲酸叔丁酯,非对映异构体2
[1846][1847]
在微波小瓶中,将(14s)-8-叔丁基-17-(4-氯吡啶-2-基)-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5(10),6,8,19(23),20-六烯-2,2,4-三酮(100mg,0.1715mmol)和4-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)-3,6-二氢-2h-吡啶-1-甲酸叔丁酯(非对映异构体混合物,84mg,0.2717mmol)合并于dma(2ml)中。向混合物中添加[1,1'-双(二苯基膦基)二茂铁]二氯钯(ii)(27mg,0.03690mmol)和碳酸钾水溶液(500μl,2m,1.000mmol),并且使氮气鼓泡穿过悬浮液,持续1分钟。将反应物封盖并在微波反应器中于150℃下加热30分钟。将反应混合物经由whatman
滤盘(puradisc 25tf)过滤,并且通过反相hplc-ms方法,使用在15.0分钟内从50%-99%流动相b运行的双梯度(流动相a=h2o(5mm hcl),流动相b=ch3cn)来纯化滤液,得到呈白色固体状的两种异构体。
[1848]
第一洗脱异构体(peak-1),非对映异构体1:2'-[(14s)-8-叔丁基-12,12-二甲基-2,2,4-三氧代-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-17-基]-1,2,3,6-四氢-[4,4'-联吡啶]-1-甲酸叔丁酯(盐酸盐)(23.4mg,36%)。esi-ms m/z计算值729.36725,实验值730.5(m 1)
;保留时间:1.32分钟(lc方法g)。
[1849]
第二洗脱异构体(peak-2),非对映异构体2:2'-[(14s)-8-叔丁基-12,12-二甲基-2,2,4-三氧代-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-17-基]-1,2,3,6-四氢-[4,4'-联吡啶]-1-甲酸叔丁酯(盐酸盐)(38.6mg,59%)。esi-ms m/z计算值729.36725,实验值730.6(m 1)
;保留时间:1.38分钟(lc方法g)。
[1850]
步骤2:4-{2-[(14s)-8-叔丁基-12,12-二甲基-2,2,4-三氧代-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-17-基]吡啶-4-基}哌啶-1-甲酸叔丁酯,化合物118,和(14s)-8-叔丁基-12,12-二甲基-17-[4-(哌啶-4-基)吡啶-2-基]-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮,化合物124
[1851][1852]
在氮气下,向2'-[(14s)-8-叔丁基-12,12-二甲基-2,2,4-三氧代-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-17-基]-1,2,3,6-四氢-[4,4'-联吡啶]-1-甲酸叔丁酯(盐酸盐),非对映异构体1(23mg,0.03001mmol,含有一些boc脱保护的材料)于etoh(2ml)中的溶液中添加pd/c(10%湿品,degussa)(10mg,0.0094mmol)并将烧瓶抽真空,并使用配备有气球的3通接头填充氢气。将反应混合物在氢气下在室温下搅拌4小时,并使用etoac作为溶剂经由小硅藻土玻璃料过滤。将反应混合物经由whatman滤盘(puradisc 25tf)过滤,并且通过反相hplc-ms方法,使用在15.0分钟内从30%-99%流动相b运行的双梯度(流动相a=h2o(5mm hcl),流动相b=ch3cn)来纯化滤液,得到4-{2-[(14s)-8-叔丁基-12,12-二甲基-2,2,4-三氧代-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-17-基]吡啶-4-基}哌啶-1-甲酸叔丁酯(盐酸盐)(4.8mg,42%)。1h nmr(400mhz,氯仿-d)δ9.35(s,1h),8.54(s,1h),8.45(s,1h),7.86(s,1h),7.69(s,1h),7.59-7.50(m,2h),7.39(d,j=7.1hz,1h),6.87(d,j=8.0hz,1h),6.75(d,j=7.9hz,1h),5.66(s,1h),4.29(s,2h),3.46(d,j=21.4hz,1h),3.28(s,1h),3.03(s,1h),2.85(s,2h),2.39(s,2h),1.95(s,3h),1.85(s,2h),1.63(m,5h),1.57(s,3h),1.45(s,9h),1.30(m,11h)。esi-ms m/z计算
值731.3829,实验值732.5(m 1)
;保留时间:1.28分钟(lc方法g);以及(14s)-8-叔丁基-12,12-二甲基-17-[4-(哌啶-4-基)吡啶-2-基]-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮(二盐酸盐)(2.3mg,22%)。esi-ms m/z计算值631.33044,实验值632.5(m 1)
;保留时间:0.99分钟(lc方法g)。
[1853]
使用2'-[(14s)-8-叔丁基-12,12-二甲基-2,2,4-三氧代-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-17-基]-1,2,3,6-四氢-[4,4'-联吡啶]-1-甲酸叔丁酯(盐酸盐),非对映异构体2作为起始物质,以与上述类似的方式制备下表中的化合物。
[1854][1855]
[1856][1857]
实施例41:(14s)-17-[4-(3-胺基丙基)吡啶-2-基]-8-叔丁基-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮,化合物110(非对映异构体1)和化合物109(非对映异构体2)的制备
[1858][1859]
步骤1:3-{2-[(14s)-8-叔丁基-12,12-二甲基-2,2,4-三氧代-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-17-基]吡啶-4-基}丙腈,非对映异构体1,和3-{2-[(14s)-8-叔丁基-12,12-二甲基-2,2,4-三氧代-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-17-基]吡啶-4-基}丙腈,非对映异构体2
[1860][1861]
第一反应:在微波小瓶中,将(14s)-8-叔丁基-17-(4-氯吡啶-2-基)-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5(10),6,8,19(23),20-六烯-2,2,4-三酮(化合物128(非对映异构体1),50mg,0.0857mmol)和3-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)丙腈(26mg,0.1436mmol)合并于dma(2ml)中。向混合物中添加[1,1'-双(二苯基膦基)二茂铁]二氯钯(ii)(12mg,0.01640mmol)和碳酸钾水溶液(220μl,2m,0.4400mmol)并使氮气鼓泡穿过悬浮液持续2分钟。将反应物封盖并在微波反应器中于150℃下加热1小时。将反应混合物经由whatman滤盘(puradisc 25tf)过滤,并且通过反相hplc-ms方法,使用在15.0分钟内从30%-99%流动相b运行的双梯度(流动相a=h2o(5mm hcl),流动相b=ch3cn)来纯化滤液,得到3-{2-[(14s)-8-叔丁基-12,12-二甲基-2,2,4-三氧代-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-17-基]吡啶-4-基}丙腈(非对映异构体1,10.9mg,21%)。esi-ms m/z计算值601.2835,实验值602.1(m 1)
;保留时间:0.37分钟(lc方法i)。
[1862]
第二反应:在微波小瓶中,将(14s)-8-叔丁基-17-(4-氯吡啶-2-基)-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5(10),6,8,19(23),20-六烯-2,2,4-三酮(化合物127(非对映异构体2),50mg,0.08574mmol)和3-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)丙腈(26mg,0.1436mmol)合并于dma(2ml)中。向混合物中添加[1,1'-双(二苯基膦基)二茂铁]二氯钯(ii)(12mg,0.0164mmol)和碳酸钾水溶液(220μl,2m,0.440mmol),并且使氮气鼓泡穿过悬浮液,持续2分钟。将反应物封盖并在微波炉中于150℃下加热1小时。将反应混合物经由whatman滤盘(puradisc 25tf)过滤,并且通过反相hplc-ms方法,使用在15.0分钟内从30%-99%流动相b运行的双梯度(流动相a=h2o(5mm hcl),流动相b=ch3cn)来纯化滤液,得到3-{2-[(14s)-8-叔丁基-12,12-二甲基-2,2,4-三氧代-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-17-基]吡啶-4-基}丙腈(非对映异构体2,8.9mg,17%)。esi-ms m/z计算值601.2835,实验值602.1(m 1)
;保留时间:0.43分钟(lc方法i)。
[1863]
步骤2:(14s)-17-[4-(3-氨基丙基)吡啶-2-基]-8-叔丁基-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),
20-六烯-2,2,4-三酮,化合物110(非对映异构体1),和(14s)-17-[4-(3-氨基丙基)吡啶-2-基]-8-叔丁基-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮,化合物109(非对映异构体2)
[1864][1865]
第一反应:向3-{2-[(14s)-8-叔丁基-12,12-二甲基-2,2,4-三氧代-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-17-基]吡啶-4-基}丙腈(非对映异构体1,8mg,0.01329mmol)于meoh(1ml)中的溶液中添加nicl2.h2o(8mg,0.05420mmol),并在冰浴中将反应物冷却。向反应小瓶中缓慢添加硼氢化钠(5mg,0.1322mmol)(剧烈反应),并使反应物从0℃搅拌至室温持续约2小时。将反应混合物经由whatman滤盘(puradisc 25tf)过滤,并且通过反相hplc-ms方法,使用在15.0分钟内从20%-80%流动相b运行的双梯度(流动相a=h2o(5mm hcl),流动相b=ch3cn)来纯化滤液,得到(14s)-17-[4-(3-氨基丙基)吡啶-2-基]-8-叔丁基-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮(二盐酸盐)(非对映异构体1,2.7mg,29%)esi-ms m/z计算值605.3148,实验值606.3(m 1)
;保留时间:1.28分钟(lc方法a)。
[1866]
第二反应:向3-{2-[(14s)-8-叔丁基-12,12-二甲基-2,2,4-三氧代-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-17-基]吡啶-4-基}丙腈(非对映异构体2,8mg,0.01329mmol)(peak-2)于meoh(1ml)中的溶液中添加nicl2.h2o(8mg,0.05420mmol),并在冰浴中将混合物冷却。向反应小瓶中缓慢添加硼氢化钠(5mg,0.1322mmol)(剧烈反应),并使反应物从0℃搅拌至室温持续约2小时。将反应混合物经由whatman滤盘(puradisc 25tf)过滤,并且通过反相hplc-ms方法,使用在15.0分钟内从20%-80%流动相b运行的双梯度(流动相a=h2o(5mm hcl),流动相b=ch3cn)来纯化滤液,得到(14s)-17-[4-(3-氨基丙基)吡啶-2-基]-8-叔丁基-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮(二盐酸盐)(非对映异构体2,2.0mg,22%)。esi-ms m/z计算值605.3148,实验值606.5(m 1)
;保留时间:1.39分钟(lc方法a)。
[1867]
以下是可商购获得的硼试剂的列表:
[1868]
2-(3,6-二氢-2h-吡喃-4-基)-4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷(二甲基氨基)甲基-三氟-硼酸钾(钾盐)
[1869]
n-[2-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)乙基]氨基甲酸叔丁酯
[1870]
1h-吡唑-3-基硼酸
[1871]
4-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)-1h-吡唑(叔丁基氨基)甲基-三氟-硼酸钾
[1872]
使用在上表中给出的硼试剂,以与上文所述类似的方式制备下表中的化合物。对于每种化合物,当使用(14s)-8-叔丁基-17-(4-氯吡啶-2-基)-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5(10),6,8,19(23),20-六烯-2,2,4-三酮(化合物128(非对映异构体1))作为起始物质时,得到非对映异构体1。当使用化合物127(非对映异构体2)作为起始物质时,得到非对映异构体2。
[1873]
[1874]
[1875]
[1876][1877]
实施例42:(14s)-17-(4-氨基吡啶-2-基)-8-叔丁基-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮,非对映异构体1,化合物49,和(14s)-17-(4-氨基吡啶-2-基)-8-叔丁基-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮,非对映异构体2,化合物48的制备
[1878][1879]
向(14s)-8-叔丁基-17-(4-氯吡啶-2-基)-12,12-二甲基-2λ
6-硫杂-3,9,11,18,
23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5(10),6,8,19(23),20-六烯-2,2,4-三酮(盐酸盐)(非对映异构体混合物,25mg,0.04035mmol)于dmf(2ml)中的溶液中添加氨基甲酸叔丁酯(9.6mg,0.08195mmol)、[2-(2-氨基苯基)苯基]-甲基磺酰基氧基-钯;二环己基-[2-(2,4,6-三异丙基苯基)苯基]膦(8.4mg,0.0099mmol)和碳酸铯(43mg,0.1320mmol)。将混合物用氮气脱气2分钟,并将小瓶封盖并且在微波炉中于150℃下加热30分钟。将反应混合物经由whatman滤盘(puradisc 25tf)过滤,并且通过反相hplc-ms,使用由phenomenex销售的luna c
18
柱(75
×
30mm,5μm粒度)(pn:00c-4252-u0-ax)和在15.0分钟内30%-99%流动相b运行的双梯度(流动相a=h2o(5mm hcl),流动相b=ch3cn)来纯化滤液。移除溶剂,并将所得残余物溶解于tfa(100μl,1.298mmol)和dcm(400ml)的1:9混合物中,并将混合物在室温下搅拌1小时。移除溶剂,并且通过反相hplc-ms方法,使用在15.0分钟内从1%-99%流动相b运行的双梯度(流动相a=h2o(5mm hcl),流动相b=ch3cn)来纯化残余物,得到两种异构体:
[1880]
第一洗脱peak-1,非对映异构体1:(14s)-17-(4-氨基吡啶-2-基)-8-叔丁基-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮(盐酸盐)(3.1mg,26%)。esi-ms m/z计算值563.2679,实验值564.26(m 1)
;保留时间:1.48分钟(lc方法a)。
[1881]
第二洗脱对映异构体,peak-2,非对映异构体2:(14s)-17-(4-氨基吡啶-2-基)-8-叔丁基-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮(盐酸盐)(1.2mg,10%)。esi-ms m/z计算值563.2679,实验值564.26(m 1)
;保留时间:1.52分钟(lc方法a)。
[1882]
实施例43:2-[(14s)-8-叔丁基-12,12-二甲基-2,2,4-三氧代-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-17-基]吡啶-4-甲酰胺,非对映异构体1,化合物83和非对映异构体2,化合物82,以及2-[(14s)-8-叔丁基-12,12-二甲基-2,2,4-三氧代-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-17-基]吡啶-4-甲腈,化合物144(非对映异构体1)和化合物143(非对映异构体2)的制备
[1883]
[1884]
步骤1:2-{8-叔丁基-12,12-二甲基-2,2,4-三氧代-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-17-基}吡啶-4-甲腈和2-[(14s)-8-叔丁基-12,12-二甲基-2,2,4-三氧代-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-17-基]吡啶-4-甲酰胺
[1885][1886]
在微波小瓶中,将(14s)-8-叔丁基-17-(4-氯吡啶-2-基)-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5(10),6,8,19(23),20-六烯-2,2,4-三酮(非对映异构体混合物,100mg,0.1715mmol)溶解于dmf(2ml)和水(500μl)中。向混合物中添加二氰基锌(28mg,0.2384mmol),随后添加三(二苄亚基丙酮)二钯(0)(9mg,0.00983mmol)和二环己基-[2-(2,6-二甲氧基苯基)苯基]膦(8mg,0.0195mmol)。将混合物用氮气吹扫,封盖并在微波炉中于150℃下加热60分钟。冷却至室温。将反应混合物经由whatman滤盘(puradisc 25tf)过滤,并且通过反相hplc-ms方法,使用在15.0分钟内从30%-99%流动相b运行的双梯度(流动相a=h2o(5mm hcl),流动相b=ch3cn)来纯化滤液,得到主要产物2-{8-叔丁基-12,12-二甲基-2,2,4-三氧代-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-17-基}吡啶-4-甲腈(47mg,48%)。esi-ms m/z计算值573.2522,实验值574.18(m 1)
;保留时间:1.55分钟(lc方法a)。
[1887]
分离由cn水解产生的副产物:2-[(14s)-8-叔丁基-12,12-二甲基-2,2,4-三氧代-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-17-基]吡啶-4-甲酰胺(25.4mg,25%)。esi-ms m/z计算值591.26276,实验值592.2(m 1)
;保留时间:0.96分钟(lc方法a)。
[1888]
步骤2:2-[(14s)-8-叔丁基-12,12-二甲基-2,2,4-三氧代-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-17-基]吡啶-4-甲酰胺,化合物83(非对映异构体1),和2-[(14s)-8-叔丁基-12,12-二甲基-2,2,4-三氧代-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-17-基]吡啶-4-甲酰胺,化合物82(非对映异构体2)
[1889][1890]
2-[(14s)-8-叔丁基-12,12-二甲基-2,2,4-三氧代-2λ
6-硫杂-3,9,11,18,23-五
氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-17-基]吡啶-4-甲酰胺的非对映异构体混合物(25mg,0.04225mmol)通过sfc,使用princeton 2-ep(250x10mm,5μm)柱,使用20%meoh(无改性剂)、80%co2以10ml/min流速而分离,得到两种异构体:
[1891]
第一洗脱对映异构体,非对映异构体1:2-[(14s)-8-叔丁基-12,12-二甲基-2,2,4-三氧代-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-17-基]吡啶-4-甲酰胺(3.4mg,26%)。esi-ms m/z计算值591.26276,实验值592.2(m 1)
;保留时间:1.64分钟(lc方法a)。
[1892]
第二洗脱对映异构体,非对映异构体2:2-[(14s)-8-叔丁基-12,12-二甲基-2,2,4-三氧代-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-17-基]吡啶-4-甲酰胺(8.6mg,65%)。1h nmr(400mhz,dmso-d6)δ8.13(d,j=7.0hz,1h),7.75(s,1h),7.69(t,j=7.8hz,1h),7.64(d,j=8.1hz,1h),7.17(d,j=7.3hz,1h),6.98-6.88(m,2h),6.79(s,1h),6.64(d,j=7.9hz,1h),5.34-5.22(m,1h),3.29(d,j=8.5hz,1h),2.70(t,j=10.1hz,1h),2.32(s,1h),1.97-1.87(m,2h),1.83(dd,j=11.8,5.2hz,1h),1.78-1.72(m,1h),1.67(s,3h),1.56(d,j=12.4hz,1h),1.50(s,3h),1.43(dd,j=14.2,10.9hz,1h),1.28(s,9h),2protons not visible。esi-ms m/z计算值591.26276,实验值592.2(m 1)
;保留时间:1.66分钟(lc方法a)。
[1893]
步骤3:2-[(14s)-8-叔丁基-12,12-二甲基-2,2,4-三氧代-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-17-基]吡啶-4-甲腈,化合物144(非对映异构体1),和2-[(14s)-8-叔丁基-12,12-二甲基-2,2,4-三氧代-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-17-基]吡啶-4-甲腈,化合物143(非对映异构体2)
[1894][1895]
2-[(14s)-8-叔丁基-12,12-二甲基-2,2,4-三氧代-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-17-基]吡啶-4-甲腈的非对映异构体混合物(18mg,0.03137mmol)通过手性sfc,利用od-3手性柱,使用50%-80%meoh-nh3,以32ml/min流速而分离,得到两种异构体:
[1896]
第一洗脱对映异构体,非对映异构体1:2-[(14s)-8-叔丁基-12,12-二甲基-2,2,4-三氧代-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-17-基]吡啶-4-甲腈(7.4mg,82%)。1h nmr(400mhz,dmso-d6)δ12.48(s,1h),8.79(d,j=5.0hz,1h),7.85(s,1h),7.73(dd,j=5.0,1.5hz,2h),7.64(d,j=7.9hz,2h),7.11(s,1h),6.87(s,1h),6.65(s,1h),5.34(s,1h),3.24(s,1h),2.78(s,1h),2.23(s,1h),1.91-1.81(m,2h),1.74(d,j=13.9hz,1h),1.64(s,3h),1.51(s,6h),1.28(s,9h)。esi-ms m/z计算值573.2522,实验值574.3(m 1)
;保留时间:1.63分钟(lc方法g)。
[1897]
第二洗脱对映异构体,非对映异构体2:2-[(14s)-8-叔丁基-12,12-二甲基-2,2,4-三氧代-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-17-基]吡啶-4-甲腈(8.2mg,91%)。1h nmr(400mhz,dmso-d6)δ12.36(s,1h),8.80(d,j=5.1hz,1h),8.03(s,1h),7.75(d,j=5.0hz,1h),7.65(s,1h),7.47(s,1h),7.25(s,1h),7.12(s,1h),6.85(s,1h),6.62(s,1h),4.87(s,1h),3.51-3.35(m,1h),3.23-3.11(m,1h),3.05-2.88(m,1h),2.39-2.25(m,1h),2.13(s,1h),1.83(s,1h),1.74(s,1h),1.60(s,3h),1.52(s,3h),1.38(s,1h),1.27(s,9h),1.14(d,j=30.1hz,1h)。esi-ms m/z计算值573.2522,实验值574.2(m 1)
;保留时间:1.61分钟(lc方法g)。
[1898]
实施例44:n-({2-[(14s)-8-叔丁基-12,12-二甲基-2,2,4-三氧代-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-17-基]吡啶-4-基}甲基)氨基甲酸叔丁酯,化合物120(非对映异构体1)和化合物119(非对映异构体2)的制备
[1899][1900]
步骤1:n-({2-[(14s)-8-叔丁基-12,12-二甲基-2,2,4-三氧代-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-17-基]吡啶-4-基}甲基)氨基甲酸叔丁酯,化合物120(非对映异构体1),和n-({2-[(14s)-8-叔丁基-12,12-二甲基-2,2,4-三氧代-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-17-基]吡啶-4-基}甲基)氨基甲酸叔丁酯,化合物119(非对映异构体2)
[1901][1902]
向2-{8-叔丁基-12,12-二甲基-2,2,4-三氧代-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-17-基}吡啶-4-甲腈(非对映异构体混合物,40mg,0.06972mmol)于meoh(2ml)中的溶液中添加nicl2.h2o(23mg,0.1558mmol),并在冰浴中冷却。向反应小瓶中缓慢添加硼氢化钠(14mg,0.3700mmol)(剧烈反应),并将反应物在0℃下搅拌15分钟,然后添加碳酸叔丁氧羰基叔丁酯(34mg,0.1558mmol)并且将反应混合物在室温下搅拌4小时。将反应混合物通过硅藻土过滤,用水稀释,并用乙酸乙酯(3x)萃取。将有机层分离,经无水na2so4干燥,过滤并蒸发。将所得残余物溶解于dmso(1ml)中,并经由whatman滤盘(puradisc 25tf)过滤,并且通过反相hplc-ms方法,使用在15.0分钟内从30%-99%流动相b运行的双梯度(流动相a=h2o(5mm hcl),流动相b=ch3cn)来纯化滤液,得到两种异构体:
[1903]
第一洗脱峰-(peak-1),非对映异构体1:n-({2-[(14s)-8-叔丁基-12,12-二甲基-2,2,4-三氧代-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-17-基]吡啶-4-基}甲基)氨基甲酸叔丁酯(盐酸盐)(16mg,59%)。esi-ms m/z计算值677.33594,实验值678.4(m 1)
;保留时间:1.1分钟(lc方法g)。
[1904]
第二洗脱峰(peak-2),非对映异构体2:n-({2-[(14s)-8-叔丁基-12,12-二甲基-2,2,4-三氧代-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-17-基]吡啶-4-基}甲基)氨基甲酸叔丁酯(盐酸盐)(21mg,84%)。esi-ms m/z计算值677.33594,实验值678.5(m 1)
;保留时间:1.18分钟(lc方法g)。
[1905]
步骤2:(14s)-17-[4-(氨基甲基)吡啶-2-基]-8-叔丁基-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮,化合物116(非对映异构体1),和(14s)-17-[4-(氨基甲基)吡啶-2-基]-8-叔丁基-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮,化合物115(非对映异构体2)
[1906][1907]
非对映异构体1:将n-({2-[(14s)-8-叔丁基-12,12-二甲基-2,2,4-三氧代-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-17-基]吡啶-4-基}甲基)氨基甲酸叔丁酯(盐酸盐)(化合物120(非对映异构体1),13mg,0.01674mmol)于(1:3tfa-dcm的预混合溶液)tfa(25μl,0.3245mmol)和dcm(75μl)中的溶液在室温下搅拌约2小时并蒸发溶剂,并且将材料在冻干机上干燥隔夜,得到(14s)-17-[4-(氨基甲基)吡啶-2-基]-8-叔丁基-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮(二盐酸盐)(非对映异构体1,12mg,80%)。1h nmr(400mhz,dmso-d6)δ12.75(s,1h),8.78(dd,j=21.2,15.5hz,3h),8.60-8.24(m,1h),7.98(d,j=20.9hz,1h),7.82(s,1h),7.66(td,j=8.0,4.3hz,1h),7.45(d,j=7.8hz,1h),7.28(t,j=6.9hz,1h),6.91(dd,j=8.5,5.7hz,1h),6.63(dd,j=8.0,1.7hz,1h),4.95(s,1h),4.23(d,j=5.8hz,2h),2.85-2.66(m,1h),2.31(d,j=15.1hz,1h),1.93(d,j=19.4hz,1h),1.85(dd,j=11.8,5.5hz,1h),1.74(s,1h),1.55(m,8h),1.27(m,10h),1.23-1.07(m,1h)。esi-ms m/z计算值577.2835,实验值578.3(m 1)
;保留时间:1.36分钟(lc方法a)。
[1908]
非对映异构体2:将n-({2-[(14s)-8-叔丁基-12,12-二甲基-2,2,4-三氧代-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-17-基]吡啶-4-基}甲基)氨基甲酸叔丁酯(盐酸盐)(化合物119(非对映异构体2),18.00mg,0.02318mmol)于(1:3tfa-dcm的预混合溶液)tfa(25μl,0.3245mmol)和dcm(75μl)中的溶液在室温下搅拌约2小时并蒸发溶剂,将材料在冻干机上干燥隔夜,得到(14s)-17-[4-(氨基甲基)吡啶-2-基]-8-叔丁基-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮(二盐酸盐)(18mg,116%)。1h nmr(400mhz,dmso-d6)δ12.57(s,1h),8.85-8.78(m,3h),8.08(s,1h),7.92(d,j=8.4hz,1h),7.81(s,1h),7.71(dd,j=8.5,7.3hz,1h),7.63(d,j=8.0hz,1h),7.18(d,j=7.2hz,1h),6.99(d,j=8.4hz,1h),6.66(d,j=8.0hz,1h),5.44(q,j=7.9hz,1h),4.22(d,j=6.0hz,2h),3.32(t,j=8.5hz,1h),2.71(t,j=10.2hz,1h),2.38(s,1h),
2.02(d,j=9.8hz,2h),1.88-1.74(m,2h),1.66(s,3h),1.62-1.42(m,5h),1.29(s,9h)。esi-ms m/z计算值577.2835,实验值578.3(m 1)
;保留时间:1.49分钟(lc方法a)。
[1909]
步骤3:n-({2-[(14s)-8-叔丁基-12,12-二甲基-2,2,4-三氧代-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-17-基]吡啶-4-基}甲基)氨基甲酸甲酯,化合物108(非对映异构体1),和n-({2-[(14s)-8-叔丁基-12,12-二甲基-2,2,4-三氧代-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-17-基]吡啶-4-基}甲基)氨基甲酸甲酯,化合物107(非对映异构体2)
[1910][1911]
非对映异构体1:向(14s)-17-[4-(氨基甲基)吡啶-2-基]-8-叔丁基-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮(二盐酸盐)(化合物116(非对映异构体1),5mg,0.007684mmol)于dcm(0.5ml)中的溶液中添加tea(8μl,0.05740mmol)并在冰浴中冷却。然后,缓慢添加氯甲酸甲酯(1μl,0.01294mmol),并且使反应物搅拌1小时,并且然后蒸发溶剂。将所得残余物溶解于dmso(1ml)中,并经由whatman滤盘(puradisc 25tf)过滤,并且通过反相hplc-ms方法,使用在15.0分钟内从30%-99%流动相b运行的双梯度来纯化滤液。流动相a=h2o(5mm hcl)。流动相b=ch3cn。通过冻干机蒸发溶剂,得到n-({2-[(14s)-8-叔丁基-12,12-二甲基-2,2,4-三氧代-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-17-基]吡啶-4-基}甲基)氨基甲酸甲酯(盐酸盐)(非对映异构体1,1.4mg,26%)。esi-ms m/z计算值635.289,实验值636.1(m 1)
;保留时间:1.56分钟(lc方法a)。
[1912]
非对映异构体2:向(14s)-17-[4-(氨基甲基)吡啶-2-基]-8-叔丁基-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮(二盐酸盐)(化合物115(非对映异构体2),12mg,0.01844mmol)于dcm(0.5ml)中的溶液中添加tea(8μl,0.05740mmol)并在冰浴中冷却。然后,缓慢添加氯甲酸甲酯(1μl,0.01294mmol),并且使反应物搅拌1小时并蒸发溶剂。将所得
残余物溶解于dmso(1ml)中,并经由whatman滤盘(puradisc 25tf)过滤,并且通过反相hplc-ms方法,使用在15.0分钟内从30%-99%流动相b运行的双梯度(流动相a=h2o(5mm hcl),流动相b=ch3cn)来纯化滤液。通过冻干机蒸发溶剂,得到呈白色固体状的n-({2-[(14s)-8-叔丁基-12,12-二甲基-2,2,4-三氧代-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-17-基]吡啶-4-基}甲基)氨基甲酸甲酯(盐酸盐)(非对映异构体2,4.1mg,76%)。1h nmr(400mhz,dmso-d6)δ12.50(s,1h),8.71(s,1h),7.89(m,3h),7.74(td,j=7.9,3.4hz,1h),7.63(d,j=8.0hz,2h),7.21(dd,j=7.2,4.0hz,1h),6.98(dd,j=8.4,3.3hz,1h),6.65(d,j=8.0hz,1h),5.46(s,1h),4.39(s,2h),3.56(s,3h),3.33(s,1h),2.67(t,j=10.2hz,1h),2.41(s,1h),2.09-1.91(m,2h),1.88-1.71(m,2h),1.67(s,3h),1.61-1.38(m,5h),1.28(s,9h)。esi-ms m/z计算值635.289,实验值636.2(m 1)
;保留时间:1.64分钟(lc方法a)。
[1913]
实施例45:4-{2-[(14s)-8-叔丁基-12,12-二甲基-2,2,4-三氧代-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-17-基]吡啶-4-基}哌啶-1-甲酸甲酯,化合物96的制备
[1914][1915]
向4-{2-[(14s)-8-叔丁基-12,12-二甲基-2,2,4-三氧代-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-17-基]吡啶-4-基}哌啶-1-甲酸叔丁酯(盐酸盐)(化合物117(非对映异构体2),10mg,0.01301mmol)于dcm(100μl)中的溶液中添加tfa(5μl,0.06490mmol),并将混合物搅拌数小时,并在高真空下移除溶剂。将残余物溶解于dcm(500ml)、tea(20μl,0.1435mmol)中,并在冰浴中冷却。然后缓慢添加氯甲酸甲酯(1.3μl,0.01682mmol)并搅拌反应物1小时,并且蒸发溶剂。将所得残余物溶解于dmso(1ml)并经由whatman滤盘(puradisc 25tf)过滤,并且通过反相hplc-ms方法,使用在15.0分钟内从20%-80%流动相b运行的双梯度(流动相a=h2o(5mm hcl),流动相b=ch3cn)来纯化滤液,得到呈白色固体状的4-{2-[(14s)-8-叔丁基-12,12-二甲基-2,2,4-三氧代-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-17-基]吡啶-4-基}哌啶-1-甲酸甲酯(盐酸盐)(2.2mg,23%)。esi-ms m/z计算值689.33594,实验值690.34(m 1)
;保留时间:1.06分钟(lc方法g)。
[1916]
实施例46:(14s)-17-(4-溴吡啶-2-基)-8-叔丁基-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5(10),6,8,19(23),20-六烯-2,2,4-三酮,非对映异构体1,化合物47和非对映异构体2,化合物46的制备
[1917][1918]
步骤1:(4s)-4-[3-(4-溴-2-吡啶基)-3-(叔丁基亚磺酰基氨基)丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯
[1919][1920]
在氮气下,在-78℃下向2,4-二溴吡啶(9.29g,39.216mmol)于无水甲苯(225ml)中的搅拌溶液中逐滴添加正丁基锂(14ml,2.5m于己烷中,35.000mmol)的溶液。添加完成后,将反应混合物在该温度下搅拌2小时。经由注射器向反应混合物中迅速添加(4s)-4-[(3e)-3-叔丁基亚磺酰基亚氨基丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(10.692g,29.821mmol)于无水甲苯(55ml)中的溶液。在添加完成后,将反应混合物在-78℃下搅拌1小时。将反应物用冷饱和nh4cl水溶液(150ml)缓慢淬灭,并且然后使其升温至室温。将反应混合物倒入盐水(100ml)和乙酸乙酯(100ml)的混合物中,并且分离两层。将水层用乙酸乙酯(2x150ml)萃取。将合并的有机层用盐水(100ml)洗涤,经无水硫酸钠干燥并浓缩。通过硅胶色谱法,使用0-25%丙酮/己烷梯度来纯化粗产物,得到呈白色泡沫状的(4s)-4-[3-(4-溴-2-吡啶基)-3-(叔丁基亚磺酰基氨基)丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(11.739g,72%)。esi-ms m/z计算值515.1817,实验值516.3(m 1)
;保留时间:5.85分钟(lc方法c)。
[1921]
步骤2:(4s)-4-[3-氨基-3-(4-溴-2-吡啶基)丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯
[1922][1923]
在环境条件下,在室温下向(4s)-4-[3-(4-溴-2-吡啶基)-3-(叔丁基亚磺酰基氨基)丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(11.739g,22.726mmol)于thf(120ml)和水(30ml)的混合物中的搅拌溶液中添加碘(2.162g,8.5182mmol)。将反应混合物加热至55℃,持续2小时。在冷却至室温之后,将反应混合物倒入饱和碳酸氢钠水溶液(200ml)和饱和na2s2o3水溶液(50ml)的混合物中。在真空下移除挥发物,并用乙酸乙酯(3x150ml)萃取残余水层。将合并的有机层用盐水(80ml)洗涤,经无水硫酸钠干燥并浓缩,得到呈琥珀色油状物的(4s)-4-[3-氨基-3-(4-溴-2-吡啶基)丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(10.592g,102%)。产物不经进一步纯化即用于下一步。esi-ms m/z计算值411.1521,实验值412.3(m 1)
;保留时间:4.33分钟(lc方法c)。
[1924]
步骤3:(4s)-4-[3-(4-溴-2-吡啶基)-3-[(6-氨磺酰基-2-吡啶基)氨基]丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯
[1925][1926]
在氮气下,在室温下向(4s)-4-[3-氨基-3-(4-溴-2-吡啶基)丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(10.592g,23.117mmol)和6-氟吡啶-2-磺酰胺(5.964g,33.854mmol)于无水dmso(40ml)中的搅拌溶液中添加diea(12.4ml,71.190mmol)。将反应混合物加热至125℃,持续24小时。在冷却至室温之后,将反应混合物倒入水(200ml)和盐水(300ml)的混合物中。将产物用乙酸乙酯(3x200ml)萃取。将合并的有机层用盐水(100ml)洗涤,经无水硫酸钠干燥并浓缩。通过反相hplc,使用45%-85%乙腈/水(0.15%tfa缓冲液;c
18
varian柱;60ml/min)的梯度纯化粗产物。将含有纯化产物的所有级分合并,并用饱和碳酸氢钠水溶液碱化至ph约8。在真空下移除挥发物,并用乙酸乙酯(3x250ml)萃取残余水层。将合并的有机层用盐水(120ml)洗涤,经无水硫酸钠干燥并浓缩,得到呈浅黄色固体状的(4s)-4-[3-(4-溴-2-吡啶基)-3-[(6-氨磺酰基-2-吡啶基)氨基]丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(6.779g,47%)。1h nmr(500mhz,dmso-d6)δ8.42(d,j=5.2hz,1h),7.80-7.75(m,1h),7.57-7.45(m,3h),7.04(s,2h),6.97(d,j=7.2hz,1h),6.71(d,j=8.5hz,1h),5.20(s,1h),3.60-3.45(m,1h),2.83-2.66(m,1h),2.16-2.01(m,1h),1.94-1.74(m,3h),1.41-1.35(m,11h),1.35-1.30(m,4h),1.22(s,3h)。esi-ms m/z计算值567.1515,实验值568.3(m 1)
;保留时间:2.37分钟(lc方法b)。
[1927]
步骤4:(4s)-4-[3-(4-溴-2-吡啶基)-3-[[6-[(6-叔丁基-2-氟-吡啶-3-羰基)氨磺酰基]-2-吡啶基]氨基]丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯
[1928][1929]
在100-ml圆底烧瓶中,将6-叔丁基-2-氟-吡啶-3-甲酸(1.483g,7.520mmol)溶解于thf(30ml)中,向其中添加cdi(1.210g,7.462mmol)。将所得混合物在室温下搅拌14小时。此后,添加(4s)-4-[3-(4-溴-2-吡啶基)-3-[(6-氨磺酰基-2-吡啶基)氨基]丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(2.4958g,4.241mmol)和dbu(3ml,20.06mmol),并将所得混合物在室温下搅拌24小时。此后,将混合物真空浓缩。然后,将混合物倒入etoac(300ml)中。然后将该混合物用饱和碳酸氢钠水溶液(150ml)、hcl水溶液(0.1n,150ml)和饱和nacl水溶液(150ml)洗涤,然后经na2so4干燥,过滤并真空蒸发。通过硅胶色谱法(120g二氧化硅),使用0至80%etoac/己烷的梯度洗脱来纯化所得棕色泡沫,得到灰白色泡沫(4s)-4-[3-(4-溴-2-吡啶基)-3-[[6-[(6-叔丁基-2-氟-吡啶-3-羰基)氨磺酰基]-2-吡啶基]氨基]丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(1.7446g,55%);esi-ms m/z计算值746.22614,实验值747.2(m 1)
;保留时间:2.13分钟和2.15分钟(lc方法a)。
[1930]
步骤5:(14s)-17-(4-溴吡啶-2-基)-8-叔丁基-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5(10),6,8,19(23),20-六烯-2,2,4-三酮,非对映异构体1,化合物47,和(14s)-17-(4-溴吡啶-2-基)-8-叔丁基-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5(10),6,8,19(23),20-六烯-2,2,4-三酮,非对映异构体2,化合物46
[1931][1932]
阶段1:在100-ml圆底烧瓶中,将(4s)-4-[3-(4-溴-2-吡啶基)-3-[[6-[(6-叔丁基-2-氟-吡啶-3-羰基)氨磺酰基]-2-吡啶基]氨基]丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(1.7446g,2.333mmol)溶解于二氯甲烷(30ml)中。添加tfa(4.0ml,51.92mmol),并使所得溶液在室温下静置24小时。然后将混合物真空蒸发,用二噁烷稀释,并再次真空蒸发。这得到橙色泡沫状物,约1.8g(>100%产率)。阶段2:在100-ml圆底烧瓶中,将来自步骤1的粗产物溶解于nmp(30ml)中,向其中添加k2co3(3.0g,21.71mmol)。将所得混合物用氮气冲洗,然后在150℃下搅拌18小时。在冷却至室温之后,将反应混合物倒入hcl水溶液(1n;200ml),然后用etoac(2
×
200ml)萃取。将合并的有机萃取物用h2o(200ml)和饱和nacl水溶液(200ml)洗涤,然后经na2so4干燥,过滤并真空蒸发。获得作为粗产物的棕色泡沫状物(约
2.02(m,2h),1.85(dd,j=12.0,5.8hz,1h),1.77-1.65(m,1h),1.60(s,3h),1.52(s,3h),1.52-1.45(m,1h),1.27(s,9h)。[注意:总质子数40h中缺少1h。]。esi-ms m/z计算值604.2832,实验值605.3(m 1)
;保留时间:1.49分钟(lc方法a)。
[1943]
使用(14s)-17-(4-溴吡啶-2-基)-8-叔丁基-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5(10),6,8,19(23),20-六烯-2,2,4-三酮,非对映异构体2,化合物46作为起始物质,以与上述类似的方式制备下表中的化合物。
[1944][1945][1946]
实施例49:(14s)-8-叔丁基-17-(5-叔丁基吡啶-2-基)-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮,化合物187(非对映异构体1)和化合物186(非对映异构体2)的制备
78℃下搅拌2小时,然后在室温下搅拌隔夜。在0℃下,将反应物用饱和nh4oh(100ml)和1n naoh(75ml)淬灭。将反应混合物过滤,并用乙醚(500ml)冲洗。将溶剂减压蒸发直至约300ml,并且然后用乙醚(1500ml)稀释,用水(720ml)洗涤,经无水硫酸钠干燥,过滤,小心地真空浓缩。通过硅胶色谱法(两次),使用0至20%etoac/己烷来纯化残余物,得到呈浅黄色固体状的n-(5-叔丁基-2-吡啶基)氨基甲酸叔丁酯(4.71g,21%)。esi-ms m/z计算值250.1681,实验值251.4(m 1)
;保留时间:2.22分钟(lc方法b)。
[1951]
步骤2:5-叔丁基吡啶-2-胺
[1952][1953]
在0℃下,向n-(5-叔丁基-2-吡啶基)氨基甲酸叔丁酯(4.51g,18.016mmol)于dcm(22ml)中的溶液中添加tfa(22ml)。将反应混合物在室温下搅拌4小时。通过减压蒸发溶剂。将残余物用dcm(300ml)稀释,并用饱和碳酸氢钠水溶液(300ml)洗涤,经无水硫酸钠干燥并真空干燥,得到呈黄色固体状的5-叔丁基吡啶-2-胺(2.69g,99%)。esi-ms m/z计算值150.1157,实验值151.2(m 1)
;保留时间:1.59分钟(lc方法b)。
[1954]
步骤3:2-溴-5-叔丁基-吡啶
[1955][1956]
在-20℃下,向5-叔丁基吡啶-2-胺(2.7g,17.974mmol)于hbr(26ml,48%w/w,110.31mmol)中的悬浮液中逐滴添加br2(4.5ml,87.349mmol),并将反应物在相同温度下搅拌1.5小时。然后将亚硝酸钠(5.75g,83.339mmol)于水(8.6ml)中的溶液逐滴添加到反应混合物中。使反应混合物在1小时内升温至15℃,并且在相同温度下搅拌30分钟。将反应混合物冷却至-20℃,并且用naoh水溶液(10n,80ml)处理。将反应混合物在室温下搅拌10分钟,然后用乙醚(3x135ml)萃取。将合并的有机层用水(150ml)洗涤,经无水硫酸钠干燥并浓缩,真空干燥,得到呈棕色油状物的2-溴-5-叔丁基-吡啶(3.7094g,96%)。esi-ms m/z计算值213.0153,实验值214.3(m 1)
;保留时间:3.22分子1h nmr(250mhz,dmso-d6)δ8.43(d,j=2.8hz,1h),7.78(dd,j=8.3,2.7hz,1h),7.55(dd,j=8.4,0.7hz,1h),1.29(s,9h)。esi-ms m/z计算值213.0153,实验值214.3(m 1)
;保留时间:3.22分钟(lc方法b)。
[1957]
步骤4:(4s)-4-[3-(5-叔丁基-2-吡啶基)-3-(叔丁基亚磺酰基氨基)丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯
[1958][1959]
将2-溴-5-叔丁基-吡啶(1.7g,7.5431mmol)溶解于乙醚(40ml)中,并且将溶液在氮气球下在干冰丙酮浴(《-70℃)中冷却。添加n-buli(3.1ml,2.5m于己烷中,7.7500mmol)。将混合物在此温度下搅拌1小时。添加(4s)-4-[(3z)-3-叔丁基亚磺酰基亚氨基丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(3.33g,8.8233mmol)于thf(8ml)中的溶液。将混合物在-78℃至-30℃下搅拌1小时。添加饱和nh4cl水溶液(25ml)。使混合物升温至室温,并在水(50ml)和etoac(100ml)之间分配。分离各层,并用更多etoac(100ml)萃取水层。将合并的有机层用盐水洗涤,经硫酸钠干燥并浓缩。将该产物与另一批使用相同化学方法制备的330mg规模的批料合并,得到粗制(4s)-4-[3-(5-叔丁基-2-吡啶基)-3-(叔丁基亚磺酰基氨基)丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(5.5g,99%调整的产率)。esi-ms m/z计算值493.3338,实验值494.6(m 1)
;保留时间:3.12分钟(lc方法b)。
[1960]
步骤5:(4s)-4-[3-氨基-3-(5-叔丁基-2-吡啶基)丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯
[1961][1962]
将(4s)-4-[3-(5-叔丁基-2-吡啶基)-3-(叔丁基亚磺酰基氨基)丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(5.5g,8.9115mmol)溶解于thf(52ml)和水(10ml)中。添加分子碘(700mg,2.7525mmol)。将混合物在35℃下搅拌16小时。然后将其冷却至室温,并使其在etoac(200ml)和含na2s2o3(60g)的饱和碳酸氢钠水溶液(200ml)之间分配。分离各层,并将水层用etoac(100ml)萃取一次。浓缩有机层。将残余物溶解于1m hcl(400ml)中,并用etoac(300ml)萃取。将水层通过2.5m naoh碱化并用etoac(2x300ml)萃取。将有机层用盐水洗涤,经无水na2so4干燥,过滤并浓缩,得到(4s)-4-[3-氨基-3-(5-叔丁基-2-吡啶基)丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(2.25g,58%)。esi-ms m/z计算值389.3042,实验值390.7(m 1)
;保留时间:3.1分钟(lc方法b)。
[1963]
步骤6:(4s)-4-[3-(5-叔丁基-2-吡啶基)-3-[(6-氨磺酰基-2-吡啶基)氨基]丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯
羰基)氨磺酰基]-2-吡啶基]氨基]-3-(5-叔丁基-2-吡啶基)丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(380mg,82%)的非对映异构体对。esi-ms m/z计算值724.37823,实验值725.2(m 1)
;保留时间:1.88分钟(lc方法a)。
[1969]
步骤8:(14s)-8-叔丁基-17-(5-叔丁基吡啶-2-基)-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮,化合物187(非对映异构体1),和(14s)-8-叔丁基-17-(5-叔丁基吡啶-2-基)-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮,化合物186(非对映异构体2)
[1970][1971]
阶段1:将(4s)-4-[3-[[6-[(6-叔丁基-2-氟-吡啶-3-羰基)氨磺酰基]-2-吡啶基]氨基]-3-(5-叔丁基-2-吡啶基)丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(380mg,0.5242mmol)溶解于dcm(9ml)中,并向混合物中添加tfa(1.5ml,19.47mmol),并在室温下搅拌。在30分钟后,反应完成。将混合物蒸发至干燥,然后用乙醚(30ml x 2)稀释,并再浓缩。然后将材料放置在高真空泵上2小时,得到呈灰白色固体状的中间体6-叔丁基-n-[[6-[[1-(5-叔丁基-2-吡啶基)-3-[(3s)-5,5-二甲基吡咯烷-3-基]丙基]氨基]-2-吡啶基]磺酰基]-2-氟-吡啶-3-甲酰胺(三氟乙酸盐)。
[1972]
阶段2:来自阶段1的材料与k2co3(750mg,5.427mmol)、分子筛和nmp(9ml)合并于小瓶中,用氮气吹扫,封盖,加热至155℃并搅拌20小时。将混合物用乙酸乙酯和水稀释。将有机层萃取(2x)并用10%柠檬酸溶液进一步洗涤,随后用盐水洗涤。将有机物分离,经硫酸钠干燥,蒸发至浅棕色油状物。通过反相制备型色谱法,使用c
18
柱和在15分钟内15%-75%乙腈/水( 5mm hcl)的梯度来纯化该残余物,得到两种产物:
[1973]
首先洗脱的非对映异构体1,白色固体:(14s)-8-叔丁基-17-(5-叔丁基吡啶-2-基)-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮(119.5mg,75%)。1h nmr(400mhz,dmso-d6)δ12.52(s,1h),8.71-8.54(m,2h),8.19(d,j=8.6hz,2h),7.84-7.62(m,2h),7.45(d,j=7.9hz,1h),7.36(d,j=7.3hz,1h),6.97(d,j=8.4hz,1h),6.62(d,j=7.9hz,1h),5.18(s,1h),4.31-4.15(m,1h),3.23(s,1h),2.75-2.61(m,1h),2.31(dd,j=11.6,5.5hz,1h),2.20-2.04(m,1h),1.86(dd,j=11.7,5.6hz,1h),1.54(s,6h),1.35(s,9h),1.27(s,9h),0.85-0.81(m,2h)。esi-ms m/z计算值604.3196,实验值605.2(m 1)
;保留时间:1.73分钟(lc方法a)。
[1974]
第二洗脱的非对映异构体2,白色固体:(14s)-8-叔丁基-17-(5-叔丁基吡啶-2-基)-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮(102.7mg,64%)。1h nmr(400mhz,dmso-d6)δ
12.43(s,1h),8.66(d,j=2.4hz,1h),8.35(s,1h),8.05-7.73(m,2h),7.73-7.68(m,1h),7.64(d,j=8.0hz,1h),7.18(d,j=7.1hz,1h),6.95(d,j=8.5hz,1h),6.66(d,j=8.0hz,1h),5.43(s,1h),3.30(t,j=8.3hz,1h),2.71(d,j=10.3hz,1h),2.05-1.92(m,2h),1.85(dd,j=11.7,5.1hz,1h),1.77(d,j=14.2hz,1h),1.67(s,3h),1.57(t,j=12.4hz,1h),1.51(s,3h),1.33(s,9h),1.28(s,9h),0.89-0.75(m,2h)。esi-ms m/z计算值604.3196,实验值605.2(m 1)
;保留时间:1.71分钟(lc方法a)。
[1975]
实施例50:(14s)-8-叔丁基-17-(6-叔丁基吡啶-2-基)-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮,化合物179(非对映异构体1)和化合物178(非对映异构体2)的制备
[1976][1977]
步骤1:2-溴-6-叔丁基-吡啶
[1978][1979]
将2,6-二溴吡啶(12.3g,50.884mmol)溶解于thf(100ml)中。添加cui(2.48g,13.022mmol)。在氮气球下,在低于-70℃下将混合物在干冰丙酮浴中搅拌。然后在15分钟内缓慢添加叔丁基氯化镁(78.2ml,1m,78.200mmol)。使反应混合物自行升温至室温,并在室温下搅拌15小时。添加饱和nh4cl水溶液(50ml)。将混合物浓缩以移除大部分thf,并且然后
用dcm(50ml x 3)萃取。合并的有机物经无水mgso4干燥,过滤并浓缩。通过硅胶色谱法(120g柱),使用0-20%etoac/己烷来纯化残余物,得到呈白色半固体状的2-溴-6-叔丁基-吡啶(8.2g,72%)。esi-ms m/z计算值213.0153,实验值214.3(m 1)
;保留时间:3.74分钟(lc方法b)。
[1980]
步骤2:(4s)-4-[3-(6-叔丁基-2-吡啶基)-3-(叔丁基亚磺酰基氨基)丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯
[1981][1982]
将2-溴-6-叔丁基吡啶(8.2g,36.385mmol)溶解于thf(120ml)中,并在氮气球下,在干冰丙酮浴中搅拌15分钟。在5分钟内快速逐滴添加n-buli(15.2ml,2.5m于己烷中,38.00mmol)。将混合物在低于-70℃下搅拌30分钟。添加(4s)-4-[(3e)-3-叔丁基亚磺酰基亚氨基丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(6.8g,18.966mmol)于thf(10ml加2ml冲洗液)中的溶液。将混合物在相同温度下再搅拌15分钟。添加nh4cl(20ml,饱和水溶液)。从冷却浴中移除混合物。添加水(50ml)和etoac(100ml),并且将混合物在温水浴中搅拌,直到形成两个均质层。分离各层。有机层经无水na2so4干燥,过滤并浓缩。通过硅胶色谱法(120g柱),使用0-40%etoac/己烷来纯化残余物,得到粗产物(4s)-4-[3-(6-叔丁基-2-吡啶基)-3-(叔丁基亚磺酰基氨基)丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(8g,77%)。esi-ms m/z计算值493.3338,实验值494.7(m 1)
;保留时间:3.46分钟(lc方法b)。
[1983]
步骤3:(4s)-4-[3-氨基-3-(6-叔丁基-2-吡啶基)丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯
[1984][1985]
将(4s)-4-[3-(6-叔丁基-2-吡啶基)-3-(叔丁基亚磺酰基氨基)丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(8g,14.582mmol)溶解于thf(50ml)和水(10ml)的溶剂混合物中。一次性添加分子碘(1.11g,0.2252ml,4.3734mmol)。然后将混合物在50℃油浴中加热3小时。然后将其冷却至室温。添加na2s2o3(10g于30ml饱和碳酸氢钠水溶液中),随后添加etoac(50ml)。分离各层,并将有机层用盐水洗涤,经无水na2so4干燥,过滤并浓缩。通过硅胶色谱法(80g柱),使用0-5%meoh/dcm来纯化残余物,得到呈白色泡沫状的粗制(4s)-4-[3-氨基-3-(6-丁基-2-吡啶基)丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(4.88g,82%)。esi-ms m/z计算值389.3042,实验值390.7(m 1)
;保留时间:3.3分钟(lc方法b)。
[1986]
步骤4:(4s)-4-[3-(6-叔丁基-2-吡啶基)-3-[(6-氨磺酰基-2-吡啶基)氨基]丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯
[1987][1988]
将(4s)-4-[3-氨基-3-(6-叔丁基-2-吡啶基)丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(4.8g,11.705mmol)溶解于dmso(5ml)中。添加6-氟吡啶-2-磺酰胺(2.6g,14.759mmol),然后添加na2co3(4g,37.740mmol)。将混合物在氮气球下充分搅拌,并放置在110℃油浴中。在20小时后,将混合物冷却至室温,用水(50ml)和etoac(50ml)稀释。分离各层,并且有机层经无水mgso4干燥,过滤并浓缩。通过硅胶色谱法(80g柱),使用0-50%etoac/己烷来纯化残余物,得到呈白色泡沫状的(4s)-4-[3-(6-叔丁基-2-吡啶基)-3-[(6-氨磺酰基-2-吡啶基)氨基]丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(2.7539g,42%)。1h nmr(500mhz,dmso-d6)δ7.64(td,j=7.8,1.4hz,1h),7.54(dd,j=8.6,7.2hz,1h),7.32(t,j=7.9hz,1h),7.29
–
7.22(m,2h),7.07(s,2h),6.98(d,j=7.2hz,1h),6.74(d,j=8.4hz,1h),5.18(s,1h),3.52(q,j=11.1hz,1h),2.81
–
2.65(m,1h),2.07(s,1h),1.97(s,1h),1.91
–
1.77(m,2h),1.43
–
1.35(m,11h),1.33(s,14h),1.22(d,j=1.3hz,3h)。esi-ms m/z计算值545.3036,实验值546.4(m 1)
;保留时间:2.27分钟(lc方法h)。
[1989]
步骤5:(4s)-4-[3-[[6-[(6-叔丁基-2-氟-吡啶-3-羰基)氨磺酰基]-2-吡啶基]氨基]-3-(6-叔丁基-2-吡啶基)丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯
[1990][1991]
向6-叔丁基-2-氟-吡啶-3-甲酸(165mg,0.8367mmol)于thf(5.0ml)中的溶液中添加cdi(140mg,0.8634mmol),并且将混合物在室温下搅拌20小时。然后添加(4s)-4-[3-(6-叔丁基-2-吡啶基)-3-[(6-氨磺酰基-2-吡啶基)氨基]丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(250mg,0.4581mmol),随后添加dbu(375μl,2.508mmol),并将所得混合物在室温下搅拌4小时。将反应物用乙酸乙酯稀释,并用饱和碳酸氢钠水溶液洗涤。将有机层进一步用10%柠檬酸溶液洗涤,随后用盐水洗涤。将有机物分离,经硫酸钠干燥并蒸发。然后通过反相制备型色谱法,使用c
18
柱和在15分钟内1%-99%乙腈/水( 5mm hcl)的梯度来纯化粗物质,然后在高真空下抽吸3小时,得到呈白色固体状的(4s)-4-[3-[[6-[(6-叔丁基-2-氟-吡啶-3-羰基)氨磺酰基]-2-吡啶基]氨基]-3-(6-叔丁基-2-吡啶基)丙基]-2,2-二甲基-吡咯
烷-1-甲酸叔丁酯(190mg,57%)的非对映异构体对。esi-ms m/z计算值724.37823,实验值725.2(m 1)
;保留时间:2.16分钟(lc方法a)。
[1992]
步骤6:(14s)-8-叔丁基-17-(6-叔丁基吡啶-2-基)-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮,化合物179(非对映异构体1),和(14s)-8-叔丁基-17-(6-叔丁基吡啶-2-基)-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮,化合物178(非对映异构体2)
[1993][1994]
阶段1:将(4s)-4-[3-[[6-[(6-叔丁基-2-氟-吡啶-3-羰基)氨磺酰基]-2-吡啶基]氨基]-3-(6-叔丁基-2-吡啶基)丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(190mg,0.2621mmol)溶解于dcm(5.5ml)中,并向混合物中添加tfa(750μl,9.735mmol),并在室温下搅拌。在30分钟后,将混合物蒸发至干燥,然后用乙醚(30ml x 2)稀释,并再浓缩。然后将材料放置在高真空泵上2小时,得到中间体6-叔丁基-n-[[6-[[1-(6-叔丁基-2-吡啶基)-3-[(3s)-5,5-二甲基吡咯烷-3-基]丙基]氨基]-2-吡啶基]磺酰基]-2-氟-吡啶-3-甲酰胺(三氟乙酸盐)esi-ms m/z计算值624.3258,实验值625.2(m 1)
;保留时间:1.38分钟,呈灰白色固体状(lc方法a)。
[1995]
阶段2:来自阶段1的材料与k2co3(375mg,2.713mmol)、分子筛和nmp(4ml)合并于小瓶中,用氮气吹扫,封盖,加热至150℃并搅拌20小时。将混合物用乙酸乙酯和水稀释。将有机层萃取(2x)并用10%柠檬酸溶液进一步洗涤,随后用盐水洗涤。将有机物分离,经硫酸钠干燥,蒸发至浅棕色油状物。通过反相制备型色谱法,使用c
18
柱和在15分钟内30%-99%乙腈/水( 5mm hcl)的梯度来纯化该残余物,得到两种异构体产物:
[1996]
非对映异构体1,极性较大,白色固体:(14s)-8-叔丁基-17-(6-叔丁基吡啶-2-基)-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮(34.2mg,43%)。1h nmr(400mhz,dmso-d6)δ12.47(s,1h),7.62(dt,j=22.7,7.3hz,4h),7.25(s,2h),7.11(d,j=7.2hz,1h),6.91(d,j=8.5hz,1h),6.65(d,j=8.0hz,1h),5.22(s,1h),3.17(s,1h),2.75(t,j=10.4hz,1h),2.18(d,j=16.5hz,2h),1.86(dd,j=11.7,5.2hz,2h),1.75(d,j=14.6hz,1h),1.65(s,3h),1.58(t,j=12.3hz,1h),1.51(s,3h),1.45(d,j=11.4hz,1h),1.30(d,j=17.4hz,18h)。esi-ms m/z计算值604.3196,实验值605.2(m 1)
;保留时间:2.02分钟(lc方法a)。
[1997]
非对映异构体2,极性较低,白色固体:(14s)-8-叔丁基-17-(6-叔丁基吡啶-2-基)-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮(42.0mg,52%)。1h nmr(400mhz,dmso-d6)δ12.32(s,1h),7.65(t,j=7.9hz,4h),7.42(d,j=31.8hz,2h),7.25(s,1h),6.90(d,j=
1-环丙基-丙基)环丙烷(6g,91%)。1h nmr(250mhz,氯仿-d)δ3.79
–
3.54(m,2h),2.29
–
1.89(m,2h),1.24(m,1h),0.79
–‑
0.11(m,12h)。
[2003]
步骤2:(4s)-4-[3-(叔丁基亚磺酰基氨基)-6,6-二环丙基-己基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯
[2004][2005]
称取mg(841mg,34.602mmol)放入干燥容器中。在顶部装有氮气气球的情况下,添加微小碘晶体,用加热枪短暂加热烧瓶,直至看到碘蒸气为止。将烧瓶冷却至室温。添加thf(60ml),随后添加一些二溴乙烷(约0.1ml)。将混合物有效地搅拌5分钟。碘颜色消失。经由注射器在20分钟内以小份添加(3-溴-1-环丙基-丙基)环丙烷(5.7g,25.256mmol)于thf(20ml)中的溶液。反应轻微放热。在完全添加后,将混合物在室温下进一步搅拌1小时。然后使用干冰丙酮浴将其冷却至约-30℃。逐滴添加含(4s)-4-[(3e)-3-叔丁基亚磺酰基亚氨基丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(4g,11.156mmol)的thf(20ml)。在此温度下搅拌30分钟后,添加nh4cl(40ml,饱和水溶液),随后添加etoac(100ml)。分离各层,并且将有机层与来自在相似条件下以360mg规模操作的另一反应的粗溶液合并。将其用盐水洗涤,经无水mgso4干燥,过滤并浓缩,得到呈浅黄色油状物的粗制(4s)-4-[3-(叔丁基亚磺酰基氨基)-6,6-二环丙基-己基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(5.2g,87%调整的产率)。esi-ms m/z计算值482.3542,实验值483.7(m 1)
;保留时间:4.84分钟(lc方法b)。
[2006]
步骤3:(4s)-4-(3-氨基-6,6-二环己基)-2,2-二甲基-吡咯烷-1-甲酸叔丁酯
[2007][2008]
将(4s)-4-[3-(叔丁基亚磺酰基氨基)-6,6-二环丙基-己基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(5.2g,9.6942mmol)溶解于thf(50ml)和水(10ml)的溶剂混合物中。一次性添加分子碘(493mg,0.1000ml,1.9424mmol)。将混合物在50℃油浴中加热3小时。然后将其冷却至室温,并用na2s2o3(2g于20ml饱和碳酸氢钠水溶液中)处理。添加etoac(50ml),然后添加水(50ml)。分离各层,并将有机层用盐水洗涤,经无水mgso4干燥,过滤并浓缩。浅黄色泡沫状粗产物不经进一步纯化即用于下一步。(4s)-4-(3-氨基-6,6-二环丙基-己基)-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(5.5g,120%)。esi-ms m/z计算值378.3246,实验值379.8(m 1)
;保留时间:3.39分钟(lc方法b)。
100%流动相b运行的双梯度(流动相a=h2o(5mm hcl),流动相b=ch3cn)来纯化所得残余物,得到两种异构体:
[2015]
第一洗脱的非对映异构体1:(4s)-4-[3-[[6-[(6-叔丁基-2-氟-吡啶-3-羰基)氨磺酰基]-2-吡啶基]氨基]-6,6-二环丙基-己基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(112mg,42%)。esi-ms m/z计算值713.3986,实验值714.5(m 1)
;保留时间:1.84分钟(lc方法m)。
[2016]
第二洗脱的非对映异构体2:(4s)-4-[3-[[6-[(6-叔丁基-2-氟-吡啶-3-羰基)氨磺酰基]-2-吡啶基]氨基]-6,6-二环丙基-己基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(124mg,46%)。esi-ms m/z计算值713.3986,实验值714.5(m 1)
;保留时间:1.89分钟(lc方法m)。
[2017]
步骤6:(14s)-8-叔丁基-17-(3,3-二环丙基丙基)-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5(10),6,8,19(23),20-六烯-2,2,4-三酮,化合物51(非对映异构体1)
[2018][2019]
将(4s)-4-[3-[[6-[(6-叔丁基-2-氟-吡啶-3-羰基)氨磺酰基]-2-吡啶基]氨基]-6,6-二环丙基-己基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(110mg,0.1541mmol)(非对映异构体1)于tfa(125μl,1.622mmol)和dcm(500μl)的1:4预混合溶液中的溶液在室温下搅拌2小时。移除溶剂并在高真空泵上干燥。将所得残余物溶解在dmso(2ml)中,并添加k2co3(347mg,2.511mmol),并且将微波小瓶封盖,并将混合物在140℃下加热16小时。冷却至室温,并将混合物经由whatman滤盘(puradisc 25tf)过滤,并且通过反相hplc-ms方法,使用在15.0分钟内从30%-99%流动相b运行的双梯度(流动相a=h2o(5mm hcl),流动相b=ch3cn)来纯化滤液,得到呈白色固体状的(14s)-8-叔丁基-17-(3,3-二环丙基丙基)-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5(10),6,8,19(23),20-六烯-2,2,4-三酮(盐酸盐)(45.1mg,46%)。1h nmr(400mhz,dmso-d6)δ12.38(s,1h),7.55(t,j=7.9hz,1h),7.39(d,j=7.9hz,1h),7.16(d,j=7.3hz,2h),6.73(d,j=8.5hz,1h),6.60(d,j=7.9hz,1h),3.28(s,1h),3.16(d,j=9.5hz,1h),2.90(s,1h),2.23(s,2h),1.90(s,1h),1.81(dd,j=12.0,5.6hz,1h),1.66(d,j=13.9hz,2h),1.56(s,3h),1.50(d,j=16.1hz,7h),1.26(s,9h),1.14(q,j=10.3,9.2hz,1h),0.53(dp,j=13.3,6.2hz,2h),0.33(dd,j=8.7,4.1hz,3h),0.25(q,j=4.3hz,1h),0.12(dt,j=8.6,4.5hz,2h),0.04(dt,j=13.9,6.6hz,2h),-0.07(p,j=4.8hz,1h)。esi-ms m/z计算值593.33997,实验值594.5(m 1)
;保留时间:1.78分钟(lc方法m)。
[2020]
使用(4s)-4-[3-[[6-[(6-叔丁基-2-氟-吡啶-3-羰基)氨磺酰基]-2-吡啶基]氨基]-6,6-二环丙基-己基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(110mg,0.1541mmol)(非对映异构体2)作为起始物质,以类似于上述方式制备下表中的化合物:
[2021][2022][2023]
实施例52:(14s,17r)-8-(3,3-二甲基丁基)-12,12-二甲基-17-(吡啶-2-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮,化合物105的制备
[2024][2025]
步骤1:(14s,17r)-8-[(1e)-3,3-二甲基丁-1-烯-1-基]-12,12-二甲基-17-(吡啶-2-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮,化合物106
[2026][2027]
通过鼓入氮气持续1分钟,使(14s,17r)-8-溴-12,12-二甲基-17-(吡啶-2-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮(40mg,0.070mmol)、2-[(e)-3,3-二甲基丁-1-烯基]-4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷(59mg,0.281mmol)、pd(dppf)cl2(5mg,0.0068mmol)、乙腈(700μl)和nahco3(420μl,1m,0.420mmol)的混合物脱气,接着将其加热至100℃,持续3小时。然后,将混合物用2ml水、2ml的5:1dcm/meoh稀释,然后添加0.5ml的1m hcl,并且当试纸显示ph为4时,将混合物分配。分离各层,并将水层用5:1dcm/meoh(2ml)萃取。将残余物以40mg/ml溶解于1:1meoh/acn中,并经历制备型sfc,经由21.2x250mm 2-pic柱,5μm粒度,使用5mm nh3/甲醇至co2(在10分钟内15%-50%)梯度洗脱,得到呈白色固体状(收集的级分蒸发后)的目标:(14s,17r)-8-[(1e)-3,3-二甲基丁-1-烯-1-基]-12,12-二甲基-17-(吡啶-2-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮(29mg,72%)。1h nmr(400mhz,氯仿-d)δ8.61-8.56(m,1h),7.96(d,j=7.9hz,1h),7.66(td,j=7.7,1.8hz,1h),7.61-7.53(m,2h),7.29(d,j=7.7hz,1h),7.21(ddd,j=7.6,4.9,1.1hz,1h),6.85(d,j=15.8hz,1h),6.78(d,j=7.9hz,1h),6.65(dd,j=6.8,2.4hz,1h),6.27(d,j=15.8hz,1h),5.98(d,j=8.2hz,1h),5.35(q,j=6.9hz,1h),3.47(dd,j=9.7,6.8hz,1h),3.13(s,1h),2.98(t,j=10.1hz,1h),2.26(dd,j=12.4,9.1hz,1h),1.93(dt,j=14.5,7.5hz,1h),1.72(d,j=9.1hz,1h),1.67(s,3h),1.65(s,3h),1.62-1.40(m,3h),1.13(s,9h)。esi-ms m/z计算值574.2726,实验值
575.5(m 1)
;保留时间:1.48分钟(lc方法s)。
[2028]
步骤2:(14s,17r)-8-(3,3-二甲基丁基)-12,12-二甲基-17-(吡啶-2-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮,化合物105
[2029][2030]
在氢气球压力下,将(14s,17r)-8-[(1e)-3,3-二甲基丁-1-烯-1-基]-12,12-二甲基-17-(吡啶-2-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮(24mg,0.04176mmol)、钯/碳(11mg,10%w/w,0.01034mmol)、etoac(2ml)和甲醇(2ml)的混合物搅拌16小时。然后,将混合物过滤,浓缩并将残余物溶解于etoac(2ml)和甲醇(2ml)中,添加pd(oh)2(7mg,20%w/w,0.00997mmol)并使混合物在55psi氢气下进行parr振荡器氢化2小时,经硅藻土过滤,蒸发溶剂,并将残余物溶解于meoh中并经由0.45μm过滤器过滤,并且滤液经历制备型sfc,经由21.2x250mm2-pic柱,5μm粒度和一系列400μl进样,使用5mm nh3/甲醇至co2(在10分钟内15%-50%)梯度洗脱,得到呈白色固体状(所收集的级分蒸发后)的目标:(14s,17r)-8-(3,3-二甲基丁基)-12,12-二甲基-17-(吡啶-2-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮(11.6mg,48%)。1h nmr(400mhz,氯仿-d)δ8.59-8.55(m,1h),7.91(d,j=7.8hz,1h),7.66(td,j=7.7,1.8hz,1h),7.59-7.51(m,2h),7.29(d,j=7.8hz,1h),7.21(ddd,j=7.5,4.8,1.1hz,1h),6.70(d,j=7.8hz,1h),6.65(dd,j=7.4,1.8hz,1h),5.96(d,j=8.2hz,1h),5.35(q,j=6.8hz,1h),3.45(dd,j=9.6,6.8hz,1h),3.08(d,j=7.4hz,1h),2.97(t,j=10.1hz,1h),2.68-2.60(m,2h),2.23(dd,j=12.4,8.9hz,1h),1.92(dt,j=14.5,7.1hz,1h),1.70(dt,j=14.3,7.3hz,1h),1.63(s,6h),1.61-1.41(m,5h),0.95(s,9h)。esi-ms m/z计算值576.28827,实验值577.5(m 1)
;保留时间:1.53分钟(lc方法s)。
[2031]
实施例53:(14s,17r)-12,12-二甲基-8-(4-甲基戊-1-炔-1-基)-17-(吡啶-2-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮,化合物157的制备
[2032][2033]
通过鼓入氮气持续1分钟,使(14s,17r)-8-溴-12,12-二甲基-17-(吡啶-2-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19
(23),20-六烯-2,2,4-三酮(25mg,0.04375mmol)、pd(pph3)4(10mg,0.0086mmol)、cui(1.7mg,0.00893mmol)、三乙胺(0.43ml)的混合物脱气,然后添加4-甲基戊-1-炔(103μl,0.8752mmol),并将混合物加热至100℃,持续16小时。然后将混合物蒸发并溶解于2ml水、2ml的5:1dcm/meoh中,然后添加0.6ml的1m hcl,并且当试纸显示ph为4时,将混合物分配。分离各层,并将水层用5:1dcm/meoh(2ml)萃取。将合并的有机萃取物干燥(mgso4)并蒸发。残留物经历快速色谱法(12g sio2,25%-70%溶液(5%meoh于etoac中)至己烷),得到目标:(14s,17r)-12,12-二甲基-8-(4-甲基戊-1-炔-1-基)-17-(吡啶-2-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮(8.5mg,34%)。1h nmr(400mhz,氯仿-d)δ8.58-8.53(m,1h),7.89(d,j=7.9hz,1h),7.65(td,j=7.7,1.8hz,1h),7.56(dd,j=8.2,7.2hz,1h),7.52-7.48(m,1h),7.29(dd,j=7.8,1.1hz,1h),7.20(ddd,j=7.6,4.9,1.1hz,1h),6.87(d,j=7.8hz,1h),6.66(dd,j=8.2,1.0hz,1h),5.93(d,j=8.4hz,1h),5.35(q,j=7.0hz,1h),3.47-3.39(m,1h),3.02-2.91(m,2h),2.32(d,j=6.5hz,2h),2.17(dd,j=11.7,7.6hz,1h),2.01-1.87(m,2h),1.74(dt,j=14.5,7.5hz,1h),1.63(s,3h),1.62(s,3h),1.60-1.37(m,3h),1.05(d,j=6.7hz,6h)。esi-ms m/z计算值572.25696,实验值573.0(m 1)
;保留时间:1.4分钟(lc方法a)。
[2034]
实施例54:(14s,17r)-12,12-二甲基-17-(吡啶-2-基)-8-[(1s,3s)-3-(丙-2-基氧基)环丁氧基]-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮,化合物161的制备
[2035][2036]
向(14s,17r)-8-溴-12,12-二甲基-17-(吡啶-2-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮(25mg,0.04375mmol)、3-异丙氧基环丁醇(17mg,0.1306mmol)、叔丁醇钠(13mg,0.1353mmol)、pd2(dba)3(4mg,0.004368mmol)和[1-(2-二苯基膦基-1-萘基)-2-萘基]-二苯基-膦(3mg,0.004818mmol)的混合物中添加甲苯(0.43ml),通过鼓入氮气30秒使混合物脱气,然后在100℃下加热16小时并且再添加pd2(dba)3(4mg,0.004368mmol)和[1-(2-二苯基膦基-1-萘基)-2-萘基]-二苯基-膦(3mg,0.0048mmol)。在100℃下继续加热24小时,然后将混合物用etoac稀释,用1m hcl将ph降低至4,用4-1dcm/meoh萃取,干燥并蒸发。将残余物溶解于1:1acn/meoh中,并且通过制备型sfc,经由21.2x250mm 2-pic柱(柱6),5μm粒度,使用5mm nh3/甲醇至co2(在10分钟内25%-50%)梯度洗脱来纯化,得到(14s,17r)-12,12-二甲基-17-(吡啶-2-基)-8-[(1s,3s)-3-(丙-2-基氧基)环丁氧基]-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮(2.0mg,7%)。1h nmr(400mhz,氯仿-d)δ10.17(s,1h),8.63-8.55(m,1h),7.91(d,j=8.5hz,1h),7.74-7.64(m,1h),7.57(dd,j=8.0,7.3hz,1h),7.52(dd,j=7.3,1.1hz,1h),
7.31(d,j=7.8hz,1h),7.26-7.15(m,1h),6.66(dd,j=8.0,1.2hz,1h),6.24(d,j=8.5hz,1h),5.94(d,j=8.4hz,1h),5.34(q,j=7.0hz,1h),4.83(p,j=7.2hz,1h),3.79(p,j=7.1hz,1h),3.61(p,j=6.1hz,1h),3.01(d,j=4.4hz,2h),2.85(ddt,j=14.3,11.9,5.8hz,2h),2.17(ddt,j=18.0,12.6,7.4hz,3h),1.92(dt,j=14.7,7.5hz,1h),1.75(d,j=7.5hz,1h),1.60(t,j=6.7hz,10h),1.15(dd,j=6.1,0.9hz,6h)。esi-ms m/z计算值620.2781,实验值621.2(m 1)
;保留时间:1.25分钟(lc方法a)。
[2037]
实施例55:(14s,17r)-12,12-二甲基-2,2,4-三氧代-17-(吡啶-2-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-8-甲腈,化合物193的制备
[2038][2039]
将氮气鼓入(14s)-8-溴-12,12-二甲基-17-(吡啶-2-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5(10),6,8,19(23),20-六烯-2,2,4-三酮(46mg,0.08049mmol)、二氰基锌(19mg,0.1618mmol)和pd(pph3)4(9mg,0.00779mmol)于dmf(0.41ml)中的混合物中,持续1分钟,并且然后在100℃下加热1小时。将混合物用etoac稀释,用水洗涤,干燥(mgso4)并蒸发,得到残余物,将所述残余物通过sfc,经由21.2x250mm od-3柱,5μm粒度,使用5mm nh3/甲醇至co2(在10分钟内50%-80%)梯度洗脱来纯化,得到(14s,17r)-12,12-二甲基-2,2,4-三氧代-17-(吡啶-2-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-8-甲腈(7.9mg,19%)。1h nmr(500mhz,dmso-d6)δ8.68-8.41(m,1h),7.81(d,j=7.6hz,1h),7.73(td,j=7.7,1.8hz,1h),7.60(dd,j=16.9,9.5hz,2h),7.43(d,j=7.9hz,1h),7.23(dd,j=7.5,4.8hz,1h),7.12(d,j=7.6hz,1h),7.07(d,j=7.2hz,1h),6.83(d,j=8.6hz,1h),5.28(t,j=10.4hz,1h),3.35(s,1h),2.83(s,1h),2.23(s,1h),1.98(t,j=12.8hz,1h),1.88(td,j=14.9,9.6hz,2h),1.76-1.67(m,1h),1.59(s,4h),1.47(s,4h)。esi-ms m/z计算值517.18964,实验值518.0(m 1)
;保留时间:1.02分钟(lc方法a)。
[2040]
实施例56:(14s,17r)-8-溴-12,12-二甲基-17-(吡啶-2-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-己烯-2,2,4-三酮,化合物246的各种类似物的制备
[2041]
[2042]
苄基(三氟)硼酸盐(钾盐)是可商购获得的硼试剂。
[2043]
3,3-二甲基丁-1-炔是可商购获得的炔烃试剂:
[2044]
使用上表中给出的硼和炔烃试剂并通过使用(14s,17r)-8-溴-12,12-二甲基-17-(吡啶-2-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮,化合物246作为起始物质,以与上述类似的方式制备下表中的化合物。
[2045][2046]
五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮,化合物247作为起始物质,以与上述类似的方式制备下表中的化合物。
[2052]
[2053]
[2054]
[2055][2056]
实施例58:(14s,17r)-8-溴-12,12-二甲基-17-[6-(三氟甲基)吡啶-2-基]-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮,化合物56,和(14s,17s)-8-溴-12,12-二甲基-17-[6-(三氟甲基)吡啶-2-基]-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮的制备
[2057]
[2058]
步骤1:(4s)-4-[3-(叔丁基亚磺酰基氨基)-3-[6-(三氟甲基)-2-吡啶基]丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯
[2059][2060]
将2-溴-6-(三氟甲基)吡啶(6.6g,28.62mmol)溶解于乙醚(100ml)中。将溶液在干冰丙酮浴中冷却,并且在氮气球下搅拌15分钟。在1分钟内添加n-buli(11.5ml,2.5m于己烷中,28.75mmol)。将浅黄色溶液在低于-70℃下搅拌45分钟。然后添加(4s)-4-[(3e)-3-叔丁基亚磺酰基亚氨基丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(5.4g,14.31mmol)于thf(8ml加上2ml冲洗液)中的溶液。将混合物在相同温度下进一步搅拌45分钟。添加nh4cl(40ml,饱和水溶液),随后添加水(50ml)和etoac(100ml)。使混合物升温至室温,并且与另一批粗物质合并。分离各层,并将有机层用盐水洗涤,经无水mgso4干燥,过滤并浓缩。通过硅胶色谱法(80g柱),使用10%-80%etoac/己烷来纯化残余物,得到呈玻璃态固体状的(4s)-4-[3-(叔丁基亚磺酰基氨基)-3-[6-(三氟甲基)-2-吡啶基]丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(6.96g,91%)。esi-ms m/z计算值505.2586,实验值506.6(m 1)
;保留时间:3.79分钟(lc方法b)。
[2061]
步骤2:(4s)-4-[3-氨基-3-[6-(三氟甲基)-2-吡啶基]丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯
[2062][2063]
将(4s)-4-[3-(叔丁基亚磺酰基氨基)-3-[6-(三氟甲基)-2-吡啶基]丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(7.45g,13.997mmol)溶解于thf(100ml)和水(20ml)的混合物中。添加分子碘(1.05g,4.14mmol)。然后将混合物在50℃油浴中加热并搅拌3小时。将其冷却至室温,用na2s2o3(5g于50ml饱和碳酸氢钠水溶液中)处理,并用etoac(100ml)稀释。分离各层,并将有机层用盐水洗涤,经无水mgso4干燥,过滤并浓缩。通过硅胶色谱法(80g柱),使用0-10%meoh/dcm来纯化残余物,得到呈浅棕色泡沫状的(4s)-4-[3-氨基-3-[6-(三氟甲基)-2-吡啶基]丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(4.6g,78%)。esi-ms m/z计算值401.229,实验值402.6(m 1)
;保留时间:2.86分钟。(lc方法b)。
[2064]
步骤3:(4s)-2,2-二甲基-4-[3-[(6-氨磺酰基-2-吡啶基)氨基]-3-[6-(三氟甲基)-2-吡啶基]丙基]吡咯烷-1-甲酸叔丁酯
[2065][2066]
将(4s)-4-[3-氨基-3-[6-(三氟甲基)-2-吡啶基]丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(4.6g,10.88mmol)溶解于dmso(6ml)中。一次性添加6-氟吡啶-2-磺酰胺(1.92g,10.90mmol),然后添加na2co3(3.5g,33.02mmol)。将混合物置于预热的110℃油浴中,并在氮气球下搅拌20小时。然后将其冷却至室温,用水(30ml)和etoac(50ml)稀释。分离各层,并将有机层用更多水(30ml)、盐水(30ml)洗涤,经无水mgso4干燥,过滤并浓缩。通过硅胶色谱法(120g柱),使用5%-50%etoac/己烷来纯化残余物,得到(4s)-2,2-二甲基-4-[3-[(6-氨磺酰基-2-吡啶基)氨基]-3-[6-(三氟甲基)-2-吡啶基]丙基]吡咯烷-1-甲酸叔丁酯(3.7738g,60%)。1h nmr(500mhz,dmso-d6)δ8.01(t,j=7.8hz,1h),7.87(td,j=9.3,8.4,2.0hz,1h),7.74(d,j=7.6hz,1h),7.64(d,j=8.4hz,1h),7.57
–
7.50(m,1h),7.07(s,2h),6.98(d,j=7.2hz,1h),6.73(d,j=8.2hz,1h),5.26(s,1h),3.52(dt,j=12.0,6.7hz,1h),2.76(dtd,j=25.7,10.6,5.3hz,1h),2.16
–
2.02(m,1h),1.98
–
1.78(m,3h),1.49
–
1.28(m,15h),1.22(s,3h)。esi-ms m/z计算值557.2284,实验值558.4(m 1)
;保留时间:2.84分钟(lc方法h)。
[2067]
步骤4:(4s)-4-[3-[[6-[(6-溴-2-氯-吡啶-3-羰基)氨磺酰基]-2-吡啶基]氨基]-3-[6-(三氟甲基)-2-吡啶基]丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯
[2068][2069]
将6-溴-2-氯-吡啶-3-甲酸(510mg,2.16mmol)和cdi(350mg,2.16mmol)的混合物溶解于thf(3.6ml)中,并且将混合物在60℃下搅拌45分钟,然后添加(4s)-2,2-二甲基-4-[3-[(6-氨磺酰基-2-吡啶基)氨基]-3-[6-(三氟甲基)-2-吡啶基]丙基]吡咯烷-1-甲酸叔丁酯(600mg,1.076mmol),随后添加dbu(726μl,4.85mmol),并且将所得混合物在室温下搅拌4小时。将混合物用etoac稀释,并用1n hcl水溶液、水、盐水洗涤,干燥(mgso4),并浓缩。将残余物纯化(快速色谱法:40g sio2,10%-35%etoac/己烷),得到所需产物:(4s)-4-[3-[[6-[(6-溴-2-氯-吡啶-3-羰基)氨磺酰基]-2-吡啶基]氨基]-3-[6-(三氟甲基)-2-吡啶基]丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(590mg,71%)。1h nmr(400mhz,氯仿-d)δ7.89(dq,j=13.7,7.5,6.8hz,1h),7.72(dd,j=13.6,8.0hz,1h),7.63(d,j=7.8hz,1h),7.60-7.51(m,2h),7.45(ddd,j=17.1,10.3,6.5hz,2h),6.74-6.65(m,1h),5.82(d,j=
9.4hz,1h),5.35(d,j=7.3hz,1h),5.16(s,1h),4.50(s,1h),4.20-4.08(m,1h),3.11(q,j=10.2hz,1h),2.37(s,0h),2.19(d,j=12.1hz,1h),2.05(s,1h),1.81(td,j=13.0,5.8hz,1h),1.67-1.54(m,11h),1.45(dd,j=14.7,10.4hz,1h),1.39(s,5h),1.35(s,4h),1.34-1.21(m,7h)。esi-ms m/z计算值774.12134,实验值776.9(m 1)
;保留时间:0.8分钟(lc方法d)。
[2070]
步骤5:6-溴-2-氯-n-[[6-[[3-[(3r)-5,5-二甲基吡咯烷-3-基]-1-[6-(三氟甲基)-2-吡啶基]丙基]氨基]-2-吡啶基]磺酰基]吡啶-3-甲酰胺
[2071][2072]
向(4s)-4-[3-[[6-[(6-溴-2-氯-吡啶-3-羰基)氨磺酰基]-2-吡啶基]氨基]-3-[6-(三氟甲基)-2-吡啶基]丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(590mg,0.7602mmol)于dcm(4ml)中的溶液中添加tfa(1.8ml,23.36mmol),并且将混合物在室温下搅拌1小时。将溶液减压浓缩至干燥,然后与thf(2x20ml)共蒸发,并且在高真空下在室温下干燥16小时,得到:6-溴-2-氯-n-[[6-[[3-[(3r)-5,5-二甲基吡咯烷-3-基]-1-[6-(三氟甲基)-2-吡啶基]丙基]氨基]-2-吡啶基]磺酰基]吡啶-3-甲酰胺(三氟乙酸盐)(772mg,100%)。esi-ms m/z计算值674.0689,实验值676.9(m 1)
;保留时间:0.5分钟(lc方法d)。
[2073]
步骤6:(14s,17r)-8-溴-12,12-二甲基-17-[6-(三氟甲基)吡啶-2-基]-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮,化合物56,和(14s,17s)-8-溴-12,12-二甲基-17-[6-(三氟甲基)吡啶-2-基]-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮
[2074][2075]
将6-溴-2-氯-n-[[6-[[3-[(3r)-5,5-二甲基吡咯烷-3-基]-1-[6-(三氟甲基)-2-吡啶基]丙基]氨基]-2-吡啶基]磺酰基]吡啶-3-甲酰胺(三氟乙酸盐)(772mg,0.7583mmol)和碳酸钾(629mg,4.551mmol)于dma(7.7ml)中的混合物在140℃下加热7小时,通过冰浴冷却,用100ml etoac和30ml水稀释,并且然后用15ml的1m hcl稀释,得到ph=2的混合物。将混合物分配并且分离有机层。将水层用100ml etoac萃取。将合并的有机萃取物干燥
(mgso4)并蒸发得到油状物。将残余物溶解于dmso(100mg/ml)中,并用1体积的dma稀释。该溶液用制备型sfc,经由21.2x250mm 2-pic柱,5μm粒度,用5mm nh3/甲醇至co2(在10分钟内40%-70%)梯度洗脱进行纯化,蒸发所收集的级分后得到白色固体:
[2076]
洗脱的第一非对映异构体:(14s,17r)-8-溴-12,12-二甲基-17-[6-(三氟甲基)吡啶-2-基]-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮(101mg,21%)。1h nmr(400mhz,氯仿-d)δ7.80(t,j=7.9hz,1h),7.63(d,j=8.1hz,1h),7.57(t,j=9.0hz,1h),7.52(d,j=7.9hz,0h),7.46(d,j=7.3hz,1h),6.77(d,j=7.9hz,1h),6.71(d,j=8.4hz,1h),5.54-5.41(m,2h),3.33(d,j=9.6hz,1h),2.97(d,j=10.6hz,1h),2.54(s,2h),1.96(p,j=6.0hz,3h),1.68(s,2h),1.63(s,3h),1.58(s,2h),1.55(s,3h)。esi-ms m/z计算值638.0923,实验值639.2(m 1)
;保留时间:1.79分钟(lc方法a)。
[2077]
洗脱的第二非对映异构体:(14s,17s)-8-溴-12,12-二甲基-17-[6-(三氟甲基)吡啶-2-基]-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮(77mg,16%)。1h nmr(400mhz,氯仿-d)δ7.90(t,j=7.8hz,1h),7.85(d,j=8.1hz,1h),7.67-7.58(m,3h),7.54(d,j=8.0hz,1h),6.99(d,j=7.9hz,1h),6.79(d,j=7.4hz,1h),6.47(s,1h),5.01(s,1h),3.55(t,j=8.6hz,1h),3.23(s,1h),2.34(d,j=12.9hz,1h),2.02-1.80(m,5h),1.72(t,j=11.5hz,1h),1.60(s,3h),1.53(s,3h)。esi-ms m/z计算值638.0923,实验值639.3(m 1)
;保留时间:1.86分钟(lc方法a)。
[2078]
实施例59:(14s,17r)-8-溴-17-(4-叔丁基吡啶-2-基)-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮,化合物55,和(14s,17s)-8-溴-17-(4-叔丁基吡啶-2-基)-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮的制备
[2079][2080]
步骤1:(4s)-4-[3-[[6-[(6-溴-2-氯-吡啶-3-羰基)氨磺酰基]-2-吡啶基]氨基]-3-(4-叔丁基-2-吡啶基)丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯
[2081][2082]
将6-溴-2-氯-吡啶-3-甲酸(510mg,2.157mmol)和cdi(350mg,2.159mmol)的混合物溶解于thf(3.6ml)中,并在60℃下搅拌45分钟,然后添加(4s)-4-[3-(4-叔丁基-2-吡啶基)-3-[(6-氨磺酰基-2-吡啶基)氨基]丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(587mg,1.076mmol),随后添加dbu(725μl,4.848mmol),并且将所得混合物在室温下搅拌2小时。将混合物用etoac稀释,并用1n hcl水溶液、水、盐水洗涤,干燥(mgso4),并浓缩。将残余物纯化(快速色谱法:40g sio2,10%-80%etoac/己烷,20分钟),得到所需产物:(4s)-4-[3-[[6-[(6-溴-2-氯-吡啶-3-羰基)氨磺酰基]-2-吡啶基]氨基]-3-(4-叔丁基-2-吡啶基)丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(707mg,86%)。1h nmr(400mhz,氯仿-d)δ8.54(d,j=5.4hz,1h),7.78(d,j=8.5hz,1h),7.58-7.46(m,2h),7.43(d,j=7.8hz,1h),7.34(s,1h),7.29(s,1h),6.62(s,1h),5.94-5.81(m,1h),5.12(d,j=68.4hz,1h),4.24-4.09(m,1h),3.05(d,j=11.5hz,0h),2.85(t,j=10.8hz,1h),2.41(s,1h),2.17(s,1h),1.95-1.68(m,2h),1.41(d,j=4.2hz,9h),1.35(s,5h),1.33(s,4h),1.32-1.24(m,4h)。esi-ms m/z计算值762.1966,实验值764.9(m 1)
;保留时间:0.64分钟(lc方法d)。
[2083]
步骤2:6-溴-n-[[6-[[1-(4-叔丁基-2-吡啶基)-3-[(3r)-5,5-二甲基吡咯烷-3-基]丙基]氨基]-2-吡啶基]磺酰基]-2-氯-吡啶-3-甲酰胺
[2084][2085]
向(4s)-4-[3-[[6-[(6-溴-2-氯-吡啶-3-羰基)氨磺酰基]-2-吡啶基]氨基]-3-(4-叔丁基-2-吡啶基)丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(707mg,0.925mmol)于dcm(5ml)中的溶液中添加tfa(2.2ml,28.56mmol),并将混合物在室温下搅拌45分钟。将该溶液减压浓缩至干,然后与thf(2x20ml)共蒸发,然后在高真空下在室温下干燥16小时,得到:6-溴-n-[[6-[[1-(4-叔丁基-2-吡啶基)-3-[(3r)-5,5-二甲基吡咯烷-3-基]丙基]氨基]-2-吡啶基]磺酰基]-2-氯-吡啶-3-甲酰胺(三氟乙酸盐)(984mg,106%)。esi-ms m/z计算值662.14417,实验值665.0(m 1)
;保留时间:0.39分钟(lc方法d)。
[2086]
步骤3:(14s,17r)-8-溴-17-(4-叔丁基吡啶-2-基)-12,12-二甲基-2λ
6-硫杂-3,
9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮,化合物55,和(14s,17s)-8-溴-17-(4-叔丁基吡啶-2-基)-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮
[2087][2088]
将6-溴-n-[[6-[[1-(4-叔丁基-2-吡啶基)-3-[(3r)-5,5-二甲基吡咯烷-3-基]丙基]氨基]-2-吡啶基]磺酰基]-2-氯-吡啶-3-甲酰胺(三氟乙酸盐)(984mg,0.978mmol)和碳酸钾(811mg,5.868mmol)于dma(10ml)中的混合物在140℃下加热7小时,通过冰浴冷却,用100ml etoac和30ml水稀释,并且然后用15ml的1m hcl(k2co3的量的2.5倍)稀释,得到ph为2的混合物。将混合物分配并且分离有机层。将水层用100ml etoac萃取。将合并的有机萃取物干燥(mgso4)并蒸发得到油状物。将残余物溶解于dmso(100mg/ml)中,并用1体积的dma稀释。该溶液用制备型sfc,经由21.2x250mm 2-pic柱,5μm粒度,用5mm nh3/甲醇至co2(在10分钟内40%-70%)梯度洗脱进行纯化,蒸发所收集的级分后得到白色固体:
[2089]
首先洗脱:(14s,17r)-8-溴-17-(4-叔丁基吡啶-2-基)-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮(139mg,23%)。1h nmr(400mhz,氯仿-d)δ8.35(d,j=5.3hz,1h),7.62(d,j=7.9hz,1h),7.54(t,j=7.8hz,1h),7.43(d,j=7.3hz,1h),7.16(d,j=5.3hz,1h),6.76(d,j=7.9hz,1h),6.64(d,j=8.4hz,1h),5.56(s,1h),5.35(q,j=7.9hz,1h),3.47(s,1h),2.56(s,1h),1.98(dd,j=12.1,6.8hz,1h),1.90(s,2h),1.62(s,3h),1.60(s,2h),1.56(s,3h),1.48(d,j=28.3hz,3h),1.29(s,9h)。esi-ms m/z计算值626.1675,实验值625.3(m 1)
;保留时间:1.28分钟(lc方法a)。
[2090]
第二洗脱:(14s,17s)-8-溴-17-(4-叔丁基吡啶-2-基)-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮(145mg,24%)。1h nmr(400mhz,氯仿-d)δ8.48(d,j=5.2hz,1h),7.84(s,1h),7.62-7.54(m,2h),7.24(d,j=5.7hz,1h),6.99(s,1h),6.71(s,1h),6.50(s,1h),4.83(s,1h),3.59(s,1h),3.26(s,1h),2.33(s,1h),1.99(s,2h),1.85(s,2h),1.71(t,j=11.6hz,1h),1.59(s,3h),1.52(s,3h),1.46(d,j=27.1hz,1h),1.34(s,9h),1.32-1.29(m,1h)。esi-ms m/z计算值626.1675,实验值627.3(m 1)
;保留时间:1.35分钟(lc方法a)。
[2091]
实施例60:4-[(14s)-8-叔丁基-12,12-二甲基-2,2,4-三氧代-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-17-基]哌啶-1-甲酸苄酯,化合物255(非对映异构体1)和化合物254(非对映异构体2)的制备
[2092]
[2093][2094]
步骤1:(4s)-2,2-二甲基-4-[3-(4-吡啶基)-3-[(2,2,2-三氟乙酰基)氨基]丙基]吡咯烷-1-甲酸叔丁酯
[2095][2096]
将(4s)-4-[3-氨基-3-(4-吡啶基)丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(1g,2.6989mmol)溶解于dcm(20ml)中,并在冰水浴中冷却。添加tea(0.5ml,3.5873mmol),随后添加(2,2,2-三氟乙酰基)2,2,2-三氟乙酸酯(0.45ml,3.1288mmol)。将混合物在冷却浴中
在氮气下搅拌1小时。添加碳酸氢钠(饱和水溶液20ml)。分离各层,并将水层用盐水洗涤,经无水na2so4干燥,过滤并浓缩,得到呈无色油状物的的(4s)-2,2-二甲基-4-[3-(4-吡啶基)-3-[(2,2,2-三氟乙酰基)氨基]丙基]吡咯烷-1-甲酸叔丁酯(910mg,75%)。esi-ms m/z计算值429.2239,实验值430.6(m 1)
;保留时间:2.83分钟(lc方法b)。
[2097]
步骤2:(4s)-4-[3-(1-苄基吡啶-1-鎓-4-基)-3-[(2,2,2-三氟乙酰基)氨基]丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯;溴化物
[2098][2099]
将(4s)-2,2-二甲基-4-[3-(4-吡啶基)-3-[(2,2,2-三氟乙酰基)氨基]丙基]吡咯烷-1-甲酸叔丁酯(910mg,2.0129mmol)溶解于ch3cn(5ml)中。添加溴甲基苯(0.24ml,1.9802mmol)。将混合物在50℃下加热12小时。然后将其浓缩,得到呈浅黄色泡沫状的(4s)-4-[3-(1-苄基吡啶-1-鎓-4-基)-3-[(2,2,2-三氟乙酰基)氨基]丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯;溴化物(1.2g,94%)。esi-ms m/z计算值599.197,实验值520.7(m 1)
;保留时间:3.47分钟(lc方法b)。
[2100]
步骤3:(4s)-4-[3-(1-苄基-3,6-二氢-2h-吡啶-4-基)-3-[(2,2,2-三氟乙酰基)氨基]丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯
[2101][2102]
将(4s)-4-[3-(1-苄基吡啶-1-鎓-4-基)-3-[(2,2,2-三氟乙酰基)氨基]丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯;溴化物(1.2g,1.8984mmol)溶解于meoh(10ml)中。将混合物在冰水浴中冷却。以三部分添加nabh4(152mg,3.9374mmol)。将混合物在室温下搅拌1小时。添加nh4cl(饱和水溶液1.0ml),并浓缩混合物以移除挥发物。然后将残余物在水和dcm(各20ml)之间分配。分离各层,并用更多dcm(10ml)萃取水层。合并的dcm层经无水na2so4干燥,过滤并浓缩,得到(4s)-4-[3-(1-苄基-3,6-二氢-2h-吡啶-4-基)-3-[(2,2,2-三氟乙酰基)氨基]丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(1.1g,105%)。esi-ms m/z计算值
523.3022,实验值524.6(m 1)
;保留时间:3.42分钟(lc方法b)。
[2103]
步骤4:4-[3-[(3s)-1-叔丁氧基羰基-5,5-二甲基-吡咯烷-3-基]-1-[(2,2,2-三氟乙酰基)氨基]丙基]-3,6-二氢-2h-吡啶-1-甲酸苄酯
[2104][2105]
在室温下,将(4s)-4-[3-(1-苄基-3,6-二氢-2h-吡啶-4-基)-3-[(2,2,2-三氟乙酰基)氨基]丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(1.1g,1.9957mmol)溶解于dcm(30ml)中。添加碳酸氢钾(900mg,8.9897mmol),随后添加氯甲酸苄酯(737.91mg,0.65ml,4.1093mmol)。将混合物在40℃油浴中搅拌1小时。添加水(20ml)并且分离各层。dcm层经无水na2so4干燥,过滤并浓缩。通过硅胶色谱法(40g柱),使用0-30%etoac/己烷来纯化残余物,得到呈浅黄色油状物的4-[3-[(3s)-1-叔丁氧基羰基-5,5-二甲基-吡咯烷-3-基]-1-[(2,2,2-三氟乙酰基)氨基]丙基]-3,6-二氢-2h-吡啶-1-甲酸苄酯(1.01g,85%)。esi-ms m/z计算值567.292,实验值568.7(m 1)
;保留时间:4.33分钟(lc方法b)。
[2106]
步骤5:(4s)-2,2-二甲基-4-[3-(4-哌啶基)-3-[(2,2,2-三氟乙酰基)氨基]丙基]吡咯烷-1-甲酸叔丁酯
[2107][2108]
将4-[3-[(3s)-1-叔丁氧基羰基-5,5-二甲基-吡咯烷-3-基]-1-[(2,2,2-三氟乙酰基)氨基]丙基]-3,6-二氢-2h-吡啶-1-甲酸苄酯(500mg,0.8368mmol)溶解于meoh(20ml)和etoac(5ml)的溶剂混合物中。将混合物用氮气吹扫。一次性添加钯/碳(10%w:w,100mg,0.0940mmol)。将混合物在60psi氢气下置于parr振荡器下2小时。然后将其用氮气吹扫,并且通过硅藻土垫过滤,用meoh(约20ml)洗涤。将合并的滤液浓缩,得到(4s)-2,2-二甲基-4-[3-(4-哌啶基)-3-[(2,2,2-三氟乙酰基)氨基]丙基]吡咯烷-1-甲酸叔丁酯(370mg,96%)
esi-ms m/z计算值435.2709,实验值436.7(m 1)
;保留时间:3.04分钟(lc方法b)。
[2109]
步骤6:4-[3-[(3s)-1-叔丁氧基羰基-5,5-二甲基-吡咯烷-3-基]-1-[(2,2,2-三氟乙酰基)氨基]丙基]哌啶-1-甲酸苄酯
[2110][2111]
将(4s)-2,2-二甲基-4-[3-(4-哌啶基)-3-[(2,2,2-三氟乙酰基)氨基]丙基]吡咯烷-1-甲酸叔丁酯(370mg,0.8071mmol)溶解于dcm(10ml)中。添加tea(0.15ml,1.0762mmol)。将混合物在冰水浴中冷却。然后逐滴添加氯甲酸苄酯(0.15ml,0.9483mmol)。将混合物在此温度下搅拌30分钟。添加饱和碳酸氢钠水溶液(20ml)。分离各层,并用更多dcm(15ml)萃取水层。合并的有机物经无水na2so4干燥,过滤并浓缩,得到4-[3-[(3s)-1-叔丁氧基羰基-5,5-二甲基-吡咯烷-3-基]-1-[(2,2,2-三氟乙酰基)氨基]丙基]哌啶-1-甲酸苄酯(415mg,86%)。esi-ms m/z计算值569.3077,实验值570.6(m 1)
;保留时间:4.37分钟(lc方法b)。
[2112]
步骤7:4-[1-氨基-3-[(3s)-1-叔丁氧基羰基-5,5-二甲基-吡咯烷-3-基]丙基]哌啶-1-甲酸苄酯
[2113][2114]
将4-[3-[(3s)-1-叔丁氧基羰基-5,5-二甲基-吡咯烷-3-基]-1-[(2,2,2-三氟乙酰基)氨基]丙基]哌啶-1-甲酸苄酯(1g,1.6677mmol)溶解于thf(10ml)中。添加含lioh(400mg,16.369mmol)的水(5ml),随后添加meoh(5ml)。将混合物在50℃油浴中加热15小时。将其冷却至室温并浓缩以移除大多数挥发物。将残余物在盐水和dcm(各30ml)之间分配。dcm层经无水na2so4干燥,过滤并浓缩,得到呈白色泡沫状的4-[1-氨基-3-[(3s)-1-叔丁氧基羰基-5,5-二甲基-吡咯烷-3-基]丙基]哌啶-1-甲酸苄酯(800mg,96%)。esi-ms m/z计算
值473.3254,实验值474.6(m 1)
;保留时间:3.31分钟(lc方法b)。
[2115]
步骤8:4-[3-[(3s)-1-叔丁氧基羰基-5,5-二甲基-吡咯烷-3-基]-1-[(6-氨磺酰基-2-吡啶基)氨基]丙基]哌啶-1-甲酸苄酯
[2116][2117]
将4-[1-氨基-3-[(3s)-1-叔丁氧基羰基-5,5-二甲基-吡咯烷-3-基]丙基]哌啶-1-甲酸苄酯(800mg,1.6046mmol)溶解于dmso(1.5ml)中。添加6-氟吡啶-2-磺酰胺(338mg,1.9294mmol),然后添加na2co3(512mg,4.8307mmol)。将混合物在110℃油浴中在氮气球下加热22小时。然后将其冷却至室温,并在etoac(30ml)和水(30ml)之间分配。分离各层,并用更多水(20ml)萃取水层。有机层经无水na2so4干燥,过滤并浓缩。通过硅胶色谱法(40g柱),使用0-35%etoac/己烷来纯化残余物,得到呈浅黄色泡沫状的4-[3-[(3s)-1-叔丁氧基羰基-5,5-二甲基-吡咯烷-3-基]-1-[(6-氨磺酰基-2-吡啶基)氨基]丙基]哌啶-1-甲酸苄酯(506mg,46%)。1h nmr(500mhz,dmso-d6)δ7.48(d,j=7.8hz,1h),7.41
–
7.26(m,5h),7.04(s,2h),6.91(d,j=7.2hz,1h),6.78(d,j=8.9hz,1h),6.63(d,j=8.5hz,1h),5.05(s,2h),4.10
–
3.96(m,2h),3.60
–
3.44(m,1h),2.84
–
2.62(m,3h),2.07(d,j=10.6hz,1h),1.86(td,j=12.8,12.3,6.2hz,1h),1.67(q,j=18.0,16.4hz,3h),1.52(s,1h),1.44
–
1.27(m,15h),1.22(d,j=3.2hz,3h),1.18(q,j=6.7,6.3hz,1h),1.15
–
1.04(m,1h)。esi-ms m/z计算值629.3247,实验值630.8(m 1)
;保留时间:2.98分钟(lc方法h)。
[2118]
步骤9:4-[3-[(3s)-1-叔丁氧基羰基-5,5-二甲基-吡咯烷-3-基]-1-[[6-[(6-叔丁基-2-氟-吡啶-3-羰基)氨磺酰基]-2-吡啶基]氨基]丙基]哌啶-1-甲酸苄酯
[2119][2120]
向6-叔丁基-2-氟-吡啶-3-甲酸(127mg,0.6440mmol)于thf(4.5ml)中的溶液中添加cdi(110mg,0.6784mmol),并且将混合物在室温下搅拌20小时。然后添加4-[3-[(3s)-1-叔丁氧基羰基-5,5-二甲基-吡咯烷-3-基]-1-[(6-氨磺酰基-2-吡啶基)氨基]丙基]哌啶-1-甲酸苄酯(225mg,0.3573mmol),随后添加dbu(225μl,1.505mmol),并将所得混合物在室
温下搅拌18小时。将反应物用乙酸乙酯稀释,并用饱和碳酸氢钠水溶液洗涤。将有机层进一步用10%柠檬酸溶液洗涤,随后用盐水洗涤。将有机物分离,经硫酸钠干燥并蒸发,然后并且通过硅胶色谱法(40克柱),使用100%己烷至100%乙酸乙酯的梯度进行纯化,得到白色固体4-[3-[(3s)-1-叔丁氧基羰基-5,5-二甲基-吡咯烷-3-基]-1-[[6-[(6-叔丁基-2-氟-吡啶-3-羰基)氨磺酰基]-2-吡啶基]氨基]丙基]哌啶-1-甲酸苄酯(213mg,63%)。esi-ms m/z计算值808.39935,实验值809.2(m 1)
;保留时间:2.44分钟(lc方法a)。
[2121]
步骤10:4-[1-[[6-[(6-叔丁基-2-氟-吡啶-3-羰基)氨磺酰基]-2-吡啶基]氨基]-3-[(3s)-5,5-二甲基吡咯烷-3-基]丙基]哌啶-1-甲酸苄酯
[2122][2123]
将4-[3-[(3s)-1-叔丁氧基羰基-5,5-二甲基-吡咯烷-3-基]-1-[[6-[(6-叔丁基-2-氟-吡啶-3-羰基)氨磺酰基]-2-吡啶基]氨基]丙基]哌啶-1-甲酸苄酯(213mg,0.2633mmol)溶解于dcm(5.0ml)中,并向混合物中添加tfa(550μl,7.139mmol),并且将反应物在室温下搅拌。在14小时后,将混合物蒸发至干燥,然后用乙醚(30ml x 2)稀释,并再浓缩。然后将材料放置在高真空泵上2小时,得到呈浅黄色油状物的4-[1-[[6-[(6-叔丁基-2-氟-吡啶-3-羰基)氨磺酰基]-2-吡啶基]氨基]-3-[(3s)-5,5-二甲基吡咯烷-3-基]丙基]哌啶-1-甲酸苄酯(三氟乙酸盐)(270mg,100%)。esi-ms m/z计算值708.3469,实验值709.2(m 1)
;保留时间:1.64分钟(lc方法a)。
[2124]
步骤11:4-[(14s)-8-叔丁基-12,12-二甲基-2,2,4-三氧代-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-17-基]哌啶-1-甲酸苄酯
[2125][2126]
向4-[1-[[6-[(6-叔丁基-2-氟-吡啶-3-羰基)氨磺酰基]-2-吡啶基]氨基]-3-[(3s)-5,5-二甲基吡咯烷-3-基]丙基]哌啶-1-甲酸苄酯(三氟乙酸盐)(216mg,0.2100mmol)于nmp(5ml)中的溶液中添加碳酸钾(304mg,2.200mmol)。将混合物用氮气吹扫5分钟。将混合物在140℃下加热16小时。将混合物冷却至室温,用1n hcl稀释并用etoac(1x)萃取。将有机相用盐水(1x)洗涤,干燥(硫酸钠),过滤并浓缩,得到棕色油状物,将所述棕色油状物过滤并使用反相hplc-ms方法,使用在15.0分钟内运行50%-99%流动相b的双
梯度(流动相a=h2o(5mm hcl,流动相b=乙腈)进行纯化,得到呈灰白色固体状的4-[(14s)-8-叔丁基-12,12-二甲基-2,2,4-三氧代-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-17-基]哌啶-1-甲酸苄酯(84mg,58%)。esi-ms m/z计算值688.3407,实验值689.2(m 1)
;保留时间:0.77分钟(lc方法i)。
[2127]
步骤12:4-[(14s)-8-叔丁基-12,12-二甲基-2,2,4-三氧代-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-17-基]哌啶-1-甲酸苄酯,化合物255(非对映异构体1),和4-[(14s)-8-叔丁基-12,12-二甲基-2,2,4-三氧代-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-17-基]哌啶-1-甲酸苄酯,化合物254(非对映异构体2)
[2128][2129]
使用在30.0分钟内50%-99%流动相b运行的双梯度(流动相a=h2o(5mm hcl),流动相b=ch3cn)对4-[(14s)-8-叔丁基-12,12-二甲基-2,2,4-三氧代-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-17-基]哌啶-1-甲酸苄酯(非对映异构体混合物,20mg,0.02903mmol)进行反相制备型hplc-ms,得到两种分离的异构体:
[2130]
洗脱的第一异构体,非对映异构体1:4-[(14s)-8-叔丁基-12,12-二甲基-2,2,4-三氧代-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-17-基]哌啶-1-甲酸苄酯(7.7mg,75%)。1h nmr(499mhz,氯仿-d)δ9.47(s,1h),7.83(s,1h),7.55(t,j=7.8hz,1h),7.46(d,j=7.2hz,1h),7.39-7.28(m,6h),6.75(s,1h),6.55(d,j=8.3hz,1h),5.08(s,2h),4.23(d,j=43.7hz,4h),3.15(s,1h),2.88(s,1h),2.72(s,2h),2.49(s,1h),1.97(d,j=10.9hz,1h),1.70(d,j=11.4hz,2h),1.66-1.62(m,5h),1.58(s,6h),1.44(d,j=6.3hz,2h),1.31(s,9h)。esi-ms m/z计算值688.3407,实验值689.3(m 1)
;保留时间:1.95分钟(lc方法g)。
[2131]
洗脱的第二异构体,非对映异构体2:4-[(14s)-8-叔丁基-12,12-二甲基-2,2,4-三氧代-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-17-基]哌啶-1-甲酸苄酯(8.2mg,82%)。1h nmr(499mhz,氯仿-d)δ12.12(s,1h),8.13(d,j=8.2hz,1h),7.65(d,j=7.3hz,1h),7.59(d,j=7.8hz,1h),7.37(d,j=4.4hz,4h),7.35-7.30(m,2h),7.04(d,j=8.1hz,1h),6.60(d,j=8.3hz,1h),5.14(s,2h),4.67(s,1h),4.29(s,2h),3.40(s,1h),3.30(dd,j=10.1,4.4hz,1h),3.16(t,j=9.6hz,1h),2.78(s,2h),2.39(s,1h),2.28(s,1h),2.02(dd,j=12.0,7.7hz,1h),1.80(s,2h),1.75-1.64(m,4h),1.61(s,3h),1.56(s,2h),1.52(s,3h),1.44-1.35(m,2h),1.32(s,9h)。esi-ms m/z计算值688.3407,实验值689.3(m 1)
;保留时间:1.95分钟(lc方法g)。
[2132]
实施例61:(14s)-8-叔丁基-12,12-二甲基-17-(1-甲基哌啶-4-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮,化合物241(非对映异构体1),和(14s)-8-叔丁基-12,12-二甲基-17-(1-甲基哌啶-4-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮,化合物240(非对映异构体2)的制备
[2133][2134]
向4-[(14s)-8-叔丁基-12,12-二甲基-2,2,4-三氧代-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-17-基]哌啶-1-甲酸苄酯(58.3mg,0.08463mmol)于甲醇(2ml)中的溶液中添加甲醛(21.63μl,37%w/v,0.2665mmol),随后添加钯/碳(10%w/w,9mg,0.008463mmol),并且将混合物搅拌,同时使氮气鼓泡穿过混合物持续2分钟。然后使氢气鼓泡穿过该溶液持续2分钟,然后将混合物在1atm氢气下搅拌16小时。添加10%钯/碳(9mg,0.008463mmol),并在1atm氢气下继续搅拌4小时,然后经硅藻土过滤,浓缩并使用反相hplc-ms方法使用由phenomenex销售的luna c
18
柱(75
×
30mm,5μm粒度)(pn:00c-4252-u0-ax),以及在15.0分钟内从1%-99%流动相b运行的双梯度(流动相a=h2o(5mm hcl),流动相b=乙腈,流速=50ml/min,进样体积=950μl并且柱温=25℃)进行纯化,得到呈白色固体状的两种异构体:
[2135]
首先洗脱的非对映异构体1:(14s)-8-叔丁基-12,12-二甲基-17-(1-甲基哌啶-4-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮(盐酸盐)(13.5mg,50%)。esi-ms m/z计算值568.3196,实验值569.3(m 1)
;保留时间:1.71分钟(lc方法q)。
[2136]
第二洗脱的非对映异构体2:(14s)-8-叔丁基-12,12-二甲基-17-(1-甲基哌啶-4-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮(盐酸盐)(10.8mg,40%);esi-ms m/z计算值568.3196,实验值569.2(m 1)
;保留时间:1.84分钟(lc方法q)。
[2137]
实施例62:(14s)-8-叔丁基-12,12-二甲基-17-(哌啶-4-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮,化合物249(非对映异构体1)和化合物248(非对映异构体2)的制备
[2138][2139]
步骤1:4-[1-氨基-3-[(3s)-1-叔丁氧基羰基-5,5-二甲基-吡咯烷-3-基]丙基]-3,6-二氢-2h-吡啶-1-甲酸苄酯
[2140][2141]
在室温下,将4-[3-[(3s)-1-叔丁氧基羰基-5,5-二甲基-吡咯烷-3-基]-1-[(2,2,2-三氟乙酰基)氨基]丙基]-3,6-二氢-2h-吡啶-1-甲酸苄酯(520mg,0.8703mmol)混合于thf(5ml)和meoh(3ml)中。添加含lioh(209mg,8.5526mmol)的水(3ml)。将混合物在50℃油浴中加热3小时。然后将其冷却至室温并浓缩。将残余物在水和dcm(各20ml)之间分配。dcm层经无水na2so4干燥,过滤并在高真空下干燥过夜,得到呈黄色泡沫状的粗制4-[1-氨基-3-[(3s)-1-叔丁氧基羰基-5,5-二甲基-吡咯烷-3-基]丙基]-3,6-二氢-2h-吡啶-1-甲酸苄酯(400mg,93%)。esi-ms m/z计算值471.3097,实验值472.7(m 1)
;保留时间:3.06分钟(lc
二氢-2h-吡啶-1-甲酸苄酯(218mg,0.3472mmol),随后添加dbu(250μl,1.672mmol),并将所得混合物在室温下搅拌18小时。将反应物用乙酸乙酯稀释,并用饱和碳酸氢钠水溶液洗涤。将有机层进一步用10%柠檬酸溶液洗涤,随后用盐水洗涤。将有机物分离,经硫酸钠干燥并蒸发。然后通过反相制备型色谱法,使用c
18
柱和在15分钟内30%-99%乙腈/水( 5毫摩尔hcl)的梯度来纯化粗物质,得到呈白色固体状的非对映异构体对4-[3-[(3s)-1-叔丁氧基羰基-5,5-二甲基-吡咯烷-3-基]-1-[[6-[(6-叔丁基-2-氟-吡啶-3-羰基)氨磺酰基]-2-吡啶基]氨基]丙基]-3,6-二氢-2h-吡啶-1-甲酸苄酯(180mg,64%)。esi-ms m/z计算值806.38367,实验值807.2(m 1)
;保留时间:2.4分钟(lc方法a)。
[2148]
步骤4:4-[(14s)-8-叔丁基-12,12-二甲基-2,2,4-三氧代-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-17-基]-1,2,3,6-四氢吡啶-1-甲酸苄酯
[2149][2150]
阶段1:将4-[3-[(3s)-1-叔丁氧基羰基-5,5-二甲基-吡咯烷-3-基]-1-[[6-[(6-叔丁基-2-氟-吡啶-3-羰基)氨磺酰基]-2-吡啶基]氨基]丙基]-3,6-二氢-2h-吡啶-1-甲酸苄酯(180mg,0.2231mmol)溶解于dcm(5.5ml)中,并向混合物中添加tfa(500μl,6.490mmol)。将反应物在室温下搅拌。在1小时后,将混合物蒸发至干燥,然后用乙醚(30ml x 2)稀释,并再浓缩。然后将材料放置在高真空泵上2小时,得到呈灰白色固体状的4-[1-[[6-[(6-叔丁基-2-氟-吡啶-3-羰基)氨磺酰基]-2-吡啶基]氨基]-3-[(3s)-5,5-二甲基吡咯烷-3-基]丙基]-3,6-二氢-2h-吡啶-1-甲酸苄酯(三氟乙酸盐)。
[2151]
阶段2:将来自阶段1的中间体与k2co3(350mg,2.532mmol)、分子筛和nmp(7.5ml)合并于小瓶中,用氮气吹扫,封盖,加热至155℃并搅拌18小时。将反应物冷却至室温,并用乙酸乙酯和水稀释。将有机层萃取(2x)并用10%柠檬酸溶液进一步洗涤,随后用盐水洗涤。将有机物分离,经硫酸钠干燥,蒸发至浅棕色油状物。残余物单独地通过反相制备型色谱法,使用c
18
柱和在15分钟内30%-99%乙腈/水( 5毫摩尔hcl)的梯度纯化,得到呈白色固体状的产物:4-[(14s)-8-叔丁基-12,12-二甲基-2,2,4-三氧代-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-17-基]-1,2,3,6-四氢吡啶-1-甲酸苄酯(137mg,89%)。esi-ms m/z计算值686.325,实验值687.3(m 1)
;保留时间:2.3分钟(lc方法a)。
[2152]
步骤5:(14s)-8-叔丁基-12,12-二甲基-17-(哌啶-4-基)-4λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮,化合物249(非对映异构体1),和(14s)-8-叔丁基-12,12-二甲基-17-(哌啶-2-基)-2
λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮,化合物248(非对映异构体2)
[2153][2154]
在氮气吹扫过的250ml圆底烧瓶中,将4-[(14s)-8-叔丁基-12,12-二甲基-2,2,4-三氧代-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-17-基]-1,2,3,6-四氢吡啶-1-甲酸苄酯(137mg,0.1995mmol)溶解于meoh(7ml)中。向氮气吹扫的反应溶液中添加钯/碳(10%w:w,16mg,0.015mmol)并且连接含有氢气的气球。在室温下于氢气球下搅拌14小时之前,使氢气吹扫穿过该溶液1分钟。粗物质通过硅藻土过滤,并在氮气流下浓缩,得到粘性残余物。将该混合物用dmso稀释,并且然后通过反相制备型色谱法,利用c
18
柱和在30分钟1%-70%乙腈/水( 5mm hcl)的梯度纯化,得到呈白色固体状的单独异构体:
[2155]
非对映异构体1:(14s)-8-叔丁基-12,12-二甲基-17-(哌啶-4-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮(盐酸盐)(34mg,58%)。esi-ms m/z计算值554.3039,实验值555.2(m 1)
;保留时间:1.45分钟(lc方法a)。
[2156]
非对映异构体2:(14s)-8-叔丁基-12,12-二甲基-17-(哌啶-4-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮(盐酸盐)(29mg,49%)。esi-ms m/z计算值554.3039,实验值555.2(m 1)
;保留时间:1.61分钟(lc方法a)。
[2157]
实施例63:(14s)-8-叔丁基-17-{1-[2-(二甲基氨基)乙酰基]哌啶-4-基}-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮,化合物236的制备
[2158][2159]
向(14s)-8-叔丁基-12,12-二甲基-17-(哌啶-4-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮(盐酸盐)(化合物248(非对映异构体2),15mg,0.02537mmol)于dmf(650μl)中的溶液中添加k2co3(15mg,0.1085mmol),随后添加2-(二甲基氨基)乙酰氯(5.0mg,0.04113mmol)。将反应物搅拌20小时,然后将混合物用0.1ml浓hcl淬灭,用dmf稀释,过滤并通过反相制备型色谱法,使用c
18
柱和在15分钟内15%-75%乙腈/水( 5mm hcl)的梯度纯化,得到(14s)-8-叔丁基-17-{1-[2-(二甲基氨基)乙酰基]哌啶-4-基}-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮(盐酸盐)(11.7mg,68%)。1h nmr(500mhz,dmso-d6)δ12.42(d,j=13.1hz,1h),9.70(d,j=15.9hz,1h),7.62(dd,j=7.9,2.1hz,1h),7.56(dd,j=8.5,7.1hz,1h),7.10(d,j=8.8hz,1h),7.03(dd,j=7.1,1.3hz,1h),6.77(dd,j=8.4,2.0hz,1h),6.64(d,j=7.9hz,1h),4.43-4.18(m,3h),3.59(dd,j=39.2,13.3hz,1h),3.11-3.02(m,1h),2.94(dt,j=24.5,12.4hz,1h),2.78(td,j=5.3,2.6hz,6h),2.67-2.53(m,2h),2.07(d,j=8.4hz,1h),1.87-1.76(m,2h),1.65(s,2h),1.63(s,1h),1.61(s,3h),1.54(d,j=10.5hz,2h),1.51(s,1h),1.48(s,3h),1.36-1.29(m,1h),1.27(s,9h),1.20(d,j=18.6hz,1h),1.12(dd,j=33.7,9.2hz,1h)。esi-ms m/z计算值639.3567,实验值640.2(m 1)
;保留时间:1.69分钟,呈白色固体状(lc方法a)。
[2160]
实施例64:(14s)-17-(1-乙酰基哌啶-4-基)-8-叔丁基-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮,化合物228的制备
[2161][2162]
向(14s)-8-叔丁基-12,12-二甲基-17-(哌啶-4-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮(盐酸盐)(化合物248(非对映异构体2),19.7mg,0.03332mmol)于dmf(1000μl)中的溶液中添加k2co3(20mg,0.1447mmol),随后添加含乙酰氯(2.5μl,0.03516mmol)的25μl dmf。将反
应物搅拌20小时。然后将混合物用0.1ml浓hcl淬灭,用dmf稀释,过滤并且通过反相制备型色谱法,利用c
18
柱和在15分钟内20%-80%乙腈/水( 5mm hcl)的梯度进行纯化,得到呈白色固体状的(14s)-17-(1-乙酰基哌啶-4-基)-8-叔丁基-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮(12.8mg,64%)。1h nmr(500mhz,dmso-d6)δ12.43(s,1h),7.61(dd,j=8.0,2.9hz,1h),7.56(dd,j=8.5,7.2hz,1h),7.03(d,j=7.9hz,1h),6.97(d,j=9.0hz,1h),6.73(d,j=8.5hz,1h),6.64(d,j=8.0hz,1h),4.45-4.31(m,2h),3.97(s,1h),3.79(dd,j=23.4,13.6hz,1h),3.10-2.98(m,1h),2.90(dd,j=21.9,11.8hz,1h),2.64(t,j=10.5hz,1h),2.41(dt,j=33.2,12.4hz,1h),2.07(d,j=12.7hz,1h),1.93(d,j=5.2hz,3h),1.84-1.73(m,2h),1.64(s,1h),1.62(s,3h),1.59-1.54(m,2h),1.52(d,j=12.4hz,1h),1.48(s,4h),1.27(s,9h),1.23(d,j=13.7hz,1h),1.17-1.09(m,1h),1.09-0.92(m,1h)。esi-ms m/z计算值596.31445,实验值597.2(m 1)
;保留时间:1.97分钟(lc方法a)。
[2163]
实施例65:(14s)-8-叔丁基-12,12-二甲基-17-[1-(3,3,3-三氟丙基)哌啶-4-基]-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮,化合物238的制备
[2164][2165]
将(14s)-8-叔丁基-12,12-二甲基-17-(哌啶-4-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮(盐酸盐)(化合物248(非对映异构体2),15mg,0.02537mmol)和3,3,3-三氟丙醛(5mg,0.04462mmol)于dce(500μl)中的溶液搅拌五分钟,并添加三乙酰氧基硼氢化钠(25mg,0.1180mmol)。将反应物搅拌20小时,并且将混合物用0.1ml浓hcl淬灭,用dmf稀释,过滤并通过反相制备型色谱法,使用c
18
柱和在15分钟内10%-99%乙腈/水( 5mm hcl)的梯度纯化,得到呈白色固体状的(14s)-8-叔丁基-12,12-二甲基-17-[1-(3,3,3-三氟丙基)哌啶-4-基]-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮(盐酸盐)(8.4mg,48%)。1h nmr(500mhz,dmso-d6)δ12.38(s,1h),10.90(s,1h),7.65-7.54(m,2h),7.13(d,j=8.8hz,1h),7.04(d,j=7.2hz,1h),6.76(d,j=8.4hz,1h),6.64(d,j=8.0hz,1h),4.08(t,j=7.1hz,1h),3.51(dd,j=23.3,11.8hz,2h),3.38-3.10(m,3h),3.07(t,j=8.7hz,1h),2.92(ddt,j=25.6,21.2,10.1hz,4h),2.62(t,j=10.4hz,1h),2.07(s,1h),1.89(d,j=10.9hz,1h),1.80(dd,j=11.8,5.3hz,1h),1.74(s,1h),1.66(d,j=4.3hz,1h),1.61(s,3h),1.58(d,j=12.9hz,2h),1.52(d,j=12.1hz,1h),1.47(s,3h),1.45(s,1h),1.44-1.36(m,1h),1.27(s,9h),1.22(d,j=12.3hz,1h)。esi-ms m/z计算值650.3226,实验值651.2(m 1)
;保留时间:1.73
分钟(lc方法a)。
[2166]
实施例66:(14s)-8-叔丁基-12,12-二甲基-17-[1-(嘧啶-2-基)哌啶-4-基]-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮,化合物218的制备
[2167][2168]
向(14s)-8-叔丁基-12,12-二甲基-17-(哌啶-4-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮(盐酸盐)(化合物248(非对映异构体2),31mg,0.05244mmol)于dmf(1.5ml)中的溶液中添加k2co3(21mg,0.1519mmol),随后添加2-氯嘧啶(6.1mg,0.05326mmol)。将反应物搅拌20小时,并且将混合物用0.1ml浓hcl淬灭,用dmf稀释,过滤并通过反相制备型色谱法,使用c
18
柱和在15分钟内1%-99%乙腈/水( 5mm hcl)的梯度使用15分钟运行来纯化,得到呈白色固体状的(14s)-8-叔丁基-12,12-二甲基-17-[1-(嘧啶-2-基)哌啶-4-基]-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮(14.1mg,42%)。1h nmr(500mhz,dmso-d6)δ12.39(s,1h),8.39(d,j=4.9hz,2h),7.61(d,j=7.9hz,1h),7.56(t,j=7.8hz,1h),7.01(dd,j=16.0,7.9hz,2h),6.73(d,j=8.5hz,1h),6.69-6.61(m,2h),4.69(d,j=13.3hz,1h),4.63(d,j=13.0hz,1h),4.02(s,1h),3.05(t,j=8.7hz,1h),2.92(d,j=13.3hz,1h),2.86(t,j=10.8hz,1h),2.64(t,j=10.5hz,1h),2.08(s,1h),1.86(d,j=13.2hz,1h),1.80(dd,j=11.7,5.3hz,1h),1.74-1.63(m,2h),1.62(s,5h),1.59-1.49(m,2h),1.48(s,3h),1.27(s,11h),1.17(d,j=12.0hz,1h)。esi-ms m/z计算值632.3257,实验值633.2(m 1)
;保留时间:1.91分钟(lc方法a)。
[2169]
使用(14s)-8-叔丁基-12,12-二甲基-17-(哌啶-4-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮,化合物249(非对映异构体1)作为起始物质,以与上述类似的方式制备下表中的化合物。
[2170]
[2171]
[2172][2173]
实施例67:(14s)-8-叔丁基-12,12-二甲基-2,2,4-三氧代-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-17-甲酸甲酯,化合物225(非对映异构体1)和化合物224(非对映异构体2);以及(14s)-8-叔丁基-12,12-二甲基-2,2,4-三氧代-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-17-甲酸,化合物231(非对映异构体1)和化合物230(非对映异构体2)的制备
[2174]
[2175][2176]
步骤1:(4s)-4-[3-(叔丁基亚磺酰基氨基)-3-(2-呋喃基)丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯
[2177][2178]
在5分钟内,在-78℃下将正丁基锂溶液(43ml,2.5m于己烷中,107.50mmol)逐滴添加到呋喃(7.8ml,107.25mmol)于thf(350ml)中的溶液中。将混合物在-78℃下搅拌15分钟并在室温下搅拌2小时。将混合物在-78℃下再冷却,并且在5分钟内逐滴添加(4s)-4-(3-叔丁基亚磺酰亚氨基丙基)-2,2-二甲基吡咯烷-1-甲酸叔丁酯(34.91g,97.367mmol)于thf(72ml)中的溶液。使反应缓慢升温至室温持续2小时。添加nh4cl(150ml)和水(150ml)的饱和溶液。将产物用etoac(3x250ml)萃取,经na2so4干燥,过滤并蒸发至干燥,得到呈橙色油状物的(4s)-4-[3-(叔丁基亚磺酰基氨基)-3-(2-呋喃基)丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(41.77g,97%)。1h nmr(400mhz,cdcl3)δ7.36(br.s.,1h),6.37-6.17(m,2h),4.45-4.30(m,1h),3.80-3.54(m,1h),3.48-3.25(m,1h),2.95-2.73(m,1h),2.08(d,j=5.1hz,1h),1.98-1.78(m,3h),1.51-1.15(m,26h)。esi-ms m/z计算值426.2552,实验值427.4(m 1)
;保留时间:1.98分钟(lc方法f)。
[2179]
步骤2:(4s)-4-[3-氨基-3-(2-呋喃基)丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯
[2180][2181]
将分子碘(2.44g,9.6135mmol)添加到(4s)-4-[3-(叔丁基亚磺酰基氨基)-3-(2-呋喃基)丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(41.77g,94.582mmol)于thf(700ml)和水(150ml)中的溶液中。将反应物在40℃下搅拌16小时。添加分子碘(2.4g,0.4868ml,9.4559mmol),并将反应物保持在40℃下持续24小时。将反应物用etoac(200ml)稀释,并用10%硫代硫酸钠水溶液(1x300ml 1x200ml)洗涤。将有机层合并,用盐水(300ml)洗涤,用na2so4干燥,过滤并蒸发至干燥。将残余物在etoac(300ml)中稀释,并用碳酸氢钠饱和水溶液(2x200ml)、10%硫代硫酸钠水溶液以及水和盐水溶液1:1(1x150ml)洗涤。将有机层用na2so4干燥,过滤并蒸发至干燥,得到棕色油状物的粗制(4s)-4-[3-氨基-3-(2-呋喃基)丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(28.8g,83%),其不经进一步纯化即用于下一步。esi-ms m/z计算值322.2256,实验值323.4(m 1)
;保留时间:1.39分钟(lc方法e)。
[2182]
步骤3:(4s)-4-[3-(苄氧基羰基氨基)-3-(2-呋喃基)丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯
[2183][2184]
在氮气下,将(2,5-二氧代吡咯烷-1-基)碳酸苄酯(42g,168.53mmol)分批添加到(4s)-4-[3-氨基-3-(2-呋喃基)丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(52.7g,161.32mmol)和三乙胺(17.424g,24ml,172.19mmol)于thf(400ml)中的溶液中,并且将反应物在室温下搅拌2小时。完成之后,添加咪唑(2.2g,32.316mmol),以便消耗cbzosu残余物,并将混合物搅拌30分钟。将反应物用etoac(600ml)稀释,并用hcl 1n(2x400ml)、5%碳酸钾(400ml)和盐水(300ml)依次洗涤。有机相经硫酸钠干燥,过滤并蒸发至干燥,得到呈橙色粘性油状物的(4s)-4-[3-(苄氧基羰基氨基)-3-(2-呋喃基)丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(73.06g,97%)。1h nmr(400mhz,cdcl3)δ7.41-7.29(m,6h),6.31(br.s.,1h),6.18(br.s.,1h),5.17-4.98(m,3h),4.87-4.73(m,1h),3.79-3.54(m,1h),2.92-2.76(m,1h),2.16-2.05(m,1h),1.93-1.73(m,3h),1.53-1.28(m,18h)。esi-ms m/z计算值456.2624,实验值357.4(m-99) ;保留时间:2.075分钟(lc方法e)。
[2185]
步骤4:(4s)-4-[3-(苄氧基羰基氨基)-4-甲氧基-4-氧代-丁基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯
[2186][2187]
在0℃下,将高碘酸钠(157g,734.02mmol)于水(650ml)中的溶液添加到(4s)-4-[3-(苄氧基羰基氨基)-3-(2-呋喃基)丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(71g,122.38mmol)和氯化钌(iii)(1.55g,7.4724mmol)于四氯化碳(275ml)和乙腈(500ml)中的搅拌溶液中。将混合物搅拌1小时,然后将其缓慢升高到室温并搅拌2小时。添加更多高碘酸钠(65g,303.89mmol),并且将反应物继续搅拌1小时,同时将温度维持在25℃以下(使用冰浴)。混合物通过硅藻土垫过滤,并用乙酸乙酯(5x300ml)洗涤。将10%硫代硫酸钠(300ml)的溶液添加到滤液中,并将双相混合物搅拌10分钟并分离相。将有机相用10%硫代硫酸钠(300ml)和水/盐水的1/1溶液(600ml)洗涤。溶液经硫酸钠干燥,过滤并蒸发至干燥。将如此获得的棕色泡沫溶解于二甲基甲酰胺(640ml)中。向该搅拌的溶液中添加碘甲烷(35.340g,15.5ml,248.98mmol),随后添加碳酸铯(20g,61.384mmol),并将反应物在室温下搅拌18小时。将反应物倒入水(1.2l)中并用乙酸乙酯(3x800ml)萃取三次。将合并的有机相用水/盐水(1/1;2x1.0l)洗涤,经硫酸钠干燥,过滤并蒸发至干燥。残余物通过干柱真空色谱法,以0%至20%etoac/庚烷洗脱来纯化。将不纯级分合并,并在330g柱上通过硅胶柱色谱法,以0%至30%etoac/庚烷洗脱来纯化。将所有纯级分混合在一起并蒸发至干燥,得到呈浅黄色油状物的(4s)-4-[3-(苄氧基羰基氨基)-4-甲氧基-4-氧代-丁基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(35g,61%)。1h nmr(400mhz,cdcl3)δ7.41-7.30(m,6h),5.34-5.23(m,1h),5.12(s,2h),4.44-4.34(m,1h),3.83-3.53(m,5h),2.99-2.74(m,1h),2.16-2.01(m,1h),1.95-1.80(m,2h),1.73-1.62(m,1h),1.50-1.43(m,13h),1.38(s,3h)。esi-ms m/z计算值448.2573,实验值349.4(m-99) ;保留时间:1.99分钟(lc方法e)。
[2188]
步骤5:(4s)-4-(3-氨基-4-甲氧基-4-氧代-丁基)-2,2-二甲基-吡咯烷-1-甲酸叔丁酯
[2189][2190]
将(4s)-4-[3-(苄氧基羰基氨基)-4-甲氧基-4-氧代-丁基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(36.2g,76.669mmol)于meoh(620ml)中的溶液用氮气脱气10分钟。添加钯/碳(8.4g,10%w/w,7.8933mmol),并使氢气鼓泡1小时。将反应物在氢气气氛下搅拌16小时。反应物通过硅藻土垫过滤,并用甲醇(2x100ml)洗涤。在挥发物蒸发后,将粗产物溶解于乙酸乙酯(400ml)中,并用1n hcl(2x250ml)萃取两次。使用1.5n naoh(450ml)将水相碱化,直到ph达到约9-10,并用乙酸乙酯(2x400ml)萃取复杂溶液两次。将有机相用水/盐水的1/1溶液
(500ml)洗涤,经硫酸钠干燥,过滤并蒸发至干燥,得到呈浅黄色油状物的(4s)-4-(3-氨基-4-甲氧基-4-氧代-丁基)-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(18.68g,76%)。1h nmr(400mhz,cdcl3)δ3.78-3.58(m,4h),3.49-3.39(m,1h),2.96-2.81(m,1h),2.17-2.06(m,1h),1.97-1.83(m,1h),1.81-1.67(m,1h),1.65-1.53(m,1h),1.53-1.36(m,18h)。esi-ms m/z计算值314.2206,实验值315.4(m 1)
;保留时间:1.325分钟(lc方法e)。
[2191]
步骤6:(4s)-4-[4-甲氧基-4-氧代-3-[(6-氨磺酰基-2-吡啶基)氨基]丁基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯
[2192][2193]
将(4s)-4-(3-氨基-4-甲氧基-4-氧代-丁基)-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(18g,56.218mmol)、6-氟吡啶-2-磺酰胺(22.7g,128.85mmol)和二异丙基乙胺(20.034g,27ml,155.01mmol)于二甲基亚砜(90ml)和二噁烷(20ml)中的溶液在120℃下搅拌40小时。冷却到室温后,将反应物用乙酸乙酯(2.0l)稀释,并用水/盐水的1/1溶液(2x1.0l)洗涤两次。有机相经硫酸钠干燥,过滤并蒸发至干燥。通过干柱真空色谱法,以10%至60%etoac/庚烷洗脱,并且在275g c
18
柱上通过反相色谱法(分4个批次),以10%至100%meoh/水洗脱来纯化残余物,得到呈白色固体状的(4s)-4-[4-甲氧基-4-氧代-3-[(6-氨磺酰基-2-吡啶基)氨基]丁基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(17.88g,66%)。1h nmr(400mhz,dmso-d6)δ7.58(t,j=7.8hz,1h),7.39(dd,j=7.8,3.2hz,1h),7.07-6.98(m,3h),6.76(d,j=8.3hz,1h),4.65(br.s.,1h),3.63(s,3h),3.59-3.47(m,1h),2.85-2.72(m,1h),2.18-2.01(m,1h),1.94-1.61(m,3h),1.46-1.30(m,15h),1.23(s,3h)。esi-ms m/z计算值470.2199,实验值415.1(m-55) ;保留时间:4.07分钟(lc方法f)。
[2194]
步骤7:(4s)-4-[3-[[6-[(6-叔丁基-2-氟-吡啶-3-羰基)氨磺酰基]-2-吡啶基]氨基]-4-甲氧基-4-氧代-丁基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯
[2195][2196]
在250-ml圆底烧瓶中,将6-叔丁基-2-氟-吡啶-3-甲酸(6.03g,30.58mmol)溶解于thf(100ml)中,向其中添加cdi(5.05g,31.14mmol)。将所得混合物在室温下搅拌22小时。此后,添加(4s)-4-[4-甲氧基-4-氧代-3-[(6-氨磺酰基-2-吡啶基)氨基]丁基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(10.02g,20.74mmol)和dbu(12ml,80.24mmol),并将所得混合物在室温下搅拌22小时。此后,将混合物倒入etoac(300ml)中。然后将该混合物用饱和碳酸氢钠水溶液(150ml)、hcl水溶液(0.1n,150ml)和饱和nacl水溶液(150ml)洗涤,然后经na2so4干燥,过滤并真空蒸发。通过硅胶色谱法(330g二氧化硅),使用0至100%etoac/己烷的梯度洗脱
来纯化所得棕色泡沫,得到白色泡沫(4s)-4-[3-[[6-[(6-叔丁基-2-氟-吡啶-3-羰基)氨磺酰基]-2-吡啶基]氨基]-4-甲氧基-4-氧代-丁基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(4.439g,33%);esi-ms m/z计算值649.29456,实验值650.3(m 1)
;保留时间:2.11分钟(lc方法a)。
[2197]
步骤8:(14s)-8-叔丁基-12,12-二甲基-2,2,4-三氧代-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-17-甲酸甲酯和(14s)-8-叔丁基-12,12-二甲基-2,2,4-三氧代-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-17-甲酸(非对映异构体混合物)
[2198][2199]
阶段1:在250-ml圆底烧瓶中,将(4s)-4-[3-[[6-[(6-叔丁基-2-氟-吡啶-3-羰基)氨磺酰基]-2-吡啶基]氨基]-4-甲氧基-4-氧代-丁基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(4.5g,6.925mmol)溶解于二氯甲烷(100ml)中。添加tfa(12.0ml,155.8mmol),并使所得溶液在室温下静置4小时。然后将混合物真空蒸发,用二噁烷稀释,并再次真空蒸发。这得到橙色泡沫状物,约5g(>100%产率)。
[2200]
阶段2:在250-ml圆底烧瓶中,将来自步骤1的粗产物溶解于nmp(100ml)中,向其中添加k2co3(13.0g,94.06mmol)。将所得混合物用氮气冲洗,然后在150℃下搅拌20小时。在冷却至室温之后,将反应混合物倒入hcl水溶液(1n;200ml),然后用etoac(2
×
300ml)萃取。将合并的有机萃取物用h2o(300ml)和饱和nacl水溶液(300ml)洗涤,然后经na2so4干燥,过滤并真空蒸发。获得作为粗产物的棕色泡沫状物。将其通过硅胶塞(150g二氧化硅;500ml etoac)纯化,得到两批产物。这对应于酯(约1.0g)和酸(约1.5g)产物,因为酯已在反应条件下部分水解。这两种产物在后续步骤中进一步纯化。
[2201]
(14s)-8-叔丁基-12,12-二甲基-2,2,4-三氧代-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-17-甲酸甲酯(1.0g,27%)esi-ms m/z计算值529.2359,实验值530.2(m 1)
;保留时间:0.74分钟(lc方法d)。
[2202]
(14s)-8-叔丁基-12,12-二甲基-2,2,4-三氧代-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-17-甲酸(1.5g,42%)esi-ms m/z计算值515.2202,实验值516.2(m 1)
;保留时间:0.69分钟和0.71分钟(lc方法d)。
[2203]
步骤9:(14s)-8-叔丁基-12,12-二甲基-2,2,4-三氧代-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-17-甲酸,非对映异构体1,化合物231,和(14s)-8-叔丁基-12,12-二甲基-2,2,4-三氧代-2λ
6-硫杂-3,
9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-17-甲酸,非对映异构体2,化合物230
[2204][2205]
通过硅胶色谱法(330g二氧化硅)使用0至100%etoac/己烷梯度洗脱剂,随后通过多批反相色谱法,对来自步骤8的含有(14s)-8-叔丁基-12,12-二甲基-2,2,4-三氧代-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-17-甲酸(1.5g,2.909mmol)的半纯化产物进行纯化,得到:
[2206]
非对映异构体1,在uplc上保留时间较短:(14s)-8-叔丁基-12,12-二甲基-2,2,4-三氧代-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-17-甲酸(203.9mg,14%);1h nmr(400mhz,dmso-d6)δ12.57(s,1h),12.43(s,1h),7.63(dd,j=8.5,7.3hz,1h),7.51(d,j=7.8hz,1h),7.41(d,j=7.9hz,1h),7.25(d,j=7.2hz,1h),6.87(d,j=8.4hz,1h),6.61(d,j=7.9hz,1h),4.37-4.07(m,1h),3.16-3.01(m,1h),2.97-2.77(m,1h),2.36-2.25(m,1h),2.25-2.06(m,1h),2.04-1.92(m,1h),1.84(dd,j=11.8,5.9hz,1h),1.75-1.65(m,1h),1.57(s,3h),1.56-1.46(m,1h),1.52(s,3h),1.26(s,9h),1.25-1.16(m,1h);esi-ms m/z计算值515.2202,实验值516.2(m 1)
;保留时间:1.75分钟(lc方法a)。
[2207]
非对映异构体2,在uplc上保留时间较长:(14s)-8-叔丁基-12,12-二甲基-2,2,4-三氧代-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-17-甲酸(369.2mg,25%);1h nmr(400mhz,dmso-d6)δ12.53(s,1h),7.64(dd,j=8.5,7.2hz,1h),7.60(d,j=8.0hz,1h),7.45(d,j=9.4hz,1h),7.12(d,j=7.1hz,1h),6.83(d,j=8.4hz,1h),6.65(d,j=8.0hz,1h),4.73-4.62(m,1h),3.06(dd,j=10.2,6.8hz,1h),2.66(t,j=10.4hz,1h),2.24-2.10(m,1h),1.92(t,j=12.9hz,1h),1.85-1.78(m,1h),1.69(dd,j=13.9,5.5hz,1h),1.63(s,3h),1.53(t,j=12.2hz,1h),1.49(s,3h),1.40-1.28(m,1h),1.27(s,9h)。[注意:缺少1h—磺酰胺或甲酸1h脱质子或与水峰混合。]esi-ms m/z计算值515.2202,实验值516.1(m 1)
;保留时间:1.82分钟(lc方法a)。
[2208]
步骤10:(14s)-8-叔丁基-12,12-二甲基-2,2,4-三氧代-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-17-甲酸甲酯,非对映异构体1,化合物225,和(14s)-8-叔丁基-12,12-二甲基-2,2,4-三氧代-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-17-甲酸甲酯,非对映异构体2,化合物224
[2209][2210]
通过硅胶色谱法(330g二氧化硅)使用0至100%etoac/己烷梯度洗脱剂,对来自步骤8的半纯化产物[含有(14s)-8-叔丁基-12,12-二甲基-2,2,4-三氧代-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-17-甲酸甲酯(1.0g,1.888mmol)]进行纯化,得到2种产物:
[2211]
非对映异构体1,较早从sio2柱洗脱:(14s)-8-叔丁基-12,12-二甲基-2,2,4-三氧代-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-17-甲酸甲酯(170.3mg,17%);1h nmr(400mhz,dmso-d6)δ12.47(s,1h),7.72-7.54(m,2h),7.40(d,j=7.7hz,1h),7.27(d,j=7.3hz,1h),6.86(d,j=8.4hz,1h),6.61(d,j=7.9hz,1h),4.46-4.17(m,1h),3.61(s,3h),3.17-3.03(m,1h),2.86-2.69(m,1h),2.38-2.14(m,2h),1.98-1.92(m,1h),1.84(dd,j=11.8,5.8hz,1h),1.75-1.64(m,1h),1.56(s,3h),1.52(s,3h),1.51-1.44(m,1h),1.37-1.27(m,1h),1.26(s,9h);esi-ms m/z计算值529.2359,实验值530.2(m 1)
;保留时间:1.96分钟(lc方法a)。
[2212]
非对映异构体2,较晚从sio2柱洗脱:(14s)-8-叔丁基-12,12-二甲基-2,2,4-三氧代-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-17-甲酸甲酯(538.0mg,54%);1h nmr(400mhz,dmso-d6)δ12.56(s,1h),7.67(dd,j=8.4,7.2hz,1h),7.60(d,j=8.0hz,1h),7.56(d,j=9.5hz,1h),7.15(d,j=7.2hz,1h),6.84(d,j=8.3hz,1h),6.65(d,j=8.0hz,1h),4.78(ddd,j=12.8,9.5,3.1hz,1h),3.63(s,3h),3.02(dd,j=10.2,6.8hz,1h),2.65(t,j=10.4hz,1h),2.24-2.09(m,1h),1.94-1.77(m,3h),1.70(dd,j=14.3,5.5hz,1h),1.63(s,3h),1.53(t,j=12.7hz,1h),1.48(s,3h),1.40-1.28(m,1h),1.27(s,9h);esi-ms m/z计算值529.2359,实验值530.2(m 1)
;保留时间:1.96分钟(lc方法a)。
[2213]
实施例68:(14s)-8-叔丁基-17-(2-羟基丙-2-基)-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮,化合物12的制备
[2214][2215]
在3-ml小瓶中,将(14s)-8-叔丁基-12,12-二甲基-2,2,4-三氧代-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-17-甲酸甲酯(化合物224(非对映异构体2),41.4mg,0.07816mmol)溶解于thf(400μl)中,并
冷却至0℃。然后,一次性添加memgbr的乙醚溶液(200μl,3.0m,0.6000mmol)。将所得混合物在室温下搅拌17小时,随后用饱和nh4cl水溶液(1ml)淬灭。添加etoac(1.2ml),然后将各相剧烈混合并允许沉降成两层。将有机层过滤,并且通过反相制备型色谱法使用c
18
柱和含有5mm hcl溶液的1%至99%乙腈/水的梯度洗脱进行纯化,得到(14s)-8-叔丁基-17-(2-羟基丙-2-基)-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮(14.2mg,34%);1h nmr(400mhz,dmso-d6)δ12.40(s,1h),7.60(d,j=7.9hz,1h),7.55(dd,j=8.5,7.2hz,1h),7.01(dd,j=7.2,0.7hz,1h),6.89-6.80(m,1h),6.77(dd,j=8.5,0.9hz,1h),6.64(d,j=8.0hz,1h),3.89(t,j=10.6hz,1h),3.09(dd,j=10.4,6.7hz,1h),2.62(t,j=10.5hz,1h),2.07-1.94(m,1h),1.80(dd,j=11.6,5.3hz,1h),1.73(t,j=12.7hz,1h),1.68-1.55(m,2h),1.61(s,3h),1.55-1.48(m,1h),1.48(s,3h),1.27(s,9h),1.23-1.13(m,1h),1.10(s,3h),1.03(s,3h)。[注意:oh信号隐藏在残留水峰下方。]esi-ms m/z计算值529.2723,实验值530.2(m 1)
;保留时间:1.93分钟(lc方法a)。
[2216]
实施例69:(14s)-n-{7-氮杂螺[3.5]壬-2-基}-8-叔丁基-12,12-二甲基-2,2,4-三氧代-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-17-甲酰胺,化合物222(非对映异构体2)的制备
[2217][2218]
步骤1:2-[(14s)-8-叔丁基-12,12-二甲基-2,2,4-三氧代-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-17-酰胺基]-7-氮杂螺[3.5]壬烷-7-甲酸叔丁酯,化合物226(非对映异构体2)
[2219][2220]
在100-ml烧瓶中,将(14s)-8-叔丁基-12,12-二甲基-2,2,4-三氧代-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-17-甲酸(非对映异构体2,化合物230,40.3mg,0.07761mmol)溶解于dmf(2ml)中,向其中添加hatu(36.89mg,0.09702mmol)并且然后添加2-氨基-7-氮杂螺[3.5]壬烷-7-甲酸叔丁酯(20.5mg,0.08538mmol),随后添加dipea(35,0.2716mmol)。在室温下搅拌16小时候,用etoac稀释并用1n hcl(1x)、饱和盐水(1x)洗涤,干燥(硫酸钠),过滤并浓缩,得到灰白色固体,将所述灰白色固体过滤并使用反相hplc-ms方法,使用由phenomenex销售的luna c
18
柱(75
×
30mm,5μm粒度)(pn:00c-4252-u0-ax),和在15.0分钟内从30%-99%流动相b运行的双梯度(流动相a=h2o(5mm hcl),流动相b=乙腈,流速=50ml/min,进样体积=950μl并且柱温=25℃)进行纯化,得到2-[(14s)-8-叔丁基-12,12-二甲基-2,2,4-三氧代-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-17-酰胺基]-7-氮杂螺[3.5]壬烷-7-甲酸叔丁酯(41.5mg,72%)esi-ms m/z计算值737.39343,实验值738.8(m 1)
;保留时间:0.85分钟(lc方法d)。esi-ms m/z计算值737.39343,实验值738.2(m 1)
;保留时间:2.19分钟(lc方法a)。
[2221]
步骤2:(14s)-n-{7-氮杂螺[3.5]壬-2-基}-8-叔丁基-12,12-二甲基-2,2,4-三氧代-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-17-甲酰胺,非对映异构体2,化合物222
[2222][2223]
将2-[(14s)-8-叔丁基-12,12-二甲基-2,2,4-三氧代-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-17-酰胺基]-7-氮杂螺[3.5]壬烷-7-甲酸叔丁酯(化合物226(非对映异构体2),38mg,0.05098mmol)溶解于dcm(1000μl)中,并向混合物中添加tfa(200μl,2.596mmol),并在室温下搅拌1小时。将混合物蒸发至干燥,然后用乙醚(30ml x 2)稀释,并再浓缩。将该混合物用dmso稀释,并
且然后通过反相制备型色谱法,使用c
18
柱和在15分钟内1%-70%乙腈/水( 5mm hcl)的梯度纯化,得到呈白色固体状的(14s)-n-{7-氮杂螺[3.5]壬-2-基}-8-叔丁基-12,12-二甲基-2,2,4-三氧代-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-17-甲酰胺(盐酸盐)(非对映异构体2,33.2mg,96%)。esi-ms m/z计算值637.341,实验值638.2(m 1)
;保留时间:1.59分钟(lc方法a)。
[2224]
步骤3:(14s)-8-叔丁基-n-[7-(2-甲氧基乙基)-7-氮杂螺[3.5]壬-2-基]-12,12-二甲基-2,2,4-三氧代-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-17-甲酰胺,化合物220(非对映异构体2)
[2225][2226]
向(14s)-n-{7-氮杂螺[3.5]壬-2-基}-8-叔丁基-12,12-二甲基-2,2,4-三氧代-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-17-甲酰胺(盐酸盐)(30mg,0.04405mmol)于dmf(1.5ml)中的溶液中添加k2co3(30mg,0.2171mmol),随后添加含1-溴-2-甲氧基-乙烷(4.2μl,0.04469mmol)的42μl dmf。将反应物在50℃下搅拌22小时。然后将混合物用0.1ml浓hcl淬灭,用dmf稀释,过滤并且通过反相制备型色谱法,利用c
18
柱和在30分钟内20%-65%乙腈/水( 5mm hcl)的梯度进行纯化,得到呈白色固体状的(14s)-8-叔丁基-n-[7-(2-甲氧基乙基)-7-氮杂螺[3.5]壬-2-基]-12,12-二甲基-2,2,4-三氧代-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-17-甲酰胺(盐酸盐)(非对映异构体2,5.7mg,17%)。1h nmr(500mhz,dmso-d6)δ12.56(d,j=7.9hz,1h),10.37-10.09(m,1h),8.14(d,j=5.2hz,1h),7.72-7.54(m,2h),7.46-7.30(m,1h),7.13(d,j=7.2hz,1h),6.87(d,j=8.4hz,1h),6.63(d,j=7.9hz,1h),4.48(t,j=9.9hz,1h),4.16(dd,j=16.7,8.9hz,2h),3.69(t,j=5.0hz,2h),3.32(d,j=13.3hz,1h),3.27(s,3h),3.19(d,j=5.2hz,2h),3.16-3.08(m,1h),2.93-2.85(m,1h),2.82-2.72(m,1h),2.60-2.54(m,1h),2.26-2.19(m,1h),2.19-2.11(m,1h),2.06-1.97(m,1h),1.87-1.75(m,6h),1.74-1.70(m,1h),1.69(d,j=2.8hz,1h),1.64(s,3h),1.62(d,j=3.3hz,1h),1.51(d,j=12.2hz,1h),1.47(s,3h),1.27(s,9h),1.26-1.19(m,1h)。esi-ms m/z计算值695.3829,实验值696.3(m 1)
;保留时间:1.63分钟(lc方法a)。
[2227]
使用(14s)-8-叔丁基-12,12-二甲基-2,2,4-三氧代-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-17-甲酸,非对映异构体1,化合物231,或(14s)-8-叔丁基-12,12-二甲基-2,2,4-三氧代-2λ
6-硫杂-3,9,
11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-17-甲酸酯,非对映异构体1,化合物225作为起始物质,以与上述类似的方式制备下表中的化合物。
[2228]
[2229][2230]
实施例70:(14s)-8-叔丁基-12,12,18-三甲基-17-苯基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮,化合物261(非对映异构体2)的制备
[2231][2232]
步骤1:(14s)-8-叔丁基-12,12-二甲基-17-苯基-3-(丙-2-烯-1-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮,非对映异构体2
[2233][2234]
向微波小瓶中添加碳酸钾(35mg,0.2532mmol)、(14s)-8-叔丁基-12,12-二甲基-17-苯基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮化合物294(非镜像异构物2)(34mg,0.06208mmol)于dmf(1ml)中的溶液和烯丙基溴(6.4μl,0.07396mmol)。使反应物在室温下搅拌过夜。再添加烯丙基溴(1.6μl,0.01849mmol),并将反应物搅拌4小时。过滤反应物并经由hplc(30%-99%acn:h2o,含hcl改性剂)纯化,得到(14s)-8-叔丁基-12,12-二甲基-17-苯基-3-(丙-2-烯-1-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮(非对映异构体2,34mg,93%)。esi-ms m/z计算值587.293,实验值588.5(m 1)
;保留时间:2.11分钟(lc方法g)。
[2235]
步骤2:(14s)-8-叔丁基-12,12,18-三甲基-17-苯基-3-(丙-2-烯-1-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮
[2236][2237]
向含有(14s)-8-叔丁基-12,12-二甲基-17-苯基-3-(丙-2-烯-1-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮(非对映异构体2,34mg,0.05785mmol)的小瓶中添加dmf(1ml)和氢化钠(3.0mg,60%w/w,0.07501mmol),随后添加碘甲烷(3.6μl,0.05783mmol)。再添加碘甲烷(1.5μl,0.02409mmol),并将反应物搅拌过夜。将反应物过滤,并经由hplc50%-99%acn:h2o(含有hcl改性剂)纯化。分离出呈固体状的(14s)-8-叔丁基-12,12,18-三甲基-17-苯基-3-(丙-2-烯-1-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮(非对映异构体2,12.6mg,36%)。esi-ms m/z计算值601.30865,实验值602.4(m 1)
;保留时间:2.31分钟(lc方法g)。
[2238]
步骤3:(14s)-8-叔丁基-12,12,18-三甲基-17-苯基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮,化合物261(非对映异构体2)
[2239][2240]
向含有(14s)-8-叔丁基-12,12,18-三甲基-17-苯基-3-(丙-2-烯-1-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮(非对映异构体2,12.6mg,0.02094mmol)的小瓶中添加1,2-二氯乙烷(0.5ml)和四(三苯基膦基)钯(0)(24.2mg,0.02094mmol)。使反应物搅拌30分钟,并且然后添加苯磺酸钠(3.9mg,0.1696mmol)。在20分钟后,将反应物过滤,并经由hplc30%-99%acn:h2o(含有hcl改性剂)纯化。分离出呈黄色固体状的(14s)-8-叔丁基-12,12,18-三甲基-17-苯基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮(非对映异构体2,7.1mg,60%)。esi-ms m/z计算值561.27734,实验值562.4(m 1)
;保留时间:1.8分钟(lc方法g)。
[2241]
步骤4:(14s)-8-叔丁基-12,12-二甲基-18-(2-甲基丙基)-17-苯基-3-(丙-2-烯-1-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮,非对映异构体2
[2242][2243]
向微波小瓶中添加(14s)-8-叔丁基-12,12-二甲基-17-苯基-3-(丙-2-烯-1-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮(非对映异构体2,19.5mg,0.03318mmol)和1-溴-2-甲基-丙烷(110μl,1.012mmol)。将反应物超声处理,直到其进入溶液中。添加氢化钠(2.7mg,60%w/w,0.06751mmol),随后添加dmf(0.2ml),并使反应物在室温下搅拌过夜。将反应物用甲醇淬灭,并经由hplc 50%-99%acn:h2o(含有hcl改性剂)纯化。分离出呈固体状的(14s)-8-叔丁基-12,12-二甲基-18-(2-甲基丙基)-17-苯基-3-(丙-2-烯-1-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮(非对映异构体2,8.2mg,38%)。esi-ms m/z计算值643.3556,实验值644.5(m 1)
;保留时间:2.54分钟(lc方法g)。
[2244]
步骤5:(14s)-8-叔丁基-12,12-二甲基-18-(2-甲基丙基)-17-苯基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮,化合物270(非对映异构体2)
[2245][2246]
向含有(14s)-8-叔丁基-12,12-二甲基-18-(2-甲基丙基)-17-苯基-3-(丙-2-烯-1-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮(非对映异构体2,8.2mg,0.01274mmol)的试管中添加1,2-二氯乙烷(0.5ml)。添加pd(pph3)4(14.8mg,0.01281mmol),并且将反应物搅拌5分钟,同时反应物变为深红色。添加苯磺酸钠(2.4mg,0.1044mmol),并使反应物在室温下搅拌1小时。将反应物蒸发,溶解于dmf中,并过滤。粗反应混合物经由hplc 50%-99%acn:h2o(含有hcl改性剂)纯化。分离出呈固体状的(14s)-8-叔丁基-12,12-二甲基-18-(2-甲基丙基)-17-苯基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮(非对映异构体2,5.3mg,69%)。esi-ms m/z计算值603.32434,实验值604.4(m 1)
;保留时间:2.23分钟(lc方法g)。
[2247]
使用(14s)-8-叔丁基-12,12-二甲基-17-苯基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮,化合物295(非对映异构体1)作为起始物质,以与上述类似的方式制备下表中的化合物。
[2248][2249]
实施例71:(14s)-12,12-二甲基-17-苯基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮,化合物289(非对映异构体1)和化合物288(非对映异构体2)的制备
[2250][2251]
步骤1:(4s)-4-[3-[[6-[(2-氯吡啶-3-羰基)氨磺酰基]-2-吡啶基]氨基]-3-苯基-丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯
[2252][2253]
向2-氯吡啶-3-甲酸(126.0mg,0.8mmol)于thf(1.008ml)中的溶液中添加cdi(162mg,0.9991mmol)(从thf再结晶),并将混合物在室温下搅拌1小时,然后添加(4s)-2,2-二甲基-4-[3-苯基-3-[(6-氨磺酰基-2-吡啶基)氨基]丙基]吡咯烷-1-甲酸叔丁酯(408.9mg,0.8368mmol),随后添加dbu(376μl,2.512mmol),并且将所得混合物在室温下搅拌16小时。浓缩以移除thf,然后用dmso稀释,过滤并使用反相hplc-ms方法,使用由phenomenex销售的luna c
18
柱(75
×
30mm,5μm粒度)(pn:00c-4252-u0-ax),以及在15.0分钟内从1%-99%流动相b运行的双梯度(流动相a=h2o(5mm hcl),流动相b=乙腈,流速=50ml/min,进样体积=950μl并且柱温=25℃)进行纯化,得到(4s)-4-[3-[[6-[(2-氯吡啶-3-羰基)氨磺酰基]-2-吡啶基]氨基]-3-苯基-丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(280.8mg,56%)。esi-ms m/z计算值627.2282,实验值628.2(m 1)
;保留时间:0.77分钟(lc方法d)。
[2254]
步骤2:2-氯-n-[[6-[[3-[(3s)-5,5-二甲基吡咯烷-3-基]-1-苯基-丙基]氨基]-2-吡啶基]磺酰基]吡啶-3-甲酰胺
[2255][2256]
将(4s)-4-[3-[[6-[(2-氯吡啶-3-羰基)氨磺酰基]-2-吡啶基]氨基]-3-苯基-丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(280.7mg,0.4468mmol)溶解于dcm(1.225ml)中,并且向混合物中添加tfa(2.039g,17.88mmol),并且将混合物在室温下搅拌2小时。将混合物减压浓缩至干燥,添加1ml甲苯,并且通过旋转蒸发(45℃水浴)移除。再次添加1ml甲苯并通过旋转蒸发(45℃水浴)移除,然后在高真空下干燥,得到2-氯-n-[[6-[[3-[(3s)-5,5-二甲基吡咯烷-3-基]-1-苯基-丙基]氨基]-2-吡啶基]磺酰基]吡啶-3-甲酰胺(三氟乙酸盐)(287mg,100%)。esi-ms m/z计算值527.1758,实验值528.4(m 1)
;保留时间:0.44分钟,呈白色固体状(lc方法d)。
[2257]
步骤3:(14s)-12,12-二甲基-17-苯基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮,化合物289(非对映异构体1),和(14s)-12,12-二甲基-17-苯基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环
[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮,化合物288(非对映异构体2)
[2258][2259]
向2-氯-n-[[6-[[3-[(3s)-5,5-二甲基吡咯烷-3-基]-1-苯基-丙基]氨基]-2-吡啶基]磺酰基]吡啶-3-甲酰胺(三氟乙酸盐)(287mg,0.4470mmol)于nmp(17ml)中的溶液中添加碳酸钾(432.6mg,3.130mmol)。将混合物用氮气吹扫5分钟。将混合物在165℃下加热2天。将混合物冷却至室温,用1n hcl稀释并用etoac(2x)萃取。将有机相合并,干燥(硫酸钠),过滤并浓缩,得到棕色油状物,将所述棕色油状物过滤并使用反相hplc-ms方法使用由phenomenex销售的luna c
18
柱(75
×
30mm,5μm粒度)(pn:00c-4252-u0-ax),以及在30.0分钟内从30%-70%流动相b运行的双梯度(流动相a=h2o(5mm hcl),流动相b=乙腈,流速=50ml/min,进样体积=950μl并且柱温=25℃)进行纯化,得到都呈白色固体状的两种异构体:
[2260]
首先洗脱的非对映异构体1:(14s)-12,12-二甲基-17-苯基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮(13.70mg,12%)。1h nmr(500mhz,dmso-d6)δ12.55(s,1h),8.17(s,1h),7.74(s,1h),7.63-7.57(m,1h),7.51(d,j=7.6hz,2h),7.33(s,2h),7.28-7.16(m,2h),6.80(d,j=8.5hz,1h),6.66(s,1h),6.16(s,1h),4.82(s,1h),3.21(s,1h),3.14(s,1h),2.34(s,1h),1.87(d,j=12.0hz,2h),1.71(s,2h),1.58(s,3h),1.55(s,1h),1.52(s,3h),1.17(s,1h)。esi-ms m/z计算值491.1991,实验值492.0(m 1)
;保留时间:1.72分钟(lc方法q)
[2261]
第二洗脱的非对映异构体2:(14s)-12,12-二甲基-17-苯基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮(13mg,12%)。1h nmr(500mhz,dmso-d6)δ12.62(s,1h),8.17(dd,j=4.7,1.9hz,1h),7.74-7.67(m,2h),7.62(t,j=7.8hz,1h),7.42(d,j=7.6hz,2h),7.30(t,j=7.5hz,2h),7.20(t,j=7.0hz,1h),7.07(d,j=7.2hz,1h),6.82(d,j=8.5hz,1h),6.62(dd,j=7.6,4.7hz,1h),5.20(t,j=10.9hz,1h),3.25(t,j=8.7hz,1h),2.77(t,j=10.5hz,1h),2.26(s,1h),1.94(d,j=5.5hz,1h),1.85(dd,j=11.9,5.2hz,1h),1.72(d,j=13.3hz,2h),1.62(s,3h),1.58(d,j=12.2hz,1h),1.48(s,3h),1.45(s,1h)。esi-ms m/z计算值491.1991,实验值492.0(m 1)
;保留时间:1.68分钟(lc方法q)。
[2262]
实施例72:(18s)-4-叔丁基-20,20-二甲基-15-苯基-10λ
6-硫杂-1,3,9,14,22-五氮杂四环[16.2.1.111,14.02,7]二十碳-2,4,6,11(22),12-五烯-8,10,10-三酮,化合物275(非对映异构体1)和化合物274(非对映异构体2)的制备
[2263][2264]
步骤1:(4s)-4-(3-羟基-3-苯基-丙基)-2,2-二甲基-吡咯烷-1-甲酸叔丁酯
[2265][2266]
在氮气气氛下,在0℃下向(4s)-2,2-二甲基-4-(3-氧代丙基)吡咯烷-1-甲酸叔丁酯(650mg,2.545mmol)于无水thf(5ml)中的溶液中添加溴(苯基)镁(3.1ml,1.0m于thf中,3.100mmol),并将反应混合物搅拌2小时,同时缓慢升温至室温。将反应物用饱和氯化铵溶液淬灭并用乙酸乙酯萃取。将合并的有机物用盐水洗涤,经硫酸钠干燥并蒸发。通过硅胶柱色谱法,使用100%己烷至100%etoac的窄梯度来纯化所得棕色残余物,得到呈无色油状物的(4s)-4-(3-羟基-3-苯基-丙基)-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(614mg,72%)。esi-ms m/z计算值333.2304,实验值334.38(m 1)
;保留时间:0.76分钟(lc方法d)。
[2267]
步骤2:(4s)-2,2-二甲基-4-(3-甲基磺酰氧基-3-苯基-丙基)吡咯烷-1-甲酸叔丁酯
[2268][2269]
在0℃下,向(4s)-4-(3-羟基-3-苯基-丙基)-2,2-二甲基吡咯烷-1-甲酸叔丁酯(600mg,1.799mmol)于二氯甲烷(5ml)和三乙胺(760μl,5.453mmol)中的溶液中缓慢逐滴添加甲磺酰氯(170μl,2.196mmol),并使反应物升温至室温并搅拌60分钟。将反应物用盐水淬灭并用dcm萃取。有机层经硫酸钠干燥并蒸发,得到(4s)-2,2-二甲基-4-(3-甲基磺酰氧基-3-苯基-丙基)吡咯烷-1-甲酸叔丁酯(740mg,40%),其按原样用于下一反应。esi-ms m/z计算值411.20795,实验值348.4(m 1)
;保留时间:0.69分钟(lc方法d)。
[2270]
步骤3:(4s)-2,2-二甲基-4-[3-苯基-3-(3-氨磺酰基吡唑-1-基)丙基]吡咯烷-1-甲酸叔丁酯和(4s)-2,2-二甲基-4-[3-苯基-3-(5-氨磺酰基吡唑-1-基)丙基]吡咯烷-1-甲酸叔丁酯
[2271][2272]
向(4s)-2,2-二甲基-4-(3-甲基磺酰氧基-3-苯基-丙基)吡咯烷-1-甲酸叔丁酯(700mg,1.701mmol)于dmf(5ml)中的溶液中添加1h-吡唑-3-磺酰胺(757mg,5.144mmol)和碳酸铯(2.8g,8.594mmol)。将反应混合物在80℃下加热24小时。向反应混合物中添加水,并将混合物用乙酸乙酯萃取。将合并的有机层用盐水洗涤,经无水硫酸钠干燥并浓缩。所得棕色残余物经由whatman滤盘(puradisc 25tf)过滤,并且滤液通过反相hplc-ms方法,使用在15.0分钟内30%-99%流动相b运行的双梯度(流动相a=h2o(5mm hcl),流动相b=ch3cn,流速=50ml/min,进样体积=950μl并且柱温=25℃)进行纯化,得到所需的(4s)-2,2-二甲基-4-[3-苯基-3-(3-氨磺酰基吡唑-1-基)丙基]吡咯烷-1-甲酸叔丁酯(184mg,23%)。1h nmr(500mhz,dmso-d6)δ8.09(d,j=2.4hz,1h),7.47-7.26(m,7h),6.62(d,j=2.4hz,1h),5.50(q,j=7.4,6.8hz,1h),3.56(dt,j=19.9,9.0hz,1h),2.86-2.68(m,1h),2.39-2.26(m,1h),2.19-2.10(m,2h),1.88(ddd,j=17.1,11.9,6.0hz,1h),1.36(dd,j=25.2,14.1hz,13h),1.24(s,3h),1.23-1.10(m,2h)。esi-ms m/z计算值462.23007,实验值463.4(m 1)
;保留时间:0.48分钟(lc方法i)。
[2273]
步骤4:(4s)-4-[3-[3-[(6-叔丁基-2-氯-吡啶-3-羰基)氨磺酰基]吡唑-1-基]-3-苯基-丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯
[2274][2275]
向6-叔丁基-2-氯-吡啶-3-甲酸(126mg,0.5897mmol)于thf(2ml)中的溶液中添加cdi(98mg,0.6044mmol),并且将混合物在室温下搅拌1小时,然后添加(4s)-2,2-二甲基-4-[3-苯基-3-(3-氨磺酰基吡唑-1-基)丙基]吡咯烷-1-甲酸叔丁酯(180mg,0.3891mmol),随后添加dbu(200μl,1.337mmol),并且将所得混合物在室温下搅拌16小时。浓缩以移除thf,然后用dmso稀释,过滤并且使用反相hplc-ms方法,使用在15.0分钟内30%-99%流动相b运行的双梯度(流动相a=h2o(5mm hcl),流动相b=乙腈)纯化,得到呈非对映异构体混合物形式的(4s)-4-[3-[3-[(6-叔丁基-2-氯-吡啶-3-羰基)氨磺酰基]吡唑-1-基]-3-苯基-丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(98mg,38%)。esi-ms m/z计算值657.27515,实验值658.5(m 1)
;保留时间:0.7分钟(lc方法i)。
[2276]
步骤5:(18s)-4-叔丁基-20,20-二甲基-15-苯基-10λ
6-硫杂-1,3,9,14,22-五氮杂四环[16.2.1.111,14.02,7]二十碳-2,4,6,11(22),12-五烯-8,10,10-三酮
[2277][2278]
将(4s)-4-[3-[3-[(6-叔丁基-2-氯-吡啶-3-羰基)氨磺酰基]吡唑-1-基]-3-苯基-丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(98mg,0.1489mmol)于dcm(500μl)和tfa(100μl,1.298mmol)中的溶液在室温下搅拌2小时。蒸发溶剂。将材料溶解于nmp(2ml)中,并且添加碳酸钾(322mg,2.330mmol)。将混合物用氮气吹扫5分钟。将混合物在140℃下加热2天,并且在160℃下加热3天。反应混合物经由whatman滤盘(puradisc 25tf)过滤,并且滤液通过反相hplc-ms方法,使用phenomenex销售的luna c
18
柱(75
×
30mm,5μm粒度)(pn:00c-4252-u0-ax)和在15.0分钟内30%-99%流动相b运行的双梯度(流动相a=h2o(5mm hcl),流动相b=ch3cn,流速=50ml/min,进样体积=950μl并且柱温=25℃)进行纯化,得到(18s)-4-叔丁基-20,20-二甲基-15-苯基-10λ
6-硫杂-1,3,9,14,22-五氮杂四环[16.2.1.111,14.02,7]二十碳-2,4,6,11(22),12-五烯-8,10,10-三酮(10.3mg,13%)。1h nmr(500mhz,dmso-d6)δ12.77(s,1h),8.22(d,j=2.4hz,1h),7.50(d,j=7.9hz,1h),7.41-7.33(m,5h),6.90(d,j=2.3hz,1h),6.62(d,j=8.0hz,1h),5.55(d,j=12.3hz,1h),2.91-2.81(m,1h),2.40-2.24(m,2h),2.19(s,1h),2.08(t,j=11.2hz,1h),1.98(t,j=10.1hz,1h),1.78(dd,j=
11.7,5.4hz,1h),1.57(s,3h),1.48(s,3h),1.27(s,10h),0.71(td,j=12.1,7.2hz,1h)。esi-ms m/z计算值521.24603,实验值522.16(m 1)
;保留时间:1.62分钟(lc方法g)。
[2279]
步骤6:(18s)-4-叔丁基-20,20-二甲基-15-苯基-10λ
6-硫杂-1,3,9,14,22-五氮杂四环[16.2.1.111,14.02,7]二十碳-2,4,6,11(22),12-五烯-8,10,10-三酮,化合物275(非对映异构体1),和(18s)-4-叔丁基-20,20-二甲基-15-苯基-10λ
6-硫杂-1,3,9,14,22-五氮杂四环[16.2.1.111,14.02,7]二十碳-2,4,6,11(22),12-五烯-8,10,10-三酮,化合物274(非对映异构体2)
[2280][2281]
通过sfc色谱法,使用phenomenex lux-4(250x10mm),5μm粒度,使用38%meoh(无改性剂)、62%co2(无改性剂),65%以10ml/min历经14分钟对(18s)-4-叔丁基-20,20-二甲基-15-苯基-10λ
6-硫杂-1,3,9,14,22-五氮杂四环[16.2.1.111,14.02,7]二十碳-2,4,6,11(22),12-五烯-8,10,10-三酮(非对映异构体混合物,8mg,0.01534mmol)进行手性分离,得到两种异构体:
[2282]
首先洗脱的非对映异构体1:(18s)-4-叔丁基-20,20-二甲基-15-苯基-10λ
6-硫杂-1,3,9,14,22-五氮杂四环[16.2.1.111,14.02,7]二十碳-2,4,6,11(22),12-五烯-8,10,10-三酮(3.0mg,75%)。esi-ms m/z计算值521.24603,实验值522.1(m 1)
;保留时间:1.6分钟(lc方法g)。
[2283]
第二洗脱的非对映异构体2:(18s)-4-叔丁基-20,20-二甲基-15-苯基-10λ
6-硫杂-1,3,9,14,22-五氮杂四环[16.2.1.111,14.02,7]二十碳-2,4,6,11(22),12-五烯-8,10,10-三酮(1.5mg,37%)esi-ms m/z计算值521.24603,实验值522.16(m 1)
;保留时间:1.61分钟(lc方法g)。
[2284]
在步骤1中使用甲基溴化镁作为起始物质,以与上文所述类似的方式制备下表中的化合物。
[2285][2286][2287]
实施例73:8-叔丁基-12,12-二甲基-2λ
6-硫杂-3,9,11,18,21,23-六氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮,化合物253(对映异构体1)和化合物252(对映异构体2)的制备
[2288][2289]
步骤1:6-氯吡嗪-2-磺酰胺
[2290][2291]
将2,6-二氯吡嗪(7.2g,48mmol,1.0当量)、苯甲硫醇(5.8ml,49mmol,1.0当量)和氢氧化钠(2.5g,62mmol,1.3当量)于40ml etoh中的混合物在室温下搅拌6小时。将乙醇旋转蒸发,添加100ml水,并用二氯甲烷(3x100ml)萃取。将合并的有机萃取物用mgso4干燥并过滤。将滤液旋转蒸发并真空干燥,得到呈淡黄色油状物的粗制2-(苄硫基)-6-氯吡嗪(11g)。1h nmr(cdcl3,250mhz):8.31(s,1h),8.21(s,1h),7.36(m,5h),4.41(s,2h)ppm.lc-ms:(m h)
=237.1
[2292]
将2-(苄硫基)-6-氯吡嗪(6.4g,27mmol,1.0当量)于100ml氯仿和25ml水中的混合物冷却至0℃,并使氯气鼓泡穿过该溶液,持续5分钟。30%氢氧化钠水溶液阱用于过量cl2。将混合物在室温下搅拌30分钟。移除并丢弃顶部水层。将底部有机层冷却至0℃,并且小心地添加40ml nh4oh。将反应混合物在室温下搅拌45分钟,旋转蒸发,并且通过快速色谱法,使用120g柱纯化并在30分钟内50%-100%etoac/己烷的梯度洗脱进行纯化,得到呈白色固体状的6-氯吡嗪-2-磺酰胺(2.9g,56%产率)。1h nmr(dmso-d6,250mhz):9.08(m,2h),7.97(s,br,2h)ppm.lc-ms:(m h)
=193.4(lc方法p)。
[2293]
步骤2:2,2-二甲基-4-[3-[(6-氨磺酰基吡嗪-2-基)氨基]丙基]吡咯啶-1-甲酸叔丁酯
[2294][2295]
在20ml小瓶中,将6-氯吡嗪-2-磺酰胺(312mg,1.611mmol)、4-(3-氨基丙基)-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(295mg,1.151mmol)、dipea(1.0ml,5.741mmol)溶解于n-buoh(2.25ml)中。将小瓶密封并在140℃下搅拌过夜。将反应物冷却并倒入水(100ml)中,并且用乙酸乙酯(2x50ml)萃取。将有机层合并,用水(2x50ml)洗涤,干燥(na2so4),过滤并浓缩。通过硅胶色谱法(40克柱,elsd检测),使用100%己烷至80%乙酸乙酯/己烷梯度来纯化橙色残余物,得到浅黄色固体2,2-二甲基-4-[3-[(6-氨磺酰基吡嗪-2-基)氨基]丙基]吡咯烷-1-甲酸叔丁酯(264mg,55%)。1h nmr(400mhz,dmso-d6)δ8.06(d,j=6.1hz,2h),7.61(s,1h),7.38(s,2h),3.56(q,j=9.7hz,1h),3.31-3.28(m,2h),2.89-2.72(m,1h),2.24-2.03(m,1h),1.90(tt,j=13.7,6.1hz,1h),1.56(dt,j=15.0,6.9hz,2h),1.45(d,j=12.2hz,1h),1.39(d,j=11.2hz,12h),1.34(s,1h),1.29(dd,j=13.7,7.0hz,1h),1.25(s,3h)。esi-ms m/z计算值413.2097,实验值414.4(m 1)
;保留时间:1.62分钟(lc方法a)。
[2296]
步骤3:4-[3-[[6-[(6-叔丁基-2-氟-吡啶-3-羰基)氨磺酰基]吡嗪-2-基]氨基]丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯
[2297][2298]
向圆底烧瓶中添加6-叔丁基-2-氟-吡啶-3-甲酸(227.6mg,1.154mmol)、羰基二咪唑(187.1mg,1.154mmol)和thf(3.7ml)。将反应物用氮气吹扫,并使其在35℃下搅拌4小时。
此时,添加2,2-二甲基-4-[3-[(6-氨磺酰基吡嗪-2-基)氨基]丙基]吡咯烷-1-甲酸叔丁酯(367mg,0.8875mmol)于thf(3.7ml)中的溶液,随后添加dbu(400μl,2.675mmol)。使反应物在室温下搅拌一个周末。通过uplc分析,反应显示所需产物。将反应物用1n柠檬酸淬灭并用etoac萃取三次。有机层经硫酸钠干燥,并蒸发。将粗制油状物溶解于dmf中,并且经由反相色谱法,使用含hcl改性剂的50%-99%acn:h2o进行纯化。分离出呈棕褐色固体状的4-[3-[[6-[(6-叔丁基-2-氟-吡啶-3-羰基)氨磺酰基]吡嗪-2-基]氨基]丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(220mg,42%)。esi-ms m/z计算值592.2843,实验值593.4(m 1)
;保留时间:1.59分钟(lc方法g)。
[2299]
步骤4:6-叔丁基-n-[6-[3-(5,5-二甲基吡咯烷-3-基)丙基氨基]吡嗪-2-基]磺酰基-2-氟-吡啶-3-甲酰胺
[2300][2301]
向含有4-[3-[[6-[(6-叔丁基-2-氟-吡啶-3-羰基)氨磺酰基]吡嗪-2-基]氨基]丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(220mg,0.3712mmol)的圆底烧瓶中添加dcm(3ml)和hcl(3ml,4m,12.00mmol)。在1小时后,将反应物蒸发至干燥并在高真空下放置3小时,得到6-叔丁基-n-[6-[3-(5,5-二甲基吡咯烷-3-基)丙基氨基]吡嗪-2-基]磺酰基-2-氟-吡啶-3-甲酰胺(盐酸盐)(196mg,100%)。esi-ms m/z计算值492.2319,实验值493.4(m 1)
;保留时间:0.37分钟(lc方法g)。
[2302]
步骤5:8-叔丁基-12,12-二甲基-2λ
6-硫杂-3,9,11,18,21,23-六氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮
[2303][2304]
向微波小瓶中添加碳酸钾(512mg,3.705mmol)、分子筛(10件)和6-叔丁基-n-[6-[3-(5,5-二甲基吡咯烷-3-基)丙基氨基]吡嗪-2-基]磺酰基-2-氟-吡啶-3-甲酰胺(盐酸盐)(196mg,0.3705mmol)于nmp(12ml)中的溶液。将反应物在预热的油浴中在150℃下加热过夜。将反应物冷却至室温,用1n hcl淬灭并用etoac萃取。有机层经硫酸钠干燥,蒸发,并且经由反相色谱法,使用含hcl改性剂的20%-99%acn:h2o纯化。分离出呈黄色固体状的8-叔丁基-12,12-二甲基-2λ
6-硫杂-3,9,11,18,21,23-六氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮(91mg,52%)。esi-ms m/z计算值
472.22565,实验值473.4(m 1)
;保留时间:1.27分钟(lc方法g)。
[2305]
步骤6:8-叔丁基-12,12-二甲基-2λ
6-硫杂-3,9,11,18,21,23-六氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮,化合物253(对映异构体1),和8-叔丁基-12,12-二甲基-2λ
6-硫杂-3,9,11,18,21,23-六氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮,化合物252(对映异构体2)
[2306][2307]
使用以下方法对8-叔丁基-12,12-二甲基-2λ
6-硫杂-3,9,11,18,21,23-六氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮(91mg,0.1926mmol)进行手性sfc:chiralpak ig(250x21.2mm,5μm)柱,40℃,流动相22%meoh、78%co2,流速70ml/min,浓度30mg/ml于meoh:dmso(83:17)中,进样体积500μl,压力142巴,波长218nm。分离出两种异构体:
[2308]
对映异构体1,峰1:8-叔丁基-12,12-二甲基-2λ
6-硫杂-3,9,11,18,21,23-六氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮(31.3mg,69%)。esi-ms m/z计算值472.22565,实验值473.1(m 1)
;保留时间:1.91分钟(lc方法a)。
[2309]
对映异构体2,峰2:8-叔丁基-12,12-二甲基-2λ
6-硫杂-3,9,11,18,21,23-六氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮(34.5mg,76%)。esi-ms m/z计算值472.22565,实验值473.1(m 1)
;保留时间:1.91分钟(lc方法a)。
[2310]
实施例74:8-叔丁基-21-羟基-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5,7,9,19,21-六烯-2,2,4-三酮,化合物251(对映异构体1)和化合物250(对映异构体2)的制备
氨基丙基)-2,2-二甲基吡咯烷-1-甲酸叔丁酯(324mg,1.264mmol)、二异丙基乙胺(1.1ml,6.315mmol)和1-丁醇(3.75ml)。将小瓶密封并在140℃下搅拌过夜。uplc显示转化为所需产物。将反应物冷却至室温并倒入水(100ml)中,并用乙酸乙酯(2x50ml)萃取。将有机层合并,用水(2x50ml)洗涤,经硫酸钠干燥,过滤并浓缩。通过硅胶色谱法(40克柱,elsd检测),使用100%己烷至80%乙酸乙酯/己烷梯度来纯化橙色残余物,得到白色泡沫状物4-[3-[(4-苄氧基-6-氨磺酰基-2-吡啶基)氨基]丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(453mg,69%)。esi-ms m/z计算值518.2563,实验值519.4(m 1)
;保留时间:1.96分钟(lc方法a)。
[2316]
步骤2:4-[3-[[4-苄氧基-6-[(6-叔丁基-2-氟-吡啶-3-羰基)氨磺酰基]-2-吡啶基]氨基]丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯
[2317][2318]
向圆底烧瓶中添加6-叔丁基-2-氟-吡啶-3-甲酸(223.8mg,1.135mmol)、羰基二咪唑(184mg,1.135mmol)和thf(4.5ml)。将反应物用氮气吹扫,并使其在35℃下搅拌4小时。此时,添加4-[3-[(4-苄氧基-6-氨磺酰基-2-吡啶基)氨基]丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(453mg,0.8734mmol)于thf(4.5ml)中的溶液,随后添加dbu(400μl,2.675mmol)。使反应物在室温下搅拌一个周末。通过uplc分析,反应显示所需产物。将反应物用1n柠檬酸淬灭并用etoac萃取三次。有机层经硫酸钠干燥,并蒸发。将粗制油状物溶解于dmf中,并且经由反相色谱法,含hcl改性剂的70%-99%acn:h2o进行纯化。分离出呈白色固体状的4-[3-[[4-苄氧基-6-[(6-叔丁基-2-氟-吡啶-3-羰基)氨磺酰基]-2-吡啶基]氨基]丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(170mg,28%)。esi-ms m/z计算值697.33093,实验值698.5(m 1)
;保留时间:1.92分钟(lc方法g)。
[2319]
步骤3:n-[[4-苄氧基-6-[3-(5,5-二甲基吡咯烷-3-基)丙基氨基]-2-吡啶基]磺酰基]-6-叔丁基-2-氟吡啶-3-甲酰胺
[2320][2321]
向含有4-[3-[[4-苄氧基-6-[(6-叔丁基-2-氟-吡啶-3-羰基)氨磺酰基]-2-吡啶基]氨基]丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(170mg,0.2436mmol)的圆底烧瓶中添
加dcm(3ml)和hcl(3ml,4m于二噁烷中,12.00mmol)。在室温下1小时后,将反应物蒸发并在高真空下干燥3小时,得到n-[[4-苄氧基-6-[3-(5,5-二甲基吡咯烷-3-基)丙基氨基]-2-吡啶基]磺酰基]-6-叔丁基-2-氟吡啶-3-甲酰胺(盐酸盐)(154mg,100%)。esi-ms m/z计算值597.2785,实验值598.3(m 1)
;保留时间:0.77分钟(lc方法g)。
[2322]
步骤4:21-(苄氧基)-8-叔丁基-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5,7,9,19,21-六烯-2,2,4-三酮
[2323][2324]
向微波小瓶中添加碳酸钾(336mg,2.431mmol)、分子筛和n-[[4-苄氧基-6-[3-(5,5-二甲基吡咯烷-3-基)丙基氨基]-2-吡啶基]磺酰基]-6-叔丁基-2-氟吡啶-3-甲酰胺(盐酸盐)(154mg,0.2428mmol)于nmp(9.2ml)中的溶液。将反应物在预热的油浴中在150℃下加热过夜。将反应物冷却至室温,用1n hcl淬灭并用etoac萃取。有机层经硫酸钠干燥,蒸发,并且经由反相色谱法,使用含hcl改性剂的40%-99%acn:h2o进行纯化。分离出呈白色固体状的21-(苄氧基)-8-叔丁基-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5,7,9,19,21-六烯-2,2,4-三酮(88mg,63%)。esi-ms m/z计算值577.2723,实验值578.4(m 1)
;保留时间:1.76分钟(lc方法g)。
[2325]
步骤5:8-叔丁基-21-羟基-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5,7,9,19,21-六烯-2,2,4-三酮
[2326][2327]
向21-(苄氧基)-8-叔丁基-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5,7,9,19,21-六烯-2,2,4-三酮(88mg,0.1523mmol)的圆底烧瓶中添加degussa型pd/c湿品(88mg,10%w/w,0.08269mmol)和异丙醇(3ml)。将反应物用氮气吹扫5分钟,并且然后将氢气球添加至反应物中过夜。将反应物过滤并经由反相色谱法(40%-99%acn:h2o,含hcl改性剂)纯化,得到8-叔丁基-21-羟基-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5,7,9,19,21-六烯-2,2,4-三酮(53mg,71%)。esi-ms m/z计算值487.2253,实验值488.4(m 1)
;保留时间:1.17分钟(lc方法g)。
[2328]
步骤6:8-叔丁基-21-羟基-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5,7,9,19,21-六烯-2,2,4-三酮,化合物251(对
映异构体1),和8-叔丁基-21-羟基-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5,7,9,19,21-六烯-2,2,4-三酮,化合物250(对映异构体2)
[2329][2330]
使用以下方法对8-叔丁基-21-羟基-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5,7,9,19,21-六烯-2,2,4-三酮(53mg,0.1087mmol)进行手性sfc:chiralpak ig(250x10mm,5μm)柱,35℃,流动相30%meoh、70%co2,流速10ml/min,浓度23mg/ml于meoh中,进样体积70μl,压力174巴,波长223nm,得到两种对映异构体:
[2331]
首先洗脱的对映异构体1:8-叔丁基-21-羟基-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5,7,9,19,21-六烯-2,2,4-三酮(18.0mg,68%)。esi-ms m/z计算值487.2253,实验值488.1(m 1)
;保留时间:1.83分钟(lc方法a)。
[2332]
第二洗脱的对映异构体2:8-叔丁基-21-羟基-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5,7,9,19,21-六烯-2,2,4-三酮(13.2mg,49%)esi-ms m/z计算值487.2253,实验值488.1(m 1)
;保留时间:1.83分钟(lc方法a)。
[2333]
实施例75:8-叔丁基-12,12-二甲基-18-氧杂-2λ
6-硫杂-3,9,11-三氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮,化合物257(对映异构体1)和化合物256(对映异构体2)的制备
[2334][2335]
步骤1:2,2-二甲基-4-[3-(3-氨磺酰基苯氧基)丙基]吡咯烷-1-甲酸叔丁酯
[2336][2337]
在100ml烧瓶中添加3-羟基苯磺酰胺(350mg,2.021mmol)和dmf(8.0ml)。在室温下向混合物中添加k2co3(850mg,6.150mmol)和2,2-二甲基-4-(3-甲基磺酰氧基丙基)吡咯烷-1-甲酸叔丁酯(675mg,2.012mmol)。将所得混合物加热至50℃,持续18小时。然后将混合物倒入1n柠檬酸中,并用etoac(2x)萃取。将有机级分合并,干燥(硫酸钠),过滤并浓缩,得到黄色油状物,将所述黄色油状物通过硅胶色谱法(80克柱),使用100%己烷至65%乙酸乙酯/己烷梯度进行纯化,得到呈浅黄色泡沫状的2,2-二甲基-4-[3-(3-氨磺酰基苯氧基)丙基]吡咯烷-1-甲酸叔丁酯(341.3mg,41%)。1h nmr(499mhz,dmso-d6)δ7.46(t,j=8.0hz,1h),7.40-7.36(m,1h),7.33(d,j=10.1hz,3h),7.18-7.09(m,1h),4.02(t,j=6.5hz,2h),3.58(q,j=8.6hz,1h),2.81(q,j=11.0hz,1h),2.16(d,j=12.0hz,1h),1.92(ddd,j=18.4,12.1,6.0hz,1h),1.74(dq,j=15.9,6.9hz,2h),1.46(q,j=9.7,8.3hz,3h),1.38(t,
j=12.9hz,12h),1.25(s,3h)。esi-ms m/z计算值412.2032,实验值413.2(m 1)
;保留时间:1.79分钟(lc方法a)。
[2338]
步骤2:4-[3-[3-[(6-叔丁基-2-氟-吡啶-3-羰基)氨磺酰基]苯氧基]丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯
[2339][2340]
向6-叔丁基-2-氟-吡啶-3-甲酸(296mg,1.501mmol)于thf(7ml)中的溶液中添加cdi(255mg,1.573mmol),并且将混合物在室温下搅拌20小时。然后添加2,2-二甲基-4-[3-(3-氨磺酰基苯氧基)丙基]吡咯烷-1-甲酸叔丁酯(341mg,0.8266mmol),随后添加dbu(425μl,2.842mmol),并将所得混合物在室温下搅拌3小时。将反应物用乙酸乙酯稀释,并用饱和碳酸氢钠水溶液洗涤。将有机层进一步用10%柠檬酸溶液洗涤,随后用盐水洗涤。将有机物分离,经硫酸钠干燥,蒸发,并且然后通过硅胶色谱法(80克柱),使用100%己烷至100%乙酸乙酯的梯度纯化,得到呈灰白色固体状的4-[3-[3-[(6-叔丁基-2-氟-吡啶-3-羰基)氨磺酰基]苯氧基]丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(475mg,83%)。esi-ms m/z计算值591.27783,实验值592.2(m 1)
;保留时间:2.31分钟(lc方法a)。
[2341]
步骤3:6-叔丁基-n-[3-[3-(5,5-二甲基吡咯烷-3-基)丙氧基]苯基]磺酰基-2-氟-吡啶-3-甲酰胺
[2342][2343]
将4-[3-[3-[(6-叔丁基-2-氟-吡啶-3-羰基)氨磺酰基]苯氧基]丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(475mg,0.6823mmol)溶解于dcm(9ml)中,并且向混合物中添加tfa(1.5ml,19.47mmol)并在室温下搅拌。在14小时后,将混合物蒸发至干燥,然后用乙醚(30ml x 2)稀释,并再浓缩。然后将材料放置在高真空泵上2小时,得到呈浅黄色油状物的6-叔丁基-n-[3-[3-(5,5-二甲基吡咯烷-3-基)丙氧基]苯基]磺酰基-2-氟-吡啶-3-甲酰胺(三氟乙酸盐)(450mg,98%)。esi-ms m/z计算值491.2254,实验值492.2(m 1)
;保留时间:1.39分钟(lc方法a)。
[2344]
步骤4:8-叔丁基-12,12-二甲基-18-氧杂-2λ
6-硫杂-3,9,11-三氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮
[2345][2346]
向6-叔丁基-n-[3-[3-(5,5-二甲基吡咯烷-3-基)丙氧基]苯基]磺酰基-2-氟-吡啶-3-甲酰胺(三氟乙酸盐)(450mg,0.6687mmol)于nmp(24.36ml)中的溶液中添加碳酸钾(648.7mg,4.694mmol)。将混合物用氮气吹扫5分钟。将混合物在150℃下加热并搅拌过夜。冷却至室温,用etoac稀释,然后用1n hcl洗涤,干燥(硫酸钠),过滤并浓缩,得到棕色油状物,将所述棕色油状物过滤并通过反相hplc-ms方法,使用由phenomenex销售的luna c
18
柱(75
×
30mm,5μm粒度)(pn:00c-4252-u0-ax),和在15.0分钟内从1%-99%流动相b运行的双梯度(流动相a=h2o(5mm hcl),流动相b=乙腈,流速=50ml/min,进样体积=950μl,并且柱温=25℃)进行纯化,得到呈白色固体状的8-叔丁基-12,12-二甲基-18-氧杂-2λ
6-硫杂-3,9,11-三氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮(129.6mg,41%)。esi-ms m/z计算值471.21918,实验值472.3(m 1)
;保留时间:2.08分钟(lc方法a)。
[2347]
步骤5:8-叔丁基-12,12-二甲基-18-氧杂-2λ
6-硫杂-3,9,11-三氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮,化合物257(对映异构体1),和8-叔丁基-12,12-二甲基-18-氧杂-2λ
6-硫杂-3,9,11-三氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮,化合物256(对映异构体2)
[2348][2349]
通过sfc色谱法,使用chiralpak ig(250x21.2mm柱,5μm粒度),用30%meoh/70%co2流动相,以70ml/min历经8.0分钟(进样体积=500μl的32mg/ml于90/10meoh/dmso中的溶液)对8-叔丁基-12,12-二甲基-18-氧杂-2λ
6-硫杂-3,9,11-三氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮(129.6mg,0.2748mmol)进行手性分离,得到两种异构体:
[2350]
首先洗脱的对映异构体1:8-叔丁基-12,12-二甲基-18-氧杂-2λ
6-硫杂-3,9,11-三氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮(57.2mg,88%)。esi-ms m/z计算值471.21918,实验值472.2(m 1)
;保留时间:2.17分钟(lc方法q)。
[2351]
第二洗脱的对映异构体2:8-叔丁基-12,12-二甲基-18-氧杂-2λ
6-硫杂-3,9,11-三氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮(52mg,80%)。esi-ms m/z计算值471.21918,实验值472.2(m 1)
;保留时间:2.19分钟,都呈白色固体状(lc方法q)。
[2352]
实施例76:8-叔丁基-12,12-二甲基-15-氧杂-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5(10),6,8,19(23),20-六烯-2,2,4-三酮,化合物259(对映异构体1)和化合物258(对映异构体2)的制备
[2353][2354]
步骤1:4-[2-[[6-[(6-叔丁基-2-氟-吡啶-3-羰基)氨磺酰基]-2-吡啶基]氨基]乙氧基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯
[2355][2356]
向6-叔丁基-2-氟-吡啶-3-甲酸(51mg,0.2586mmol)于thf(2ml)中的溶液中添加cdi(47mg,0.2899mmol),并且将混合物在室温下搅拌1小时,然后添加2,2-二甲基-4-[2-[(6-氨磺酰基-2-吡啶基)氨基]乙氧基]吡咯烷-1-甲酸叔丁酯(100mg,0.2412mmol),随后添加dbu(120μl,0.8024mmol),并且将所得混合物在室温下搅拌16小时。将反应混合物用饱和氯化铵溶液和盐水的1:1混合物淬灭,并用乙酸乙酯萃取。将合并有机萃取物用盐水洗涤,经硫酸钠干燥,过滤并浓缩。通过硅胶柱色谱法,使用100%己烷至100%etoac的窄梯度来纯化所得棕色残余物,得到呈灰白色固体状的4-[2-[[6-[(6-叔丁基-2-氟-吡啶-3-羰基)氨磺酰基]-2-吡啶基]氨基]乙氧基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(87mg,57%)。esi-ms m/z计算值593.2683,实验值594.54(m 1)
;保留时间:0.57分钟(lc方法g)。
[2357]
步骤2:8-叔丁基-12,12-二甲基-15-氧杂-2λ
6-硫杂-3,9,11,18,23-五氮杂四环
[17.3.1.111,14.05,10]二十四碳-1(22),5(10),6,8,19(23),20-六烯-2,2,4-三酮
[2358][2359]
在室温下,将4-[2-[[6-[(6-叔丁基-2-氟-吡啶-3-羰基)氨磺酰基]-2-吡啶基]氨基]乙氧基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(87mg,0.1465mmol)于1:4tfa(125μl,1.622mmol)和dcm(500μl)的预混合溶液中的溶液搅拌1小时,并在脱保护完成后,移除溶剂。将所得残余物溶解于nmp(2ml)中并添加碳酸钾(174mg,1.259mmol)。将混合物用氮气吹扫5分钟。将混合物在160℃下加热过夜。将混合物冷却至室温,用1n hcl稀释并用etoac(1x)萃取。将有机相用盐水(1x)洗涤,干燥(硫酸钠),过滤并浓缩,得到棕色油状物,将所述棕色油状物过滤并通过反相hplc-ms方法,使用在15.0分钟内30%-99%流动相b运行的双梯度(流动相a=h2o(5mm hcl),流动相b=乙腈)进行纯化,得到呈灰白色固体状的8-叔丁基-12,12-二甲基-15-氧杂-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5(10),6,8,19(23),20-六烯-2,2,4-三酮(42.5mg,61%)。esi-ms m/z计算值473.2097,实验值474.1(m 1)
;保留时间:0.98分钟(lc方法g)。
[2360]
步骤3:8-叔丁基-12,12-二甲基-15-氧杂-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5(10),6,8,19(23),20-六烯-2,2,4-三酮,化合物259(对映异构体1),和8-叔丁基-12,12-二甲基-15-氧杂-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5(10),6,8,19(23),20-六烯-2,2,4-三酮,化合物258(对映异构体2)
[2361][2362]
通过sfc色谱法,使用phenomenex lux-4(250x10mm)5μm粒度柱,在35℃下,用42%meoh(无改性剂)、58%co2流动相以10ml/min流速(浓度23mg/ml于甲醇中,进样体积=70μl,压力178巴,波长210nm)对外消旋8-叔丁基-12,12-二甲基-15-氧杂-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5(10),6,8,19(23),20-六烯-2,2,4-三酮(40mg,0.08446mmol)进行手性分离,得到两种异构体:
[2363]
首先洗脱的对映异构体1:8-叔丁基-12,12-二甲基-15-氧杂-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5(10),6,8,19(23),20-六烯-2,2,4-三酮(18mg,87%)。esi-ms m/z计算值473.2097,实验值474.1(m 1)
;保留时间:1.71分钟(lc方法g)。
[2364]
第二洗脱的对映异构体2:8-叔丁基-12,12-二甲基-15-氧杂-2λ
6-硫杂-3,9,11,
18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5(10),6,8,19(23),20-六烯-2,2,4-三酮(16mg,80%)。esi-ms m/z计算值473.2097,实验值474.3(m 1)
;保留时间:1.71分钟(lc方法g)。
[2365]
实施例77:(5s)-11-叔丁基-7,7-二甲基-17λ
6-硫杂-1,8,10,16-四氮杂五环[16.5.2.15,8.09,14.021,24]二十六碳-9(14),10,12,18,20,22,24-七烯-15,17,17-三酮,化合物260的制备
[2366][2367]
步骤1:6-叔丁基-2-氯-n-(1h-吲哚-6-磺酰基)吡啶-3-甲酰胺
[2368][2369]
向6-叔丁基-2-氯-吡啶-3-甲酸(108mg,0.5055mmol)于thf(2ml)中的溶液中添加cdi(87mg,0.5365mmol),并且将混合物在室温下搅拌1小时,然后添加1h-吲哚-6-磺酰胺(100mg,0.5096mmol),随后添加dbu(230μl,1.538mmol),并且将所得混合物在室温下搅拌16小时。将反应混合物用饱和氯化铵和盐水的1:1混合物淬灭,并用乙酸乙酯萃取。将有机相用1m柠檬酸溶液洗涤,随后用盐水洗涤。将有机物分离,经硫酸钠干燥并蒸发。通过硅胶柱色谱法,使用100%己烷至100%etoac的窄梯度来纯化所得棕色残余物,得到呈白色固体状的6-叔丁基-2-氯-n-(1h-吲哚-6-磺酰基)吡啶-3-甲酰胺(120mg,61%)。esi-ms m/z计算值391.07574,实验值392.2(m 1)
;保留时间:0.36分钟(lc方法i)。
[2370]
步骤2:(4s)-4-[3-[6-[(6-叔丁基-2-氯-吡啶-3-羰基)氨磺酰基]吲哚-1-基]丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯
[2371][2372]
向(4s)-2,2-二甲基-4-(3-甲基磺酰氧基丙基)吡咯烷-1-甲酸叔丁酯(104mg,
0.3100mmol)于dmf(3ml)中的溶液中添加6-叔丁基-2-氯-n-(1h-吲哚-6-磺酰基)吡啶-3-甲酰胺(120mg,0.3062mmol)和碳酸铯(308mg,0.9453mmol)并将反应混合物在70℃下加热24小时。将混合物倒在碎冰上,并且通过过滤收集所得白色固体并干燥,得到(4s)-4-[3-[6-[(6-叔丁基-2-氯-吡啶-3-羰基)胺磺酰基]吲哚-1-基]丙基]-2,2-二甲基-吡咯啶-1-甲酸第三丁酯(152mg,78%)。esi-ms m/z计算值630.2643,实验值631.5(m 1)
;保留时间:0.7分钟(lc方法i)。
[2373]
步骤3:(5s)-11-叔丁基-7,7-二甲基-17λ
6-硫杂-1,8,10,16-四氮杂五环[16.5.2.15,8.09,14.021,24]二十六碳-9(14),10,12,18,20,22,24-七烯-15,17,17-三酮,化合物260
[2374][2375]
向(4s)-4-[3-[6-[(6-叔丁基-2-氯-吡啶-3-羰基)氨磺酰基]吲哚-1-基]丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(150mg,0.2376mmol)于nmp(2ml)中的溶液中添加碳酸钾(267mg,1.932mmol)。将混合物用氮气吹扫5分钟。将混合物在160℃下加热4天。将混合物冷却至室温,用1n hcl稀释并用etoac(1x)萃取。将有机相用盐水(1x)洗涤,干燥(硫酸钠),过滤并浓缩,得到棕色油状物,将所述棕色油状物过滤并通过使用反相hplc-ms方法,使用在15.0分钟内30%-99%流动相b运行的双梯度(流动相a=h2o(5mm hcl),流动相b=乙腈)进行纯化,得到呈灰白色固体状的(5s)-11-叔丁基-7,7-二甲基-17λ
6-硫杂-1,8,10,16-四氮杂五环[16.5.2.15,8.09,14.021,24]二十六碳-9(14),10,12,18,20,22,24-七烯-15,17,17-三酮(5.8mg,5%)。1h nmr(499mhz,dmso-d6)δ12.31(s,1h),7.95(d,j=1.5hz,1h),7.77(d,j=8.4hz,1h),7.67-7.65(m,1h),7.53(d,j=7.9hz,1h),6.63(d,j=7.9hz,2h),6.59(d,j=3.1hz,1h),4.52(dt,j=14.2,4.8hz,1h),4.25-4.18(m,1h),3.00(t,j=7.8hz,1h),2.13(d,j=11.5hz,2h),1.70-1.62(m,1h),1.53(s,3h),1.45-1.34(m,4h),1.24(d,j=6.6hz,15h),0.86(dt,j=10.8,7.2hz,1h)。esi-ms m/z计算值494.23517,实验值495.14(m 1)
;保留时间:1.61分钟(lc方法g)。
[2376]
实施例78:(14s)-8-叔丁基-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮,化合物296的制备
[2377][2378]
步骤1:(4s)-4-[3-[[6-[(6-叔丁基-2-氯-吡啶-3-羰基)氨磺酰基]-2-吡啶基]氨基]丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯
[2379][2380]
向6-叔丁基-2-氯-吡啶-3-甲酸(200mg,0.9361mmol)于thf(8ml)中的溶液中添加cdi(155mg,0.9559mmol)(从thf再结晶),并将混合物在室温下搅拌2小时,然后添加(4s)-2,2-二甲基-4-[3-[(6-氨磺酰基-2-吡啶基)氨基]丙基]吡咯烷-1-甲酸叔丁酯(231mg,0.5599mmol),随后添加dbu(275μl,1.839mmol),并且将所得混合物在室温下搅拌16小时。将反应物用乙酸乙酯稀释,并用饱和碳酸氢钠水溶液洗涤,并且然后将有机相萃取并用盐水洗涤。将有机物分离,经硫酸钠干燥,蒸发并且然后通过硅胶色谱法(80克柱),使用100%己烷至100%乙酸乙酯梯度,随后通过第二硅胶柱(40克柱),使用100%二氯甲烷至15%甲醇/二氯甲烷梯度进行纯化,得到呈灰白色固体状的(4s)-4-[3-[[6-[(6-叔丁基-2-氯-吡啶-3-羰基)氨磺酰基]-2-吡啶基]氨基]丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(205mg,60%)。1h nmr(500mhz,dmso-d6)δ12.68(s,1h),7.89(t,j=7.5hz,1h),7.61(t,j=7.9hz,1h),7.52(dd,j=8.0,2.1hz,1h),7.18(dd,j=18.9,8.2hz,2h),6.74(d,j=8.5hz,1h),3.53(ddd,j=26.7,10.5,7.4hz,1h),3.37(s,2h),3.25(d,j=5.5hz,2h),2.76(q,j=10.5hz,1h),2.14-1.99(m,1h),1.84(ddd,j=18.1,12.0,6.0hz,1h),1.49(tt,j=12.8,6.8hz,2h),1.37(d,j=11.7hz,9h),1.34-1.30(m,4h),1.28(s,9h),1.21(s,3h)。esi-ms m/z计算值607.2595,实验值608.5(m 1)
;保留时间:2.27分钟(lc方法a)。
[2381]
步骤2:(14s)-8-叔丁基-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环
[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮,化合物296
[2382][2383]
阶段1:将(4s)-4-[3-[[6-[(6-叔丁基-2-氯-吡啶-3-羰基)氨磺酰基]-2-吡啶基]氨基]丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(195mg,0.3206mmol)溶解于dcm(9ml)中,并且向混合物中添加hcl(4m于二噁烷中)(2.5ml,4m,10.00mmol)并在室温下搅拌。将混合物蒸发至干,然后放置在高真空泵上2小时,得到中间体6-叔丁基-2-氯-n-[[6-[3-[(3s)-5,5-二甲基吡咯烷-3-基]丙基氨基]-2-吡啶基]磺酰基]吡啶-3-甲酰胺(盐酸盐),esi-ms m/z计算值507.2071,实验值508.2(m 1)
;保留时间:1.29分钟(lc方法a),呈灰白色固体状。
[2384]
阶段2:来自阶段1的材料与k2co3(500mg,3.618mmol)、分子筛和dmso(6ml)合并于小瓶中,用氮气吹扫,封盖,加热至165℃并搅拌60小时。冷却至室温,并将混合物过滤,并且在氮气流下浓缩,得到残余物,将所述残余物通过反相制备型色谱法,利用c
18
柱和在15分钟内30%-99%乙腈/水( 5mm hcl)的梯度进行纯化,得到灰白色固体(14s)-8-叔丁基-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮(盐酸盐)(70mg,43%)。1h nmr(500mhz,dmso-d6)δ12.45(s,1h),7.63-7.52(m,2h),7.05(d,j=7.2hz,2h),6.72(d,j=8.5hz,1h),6.63(d,j=8.0hz,1h),3.91(d,j=13.9hz,1h),3.07(s,1h),2.93(dt,j=13.7,3.7hz,1h),2.73-2.59(m,1h),2.10(s,1h),1.80(dd,j=11.9,5.5hz,2h),1.61(s,3h),1.55(dd,j=31.2,11.5hz,3h),1.48(s,3h),1.30(td,j=9.7,8.1,3.1hz,1h),1.27(s,9h)。esi-ms m/z计算值471.2304,实验值472.2(m 1)
;保留时间:2.02分钟(lc方法a)。
[2385]
实施例79:(18s)-11,11,16,16-四甲基-2λ
6-硫杂-3,13,15,22,27-五氮杂五环[21.3.1.115,18.05,14.07,12]二十八碳-1(27),5(14),6,12,23,25-六烯-2,2,4-三酮,化合物265的制备
[2386][2387]
步骤1:2-氯-8,8-二甲基-6,7-二氢-5h-喹啉-3-甲酸
[2388][2389]
将氢氧化钾(3.81g,67.97mmol)于水(12.50ml)中的溶液添加到2-氯-8,8-二甲基-6,7-二氢-5h喹啉-3-甲腈(2.5g,11.33mmol)于异丙醇(12.50ml)中的溶液中。使反应混合物在预热的90℃油浴中搅拌过夜。在冷却到室温之后,将反应混合物浓缩并酸化至ph约3。将沉淀过滤,用水洗涤,并且在真空烘箱中干燥过夜,得到白色固体。2-氯-8,8-二甲基-6,7-二氢-5h-喹啉-3-甲酸(2.5g,91%)。1h nmr(400mhz,dmso)δ13.45(s,1h),7.89(s,1h),2.75(s,2h),1.73(s,4h),1.25(s,6h)。esi-ms m/z计算值239.0713,实验值240.0(m 1)
;保留时间:1.48分钟(lc方法a)。
[2390]
步骤2:(4s)-4-[3-[[6-[(2-氯-8,8-二甲基-6,7-二氢-5h-喹啉-3-羰基)氨磺酰基]-2-吡啶基]氨基]丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯
[2391][2392]
向2-氯-8,8-二甲基-6,7-二氢-5h-喹啉-3-甲酸(95mg,0.3963mmol)于thf(4ml)中的溶液中添加cdi(65mg,0.4009mmol),并将混合物在室温下搅拌14小时,然后添加(4s)-2,2-二甲基-4-[3-[(6-氨磺酰基-2-吡啶基)氨基]丙基]吡咯烷-1-甲酸叔丁酯(125mg,0.3030mmol),随后添加dbu(150μl,1.003mmol),并且将所得混合物在室温下搅拌16小时。将反应物用乙酸乙酯稀释,并用饱和碳酸氢钠水溶液洗涤,并且然后将有机相萃取并用盐水洗涤。将有机物分离,经硫酸钠干燥,蒸发,并且然后将残余物通过反相制备型色谱法,使用c
18
柱和在30分钟内30%-80%乙腈/水( 5mm hcl)的梯度纯化,得到(4s)-4-[3-[[6-[(2-氯-8,8-二甲基-6,7-二氢-5h-喹啉-3-羰基)氨磺酰基]-2-吡啶基]氨基]丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(86mg,45%)。esi-ms m/z计算值633.27515,实验值634.2(m 1)
;保留时间:2.29分钟,呈灰白色固体状(lc方法a)。
[2393]
步骤3:(18s)-11,11,16,16-四甲基-2λ
6-硫杂-3,13,15,22,27-五氮杂五环[21.3.1.115,18.05,14.07,12]二十八碳-1(27),5(14),6,12,23,25-六烯-2,2,4-三酮,化合物265
[2394][2395]
阶段1:将(4s)-4-[3-[[6-[(2-氯-8,8-二甲基-6,7-二氢-5h-喹啉-3-羰基)氨磺酰基]-2-吡啶基]氨基]丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(86mg,0.1356mmol)溶解于dcm(3ml)中,并且向混合物中添加tfa(500μl,6.490mmol),并且将反应物在室温下搅拌。在2小时后,将混合物蒸发至干燥,然后用乙醚(30ml x 2)稀释,并再浓缩。然后将材料放置在高真空泵上2小时,得到中间体2-氯-n-[[6-[3-[(3s)-5,5-二甲基吡咯烷-3-基]丙基氨基]-2-吡啶基]磺酰基]-8,8-二甲基-6,7-二氢-5h-喹啉-3-甲酰胺,esi-ms m/z计算值533.2227,实验值534.2(m 1)
;保留时间:1.34分钟,呈浅棕色固体状。阶段2:来自阶段1的材料与k2co3(205mg,1.483mmol)、分子筛和nmp(4ml)合并于小瓶中,用氮气吹扫,封盖,加热至170℃并搅拌84小时。冷却至室温,并将混合物用乙酸乙酯和水稀释。将有机层萃取
(2x)并用10%柠檬酸溶液进一步洗涤,随后用盐水洗涤。将有机物分离,经硫酸钠干燥,蒸发至浅棕色油状物。该残余物通过反相制备型色谱法,利用c
18
柱和在15分钟内10%-99%乙腈/水( 5mm hcl)的梯度进行纯化,得到呈白色固体状的(18s)-11,11,16,16-四甲基-2λ
6-硫杂-3,13,15,22,27-五氮杂五环[21.3.1.115,18.05,14.07,12]二十八碳-1(27),5(14),6,12,23,25-六烯-2,2,4-三酮(7.79mg,11%)。1h nmr(499mhz,dmso-d6)δ12.34(s,1h),7.56(dd,j=8.5,7.1hz,1h),7.30(s,1h),7.04(d,j=7.1hz,1h),6.95(d,j=8.9hz,1h),6.70(d,j=8.4hz,1h),3.91(d,j=11.7hz,1h),3.08(s,1h),2.98-2.89(m,1h),2.69-2.62(m,2h),2.58-2.52(m,1h),2.14-2.03(m,1h),1.79(dd,j=11.7,5.4hz,1h),1.70(dt,j=14.9,4.8hz,4h),1.67-1.62(m,1h),1.59(s,3h),1.56(dd,j=11.7,4.7hz,2h),1.50(d,j=12.3hz,1h),1.46(s,3h),1.29(s,3h),1.25(dd,j=13.8,4.9hz,1h),1.15(s,3h)。esi-ms m/z计算值497.24606,实验值498.2(m 1)
;保留时间:2.04分钟(lc方法a)。
[2396]
实施例80:(14s)-8-叔丁基-12,12-二甲基-2λ
6-硫杂-3,7,9,11,18,23-六氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮,化合物11的制备
[2397][2398]
步骤1:2-叔丁基-4-羟基-嘧啶-5-甲酸甲酯
[2399][2400]
向2,2-二甲基丙脒(盐酸盐)(35g,256.18mmol)于meoh(560ml)中的溶液中添加甲醇钠(14g,259.15mmol),并将溶液在室温下搅拌15分钟。向其中添加2-(甲氧基亚甲基)丙二酸二甲酯(44.6g,256.10mmol)于meoh(20ml)中的溶液,并将溶液在室温下搅拌45分钟,然后回流1小时。将悬浮液冷却至室温并浓缩。将油状物质溶解于h2o(875ml)中,并用acoh将ph调节至3(ph试纸)。通过过滤收集沉淀的固体,用h2o(250ml)洗涤并干燥。得到呈白色固体状的2-叔丁基-4-羟基-嘧啶-5-甲酸甲酯(25.18g,47%)。esi-ms m/z计算值
210.1004,实验值211.2(m 1)
;保留时间:1.32分钟。将水性滤液用dcm(6x30ml)萃取。将合并的有机层用盐水洗涤,经硫酸钠干燥,过滤并减压浓缩。所得半固体由mtbe(60ml)研磨。得到呈白色固体状的2-叔丁基-4-羟基-嘧啶-5-甲酸甲酯(4.65g,9%)。esi-ms m/z计算值210.1004,实验值211.2(m 1)
;保留时间:1.32分钟(lc方法e)。
[2401]
步骤2:2-叔丁基-4-氯-嘧啶-5-甲酸甲酯
[2402][2403]
向冰冷(0-5℃)的氧氯化磷(20.892g,12.7ml,136.25mmol)中逐滴添加三乙胺(166.98mg,230μl,1.6502mmol),随后添加2-叔丁基-4-羟基-嘧啶-5-甲酸甲酯(20.5g,97.415mmol)。然后将混合物升温至80℃,持续5小时。将反应混合物冷却至室温,减压浓缩,用dcm(110ml)稀释,并缓慢倒入冰(约440g)和水(90ml)上。将所得混合物在室温下搅拌,直到冰全部融化。分离有机相,并用dcm(2x50ml)萃取水相。将合并的有机层用碳酸氢钠(100ml)、盐水(150ml)洗涤,经硫酸钠干燥,过滤并减压浓缩。得到呈黄色固体状的2-叔丁基-4-氯-嘧啶-5-甲酸甲酯(21.2g,95%)。1h nmr(400mhz,dmso-d6)δ9.14(s,1h),3.90(s,3h),1.35(s,9h)。esi-ms m/z计算值228.0666,实验值229.1(m 1)
;保留时间:4.49分钟(lc方法f)。
[2404]
步骤3:2-叔丁基-4-氯-嘧啶-5-甲酸
[2405][2406]
向2-叔丁基-4-氯-嘧啶-5-甲酸甲酯(10.96g,47.928mmol)于thf(120ml)和水(120ml)中的溶液中添加氢氧化锂水合物(3g,71.491mmol),并且将反应物在室温下搅拌0.5小时。添加1n hcl水溶液,直至达到ph=2并且在减压下移除挥发物。然后使用混合物chcl3/meoh 3:1v/v(4x100ml)萃取产物。合并的有机层经硫酸钠干燥,过滤并减压浓缩,得到呈白色固体状的2-叔丁基-4-氯-嘧啶-5-甲酸(10.1g,96%)。1h nmr(400mhz,dmso-d6)δ13.95(br.s.,1h),9.11(s,1h),1.35(s,9h)。esi-ms m/z计算值214.0509,实验值215.1(m 1)
;保留时间:4.11分钟(lc方法a)。
[2407]
步骤4:(4s)-4-[3-[[6-[(2-叔丁基-4-氯-嘧啶-5-羰基)氨磺酰基]-2-吡啶基]氨基]丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯
[2408][2409]
在氮气下,向圆底烧瓶中装入2-叔丁基-4-氯-嘧啶-5-甲酸(500mg,2.3294mmol)和四氢呋喃(4ml)。添加1,1'-羰基二咪唑(380mg,2.3435mmol),并且将混合物在室温下在
氮气下搅拌2小时(通过lcms测定在氢氧化铵中淬灭的等分试样完全转化)。在单独的烧瓶中,在氮气气氛下制备(4s)-2,2-二甲基-4-[3-[(6-甲基磺酰基-2-吡啶基)氨基]丙基]吡咯烷-1-甲酸叔丁酯(300mg,0.7272mmol)于无水四氢呋喃(2ml)中的溶液,并且随后将其经由注射器添加到活化溶液中。通过注射器添加1,8-二氮杂双环[5.4.0]十一碳-7-烯(0.3ml,2.0061mmol),并将反应混合物在氮气气氛下在室温下搅拌2小时。之后,减压移除溶剂,并且将所得浓稠油状物用乙酸乙酯(40ml)和水(25ml)处理。将水相用乙酸乙酯(30ml)萃取。将合并的有机层用1n hcl水溶液(20ml)、盐水(20ml)洗涤,并经硫酸钠干燥。粗产物通过反相色谱法,使用80g筒柱,用mecn/水(含0.1%甲酸)的梯度洗脱(50%为5个柱体积,然后在20cv中为50%至100%)直接纯化,得到呈浅黄色固体状的(4s)-4-[3-[[6-[(2-叔丁基-4-氯-嘧啶-5-羰基)氨磺酰基]-2-吡啶基]氨基]丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(850mg,59%)。1h nmr(400mhz,dmso-d6)δ12.80(br.s.,1h),8.89(s,1h),7.61(t,j=7.8hz,1h),7.21(br.s.,1h),7.16(d,j=7.3hz,1h),6.74(d,j=8.6hz,1h),3.58-3.45(m,1h),3.24-3.20(m,2h),2.76(q,j=10.2hz,1h),2.12-1.98(m,1h),1.89-1.82(m,1h),1.57-1.44(m,2h),1.43-1.26(m,24h),1.22(s,3h)。esi-ms m/z计算值608.2548,实验值553.2(m-55) ;保留时间:2.32分钟(lc方法e)。
[2410]
步骤5:2-叔丁基-4-氯-n-[[6-[3-[(3s)-5,5-二甲基吡咯烷-3-基]丙基氨基]-2-吡啶基]磺酰基]嘧啶-5-甲酰胺
[2411][2412]
在圆底烧瓶中,在室温下将(4s)-4-[3-[[6-[(2-叔丁基-4-氯-嘧啶-5-羰基)氨磺酰基]-2-吡啶基]氨基]丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(250mg,0.4042mmol)在二氯甲烷(2ml)和hcl(1.5ml,4m于二噁烷中,6.0000mmol)中搅拌2小时。将溶剂蒸发,得到呈黄色固体状的2-叔丁基-4-氯-n-[[6-[3-[(3s)-5,5-二甲基吡咯烷-3-基]丙基氨基]-2-吡啶基]磺酰基]嘧啶-5-甲酰胺(盐酸盐)(250mg,91%)。esi-ms m/z计算值508.2023,实验值509.2(m 1)
;保留时间:1.44分钟(lc方法e)。
[2413]
步骤6:(14s)-8-叔丁基-12,12-二甲基-2λ
6-硫杂-3,7,9,11,18,23-六氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮,化合物11
[2414][2415]
将2-叔丁基-4-氯-n-[[6-[3-[(3s)-5,5-二甲基吡咯烷-3-基]丙基氨基]-2-吡啶基]磺酰基]嘧啶-5-甲酰胺(二盐酸盐)(250mg,0.3694mmol)溶解于n-甲基-2-吡咯烷酮(nmp)(3ml)中。添加碳酸钾(320mg,2.3154mmol)和氟化铯(60mg,0.3950mmol)。将管密封,
并将混合物在150℃下加热2小时。将反应混合物通过反相色谱法(c
18
,50g),使用5%至100%乙腈/水和5%至100%乙腈/水(含0.1%甲酸)的梯度直接纯化两次,得到呈浅棕色固体状的(14s)-8-叔丁基-12,12-二甲基-2λ
6-硫杂-3,7,9,11,18,23-六氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮(23mg,13%)。1h nmr(400mhz,dmso-d6,80℃)δ8.29(s,1h),7.59-7.55(m,1h),7.09(d,j=7.3hz,1h),6.82(br.s.,1h),6.73(d,j=8.3hz,1h),3.88-3.79(m,2h),3.42-3.28(m,2h),3.06-3.00(m,1h),2.83(t,j=10.5hz,1h),2.23-2.11(m,1h),1.93-1.89(m,1h),1.85-1.74(m,1h),1.68-1.53(m,9h),1.34(s,9h)。esi-ms m/z计算值472.2257,实验值473.2(m 1)
;保留时间:3.03分钟(lc方法f)。
[2416]
实施例81:(14s)-8-叔丁基-17-(4-叔丁基吡啶-2-基)-12,12-二甲基-2λ
6-硫杂-3,7,9,11,18,23-六氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮,化合物2(非对映异构体1)和化合物1(非对映异构体2)的制备
[2417][2418]
步骤1:(4s)-4-[3-[[6-[(2-叔丁基-4-氯-嘧啶-5-羰基)氨磺酰基]-2-吡啶基]氨基]-3-(4-叔丁基-2-吡啶基)丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯
[2419]
[2420]
在氮气下,向圆底烧瓶中装入2-叔丁基-4-氯-嘧啶-5-甲酸(284mg,1.3231mmol)和四氢呋喃(8ml)。添加1,1'-羰基二咪唑(271mg,1.6713mmol),并且将混合物在室温下在氮气下搅拌3小时30分钟。在单独的烧瓶中,在氮气气氛下制备(4s)-4-[3-(4-叔丁基-2-吡啶基)-3-[(6-氨磺酰基-2-吡啶基)氨基]丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(731mg,1.3395mmol)于四氢呋喃(5.4ml)中的溶液,并且随后将其添加到活化溶液中。添加1,8-二氮杂双环[5.4.0]十一碳-7-烯(578.22mg,568μl,3.7982mmol),并将反应混合物在氮气气氛下在室温下搅拌3小时。减压移除溶剂,并且将所得浓稠油状物用乙酸乙酯(30ml)和水(20ml)处理。将水相用乙酸乙酯(20ml)萃取。将合并的有机层用1n hcl水溶液(20ml)洗涤,并经硫酸钠干燥。粗产物在c
18
上通过反相色谱法(80g,用50%至100%乙腈/水洗脱)纯化。将产物级分合并,并且减压移除有机溶剂。将剩余的水性混合物用乙酸乙酯(2x25ml)萃取。合并的有机层经无水硫酸钠干燥,过滤并减压浓缩,得到呈米色固体状的(4s)-4-[3-[[6-[(2-叔丁基-4-氯-嘧啶-5-羰基)氨磺酰基]-2-吡啶基]氨基]-3-(4-叔丁基-2-吡啶基)丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(516mg,53%)。1h nmr(400mhz,dmso-d6)δ8.77(d,j=4.2hz,1h),8.40(d,j=5.4hz,1h),7.46(t,j=7.8hz,1h),7.41(s,1h),7.28-7.10(m,2h),7.02(d,j=7.1hz,1h),6.60(br.s.,1h),5.03(br.s.,1h),3.94-3.55(m,1h),3.52-3.38(m,1h),2.74-2.60(m,1h),2.04-1.90(m,2h),1.88-1.67(m,3h),1.42-1.12(m,35h)。esi-ms m/z计算值741.3439,实验值742.2(m 1)
;保留时间:2.07分钟(lc方法e)。
[2421]
步骤2:2-叔丁基-n-[[6-[[1-(4-叔丁基-2-吡啶基)-3-[(3s)-5,5-二甲基吡咯烷-3-基]丙基]氨基]-2-吡啶基]磺酰基]-4-氯-嘧啶-5-甲酰胺
[2422][2423]
将hcl(于二噁烷中)(2.2ml,4m,8.8000mmol)添加到(4s)-4-[3-[[6-[(2-叔丁基-4-氯-嘧啶-5-羰基)氨磺酰基]-2-吡啶基]氨基]-3-(4-叔丁基-2-吡啶基)丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(444mg,0.5981mmol)于二氯甲烷(7ml)中的溶液中。将反应混合物在室温下搅拌3小时。将溶剂蒸发,得到呈米色固体状的2-叔丁基-n-[[6-[[1-(4-叔丁基-2-吡啶基)-3-[(3s)-5,5-二甲基吡咯烷-3-基]丙基]氨基]-2-吡啶基]磺酰基]-4-氯-嘧啶-5-甲酰胺(三盐酸盐)(495mg,80%)。esi-ms m/z计算值641.2915,实验值642.2(m 1)
;保留时间:1.4分钟(lc方法e)。粗产物不经进一步纯化即用于下一步。
[2424]
步骤3:(14s)-8-叔丁基-17-(4-叔丁基吡啶-2-基)-12,12-二甲基-2λ
6-硫杂-3,7,9,11,18,23-六氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮
[2425][2426]
将2-叔丁基-n-[[6-[[1-(4-叔丁基-2-吡啶基)-3-[(3s)-5,5-二甲基吡咯烷-3-基]丙基]氨基]-2-吡啶基]磺酰基]-4-氯-嘧啶-5-甲酰胺(三盐酸盐)(495mg,0.4801mmol)溶解于n-甲基-2-吡咯烷酮(10ml)中。添加碳酸钾(516mg,3.7336mmol)和氟化铯(97mg,0.6386mmol)。将混合物在150℃下加热2小时。将反应混合物与50mg规模运行的另一反应混合物合并,并在下一步中进行处理。
[2427]
步骤4:(14s)-8-叔丁基-17-(4-叔丁基吡啶-2-基)-12,12-二甲基-2λ
6-硫杂-3,7,9,11,18,23-六氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮,化合物2(非对映异构体1)和(14s)-8-叔丁基-17-(4-叔丁基吡啶-2-基)-12,12-二甲基-2λ
6-硫杂-3,7,9,11,18,23-六氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮,化合物1(非对映异构体2)
[2428][2429]
合并来自步骤3的两种反应混合物,并在c
18
上通过反相色谱法(120g,用5%至100%乙腈/水 0.1%hcooh)纯化并冷冻干燥,得到呈米色固体状的(13s)-22-(叔丁基)-8-(4-(叔丁基)吡啶-2-基)-15,15-二甲基-5-硫杂-4,7-二氮杂-2(4,5)-嘧啶杂-6(2,6)-吡啶杂-1(1,3)-吡咯烷杂环十蕃(pyrrolidinacyclodecaphan)-3-酮5,5-二氧化物(195mg,52%)。非对映异构体的混合物在waters xselect csh柱(75x30mm,5um)上通过制备型hplc,使用水(10mm nh4hco2)/mecn(100%保持3分钟,然后历经1分钟线性梯度至40%mecn,然后历经11分钟线性梯度至60%mecn,然后历经2分钟线性梯度至95%mecn,保持2分钟)纯化,并冷冻干燥,得到两种异构体:
[2430]
非对映异构体1:呈白色蓬松固体状的(13s)-22-(叔丁基)-8-(4-(叔丁基)吡啶-2-基)-15,15-二甲基-5-硫杂-4,7-二氮杂-2(4,5)-嘧啶杂-6(2,6)-吡啶杂-1(1,3)-吡咯烷杂环十蕃-3-酮5,5-二氧化物(异构体1,首先洗脱的产物)(62mg,21%)。1h nmr(400mhz,dmso-d6)δ8.39(d,j=5.1hz,1h),8.25(s,1h),8.13(s,1h),7.52(t,j=7.8hz,1h),7.49(d,j=1.7hz,1h),7.20(dd,j=5.3,1.6hz,1h),7.11-7.02(m,2h),6.76(d,j=8.3hz,1h),5.39-5.29(m,1h),3.61-3.53(m,1h),2.94(t,j=10.9hz,1h),2.29-2.15(m,1h),2.01-1.91(m,2h),1.88(dd,j=11.9,5.3hz,1h),1.73-1.44(m,9h),1.32(s,9h),1.25(s,9h),esi-ms m/z计算值605.3148,实验值606.3(m 1)
;保留时间:2.64分钟(lc方法f)。
[2431]
非对映异构体2:呈白色蓬松固体状的(13s)-22-(叔丁基)-8-(4-(叔丁基)吡啶-2-基)-15,15-二甲基-5-硫杂-4,7-二氮杂-2(4,5)-嘧啶杂-6(2,6)-吡啶杂-1(1,3)-吡咯烷杂环十蕃-3-酮5,5-二氧化物(异构体2,第二洗脱的产物)(67mg,22%)。1h nmr(400mhz,dmso-d6)δ8.47(d,j=5.1hz,1h),8.13(s,1h),8.08(s,1h),7.53-7.45(m,2h),7.27(dd,j=5.3,1.8hz,1h),7.16(d,j=6.8hz,1h),6.92(br.s.,1h),6.73(d,j=8.3hz,1h),5.09-5.01(m,1h),3.77(br.s.,1h),3.48-3.37(m,1h),2.23(br.s.,1h),2.01(d,j=6.8hz,2h),1.85(dd,j=11.9,6.0hz,1h),1.73-1.44(m,8h),1.31(d,j=4.4hz,18h),1.22-1.11(m,1h)。esi-ms m/z计算值605.3148,实验值606.3(m 1)
;保留时间:2.56分钟(lc方法f)。
[2432]
实施例82:(18s)-11,11,16,16-四甲基-21-(吡啶-2-基)-10-氧杂-2λ
6-硫杂-3,13,15,22,27-五氮杂五环[21.3.1.115,18.05,14.07,12]二十八碳-1(27),5(14),6,12,23,25-六烯-2,2,4-三酮,化合物213(非对映异构体1)和化合物212(非对映异构体2)的制备
[2433][2434]
步骤1:2-氟-8,8-二甲基-6,8-二氢-5h-吡喃并[3,4-b]吡啶-3-甲酸的制备
[2435]
阶段a:5-溴-6-氯吡啶-2-胺的合成
[2436][2437]
将2-氨基-6-氯吡啶(2.00g,15.6mmol)于乙腈(20ml)中的溶液用n-溴代丁二酰亚胺(3.10g,17.4mmol)处理,并用铝箔覆盖在室温下搅拌隔夜。然后将固体倾析并用另一部分乙腈(15ml)洗涤。减压移除挥发物,并将残余物在120g柱上,从0%至40%etoac/庚烷洗脱进行纯化,得到呈白色固体状的5-溴-6-氯吡啶-2-胺(1.75g,54%产率)。1h nmr(300mhz,dmso-d6)δ6.33(d,j=8.5hz,1h),6.58(s,2h),7.61(d,j=8.5hz,1h)。[m h]
=207.0。
[2438]
阶段b:3-溴-2-氯-6-氟吡啶的合成
[2439][2440]
将5-溴-6-氯吡啶-2-胺(3.00g,14.5mmol)于氟化氢吡啶(72ml约70%hf)中的溶液在冰浴中冷却,并用固体亚硝酸钠(1.20g,17.4mmol)逐份处理。然后使反应物在3-4小时内逐渐温热至室温。通过缓慢添加碳酸氢钠水溶液(750ml)进行淬灭,添加固体碳酸氢钠以确保水溶液维持约8的ph。将不透明水层用水(100ml)转移到2.0-l分液漏斗中,并用etoac(3x200ml)萃取。将合并的有机层用水、盐水洗涤,经na2so4干燥,过滤并减压浓缩,得到呈琥珀色油状物并且仍含吡啶(约17%)的粗制3-溴-2-氯-6-氟吡啶(2.91g,96%产率)。1h nmr(300mhz,cdcl3)δ6.81(ddd,j=8.4,3.4,0.9hz,1h),7.99(ddd,j=8.4,7.0,0.9hz,1h)。
19
f nmr(282mhz,cdcl3)δ-69.1(d,j=4.6hz,1f)。该材料不经进一步纯化即用于下一步。
[2441]
阶段c:2-(2-氯-6-氟吡啶-3-基)乙酸酯的合成
[2442][2443]
有机锌试剂的制备:向火焰干燥的烧瓶中添加锌粉(7.36g,113mmol),并且将烧瓶在氮气下再次火焰干燥。冷却后,用thf(27ml)覆盖锌。添加氯三甲基硅烷(0.75ml),并使用加热枪将烧瓶加热至接近thf的沸点。冷却后,将烧瓶置于设定为40℃的油浴中,并用2-溴乙酸乙酯(9.40g,56.3mmol)于thf(70ml)中的溶液处理一小时。在油浴中再继续搅拌30分钟,然后将烧瓶移开并停止搅拌,以使残留的锌沉淀于烧瓶底部,由此得到有机锌浓度为约0.5-0.6m的澄清黄色溶液。
[2444]
向另一个火焰干燥的烧瓶中添加3-溴-2-氯-6-氟吡啶(1.50g,7.13mmol)和thf(20ml)。将溶液用氮气鼓泡约5分钟,然后添加4,5-双(二苯基膦基)-9,9-二甲基氧杂蒽(xantphos,206mg,0.356mmol),随后添加双(二亚芐基丙酮)钯(0)(205mg,0.356mmol)。然后添加先前制备的有机锌试剂的溶液(43ml,0.5m于thf中,21.5mmol),将烧瓶密封并在70℃油浴中加热19小时。注意:使用3-溴-2-氯-6-氟吡啶(1.365g,6.49mmol)并按照与刚刚所阐述反应类似的程序,并行地设置另一反应。
[2445]
通过缓慢添加5%碳酸氢钠水溶液(约50ml)淬灭两种粗制反应物,并将混合物转移到具有更多5%碳酸氢钠水溶液(约400ml)的1.0-l分液漏斗中。然后用etoac(3x200ml)
萃取水层。将合并的有机层用水(100ml)、盐水洗涤,经硫酸钠干燥,过滤并减压浓缩。残余物在120g柱上酮硅胶色谱法,用从0%至20%etoac/庚烷洗脱来纯化,得到呈黄色油状物的2-(2-氯-6-氟吡啶-3-基)乙酸酯(2.225g,75%产率)。1h nmr(300mhz,cdcl3)δ1.27(t,j=7.1hz,1h),3.75(s,2h),4.19(q,j=7.1hz,2h),6.88(dd,j=8.1,3.1hz,1h),7.75(t,j=7.9,1h)。[m h]
=218.1。
[2446]
阶段d:2-(2-氯-6-氟吡啶-3-基)乙醇的合成
[2447][2448]
在0℃下,向2-(2-氯-6-氟吡啶-3-基)乙酸乙酯(2.225g,10.23mmol)于四氢呋喃(17ml)和甲醇(1.7ml)中的溶液中以若干份添加硼氢化锂(370mg,15.3mmol)。然后将混合物升温至室温,并在氮气气氛下搅拌过夜。完成之后,将混合物冷却至0℃,并且通过添加饱和氯化铵水溶液将混合物的ph调节至约7。将水层用乙酸乙酯(2x50ml)萃取,并且合并的有机层经硫酸钠干燥,过滤并减压浓缩。在高真空下进一步干燥之后,获得呈黄色油状物的纯2-(2-氯-6-氟吡啶-3-基)乙醇(1.64g,91%产率)。1h nmr(300mhz,cdcl3)δ2.98(t,j=6.4hz,2h),3.92(t,j=6.4hz,2h),6.85(dd,j=8.0,3.2hz,1h),7.75(t,j=8.0hz,1h)。
19
f nmr(282mhz,cdcl3)δ-69.5(d,j=5.4hz,1f)。[m h]
=176.1。
[2449]
阶段e:2-(6-氟-2-(丙-1-烯-2-基)吡啶-3-基)乙醇的合成
[2450][2451]
向圆底烧瓶中装入2-(2-氯-6-氟吡啶-3-基)乙醇(1.64g,9.34mmol)、异丙烯基硼酸频哪醇酯(1.93ml,10.3mmol)、碳酸钠(3.0g,28mmol)、四(三苯基膦)钯(1.08g,0.934mmol)、二噁烷(47ml)和水(18ml)。在氮气气氛下,将混合物在100℃下加热16小时。冷却后,将反应混合物用乙酸乙酯(50ml)稀释,转移到分液漏斗中,并用水(20ml)和盐水(20ml)洗涤。有机层经硫酸钠干燥,过滤并减压浓缩。残余物通过硅胶柱色谱法,用0%至60%乙酸乙酯/庚烷洗脱来纯化,得到呈黄色油状物的2-(6-氟-2-(丙-1-烯-2-基)吡啶-3-基)乙醇(1.57g,93%产率)。1h nmr(300mhz,cdcl3)δ2.09-2.12(m,3h),2.96(t,j=6.7hz,2h),3.82(t,j=6.7hz,2h),5.00-5.05(m,1h),5.34-5.38(m,1h),6.78(dd,j=8.3,3.4hz,1h),7.71(t,j=8.2hz,1h)。
19
f nmr(282mhz,cdcl3)δ-70.9(d,j=5.8hz,1f)。[m h]
=182.1。
[2452]
阶段f.2-氟-8-(碘甲基)-8-甲基-6,8-二氢-5h-吡喃并[3,4-b]吡啶的合成
[2453][2454]
在氮气气氛下,在0℃下向含有碳酸氢钠(2.43g,28.9mmol)的2-(6-氟-2-(丙-1-烯-2-基)吡啶-3-基)乙醇(1.57g,8.66mmol)于乙腈(66ml)中的搅拌溶液中分数份添加碘
(7.32g,28.9mmol),并将混合物在室温下搅拌过夜。完成之后,添加10%硫代硫酸钠(50ml),并用乙酸乙酯(50ml)萃取水层。然后将有机层用盐水(30ml)洗涤,经硫酸钠干燥,过滤并减压浓缩。残余物通过硅胶柱色谱法,用0%至20%乙酸乙酯/庚烷洗脱来纯化,得到呈黄色油状物的2-氟-8-(碘甲基)-8-甲基-6,8-二氢-5h-吡喃并[3,4-b]吡啶(1.81g,68%产率)。1h nmr(300mhz,cdcl3)δ1.65(s,3h),2.62-2.75(m,1h),3.93-4.06(m,1h),3.58(d,j=10.3hz,1h),3.78(d,j=10.3hz,1h),3.85-3.94(m,1h),3.98-4.07(m,1h),6.77(dd,j=8.2,2.9hz,1h),7.51(t,j=8.2hz,1h)。
19
f nmr(282mhz,cdcl3)δ-70.0(d,j=6.2hz,1f)。[m h]
=308.0。
[2455]
阶段g.2-氟-8,8-二甲基-6,8-二氢-5h-吡喃并[3,4-b]吡啶的合成
[2456][2457]
向2-氟-8-(碘甲基)-8-甲基-6,8-二氢-5h-吡喃并[3,4-b]吡啶(1.81g,5.89mmol)于四氢呋喃(42ml)中的搅拌溶液中添加雷尼镍(8g),并将混合物在室温下搅拌2天(在用氮气吹扫后用塑料隔片密封烧瓶)。再添加雷尼镍(8g)并再搅拌一天。完成之后,混合物经硅藻土过滤,并用乙酸乙酯洗涤。减压移除溶剂,并将混合物用乙酸乙酯(50ml)稀释。将有机层用水(20ml)、盐水(20ml)洗涤,经硫酸钠干燥,过滤并减压浓缩,得到呈黄色油状物的粗制2-氟-8,8-二甲基-6,8-二氢-5h-吡喃并[3,4-b]吡啶(900mg,84%产率),其不经进一步纯化即直接用于下一步。[m h]
=182.1。注意:该化合物看来具有挥发性并且不应长时间保持在高真空下。
[2458]
阶段h.2-氟-8,8-二甲基-6,8-二氢-5h-吡喃并[3,4-b]吡啶-3-甲酸的合成
[2459][2460]
在氮气气氛下,在-78℃下历经10分钟向二异丙胺(0.78ml,5.41mmol)于四氢呋喃(11ml)中的溶液中添加正丁基锂(2.16ml,2.5m于己烷中,5.41mmol),使内部温度维持在-60℃以下。然后将混合物在0℃下搅拌15分钟,然后冷却回到-78℃。在10分钟内向该混合物中添加2-氟-8,8-二甲基-6,8-二氢-5h-吡喃并[3,4-b]吡啶(1.07g,5.41mmol)于四氢呋喃(3.0ml)中的溶液,将内部温度维持在-65℃。将反应物在-78℃下搅拌4小时,然后添加一粒干冰(用氮气吹干)。将混合物搅拌一小时,然后逐渐升温至室温过夜(注意:由于升温至室温后会散发出大量二氧化碳气体,故反应烧瓶用隔片封盖并且在顶部有空气球)。完成之后,将反应物用水(10ml)稀释,并用甲基叔丁基甲基二乙醚(2x10ml)萃取。将水层用1.0n hcl酸化至ph 4-5,并用乙酸乙酯(2x20ml)萃取。合并的有机层经硫酸钠干燥,过滤并减压浓缩。通过硅胶柱色谱法,用含有1%甲酸的100%乙酸乙酯洗脱来纯化产物。将收集的级分在压力下浓缩,并且将残余物再溶解于乙酸乙酯(20ml)中。然后用饱和碳酸氢钠(20ml)萃取溶液。收集水层,用3.0n hcl酸化至约4的ph,并用乙酸乙酯(20ml)再次萃取。将溶剂减压移除,得到呈灰白色固体状的2-氟-8,8-二甲基-6,8-二氢-5h-吡喃并[3,4-b]吡啶-3-甲酸(280mg,23%产率)。1h nmr(300mhz,cdcl3)δ1.56(s,6h),2.90(t,j=5.4hz,2h),3.98(t,j
=5.6hz,2h),8.16(d,j=9.0hz,1h)。
19
f nmr(282mhz,cdcl3)δ-64.7(d,j=7.6hz,1f)。[m h]
=226.1。
[2461]
步骤2:(4s)-4-[3-[[6-[(2-氟-8,8-二甲基-5,6-二氢吡喃并[3,4-b]吡啶-3-羰基)氨磺酰基]-2-吡啶基]氨基]-3-(2-吡啶基)丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯
[2462][2463]
向2-氟-8,8-二甲基-5,6-二氢吡喃并[3,4-b]吡啶-3-甲酸(195mg,0.8658mmol)于thf(5ml)中的溶液中添加cdi(145mg,0.8942mmol),并且将混合物在室温下搅拌20小时。然后添加(4s)-2,2-二甲基-4-[3-(2-吡啶基)-3-[(6-氨磺酰基-2-吡啶基)氨基]丙基]吡咯烷-1-甲酸叔丁酯(235mg,0.4800mmol),随后添加dbu(350μl,2.340mmol),并将所得混合物在室温下搅拌18小时。将反应物用乙酸乙酯稀释,并用饱和碳酸氢钠水溶液洗涤。将有机层进一步用10%柠檬酸溶液洗涤,随后用盐水洗涤。将有机物分离,经硫酸钠干燥并蒸发。然后通过反相制备型色谱法,使用c
18
柱和在15分钟内1%-99%乙腈-水( 5mm hcl)的梯度来纯化粗物质,得到呈白色固体状的(4s)-4-[3-[[6-[(2-氟-8,8-二甲基-5,6-二氢吡喃并[3,4-b]吡啶-3-羰基)氨磺酰基]-2-吡啶基]氨基]-3-(2-吡啶基)丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(302mg,90%)的非对映异构体对。esi-ms m/z计算值696.31055,实验值696.2(m 1)
;保留时间:1.58分钟(lc方法a)。
[2464]
步骤3:(18s)-11,11,16,16-四甲基-21-(吡啶-2-基)-10-氧杂-2λ
6-硫杂-3,13,15,22,27-五氮杂五环[21.3.1.115,18.05,14.07,12]二十八碳-1(27),5(14),6,12,23,25-六烯-2,2,4-三酮,化合物213(非对映异构体1),和(18s)-11,11,16,16-四甲基-21-(吡啶-2-基)-10-氧杂-2λ
6-硫杂-3,13,15,22,27-五氮杂五环[21.3.1.115,18.05,14.07,12]二十八碳-1(27),5(14),6,12,23,25-六烯-2,2,4-三酮,化合物212(非对映异构体2)
[2465][2466]
阶段1:将(4s)-4-[3-[[6-[(2-氟-8,8-二甲基-5,6-二氢吡喃并[3,4-b]吡啶-3-羰基)氨磺酰基]-2-吡啶基]氨基]-3-(2-吡啶基)丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(302mg,0.4334mmol)溶解于dcm(10ml)中,并且向混合物中添加tfa(1.25ml,16.22mmol),并且将反应物在室温下搅拌。在1小时后,反应完成。将混合物蒸发至干燥,然
后用乙醚(30ml x 2)稀释,并再浓缩。然后将材料置于高真空泵上2小时,得到呈棕褐色残余物的中间体n-[[6-[[3-[(3s)-5,5-二甲基吡咯烷-3-基]-1-(2-吡啶基)丙基]氨基]-2-吡啶基]磺酰基]-2-氟-8,8-二甲基-5,6-二氢吡喃并[3,4-b]吡啶-3-甲酰胺。esi-ms m/z计算值596.2581,实验值597.2(m 1)
;保留时间:0.83分钟(lc方法a)。
[2467]
阶段2:将来自阶段1的中间体与k2co3(700mg,5.065mmol)、分子筛和nmp(8ml)合并于小瓶中,用氮气吹扫,封盖,加热至150℃并搅拌18小时。冷却至室温,并将混合物用乙酸乙酯和水稀释。将有机层萃取(2x)并用10%柠檬酸溶液进一步洗涤,随后用盐水洗涤。将有机物分离,经硫酸钠干燥,蒸发至浅棕色油状物。利用c
18
柱和历经15分钟1%-99%乙腈/水( 5mm hcl)梯度对残余物进行反相制备型色谱法,得到呈白色固体状的异构体产物:
[2468]
首先洗脱的非对映异构体1:(18s)-11,11,16,16-四甲基-21-(吡啶-2-基)-10-氧杂-2λ
6-硫杂-3,13,15,22,27-五氮杂五环[21.3.1.115,18.05,14.07,12]二十八碳-1(27),5(14),6,12,23,25-六烯-2,2,4-三酮(67.3mg,52%)。1h nmr(500mhz,dmso-d6)δ12.59(s,1h),8.80(dd,j=5.7,1.6hz,1h),8.50(t,j=8.0hz,1h),8.20(d,j=8.3hz,2h),7.90(t,j=6.7hz,1h),7.74(dd,j=8.5,7.3hz,1h),7.36(d,j=7.3hz,1h),7.27(s,1h),6.99(d,j=8.5hz,1h),5.15(s,1h),3.81(td,j=5.5,2.3hz,2h),3.27(s,1h),2.64(qt,j=15.8,5.5hz,3h),2.29(s,1h),2.13(d,j=11.1hz,1h),1.85(dd,j=11.8,5.7hz,1h),1.82-1.72(m,1h),1.49(d,j=7.2hz,6h),1.46(s,3h),1.45-1.38(m,1h),1.37(s,3h),1.35-1.20(m,1h),1.20-1.10(m,1h)。esi-ms m/z计算值576.2519,实验值577.3(m 1)
;保留时间:1.26分钟(lc方法a)。
[2469]
第二洗脱的非对映异构体2:(18s)-11,11,16,16-四甲基-21-(吡啶-2-基)-10-氧杂-2λ
6-硫杂-3,13,15,22,27-五氮杂五环[21.3.1.115,18.05,14.07,12]二十八碳-1(27),5(14),6,12,23,25-六烯-2,2,4-三酮(44.1mg,34%)。1h nmr(500mhz,dmso-d6)δ12.50(s,1h),8.83(dd,j=5.8,1.6hz,1h),8.52(t,j=7.9hz,1h),8.18(d,j=8.5hz,1h),8.11(d,j=8.1hz,1h),7.90(t,j=6.7hz,1h),7.74(dd,j=8.5,7.3hz,1h),7.46(s,1h),7.21(d,j=7.2hz,1h),7.00(d,j=8.4hz,1h),5.57(t,j=11.7hz,1h),3.87-3.78(m,2h),3.44(t,j=8.2hz,1h),2.74(dt,j=15.8,5.4hz,1h),2.71-2.58(m,2h),2.46(dd,j=17.5,5.0hz,1h),2.12-2.04(m,2h),1.81(ddd,j=24.1,13.5,5.1hz,2h),1.62(s,3h),1.57(d,j=12.5hz,1h),1.53(s,3h),1.49(d,j=10.3hz,1h),1.46(s,3h),1.36(s,3h)。esi-ms m/z计算值576.2519,实验值577.3(m 1)
;保留时间:1.39分钟(lc方法a)。
[2470]
实施例83:(18s)-11,11,16,16-四甲基-21-(吡啶-2-基)-2λ
6-硫杂-3,13,15,22,27-五氮杂五环[21.3.1.115,18.05,14.07,12]二十八碳-1(27),5(14),6,12,23,25-六烯-2,2,4-三酮,化合物264(非对映异构体1)和化合物263(非对映异构体2)的制备
[2471][2472]
步骤1:(4s)-4-[3-[[6-[(2-氯-8,8-二甲基-6,7-二氢-5h-喹啉-3-羰基)氨磺酰基]-2-吡啶基]氨基]-3-(2-吡啶基)丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯
[2473][2474]
向2-氯-8,8-二甲基-6,7-二氢-5h-喹啉-3-甲酸(115mg,0.4798mmol)于thf(4ml)中的溶液中添加cdi(82mg,0.5057mmol),并将混合物在室温下搅拌14小时,然后添加(4s)-2,2-二甲基-4-[3-(2-吡啶基)-3-[(6-氨磺酰基-2-吡啶基)氨基]丙基]吡咯烷-1-甲酸叔丁酯(180mg,0.3676mmol),随后添加dbu(180μl,1.204mmol),并且将所得混合物在室温下搅拌16小时。将反应物用乙酸乙酯稀释,并用饱和碳酸氢钠水溶液洗涤。将有机层进一步用10%柠檬酸溶液洗涤,随后用盐水洗涤。将有机物分离,经硫酸钠干燥,蒸发,并且然后将残余物通过反相制备型色谱法,使用c
18
柱和在15分钟内10%-99%乙腈/水( 5mm hcl)的梯度纯化,得到呈灰白色固体状的(4s)-4-[3-[[6-[(2-氯-8,8-二甲基-6,7-二氢-5h-喹啉-3-羰基)氨磺酰基]-2-吡啶基]氨基]-3-(2-吡啶基)丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(153mg,59%)。esi-ms m/z计算值710.3017,实验值711.2(m 1)
;保留时间:1.84分钟(lc方法a)。
[2475]
步骤2:(18s)-11,11,16,16-四甲基-21-(吡啶-2-基)-2λ
6-硫杂-3,13,15,22,27-五氮杂五环[21.3.1.115,18.05,14.07,12]二十八碳-1(27),5(14),6,12,23,25-六烯-2,2,4-三酮,化合物264(非对映异构体1),和(18s)-11,11,16,16-四甲基-21-(吡啶-2-基)-2λ
6-硫杂-3,13,15,22,27-五氮杂五环[21.3.1.115,18.05,14.07,12]二十八碳-1(27),5
(14),6,12,23,25-六烯-2,2,4-三酮,化合物263(非对映异构体2)
[2476][2477]
阶段1:将(4s)-4-[3-[[6-[(2-氯-8,8-二甲基-6,7-二氢-5h-喹啉-3-羰基)氨磺酰基]-2-吡啶基]氨基]-3-(2-吡啶基)丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(126mg,0.1771mmol)溶解于dcm(3ml)中,并且向混合物中添加tfa(500μl,6.490mmol)并在室温下搅拌。在2小时后,反应完成。将混合物蒸发至干燥,然后用乙醚(30ml x 2)稀释,并再浓缩。然后将材料置于高真空泵上2小时,得到呈灰白色固体状的中间体2-氯-n-[[6-[[3-[(3s)-5,5-二甲基吡咯烷-3-基]-1-(2-吡啶基)丙基]氨基]-2-吡啶基]磺酰基]-8,8-二甲基-6,7-二氢-5h-喹啉-3-甲酰胺。esi-ms m/z计算值610.24927,实验值611.2(m 1)
;保留时间:1.13分钟(lc方法a)。
[2478]
阶段2:来自阶段1的材料与k2co3(275mg,1.990mmol)、分子筛和nmp(4ml)合并于小瓶中,用氮气吹扫,封盖,加热至170℃并搅拌84小时。冷却至室温,并将混合物用乙酸乙酯和水稀释。将有机层萃取(2x)并用10%柠檬酸溶液进一步洗涤,随后用盐水洗涤。将有机物分离,经硫酸钠干燥,蒸发至浅棕色油状物。通过反相制备型色谱法,使用c
18
柱和在15分钟内20%-80%乙腈/水( 5mm hcl)的梯度来纯化该残余物,得到两种产物:
[2479]
非对映异构体1,极性较大,棕褐色固体:(18s)-11,11,16,16-四甲基-21-(吡啶-2-基)-2λ
6-硫杂-3,13,15,22,27-五氮杂五环[21.3.1.115,18.05,14.07,12]二十八碳-1(27),5(14),6,12,23,25-六烯-2,2,4-三酮(盐酸盐)(14.33mg,26%)。1h nmr(499mhz,dmso-d6)δ12.38(s,1h),8.72(d,j=5.4hz,1h),8.26(s,1h),7.87(d,j=94.5hz,2h),7.70(t,j=7.8hz,2h),7.31(d,j=7.1hz,1h),7.19(s,1h),6.94(d,j=8.3hz,1h),5.07(s,1h),3.19(s,1h),2.82(s,1h),2.66-2.56(m,2h),2.56-2.52(m,1h),2.28(d,j=17.0hz,1h),2.15(s,1h),1.84(dd,j=11.8,5.8hz,1h),1.77-1.66(m,5h),1.54(d,j=12.6hz,6h),1.48(d,j=11.6hz,1h),1.27(s,3h),1.22(d,j=5.2hz,1h),1.19(s,3h)。esi-ms m/z计算值574.2726,实验值575.2(m 1)
;保留时间:1.51分钟(lc方法a)。
[2480]
非对映异构体2,极性较低,棕褐色固体:(18s)-11,11,16,16-四甲基-21-(吡啶-2-基)-2λ
6-硫杂-3,13,15,22,27-五氮杂五环[21.3.1.115,18.05,14.07,12]二十八碳-1(27),5(14),6,12,23,25-六烯-2,2,4-三酮(盐酸盐)(12.77mg,23%)。1h nmr(499mhz,dmso-d6)δ12.39(s,1h),8.80-8.64(m,1h),8.27(s,1h),7.90(d,j=9.0hz,2h),7.70(dd,j=8.5,7.3hz,2h),7.34(s,1h),7.17(d,j=7.3hz,1h),6.94(d,j=8.4hz,1h),5.43(s,1h),3.30(dd,j=9.6,7.0hz,1h),2.71-2.62(m,2h),2.59-2.50(m,2h),2.35(p,j=1.9hz,1h),2.04-1.93(m,2h),1.82(dd,j=11.6,5.2hz,1h),1.79-1.69(m,4h),1.64(s,4h),1.54(t,j=12.4hz,1h),1.48(s,3h),1.31(s,3h),1.16(s,3h)。esi-ms m/z计算值574.2726,实验值575.2(m 1)
;保留时间:1.68分钟(lc方法a)。
[2481]
实施例84:(14s)-8-叔丁基-12,12-二甲基-17-(丙-2-烯-1-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮,化合物35(非对映异构体1)和化合物34(非对映异构体2)的制备
[2482][2483]
步骤1:(4s)-4-[3-(叔丁基亚磺酰基氨基)己-5-烯基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯
[2484][2485]
使用干冰/丙酮浴将(4s)-4-[(3e)-3-叔丁基亚磺酰基亚氨基丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(10.5g,29.286mmol)于无水thf(175ml)中的溶液冷却至-70℃,并搅拌10分钟。然后添加烯丙基氯化镁(88ml,2m于thf中,176.00mmol),并将溶液在干冰/乙腈浴中升高至-40℃并搅拌1小时。添加饱和nh4cl水溶液(200ml),然后将溶液升温至室温。添加etoac(200ml)和水(100ml)以进行分配。将水溶液用etoac(2x150ml)萃取。将合并的有机层用盐水洗涤,经无水na2so4干燥,过滤并减压浓缩。所得的粗产物通过快速色谱法(装载sio2)(220g sio2,从0至50%乙酸乙酯/己烷洗脱)纯化,得到呈浅金色凝胶状的(4s)-4-[3-(叔丁基亚磺酰基氨基)己-5-烯基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(11.56g,99%)。esi-ms m/z计算值400.276,实验值401.3(m 1)
;保留时间:6.36分钟(lc方法c)。
[2486]
步骤2:(4s)-4-(3-氨基己-5-烯基)-2,2-二甲基-吡咯烷-1-甲酸叔丁酯
[2487][2488]
将(4s)-4-[3-(叔丁基亚磺酰基氨基)己-5-烯基l]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(11.497g,28.698mmol)溶解于thf(110ml)和水(18ml)中。然后添加分子碘(2.2g,0.4462ml,8.6679mmol),并将溶液在52℃下搅拌3小时。将溶液冷却至室温,然后在etoac(250ml)和含na2s2o3(75g)的饱和碳酸氢钠水溶液(250ml)间分配。分离各层,并用etoac(2x150ml)萃取水层。将有机层合并,用盐水洗涤,经无水硫酸钠干燥,并减压浓缩,得到呈金色凝胶状的粗制(4s)-4-(3-氨基己-5-烯基)-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(10.077g,116%)。esi-ms m/z计算值296.2464,实验值297.4(m 1)
;保留时间:2.5分钟(lc方法b)。
[2489]
步骤3:(4s)-2,2-二甲基-4-[3-[(6-氨磺酰基-2-吡啶基)氨基]己-5-烯基]吡咯烷-1-甲酸叔丁酯
[2490][2491]
向溶解于无水dmso(32ml)中的粗制(4s)-4-(3-氨基己-5-烯基)-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(10.77g,36.330mmol)和6-氟吡啶-2-磺酰胺(10.880g,61.761mmol)的混合物中添加diea(21ml,120.56mmol)。将溶液在115℃下搅拌68小时,然后冷却至室温,并且然后用水(300ml)和etoac(250ml)稀释。分离各层,并用etoac(2x150ml)萃取水层。将有机层合并并用盐水(2x150ml)洗涤,经无水na2so4干燥,并减压浓缩。粗产物通过快速色谱法(装载sio2)(330g sio2,从0至50%丙酮/己烷洗脱)纯化,并且然后通过快速色谱法(装载sio2)(330g sio2,从0-50%丙酮/己烷洗脱)纯化,得到呈灰白色固体状的(4s)-2,2-二甲基-4-[3-[(6-氨磺酰基-2-吡啶基)氨基]己-5-烯基]吡咯烷-1-甲酸叔丁酯(7.945g,45%)。1h nmr(500mhz,dmso-d6)δ7.53-7.46(m,1h),7.06(s,2h),6.97-6.91(m,1h),6.83(d,j=8.2hz,1h),6.62(d,j=8.4hz,1h),5.89-5.77(m,1h),5.10-4.97(m,2h),4.07(d,j=8.0hz,1h),3.58
–
3.46(m,1h),2.81
–
2.71(m,1h),2.26(dtd,j=20.7,13.8,6.6hz,2h),2.05(d,j=6.1hz,1h),1.95-1.77(m,1h),1.59-1.42(m,2h),1.40(s,6h),1.38-1.31(m,9h),1.23(s,3h)。esi-ms m/z计算值452.2457,实验值453.1(m 1)
;保留时间:2.81分钟(lc方法h)。
[2492]
步骤4:(4s)-4-[3-[[6-[(6-叔丁基-2-氟-吡啶-3-羰基)氨磺酰基]-2-吡啶基]氨基]己-5-烯基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯
[2493][2494]
在250-ml圆底烧瓶中,将6-叔丁基-2-氟-吡啶-3-甲酸(4.0091g,20.33mmol)溶解于thf(100ml)中,向其中添加cdi(3.5g,21.59mmol)。将所得混合物在室温下搅拌14小时。此后,添加(4s)-2,2-二甲基-4-[3-[(6-氨磺酰基-2-吡啶基)氨基]己-5-烯基]吡咯烷-1-甲酸叔丁酯(5g,10.61mmol)和dbu(6ml,40.12mmol),并将所得混合物在室温下搅拌24小时。此后,将混合物真空浓缩。然后,将其用etoac(300ml)稀释。然后将该混合物用饱和碳酸氢钠水溶液(200ml)、hcl水溶液(0.1n,200ml)和饱和nacl水溶液(300ml)洗涤,然后经na2so4干燥,过滤并真空蒸发。通过硅胶色谱法(220g二氧化硅),使用0至100%etoac/己烷的梯度洗脱进行纯化,得到黄色泡沫(4s)-4-[3-[[6-[(6-叔丁基-2-氟-吡啶-3-羰基)氨磺酰基]-2-吡啶基]氨基]己-5-烯基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(6.56g,98%)esi-ms m/z计算值631.3204,实验值632.4(m 1)
;保留时间:2.27分钟和2.30分钟(lc方法a)。
[2495]
步骤5:(14s)-8-叔丁基-12,12-二甲基-17-(丙-2-烯-1-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮,化合物35(非对映异构体1),和(14s)-8-叔丁基-12,12-二甲基-17-(丙-2-烯-1-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮,化合物34(非对映异构体2)
[2496][2497]
阶段1:在20-ml小瓶中,将(4s)-4-[3-[[6-[(6-叔丁基-2-氟-吡啶-3-羰基)氨磺酰基]-2-吡啶基]氨基]己-5-烯基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(2300mg,3.640mmol)溶解于二氯甲烷(30ml)中。添加tfa(5ml,64.90mmol),并使所得溶液在室温下静置12小时。然后将混合物真空蒸发,用二噁烷稀释,并再次真空蒸发。这得到黄色油状物,约4100mg(>100%产率)。
[2498]
阶段2:在100-ml圆底烧瓶中,将来自步骤1的粗产物溶解于nmp(35ml)中,向其中添加k2co3(8g,57.88mmol)。将所得混合物用氮气冲洗,然后在150℃下搅拌17小时。在冷却至室温之后,将所得混合物倒入hcl水溶液(1n;80ml),然后用etoac(2
×
80ml)萃取。将合并的有机萃取物用h2o(80ml)和饱和nacl水溶液(80ml)洗涤,然后经na2so4干燥,过滤并真空蒸发。通过硅胶色谱法(220g二氧化硅),使用1%至30%etoac/己烷的梯度洗脱来进行纯化,充分地分离非对映异构体。收集纯级分并合并混合级分,以备将来可能再纯化。二氧化
硅上极性较小的峰被指定为峰1并且极性较大的峰被指定为峰2。
[2499]
非对映异构体1,“峰1”:(14s)-8-叔丁基-12,12-二甲基-17-(丙-2-烯-1-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮(522mg,56%)。1h nmr(400mhz,dmso-d6)δ12.40(s,1h),7.57(dd,j=8.5,7.3hz,1h),7.40(d,j=7.9hz,1h),7.20(dd,j=11.8,7.2hz,2h),6.72(d,j=8.5hz,1h),6.61(d,j=7.9hz,1h),5.90-5.75(m,1h),5.04-4.92(m,2h),3.42(s,1h),3.17(s,1h),2.86(s,1h),2.33-2.08(m,3h),1.82(dd,j=11.8,5.8hz,1h),1.52(m,9h),1.26(m,10h),1.19-1.08(m,1h)。esi-ms m/z计算值511.26172,实验值512.3(m 1)
;保留时间:2.14分钟(lc方法a)。
[2500]
非对映异构体2,“峰2”:(14s)-8-叔丁基-12,12-二甲基-17-(丙-2-烯-1-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮(566.2mg,61%)。1h nmr(400mhz,dmso-d6)δ12.40(s,1h),7.57(dd,j=8.5,7.3hz,1h),7.40(d,j=7.9hz,1h),7.20(dd,j=11.8,7.2hz,2h),6.72(d,j=8.5hz,1h),6.61(d,j=7.9hz,1h),5.90-5.75(m,1h),5.04-4.92(m,2h),3.42(s,1h),3.17(s,1h),2.86(s,1h),2.33-2.08(m,3h),1.82(dd,j=11.8,5.8hz,1h),1.52(m,9h),1.26(m,10h),1.19-1.08(m,1h)。esi-ms m/z计算值511.26172,实验值512.3(m 1)
;保留时间:2.13分钟(lc方法a)。
[2501]
实施例85:(14s)-8-叔丁基-17-(2,3-二羟丙基)-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮,化合物33(对映异构体1)、化合物32(对映异构体2)、化合物30(对映异构体3)和化合物31(对映异构体4)的制备
[2502][2503]
步骤1:(14s)-8-叔丁基-17-(2,3-二羟丙基)-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮,化合物33(对映异构体1),和(14s)-8-叔丁基-17-(2,3-二羟丙基)-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮,化合物32(对映异构体2)
[2504][2505]
在氮气下,将4-甲基-4-氧代-吗啉-4-鎓(20mg,0.1707mmol)和锇酸钾(vi)二水合
物(4mg,0.01086mmol)添加到1打兰小瓶中。添加含(14s)-8-叔丁基-12,12-二甲基-17-(丙-2-烯-1-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮(化合物34(非对映异构体2),50mg,0.09772mmol)的丙酮(1ml),随后添加水(100μl)。搅拌过夜(得到深黑色溶液)。用硫代硫酸钠和水淬灭。倒入dcm中并使用ptfe玻璃料分离。反萃取一次。蒸发掉挥发物,并将粗产物溶解于dmso中,并且经由制备型hplc(c
18
acn/水hcl改性剂,15分钟0-99%乙腈梯度)进行纯化。蒸发纯级分后,分离出两种异构体:
[2506]
峰1,对映异构体1:(14s)-8-叔丁基-17-(2,3-二羟丙基)-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮(1.0mg,2%)。esi-ms m/z计算值545.2672,实验值546.2(m 1)
;保留时间:1.76分钟。(lc方法a)。
[2507]
峰2,对映异构体2:(14s)-8-叔丁基-17-(2,3-二羟丙基)-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮(2.3mg,4%)。esi-ms m/z计算值545.2672,实验值546.27(m 1)
;保留时间:1.8分钟(lc方法a)。
[2508]
步骤2:(14s)-8-叔丁基-17-(2,3-二羟丙基)-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮,化合物30(对映异构体3),和(14s)-8-叔丁基-17-(2,3-二羟丙基)-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮,化合物31(对映异构体4)
[2509][2510]
在氮气下,将4-甲基-4-氧代-吗啉-4-鎓(12mg,0.1024mmol)和锇酸钾(vi)二水合物(2mg,0.005428mmol)添加到1打兰小瓶中。添加含(14s)-8-叔丁基-12,12-二甲基-17-(丙-2-烯-1-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮(化合物35(非对映异构体1),25mg,0.04886mmol)的丙酮(5ml),随后添加水(125μl)。搅拌过夜。用硫代硫酸钠和水淬灭。倒入dcm中并使用ptfe玻璃料分离。反萃取一次。蒸发掉挥发物。将粗产物溶解于dmso中,并且经由制备型hplc(c
18
acn/水hcl改性剂,15分钟0-99%acn梯度)进行纯化。蒸发纯级分后,分离出两种异构体:
[2511]
峰1(在uplc上的保留时间较短),对映异构体3:(14s)-8-叔丁基-17-(2,3-二羟丙基)-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮(6.8mg,26%)。esi-ms m/z计算值545.2672,实验值546.5(m 1)
;保留时间:1.64分钟(lc方法a)。
[2512]
峰2,对映异构体4:(14s)-8-叔丁基-17-(2,3-二羟丙基)-12,12-二甲基-2λ
6-硫
杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮(4.9mg,18%)。esi-ms m/z计算值545.2672,实验值546.5(m 1)
;保留时间:1.66分钟(lc方法a)。
[2513]
实施例86:(14s)-8-叔丁基-17-[(2e)-4-羟基-4-甲基戊-2-烯-1-基]-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮,化合物24(非对映异构体1)和化合物23(非对映异构体2)的制备
[2514][2515]
步骤1:(2z)-4-[(14s)-8-叔丁基-12,12-二甲基-2,2,4-三氧代-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-17-基]丁-2-烯酸乙酯和(2e)-4-[(14s)-8-叔丁基-12,12-二甲基-2,2,4-三氧代-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-17-基]丁-2-烯酸乙酯
[2516][2517]
在1-ml hplc中,将(14s)-8-叔丁基-12,12-二甲基-17-(丙-2-烯-1-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮(化合物34(非对映异构体2),57.2mg,0.1118mmol)溶解于dce(400μl),向其中添加丙烯酸乙酯(50μl,0.4615mmol)和hoveyda-grubbs第2代催化剂(8.3mg,0.01325mmol)。将小瓶盖上螺帽式隔片,并将反应混合物在60℃下搅拌72小时。然后将其冷却至室温,并且通过硅胶色谱法(4g二氧化硅),使用0至50%etoac/己烷的梯度洗脱直接纯化,得到两种产物:
[2518]
(2z)-4-[(14s)-8-叔丁基-12,12-二甲基-2,2,4-三氧代-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-17-基]丁-2-烯酸乙酯(5.6mg,9%)。esi-ms m/z计算值583.28284,实验值584.3(m 1)
;保留时间:2.19分钟(lc方法a)。
[2519]
(2e)-4-[(14s)-8-叔丁基-12,12-二甲基-2,2,4-三氧代-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-17-基]丁-2-烯酸乙酯(最后洗脱,40.9mg,63%)。1h nmr(400mhz,dmso-d6)δ12.50(s,1h),7.65-7.54(m,2h),7.15-7.03(m,2h),6.89(dt,j=15.1,7.3hz,1h),6.71(d,j=8.5hz,1h),6.63(d,j=8.0hz,1h),5.87(d,j=15.6hz,1h),4.34-4.23(m,1h),4.06(q,j=6.8hz,2h),
3.32-3.27(m,1h),3.04(t,j=8.6hz,1h),2.69-2.59(m,1h),2.38-2.25(m,2h),2.15-2.01(m,1h),1.79(dd,j=12.0,5.3hz,1h),1.65-1.62(m,1h),1.61(s,3h),1.55-1.49(m,2h),1.48(s,3h),1.34-1.28(m,1h),1.27(s,9h),1.16(t,j=7.1hz,3h)[注意:6.89和5.87ppm峰的耦合常数》15hz提示反式烯烃。]esi-ms m/z计算值583.28284,实验值584.3(m 1)
;保留时间:2.15分钟(lc方法a)。
[2520]
步骤2:(14s)-8-叔丁基-17-[(2e)-4-羟基-4-甲基戊-2-烯-1-基]-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮,化合物23(非对映异构体2)
[2521][2522]
阶段1:在3-ml小瓶中,将(2e)-4-[(14s)-8-叔丁基-12,12-二甲基-2,2,4-三氧代-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-17-基]丁-2-烯酸乙酯(38.4mg,0.06578mmol)溶解于无水thf(300μl)中,用氮气冲洗,并用螺旋顶式隔片密封。然后,逐滴添加memgbr的乙醚溶液(200μl,3.0m,0.6000mmol)。将所得橙色溶液在室温下保持16小时。然后将其用1n hcl溶液(1ml)逐滴淬灭,并用etoac(2
×
1ml)萃取。将合并的有机萃取物用h2o(2ml)和饱和nacl水溶液(2ml)洗涤,然后经na2so4干燥,过滤并真空蒸发。
[2523]
阶段2:将来自步骤1的粗产物溶解于thf(400μl)中,并用naoh水溶液(400μl,1.0m,0.4000mmol)处理。将所得混合物在50℃下剧烈搅拌3小时。将其冷却至室温,然后添加1n hcl溶液(3.0ml),随后添加etoac(3.0ml)。将各相剧烈混合,并且然后使其沉降成两层。将有机层过滤,并通过反相制备型色谱法,使用c
18
柱和含5mm hcl溶液的1%至99%乙腈/水梯度洗脱进行纯化,得到(14s)-8-叔丁基-17-[(2e)-4-羟基-4-甲基戊-2-烯-1-基]-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮(2.2mg,6%)。esi-ms m/z计算值569.3036,实验值570.3(m 1)
;保留时间:2.13分钟(lc方法a)。
[2524]
使用(14s)-8-叔丁基-12,12-二甲基-17-(丙-2-烯-1-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮非对映异构体1,化合物35作为起始物质,以与上述类似的方式制备下表中的化合物。
[2525]
[2526][2527]
实施例87:(14s)-8-叔丁基-17-(2-羟丙基)-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮,化合物22(对映异构体1)、化合物20(对映异构体2)、化合物28(对映异构体3)和化合物27(对映异构体4)的制备
[2528][2529]
步骤1:(14s)-8-叔丁基-17-(2,3-二羟丙基)-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮。
[2530][2531]
在氮气下,将4-甲基-4-氧代-吗啉-4-鎓(185mg,1.579mmol)和锇酸钾(vi)二水合物(32mg,0.0868mmol)添加到1打兰小瓶中。添加含(14s)-8-叔丁基-12,12-二甲基-17-(丙-2-烯-1-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮(化合物34(非对映异构体2),400mg,0.7817mmol)的丙酮(8ml),随后添加水(800μl)。搅拌过夜(得到深黑色溶液)。用硫代硫酸
钠和水淬灭。倒入dcm中并使用ptfe玻璃料分离。反萃取一次。蒸发掉挥发物。将粗产物溶解于dmso中,并且经由制备型hplc(c
18
acn/水hcl改性剂,15分钟0-99%acn梯度)进行纯化。将级分真空浓缩,得到(14s)-8-叔丁基-17-(2,3-二羟丙基)-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮(241.3mg,57%)。esi-ms m/z计算值545.2672,实验值546.2(m 1)
;保留时间:1.65分钟(lc方法a)。
[2532]
步骤2:2-[(14s)-8-叔丁基-12,12-二甲基-2,2,4-三氧代-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-17-基]乙醛
[2533][2534]
在氮气下,将(14s)-8-叔丁基-17-(2,3-二羟丙基)-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮(250mg,0.4581mmol)溶解于二噁烷(10ml):水(2ml)和2,6-二甲基吡啶(140μl,1.209mmol)中。添加高碘酸盐(钠盐)(210mg,0.9818mmol)并在室温下搅拌1小时。用dcm/1n hcl稀释并分离各层。蒸发溶剂,随后将其放于氮气下并在0℃下将粗产物溶解于thf(2ml)中。用水淬灭,随后添加dcm/1n hcl。通过ptfe玻璃料分离各层,随后减压蒸发溶剂。得到2-[(14s)-8-叔丁基-12,12-二甲基-2,2,4-三氧代-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-17-基]乙醛(198.5mg,84%)。1h nmr(400mhz,dmso-d6)δ12.49(s,1h),9.68(t,j=1.9hz,1h),7.60(t,j=7.9hz,1h),7.32(dd,j=59.6,7.5hz,3h),6.66(dd,j=48.0,8.2hz,2h),3.90(s,1h),3.20(s,1h),2.99-2.61(m,2h),2.36-2.20(m,2h),1.90-1.41(m,10h),1.26(m,11h)。
[2535]
步骤3:(14s)-8-叔丁基-17-(2-羟丙基)-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮,化合物22(对映异构体1),和(14s)-8-叔丁基-17-(2-羟丙基)-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮,化合物20(对映异构体2)
[2536][2537]
在氮气下,将2-[(14s)-8-叔丁基-12,12-二甲基-2,2,4-三氧代-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-17-基]乙醛(25mg,0.04867mmol)溶解于thf(1ml)中。冷却至0℃。添加memgbr(25μl,
0.2159mmol)并搅拌2小时。用饱和氯化铵溶液淬灭并通过ptfe玻璃料用dcm萃取。蒸发掉挥发物,随后经由制备型lcms(1%-99%acn/水hcl改性剂)纯化。分离出两种异构体:
[2538]
对映异构体1,首先洗脱,峰1:(14s)-8-叔丁基-17-(2-羟丙基)-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮(2.5mg,10%)。1h nmr(400mhz,甲醇-d4)δ7.65(s,1h),7.56(t,j=7.9hz,1h),7.31(d,j=7.2hz,1h),6.80-6.67(m,2h),3.85(q,j=6.3hz,1h),3.69(s,1h),3.29-3.04(m,2h),2.34(s,1h),2.12-1.67(m,4h),1.61(d,j=17.9hz,9h),1.39-1.18(m,14h)。esi-ms m/z计算值529.2723,实验值530.2(m 1)
;保留时间:1.86分钟(lc方法a)。
[2539]
对映异构体2,第二洗脱,峰1:(14s)-8-叔丁基-17-(2-羟丙基)-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮(4.2mg,16%)。1h nmr(400mhz,甲醇-d4)δ7.65(s,1h),7.56(t,j=7.9hz,1h),7.31(d,j=7.2hz,1h),6.80-6.67(m,2h),3.85(q,j=6.3hz,1h),3.69(s,1h),3.29-3.04(m,2h),2.34(s,1h),2.12-1.67(m,4h),1.61(d,j=17.9hz,9h),1.39-1.18(m,14h)。esi-ms m/z计算值529.2723,实验值530.3(m 1)
;保留时间:1.86分钟(lc方法a)。
[2540]
在步骤1中使用(14s)-8-叔丁基-12,12-二甲基-17-(丙-2-烯-1-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮(化合物35(非对映异构体1))作为起始物质,以与上述类似的方式制备下表中的化合物:
[2541]
[2542][2543]
实施例88:4-[(14s)-8-叔丁基-12,12-二甲基-2,2,4-三氧代-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-17-基]丁酸,化合物19的制备
[2544][2545]
步骤1:4-[(14s)-8-叔丁基-12,12-二甲基-2,2,4-三氧代-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-17-基]丁酸乙酯
[2546][2547]
在5-ml微波小瓶中,将(2e)-4-[(14s)-8-叔丁基-12,12-二甲基-2,2,4-三氧代-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-17-基]丁-2-烯酸乙酯(源自化合物34(非对映异构体2),293.3mg,0.5024mmol)溶解于etoh(2.0ml)中,并用氮气气球吹扫5分钟。添加pd/c(23.5mg,10%w/w,0.02208mmol),并将所得混合物在氢气球(2l,79.37mmol)下于室温下搅拌1小时,然后在50℃下搅拌18小时。然后将反应混合物冷却至室温,通过硅藻土过滤(用meoh冲洗),并蒸发至干燥,得到呈灰白色固体状的4-[(14s)-8-叔丁基-12,12-二甲基-2,2,4-三氧代-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-17-基]丁酸乙酯(278.4mg,95%)。esi-ms m/z计算值585.29846,实验值586.3(m 1)
;保留时间:2.18分钟(lc方法a)。
[2548]
步骤2:4-[(14s)-8-叔丁基-12,12-二甲基-2,2,4-三氧代-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-17-基]丁酸,化合物19
[2549][2550]
在20-ml小瓶中,将4-[(14s)-8-叔丁基-12,12-二甲基-2,2,4-三氧代-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-17-基]丁酸乙酯(226.6mg,0.3868mmol)溶解于无水thf(2.0ml)中,向其中添加无水naoh(2.0ml,1.0m,2.000mmol)。将所得混合物在50℃下剧烈搅拌17小时。然后将反应混合物冷却至室温,用1n hcl(5ml)淬灭,并用etoac(3
×
3ml)萃取。将合并的有机萃取物用h2o(5ml)和饱和nacl水溶液(5ml)洗涤,然后经na2so4干燥,过滤并真空蒸发。这得到了灰白色固体:4-[(14s)-8-叔丁基-12,12-二甲基-2,2,4-三氧代-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-17-基]丁酸(213.2mg,99%)esi-ms m/z计算值557.2672,实验值558.3(m 1)
;保留时间:1.94分钟(lc方法a)。将少量(10.5mg)的材料溶解于meoh(500μl)中,过滤,并且通过反相制备型色谱法,使用c
18
柱和含5mm hcl溶液的1%至99%mecn/h2o梯度洗脱进行纯化,得到4-[(14s)-8-叔丁基-12,12-二甲基-2,2,4-三氧代-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,
14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-17-基]丁酸(7.8mg)。esi-ms m/z计算值557.2672,实验值558.3(m 1)
;保留时间:1.94分钟(lc方法a)。
[2551]
步骤3:(10s)-16-叔丁基-12,12-二甲基-22λ
6-硫杂-2,13,15,21,27-五氮杂五环[21.3.1.110,13.02,7.014,19]二十八碳-1(26),14(19),15,17,23(27),24-六烯-3,20,22,22-四酮,化合物14
[2552][2553]
在1-ml hplc小瓶中,将4-[(14s)-8-叔丁基-12,12-二甲基-2,2,4-三氧代-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-17-基]丁酸(6.7mg,0.01201mmol)溶解于dmf(200μl)中,向其中添加dipea(20μl,0.1148mmol)和hatu(7.5mg,0.01972mmol)。将所得溶液在室温下搅拌2小时,随后添加第二份hatu(7.5mg,0.01972mmol)。将所得溶液在室温下搅拌24小时,随后添加第三份hatu(7.5mg,0.01972mmol)。将所得溶液在室温下搅拌24小时,随后将其用meoh(600μl)稀释,过滤,并且通过反相制备型色谱法,使用c
18
柱和含5mm hcl溶液的1%至99%mecn/h2o梯度洗脱进行纯化,得到(10s)-16-叔丁基-12,12-二甲基-22λ
6-硫杂-2,13,15,21,27-五氮杂五环[21.3.1.110,13.02,7.014,19]二十八碳-1(26),14(19),15,17,23(27),24-六烯-3,20,22,22-四酮(3.6mg,56%),esi-ms m/z计算值539.25665,实验值540.2(m 1)
;保留时间:1.97分钟(lc方法a)。
[2554]
步骤4:4-[(14s)-8-叔丁基-12,12-二甲基-2,2,4-三氧代-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-17-基]-n,n-二甲基丁酰胺,化合物18
[2555]
4-[(14s)-8-叔丁基-12,12-二甲基-2,2,4-三氧代-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-17-基]-n,n-双(丙-2-基)丁酰胺,化合物17
[2556]
n-叔丁基-4-[(14s)-8-叔丁基-12,12-二甲基-2,2,4-三氧代-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-17-基]丁酰胺,化合物16
[2557]
n-苄基-4-[(14s)-8-叔丁基-12,12-二甲基-2,2,4-三氧代-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-17-基]丁酰胺,化合物15
[2558][2559]
在该实验中,以相同方式进行4个反应。
[2560]
一般程序:在1-ml hplc小瓶中,将4-[(14s)-8-叔丁基-12,12-二甲基-2,2,4-三氧代-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-17-基]丁酸(9.6mg,0.0172mmol)溶解于dmf(100μl)中,向其中添加胺底物,随后添加dipea(10μl,0.0574mmol)和hatu(12.5mg,0.03287mmol)。将所得混合物搅拌5分钟或90分钟,这取决于胺底物。然后将其用meoh(500μl)稀释,过滤,并且通过反相制备色谱法,使用c
18
柱和1%至99%mecn/h2o(含有5mm hcl溶液)的梯度洗脱来纯化,得到产物:
[2561]
胺底物:
[2562]-me2nh(盐酸盐)(7.0mg,0.0858mmol),反应时间为5分钟;
[2563]-ipr2nh(10μl,0.0713mmol),反应时间为5分钟;
[2564]-t-bunh2(10μl,0.0956mmol),反应时间为5分钟;
[2565]-bnnh2(10μl,0.0915mmol),反应时间为90分钟。
[2566]
产品清单:
[2567]-4-[(14s)-8-叔丁基-12,12-二甲基-2,2,4-三氧代-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-17-基]-n,n-二甲基丁酰胺(盐酸盐)(5.9mg,55%)esi-ms m/z计算值584.31445,实验值585.3(m 1)
;保留时间:1.99分钟(lc方法a)。
[2568]-4-[(14s)-8-叔丁基-12,12-二甲基-2,2,4-三氧代-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-17-基]-n,n-双(丙-2-基)丁酰胺(盐酸盐)(6mg,51%)esi-ms m/z计算值640.3771,实验值641.4(m 1)
;保留时间:2.3分钟(lc方法a)。
[2569]-n-叔丁基-4-[(14s)-8-叔丁基-12,12-二甲基-2,2,4-三氧代-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-17-基]丁酰胺(盐酸盐)(7.6mg,68%)esi-ms m/z计算值612.34576,实验值613.4(m 1)
;保留时间:2.14分钟(lc方法a)。
[2570]-n-苄基-4-[(14s)-8-叔丁基-12,12-二甲基-2,2,4-三氧代-2λ
6-硫杂-3,9,11,
吡咯烷-1-甲酸叔丁酯(1g,4.1094mmol)与tempo(13mg,0.0832mmol)和溴化钠(42mg,0.4082mmol)于dcm(20ml)中的悬浮液中。一旦溶液变成棕色,将其搅拌10分钟并用乙醇(205.14mg,0.26ml,4.4529mmol)淬灭。将反应混合物用dcm(10ml)稀释,将有机相分离,用硫酸钠干燥,过滤并减压浓缩,得到呈橙色油状物的2,2-二甲基-4-(2-氧代乙基)吡咯烷-1-甲酸叔丁酯(1.075g,99%)。1h nmr(400mhz,cdcl3)δ9.78(s,1h),3.88-3.70(m,1h),3.02-2.85(m,1h),2.75-2.39(m,3h),2.01-1.86(m,1h),1.57-1.30(m,16h)。esi-ms m/z计算值241.1678,实验值186.4(m-55) ;保留时间:1.778分钟(lc方法e)。
[2577]
步骤2:3-[(6-叔丁基-2-氯-吡啶-3-羰基)氨磺酰基]苯甲酸
[2578][2579]
向6-叔丁基-2-氯-吡啶-3-甲酸(500mg,2.340mmol)于thf(4ml)中的溶液中添加cdi(474mg,2.923mmol)(从thf再结晶),并且将混合物在室温下搅拌1小时,然后添加3-氨磺酰基苯甲酸(470.8mg,2.340mmol),随后添加dbu(1.448ml,9.683mmol),并且将所得混合物在室温下搅拌1小时。将混合物用etoac和1n hcl稀释,分离并用etoac再次洗涤水层。将有机相合并,干燥(硫酸钠),过滤并浓缩,得到黄色油状物,所述黄色油缓慢结晶为粗产物3-[(6-叔丁基-2-氯-吡啶-3-羰基)氨磺酰基]苯甲酸(1.2432g,86%)。esi-ms m/z计算值396.05466,实验值397.2(m 1)
;保留时间:0.58分钟(lc方法d)。
[2580]
步骤3:4-(2-苯胺基乙基)-2,2-二甲基-吡咯烷-1-甲酸叔丁酯
[2581][2582]
在0℃下,向2,2-二甲基-4-(2-氧代乙基)吡咯烷-1-甲酸叔丁酯(680.7mg,2.821mmol)于二氯甲烷(10.21ml)中的溶液中添加苯胺(308.4μl,3.384mmol)和na(oac)3bh(1.197g,5.648mmol)。搅拌2小时,然后用dcm和meoh稀释,并经硅藻土过滤。将滤液通过旋转蒸发浓缩,溶解于etoac中,并用饱和碳酸氢钠水溶液(1x)、盐水(1x)洗涤,经硫酸钠干燥,过滤并浓缩,得到澄清油状物,将其通过硅胶色谱法,使用100%己烷至100%etoac的窄梯度进行纯化,得到呈澄清油状物的4-(2-苯胺基乙基)-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(853.5mg,90%)。esi-ms m/z计算值318.23074,实验值319.2(m 1)
;保留时间:0.54分钟(lc方法d)。
[2583]
步骤4:4-[2-(n-[3-[(6-叔丁基-2-氯-吡啶-3-羰基)氨磺酰基]苯甲酰基]苯胺基)乙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯
[2584]
[2585]
在烧瓶中将4-(2-苯胺基乙基)-2,2-二甲基吡咯烷-1-甲酸叔丁酯(409.8mg,1.287mmol)和3-[(6-叔丁基-2-氯-吡啶-3-羰基)氨磺酰基]苯甲酸(260.8mg,0.6572mmol)溶解于dcm(18ml)中,并且向该混合物中依序添加edc(215.5mg,1.124mmol)、dmap(96.34mg,0.7886mmol),并且最终添加dmap(254.9mg,1.972mmol)。混合物在30分钟后显示出一定转化,并搅拌隔夜,但无进一步进展。添加3-(乙基亚氨基亚甲基氨基)-n,n-二甲基-丙-1-胺(盐酸盐)(215.5mg,1.124mmol)(来自新瓶)、dmap(96.34mg,0.7886mmol)和diea(254.9mg,1.972mmol),加热至65℃并搅拌2小时,约50%转化。添加dmap(80.29mg,0.6572mmol)和diea(127.4mg,0.9857mmol),加热至75℃并搅拌3.5小时。冷却至室温,然后用1n hcl稀释,用etoac洗涤(2x,添加痕量meoh以改善溶解度),合并有机层,干燥(硫酸钠),过滤并浓缩,得到澄清油状物。通过硅胶色谱法,使用100%己烷至100%etoac的窄梯度纯化,得到混有酸起始物质的产物。将该材料溶解于etoac中,用1n naoh(2x)洗涤,干燥(硫酸钠),过滤并浓缩,得到直接用于下一步的澄清油状物,4-[2-(n-[3-[(6-叔丁基-2-氯-吡啶-3-羰基)氨磺酰基]苯甲酰基]苯胺基)乙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(120.3mg,26%)。esi-ms m/z计算值696.27484,实验值697.2(m 1)
;保留时间:0.83分钟(lc方法d)。
[2586]
步骤5:6-叔丁基-2-氯-n-[3-[2-(5,5-二甲基吡咯烷-3-基)乙基-苯基-氨甲酰基]苯基]磺酰基-吡啶-3-甲酰胺
[2587][2588]
将4-[2-(n-[3-[(6-叔丁基-2-氯-吡啶-3-羰基)氨磺酰基]苯甲酰基]苯胺基)乙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(120.3mg,0.1725mmol)溶解于dcm(525μl)中,并且向混合物中添加tfa(532μl,6.905mmol)并且将混合物在室温下搅拌1小时。减压浓缩混合物至干燥,添加10ml乙醚,并通过旋转蒸发移除挥发物。自10ml乙醚再重复该蒸发两次,然后在高真空下干燥15分钟,得到呈白色固体状的6-叔丁基-2-氯-n-[3-[2-(5,5-二甲基吡咯烷-3-基)乙基-苯基-氨甲酰基]苯基]磺酰基-吡啶-3-甲酰胺(三氟乙酸盐)(143.5mg,100%)。esi-ms m/z计算值596.2224,实验值597.1(m 1)
;保留时间:0.51分钟(lc方法d)。
[2589]
步骤6:8-叔丁基-12,12-二甲基-17-苯基-2λ
6-硫杂-3,9,11,17-四氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4,18-四酮
[2590][2591]
向6-叔丁基-2-氯-n-[3-[2-(5,5-二甲基吡咯烷-3-基)乙基-苯基-氨甲酰基]苯基]磺酰基-吡啶-3-甲酰胺(三氟乙酸盐)(143.5mg,0.1721mmol)于nmp(7ml)中的溶液中添加碳酸钾(167mg,1.208mmol)。将混合物用氮气吹扫5分钟。将混合物在165℃下加热并搅拌3天,然后添加氟化铯(31mg,0.2070mmol),随后添加分子筛,并将混合物封盖,加热至180℃并搅拌过夜。冷却至室温,滤出分子筛,用etoac洗脱,然后用etoac稀释滤液,用1n hcl洗涤,干燥(硫酸钠),过滤并浓缩,得到棕色油状物,,将所述棕色油状物过滤并使用反相hplc-ms方法,使用由phenomenex销售的luna c
18
柱(75
×
30mm,5μm粒度)(pn:00c-4252-u0-ax),和在15.0分钟内从1%-99%流动相b运行的双梯度(流动相a=h2o(5mm hcl),流动相b=乙腈,流速=50ml/min,进样体积=950μl,并且柱温=25℃)进行纯化,得到呈白色固体状的8-叔丁基-12,12-二甲基-17-苯基-2λ
6-硫杂-3,9,11,17-四氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4,18-四酮(28mg,29%)。esi-ms m/z计算值560.2457,实验值561.2(m 1)
;保留时间:0.76分钟(lc方法d)。
[2592]
步骤7:8-叔丁基-12,12-二甲基-17-苯基-2λ
6-硫杂-3,9,11,17-四氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4,18-四酮,化合物267(对映异构体1),和8-叔丁基-12,12-二甲基-17-苯基-2λ
6-硫杂-3,9,11,17-四氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4,18-四酮,化合物266(对映异构体2)
[2593][2594]
通过sfc色谱法,使用regis-[r,r]-whelk-o(250x10mm柱,5μm粒度),用44%meoh/56%co2流动相,以10ml/min历经14.0分钟(进样体积=70μl的23mg/ml于78/22meoh/dmso中的溶液)对外消旋8-叔丁基-12,12-二甲基-17-苯基-2λ
6-硫杂-3,9,11,17-四氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4,18-四酮(28mg,0.04994mmol)进行手性分离,得到两种异构体,均为白色固体:
[2595]
对映异构体1,首次洗脱:8-叔丁基-12,12-二甲基-17-苯基-2λ
6-硫杂-3,9,11,17-四氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4,18-四酮(6.1mg,44%)。1h nmr(500mhz,dmso-d6)δ12.60(s,1h),8.21(s,2h),7.83(s,2h),7.52(s,1h),7.46(s,4h),7.34(s,1h),6.65(d,j=7.9hz,1h),3.69(s,2h),2.72(d,j=17.3hz,1h),1.98(s,1h),1.84(s,1h),1.71(s,1h),1.52(s,3h),1.46(s,3h),1.36(s,1h),
1.26(s,9h),1.13(s,1h),一个h在nmr中模糊。esi-ms m/z计算值560.2457,实验值561.5(m 1)
;保留时间:2.11分钟(lc方法a)。
[2596]
对映异构体2,第二洗脱:8-叔丁基-12,12-二甲基-17-苯基-2λ
6-硫杂-3,9,11,17-四氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4,18-四酮(6.7mg,48%)。1h nmr(500mhz,dmso-d6)δ12.56(s,1h),8.21(s,2h),7.82(d,j=8.3hz,2h),7.52(s,1h),7.46(s,4h),7.34(s,1h),6.64(d,j=7.9hz,1h),3.69(s,2h),2.72(d,j=17.1hz,1h),1.97(s,1h),1.83(s,1h),1.70(s,1h),1.52(s,3h),1.45(s,3h),1.36(d,j=5.9hz,1h),1.26(s,9h),1.13(s,1h),一个h在nmr中模糊。esi-ms m/z计算值560.2457,实验值561.5(m 1)
;保留时间:2.11分钟(lc方法a)。
[2597]
实施例90:(18s)-21-(4-叔丁基吡啶-2-基)-11,16,16-三甲基-2λ
6-硫杂-3,13,15,22,27-五氮杂五环[21.3.1.115,18.05,14.07,12]二十八碳-1(26),5(14),6,8,10,12,23(27),24-八烯-2,2,4-三酮,化合物4(非对映异构体1),化合物3(非对映异构体2)的制备
[2598][2599]
步骤1:(4s)-4-[3-(4-叔丁基-2-吡啶基)-3-[[6-[(2-氯-8-甲基-喹啉-3-羰基)氨磺酰基]-2-吡啶基]氨基]丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯
[2600][2601]
将2-氯-8-甲基-喹啉-3-甲酸(92.5mg,0.4173mmol)溶解于thf(2.5ml)中,并添加cdi(130mg,0.8017mmol)。将反应物在氮气下搅拌5小时。此时,添加(4s)-4-[3-(4-叔丁基-2-吡啶基)-3-[(6-氨磺酰基-2-吡啶基)氨基]丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯
(226.8mg,0.4156mmol)和dbu(300μl,2.006mmol),并且将反应物再搅拌16小时。将反应物在乙酸乙酯与1m hcl溶液之间分配。将有机物分离,用盐水洗涤,经硫酸钠干燥并蒸发。粗产物通过反相hplc,使用10%-99%乙腈/5mm hcl水溶液梯度纯化,得到呈黄色固体状的(4s)-4-[3-(4-叔丁基-2-吡啶基)-3-[[6-[(2-氯-8-甲基-喹啉-3-羰基)氨磺酰基]-2-吡啶基]氨基]丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(盐酸盐)(212.2mg,65%)。esi-ms m/z计算值748.3174,实验值749.6(m 1)
;保留时间:0.72分钟(lc方法a)。
[2602]
步骤2:n-[[6-[[1-(4-叔丁基-2-吡啶基)-3-[(3s)-5,5-二甲基吡咯烷-3-基]丙基]氨基]-2-吡啶基]磺酰基]-2-氯-8-甲基-喹啉-3-甲酰胺
[2603][2604]
将(4s)-4-[3-(4-叔丁基-2-吡啶基)-3-[[6-[(2-氯-8-甲基-喹啉-3-羰基)氨磺酰基]-2-吡啶基]氨基]丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(盐酸盐)(212mg,0.2698mmol)溶解于二氯甲烷(2ml):hcl于二噁烷(1ml,4m,4.000mmol)中的混合物中,并在室温下搅拌3小时。将反应物蒸发并进一步干燥,得到呈白色固体状的n-[[6-[[1-(4-叔丁基-2-吡啶基)-3-[(3s)-5,5-二甲基吡咯烷-3-基]丙基]氨基]-2-吡啶基]磺酰基]-2-氯-8-甲基-喹啉-3-甲酰胺(二盐酸盐)(194mg,100%)。保留时间:0.72分钟esi-ms m/z计算值648.26495,实验值649.6(m 1)
;保留时间:0.5分钟(lc方法d)。
[2605]
步骤3:(18s)-21-(4-叔丁基吡啶-2-基)-11,16,16-三甲基-2λ
6-硫杂-3,13,15,22,27-五氮杂五环[21.3.1.115,18.05,14.07,12]二十八碳-1(26),5(14),6,8,10,12,23(27),24-八烯-2,2,4-三酮,化合物4(非对映异构体1),和(18s)-21-(4-叔丁基吡啶-2-基)-11,16,16-三甲基-2λ
6-硫杂-3,13,15,22,27-五氮杂五环[21.3.1.115,18.05,14.07,12]二十八碳-1(26),5(14),6,8,10,12,23(27),24-八烯-2,2,4-三酮,化合物3(非对映异构体2)
[2606][2607]
将n-[[6-[[1-(4-叔丁基-2-吡啶基)-3-[(3s)-5,5-二甲基吡咯烷-3-基]丙基]氨
基]-2-吡啶基]磺酰基]-2-氯-8-甲基-喹啉-3-甲酰胺(二盐酸盐)(194mg,0.2686mmol)和k2co3(277.5mg,2.008mmol)合并于nmp(3ml)中,并在150℃下加热16小时。将反应物在乙酸乙酯与10%柠檬酸溶液之间分配。将有机物分离,用盐水洗涤,经硫酸钠干燥并蒸发。粗产物通过反相hplc,利用10%-99%乙腈/5mm hcl水溶液梯度纯化,得到两种立体异构体:
[2608]
非对映异构体1,首先洗脱,峰1:(18s)-21-(4-叔丁基吡啶-2-基)-11,16,16-三甲基-2λ
6-硫杂-3,13,15,22,27-五氮杂五环[21.3.1.115,18.05,14.07,12]二十八碳-1(26),5(14),6,8,10,12,23(27),24-八烯-2,2,4-三酮(二盐酸盐)(33.9mg,18%)。esi-ms m/z计算值612.28827,实验值613.7(m 1)
;保留时间:1.45分钟(lc方法a)。
[2609]
非对映异构体2,第二洗脱,峰2:(18s)-21-(4-叔丁基吡啶-2-基)-11,16,16-三甲基-2λ
6-硫杂-3,13,15,22,27-五氮杂五环[21.3.1.115,18.05,14.07,12]二十八碳-1(26),5(14),6,8,10,12,23(27),24-八烯-2,2,4-三酮(二盐酸盐)(25.8mg,13%)。esi-ms m/z计算值612.28827,实验值613.5(m 1)
;保留时间:1.59分钟(lc方法a)。
[2610]
以下是可商购获得的氯喹啉试剂的列表:
[2611]
2-氯喹啉-3-甲酸
[2612]
2-氯-7-甲基-喹啉-3-甲酸
[2613]
2-氯-6-甲基-喹啉-3-甲酸。
[2614]
使用在上表中给出的可商购获得的氯喹啉试剂,以与上文所述类似的方式制备下表中的化合物。对于每个制备的非对映异构体对,两种组分的分离通过反相hplc,使用10%-99%乙腈/5mm hcl水溶液梯度来实现。非对映异构体1是在分离程序期间洗脱的第一异构体。非对映异构体2是待洗脱的第二异构体。
[2615][2616]
[2617][2618]
实施例91:(14s)-8-叔丁基-12,12,17-三甲基-17-(吡啶-2-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮,化合物45(非对映异构体1)和化合物44(非对映异构体2)的制备
[2619][2620]
步骤1:(4s)-4-[3-羟基-3-(2-吡啶基)丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯
[2621][2622]
在氮气下,在-78℃下于剧烈搅拌下,向2-溴吡啶(5.3ml,55.584mmol)于无水thf(100ml)中的混合物中逐滴添加含正丁基锂(31.5ml,1.8m,56.700mmol)的己烷。将混合物在-78℃下剧烈搅拌0.5小时,并且逐滴添加(4s)-2,2-二甲基-4-(3-氧代丙基)吡咯烷-1-甲酸叔丁酯(6.00g,22.322mmol)于thf(70ml)中的溶液。将反应物在-78℃下搅拌30分钟。将反应物用饱和nh4cl水溶液(200ml)淬灭,并且使反应物升温至室温。添加h2o(200ml)并用
etoac(3x250ml)萃取混合物。将合并的有机层用饱和nacl水溶液(100ml)洗涤,经无水硫酸钠干燥,过滤并真空浓缩,得到呈棕色油状物的产物,(4s)-4-[3-羟基-3-(2-吡啶基)丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(10.71g,105%)esi-ms m/z计算值334.2256,实验值335.2(m 1)
;保留时间:2.28分钟(lc方法b)。
[2623]
步骤2:(4s)-2,2-二甲基-4-[3-氧代-3-(2-吡啶基)丙基]吡咯烷-1-甲酸叔丁酯
[2624][2625]
将(4s)-4-[3-羟基-3-(2-吡啶基)丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(10.71g,23.472mmol)溶解于dcm(90ml)中。将溶液在冰水浴中冷却。以小份添加戴斯-马丁过碘烷(13.59g,30.439mmol)。移开冰浴,同时在氮气下搅拌混合物。在升温至室温3小时后,lcms(elsd)显示起始物质消失。添加na2s2o3(约10g)于饱和碳酸氢钠水溶液(250ml)中的溶液。将混合物搅拌30分钟。分离各层。将dcm层进一步用碳酸氢钠(饱和水溶液200ml x 2)萃取,用饱和nacl水溶液(200ml)洗涤,并经无水硫酸钠干燥,过滤并浓缩。对粗棕色油状物(10.66g)进行快速色谱法(装载dcm)(120g sio2,在35分钟内自0至30%etoac/己烷洗脱)。最终纯化质量=4.38g(橙色油状物)(4s)-2,2-二甲基-4-[3-氧代-3-(2-吡啶基)丙基]吡咯烷-1-甲酸叔丁酯(4.38g,54%)esi-ms m/z计算值332.21,实验值333.2(m 1)
;保留时间:3.05分钟(lc方法b)。
[2626]
步骤3:(4s)-4-[(3e)-3-叔丁基亚磺酰基亚氨基-3-(2-吡啶基)丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯
[2627][2628]
在氮气下,向在室温下搅拌的(4s)-2,2-二甲基-4-[3-氧代-3-(2-吡啶基)丙基]吡咯烷-1-甲酸叔丁酯(5.6g,13.476mmol)于无水thf(36ml)中的溶液中添加2-甲基丙烷-2-亚磺酰胺(3.3963g,27.181mmol)和乙醇钛(iv)(8.5ml,36.589mmol)。将反应物加热到80℃并在80℃下搅拌4天。将反应物在冰浴中冷却,用etoac(36ml)稀释,并且在轻轻搅拌下倒入冰冷的饱和nacl水溶液(72ml)中。形成的沉淀经由硅藻土垫过滤,并用etoac(2x36ml)洗涤。将滤液用饱和nacl水溶液(72ml)洗涤,经无水硫酸钠干燥,过滤并真空浓缩。对粗油状物(7.41g)进行快速色谱法(装载dcm)(80g sio2,在40分钟内0至30%etoac/己烷洗脱),得到呈橙色油状物的(4s)-4-[(3e)-3-叔丁基亚磺酰基亚氨基-3-(2-吡啶基)丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(3.0615g,47%)esi-ms m/z计算值435.2556,实验值436.5(m 1)
;保留时间:6.55分钟(lc方法c)。
[2629]
步骤4:(4s)-4-[3-(叔丁基亚磺酰基氨基)-3-(2-吡啶基)丁基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯
[2630][2631]
在氮气下,将(4s)-4-[(3e)-3-叔丁基亚磺酰基亚氨基-3-(2-吡啶基)丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(2.29g,4.7312mmol)溶解于无水thf(16.8ml)中,并将溶液在干冰-丙酮浴(-78℃)中冷却并搅拌5分钟。逐滴添加溴(甲基)镁(9ml,1.4m于thf/甲苯(1:3,v:v)中,12.600mmol),并使反应物在干冰-乙腈浴(-40-30℃)中升温,并搅拌1小时。添加饱和nh4cl水溶液(50ml),并使混合物升温至室温。添加etoac(50ml)和h2o(50ml)。分离各层,并用etoac(50ml)萃取水层。将合并的etoac层用饱和nacl水溶液(50ml)洗涤,经无水硫酸钠干燥,过滤并真空浓缩。对粗产物进行快速色谱法(装载dcm)(25g sio2,在40分钟内0至100%etoac/己烷洗脱)。收集并浓缩适当的级分,得到呈浅棕色泡沫状固体的(4s)-4-[3-(叔丁基亚磺酰基氨基)-3-(2-吡啶基)丁基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(2.1258g,97%)。esi-ms m/z计算值451.2869,实验值452.5(m 1)
;保留时间:5.02分钟(lc方法c)。
[2632]
步骤5:(4s)-4-[3-氨基-3-(2-吡啶基)丁基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯
[2633][2634]
将(4s)-4-[3-(叔丁基亚磺酰基氨基)-3-(2-吡啶基)丁基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(2.1258g,4.6124mmol)溶解于thf(15ml)和水(3ml)中。添加分子碘(350.0mg,0.0710ml,1.3762mmol)。将混合物在55℃下搅拌2小时。然后将其冷却至室温,并使其在etoac(35ml)和含na2s2o3(7g)的饱和碳酸氢钠水溶液(35ml)之间分配。分离各层,并将水层用etoac(50ml)萃取一次。将有机层用饱和nacl水溶液(50ml)洗涤,经无水硫酸钠干燥,过滤并真空浓缩,得到(4s)-4-[3-氨基-3-(2-吡啶基)丁基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(1.8514g,104%)esi-ms m/z计算值347.2573,实验值348.3(m 1)
;保留时间:2.46分钟(lc方法b)。
[2635]
步骤6:(4s)-2,2-二甲基-4-[3-(2-吡啶基)-3-[(6-氨磺酰基-2-吡啶基)氨基]丁基]吡咯烷-1-甲酸叔丁酯
[2636][2637]
向(4s)-4-[3-氨基-3-(2-吡啶基)丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(1.245g,3.2245mmol)和6-氟吡啶-2-磺酰胺(2g,10.785mmol)于dmso(5ml)中的混合物中添加diea(1.4840g,2ml,11.482mmol)。将混合物在125℃下搅拌6天。将反应混合物冷却至室温,并且然后用水(200ml)和etoac(100ml)稀释。分离各层,并将有机层用盐水(2x100ml)洗涤,经无水na2so4干燥,并浓缩。通过硅胶色谱法(120g柱),使用0-80%etoac/己烷来纯化残余物,得到呈浅棕色固体状的(4s)-2,2-二甲基-4-[3-(2-吡啶基)-3-[(6-氨磺酰基-2-吡啶基)氨基]丁基]吡咯烷-1-甲酸叔丁酯(516.3mg,30%)。1h nmr(500mhz,dmso-d6)δ8.56
–
8.51(m,1h),7.77
–
7.70(m,1h),7.56
–
7.48(m,2h),7.41
–
7.36(m,1h),7.26
–
7.20(m,1h),6.97
–
6.93(m,1h),6.74
–
6.61(m,3h),3.50
–
3.40(m,1h),2.67
–
2.57(m,1h),2.45
–
2.26(m,1h),2.17
–
2.01(m,1h),1.96
–
1.87(m,1h),1.86
–
1.75(m,1h),1.74
–
1.70(m,3h),1.40
–
1.34(m,9h),1.31
–
1.23(m,4h),1.18
–
1.16(m,3h),1.14
–
1.06(m,1h),1.06
–
0.97(m,1h)。esi-ms m/z计算值503.2566,实验值504.6(m 1)
;保留时间:4.44分钟(lc方法c)。
[2638]
步骤7:(4s)-4-[3-[[6-[(6-叔丁基-2-氟-吡啶-3-羰基)氨磺酰基]-2-吡啶基]氨基]-3-(2-吡啶基)丁基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯
[2639][2640]
向6-叔丁基-2-氟-吡啶-3-甲酸(580mg,2.7940mmol)于thf(2ml)中的溶液中添加cdi(490mg,3.0219mmol),并且将混合物在室温下搅拌16小时。然后添加(4s)-2,2-二甲基-4-[3-(2-吡啶基)-3-[(6-氨磺酰基-2-吡啶基)氨基]丁基]吡咯烷-1-甲酸叔丁酯(405mg,0.6929mmol),随后添加dbu(407.20mg,0.4ml,2.6748mmol),并将所得混合物在室温下搅拌2小时。将反应物用饱和氯化铵和盐水溶液的1:1混合物淬灭,然后用乙酸乙酯萃取。将合并的有机层用盐水洗涤,经硫酸钠干燥,过滤并蒸发。所得残余物通过快速色谱法使用20%-70%etoac/己烷来纯化,得到呈浅黄色固体状的(4s)-4-[3-[[6-[(6-叔丁基-2-氟-吡啶-3-羰基)氨磺酰基]-2-吡啶基]氨基]-3-(2-吡啶基)丁基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(400mg,80%)。esi-ms m/z计算值682.3313,实验值683.7(m 1)
;保留时间:5.6分钟(lc方法c)。
[2641]
步骤8:6-叔丁基-n-[[6-[[3-[(3s)-5,5-二甲基吡咯烷-3-基]-1-甲基-1-(2-吡啶基)丙基]氨基]-2-吡啶基]磺酰基]-2-氟-吡啶-3-甲酰胺
[2642][2643]
向(4s)-4-[3-[[6-[(6-叔丁基-2-氟-吡啶-3-羰基)氨磺酰基]-2-吡啶基]氨基]-3-(2-吡啶基)丁基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(265mg,0.3498mmol)于dcm(1.5ml)中的溶液中添加tfa(740.00mg,0.5ml,6.4899mmol),并且将混合物在室温下搅拌1小时。蒸发溶剂。将残余物溶解于etoac(10ml)中。将混合物用h2o(5x20ml)萃取。将水用固体碳酸氢钠碱化,并用dcm(2x50ml)萃取。将有机层干燥并蒸发,得到呈灰白色固体状的6-叔丁基-n-[[6-[[3-[(3s)-5,5-二甲基吡咯烷-3-基]-1-甲基-1-(2-吡啶基)丙基]氨基]-2-吡啶基]磺酰基]-2-氟-吡啶-3-甲酰胺(153mg,74%)。esi-ms m/z计算值582.2788,实验值583.6(m 1)
;保留时间:2.0分钟(lc方法b)。
[2644]
步骤9:(14s)-8-叔丁基-12,12,17-三甲基-17-(吡啶-2-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮,化合物45(非对映异构体1),和(14s)-8-叔丁基-12,12,17三甲基-17-(吡啶-2-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮,化合物44(非对映异构体2)
[2645][2646]
向6-叔丁基-n-[[6-[[3-[(3s)-5,5-二甲基吡咯烷-3-基]-1-甲基-1-(2-吡啶基)丙基]氨基]-2-吡啶基]磺酰基]-2-氟-吡啶-3-甲酰胺(306mg,0.5207mmol)于dmf(3ml)中的溶液中添加k2co3(250mg,1.8089mmol)。将混合物用氮气吹扫5分钟。将混合物在140℃下加热16小时并冷却至室温。反应物通过反相hplc(20%至80%乙腈/水,历经20分钟,流速40ml/min 5mm hcl作为改性剂)纯化,得到两种异构体:
[2647]
非对映异构体1:呈白色固体状的(14s)-8-叔丁基-12,12,17三甲基-17-(吡啶-2-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮(盐酸盐)(59.1mg,18%)。1h nmr(500mhz,dmso-d6)δ12.78(s,1h),8.68
–
8.57(m,1h),7.96(s,1h),7.87
–
7.72(m,2h),7.69(t,j=7.7,7.7hz,1h),7.38
–
7.32(m,2h),7.13(d,j=8.5hz,1h),6.60(d,j=7.9hz,1h),3.47
–
3.21(m,2h),2.18
–
2.10(m,1h),2.00
–
1.84(m,1h),1.80
–
1.60(m,5h),1.57
–
1.40(m,6h),1.30
–
1.22(m,10h),1.07
–
0.70(m,2h)。esi-ms m/z计算值562.2726,实验值563.0(m 1)
;保留时间:2.39
分钟(lc方法b)。
[2648]
非对映异构体2:呈白色固体状的(14s)-8-叔丁基-12,12,17三甲基-17-(吡啶-2-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮(盐酸盐)(55.4mg,17%)。1h nmr(500mhz,dmso-d6)δ12.58(s,1h),8.60(s,1h),7.73(m,4h),7.34(d,j=7.3hz,1h),7.29(d,j=7.8hz,1h),7.10(d,j=8.5hz,1h),6.56(d,j=7.8hz,1h),3.28(s,1h),3.03(s,1h),2.27(s,3h),1.85(d,j=9.9hz,2h),1.55(m,6h),1.48(s,3h),1.45
–
1.37(m,1h),1.25(s,9h),0.98(q,j=11.8hz,1h)。esi-ms m/z计算值562.2726,实验值563.0(m 1)
;保留时间:2.29分钟(lc方法b)。
[2649]
实施例92:3-氧代-2,3-二氢-1h-吡唑-1-甲酸叔丁酯的合成
[2650][2651]
启动50l反应器,并将夹套设定为20℃,其中以150rpm搅拌,装备回流冷凝器(10℃)和氮气吹扫。添加meoh(2.860l)和(e)-3-甲氧基丙-2-烯酸甲酯(2.643kg,22.76mol),并将反应器封盖。将反应物加热到40℃的内部温度,并且将系统设定为将夹套温度保持在40℃。在30分钟内经由加料漏斗逐份添加水合肼(1300g,55%w/w,22.31mol)。将反应物加热至60℃持续1小时。将反应混合物冷却至20℃,并且逐份添加三乙胺(2.483kg,3.420l,24.54mol),维持反应温度《30℃。逐份添加boc酸酐(二碳酸二叔丁酯)(4.967kg,5.228l,22.76mol)于meoh(2.860l)中的溶液,维持温度《45℃。将反应混合物在20℃下搅拌16小时。将反应溶液部分浓缩以移除meoh,产生澄清浅琥珀色油状物。将所得油状物转移到50l反应器中,搅拌并添加水(7.150l)和庚烷(7.150l)。此类添加使少量产物沉淀。将水层排放到清洁容器中,并且过滤界面和庚烷层以分离出固体(产物)。将水层转移回到反应器,并且将收集的固体放回反应器中并与水层混合。将液滴漏斗添加到反应器中,并且装载乙酸(1.474kg,1.396l,24.54mol)并逐滴添加。将夹套设定为0℃以吸收淬灭放热。在完成添加后(ph=5),将反应混合物搅拌1小时。通过过滤收集固体并且用水(7.150l)洗涤,并用水(3.575l)再次洗涤。将结晶固体转移到20l旋转蒸发仪球罐中,并且添加庚烷(7.150l)。将混合物在45℃下浆化30分钟,并且蒸馏出1-2体积的溶剂。过滤旋转蒸发烧瓶中的浆液,并将固体用庚烷(3.575l)洗涤。将固体在真空(50℃,15mbar)中进一步干燥,得到呈粗结晶固体状的5-氧代-1h-吡唑-2-甲酸叔丁酯(2921g,71%)。1h nmr(400mhz,dmso-d6)δ10.95(s,1h),7.98(d,j=2.9hz,1h),5.90(d,j=2.9hz,1h),1.54(s,9h)。
[2652]
实施例93:2-氯-6-[3-[2-[1-(三氟甲基)环丙基]乙氧基]吡唑-1-基]吡啶-3-甲酸的制备
[2653][2654]
步骤1:2-[1-(三氟甲基)环丙基]乙醇
[2655][2656]
在30分钟内向在冰浴中的氢化铝锂(293mg,7.732mmol)于四氢呋喃(10.00ml)中的溶液中逐滴添加含2-[1-(三氟甲基)环丙基]乙酸(1.002g,5.948mmol)的四氢呋喃(3.0ml),保持反应温度低于20℃。使混合物逐渐温热至环境温度并搅拌18小时。将混合物用冰浴冷却,并依次用水(295μl,16.36mmol)、氢氧化钠水溶液(297μl,6m,1.784mmol)淬灭,并且然后用水(884μl,49.07mmol)淬灭,得到呈混合物形式的颗粒状固体。使用硅藻土滤出固体,并用乙醚洗涤沉淀。将滤液进一步用硫酸镁干燥,过滤并真空浓缩,得到含有残留四氢呋喃和乙醚的产物。将混合物不经进一步纯化直接用于下一步。
[2657]
步骤2:3-[2-[1-(三氟甲基)环丙基]乙氧基]吡唑-1-甲酸叔丁酯
[2658][2659]
将5-氧代-1h-吡唑-2-甲酸叔丁酯(1.043g,5.660mmol)、2-[1-(三氟甲基)环丙基]乙醇(916mg,5.943mmol)和三苯基膦(1.637g,6.243mmol)合并于四氢呋喃(10.48ml)中,并且在冰浴中冷却反应物。将偶氮二甲酸二异丙酯(1.288g,1.254ml,6.368mmol)逐滴添加到反应混合物中,并使反应物升温至室温持续16小时。将混合物蒸发,并将所得材料在乙酸乙酯(30ml)和1n氢氧化钠(30ml)之间分配。将有机层分离,用盐水(30ml)洗涤,经硫酸钠干燥并浓缩。粗物质通过硅胶色谱法,用乙酸乙酯/己烷(0-30%)的梯度洗脱来纯化,得到3-[2-[1-(三氟甲基)环丙基]乙氧基]吡唑-1-甲酸叔丁酯(1.03g,57%)。esi-ms m/z计算值320.13,实验值321.1(m 1)
;保留时间:0.72分钟(lc方法j)。
[2660]
步骤3:3-[2-[1-(三氟甲基)环丙基]乙氧基]-1h-吡唑
[2661][2662]
将3-[2-[1-(三氟甲基)环丙基]乙氧基]吡唑-1-甲酸叔丁酯(1.03g,3.216mmol)
溶解于含有三氟乙酸(2.478ml,32.16mmol)的二氯甲烷(10.30ml)中,并将反应物在室温下搅拌2小时。将反应物蒸发,并将所得油状物在乙酸乙酯(10ml)与饱和碳酸氢钠溶液之间分配。将有机层分离,用盐水洗涤,经硫酸钠干燥并蒸发,得到3-[2-[1-(三氟甲基)环丙基]乙氧基]-1h-吡唑(612mg,86%)。1h nmr(400mhz,二甲基亚砜-d6)δ11.86(s,1h),7.50(t,j=2.1hz,1h),5.63(t,j=2.3hz,1h),4.14(t,j=7.1hz,2h),2.01(t,j=7.1hz,2h),0.96-0.88(m,2h),0.88-0.81(m,2h)。esi-ms m/z计算值220.08,实验值221.0(m 1)
;保留时间:0.5min(lc方法j)。
[2663]
步骤4:2-氯-6-[3-[2-[1-(三氟甲基)环丙基]乙氧基]吡唑-1-基]吡啶-3-甲酸叔丁酯
[2664][2665]
将2,6-二氯吡啶-3-甲酸叔丁酯(687mg,2.770mmol)、3-[2-[1-(三氟甲基)环丙基]乙氧基]-1h-吡唑(610mg,2.770mmol)和新鲜研磨的碳酸钾(459mg,3.324mmol)合并于无水二甲基亚砜(13.75ml)中。添加1,4-二氮杂双环[2.2.2]辛烷(62mg,0.554mmol),并将混合物在氮气下在室温下搅拌16小时。将反应混合物用水(20ml)稀释并搅拌15分钟。收集所得固体并用水洗涤。将固体溶解于二氯甲烷中并经硫酸镁干燥。将混合物过滤并浓缩,得到2-氯-6-[3-[2-[1-(三氟甲基)环丙基]乙氧基]吡唑-1-基]吡啶-3-甲酸叔丁酯(1.01g,84%)。esi-ms m/z计算值431.12,实验值432.1(m 1)
;保留时间:0.88min(lc方法j)。
[2666]
步骤5:2-氯-6-[3-[2-[1-(三氟甲基)环丙基]乙氧基]吡唑-1-基]吡啶-3-甲酸
[2667][2668]
将2-氯-6-[3-[2-[1-(三氟甲基)环丙基]乙氧基]吡唑-1-基]吡啶-3-甲酸叔丁酯(1.01g,2.339mmol)和三氟乙酸(1.8ml,23.39mmol)合并于二氯甲烷(10ml)中,并在40℃下加热3小时。浓缩反应物。添加己烷,并再次浓缩混合物,得到2-氯-6-[3-[2-[1-(三氟甲基)环丙基]乙氧基]吡唑-1-基]吡啶-3-甲酸(873mg,99%)esi-ms m/z计算值375.06,实验值376.1(m 1)
;保留时间:0.69分钟(lc方法j)。
[2669]
实施例94:2-氯-6-[3-(2-二螺[2.0.2.1]庚-7-基乙氧基)吡唑-1-基]吡啶-3-甲酸的制备
[2670][2671]
步骤1:7-(溴甲基)二螺[2.0.2.1]庚烷
[2672][2673]
使1000ml、3颈圆底烧瓶配备有机械搅拌器、冷却浴、加料漏斗、j-kem温度探针和氮气入口/出口。在氮气气氛下,向容器中装入三苯基膦(102.7ml,443.2mmol)和二氯甲烷(1l),得到澄清无色溶液。开始搅拌,并向冷却浴中装入丙酮。将干冰分批添加到冷却浴中,直到获得-15℃的锅温。向加料漏斗中装入溴(22.82ml,443.0mmol)于二氯甲烷(220ml,10ml/g)中的溶液,随后在1小时内逐滴添加该溶液。在添加期间将干冰分批添加到冷却浴中,以将锅温维持在-15℃。在溴添加完成之后,将浅黄色悬浮液在-15℃下继续搅拌15分钟,在该温度下将悬浮液冷却至-30℃。向加料漏斗中装入二螺[2.0.2.1]庚-7-基甲醇(50g,402.6mmol)、吡啶(35.82ml,442.9mmol)和二氯甲烷(250ml,5ml/g)的溶液。然后在1.5小时内逐滴添加澄清浅黄色溶液,将锅温维持在-30℃。使所得澄清浅黄色反应混合物逐渐升温至-5℃的锅温,并且然后在-5℃下继续搅拌1小时。然后将反应混合物倒入己烷(2000ml)中,导致沉淀的形成。将悬浮液在室温下搅拌30分钟,并且然后通过具有20mm硅藻土层的玻璃料布氏漏斗过滤。将澄清滤液减压浓缩(水浴温度为20℃),得到含有一些沉淀的黄色油状物。将油状物用一些己烷稀释,在室温下静置15分钟,然并且后通过具有20mm硅藻土层的玻璃料布氏漏斗过滤。将澄清滤液减压浓缩(水浴温度为20℃),得到呈澄清黄色油状物的7-(溴甲基)二螺[2.0.2.1]庚烷(70g,93%)。1h nmr(400mhz,氯仿-d)δ3.49(d,j=7.5hz,2h),1.90(t,j=7.5hz,1h),1.06-0.84(m,4h),0.71(ddd,j=9.1,5.1,4.0hz,2h),0.54(dddd,j=8.6,4.8,3.8,1.0hz,2h)。
[2674]
步骤2:2-二螺[2.0.2.1]庚-7-基乙腈
[2675][2676]
使1000ml、3颈圆底烧瓶配备有机械搅拌器、用作二级防护的冷却浴、j-kem温度探针和氮气入口/出口。在氮气气氛下,向容器中装入7-(溴甲基)二螺[2.0.2.1]庚烷(35g,187.1mmol)和二甲基亚砜(245ml),得到澄清琥珀色溶液。开始搅拌,并记录锅温为19℃。然后向容器中装入一次性添加的固体氰化钠(11.46g,233.8mmol),得到深色溶液并在15分钟
内逐渐放热达到49℃。几分钟后,锅温开始降低,并且将混合物继续在室温下搅拌过夜(约15小时)。将深色反应混合物用冰冷饱和碳酸钠溶液(500ml)淬灭,并且然后转移到分液漏斗中并用乙醚(500ml)分配。移除有机物,并用乙醚(2x250ml)萃取残余水。将合并的有机物用水(500ml)洗涤,经硫酸钠(200g)干燥,并且然后通过玻璃料布氏漏斗过滤。将澄清琥珀色滤液减压浓缩(水浴温度20℃),得到呈澄清琥珀色油状物的2-二螺[2.0.2.1]庚-7-基乙腈(21g,84%)。1h nmr(400mhz,氯仿-d)δ2.42(d,j=6.6hz,2h),1.69(t,j=6.6hz,1h),1.02-0.88(m,4h),0.79-0.70(m,2h),0.66-0.55(m,2h)。
[2677]
步骤3:2-二螺[2.0.2.1]庚-7-基乙酸
[2678][2679]
向2-二螺[2.0.2.1]庚-7-基乙腈(2.1g,14.19mmol)于etoh(32ml)中的溶液中添加氢氧化钠(5.12g,128.0mmol),随后添加水(13ml),并将所得溶液搅拌并加热至70℃过夜。然后将混合物冷却至室温,用水稀释并用乙醚萃取。通过添加6n盐酸(产生浑浊沉淀)将水相调节至ph=1,并用乙醚(3x)萃取。将有机相干燥(硫酸镁)、过滤并浓缩,得到呈橙色固体状的2-二螺[2.0.2.1]庚-7-基乙酸(2.19g,99%产率,98%纯度),其不经进一步纯化即用于下一步。1h nmr(400mhz,氯仿-d)δ2.44(d,j=6.9hz,2h),1.67(t,j=6.9hz,1h),0.91(ddd,j=9.0,5.2,3.9hz,2h),0.81(dddd,j=8.9,5.2,3.9,0.5hz,2h),0.69(ddd,j=8.9,5.2,3.9hz,2h),0.56-0.44(m,2h)。
[2680]
步骤4:2-二螺[2.0.2.1]庚-7-基乙醇
[2681][2682]
在15分钟内向在冰/水浴中冷却的溶解于四氢呋喃(33.71ml)中的氢化铝锂(827.4mg,902.3μl,21.80mmol)中逐滴添加含2-二螺[2.0.2.1]庚-7-基乙酸(2.552g,16.77mmol)的四氢呋喃(7.470ml),保持反应温度<20℃。使混合物搅拌总共18小时,逐渐升温到环境温度。将混合物用冰/水浴冷却,并且通过依次缓慢添加水(838.4mg,838.4μl,46.54mmol),随后添加氢氧化钠(1.006ml,5m,5.031mmol),然后添加水(2.493g,2.493ml,138.4mmol)淬灭,得到经经硅藻土过滤过滤的白色粒状浆液。用乙醚洗涤过滤后的固体。将滤液在约300mbar和30℃水浴下真空浓缩。将残余物用乙醚稀释,干燥(硫酸镁),过滤并在约300mbar和30℃水浴下真空浓缩,随后真空浓缩约30秒,得到2-二螺[2.0.2.1]庚-7-基乙醇(2.318g,100%),其不经进一步纯化即直接用于后续步骤。1h nmr(400mhz,氯仿-d)δ3.64(s,2h),1.68(d,j=6.7hz,2h),1.39(s,1h),1.31(s,1h),0.82(d,j=14.0hz,4h),0.65(s,2h),0.50(d,j=3.6hz,2h)。
[2683]
步骤5:3-(2-二螺[2.0.2.1]庚-7-基乙氧基)吡唑-1-甲酸叔丁酯
[2684][2685]
向5-氧代-1h-吡唑-2-甲酸叔丁酯(2.942g,15.97mmol)和2-二螺[2.0.2.1]庚-7-基乙醇(2.318g,16.77mmol)于四氢呋喃(36.78ml)中的溶液中添加三苯基膦(4.399g,
16.77mmol)。在10分钟内向混合物中缓慢地逐滴添加偶氮二甲酸二异丙酯(3.391g,3.302ml,16.77mmol)(注意到轻度放热)。将反应混合物在室温下搅拌30分钟,然后在50℃下搅拌30分钟。真空依次四氢呋喃。向粗残余物中添加甲苯(23.54ml),并将混合物搅拌过夜,因为沉淀逐渐结晶。用硅藻土浆化,然后将沉淀过滤掉,并用甲苯(8.705ml)洗涤,并且再用甲苯(8.705ml)洗涤。将滤液真空浓缩。通过硅胶色谱法,使用从100%己烷到100%乙酸乙酯的窄梯度来纯化粗产物,得到3-(2-二螺[2.0.2.1]庚-7-基乙氧基)吡唑-1-甲酸叔丁酯(3.449g,71%)。esi-ms m/z计算值304.17868,实验值305.1(m 1)
;保留时间:0.82min(lc方法j)。
[2686]
步骤6:3-(2-二螺[2.0.2.1]庚-7-基乙氧基)-1h-吡唑
[2687][2688]
将3-(2-二螺[2.0.2.1]庚-7-基乙氧基)吡唑-1-甲酸叔丁酯(5.304g,17.43mmol)溶解于含有三氟乙酸(29.81g,20.14ml,261.4mmol)的二氯甲烷(53.04ml)中,并将反应物在室温下搅拌120分钟。将反应物蒸发,并且将所得油状物在乙酸乙酯和饱和碳酸氢钠溶液之间分配,并分离各层。将水性部分用乙酸乙酯萃取两次,然后将有机物合并,用盐水洗涤,经硫酸钠干燥,过滤并蒸发,得到油状物3-(2-二螺[2.0.2.1]庚-7-基乙氧基)-1h-吡唑(3.56g,100%)。esi-ms m/z计算值204.12627,实验值205.1(m 1)
;保留时间:0.59min(lc方法j)。
[2689]
步骤7:2-氯-6-[3-(2-二螺[2.0.2.1]庚-7-基乙氧基)吡唑-1-基]吡啶-3-甲酸叔丁酯
[2690][2691]
将2,6-二氯吡啶-3-甲酸叔丁酯(4.322g,17.42mmol)、3-(2-二螺[2.0.2.1]庚-7-基乙氧基)-1h-吡唑(3.559g,17.42mmol)和碳酸钾(2.891g,20.92mmol)合并于无水二甲基亚砜(71.18ml)中。添加1,4-二氮杂双环[2.2.2]辛烷(391.1mg,3.487mmol),并将混合物在室温下在氮气下搅拌16小时。将反应混合物用水(136.9ml)稀释并搅拌15分钟。将所得白色固体过滤并用水洗涤。将固体溶解于二氯甲烷中并经硫酸镁干燥。将混合物过滤并蒸发,得到呈白色固体状的2-氯-6-[3-(2-二螺[2.0.2.1]庚-7-基乙氧基)吡唑-1-基]吡啶-3-甲酸叔丁酯(5.69g,79%)。1h nmr(400mhz,氯仿-d)δ8.35(d,j=2.9hz,1h),8.18(d,j=8.4hz,1h),7.69(d,j=8.4hz,1h),5.94(d,j=2.9hz,1h),4.25(s,2h),1.90(d,j=6.8hz,2h),1.62(s,9h),1.49(t,j=6.6hz,1h),0.85(d,j=1.5hz,4h),0.65(d,j=1.5hz,2h),0.52(d,j=1.1hz,2h)。esi-ms m/z计算值415.16626,实验值360.0(m-tbu)
;保留时间:2.09min(lc方法a)。
[2692]
步骤8:2-氯-6-[3-(2-二螺[2.0.2.1]庚-7-基乙氧基)吡唑-1-基]吡啶-3-甲酸
[2693][2694]
将2-氯-6-[3-(2-二螺[2.0.2.1]庚-7-基乙氧基)吡唑-1-基]吡啶-3-甲酸叔丁酯(5.85g,14.07mmol)溶解于含有三氟乙酸(16.26ml,211.1mmol)的二氯甲烷(58.5ml)中,并将反应物在室温下搅拌16小时。将反应物蒸发,并向所得固体中添加乙醚,并且然后减压移除乙醚。再重复两次从乙醚中蒸发,得到白色固体2-氯-6-[3-(2-二螺[2.0.2.1]庚-7-基乙氧基)吡唑-1-基]吡啶-3-甲酸(5.06g,100%)。1h nmr(400mhz,氯仿-d)δ8.41(d,j=8.5hz,1h),8.37(d,j=2.9hz,1h),7.75(d,j=8.5hz,1h),5.97(d,j=2.9hz,1h),4.27(s,2h),1.91(d,j=6.7hz,2h),1.50(s,1h),0.85(d,j=1.5hz,4h),0.71-0.62(m,2h),0.52(d,j=1.1hz,2h)。esi-ms m/z计算值359.10367,实验值360.2(m 1)
;保留时间:2.16分钟(lc方法a)。
[2695]
实施例95:2-氯-6-(3-氟-5-异丁氧基-苯基)吡啶-3-甲酸的制备
[2696][2697]
步骤1:2-氯-6-(3-氟-5-异丁氧基-苯基)吡啶-3-甲酸叔丁酯
[2698][2699]
将2,6-二氯吡啶-3-甲酸叔丁酯(15.0g,60.5mmol)和(3-氟-5-异丁氧基-苯基)硼酸(13.46g,63.48mmol)合并,并完全溶解于乙醇(150ml)和甲苯(150ml)中。添加碳酸钠(19.23g,181.4mmol)于水(30ml)中的悬浮液。在氮气下添加四(三苯基膦)钯(0)(2.096g,1.814mmol)。使反应混合物在60℃下搅拌16小时。在减压下移除挥发物。将剩余的固体在水(100ml)和乙酸乙酯(100ml)之间分配。将有机层用盐水(1x100ml)洗涤,经硫酸钠干燥,过滤并减压浓缩。对材料进行硅胶柱色谱法(0%至20%乙酸乙酯/己烷梯度)。材料通过硅胶色谱法(等度100%己烷持续10分钟,然后0至5%乙酸乙酯/己烷梯度)再纯化,得到呈无色油状物的2-氯-6-(3-氟-5-异丁氧基-苯基)吡啶-3-甲酸叔丁酯(18.87g,49.68mmol,82%)。1h nmr(400mhz,二甲基亚砜-d6)δ8.24(d,j=8.0hz,1h),8.16(d,j=8.1hz,1h),7.48(dd,j=9.4,2.0hz,2h),6.99(dt,j=10.8,2.2hz,1h),3.86(d,j=6.5hz,2h),2.05(dt,j=13.3,6.6hz,1h),1.57(d,j=9.3hz,9h),1.00(t,j=5.5hz,6h)。esi-ms m/z计算值379.13504,实验值380.2(m 1)
;保留时间:2.57分钟(lc方法a)。
[2700]
步骤2:2-氯-6-(3-氟-5-异丁氧基-苯基)吡啶-3-甲酸
[2701][2702]
将2-氯-6-(3-氟-5-异丁氧基-苯基)吡啶-3-甲酸叔丁酯(18.57g,48.89mmol)溶解于二氯甲烷(200ml)中。添加三氟乙酸(60ml,780mmol),并使反应混合物在室温下搅拌1小时。将反应混合物在40℃下搅拌2小时。将反应混合物减压浓缩,并溶解于乙酸乙酯(100ml)中。将该溶液用饱和碳酸氢钠水溶液(1x100ml)和盐水(1x100ml)洗涤,经硫酸钠干燥,过滤并减压浓缩。将粗产物悬浮于乙酸乙酯(75ml)中,并用盐酸水溶液(1n,1x75ml)洗涤。有机层经硫酸钠干燥,过滤并减压浓缩。将所得固体(17.7g)于二氯甲烷(35ml)中的浆液在40℃下搅拌30分钟。在冷却至室温之后,将浆液过滤,并且然后用冷二氯甲烷冲洗,得到呈白色固体状的2-氯-6-(3-氟-5-异丁氧基-苯基)吡啶-3-甲酸(11.35g,35.06mmol,72%)。1h nmr(400mhz,二甲基亚砜-d6)δ13.76(s,1h),8.31(d,j=8.0hz,1h),8.17(d,j=8.1hz,1h),7.54-7.47(m,2h),7.00(dt,j=10.8,2.3hz,1h),3.87(d,j=6.5hz,2h),2.05(dt,j=13.3,6.6hz,1h),1.01(d,j=6.7hz,6h)。esi-ms m/z计算值323.1,实验值324.1(m 1)
;保留时间:1.96min(lc方法a)。
[2703]
实施例96:(14s)-12,12-二甲基-8-(3-{2-[1-(三氟甲基)环丙基]乙氧基}-1h-吡唑-1-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5,7,9,19,21-六烯-2,2,4-三酮的制备
[2704]
[2705]
步骤1:4-(3-羟丙基)-2,2-二甲基-吡咯烷-1-甲酸叔丁酯
[2706][2707]
使1l、3颈圆底烧瓶配备有机械搅拌器、冷却浴、加料漏斗、j-kem温度探针和氮气入口/出口。在氮气气氛下,向容器中装入3-(5,5-二甲基吡咯烷-3-基)丙-1-醇(15g,95.39mmol)和二氯甲烷(225ml,15ml/g),得到澄清浅黄色溶液。开始搅拌,并记录锅温为19℃。向冷却浴中装入碎冰/水并将锅温降低至0℃。向加料漏斗中装入三乙胺(12.55g,124.0mmol),随后在5分钟内逐滴添加纯品。未观察到放热。然后向加料漏斗中装入溶解于二氯甲烷(225ml)中的二碳酸二叔丁酯(22.89g,104.9mmol)。然后在30分钟内逐滴添加澄清浅黄色溶液,从而导致缓慢气体逸出。未观察到放热。移除冷却浴,并且使所得的澄清浅黄色溶液温热至室温,并在室温下继续搅拌3小时。将反应混合物转移到分液漏斗中并用水(75ml)分配。将有机物移除并用饱和氯化钠溶液(75ml)洗涤,经硫酸钠(150g)干燥,并且然后通过玻璃料布氏漏斗过滤。将滤液减压浓缩,得到(30g)作为所需粗产物的澄清浅黄色油状物。该材料通过硅胶柱快速色谱法(液体负载用二氯甲烷进行),在60分钟内用100%二氯甲烷至10%甲醇/二氯甲烷的梯度洗脱进行纯化,从而收集50ml级分。将所需产物级分合并并减压浓缩,得到呈澄清浅黄色粘性油状物的4-(3-羟丙基)-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(22g,0.0855mol,90%产率)。1h nmr(400mhz,dmso-d6)δ4.38(td,j=5.2,1.4hz,1h),3.54(dt,j=10.3,6.7hz,1h),3.38(td,j=6.6,3.5hz,2h),2.76(q,j=10.3hz,1h),2.07(td,j=11.6,5.7hz,1h),1.87(ddd,j=16.7,12.1,6.0hz,1h),1.37(dd,j=14.2,10.4hz,17h),1.24(s,3h)。
[2708]
步骤2:2,2-二甲基-4-(3-甲基磺酰基氧基丙基)吡咯烷-1-甲酸叔丁酯
[2709][2710]
将4-(3-羟丙基)-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(50.5g,196.22mmol)和三乙胺(39.711g,54.698ml,392.44mmol)溶解于二氯甲烷(500ml)中,并将所得溶液在冰水浴中冷却30分钟。在30分钟内逐滴添加甲磺酰氯(24.725g,16.706ml,215.84mmol),然后移除冰浴,并将混合物在室温下搅拌一小时。然后用饱和碳酸氢钠溶液(200ml)淬灭反应物。分离各相,并用饱和碳酸氢钠(200ml)和水(2x100ml)萃取有机相。将水相丢弃,并将有机相经硫酸钠干燥,过滤并真空浓缩,得到呈浅黄色油状物的2,2-二甲基-4-(3-甲基磺酰基氧基丙基)吡咯烷-1-甲酸叔丁酯(64.2g,93%)。esi-ms m/z计算值335.1766,实验值336.4(m 1)
;保留时间:5.54min(lc方法c)。
[2711]
步骤3:4-(3-氨基丙基)-2,2-二甲基-吡咯烷-1-甲酸叔丁酯
[2712][2713]
将2,2-二甲基-4-(3-甲基磺酰基氧基丙基)吡咯烷-1-甲酸叔丁酯(64.2g,191.38mmol)溶解在二噁烷(650ml)中,并且然后添加氢氧化铵(650ml),并将所得混合物加热至45℃,持续18小时。在18小时后,将反应物冷却至室温。将溶液用1m氢氧化钠(200ml)稀释,并且然后用乙醚(3x650ml)萃取。丢弃水相,并且用水(2x200ml)萃取合并的有机相。将
水相丢弃,并将有机相经硫酸钠干燥,过滤并真空浓缩,得到呈浅黄色油状物的4-(3-氨基丙基)-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(48.9g,95%)。esi-ms m/z计算值256.2151,实验值257.3(m 1)
;保留时间:3.70min(lc方法c)。
[2714]
步骤4:2,2-二甲基-4-[3-[(6-氨磺酰基-2-吡啶基)氨基]丙基]吡咯烷-1-甲酸叔丁酯
[2715][2716]
向含4-(3-氨基丙基)-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(8.91g,34.8mmol)和6-氟吡啶-2-磺酰胺(6.13g,34.8mmol)的二甲基亚砜(75ml)中添加碳酸钾(4.91g,35.5mmol),并且将混合物在100℃下搅拌12小时,并且然后冷却至环境温度并再搅拌4小时(总共16小时)。将反应混合物缓慢倒入含盐酸(35ml,1m,35.00mmol)的水(200ml)中(有些起泡沫),并用乙酸乙酯(250ml)稀释。分离有机相并用100ml盐水洗涤。将有机相经硫酸镁干燥,经硅藻土过滤并真空浓缩,得到深黄色油状物。粗产物通过硅胶色谱法,用0%-100%乙酸乙酯/己烷洗脱来进行纯化。收集纯(9.0g)和不纯(3g)级分。通过硅胶色谱法,用0%-100%乙酸乙酯/己烷洗脱来纯化不纯级分,总共得到2,2-二甲基-4-[3-[(6-亚氨基甲酰基-2-吡啶基)氨基]丙基]吡咯烷-1-甲酸叔丁酯(10.0g,69%)。1h nmr(400mhz,二甲基亚砜-d6)δ7.52(dd,j=8.5,7.2hz,1h),7.07(s,2h),6.95(dd,j=7.2,0.7hz,2h),6.61(d,j=8.5hz,1h),3.55(q,j=9.1hz,1h),3.32-3.24(m,2h),2.79(q,j=10.0hz,1h),2.13(d,j=16.1hz,1h),1.96-1.82(m,1h),1.51(dt,j=18.0,9.3hz,2h),1.37(dd,j=12.9,10.6hz,15h),1.24(s,3h)。esi-ms m/z计算值412.21442,实验值413.1(m 1)
;保留时间:2.34min(lc方法k)。
[2717]
步骤5:4-[3-[[6-[[2-氯-6-[3-[2-[1-(三氟甲基)环丙基]乙氧基]吡唑-1-基]吡啶-3-羰基]氨磺酰基]-2-吡啶基]氨基]丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯
[2718][2719]
部分a:向含2-氯-6-[3-[2-[1-(三氟甲基)环丙基]乙氧基]吡唑-1-基]吡啶-3-甲酸(11.4g,30.34mmol)的四氢呋喃(150ml)中缓慢添加羰基二咪唑(5.9g,36mmol)。将混合物在环境温度下搅拌1小时。再添加羰基二咪唑(0.5g,3mmol),并将反应物在环境温度下再搅拌1小时(总共2小时)。
[2720]
部分b:向a部分中制备的活化酯中添加含2,2-二甲基-4-[3-[(6-氨磺酰基-2-吡啶基)氨基]丙基]吡咯啶-1-甲酸叔丁酯(10.0g,24.24mmol)的四氢呋喃(50ml),随后添加1,8-二氮杂双环[5.4.0]十一碳-7-烯(7.5ml,50mmol)并且将混合物在环境温度下搅拌16小时。将含柠檬酸(25.1g,130.6mmol)的水(200ml)缓慢添加到反应混合物中并酸化至约ph=3。混合物变得浑浊,但没有形成沉淀。将混合物用乙酸乙酯(400ml)萃取,并将有机相用
盐水洗涤,经硫酸镁干燥,经硅藻土过滤,并真空浓缩。粗产物通过硅胶色谱法,用0-80%乙酸乙酯/己烷洗脱来纯化,得到泡沫状产物4-[3-[[6-[[2-氯-6-[3-[2-[1-(三氟甲基)环丙基]乙氧基]吡唑-1-基]吡啶-3-羰基]氨磺酰基]-2-吡啶基]氨基]丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(13.82g,74%)1h nmr(400mhz,二甲基亚砜-d6)δ12.79(s,1h),8.40(t,j=2.7hz,1h),8.11(d,j=8.4hz,1h),7.71(d,j=8.3hz,1h),7.62(dd,j=8.5,7.2hz,1h),7.21(d,j=5.8hz,1h),7.17(d,j=7.1hz,1h),6.74(d,j=8.5hz,1h),6.19(t,j=2.3hz,1h),4.34(t,j=7.1hz,2h),3.50(dt,j=18.3,9.0hz,1h),3.23(d,j=6.7hz,2h),2.80-2.69(m,1h),2.09(t,j=7.1hz,2h),1.79(td,j=12.4,6.1hz,1h),1.52(dt,j=15.4,8.0hz,2h),1.36(d,j=11.4hz,10h),1.33-1.25(m,5h),1.17(s,2h),0.99-0.92(m,2h),0.89(d,j=5.0hz,2h)。esi-ms m/z计算值769.2636,实验值770.1(m 1)
;保留时间:3.48min(lc方法k)。
[2721]
步骤6:2-氯-{n}-[[6-[3-(5,5-二甲基吡咯烷-3-基)丙基氨基]-2-吡啶基]磺酰基]-6-[3-[2-[1-(三氟甲基)环丙基]乙氧基]吡唑-1-基]吡啶-3-甲酰胺(二盐酸盐)
[2722][2723]
向含4-[3-[[6-[[2-氯-6-[3-[2-[1-(三氟甲基)环丙基]乙氧基]吡唑-1-基]吡啶-3-羰基]氨磺酰基]-2-吡啶基]氨基]丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(13.8g,17.92mmol)的二氯甲烷(75ml)中添加盐酸(15ml,4m,60.00mmol),并将混合物在环境温度下搅拌16小时。真空移除溶剂,并用100ml乙酸乙酯稀释残余物。将溶剂真空移除并再用100ml乙酸乙酯重复操作,得到泡沫状物2-氯-{n}-[[6-[3-(5,5-二甲基吡咯烷-3-基)丙基氨基]-2-吡啶基]磺酰基]-6-[3-[2-[1-(三氟甲基)环丙基]乙氧基]吡唑-1-基]吡啶-3-甲酰胺(二盐酸盐)(13.5g,101%)。1h nmr(400mhz,二甲基亚砜-d6)δ12.83(s,1h),9.06(s,1h),8.92(s,1h),8.42(d,j=2.8hz,1h),8.11(d,j=8.4hz,1h),7.72(d,j=8.4hz,1h),7.63(dd,j=8.5,7.2hz,1h),7.29(s,1h),7.18(dd,j=7.2,0.7hz,1h),6.76(dd,j=8.5,0.7hz,1h),6.21(d,j=2.9hz,1h),4.95(s,2h),4.35(t,j=7.0hz,2h),3.41-3.28(m,1h),3.24(p,j=6.7hz,2h),2.80(tt,j=11.8,6.7hz,1h),2.35(q,j=7.8,7.3hz,1h),2.09(t,j=7.1hz,2h),1.91(dd,j=12.8,7.6hz,1h),1.58-1.43(m,3h),1.42-1.31(m,5h),1.24(s,3h),1.01-0.93(m,2h),0.90(dd,j=7.9,3.2hz,2h)。esi-ms m/z计算值669.2112,实验值670.0(m 1)
;保留时间:2.26min(lc方法k)。
[2724]
步骤7:12,12-二甲基-8-(3-{2-[1-(三氟甲基)环丙基]乙氧基}-1h-吡唑-1-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮
[2725][2726]
向含2-氯-n-[[6-[3-(5,5-二甲基吡咯烷-3-基)丙基氨基]-2-吡啶基]磺酰基]-6-[3-[2-[1-(三氟甲基)环丙基]乙氧基]吡唑-1-基]吡啶-3-甲酰胺(二盐酸盐)(12.9g,17.36mmol)的nmp(120ml)中添加碳酸钾(9.64g,69.8mmol),随后添加氟化铯(2.69g,17.7mmol),并将浆液在150℃下加热16小时。然后将反应物冷却到环境温度。将混合物用水(100ml)稀释并倒入水(400ml)中,并将混合物用盐酸(27.0ml,6m,162.0mmol)缓慢酸化。使用中等玻璃料收集沉淀,并用50ml水洗涤3次。将固体空气干燥1小时,并且然后溶解于乙酸乙酯(400ml)中。将有机相真空浓缩,并且通过硅胶色谱法用0-100%乙酸乙酯/己烷洗脱来纯化粗产物。收集6.3g纯产物和6g不纯级分。通过硅胶色谱法用0-5%甲醇/二氯甲烷洗脱来纯化不纯级分,实现产物与杂质的良好分离。将纯产物级分合并,得到12,12-二甲基-8-(3-{2-[1-(三氟甲基)环丙基]乙氧基}-1h-吡唑-1-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮(7.4g,67%)。1h nmr(400mhz,二甲基亚砜-d6)δ12.52(s,1h),8.22(d,j=2.8hz,1h),7.82(d,j=8.2hz,1h),7.58(dd,j=8.5,7.2hz,1h),7.05(d,j=7.0hz,1h),7.00(s,1h),6.92(d,j=8.2hz,1h),6.71(d,j=8.2hz,1h),6.11(d,j=2.8hz,1h),4.31(t,j=7.0hz,2h),4.02-3.81(m,1h),3.15(dt,j=10.1,3.8hz,1h),2.95(d,j=13.7hz,1h),2.78-2.61(m,1h),2.15(dd,j=5.7,2.9hz,1h),2.07(d,j=6.4hz,2h),1.92-1.82(m,1h),1.81-1.69(m,1h),1.64-1.53(m,6h),1.51(s,3h),1.36-1.23(m,1h),0.99-0.93(m,2h),0.90(d,j=10.8hz,2h)。esi-ms m/z计算值633.2345,实验值634.2(m 1)
;保留时间:2.23min(lc方法l)。
[2727]
步骤8:(14r)-12,12-二甲基-8-(3-{2-[1-(三氟甲基)环丙基]乙氧基}-1h-吡唑-1-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5,7,9,19,21-六烯-2,2,4-三酮和(14s)-12,12-二甲基-8-(3-{2-[1-(三氟甲基)环丙基]乙氧基}-1h-吡唑-1-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5,7,9,19,21-六烯-2,2,4-三酮
[2728][2729]
将外消旋12,12-二甲基-8-(3-{2-[1-(三氟甲基)环丙基]乙氧基}-1h-吡唑-1-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮(7.4g)溶解于150ml乙腈中,并进行手性sfc纯化。样品通过手性sfc色谱法,使用chiralpak as-h(250x21.2mm柱,5μm粒度)和25%乙腈:甲醇(90:10))/75%二氧化碳流动相,以70ml/min进行分离,得到呈洗脱的第一对映异构体形式的(14r)-12,12-二甲基-8-(3-{2-[1-(三氟甲基)环丙基]乙氧基}-1h-吡唑-1-基)-2λ
6-硫
杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5,7,9,19,21-六烯-2,2,4-三酮(2.91g,53%);1h nmr(400mhz,二甲基亚砜-d6)δ12.51(s,1h),8.21(d,j=2.7hz,1h),7.82(d,j=8.2hz,1h),7.58(t,j=7.8hz,1h),7.05(d,j=7.0hz,1h),6.99(d,j=5.8hz,1h),6.92(d,j=8.2hz,1h),6.71(d,j=8.5hz,1h),6.11(d,j=2.7hz,1h),4.31(t,j=7.0hz,2h),3.93(s,1h),3.16(s,1h),2.95(d,j=12.7hz,1h),2.80-2.64(m,1h),2.10(s,1h),2.08(t,j=7.1hz,2h),1.86(dd,j=11.5,5.4hz,1h),1.81-1.71(m,1h),1.60(s,6h),1.51(s,3h),1.31(d,j=12.8hz,1h),0.95(d,j=4.3hz,2h),0.89(s,2h);esi-ms m/z计算值633.2345,实验值634.3(m 1)
;保留时间:2.19分钟;以及呈洗脱的第二对映异构体形式的(14s)-12,12-二甲基-8-(3-{2-[1-(三氟甲基)环丙基]乙氧基}-1h-吡唑-1-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5,7,9,19,21-六烯-2,2,4-三酮(3.0g,54%)1h nmr(400mhz,二甲基亚砜-d6)δ12.52(s,1h),8.22(d,j=2.8hz,1h),7.82(d,j=8.2hz,1h),7.58(dd,j=8.5,7.1hz,1h),7.05(d,j=7.2hz,1h),6.99(s,1h),6.92(d,j=8.2hz,1h),6.71(d,j=8.5hz,1h),6.11(d,j=2.8hz,1h),4.31(t,j=7.0hz,2h),3.92(d,j=12.6hz,1h),3.15(s,1h),2.95(d,j=13.2hz,1h),2.78-2.64(m,1h),2.08(t,j=7.1hz,3h),1.86(dd,j=11.9,5.3hz,1h),1.77(s,1h),1.60(s,6h),1.51(s,3h),1.31(q,j=11.9hz,1h),1.00-0.92(m,2h),0.90(d,j=10.4hz,2h)。esi-ms m/z计算值633.2345,实验值634.1(m 1)
;保留时间:2.2min(lc方法a)。
[2730]
实施例97:(4s)-4-[3-(4-叔丁基-2-吡啶基)-3-[(6-氨磺酰基-2-吡啶基)氨基]丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯的制备
[2731][2732]
步骤1:4-叔丁基-1-氧代-吡啶-1-鎓
[2733][2734]
在2l圆底烧瓶中,将4-叔丁基吡啶(73.030g,81ml,529.34mmol)添加到冰乙酸
(600ml)中。接着,添加过氧化氢(30%于水中,450ml),并将反应混合物在空气下回流4小时。再添加过氧化氢(30%于水中,450ml),并继续回流过夜(16小时)。在旋转蒸发仪中移除溶剂,并将剩余溶液用饱和碳酸钠溶液中和,并且然后用二氯甲烷(2x500ml)加上氯仿:异丙醇(3:1,v:v,3x200ml)萃取。合并的有机物经mgso4干燥,过滤并浓缩,得到粗制的4-叔丁基-1-氧化-吡啶-1-鎓(89g,100%)。esi-ms m/z计算值151.0997,实验值152.4(m 1)
;保留时间:1.92分钟(lc方法b)。
[2735]
步骤2:4-叔丁基-2-氯-吡啶
[2736][2737]
将4-叔丁基-1-氧代-吡啶-1-鎓(50.6g,301.18mmol)置于反应烧瓶中,并在冰浴中冷却。将pocl3(250ml)缓慢添加到反应烧瓶中,以获得混合物。将混合物在回流下加热20小时。此后,将温度缓慢降低至20℃,通过真空蒸发从混合物中移除溶剂,然后添加碳酸钠水溶液用于中和,并且使用乙酸乙酯(2x800ml)萃取内容物。将有机层通过盐水洗涤,经硫酸钠干燥并浓缩。通过硅胶快速色谱法,使用0至30%乙酸乙酯/己烷来纯化粗残余物,得到呈琥珀色液体状的4-叔丁基-2-氯-吡啶(38.6g,72%)。1h nmr(500mhz,dmso-d6)δ8.32(dd,j=5.3,0.7hz,1h),7.48
–
7.40(m,2h),1.27(s,9h)。esi-ms m/z计算值169.0658,实验值170.3(m 1)
;保留时间:3.11分钟(lc方法b)。
[2738]
步骤3:2-溴-4-叔丁基-吡啶
[2739][2740]
将4-叔丁基-2-氯-吡啶(27.07g,151.58mmol)和三甲基溴硅烷(170.52g,150ml,1.092mol)于丙腈(450ml)中的溶液在回流下搅拌21小时。将反应烧瓶抽真空以移除溶剂,添加碳酸钠水溶液用于中和,并使用乙酸乙酯(2x800ml)萃取反应烧瓶中的内容物。将有机层通过盐水洗涤,经硫酸钠干燥并浓缩。通过硅胶快速色谱法,使用0至30%乙酸乙酯/己烷来纯化粗残余物,得到呈琥珀色液体状的2-溴-4-叔丁基-吡啶(34.2g,100%)。1h nmr(500mhz,dmso-d6)δ8.29(d,j=5.3hz,1h),7.58(s,1h),7.46(dd,j=5.2,1.7hz,1h),1.27(s,9h)。esi-ms m/z计算值213.0153,实验值214.3(m 1)
;保留时间:5.01分钟(lc方法c)。
[2741]
步骤4:(4s)-4-[3-(4-叔丁基-2-吡啶基)-3-(叔丁基亚磺酰基氨基)丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯
[2742]
[2743]
将2-溴-4-叔丁基-吡啶(6g,26.623mmol)溶解于乙醚(60ml)中,并且将溶液在氮气气氛下在干冰丙酮浴(《-70℃)中冷却。逐滴添加n-buli(12ml,2.5m于己烷中,30.00mmol)。将混合物在冷却浴中搅拌40分钟。添加(4s)-4-[(3z)-3-叔丁基亚磺酰基亚氨基丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(4.45g,11.79mmol)于thf(5ml)中的溶液。将混合物在-78℃至-40℃下搅拌45分钟。添加饱和nh4cl水溶液(80ml)。使混合物升温至室温,并在水(80ml)和etoac(100ml)之间分配。将该淬灭的混合物分成两层,并将水层用etoac(100ml)萃取一次。将合并的有机物用盐水洗涤,经无水na2so4干燥,过滤并浓缩。通过硅胶快速色谱法,使用0至20%乙酸乙酯/己烷来纯化残余物,得到(4s)-4-[3-(4-叔丁基-2-吡啶基)-3-(叔丁基亚磺酰基氨基)丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(4.87g,79%)。esi-ms m/z计算值493.3338,实验值494.6(m 1)
;保留时间:3.01分钟(lc方法b)。
[2744]
步骤5:(4s)-4-[3-氨基-3-(4-叔丁基-2-吡啶基)丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯
[2745][2746]
将(4s)-4-[3-(4-叔丁基-2-吡啶基)-3-(叔丁基亚磺酰基氨基)丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(4.87g,9.37mmol)溶解于thf(43ml)和水(8.3ml)中。添加分子碘(750mg,2.95mmol)。将混合物在52℃下搅拌3小时。然后将其冷却至室温,并使其在etoac(200ml)和含na2s2o3(60g)的饱和nahco3水溶液(200ml)之间分配。分离各层,并且水层再用etoac(100ml)萃取一次。将有机层用盐水洗涤,经无水na2so4干燥,过滤并浓缩,得到(4s)-4-[3-氨基-3-(4-叔丁基-2-吡啶基)丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(3.9g,102%)。esi-ms m/z计算值389.3042,实验值390.7(m 1)
;保留时间:2.94分钟(lc方法b)。
[2747]
步骤6:(4s)-4-[3-(4-叔丁基-2-吡啶基)-3-[(6-氨磺酰基-2-吡啶基)氨基]丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯
[2748][2749]
向(4s)-4-[3-氨基-3-(4-叔丁基-2-吡啶基)丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(3.9g,9.5104mmol)和6-氟吡啶-2-磺酰胺(3g,16.178mmol)于dmso(10ml)中的混合物中添加diea(5ml,28.706mmol)。将混合物在115℃下搅拌24小时。将反应混合物冷却至室温,并且然后用水(100ml)和etoac(100ml)稀释。分离各层,并将有机层用盐水(2x100ml)洗
涤,经无水na2so4干燥,并浓缩。通过硅胶快速色谱法(120g柱),使用0-80%etoac/己烷来纯化残余物,得到呈浅色固体状的(4s)-4-[3-(4-叔丁基-2-吡啶基)-3-[(6-氨磺酰基-2-吡啶基)氨基]丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(3.66g,67%)。1h nmr(500mhz,dmso-d6)δ8.43(d,j=5.2hz,1h),7.55
–
7.48(m,2h),7.44(d,j=9.5hz,1h),7.24(dd,j=5.2,1.9hz,1h),7.07(s,2h),6.95(d,j=7.2hz,1h),6.73(d,j=8.5hz,1h),5.22(s,1h),3.51(p,j=8.9hz,1h),2.73(dtd,j=21.5,10.6,4.4hz,1h),2.05(s,1h),1.94
–
1.73(m,3h),1.42
–
1.35(m,10h),1.32(dd,j=12.4,3.0hz,4h),1.26(d,j=0.9hz,9h),1.21(s,3h)。esi-ms m/z计算值545.3036,实验值546.1(m 1)
;保留时间:2.19分钟(lc方法h)。
[2750]
实施例98:n-[3-[(3s)-5,5-二甲基-1-(2,2,2-三氟乙酰基)吡咯烷-3-基]亚丙基]-2-甲基-丙烷-2-亚磺酰胺的制备
[2751][2752]
步骤1:2,2,2-三氟-1-[(4s)-4-(3-羟丙基)-2,2-二甲基-吡咯烷-1-基]乙烯酮
[2753][2754]
将3-[(3s)-5,5-二甲基吡咯烷-3-基]丙-1-醇(8.3g,50.142mmol)溶解于dcm(100ml)中。添加net3(14ml,100.44mmol),并将混合物在氮气球下在冰水浴中搅拌5分钟。在5分钟内经由注射器逐滴添加三氟乙酸酐(11ml,78.036mmol)。使混合物在室温下搅拌2小时。然后将其浓缩,并将残余物溶解于meoh和thf(各20ml)的混合物。添加含lioh(1g,41.757mmol)的水(20ml)。将混合物在室温下搅拌2小时。将混合物浓缩,并且然后在水和dcm(各50ml)之间分配。分离各层,并将水层用dcm(50ml x 2)进一步萃取。合并的有机物经无水mgso4干燥,过滤并真空浓缩,得到2,2,2-三氟-1-[(4s)-4-(3-羟丙基)-2,2-二甲基-吡咯烷-1-基]乙酮(10.3g,77%)。esi-ms m/z计算值253.129,实验值254.3(m 1)
;保留时间:2.41分钟(lc方法b)。
[2755]
步骤2:3-[(3s)-5,5-二甲基-1-(2,2,2-三氟乙酰基)吡咯烷-3-基]丙醛
[2756][2757]
将2,2,2-三氟-1-[(4s)-4-(3-羟丙基)-2,2-二甲基-吡咯烷-1-基]乙酮(7g,
26.26mmol)溶解于dcm(100ml)中。将溶液在冰水浴中冷却。在1分钟内以小份添加戴斯-马丁过碘烷(12.895g,28.88mmol)。将混合物在氮气(气球)下搅拌,同时移除冰浴。在2小时后,添加nas2o3(约10g)于饱和nahco3水溶液(50ml)中的混合溶液。将混合物搅拌30分钟。分离各层。将dcm层进一步用nahco3(饱和水溶液50ml x 2)萃取,经无水na2so4干燥,过滤并浓缩。通过硅胶色谱法(rf:0.48 3/1己烷/etoac),使用0-50%etoac/己烷来纯化残余油状物,得到3-[(3s)-5,5-二甲基-1-(2,2,2-三氟乙酰基)吡咯烷-3-基]丙醛(5.58g,80%)。esi-ms m/z计算值251.1133,实验值252.5(m 1)
;保留时间:3.54分钟(lc方法b)。
[2758]
步骤3:n-[3-[(3s)-5,5-二甲基-1-(2,2,2-三氟乙酰基)吡咯烷-3-基]亚丙基]-2-甲基-丙烷-2-亚磺酰胺
[2759][2760]
在室温下,将3-[(3s)-5,5-二甲基-1-(2,2,2-三氟乙酰基)吡咯烷-3-基]丙醛(7.5g,28.36mmol)溶解于dcm(70ml)中。添加2-甲基丙烷-2-亚磺酰胺(3.45g,27.896mmol),随后添加硫酸镁(18g,148.79mmol)和对甲苯磺酸吡啶鎓(358mg,1.40mmol)。将混合物在氮气气氛下搅拌18小时。然后将其过滤通过硅藻土垫,再用dcm洗涤。将合并的滤液浓缩,并且通过硅胶快速色谱法,使用5%-60%etoac/己烷来纯化残余物,得到n-[3-[(3s)-5,5-二甲基-1-(2,2,2-三氟乙酰基)吡咯烷-3-基]亚丙基]-2-甲基-丙烷-2-亚磺酰胺(9.8g,93%)。esi-ms m/z计算值354.1589,实验值355.5(m 1)
;保留时间:3.12分钟(lc方法b)。
[2761]
实施例99:(14s)-12,12-二甲基-17-(吡啶-2-基)-8-(3-{2-[1-(三氟甲基)环丙基]乙氧基}-1h-吡唑-1-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮(非对映异构体1,化合物362)和(14s)-12,12-二甲基-17-(吡啶-2-基)-8-(3-{2-[1-(三氟甲基)环丙基]乙氧基}-1h-吡唑-1-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮(非对映异构体2,化合物361)的制备
[2762][2763]
步骤1:(4s)-4-[3-[[6-[[2-氯-6-[3-[2-[1-(三氟甲基)环丙基]乙氧基]吡唑-1-基]吡啶-3-羰基]氨磺酰基]-2-吡啶基]氨基]-3-(2-吡啶基)丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯
[2764][2765]
向2-氯-6-[3-[2-[1-(三氟甲基)环丙基]乙氧基]吡唑-1-基]吡啶-3-甲酸(350mg,0.9315mmol)于thf(6ml)中的溶液中添加cdi(150mg,0.9251mmol)(从thf再结晶),并将混合物在室温下搅拌3小时,然后添加(4s)-2,2-二甲基-4-[3-(2-吡啶基)-3-[(6-氨磺酰基-2-吡啶基)氨基]丙基]吡咯烷-1-甲酸叔丁酯(271mg,0.5535mmol),随后添加dbu(275μl,1.839mmol),并且将所得混合物在室温下搅拌16小时。将反应物用乙酸乙酯稀释,并用饱和碳酸氢钠水溶液洗涤。将有机层进一步用10%柠檬酸溶液洗涤,随后用盐水洗涤。将有机物分离,经硫酸钠干燥,蒸发并且然后通过硅胶色谱法(40克柱),使用100%己烷至100%乙酸乙酯梯度,随后通过第二硅胶柱(40克柱),使用100%二氯甲烷至15%甲醇/二氯甲烷梯度进行纯化,得到呈灰白色固体状的(4s)-4-[3-[[6-[[2-氯-6-[3-[2-[1-(三氟甲基)环丙基]乙氧基]吡唑-1-基]吡啶-3-羰基]氨磺酰基]-2-吡啶基]氨基]-3-(2-吡啶基)丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(309mg,66%)。esi-ms m/z计算值846.29016,实验值847.2(m 1)
;保留时间:1.98分钟(lc方法a)。
[2766]
步骤2:(14s)-12,12-二甲基-17-(吡啶-2-基)-8-(3-{2-[1-(三氟甲基)环丙基]乙氧基}-1h-吡唑-1-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二
十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮
[2767][2768]
阶段1:将(4s)-4-[3-[[6-[[2-氯-6-[3-[2-[1-(三氟甲基)环丙基]乙氧基]吡唑-1-基]吡啶-3-羰基]氨磺酰基]-2-吡啶基]氨基]-3-(2-吡啶基)丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(309mg,0.3647mmol)溶解于dcm(14ml)中,并且向混合物中添加hcl(4m于二噁烷中)(3.0ml,12.00mmol),并且将反应物在室温下搅拌。在2小时后,将反应物用碳酸钠水溶液碱化,直到ph约8。然后将其用乙酸乙酯稀释,并用饱和碳酸氢钠水溶液洗涤。将有机层萃取,并且然后用盐水进一步洗涤。将有机物分离,经硫酸钠干燥,蒸发,并且然后置于高真空泵上2小时,得到呈灰白色固体状的中间体2-氯-n-[[6-[[3-[(3s)-5,5-二甲基吡咯烷-3-基]-1-(2-吡啶基)丙基]氨基]-2-吡啶基]磺酰基]-6-[3-[2-[1-(三氟甲基)环丙基]乙氧基]吡唑-1-基]吡啶-3-甲酰胺(盐酸盐)。esi-ms m/z计算值746.23773,实验值747.2(m 1)
;保留时间:1.4分钟(lc方法a)。
[2769]
阶段2:来自阶段1的材料与k2co3(560mg,4.052mmol)、分子筛和dmso(14ml)合并于小瓶中,用氮气吹扫,封盖,加热至155℃并搅拌18小时。冷却至室温,并将反应物用乙酸乙酯稀释,并用饱和碳酸氢钠水溶液洗涤。将有机层进一步用盐水洗涤。将有机物分离,经硫酸钠干燥,蒸发,并且然后通过根据色谱法(40克柱),使用100%己烷至100%乙酸乙酯梯度进行纯化,得到(14s)-12,12-二甲基-17-(吡啶-2-基)-8-(3-{2-[1-(三氟甲基)环丙基]乙氧基}-1h-吡唑-1-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮(99mg,38%)。esi-ms m/z计算值710.26105,实验值711.2(m 1)
;保留时间:1.81分钟(lc方法a)。
[2770]
步骤3:(14s)-12,12-二甲基-17-(吡啶-2-基)-8-(3-{2-[1-(三氟甲基)环丙基]乙氧基}-1h-吡唑-1-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮(非对映异构体1,化合物362)和(14s)-12,12-二甲基-17-(吡啶-2-基)-8-(3-{2-[1-(三氟甲基)环丙基]乙氧基}-1h-吡唑-1-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮(非对映异构体2,化合物361)
[2771][2772]
使用以下方法对(14s)-12,12-二甲基-17-(吡啶-2-基)-8-(3-{2-[1-(三氟甲基)环丙基]乙氧基}-1h-吡唑-1-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮(两种非对映异构体的混合物,98mg,0.1379mmol)进行sfc:chiralpak ic(250x21.2mm,5μm)柱,40℃,流动相41%meoh、59%co2,流速70ml/min,浓度30mg/ml于meoh:dmso(90:10)中,进样体积500μl,压力166巴,波长278nm。分离出两种非对映异构体:
[2773]
非对映异构体1:灰白色固体:(14s)-12,12-二甲基-17-(吡啶-2-基)-8-(3-{2-[1-(三氟甲基)环丙基]乙氧基}-1h-吡唑-1-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮(44.22mg,90%)。1h nmr(500mhz,dmso-d6)δ12.58(s,1h),8.52(d,j=4.9hz,1h),8.23(d,j=2.8hz,1h),7.84(d,j=8.2hz,1h),7.69(dt,j=47.2,7.8hz,3h),7.44(d,j=7.9hz,1h),7.23(dd,j=7.6,4.9hz,1h),7.10(d,j=7.1hz,1h),6.91(dd,j=24.4,8.3hz,2h),6.12(d,j=2.8hz,1h),5.26(s,1h),4.32(t,j=7.0hz,2h),2.80(s,1h),2.24(s,1h),2.08(t,j=7.2hz,2h),2.00-1.85(m,3h),1.75(d,j=14.4hz,1h),1.64(s,4h),1.53(s,3h),1.48(d,j=12.9hz,1h),1.23(s,1h),0.96(d,j=4.7hz,2h),0.87(d,j=18.8hz,2h)。esi-ms m/z计算值710.26105,实验值711.2(m 1)
;保留时间:1.8分钟(lc方法a)。
[2774]
非对映异构体2:灰白色固体:(14s)-12,12-二甲基-17-(吡啶-2-基)-8-(3-{2-[1-(三氟甲基)环丙基]乙氧基}-1h-吡唑-1-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮(42.62mg,87%)。esi-ms m/z计算值710.26105,实验值711.2(m 1)
;保留时间:1.83分钟(lc方法a)。
[2775]
实施例100:(14s)-8-[3-(2-{二螺[2.0.2.1]庚-7-基}乙氧基)-1h-吡唑-1-基]-12,12-二甲基-17-(吡啶-2-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮(非对映异构体1,化合物356)和(14s)-8-[3-(2-{二螺[2.0.2.1]庚-7-基}乙氧基)-1h-吡唑-1-基]-12,12-二甲基-17-(吡啶-2-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮(非对映异构体2,化合物355)的制备
[2776][2777]
步骤1:(4r)-4-[3-[[6-[[2-氯-6-[3-(2-二螺[2.0.2.1]庚-7-基乙氧基)吡唑-1-基]吡啶-3-羰基]氨磺酰基]-2-吡啶基]氨基]-3-(2-吡啶基)丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯
[2778][2779]
向2-氯-6-[3-(2-二螺[2.0.2.1]庚-7-基乙氧基)吡唑-1-基]吡啶-3-甲酸(300mg,0.8338mmol)于thf(1.80ml)中的溶液中添加cdi(168.8mg,1.041mmol)(从thf再结晶),并将混合物在室温下搅拌2小时,然后添加(4s)-2,2-二甲基-4-[3-(2-吡啶基)-3-[(6-氨磺酰基-2-吡啶基)氨基]丙基]吡咯烷-1-甲酸叔丁酯(428.7mg,0.8756mmol)于thf(1.80ml)中的溶液,随后添加dbu(398.6mg,2.618mmol),并且将所得混合物在室温下搅拌3小时。将反应物用水和etoac稀释,然后添加hcl(932.2μl,6m,5.593mmol)。分离各层,并将有机层用水(1x)和盐水(1x)洗涤,然后经硫酸钠干燥并浓缩,得到白色泡沫,将所述白色泡沫过滤并使用反相hplc-ms方法,使用由phenomenex销售的luna c
18
(2)柱(75
×
30mm,5μm粒度)(pn:00c-4252-u0-ax)和在15.0分钟内从1%-99%流动相b运行的双梯度(流动相a=h2o(5mm hcl),流动相b=乙腈,流速=50ml/min,进样添加=950μl,并且柱温=25℃)进行纯化,得到(4r)-4-[3-[[6-[[2-氯-6-[3-(2-二螺[2.0.2.1]庚-7-基乙氧基)吡唑-1-基]吡啶-3-羰基]氨磺酰基]-2-吡啶基]氨基]-3-(2-吡啶基)丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(330mg,48%)。esi-ms m/z计算值830.3341,实验值831.8(m 1)
;保留时间:0.82分钟(lc方法d)。
[2780]
步骤2:2-氯-n-[[6-[[3-[(3r)-5,5-二甲基吡咯烷-3-基]-1-(2-吡啶基)丙基]氨基]-2-吡啶基]磺酰基]-6-[3-(2-二螺[2.0.2.1]庚-7-基乙氧基)吡唑-1-基]吡啶-3-甲酰胺
[2781][2782]
将(4r)-4-[3-[[6-[[2-氯-6-[3-(2-二螺[2.0.2.1]庚-7-基乙氧基)吡唑-1-基]吡啶-3-羰基]氨磺酰基]-2-吡啶基]氨基]-3-(2-吡啶基)丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(330mg,0.3969mmol)溶解于dcm(1.44ml)中,并且向混合物中添加tfa(1.22ml,15.89mmol),并且将混合物在室温下搅拌3小时。将混合物减压浓缩至干燥,添加1ml甲苯,并且通过旋转蒸发(45℃水浴)移除。再次添加1ml甲苯并通过旋转蒸发(45℃水浴)移除,然后真空干燥,得到2-氯-n-[[6-[[3-[(3r)-5,5-二甲基吡咯烷-3-基]-1-(2-吡啶基)丙基]氨基]-2-吡啶基]磺酰基]-6-[3-(2-二螺[2.0.2.1]庚-7-基乙氧基)吡唑-1-基]吡啶-3-甲酰胺(三氟乙酸盐)(335.5mg,100%),esi-ms m/z计算值730.2817,实验值731.7(m 1)
;保留时间:0.57分钟,呈白色固体状(lc方法d)。
[2783]
步骤3:(14s)-8-[3-(2-{二螺[2.0.2.1]庚-7-基}乙氧基)-1h-吡唑-1-基]-12,12-二甲基-17-(吡啶-2-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮(非对映异构体1,化合物356)和(14s)-8-[3-(2-{二螺[2.0.2.1]庚-7-基}乙氧基)-1h-吡唑-1-基]-12,12-二甲基-17-(吡啶-2-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮(非对映异构体2,化合物355)
[2784][2785]
向2-氯-n-[[6-[[3-[(3r)-5,5-二甲基吡咯烷-3-基]-1-(2-吡啶基)丙基]氨基]-2-吡啶基]磺酰基]-6-[3-(2-二螺[2.0.2.1]庚-7-基乙氧基)吡唑-1-基]吡啶-3-甲酰胺(三氟乙酸盐)(335.5mg,0.3969mmol)于nmp(20ml)中的溶液中添加碳酸钾(384.1mg,2.779mmol)。将混合物用氮气吹扫5分钟。将混合物在165℃下加热16小时。将混合物冷却至室温,用1n hcl稀释并用etoac(1x)萃取。将有机相用盐水(1x)洗涤,干燥(硫酸钠),过滤并浓缩,得到棕色油状物,将所述棕色油状物过滤并使用反相hplc-ms方法,使用由phenomenex销售的luna c
18
(2)柱(75
×
30mm,5μm粒度)(pn:00c-4252-u0-ax),和在15.0分
钟内从50%-99%流动相b运行的双梯度(流动相a=h2o(5mm hcl),流动相b=乙腈,流速=50ml/min,进样体积=950μl,并且柱温=25℃)进行纯化,得到待洗脱的第一非对映异构体,呈白色固体状的(14s)-8-[3-(2-{二螺[2.0.2.1]庚-7-基}乙氧基)-1h-吡唑-1-基]-12,12-二甲基-17-(吡啶-2-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮(110mg,80%)。1h nmr(500mhz,dmso-d6)δ12.47(s,1h),8.72(d,j=5.3hz,1h),8.20(d,j=2.8hz,2h),7.99(s,2h),7.70(t,j=7.8hz,3h),7.30(d,j=7.2hz,1h),6.95(d,j=8.4hz,1h),6.91(d,j=8.2hz,1h),6.08(d,j=2.7hz,1h),5.16(s,1h),4.21(t,j=6.7hz,2h),3.23(s,1h),2.94(s,1h),2.34(s,1h),2.19(s,1h),1.91(dd,j=12.2,5.7hz,1h),1.81(q,j=6.7hz,3h),1.60(s,4h),1.55(s,4h),1.47(s,1h),1.19(s,1h),0.83(d,j=5.7hz,4h),0.67-0.60(m,2h),0.50(d,j=9.0hz,2h)。esi-ms m/z计算值694.305,实验值695.7(m 1)
;保留时间:1.98分钟(lc方法a),和待洗脱的第二非对映异构体,呈白色固体状的(14s)-8-[3-(2-{二螺[2.0.2.1]庚-7-基}乙氧基)-1h-吡唑-1-基]-12,12-二甲基-17-(吡啶-2-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮(70mg,51%)。1h nmr(500mhz,dmso-d6)δ12.55(s,1h),8.77(d,j=5.3hz,1h),8.33(s,1h),8.23(d,j=2.7hz,1h),8.08-8.00(m,1h),7.95(s,1h),7.86(d,j=8.2hz,1h),7.73(t,j=7.9hz,2h),7.19(d,j=7.2hz,1h),6.98(d,j=8.5hz,1h),6.94(d,j=8.2hz,1h),6.10(d,j=2.7hz,1h),5.48(s,1h),4.22(t,j=6.6hz,2h),3.42(s,1h),2.74(t,j=10.3hz,1h),2.42(s,1h),2.04(s,2h),1.90(dd,j=11.7,5.2hz,1h),1.82(q,j=6.5hz,2h),1.78(s,1h),1.66(s,3h),1.61(d,j=12.5hz,1h),1.54(s,3h),1.53-1.45(m,2h),0.84(q,j=4.1,3.6hz,4h),0.65(dd,j=8.4,4.3hz,2h),0.51(dd,j=8.8,4.2hz,2h)。esi-ms m/z计算值694.305,实验值695.7(m 1)
;保留时间:2.0分钟(lc方法a)。
[2786]
实施例102:(14s)-8-[3-氟-5-(2-甲基丙氧基)苯基]-12,12-二甲基-17-(吡啶-2-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5(10),6,8,19(23),20-六烯-2,2,4-三酮(非对映异构体1,化合物352)和(14s)-8-[3-氟-5-(2-甲基丙氧基)苯基]-12,12-二甲基-17-(吡啶-2-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5(10),6,8,19(23),20-六烯-2,2,4-三酮(非对映异构体2,化合物351)的制备
[2787][2788]
步骤1:(4s)-4-[3-[[6-[[2-氯-6-(3-氟-5-异丁氧基-苯基)吡啶-3-羰基]氨磺酰基]-2-吡啶基]氨基]-3-(2-吡啶基)丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯
[2789][2790]
向2-氯-6-(3-氟-5-异丁氧基-苯基)吡啶-3-甲酸(143mg,0.4417mmol)于thf(5ml)中的溶液中添加cdi(78mg,0.4810mmol),并将混合物在室温下搅拌3小时,然后添加(4s)-2,2-二甲基-4-[3-(2-吡啶基)-3-[(6-氨磺酰基-2-吡啶基)氨基]丙基]吡咯烷-1-甲酸叔丁酯(170mg,0.3472mmol),随后添加dbu(200μl,1.337mmol),并且将所得混合物在室温下搅拌2小时。将反应物用饱和氯化铵和盐水溶液的1:1混合物淬灭,然后用乙酸乙酯萃取。将合并的有机层用盐水洗涤,经硫酸钠干燥,过滤并蒸发。将所得残余物通过反相hplc-ms方法,使用在15.0分钟内从30%-99%流动相b运行的双梯度纯化。流动相a=h20(5mm hcl)。流动相b=ch3cn,得到(4s)-4-[3-[[6-[[2-氯-6-(3-氟-5-异丁氧基-苯基)吡啶-3-羰基]氨磺酰基]-2-吡啶基]氨基]-3-(2-吡啶基)丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(152mg,55%)esi-ms m/z计算值794.30286,实验值795.4(m 1)
;保留时间:0.63分钟,呈灰白色固体状(lc方法g)。
[2791]
步骤2:(14s)-8-[3-氟-5-(2-甲基丙氧基)苯基]-12,12-二甲基-17-(吡啶-2-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5(10),6,8,19(23),20-六烯-2,2,4-三酮(非对映异构体1,化合物352)和(14s)-8-[3-氟-5-(2-甲基丙氧基)苯基]-12,12-二甲基-17-(吡啶-2-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5(10),6,8,19(23),20-六烯-2,2,4-三酮(非对映异构体2,化合物351)
[2792][2793]
在室温下,搅拌(4s)-4-[3-[[6-[[2-氯-6-(3-氟-5-异丁氧基-苯基)吡啶-3-羰基]氨磺酰基]-2-吡啶基]氨基]-3-(2-吡啶基)丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(152mg,0.1911mmol)于(1:4tfa-dcm预混合溶液)tfa(150μl,1.947mmol)和dcm(450μl)中的溶液,并移除溶剂。将残余物溶解于nmp(5ml)中,并且添加碳酸钾(331mg,2.395mmol)。将混合物在140℃下加热16小时。将混合物冷却至室温,并将反应混合物经由whatman滤盘(puradisc 25tf)过滤,并且通过反相hplc-ms方法,使用在15分钟内从30%-99%流动相b运行的双梯度(流动相a=h20(5mm hcl),流动相b=ch3cn)来纯化滤液,得到洗脱非对映异构体1(14s)-8-[3-氟-5-(2-甲基丙氧基)苯基]-12,12-二甲基-17-(吡啶-2-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5(10),6,8,19(23),20-六烯-2,2,4-三酮(11.6mg,18%)。1h nmr(500mhz,dmso-d6)δ12.66(s,1h),8.74-8.70(m,1h),8.24(s,1h),7.99(s,2h),7.72(t,j=7.9hz,2h),7.62(d,j=7.6hz,1h),7.48(d,j=2.2hz,1h),7.45-7.38(m,1h),7.33(d,j=7.1hz,1h),7.27(d,j=7.9hz,1h),6.97(d,j=8.4hz,1h),6.89(dt,j=10.7,2.3hz,1h),5.09(s,1h),3.84(d,j=6.7hz,2h),3.31(t,j=7.1hz,1h),2.86(s,1h),2.34(s,1h),2.17(d,j=9.3hz,1h),2.05(dp,j=13.3,6.7hz,1h),1.91(dd,j=11.9,5.7hz,1h),1.77(s,1h),1.64(s,3h),1.59(s,3h),1.57-1.47(m,1h),1.27-1.06(m,1h),0.99(d,j=6.7hz,7h)。esi-ms m/z计算值658.27374,实验值659.4(m 1)
;保留时间:2.95分钟(lc方法a),和洗脱非对映异构体2(14s)-8-[3-氟-5-(2-甲基丙氧基)苯基]-12,12-二甲基-17-(吡啶-2-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5(10),6,8,19(23),20-六烯-2,2,4-三酮(19.8mg,31%)。1h nmr(500mhz,dmso-d6)δ12.59(s,1h),8.72(d,j=5.3hz,1h),8.21(s,1h),7.95(d,j=8.8hz,1h),7.85(s,1h),7.80(s,1h),7.72(dd,j=8.5,7.2hz,1h),7.64(s,1h),7.51(t,j=1.8hz,1h),7.43(dt,j=9.8,2.0hz,1h),7.30(d,j=8.0hz,1h),7.19(d,j=7.2hz,1h),6.97(d,j=8.4hz,1h),6.91(dt,j=10.7,2.3hz,1h),5.46(d,j=10.9hz,1h),3.85(d,j=6.6hz,2h),3.39(t,j=8.6hz,1h),2.76(t,j=10.3hz,1h),2.37(s,1h),2.13-1.96(m,2h),1.91(dd,j=11.8,5.3hz,1h),1.80(d,j=13.0hz,1h),1.69(s,3h),1.65(d,j=12.4hz,1h),1.61(s,3h),1.56-1.47(m,1h),1.00(d,j=6.6hz,7h)。esi-ms m/z计算值658.27374,实验值659.4(m 1)
;保留时间:2.95分钟(lc方法a)。
[2794]
实施例103:3-(3,3-二甲基丁氧基)-1h-吡唑的制备
[2795][2796]
步骤1:3-(3,3-二甲基丁氧基)吡唑-1-甲酸叔丁酯
[2797]
[2798]
使5000ml 3颈圆底烧瓶配备有机械搅拌器、加热套、j-kem温度探针/控制器、加料漏斗、水冷却回流冷凝器和氮气入口/出口。在氮气气氛下,向容器中装入5-氧代-1h-吡唑-2-甲酸叔丁酯(100g,0.5429mol)和四氢呋喃(1200ml,12ml/g),得到澄清浅黄色溶液。开始搅拌,并记录锅温为19℃。然后向容器中装入一次性添加的呈固体状的3,3-二甲基丁-1-醇(52.6g,0.5972mol),随后装入一次性添加的固体三苯基膦(156.6g,0.5972mol)。然后将所得澄清浅黄色溶液用在1小时内逐滴添加的纯偶氮二甲酸二异丙酯(澄清红橙色液体)(117.6ml,0.5972mol)处理,使得逐渐放热达到40℃并得到澄清浅琥珀色溶液。然后将反应混合物加热到50℃的锅温,并且将条件保持2小时,此时lc/ms分析指示起始物质已完全消耗。将澄清琥珀色反应混合物减压浓缩,并将所得澄清琥珀色油状物悬浮于甲苯(800ml)中,并在室温下搅拌1小时,在此期间沉淀出固体(三苯基膦氧化物mw=278.28)。将浓稠浆液通过玻璃料布氏漏斗过滤,并将滤饼用甲苯(150ml)置换洗涤,并且然后抽吸30分钟。将灰白色固体滤饼标记为e28965-202-fc-tpo,并且与通过lc/ms对三苯基膦氧化物所测定的一致。将澄清琥珀色滤液减压浓缩,得到澄清琥珀色油状物。通过硅胶柱快速色谱法(硅藻土上的固体负载,1.5kg二氧化硅redisep柱),用100%己烷至20%etoac/己烷的梯度洗脱来纯化材料,收集450ml级分。以约5%etoac/己烷洗脱产物。将所需级分合并并减压浓缩,得到澄清无色油状物,将其在静置后固化,得到白色固体(110g,0.410mol,75%产率),作为所需产物3-(3,3-二甲基丁氧基)吡唑-1-甲酸叔丁酯。esi-ms m/z计算值268.17868,实验值279.0(m 1)
;保留时间:1.26分钟(lc方法a)。
[2799]
步骤2:3-(3,3-二甲基丁氧基)-1h-吡唑:
[2800][2801]
使5000ml 3颈圆底烧瓶配备有机械搅拌器、加热套、j-kem温度探针、水冷却回流冷凝器、加料漏斗和氮气入口/出口。在氮气气氛下,向容器中装入3-(3,3-二甲基丁氧基)吡唑-1-甲酸叔丁酯(110g,0.4099mol)、二氯甲烷(440ml,4ml/g)和甲醇(440ml,4ml/g),得到澄清无色溶液。开始搅拌,并记录锅温为19℃。向加料漏斗中装入含4摩尔hcl的1,4-二噁烷(307.5ml,1.230mol),随后在1小时内逐滴添加,使得逐渐放热达到30℃。将所得澄清浅黄色溶液加热到45℃的锅温,并且将条件保持1小时,此时lc/ms分析指示反应完成。使反应混合物冷却至室温,并且然后减压浓缩。将剩余的残余物溶解于叔丁基甲基醚(1200ml)中,并且然后转移到分液漏斗中,并用2摩尔氢氧化钠溶液(615ml,1.230mol)分配。移除有机物,并用叔丁基甲基醚(2x200ml)萃取残余水。将合并的有机物用饱和氯化钠溶液(500ml)洗涤,经硫酸钠(300g)干燥,并且然后通过玻璃料布氏漏斗过滤。将澄清浅黄色滤液减压浓缩,得到作为所需产物3-(3,3-二甲基丁氧基)-1h-吡唑的澄清浅黄色油状物(67g,0.398mol,97%产率)。1h nmr(400mhz,dmso-d6)δ7.50(d,j=2.4hz,1h),5.64(d,j=2.3hz,1h),4.09(dd,j=7.7,7.0hz,2h),1.71-1.52(m,2h),0.94(s,9h)。esi-ms m/z计算值168.12627,实验值169.1(m 1)
;保留时间:1.26分钟(lc方法a)。
[2802]
以与上述类似的方式制备下表中的吡唑试剂:
[2803][2804]
实施例104:3-((1-甲基环丙基)甲氧基)-1h-吡唑的制备
[2805][2806]
步骤1:1-(3-羟基吡唑-1-基)乙酮
[2807][2808]
向配备有搅拌棒和冷凝器的100ml圆底烧瓶中装入1h-吡唑-5-醇(4.97g,59.11mmol)和吡啶(25ml,309.1mmol)。将混合物在95℃下搅拌。在3分钟内逐滴添加乙酸酐(5.6ml,59.35mmol)于吡啶(10ml,123.6mmol)中的溶液。然后将混合物在95℃下再搅拌三小时。在减压下移除溶剂。将固体残余物在40ml乙醚中研磨,过滤,用乙醚洗涤并干燥,得到1-(3-羟基吡唑-1-基)乙酮(6.96g,93%)。1h nmr(400mhz,dmso-d6)δ10.96(s,1h),8.13(d,j=3.0hz,1h),6.01(d,j=3.0hz,1h),2.48(s,3h)。
[2809]
步骤2:3-((1-甲基环丙基)甲氧基)-1h-吡唑
[2810][2811]
将1-(3-羟基-1h-吡唑-1-基)乙-1-酮(1.16g,9.0mmol)、(1-甲基环丙基)甲醇(0.80g,9.3mmol)和pph3(2.67g,10.1mmol)在20ml thf中混合并冷却至0℃。逐滴添加diad(2ml,10.1mmol)。使混合物达到室温过夜。添加etoac(100ml),并将溶液用饱和nahco3水溶液和盐水洗涤,经na2so4干燥并浓缩。通过柱色谱法(二氧化硅;庚烷/etoac9:1)纯化残余物,得到白色固体状的混有22%ph3po和400mg纯1-(3-((1-甲基环丙基)甲氧基)-1h-吡唑-1-基)乙-1-酮的1.1g产物(组合产量1.5g,最大69%)。1h nmr(cdcl3,300mhz):0.43(m,2h);0.56(m,2h);1.21(s,3h);2.56(s,3h);4.00(s,2h);5.97(d,1h);8.04(d,1h)。
[2812]
将1-(3-((1-甲基环丙基)甲氧基)-1h-吡唑-1-基)乙-1-酮(1.5g,最大6.2mmol)溶解于meoh(20ml)中,添加6n naoh水溶液(1.27ml,7.6mmol),并将混合物在室温下搅拌过夜。将溶液浓缩,用庚烷汽提并涂布在二氧化硅上。通过柱色谱法(二氧化硅;庚烷/etoac 9:1
→
1:1)纯化残余物,得到呈无色油状物的3-((1-甲基环丙基)甲氧基)-1h-吡唑(790mg,
84%)。1h nmr(cdcl3,300mhz):0.41(m,2h);0.54(m,2h);1.22(s,3h);3.92(s,2h);5.73(d,1h);7.34(d,1h)。
[2813]
实施例105:3-(环丙基甲氧基)-1h-吡唑的制备
[2814][2815]
向1-(3-羟基-1h-吡唑-1-基)乙-1-酮(2.3g,18mmol,1当量)和k2co3(3.79g,27.4mmol,1.5当量)于dmf(20ml)中的悬浮液中添加(溴甲基)环丙烷(2.7g,1.1当量)。将反应混合物在80℃(外部100℃)下加热4小时,并在室温下搅拌过夜。添加etoac(100ml)和h2o(50ml)并且分离各层。将水层用etoac(100ml)萃取一次,并将有机层合并,用h2o(50ml)、盐水洗涤,经na2so4干燥并浓缩。通过自动柱色谱法(120g二氧化硅)使用0-20%etoac/庚烷的梯度来纯化残余物(3.7g油状物)。将含产物的级分汇集并浓缩,得到呈油状物的1-(3-(环丙基甲氧基)-1h-吡唑-1-基)乙-1-酮(2.22g,67.6%产率),其结晶为固体。1h nmr(dmso-d6,300mhz):8.21(d,1h);6.19(d,1h);4.01(d,2h);2.47(s,3h);1.28-1.20(m,1h);0.58-0.52(m,2h);0.35-0.30(m,2h)ppm
[2816]
将1-(3-(环丙基甲氧基)-1h-吡唑-1-基)乙-1-酮(2.22g,12.3mmol)溶解于meoh(40ml)中,并且添加30%naoh(1.81g,13.6mmol,1.1当量),用h2o(2ml)稀释。将反应混合物在室温下搅拌4小时,之后,样品的nmr分析显示完全转化。将溶剂浓缩,并且添加etoac(25ml)和h2o(6ml)。将各层分离,并将有机层用盐水(5ml)洗涤,经na2so4干燥并浓缩至干燥,得到呈无色油状物的3-(环丙基甲氧基)-1h-吡唑(1.42g,83%产率)。1h nmr(cdcl3,300mhz):7.35(d,1h);5.75(d,1h);3.98(d,2h);1.34-1.24(m,1h);0.65-0.58(m,2h);0.37-0.32(m,2h)ppm。
[2817]
下表包含可商购获得的吡唑和环脲试剂的列表:
[2818]
化合物名称 3-异丙基-1h-吡唑 3-甲氧基-1h-吡唑 1-甲基咪唑啶-2-酮 1-异丙基咪唑啶-2-酮 1-(环丙基甲基)咪唑烷-2-酮 4-异丙基-1h-吡唑
[2819]
实施例106:(14s,17r)-8-[3-(3,3-二甲基丁氧基)-1h-吡唑-1-基]-12,12-二甲基-17-(吡啶-2-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮(化合物320)的制备
[2820]
[2821]
通过鼓入氮气1分钟,使(14s,17r)-8-溴-12,12-二甲基-17-(吡啶-2-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮(25mg,0.04375mmol)、3-(3,3-二甲基丁氧基)-1h-吡唑(37mg,0.2199mmol)、六苯基-1,7-二钯九环[5.5.5.01,4.01,11.01,14.02,4.05,7.07,9.07,16]二十七碳-2,5,8,11,13,16-六烯-4,10,15-三酮(2mg,0.0022mmol)、(5-二苯基膦基-9,9-二甲基-氧杂蒽-4-基)-二苯基膦(4mg,0.0069mmol)、cs2co3(36mg,0.110mmol)和dm f(530μl)的混合物脱气,然后加热至100℃持续1小时。在冷却至室温后,再添加以下试剂:3-(3,3-二甲基丁氧基)-1h-吡唑(37mg,0.2199mmol)、六苯基-1,7-二钯九环[5.5.5.01,4.01,11.01,14.02,4.05,7.07,9.07,16]二十七碳-2,5,8,11,13,16-六烯-4,10,15-三酮(2mg,0.0022mmol)、(5-二苯基膦基-9,9-二甲基-氧杂蒽-4-基)-二苯基膦(4mg,0.006913mmol)和cs2co3(36mg,0.110mmol),通过鼓入氮气1分钟使混合物脱气,然后加热至110℃持续16小时。然后,将混合物用2ml水、2ml的5:1dcm/meoh稀释,然后添加0.6ml的1m hcl,并且当试纸显示ph为4时,将混合物分配。分离各层,并将水层用5:1dcm/meoh(2ml)萃取。将合并的有机萃取物干燥(mgso4)并蒸发。将残余物以40mg/ml溶解于1:1meoh/acn中,并经历制备型sfc,经由21.2x250mm 2-pic柱,5μm粒度,使用5mm nh3/甲醇至co2(在10分钟内15%-50%)梯度洗脱,得到呈白色固体状的目标:(14s,17r)-8-[3-(3,3-二甲基丁氧基)-1h-吡唑-1-基]-12,12-二甲基-17-(吡啶-2-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮(4.5mg,16%)。1h nmr(400mhz,氯仿-d)δ8.54(d,j=4.8hz,1h),8.19(d,j=2.8hz,1h),8.01(d,j=8.0hz,1h),7.71-7.63(m,1h),7.56(t,j=7.8hz,1h),7.49(d,j=7.3hz,1h),7.32(d,j=7.8hz,1h),7.19(dd,j=7.6,5.0hz,1h),6.65(d,j=8.3hz,1h),5.90(d,j=2.8hz,1h),5.75(s,1h),5.36(q,j=7.4hz,1h),4.32(t,j=7.4hz,2h),3.48(s,1h),3.02(t,j=10.4hz,1h),2.82(s,1h),2.11(s,1h),1.93(d,j=8.0hz,1h),1.84(s,1h),1.74(t,j=7.4hz,2h),1.64(s,4h),1.62(s,3h),1.59-1.37(m,3h),1.00(s,9h)。esi-ms m/z计算值658.305,实验值659.1(m 1)
;保留时间:1.58分钟(lc方法a)。
[2822]
使用以上实施例中制备的吡唑试剂以及在上表中提供的可商购获得的吡唑和环脲试剂,以与上文所述类似的方式制备下表中的化合物。
[2823]
[2824]
[2825]
[2826]
[2827]
[2828][2829]
[2830][2831]
实施例107:(14s,17r)-8-(4,4-二氟环己基)-12,12-二甲基-17-(吡啶-2-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮的制备
[2832][2833]
步骤1:(14s,17r)-8-(4,4-二氟环己-1-烯-1-基)-12,12-二甲基-17-(吡啶-2-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮(化合物325)
[2834][2835]
通过鼓入氮气持续1分钟,使(14s,17r)-8-溴-12,12-二甲基-17-(吡啶-2-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮(25mg,0.0437mmol)、2-(4,4-二氟环己烯-1-基)-4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷(43mg,0.176mmol)、pd(dppf)cl2(3.3mg,0.0045mmol)、dmf(437μl)和碳酸氢钠水溶液(260μl,1m,0.2600mmol)的混合物脱气,然后加热至100℃持续1小时。然后,将混合物用2ml水、2ml的5:1dcm/meoh稀释,然后添加0.6ml的1m hcl,并且当试纸显示ph为4时,将混合物分配。分离各层,并将水层用5:1dcm/meoh(2ml)萃取。将残余物以40mg/ml溶解于1:1meoh/acn中,并经历制备型sfc,经由21.2x250mm 2-pic柱,5μm粒度,使用5mm nh3/甲醇至co2(在10分钟内15%-50%)梯度洗脱,得到呈白色固体状的目标:(14s,17r)-8-(4,4-二氟环己-1-烯-1-基)-12,12-二甲基-17-(吡啶-2-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮(23mg,86%)。1h nmr(400mhz,氯仿-d)δ8.57(d,j=4.8hz,1h),7.98(d,j=8.1hz,1h),7.66(td,j=7.7,1.8hz,1h),7.60-7.50(m,2h),7.29(d,j=7.7hz,1h),7.23-7.16(m,1h),6.98(d,j=8.1hz,1h),6.69-6.65(m,1h),6.56(s,1h),5.94(d,j=8.3hz,1h),5.35(q,j=7.1hz,1h),3.51-3.40(m,1h),3.14-3.03(m,1h),3.00(d,j=9.5hz,1h),2.83-2.69(m,4h),2.19(ddt,j=20.4,13.6,7.5hz,3h),1.94(dt,j=14.7,7.5hz,1h),1.71(dd,j=14.2,7.3hz,1h),1.63(s,6h),1.59-1.42(m,3h)。esi-ms m/z计算值608.2381,实验值609.1(m 1)
;保留时间:1.26分钟(lc方法a)。
[2836]
步骤2:(14s,17r)-8-(4,4-二氟环己基)-12,12-二甲基-17-(吡啶-2-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮(化合物324)
[2837][2838]
在氢气球压力下,将(14s,17r)-8-(4,4-二氟环己-1-烯-1-基)-12,12-二甲基-17-(吡啶-2-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮(20.00mg,0.0329mmol)、pd(oh)2(11.54mg,20%w/w,0.0164mmol)和etoac(1ml)的混合物搅拌16小时。然后,将混合物过滤,浓缩并将残余物溶解于etoh(1ml)中,并添加pto2(3.731mg,0.0164mmol)并使混合物在55psi氢气下进行parr振荡器氢化2小时,经硅藻土过滤,蒸发溶剂,并将残余物溶解于meoh中并经由
0.45μm过滤器过滤,并且滤液经历制备型sfc,经由21.2x250mm 2-pic柱,5μm粒度,使用5mm nh3/甲醇至co2(在10分钟内15%-50%)梯度洗脱,得到呈白色固体状的目标:(14s,17r)-8-(4,4-二氟环己基)-12,12-二甲基-17-(吡啶-2-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮(1.7mg,8%)。1h nmr(400mhz,氯仿-d)δ8.60-8.52(m,1h),7.93(d,j=7.8hz,1h),7.66(td,j=7.7,1.8hz,1h),7.57(t,j=7.7hz,1h),7.53(d,j=7.2hz,1h),7.29(d,j=7.9hz,1h),7.21(dd,j=7.5,5.0hz,1h),6.68(dd,j=10.8,8.0hz,2h),5.89(d,j=8.3hz,1h),5.34(q,j=7.1hz,1h),3.48-3.39(m,1h),3.04-2.92(m,2h),2.68(s,1h),2.25-2.14(m,3h),1.99-1.87(m,6h),1.85-1.65(m,2h),1.63(s,3h),1.61(s,3h),1.59-1.36(m,3h)。esi-ms m/z计算值610.2538,实验值611.4(m 1)
;保留时间:1.31分钟(lc方法s)。
[2839]
实施例108:(14s,17r)-8-环丁基-12,12-二甲基-17-(吡啶-2-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮(化合物330)的制备
[2840][2841]
将(14s)-8-溴-12,12-二甲基-17-(吡啶-2-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5(10),6,8,19(23),20-六烯-2,2,4-三酮(30mg,0.05249mmol)、溴(环丁基)锌(315μl,0.5m于thf中,0.1575mmol)和pd(pph3)4(6mg,0.005192mmol)于dmf(520μl)中的混合物用氮气鼓泡1分钟,并且然后在100℃下加热3小时,然后再添加以下试剂:溴(环丁基)锌(630μl,0.5m,0.3150mmol)和pd(pph3)4(6mg,0.005192mmol),并将混合物加热至100℃持续3小时。然后,将混合物用2ml水、2ml的5:1dcm/meoh稀释,然后添加0.6ml的1m hcl,并且当试纸显示ph为3时,将混合物分配。分离各层,并将水层用5:1dcm/meoh(2ml)萃取。将合并的有机萃取物干燥(mgso4)并蒸发。将残余物溶解于1:1meoh/acn中,并经历制备型sfc,经由21.2x250mm 2-pic柱,5μm粒度和一系列400μl进样,使用5mm nh3/甲醇至co2(在10分钟内15%-50%)梯度洗脱,得到呈白色固体状(收集的级分蒸发后)的目标:(14s,17r)-8-环丁基-12,12-二甲基-17-(吡啶-2-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮(15.8mg,55%)。1h nmr(400mhz,氯仿-d)δ8.57(d,j=4.8hz,1h),7.91(d,j=7.8hz,1h),7.66(td,j=7.7,1.8hz,1h),7.60-7.52(m,2h),7.29(d,j=7.8hz,1h),7.21(dd,j=7.6,4.9hz,1h),6.70-6.61(m,2h),5.96(d,j=8.2hz,1h),5.35(q,j=6.8hz,1h),3.56(p,j=8.6hz,1h),3.46(dd,j=9.7,6.8hz,1h),3.10(d,j=9.5hz,1h),3.00(t,j=10.0hz,1h),2.40-2.21(m,5h),2.10-1.98(m,1h),1.97-1.85(m,2h),1.77-1.69(m,1h),1.68(s,3h),1.67(s,3h),1.64-1.43(m,3h)。esi-ms m/z计算值546.24133,实验值547.4(m 1)
;保留时间:1.29分钟(lc方法a)。
[2842]
实施例109:(14s,17r)-8-(6-氟吡啶-2-基)-12,12-二甲基-17-(吡啶-2-基)-2
λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮(化合物318)的制备
[2843][2844]
通过鼓入氮气持续1分钟,使(14s,17r)-8-溴-12,12-二甲基-17-(吡啶-2-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮(250mg,0.4375mmol)、(6-氟-2-吡啶基)硼酸(185mg,1.313mmol)、pd(dppf)cl2(32mg,0.044mmol)、乙腈(4.4ml)和nahco3(2.6ml,1m,2.600mmol)的混合物脱气,然后加热至100℃持续3小时。然后,将混合物用2ml水、2ml的5:1dcm/meoh稀释,然后添加0.5ml的1m hcl,并且当试纸显示ph为4时,将混合物分配。分离各层,并将水层用5:1dcm/meoh(2ml)萃取。将残余物通过快速色谱法(12g sio2,50%-80%etoac/己烷,历经15分钟)纯化,得到目标:(14s,17r)-8-(6-氟吡啶-2-基)-12,12-二甲基-17-(吡啶-2-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮(180mg,70%)。1h nmr(400mhz,氯仿-d)δ8.56(d,j=4.8hz,1h),8.17(dd,j=7.5,2.3hz,1h),8.09(d,j=8.0hz,1h),7.92(t,j=8.0hz,1h),7.86(d,j=8.2hz,1h),7.66(td,j=7.6,1.8hz,1h),7.58(t,j=7.7hz,1h),7.53(d,j=7.2hz,1h),7.31(d,j=7.8hz,1h),7.20(dd,j=7.5,4.9hz,1h),6.96(dd,j=8.2,2.9hz,1h),6.67(d,j=8.2hz,1h),5.85(d,j=8.5hz,1h),5.38(q,j=7.4hz,1h),3.51(dd,j=9.7,6.8hz,1h),3.04(t,j=10.2hz,1h),2.94(d,j=9.5hz,1h),2.20(dd,j=12.3,8.0hz,1h),1.95(q,j=7.1hz,1h),1.80(dt,j=15.0,8.2hz,1h),1.72(s,3h),1.71(s,3h),1.68-1.58(m,2h),1.52(q,j=12.1,10.8hz,1h)。esi-ms m/z计算值587.2115,实验值588.1(m 1)
;保留时间:1.14分钟(lc方法a)。
[2845]
以下是可商购获得的硼酸试剂的列表:
[2846]
(4-异丙基苯基)硼酸
[2847]
(1-异丙基吡唑-4-基)硼酸
[2848]
(2-氯-6-氟-苯基)硼酸
[2849]
(2,6-二氯苯基)硼酸
[2850]
(3-甲氧基苯基)硼酸
[2851]
(6-甲氧基-2-吡啶基)硼酸
[2852]
环己烯-1-基硼酸
[2853]
2-(4,4-二甲基环己烯-1-基)-4,4,5,5-四甲基-1,3,2-二氧杂环戊
[2854]
硼烷
[2855]
环丙基硼酸
[2856]
使用在上表中给出的硼酸,以与上文所述类似的方式制备下表中的化合物:
[2857]
[2858]
[2859]
[2860]
[2861][2862]
[2863][2864]
实施例110:(14s,17r)-8-[6-(环丁基甲氧基)吡啶-2-基]-12,12-二甲基-17-(吡啶-2-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮(化合物313)的制备
[2865][2866]
向环丁基甲醇(16μl,0.170mmol)于dmf(550μl)中的溶液中添加[双(三甲基硅基)氨基]钠(170μl,1m于thf中,0.170mmol),并且在室温下搅拌1分钟之后,添加(14s,17r)-8-(6-氟吡啶-2-基)-12,12-二甲基-17-(吡啶-2-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮(20mg,0.034mmol)。然后将混合物在80℃下搅拌1小时,用5ml dcm稀释,并且然后添加0.2ml的1n hcl和5ml水(ph试纸<4)。将混合物分配,用dcm萃取水层,将有机物干燥(mgso4)并蒸发。使残余物经历制备型sfc,经由21.2x250mm 2-pic柱,5μm粒度,使用5mm nh3/甲醇至co2(在10分钟内15%-50%)梯度洗脱,得到呈白色固体状的目标:(14s,17r)-8-[6-(环丁基甲氧基)吡啶-2-基]-12,12-二甲基-17-(吡啶-2-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮(10.3mg,46%)。1h nmr(400mhz,氯仿-d)δ8.56(d,j=4.7hz,1h),8.13(d,j=8.0hz,1h),7.93(d,j=8.0hz,1h),7.86(d,j=7.4hz,1h),7.68(d,j=7.7hz,1h),7.66-7.63(m,1h),7.60-7.51(m,2h),7.31(d,j=7.8hz,1h),7.20(dd,j=7.6,4.8hz,1h),6.77(d,j=8.2hz,1h),6.67(d,j=7.8hz,1h),5.94(d,j=8.2hz,1h),5.38(q,j=7.0hz,1h),4.39(d,j=6.8hz,2h),3.52(s,1h),3.05(dd,j=8.9,5.3hz,2h),2.82(hept,j=7.7hz,1h),2.24(dd,j=12.1,
7.4hz,1h),2.20-2.10(m,2h),2.07-1.84(m,5h),1.77(s,1h),1.73(s,3h),1.71(s,3h),1.60(dd,j=12.4,7.9hz,2h),1.52(q,j=7.4,5.9hz,1h)。esi-ms m/z计算值653.27844,实验值654.5(m 1)
;保留时间:1.47分钟(lc方法a)。
[2867]
以下是可商购获得的醇试剂的列表:
[2868]
2-甲基丙-1-醇
[2869]
环丙基甲醇
[2870]
2,2-二甲基丙-1-醇
[2871]
2-环丙基乙醇
[2872]
3,3-二甲基丁-1-醇
[2873]
乙醇
[2874]
使用在上表中给出的醇试剂,以与上文所述类似的方式制备下表中的化合物。
[2875]
[2876]
[2877]
[2878][2879][2880]
使用以上实施例中制备的吡唑试剂、上表中给出的吡唑、醇和硼酸试剂并使用(14s,17s)-8-溴-12,12-二甲基-17-(吡啶-2-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮作为起始物质,以与上述类似的方式制备下表中的化合物:
[2881]
[2882]
[2883]
[2884]
[2885][2886][2887]
实施例111:(14s,17r)-8-溴-17-(4-叔丁基吡啶-2-基)-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮和(14s,17s)-8-溴-17-(4-叔丁基吡啶-2-基)-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮的制备
[2888][2889]
步骤1:(4s)-4-[3-[[6-[(6-溴-2-氯-吡啶-3-羰基)氨磺酰基]-2-吡啶基]氨基]-3-(4-叔丁基-2-吡啶基)丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯
[2890][2891]
将6-溴-2-氯-吡啶-3-甲酸(510mg,2.157mmol)和cdi(350mg,2.159mmol)的混合物溶解于thf(3.6ml)中,并将混合物在60℃下搅拌45分钟,然后添加(4s)-4-[3-(4-叔丁基-2-吡啶基)-3-[(6-氨磺酰基-2-吡啶基)氨基]丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(587mg,1.076mmol),随后添加dbu(725μl,4.848mmol),并且将所得混合物在室温下搅拌2小时。将混合物用etoac稀释,并用1n hcl水溶液、水、盐水洗涤,干燥(mgso4),并浓缩。将残余物纯化(快速色谱法:40g sio2,10%-80%etoac/己烷,20分钟),得到所需产物:(4s)-4-[3-[[6-[(6-溴-2-氯-吡啶-3-羰基)氨磺酰基]-2-吡啶基]氨基]-3-(4-叔丁基-2-吡啶基)丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(707mg,86%)。1h nmr(400mhz,氯仿-d)δ8.54(d,j=5.4hz,1h),7.78(d,j=8.5hz,1h),7.58-7.46(m,2h),7.43(d,j=7.8hz,1h),7.34(s,1h),7.29(s,1h),6.62(s,1h),5.94-5.81(m,1h),5.12(m,1h),4.24-4.09(m,1h),3.05(d,j=11.5hz,1h),2.85(t,j=10.8hz,1h),2.41(s,1h),2.17(s,2h),1.95-1.68(m,4h),1.41(d,j=4.2hz,9h),1.35(s,5h),1.33(s,4h),1.32-1.24(m,4h)。esi-ms m/z计算值762.1966,实验值764.9(m 1)
;保留时间:0.64分钟(lc方法d)。
[2892]
步骤2:6-溴-n-[[6-[[1-(4-叔丁基-2-吡啶基)-3-[(3r)-5,5-二甲基吡咯烷-3-基]丙基]氨基]-2-吡啶基]磺酰基]-2-氯-吡啶-3-甲酰胺
[2893][2894]
向(4s)-4-[3-[[6-[(6-溴-2-氯-吡啶-3-羰基)氨磺酰基]-2-吡啶基]氨基]-3-(4-叔丁基-2-吡啶基)丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(707mg,0.925mmol)于dcm(5ml)中的溶液中添加tfa(2.2ml,28.56mmol),并将混合物在室温下搅拌45分钟。将该溶液减压浓缩至干,然后与thf(2x20ml)共蒸发,然后在高真空下在室温下干燥16小时,得到:6-溴-n-[[6-[[1-(4-叔丁基-2-吡啶基)-3-[(3r)-5,5-二甲基吡咯烷-3-基]丙基]氨基]-2-吡啶基]磺酰基]-2-氯-吡啶-3-甲酰胺(三氟乙酸盐)(984mg,106%)。esi-ms m/z计算值662.14417,实验值665.0(m 1)
;保留时间:0.39分钟(lc方法d)。
[2895]
步骤3:(14s,17r)-8-溴-17-(4-叔丁基吡啶-2-基)-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮和(14s,17s)-8-溴-17-(4-叔丁基吡啶-2-基)-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮
[2896][2897]
将6-溴-n-[[6-[[1-(4-叔丁基-2-吡啶基)-3-[(3r)-5,5-二甲基吡咯烷-3-基]丙基]氨基]-2-吡啶基]磺酰基]-2-氯-吡啶-3-甲酰胺(三氟乙酸盐)(984mg,0.978mmol)和碳酸钾(811mg,5.868mmol)和碳酸钾(811mg,5.868mmol)于dma(10ml)中的混合物在140℃下加热7小时,通过冰浴冷却,用100ml etoac和30ml水稀释,并且然后用15ml的1m hcl(k2co3的量的2.5倍)稀释,得到试纸显示ph 2的混合物。将混合物分配,并分离有机层。将水层用100ml etoac萃取。将合并的有机萃取物干燥(mgso4)并蒸发得到油状物。将残余物溶解于dmso(100mg/ml)中,并用1体积的dma稀释。该溶液用制备型sfc,经由21.2x250mm 2-pic柱,5μm粒度,用5mm nh3/甲醇至co2(在10分钟内40%-70%)梯度洗脱进行纯化,(蒸发所收集的级分后)得到白色固体:
[2898]
首先洗脱:(14s,17r)-8-溴-17-(4-叔丁基吡啶-2-基)-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮(139mg,23%)。1h nmr(400mhz,氯仿-d)δ8.35(d,j=5.3hz,1h),7.62(d,j
=7.9hz,1h),7.54(t,j=7.8hz,1h),7.43(d,j=7.3hz,1h),7.16(d,j=5.3hz,1h),6.76(d,j=7.9hz,1h),6.64(d,j=8.4hz,1h),5.56(s,1h),5.35(q,j=7.9hz,1h),3.47(s,1h),2.56(s,1h),1.98(dd,j=12.1,6.8hz,1h),1.90(s,2h),1.62(s,3h),1.60(s,2h),1.56(s,3h),1.48(d,j=28.3hz,3h),1.29(s,9h)。esi-ms m/z计算值626.1675,实验值625.3(m 1)
;保留时间:1.28分钟(lc方法a)。
[2899]
第二洗脱:(14s,17s)-8-溴-17-(4-叔丁基吡啶-2-基)-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮(145mg,24%)。1h nmr(400mhz,氯仿-d)δ8.48(d,j=5.2hz,1h),7.84(s,1h),7.62-7.54(m,2h),7.24(d,j=5.7hz,1h),6.99(s,1h),6.71(s,1h),6.50(s,1h),4.83(s,1h),3.59(s,1h),3.26(s,1h),2.33(s,1h),1.99(s,2h),1.85(s,2h),1.71(t,j=11.6hz,1h),1.59(s,3h),1.52(s,3h),1.46(d,j=27.1hz,1h),1.34(s,9h),1.32-1.29(m,1h)。esi-ms m/z计算值626.1675,实验值627.3(m 1)
;保留时间:1.35分钟(lc方法a)。
[2900]
实施例112:(14s,17r)-17-(4-叔丁基吡啶-2-基)-8-[3-(3,3-二甲基丁氧基)-1h-吡唑-1-基]-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮(化合物305)的制备
[2901][2902]
通过鼓入氮气1分钟,使3-(3,3-二甲基丁氧基)-1h-吡唑(89mg,0.529mmol)、六苯基-1,7-二钯九环[5.5.5.01,4.01,11.01,14.02,4.05,7.07,9.07,16]二十七碳-2,5,8,11,13,16-六烯-4,10,15-三酮(6mg,0.0066mmol)、(5-二苯基膦基-9,9-二甲基-氧杂蒽-4-基)-二苯基膦(12mg,0.021mmol)、cs2co3(172mg,0.528mmol)和dmf(1.3ml)的混合物脱气,然后加热至100℃持续16小时。然后,将混合物用2ml水、2ml dcm稀释,然后添加0.6ml的1m hcl,并且当试纸显示ph为4时,将混合物分配。分离各层,并将水层用dcm(2ml)萃取。将合并的有机萃取物干燥(mgso4)并蒸发。将残余物以40mg/ml溶解于1:1meoh/acn中,并经历制备型sfc,经由21.2x250mm 2-pic柱,5μm粒度,使用5mm nh3/甲醇至co2(在10分钟内15%-50%)梯度洗脱,得到呈白色固体状的目标:(14s,17r)-17-(4-叔丁基吡啶-2-基)-8-[3-(3,3-二甲基丁氧基)-1h-吡唑-1-基]-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮(28.2mg,30%)。1h nmr(400mhz,氯仿-d)δ8.46(d,j=5.3hz,1h),8.19(d,j=2.8hz,1h),8.06(d,j=8.3hz,1h),7.61-7.49(m,2h),7.29(s,1h),7.20(d,j=5.3hz,1h),6.65(d,j=8.0hz,1h),5.91(s,1h),5.85(s,1h),5.30(s,3h),4.32(t,j=7.4hz,2h),3.53(s,1h),3.01(s,2h),2.21(s,1h),1.92(d,j=10.1hz,1h),1.74(t,j=7.4hz,3h),1.65(s,6h),1.58(d,j=9.5hz,1h),1.49(d,j=11.6hz,1h),1.32(s,9h),1.00(s,9h)。esi-ms m/z计算值714.36755,实验值715.7(m 1)
;保留时间:1.72分钟(lc方法a)。
[2903]
实施例113:(14s,17r)-17-(4-叔丁基吡啶-2-基)-8-(6-氟吡啶-2-基)-12,12-二
甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮(化合物307)的制备
[2904][2905]
通过鼓入氮气持续1分钟,使(14s,17r)-8-溴-17-(4-叔丁基吡啶-2-基)-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮(55mg,0.088mmol)、(6-氟-2-吡啶基)硼酸(37mg,0.26mmol)、pd(dppf)cl2(6.4mg,0.0087mmol)、乙腈(968μl)和nahco3(520μl,1m,0.52mmol)的混合物脱气,然后加热至100℃持续2小时。然后,将混合物用2ml水、2ml的5:1dcm/meoh稀释,然后添加0.5ml的1m hcl,并且当试纸显示ph为4时,将混合物分配。分离各层,并将水层用5:1dcm/meoh(2ml)萃取。将残余物通过快速色谱法(4g sio2,20%-80%etoac/己烷,历经15分钟)纯化,得到目标:(14s,17r)-17-(4-叔丁基吡啶-2-基)-8-(6-氟吡啶-2-基)-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮(25.5mg,45%)。1h nmr(400mhz,氯仿-d)δ8.46(d,j=5.2hz,1h),8.22-8.16(m,1h),8.13(d,j=8.0hz,1h),7.96-7.85(m,2h),7.62-7.52(m,2h),7.21-7.17(m,1h),6.97(dd,j=8.3,2.8hz,1h),6.67(d,j=7.8hz,1h),5.90(d,j=8.2hz,1h),5.33(q,j=7.4hz,1h),3.85-3.70(m,1h),3.53(s,1h),3.03(s,2h),2.25(t,j=9.6hz,1h),2.00-1.89(m,1h),1.88-1.83(m,1h),1.78(d,j=7.5hz,1h),1.73(s,3h),1.72(s,3h),1.61(q,j=9.4hz,1h),1.50(d,j=16.1hz,1h),1.32(s,9h)。esi-ms m/z计算值643.2741,实验值644.6(m 1)
;保留时间:1.33分钟(lc方法a)。
[2906]
实施例114:(14s,17r)-17-(4-叔丁基吡啶-2-基)-8-[6-(3,3-二甲基丁氧基)吡啶-2-基]-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮(化合物303)的制备
[2907][2908]
向3,3-二甲基丁-1-醇(360μl,0.25m,0.09mmol)于dmf中的溶液中添加[双(三甲基硅基)氨基]钠(90μl,1m,0.09mmol),并且在室温下搅拌1分钟之后,将其添加到(14s,17r)-17-(4-叔丁基吡啶-2-基)-8-(6-氟吡啶-2-基)-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮(11.6mg,0.018mmol)中。然后将混合物在80℃下搅拌1小时,用5ml dcm稀释,并且然
后添加0.2ml的1n hcl和5ml水(ph试纸<4)。将混合物分配,用dcm萃取水层,将有机物干燥(mgso4)并蒸发。使残余物经历制备型sfc,经由21.2x250mm 2-pic柱,5μm粒度,使用5mm nh3/甲醇至co2(在10分钟内15%-50%)梯度洗脱,得到呈白色固体状的目标:(14s,17r)-17-(4-叔丁基吡啶-2-基)-8-[6-(3,3-二甲基丁氧基)吡啶-2-基]-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮(6.7mg,51%)。1h nmr(400mhz,氯仿-d)δ8.46(d,j=5.3hz,1h),8.13(s,1h),7.93(s,1h),7.85(d,j=7.4hz,1h),7.67(t,j=7.8hz,1h),7.56(d,j=6.5hz,2h),7.26(s,1h),7.20(d,j=5.2hz,1h),6.74(d,j=8.2hz,1h),6.68-6.61(m,1h),5.94(s,1h),5.34(d,j=6.9hz,1h),4.49(t,j=7.4hz,2h),3.54(s,1h),3.05-2.98(m,1h),2.26(s,1h),1.93(d,j=9.0hz,1h),1.78-1.75(m,4h),1.73(s,3h),1.71(s,3h),1.60(d,j=12.4hz,2h),1.49(d,j=9.1hz,1h),1.32(s,9h),1.02(s,9h)。esi-ms m/z计算值725.3723,实验值726.5(m 1)
;保留时间:1.75分钟(lc方法a)。
[2909]
实施例115:(14s,17r)-17-(4-叔丁基吡啶-2-基)-8-[6-(环丁基甲氧基)吡啶-2-基]-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮(化合物302)的制备
[2910][2911]
向环丁基甲醇(174μl,0.25m,0.043mmol)于dmf中的溶液中添加[双(三甲基硅基)氨基]钠(44μl,1m,0.044mmol),并且在室温下搅拌1分钟之后,将其添加到(14s,17r)-17-(4-叔丁基吡啶-2-基)-8-(6-氟吡啶-2-基)-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮(5.6mg,0.0087mmol)中。然后将混合物在80℃下搅拌200分钟,用5ml dcm稀释,并且然后添加0.2ml的1n hcl和5ml水(ph试纸<4)。将混合物分配,用dcm萃取水层,将有机物干燥(mgso4)并蒸发。使残余物经历制备型sfc,经由21.2x250mm 2-pic柱,5μm粒度,使用5mm nh3/甲醇至co2(在10分钟内15%-50%)梯度洗脱,得到呈白色固体状的目标:(14s,17r)-17-(4-叔丁基吡啶-2-基)-8-[6-(环丁基甲氧基)吡啶-2-基]-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮(2.8mg,45%)。1h nmr(400mhz,氯仿-d)δ8.48(d,j=5.3hz,1h),8.17(d,j=8.1hz,1h),7.99(d,j=8.1hz,1h),7.86(d,j=7.4hz,1h),7.68(t,j=7.8hz,1h),7.58(d,j=4.6hz,2h),7.21(dd,j=5.4,1.9hz,1h),6.78(d,j=8.2hz,1h),6.70-6.63(m,1h),6.02(d,j=8.1hz,1h),5.31(q,j=6.9hz,1h),4.39(d,j=6.8hz,2h),3.54(t,j=8.4hz,1h),3.21(s,1h),3.02(t,j=10.2hz,1h),2.82(p,j=7.2hz,1h),2.33(t,j=10.8hz,1h),2.15(dq,j=9.8,6.1hz,2h),1.94(tq,j=16.3,8.4hz,5h),1.75(s,3h),1.72(s,3h),1.68-1.43(m,5h),1.33(s,9h)。esi-ms m/z计算值709.341,实验值710.5(m 1)
;保留时
间:1.62分钟(lc方法a)。
[2912]
实施例116:(14s,17r)-17-(4-叔丁基吡啶-2-基)-8-[6-(2-环丙基乙氧基)吡啶-2-基]-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮(化合物301)的制备
[2913][2914]
向2-环丙基乙醇(约174.0μl,0.25m,0.043mmol)于dmf中的溶液中添加[双(三甲基硅基)氨基]钠(约43.50μl,1m于thf中,0.043mmol),并且在室温下搅拌1分钟之后,将其添加到(14s,17r)-17-(4-叔丁基吡啶-2-基)-8-(6-氟吡啶-2-基)-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮(5.6mg,0.008699mmol)中。然后将混合物在80℃下搅拌200分钟,用5ml dcm稀释,并且然后添加0.2ml的1n hcl和5ml水(ph试纸<4)。将混合物分配,用dcm萃取水层,将有机物干燥(mgso4)并蒸发。使残余物经历制备型sfc,经由21.2x250mm 2-pic柱,5μm粒度,使用5mm nh3/甲醇至co2(在10分钟内15%-50%)梯度洗脱,得到呈白色固体状的目标:(14s,17r)-17-(4-叔丁基吡啶-2-基)-8-[6-(2-环丙基乙氧基)吡啶-2-基]-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮(2.3mg,37%)。1h nmr(400mhz,氯仿-d)δ8.48(d,j=5.2hz,1h),8.16(d,j=8.0hz,1h),7.98(d,j=8.1hz,1h),7.87(d,j=7.4hz,1h),7.68(t,j=7.9hz,1h),7.57(d,j=4.7hz,2h),7.21(d,j=5.4hz,1h),6.77(d,j=8.2hz,1h),6.66(d,j=6.5hz,1h),6.01(s,1h),5.31(d,j=7.2hz,1h),4.49(t,j=6.8hz,2h),3.53(d,j=8.6hz,1h),3.21(s,1h),3.07-2.99(m,1h),2.31(d,j=10.9hz,1h),1.94(dd,j=14.6,7.4hz,1h),1.75(s,3h),1.71(s,3h),1.69-1.41(m,5h),1.33(s,9h),1.26(s,2h),0.93-0.80(m,1h),0.50(d,j=7.7hz,2h),0.14(d,j=5.0hz,2h)。esi-ms m/z计算值709.341,实验值710.5(m 1)
;保留时间:1.59分钟(lc方法a)。
[2915]
实施例117:(14s,17r)-8-溴-12,12-二甲基-17-[6-(三氟甲基)吡啶-2-基]-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮和(14s,17s)-8-溴-12,12-二甲基-17-[6-(三氟甲基)吡啶-2-基]-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮的制备
[2916][2917]
步骤1:(4s)-4-[3-(叔丁基亚磺酰基氨基)-3-[6-(三氟甲基)-2-吡啶基]丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯
[2918][2919]
将2-溴-6-(三氟甲基)吡啶(6.6g,28.62mmol)溶解于乙醚(100ml)中。将溶液在干冰丙酮浴中冷却,并且在氮气球下搅拌15分钟。在1分钟内添加n-buli(11.5ml,2.5m于己烷中,28.75mmol)。将浅黄色溶液在《-70℃下搅拌45分钟。然后添加(4s)-4-[(3e)-3-叔丁基亚磺酰基亚氨基丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(5.4g,14.31mmol)于thf(8ml加上2ml冲洗液)中的溶液。将混合物在相同温度下进一步搅拌45分钟。添加nh4cl(40ml,饱和水溶液),随后添加水(50ml)和etoac(100ml)。使混合物升温至室温,并且与另一批在相同条件下以360mg规模制备的粗物质合并。分离各层,并将有机层用盐水洗涤,经无水mgso4干燥,过滤并浓缩。通过硅胶色谱法(80g柱),使用10%-80%etoac/己烷来纯化残余物,得到呈玻璃态固体状的(4s)-4-[3-(叔丁基亚磺酰基氨基)-3-[6-(三氟甲基)-2-吡啶基]丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(6.96g,91%调整的产率)。esi-ms m/z计算值505.2586,实验值506.6(m 1)
;保留时间:3.79分钟(lc方法b)。
[2920]
步骤2:(4s)-4-[3-氨基-3-[6-(三氟甲基)-2-吡啶基]丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯
[2921][2922]
将(4s)-4-[3-(叔丁基亚磺酰基氨基)-3-[6-(三氟甲基)-2-吡啶基]丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(7.45g,13.997mmol)溶解于thf(100ml)和水(20ml)的混合物中。添加分子碘(1.05g,4.14mmol)。然后将混合物在50℃油浴中加热并搅拌3小时。将其冷却至室温,用na2s2o3(5g于50ml饱和nahco3水溶液中)处理,并用etoac(100ml)稀释。分离各层,并将有机层用盐水洗涤,经无水mgso4干燥,过滤并浓缩。通过硅胶色谱法(80g柱),使用0-10%meoh/dcm来纯化残余物,得到呈浅棕色泡沫状的(4s)-4-[3-氨基-3-[6-(三氟甲基)-2-吡啶基]丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(4.6g,78%)。esi-ms m/z计算值401.229,实验值402.6(m 1)
;保留时间:2.86分钟。(lc方法b)。
[2923]
步骤3:(4s)-2,2-二甲基-4-[3-[(6-氨磺酰基-2-吡啶基)氨基]-3-[6-(三氟甲基)-2-吡啶基]丙基]吡咯烷-1-甲酸叔丁酯
[2924][2925]
将(4s)-4-[3-氨基-3-[6-(三氟甲基)-2-吡啶基]丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(4.6g,10.88mmol)溶解于dmso(6ml)中。一次性添加6-氟吡啶-2-磺酰胺(1.92g,10.90mmol),然后添加na2co3(3.5g,33.02mmol)。将混合物置于预热的110℃油浴中,并在氮气球下搅拌20小时。然后将其冷却至室温,用水(30ml)和etoac(50ml)稀释。分离各层,并将有机层用更多水(30ml)、盐水(30ml)洗涤,经无水mgso4干燥,过滤并浓缩。通过硅胶色谱法(120g柱),使用5%-50%etoac/己烷来纯化残余物,得到(4s)-2,2-二甲基-4-[3-[(6-氨磺酰基-2-吡啶基)氨基]-3-[6-(三氟甲基)-2-吡啶基]丙基]吡咯烷-1-甲酸叔丁酯(3.7738g,60%)。1h nmr(500mhz,dmso-d6)δ8.01(t,j=7.8hz,1h),7.87(td,j=9.3,8.4,2.0hz,1h),7.74(d,j=7.6hz,1h),7.64(d,j=8.4hz,1h),7.57
–
7.50(m,1h),7.07(s,2h),6.98(d,j=7.2hz,1h),6.73(d,j=8.2hz,1h),5.26(s,1h),3.52(dt,j=12.0,6.7hz,1h),2.76(dtd,j=25.7,10.6,5.3hz,1h),2.16
–
2.02(m,1h),1.98
–
1.78(m,3h),1.49
–
1.28(m,15h),1.22(s,3h)。esi-ms m/z计算值557.2284,实验值558.4(m 1)
;保留时间:2.84分钟(lc方法h)。
[2926]
步骤4:(4s)-4-[3-[[6-[(6-溴-2-氯-吡啶-3-羰基)氨磺酰基]-2-吡啶基]氨基]-3-[6-(三氟甲基)-2-吡啶基]丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯
[2927][2928]
将6-溴-2-氯-吡啶-3-甲酸(510mg,2.16mmol)和cdi(350mg,2.16mmol)的混合物溶解于thf(3.6ml)中,并且将混合物在60℃下搅拌45分钟,然后添加(4s)-2,2-二甲基-4-[3-[(6-氨磺酰基-2-吡啶基)氨基]-3-[6-(三氟甲基)-2-吡啶基]丙基]吡咯烷-1-甲酸叔丁酯(600mg,1.076mmol),随后添加dbu(726μl,4.85mmol),并且将所得混合物在室温下搅拌4小时。将混合物用etoac稀释,并用1n hcl水溶液、水、盐水洗涤,干燥(mgso4),并浓缩。将残余物纯化(快速色谱法:40g sio2,10%-35%etoac/己烷),得到所需产物:(4s)-4-[3-[[6-[(6-溴-2-氯-吡啶-3-羰基)氨磺酰基]-2-吡啶基]氨基]-3-[6-(三氟甲基)-2-吡啶基]丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(590mg,71%)。1h nmr(400mhz,氯仿-d)δ7.89(dq,j=13.7,7.5,6.8hz,1h),7.72(dd,j=13.6,8.0hz,1h),7.63(d,j=7.8hz,1h),7.60-7.51(m,2h),7.45(ddd,j=17.1,10.3,6.5hz,2h),6.74-6.65(m,1h),5.82(d,j=9.4hz,1h),5.35-5.16(m,1h),4.50-4.17(m,1h),4.16-4.08(m,1h),3.11(q,j=10.2hz,1h),2.4-2.3(m,1h),2.2-2.1(m,1h),2.1-1.9(m,1h),1.8-1.65(m,2h),1.6-1.5(m,2h),1.40-1.35(m,9h),1.35-1.25(m,6h)。esi-ms m/z计算值776.1193,实验值776.9(m 1)
;保留时间:0.8分钟(lc方法d)。
[2929]
步骤5:6-溴-2-氯-n-[[6-[[3-[(3r)-5,5-二甲基吡咯烷-3-基]-1-[6-(三氟甲基)-2-吡啶基]丙基]氨基]-2-吡啶基]磺酰基]吡啶-3-甲酰胺
[2930][2931]
向(4s)-4-[3-[[6-[(6-溴-2-氯-吡啶-3-羰基)氨磺酰基]-2-吡啶基]氨基]-3-[6-(三氟甲基)-2-吡啶基]丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(590mg,0.7602mmol)于dcm(4ml)中的溶液中添加tfa(1.8ml,23.36mmol),并且将混合物在室温下搅拌1小时。将溶液减压浓缩至干燥,然后与thf(2x20ml)共蒸发,然后在高真空下在室温下干燥16小时,得到:6-溴-2-氯-n-[[6-[[3-[(3r)-5,5-二甲基吡咯烷-3-基]-1-[6-(三氟甲基)-2-吡啶基]丙基]氨基]-2-吡啶基]磺酰基]吡啶-3-甲酰胺(三氟乙酸盐)(772mg,100%)。esi-ms m/z计算值674.0689,实验值676.9(m 1)
;保留时间:0.5分钟(lc方法d)。
[2932]
步骤6:(14s,17r)-8-溴-12,12-二甲基-17-[6-(三氟甲基)吡啶-2-基]-2λ
6-硫
杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮和(14s,17s)-8-溴-12,12-二甲基-17-[6-(三氟甲基)吡啶-2-基]-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮
[2933][2934]
将6-溴-2-氯-n-[[6-[[3-[(3r)-5,5-二甲基吡咯烷-3-基]-1-[6-(三氟甲基)-2-吡啶基]丙基]氨基]-2-吡啶基]磺酰基]吡啶-3-甲酰胺(三氟乙酸盐)(772mg,0.7583mmol)和碳酸钾(629mg,4.551mmol)于dma(7.7ml)中的混合物在140℃下加热7小时,通过冰浴冷却,用100ml etoac和30ml水稀释,并且然后用15ml的1m hcl稀释,得到试纸显示ph=2的混合物。将混合物分配并且分离有机层。将水层用100ml etoac萃取。将合并的有机萃取物干燥(mgso4)并蒸发得到油状物。将残余物溶解于dmso(100mg/ml)中,并用1体积的dma稀释。该溶液用制备型sfc,经由21.2x250mm 2-pic柱,5μm粒度,用5mm nh3/甲醇至co2(在10分钟内40%-70%)梯度洗脱进行纯化,蒸发所收集的级分后得到白色固体:
[2935]
洗脱的第一非对映异构体:(14s,17r)-8-溴-12,12-二甲基-17-[6-(三氟甲基)吡啶-2-基]-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮(101mg,21%)。1h nmr(400mhz,氯仿-d)δ7.80(t,j=7.9hz,1h),7.63(d,j=8.1hz,1h),7.57(t,j=9.0hz,1h),7.52(d,j=7.9hz,1h),7.46(d,j=7.3hz,1h),6.77(d,j=7.9hz,1h),6.71(d,j=8.4hz,1h),5.54-5.41(m,2h),3.33(d,j=9.6hz,1h),2.97(d,j=10.6hz,1h),2.54(s,2h),1.96(p,j=6.0hz,3h),1.68(s,2h),1.63(s,3h),1.58(s,2h),1.55(s,3h)。esi-ms m/z计算值638.0923,实验值639.2(m 1)
;保留时间:1.79分钟(lc方法a)。
[2936]
洗脱的第二非对映异构体:(14s,17s)-8-溴-12,12-二甲基-17-[6-(三氟甲基)吡啶-2-基]-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮(77mg,16%)。1h nmr(400mhz,氯仿-d)δ7.90(t,j=7.8hz,1h),7.85(d,j=8.1hz,1h),7.67-7.58(m,3h),7.54(d,j=8.0hz,1h),6.99(d,j=7.9hz,1h),6.79(d,j=7.4hz,1h),6.47(s,1h),5.01(s,1h),3.55(t,j=8.6hz,1h),3.23(s,1h),2.34(d,j=12.9hz,1h),2.02-1.80(m,5h),1.72(t,j=11.5hz,1h),1.60(s,3h),1.53(s,3h)。esi-ms m/z计算值638.0923,实验值639.3(m 1)
;保留时间:1.86分钟(lc方法a)。
[2937]
实施例118:(14s,17r)-8-[3-(3,3-二甲基丁氧基)-1h-吡唑-1-基]-12,12-二甲基-17-[6-(三氟甲基)吡啶-2-基]-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮(化合物306)的制备
[2938][2939]
通过鼓入氮气1分钟,使(14s,17r)-8-溴-12,12-二甲基-17-[6-(三氟甲基)吡啶-2-基]-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮(45mg,0.07037mmol)、3-(3,3-二甲基丁氧基)-1h-吡唑(47mg,0.28mmol)、六苯基-1,7-二钯九环[5.5.5.01,4.01,11.01,14.02,4.05,7.07,9.07,16]二十七碳-2,5,8,11,13,16-六烯-4,10,15-三酮(3.1mg,0.0034mmol)、(5-二苯基膦基-9,9-二甲基-氧杂蒽-4-基)-二苯基膦(6.2mg,0.011mmol)、cs2co3(92mg,0.28mmol)和dmf(700μl)的混合物脱气,然后加热至100℃持续16小时。然后,将混合物用2ml水、2ml dcm稀释,然后添加0.6ml的1m hcl,并且当试纸显示ph=4时,将混合物分配。分离各层,并将水层用dcm(2ml)萃取。将合并的有机萃取物干燥(mgso4)并蒸发。将残余物以40mg/ml溶解于1:1meoh/acn中,并经历制备型sfc,经由21.2 x250mm 2-pic柱,5μm粒度,使用5mm nh3/甲醇至co2(在10分钟内15%-50%)梯度洗脱,得到白色固体:(14s,17r)-8-[3-(3,3-二甲基丁氧基)-1h-吡唑-1-基]-12,12-二甲基-17-[6-(三氟甲基)吡啶-2-基]-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮(6.0mg,12%)。1h nmr(400mhz,氯仿-d)δ8.19(d,j=2.8hz,1h),8.02(d,j=8.3hz,1h),7.83(t,j=7.9hz,1h),7.64-7.56(m,2h),7.54(d,j=7.5hz,2h),7.24(s,1h),6.71(d,j=8.3hz,1h),5.91(d,j=2.8hz,1h),5.69(d,j=8.9hz,1h),5.49(d,j=7.6hz,1h),4.32(t,j=7.4hz,2h),3.44(s,1h),3.01(t,j=10.3hz,1h),2.86(d,j=14.3hz,1h),2.14(t,j=10.4hz,1h),1.96(s,1h),1.87(s,1h),1.74(t,j=7.4hz,2h),1.66(s,3h),1.64(s,3h),1.59(d,j=12.4hz,3h),1.00(s,9h)。esi-ms m/z计算值726.29236,实验值727.6(m 1)
;保留时间:2.15分钟(lc方法a)。
[2940]
实施例119:(14s,17r)-8-(6-氟吡啶-2-基)-12,12-二甲基-17-[6-(三氟甲基)吡啶-2-基]-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮(化合物308)的制备
[2941][2942]
通过鼓入氮气持续1分钟,使(14s,17r)-8-溴-12,12-二甲基-17-[6-(三氟甲基)吡啶-2-基]-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1
(22),5,7,9,19(23),20-六烯-2,2,4-三酮(48mg,0.075mmol)、(6-氟-2-吡啶基)硼酸(32mg,0.23mmol)、pd(dppf)cl2(5.5mg,0.0075mmol)、乙腈(840μl)和nahco3(446μl,1m,0.446mmol)的混合物脱气,然后加热至100℃持续2小时。然后,将混合物用2ml水、2ml的5:1dcm/meoh稀释,然后添加0.5ml的1m hcl,并且当试纸显示ph为4时,将混合物分配。分离各层,并将水层用5:1dcm/meoh(2ml)萃取。将残余物通过快速色谱法(4g sio2,10%-40%etoac/己烷,历经15分钟)纯化,得到目标:(14s,17r)-8-(6-氟吡啶-2-基)-12,12-二甲基-17-[6-(三氟甲基)吡啶-2-基]-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮(47.8mg,97%)。1h nmr(400mhz,氯仿-d)δ9.95(s,1h),8.17(dd,j=7.3,2.1hz,1h),8.09(d,j=8.0hz,1h),7.89(tt,j=17.0,7.9hz,3h),7.58(ddd,j=24.3,13.5,7.8hz,4h),6.97(dd,j=8.0,2.7hz,1h),6.73(d,j=8.2hz,1h),5.73(d,j=8.8hz,1h),5.51(q,j=7.7hz,1h),3.96(q,j=7.1,6.4hz,1h),3.78-3.71(m,1h),3.45(dd,j=9.6,6.7hz,1h),3.04(t,j=10.2hz,1h),2.92(t,j=14.5hz,1h),2.20(dd,j=12.4,8.2hz,1h),1.98(d,j=7.3hz,1h),1.91-1.79(m,2h),1.73(s,3h),1.72(s,3h),1.65(d,j=11.0hz,1h)。esi-ms m/z计算值655.19885,实验值656.5(m 1)
;保留时间:1.78分钟(lc方法a)。
[2943]
实施例120:(14s,17r)-8-[6-(3,3-二甲基丁氧基)吡啶-2-基]-12,12-二甲基-17-[6-(三氟甲基)吡啶-2-基]-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮(化合物304)的制备
[2944][2945]
向3,3-二甲基丁-1-醇(610μl,0.25m,0.152mmol)于dmf中的溶液中添加[双(三甲基硅基)氨基]钠(152μl,1m,0.152mmol),并且在室温下搅拌1分钟之后,向该溶液中添加(14s,17r)-8-(6-氟吡啶-2-基)-12,12-二甲基-17-[6-(三氟甲基)吡啶-2-基]-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮(20mg,0.0305mmol)。然后将混合物在80℃下搅拌1小时,用5ml dcm稀释,并且然后添加0.2ml的1n hcl和5ml水(ph试纸<4)。将混合物分配,用dcm萃取水层,将有机物干燥(mgso4)并蒸发。使残余物经历制备型sfc,经由21.2x250mm 2-pic柱,5μm粒度,使用5mm nh3/甲醇至co2(在10分钟内15%-50%)梯度洗脱,得到呈白色固体状的目标:(14s,17r)-8-[6-(3,3-二甲基丁氧基)吡啶-2-基]-12,12-二甲基-17-[6-(三氟甲基)吡啶-2-基]-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮(4.3mg,19%)。1h nmr(400mhz,氯仿-d)δ8.11(s,1h),7.90(s,1h),7.85(d,j=7.3hz,2h),7.66(t,j=7.9hz,1h),7.58(s,4h),6.73(t,j=8.0hz,2h),5.83(s,1h),5.50(s,1h),4.49(t,j=7.4hz,2h),3.46(s,1h),3.02(d,j=7.6hz,2h),2.23(s,1h),1.97(s,1h),1.76(d,j=7.6hz,2h),1.71(s,2h),1.66-1.52(m,8h),1.02(s,9h)。esi-ms m/z计算值
[2946]
实施例121:(14s)-12,12-二甲基-17-(丙-2-基)-8-(3-{2-[1-(三氟甲基)环丙基]乙氧基}-1h-吡唑-1-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮(非对映异构体1,化合物358)和(14s)-12,12-二甲基-17-(丙-2-基)-8-(3-{2-[1-(三氟甲基)环丙基]乙氧基}-1h-吡唑-1-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮(非对映异构体2,化合物357)的制备
[2947][2948]
步骤1:(4s)-4-[3-(叔丁基亚磺酰基氨基)-4-甲基-戊基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯
[2949][2950]
将(4s)-4-[(3e)-3-叔丁基亚磺酰基亚氨基丙基]-2,2-二甲基-[2951]
吡咯烷-1-甲酸叔丁酯(10g,26.496mmol)溶解于thf(150ml)中。在氮气球下,使用干冰丙酮浴将溶液冷却至-78℃,并搅拌5分钟。逐滴添加异丙基氯化镁(125ml,1.3m于thf中,162.50mmol)。使混合物升温至约-35℃并搅拌1小时。添加饱和nh4cl水溶液(80ml)。将混合物升温至室温。添加etoac(200ml)和水(100ml)。分离各层,并且水层再用etoac(200ml)萃取一次。将合并的有机物用盐水洗涤,经无水na2so4干燥,过滤并浓缩,得到粗制(4s)-4-[3-(叔丁基亚磺酰基氨基)-4-甲基-戊基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(12.5g,100%)。esi-ms m/z计算值402.2916,实验值403.6(m 1)
;保留时间:4.02分钟(lc方法b)。
[2952]
步骤2:(4s)-4-(3-氨基-4-甲基-戊基)-2,2-二甲基-吡咯烷-1-甲酸叔丁酯
[2953][2954]
将(4s)-4-[3-(叔丁基亚磺酰基氨基)-4-甲基-戊基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(12.5g,26.39mmol)溶解于thf(180ml)和水(36ml)的溶剂混合物中。一次性添加分子碘(2g,7.86mmol)。将混合物在35℃下搅拌18小时。然后将其冷却至室温,并使其在etoac(300ml)和含na2s2o3(50g)的饱和nahco3水溶液(300ml)之间分配。分离各层,并且水层再用etoac(200ml)萃取一次。浓缩有机层。将残余物溶解于1m hcl(500ml)中,并用乙醚(300ml)萃取。将水层通过2.5m naoh碱化并用etoac(2x300ml)萃取。将有机层用盐水洗涤,经无水na2so4干燥,过滤并浓缩,得到(4s)-4-(3-氨基-4-甲基-戊基)-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(6.8g,82%)。esi-ms m/z计算值298.262,实验值299.7(m 1)
;保留时间:2.69分钟(lc方法b)。
[2955]
步骤3:(4s)-2,2-二甲基-4-[4-甲基-3-[(6-氨磺酰基-2-吡啶基)氨基]戊基]吡咯烷-1-甲酸叔丁酯
[2956][2957]
向(4s)-4-(3-氨基-4-甲基-戊基)-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(6.8g,21.64mmol)和6-氟吡啶-2-磺酰胺(7.5g,40.44mmol)于dmso(20ml)中的混合物中添加diea(12ml,68.89mmol)。将混合物在115℃下搅拌20小时。然后使其冷却至室温,并在etoac(300ml)和饱和碳酸氢钠(500ml)之间分配。用更多etoac(300ml)萃取水层。将合并的etoac溶液用盐水(2x500ml)洗涤,经无水na2so4干燥,过滤并浓缩。通过硅胶色谱法,使用0-70%etoac/己烷来纯化残余物,得到呈固体状的(4s)-2,2-二甲基-4-[4-甲基-3-[(6-氨磺酰基-2-吡啶基)氨基]戊基]吡咯烷-1-甲酸叔丁酯(8.1g,79%)。1h nmr(500mhz,dmso-d6)δ7.48(t,j=7.8hz,1h),7.03(s,2h),6.90(d,j=7.1hz,1h),6.72(d,j=9.1hz,1h),6.65(d,j=8.3hz,1h),3.52(dt,j=18.4,10.7hz,1h),2.82
–
2.69(m,1h),2.07(d,j=10.9hz,1h),1.85(d,j=17.6hz,1h),1.82
–
1.72(m,1h),1.50(d,j=11.8hz,1h),1.43
–
1.28(m,16h),1.23(d,j=2.9hz,3h),0.88(dd,j=9.1,6.7hz,6h)。esi-ms m/z计算值454.2614,实验值455.2(m 1)
;保留时间:2.77分钟(lc方法h)。
[2958]
步骤4:(4s)-4-[3-[[6-[[2-氯-6-[3-[2-[1-(三氟甲基)环丙基]乙氧基]吡唑-1-基]吡啶-3-羰基]氨磺酰基]-2-吡啶基]氨基]-4-甲基-戊基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯
[2959][2960]
向2-氯-6-[3-[2-[1-(三氟甲基)环丙基]乙氧基]吡唑-1-基]吡啶-3-甲酸(175mg,0.47mmol)于thf(5ml)中的溶液中添加cdi(77mg,0.47mmol)(从thf再结晶),并且将混合物在室温下搅拌3小时。然后添加(4s)-2,2-二甲基-4-[4-甲基-3-[(6-氨磺酰基-2-吡啶基)氨基]戊基]吡咯烷-1-甲酸丁酯(151.5mg,0.33mmol),随后添加dbu(200μl,1.34mmol),并将所得混合物在室温下搅拌16小时。将反应物用乙酸乙酯稀释,并用饱和碳酸氢钠水溶液洗涤。将有机层进一步用10%柠檬酸溶液洗涤,随后用盐水洗涤。将有机物分离,经硫酸钠干燥,蒸发并且然后通过硅胶色谱法(40克柱),使用100%己烷至100%乙酸乙酯梯度,随后通过第二硅胶柱(24克柱),使用100%二氯甲烷至15%甲醇/二氯甲烷梯度进行纯化,得到呈灰白色固体状的(4s)-4-[3-[[6-[[2-氯-6-[3-[2-[1-(三氟甲基)环丙基]乙氧基]吡唑-1-基]吡啶-3-羰基]氨磺酰基]-2-吡啶基]氨基]-4-甲基-戊基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(155mg,57%)。1h nmr(500mhz,dmso-d6)δ12.75(s,1h),8.41(t,j=3.9hz,1h),8.09(d,j=7.8hz,1h),7.71(d,j=8.4hz,1h),7.59(t,j=7.8hz,1h),7.13(d,j=7.2hz,1h),6.98(s,1h),6.77(d,j=8.5hz,1h),6.19(d,j=3.1hz,1h),4.35(t,j=7.2hz,2h),3.87(s,1h),3.58-3.41(m,1h),2.69(q,j=10.1,9.6hz,1h),2.09(d,j=3.9hz,4h),1.98(s,1h),1.77(dd,j=12.9,6.6hz,2h),1.49(s,1h),1.36(d,j=15.9hz,9h),1.31-1.26(m,4h),1.25-1.19(m,1h),1.16(s,3h),0.96(d,j=5.1hz,2h),0.89(s,2h),0.83(d,j=6.8hz,6h)。esi-ms m/z计算值811.31055,实验值812.6(m 1)
;保留时间:2.49分钟(lc方法a)。
[2961]
步骤5:(14s)-12,12-二甲基-17-(丙-2-基)-8-(3-{2-[1-(三氟甲基)环丙基]乙氧基}-1h-吡唑-1-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮(非对映异构体1,化合物358)和(14s)-12,12-二甲基-17-(丙-2-基)-8-(3-{2-[1-(三氟甲基)环丙基]乙氧基}-1h-吡唑-1-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮(非对映异构体2,化合物357)
[2962]
[2963]
将(4s)-4-[3-[[6-[[2-氯-6-[3-[2-[1-(三氟甲基)环丙基]乙氧基]吡唑-1-基]吡啶-3-羰基]氨磺酰基]-2-吡啶基]氨基]-4-甲基-戊基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(145mg,0.18mmol)溶解于dcm(4.0ml)中,并且向混合物中添加hcl(2ml,4m于二噁烷中,8.0mmol)并在室温下搅拌。在1小时后,将混合物蒸发至干燥,然后用乙醚(5mls x 2)稀释,并再浓缩。然后将材料置于高真空泵上2小时,得到呈灰白色固体状的中间体2-氯-n-[[6-[[1-[2-[(3s)-5,5-二甲基吡咯烷-3-基]乙基]-2-甲基-丙基]氨基]-2-吡啶基]磺酰基]-6-[3-[2-[1-(三氟甲基)环丙基]乙氧基]吡唑-1-基]吡啶-3-甲酰胺(盐酸盐)。esi-ms m/z计算值711.2581,实验值712.2(m 1)
;保留时间:1.76分钟。
[2964]
将材料与k2co3(175mg,1.266mmol)、分子筛和dmso(5ml)合并于小瓶中,将其用氮气吹扫,封盖,加热至155℃并搅拌18小时。将混合物冷却至室温。将混合物过滤并在氮气流下浓缩,得到残余物,将所述残余物通过利用c
18
柱的反相制备型色谱法和hplc-ms方法30%-99%a1b1(乙腈-水 5毫摩尔hcl,15分钟方法x4次进样)纯化,得到两种产物:
[2965]
非对映异构体1,极性较大,棕褐色固体:(14s)-12,12-二甲基-17-(丙-2-基)-8-(3-{2-[1-(三氟甲基)环丙基]乙氧基}-1h-吡唑-1-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮(25.55mg,42%)esi-ms m/z计算值675.28143,实验值676.2(m 1)
;保留时间:2.33分钟(lc方法a)。
[2966]
非对映异构体2,极性较低,棕褐色固体:(14s)-12,12-二甲基-17-(丙-2-基)-8-(3-{2-[1-(三氟甲基)环丙基]乙氧基}-1h-吡唑-1-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮(18.18mg,30%)。1h nmr(500mhz,dmso-d6)δ12.47(s,1h),8.21(d,j=2.8hz,1h),7.67(d,j=8.3hz,1h),7.58(t,j=7.9hz,1h),7.16(d,j=7.3hz,1h),7.09(s,1h),6.90(d,j=8.2hz,1h),6.78(d,j=8.6hz,1h),6.11(d,j=2.8hz,1h),4.32(t,j=7.0hz,2h),3.35(s,2h),3.13(s,1h),2.92(s,1h),2.27(s,1h),2.08(t,j=7.1hz,2h),2.01(s,1h),1.91-1.83(m,1h),1.67(s,2h),1.56(d,j=28.2hz,7h),1.20(s,1h),0.96(d,j=4.9hz,2h),0.89(t,j=6.5hz,8h)。esi-ms m/z计算值675.28143,实验值676.2(m 1)
;保留时间:2.4分钟(lc方法a)。
[2967]
实施例122:(14s)-8-[3-(2-{二螺[2.0.2.1]庚-7-基}乙氧基)-1h-吡唑-1-基]-12,12-二甲基-17-(丙-2-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮(非对映异构体1,化合物354)和(14s)-8-[3-(2-{二螺[2.0.2.1]庚-7-基}乙氧基)-1h-吡唑-1-基]-12,12-二甲基-17-(丙-2-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮(非对映异构体2,化合物353)的制备
[3-[[6-[[2-氯-6-[3-(2-二螺[2.0.2.1]庚-7-基乙氧基)吡唑-1-基]吡啶-3-羰基]氨磺酰基]-2-吡啶基]氨基]-4-甲基-戊基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(55mg,50%),均呈白色固体状。
[2972]
步骤2:2-氯-n-[[6-[[1-[2-[(3r)-5,5-二甲基吡咯烷-3-基]乙基]-2-甲基-丙基]氨基]-2-吡啶基]磺酰基]-6-[3-(2-二螺[2.0.2.1]庚-7-基乙氧基)吡唑-1-基]吡啶-3-甲酰胺,非对映异构体1
[2973][2974]
将(4r)-4-[3-[[6-[[2-氯-6-[3-(2-二螺[2.0.2.1]庚-7-基乙氧基)吡唑-1-基]吡啶-3-羰基]氨磺酰基]-2-吡啶基]氨基]-4-甲基-戊基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(50mg,0.06278mmol)(非对映异构体1)溶解于dcm(218.2μl)中,并且向混合物中添加tfa(193.6μl,2.51mmol),并且将混合物在室温下搅拌3小时。将混合物减压浓缩至干燥,添加1ml甲苯,并且通过旋转蒸发(45℃水浴)移除。再次添加1ml甲苯并通过旋转蒸发(45℃水浴)移除,然后在高真空下干燥,得到呈白色固体状的2-氯-n-[[6-[[1-[2-[(3r)-5,5-二甲基吡咯烷-3-基]乙基]-2-甲基-丙基]氨基]-2-吡啶基]磺酰基]-6-[3-(2-二螺[2.0.2.1]庚-7-基乙氧基)吡唑-1-基]吡啶-3-甲酰胺(三氟乙酸盐)(50.87mg,100%)。esi-ms m/z计算值695.30206,实验值696.7(m 1)
;保留时间:0.75分钟(lc方法d)。
[2975]
步骤3:(14s)-8-[3-(2-{二螺[2.0.2.1]庚-7-基}乙氧基)-1h-吡唑-1-基]-12,12-二甲基-17-(丙-2-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮,非对映异构体1(化合物56)
[2976][2977]
向2-氯-n-[[6-[[1-[2-[(3r)-5,5-二甲基吡咯烷-3-基]乙基]-2-甲基-丙基]氨基]-2-吡啶基]磺酰基]-6-[3-(2-二螺[2.0.2.1]庚-7-基乙氧基)吡唑-1-基]吡啶-3-甲酰胺,非对映异构体1(三氟乙酸盐)(50.87mg,0.06278mmol)于nmp(3ml)中的溶液中添加碳酸钾(60.76mg,0.4396mmol)。将混合物用氮气吹扫5分钟。将混合物在165℃下加热16小时。将混合物冷却至室温,用1n hcl稀释并用etoac(1x)萃取。将有机相用盐水(1x)洗涤,干燥(硫酸钠),过滤并浓缩,得到棕色油状物,将所述棕色油状物过滤并使用反相hplc-ms方法,使用由phenomenex销售的luna c
18
(2)柱(75
×
30mm,5μm粒度)(pn:00c-4252-u0-ax),和在15.0分钟内从50%-99%流动相b运行的双梯度(流动相a=h2o(5mm hcl),流动相b=乙腈,流速=50ml/min,进样体积=950μl,并且柱温=25℃)进行纯化,得到呈白色固体状的(14s)-8-[3-(2-{二螺[2.0.2.1]庚-7-基}乙氧基)-1h-吡唑-1-基]-12,12-二甲基-17-(丙-2-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1
(22),5,7,9,19(23),20-六烯-2,2,4-三酮,非对映异构体1(28mg,68%)。1h nmr(500mhz,dmso-d6)δ12.43(s,1h),8.19(d,j=2.8hz,1h),7.66(d,j=8.2hz,1h),7.58(t,j=7.9hz,1h),7.16(d,j=7.2hz,1h),7.07(s,1h),6.89(d,j=8.1hz,1h),6.78(d,j=8.5hz,1h),6.07(d,j=2.7hz,1h),4.21(t,j=6.7hz,2h),3.13(s,1h),2.92(s,1h),2.27(d,j=8.8hz,1h),2.00(s,1h),1.88(dd,j=12.0,5.9hz,1h),1.81(q,j=6.7hz,2h),1.67(s,2h),1.59(s,3h),1.57(s,1h),1.54(s,3h),1.47(t,j=6.6hz,1h),1.20(s,1h),0.89(t,j=6.7hz,6h),0.87-0.78(m,4h),0.64(dd,j=8.1,4.1hz,2h),0.50(dd,j=8.4,4.2hz,2h)。nmr中的两个质子被水或dmso-d6信号遮盖。esi-ms m/z计算值659.3254,实验值660.7(m 1)
;保留时间:1.75分钟(lc方法m)。
[2978]
步骤4:2-氯-n-[[6-[[1-[2-[(3r)-5,5-二甲基吡咯烷-3-基]乙基]-2-甲基-丙基]氨基]-2-吡啶基]磺酰基]-6-[3-(2-二螺[2.0.2.1]庚-7-基乙氧基)吡唑-1-基]吡啶-3-甲酰胺,非对映异构体2
[2979][2980]
将(4r)-4-[3-[[6-[[2-氯-6-[3-(2-二螺[2.0.2.1]庚-7-基乙氧基)吡唑-1-基]吡啶-3-羰基]氨磺酰基]-2-吡啶基]氨基]-4-甲基-戊基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(55mg,0.069mmol)(非对映异构体2)溶解于dcm(240μl)中,并且向混合物中添加tfa(213μl,2.76mmol),并且将混合物在室温下搅拌3小时。将混合物减压浓缩至干燥,添加1ml甲苯,并且通过旋转蒸发(45℃水浴)移除。再次添加1ml甲苯并通过旋转蒸发(45℃水浴)移除,然后在高真空下干燥,得到呈白色固体状的2-氯-n-[[6-[[1-[2-[(3r)-5,5-二甲基吡咯烷-3-基]乙基]-2-甲基-丙基]氨基]-2-吡啶基]磺酰基]-6-[3-(2-二螺[2.0.2.1]庚-7-基乙氧基)吡唑-1-基]吡啶-3-甲酰胺,非对映异构体2(三氟乙酸盐)(55.96mg,100%)。esi-ms m/z计算值695.30206,实验值696.7(m 1)
;保留时间:0.75分钟(lc方法d)。
[2981]
步骤5:(14s)-8-[3-(2-{二螺[2.0.2.1]庚-7-基}乙氧基)-1h-吡唑-1-基]-12,12-二甲基-17-(丙-2-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮(化合物55)
[2982][2983]
向2-氯-n-[[6-[[1-[2-[(3r)-5,5-二甲基吡咯烷-3-基]乙基]-2-甲基-丙基]氨基]-2-吡啶基]磺酰基]-6-[3-(2-二螺[2.0.2.1]庚-7-基乙氧基)吡唑-1-基]吡啶-3-甲酰胺,非对映异构体2(三氟乙酸盐)(55.96mg,0.069mmol)于nmp(3ml)中的溶液中添加碳酸钾(66.84mg,0.4836mmol)。将混合物用氮气吹扫5分钟。将混合物在165℃下加热16小时。将混合物冷却至室温,用1n hcl稀释并用etoac(1x)萃取。将有机相用盐水(1x)洗涤,干燥(硫酸
钠),过滤并浓缩,得到棕色油状物,将所述棕色油状物过滤并使用反相hplc-ms方法,使用由phenomenex销售的luna c
18
(2)柱(75
×
30mm,5μm粒度)(pn:00c-4252-u0-ax),和在15.0分钟内从50%-99%流动相b运行的双梯度(流动相a=h2o(5mm hcl),流动相b=乙腈,流速=50ml/min,进样体积=950μl,并且柱温=25℃)进行纯化,得到呈白色固体状的(14s)-8-[3-(2-{二螺[2.0.2.1]庚-7-基}乙氧基)-1h-吡唑-1-基]-12,12-二甲基-17-(丙-2-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮,非对映异构体2(27.2mg,60%)。1h nmr(500mhz,dmso-d6)δ12.47(s,1h),8.21(d,j=2.8hz,1h),7.83(d,j=8.2hz,1h),7.56(t,j=7.8hz,1h),7.02(d,j=7.1hz,1h),6.92(dd,j=8.7,4.8hz,2h),6.74(d,j=8.5hz,1h),6.09(d,j=2.7hz,1h),4.22(t,j=6.7hz,2h),3.96(s,1h),3.15(dd,j=10.6,6.9hz,1h),2.68(t,j=10.6hz,1h),2.08(s,1h),1.83(dq,j=19.6,6.6,6.0hz,3h),1.64(d,j=6.1hz,2h),1.61(s,3h),1.57(d,j=12.5hz,2h),1.51(s,3h),1.48(t,j=6.7hz,2h),1.32-1.21(m,1h),0.92-0.79(m,10h),0.68-0.61(m,2h),0.50(d,j=8.5hz,2h)。esi-ms m/z计算值659.3254,实验值660.7(m 1)
;保留时间:1.62分钟(lc方法m)。
[2984]
实施例123:12,12-二甲基-17-苯基-8-(3-{2-[1-(三氟甲基)环丙基]乙氧基}-1h-吡唑-1-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮,化合物388(对映异构体1)、化合物387(对映异构体2)、化合物384(对映异构体3)和化合物383(对映异构体4)的制备
[2985][2986]
步骤1:3-(苄氧基羰基氨基)-3-苯基-丙酸
[2987][2988]
将3-氨基-3-苯基-丙酸(30g,177.98mmol)与氢氧化钠(180ml,1m,180.00mmol)混合,并在冰水浴中冷却。一起添加cbz氯化物(30ml,188.87mmol)和氢氧化钠(180ml,1m,180.00mmol)。将反应混合物在室温下搅拌16小时。将混合物用乙醚(450ml)萃取。分离各层,并在冰水浴中冷却水层。添加浓hcl直到溶液的ph达到1。然后用dcm(500ml x 3)萃取溶液。将合并的有机物通过盐水(800ml)洗涤,经硫酸钠干燥,过滤并浓缩,得到呈白色固体状的3-(苄氧基羰基氨基)-3-苯基-丙酸(40.8g,73%)。esi-ms m/z计算值299.1158,实验值300.5(m 1)
;保留时间:3.26分钟(lc方法b)。
[2989]
步骤2:n-[3-[甲氧基(甲基)氨基]-3-氧代-1-苯基-丙基]氨基甲酸苄酯
[2990][2991]
向配备有搅拌棒的500ml圆底烧瓶中添加3-(苄氧基羰基氨基)-3-苯基丙酸(9.5g,28.57mmol)、二氯甲烷(50ml)和四氢呋喃(200ml)。向该搅拌的溶液中添加1,1'-羰基二咪唑酮(6g,36.26mmol),并在室温下搅拌40分钟。此时,添加n,o-二甲基羟胺(盐酸盐)(3.6g,36.17mmol)。然后将混合物在室温下搅拌19小时。将反应混合物与以3.5g3-(苄氧基羰基氨基)-3-苯基-丙酸操作的另一反应物合并,并将其用1m hcl(100ml)淬灭,并移除溶剂。将水层用乙酸乙酯(3x100ml)以及盐水和饱和碳酸氢钠溶液(200ml)的1:1混合物萃取。有机层经硫酸钠干燥并浓缩,得到呈白色固体状的n-[3-[甲氧基(甲基)氨基]-3-氧代-1-苯基-丙基]氨基甲酸苄酯(13.5g,调整产率:96%)。esi-ms m/z计算值342.16,实验值343.4(m 1)
;保留时间:3.22分钟(lc方法b)。
[2992]
步骤3:n-(3-氧代-1-苯基-丙基)氨基甲酸苄酯
[2993][2994]
在0℃下,向n-[3-[甲氧基(甲基)氨基]-3-氧代-1-苯基-丙基]氨基甲酸苄酯(61.95g,171.89mmol)于四氢呋喃(800ml)中的溶液中添加lialh4(2m于thf中,130ml,260mmol)。将反应混合物从0℃至25℃逐渐搅拌50分钟。将混合物用5%hcl溶液(800ml)淬灭,并用乙酸乙酯(3x600ml)萃取。有机层经硫酸钠干燥并浓缩,得到n-(3-氧代-1-苯基-丙基)氨基甲酸苄酯(48.38g,94%)。esi-ms m/z计算值283.1208,实验值284.4(m 1)
;保留时间:3.25分钟(lc方法b)。
[2995]
步骤4:n-[3-[1-[(4-甲氧基苯基)甲基]-5,5-二甲基-2-氧代-吡咯烷-3-亚基]-1-苯基-丙基]氨基甲酸苄酯
[2996][2997]
将3-二乙氧基磷酰基-1-[(4-甲氧基苯基)甲基]-5,5-二甲基-吡咯烷-2-酮(5g,12.86mmol)溶解于四氢呋喃(95ml)中,并在冰水浴中冷却。添加含60%nah的矿物油(1.2g,30mmol),并将所得混合物搅拌三十分钟。将n-(3-氧代-1-苯基-丙基)氨基甲酸苄酯(6.17g,17.422mmol)溶解于四氢呋喃(35ml)中,将所得溶液以缓慢流添加到冷却的膦酸酯溶液中。将所得混合物在0℃下搅拌,并使其升温至室温并搅拌十六小时。通过添加水(150ml)淬灭反应混合物并用乙酸乙酯(3x200ml)萃取。将有机层用盐水洗涤,经硫酸钠干燥并浓缩。残余物(与来自使用2g的3-二乙氧基磷酰基-1-[(4-甲氧基苯基)甲基]-5,5-二
m/z计算值380.21,实验值381.6(m 1)
;保留时间:3.52分钟(lc方法b)。
[3007]
步骤8:n-[3-(5,5-二甲基吡咯烷-3-基)-1-苯基-丙基]氨基甲酸苄酯
[3008][3009]
在回流下,向n-[3-(5,5-二甲基-2-氧代-吡咯烷-3-基)-1-苯基-丙基]氨基甲酸苄酯(1.55g,3.66mmol)于无水四氢呋喃(25ml)中的溶液中逐滴添加含2m硼烷二甲硫醚复合物的thf(15ml,30mmol)。在3小时后,将混合物冷却至0℃,并逐滴添加15ml meoh/hcl(9:1)溶液。将混合物在60℃下搅拌4小时,使其冷却至环境温度并减压浓缩。将残余物用饱和碳酸氢钠稀释,并用二氯甲烷(3x50ml)萃取。有机层经硫酸钠干燥并浓缩,得到粗产物n-[3-(5,5-二甲基吡咯烷-3-基)-1-苯基-丙基]氨基甲酸苄酯(1.89g,98%)esi-ms m/z计算值366.2307,实验值367.6(m 1)
;保留时间:3.07分钟(lc方法b)。
[3010]
步骤9:4-[3-(苄氧基羰基氨基)-3-苯基-丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯
[3011][3012]
向n-[3-(5,5-二甲基吡咯烷-3-基)-1-苯基-丙基]氨基甲酸苄酯(3.42g,8.3985mmol)于tea(2.9040g,4ml,28.698mmol)和二氯甲烷(60ml)中的溶液中添加二碳酸二叔丁酯(4g,17.778mmol),并在室温下搅拌1小时。将反应混合物用二氯甲烷(300ml)稀释,用碳酸氢钠和盐水洗涤,经硫酸钠干燥并浓缩。残余物通过硅胶柱色谱法使用0-40%己烷-乙酸乙酯来纯化,得到4-[3-(苄氧基羰基氨基)-3-苯基-丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(1.7g,43%)esi-ms m/z计算值466.2832,实验值467.5(m 1)
;保留时间:7.74分钟(lc方法c)。
[3013]
步骤10:4-(3-氨基-3-苯基-丙基)-2,2-二甲基-吡咯烷-1-甲酸叔丁酯
[3014][3015]
向4-[3-(苄氧基羰基氨基)-3-苯基-丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(1.7g,3.57mmol)于甲醇(30ml)和乙酸(1ml,17.58mmol)中的溶液中添加10%钯/碳(200mg)。将该混合物在parr振荡器中在55psi氢气下保持1小时。将反应混合物通过硅藻土垫过滤。将滤液浓缩并用乙酸乙酯(100ml)稀释,并用饱和碳酸氢钠和盐水洗涤。有机层经
硫酸钠干燥并浓缩,得到呈白色固体状的4-(3-氨基-3-苯基-丙基)-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(1.22g,98%)。esi-ms m/z计算值332.2464,实验值333.5(m 1)
;保留时间:3.25分钟(lc方法b)。
[3016]
步骤11:2,2-二甲基-4-[3-苯基-3-[(6-氨磺酰基-2-吡啶基)氨基]丙基]吡咯烷-1-甲酸叔丁酯
[3017][3018]
将4-(3-氨基-3-苯基-丙基)-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(1.22g,3.49mmol)、6-氟吡啶-2-磺酰胺(1g,5.68mmol)和碳酸钠(0.8g,7.55mmol)于二噁烷(5ml)中的浆液加热至110℃持续48小时。将混合物冷却,并添加水(30ml),然后用乙酸乙酯(2x50ml)萃取。有机层经硫酸钠干燥并浓缩。残余物通过制备型hplc(柱:varian c
18 10μm 5x30cm;流速:60ml/min.;流动相a:水 0.1%tfa;流动相b:乙腈 0.1%tfa;方法:0-45%b,在60分钟内)纯化。将合并的纯级分与饱和碳酸氢钠混合至ph 8-9。移除乙腈,并将水相用乙酸乙酯(3x200ml)萃取,将有机层通过盐水洗涤,经硫酸钠干燥并浓缩,得到呈灰白色固体状的2,2-二甲基-4-[3-苯基-3-[(6-氨磺酰基-2-吡啶基)氨基]丙基]吡咯烷-1-甲酸叔丁酯(1.06g,60%)。1h nmr(250mhz,dmso-d6)δ7.56-7.40(m,3h),7.30(t,j=7.4hz,2h),7.19(t,j=7.2hz,1h),7.06(s,1h),6.94(d,j=7.2hz,1h),6.61(d,j=8.5hz,1h),5.02(s,1h),3.52(s,1h),2.77(t,j=10.1hz,1h),2.09(s,1h),1.81(t,j=18.2hz,3h),1.54-1.28(m,12h),1.22(s,3h)。esi-ms m/z计算值488.2457,实验值489.4(m 1)
;保留时间:2.75分钟(lc方法h)。
[3019]
步骤12:4-[3-[[6-[[2-氯-6-[3-[2-[1-(三氟甲基)环丙基]乙氧基]吡唑-1-基]吡啶-3-羰基]氨磺酰基]-2-吡啶基]氨基]-3-苯基-丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯
[3020][3021]
向2-氯-6-[3-[2-[1-(三氟甲基)环丙基]乙氧基]吡唑-1-基]吡啶-3-甲酸(848mg,2.257mmol)于thf(6ml)中的溶液中添加cdi(457.1mg,2.819mmol)(从thf再结晶),并将混合物在室温下搅拌1小时,然后添加2,2-二甲基-4-[3-苯基-3-[(6-氨磺酰基-2-吡啶基)氨基]丙基]吡咯烷-1-甲酸叔丁酯(1.153g,2.360mmol)于thf(2ml)中的溶液,随后添加dbu(1.079g,7.088mmol),并且将所得混合物在室温下搅拌3小时。将反应物用水和etoac稀释,然后添加hcl(2.523ml,6m,15.14mmol),然后使水层的ph=1。分离各层,并且将有机层用水和盐水洗涤,然后经硫酸钠干燥,并浓缩,得到白色泡沫,将所述白色泡沫在275g c
18
反相柱上,用50%-100%acn/水梯度洗脱进行纯化,得到呈白色固体状的4-[3-[[6-[[2-氯-6-[3-[2-[1-(三氟甲基)环丙基]乙氧基]吡唑-1-基]吡啶-3-羰基]氨磺酰基]-2-吡啶基]氨基]-3-苯基-丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(1.44g,75%)。esi-ms m/z计算值845.2949,实验值846.3(m 1)
;保留时间:0.91分钟(lc方法d)。
[3022]
步骤13:2-氯-n-[[6-[[3-(5,5-二甲基吡咯烷-3-基)-1-苯基-丙基]氨基]-2-吡啶基]磺酰基]-6-[3-[2-[1-(三氟甲基)环丙基]乙氧基]吡唑-1-基]吡啶-3-甲酰胺
[3023][3024]
将4-[3-[[6-[[2-氯-6-[3-[2-[1-(三氟甲基)环丙基]乙氧基]吡唑-1-基]吡啶-3-羰基]氨磺酰基]-2-吡啶基]氨基]-3-苯基-丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(1.44g,1.701mmol)溶解于dcm(6ml)中,并且向混合物中添加tfa(5.2ml,68.08mmol),并且将混合物在室温下搅拌2小时。将混合物减压浓缩至干燥,添加50ml甲苯,并且通过旋转蒸发(45℃水浴)移除。再次添加50ml甲苯并通过旋转蒸发(45℃水浴)移除,然后真空干燥,得到2-氯-n-[[6-[[3-(5,5-二甲基吡咯烷-3-基)-1-苯基-丙基]氨基]-2-吡啶基]磺酰基]-6-[3-[2-[1-(三氟甲基)环丙基]乙氧基]吡唑-1-基]吡啶-3-甲酰胺(三氟乙酸盐)(1.463g,100%)esi-ms m/z计算值745.2425,实验值746.2(m 1)
;保留时间:0.62分钟,呈白色固体状(lc方法d)。
[3025]
步骤14:12,12-二甲基-17-苯基-8-(3-{2-[1-(三氟甲基)环丙基]乙氧基}-1h-吡唑-1-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮,非对映异构体1,和12,12-二甲基-17-苯基-8-(3-{2-[1-(三氟甲基)环丙基]乙氧基}-1h-吡唑-1-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮,非对映异构体2
[3026][3027]
向2-氯-n-[[6-[[3-(5,5-二甲基吡咯烷-3-基)-1-苯基-丙基]氨基]-2-吡啶基]磺酰基]-6-[3-[2-[1-(三氟甲基)环丙基]-乙氧基]吡唑-1-基]吡啶-3-甲酰胺(三氟乙酸盐)(1.463g,1.701mmol)于nmp(88ml)中的溶液中添加k2co3(1.646g,11.91mmol)。将混合物用氮气吹扫5分钟。将混合物在150℃下加热过夜。将混合物冷却至室温,并用300ml水稀释,随后缓慢添加hcl(2ml,12m,25.52mmol),得到沉淀。将混合物进一步用100ml 1n hcl水溶液稀释,然后用etoac(1x300ml)萃取,并将有机相用饱和盐水洗涤。然后将有机层干燥(硫酸钠),过滤并浓缩,得到棕褐色固体,将其在275g反相柱上,用50%至100%乙腈/水梯度洗脱进行层析分离,得到对应于非对映异构体产物的2个峰:
[3028]
非对映异构体1:12,12-二甲基-17-苯基-8-(3-{2-[1-(三氟甲基)环丙基]乙氧基}-1h-吡唑-1-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮(211mg,35%)esi-ms m/z计算值709.2658,实验值710.2(m 1)
;保留时间:0.86分钟(lc方法t)。
[3029]
非对映异构体2:12,12-二甲基-17-苯基-8-(3-{2-[1-(三氟甲基)环丙基]乙氧基}-1h-吡唑-1-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮(386mg,64%)esi-ms m/z计算值709.2658,实验值710.2(m 1)
;保留时间:0.88分钟(lc方法t)。
[3030]
步骤15:12,12-二甲基-17-苯基-8-(3-{2-[1-(三氟甲基)环丙基]乙氧基}-1h-吡唑-1-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮,化合物388(对映异构体1),和12,12-二甲基-17-苯基-8-(3-{2-[1-(三氟甲基)环丙基]乙氧基}-1h-吡唑-1-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮,化合物387(对映异构体2)
[3031][3032]
通过sfc色谱法,使用chiralpak as-h(250x21.2mm),5μm粒度,使用15%meoh(无改质剂)、45%co2,以10ml/min历经14分钟对12,12-二甲基-17-苯基-8-(3-{2-[1-(三氟甲基)环丙基]乙氧基}-1h-吡唑-1-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮(211mg,0.2973mmol,(非对映异构体1))进行手性分离,得到白色固体:
[3033]
洗脱的第一对映异构体(对映异构体1)12,12-二甲基-17-苯基-8-(3-{2-[1-(三氟甲基)环丙基]乙氧基}-1h-吡唑-1-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮(92.2mg,87%)。1h nmr(400mhz,氯仿-d)δ8.20(d,j=2.8hz,1h),8.00(d,j=8.3hz,1h),7.57(dd,j=8.4,7.2hz,1h),7.49(dd,j=7.3,0.8hz,1h),7.39(dt,j=6.3,1.5hz,2h),7.36-7.31(m,2h),7.30-7.24(m,1h),7.18(d,j=8.3hz,1h),6.58(dd,j=8.3,0.8hz,1h),5.90(d,j=2.8hz,1h),5.40-5.31(m,1h),4.75(d,j=8.8hz,1h),4.40(t,j=7.1hz,2h),3.44(dd,j=10.1,6.9hz,1h),3.03(t,j=10.4hz,1h),2.62(dd,j=19.5,8.0hz,1h),2.10(t,j=7.2hz,2h),2.04(d,j=7.4hz,1h),2.01-1.95(m,1h),1.88(dt,j=14.8,8.4hz,1h),1.64(m,7h)1.58-1.49(m,1h),1.25(s,1h),1.05-1.00(m,2h),0.78-0.71(m,2h)esi-ms m/z计算值709.2658,实验值710.2(m 1)
;保留时间:1.3分钟(lc方法m);
[3034]
洗脱的第二对映异构体(对映异构体2)12,12-二甲基-17-苯基-8-(3-{2-[1-(三氟甲基)环丙基]乙氧基}-1h-吡唑-1-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮(96.8mg,92%)。1h nmr(400mhz,氯仿-d)δ8.20(d,j=2.8hz,1h),8.00(d,j=8.3hz,1h),7.57(dd,j=8.3,7.3hz,1h),7.49(d,j=6.8hz,1h),7.41-7.37(m,2h),7.37-7.31(m,2h),7.30-7.26(m,1h),7.18(d,j=8.3hz,1h),6.58(dd,j=8.4,0.8hz,1h),5.90(d,j=2.8hz,1h),5.41-5.30(m,1h),4.75(d,j=8.8hz,1h),4.40(t,j=7.1hz,2h),3.44(dd,j=10.1,6.9hz,1h),3.03(t,j=10.4hz,1h),2.62(dd,j=19.2,8.1hz,1h),2.11(d,j=7.1hz,2h),2.03(s,1h),2.01-1.94(m,1h),1.88(dt,j=14.9,8.4hz,1h),1.65(s,3h),1.63(s,3h),1.59-1.45(m,2h),1.25(s,2h),1.08-0.99(m,2h),0.79-0.69(m,2h)esi-ms m/z计算值709.2658,实验值710.14(m 1)
;保留时间:1.29分钟(lc方法m)。
[3035]
步骤16:12,12-二甲基-17-苯基-8-(3-{2-[1-(三氟甲基)环丙基]乙氧基}-1h-吡唑-1-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮,化合物384(对映异构体3),和12,12-二甲基-17-苯基-8-(3-{2-[1-(三氟甲基)环丙基]乙氧基}-1h-吡唑-1-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮,化合物383(对映异构体4)
[3036][3037]
通过sfc色谱法,使用chiralpak ad-h(250x21.2mm),5μm粒度,使用15%meoh(无改质剂)、45%co2,以10ml/min历经14分钟对12,12-二甲基-17-苯基-8-(3-{2-[1-(三氟甲基)环丙基]乙氧基}-1h-吡唑-1-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮(380mg,0.53mmol,非对映异构体2)进行手性分离,得到白色固体:
[3038]
洗脱的第一对映异构体(对映异构体3):12,12-二甲基-17-苯基-8-(3-{2-[1-(三氟甲基)环丙基]乙氧基}-1h-吡唑-1-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮(97mg,51%)esi-ms m/z计算值709.2658,实验值710.14(m 1)
;保留时间:1.38分钟(lc方法t)。
[3039]
洗脱的第二对映异构体(对映异构体4):12,12-二甲基-17-苯基-8-(3-{2-[1-(三氟甲基)环丙基]乙氧基}-1h-吡唑-1-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮(90mg,47%)esi-ms m/z计算值709.2658,实验值710.2(m 1)
;保留时间:1.39分钟(lc方法t)。
[3040]
实施例124:(14s)-8-[3-(2-{二螺[2.0.2.1]庚-7-基}乙氧基)-1h-吡唑-1-基]-12,12-二甲基-17-苯基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮(非对映异构体1,化合物364)和(14s)-8-[3-(2-{二螺[2.0.2.1]庚-7-基}乙氧基)-1h-吡唑-1-基]-12,12-二甲基-17-苯基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮(非对映异构体2,化合物363)的制备
[3041][3042]
步骤1:(4s)-4-[3-(叔丁基亚磺酰基氨基)-3-苯基-丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯
[3043][3044]
将(4s)-4-[(3z)-3-叔丁基亚磺酰基亚氨基丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(3.5g,9.2737mmol)溶解于thf(50ml)中,并在氮气球下在-70℃干冰丙酮浴中冷却。10分钟后,历经5分钟以恒定速率添加苯基锂(5.2ml,1.9m于二丁基醚中,9.88mmol)。将混合物在相同温度下搅拌30分钟,并使其升温至-30℃。添加饱和nh4cl水溶液(20ml)。将混合物升温至室温,并在水(50ml)和etoac(50ml)之间分配。分离各层。将etoac层用盐水洗涤,经无水na2so4干燥,过滤并浓缩。通过硅胶色谱法,使用0-40%etoac/己烷来纯化残余物,得到(4s)-4-[3-(叔丁基亚磺酰基氨基)-3-苯基-丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(3.54g,83%)。esi-ms m/z计算值436.276,实验值437.6(m 1)
;保留时间:3.76分钟(lc方法b)。
[3045]
步骤2:(4s)-4-(3-氨基-3-苯基-丙基)-2,2-二甲基-吡咯烷-1-甲酸叔丁酯
[3046][3047]
将(4s)-4-[3-(叔丁基亚磺酰基氨基)-3-苯基-丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(3.54g,7.7018mmol)溶解于thf(50ml)和水(10ml)的溶剂混合物中。一次性添加分子碘(391mg,0.0793ml,1.54mmol)。将混合物在50℃-55℃油浴中在氮气下加热6小时。然后将其冷却至室温,并用etoac(50ml)和含nas2o3水溶液(10g)的饱和nahco3水溶液(50ml)稀释。分离各层,并用水(30ml)和盐水洗涤有机层。分离各层,并且有机层经无水na2so4干燥,过滤并浓缩。该粗物质不经进一步纯化即用于下一步。esi-ms m/z计算值332.24637,实验值333.6(m 1)
;保留时间:2.69分钟(lc方法b)。
[3048]
步骤3:(4s)-2,2-二甲基-4-[3-苯基-3-[(6-氨磺酰基-2-吡啶基)氨基]丙基]吡咯烷-1-甲酸叔丁酯
[3049]
[3050]
将(4s)-4-(3-氨基-3-苯基-丙基)-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(3g,8.12mmol)溶解于dmso(5ml)中。添加6-氟吡啶-2-磺酰胺(2.1g,11.92mmol)和na2co3(2.6g,24.53mmol)。将混合物在110℃油浴中在氮气球下加热18小时。然后将其冷却至室温,并在水和etoac(各20ml)之间分配。分离各层,并且水层再用etoac(20ml)萃取一次。将合并的etoac溶液浓缩并且通过硅胶色谱法,使用5%-100%etoac/己烷来纯化残余物,得到呈白色泡沫状的(4s)-2,2-二甲基-4-[3-苯基-3-[(6-氨磺酰基-2-吡啶基)氨基]丙基]吡咯烷-1-甲酸叔丁酯(2.35g,57%)。1h nmr(500mhz,dmso-d6)δ7.52-7.40(m,3h),7.28(t,j=7.6hz,2h),7.18(t,j=7.3hz,1h),7.04(s,2h),6.93(d,j=7.2hz,1h),6.60(d,j=8.3hz,1h),3.61-3.45(m,1h),2.84-2.66(m,1h),2.14-2.03(m,1h),1.98(s,1h),1.91-1.61(m,3h),1.47-1.28(m,13h),1.21(s,4h)。esi-ms m/z计算值488.2457,实验值489.4(m 1)
;保留时间:2.79分钟(lc方法h)。
[3051]
步骤4:(4s)-4-[3-[[6-[[2-氯-6-[3-(2-二螺[2.0.2.1]庚-7-基乙氧基)吡唑-1-基]吡啶-3-羰基]氨磺酰基]-2-吡啶基]氨基]-3-苯基-丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯
[3052][3053]
向2-氯-6-[3-(2-二螺[2.0.2.1]庚-7-基乙氧基)吡唑-1-基]吡啶-3-甲酸(250mg,0.695mmol)于thf(2ml)中的溶液中添加cdi(140.7mg,0.868mmol)(从thf再结晶),并将混合物在室温下搅拌1小时,然后添加(4s)-2,2-二甲基-4-[3-苯基-3-[(6-氨磺酰基-2-吡啶基)氨基]丙基]吡咯烷-1-甲酸叔丁酯(355.1mg,0.727mmol),随后添加dbu(326.3μl,2.182mmol),并且将所得混合物在室温下搅拌16小时。浓缩以移除thf,然后用dmso稀释,过滤并使用反相hplc-ms方法,使用由phenomenex销售的luna c
18
(2)柱(75
×
30mm,5μm粒度)(pn:00c-4252-u0-ax),以及在15.0分钟内从1%-99%流动相b运行的双梯度(流动相a=h2o(5mm hcl),流动相b=乙腈,流速=50ml/min,进样体积=950μl并且柱温=25℃)进行纯化,得到呈非对映异构体混合物形式的(4s)-4-[3-[[6-[[2-氯-6-[3-(2-二螺[2.0.2.1]庚-7-基乙氧基)吡唑-1-基]吡啶-3-羰基]氨磺酰基]-2-吡啶基]氨基]-3-苯基-丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(282.6mg,49%)。esi-ms m/z计算值829.3388,实验值830.3(m 1)
;保留时间:0.96分钟(lc方法d)。
[3054]
步骤5:2-氯-n-[[6-[[3-[(3s)-5,5-二甲基吡咯烷-3-基]-1-苯基-丙基]氨基]-2-吡啶基]磺酰基]-6-[3-(2-二螺[2.0.2.1]庚-7-基乙氧基)吡唑-1-基]吡啶-3-甲酰胺
[3055][3056]
将(4s)-4-[3-[[6-[[2-氯-6-[3-(2-二螺[2.0.2.1]庚-7-基乙氧基)吡唑-1-基]吡啶-3-羰基]氨磺酰基]-2-吡啶基]氨基]-3-苯基-丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(282.6mg,0.3403mmol)溶解于dcm(1.2ml)中,并且向混合物中添加tfa(1ml,13.62mmol),并且将混合物在室温下搅拌2小时。将混合物减压浓缩至干燥,添加1ml甲苯,并且通过旋转蒸发(45℃水浴)移除。再次添加1ml甲苯并通过旋转蒸发(45℃水浴)移除,然后在高真空下干燥,得到呈白色固体状的2-氯-n-[[6-[[3-[(3s)-5,5-二甲基吡咯烷-3-基]-1-苯基-丙基]氨基]-2-吡啶基]磺酰基]-6-[3-(2-二螺[2.0.2.1]庚-7-基乙氧基)吡唑-1-基]吡啶-3-甲酰胺(三氟乙酸盐)(287.3mg,100%)。esi-ms m/z计算值729.2864,实验值730.6(m 1)
;保留时间:0.73分钟(lc方法d)。
[3057]
步骤6:(14s)-8-[3-(2-{二螺[2.0.2.1]庚-7-基}乙氧基)-1h-吡唑-1-基]-12,12-二甲基-17-苯基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮(非对映异构体1,化合物364)和(14s)-8-[3-(2-{二螺[2.0.2.1]庚-7-基}乙氧基)-1h-吡唑-1-基]-12,12-二甲基-17-苯基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮(非对映异构体2,化合物363)
[3058][3059]
向2-氯-n-[[6-[[3-[(3s)-5,5-二甲基吡咯烷-3-基]-1-苯基-丙基]氨基]-2-吡啶基]磺酰基]-6-[3-(2-二螺[2.0.2.1]庚-7-基乙氧基)吡唑-1-基]吡啶-3-甲酰胺(三氟乙酸盐)(287.3mg,0.3403mmol)于nmp(17ml)中的溶液中添加碳酸钾(329.3mg,2.383mmol)。将混合物用氮气吹扫5分钟。将混合物在165℃下加热16小时。将混合物冷却至室温,用1n hcl稀释并用etoac(1x)萃取。将有机相用盐水(1x)洗涤,干燥(硫酸钠),过滤并
浓缩,得到棕色油状物,将所述棕色油状物过滤并使用反相hplc-ms方法使用由phenomenex销售的luna c
18
(2)柱(75
×
30mm,5μm粒度)(pn:00c-4252-u0-ax),以及在15.0分钟内从50%-99%流动相b运行的双梯度(流动相a=h2o(5mm hcl),流动相b=乙腈,流速=50ml/min,进样体积=950μl并且柱温=25℃)进行纯化,得到呈白色固体状的两种非对映异构体:
[3060]
首先洗脱的非对映异构体1:(14s)-8-[3-(2-{二螺[2.0.2.1]庚-7-基}乙氧基)-1h-吡唑-1-基]-12,12-二甲基-17-苯基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮(66.5mg,56%)。:1h nmr(500mhz,dmso-d6)δ12.58(s,1h),8.23(d,j=2.7hz,1h),7.87(d,j=8.2hz,1h),7.68(d,j=9.2hz,1h),7.62(t,j=7.9hz,1h),7.43(d,j=7.7hz,2h),7.31(t,j=7.5hz,2h),7.21(t,j=7.4hz,1h),7.08(d,j=7.2hz,1h),6.95(d,j=8.2hz,1h),6.81(d,j=8.5hz,1h),6.10(d,j=2.7hz,1h),5.20(t,j=11.1hz,1h),4.23(t,j=6.7hz,2h),3.31(d,j=9.6hz,1h),2.82(t,j=10.5hz,1h),2.29(s,1h),1.99-1.86(m,2h),1.82(q,j=6.6hz,2h),1.74(dd,j=14.0,8.7hz,2h),1.65(s,3h),1.61(d,j=12.5hz,1h),1.54(s,3h),1.51-1.44(m,2h),0.85(d,j=6.2hz,4h),0.65(dd,j=8.6,4.2hz,2h),0.51(d,j=8.7hz,2h)。esi-ms m/z计算值693.30975,实验值694.6(m 1)
;保留时间:2.53分钟(lc方法q),esi-ms m/z计算值693.30975,实验值694.6(m 1)
;保留时间:1.62分钟(lc方法v,正交方法)。
[3061]
第二洗脱的非对映异构体2:(14s)-8-[3-(2-{二螺[2.0.2.1]庚-7-基}乙氧基)-1h-吡唑-1-基]-12,12-二甲基-17-苯基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮(62.12mg,53%)。1h nmr(500mhz,dmso-d6)δ12.31(s,1h),8.22(d,j=2.7hz,1h),7.76(s,1h),7.67(d,j=8.3hz,1h),7.61(t,j=7.9hz,1h),7.52(d,j=7.5hz,2h),7.35(s,2h),7.26(d,j=7.5hz,1h),7.18(d,j=7.2hz,1h),6.93(d,j=8.3hz,1h),6.77(d,j=8.5hz,1h),6.10(d,j=2.7hz,1h),4.97(s,1h),4.22(t,j=6.6hz,2h),3.21(d,j=35.4hz,2h),2.34(s,1h),2.19(t,j=7.4hz,1h),1.96(s,1h),1.90(dd,j=12.0,5.8hz,1h),1.82(q,j=6.6hz,2h),1.72(s,1h),1.64(s,3h),1.55(s,4h),1.48(t,j=6.6hz,1h),1.15(s,1h),0.89-0.79(m,4h),0.65(dd,j=8.3,4.3hz,2h),0.51(dd,j=8.3,4.1hz,2h)。esi-ms m/z计算值693.30975,实验值694.2(m 1)
;保留时间:2.3分钟(lc方法g),esi-ms m/z计算值693.30975,实验值694.6(m 1)
;保留时间:1.75分钟(lc方法v,正交方法)。
[3062]
实施例125:4-[(14s)-12,12-二甲基-2,2,4-三氧代-8-(3-{2-[1-(三氟甲基)环丙基]乙氧基}-1h-吡唑-1-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-17-基]苯甲酸(非对映异构体1,化合物371)和4-[(14s)-12,12-二甲基-2,2,4-三氧代-8-(3-{2-[1-(三氟甲基)环丙基]乙氧基}-1h-吡唑-1-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-17-基]苯甲酸(非对映异构体2,化合物370)的制备
[3063][3064][3065]
步骤1:4-[1-(叔丁基亚磺酰基氨基)-3-[(3s)-5,5-二甲基-1-(2,2,2-三氟乙酰基)吡咯烷-3-基]丙基]苯甲酸甲酯
[3066]
[3067]
将4-碘苯甲酸甲酯(5.1g,19.073mmol)溶解于thf(75ml)中,并且在氮气下,将澄清溶液在干冰/丙酮浴(-23℃至-19℃)中冷却。然后在3分钟内经由注射器分批添加异丙基氯化镁(14.8ml,1.3m于thf中,19.240mmol)。将所得混合物在相同温度范围内搅拌100分钟。然后将其冷却至-30℃。在5分钟内缓慢添加n-[3-[(3s)-5,5-二甲基-1-(2,2,2-三氟乙酰基)吡咯烷-3-基]亚丙基]-2-甲基-丙烷-2-亚磺酰胺(2.37g,6.352mmol)于dcm(20ml)中的溶液。将混合物在30℃下进一步搅拌2小时。一次性添加饱和nh4cl水溶液(30ml),并使混合物在冷却浴外升温至室温。蒸发大部分挥发物,并且将残余物在etoac与水(各50ml)之间分配。分离各层,并将水层用etoac(20ml)萃取一次。合并的有机物经无水mgso4干燥,过滤并浓缩。通过硅胶色谱法,使用5%-100%etoac/己烷来纯化残余物,得到4-[1-(叔丁基亚磺酰基氨基)-3-[(3s)-5,5-二甲基-1-(2,2,2-三氟乙酰基)吡咯烷-3-基]丙基]苯甲酸甲酯(2.66g,81%)。esi-ms m/z计算值490.2113,实验值491.6(m 1)
;保留时间:3.32分钟(lc方法b)。
[3068]
步骤2:4-[1-氨基-3-[(3s)-5,5-二甲基-1-(2,2,2-三氟乙酰基)吡咯烷-3-基]丙基]苯甲酸甲酯
[3069][3070]
在室温下,将4-[1-(叔丁基亚磺酰基氨基)-3-[(3s)-5,5-二甲基-1-(2,2,2-三氟乙酰基)吡咯烷-3-基]丙基]苯甲酸甲酯(2.6g,5.035mmol)溶解于meoh(30ml)中。通过移液管添加hcl(12ml,4m,48.00mmol)于二噁烷中的溶液。将混合物在室温下搅拌1小时。将混合物真空浓缩以移除大多数挥发物。将残余物在dcm与饱和nahco3水溶液(各40ml)之间分配。分离各层,并将水层用dcm(15ml)萃取一次。合并的有机物经无水na2so4干燥,过滤并浓缩,得到4-[1-氨基-3-[(3s)-5,5-二甲基-1-(2,2,2-三氟乙酰基)吡咯烷-3-基]丙基]苯甲酸甲酯(1.9g,93%)。esi-ms m/z计算值386.1817,实验值387.5(m 1)
;保留时间:2.43分钟(lc方法b)。
[3071]
步骤3:4-[3-[(3s)-5,5-二甲基-1-(2,2,2-三氟乙酰基)吡咯烷-3-基]-1-[(6-氨磺酰基-2-吡啶基)氨基]丙基]苯甲酸甲酯
[3072]
[3073]
在室温下,将4-[1-氨基-3-[(3s)-5,5-二甲基-1-(2,2,2-三氟乙酰基)吡咯烷-3-基]丙基]苯甲酸甲酯(1.9g,4.671mmol)溶解于dmso(3ml)中。添加6-氟吡啶-2-磺酰胺(1.32g,7.493mmol),然后添加na2co3(1.5g,14.153mmol)。将混合物在110℃油浴中加热16小时。然后将其冷却至室温,用etoac(30ml)和水(30ml)稀释。将有机层进一步用水(20ml x 2)、盐水洗涤,经无水mgso4干燥,过滤并浓缩。通过硅胶色谱法,使用20%-80%etoac/己烷来纯化残余物,得到4-[3-[(3s)-5,5-二甲基-1-(2,2,2-三氟乙酰基)吡咯烷-3-基]-1-[(6-氨磺酰基-2-吡啶基)氨基]丙基]苯甲酸甲酯(1.067g,40%)。1h nmr(500mhz,dmso-d6)δ7.89(d,j=8.2hz,2h),7.59(d,j=8.3hz,3h),7.54-7.47(m,1h),7.05(s,2h),6.95(d,j=7.2hz,1h),6.62(d,j=8.4hz,1h),3.81(m,4h),3.19-3.04(m,1h),2.34-2.20(m,1h),2.00-1.66(m,3h),1.55-1.20(m,4h),1.43(s,3h),1.34-1.31(s,3h)。esi-ms m/z计算值542.1811,实验值543.4(m 1)
;保留时间:2.48分钟(lc方法h)。
[3074]
步骤4:4-[1-[[6-[[2-氯-6-[3-[2-[1-(三氟甲基)环丙基]乙氧基]吡唑-1-基]吡啶-3-羰基]氨磺酰基]-2-吡啶基]氨基]-3-[(3s)-5,5-二甲基-1-(2,2,2-三氟乙酰基)吡咯烷-3-基]丙基]苯甲酸甲酯
[3075][3076]
向2-氯-6-[3-[2-[1-(三氟甲基)环丙基]乙氧基]吡唑-1-基]吡啶-3-甲酸(232mg,0.6175mmol)于thf(1.6ml)中的溶液中添加cdi(125.1mg,0.771mmol)(从thf再结晶),并且将混合物在室温下搅拌1小时。然后添加4-[3-[(3s)-5,5-二甲基-1-(2,2,2-三氟乙酰基)吡咯烷-3-基]-1-[(6-氨磺酰基-2-吡啶基)氨基]丙基]苯甲酸甲酯(350.4mg,0.646mmol)于thf(580μl)中的溶液,随后添加dbu(295.2mg,1.939mmol),并且将所得混合物在室温下搅拌3小时。将反应物用水和etoac稀释,然后添加hcl水溶液(690.3μl,6m,4.142mmol)(诸如使水层的ph=1)。分离各层,并且将有机层用水(1x)和盐水(1x)洗涤,然后经无水硫酸钠干燥,并浓缩,得到白色泡沫,将所述白色泡沫在275g c
18
反相柱上,用50%-100%acn/水梯度洗脱进行纯化,得到呈白色固体状的4-[1-[[6-[[2-氯-6-[3-[2-[1-(三氟甲基)环丙基]乙氧基]吡唑-1-基]吡啶-3-羰基]氨磺酰基]-2-吡啶基]氨基]-3-[(3s)-5,5-二甲基-1-(2,2,2-三氟乙酰基)吡咯烷-3-基]丙基]苯甲酸甲酯(385.3mg,69%)。1h nmr(499mhz,dmso-d6)δ12.69(s,1h),8.38(d,j=2.9hz,1h),7.96(s,1h),7.81(d,j=8.1hz,2h),7.64(dd,j=8.3,1.7hz,1h),7.60(s,1h),7.52(d,j=8.2hz,2h),7.15(d,j=7.2hz,1h),6.74(s,1h),6.18(d,j=2.9hz,1h),4.99(s,1h),4.35(s,2h),3.78(s,3h),3.76(d,j=13.2hz,1h),3.08(d,j=11.7hz,1h),2.25-2.16(m,1h),2.09(t,j=7.1hz,2h),1.89(dd,j=11.5,6.3hz,1h),1.80-1.72(m,1h),1.51-1.43(m,1h),1.40(d,j=5.4hz,4h),1.29(d,j=1.9hz,3h),1.23(s,3h),0.96(d,j=2.5hz,2h),0.89(d,j=2.3hz,2h)。esi-ms m/z计算值899.2303,实验值900.1(m 1)
;保留时间:0.84分钟(lc方法d)。
u0-ax),和在15.0分钟内从1%-99%流动相b运行的双梯度(流动相a=h2o(5mm hcl),流动相b=乙腈,流速=50ml/min,进样体积=950μl,并且柱温=25℃)进行纯化,得到4-[(14s)-12,12-二甲基-2,2,4-三氧代-8-(3-{2-[1-(三氟甲基)环丙基]乙氧基}-1h-吡唑-1-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-17-基]苯甲酸(65mg,40%)。esi-ms m/z计算值753.2556,实验值754.1(m 1)
;保留时间:0.81分钟,呈白色固体状(lc方法d)。
[3083]
步骤7:4-[(14s)-12,12-二甲基-2,2,4-三氧代-8-(3-{2-[1-(三氟甲基)环丙基]乙氧基}-1h-吡唑-1-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-17-基]苯甲酸(非对映异构体1,化合物371)和4-[(14s)-12,12-二甲基-2,2,4-三氧代-8-(3-{2-[1-(三氟甲基)环丙基]乙氧基}-1h-吡唑-1-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-17-基]苯甲酸(非对映异构体2,化合物370)
[3084][3085]
通过sfc色谱法,使用chiralpak ig(250x21.2mm柱,5μm粒度),用40%meoh/60%co2流动相,以70ml/min历经11.0分钟(进样体积=500μl的32mg/ml于meoh中的溶液)对4-[(14s)-12,12-二甲基-2,2,4-三氧代-8-(3-{2-[1-(三氟甲基)环丙基]乙氧基}-1h-吡唑-1-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-17-基]苯甲酸(65mg,0.08623mmol)进行手性分离,得到两种非对映异构体:
[3086]
首先洗脱的非对映异构体1:4-[(14s)-12,12-二甲基-2,2,4-三氧代-8-(3-{2-[1-(三氟甲基)环丙基]乙氧基}-1h-吡唑-1-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-17-基]苯甲酸(28mg,86%)。1h nmr(500mhz,dmso-d6)δ8.23(d,j=2.7hz,1h),7.88(d,j=8.0hz,2h),7.84(d,j=8.1hz,1h),7.59(t,j=7.9hz,1h),7.55(d,j=8.1hz,2h),7.40(s,1h),7.08(d,j=7.2hz,1h),6.92(d,j=8.2hz,1h),6.78(d,j=8.7hz,1h),6.07(d,j=2.8hz,1h),5.33(d,j=11.2hz,1h),4.34(t,j=6.9hz,2h),3.43(s,1h),2.93(s,1h),2.29(s,1h),2.11(t,j=7.0hz,2h),1.98(s,1h),1.92-1.87(m,1h),1.82-1.71(m,2h),1.66(s,3h),1.61(t,j=
12.3hz,1h),1.56(s,3h),1.52(d,j=12.5hz,1h),0.98(d,j=5.1hz,2h),0.90(s,2h)。esi-ms m/z计算值753.2556,实验值754.6(m 1)
;保留时间:2.18分钟(lc方法q)。
[3087]
第二洗脱的非对映异构体2:4-[(14s)-12,12-二甲基-2,2,4-三氧代-8-(3-{2-[1-(三氟甲基)环丙基]乙氧基}-1h-吡唑-1-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-17-基]苯甲酸(18.8mg,55%)。1h nmr(500mhz,dmso-d6)δ8.22(d,j=2.8hz,1h),7.92(d,j=8.0hz,2h),7.69(d,j=8.1hz,1h),7.65(d,j=8.0hz,2h),7.57(t,j=7.9hz,1h),7.37(s,1h),7.20(d,j=7.2hz,1h),6.90(d,j=8.1hz,1h),6.73(d,j=8.5hz,1h),6.06(d,j=2.7hz,1h),4.99(s,1h),4.34(t,j=7.0hz,2h),3.38(s,2h),2.30(s,2h),2.11(q,j=6.9hz,2h),1.95(s,1h),1.90(dd,j=12.0,5.9hz,1h),1.74(s,1h),1.65(s,3h),1.59(d,j=11.6hz,1h),1.56(s,3h),1.22-1.13(m,1h),0.97(d,j=5.2hz,2h),0.89(d,j=9.2hz,2h)。esi-ms m/z计算值753.2556,实验值754.6(m 1)
;保留时间:2.19分钟(lc方法q)。
[3088]
实施例126:(14s)-12,12-二甲基-17-(嘧啶-5-基)-8-(3-{2-[1-(三氟甲基)环丙基]乙氧基}-1h-吡唑-1-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮(非对映异构体1,化合物375)和(14s)-12,12-二甲基-17-(嘧啶-5-基)-8-(3-{2-[1-(三氟甲基)环丙基]乙氧基}-1h-吡唑-1-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮(非对映异构体2,化合物374)的制备
[3089]
[3090][3091]
步骤1:n-[3-[(3s)-5,5-二甲基-1-(2,2,2-三氟乙酰基)吡咯烷-3-基]-1-嘧啶-5-基-丙基]-2-甲基-丙烷-2-亚磺酰胺
[3092][3093]
将5-溴嘧啶(3.2g,19.725mmol)溶解于thf(90ml)中。将混合物在乙醇液氮浴中冷却,直至浴温《-100℃,并将溶液搅拌10分钟。沿着反应烧瓶的内壁滴加n-buli(8ml,2.5m于己烷中,20.00mmol)。几分钟后停止搅拌。使混合物在冷浴中放置20分钟。然后在3分钟内沿着烧瓶的内壁添加含n-[3-[(3s)-5,5-二甲基-1-(2,2,2-三氟乙酰基)吡咯烷-3-基]亚丙基]-2-甲基-丙烷-2-亚磺酰胺(2.4g,6.4328mmol)的thf(10ml)。使混合物在同一浸浴中升温。当浴温达到约-85℃时,再次开始搅拌。在《-70℃下继续反应15分钟。一次性添加饱和nh4cl(20ml)。使混合物升温至室温并浓缩。将残余物在水与etoac(各30ml)之间分配。将水层用etoac萃取一次。合并并且浓缩的etoac混合物通过短硅胶柱,使用100%etoac作为洗脱液来纯化,得到n-[3-[(3s)-5,5-二甲基-1-(2,2,2-三氟乙酰基)吡咯烷-3-基]-1-嘧啶-5-基-丙基]-2-甲基-丙烷-2-亚磺酰胺(1g,34%)。esi-ms m/z计算值434.1963,实验值435.6(m 1)
;保留时间:2.61分钟(lc方法b)。
[3094]
步骤2:1-[(4s)-4-(3-氨基-3-嘧啶-5-基-丙基)-2,2-二甲基-吡咯烷-1-基]-2,2,2-三氟-乙酮
[3095][3096]
将n-[3-[(3s)-5,5-二甲基-1-(2,2,2-三氟乙酰基)吡咯烷-3-基]-1-嘧啶-5-基-丙基]-2-甲基-丙烷-2-亚磺酰胺(1.2g,2.62mmol)溶解于meoh(10ml)中。添加含hcl(4ml,4m,16.00mmol)溶液的二噁烷。将混合物在室温下搅拌1小时。对其进行浓缩,并且将残余物在dcm和nahco3水溶液(各20ml)之间分配。将水层用dcm萃取一次(f20ml)。将合并的dcm溶液用盐水洗涤,经无水na2so4干燥,过滤并浓缩,得到1-[(4s)-4-(3-氨基-3-嘧啶-5-基-丙基)-2,2-二甲基-吡咯烷-1-基]-2,2,2-三氟-乙酮(900mg,99%)。esi-ms m/z计算值330.1667,实验值331.4(m 1)
;保留时间:1.91分钟(lc方法b)。
[3097]
步骤3:6-[[3-[(3s)-5,5-二甲基-1-(2,2,2-三氟乙酰基)吡咯烷-3-基]-1-嘧啶-5-基-丙基]氨基]吡啶-2-磺酰胺
[3098][3099]
将1-[(4s)-4-(3-氨基-3-嘧啶-5-基-丙基)-2,2-二甲基-吡咯烷-1-基]-2,2,2-三氟-乙酮(900mg,2.59mmol)溶解于dmso(2ml)中。添加6-氟吡啶-2-磺酰胺(768mg,4.36mmol)和na2co3(868mg,8.19mmol)。在氮气球下,将混合物在110℃油浴中加热18小时。然后将其冷却至室温,并在etoac和水(各20ml)之间分配。将有机层用水(10ml x 2)、盐水洗涤,经无水na2so4干制,过滤并浓缩。通过硅胶色谱法,使用5%-80%etoac/己烷来纯化残余物,得到6-[[3-[(3s)-5,5-二甲基-1-(2,2,2-三氟乙酰基)吡咯烷-3-基]-1-嘧啶-5-基-丙基]氨基]吡啶-2-磺酰胺(0.504g,38%)。1h nmr(500mhz,dmso-d6)δ9.03(s,1h),8.89(s,2h),7.65(d,j=8.2hz,1h),7.54(dd,j=8.4,7.2hz,1h),7.11(s,2h),6.98(d,j=7.2hz,1h),6.66(d,j=8.4hz,1h),5.18-5.03(m,1h),3.87-3.76(m,1h),3.15(q,j=11.3hz,1h),2.34-2.21(m,1h),2.05-1.76(m,3h),1.59-1.48(m,1h),1.47-1.42(m,4h),1.34(s,3h),1.33-1.25(m,1h)。esi-ms m/z计算值486.1661,实验值487.3(m 1)
;保留时间:1.9分钟(lc方法h)。
[3100]
步骤4:2-氯-n-[[6-[[3-[(3s)-5,5-二甲基-1-(2,2,2-三氟乙酰基)吡咯烷-3-基]-1-嘧啶-5-基-丙基]氨基]-2-吡啶基]磺酰基]-6-[3-[2-[1-(三氟甲基)环丙基]乙氧基]吡唑-1-基]吡啶-3-甲酰胺
[3101][3102]
向2-氯-6-[3-[2-[1-(三氟甲基)环丙基]乙氧基]吡唑-1-基]吡啶-3-甲酸(447mg,1.19mmol)于thf(12.0ml)中的溶液中添加cdi(195mg,1.203mmol)(从thf再结晶),并且将混合物在室温下搅拌2小时,然后添加6-[[3-[(3s)-5,5-二甲基-1-(2,2,2-三氟乙酰基)吡咯烷-3-基]-1-嘧啶-5-基-丙基]氨基]吡啶-2-磺酰胺(350mg,0.72mmol),随后添加dbu(350μl,2.34mmol),并且将所得混合物在室温下搅拌3小时。将反应物用乙酸乙酯稀释,并用饱和碳酸氢钠水溶液洗涤,随后用盐水洗涤。将有机物分离,经硫酸钠干燥,蒸发并且通过硅胶色谱法(40克柱),使用100%己烷至100%乙酸乙酯的梯度,随后通过第二硅胶柱(40克柱),使用100%二氯甲烷至15%甲醇的梯度进行纯化,得到呈灰白色固体状的2-氯-n-[[6-[[3-[(3s)-5,5-二甲基-1-(2,2,2-三氟乙酰基)吡咯烷-3-基]-1-嘧啶-5-基-丙基]氨基]-2-吡啶基]磺酰基]-6-[3-[2-[1-(三氟甲基)环丙基]乙氧基]吡唑-1-基]吡啶-3-甲酰胺(568mg,94%)。esi-ms m/z计算值843.2153,实验值844.2(m 1)
;保留时间:2.07分钟(lc方法a)。
[3103]
步骤5:2-氯-n-[[6-[[3-[(3s)-5,5-二甲基吡咯烷-3-基]-1-嘧啶-5-基-丙基]氨基]-2-吡啶基]磺酰基]-6-[3-[2-[1-(三氟甲基)环丙基]乙氧基]吡唑-1-基]吡啶-3-甲酰胺
[3104][3105]
将2-氯-n-[[6-[[3-[(3s)-5,5-二甲基-1-(2,2,2-三氟乙酰基)吡咯烷-3-基]-1-嘧啶-5-基-丙基]氨基]-2-吡啶基]磺酰基]-6-[3-[2-[1-(三氟甲基)环丙基]乙氧基]吡唑-1-基]吡啶-3-甲酰胺(568mg,0.67mmol)和k2co3(950mg,6.87mmol)于甲醇(25ml)和水(10ml)中的混合物在室温下搅拌12小时。将混合物在70℃下加热2小时。添加另一份k2co3(950mg,6.87mmol),并将反应物在90℃下加热4小时。将混合物真空浓缩,并且将残余物在水与etoac之间分配。分离有机层,并用乙酸乙酯再萃取水层。将合并的有机层用盐水洗涤,分离并经硫酸钠干燥。将混合物蒸发,并且然后悬浮于乙醚(10ml)中,并添加hcl(175μl,4m于二噁烷中,0.70mmol)。将材料浓缩至干燥,得到灰白色固体2-氯-n-[[6-[[3-[(3s)-5,5-二甲基吡咯烷-3-基]-1-嘧啶-5-基-丙基]氨基]-2-吡啶基]磺酰基]-6-[3-[2-[1-(三氟甲基)环丙基]乙氧基]吡唑-1-基]吡啶-3-甲酰胺(二盐酸盐)(500mg,91%)。1h nmr(499mhz,dmso-d6)δ12.81(s,1h),9.12(s,1h),9.05(s,1h),9.01(d,j=0.8hz,1h),8.85(s,2h),
8.42(dd,j=2.8,1.7hz,1h),8.05(d,j=8.3hz,2h),7.71(dd,j=8.4,1.2hz,1h),7.66(ddd,j=8.1,7.0,0.9hz,1h),7.21(dd,j=7.1,1.9hz,1h),6.87(d,j=8.5hz,1h),6.20(d,j=2.8hz,1h),4.92(s,1h),4.36(t,j=7.1hz,2h),3.34(q,j=11.1,8.7hz,1h),2.84(ddt,j=27.3,8.7,5.0hz,1h),2.54(s,1h),2.45-2.31(m,1h),2.14-2.05(m,2h),1.94(dt,j=13.3,7.1hz,2h),1.81(ddd,j=10.8,8.2,5.4hz,1h),1.62-1.46(m,1h),1.43-1.37(m,1h),1.36(d,j=3.3hz,3h),1.35-1.28(m,1h),1.26(d,j=2.5hz,3h),0.99-0.93(m,2h),0.90(dt,j=5.0,1.7hz,2h)。esi-ms m/z计算值747.233,实验值748.2(m 1)
;保留时间:1.57分钟(lc方法a)。
[3106]
步骤6:(14s)-12,12-二甲基-17-(嘧啶-5-基)-8-(3-{2-[1-(三氟甲基)环丙基]乙氧基}-1h-吡唑-1-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮
[3107][3108]
将2-氯-n-[[6-[[3-[(3s)-5,5-二甲基吡咯烷-3-基]-1-嘧啶-5-基-丙基]氨基]-2-吡啶基]磺酰基]-6-[3-[2-[1-(三氟甲基)环丙基]乙氧基]吡唑-1-基]吡啶-3-甲酰胺(盐酸盐)(500mg,0.64mmol)、k2co3(650mg,4.70mmol)、分子筛和dmso(13ml)于20ml微波小瓶中的混合物用氮气吹扫,封盖,加热至155℃并搅拌18小时。将混合物冷却至室温,过滤,并且然后用饱和柠檬酸水溶液酸化。然后添加乙酸乙酯,并且萃取水层(3 x50ml)。将合并的有机萃取物用水(50ml)和饱和盐水溶液(50ml)洗涤,然后经硫酸钠干燥,过滤并真空蒸发。该粗产物通过硅胶色谱法,使用80g柱,用100%二氯甲烷至15%甲醇/二氯甲烷洗脱进行纯化,得到灰白色固体(14s)-12,12-二甲基-17-(嘧啶-5-基)-8-(3-{2-[1-(三氟甲基)环丙基]乙氧基}-1h-吡唑-1-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮(135mg,28%)。esi-ms m/z计算值711.2563,实验值712.2(m 1)
;保留时间:2.04分钟(lc方法a)。
[3109]
步骤7:(14s)-12,12-二甲基-17-(嘧啶-5-基)-8-(3-{2-[1-(三氟甲基)环丙基]乙氧基}-1h-吡唑-1-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮(非对映异构体1,化合物375)和(14s)-12,12-二甲基-17-(嘧啶-5-基)-8-(3-{2-[1-(三氟甲基)环丙基]乙氧基}-1h-吡唑-1-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮(非对映异构体2,化合物374)
[3110][3111]
使用以下方法对(14s)-12,12-二甲基-17-(嘧啶-5-基)-8-(3-{2-[1-(三氟甲基)环丙基]乙氧基}-1h-吡唑-1-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮(两种非对映异构体的混合物,130mg,0.1826mmol)进行sfc:chiralpak ic(250x21.2mm,5μm)柱,40℃,流动相41%meoh、59%co2,流速70ml/min,浓度32.5mg/ml于meoh中,进样体积500μl,压力166巴,波长278nm。分离出两种非对映异构体,并分离为灰白色固体:
[3112]
非对映异构体1:(14s)-12,12-二甲基-17-(嘧啶-5-基)-8-(3-{2-[1-(三氟甲基)环丙基]乙氧基}-1h-吡唑-1-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮(48.8mg,74%)。1h nmr(500mhz,dmso-d6)δ12.57(s,1h),9.06(s,1h),8.88(s,2h),8.23(d,j=2.7hz,1h),7.91(d,j=8.3hz,1h),7.79(d,j=8.7hz,1h),7.66(t,j=7.9hz,1h),7.13(d,j=7.2hz,1h),6.95(d,j=8.2hz,1h),6.80(d,j=8.5hz,1h),6.12(d,j=2.7hz,1h),5.23(t,j=11.1hz,1h),4.32(t,j=7.0hz,2h),2.79(t,j=10.4hz,1h),2.30(d,j=17.4hz,1h),2.14-2.02(m,3h),1.91-1.85(m,1h),1.78(t,j=13.4hz,2h),1.63(s,3h),1.60(d,j=12.4hz,1h),1.53(s,3h),1.51-1.45(m,1h),1.23(s,1h),0.99-0.92(m,2h),0.91-0.84(m,2h)。esi-ms m/z计算值711.2563,实验值712.2(m 1)
;保留时间:2.04分钟(lc方法a)。
[3113]
非对映异构体2:(14s)-12,12-二甲基-17-(嘧啶-5-基)-8-(3-{2-[1-(三氟甲基)环丙基]乙氧基}-1h-吡唑-1-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮(60.81mg,93%)。1h nmr(500mhz,dmso-d6)δ12.47(s,1h),9.07(s,1h),8.98(s,2h),8.21(d,j=2.7hz,1h),7.84(s,1h),7.73(s,1h),7.65(t,j=7.9hz,1h),7.25(d,j=7.3hz,1h),6.92(d,j=8.2hz,1h),6.78(d,j=8.5hz,1h),6.10(d,j=2.7hz,1h),4.84(s,1h),4.31(t,j=7.1hz,2h),2.99(s,1h),2.38-2.27(m,1h),2.08(t,j=7.1hz,2h),1.98(d,j=16.9hz,1h),1.89(dd,j=11.9,5.7hz,1h),1.80-1.70(m,1h),1.59(s,3h),1.56(s,1h),1.54(s,3h),1.24(d,j=4.8hz,2h),1.13(d,j=14.0hz,1h),0.97-0.91(m,2h),0.91-0.84(m,2h)。esi-ms m/z计算值711.2563,实验值712.2(m 1)
;保留时间:2.04分钟(lc方法a)。
[3114]
实施例127:12,12-二甲基-15-苯基-8-(3-{2-[1-(三氟甲基)环丙基]乙氧基}-1h-吡唑-1-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮,化合物394(对映异构体1)、化合物393(对映异构体2)、化合物386(对映异构体3)和化合物385(对映异构体4)的制备
[3115][3116][3117]
步骤1:n-(3-氧代-3-苯基-丙基)氨基甲酸叔丁酯
[3118]
[3119]
将乙酸钯(1.1213g,4.99mmol)和三苯基膦(2.620g,9.99mmol)溶解于thf(500ml)中。向所得溶液中添加3-(叔丁氧基羰基氨基)丙酸(18.9g,99.89mmol)、苯基硼酸(24.359g,199.78mmol)、水(5ml)和三乙酸酐(27.906g,149.83mmol),并且将混合物在60℃下搅拌24小时。将混合物过滤,添加饱和碳酸氢钠(500ml),并用乙酸乙酯(3x300ml)萃取混合物。将有机级分合并,经硫酸钠干燥并蒸发,残余物通过硅胶柱色谱法,使用0-10%乙酸乙酯/己烷来纯化,得到呈浅黄色固体状的n-(3-氧代-3-苯基-丙基)氨基甲酸叔丁酯(18.42g,72%)。esi-ms m/z计算值249.1365,实验值250.2(m 1)
;保留时间:2.8分钟(lc方法b)。
[3120]
步骤2:n-[(3z)-3-[1-[(4-甲氧基苯基)甲基]-5,5-二甲基-2-氧代-吡咯烷-3-亚基]-3-苯基-丙基]氨基甲酸叔丁酯,异构体a,和n-[(3e)-3-[1-[(4-甲氧基苯基)甲基]-5,5-二甲基-2-氧代-吡咯烷-3-亚基]-3-苯基-丙基]氨基甲酸叔丁酯,异构体b
[3121][3122]
将3-二乙氧基磷酰基-1-[(4-甲氧基苯基)甲基]-5,5-二甲基-吡咯烷-2-酮(5g,13.54mmol)溶解于四氢呋喃(40ml)中,并在冰水浴中冷却。添加nah(60%,730.89mg,18.274mmol)并将所得混合物搅拌30分钟。将n-(3-氧代-3-苯基-丙基)氨基甲酸叔丁酯(4.2183g,16.92mmol)溶解于四氢呋喃(10ml)中,并将所得溶液逐滴添加到冷却的膦酸酯溶液中。移除冰水浴,并将所得混合物在室温下搅拌16小时,然后用水(50ml)稀释,并用乙酸乙酯(3x30ml)萃取。将有机级分合并,经硫酸钠干燥并蒸发;残余物通过硅胶柱色谱法使用0-20%乙酸乙酯/己烷来纯化。分离具有未知z或e构型的两种异构体。构型任意地归于每种异构体的结构。
[3123]
异构体a(极性较小):n-[(3z)-3-[1-[(4-甲氧基苯基)甲基]-5,5-二甲基-2-氧代-吡咯烷-3-亚基]-3-苯基-丙基]氨基甲酸叔丁酯(1.725g,26%)。1h nmr(250mhz,cdcl3)δ7.51-7.02(m,8h),6.96-6.60(m,2h),4.44(s,2h),3.79(s,3h),3.39-2.97(m,4h),2.41(s,2h),1.42(s,9h),1.08(s,6h)。esi-ms m/z计算值464.2675,实验值465.1(m 1)
;保留时间:3.64分钟(lc方法b)。
[3124]
异构体b(极性较大):n-[(3e)-3-[1-[(4-甲氧基苯基)甲基]-5,5-二甲基-2-氧代-吡咯烷-3-亚基]-3-苯基-丙基]氨基甲酸叔丁酯(3.981g,62%)。1h nmr(250mhz,cdcl3)δ7.60-6.95(m,7h),6.95-6.54(m,2h),4.54(s,1h),4.36(s,2h),3.76(s,3h),3.23-2.92(m,2h),2.76-2.46(m,4h),1.42(s,9h),1.18(s,6h)。esi-ms m/z计算值464.2675,实验值465.2(m 1)
;保留时间:3.34分钟(lc方法b)。
[3125]
步骤3:n-[3-[1-[(4-甲氧基苯基)甲基]-5,5-二甲基-2-氧代-吡咯烷-3-基]-3-苯基-丙基]氨基甲酸叔丁酯
[3-(二苄基氨基)-1-苯基-丙基]-5,5-二甲基-吡咯烷-2-酮(3.8957g,93%)。esi-ms m/z计算值426.26712,实验值427.1(m 1)
;保留时间:2.52分钟(lc方法b)。
[3134]
步骤6:4-[3-(二苄基氨基)-1-苯基-丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯
[3135][3136]
在氩气下,向3-[3-(二苄基氨基)-1-苯基-丙基]-5,5-二甲基-吡咯烷-2-酮(3.8957g,9.1321mmol)中添加硼烷二甲硫醚复合物(50ml,2m于thf中,100.00mmol),并将混合物在70℃下搅拌16小时。将混合物冷却至室温,并且缓慢添加甲醇(100ml),随后添加6m hcl(50ml)。将混合物在70℃下搅拌1小时并蒸发。向残余物中添加氯仿(100ml),随后添加naoh水溶液(100ml,15%w/w)和boc酸酐(2.1923g,10.045mmol)。将混合物在室温下搅拌1小时,然后分离有机相,并用氯仿(2x50ml)萃取水相。将有机级分合并,经硫酸钠干燥并蒸发,然后通过硅胶柱色谱法使用0-10%乙酸乙酯/己烷纯化残余物,得到呈无色油状物的4-[3-(二苄基氨基)-1-苯基-丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(3.91g,79%)。esi-ms m/z计算值512.3403,实验值513.4(m 1)
;保留时间:3.19分钟(lc方法b)。
[3137]
步骤7:4-(3-氨基-1-苯基-丙基)-2,2-二甲基-吡咯烷-1-甲酸叔丁酯
[3138][3139]
将4-[3-(二苄基氨基)-1-苯基-丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(3.91g,7.6259mmol)溶解于dmso(100ml)中。添加甲酸铵(1.9235g,30.504mmol),随后添加钯/碳(0.4g,10%w/w,0.3759mmol)。将混合物在氩气下在65℃下搅拌3小时。在冷却后,将其通过硅藻土过滤并浓缩,然后通过硅胶柱色谱法使用0-5%甲醇/二氯甲烷纯化残余物,得到4-(3-氨基-1-苯基-丙基)-2,2-二甲基吡咯烷-1-甲酸叔丁酯(2.446g,86%)。esi-ms m/z计算值332.24637,实验值333.0(m 1)
;保留时间:2.57分钟(lc方法b)。
[3140]
步骤8:2,2-二甲基-4-[1-苯基-3-[(6-氨磺酰基-2-吡啶基)氨基]丙基]吡咯烷-1-甲酸叔丁酯
[3141][3142]
将4-(3-氨基-1-苯基-丙基)-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(2.38g,7.16mmol)和6-氟吡啶-2-磺酰胺(1.8915g,10.74mmol)溶解于dmso(71.4ml)中,然后添加碳酸钠(2.2761g,21.475mmol),并将混合物在100℃下搅拌7小时。将混合物用水(350ml)淬灭,并用etoac(3x100ml)萃取。将有机级分合并,经硫酸钠干燥并蒸发,然后通过硅胶柱色谱法使用0-50%乙酸乙酯/己烷纯化残余物,得到2,2-二甲基-4-[1-苯基-3-[(6-氨磺酰基-2-吡啶基)氨基]丙基]吡咯烷-1-甲酸叔丁酯(3.1304g,84%)。1h nmr(250mhz,dmso-d6)δ7.51(t,j=7.8hz,1h),7.44
–
7.14(m,5h),7.03(s,2h),6.96(d,j=7.2hz,1h),6.93
–
6.84(m,1h),6.54(d,j=8.5hz,1h),3.83
–
3.57(m,1h),3.14
–
2.84(m,3h),2.48
–
2.28(m,2h),1.95
–
1.77(m,2h),1.39(s,9h),1.32
–
1.21(m,5h),1.16(s,3h)。esi-ms m/z计算值488.24573,实验值489.4(m 1)
;保留时间:2.77分钟(lc方法c)。
[3143]
步骤9:4-[3-[[6-[[2-氯-6-[3-[2-[1-(三氟甲基)环丙基]乙氧基]吡唑-1-基]吡啶-3-羰基]氨磺酰基]-2-吡啶基]氨基]-1-苯基-丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯
[3144][3145]
向2-氯-6-[3-[2-[1-(三氟甲基)环丙基]乙氧基]吡唑-1-基]吡啶-3-甲酸(592mg,1.576mmol)于thf(17ml)中的溶液中添加cdi(255mg,1.573mmol)(从thf再结晶),并且将混合物在室温下搅拌1.5小时。然后添加2,2-二甲基-4-[1-苯基-3-[(6-氨磺酰基-2-吡啶基)氨基]丙基]吡咯烷-1-甲酸叔丁酯(512mg,1.048mmol)于thf(9ml)中的溶液,随后添加dbu(515mg,3.383mmol),并将所得混合物在室温下搅拌3小时。将反应物用乙酸乙酯稀释,并用饱和碳酸氢钠水溶液洗涤,随后用盐水洗涤。将有机物分离,经硫酸钠干燥,蒸发并且然后通过硅胶色谱法(40克柱),使用100%二氯甲烷至15%甲醇/二氯甲烷梯度,随后通过第二硅胶柱(40克柱),使用100%己烷至80%乙酸乙酯/己烷梯度进行纯化,得到呈白色固体状的4-[3-[[6-[[2-氯-6-[3-[2-[1-(三氟甲基)环丙基]乙氧基]吡唑-1-基]吡啶-3-羰基]氨磺酰基]-2-吡啶基]氨基]-1-苯基-丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(650mg,73%)。1h nmr(400mhz,dmso-d6)δ12.71(s,1h),8.42(t,j=2.9hz,1h),8.01(dd,j=8.3,2.9hz,1h),7.69(d,j=8.3hz,1h),7.61(dd,j=8.5,7.2hz,1h),7.32-7.24(m,2h),7.24-7.15(m,4h),7.12(t,j=5.0hz,1h),6.70(d,j=8.5hz,1h),6.20(t,j=2.5hz,1h),4.37(t,j=7.1hz,2h),3.68(ddd,j=22.3,10.7,7.3hz,1h),2.95(qd,j=15.5,12.9,
4.8hz,3h),2.47(d,j=7.9hz,1h),2.44-2.30(m,1h),2.10(t,j=7.1hz,2h),1.88(dd,j=12.7,5.9hz,2h),1.37(d,j=3.6hz,9h),1.35-1.29(m,1h),1.25(d,j=14.4hz,4h),1.13(s,3h),0.99-0.92(m,2h),0.90(d,j=9.5hz,2h)。esi-ms m/z计算值845.2949,实验值846.2(m 1)
;保留时间:2.12分钟(lc方法a)。
[3146]
步骤10:12,12-二甲基-15-苯基-8-(3-{2-[1-(三氟甲基)环丙基]乙氧基}-1h-吡唑-1-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮
[3147][3148]
阶段1:将4-[3-[[6-[[2-氯-6-[3-[2-[1-(三氟甲基)环丙基]乙氧基]吡唑-1-基]吡啶-3-羰基]氨磺酰基]-2-吡啶基]氨基]-1-苯基-丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(650mg,0.7680mmol)溶解于dcm(20ml)中,并且向混合物中添加hcl(4m于二噁烷中)(5.0ml,4m,20.00mmol)并在室温下搅拌。在16小时后,将混合物蒸发至干燥,然后用乙醚(5ml x2)稀释,并浓缩。将该材料通过硅胶色谱法(40克柱)使用100%二氯甲烷至25%甲醇的梯度纯化,浓缩并且然后置于高真空泵上2小时,得到呈灰白色固体状的中间体2-氯-n-[[6-[[3-(5,5-二甲基吡咯烷-3-基)-3-苯基-丙基]氨基]-2-吡啶基]磺酰基]-6-[3-[2-[1-(三氟甲基)环丙基]乙氧基]吡唑-1-基]吡啶-3-甲酰胺(盐酸盐)(329mg,55%)。esi-ms m/z计算值745.2425,实验值746.2(m 1)
;保留时间:1.67分钟(lc方法g)。
[3149]
阶段2:来自阶段1的材料与k2co3(770mg,5.571mmol)、分子筛和dmso(20ml)合并于小瓶中,用氮气吹扫,封盖,加热至155℃并搅拌16小时。将混合物过滤并在氮气流下浓缩,得到残余物,将所述残余物通过反相制备型色谱法,利用c
18
柱和在15分钟内30%-99%乙腈/水( 5mm hcl)的梯度进行纯化,得到呈灰白色固体状的12,12-二甲基-15-苯基-8-(3-{2-[1-(三氟甲基)环丙基]乙氧基}-1h-吡唑-1-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮(270mg,50%)。esi-ms m/z计算值709.2658,实验值710.2(m 1)
;保留时间:1.84分钟(lc方法g)。
[3150]
步骤11:12,12-二甲基-15-苯基-8-(3-{2-[1-(三氟甲基)环丙基]乙氧基}-1h-吡唑-1-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮,化合物394(对映异构体1),和12,12-二甲基-15-苯基-8-(3-{2-[1-(三氟甲基)环丙基]乙氧基}-1h-吡唑-1-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮,化合物393(对映异构体2)
[3151][3152]
使用以下方法对12,12-二甲基-15-苯基-8-(3-{2-[1-(三氟甲基)环丙基]乙氧基}-1h-吡唑-1-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮(源自步骤2中的异构体b的两种对映异构体的混合物,270mg,0.3804mmol)进行sfc:正相sfc-ms方法,使用由chiral technologies(pn:20945)销售的as-h柱(250
×
21.2mm,5μm粒度)和在14.5分钟内从15%-45%流动相b运行的双梯度(包括45%-80%流动相冲洗液)。流动相a=co2。流动相b=meoh(20mm nh3)。流速=15%-45%meoh[20mm nh3]60ml/min,45%-80%meoh[20mm nh3]40ml/min,进样体积=变量,柱温=40℃。分离出两种对映异构体1和2:
[3153]
对映异构体1通过硅胶色谱法,使用12g柱,用100%二氯甲烷至10%甲醇/二氯甲烷洗脱进行进一步纯化,得到白色固体12,12-二甲基-15-苯基-8-(3-{2-[1-(三氟甲基)环丙基]乙氧基}-1h-吡唑-1-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮,对映异构体1(98.2mg,73%)。1h nmr(400mhz,dmso-d6)δ12.63(s,1h),8.18(d,j=2.8hz,1h),7.77(d,j=8.2hz,1h),7.62(t,j=7.9hz,1h),7.36-7.20(m,6h),7.17(d,j=7.2hz,1h),6.92(d,j=8.2hz,1h),6.79(d,j=8.6hz,1h),6.08(d,j=2.8hz,1h),4.31(t,j=7.1hz,2h),3.71(d,j=11.5hz,1h),3.40(s,1h),2.94(s,1h),2.83(s,1h),2.58(s,2h),2.52(s,1h),2.11-2.04(m,2h),1.67(s,1h),1.49(s,3h),1.43(s,3h),1.38(t,j=11.9hz,1h),1.22(d,j=12.6hz,1h),0.95(d,j=4.6hz,2h),0.90(d,j=11.0hz,2h)。esi-ms m/z计算值709.2658,实验值710.2(m 1)
;保留时间:1.84分钟(lc方法a)。
[3154]
对映异构体2通过硅胶色谱法,使用12g柱,用100%二氯甲烷至10%甲醇/二氯甲烷洗脱进行进一步纯化,得到白色固体:12,12-二甲基-15-苯基-8-(3-{2-[1-(三氟甲基)环丙基]乙氧基}-1h-吡唑-1-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮,对映异构体2(91.3mg,68%)。1hnmr(400mhz,dmso-d6)δ12.63(s,1h),8.18(d,j=2.8hz,1h),7.77(d,j=8.2hz,1h),7.62(t,j=7.8hz,1h),7.36-7.20(m,6h),7.17(d,j=7.2hz,1h),6.93(d,j=8.2hz,1h),6.79(d,j=8.5hz,1h),6.08(d,j=2.7hz,1h),4.31(t,j=7.0hz,2h),3.70(s,1h),
3.40(s,1h),2.95(s,1h),2.83(s,1h),2.58(s,2h),2.52(d,j=1.6hz,1h),2.07(d,j=1.5hz,2h),1.68(s,1h),1.49(s,3h),1.43(s,3h),1.37(d,j=12.2hz,1h),1.23(s,1h),0.98-0.92(m,2h),0.88(td,j=5.9,5.3,3.5hz,2h)。esi-ms m/z计算值709.2658,实验值710.2(m 1)
;保留时间:1.84分钟(lc方法a)。
[3155]
使用步骤2的异构体a,即来自步骤2的n-[(3z)-3-[1-[(4-甲氧基苯基)甲基]-5,5-二甲基-2-氧代-吡咯烷-3-亚基]-3-苯基-丙基]氨基甲酸叔丁酯作为起始物质,以与上文所述类似的方式制备以下化合物。
[3156]
步骤12:12,12-二甲基-15-苯基-8-(3-{2-[1-(三氟甲基)环丙基]乙氧基}-1h-吡唑-1-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮,化合物386(对映异构体3),和12,12-二甲基-15-苯基-8-(3-{2-[1-(三氟甲基)环丙基]乙氧基}-1h-吡唑-1-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮,化合物385(对映异构体4)
[3157][3158]
使用以下方法对12,12-二甲基-15-苯基-8-(3-{2-[1-(三氟甲基)环丙基]乙氧基}-1h-吡唑-1-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮(源自于步骤2的异构体a的两种对映异构体的混合物,235mg,0.3311mmol)进行sfc:正相sfc-ms方法,使用由phenomenex销售的lux-4柱(250
×
21.2mm,5μm粒度)(pn:00g-4491-p0-ax)和在14.5分钟内从50%-80%流动相b运行的双梯度。流动相a=co2。流动相b=meoh(20mm nh3)。流速=50-80%meoh[20mm nh3]40ml/min。进样体积=变量,柱温=40℃。分离出两种对映异构体3和4:
[3159]
sfc峰1(对映异构体3)通过反相制备型色谱法,利用c
18
柱和在15分钟内30%-99%乙腈/水( 5mm hcl)的梯度进行进一步纯化,得到白色固体:12,12-二甲基-15-苯基-8-(3-{2-[1-(三氟甲基)环丙基]乙氧基}-1h-吡唑-1-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮,对映异构体3(63.79mg,54%)。1h nmr(400mhz,dmso-d6)δ12.37(s,1h),8.19(d,j=2.8hz,1h),7.62(t,j=7.8hz,2h),7.42-7.17(m,7h),6.90(d,j=8.2hz,1h),6.78(d,j=8.5hz,1h),6.09
(d,j=2.8hz,1h),4.30(t,j=7.1hz,2h),3.75(s,1h),3.44(s,1h),3.12(d,j=42.0hz,1h),2.89(d,j=47.8hz,3h),2.54(d,j=12.3hz,1h),2.09-2.04(m,2h),1.81(s,2h),1.66(s,3h),1.57(s,1h),1.38(s,3h),1.00-0.92(m,2h),0.91-0.84(m,2h)。esi-ms m/z计算值709.2658,实验值710.2(m 1)
;保留时间:1.87分钟(lc方法a)。
[3160]
sfc峰2(对映异构体4)通过反相制备型色谱法,利用c
18
柱和在15分钟内130%-99%乙腈/水( 5毫摩尔hcl)的梯度进行进一步纯化,得到呈白色固体状的12,12-二甲基-15-苯基-8-(3-{2-[1-(三氟甲基)环丙基]乙氧基}-1h-吡唑-1-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮,对映异构体4(50.21mg,43%)。1h nmr(400mhz,dmso-d6)δ12.37(s,1h),8.19(d,j=2.7hz,1h),7.62(t,j=8.0hz,2h),7.43-7.17(m,7h),6.90(d,j=8.2hz,1h),6.78(d,j=8.5hz,1h),6.09(d,j=2.8hz,1h),4.30(t,j=7.1hz,2h),3.75(s,1h),3.41(d,j=20.2hz,1h),3.10(s,1h),2.89(d,j=45.7hz,3h),2.56-2.52(m,1h),2.10-2.04(m,2h),1.81(s,2h),1.66(s,3h),1.58(s,1h),1.38(s,3h),0.99-0.92(m,2h),0.91-0.83(m,2h)。esi-ms m/z计算值709.2658,实验值710.2(m 1)
;保留时间:1.87分钟(lc方法a)。
[3161]
实施例128:12,12-二甲基-16-苯基-8-(3-{2-[1-(三氟甲基)环丙基]乙氧基}-1h-吡唑-1-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮,化合物392(对映异构体1)、化合物391(对映异构体2)、化合物390(对映异构体3)和化合物389(对映异构体4)的制备
[3162][3163]
步骤1:3-(苄氧基羰基氨基)-2-苯基-丙酸
[3164][3165]
在0℃下,向3-氨基-2-苯基-丙酸(盐酸盐)(16.4g,81.33mmol)于nahco3饱和溶液(420ml)和1,4-二噁烷(420ml)的混合物中的溶液中逐滴添加cbzcl(14ml,93.53mmol),然后将反应溶液搅拌19小时,同时使反应物升温至室温。将反应溶液用hcl水溶液(6m)酸化,直至ph达到2。在减压下移除大部分1,4-二噁烷。将溶液用乙酸乙酯(3x400ml)萃取。合并的有机层经硫酸钠干燥,过滤并减压浓缩,得到浅黄色液体3-(苄氧基羰基氨基)-2-苯基-丙酸(27.83g,95%)。esi-ms m/z计算值299.1158,实验值300.2(m 1)
;保留时间:4.31分钟(lc方法c)。
[3166]
步骤2:n-[3-[甲氧基(甲基)氨基]-3-氧代-2-苯基-丙基]氨基甲酸苄酯
[3167][3168]
在0℃下,向3-(苄氧羰基氨基)-2-苯基-丙酸(27.83g,77.17mmol)和n,o-二甲基羟胺(盐酸盐)(9.033g,92.61mmol)于无水ch2cl2(300ml)中的溶液中添加et3n(12.9ml,92.605mmol),随后添加edci(17.752g,92.605mmol)。将所得溶液搅拌2天,同时使反应物升温至环境温度。向反应溶液中添加二氯甲烷(500ml)和盐水(80ml)。将有机层分离,用hcl水溶液(80ml,1m)、饱和碳酸氢钠水溶液(80ml)和盐水(80ml)洗涤。然后将有机层经无水硫酸钠干燥,过滤并减压浓缩。粗产物通过快速色谱法(以ch2cl2装载)(330g sio2,用0至100%乙醚/己烷洗脱)纯化,将产物级分合并并浓缩,得到呈无色油状物的n-[3-[甲氧基(甲基)氨基]-3-氧代-2-苯基-丙基]氨基甲酸苄酯(23.7g,90%)。11hnmr(250mhz,cdcl3)δ7.52-7.05(m,10h),5.39-5.20(m,1h),5.09(s,2h),4.41-4.13(m,1h),3.60(t,j=6.9hz,2h),3.28(s,3h),3.15(s,3h)。esi-ms m/z计算值342.158,实验值343.3(m 1)
;保留时间:4.76分钟(lc方法c)。
[3169]
步骤3:n-(3-氧代-2-苯基-丙基)氨基甲酸苄酯
[3170][3171]
在-78℃下,向n-[3-[甲氧基(甲基)氨基]-3-氧代-2-苯基-丙基]氨基甲酸苄酯(23.7g,69.22mmol)于无水thf(350ml)中的溶液中添加lah(3.34g,88.00mmol)。将反应溶液搅拌2小时,同时将反应溶液升温至0℃,然后将反应物再冷却至-78℃。非常缓慢地添加饱和罗谢尔盐(rochelle salt)水溶液(200ml)。使反应溶液升温至环境温度并进一步搅拌1小时,直到反应溶液变为两个透明层。分离有机层,并用乙醚(2 x250ml)萃取水层。将合并的有机层用盐水(2x200ml)洗涤,经无水硫酸钠干燥,过滤并减压浓缩。粗产物通过快速色谱法(以ch2cl2装载)(330g sio2,用0至70%乙醚/己烷洗脱)纯化,浓缩得到呈无色油状物的n-(3-氧代-2-苯基-丙基)氨基甲酸苄酯(16.01g,82%)。11hnmr(250mhz,cdcl3)δ9.72(s,1h),7.67-7.01(m,10h),5.33-4.88(m,3h),3.92(dd,j=8.2,5.8hz,1h),3.73(ddd,j=13.9,8.1,5.8hz,1h),3.58(dt,j=13.7,6.3hz,1h)。esi-ms m/z计算值283.1208,实验值284.3(m 1)
;保留时间:4.58分钟(lc方法c)。
[3172]
步骤4:n-[(3e)-3-[1-[(4-甲氧基苯基)甲基]-5,5-二甲基-2-氧代-吡咯烷-3-亚基]-2-苯基-丙基]氨基甲酸苄酯和n-[(3z)-3-[1-[(4-甲氧基苯基)甲基]-5,5-二甲基-2-氧代-吡咯烷-3-亚基]-2-苯基-丙基]氨基甲酸苄酯
[3173][3174]
在氩气下,在0℃下向3-二乙氧基磷酰基-1-[(4-甲氧基苯基)甲基]-5,5-二甲基-吡咯烷-2-酮(18.09g,48.97mmol)于无水thf(300ml)中的溶液中添加nah(2.364g,59.11mmol)。将所得溶液在此温度下搅拌30分钟,然后缓慢添加含n-(3-氧代-2-苯基-丙基)氨基甲酸苄酯(16g,53.65mmol)的无水thf(150ml)。将所得溶液在环境温度下搅拌2天。向反应溶液中添加水(300ml),并用乙酸乙酯(3x300ml)萃取水相。将合并的有机层用盐水(200ml)洗涤,经硫酸钠干燥,过滤并减压浓缩。粗产物通过快速色谱法(以ch2cl2装载)(330g sio2,用0至80%乙醚/己烷洗脱)纯化,得到来自异构体(任意地指定z/e立体化学):
[3175]
呈白色泡沫固体状的n-[(3e)-3-[1-[(4-甲氧基苯基)甲基]-5,5-二甲基-2-氧代-吡咯烷-3-亚基]-2-苯基-丙基]氨基甲酸苄酯(10.73g,44%)。11hnmr(250mhz,cdcl3)δ7.49-7.27(m,8h),7.26-7.17(m,4h),6.81(dd,j=9.1,2.5hz,2h),6.76-6.63(m,1h),5.09(s,2h),4.84(s,1h),4.57-4.31(m,2h),3.84-3.78(m,1h),3.77(s,3h),3.60-3.37(m,2h),2.49(q,j=16.7hz,2h),1.12(s,3h),1.08(s,3h)。esi-ms m/z计算值498.2519,实验值499.4(m 1)
;保留时间:5.84分钟(lc方法c)。
[3176]
呈浅黄色粘性油状物的n-[(3z)-3-[1-[(4-甲氧基苯基)甲基]-5,5-二甲基-2-氧代-吡咯烷-3-亚基]-2-苯基-丙基]氨基甲酸苄酯(9.95g,40%)。11hnmr(250mhz,cdcl3)δ7.34(h,j=2.9hz,10h),7.26-7.18(m,2h),6.77(d,j=8.6hz,2h),5.98(d,j=10.2hz,1h),5.72(d,j=7.3hz,1h),5.23(td,j=10.3,5.6hz,1h),5.16-4.96(m,2h),4.51(d,j=15.3hz,1h),4.32(d,j=15.2hz,1h),3.75(s,3h),3.72-3.55(m,1h),3.52-3.30(m,1h),2.48(s,2h),1.10(s,6h)。esi-ms m/z计算值498.2519,实验值499.5(m 1)
;保留时间:6.2分钟(lc方法c)。
[3177]
步骤5:3-(3-氨基-2-苯基-丙基)-1-[(4-甲氧基苯基)甲基]-5,5-二甲基-吡咯烷-2-酮,非对映异构体1,和3-(3-氨基-2-苯基-丙基)-1-[(4-甲氧基苯基)甲基]-5,5-二甲基-吡咯烷-2-酮,非对映异构体2
[3178][3179]
向n-[3-[1-[(4-甲氧基苯基)甲基]-5,5-二甲基-2-氧代-吡咯烷-3-亚基]-2-苯基-丙基]氨基甲酸苄酯(20.97g,42.06mmol)(z和e异构体的重组混合物)于无水etoh(500ml)中的溶液中添加10%pd/c(2g,18.79mmol)。将所得溶液在parr振荡器中在60psi下
氢化44小时。将反应溶液通过硅藻土过滤并用乙醇洗涤。将滤液减压浓缩,得到粗产物(15.5g粘性油状物),其中两种立体异构体的比率为1:1.4。粗产物通过反相hplc(2.5g/运行,总共6次运行)使用历经60分钟20%至55%流动相b的梯度(流动相a:含0.1%tfa的水;流动相b:含0.1%tfa的乙腈)纯化。将每种异构体的纯级分合并,并减压浓缩以移除乙腈。然后将水层用固体碳酸钠小心地碱化(以达到ph=9至10),并用乙酸乙酯萃取。将合并的乙酸乙酯层经无水硫酸钠干燥,过滤并减压浓缩,得到两种纯异构体。
[3180]
非对映异构体1(粘性浅黄色油状物,极性较大):3-(3-氨基-2-苯基-丙基)-1-[(4-甲氧基苯基)甲基]-5,5-二甲基-吡咯烷-2-酮(4.636g,30%)。11hnmr(250mhz,cdcl3)δ7.48-7.07(m,7h),6.79(d,j=8.7hz,2h),4.51-4.15(m,2h),3.77(s,3h),2.92(d,j=6.8hz,2h),2.76-2.53(m,1h),2.39(td,j=12.7,12.0,3.6hz,1h),2.31-2.09(m,1h),2.09-1.91(m,1h),1.69-1.58(m,1h),1.48(s,2h),1.27(d,j=2.8hz,1h),1.16(s,3h),0.91(s,3h)。esi-ms m/z计算值366.2307,实验值367.2(m 1)
;保留时间:3.38分钟(lc方法c)。
[3181]
非对映异构体2(粘性浅黄色油状物,极性较小):3-(3-氨基-2-苯基-丙基)-1-[(4-甲氧基苯基)甲基]-5,5-二甲基-吡咯烷-2-酮(7.3g,47%)。11hnmr(250mhz,cdcl3)δ7.49-7.04(m,7h),6.91-6.66(m,2h),4.42(d,j=15.2hz,1h),4.21(d,j=15.2hz,1h),3.77(s,3h),2.94(td,j=16.0,14.2,10.5hz,3h),2.58-2.24(m,2h),1.76(dd,j=12.4,8.1hz,1h),1.62(s,2h),1.37-1.17(m,2h),1.07(s,3h),0.96(s,3h)。esi-ms m/z计算值366.2307,实验值367.2(m 1)
;保留时间:3.67分钟(lc方法c)。
[3182]
步骤6:3-(3-氨基-2-苯基-丙基)-5,5-二甲基-吡咯烷-2-酮
[3183][3184]
将3-(3-氨基-2-苯基-丙基)-1-[(4-甲氧基苯基)甲基]-5,5-二甲基-吡咯烷-2-酮,极性较小的非对映异构体2(7.29g,19.69mmol)溶解于tfa(110ml,1.43mol)中,并且在密封管中于100℃下加热69小时。添加1,2-二氯甲烷(50ml),并且在减压下移除所有溶剂。粗产物通过反相hplc(1.5g/运行,总共2次运行)使用在40分钟内5%至45%流动相b的梯度(流动相a:含0.1%tfa的水;流动相b:含0.1%tfa的乙腈)纯化。将纯级分合并,并减压浓缩以移除大多数溶剂。然后将水层用固体碳酸钠小心地碱化(ph=9至10),并用2-甲基四氢呋喃萃取。将有机层经无水硫酸钠干燥,过滤并减压浓缩,得到呈白色泡沫状的3-(3-氨基-2-苯基-丙基)-5,5-二甲基-吡咯烷-2-酮(5.10g,100%)。1h nmr(250mhz,cdcl3)δ7.45-7.11(m,5h),6.14(s,1h),3.35-3.08(m,3h),3.08-2.85(m,3h),2.61-2.12(m,2h),1.76(dd,j=12.6,8.4hz,1h),1.53(dd,j=14.4,7.5hz,1h),1.19(s,3h),1.12(s,3h)。esi-ms m/z计算值246.1732,实验值247.1(m 1)
;保留时间:2.27分钟(lc方法c)。
[3185]
步骤7:3-(5,5-二甲基吡咯烷-3-基)-2-苯基-丙-1-胺
[3186][3187]
向3-(3-氨基-2-苯基-丙基)-5,5-二甲基-吡咯烷-2-酮(1.596g,6.15mmol)于无水thf(65ml)中的溶液中缓慢添加lah(2.05g,54.012mmol)。将所得溶液在40℃下在氩气下搅拌2天,并且然后回流2天。将反应溶液冷却至0℃,然后缓慢添加水(2.1ml),随后添加15%naoh水溶液(2.1ml)和水(6.3ml)。将溶液在环境温度下搅拌30分钟,然后通过硅藻土过滤,并用thf洗涤。将滤液减压浓缩,得到呈浅色粘性油状物的3-(5,5-二甲基吡咯烷-3-基)-2-苯基-丙-1-胺(1.529g,89%)。esi-ms m/z计算值232.1939,实验值233.3(m 1)
;保留时间:1.43分钟、1.31分钟(lc方法c)。
[3188]
步骤8:4-(3-氨基-2-苯基-丙基)-2,2-二甲基-吡咯烷-1-甲酸叔丁酯
[3189][3190]
在配备有迪恩-斯塔克分水器(dean-stark trap)和冷凝器的烧瓶中,将3-(5,5-二甲基吡咯烷-3-基)-2-苯基-丙-1-胺(1.394g,4.98mmol)于甲基异丁基酮(40ml)中的混合物加热,以在氩气下回流约10小时。将反应溶液冷却至0℃,然后逐滴添加含boc2o(1.118g,1.1768ml,5.1226mmol)的甲基异丁基酮(4ml)。添加完成后,将所得溶液在环境温度下搅拌30分钟。然后添加水(10ml),分离有机层。将有机层减压浓缩。将所得残余物溶解于水(4ml)和2-丙醇(40ml)的混合物中,并且在50℃下加热2小时,直到亚胺完全转化为伯胺。在减压下移除所有溶剂。向残余物中添加甲苯(2x10ml),并且在减压下移除甲苯,得到呈粘性棕色油状物的粗产物4-(3-氨基-2-苯基-丙基)-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(1.86g,56%)。esi-ms m/z计算值332.2464,实验值333.4(m 1)
;保留时间:3.95分钟(lc方法c)。
[3191]
步骤9:2,2-二甲基-4-[2-苯基-3-[(6-氨磺酰基-2-吡啶基)氨基]丙基]吡咯烷-1-甲酸叔丁酯
[3192][3193]
向4-(3-氨基-2-苯基-丙基)-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(1.605g,2.41mmol)和6-氟吡啶-2-磺酰胺(563mg,3.20mmol)于无水dmso(4.8ml)中的混合物中添加k2co3(1.18g,8.54mmol)。将所得溶液在100℃下在氩气下搅拌34小时。将反应溶液在乙酸乙酯(150ml)和柠檬酸(28.5ml,0.3m)之间分配。将有机层分离,用盐水洗涤,经无水硫酸钠干燥,过滤并减压浓缩。粗产物通过快速色谱法(以ch2cl2装载)(40g sio2,用0至70%乙醚/己
烷洗脱)纯化,得到呈棕色固体泡沫状的2,2-二甲基-4-[2-苯基-3-[(6-氨磺酰基-2-吡啶基)氨基]丙基]吡咯烷-1-甲酸叔丁酯(291mg,25%)。1h nmr(250mhz,dmso-d6)δ7.50(t,j=7.8hz,1h),7.34-7.26(m,3h),7.26-7.17(m,1h),7.10(s,2h),7.00-6.86(m,2h),6.60(d,j=8.8hz,1h),3.58-3.42(m,3h),2.92-2.74(m,2h),1.88-1.58(m,5h),1.37(s,9h),1.29(d,j=4.5hz,3h),1.09(s,3h)。esi-ms m/z计算值488.2457,实验值489.4(m 1)
;保留时间:2.73分钟(lc方法h)。
[3194]
步骤10:4-[3-[[6-[[2-氯-6-[3-[2-[1-(三氟甲基)环丙基]乙氧基]吡唑-1-基]吡啶-3-羰基]氨磺酰基]-2-吡啶基]氨基]-2-苯基-丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯
[3195][3196]
将2-氯-6-[3-[2-[1-(三氟甲基)环丙基]乙氧基]吡唑-1-基]吡啶-3-甲酸(324mg,0.86mmol)和羰基二咪唑(153mg,0.9436mmol)合并于thf(2ml)中,并在室温下加热2小时。然后添加2,2-二甲基-4-[2-苯基-3-[(6-氨磺酰基-2-吡啶基)氨基]丙基]吡咯烷-1-甲酸叔丁酯(275mg,0.56mmol),随后添加dbu(500μl,3.343mmol),并将反应物在室温下搅拌14小时。将反应混合物用饱和氯化铵淬灭并用乙酸乙酯萃取。将合并的有机层用盐水洗涤,干燥(mgso4),过滤并浓缩。所得棕色残余物通过硅胶柱色谱法,使用100%己烷至100%etoac的窄梯度纯化,得到呈灰白色固体状的4-[3-[[6-[[2-氯-6-[3-[2-[1-(三氟甲基)环丙基]乙氧基]吡唑-1-基]吡啶-3-羰基]氨磺酰基]-2-吡啶基]氨基]-2-苯基-丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(229mg,48%)。esi-ms m/z计算值845.2949,实验值846.2(m 1)
;保留时间:0.61分钟(lc方法u)。
[3197]
步骤11:12,12-二甲基-16-苯基-8-(3-{2-[1-(三氟甲基)环丙基]乙氧基}-1h-吡唑-1-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮
[3198][3199]
将4-[3-[[6-[[2-氯-6-[3-[2-[1-(三氟甲基)环丙基]乙氧基]吡唑-1-基]吡啶-3-羰基]氨磺酰基]-2-吡啶基]氨基]-2-苯基-丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(570mg,0.67mmol)于tfa(700μl,9.09mmol)和dcm(2ml)中的溶液在室温下搅拌2小时。在反
应完成后,移除溶剂。将残余物溶解于乙酸乙酯中,并用饱和nahco3溶液(2ml)洗涤,并且收集有机层并移除溶剂。将材料溶解于二甲基亚砜(15ml)中,添加烘箱干燥的分子筛,并将混合物搅拌10分钟。然后,添加碳酸钾(320mg,2.31mmol),并将反应混合物在140℃下加热16小时。将反应混合物经由whatman滤盘(puradisc 25tf)过滤,并且通过反相hplc-ms方法,使用在15.0分钟内从50%-99%流动相b运行的双梯度来纯化滤液。(流动相a=h20(5mm hcl)。流动相b=ch3cn),得到呈灰白色固体状的12,12-二甲基-16-苯基-8-(3-{2-[1-(三氟甲基)环丙基]乙氧基}-1h-吡唑-1-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮(285mg,60%)。esi-ms m/z计算值709.2658,实验值710.2(m 1)
;保留时间:1.31分钟(lc方法m)。
[3200]
步骤12:12,12-二甲基-16-苯基-8-(3-{2-[1-(三氟甲基)环丙基]乙氧基}-1h-吡唑-1-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮,化合物392(对映异构体1),和12,12-二甲基-16-苯基-8-(3-{2-[1-(三氟甲基)环丙基]乙氧基}-1h-吡唑-1-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮,化合物391(对映异构体2)
[3201][3202]
通过sfc色谱法,使用chiralpak lux-3(250x21.2mm),5μm粒度,使用15%meoh(无改性剂)、85%co2至45%meoh(无改性剂)、65%co2,以40ml/min历经14分钟对12,12-二甲基-16-苯基-8-(3-{2-[1-(三氟甲基)环丙基]乙氧基}-1h-吡唑-1-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮,源自3-(3-氨基-2-苯基-丙基)-1-[(4-甲氧基苯基)甲基]-5,5-二甲基-吡咯烷-2-酮,极性较小的非对映异构体2的异构体混合物(285mg,0.4015mmol)进行手性分离,得到洗脱的第一对映异构体(峰-1):
[3203]
对映异构体1:12,12-二甲基-16-苯基-8-(3-{2-[1-(三氟甲基)环丙基]乙氧基}-1h-吡唑-1-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮(66.1mg,46%)。1h nmr(400mhz,氯仿-d)δ8.23-8.15(m,2h),7.65-7.53(m,2h),7.38(d,j=8.4hz,1h),7.32(t,j=7.4hz,2h),7.28-7.20(m,1h),7.12(dd,j=7.0,1.8hz,2h),6.54(d,j=7.9hz,1h),5.91(d,j=2.8hz,1h),4.98(s,1h),4.53(t,j=11.5hz,1h),4.40(t,j=7.1hz,2h),3.79(t,j=8.5hz,1h),3.29(s,
1h),3.03(qd,j=8.9,8.3,3.7hz,2h),2.46-2.27(m,2h),2.09(t,j=7.2hz,2h),2.05-1.97(m,1h),1.63(d,j=5.7hz,6h),1.59-1.47(m,2h),1.04-0.97(m,2h),0.75-0.70(m,2h)。esi-ms m/z计算值709.2658,实验值710.14(m 1)
;保留时间:1.36分钟(lc方法m);
[3204]
对映异构体2(第二洗脱的对映异构体):12,12-二甲基-16-苯基-8-(3-{2-[1-(三氟甲基)环丙基]乙氧基}-1h-吡唑-1-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮,对映异构体2(87.5mg,57%)。1h nmr(400mhz,氯仿-d)δ8.22-8.16(m,2h),7.58(q,j=7.8hz,2h),7.38(d,j=8.4hz,1h),7.32(t,j=7.4hz,2h),7.26-7.21(m,1h),7.15-7.10(m,2h),6.54(d,j=7.9hz,1h),5.91(d,j=2.8hz,1h),5.00(d,j=14.3hz,1h),4.54(t,j=11.7hz,1h),4.40(t,j=7.2hz,2h),3.79(t,j=8.4hz,1h),3.29(s,1h),3.03(qd,j=8.5,3.8hz,2h),2.43-2.27(m,2h),2.09(t,j=7.2hz,2h),2.02(d,j=11.7hz,1h),1.63(d,j=6.1hz,6h),1.58-1.49(m,2h),1.04-0.98(m,2h),0.77-0.69(m,2h)。esi-ms m/z计算值709.2658,实验值710.2(m 1)
;保留时间:1.36分钟(lc方法m)。
[3205]
使用(3-氨基-2-苯基-丙基)-1-[(4-甲氧基苯基)甲基]-5,5-二甲基-吡咯烷-2-酮非对映异构体1作为起始物质,以与上文所述类似的方式制备以下化合物。
[3206]
步骤13:12,12-二甲基-16-苯基-8-(3-{2-[1-(三氟甲基)环丙基]乙氧基}-1h-吡唑-1-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮,化合物390(对映异构体3),和12,12-二甲基-16-苯基-8-(3-{2-[1-(三氟甲基)环丙基]乙氧基}-1h-吡唑-1-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮,化合物389(对映异构体4)
[3207][3208]
使用以下方法对第一批12,12-二甲基-16-苯基-8-(3-{2-[1-(三氟甲基)环丙基]乙氧基}-1h-吡唑-1-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮,源自(3-氨基-2-苯基-丙基)-1-[(4-甲氧基苯基)甲基]-5,5-二甲基-吡咯烷-2-酮非对映异构体1,(50mg,0.070mmol)的两种异构体的混合物进行sfc:chiralpak as-3(250x10mm,5μm)柱,35℃,流动相32%meoh(无改性剂),68%co2,流速10ml/min,浓度24mg/ml于meoh中(无改性剂),进样体积70μl,压力100巴,波长210nm。
[3209]
使用以下方法对第二批相同材料(40mg,0.0564mmol)进行sfc分离:chiralpak as-h(250x21.2mm),5μm粒度柱,使用15%meoh(无改性剂)/85%co2至45%meoh(无改性剂)/65%co2,历经14分钟,流速40ml/min。
[3210]
将每次分离的峰1产物合并,得到12,12-二甲基-16-苯基-8-(3-{2-[1-(三氟甲基)环丙基]乙氧基}-1h-吡唑-1-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮,对映异构体3(30.5mg,64%)。1h nmr(400mhz,氯仿-d)δ10.45(s,1h),8.18(d,j=2.8hz,1h),8.14(d,j=8.4hz,1h),7.58(d,j=4.3hz,2h),7.37-7.30(m,3h),7.26(t,j=3.6hz,1h),7.18-7.12(m,2h),6.61-6.52(m,1h),5.91(d,j=2.8hz,1h),4.84(s,1h),4.40(t,j=7.1hz,2h),3.68(d,j=10.5hz,2h),3.38(d,j=29.4hz,2h),2.83(s,1h),2.31(s,2h),2.09(t,j=7.2hz,2h),2.01(dd,j=12.1,6.9hz,1h),1.92(s,1h),1.72(t,j=11.2hz,1h),1.60(s,3h),1.56(s,3h),1.07-0.97(m,2h),0.74(q,j=1.7hz,2h)。esi-ms m/z计算值709.2658,实验值710.2(m 1)
;保留时间:1.39分钟(lc方法m)。
[3211]
将每次分离的峰2产物合并,得到12,12-二甲基-16-苯基-8-(3-{2-[1-(三氟甲基)环丙基]乙氧基}-1h-吡唑-1-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮,对映异构体4:(34.6mg,72%)。1h nmr(400mhz,氯仿-d)δ10.51(s,1h),8.18(d,j=2.8hz,1h),8.14(d,j=8.4hz,1h),7.58(d,j=4.8hz,2h),7.33(q,j=8.4,7.9hz,3h),7.26(t,j=3.7hz,1h),7.19-7.12(m,2h),6.56(t,j=4.7hz,1h),5.91(d,j=2.8hz,1h),4.84(s,1h),4.40(t,j=7.1hz,2h),3.68(d,j=10.1hz,2h),3.38(d,j=27.3hz,2h),2.83(s,1h),2.31(d,j=7.6hz,2h),2.09(t,j=7.2hz,2h),2.01(dd,j=11.9,7.0hz,1h),1.92(s,1h),1.72(t,j=11.3hz,1h),1.60(s,3h),1.56(s,3h),1.05-0.99(m,2h),0.74(q,j=3.0,1.7hz,2h)。esi-ms m/z计算值709.2658,实验值710.2(m 1)
;保留时间:1.38分钟(lc方法m)。
[3212]
实施例129:3-[(14s)-12,12-二甲基-2,2,4-三氧代-8-(3-{2-[1-(三氟甲基)环丙基]乙氧基}-1h
‑‑
吡唑-1-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-18-基]丙酰胺(化合物378)的制备
[3213][3214]
步骤1:(14s)-12,12-二甲基-3-(丙-2-烯-1-基)-8-(3-{2-[1-(三氟甲基)环丙基]乙氧基}-1h-吡唑-1-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮
[3215][3216]
向20ml小瓶中添加(14s)-12,12-二甲基-8-(3-{2-[1-(三氟甲基)环丙基]乙氧基}-1h-吡唑-1-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5,7,9,19,21-六烯-2,2,4-三酮(500mg,0.79mmol)、碳酸钾(437mg,3.16mmol)和无水dmso(5ml)。使反应物在室温下搅拌,并且添加烯丙基溴(76μl,0.8783mmol)。将反应物封盖,并使其在室温下搅拌过夜。再添加一定量的烯丙基溴(40μl,0.4622mmol),并将反应物再搅拌3小时。将反应物过滤并经由反相柱色谱法,用50%-99%acn:h2o纯化,得到呈白色固体状的(14s)-12,12-二甲基-3-(丙-2-烯-1-基)-8-(3-{2-[1-(三氟甲基)环丙基]乙氧基}-1h-吡唑-1-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮(480mg,90%)。esi-ms m/z计算值673.2658,实验值674.4(m 1)
;保留时间:2.1分钟(lc方法g)。
[3217]
步骤2:3-[(14s)-12,12-二甲基-2,2,4-三氧代-3-(丙-2-烯-1-基)-8-(3-{2-[1-(三氟甲基)环丙基]乙氧基}-1h-吡唑-1-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-18-基]丙酰胺
[3218][3219]
向微波小瓶中添加(14s)-12,12-二甲基-3-(丙-2-烯-1-基)-8-(3-{2-[1-(三氟甲基)环丙基]乙氧基}-1h-吡唑-1-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮(30mg,0.045mmol)、dmf(0.5ml)和氢化钠(10.7mg,60%w/w,0.27mmol)。在室温下搅拌5分钟后,反应物变为亮黄色。添加3-溴丙酰胺(10.2mg,0.067mmol)。在3小时后,在添加氢化钠(10.7mg,60%w/w,0.2675mmol),随后添加3-溴丙酰胺(10.2mg,0.06711mmol),并使反应物搅拌3天。将反应物过滤,并通过hplc(30%-99%)acn:h2o(含有hcl改性剂)纯化。分离出呈黄色固体状的3-[(14s)-12,12-二甲基-2,2,4-三氧代-3-(丙-2-烯-1-基)-8-(3-{2-[1-(三氟甲基)环丙基]乙氧基}-1h-吡唑-1-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-18-基]丙酰胺(8mg,24%)。esi-ms m/z计算值744.3029,实验值745.5(m 1)
;保留时间:1.84分钟(lc方法g)。
[3220]
步骤3:3-[(14s)-12,12-二甲基-2,2,4-三氧代-8-(3-{2-[1-(三氟甲基)环丙基]乙氧基}-1h
‑‑
吡唑-1-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-18-基]丙酰胺(化合物378)
[3221][3222]
向含有3-[(14s)-12,12-二甲基-2,2,4-三氧代-3-(丙-2-烯-1-基)-8-(3-{2-[1-(三氟甲基)环丙基]乙氧基}-1h-吡唑-1-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-18-基]丙酰胺(8mg,0.012mmol)的试管中添加1,2-二氯乙烷(0.5ml)。添加pd(pph3)4(12.5mg,0.012mmol),并且将反应物搅拌5分钟,直到反应物变为深红色。添加添加苯磺酸盐(钠盐)(2mg,0.087mmol),并将反应物在室温下搅拌10分钟。将反应物过滤,并经由hplc(30%-99%)acn:h2o(含有hcl改性剂)纯化。分离出呈固体状的3-[(14s)-12,12-二甲基-2,2,4-三氧代-8-(3-{2-[1-(三氟甲基)环丙基]乙氧基}-1h-吡唑-1-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-18-基]丙酰胺(7.4mg,98%)。esi-ms m/z计算值704.2716,实验值705.4(m 1)
;保留时间:1.51分钟(lc方法g)。
[3223]
以下是可商购获得的烷基卤化物试剂的列表:
[3224]
3-(2-氯乙氧基)丙腈
[3225]
2-氯-n,n-二甲基-乙酰胺
[3226]
3-(溴甲基)-4-甲基-1,2,4-三唑
[3227]
6-溴己腈
[3228]
3-(氯甲基)氧杂环丁烷
[3229]
使用上表中给出的烷基卤化物,以与上文所述类似的方式制备下表中的化合物:
[3230]
[3231][3232]
实施例130:(14s)-18-[(2s)-2,3-二羟丙基]-12,12-二甲基-8-(3-{2-[1-(三氟甲基)环丙基]乙氧基}-1h-吡唑-1-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮(化合物381)和(14s)-18-[(2r)-2,3-二羟丙基]-12,12-二甲基-8-(3-{2-[1-(三氟甲基)环丙基]乙氧基}-1h-吡唑-1-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮(化合物379)的制备
[3233]
[3234][3235]
步骤1:(4s)-2,2-二甲基-4-[3-(对甲苯基磺酰氧基)丙基]吡咯烷-1-甲酸叔丁酯
[3236][3237]
使500ml、3颈圆底烧瓶配备有机械搅拌器、冷却浴、加料漏斗、j-kem温度探针和氮气入口/出口。在氮气气氛下,向容器中装入(4s)-4-(3-羟丙基)-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(10g,38.85mmol)和二氯甲烷(250ml),得到澄清无色溶液。开始搅拌,并记录锅温为19℃。向冷却浴中装入碎冰/水,并且将锅温降低至0℃。向加料漏斗中装入三乙胺(5.11g,50.50mmol),在5分钟内逐滴添加纯三乙胺。然后向加料漏斗中装入在20分钟内逐滴添加的对甲苯磺酰氯(8.148g,42.74mmol)于二氯甲烷(15ml)中的溶液,得到澄清浅黄色溶液并放热达到2℃。将混合物继续在《5℃下搅拌1小时,并且然后使混合物升温至室温并搅拌8小时。将反应混合物进一步用二氯甲烷(200ml)稀释,并且然后倒入饱和氯化铵溶液(250ml)中。然后将双相混合物转移到分液漏斗中。将有机物移除,用饱和氯化铵溶液(150ml)洗涤,经硫酸钠(150g)干燥,并且然后通过玻璃料布氏漏斗过滤。将滤液减压浓缩,得到呈澄清琥珀色油状物的所需产物(4s)-2,2-二甲基-4-[3-(对甲苯基磺酰氧基)丙基]吡咯烷-1-甲酸叔丁酯(14.23g,89%产率)。
[3238]
步骤2:(4s)-4-[3-[(2,2-二甲基-1,3-二氧戊环-4-基)甲基氨基]丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯和(4s)-4-[3-(2,3-二羟丙基氨基)丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯
[3239][3240]
向(4s)-2,2-二甲基-4-[3-(对甲苯基磺酰氧基)丙基]吡咯烷-1-甲酸叔丁酯
(200mg,0.4860mmol)于乙腈(2ml)中的溶液中添加(2,2-二甲基-1,3-二氧戊环-4-基)甲胺(160μl,1.234mmol),随后添加diea(450μl,2.584mmol)并且将反应混合物在室温下搅拌过夜。将混合物在50℃下加热6小时。将反应混合物经由whatman滤盘(puradisc 25tf)过滤,并且通过反相hplc-ms方法,使用在15分钟内从1%-99%流动相b运行的双梯度(流动相a=h20(无改性剂),流动相b=ch3cn)来纯化滤液,蒸发后得到(4s)-4-[3-[(2,2-二甲基-1,3-二氧戊环-4-基)甲基氨基]丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯和约35%的(4s)-4-[3-(2,3-二羟丙基氨基)丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(120mg,67%)。将混合物用于下一步中。esi-ms m/z计算值370.28317,实验值371.44(m 1)
;保留时间:0.54分钟,副产物esi-ms m/z计算值330.25186,实验值331.4(m 1)
;保留时间:0.45分钟(lc方法d)。
[3241]
步骤3:(4s)-4-[3-[(2,2-二甲基-1,3-二氧戊环-4-基)甲基-(6-氨磺酰基-2-吡啶基)氨基]丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯和(4s)-4-[3-[2,3-二羟丙基-(6-氨磺酰基-2-吡啶基)氨基]丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯
[3242]
向含有35%的(4s)-4-[3-(2,3-二羟丙基氨基)丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯的(4s)-4-[3-[(2,2-二甲基-1,3-二氧戊环-4-基)甲基氨基]丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(120mg,0.32mmol)、6-氟吡啶-2-磺酰胺(62mg,0.35mmol)和dmso(2ml)的混合物中添加diea(300μl,1.722mmol)。将混合物在80℃下搅拌18小时,然后在120℃下搅拌2天。将反应混合物冷却至环境温度,并且经由whatman滤盘(puradisc 25tf)过滤,并且滤液通过反相hplc-ms方法使用在15分钟内从1%-99%流动相b运行的双梯度(流动相a=h20(无改性剂),流动相b=ch3cn)进行纯化,得到(4s)-4-[3-[(2,2-二甲基-1,3-二氧戊环-4-基)甲基-(6-氨磺酰基-2-吡啶基)氨基]丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(65mg,38%)esi-ms m/z计算值526.28253,实验值527.13(m 1)
;保留时间:0.71分钟(lc方法d)以及(4s)-4-[3-[2,3-二羟丙基-(6-氨磺酰基-2-吡啶基)氨基]丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(23mg,15%),esi-ms m/z计算值486.25122,实验值487.13(m 1)
;保留时间:0.58分钟(lc方法d)。
[3243]
步骤4:(4s)-4-[3-[[6-[[2-氯-6-[3-[2-[1-(三氟甲基)环丙基]乙氧基]吡唑-1-基]吡啶-3-羰基]氨磺酰基]-2-吡啶基]-[(2,2-二甲基-1,3-二氧戊环-4-基)甲基]氨基]丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯
[3244][3245]
向2-氯-6-[3-[2-[1-(三氟甲基)环丙基]乙氧基]吡唑-1-基]吡啶-3-甲酸(47mg,
0.12mmol)于thf(2ml)中的溶液中添加cdi(23mg,0.14mmol)(从thf再结晶),并将混合物在室温下搅拌3小时,然后添加(4s)-4-[3-[(2,2-二甲基-1,3-二氧戊环-4-基)甲基-(6-氨磺酰基-2-吡啶基)氨基]丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(60mg,0.11mmol)于thf(1ml)中的溶液,随后添加dbu(40μl,0.27mmol),并且将所得混合物在室温下搅拌18小时。将反应混合物经由whatman滤盘(puradisc 25tf)过滤,并且滤液通过反相hplc-ms方法,使用在15.0分钟内从50%-99%流动相b运行的双梯度(流动相a=含10mm甲酸铵的h20;流动相b=ch3cn)进行纯化。将含有产物的级分合并并冻干,得到呈白色固体状的(4s)-4-[3-[[6-[[2-氯-6-[3-[2-[1-(三氟甲基)环丙基]乙氧基]吡唑-1-基]吡啶-3-羰基]氨磺酰基]-2-吡啶基]-[(2,2-二甲基-1,3-二氧戊环-4-基)甲基]氨基]丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(68mg,68%)。esi-ms m/z计算值883.33167,实验值884.36(m 1)
;保留时间:0.62分钟(lc方法u)。
[3246]
步骤5:(14s)-18-(2,3-二羟丙基)-12,12-二甲基-8-(3-{2-[1-(三氟甲基)环丙基]乙氧基}-1h-吡唑-1-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮(化合物382)
[3247][3248]
将(4s)-4-[3-[[6-[[2-氯-6-[3-[2-[1-(三氟甲基)环丙基]乙氧基]吡唑-1-基]吡啶-3-羰基]氨磺酰基]-2-吡啶基]-[(2,2-二甲基-1,3-二氧戊环-4-基)甲基]氨基]丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(68mg,0.077mmol)于tfa(30μl,0.389mmol)和dcm(150μl)中的溶液在室温下搅拌2小时。在反应完成后,移除溶剂。将残余物溶解于乙酸乙酯中,并用饱和nahco3溶液(2ml)洗涤,并且收集有机层并移除溶剂。将材料溶解于二甲基亚砜(2ml)中。添加烘箱干燥的分子筛,并将混合物搅拌10分钟。然后,添加碳酸钾(42mg,0.304mmol),并将反应混合物在140℃下加热16小时。将反应混合物经由whatman滤盘(puradisc 25tf)过滤,并且通过反相hplc-ms方法,使用在15分钟内从50%-99%流动相b运行的双梯度(流动相a=含有5mm hcl的h20;流动相b=ch3cn)来纯化滤液,得到呈灰白色固体状的(14s)-18-(2,3-二羟丙基)-12,12-二甲基-8-(3-{2-[1-(三氟甲基)环丙基]乙氧基}-1h-吡唑-1-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮(32mg,59%)。esi-ms m/z计算值707.2713,实验值708.22(m 1)
;保留时间:1.54分钟(lc方法g)。
[3249]
步骤6:(14s)-18-[(2s)-2,3-二羟丙基]-12,12-二甲基-8-(3-{2-[1-(三氟甲基)环丙基]乙氧基}-1h-吡唑-1-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮(化合物381)和(14s)-18-[(2r)-2,3-二羟丙基]-12,12-二甲基-8-(3-{2-[1-(三氟甲基)环丙基]乙氧基}-1h-吡唑-1-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,
7,9,19(23),20-六烯-2,2,4-三酮(化合物379)
[3250][3251]
通过sfc色谱法,使用chiralpak ic(250x10mm),5μm粒度的柱,使用30%meoh-62%co2,以10ml/min,历经16分钟对(14s)-18-(2,3-二羟丙基)-12,12-二甲基-8-(3-{2-[1-(三氟甲基)环丙基]乙氧基}-1h-吡唑-1-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮(25mg,0.0353mmol)(非对映异构体混合物)进行手性分离,得到呈白色固体状的两种异构体:
[3252]
洗脱的第一异构体(peak-1)是(14s)-18-[(2s)-2,3-二羟丙基]-12,12-二甲基-8-(3-{2-[1-(三氟甲基)环丙基]乙氧基}-1h-吡唑-1-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮(9.4mg,75%)。esi-ms m/z计算值707.2713,实验值708.11(m 1)
;保留时间:1.54分钟(lc方法g)。
[3253]
洗脱的第二对映异构体(peak-2)是(14s)-18-[(2r)-2,3-二羟丙基]-12,12-二甲基-8-(3-{2-[1-(三氟甲基)环丙基]乙氧基}-1h-吡唑-1-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮(5.2mg,42%)。1h nmr(500mhz,dmso-d6)δ12.61(s,1h),8.22(d,j=2.7hz,1h),7.78(d,j=8.2hz,1h),7.72(t,j=8.0hz,1h),7.18(d,j=7.3hz,1h),7.08(s,1h),6.92(d,j=8.2hz,1h),6.12(d,j=2.7hz,1h),4.95(d,j=5.2hz,1h),4.81(s,1h),4.32(t,j=7.3hz,3h),3.70(s,1h),3.59(d,j=14.8hz,1h),3.40(d,j=11.1hz,2h),3.22(dd,j=15.3,8.5hz,1h),2.18(s,1h),2.08(t,j=7.1hz,3h),1.86(s,1h),1.61(s,3h),1.52(s,6h),1.34(d,j=19.9hz,1h),1.23(d,j=10.0hz,2h),1.11(s,1h),0.96(d,j=5.0hz,2h),0.89(s,2h)。esi-ms m/z计算值707.2713,实验值708.22(m 1)
;保留时间:1.51分钟(lc方法g)。
[3254]
实施例131:(14s)-12,12-二甲基-18-苯基-8-(3-{2-[1-(三氟甲基)环丙基]乙氧基}-1h-吡唑-1-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮(化合物395)的制备
[3255][3256]
步骤1:6-苯胺基吡啶-2-磺酰胺
[3257][3258]
在氮气下,向6-溴吡啶-2-磺酰胺(1.0g,4.218mmol)、pd2(dba)3(408mg,0.446mmol)、xantphos(490mg,0.847mmol)和碳酸铯(4.25g,13.04mmol)中添加脱气的1,4-二噁烷(22ml),随后添加苯胺(475μl,5.213mmol)。将混合物在油浴中在120℃下加热20小时。将混合物冷却至环境温度,并且添加饱和氯化铵,并将混合物用乙酸乙酯萃取。将合并的有机萃取物用盐水洗涤,经硫酸钠干燥,过滤并浓缩。所得棕色残余物通过硅胶柱色谱法(40g柱),使用100%己烷至100%乙酸乙酯的浅梯度纯化,得到呈浅黄色固体状的6-苯胺基吡啶-2-磺酰胺(370mg,35%)。1h nmr(400mhz,dmso-d6)δ9.44(s,1h),7.91-7.62(m,3h),7.44-7.19(m,5h),7.06-6.80(m,2h)。esi-ms m/z计算值249.05719,实验值250.2(m 1)
;保留时间:0.9分钟(lc方法a)。
[3259]
步骤2:(4s)-2,2-二甲基-4-[3-(n-(6-氨磺酰基-2-吡啶基)苯胺基)丙基]吡咯烷-1-甲酸叔丁酯
[3260][3261]
将6-苯胺基吡啶-2-磺酰胺(445mg,1.785mmol)和nah(160mg,60%w/w,4.00mmol)合并于dmso(11ml)中并搅拌15分钟。然后添加(4s)-2,2-二甲基-4-[3-(对甲苯基磺酰氧基)丙基]吡咯烷-1-甲酸叔丁酯(685mg,1.664mmol)并且使混合物搅拌90分钟。将该粗混合物过滤,用乙酸乙酯稀释,并用水(2x20ml)洗涤,随后用盐水洗涤。将有机物进一步用水洗涤,然后分离,经硫酸钠干燥,并蒸发。残余物通过硅胶色谱法(80克柱)使用100%己烷至
60%乙酸乙酯/己烷的梯度进行纯化,以分离两种产物:
[3262]
极性较大的灰白色固体(4s)-4-[3-[(6-苯胺基-2-吡啶基)磺酰基氨基]丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(65mg,8%)esi-ms m/z计算值488.24573,实验值489.2(m 1)
;保留时间:1.91分钟(lc方法a)。
[3263]
极性较小的白色固体(4s)-2,2-二甲基-4-[3-(n-(6-氨磺酰基-2-吡啶基)苯胺基)丙基]吡咯烷-1-甲酸叔丁酯(347mg,43%)。1h nmr(400mhz,dmso-d6)δ7.58-7.45(m,3h),7.40-7.28(m,3h),7.23(d,j=3.0hz,2h),7.11(d,j=7.1hz,1h),6.41-6.32(m,1h),4.00(dt,j=16.9,9.5hz,2h),3.47(q,j=10.6hz,1h),2.76-2.67(m,1h),2.06(d,j=18.4hz,1h),1.87-1.78(m,1h),1.53(q,j=7.5hz,2h),1.35(dd,j=19.8,11.1hz,15h),1.20(s,3h)。esi-ms m/z计算值488.24573,实验值489.2(m 1)
;保留时间:2.0分钟(lc方法a)。
[3264]
步骤3:(4s)-4-[3-(n-[6-[[2-氯-6-[3-[2-[1-(三氟甲基)环丙基]乙氧基]吡唑-1-基]吡啶-3-羰基]氨磺酰基]-2-吡啶基]苯胺基)丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯
[3265][3266]
向2-氯-6-[3-[2-[1-(三氟甲基)环丙基]乙氧基]吡唑-1-基]吡啶-3-甲酸(250mg,0.665mmol)于thf(5.0ml)中的溶液中添加cdi(130mg,0.802mmol)(从thf再结晶),并将混合物在室温下搅拌3小时,然后添加(4s)-2,2-二甲基-4-[3-(n-(6-氨磺酰基-2-吡啶基)苯胺基)丙基]吡咯烷-1-甲酸叔丁酯(340mg,0.696mmol)于thf(1.25ml)中的溶液,随后添加dbu(310μl,2.073mmol),并且将所得混合物在室温下搅拌18小时。将反应物用乙酸乙酯稀释,并用水(2x20ml)洗涤,随后用盐水洗涤。将有机物进一步用水洗涤,然后分离,经硫酸钠干燥,并蒸发。残余物通过硅胶色谱法(80克柱),使用100%己烷至50%乙酸乙酯/己烷的梯度进行纯化,得到呈灰白色固体状的(4s)-4-[3-(n-[6-[[2-氯-6-[3-[2-[1-(三氟甲基)环丙基]乙氧基]吡唑-1-基]吡啶-3-羰基]氨磺酰基]-2-吡啶基]苯胺基)丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(135mg,24%)。esi-ms m/z计算值845.2949,实验值846.6(m 1)
;保留时间:2.3分钟(lc方法a)。
[3267]
步骤4:(14s)-12,12-二甲基-18-苯基-8-(3-{2-[1-(三氟甲基)环丙基]乙氧基}-1h-吡唑-1-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮(化合物395)
[3268][3269]
将(4s)-4-[3-(n-[6-[[2-氯-6-[3-[2-[1-(三氟甲基)环丙基]乙氧基]吡唑-1-基]吡啶-3-羰基]氨磺酰基]-2-吡啶基]苯胺基)丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(135mg,0.159mmol)溶解于dcm(5ml)中,并且向混合物中添加hcl(4m于二噁烷中)(1000μl,4.00mmol),并且将所得混合物在室温下搅拌90分钟。将混合物蒸发至干燥,然后用乙醚(5ml x 2)稀释,浓缩并放置在高真空泵上过夜,得到呈粘性油状的粗制中间体2-氯-n-[[6-[n-[3-[(3s)-5,5-二甲基吡咯烷-3-基]丙基]苯胺基]-2-吡啶基]磺酰基]-6-[3-[2-[1-(三氟甲基)环丙基]乙氧基]吡唑-1-基]吡啶-3-甲酰胺(盐酸盐)(120mg,96%)。esi-ms m/z计算值745.2425,实验值746.5(m 1)
;保留时间:1.12分钟。将材料与k2co3(160mg,1.158mmol)、分子筛和dmso(8ml)合并于小瓶中,将其用氮气吹扫,封盖,加热至155℃并搅拌16小时。将混合物过滤,用乙酸乙酯稀释,并用水(2x20ml)洗涤,随后用盐水洗涤。将有机物进一步用水洗涤,然后分离,经硫酸钠干燥,并蒸发。残余物通过硅胶色谱法(12克柱),使用100%己烷至70%乙酸乙酯/己烷的梯度进行纯化,得到呈灰白色固体状的(14s)-12,12-二甲基-18-苯基-8-(3-{2-[1-(三氟甲基)环丙基]乙氧基}-1h-吡唑-1-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮(52.32mg,46%)。1h nmr(400mhz,dmso-d6)δ12.70(s,1h),8.23(d,j=2.8hz,1h),7.86(d,j=8.2hz,1h),7.68-7.53(m,3h),7.48-7.35(m,3h),7.26(d,j=7.2hz,1h),6.95(d,j=8.3hz,1h),6.38(d,j=8.7hz,1h),6.12(d,j=2.7hz,1h),4.91(s,1h),4.32(t,j=7.1hz,2h),3.37(s,1h),3.30(d,j=10.2hz,1h),2.96(t,j=10.3hz,1h),2.20(s,1h),2.09(t,j=7.1hz,2h),1.86(dd,j=11.9,5.2hz,1h),1.61(s,4h),1.55(s,3h),1.47(d,j=12.7hz,4h),1.04-0.94(m,2h),0.94-0.85(m,2h)。esi-ms m/z计算值709.2658,实验值710.2(m 1)
;保留时间:2.06分钟(lc方法a)。
[3270]
实施例132:(14s)-12,12-二甲基-18-[(2h-1,2,3,4-四唑-5-基)甲基]-8-(3-{2-[1-(三氟甲基)环丙基]乙氧基}-1h-吡唑-1-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮(化合物372)的制备
[3271][3272]
步骤1:(4s)-2,2-二甲基-4-[3-[(6-氨磺酰基-2-吡啶基)-(1h-四唑-5-基甲基)氨基]丙基]吡咯烷-1-甲酸叔丁酯
[3273][3274]
将(4s)-2,2-二甲基-4-[3-[(6-氨磺酰基-2-吡啶基)氨基]丙基]吡咯烷-1-甲酸叔丁酯(25mg,0.061mmol)和nah(8mg,60%w/w,0.20mmol)合并于dmso(750μl)中并搅拌15分钟。然后添加5-(氯甲基)-1h-四唑(8mg,0.067mmol)并且使混合物搅拌90分钟。再添加1当量的5-(氯甲基)-1h-四唑(8mg,0.06750mmol)并使混合物搅拌16小时。将混合物过滤,并且然后通过使用c
18
柱的反相制备型色谱法和hplc-ms方法1%-70%a1b1(乙腈-水 5毫摩尔hcl,15分钟方法)纯化,得到呈白色固体状的所需(4s)-2,2-二甲基-4-[3-[(6-氨磺酰基-2-吡啶基)-(1h-四唑-5-基甲基)氨基]丙基]吡咯烷-1-甲酸叔丁酯(17.59mg,59%)。1h nmr(500mhz,dmso-d6)δ7.73(t,j=8.0hz,1h),7.18(s,2h),7.11(d,j=7.2hz,1h),6.95(d,j=8.6hz,1h),5.12(s,2h),3.55(dt,j=17.4,7.8hz,3h),2.86
–
2.69(m,1h),2.08(s,1h),1.99
–
1.76(m,1h),1.58(d,j=17.6hz,2h),1.39(d,j=13.3hz,9h),1.35(d,j=12.2hz,5h),1.30(d,j=7.6hz,1h),1.23(s,3h),未观察到四唑的可交换nh。esi-ms m/z计算值494.24237,实验值495.2(m 1)
;保留时间:1.55分钟(lc方法a)。
[3275]
步骤2:(4s)-4-[3-[[6-[[2-氯-6-[3-[2-[1-(三氟甲基)环丙基]乙氧基]吡唑-1-基]吡啶-3-羰基]氨磺酰基]-2-吡啶基]-(2h-四唑-5-基甲基)氨基]丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯
[3276][3277]
向2-氯-6-[3-[2-[1-(三氟甲基)环丙基]乙氧基]吡唑-1-基]吡啶-3-甲酸(24mg,0.0634mmol)于thf(500μl)中的溶液中添加cdi(10mg,0.062mmol)(从thf再结晶),并将混合物在室温下搅拌4小时,然后添加(4s)-2,2-二甲基-4-[3-[(6-氨磺酰基-2-吡啶基)-(2h-四唑-5-基甲基)氨基]丙基]吡咯烷-1-甲酸叔丁酯(15mg,0.030mmol)于thf(275μl)中的溶液,随后添加dbu(13μl,0.087mmol),并且将所得混合物在室温下搅拌2小时。将反应混合物过滤,并且然后通过反相型色谱法,使用c
18
柱(hplc-ms方法1%-99%梯度,乙腈/水 5毫摩尔hcl,经15分钟运行)纯化,得到呈灰白色固体状的(4s)-4-[3-[[6-[[2-氯-6-[3-[2-[1-(三氟甲基)环丙基]乙氧基]吡唑-1-基]吡啶-3-羰基]氨磺酰基]-2-吡啶基]-(2h-四唑-5-基甲基)氨基]丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(11mg,43%)。esi-ms m/z计算值851.29156,实验值852.2(m 1)
;保留时间:2.21分钟(lc方法a)。
[3278]
步骤3:(14s)-12,12-二甲基-18-[(2h-1,2,3,4-四唑-5-基)甲基]-8-(3-{2-[1-(三氟甲基)环丙基]乙氧基}-1h-吡唑-1-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮(化合物372)
[3279][3280]
将(4s)-4-[3-[[6-[[2-氯-6-[3-[2-[1-(三氟甲基)环丙基]乙氧基]吡唑-1-基]吡啶-3-羰基]氨磺酰基]-2-吡啶基]-(2h-四唑-5-基甲基)氨基]丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(11mg,0.01291mmol)溶解于dcm(500μl)中,并且向混合物中添加hcl(4m于二噁烷中)(100μl,0.40mmol),并且将混合物在室温下搅拌2小时。将混合物蒸发至干燥,然后置于高真空泵上2小时,得到中间体2-氯-n-[[6-[3-[(3s)-5,5-二甲基吡咯烷-3-基]丙基-(2h-四唑-5-基甲基)氨基]-2-吡啶基]磺酰基]-6-[3-[2-[1-(三氟甲基)环丙基]乙氧基]吡唑-1-基]吡啶-3-甲酰胺(盐酸盐)。将材料与k2co3(20mg,0.145mmol)、分子筛和dmso(500μl)合并于小瓶中,将其用氮气吹扫,封盖,加热至155℃并搅拌18小时。将混合物冷却至室温,过滤并在氮气流下浓缩,得到残余物,将所述残余物通过使用c
18
柱的反相制备型色谱法和使用30%-99%梯度(乙腈-水 5毫摩尔hcl,15分钟方法)的hplc-ms方法纯化,得到呈灰白色固体状的(14s)-12,12-二甲基-18-[(2h-1,2,3,4-四唑-5-基)甲基]-8-(3-{2-[1-(三氟甲基)环丙基]乙氧基}-1h-吡唑-1-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂
四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮(1.81mg,18%)。esi-ms m/z计算值715.26245,实验值716.2(m 1)
;保留时间:2.01分钟(lc方法a)。
[3281]
实施例133:(12s)-14,14-二甲基-18-(3-{2-[1-(三氟甲基)环丙基]乙氧基}-1h-吡唑-1-基)-24λ
6-硫杂-2,5,6,7,8,15,17,23,29-九氮杂五环[23.3.1.112,15.04,8.016,21]三十碳-1(28),4,6,16,18,20,25(29),26-八烯-22,24,24-三酮(化合物380)的制备
[3282][3283]
步骤1:(4s)-4-[3-[5-(氨基甲基)四唑-1-基]丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯
[3284][3285]
向含有(4s)-2,2-二甲基-4-[3-(对甲苯基磺酰氧基)丙基]吡咯烷-1-甲酸叔丁酯(530mg,1.288mmol)和2h-四唑-5-基甲胺(155mg,1.564mmol)于dmso(15ml)中的混合物的40ml密封小瓶中添加diea(350μl,2.01mmol)。将混合物在85℃下搅拌2小时。将混合物冷却至环境温度,并且添加饱和氯化铵,并将混合物用乙酸乙酯萃取。将合并的有机萃取物用盐水洗涤,经硫酸钠干燥,过滤并浓缩。使用硅胶柱色谱法(4克柱),使用100%二氯甲烷至20%二氯甲烷/甲醇的梯度纯化所得无色油状物,得到呈粘性油状物的(4s)-4-[3-[5-(氨基甲基)四唑-1-基]丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(318mg,73%)。esi-ms m/z计算值338.243,实验值339.2(m 1)
;保留时间:1.12分钟(lc方法a)。
[3286]
步骤2:(4s)-2,2-二甲基-4-[3-[5-[[(6-氨磺酰基-2-吡啶基)氨基]甲基]四唑-1-基]丙基]吡咯烷-1-甲酸叔丁酯
[3287][3288]
在150ml密封容器中合并含(4s)-4-[3-[5-(氨基甲基)四唑-1-基]丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(300mg,0.886mmol)的dmso(10.0ml),随后合并k2co3(650mg,4.703mmol)和6-氟吡啶-2-磺酰胺(200mg,1.135mmol)。将容器密封并在加热板上加热至95℃,持续72小时。添加碳酸铯(1.45g,4.450mmol),并且将混合物再加热至105℃持续24小时。将混合物冷却至环境温度,并且添加饱和氯化铵并用乙酸乙酯萃取。将合并的有机萃取物用盐水洗涤,经硫酸钠干燥,过滤并浓缩。将所得无色油状物通过使用100%二氯甲烷至20%二氯甲烷/甲醇梯度的硅胶柱色谱法(40克柱)进行纯化,随后通过使用c
18
柱的反相制备型色谱法和hplc-ms方法(1%-70%梯度乙腈-水 5毫摩尔hcl,4次进样,15分钟运行)进行二次纯化,得到(4s)-2,2-二甲基-4-[3-[5-[[(6-氨磺酰基-2-吡啶基)氨基]甲基]四唑-1-基]丙基]吡咯烷-1-甲酸叔丁酯(165mg,38%)esi-ms m/z计算值494.24237,实验值495.2(m 1)
;保留时间:1.55分钟(lc方法a)。
[3289]
步骤3:(4s)-4-[3-[5-[[[6-[[2-氯-6-[3-[2-[1-(三氟甲基)环丙基]乙氧基]吡唑-1-基]吡啶-3-羰基]氨磺酰基]-2-吡啶基]氨基]甲基]四唑-1-基]丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯
[3290][3291]
向2-氯-6-[3-[2-[1-(三氟甲基)环丙基]乙氧基]吡唑-1-基]吡啶-3-甲酸(168mg,0.447mmol)于thf(3.5ml)中的溶液中添加cdi(75mg,0.462mmol)(从thf再结晶),并将混合物在室温下搅拌4小时,然后添加(4s)-2,2-二甲基-4-[3-[5-[[(6-氨磺酰基-2-吡啶基)氨基]甲基]四唑-1-基]丙基]吡咯烷-1-甲酸叔丁酯(100mg,0.202mmol)于thf(1.5ml)中的溶液,随后添加dbu(110μl,0.736mmol),并且将所得混合物在室温下搅拌18小时。将反应混合物过滤,并且然后通过使用c
18
柱的反相制备型色谱法和hplc-ms方法(30%-99%梯度乙腈-水 5毫摩尔hcl x 2次进样,15分钟运行)进行纯化,得到呈灰白色固体状的(4s)-4-[3-[5-[[[6-[[2-氯-6-[3-[2-[1-(三氟甲基)环丙基]乙氧基]吡唑-1-基]吡啶-3-羰基]氨磺酰基]-2-吡啶基]氨基]甲基]四唑-1-基]丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(44.90mg,26%)。esi-ms m/z计算值851.29156,实验值852.2(m 1)
;保留时间:2.21分钟(lc方法a)。
[3292]
步骤4:(12s)-14,14-二甲基-18-(3-{2-[1-(三氟甲基)环丙基]乙氧基}-1h-吡唑-1-基)-24λ
6-硫杂-2,5,6,7,8,15,17,23,29-九氮杂五环[23.3.1.112,15.04,8.016,
21]三十碳-1(28),4,6,16,18,20,25(29),26-八烯-22,24,24-三酮(化合物380)
[3293][3294]
将(4s)-4-[3-[5-[[[6-[[2-氯-6-[3-[2-[1-(三氟甲基)环丙基]乙氧基]吡唑-1-基]吡啶-3-羰基]氨磺酰基]-2-吡啶基]氨基]甲基]四唑-1-基]丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(44.9mg,0.0527mmol)溶解于dcm(1.5ml)中,并且向混合物中添加hcl(4m于二噁烷中)(400μl,4m,1.600mmol),并且将混合物在室温下搅拌2小时。将混合物蒸发至干燥,然后置于高真空泵上2小时,得到呈灰白色固体状的中间体2-氯-n-[[6-[[1-[3-[(3s)-5,5-二甲基吡咯烷-3-基]丙基]四唑-5-基]甲基氨基]-2-吡啶基]磺酰基]-6-[3-[2-[1-(三氟甲基)环丙基]乙氧基]吡唑-1-基]吡啶-3-甲酰胺(盐酸盐)。esi-ms m/z计算值751.23914,实验值752.2(m 1)
;保留时间:0.76分钟。将材料与k2co3(75mg,0.543mmol)、分子筛和dmso(1.5ml)合并于小瓶中,将其用氮气吹扫,封盖,加热至155℃并搅拌16小时。将混合物过滤并在氮气流下浓缩,得到残余物,所述残余物通过使用c
18
柱的反相制备型色谱法和hplc-ms方法(30%-99%梯度,乙腈-水 5毫摩尔hcl,15分钟方法)纯化,得到呈灰白色固体状的(12s)-14,14-二甲基-18-(3-{2-[1-(三氟甲基)环丙基]乙氧基}-1h-吡唑-1-基)-24λ
6-硫杂-2,5,6,7,8,15,17,23,29-九氮杂五环[23.3.1.112,15.04,8.016,21]三十碳-1(28),4,6,16,18,20,25(29),26-八烯-22,24,24-三酮(15.6mg,41%)。esi-ms m/z计算值715.26245,实验值716.2(m 1)
;保留时间:1.97分钟(lc方法a)。
[3295]
实施例134:(14s)-17-(4-叔丁基吡啶-2-基)-8-[3-(2-{二螺[2.0.24.13]庚-7-基}乙氧基)-1h-吡唑-1-基]-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮,非对映异构体1(化合物300),和(14s)-17-(4-叔丁基吡啶-2-基)-8-[3-(2-{二螺[2.0.24.13]庚-7-基}乙氧基)-1h-吡唑-1-基]-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮,非对映异构体2(化合物299)的制备
[3296][3297]
步骤1:(4s)-4-[3-(4-叔丁基-2-吡啶基)-3-[[6-[[2-氯-6-[3-(2-二螺[2.0.24.13]庚-7-基乙氧基)吡唑-1-基]吡啶-3-羰基]氨磺酰基]-2-吡啶基]氨基]丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯
[3298][3299]
在20-ml小瓶中,将2-氯-6-[3-(2-二螺[2.0.24.13]庚-7-基乙氧基)吡唑-1-基]吡啶-3-甲酸(178.8mg,0.447mmol)溶解于thf(3.0ml)中,向其添加cdi(120.5mg,0.743mmol)。将所得混合物在室温下搅拌15小时。此后,添加(4s)-4-[3-(4-叔丁基-2-吡啶基)-3-[(6-氨磺酰基-2-吡啶基)氨基]丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(300mg,0.5497mmol)和dbu(300μl,2.006mmol),并将所得混合物在室温下搅拌24小时。此后,添加hcl水溶液(1n,4ml),并用etoac(3
×
3ml)萃取混合物。将合并的有机萃取物用h2o(5ml)和饱和nacl水溶液(5ml)洗涤,然后经na2so4干燥,过滤并真空蒸发,得到橙色泡沫。通过硅胶色谱法(12g二氧化硅),使用0至80%etoac/己烷梯度洗脱进行纯化,得到(4s)-4-[3-(4-叔丁基-2-吡啶基)-3-[[6-[[2-氯-6-[3-(2-二螺[2.0.24.13]庚-7-基乙氧基)吡唑-1-基]吡啶-3-羰基]氨磺酰基]-2-吡啶基]氨基]丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(173.0mg,44%)esi-ms m/z计算值886.39667,实验值887.5(m 1)
;保留时间:2.19分钟(lc方法a)。
[3300]
步骤2:(14s)-17-(4-叔丁基吡啶-2-基)-8-[3-(2-{二螺[2.0.24.13]庚-7-基}乙氧基)-1h-吡唑-1-基]-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮,非对映异构体1(化合物300),和(14s)-17-(4-叔丁基吡啶-2-基)-8-[3-(2-{二螺[2.0.24.13]庚-7-基}乙氧基)-1h-吡唑-1-基]-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮,非对映异构体2(化合物299)
[3301][3302]
阶段1:在20-ml小瓶中,将(4s)-4-[3-(4-叔丁基-2-吡啶基)-3-[[6-[[2-氯-6-[3-(2-二螺[2.0.24.13]庚-7-基乙氧基)吡唑-1-基]吡啶-3-羰基]氨磺酰基]-2-吡啶基]氨基]丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(173.0mg,0.195mmol)溶解于ch2cl2(4.0ml)中。添加tfa(1.0ml,12.98mmol),并使所得溶液在室温下静置3小时。然后将混合物真空蒸发,用二噁烷稀释,并再次真空蒸发。这得到橙色油状物,300mg(>100%产率)。
[3303]
阶段2:在具有减压隔片盖的20-ml微波小瓶中,将来自阶段1的粗产物溶解于nmp(4.0ml)中,向其添加k2co3(285.9mg,2.069mmol)。将所得混合物用n2冲洗,并且然后在140℃下搅拌18小时。在冷却至室温之后,将反应混合物用1n hcl溶液(5ml)淬灭,并用etoac(3
×
3ml)萃取。将合并的有机萃取物用h2o(5ml)和饱和nacl水溶液(5ml)洗涤,然后经na2so4干燥,过滤并真空蒸发。通过硅胶色谱法(12g二氧化硅),使用0至80%etoac/己烷梯度洗脱进行纯化,得到灰白色粉末(65.2mg,44.5%产率),但其中包含两种非对映异构体。通过反相制备型色谱法,使用c
18
柱和含有5mm hcl的1%至99%mecn/h2o梯度洗脱进一步纯化,得到两种产物:
[3304]
非对映异构体1:“峰1”,(14s)-17-(4-叔丁基吡啶-2-基)-8-[3-(2-{二螺[2.0.24.13]庚-7-基}乙氧基)-1h-吡唑-1-基]-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮(19.0mg,13%);1h nmr(400mhz,dmso-d6)δ12.74-12.01(bs,1h),8.66-8.54(m,1h),8.20(d,j=2.7hz,1h),8.05-7.83(m,2h),7.77-7.56(m,3h),7.36-7.24(m,1h),6.99-6.91(m,1h),6.91(d,j=8.2hz,1h),6.08(d,j=2.7hz,1h),5.24-4.99(m,1h),4.21(t,j=6.6hz,2h),3.09-2.77(m,2h),2.39-2.27(m,1h),2.24-2.11(m,1h),1.91(dd,j=11.9,5.7hz,1h),1.85-1.71(m,3h),1.58(s,3h),1.55(s,3h),1.54-1.48(m,1h),1.47(t,j=6.4hz,1h),1.30(s,9h),1.20-1.08(m,1h),0.88-0.77(m,4h),0.68-0.59(m,2h),0.54-0.45(m,2h)。[注意:1h丢失,可能隐藏在水峰之下。]esi-ms m/z计算值750.36755,实验值751.4(m 1)
;保留时间:2.05分钟(lc方法a)。
[3305]
非对映异构体2:“峰2”,(14s)-17-(4-叔丁基吡啶-2-基)-8-[3-(2-{二螺[2.0.24.13]庚-7-基}乙氧基)-1h-吡唑-1-基]-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮
(27.8mg,19%);1h nmr(400mhz,dmso-d6)δ12.97-11.36(bs,1h),8.73-8.57(m,1h),8.22(d,j=2.8hz,1h),8.15-8.05(m,1h),8.05-7.90(m,1h),7.87(d,j=8.2hz,1h),7.80-7.71(m,1h),7.71(t,j=7.9hz,1h),7.19(d,j=7.2hz,1h),6.97(d,j=8.4hz,1h),6.94(d,j=8.2hz,1h),6.10(d,j=2.8hz,1h),5.59-5.40(m,1h),4.22(t,j=6.6hz,2h),2.71(t,j=10.4hz,1h),2.42-2.28(m,1h),2.12-1.93(m,2h),1.89(dd,j=12.0,5.3hz,1h),1.85-1.79(m,2h),1.79-1.73(m,1h),1.66(s,3h),1.65-1.56(m,1h),1.54(s,3h),1.47(t,j=6.5hz,2h),1.32(s,9h),0.91-0.74(m,4h),0.70-0.58(m,2h),0.54-0.42(m,2h)。[注意:1h丢失,可能隐藏在水峰之下。]esi-ms m/z计算值750.36755,实验值751.3(m 1)
;保留时间:2.04分钟(lc方法a)。
[3306]
实施例135:12-甲基-12-丙基-8-(3-{2-[1-(三氟甲基)环丙基]乙氧基}-1h吡唑-1-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮,对映异构体1(化合物368)、对映异构体2(化合物367)、对映异构体3(化合物366)和对映异构体4(化合物365)的制备
[3307]
[3308][3309]
步骤1:2-硝基戊烷
[3310][3311]
向配备有冷凝器的2l 3颈烧瓶中添加含3-氯过氧苯甲酸(184.07g,800.00mmol)的1,2-二氯乙烷(1.2l),并将混合物加热到85℃。逐滴添加含戊-2-胺(17.970g,199.98mmol)的1,2-二氯乙烷(100ml)。将混合物在85℃下搅拌3小时。冷却至室温后,将反应混合物过滤并用1n naoh(3x1.5l)洗涤,并经na2so4干燥。将有机层蒸发,得到粗制2-硝基戊烷,将其与前4批合并,并通过蒸馏纯化,得到呈黄色油状物的2-硝基戊烷(9.61g,39%)。1h nmr(250mhz,cdcl3)δ4.78
–
4.35(m,1h),2.11
–
1.88(m,1h),1.66(ddt,j=14.1,8.9,4.6hz,1h),1.51(d,j=6.6hz,3h),1.33(dt,j=15.1,7.6hz,2h),0.93(t,j=7.3hz,3h)
[3312]
步骤2:3-(2-甲基-2-硝基-戊基)四氢吡喃-2-酮
[3313]
向2-硝基戊烷(24.9g,201.93mmol)和3-亚甲基四氢吡喃-2-酮(17.02g,127.51mmol)的溶液中逐滴添加1,8-二氮杂双环[5.4.0]十一碳-7-烯(2.3g,14.806mmol)。将混合物在室温下搅拌2小时。将反应混合物用dcm(200ml)稀释,并用5%hcl(2x5ml)洗涤。将有机层蒸发,得到粗物质,所述粗物质在220g硅胶上通过色谱法纯化,得到呈浅黄色油状物的3-(2-甲基-2-硝基-戊基)四氢吡喃-2-酮(26.1g,85%)。1h nmr(250mhz,cdcl3)δ4.39
–
4.21(m,2h),2.89
–
2.29(m,2h),2.25
–
1.69(m,6h),1.60
–
1.53(m,3h),1.50
–
1.04(m,3h),
1.01
–
0.82(m,3h)。
[3314]
步骤3:3-(3-羟丙基)-5-甲基-5-丙基-吡咯烷-2-酮
[3315][3316]
向3-(2-甲基-2-硝基-戊基)四氢吡喃-2-酮(12g,43.965mmol)于etoac(50ml)中的溶液中添加雷尼镍(5g,32.187mmol),并将混合物在h2气氛(约10巴)下在80℃下搅拌过夜。过滤反应混合物。将滤液蒸发,得到呈浅黄色油状物的3-(3-羟丙基)-5-甲基-5-丙基-吡咯烷-2-酮(8g,91%),其不经进一步纯化即直接用于下一步。esi-ms m/z计算值199.1572,实验值200.6(m 1)
;保留时间:2.17分钟(lc方法b)。
[3317]
步骤4:3-(5-甲基-5-丙基-吡咯烷-3-基)丙-1-醇
[3318]
在回流下,向3-(3-羟丙基)-5-甲基-5-丙基-吡咯烷-2-酮(7.98g,38.040mmol)于无水四氢呋喃(200ml)中的溶液中逐滴添加含2m硼烷二甲硫醚复合物的thf(150ml,300mmol)。在1小时后,将混合物在0℃下冷却,并且缓慢地添加150ml meoh/hcl(9:1)溶液。将混合物在55℃下搅拌20小时,使其冷却至环境温度并减压浓缩。将残余物用饱和碳酸氢钠(200ml)稀释,并用二氯甲烷(2x150ml)萃取。不分离水层中的产物,而是直接用于下一个boc保护步骤。esi-ms m/z计算值185.17796,实验值186.5(m 1)
;保留时间:1.49分钟(lc方法b)。
[3319]
步骤5:4-(3-羟丙基)-2-甲基-2-丙基-吡咯烷-1-甲酸叔丁酯
[3320][3321]
向3-(5-甲基-5-丙基-吡咯烷-3-基)丙-1-醇(7.049g,38.040mmol)于饱和nahco3(200ml)、2m naoh(50ml)和二噁烷(80ml)中的溶液中添加boc2o(16.604g,76.080mmol)。将混合物在室温下搅拌1小时。将混合物用乙酸乙酯(3x200ml)萃取。将有机层用盐水(500ml)洗涤,经硫酸钠干燥并浓缩。将残余物通过硅胶柱色谱法,使用0-70%己烷-乙酸乙酯纯化,得到呈无色凝胶状的4-(3-羟丙基)-2-甲基-2-丙基-吡咯烷-1-甲酸叔丁酯(2.13g,19%)。esi-ms m/z计算值285.2304,实验值286.5(m 1)
;保留时间:3.26分钟(lc方法b)。
[3322]
步骤6:2-甲基-4-(3-甲基磺酰氧基丙基)-2-丙基-吡咯烷-1-甲酸叔丁酯
[3323][3324]
在-5℃下,向4-(3-羟丙基)-2-甲基-2-丙基-吡咯烷-1-甲酸叔丁酯(2.13g,7.3134mmol)和tea(1.4520g,2ml,14.349mmol)于dcm(20ml)中的溶液中逐滴添加mscl(1.4800g,1.0000ml,12.881mmol)。将混合物在0℃下搅拌1小时。将混合物用水(20ml)稀释,并分离两层。将水层用dcm(2x50ml)萃取。将合并的有机层用水(50ml)和盐水(80ml)洗涤,经硫酸钠干燥,过滤并浓缩,得到呈浅黄色油状的2-甲基-4-(3-甲基磺酰氧基丙基)-2-丙基-吡咯烷-1-甲酸叔丁酯(2.7g,100%)。esi-ms m/z计算值363.2079,实验值364.5(m 1)
;保留时间:3.52分钟(lc方法b)。
[3325]
步骤7:4-(3-氨基丙基)-2-甲基-2-丙基-吡咯烷-1-甲酸叔丁酯
[3326]
向2-甲基-4-(3-甲基磺酰氧基丙基)-2-丙基-吡咯烷-1-甲酸叔丁酯(2.7g,7.2790mmol)于nmp(20ml)中的溶液中添加nan3(0.55g,8.4179mmol),并将混合物在45℃下搅拌18小时。将混合物用水(50ml)稀释,并随后用饱和碳酸氢钠(50ml)稀释,并且用乙酸乙酯(2x80ml)萃取混合物。将有机层用盐水(150ml)洗涤,经硫酸钠干燥,过滤并浓缩,得到中间体叠氮化物。向该叠氮化物中间体于etoac(20ml)中的溶液中添加单水合氧化铂(0.35g,1.5105mmol)。将混合物在parr振荡器中在40psi氢气下保持2小时。将反应混合物通过硅藻土垫过滤。将滤液浓缩,得到呈深色油状物的4-(3-氨基丙基)-2-甲基-2-丙基-吡咯烷-1-甲酸叔丁酯(2g,95%)。esi-ms m/z计算值284.2464,实验值285.6(m 1)
;保留时间:2.57分钟(lc方法b)。
[3327]
步骤8:2-甲基-2-丙基-4-[3-[(6-氨磺酰基-2-吡啶基)氨基]丙基]吡咯烷-1-甲酸叔丁酯
[3328][3329]
向4-(3-氨基丙基)-2-甲基-2-丙基-吡咯烷-1-甲酸叔丁酯(2g,6.8908mmol)和6-氟吡啶-2-磺酰胺(1.5g,8.0888mmol)于dmso(10ml)中的混合物中添加diea(2.2260g,3ml,
17.223mmol)。将混合物在110℃下搅拌16小时。将混合物冷却至室温,并将混合物直接装载至制备型hplc柱上进行纯化(柱:varian c
18 10μm,5x30cm;流速:60ml/min.;流动相a:水;流动相b:乙腈;方法:经60分钟0-45%b)。将纯产物级分合并,并移除乙腈。将浑浊水相用乙酸乙酯(2x200ml)萃取。将有机层通过盐水(250ml)洗涤,经硫酸钠干燥并浓缩,得到呈白色固体状的2-甲基-2-丙基-4-[3-[(6-氨磺酰基-2-吡啶基)氨基]丙基]吡咯烷-1-甲酸叔丁酯(2.58g,82%)。1h nmr(500mhz,dmso-d6)δ7.55-7.46(m,1h),7.07(s,2h),6.94(d,j=7.0hz,2h),6.60(d,j=8.4hz,1h),3.62-3.51(m,1h),3.30-3.24(m,2h),2.86-2.63(m,1h),2.09-2.02(m,1h),1.80-1.45(m,5h),1.43
–
1.32(m,12h),1.29(d,j=11.9hz,2h),1.25-1.20(m,2h),1.18
–
1.00(m,1h),0.91-0.80(m,3h)。esi-ms m/z计算值440.2457,实验值441.1(m 1)
;保留时间:2.7分钟(lc方法h)。
[3330]
步骤9:4-[3-[[6-[[2-氯-6-[3-[2-[1-(三氟甲基)环丙基]乙氧基]吡唑-1-基]吡啶-3-羰基]氨磺酰基]-2-吡啶基]氨基]丙基]-2-甲基-2-丙基-吡咯烷-1-甲酸叔丁酯
[3331][3332]
向2-氯-6-[3-[2-[1-(三氟甲基)环丙基]乙氧基]吡唑-1-基]吡啶-3-甲酸(400mg,1.065mmol)于thf(3.2ml)中的溶液中添加cdi(215.7mg,1.330mmol)(从thf再结晶),并将混合物在室温下搅拌1小时,然后添加2-甲基-2-丙基-4-[3-[(6-氨磺酰基-2-吡啶基)氨基]丙基]吡咯烷-1-甲酸叔丁酯(490.2mg,1.113mmol),随后添加dbu(509.1mg,3.344mmol),并且将所得混合物在室温下搅拌16小时。浓缩以移除thf,然后用dmso稀释,过滤并使用275g c
18
反相柱,使用50%acn/h2o至99%acn/h2o梯度进行纯化。产物并未充分与起始磺酰胺分离。将不纯产物溶解于dmso中,过滤并使用反相hplc-ms方法,使用由phenomenex销售的luna c
18
(2)柱(75
×
30mm,5μm粒度)(pn:00c-4252-u0-ax),以及在15.0分钟内从1%-99%流动相b运行的双梯度(流动相a=h2o(5mm hcl),流动相b=乙腈,流速=50ml/min,进样体积=950μl并且柱温=25℃)进行进一步纯化,得到呈白色固体状的4-[3-[[6-[[2-氯-6-[3-[2-[1-(三氟甲基)环丙基]乙氧基]吡唑-1-基]吡啶-3-羰基]氨磺酰基]-2-吡啶基]氨基]丙基]-2-甲基-2-丙基-吡咯烷-1-甲酸叔丁酯(533.3mg,63%)。esi-ms m/z计算值797.2949,实验值798.3(m 1)
;保留时间:0.91分钟(lc方法d)。
[3333]
步骤10:2-氯-n-[[6-[3-(5-甲基-5-丙基-吡咯烷-3-基)丙基氨基]-2-吡啶基]磺酰基]-6-[3-[2-[1-(三氟甲基)环丙基]乙氧基]吡唑-1-基]吡啶-3-甲酰胺
基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮,对映异构体1(化合物368);12-甲基-12-丙基-8-(3-{2-[1-(三氟甲基)环丙基]乙氧基}-1h吡唑-1-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮,对映异构体2(化合物367);12-甲基-12-丙基-8-(3-{2-[1-(三氟甲基)环丙基]乙氧基}-1h吡唑-1-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮,对映异构体3(化合物366);和12-甲基-12-丙基-8-(3-{2-[1-(三氟甲基)环丙基]乙氧基}-1h吡唑-1-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮,对映异构体4(化合物365)
[3340][3341]
通过sfc色谱法,使用chiralpak ig(250x21.2mm柱,5μm粒度),用40%meoh/60%co2流动相,以70ml/min历经11.0分钟(进样体积=500μl的32mg/ml于meoh中的溶液)对12-甲基-12-丙基-8-(3-{2-[1-(三氟甲基)环丙基]乙氧基}-1h吡唑-1-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮(122mg,0.1844mmol)进行手性分离,得到四种异构体:
[3342]
洗脱的第一对映异构体:12-甲基-12-丙基-8-(3-{2-[1-(三氟甲基)环丙基]乙氧基}-1h吡唑-1-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮,对映异构体1(29.2mg,96%)。1h nmr(500mhz,dmso-d6)δ12.51(s,1h),8.16(d,j=2.8hz,1h),7.81(d,j=8.1hz,1h),7.57(t,j=7.8hz,1h),7.06(d,j=7.1hz,1h),6.97(s,1h),6.92(d,j=8.1hz,1h),6.70(d,j=8.5hz,1h),6.13(d,j=2.8hz,1h),4.32(t,j=7.1hz,2h),3.91(s,1h),3.20(s,1h),2.96(d,j=13.2hz,1h),2.73(s,1h),2.37(s,1h),2.09(t,j=7.3hz,3h),1.93
–
1.84(m,1h),1.75(s,1h),1.58(s,2h),1.45(s,3h),1.42
–
1.32(m,2h),1.30(dd,j=14.2,10.3hz,1h),1.24(s,1h),1.16(d,j=8.2hz,1h),0.96(d,j=4.9hz,2h),0.89(s,2h),0.83(t,j=7.2hz,3h)。esi-ms m/z计算值661.2658,实验值662.5(m 1)
;保留时间:2.37分钟(lc方法a)。
[3343]
洗脱的第二对映异构体,12-甲基-12-丙基-8-(3-{2-[1-(三氟甲基)环丙基]乙氧基}-1h吡唑-1-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮,对映异构体2(11.1mg,36%)。:1h nmr(500mhz,dmso-d6)δ12.51(s,1h),8.19(d,j=2.9hz,1h),7.83(d,j=8.2hz,1h),7.58(t,j=7.8hz,1h),7.05(d,j=7.0hz,1h),6.96(s,1h),6.92(d,j=7.9hz,1h),6.71(d,j=
8.5hz,1h),6.12(t,j=3.4hz,1h),4.32(t,j=7.0hz,2h),3.94(s,1h),3.18(s,1h),2.94(d,j=13.2hz,1h),2.65(s,1h),2.09(t,j=7.5hz,4h),1.79(d,j=15.7hz,2h),1.67(d,j=11.6hz,2h),1.61(d,j=4.6hz,5h),1.35(d,j=9.2hz,1h),1.30(d,j=17.7hz,1h),1.05(s,1h),0.96(d,j=5.0hz,2h),0.89(s,2h),0.75(t,j=7.1hz,3h)。esi-ms m/z计算值661.2658,实验值662.6(m 1)
;保留时间:2.36分钟(lc方法a)。
[3344]
洗脱的第三对映异构体,12-甲基-12-丙基-8-(3-{2-[1-(三氟甲基)环丙基]乙氧基}-1h吡唑-1-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮,对映异构体3(13.6mg,44%)。1h nmr(500mhz,dmso-d6)δ12.51(s,1h),8.19(d,j=2.7hz,1h),7.83(d,j=8.2hz,1h),7.58(t,j=7.9hz,1h),7.05(d,j=7.2hz,1h),6.97(s,1h),6.92(d,j=8.2hz,1h),6.71(d,j=8.6hz,1h),6.12(d,j=2.7hz,1h),4.32(t,j=7.1hz,2h),3.98
–
3.88(m,1h),3.18(s,1h),2.94(d,j=13.2hz,1h),2.64(s,1h),2.09(t,j=7.0hz,4h),1.79(d,j=14.0hz,2h),1.67(d,j=11.5hz,2h),1.61(s,3h),1.59(s,1h),1.36(s,1h),1.34
–
1.27(m,2h),1.10
–
1.01(m,1h),0.96(d,j=4.9hz,2h),0.88(d,j=17.4hz,2h),0.75(t,j=7.3hz,3h)。esi-ms m/z计算值661.2658,实验值662.6(m 1)
;保留时间:2.36分钟(lc方法a)。
[3345]
洗脱的第四和最终对映异构体,12-甲基-12-丙基-8-(3-{2-[1-(三氟甲基)环丙基]乙氧基}-1h吡唑-1-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮,对映异构体4(24.8mg,81%)。esi-ms m/z计算值661.2658,实验值662.6(m 1)
;保留时间:2.36分钟(lc方法a)。
[3346]
实施例136:(14s)-7-苯甲基-17-(4-叔丁基吡啶-2-基)-8-[3-(2-{二螺[2.0.24.13]庚-7-基}乙氧基)-1h-吡唑-1-基]-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮,非对映异构体1(化合物396),和(14s)-7-苯甲基-17-(4-叔丁基吡啶-2-基)-8-[3-(2-{二螺[2.0.24.13]庚-7-基}乙氧基)-1h-吡唑-1-基]-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮,非对映异构体2(化合物397)的制备
[3347][3348][3349]
步骤1:3-苄基-2,6-二氟-吡啶
[3350][3351]
在250-ml圆底烧瓶中,将(2,6-二氟-3-吡啶基)硼酸(3.1351g,19.73mmol)、苄基氯(2.64g,20.86mmol)和pd(pph3)4(0.5525g,0.4781mmol)与dme(80ml)和na2co3水溶液(40ml,2.0m,80.00mmol)混合。将所得混合物用n2气体吹扫5分钟,并且然后在110℃下回流搅拌92小时。将其冷却至室温,并且通过硅藻土过滤(用100ml etoac冲洗)。将滤液用h2o(100ml)稀释,并且分离各层。将有机层置于一旁,并用etoac(100ml)萃取水层。将合并的有机萃取物用h2o(100ml)和饱和nacl水溶液(100ml)洗涤,然后经na2so4干燥,过滤并真空蒸发。通过硅胶色谱法(220g二氧化硅),使用0至15%etoac/己烷的梯度洗脱来进行纯化,得
3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮,非对映异构体1,和(14s)-7-苄基-17-(4-叔丁基吡啶-2-基)-8-氟-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮,非对映异构体2
[3359][3360]
在1打兰小瓶中,将(4s)-4-[3-[[6-[(5-苄基-2,6-二氟-吡啶-3-羰基)氨磺酰基]-2-吡啶基]氨基]-3-(4-叔丁基-2-吡啶基)丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(80mg,0.08135mmol)溶解于ch2cl2(1.0ml)中。添加tfa(200μl,2.596mmol),并使所得溶液在室温下静置2小时。然后将混合物真空蒸发,用二噁烷(1.0ml)稀释,并再次真空蒸发。这得到黄色油状物,约100mg(>100%产率)。
[3361]
在1打兰小瓶中,将来自步骤1的粗产物溶解于nmp(1.0ml)中,向其中添加k2co3(150mg,1.085mmol)。将所得混合物用n2冲洗,然后在140℃下搅拌19小时。在冷却至室温之后,将反应混合物倒入1n hcl溶液(5ml)中,并用etoac(3
×
3ml)萃取。将合并的有机萃取物用h2o(5ml)和饱和nacl水溶液(5ml)洗涤,然后经na2so4干燥,过滤并真空蒸发。然后将该材料用1:1dmso:meoh(2ml)稀释,过滤,并且通过反相制备型色谱法,使用c
18
柱和20%至80%mecn/h2o(含有5mm hcl溶液)的梯度洗脱来纯化,得到2种产物:
[3362]
非对映异构体1,“峰1”:在30分钟hplc上较早的保留时间,(14s)-7-苄基-17-(4-叔丁基吡啶-2-基)-8-氟-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮(12.1mg,23%)。1h nmr(400mhz,dmso-d6)δ12.92-12.06(bs,1h),8.71-8.56(m,1h),8.16-7.85(m,2h),7.84-7.57(m,3h),7.30(t,j=7.4hz,3h),7.24(d,j=7.0hz,2h),7.20(t,j=7.0hz,1h),7.01-6.88(m,1h),5.34-4.94(m,1h),3.82(s,2h),3.27-3.08(m,1h),2.97-2.69(m,1h),2.35-2.23(m,1h),2.22-2.06(m,1h),1.86(dd,j=11.9,5.6hz,1h),1.81-1.67(m,1h),1.58-1.47(m,1h),1.46(s,6h),1.30(s,9h),1.21-1.05(m,1h)。[注意:1h从产物(c36h41fn6o3s)中的总计数41中缺失]。esi-ms m/z计算值656.2945,实验值657.3(m 1)
;保留时间:1.76分钟(lc方法a)。
[3363]
非对映异构体2,“峰2”:在30分钟hplc上稍晚的保留时间,(14s)-7-苄基-17-(4-叔丁基吡啶-2-基)-8-氟-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮(12.5mg,23%)。1h nmr(400mhz,dmso-d6)δ13.28-11.78(bs,1h),8.84-8.50(m,1h),8.12-7.85(m,2h),7.84(d,j=10.0hz,1h),7.71(t,j=7.8hz,1h),7.31(t,j=7.5hz,2h),7.25(d,j=7.0hz,2h),7.23-7.14(m,2h),6.95(d,j=8.1hz,1h),5.55-5.28(m,1h),3.91-3.78(m,
2h),3.36-3.26(m,1h),2.64(t,j=10.5hz,1h),2.37-2.21(m,1h),2.07-1.88(m,2h),1.85(dd,j=12.0,5.1hz,1h),1.80-1.69(m,1h),1.59(s,3h),1.57-1.43(m,2h),1.41(s,3h),1.30(s,9h),1.26-1.07(m,1h)。esi-ms m/z计算值656.2945,实验值657.3(m 1)
;保留时间:1.75分钟(lc方法a)。
[3364]
步骤5:(14s)-7-苄基-17-(4-叔丁基吡啶-2-基)-8-[3-(2-{二螺[2.0.24.13]庚-7-基}乙氧基)-1h-吡唑-1-基]-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮,非对映异构体1(化合物396)
[3365][3366]
在1打兰小瓶中,将(14s)-7-苄基-17-(4-叔丁基吡啶-2-基)-8-氟-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮(12.1mg,0.01842mmol)[来自步骤4的峰1]于dmso-d6(400μl)中的溶液与3-(2-二螺[2.0.24.13]庚-7-基乙氧基)-1h-吡唑(12.0mg,0.05875mmol)、dabco(5mg,0.04457mmol)、k2co3(20mg,0.1447mmol)和dmso(400μl)混合。将所得混合物在室温下搅拌12小时,然后在100℃下搅拌3小时,并且然后在150℃下搅拌16小时。将其冷却至室温,并且添加k2co3(20mg,0.1447mmol)。将所得混合物在170℃下搅拌25小时。将其冷却至室温,然后添加1n hcl水溶液(1.0ml),随后添加etoac(1.0ml)。将各相剧烈混合,并且然后使其沉降成两层。将有机层过滤并通过反相制备型色谱法使用c
18
柱和含有5mm hcl溶液的1%至99%乙腈/水梯度洗脱纯化,得到两种产物(在反应期间发生一定外消旋作用):
[3367]-非对映异构体1,“峰1”,在30分钟hplc运行上较早洗脱的化合物,(14s)-7-苄基-17-(4-叔丁基吡啶-2-基)-8-[3-(2-{二螺[2.0.24.13]庚-7-基}乙氧基)-1h-吡唑-1-基]-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮(盐酸盐)(1.8mg,11%)。esi-ms m/z计算值840.41455,实验值841.5(m 1)
;保留时间:2.21分钟(lc方法a)。
[3368]-非对映异构体2,“峰2”,在30分钟hplc运行上稍晚洗脱的化合物,(14s)-7-苄基-17-(4-叔丁基吡啶-2-基)-8-[3-(2-{二螺[2.0.24.13]庚-7-基}乙氧基)-1h-吡唑-1-基]-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮(盐酸盐)(1.5mg,9%)。esi-ms m/z计算值840.41455,实验值841.4(m 1)
;保留时间:2.21分钟(lc方法a)。
[3369]
步骤6:(14s)-7-苄基-17-(4-叔丁基吡啶-2-基)-8-[3-(2-{二螺[2.0.24.13]庚-7-基}乙氧基)-1h-吡唑-1-基]-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮,非对映异构体2(化合物397)
[3370][3371]
在1打兰小瓶中,将(14s)-7-苄基-17-(4-叔丁基吡啶-2-基)-8-氟-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮(12.5mg,0.01903mmol)[来自步骤4的峰2]于dmso-d6(400μl)中的溶液与3-(2-二螺[2.0.24.13]庚-7-基乙氧基)-1h-吡唑(12.2mg,0.05973mmol)、dabco(5mg,0.04457mmol)、k2co3(20mg,0.1447mmol)和dmso(400μl)混合。将所得混合物在室温下搅拌12小时,然后在100℃下搅拌3小时,并且然后在150℃下搅拌16小时。将其冷却至室温,并且添加k2co3(20mg,0.1447mmol)。将所得混合物在170℃下搅拌25小时。将其冷却至室温,然后添加1n hcl水溶液(1.0ml),随后添加etoac(1.0ml)。将各相剧烈混合,并且然后使其沉降成两层。将有机层过滤并通过反相制备型色谱法使用c
18
柱和含有5mm hcl溶液的1%至99%乙腈/水梯度洗脱纯化,得到两种产物(在反应期间发生一定外消旋作用):
[3372]-非对映异构体1,“峰1”,在30分钟hplc运行上较早洗脱的化合物,(14s)-7-苄基-17-(4-叔丁基吡啶-2-基)-8-[3-(2-{二螺[2.0.24.13]庚-7-基}乙氧基)-1h-吡唑-1-基]-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮(盐酸盐)(0.7mg,4%)。esi-ms m/z计算值840.41455,实验值841.5(m 1)
;保留时间:2.22分钟(lc方法a)。
[3373]-非对映异构体2,“峰2”,在30分钟hplc运行上稍晚洗脱的化合物,(14s)-7-苄基-17-(4-叔丁基吡啶-2-基)-8-[3-(2-{二螺[2.0.24.13]庚-7-基}乙氧基)-1h-吡唑-1-基]-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮(盐酸盐)(3.8mg,23%)。esi-ms m/z计算值840.41455,实验值841.5(m 1)
;保留时间:2.22分钟(lc方法a)。
[3374]
实施例137:(14s)-7-溴-8-叔丁基-17-(4-叔丁基吡啶-2-基)-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮(化合物398)的制备
[3375][3376]
步骤1:(1e)-4,4-二甲基-3-氧代戊-1-烯-1-醇钠
[3377][3378]
将3,3-二甲基丁-2-酮(20.0g,200mmol)和甲酸乙酯(16.1ml,200mmol)的混合物缓慢添加到含氢化钠(8.0g,200mmol)的甲苯(200ml)中,并将反应混合物在室温下搅拌过夜。将溶剂减压蒸发,并且其未经纯化即用于下一反应。
[3379]
步骤2:6-叔丁基-2-羟基吡啶-3-甲腈
[[6-[(5-溴-6-叔丁基-2-氯-吡啶-3-羰基)氨磺酰基]-2-吡啶基]氨基]-3-(4-叔丁基-2-吡啶基)丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯
[3392][3393]
在100-ml圆底烧瓶中,将5-溴-6-叔丁基-2-氯-吡啶-3-甲酸(2.6298g,8.989mmol)与dcm(30ml)混合并冷却至0℃,向其中添加dmf(100μl,1.291mmol)和草酰氯(2.0ml,22.93mmol)。将所得溶液在2小时内升温至室温。在验证确实形成酰氯后[使用吗啉将少量样品淬灭,得到(5-溴-6-叔丁基-2-氯-3-吡啶基)-吗啉基-甲酮],真空蒸发混合物。
[3394]
单独地,在250-ml圆底烧瓶中,制备(4s)-4-[3-(4-叔丁基-2-吡啶基)-3-[(6-氨磺酰基-2-吡啶基)氨基]丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(4.0082g,7.345mmol)和dipea(10ml,57.41mmol)于dcm(60ml)中的溶液。将上述生成的粗制酰氯溶解于dcm(20ml)中并添加到磺酰胺溶液中。将所得混合物在室温下搅拌72小时。然后将其倒入0.5n hcl水溶液(250ml)中,并用etoac(3
×
100ml)萃取。将合并的有机萃取物用h2o(200ml)和盐水(200ml)洗涤,然后经na2so4干燥,过滤并真空蒸发。通过硅胶色谱法,使用0至80%etoac/己烷梯度洗脱进行纯化,得到在uplc上质量相同的两种产物:
[3395]“峰1”,在硅胶上较晚洗脱的产物,在反相uplc上的保留时间略早,橙色泡沫状物,(4s)-4-[3-[[6-[(5-溴-6-叔丁基-2-氯-吡啶-3-羰基)氨磺酰基]-2-吡啶基]氨基]-3-(4-叔丁基-2-吡啶基)丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(891.5mg,14%);esi-ms m/z计算值818.25916,实验值819.2(m 1)
;保留时间:2.03分钟(lc方法a)。
[3396]“峰2”,在硅胶上较早洗脱的产物,在反相uplc上的保留时间略晚,橙色泡沫状物,(4s)-4-[3-[[6-[(5-溴-6-叔丁基-2-氯-吡啶-3-羰基)氨磺酰基]-2-吡啶基]氨基]-3-(4-叔丁基-2-吡啶基)丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(1.8010g,21%);esi-ms m/z计算值818.25916,实验值819.2(m 1)
;保留时间:2.04分钟(lc方法a)。
[3397]
步骤7:(14s)-7-溴-8-叔丁基-17-(4-叔丁基吡啶-2-基)-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮(化合物398)
[3398][3399]
阶段1:在20-ml小瓶中,将(4s)-4-[3-[[6-[(5-溴-6-叔丁基-2-氯-吡啶-3-羰基)氨磺酰基]-2-吡啶基]氨基]-3-(4-叔丁基-2-吡啶基)丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(1.8010g,1.537mmol)溶解于dcm(8.0ml)中,向其添加tfa(2ml,25.96mmol)。将所得溶液在室温下搅拌21小时。然后将其真空蒸发,得到粗固体。
[3400]
阶段2:在100-ml圆底烧瓶中,将来自步骤1的产物溶解于nmp(25ml)中,向其中添加k2co3(2.723g,19.70mmol)。将回流冷凝器安装在烧瓶上方,并且将混合物在140℃下搅拌18小时,然后在160℃下搅拌23小时。然后将其冷却至室温,并倒入1n hcl(100ml)中。将混合物用etoac(3
×
100ml)萃取。将合并的有机萃取物用h2o(200ml)和盐水(200ml)洗涤,然后经na2so4干燥,过滤并真空蒸发。通过硅胶色谱法,使用0-90%etoac/己烷的梯度洗脱进行纯化,得到米色固体,(14s)-7-溴-8-叔丁基-17-(4-叔丁基吡啶-2-基)-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮(621.3mg,56%);1h nmr(400mhz,dmso-d6)δ8.40(d,j=5.2hz,1h),7.77(s,1h),7.72-7.57(m,2h),7.45(d,j=1.9hz,1h),7.23(dd,j=5.3,1.9hz,1h),7.09(d,j=7.2hz,1h),6.86(d,j=8.4hz,1h),5.23(ddd,j=12.3,9.3,3.2hz,1h),3.20(dd,j=10.5,6.8hz,1h),2.75(t,j=10.6hz,1h),2.29-2.15(m,1h),1.97-1.81(m,3h),1.76-1.69(m,1h),1.67-1.57(m,1h),1.57(s,3h),1.51(s,3h),1.46(s,9h),1.23(s,9h)。[注意:产物(c
33h43
brn6o3s)的总数43中缺少2h。]esi-ms m/z计算值682.2301,实验值683.2(m 1)
;保留时间:1.83分钟(lc方法a)。
[3401]
实施例138:(14s)-8-叔丁基-17-(4-叔丁基吡啶-2-基)-12,12-二甲基-7-[(1e)-2-苯基乙烯基]-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮(化合物399)的制备
[3402][3403]
在1打兰小瓶中,将[(e)-苯乙烯基]硼酸(41.2mg,0.2784mmol)、(14s)-7-溴-8-叔丁基-17-(4-叔丁基吡啶-2-基)-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环
[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮(102.5mg,0.1424mmol;源自于峰2)、pd(pph3)4(16.3mg,0.01411mmol)和na2co3水溶液(400μl,2.0m,0.8000mmol)与二噁烷(600μl)混合在一起。在超声处理下,将所得混合物在氮气下吹扫10分钟。将减压帽安装在小瓶上,并且将反应混合物在110℃下剧烈搅拌18小时。将其冷却至室温,然后添加1n hcl(1.0ml),随后添加etoac(1.0ml)。将各相剧烈混合,并且然后使其沉降成两层。将有机层过滤,并且通过反相制备型色谱法使用c
18
柱和含有5mm hcl溶液的1%至99%乙腈/水梯度洗脱进行纯化,得到(14s)-8-叔丁基-17-(4-叔丁基吡啶-2-基)-12,12-二甲基-7-[(1e)-2-苯基乙烯基]-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮(53.3mg,53%);1h nmr(400mhz,dmso-d6)δ12.88-12.21(bs,1h),8.56(s,1h),7.87(s,1h),7.86-7.72(m,1h),7.70(t,j=7.9hz,1h),7.62-7.50(m,3h),7.39(t,j=7.6hz,2h),7.27(t,j=7.3hz,1h),7.19(d,j=7.2hz,1h),6.94(d,j=8.5hz,1h),6.83(d,j=15.9hz,1h),5.47-5.28(m,1h),3.31(dd,j=10.2,6.6hz,2h),2.74(t,j=10.5hz,1h),2.36-2.20(m,1h),2.05-1.90(m,2h),1.86(dd,j=11.7,5.2hz,1h),1.81-1.72(m,1h),1.64(s,3h),1.63-1.56(m,1h),1.55(s,3h),1.44(s,9h),1.29(s,9h)。[注意:产物(c
41h50
n6o3s)的总数50中缺少2h。]esi-ms m/z计算值706.3665,实验值707.7(m 1)
;保留时间:2.0分钟(lc方法a)。
[3404]
实施例139:(14s)-8-叔丁基-17-(4-叔丁基吡啶-2-基)-12,12-二甲基-7-(2-苯乙基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮(化合物400)的制备
[3405][3406]
在5-ml微波小瓶中,将(14s)-8-叔丁基-17-(4-叔丁基吡啶-2-基)-12,12-二甲基-7-[(1e)-2-苯基乙烯基]-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮(18.2mg,0.02574mmol;源自峰2)悬浮于etoh(1.5ml)中,并将该混合物用氮气吹扫5分钟。添加pd(oh)2/c(4.6mg,10%w/w,0.003276mmol),并将所得混合物(2l,79.37mmol)在h2气球下在50℃下搅拌16小时。然后将其冷却至室温,并且经硅藻土过滤(meoh冲洗)。将所得液体真空蒸发,并重新进行以下反应条件:h2(2l,79.37mmol)、pd(oh)2/c(4.6mg,10%w/w,0.003276mmol)和etoh(1.5ml),在50℃下持续16小时。然后将其冷却至室温,并且经硅藻土过滤(meoh冲洗)。将所得液体真空蒸发,重新溶解于meoh(1ml)中,过滤,并通过反相制备型色谱法,使用c
18
柱和含5mm hcl溶液的1%至99%mecn/h2o梯度洗脱进行纯化,得到白色固体,(14s)-8-叔丁基-17-(4-叔丁基吡啶-2-基)-12,12-二甲基-7-(2-苯乙基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮(13.2mg,
72%);1h nmr(400mhz,dmso-d6)δ12.67-12.28(bs,1h),8.74(d,j=6.1hz,1h),8.24-8.00(m,2h),7.97-7.87(m,1h),7.75(dd,j=8.5,7.2hz,1h),7.69(s,1h),7.34(s,2h),7.33(s,2h),7.25(s,1h),7.25-7.17(m,1h),7.00(d,j=8.5hz,1h),5.58-5.47(m,1h),3.41-3.27(m,1h),3.07-2.83(m,3h),2.77-2.60(m,2h),2.42-2.31(m,1h),2.06-1.93(m,2h),1.84(dd,j=11.7,5.2hz,1h),1.80-1.72(m,1h),1.64(s,3h),1.61-1.52(m,1h),1.52(s,3h),1.52-1.44(m,1h),1.38(s,9h),1.34(s,9h)。esi-ms m/z计算值708.38214,实验值709.3(m 1)
;保留时间:2.01分钟(lc方法a)。
[3407]
实施例140:(14s)-8-叔丁基-17-(4-叔丁基吡啶-2-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮(化合物401)的制备
[3408][3409]
步骤1:(3s)-3-甲酰基吡咯烷-1-甲酸叔丁酯
[3410][3411]
将(3s)-3-(羟甲基)吡咯烷-1-甲酸叔丁酯(25g,124.22mmol)于二氯甲烷(200ml)中的溶液冷却至0℃。添加溴化钠(1.3g,12.634mmol)和碳酸氢钠(1.5g,17.856mmol)溶解于水(50ml)中的溶液。在0℃下搅拌15分钟后,添加tempo(200mg,1.2800mmol),随后缓慢逐滴添加次氯酸钠水溶液(130ml,1.1m,143.00mmol),将内部温度保持在6-8℃范围内。分离有机层,并用dcm(200ml)萃取水层。将合并的有机层用盐水(200ml)洗涤,经na2so4干燥,过滤,并浓缩,得到呈黄色油状物的粗制(3s)-3-甲酰基吡咯烷-1-甲酸叔丁酯(22.15g,85%)。1h nmr(400mhz,cdcl3)δ9.70(d,j=1.5hz,1h),3.78-3.62(m,1h),3.58-3.47(m,1h),3.42-3.30(m,2h),3.13-3.03(m,1h),2.28-2.00(m,2h),1.47(s,9h)。
[3412]
步骤2:(3r)-3-[(e)-3-乙氧基-3-氧代-丙-1-烯基]吡咯烷-1-甲酸叔丁酯
[3413][3414]
向火焰干燥的圆底烧瓶中装入2-二乙氧基磷酰基乙酸乙酯(27g,120.43mmol)和thf(350ml)。将溶液冷却至-78℃,并且然后添加nahmds于thf中的溶液(110ml,1m,110.00mmol)。将混合物在-78℃下搅拌30分钟,并且然后逐滴添加(3s)-3-甲酰基吡咯烷-1-甲酸叔丁酯(22.15g,105.61mmol)于thf(100ml)中的溶液。将混合物在-78℃下搅拌15分钟。通过添加饱和nh4cl水溶液(200ml)淬灭反应物,分离各层,并用etoac(3
×
150ml)萃取水相。将合并的有机相用盐水(200ml)洗涤,并经无水硫酸钠干燥,过滤并减压浓缩。粗物质经由硅胶柱色谱法,使用0至50%etoac/庚烷梯度进行纯化,得到呈澄清油状物的(3r)-3-[(e)-3-乙氧基-3-氧代-丙-1-烯基]吡咯烷-1-甲酸叔丁酯(22.3g,78%)。1h nmr(400mhz,cdcl3)δ6.89(dd,j=15.7,7.8hz,1h),5.88(d,j=15.6hz,1h),4.20(q,j=7.1hz,2h),3.66-3.41(m,2h),3.40-3.26(m,1h),3.21-3.08(m,1h),3.21-3.08(m,1h),3.01-2.86(m,1h),2.13-2.02(m,1h),1.85-1.72(m,1h),1.46(s,9h),1.29(t,j=7.2hz,3h)。esi-ms m/z计算值269.1627,实验值214.2(m
–
tbu 2h=m
–
55)
;保留时间:1.88分钟(lc方法e)。
[3415]
步骤3:(3s)-3-(3-乙氧基-3-氧代-丙基)吡咯烷-1-甲酸叔丁酯
[3416][3417]
将10%碳/钯(50%湿,5%w/w,2.33g,1.0947mmol)添加到(3r)-3-[(e)-3-乙氧基-3-氧代-丙-1-烯基]吡咯烷-1-甲酸叔丁酯(22.3g,82.796mmol)于甲醇(150ml)中的混合物中。将氢气鼓泡到悬浮液中持续2分钟,并且然后将反应混合物在氢气氛下搅拌20小时。将反应混合物通过硅藻土过滤,并用甲醇冲洗。将滤液真空浓缩,得到呈无色油状物的粗制(3s)-3-(3-乙氧基-3-氧代-丙基)吡咯烷-1-甲酸叔丁酯(21.7g,96%)。1h nmr(400mhz,cdcl3)δ4.19-4.07(m,2h),3.61-3.36(m,2h),3.42-3.39(m,1h),2.97-2.78(m,1h),2.39-2.27(m,2h),2.15-2.10(m,1h),2.04-1.92(m,1h),1.75-1.68(m,2h),1.55-1.36(m,10h),1.30-1.18(m,3h).esi-ms m/z计算值271.1784,实验值216.2(m
–
tbu 2h=m
–
55)
;保留时间:1.88分钟(lc方法e)。
[3418]
步骤4:(3s)-3-(3-羟丙基)吡咯烷-1-甲酸叔丁酯
[3419][3420]
在0℃下,向(3s)-3-(3-乙氧基-3-氧代-丙基)吡咯烷-1-甲酸叔丁酯(13.8g,49.331mmol)于thf(125ml)中的溶液中添加libh4于thf(67ml,2m,134.00mmol)中的溶液。将反应混合物在室温下搅拌16小时。在0℃下,将反应混合物缓慢添加到饱和nh4cl水溶液(200ml)中。用etoac(3
×
200ml)萃取产物。将合并的有机层用盐水(200ml)洗涤,经无水硫酸钠干燥,过滤并减压浓缩。粗物质经由硅胶柱色谱法,使用20至100%etoac/庚烷梯度进行纯化,得到呈澄清油状物的(3s)-3-(3-羟丙基)吡咯烷-1-甲酸叔丁酯(11g,91%)。分离的产物具有91.8%的对映异构体比率。1h nmr(400mhz,cdcl3)δ3.66(t,j=6.5hz,2h),3.61-3.36(m,2h),3.31-3.17(m,1h),2.93-2.80(m,1h),2.19-2.07(m,1h),2.03-1.96(m,1h),1.76-1.54(m,3h),1.54-1.38(m,12h).esi-ms m/z计算值229.1678,实验值252.2(m na=m 23)
;174.2(m
–
tbu 2h=m
–
55)
;保留时间:3.32分钟(lc方法f)。
[3421]
步骤5:(3s)-3-(3-氧代丙基)吡咯烷-1-甲酸叔丁酯
[3422][3423]
将(3s)-3-(3-羟丙基)吡咯烷-1-甲酸叔丁酯(2g,7.8494mmol)于二氯甲烷(20ml)中的溶液冷却至0℃。添加溴化钠(135mg,1.3120mmol)和碳酸氢钠(150mg,1.7856mmol)溶解于水(5ml)中的溶液。在0℃下搅拌15分钟后,添加tempo(45mg,0.2880mmol),随后缓慢逐滴添加次氯酸钠水溶液(9.6ml,1.1m,10.560mmol),将内部温度保持在6-8℃范围内。分离有机层,并用二氯甲烷(30ml)萃取水层。将合并的有机层用盐水(40ml)洗涤,经na2so4干燥,过滤,并浓缩,得到呈橙色油状物的粗制(3s)-3-(3-氧代丙基)吡咯烷-1-甲酸叔丁酯(1.9g,98%)。1h nmr(400mhz,cdcl3)δ9.80(s,1h),3.62-3.38(m,2h),3.33-3.20(m,1h),2.90-2.87(m,1h),2.50(t,j=7.5hz,2h),2.21-2.06(m,1h),2.06-1.95(m,1h),1.80-1.67(m,2h),1.56-1.42(m,10h)。
[3424]
步骤6:(3s)-3-[(3e)-3-叔丁基亚磺酰基亚氨基丙基]吡咯烷-1-甲酸叔丁酯
[3425][3426]
向溶解于二氯甲烷(20ml)中的(3s)-3-(3-氧代丙基)吡咯烷-1-甲酸叔丁酯(1.9g,7.9410mmol)中添加2-甲基丙烷-2-亚磺酰胺(1.5g,12.376mmol)、硫酸镁(4.8g,39.878mmol)和对甲苯磺酸吡啶鎓(145mg,0.5747mmol)。将反应混合物在室温下搅拌16小时。将反应混合物过滤,然后浓缩。粗产物通过硅胶色谱法,用0至70%etoac/庚烷梯度进行纯化,得到呈澄清油状物的(3s)-3-[(3e)-3-叔丁基亚磺酰基亚氨基丙基]吡咯烷-1-甲酸叔丁酯(2g,68%)。esi-ms m/z计算值330.1977,实验值231.2(m
–
boc 2h=m
–
99)
;保留时间:1.86分钟(lc方法e)。
[3427]
步骤7:(3s)-3-[3-(4-叔丁基-2-吡啶基)-3-(叔丁基亚磺酰基氨基)丙基]吡咯烷-1-甲酸叔丁酯
[3428][3429]
在-78℃下,将含正丁锂的己烷(2.5ml,2.5m,6.2500mmol)逐滴添加到2-溴-4-叔丁基-吡啶(1.4g,6.3428mmol)于thf(28ml)中的溶液中。将混合物在-78℃下搅拌30分钟。逐滴添加(3s)-3-[(3e)-3-叔丁基亚磺酰基亚氨基丙基]吡咯烷-1-甲酸叔丁酯(2g,5.3860mmol)于thf(6ml)中的溶液。将反应混合物在-78℃下搅拌10分钟。将反应混合物缓慢升温至室温并搅拌4小时。添加饱和nh4cl溶液(15ml)。用etoac(2
×
20ml)萃取产物。将合并的有机相用盐水(20ml)洗涤,经亚硫酸钠干燥,过滤并蒸发至干燥。粗物质通过硅胶柱色谱法,使用30至100%etoac/庚烷,然后0至20%甲醇/etoac的梯度进行纯化,得到呈黄色油状物的(3s)-3-[3-(4-叔丁基-2-吡啶基)-3-(叔丁基亚磺酰基氨基)丙基]吡咯烷-1-甲酸叔丁酯(1.12g,36%)。esi-ms m/z计算值465.3025,实验值466.2(m 1)
;保留时间:1.77分钟(lc方法e)。
[3430]
步骤8:(3s)-3-[3-氨基-3-(4-叔丁基-2-吡啶基)丙基]吡咯烷-1-甲酸叔丁酯
[3431][3432]
将碘(250mg,0.9850mmol)添加到(3s)-3-[3-(4-叔丁基-2-吡啶基)-3-(叔丁基亚磺酰基氨基)丙基]吡咯烷-1-甲酸叔丁酯(1.12g,1.9240mmol)于thf(8.2ml)和水(1.6ml)中的溶液中。将反应物在60℃下搅拌2小时。将反应物用乙酸乙酯(30ml)稀释,并且依次用5%碳酸氢钠水溶液(2
×
35ml)和10%硫代硫酸钠水溶液(2
×
35ml)和盐水(50ml)洗涤。有机相经硫酸钠干燥,过滤并蒸发至干燥,得到呈橙色油状物的(3s)-3-[3-氨基-3-(4-叔丁基-2-吡啶基)丙基]吡咯烷-1-甲酸叔丁酯(900mg,98%)。esi-ms m/z计算值361.2729,实验值362.4(m 1)
;保留时间:1.45分钟(lc方法e)。
[3433]
步骤9:(3s)-3-[3-(4-叔丁基-2-吡啶基)-3-[(6-氨磺酰基-2-吡啶基)氨基]丙基]吡咯烷-1-甲酸叔丁酯
[3434]
[3435]
向(3s)-3-[3-氨基-3-(4-叔丁基-2-吡啶基)丙基]吡咯烷-1-甲酸叔丁酯(900mg,1.8920mmol)和6-氟吡啶-2-磺酰胺(1g,5.1915mmol)于乙腈(6ml)中的溶液中添加dipea(890.40mg,1.2ml,6.8893mmol)。将反应管密封,并将混合物在120℃下搅拌16小时。将反应物在乙酸乙酯(20ml)和水(20ml)之间分配。将水相用乙酸乙酯(20ml)萃取。将合并的有机层用盐水(50ml)洗涤,经硫酸钠干燥,过滤并浓缩。粗物质在c
18
上通过反相色谱法(用5至100%mecn/水 0.1%hcooh洗脱)纯化,得到呈浅黄色固体状的(3s)-3-[3-(4-叔丁基-2-吡啶基)-3-[(6-氨磺酰基-2-吡啶基)氨基]丙基]吡咯烷-1-甲酸叔丁酯(350mg,36%)。1h nmr(400mhz,cdcl3)δ8.46(d,j=5.4hz,1h),7.52-7.48(m,1h),7.24-7.15(m,2h),6.58(d,j=8.6hz,1h),5.96-5.93(m,1h),5.18-4.85(m,2h),3.67-3.32(m,3h),3.26-3.17(m,1h),2.97-2.84(m,1h),2.82-2.69(m,1h),1.97-1.92(m,3h),1.47-1.39(m,13h),1.31(s,9h)。esi-ms m/z计算值517.2723,实验值518.2(m 1)
;保留时间:1.54分钟(lc方法e)。
[3436]
步骤10:(3s)-3-[3-[[6-[(6-叔丁基-2-氟吡啶-3-羰基)氨磺酰基]-2-吡啶基]氨基]-3-(4-叔丁基-2-吡啶基)丙基]吡咯烷-1-甲酸叔丁酯
[3437][3438]
在氮气下,向圆底烧瓶中装入6-叔丁基-2-氟-吡啶-3-甲酸(130mg,0.6592mmol)和thf(4ml)。添加1,1'-羰基二咪唑(128mg,0.7894mmol),并且将混合物在室温下在氮气下搅拌3.5小时。在单独的烧瓶中,在氮气下制备(3s)-3-[3-(4-叔丁基-2-吡啶基)-3-[(6-氨磺酰基-2-吡啶基)氨基]丙基]吡咯烷-1-甲酸叔丁酯(320mg,0.6181mmol)于thf(3ml)中的溶液,并且将其添加到活化的酸溶液中。添加1,8-二氮杂双环[5.4.0]十一碳-7-烯(305.40mg,0.3ml,2.0061mmol),并将反应混合物在氮气下在室温下搅拌3小时。减压移除溶剂,并且将所得浓稠油状物用乙酸乙酯(30ml)和水(20ml)处理。将水相用乙酸乙酯(20ml)萃取。将合并的有机层用1n hcl(20ml)洗涤并经硫酸钠干燥。粗产物在c
18
上通过反相色谱法(用5至100%乙腈/水洗脱)纯化,得到呈浅棕色固体状的(3s)-3-[3-[[6-[(6-叔丁基-2-氟-吡啶-3-羰基)氨磺酰基]-2-吡啶基]氨基]-3-(4-叔丁基-2-吡啶基)丙基]吡咯烷-1-甲酸叔丁酯(114mg,23%)。esi-ms m/z计算值696.3469,实验值697.4(m 1)
;保留时间:1.9分钟(lc方法e)。
[3439]
步骤11:6-叔丁基-n-[[6-[[1-(4-叔丁基-2-吡啶基)-3-[(3s)-吡咯烷-3-基]丙基]氨基]-2-吡啶基]磺酰基]-2-氟-吡啶-3-甲酰胺
[3440][3441]
在圆底烧瓶中,将(3s)-3-[3-[[6-[(6-叔丁基-2-氟-吡啶-3-羰基)氨磺酰基]-2-吡啶基]氨基]-3-(4-叔丁基-2-吡啶基)丙基]吡咯烷-1-甲酸叔丁酯(114mg,0.1489mmol)在室温下在dcm(2ml)和含4m hcl的二噁烷(0.7ml,2.8000mmol)中搅拌2小时。将溶剂蒸发,得到呈棕色固体状的6-叔丁基-n-[[6-[[1-(4-叔丁基-2-吡啶基)-3-[(3s)-吡咯烷-3-基]丙基]氨基]-2-吡啶基]磺酰基]-2-氟-吡啶-3-甲酰胺(盐酸盐)(110mg,105%)。esi-ms m/z计算值596.2945,实验值597.3(m 1)
;保留时间:1.4分钟(lc方法e)。
[3442]
步骤12:(14s)-8-叔丁基-17-(4-叔丁基吡啶-2-基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮(化合物401)
[3443][3444]
将6-叔丁基-n-[[6-[[1-(4-叔丁基-2-吡啶基)-3-[(3s)-吡咯烷-3-基]丙基]氨基]-2-吡啶基]磺酰基]-2-氟-吡啶-3-甲酰胺(盐酸盐)(110mg,0.1558mmol)溶解于dmso(2ml)中。添加碳酸钾(280mg,2.0260mmol)。将反应管密封,并将混合物在120℃下加热2小时。反应混合物通过反相色谱法,使用c
18
柱和5%-100%乙腈/水(含0.1%hco2h)梯度直接纯化,蒸发溶剂,得到两种非对映异构体的混合物,(133s)-266-(叔丁基)-8-(4-(叔丁基)吡啶-2-基)-5-硫杂-4,7-二氮杂-2(2,3),6(2,6)-二吡啶杂-1(1,3)-吡咯烷杂环十蕃-3-酮5,5-二氧化物(49mg,54%);1h nmr(400mhz,dmso-d6)δ8.47-8.35(m,1h),7.66-7.56(m,2h),7.50(dd,j=8.3,1.5hz,1h),7.40-7.33(m,1h),7.26-7.10(m,2h),6.88(dd,j=8.3,3.4hz,1h),6.69(dd,j=7.9,4.5hz,1h),5.41-5.26(m,1h),3.79-3.69(m,1h),3.64-3.58(m,1h),3.54-3.34(m,2h),2.61(t,j=10.3hz,1h),2.41-2.30(m,1h),2.27-2.22(m,1h),2.09-1.77(m,3h),1.72-1.49(m,2h),1.35-1.08(m,18h)。esi-ms m/z计算值576.2883,实验值577.3(m 1)
;保留时间:4.07分钟和保留时间:4.22分钟(lc方法f)。
[3445]
实施例141:(14s)-8-叔丁基-17-(4-叔丁基吡啶-2-基)-12,12-二甲基-7-苯基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮(化合物402)的制备
[3446][3447]
在1打兰小瓶中,将苯基硼酸(10mg,0.08201mmol)、(14s)-7-溴-8-叔丁基-17-(4-叔丁基吡啶-2-基)-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮(20.4mg,0.02835mmol;源自于峰2)、pd(pph3)4(3.5mg,0.003029mmol)和na2co3水溶液(100μl,2.0m,0.2000mmol)与二噁烷(200μl)混合在一起。在超声处理下,将所得混合物在氮气下吹扫10分钟。将减压帽安装在小瓶上,并且将反应混合物在110℃下剧烈搅拌21小时。将其冷却至室温,然后添加1n hcl(0.5ml),随后添加etoac(0.5ml)。将各相剧烈混合,并且然后使其沉降成两层。将有机层过滤并通过反相制备型色谱法,使用c
18
柱和含5mm hcl的1%至99%乙腈/水梯度洗脱进行纯化,得到白色固体,(14s)-8-叔丁基-17-(4-叔丁基吡啶-2-基)-12,12-二甲基-7-苯基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮(7.2mg,37%);1h nmr(400mhz,dmso-d6)δ12.70-12.04(bs,1h),8.73-8.56(m,1h),8.06-7.82(m,2h),7.81-7.63(m,2h),7.45-7.35(m,3h),7.34(s,1h),7.33-7.24(m,2h),7.20(d,j=7.3hz,1h),6.96(d,j=8.5hz,1h),5.50-5.35(m,1h),3.38-3.28(m,1h),2.71(t,j=10.6hz,1h),2.43-2.30(m,1h),2.06-1.92(m,2h),1.88(dd,j=11.8,5.2hz,1h),1.78(dd,j=14.3,5.3hz,1h),1.70(s,3h),1.61(d,j=12.5hz,1h),1.56(s,3h),1.54-1.43(m,1h),1.31(s,9h),1.15(s,9h)。[注意:在3.38-3.28处的1h多重峰完全隐藏在水峰下;仅在cosy中可见。]esi-ms m/z计算值680.3508,实验值681.4(m 1)
;保留时间:1.94分钟(lc方法a)。
[3448]
实施例142:(18s)-21-(4-叔丁基吡啶-2-基)-10-(3,3-二甲基丁氧基)-16,16-二甲基-2λ
6-硫杂-3,13,15,22,27-五氮杂五环[21.3.1.115,18.05,14.07,12]二十八碳-1(27),5(14),6,8,10,12,23,25-八烯-2,2,4-三酮(化合物403),和(18s)-21-(4-叔丁基吡啶-2-基)-10-(3,3-二甲基丁氧基)-16,16-二甲基-2λ
6-硫杂-3,13,15,22,27-五氮杂五环[21.3.1.115,18.05,14.07,12]二十八碳-1(27),5(14),6,8,10,12,23,25-八烯-2,2,4-三酮(化合物404)的制备
[3449]
步骤1:2-氯-7-羟基喹啉-3-甲醛
[3450][3451]
将含2-氯7-羟基喹啉-3-甲醛(5.0g,22.56mmol)的dcm(200ml)冷却至-78℃,并且缓慢添加三溴化硼(28.2g,0.113mol)。将反应溶液升温至室温并搅拌2天。将反应物冷却至0℃,然后添加1n naoh水溶液,直到ph达到约5。添加饱和碳酸氢钠水溶液,直到ph达到7。然后,减压移除溶剂,并将剩余的水溶液用2-甲基-thf(4
×
150ml)萃取。合并的有机层经硫酸
钠干燥,过滤并浓缩。残余物通过反相hplc,使用20%至100%水/乙腈(0.1%tfa改性剂)纯化,得到呈白色固体状的2-氯-7-羟基喹啉-3-甲醛(2.25g,48%)。1h nmr(250mhz,dmso-d6)δ:11.10(s,1h),10.31(s,1h),8.83(s,1h),8.14(d,j=8.8hz,1h),7.29(dd,j=2.0,8.8hz,1h),7.23(s,1h)。esi-ms m/z计算值207.0,实验值208.1(m 1)
。保留时间:2.09分钟(lc方法p)。
[3452]
步骤2:7-(3,3-二甲基丁氧基)-2-氯喹啉-3-甲醛
[3453][3454]
将2-氯-7-羟基喹啉-3-甲醛(2.25g,10.88mmol)、1-溴-3,3-二甲基丁烷(2.34g,14.15mmol)和碳酸钾(3.46g,25.02mmol)混合于dmf(50ml)中。将所得溶液在70℃下搅拌3小时,并且然后冷却至室温。添加水(150ml),并用乙酸乙酯(3
×
200ml)萃取溶液。将合并的有机层用盐水(50ml)洗涤,经硫酸镁干燥,过滤并减压浓缩。残余物通过硅胶色谱法,使用0至100%dcm/己烷纯化,得到呈白色固体状的7-(3,3-二甲基丁氧基)-2-氯喹啉-3-甲醛(2.40g,76%)。1h nmr(250mhz,cdcl3)δ10.51(s,1h),8.66(s,1h),7.83(d,j=9.0hz,1h),7.37(d,j=2.5hz,1h),7.25(dd,j=2.5,9.0hz,1h),4.20(t,j=7.3hz,2h),1.82(t,j=7.3hz,2h),1.02(s,9h)。esi-ms m/z计算值291.1,实验值292.1(m h)
;保留时间:3.94分钟(lc方法p)。
[3455]
步骤3:7-(3,3-二甲基丁氧基)-2-氯喹啉-3-甲酸
[3456][3457]
向7-(3,3-二甲基丁氧基)-2-氯喹啉-3-甲醛(2.40g,8.25mmol)于叔丁醇(116ml)中的悬浮液中添加2-甲基-2-丁烯(6.93g,99mmol),随后添加亚氯酸钠(4.98g,55.28mmol)和单水合磷酸二氢钠(6.26g,45.38mmol)于水(39ml)中的水溶液。将所得溶液在室温下搅拌1小时。然后,减压移除所有有机溶剂。向剩余的水溶液中添加1n hcl,直到ph值为约4。将溶液过滤,并将所得固体用水洗涤,得到呈灰白色固体状的7-(3,3-二甲基丁氧基)-2-氯喹啉-3-甲酸(2.5g,99%)。1h nmr(250mhz,dmso-d6)δ8.85(s,1h),8.07(d,j=9.0hz,1h),7.45(s,1h),7.33(dd,j=1.8,9.0hz,1h),4.23(t,j=7.3hz,2h),1.75(t,j=7.3hz,2h),1.00(s,9h)。esi-ms m/z计算值307.1,实验值308.2(m h)
。保留时间:3.35分钟(lc方法p)。
[3458]
步骤4:(4s)-4-[3-(4-叔丁基-2-吡啶基)-3-[[6-[[2-氯-7-(3,3-二甲基丁氧基)喹啉-3-羰基]氨磺酰基]-2-吡啶基]氨基]丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯
[3459]
[3460]
在100-ml圆底烧瓶中,将2-氯-7-(3,3-二甲基丁氧基)喹啉-3-甲酸(1.1871g,3.857mmol)溶解于thf(20ml)中,向其添加cdi(1.1795g,7.274mmol)。将所得混合物在室温下搅拌17小时。此后,添加(4s)-4-[3-(4-叔丁基-2-吡啶基)-3-[(6-氨磺酰基-2-吡啶基)氨基]丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(2.0292g,3.465mmol)和dbu(2.0ml,13.37mmol),并将所得混合物在室温下搅拌5.5小时。此后,将混合物倒入0.1n hcl水溶液(100ml)中,并用乙酸乙酯(3
×
100ml)萃取。将合并的有机萃取物用h2o(100ml)和盐水(100ml)洗涤,然后经na2so4干燥,过滤并真空蒸发。所得粉红色泡沫状物通过硅胶色谱法(120g二氧化硅),使用0-70%etoac/己烷梯度洗脱进行纯化,得到白色泡沫状物,(4s)-4-[3-(4-叔丁基-2-吡啶基)-3-[[6-[[2-氯-7-(3,3-二甲基丁氧基)喹啉-3-羰基]氨磺酰基]-2-吡啶基]氨基]丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(1.9468g,65%)esi-ms m/z计算值834.3905,实验值835.4(m 1)
;保留时间:2.08分钟(lc方法a)。
[3461]
步骤5:(18s)-21-(4-叔丁基吡啶-2-基)-10-(3,3-二甲基丁氧基)-16,16-二甲基-2λ
6-硫杂-3,13,15,22,27-五氮杂五环[21.3.1.115,18.05,14.07,12]二十八碳-1(27),5(14),6,8,10,12,23,25-八烯-2,2,4-三酮(化合物403),(18s)-21-(4-叔丁基吡啶-2-基)-10-(3,3-二甲基丁氧基)-16,16-二甲基-2λ
6-硫杂-3,13,15,22,27-五氮杂五环[21.3.1.115,18.05,14.07,12]二十八碳-1(27),5(14),6,8,10,12,23,25-八烯-2,2,4-三酮(化合物404)
[3462][3463]
阶段1:在100-ml圆底烧瓶中,将(4s)-4-[3-(4-叔丁基-2-吡啶基)-3-[[6-[[2-氯-7-(3,3-二甲基丁氧基)喹啉-3-羰基]氨磺酰基]-2-吡啶基]氨基]丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(1.9468g,2.237mmol)溶解于dcm(20ml)中。添加tfa(5.0ml,64.90mmol),并使所得溶液在室温下静置14小时。然后将混合物真空蒸发,溶解于二噁烷(3ml)并再次真空蒸发,得到n-[[6-[[1-(4-叔丁基-2-吡啶基)-3-[(3s)-5,5-二甲基吡咯烷-3-基]丙基]氨基]-2-吡啶基]磺酰基]-2-氯-7-(3,3-二甲基丁氧基)喹啉-3-甲酰胺(三氟乙酸盐)(3g,》100%)。
[3464]
阶段2:在100-ml圆底烧瓶中,将来自步骤1的粗产物溶解于nmp(20ml)中,向其中添加k2co3(3.1519g,22.81mmol)。将所得混合物用氮气冲洗,然后在150℃下搅拌24小时。然后将反应混合物冷却至室温,用1n hcl(50ml)淬灭,并用etoac(3
×
50ml)萃取。将合并的有机萃取物用h2o(100ml)和盐水(100ml)洗涤,然后经na2so4干燥,过滤并真空蒸发。通过硅胶色谱法,使用0至70%etoac/己烷梯度洗脱进行纯化,得到都不纯的3批产物(大致相等量,约160mg)。将其通过反相制备型色谱法,使用c
18
柱和含5mm hcl的1%至99%mecn/h2o梯度洗脱进行再纯化,得到2种分离的产物:
[3465]“峰1”:在反相uplc上较早的保留时间,浅黄色固体:(18s)-21-(4-叔丁基吡啶-2-基)-10-(3,3-二甲基丁氧基)-16,16-二甲基-2λ
6-硫杂-3,13,15,22,27-五氮杂五环
[21.3.1.115,18.05,14.07,12]二十八碳-1(27),5(14),6,8,10,12,23,25-八烯-2,2,4-三酮(187.6mg,12%);1h nmr(400mhz,dmso-d6)δ13.00-12.59(bs,1h),8.69(d,j=6.2hz,1h),8.18-8.06(m,1h),8.02(s,2h),7.94-7.83(m,1h),7.78(t,j=8.0hz,1h),7.70(d,j=8.9hz,1h),7.44(d,j=7.2hz,1h),7.02(d,j=8.5hz,1h),6.98-6.89(m,1h),6.83(dd,j=8.8,2.4hz,1h),5.07-4.85(m,1h),4.12(td,j=7.4,2.1hz,2h),3.52-3.39(m,1h),3.00-2.76(m,1h),2.72-2.58(m,1h),2.38-2.24(m,1h),2.15-2.02(m,1h),1.89(dd,j=11.6,5.4hz,1h),1.85-1.73(m,1h),1.70(t,j=7.1hz,2h),1.63(s,3h),1.60(s,3h),1.49(t,j=11.5hz,1h),1.31(s,9h),1.22-1.09(m,1h),0.98(s,9h)。esi-ms m/z计算值698.36145,实验值699.5(m 1)
;保留时间:1.64分钟(lc方法a)。
[3466]“峰2”:在反相uplc上较晚的保留时间,浅黄色固体:(18s)-21-(4-叔丁基吡啶-2-基)-10-(3,3-二甲基丁氧基)-16,16-二甲基-2λ
6-硫杂-3,13,15,22,27-五氮杂五环[21.3.1.115,18.05,14.07,12]二十八碳-1(27),5(14),6,8,10,12,23,25-八烯-2,2,4-三酮(137.3mg,9%);1h nmr(400mhz,dmso-d6)δ12.95-12.37(bs,1h),8.72-8.54(m,1h),8.25(s,1h),8.08-7.82(m,2h),7.82-7.60(m,3h),7.22(d,j=7.1hz,1h),7.01-6.89(m,2h),6.84(dd,j=8.8,2.4hz,1h),5.60-5.37(m,1h),4.19-4.08(m,2h),3.60-3.34(m,1h),2.75(t,j=10.2hz,1h),2.42-2.27(m,1h),2.09-1.94(m,2h),1.88(dd,j=11.8,5.2hz,1h),1.84-1.75(m,1h),1.75(s,3h),1.72(t,j=7.1hz,2h),1.66-1.55(m,1h),1.60(s,3h),1.55-1.42(m,1h),1.32(s,9h),0.99(s,9h)。esi-ms m/z计算值698.36145,实验值699.6(m 1)
;保留时间:1.75分钟(lc方法a)。
[3467]
实施例143:(14s)-8-叔丁基-12,12-二甲基-17-[(1e)-2-苯基乙烯基]-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮(化合物405)的制备
[3468][3469]
步骤1:(4s)-4-[3-(叔丁基亚磺酰基氨基)戊-4-烯基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯
[3470][3471]
在-78℃下,向(4s)-4-[(3e)-3-叔丁基亚磺酰基亚氨基丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(6g,16.735mmol)于thf(60.000ml)中的溶液中逐滴添加乙烯基溴化镁于thf(34ml,1m,34.000mmol)中的溶液。将反应物在-78℃下搅拌30分钟,并且然后在3小时内缓慢升温至室温。添加饱和nh4cl水溶液(50ml),并用etoac(3
×
50ml)萃取产物。将合并的有机层用盐水(50ml)洗涤,经硫酸钠干燥,过滤并减压浓缩。粗产物通过硅胶色谱法(dcm/meoh,0至20%)纯化,得到呈黄色油状物的(4s)-4-[3-(叔丁基亚磺酰基氨基)戊-4-烯基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(6.05g,91%)。esi-ms m/z计算值386.2603,实验值387.2(m 1)
;保留时间:1.976分钟(lc方法e)。
[3472]
步骤2:(4s)-4-(3-氨基戊-4-烯基)-2,2-二甲基吡咯烷-1-甲酸叔丁酯
[3473][3474]
向(4s)-4-[3-(叔丁基亚磺酰基氨基)戊-4-烯基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(6.5g,16.814mmol)于thf(55ml)和水(8.6ml)中的溶液中添加碘(1.3g,0.2637ml,5.1220mmol),并将混合物在50℃下搅拌18小时。将反应混合物冷却至室温并用dcm(3
×
25ml)萃取。将合并的有机层用饱和nahco3水溶液(50ml)和10%硫代硫酸钠(50ml)洗涤。将合并的有机层用盐水(50ml)洗涤,经硫酸钠干燥,过滤并减压浓缩,得到(4s)-4-(3-氨基戊-4-烯基)-2,2-吡咯烷-1-甲酸叔丁酯。esi-ms m/z计算值282.23074,实验值283.4(m 1)
;保留时间:1.37分钟(lc方法e)。
[3475]
步骤3:(4s)-2,2-二甲基-4-[3-[(6-氨磺酰基-2-吡啶基)氨基]戊-4-烯基]吡咯烷-1-甲酸叔丁酯
[3476][3477]
向(4s)-4-(3-氨基戊-4-烯基)-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(4.75g,16.819mmol)和6-氟吡啶-2-磺酰胺(4.5g,25.544mmol)于乙腈(30ml)中的溶液中添加dipea(7.6426g,10.3ml,59.134mmol)。将混合物在120℃下搅拌48小时。然后将反应混合物
冷却至室温,并在乙酸乙酯(10ml)和水(10ml)之间分配。将水相用乙酸乙酯(2
×
40ml)萃取。将合并的有机层用盐水(40ml)洗涤,经硫酸钠干燥,过滤并浓缩,得到粗产物。粗物质通过反相色谱法,用5%至80%meoh/h2o( 0.1%甲酸作为改性剂)梯度洗脱进行纯化,得到呈米色固体状的(4s)-2,2-二甲基-4-[3-[(6-氨磺酰基-2-吡啶基)氨基]戊-4-烯基]吡咯烷-1-甲酸叔丁酯(2.54g,33%)。esi-ms m/z计算值438.2301,实验值383.2(m
–
tbu 2h=m
–
55)
;保留时间:4.28分钟(lc方法f)。
[3478]
步骤4:(4s)-4-[3-[[6-[(6-叔丁基-2-氟-吡啶-3-羰基)氨磺酰基]-2-吡啶基]氨基]戊-4-烯基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯
[3479][3480]
在100-ml圆底烧瓶中,将6-叔丁基-2-氟-吡啶-3-甲酸(2.8562g,14.48mmol)溶解于thf(50ml)中,向其中添加cdi(3.5552g,21.93mmol)。将所得混合物在室温下搅拌14小时。此后,添加(4s)-2,2-二甲基-4-[3-[(6-氨磺酰基-2-吡啶基)氨基]戊-4-烯基]吡咯烷-1-甲酸叔丁酯(4.4g,9.681mmol)和dbu(6ml,40.12mmol),并将所得混合物在室温下搅拌6小时。此后,将混合物倒入0.1n hcl水溶液(80ml)中,并用乙酸乙酯(3
×
80ml)萃取。将合并的有机萃取物用h2o(100ml)和盐水(100ml)洗涤,然后经na2so4干燥,过滤并真空蒸发。通过硅胶色谱法(220g二氧化硅),使用0至70%etoac/己烷梯度洗脱进行纯化,得到白色泡沫(4s)-4-[3-[[6-[(6-叔丁基-2-氟-吡啶-3-羰基)氨磺酰基]-2-吡啶基]氨基]戊-4-烯基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(3.9345g,66%)esi-ms m/z计算值617.30475,实验值618.5(m 1)
;保留时间:2.19分钟和2.21分钟(lc方法a)。
[3481]
步骤5:(14s)-8-叔丁基-17-乙烯基-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮,(14s)-8-叔丁基-17-乙烯基-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮
[3482][3483]
阶段1:在100-ml圆底烧瓶中,将(4s)-4-[3-[[6-[(6-叔丁基-2-氟-吡啶-3-羰基)氨磺酰基]-2-吡啶基]氨基]戊-4-烯基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(3.9345g,6.369mmol)溶解于dcm(30ml)中。添加tfa(5ml,64.90mmol),并将所得溶液在室温下搅拌12小时。然后将混合物真空蒸发,用二噁烷稀释,并再次真空蒸发。这得到棕色油状物,6g(>100%产率)。
[3484]
阶段2:在100-ml圆底烧瓶中,将来自步骤1的粗产物溶解于nmp(40ml)中,向其中添加k2co3(9.123g,66.01mmol)。将所得混合物用氮气冲洗,然后在150℃下搅拌27小时。在冷却至室温之后,将所得混合物倒入1n hcl(50ml),然后用etoac(3
×
50ml)萃取。将合并的有机萃取物用h2o(2
×
50ml)和盐水(50ml)洗涤,然后经na2so4干燥,过滤并真空蒸发。通过硅胶色谱法纯化若干次,得到两种单独的产物。
[3485]“峰1”,较早自二氧化硅柱洗脱:(14s)-8-叔丁基-17-乙烯基-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮(691.0mg,22%);1h nmr(400mhz,dmso-d6)δ12.30(s,1h),7.59(dd,j=8.5,7.3hz,1h),7.45(d,j=7.9hz,1h),7.37(d,j=7.6hz,1h),7.19(d,j=7.3hz,1h),6.75(d,j=8.5hz,1h),6.62(d,j=7.9hz,1h),6.04(dt,j=17.2,9.1hz,1h),5.19(d,j=17.3hz,1h),5.05(d,j=10.3hz,1h),4.28-4.01(m,1h),3.21-3.07(m,1h),3.06-2.88(m,1h),2.31-2.19(m,1h),2.19-1.98(m,1h),1.84(dd,j=11.8,5.7hz,1h),1.76-1.64(m,1h),1.58(s,3h),1.58-1.52(m,1h),1.52(s,3h),1.52-1.43(m,1h),1.27(s,9h),1.16-1.06(m,1h)。esi-ms m/z计算值497.24606,实验值498.2(m 1)
;保留时间:2.06分钟(lc方法a)。
[3486]“峰2”,较晚自二氧化硅柱洗脱:(14s)-8-叔丁基-17-乙烯基-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮(798.1mg,25%);1h nmr(400mhz,dmso-d6)δ12.49(s,1h),7.66-7.52(m,2h),7.14(d,j=8.9hz,1h),7.07(d,j=7.2hz,1h),6.78(d,j=8.4hz,1h),6.63(d,j=8.0hz,1h),5.84(ddd,j=17.1,10.2,4.3hz,1h),5.14(dt,j=17.2,1.8hz,1h),4.94(dt,j=10.2,1.8hz,1h),4.70-4.54(m,1h),3.07(dd,j=10.3,6.8hz,1h),2.68(t,j=10.3hz,1h),2.22-2.07(m,1h),1.81(dd,j=11.7,5.2hz,1h),1.69-1.65(m,2h),1.62(s,3h),1.62-1.48(m,2h),1.48(s,3h),1.41-1.27(m,1h),1.27(s,9h)。esi-ms m/z计算值497.24606,实验值498.2(m 1)
;保留时间:2.07分钟(lc方法a)。
[3487]
步骤6:(14s)-8-叔丁基-12,12-二甲基-17-[(1e)-2-苯基乙烯基]-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮(化合物405)
[3488][3489]
在1打兰小瓶中,将峰2(14s)-8-叔丁基-17-乙烯基-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮(30mg,0.06028mmol)溶解于dce(500μl)中,向其中添加苯乙烯(20μl,0.1746mmol)和hoveyda-grubbs第2代催化剂(2.0mg,0.003192mmol)。将所得混合物在氮气气氛下在室温下搅拌17.5小时,然后在55℃下搅拌44小时。然后将其冷却至室温,然后添加
第二份hoveyda-grubbs第2代催化剂(2.0mg,0.003192mmol)。将所得混合物在氮气气氛下在55℃下搅拌28小时。将其冷却至室温,并且通过短硅藻土管和二氧化硅过滤(用dcm冲洗)。真空蒸发,然后通过反相制备型色谱法,使用c
18
柱和含5mm hcl溶液的1%至99%mecn/h2o梯度洗脱进行纯化,得到(14s)-8-叔丁基-12,12-二甲基-17-[(1e)-2-苯基乙烯基]-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮(2.6mg,8%);1h nmr(400mhz,dmso-d6)δ12.51(s,1h),7.63(dd,j=8.5,7.2hz,1h),7.61(d,j=8.0hz,1h),7.40-7.33(m,2h),7.32-7.23(m,3h),7.22-7.16(m,1h),7.09(d,j=7.2hz,1h),6.83(d,j=8.4hz,1h),6.65(d,j=8.0hz,1h),6.50(d,j=15.9hz,1h),6.30(dd,j=15.9,4.8hz,1h),4.86-4.74(m,1h),3.12(dd,j=10.3,6.7hz,1h),2.71(t,j=10.5hz,1h),2.25-2.10(m,1h),1.83(dd,j=11.8,5.2hz,1h),1.78-1.65(m,3h),1.64(s,3h),1.55(t,j=12.5hz,1h),1.50(s,3h),1.44-1.35(m,1h),1.28(s,9h);esi-ms m/z计算值573.27734,实验值574.3(m 1)
;保留时间:2.26分钟(lc方法a)。
[3490]
实施例144:(14s)-8-叔丁基-12,12-二甲基-17-[(1e)-2-(吡啶-3-基)乙烯基]-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮(化合物406)的制备
[3491][3492]
在1打兰小瓶中,将峰2(14s)-8-叔丁基-17-乙烯基-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮(60mg,0.1206mmol)溶解于mecn(1.5ml)中,向其中添加3-溴吡啶(39.1mg,0.2475mmol)、pd(oac)2(3.0mg,0.01336mmol)、p(邻甲苯基)3(3.0mg,0.009857mmol)和et3n(50μl,0.3587mmol)。将所得混合物用氮气流吹扫5分钟,并且然后在80℃下在氮气下搅拌22.5小时。然后将其冷却至室温,用meoh(1ml)稀释,过滤,并且通过反相制备型色谱法,使用c
18
柱和含5mm hcl溶液的1%至70%mecn/h2o梯度洗脱进行纯化,得到(14s)-8-叔丁基-12,12-二甲基-17-[(1e)-2-(吡啶-3-基)乙烯基]-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮(盐酸盐)(31.8mg,43%);1h nmr(400mhz,dmso-d6)δ12.52(s,1h),8.91(d,j=2.1hz,1h),8.72-8.62(m,1h),8.57-8.41(m,1h),7.89(dd,j=8.2,5.4hz,1h),7.66(dd,j=8.5,7.3hz,1h),7.61(d,j=8.0hz,1h),7.39(d,j=8.4hz,1h),7.13(d,j=7.2hz,1h),6.87(d,j=8.5hz,1h),6.79(dd,j=16.0,4.2hz,1h),6.70-6.59(m,2h),4.90-4.79(m,1h),3.10(dd,j=10.3,6.7hz,1h),2.70(t,j=10.3hz,1h),2.25-2.11(m,1h),1.84(dd,j=11.8,5.3hz,1h),1.79-1.67(m,3h),1.65(s,3h),1.56(t,j=12.3hz,1h),1.50(s,3h),1.45-1.34(m,1h),1.28(s,9h)。esi-ms m/z计算值574.2726,实验值575.2(m 1)
;保留时间:1.62分钟(lc方法a)。
m/z计算值451.2869,实验值452.4(m 1)
;保留时间:1.55分钟和1.58分钟(lc方法e)。
[3498]
步骤2:(4s)-4-[3-氨基-4-(2-吡啶基)丁基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯
[3499][3500]
将碘(3g,11.820mmol)添加到(4s)-4-[3-(叔丁基亚磺酰基氨基)-4-(2-吡啶基)丁基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(11.5g,24.392mmol)于thf(80ml)和水(17ml)中的溶液中。将反应物在60℃下搅拌2小时。将反应物用乙酸乙酯(125ml)稀释,并且依次用5%碳酸氢钠水溶液(2
×
125ml)、10%硫代硫酸钠水溶液(2
×
125ml)和盐水(150ml)洗涤。有机相经硫酸钠干燥,过滤并蒸发至干燥,得到呈橙色油状物的粗制(4s)-4-[3-氨基-4-(2-吡啶基)丁基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(8.33g,80%)。esi-ms m/z计算值347.25726,实验值348.4(m 1)
;保留时间:1.37分钟(lc方法e)。
[3501]
步骤3:(4s)-2,2-二甲基-4-[4-(2-吡啶基)-3-[(6-氨磺酰基-2-吡啶基)氨基]丁基]吡咯烷-1-甲酸叔丁酯
[3502][3503]
向(4s)-4-[3-氨基-4-(2-吡啶基)丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(8.3g,19.586mmol)和6-氟吡啶-2-磺酰胺(11g,62.440mmol)于乙腈(65ml)中的溶液中添加dipea(11.130g,15ml,86.117mmol)。将反应管密封,并将混合物在120℃下搅拌16小时。将反应物在乙酸乙酯(120ml)和水(120ml)之间分配。将水相用乙酸乙酯(2
×
100ml)萃取。将合并的有机层用盐水(150ml)洗涤,经硫酸钠干燥,过滤并浓缩。粗产物在c
18
上通过反相色谱法(用5%至100%mecn/水洗脱)纯化。将产物级分合并。蒸发mecn,并用乙酸乙酯(2
×
100ml)萃取水溶液。将合并的有机层用盐水(100ml)洗涤,经硫酸钠干燥,过滤并浓缩,得到呈浅棕色固体状的(4s)-2,2-二甲基-4-[4-(2-吡啶基)-3-[(6-氨磺酰基-2-吡啶基)氨基]丁基]吡咯烷-1-甲酸叔丁酯(5.2g,50%)。1h nmr(400mhz,dmso-d6)δ8.50-8.43(m,1h),7.66(t,j=7.6hz,1h),7.54-7.47(m,1h),7.33(d,j=7.6hz,1h),7.21-7.16(m,1h),7.11(br.s.,2h),6.94(d,j=6.8hz,2h),6.61(d,j=8.3hz,1h),4.28(br.s.,1h),3.52-3.40(m,1h),3.05-3.00(m,1h),2.88-2.83(m,1h),2.76-2.65(m,1h),2.01-1.98(m,1h),1.86-1.71(m,1h),1.58-1.43(m,2h),1.41-1.24(m,15h),1.23-1.14(m,3h)。esi-ms m/z计算值503.25662,实验值504.3(m 1)
;保留时间:2.77分钟(lc方法f)。
[3504]
步骤4:(4s)-4-[3-[[6-[(6-叔丁基-2-氟-吡啶-3-羰基)氨磺酰基]-2-吡啶基]氨基]-4-(2-吡啶基)丁基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯
[3505][3506]
在20-ml小瓶中,将6-叔丁基-2-氟-吡啶-3-甲酸(220mg,1.116mmol)与dcm(2.0ml)混合并冷却至0℃,向其中添加dmf(10μl,0.1291mmol)和草酰氯(200μl,2.293mmol)。将所得溶液在4小时内升温至室温。在验证确实形成酰氯后(使用吗啉将少量样品淬灭),真空蒸发混合物。
[3507]
单独地,在100-ml圆底烧瓶中,制备(4s)-2,2-二甲基-4-[4-(2-吡啶基)-3-[(6-氨磺酰基-2-吡啶基)氨基]丁基]吡咯烷-1-甲酸叔丁酯(280mg,0.5354mmol)和dipea(700μl,4.019mmol)于dcm(3.0ml)中的溶液。将上述生成的粗制酰氯溶解于dcm(1.5ml)中并添加到磺酰胺溶液中。将所得混合物在室温下搅拌16小时。然后将其用0.5n hcl(10ml)淬灭,并用etoac(3
×
10ml)萃取。将合并的有机萃取物用h2o(10ml)和盐水(10ml)洗涤,然后经na2so4干燥,过滤并真空蒸发。通过硅胶色谱法,使用0至100%etoac/己烷梯度洗脱进行纯化,得到呈粉红色泡沫状的不纯(约60%纯)产物:(4s)-4-[3-[[6-[(6-叔丁基-2-氟-吡啶-3-羰基)氨磺酰基]-2-吡啶基]氨基]-4-(2-吡啶基)丁基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(246.7mg,43%);esi-ms m/z计算值682.33124,实验值683.3(m 1)
;保留时间:1.71分钟(lc方法a)。
[3508]
步骤5:(14s)-8-叔丁基-12,12-二甲基-17-[(吡啶-2-基)甲基]-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮(化合物407),(14s)-8-叔丁基-12,12-二甲基-17-[(吡啶-2-基)甲基]-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮(化合物408)
[3509][3510]
阶段1:在20-ml小瓶中,将(4s)-4-[3-[[6-[(6-叔丁基-2-氟-吡啶-3-羰基)氨磺酰基]-2-吡啶基]氨基]-4-(2-吡啶基)丁基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(246.7mg,0.2312mmol)溶解于dcm(4ml)中。添加tfa(500μl,6.490mmol),并将所得溶液在室温下搅拌21小时。然后将混合物真空蒸发,用二噁烷稀释,并再次真空蒸发。这得到棕色油状物,约600mg(>100%产率)。
[3511]
阶段2:在20-ml微波小瓶中,将来自步骤1的粗产物溶解于nmp(4ml)中,向其中添加k2co3(396.2mg,2.867mmol)。将所得混合物用氮气冲洗,然后在150℃下搅拌21小时。在冷
却至室温之后,将所得混合物用1n hcl(5ml)淬灭,然后用etoac(3
×
5ml)萃取。将合并的有机萃取物用h2o(2
×
5ml)和盐水(5ml)洗涤,然后经na2so4干燥,过滤并真空蒸发,得到浅棕色油状物。通过反相制备型色谱法,使用c
18
柱和含有5mm hcl溶液的1%至70%mecn/h2o梯度洗脱进行纯化,得到2种产物:第一洗脱产物(“峰1”)是纯的。第二洗脱产物(“峰2”)略微不纯(约90%纯度),并因此通过反相制备型色谱法再纯化。
[3512]“峰1”,在反相uplc上较早的保留时间,(14s)-8-叔丁基-12,12-二甲基-17-[(吡啶-2-基)甲基]-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮(15.0mg,12%)1h nmr(400mhz,dmso-d6)δ12.63-12.11(bs,1h),8.76(d,j=5.8hz,1h),8.45-8.33(m,1h),7.85(t,j=6.8hz,1h),7.83-7.71(m,1h),7.56(t,j=7.9hz,1h),7.51-7.43(m,1h),7.43-7.33(m,1h),7.24-7.09(m,1h),6.65(d,j=3.6hz,1h),6.63(d,j=3.1hz,1h),3.46-3.31(m,1h),3.22-3.00(m,1h),3.00-2.75(m,1h),2.32-2.20(m,1h),1.84(dd,j=11.8,5.8hz,1h),1.75-1.65(m,2h),1.58(s,3h),1.53(s,3h),1.52-1.45(m,1h),1.39-1.28(m,1h),1.27(s,9h),1.26-1.15(m,1h)。[注意:产物(c
30h38
n6o3s)中的总数38中缺少2h,很可能隐藏在较宽的水信号下。]esi-ms m/z计算值562.2726,实验值563.2(m 1)
;保留时间:1.47分钟(lc方法a)。
[3513]“峰2”,在反相uplc上较晚的保留时间,(14s)-8-叔丁基-12,12-二甲基-17-[(吡啶-2-基)甲基]-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮(11.0mg,8%);1h nmr(400mhz,dmso-d6)δ12.39-11.85(bs,1h),8.60(dd,j=5.9,1.7hz,1h),8.28(td,j=7.8,1.6hz,1h),7.87(d,j=8.0hz,1h),7.77-7.65(m,2h),7.46(dd,j=8.4,7.2hz,1h),7.16(d,j=8.9hz,1h),6.88(d,j=7.1hz,1h),6.68(d,j=7.9hz,1h),6.58(d,j=8.4hz,1h),4.83-4.67(m,1h),3.47-3.37(m,2h),3.35(dd,j=13.5,3.6hz,1h),2.93(dd,j=13.4,10.5hz,1h),2.59-2.50(m,1h),2.20-2.06(m,1h),1.81(dd,j=11.4,5.1hz,1h),1.78-1.71(m,1h),1.71-1.66(m,1h),1.65(s,3h),1.56-1.48(m,1h),1.48(s,3h),1.29(s,9h),1.28-1.21(m,1h);esi-ms m/z计算值562.2726,实验值563.2(m 1)
;保留时间:1.64分钟(lc方法a)。
[3514]
实施例146:(20r)-4-叔丁基-17-(4-叔丁基吡啶-2-基)-10λ
6-硫杂-1,3,9,16,25-五氮杂四环[18.3.1.111,15.02,7]二十五碳-2,4,6,11,13,15(25)-六烯-8,10,10-三酮(化合物409)的制备
[3515][3516]
步骤1:(3s)-3-甲酰基哌啶-1-甲酸叔丁酯
[3517]
[3518]
向配备有温度探针和加料漏斗的三颈100-ml烧瓶中装入(3s)-3-(羟甲基)哌啶-1-甲酸叔丁酯(10g,46.449mmol)于二氯甲烷(80ml)中的溶液,并将混合物冷却至0℃。将溴化钠(500mg,4.8594mmol)和碳酸氢钠(600mg,7.1423mmol)的溶液溶解于水(20ml)中并添加到反应烧瓶中。在0℃下搅拌15分钟后,添加tempo(75mg,0.4800mmol),随后缓慢地逐滴添加次氯酸钠水溶液(50ml,1.1m,55.000mmol)持续1小时(将内部温度保持在6-8℃范围内)。将混合物在0℃下搅拌10分钟,并且然后添加etoh(10ml)。在2分钟后,在0℃下分离各层(通过停止搅拌)。分离有机层,并用二氯甲烷(3
×
500ml)萃取水层。将合并的有机层用盐水(3
×
50ml)洗涤,经na2so4干燥,过滤,并浓缩,得到呈浅橙色油状物的粗制(3s)-3-甲酰基哌啶-1-甲酸叔丁酯(9.89g,95%)。1h nmr(400mhz,cdcl3)δ9.70(s,1h),3.92(br.s.,1h),3.72-3.58(m,1h),3.33(dd,j=13.7,8.3hz,1h),3.09(ddd,j=13.1,9.4,3.2hz,1h),2.43(br.s.,1h),1.95(br.s.,1h),1.83-1.72(m,1h),1.71-1.62(m,2h),1.47(s,9h)。esi-ms m/z计算值213.1365,实验值158.2(m
–
tbu 2h=m
–
55)
;保留时间:1.68分钟(lc方法e)。
[3519]
步骤2:(3r)-3-[(e)-3-乙氧基-3-氧代-丙-1-烯基]哌啶-1-甲酸叔丁酯
[3520][3521]
向火焰干燥的圆底烧瓶中装入2-二乙氧基磷酰基乙酸乙酯(9.3790g,8.3ml,41.835mmol)和thf(130ml)。将溶液冷却至-78℃,并且然后添加nahmds于thf中的溶液(42ml,1m,42.000mmol)。将混合物在-78℃下搅拌30分钟。然后,将该混合物添加到(3s)-3-甲酰基哌啶-1-甲酸叔丁酯(9.85g,43.876mmol)于thf(45ml)中的冷却(至-78℃)的溶液中。将混合物在-78℃下搅拌30分钟。通过添加饱和nh4cl水溶液(50ml)来淬灭反应物。分离各层,并且用etoac(3
×
50ml)萃取水相。将合并的有机相用盐水(50ml)洗涤,并经无水硫酸钠干燥,过滤并减压浓缩。粗物质经由硅胶柱色谱法,使用0至50%etoac/庚烷梯度进行纯化,得到呈澄清油状物的(3r)-3-[(e)-3-乙氧基-3-氧代-丙-1-烯基]哌啶-1-甲酸叔丁酯(8.3095g,67%)。esi-ms m/z计算值283.1784,实验值228.2(m
–
tbu 2h=m
–
55)
;保留时间:1.93分钟(lc方法e)。
[3522]
步骤3:(3r)-3-(3-乙氧基-3-氧代-丙基)哌啶-1-甲酸叔丁酯
[3523][3524]
将5%碳/钯(50%湿,5%w/w,650mg,0.3054mmol)添加到(3r)-3-[(e)-3-乙氧基-3-氧代-丙-1-烯基]哌啶-1-甲酸叔丁酯(8.3g,29.291mmol)于甲醇(100ml)中的混合物中。将氢气鼓泡到悬浮液中持续2分钟,并且然后将反应混合物在氢气氛下搅拌18小时。将反应混合物在硅藻土上过滤并用甲醇冲洗。将滤液真空浓缩,得到呈无色油状物的粗制(3r)-3-(3-乙氧基-3-氧代-丙基)哌啶-1-甲酸叔丁酯(8.104g,97%)。esi-ms m/z计算值285.194,实验值230.2(m
–
tbu 2h=m
–
55)
;保留时间:1.92分钟(lc方法e)。
[3525]
步骤4:(3r)-3-(3-羟丙基)哌啶-1-甲酸叔丁酯
[3526][3527]
在0℃下,向(3r)-3-(3-乙氧基-3-氧代丙基)哌啶-1-甲酸叔丁酯(8.1g,27.475mmol)于thf(100ml)中的溶液中添加libh4(1.8g,82.630mmol)。将反应混合物在室温下搅拌16小时。在0℃下,将饱和nh4cl水溶液(50ml)缓慢添加到反应混合物中持续15分钟。用etoac(3
×
50ml)萃取产物。将合并的有机层用盐水(50ml)洗涤,经无水硫酸钠干燥,过滤并真空浓缩,得到呈无色油状物的粗制(3r)-3-(3-羟丙基)哌啶-1-甲酸叔丁酯(6.65g,99%)。esi-ms m/z计算值243.1834,实验值188.4(m
–
tbu 2h=m
–
55)
;保留时间:1.69分钟(lc方法e)。
[3528]
步骤5:(3r)-3-(3-苯甲酰基氧基丙基)哌啶-1-甲酸叔丁酯
[3529][3530]
在0℃下,向(3r)-3-(3-羟丙基)哌啶-1-甲酸叔丁酯(6.15g,24.464mmol)于吡啶(58.680g,60ml,741.85mmol)中的溶液中添加苯甲酰氯(6.8970g,5.7ml,49.066mmol)。然后将反应混合物升温至室温,并在室温下搅拌2小时。添加dcm(50ml),并且然后在0℃下在5分钟内缓慢地将饱和nh4cl水溶液(50ml)添加到反应混合物中。将产物用dcm(3
×
50ml)萃取,并将合并的有机层用盐水(60ml)洗涤,经无水硫酸钠干燥,过滤并真空浓缩。粗残余物通过硅胶色谱法,使用etoac/庚烷梯度进行纯化,得到呈无色油状物的(3r)-3-(3-苯甲酰基氧基丙基)哌啶-1-甲酸叔丁酯(8.25g,94%)。esi-ms m/z计算值347.2097,实验值248.2(m
–
boc 2h=m
–
99)
;保留时间:5.05分钟(lc方法f)。
[3531]
步骤6:(3r)-3-(3-苯甲酰基氧基丙基)哌啶-1-甲酸叔丁酯
[3532][3533]
通过手性sfc(使用lux-cellulose-5柱并将20%甲醇/100巴co2作为洗脱液)纯化3-(3-苯甲酰基氧基丙基)哌啶-1-甲酸叔丁酯的94:6er混合物(8.05g,22.335mmol),得到(3r)-3-(3-苯甲酰基氧基丙基)哌啶-1-甲酸叔丁酯(5.995g,77%);esi-ms m/z计算值347.2097,实验值248.2(m
–
boc 2h=m
–
99)
;保留时间:2.15分钟(lc方法e)。次要产物:(3s)-3-(3-苯甲酰基氧基丙基)哌啶-1-甲酸叔丁酯(501.7mg,5%);esi-ms m/z计算值347.2097,实验值248.2(m-boc 2h=m-99)
;保留时间:2.14分钟(lc方法e)。
[3534]
步骤7:(3r)-3-(3-羟丙基)哌啶-1-甲酸叔丁酯
[3535][3536]
在室温下,将甲醇钠于meoh(3.8ml,25%w/v,17.585mmol)中的溶液逐滴添加到(3r)-3-(3-苯甲酰基氧基丙基)哌啶-1-甲酸叔丁酯(6g,17.148mmol)于甲醇(75ml)中的溶液中。将混合物在室温下搅拌24小时。将混合物真空浓缩,然后粗物质要通过硅胶柱色谱法,使用0至100%etoac/庚烷梯度进行纯化,得到呈澄清油状物的(3r)-3-(3-羟丙基)哌啶-1-甲酸叔丁酯(3.96g,94%)。esi-ms m/z计算值243.1834,实验值188.2(m
–
tbu 2h=m
–
55)
;保留时间:1.68分钟(lc方法e)。
[3537]
步骤8:(3r)-3-(3-氧代丙基)哌啶-1-甲酸叔丁酯
[3538][3539]
向配备有温度探针和加料漏斗的三颈300-ml烧瓶中装入(3r)-3-(3-羟丙基)哌啶-1-甲酸叔丁酯(4g,16.323mmol)于dcm(32ml)中的溶液,并将混合物冷却至0℃。添加溴化钠(175mg,1.7008mmol)和碳酸氢钠(210mg,2.4998mmol)溶解于水(8ml)中的溶液。在0℃下搅拌15分钟后,添加tempo(30mg,0.1920mmol),随后缓慢添加次氯酸钠水溶液(17.5ml,1.1m,19.250mmol)持续30分钟(逐滴添加以将内部温度保持在6-8℃范围内)。添加乙醇(10ml)并停止搅拌,直到分离各层。然后将有机层分离,并用dcm(3
×
20ml)萃取水层。将合并的有机层用盐水(3
×
40ml)洗涤,经na2so4干燥,过滤,并浓缩,得到呈橙色油状物的粗制(3r)-3-(3-氧代丙基)哌啶-1-甲酸叔丁酯(3.41g,83%)。1h nmr(400mhz,cdcl3)δ9.79(s,1h),4.10-3.68(m,2h),2.80(t,j=11.4hz,1h),2.57(s,1h),2.50(t,j=7.3hz,2h),1.89-1.76(m,1h),1.46(s,14h),1.20-1.01(m,1h)。esi-ms m/z计算值241.1678,实验值186.2(m
–
tbu 2h=m
–
55)
;保留时间:1.77分钟(lc方法e)。
[3540]
步骤9:(3r)-3-[(3e)-3-叔丁基亚磺酰基亚氨基丙基]哌啶-1-甲酸叔丁酯
[3541][3542]
向溶解于dcm(35ml)中的(3r)-3-(3-氧代丙基)哌啶-1-甲酸叔丁酯(3g,11.810mmol)中添加外消旋2-甲基丙烷-2-亚磺酰胺(2.15g,17.739mmol)、硫酸镁(8g,66.463mmol)和对甲苯磺酸吡啶鎓(300mg,1.1890mmol)。将反应混合物在室温下搅拌18小时。将反应混合物过滤,然后浓缩。粗物质通过硅胶色谱法,用20%至100%etoac/庚烷梯度洗脱进行纯化,得到呈黄色油状物的(3r)-3-[(3e)-3-叔丁基亚磺酰基亚氨基丙基]哌啶-1-甲酸叔丁酯(3.75g,92%)。esi-ms m/z计算值344.2134,实验值245.2(m
–
boc 2h=m
–
99)
;
保留时间:1.94分钟(lc方法e)。
[3543]
步骤10:(3r)-3-[3-(4-叔丁基-2-吡啶基)-3-(叔丁基亚磺酰基氨基)丙基]哌啶-1-甲酸叔丁酯
[3544][3545]
在-78℃下,将正丁锂于己烷(3.9ml,2.5m,9.7500mmol)中的溶液逐滴添加到2-溴-4-叔丁基-吡啶(2.1g,8.9158mmol)于thf(45ml)中的溶液中。将混合物在-78℃下搅拌45分钟。逐滴添加(3r)-3-[(3e)-3-叔丁基亚磺酰基亚氨基丙基]哌啶-1-甲酸叔丁酯(2.75g,7.9743mmol)于thf(15ml)中的溶液。在4小时内将反应物缓慢升温至室温。添加饱和nh4cl水溶液(50ml),并用etoac(3
×
50ml)萃取产物。将合并的有机相用盐水(50ml)洗涤,经na2so4干燥,过滤并真空蒸发。粗产物通过反相色谱法,用5%至100%meoh/水(含0.1%甲酸作为改性剂)梯度洗脱进行纯化,得到呈黄色油状物的(3r)-3-[3-(4-叔丁基-2-吡啶基)-3-(叔丁基亚磺酰基氨基)丙基]哌啶-1-甲酸叔丁酯(2.38g,57%)。esi-ms m/z计算值479.3182,实验值480.4(m 1)
;保留时间:1.82分钟(lc方法e)。
[3546]
步骤11:(3r)-3-[3-氨基-3-(4-叔丁基-2-吡啶基)丙基]哌啶-1-甲酸叔丁酯
[3547][3548]
向(3r)-3-[3-(4-叔丁基-2-吡啶基)-3-(叔丁基亚磺酰基氨基)丙基]哌啶-1-甲酸叔丁酯(2.38g,4.5296mmol)于thf(16ml)和水(4ml)中的溶液中添加碘(650mg,2.5610mmol),并且将混合物在60℃下搅拌2小时。将反应混合物冷却至室温并用etoac(3
×
20ml)萃取。将合并的有机层用饱和nahco3水溶液(40ml)、10%硫代硫酸钠水溶液(40ml)和盐水(40ml)洗涤,经硫酸钠干燥,过滤并减压浓缩,得到呈黄色油状物的(3r)-3-[3-氨基-3-(4-叔丁基-2-吡啶基)丙基]哌啶-1-甲酸叔丁酯(2.04g,56%)。esi-ms m/z计算值375.2886,实验值376.4(m 1)
;保留时间:1.48分钟(lc方法e)。
[3549]
步骤12:(3r)-3-[3-(4-叔丁基-2-吡啶基)-3-[(6-氨磺酰基-2-吡啶基)氨基]丙基]哌啶-1-甲酸叔丁酯
[3550]
[3551]
向(3r)-3-[3-氨基-3-(4-叔丁基-2-吡啶基)丙基]哌啶-1-甲酸叔丁酯(2g,2.3060mmol)和6-氟吡啶-2-磺酰胺(609.37mg,3.4590mmol)于乙腈(20ml)中的溶液中添加dipea(983.51mg,1.3255ml,7.6098mmol)。将反应管密封,并将混合物在120℃下搅拌24小时。然后将反应混合物冷却至室温,并在乙酸乙酯(50ml)和水(50ml)之间分配。将水相用乙酸乙酯(2
×
20ml)萃取。将合并的有机层用盐水(20ml)洗涤,经硫酸钠干燥,过滤并真空浓缩。粗产物通过反相色谱法,用5%至100%meoh/水(含0.1%甲酸作为改性剂)梯度洗脱进行纯化。将所得级分真空蒸发,并将所得水溶液用饱和nahco3水溶液(20ml)中和。将所得水溶液用dcm(4
×
20ml)萃取,并将合并的有机层用盐水洗涤,经硫酸钠干燥,过滤并减压浓缩。这得到呈黄色半固体状的(3r)-3-[3-(4-叔丁基-2-吡啶基)-3-[(6-氨磺酰基-2-吡啶基)氨基]丙基]哌啶-1-甲酸叔丁酯(210mg,17%)。esi-ms m/z计算值531.2879,实验值532.4(m 1)
;保留时间:1.59分钟(lc方法e)。
[3552]
步骤13:(3r)-3-[3-[[6-[(6-叔丁基-2-氟吡啶-3-羰基)氨磺酰基]-2-吡啶基]氨基]-3-(5-叔丁基-2-吡啶基)丙基]哌啶-1-甲酸叔丁酯
[3553][3554]
向圆底烧瓶中装入含6-叔丁基-2-氟-吡啶-3-甲酸(112mg,0.5679mmol)的thf(9ml)。添加1,1'-羰基二咪唑(200mg,1.2334mmol),并且将混合物在室温下搅拌2小时。在单独的烧瓶中,制备(3r)-3-[3-(5-叔丁基-2-吡啶基)-3-[(6-氨磺酰基-2-吡啶基)氨基]丙基]哌啶-1-甲酸叔丁酯(300mg,0.5637mmol)于thf(5ml)中的溶液,并且将其添加到活化的酸溶液中。然后添加1,8-二氮杂双环[5.4.0]十一碳-7-烯(458.10mg,0.45ml,3.0091mmol),并将反应混合物在室温下搅拌21小时。然后,减压移除溶剂,并且将所得浓稠油状物用etoac(10ml)和水(10ml)处理。将水相用etoac(3
×
10ml)萃取。将合并的有机层用1n hcl水溶液(20ml)、盐水(20ml)洗涤,经硫酸钠干燥,过滤并真空浓缩。粗混合物通过反相色谱法,用5%至100%meoh/水(含0.1%甲酸作为改性剂)梯度洗脱进行纯化,得到呈浅黄色油状物的(3r)-3-[3-[[6-[(6-叔丁基-2-氟-吡啶-3-羰基)氨磺酰基]-2-吡啶基]氨基]-3-(5-叔丁基-2-吡啶基)丙基]哌啶-1-甲酸叔丁酯(331.2mg,74%)。1h nmr(400mhz,dmso-d6)δ8.38(d,j=5.4hz,1h),8.13(t,j=8.8hz,1h),7.47-7.40(m,1h),7.40-7.37(m,1h),7.27(d,j=5.4hz,1h),7.19(d,j=5.4hz,1h),7.09(d,j=8.3hz,1h),6.99(d,j=7.3hz,1h),6.51(d,j=8.3hz,1h),5.00-4.77(br.s.,1h),3.74-3.64(m,1h),2.76-2.59(m,1h),1.89-1.73(m,2h),1.68-1.57(m,1h),1.54-1.42(m,1h),1.39-1.31(m,9h),1.27(s,9h),1.20-1.15(m,17h)。
19
f nmr(377mhz,dmso-d6)δ
–
65.98(s,1f)。esi-ms m/z计算值710.3626,实验值711.4(m 1)
;保留时间:1.93分钟(lc方法e)。
[3555]
步骤14:6-叔丁基-n-[[6-[[1-(4-叔丁基-2-吡啶基)-3-[(3r)-3-哌啶基]丙基]氨基]-2-吡啶基]磺酰基]-2-氟-吡啶-3-甲酰胺
[3556][3557]
在圆底烧瓶中,向(3r)-3-[3-[[6-[(6-叔丁基-2-氟-吡啶-3-羰基)氨磺酰基]-2-吡啶基]氨基]-3-(4-叔丁基-2-吡啶基)丙基]哌啶-1-甲酸叔丁酯(325mg,0.4567mmol)于dcm(6.5ml)中添加含4m hcl的二噁烷(1.75ml,4m,7.00mmol),并搅拌18小时。将溶剂蒸发,得到两种非对映异构体的混合物,呈黄色固体状的6-叔丁基-n-[[6-[[1-(4-叔丁基-2-吡啶基)-3-[(3r)-3-哌啶基]丙基]氨基]-2-吡啶基]磺酰基]-2-氟-吡啶-3-甲酰胺(盐酸盐)(325.1mg,99%)。esi-ms m/z计算值610.3101,实验值611.2(m 1)
;保留时间:1.4分钟(lc方法e)。
[3558]
步骤15:(20r)-4-叔丁基-17-(4-叔丁基吡啶-2-基)-10λ
6-硫杂-1,3,9,16,25-五氮杂四环[18.3.1.111,15.02,7]二十五碳-2,4,6,11,13,15(25)-六烯-8,10,10-三酮(化合物409)
[3559][3560]
将6-叔丁基-n-[[6-[[1-(4-叔丁基-2-吡啶基)-3-[(3r)-3-哌啶基]丙基]氨基]-2-吡啶基]磺酰基]-2-氟-吡啶-3-甲酰胺(盐酸盐)(325mg,0.4508mmol)溶解于dmso(6.5ml)中,并添加碳酸钾(815mg,5.8970mmol)。将反应管密封,并将混合物在120℃下加热24小时。然后将混合物冷却至室温,并且将粗混合物通过反相色谱法,使用5%至100%meoh/水(含0.1%甲酸作为改性剂)直接纯化,得到呈米色固体状的(20r)-4-叔丁基-17-(4-叔丁基吡啶-2-基)-10λ
6-硫杂-1,3,9,16,25-五氮杂四环[18.3.1.111,15.02,7]二十五碳-2,4,6,11,13,15(25)-六烯-8,10,10-三酮(46.3mg,17%)。1h nmr(400mhz,dmso-d6)δ8.41(d,j=5.4hz,1h),7.56-7.45(m,2h),7.44-7.37(m,1h),7.24(d,j=4.9hz,1h),7.09-6.97(m,1h),6.96-6.84(m,1h),6.68-6.57(m,1h),6.57-6.44(m,1h),4.81-4.67(m,1h),4.63-4.45(m,1h),4.17-3.98(m,1h),2.79-2.55(m,1h),2.45-2.35(m,1h),1.81-1.69(m,1h),1.56(br.s.,3h),1.33-1.05(m,22h),1.00-0.88(m,1h)。esi-ms m/z计算值590.3039,实验值591.4(m 1)
;保留时间:4.46分钟(lc方法f)。
[3561]
实施例147:(14s)-8-叔丁基-17-{4-[(2-甲氧基乙基)(甲基)氨基]吡啶-2-基}-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮(化合物410)的制备
[3562][3563]
在1打兰小瓶中,将峰2的(14s)-17-(4-溴吡啶-2-基)-8-叔丁基-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5(10),6,8,19(23),20-六烯-2,2,4-三酮(20mg,0.03187mmol)和2-甲氧基-n-甲基-乙胺(33.2mg,0.3725mmol)与二噁烷(300μl)混合,向其中添加ruphos pd g3(2.5mg,0.002989mmol)和叔丁醇钠(12.9mg,0.1342mmol)。将所得混合物用氮气吹扫,然后在110℃下搅拌18小时。然后将其冷却至室温,用meoh(700μl)稀释,过滤,并且通过反相制备型色谱法,使用c
18
柱和含5mm hcl溶液的1%至70%mecn/h2o梯度洗脱进行纯化,得到(14s)-8-叔丁基-17-{4-[(2-甲氧基乙基)(甲基)氨基]吡啶-2-基}-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮(盐酸盐)(3.7mg,17%);1h nmr(400mhz,dmso-d6)δ13.62and 13.55(一个质子有两个单峰组合,1h),12.44(s,1h),8.25-8.06(m,1h),7.93(d,j=8.7hz,1h),7.74(dd,j=8.4,7.3hz,1h),7.65(d,j=7.9hz,1h),7.22(d,j=7.2hz,1h),7.15and 6.85(1h总计有单峰和双重峰),7.08-6.98(m,1h),6.97(d,j=8.4hz,1h),6.65(d,j=8.0hz,1h),5.28(t,j=9.8hz,1h),3.91-3.62(m,2h),3.59-3.47(m,2h),3.28(dd,j=9.7,6.7hz,1h),3.26-3.06(两个甲基有四个单峰组合,6h),2.71-2.59(m,1h),2.43-2.29(m,1h),2.05-1.87(m,2h),1.83(dd,j=11.7,5.1hz,1h),1.80-1.71(m,1h),1.68(s,3h),1.55(t,j=12.5hz,1h),1.50(s,3h),1.48-1.38(m,1h),1.28(s,9h)。esi-ms m/z计算值635.3254,实验值636.3(m 1)
;保留时间:1.71分钟(lc方法a)。
[3564]
实施例148:(14s,17r)-8-叔丁基-17-{6-[(2-甲氧基乙基)(甲基)氨基]吡啶-2-基}-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮(化合物411)的制备
[3565][3566]
在1打兰小瓶中,将(14s,17r)-17-(6-溴吡啶-2-基)-8-叔丁基-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19
(23),20-六烯-2,2,4-三酮(20mg,0.03187mmol)和2-甲氧基-n-甲基-乙胺(33.2mg,0.3725mmol)与二噁烷(300μl)混合,向其中添加ruphos pd g3(2.5mg,0.002989mmol)和叔丁醇钠(12.9mg,0.1342mmol)。将所得混合物用氮气吹扫,然后在110℃下搅拌18小时。然后将其冷却至室温,用meoh(700μl)稀释,过滤,并且通过反相制备型色谱法,使用c
18
柱和含5mm hcl溶液的1%至70%mecn/h2o梯度洗脱进行纯化,得到(14s,17r)-8-叔丁基-17-{6-[(2-甲氧基乙基)(甲基)氨基]吡啶-2-基}-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮(盐酸盐)(3.6mg,17%);1h nmr(400mhz,dmso-d6)δ12.58-12.29(bs,1h),12.11-11.19(bs,1h),8.25-7.82(m,1h),7.76-7.56(m,2h),7.56-7.26(m,1h),7.22-7.06(m,1h),6.89(d,j=8.5hz,1h),6.65(d,j=8.0hz,1h),6.59-6.21(m,1h),5.34-4.97(m,1h),3.85-3.67(m,2h),3.53-3.40(m,2h),3.36-2.91(m,7h),2.80-2.64(m,1h),2.30-2.14(m,1h),2.12-1.89(m,2h),1.85(dd,j=11.7,5.2hz,1h),1.80-1.69(m,1h),1.64(s,3h),1.57(t,j=12.5hz,1h),1.50(s,3h),1.47-1.38(m,1h),1.28(s,9h)。esi-ms m/z计算值635.3254,实验值636.3(m 1)
;保留时间:1.69分钟(lc方法a)。
[3567]
实施例149:(14s)-8-叔丁基-17-{5-[(2-甲氧基乙基)(甲基)氨基]吡啶-2-基}-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮(化合物412)的制备
[3568][3569]
在1打兰小瓶中,将峰2的(14s)-17-(5-溴吡啶-2-基)-8-叔丁基-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮(20.0mg,0.03187mmol)和2-甲氧基-n-甲基-乙胺(20.2mg,0.2266mmol)与二噁烷(300μl)混合,向其中添加ruphos pd g3(3.1mg,0.003706mmol)和叔丁醇钠(16.2mg,0.1686mmol)。将所得混合物用氮气吹扫,然后在90℃下搅拌18小时。然后将其冷却至室温,用meoh(700μl)稀释,过滤,并且通过反相制备型色谱法,使用c
18
柱和含5mm hcl溶液的1%至70%mecn/h2o梯度洗脱进行纯化,得到(14s)-8-叔丁基-17-{5-[(2-甲氧基乙基)(甲基)氨基]吡啶-2-基}-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮(盐酸盐)(5.2mg,24%);1h nmr(400mhz,dmso-d6)δ15.77-15.24(bs,1h),12.58-12.16(bs,1h),7.97(s,1h),7.92-7.72(bs,2h),7.72(t,j=7.8hz,1h),7.65(d,j=8.0hz,1h),7.19(d,j=7.2hz,1h),6.93(d,j=8.5hz,1h),6.66(d,j=8.0hz,1h),5.44-5.27(m,1h),3.68-3.57(m,2h),3.49(t,j=5.3hz,2h),3.33-3.24(m,1h),3.21(s,3h),2.99(s,3h),2.72-2.60(m,
1h),2.40-2.25(m,1h),1.99-1.87(m,2h),1.84(dd,j=11.6,5.2hz,1h),1.79-1.70(m,1h),1.67(s,3h),1.56(t,j=12.4hz,1h),1.50(s,3h),1.48-1.37(m,1h),1.28(s,9h),1.20-1.06(m,1h)。esi-ms m/z计算值635.3254,实验值636.3(m 1)
;保留时间:1.69分钟(lc方法a)。
[3570]
实施例150:(14s)-8-叔丁基-17-{5-[1-(3,3-二甲基丁基)-1h-吡唑-3-基]吡啶-2-基}-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮(化合物413)的制备
[3571][3572]
在1打兰小瓶中,将峰2的(14s)-17-(5-溴吡啶-2-基)-8-叔丁基-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮(21.0mg,0.03346mmol)和1-(3,3-二甲基丁基)-3-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)吡唑(22.5mg,0.08088mmol)与二噁烷(500μl)混合,向其中添加pd(dppf)cl2–
dcm(3mg,0.003674mmol)和na2co3水溶液(80μl,2.0m,0.1600mmol)。将所得混合物用氮气吹扫,然后在120℃下搅拌110分钟。然后将其冷却至室温,用meoh(600μl)稀释,过滤,并且通过反相制备型色谱法,使用c
18
柱和含5mm hcl溶液的1%至99%mecn/h2o梯度洗脱进行纯化,得到灰白色固体,(14s)-8-叔丁基-17-{5-[1-(3,3-二甲基丁基)-1h-吡唑-3-基]吡啶-2-基}-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮(盐酸盐)(15.0mg,61%);1h nmr(400mhz,dmso-d6)δ12.49(s,1h),8.66(d,j=2.3hz,1h),7.99-7.89(m,1h),7.79(d,j=9.0hz,1h),7.66(dd,j=8.5,7.3hz,1h),7.64(d,j=8.0hz,2h),7.52(d,j=1.8hz,1h),7.12(d,j=7.2hz,1h),6.92(d,j=8.4hz,1h),6.66(d,j=8.0hz,1h),6.45(d,j=1.9hz,1h),5.40-5.30(m,1h),4.15-4.05(m,2h),3.24(dd,j=10.3,6.7hz,1h),2.77(t,j=10.4hz,1h),2.32-2.17(m,1h),2.04-1.91(m,2h),1.86(dd,j=11.7,5.2hz,1h),1.81-1.71(m,1h),1.66(s,3h),1.65-1.56(m,3h),1.52(s,3h),1.51-1.41(m,1h),1.28(s,9h),0.80(s,9h)。esi-ms m/z计算值698.3727,实验值699.3(m 1)
;保留时间:2.27分钟(lc方法a)。
[3573]
实施例151:(14s)-8-叔丁基-17-{4-[1-(3,3-二甲基丁基)-1h-吡唑-3-基]吡啶-2-基}-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮(化合物414)的制备
[3574][3575]
在1打兰小瓶中,将峰2的(14s)-17-(4-溴吡啶-2-基)-8-叔丁基-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5(10),6,8,19(23),20-六烯-2,2,4-三酮(21.7mg,0.03458mmol)和1-(3,3-二甲基丁基)-3-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)吡唑(22.5mg,0.08088mmol)与二噁烷(500μl)混合,向其中添加pd(dppf)cl2–
dcm(3.1mg,0.003796mmol)和na2co3水溶液(80μl,2.0m,0.1600mmol)。将所得混合物用氮气吹扫,然后在110℃下搅拌18小时。然后将其冷却至室温,用meoh(600μl)稀释,过滤,并且通过反相制备型色谱法,使用c
18
柱和含5mm hcl溶液的1%至99%mecn/h2o梯度洗脱进行纯化,得到米色固体(14s)-8-叔丁基-17-{4-[1-(3,3-二甲基丁基)-1h-吡唑-3-基]吡啶-2-基}-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮(盐酸盐)(10.7mg,42%);1h nmr(400mhz,dmso-d6)δ12.47(s,1h),8.72(d,j=5.3hz,1h),7.82(d,j=9.0hz,1h),7.77(s,1h),7.66(dd,j=8.5,7.3hz,1h),7.64(d,j=8.0hz,1h),7.56(d,j=1.9hz,1h),7.52(d,j=5.3hz,1h),7.13(d,j=7.2hz,1h),6.90(d,j=8.4hz,1h),6.65(d,j=8.0hz,1h),6.58(d,j=1.9hz,1h),5.41(td,j=10.0,9.3,4.9hz,1h),4.14(t,j=8.2hz,2h),3.28(dd,j=10.1,6.6hz,1h),2.76(t,j=10.4hz,1h),2.32-2.19(m,1h),2.14-2.00(m,1h),1.97-1.87(m,1h),1.85(dd,j=11.9,5.4hz,1h),1.77(dd,j=14.1,5.7hz,1h),1.65(s,3h),1.58(t,j=12.5hz,1h),1.51(s,3h),1.50-1.41(m,3h),1.28(s,9h),0.67(s,9h)。esi-ms m/z计算值698.3727,实验值699.4(m 1)
;保留时间:2.17分钟(lc方法a)。
[3576]
实施例152:(5s)-11-叔丁基-7,7-二甲基-3-苯基-17λ
6-硫杂-2,8,10,16,22-五氮杂四环[16.3.1.15,8.09,14]二十三碳-1(21),9(14),10,12,18(22),19-六烯-15,17,17-三酮(化合物415)和(5s)-11-叔丁基-7,7-二甲基-3-苯基-17λ
6-硫杂-2,8,10,16,22-五氮杂四环[16.3.1.15,8.09,14]二十三碳-1(21),9(14),10,12,18(22),19-六烯-15,17,17-三酮(化合物416)的制备
[3577][3578]
步骤1:3-(2-甲基-2-硝基-丙基)四氢呋喃-2-酮
[3579][3580]
将3-亚甲基四氢呋喃-2-酮(101.11g,90.357ml,989.46mmol)溶解于乙腈(1.1l)中的溶液以缓慢流添加到dbu(23.414g,23ml,153.80mmol)和2-硝基丙烷(107.14g,108ml,1.2026mol)的混合物中。反应是放热的:添加速率使得在添加过程中内部温度保持低于35℃。将所得溶液在室温下搅拌19小时,然后真空浓缩,得到浅黄色固体。将粗产物在乙醚(500ml)中搅拌过夜,然后过滤。将固体溶解于dcm(500ml)中,并用3.0m hcl水溶液(2
×
500ml)、h2o(500ml)、饱和nahco3水溶液(500ml)和饱和nacl水溶液(500ml)洗涤。dcm层经无水硫酸镁干燥,过滤并真空浓缩,得到白色晶体固体。3-(2-甲基-2-硝基-丙基)四氢呋喃-2-酮(157.59g,82%):1h nmr(500mhz,dmso-d6)δ4.27(td,j=8.6,8.6,1.5hz,1h),4.15-4.00(m,1h),2.68(dddd,j=11.4,9.7,8.5,2.9hz,1h),2.43(dd,j=14.8,2.9hz,1h),2.34-2.23(m,1h),2.09-1.99(m,1h),1.85(qd,j=11.6,11.6,11.5,8.6hz,1h),1.59(s,3h),1.58(s,3h)。esi-ms m/z计算值187.08446,实验值188.2(m 1)
;保留时间:1.39分钟
(lc方法b)。
[3581]
步骤2:(3r)-3-(2-甲基-2-硝基-丙基)四氢呋喃-2-酮和(3s)-3-(2-甲基-2-硝基-丙基)四氢呋喃-2-酮
[3582][3583]
通过手性sfc,使用ad-h(2x25cm)柱,并使用35%甲醇/100巴co2作为洗脱液分离3-(2-甲基-2-硝基-丙基)四氢呋喃-2-酮(173.55g,927.1mmol)的外消旋混合物。流速为70ml/min(220nm),并且进样体积为3ml的20mg/ml于甲醇:dcm中的溶液。在添加乙腈以防止在甲醇中浓缩的情况下冷干燥后,分离出呈固体状的两种异构体。
[3584]
峰1,(3r)-3-(2-甲基-2-硝基-丙基)四氢呋喃-2-酮(88g,50%)。1h nmr(400mhz,dmso-d6)δ4.27(td,j=8.6,1.5hz,1h),4.09(ddd,j=10.9,8.7,6.1hz,1h),2.76-2.63(m,1h),2.43(dd,j=14.8,2.9hz,1h),2.35-2.24(m,1h),2.04(dd,j=14.8,10.0hz,1h),1.94-1.79(m,1h),1.59(s,3h),1.58(s,3h)。esi-ms m/z计算值187.08446,保留时间:0.71分钟(质量未检测)(lc方法a)。
[3585]
峰2,(3s)-3-(2-甲基-2-硝基-丙基)四氢呋喃-2-酮(80g,46%)。1h nmr(400mhz,dmso-d6)δ4.27(td,j=8.6,1.5hz,1h),4.09(ddd,j=10.9,8.7,6.1hz,1h),2.76-2.62(m,1h),2.43(dd,j=14.8,2.9hz,1h),2.33-2.23(m,1h),2.04(dd,j=14.8,10.0hz,1h),1.91-1.78(m,1h),1.59(s,3h),1.58(s,3h)。esi-ms m/z计算值187.08446,保留时间:0.76分钟(质量未检测)(lc方法a)。
[3586]
步骤3:(3r)-3-(2-羟乙基)-5,5-二甲基-吡咯烷-2-酮
[3587][3588]
在parr反应器中,向(3r)-3-(2-甲基-2-硝基-丙基)四氢呋喃-2-酮(37g,197.66mmol)于乙醇(370.00ml)中的溶液中添加雷尼镍(8g,91.230mmol)。将反应器在80℃下在氢气(3巴)下搅拌48小时。添加硅藻土(10g),并过滤所得浆液。将固体用乙醇(2
×
150ml)洗涤并丢弃。将合并的滤液真空浓缩,得到黄色固体。然后将固体用乙醚研磨过夜,并且收集所得固体,得到呈白色固体状的(3r)-3-(2-羟乙基)-5,5-二甲基-吡咯烷-2-酮(26.9g,82%)。1h nmr(500mhz,dmso-d6)δ7.68(s,1h),4.54(m,1h),3.47(m,1h),3.41(m,1h),2.48-2.42(m,1h),2.04(m,1h),1.86(m,1h),1.42(m,1h),1.30(m,1h),1.18(s,3h),1.13(s,3h)。
[3589]
步骤4:2-[(3r)-5,5-二甲基吡咯烷-3-基]乙醇
[3590][3591]
将lah(40g,1.0539mol)以小份添加到(3r)-3-(2-羟乙基)-5,5-二甲基-吡咯烷-2-酮(31.5g,200.37mmol)于thf(350ml)中的冷却(0℃)溶液中。使所得浆液升温至室温并
搅拌1小时。然后将其加热至70℃,持续48小时。在冷却至室温之后,使用冰浴将反应物冷却至0℃。缓慢添加水(40ml),随后添加15%w/v naoh水溶液(40ml)。再添加120ml水,并且移除冰浴。将淬灭的反应混合物用乙醚(200ml)稀释,并使其升温并在室温下搅拌30分钟。将混合物通过硅藻土过滤,并将固体用乙醚洗涤(2
×
100ml)。然后合并的滤液经无水硫酸钠干燥并过滤。将合并的滤液真空蒸发,得到呈浅黄色油状物的2-[(3r)-5,5-二甲基吡咯烷-3-基]乙醇(32g,100%)。1h nmr(500mhz,dmso-d6)δ4.40(s,1h),3.46
–
3.39(m,2h),2.97
–
2.90(m,1h),2.44
–
2.32(m,1h),2.19
–
2.00(m,1h),1.71
–
1.62(m,1h),1.49
–
1.35(m,2h),1.09
–
0.97(m,7h)。
[3592]
步骤5:(4r)-4-(2-羟乙基)-2,2-二甲基-吡咯烷-1-甲酸叔丁酯
[3593][3594]
将2-[(3r)-5,5-二甲基吡咯烷-3-基]乙醇(32g,203.31mmol)于dcm(160.00ml)中的溶液冷却至0℃,然后添加naoh(19g,475.03mmol)于h2o(160ml)中的溶液。将碳酸叔丁氧羰基叔丁酯(59g,62.105ml,270.34mmol)于dcm(160ml)中的溶液逐滴添加到冷却的胺混合物中,然后移除冰水浴,并使反应物在室温下搅拌22小时。然后分离各相:用dcm(150ml)萃取水相。有机相经硫酸钠干燥并真空浓缩,然后通过硅胶色谱法,使用3%meoh/dcm纯化,得到呈澄清油状物的(4r)-4-(2-羟乙基)-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(30.915g,60%)。1h nmr(500mhz,dmso-d6)δ4.42(t,j=5.1,1h),3.56(q,j=8.7hz,1h),3.42
–
3.36(m,2h),2.79(dt,j=12.8,10.6hz,1h),2.21
–
2.10(m,1h),1.92
–
1.84(m,1h),1.47
–
1.44(m,2h),1.37(m,13h),1.24(s,3h)。esi-ms m/z计算值243.18344,实验值244.5(m 1)
;保留时间:2.17分钟(lc方法h)。
[3595]
步骤6:(4r)-2,2-二甲基-4-(2-氧代乙基)吡咯烷-1-甲酸叔丁酯
[3596][3597]
通过将碳酸氢钠(9.53g,113.44mmol)溶解到次氯酸钠水溶液(136ml,1.6m,217.60mmol)中并在0℃下在冰浴中搅拌来制备漂白剂的缓冲溶液。然后将该溶液逐滴添加到机械搅拌的第二溶液中,所述溶液通过将溴化钠(944mg,9.1745mmol)(溶解于水(5ml)中)和tempo(73mg,0.4672mmol)添加到保持在-12℃下的含(4r)-4-(2-羟乙基)-2,2-二甲基吡咯烷-1-甲酸叔丁酯(43.68g,179.50mmol)的dcm(570ml)中来预先制备。在将漂白剂缓冲溶液添加到底物溶液期间,将内部温度保持在-10℃以下。在完成添加后,将反应混合物保持在-14℃持续10分钟。用乙醇(2.3670g,3ml,51.380mmol)淬灭过量的漂白剂。将反应混合物在35℃下减压浓缩。将所得残余物在乙酸乙酯(200ml)和水(100ml)之间分配。将水相分离并用乙酸乙酯(100ml)萃取。将有机物合并,用盐水(150ml)洗涤,用硫酸钠干燥,过滤并减压浓缩,得到(4r)-2,2-二甲基-4-(2-氧乙基)吡咯烷-1-甲酸叔丁酯(34.6g,69%)1h nmr(400mhz,cdcl3)δ9.78(s,1h),3.87-3.70(m,1h),3.01-2.82(m,1h),2.68-2.41(m,3h),2.07-1.94(m,1h),1.53-1.30(m,16h)。esi-ms m/z计算值241.1678,实验值186.2(m
–
tbu 2h=m
–
55)
;保留时间:1.79分钟(lc方法e)。
[3598]
步骤7:(4r)-4-[(2e)-2-叔丁基亚磺酰基亚氨基乙基]-2,2-二甲基-吡咯烷-1-甲
酸叔丁酯
[3599][3600]
向(4r)-2,2-二甲基-4-(2-氧代乙基)吡咯烷-1-甲酸叔丁酯(15.74g,61.962mmol)于dcm(125ml)中的溶液中添加硫酸镁(48g,398.78mmol)、外消旋2-甲基丙烷-2-磺酰胺(13.2g,108.91mmol)和对甲苯磺酸吡啶鎓(904mg,3.5829mmol)。将反应混合物在室温下搅拌24小时。将混合物过滤并通过硅胶色谱法,用0%至50%乙酸乙酯/庚烷洗脱来纯化,得到呈白色固体状的(4r)-4-[(2e)-2-叔丁基亚磺酰基亚氨基乙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(20.1g,89%)。1h nmr(400mhz,cdcl3)δ8.11-8.00(m,1h),3.88-3.60(m,1h),3.05-2.86(m,1h),2.68-2.45(m,3h),2.07-1.91(m,1h),1.64-1.13(m,25h)。esi-ms m/z计算值344.2134,实验值245.2(m
–
boc 2h=m
–
99)
;保留时间:1.95分钟(lc方法e)。
[3601]
步骤8:(4s)-4-[2-(叔丁基亚磺酰基氨基)-2-苯基-乙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯
[3602][3603]
在
–
78℃下,将氯(苯基)镁于thf(3.0ml,2m,6.0mmol)中的溶液逐滴添加到(4r)-4-[(2e)-2-叔丁基亚磺酰基亚氨基乙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(1.4g,3.9418mmol)于thf(14ml)中的溶液中,并将混合物在
–
78℃下搅拌30分钟。将反应物在5小时内升温至室温。添加饱和nh4cl水溶液(50ml)。用etoac(3
×
50ml)萃取产物。将合并的有机相用盐水(50ml)洗涤,经na2so4干燥,过滤并蒸发至干燥(1.79g粗产物,纯度为84.6%)。将该混合物通过硅胶色谱法(用0至50%乙酸乙酯/己烷洗脱)纯化,得到呈无色油状物的(4s)-4-[2-(叔丁基亚磺酰基氨基)-2-苯基-乙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(1.51g,69%)。1h nmr(400mhz,cdcl3)δ7.40-7.28(m,5h),4.39-4.25(m,1h),3.77-3.23(m,2h),3.02-2.66(m,1h),2.11-1.69(m,4h),1.49-1.12(m,24h)。esi-ms m/z计算值422.2603,实验值323.2(m
–
boc 2h=m
–
99)
;保留时间:1.98分钟(lc方法e)。
[3604]
步骤9:(4s)-4-(2-氨基-2-苯基-乙基)-2,2-二甲基-吡咯烷-1-甲酸叔丁酯
[3605][3606]
将碘(66mg,0.2600mmol)添加到(4s)-4-[2-(叔丁基亚磺酰基氨基)-2-苯基-乙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(1.49g,3.5256mmol)于thf(11ml)和水(2.3ml)中
的溶液中。将反应物在60℃下搅拌2小时。添加碘(78mg,0.3073mmol),并将反应物在60℃下搅拌2.5小时。添加碘(71mg,0.2797mmol),将反应物在60℃下搅拌1.5小时。冷却至室温后,将反应物用乙酸乙酯(25ml)稀释,并且依次用5%碳酸氢钠水溶液(2
×
25ml)、10%硫代硫酸钠水溶液(2
×
25ml)和盐水(50ml)洗涤。有机相经硫酸钠干燥,过滤并蒸发至干燥,得到呈浅黄色油状物的(4s)-4-(2-氨基-2-苯基-乙基)-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(1.27g,92%)。1h nmr(400mhz,cdcl3)δ7.39-7.23(m,5h),3.92-3.84(m,1h),3.80-3.39(m,1h),3.03-2.73(m,1h),2.17-1.85(m,4h),1.84-1.66(m,3h),1.49-1.33(m,12h),1.29-1.17(m,3h)。esi-ms m/z计算值318.23074,实验值319.2(m 1)
;保留时间:1.39分钟(lc方法e)。
[3607]
步骤10:(4s)-2,2-二甲基-4-[2-苯基-2-[(6-氨磺酰基-2-吡啶基)氨基]乙基]吡咯烷-1-甲酸叔丁酯
[3608][3609]
向(4s)-4-(2-氨基-2-苯基-乙基)-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(1.25g,3.2069mmol)和6-氟吡啶-2-磺酰胺(1.69g,9.5931mmol)于乙腈(11ml)中的溶液中添加dipea(1.4840g,2ml,11.482mmol)。将反应管密封,并将混合物在120℃下搅拌45小时。将反应物在乙酸乙酯(50ml)和水(100ml)之间分配。将水相用乙酸乙酯(50ml)萃取。将合并的有机层用盐水(100ml)洗涤,经硫酸钠干燥,过滤并浓缩。将粗物质在c
18
上通过反相色谱法(用5%至100%甲醇/水 0.1%hcooh洗脱)进行纯化。将产物级分合并,并且减压移除有机溶剂。将5%nahco3溶液(20ml)添加到水性混合物中,然后将其用乙酸乙酯(2
×
20ml)萃取。合并的有机层经无水硫酸钠干燥,过滤并减压浓缩,得到呈米色固体状的(4s)-2,2-二甲基-4-[2-苯基-2-[(6-氨磺酰基-2-吡啶基)氨基]乙基]吡咯烷-1-甲酸叔丁酯(583mg,38%)。1h nmr(400mhz,dmso-d6)δ7.55-7.38(m,4h),7.34-7.24(m,2h),7.23-7.16(m,1h),7.09-7.02(m,2h),6.95(d,j=7.1hz,1h),6.63(dd,j=8.4,2.6hz,1h),5.22-4.91(m,1h),3.60-3.42(m,1h),2.93-2.69(m,1h),2.22-1.98(m,1h),1.97-1.82(m,2h),1.82-1.65(m,1h),1.63-1.42(m,1h),1.41-1.24(m,12h),1.19-1.06(m,3h)。esi-ms m/z计算值474.23007,实验值419.2(m
–
tbu 2h=m
–
55)
;保留时间:4.3分钟(lc方法f)。
[3610]
步骤11:(4s)-4-[2-[[6-[(6-叔丁基-2-氟-吡啶-3-羰基)氨磺酰基]-2-吡啶基]氨基]-2-苯基-乙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯
[3611][3612]
将6-叔丁基-2-氟-吡啶-3-甲酸(85.9mg,0.4356mmol)和cdi(76.3mg,0.4706mmol)的混合物溶解于thf(600μl)中,并将混合物在室温下搅拌16小时。添加(4s)-2,2-二甲基-4-[2-苯基-2-[(6-氨磺酰基-2-吡啶基)氨基]乙基]吡咯烷-1-甲酸叔丁酯(109.8mg,0.2313mmol),随后添加dbu(140μl,0.9362mmol),并将所得混合物再搅拌24小时。将混合物用乙酸乙酯稀释,并用1n hcl、盐水洗涤,经硫酸钠干燥,并浓缩。残余物通过硅胶色谱法,用0-100%乙酸乙酯/己烷洗脱进行纯化,得到呈澄清油状物的(4s)-4-[2-[[6-[(6-叔丁基-2-氟-吡啶-3-羰基)氨磺酰基]-2-吡啶基]氨基]-2-苯基-乙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(120mg,79%)。esi-ms m/z计算值653.30475,实验值654.4(m 1)
;保留时间:0.87分钟(lc方法d)。
[3613]
步骤12:(5s)-11-叔丁基-7,7-二甲基-3-苯基-17λ
6-硫杂-2,8,10,16,22-五氮杂四环[16.3.1.15,8.09,14]二十三碳-1(21),9(14),10,12,18(22),19-六烯-15,17,17-三酮(化合物415)和(5s)-11-叔丁基-7,7-二甲基-3-苯基-17λ
6-硫杂-2,8,10,16,22-五氮杂四环[16.3.1.15,8.09,14]二十三碳-1(21),9(14),10,12,18(22),19-六烯-15,17,17-三酮(化合物416)
[3614][3615]
阶段1:将(4s)-4-[2-[[6-[(6-叔丁基-2-氟-吡啶-3-羰基)氨磺酰基]-2-吡啶基]氨基]-2-苯基-乙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(120mg,0.1835mmol)和tfa(150μl,1.947mmol)合并于dcm(2ml)中,并在室温下搅拌2小时。将反应混合物蒸发,得到6-叔丁基-n-[[6-[[2-[(3s)-5,5-二甲基吡咯烷-3-基]-1-苯基-乙基]氨基]-2-吡啶基]磺酰基]-2-氟-吡啶-3-甲酰胺(三氟乙酸盐)。
[3616]
阶段2:将上述产物与碳酸钾(331mg,2.395mmol)一起溶解于nmp(6ml)中,并在120℃下加热16小时。将混合物冷却至室温,并在乙酸乙酯和1n hcl之间分配。将有机物分离,用盐水洗涤,经硫酸钠干燥并蒸发。将粗物质通过硅胶色谱法,用0-100%乙酸乙酯/己烷洗脱进行纯化,得到呈非对映异构体混合物形式的(5s)-11-叔丁基-7,7-二甲基-3-苯基-17λ
6-硫杂-2,8,10,16,22-五氮杂四环[16.3.1.15,8.09,14]二十三碳-1(21),9(14),10,12,18(22),19-六烯-15,17,17-三酮(26.4mg)。通过sfc色谱法分离非对映异构体:chiralpak ig(250x10mm),5μm柱,在35℃下,洗脱液:22%meoh(20mm nh3),78%co2,流速:10ml/min,浓
度:20mg/ml于甲醇中(无改性剂),进样体积:70μl,压力:154巴,波长:210nm。由此得到:
[3617]
峰1:(5s)-11-叔丁基-7,7-二甲基-3-苯基-17λ
6-硫杂-2,8,10,16,22-五氮杂四环[16.3.1.15,8.09,14]二十三碳-1(21),9(14),10,12,18(22),19-六烯-15,17,17-三酮(10.0mg,10%);esi-ms m/z计算值533.24603,实验值534.5(m 1)
;保留时间:2.16分钟(lc方法a)。
[3618]
峰2:(5s)-11-叔丁基-7,7-二甲基-3-苯基-17λ
6-硫杂-2,8,10,16,22-五氮杂四环[16.3.1.15,8.09,14]二十三碳-1(21),9(14),10,12,18(22),19-六烯-15,17,17-三酮(2.4mg,2%);esi-ms m/z计算值533.24603,实验值534.5(m 1)
;保留时间:2.17分钟(lc方法a)。
[3619]
实施例153:(14s)-8-叔丁基-17-(4-叔丁基吡啶-2-基)-12,12-二甲基-2λ
6-硫杂-3,11,18,23-四氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5,7,9,19,21-六烯-2,2,4-三酮(化合物417)和(14s)-7-溴-8-叔丁基-17-(4-叔丁基吡啶-2-基)-12,12-二甲基-2λ
6-硫杂-3,11,18,23-四氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5,7,9,19,21-六烯-2,2,4-三酮(化合物418)的制备
[3620][3621]
步骤1:(4s)-4-[3-[[6-[(5-溴-4-叔丁基-2-氟-苯甲酰基)氨磺酰基]-2-吡啶基]氨基]-3-(4-叔丁基-2-吡啶基)丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯
[3622][3623]
向圆底烧瓶中装入4-叔丁基-2-氟-苯甲酸(230mg,1.1370mmol)和thf(7ml)。添加1,1'-羰基二咪唑(185mg,1.1409mmol),并且将混合物在室温下在氮气下搅拌2小时。在单独的烧瓶中,在氮气下制备(4s)-4-[3-(4-叔丁基-2-吡啶基)-3-[(6-氨磺酰基-2-吡啶基)氨基]丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(520mg,0.9528mmol)于thf(7ml)中的溶液,并且随后经由注射器将其添加到活化的酸溶液中。添加1,8-二氮杂双环[5.4.0]十一碳-7-烯(610.80mg,0.6ml,4.0122mmol),并将反应混合物在氮气下在室温下搅拌18小时。然后在减压下移除溶剂。粗物质通过反相色谱法,用5%至100%mecn/水(含0.1%甲酸作为改性剂)梯度洗脱进行直接纯化,得到呈黄色固体状的(4s)-4-[3-[[6-[(5-溴-4-叔丁基-2-氟-苯甲酰基)氨磺酰基]-2-吡啶基]氨基]-3-(4-叔丁基-2-吡啶基)丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(300mg,36%)。1h nmr(400mhz,cdcl3)δ8.49(d,j=5.4hz,1h),7.97(d,j=7.3hz,1h),7.58-7.52(m,2h),7.22-7.15(m,2h),6.62-6.57(m,1h),5.89(d,j=7.1hz,1h),5.18-5.08(m,1h),4.11-4.00(m,1h),2.77(t,j=10.8hz,1h),2.32-2.19(m,1h),2.14-2.03(m,1h),1.98-1.83(m,1h),1.80-1.70(m,2h),1.49(s,10h),1.44(s,8h),1.34-1.23(m,19h)。
19
f nmr(377mhz,cdcl3)δ
–
113.56(br.s.,1f)。esi-ms m/z计算值801.29346,实验值802.2(m 1)
;保留时间:2.19分钟(lc方法e)。
[3624]
步骤2:5-溴-4-叔丁基-n-[[6-[[1-(4-叔丁基-2-吡啶基)-3-[(3s)-5,5-二甲基吡咯烷-3-基]丙基]氨基]-2-吡啶基]磺酰基]-2-氟-苯甲酰胺
[3625][3626]
在圆底烧瓶中,向(4s)-4-[3-[[6-[(5-溴-4-叔丁基-2-氟-苯甲酰基)氨磺酰基]-2-吡啶基]氨基]-3-(4-叔丁基-2-吡啶基)丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(300mg,0.3385mmol)于dcm(4ml)中的溶液中添加含4m hcl的二噁烷(2ml,4m,8.0000mmol),然后将其在室温下搅拌2小时。将溶剂蒸发,得到呈浅黄色固体状的粗制5-溴-4-叔丁基-n-[[6-[[1-(4-叔丁基-2-吡啶基)-3-[(3s)-5,5-二甲基吡咯烷-3-基]丙基]氨基]-2-吡啶基]磺酰基]-2-氟-苯甲酰胺(盐酸盐)(297mg,107%)。1h nmr(400mhz,dmso-d6)δ9.23-8.94(m,2h),8.51(d,j=6.1hz,1h),8.15(d,j=8.1hz,1h),7.85(br.s.,1h),7.76-7.60(m,3h),7.33(d,j=13.0hz,1h),7.23(d,j=7.3hz,1h),7.00(d,j=8.3hz,1h),5.24-5.20(m,1h),3.42-3.28(m,1h),2.91-2.79(m,1h),2.44-2.36(m,1h),2.03-1.91(m,
3h),1.60-1.35(m,15h),1.27-1.19(m,12h)。
19
f nmr(377mhz,dmso-d6)δ
–
112.94(br.s.,1f)。esi-ms m/z计算值701.241,实验值702.2(m 1)
;保留时间:1.51分钟(lc方法e)。
[3627]
步骤3:(14s)-7-溴-8-叔丁基-17-(4-叔丁基吡啶-2-基)-12,12-二甲基-2λ
6-硫杂-3,11,18,23-四氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5,7,9,19,21-六烯-2,2,4-三酮(化合物418)
[3628][3629]
在火焰干燥的反应管中,将5-溴-4-叔丁基-n-[[6-[[1-(4-叔丁基-2-吡啶基)-3-[(3s)-5,5-二甲基吡咯烷-3-基]丙基]氨基]-2-吡啶基]磺酰基]-2-氟-苯甲酰胺(盐酸盐)(240mg,0.2917mmol)溶解于dmso(5ml)中,然后添加碳酸铯(815mg,2.5014mmol)。将管密封并加热到150℃。将反应混合物在此温度下搅拌4天。将反应混合物过滤,然后通过反相色谱法,使用c
18
柱和5%至100%乙腈/水(含有0.1%甲酸)梯度进行纯化,得到呈白色固体状的(14s)-7-溴-8-叔丁基-17-(4-叔丁基吡啶-2-基)-12,12-二甲基-2λ
6-硫杂-3,11,18,23-四氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5,7,9,19,21-六烯-2,2,4-三酮(35mg,17%)。1h nmr(400mhz,dmso-d6)δ8.40(d,j=5.1hz,1h),7.63-7.57(m,1h),7.47-7.44(m,2h),7.23(dd,j=5.3,1.8hz,1h),7.11-7.00(m,2h),6.85-6.82(m,1h),5.28-5.22(m,1h),3.21(br.s.,1h),2.86(br.s.,1h),2.22(br.s.,1h),1.97-1.83(m,3h),1.72-1.67(m,1h),1.61-1.34(m,18h),1.23(s,9h)。esi-ms m/z计算值681.2348,实验值682.3(m 1)
;保留时间:4.59分钟(lc方法f)。
[3630]
步骤4:(14s)-8-叔丁基-17-(4-叔丁基吡啶-2-基)-12,12-二甲基-2λ
6-硫杂-3,11,18,23-四氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5,7,9,19,21-六烯-2,2,4-三酮(化合物417)
[3631][3632]
将钯/碳(10%,50%湿,5%w/w,30mg,0.0141mmol)添加到(14s)-7-溴-8-叔丁基-17-(4-叔丁基吡啶-2-基)-12,12-二甲基-2λ
6-硫杂-3,11,18,23-四氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5,7,9,19,21-六烯-2,2,4-三酮(30mg,0.0435mmol)于甲醇(1ml)中的混合物中。将氢气鼓泡到悬浮液中持续2分钟,并且然后将反应混合物在氢气氛下搅拌48小时。将反应混合物在硅藻土上过滤并用甲醇冲洗。浓缩滤液。
粗物质通过反相色谱法,使用c
18
柱和5%至100%乙腈/水梯度进行直接纯化,得到呈白色固体状的(14s)-8-叔丁基-17-(4-叔丁基吡啶-2-基)-12,12-二甲基-2λ
6-硫杂-3,11,18,23-四氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5,7,9,19,21-六烯-2,2,4-三酮(15mg,57%)。1h nmr(400mhz,dmso-d6)δ12.55(br.s.,1h),8.41(d,j=5.4hz,1h),7.66-7.55(m,2h),7.47(br.s.,1h),7.32(d,j=8.3hz,1h),7.26-7.23(m,1h),7.09(d,j=7.1hz,1h),7.01(d,j=1.7hz,1h),6.86(d,j=8.3hz,1h),6.75(dd,j=8.3,1.5hz,1h),5.30-5.27(m,1h),3.26-3.19(m,1h),2.91(t,j=10.1hz,1h),2.30-2.25(m,1h),1.93-1.89(m,3h),1.72-1.67(m,1h),1.60-1.53(m,4h),1.43-1.39(m,1h),1.36(s,3h),1.27(s,9h),1.24(s,9h)。esi-ms m/z计算值603.32434,实验值604.4(m 1)
;保留时间:3.79分钟(lc方法f)。
[3633]
实施例154:(14s)-8-叔丁基-17-[4-(3,3-二甲基丁基)吡啶-2-基]-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮(化合物419)的制备
[3634][3635]
步骤1:(14s)-8-叔丁基-17-{4-[(1e)-3,3-二甲基丁-1-烯-1-基]吡啶-2-基}-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮
[3636][3637]
将(14s)-17-(4-溴吡啶-2-基)-8-叔丁基-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5(10),6,8,19(23),20-六烯-2,2,4-三酮(51.4mg,0.08190mmol)、[(e)-3,3-二甲基丁-1-烯基]硼酸(22.9mg,0.1789mmol)、二氯[1,1'-双(二苯基膦基)二茂铁]钯(ii)二氯甲烷加合物(6.9mg,0.008449mmol)和2m碳酸钾水溶液(125μl,2m,0.2500mmol)合并于dmf(1ml)并在90℃下加热16小时。将反应物过滤并通过反相hplc,使用1%-99%乙腈/5mm hcl水溶液梯度进行纯化,得到呈灰白色固体状的(14s)-8-叔丁基-17-{4-[(1e)-3,3-二甲基丁-1-烯-1-基]吡啶-2-基}-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮(30.9mg,60%)。esi-ms m/z计算值630.3352,实验值631.4(m 1)
;保留时间:0.74分钟(lc方法d)。
[3638]
步骤2:(14s)-8-叔丁基-17-[4-(3,3-二甲基丁基)吡啶-2-基]-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮(化合物419)
[3639][3640]
在氢气气球下,将(14s)-8-叔丁基-17-{4-[(1e)-3,3-二甲基丁-1-烯-1-基]吡啶-2-基}-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮(30mg,0.04756mmol)和pd/c(12mg,10%w/w,0.01128mmol)合并于甲醇(4ml)中。将反应混合物在室温下搅拌4小时。将反应物过滤,并将固体用甲醇洗涤。将有机物蒸发,并将粗物质通过硅胶色谱法,用0-100%乙酸乙酯/己烷洗脱进行纯化,得到呈白色固体状的(14s)-8-叔丁基-17-[4-(3,3-二甲基丁基)吡啶-2-基]-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮(5mg,17%)。esi-ms m/z计算值632.3508,实验值633.5(m 1)
;保留时间:1.94分钟(lc方法a)。
[3641]
实施例155:(14s)-8-叔丁基-17-{[5-(3,3-二甲基丁基)吡啶-2-基]甲基}-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮(化合物420)和(14s)-8-叔丁基-17-{[5-(3,3-二甲基丁基)吡啶-2-基]甲基}-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮(化合物421)的制备
[3642][3643]
步骤1:(4s)-4-[4-(5-溴-2-吡啶基)-3-(叔丁基亚磺酰基氨基)丁基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯
[3644][3645]
在-78℃下,将5-溴-2-甲基-吡啶(2.03g,11.801mmol)于thf(10ml)中的溶液缓慢添加到lda(2m于thf/庚烷/乙苯中)(6ml,2m,12.000mmol)于thf(50ml)中的溶液中。将所得混合物在-78℃下搅拌3小时。然后,在-78℃下逐滴添加(4s)-4-[(3z)-3-叔丁基亚磺酰基亚氨基丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(3g,7.8653mmol)于thf(15ml)中的溶液,并将所得混合物在此温度下搅拌2小时。在使其在1小时内缓慢升温至室温后,用饱和nh4cl水溶液(80ml)处理所得混合物。将产物用乙酸乙酯(3
×
80ml)萃取。将合并的萃取物用水(80ml)洗涤,用无水硫酸钠干燥,过滤并减压浓缩。将粗产物通过反相色谱法,使用5%至100%乙腈/水梯度直接纯化。从所得的级分中蒸发乙腈,并用etoac(3
×
80ml)萃取产物。将合并的萃取物用盐水(80ml)洗涤,用无水硫酸钠干燥,过滤并减压浓缩。通过硅胶色谱法,使用70%-100%etoac/庚烷梯度进行二次纯化,得到(4s)-4-[4-(5-溴-2-吡啶基)-3-(叔丁基亚磺酰基氨基)丁基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(2.22g,53%);esi-ms m/z计算值529.1974,实验值530.2(m 1)
;保留时间:2.02分钟(lc方法e)。
[3646]
步骤2:(4s)-4-[3-氨基-4-(5-溴-2-吡啶基)丁基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯
[3647][3648]
将碘(600mg,0.1217ml,2.3640mmol)添加到(4s)-4-[4-(5-溴-2-吡啶基)-3-(叔丁基亚磺酰基氨基)丁基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(6.65g,12.534mmol)于thf(50ml)和h2o(10ml)中的溶液中。将反应物在60℃下搅拌2小时。然后,添加第二份碘(300mg,0.0609ml,1.1820mmol),并将反应物在60℃下再搅拌2小时。将反应物用乙酸乙酯(150ml)稀释,并且依次用5%碳酸氢钠水溶液(2
×
100ml)、10%硫代硫酸钠水溶液(2
×
100ml)和盐水(100ml)洗涤。有机相经硫酸钠干燥,过滤并蒸发至干燥。所得粗产物通过反相色谱法,用5%至100%乙腈/水(含0.1%甲酸作为改性剂)洗脱进行纯化,得到(4s)-4-[3-氨基-4-(5-溴-2-吡啶基)丁基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(4g,73%);1h nmr(400mhz,cdcl3)δ8.60(s,1h),7.73(d,j=8.1hz,1h),7.07(d,j=8.3hz,1h),3.79-3.56(m,1h),3.18(dd,j=7.5,3.8hz,1h),2.98-2.78(m,2h),2.63(dd,j=13.7,8.6hz,1h),2.18-2.02(m,1h),1.95-1.82(m,1h),1.52-1.22(m,22h)。esi-ms m/z计算值425.1678,实验值426.2(m 1)
;保留时间:1.45分钟(lc方法e)。
[3649]
步骤3:(4s)-4-[4-(5-溴-2-吡啶基)-3-[(6-氨磺酰基-2-吡啶基)氨基]丁基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯
[3650][3651]
向(4s)-4-[3-氨基-4-(5-溴-2-吡啶基)丁基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(3.8g,8.7338mmol)和6-氟吡啶-2-磺酰胺(4.9g,27.814mmol)于ch3cn(28ml)中的溶液中添加dipea(4.4520g,6ml,34.447mmol)。将反应管密封,并将混合物在120℃下搅拌24小时。使混合物冷却至室温。然后,将第二份dipea(2.2260g,3ml,17.223mmol)和6-氟吡啶-2-磺酰胺(2.4g,13.623mmol)添加到反应混合物中。将管密封,并将混合物在120℃下搅拌24小时。将反应物在dcm(100ml)和水(100ml)之间分配。将水相用dcm(2
×
75ml)萃取。将合并的有机层用盐水(100ml)洗涤,经硫酸钠干燥,过滤并浓缩。将粗物质通过反相色谱法,用5%至100%乙腈/水(含0.1%hco2h作为改性剂)洗脱进行纯化。将产物级分合并并蒸发。添加乙酸乙酯(250ml),并将所得溶液用饱和nahco3水溶液(150ml)洗涤,然后用水(150ml)洗涤,经na2so4干燥,过滤并真空蒸发,得到(4s)-4-[4-(5-溴-2-吡啶基)-3-[(6-氨磺酰基-2-吡啶基)氨基]丁基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯。使用硅胶色谱法(用30%至65%乙酸乙酯/庚烷洗脱)进行二次纯化,得到呈白色固体状的(4s)-4-[4-(5-溴-2-吡啶基)-3-[(6-氨磺酰基-2-吡啶基)氨基]丁基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(4.27g,84%)。1h nmr(400mhz,dmso-d6)δ8.57(d,j=2.4hz,1h),7.90(dd,j=8.3,2.4hz,1h),7.50(t,j=7.8hz,1h),7.33(d,j=8.3hz,1h),7.09(s,2h),7.02-6.84(m,2h),6.58(d,j=8.6hz,1h),4.41-4.24(m,1h),3.55-3.40(m,1h),3.04-2.83(m,2h),2.80-2.66(m,1h),2.06-1.99(m,1h),1.88-1.72(m,1h),1.59-1.44(m,2h),1.44-1.28(m,15h),1.22-1.19(m,3h)。esi-ms m/z计算值581.1671,实验值582.2(m 1)
;保留时间:4.38分钟(lc方法f)。
[3652]
步骤4:(4s)-4-[4-(5-溴-2-吡啶基)-3-[[6-[(6-叔丁基-2-氟-吡啶-3-羰基)氨磺酰基]-2-吡啶基]氨基]丁基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯
[3653][3654]
将6-叔丁基-2-氟-吡啶-3-甲酸(621mg,3.149mmol)和cdi(577.1mg,3.559mmol)的混合物溶解于thf(6ml)中,并将混合物在室温下搅拌16小时。添加(4s)-4-[4-(5-溴-2-吡啶基)-3-[(6-氨磺酰基-2-吡啶基)氨基]丁基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(1.038g,1.782mmol),随后添加dbu(1.1ml,7.356mmol),并将所得混合物再搅拌24小时。将
混合物用乙酸乙酯稀释,并用1n hcl洗涤,然后用盐水洗涤,经硫酸钠干燥并真空浓缩。将粗物质通过硅胶色谱法,用0-60%乙酸乙酯/己烷洗脱进行纯化,得到呈澄清油状物的(4s)-4-[4-(5-溴-2-吡啶基)-3-[[6-[(6-叔丁基-2-氟-吡啶-3-羰基)氨磺酰基]-2-吡啶基]氨基]丁基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(557mg,41%)。esi-ms m/z计算值760.24176,实验值761.3(m 1)
;保留时间:0.87分钟(lc方法d)。
[3655]
步骤5:(14s)-17-[(5-溴吡啶-2-基)甲基]-8-叔丁基-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮和(14s)-17-[(5-溴吡啶-2-基)甲基]-8-叔丁基-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮
[3656][3657]
阶段1:将(4s)-4-[4-(5-溴-2-吡啶基)-3-[[6-[(6-叔丁基-2-氟-吡啶-3-羰基)氨磺酰基]-2-吡啶基]氨基]丁基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(557mg,0.7312mmol)和tfa(600μl,7.788mmol)合并于dcm(5ml)中,并在室温下搅拌2小时。将反应混合物蒸发并直接用于下一步。
[3658]
阶段2:将来自第1阶段的胺与碳酸钾(1.21g,8.755mmol)一起溶解于nmp(10ml)中,并在120℃下加热16小时。将反应物冷却至室温,并在乙酸乙酯和1n hcl之间分配。将有机物分离,用盐水洗涤,经硫酸钠干燥,并真空蒸发。将粗物质通过硅胶色谱法,用0-100%乙酸乙酯/己烷洗脱进行纯化,得到两种非对映异构体。
[3659]
峰1:(14s)-17-[(5-溴吡啶-2-基)甲基]-8-叔丁基-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮(99.7mg,21%);esi-ms m/z计算值640.1831,实验值641.3(m 1)
;保留时间:0.79分钟(lc方法d)。
[3660]
峰2:(14s)-17-[(5-溴吡啶-2-基)甲基]-8-叔丁基-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮(120.0mg,26%);esi-ms m/z计算值640.1831,实验值641.3(m 1)
;保留时间:0.76分钟(lc方法d)。
[3661]
步骤6:(14s)-8-叔丁基-17-({5-[(1e)-3,3-二甲基丁-1-烯-1-基]吡啶-2-基}甲基)-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮
[3662][3663]
将峰1(14s)-17-[(5-溴吡啶-2-基)甲基]-8-叔丁基-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮(30.1mg,0.04691mmol)、[(e)-3,3-二甲基丁-1-烯基]硼酸(12.7mg,0.09924mmol)、二氯[1,1'-双(二苯基膦基)二茂铁]钯(ii)二氯甲烷加合物(6mg,0.007347mmol)和碳酸钾水溶液(70μl,2m,0.1400mmol)合并于dmf(0.5ml)并在90℃下加热16小时。将反应物冷却,用dmso(0.5ml)稀释,过滤并通过反相hplc,使用1%-99%乙腈/5mm hcl梯度进行纯化,得到峰1,即呈灰白色固体状的(14s)-8-叔丁基-17-({5-[(1e)-3,3-二甲基丁-1-烯-1-基]吡啶-2-基}甲基)-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮(盐酸盐)(21.4mg,67%)。esi-ms m/z计算值644.3508,实验值645.5(m 1)
;保留时间:0.7分钟(lc方法d)。
[3664]
步骤7:(14s)-8-叔丁基-17-{[5-(3,3-二甲基丁基)吡啶-2-基]甲基}-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮(化合物420)
[3665][3666]
在氢气气球下,将峰1(14s)-8-叔丁基-17-({5-[(1e)-3,3-二甲基丁-1-烯-1-基]吡啶-2-基}甲基)-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮(盐酸盐)(21.4mg,0.03141mmol)和pd/c(8.9mg,10%w/w,0.008363mmol)合并于甲醇(4ml)中。将反应混合物在室温下搅拌4小时。将反应物过滤,并将固体用甲醇洗涤。将有机物蒸发,并将粗物质通过反相hplc,利用1%-99%乙腈/5mm hcl梯度进行纯化,得到峰1,即呈白色固体状的(14s)-8-叔丁基-17-{[5-(3,3-二甲基丁基)吡啶-2-基]甲基}-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮(盐酸盐)(6.0mg,28%)。esi-ms m/z计算值646.3665,实验值647.5(m 1)
;保留时间:1.86分钟(lc方法a)。
五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮(盐酸盐)(9.9mg,51%)。esi-ms m/z计算值646.3665,实验值647.5(m 1)
;保留时间:1.91分钟(lc方法a)。
[3673]
实施例156:(14s)-8-叔丁基-17-({5-[(3-甲氧基丙基)(甲基)氨基]吡啶-2-基}甲基)-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮(化合物422)的制备
[3674][3675]
将峰1(14s)-17-[(5-溴吡啶-2-基)甲基]-8-叔丁基-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮(27.9mg,0.04348mmol)和3-甲氧基-n-甲基-丙-1-胺(26.1mg,0.2530mmol)合并于二噁烷(400μl)中。添加ruphos pd g3(5.4mg,0.006456mmol)和叔丁醇钠(22.6mg,0.2352mmol)。将所得混合物用氮气吹扫,然后在90℃下搅拌6小时。然后将其冷却至室温,用dmso(600μl)稀释,过滤,并通过反相hplc,使用1%-99%乙腈/5mm hcl梯度进行纯化,得到峰1,即(14s)-8-叔丁基-17-({5-[(3-甲氧基丙基)(甲基)氨基]吡啶-2-基}甲基)-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮(盐酸盐)(4.7mg,15%)。esi-ms m/z计算值663.3567,实验值664.6(m 1)
;保留时间:1.68分钟(lc方法a)。
[3676]
实施例157:(14s)-8-叔丁基-17-({5-[(3-甲氧基丙基)(甲基)氨基]吡啶-2-基}甲基)-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮(化合物423)的制备
[3677][3678]
将峰2(14s)-17-[(5-溴吡啶-2-基)甲基]-8-叔丁基-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮(26.5mg,0.04130mmol)和3-甲氧基-n-甲基-丙-1-胺(27.0mg,0.2617mmol)合并于二噁烷(400μl)中。添加ruphos pd g3(5.3mg,0.006337mmol)和叔丁醇钠(23.1mg,0.2404mmol)。将所得混合物用氮气吹扫,然后在90℃下搅拌6小时。然后将其冷却至室温,用dmso(600μl)稀释,过滤,并通过反相hplc,使用1%-99%乙腈/5mm hcl梯度进行纯化,得到(14s)-8-叔丁基-17-({5-[(3-甲氧基丙基)(甲基)氨基]吡啶-2-基}甲基)-12,12-二甲
基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮(盐酸盐)(2.8mg,10%)。esi-ms m/z计算值663.3567,实验值664.5(m 1)
;保留时间:1.75分钟(lc方法a)。
[3679]
实施例158:(14s)-8-叔丁基-16-(2,2-二甲基丙基)-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5(10),6,8,19(23),20-六烯-2,2,4-三酮(化合物424)、(14s)-8-叔丁基-16-(2,2-二甲基丙基)-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5(10),6,8,19(23),20-六烯-2,2,4-三酮(化合物425)以及(14s)-8-叔丁基-16-(2,2-二甲基丙基)-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5(10),6,8,19(23),20-六烯-2,2,4-三酮(化合物426)的制备
[3680][3681]
步骤1:(4r)-4-(2-羟基-4,4-二甲基-戊基)-2,2-二甲基-吡咯烷-1-甲酸叔丁酯
[3682][3683]
在0℃下,向(4r)-2,2-二甲基-4-(2-氧代乙基)吡咯烷-1-甲酸叔丁酯(1.68g,6.3071mmol)于thf(27ml)中的溶液中逐滴添加新戊基氯化镁于thf(14ml,1m,14.0mmol)中的溶液。将混合物在0℃下搅拌1小时,然后用饱和氯化铵水溶液(30ml)淬灭。将混合物在乙酸乙酯(100ml)中稀释,并分离相。将水相用乙酸乙酯(2
×
50ml)萃取。合并的有机层经无水硫酸钠干燥,过滤并减压浓缩。将粗残余物通过硅胶色谱法,用0%至50%乙酸乙酯/庚烷洗脱进行纯化,得到呈白色固体状的(4r)-4-(2-羟基-4,4-二甲基戊基)-2,2-二甲基吡咯烷-1-甲酸叔丁酯(1.403g,64%)。1h nmr(400mhz,cdcl3)δ3.86-3.64(m,2h),2.98-2.87(m,1h),2.37-2.26(m,1h),2.03-1.89(m,1h),1.53-1.44(m,12h),1.43-1.29(m,9h),0.99-0.97(m,9h)。esi-ms m/z计算值313.2617,实验值258.2(m
–
tbu 2h=m
–
55)
;保留时间:2.07分钟(lc方法e)。
[3684]
步骤2:(4r)-4-(4,4-二甲基-2-氧代-戊基)-2,2-二甲基-吡咯烷-1-甲酸叔丁酯
[3685][3686]
向(4r)-4-(2-羟基-4,4-二甲基-戊基)-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(1.18g,3.3878mmol)于dcm(12ml)中的溶液中添加戴斯-马丁过碘烷(1.87g,4.4089mmol),并将混合物搅拌30分钟。将混合物用饱和nahco3水溶液(40ml)淬灭,并用dcm(2
×
40ml)萃取。将有机相用饱和nahco3水溶液(20ml)和盐水(20ml)洗涤,经硫酸钠干燥,过滤并浓缩至干燥。将粗物质通过硅胶色谱法,用0至40%乙酸乙酯/庚烷洗脱进行纯化,得到呈白色固体状的(4r)-4-(4,4-二甲基-2-氧代-戊基)-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(997mg,93%)。esi-ms m/z计算值311.246,实验值256.2(m
–
tbu 2h=m
–
55)
;保留时间:2.11分钟(lc方法e)。
[3687]
步骤3:(4s)-4-(4,4-二甲基-2-亚甲基-戊基)-2,2-二甲基-吡咯烷-1-甲酸叔丁酯
[3688][3689]
在0℃下,向甲基(三苯基)溴化鏻(1.64g,4.5910mmol)于thf(8.5ml)中的溶液中逐滴添加nahmds于thf(4.6ml,1m,4.6000mmol)中的溶液,并将混合物在室温下搅拌1小时。将所得黄色溶液用含(4r)-4-(4,4-二甲基-2-氧代-戊基)-2,2-二甲基吡咯烷-1-甲酸叔丁酯(580mg,1.8268mmol)的thf(8.5ml)处理,并将其在70℃下搅拌16小时。在冷却至室温之后,添加水(30ml),并将混合物用乙酸乙酯(3
×
30ml)萃取。将合并的有机相用盐水(2
×
20ml)洗涤,经硫酸钠干燥,过滤并浓缩至干燥。将粗残余物通过硅胶色谱法,用0%至20%乙酸乙酯/庚烷洗脱进行纯化,得到呈无色油状物的(4s)-4-(4,4-二甲基-2-亚甲基-戊
基)-2,2-二甲基吡咯烷-1-甲酸叔丁酯(444mg,77%)。esi-ms m/z计算值309.2668,实验值254.2(m
–
tbu 2h=m
–
55)
;保留时间:2.51分钟(lc方法e)。
[3690]
步骤4:(4s)-4-[2-(羟甲基)-4,4-二甲基-戊基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯
[3691][3692]
将(4s)-4-(4,4-二甲基-2-亚甲基-戊基)-2,2-二甲基吡咯烷-1-甲酸叔丁酯(444mg,1.3629mmol)于thf(15ml)中的溶液冷却至0℃,并添加含9-硼杂双环[3.3.1]壬烷溶液的thf(9.5ml,0.5m,4.7500mmol)。将所得混合物在氮气下在室温下搅拌16小时。在冷却至0℃之后,缓慢添加1n naoh(6.9ml,6.9000mmol)和过氧化氢(666mg,0.6000ml,6.8529mmol),并且将混合物在室温下搅拌24小时。将混合物用水(30ml)稀释,并用乙酸乙酯(3
×
40ml)萃取。有机相经硫酸钠干燥,过滤并浓缩至干燥。将粗制油状物通过硅胶色谱法,使用0%至20%乙酸乙酯/庚烷梯度进行纯化,得到呈无色油状物的(4s)-4-[2-(羟甲基)-4,4-二甲基-戊基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(440mg,89%)。esi-ms m/z计算值327.2773,实验值272.2(m
–
tbu 2h=m
–
55)
;保留时间:2.08分钟(lc方法e)。
[3693]
步骤5:(4s)-4-[4,4-二甲基-2-(甲基磺酰氧基甲基)戊基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯
[3694][3695]
在0℃下,向(4s)-4-[2-(羟甲基)-4,4-二甲基-戊基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(440mg,1.2092mmol)于dcm(6.5ml)中的溶液中添加三乙胺(159.72mg,0.22ml,1.5784mmol),随后添加甲磺酰氯(165.76mg,0.112ml,1.4470mmol)。移除冰浴,并将混合物搅拌2.5小时。将混合物在dcm(25ml)和水(20ml)之间分配。分离各相,并将水层用dcm(2
×
20ml)萃取。将有机相用盐水(2
×
20ml)洗涤,经硫酸钠干燥,过滤并浓缩至干燥,得到呈无色油状物的粗制(4s)-4-[4,4-二甲基-2-(甲基磺酰氧基甲基)戊基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(540mg,101%)。esi-ms m/z计算值405.25488,实验值350.2(m
–
tbu 2h=m
–
55)
;保留时间:2.09分钟(lc方法e)。
[3696]
步骤6:(4s)-4-[2-(叠氮基甲基)-4,4-二甲基-戊基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯
[3697][3698]
向(4s)-4-[4,4-二甲基-2-(甲基磺酰氧基甲基)戊基]-2,2-二甲基-吡咯烷-1-甲
酸叔丁酯(540mg,1.2169mmol)于dmf(8.5ml)中的溶液中添加叠氮化钠(175mg,2.6919mmol),并且将混合物在65℃下搅拌16小时。将混合物用水(25ml)稀释,并用乙酸乙酯(2
×
25ml)萃取。将有机相用盐水(3
×
25ml)洗涤,经硫酸钠干燥,过滤并浓缩至干燥,得到呈无色油状物的粗制(4s)-4-[2-(叠氮基甲基)-4,4-二甲基-戊基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(446mg,95%)。esi-ms m/z计算值352.2838,实验值253.4(m
–
boc 2h=m
–
99)
;保留时间:2.41分钟(lc方法e)。
[3699]
步骤7:(4s)-4-[2-(氨基甲基)-4,4-二甲基-戊基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯
[3700][3701]
通过鼓入氮气10分钟,使(4s)-4-[2-(叠氮基甲基)-4,4-二甲基-戊基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(446mg,1.1513mmol)于甲醇(11ml)中的溶液脱气。向溶液中添加10%钯/碳(50%湿;230mg,0.1081mmol),并且将混合物再用氮气脱气10分钟。将氢气鼓泡通过混合物持续10分钟,并且然后将混合物在室温下在氢气气氛下搅拌4小时。将混合物通过硅藻土垫过滤,并用甲醇(25ml)冲洗。将滤液减压浓缩,得到呈无色油状物的粗制(4s)-4-[2-(氨基甲基)-4,4-二甲基-戊基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(349mg,88%)。1h nmr(400mhz,cdcl3)δ3.78-3.59(m,1h),2.98-2.82(m,1h),2.66-2.54(m,1h),2.21-2.12(m,1h),1.95-1.88(m,1h),1.75-1.66(m,2h),1.53-1.34(m,16h),1.32-1.22(m,6h),0.91-0.88(m,9h)。esi-ms m/z计算值326.29333,实验值327.4(m 1)
;保留时间:1.51分钟(lc方法e)。
[3702]
步骤8:(4s)-4-[4,4-二甲基-2-[[(6-氨磺酰基-2-吡啶基)氨基]甲基]戊基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯
[3703][3704]
向(4s)-4-[2-(氨基甲基)-4,4-二甲基-戊基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(82mg,0.2509mmol)于mecn(1ml)中的溶液中添加dipea(129.85mg,0.175ml,1.0047mmol)和6-氟吡啶-2-磺酰胺(445mg,2.5260mmol)。将反应小瓶密封,并将混合物在120℃下加热18小时。将所得混合物冷却至室温,过滤,并且通过反相色谱法,用5%至100%甲醇/水洗脱进行纯化,得到呈白色固体状的(4s)-4-[4,4-二甲基-2-[[(6-氨磺酰基-2-吡啶基)氨基]甲基]戊基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(75mg,62%)。esi-ms m/z计算值482.29266,实验值427.2(m
–
tbu 2h=m
–
55)
;保留时间:2.03分钟(lc方法e)。
[3705]
步骤9:(4s)-4-[2-[[[6-[(6-叔丁基-2-氟-吡啶-3-羰基)氨磺酰基]-2-吡啶基]氨基]甲基]-4,4-二甲基-戊基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯
[3706][3707]
向圆底烧瓶中装入6-叔丁基-2-氟-吡啶-3-甲酸(50mg,0.2535mmol)和thf(1.5ml)。添加1,1'-羰基二咪唑(41mg,0.2529mmol),并且将混合物在室温下搅拌2小时。在单独的烧瓶中,在氮气下制备(4s)-4-[4,4-二甲基-2-[[(6-氨磺酰基-2-吡啶基)氨基]甲基]戊基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(75mg,0.1554mmol)于thf(1ml)中的溶液,并且将其添加到活化的酸溶液中。然后,添加1,8-二氮杂双环[5.4.0]十一碳-7-烯(71.260mg,70μl,0.4681mmol),并将反应混合物在氮气下在室温下搅拌16小时。减压浓缩后,将粗物质通过反相色谱法,用5%至100%甲醇/水梯度洗脱进行纯化,得到呈白色固体状的(4s)-4-[2-[[[6-[(6-叔丁基-2-氟-吡啶-3-羰基)氨磺酰基]-2-吡啶基]氨基]甲基]-4,4-二甲基-戊基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(95mg,79%)。1h nmr(400mhz,cdcl3)δ10.71(br s,1h),8.34(dd,j=9.8,8.8hz,1h),7.56-7.49(m,1h),7.46-7.41(m,1h),7.13(dd,j=7.8,2.0hz,1h),6.43-6.36(m,1h),4.79-4.67(m,1h),3.50-3.42(m,4h),2.96-2.88(m,2h),2.25-2.14(m,1h),2.09-2.00(m,2h),1.49-1.42(m,10h),1.35-1.26(m,17h),0.90(br s,9h)。esi-ms m/z计算值661.3673,实验值662.2(m 1)
;保留时间:2.37分钟(lc方法e)。
[3708]
步骤10:6-叔丁基-n-[[6-[[2-[[(3s)-5,5-二甲基吡咯烷-3-基]甲基]-4,4-二甲基-戊基]氨基]-2-吡啶基]磺酰基]-2-氟-吡啶-3-甲酰胺
[3709][3710]
将(4s)-4-[2-[[[6-[(6-叔丁基-2-氟-吡啶-3-羰基)氨磺酰基]-2-吡啶基]氨基]甲基]-4,4-二甲基-戊基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(95mg,0.1435mmol)于dcm(1ml)中的溶液用含4m hcl的二噁烷(0.4ml,1.6mmol)处理。在室温下搅拌2小时后,将混合物浓缩至干燥,得到呈白色固体状的粗制6-叔丁基-n-[[6-[[2-[[(3s)-5,5-二甲基吡咯烷-3-基]甲基]-4,4-二甲基-戊基]氨基]-2-吡啶基]磺酰基]-2-氟-吡啶-3-甲酰胺(盐酸盐)(103mg,91%)。1h nmr(400mhz,dmso-d6)δ12.48(br s,1h),9.67(s,1h),8.89-8.76(m,1h),8.18-8.10(m,1h),7.64-7.57(m,1h),7.50(s,1h),7.25-7.17(m,1h),7.16(d,j=1.7hz,1h),6.81-6.73(m,1h),3.51-3.43(m,2h),3.28-3.21(m,2h),2.87-2.72(m,1h),2.71-2.62(m,2h),2.11-2.02(m,1h),1.97-1.87(m,2h),1.39-1.33(m,3h),1.32-1.25(m,14h),0.80(s,9h)。esi-ms m/z计算值561.3149,实验值562.2(m 1)
;保留时间:1.62分钟(lc方法e)。
[3711]
步骤11:(14s)-8-叔丁基-16-(2,2-二甲基丙基)-12,12-二甲基-2λ
6-硫杂-3,9,
11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5(10),6,8,19(23),20-六烯-2,2,4-三酮(化合物424)
[3712][3713]
向6-叔丁基-n-[[6-[[2-[[(3s)-5,5-二甲基吡咯烷-3-基]甲基]-4,4-二甲基-戊基]氨基]-2-吡啶基]磺酰基]-2-氟-吡啶-3-甲酰胺(盐酸盐)(85mg,0.1421mmol)于dmso(1.5ml)中的溶液中添加碳酸钾(150mg,1.0853mmol)。将反应小瓶密封,并将混合物在120℃下搅拌24小时。将混合物冷却至室温,过滤并通过反相色谱法,用5%至100%甲醇/水洗脱进行纯化,得到呈白色固体状的(14s)-8-叔丁基-16-(2,2-二甲基丙基)-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5(10),6,8,19(23),20-六烯-2,2,4-三酮(21mg,27%)。1h nmr(400mhz,dmso-d6)δ7.51-7.29(m,2h),6.91-6.82(m,1h),6.65-6.48(m,1h),6.47-6.31(m,2h),3.95-3.80(m,1h),3.57-3.37(m,1h),3.05-2.92(m,1h),2.76-2.65(m,1h),2.30-2.09(m,1h),1.94-1.76(m,1h),1.70(dd,j=11.2,4.4hz,1h),1.62(s,1h),1.57(s,2h),1.48(s,3h),1.45-1.35(m,2h),1.34-1.16(m,12h),0.97-0.84(m,9h)。esi-ms m/z计算值541.30865,实验值542.3(m 1)
;保留时间:4.06分钟(lc方法f)。
[3714]
步骤12:(14s)-8-叔丁基-16-(2,2-二甲基丙基)-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5(10),6,8,19(23),20-六烯-2,2,4-三酮(化合物425)和(14s)-8-叔丁基-16-(2,2-二甲基丙基)-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5(10),6,8,19(23),20-六烯-2,2,4-三酮(化合物426)
[3715][3716]
在35℃下,使用chiralpak ig柱(250x10mm;5μm)对(14s)-8-叔丁基-16-(2,2-二甲基丙基)-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5(10),6,8,19(23),20-六烯-2,2,4-三酮(8.6mg,0.01587mmol)(非对映异构体的30:70混合物)进行手性sfc。流动相为18%meoh(含20mm nh3),82%co2,流速为10ml/min。样品浓度为24mg/ml于甲醇中(无改性剂),进样体积为70μl,出口压力为152巴,检测波长为210nm。蒸发溶剂,得到呈无色膜状物的两种异构体。
[3717]
峰1:(14s)-8-叔丁基-16-(2,2-二甲基丙基)-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5(10),6,8,19(23),20-六烯-2,2,4-三酮(1.2mg,47%);esi-ms m/z计算值541.30865,实验值542.48(m 1)
;保留时间:2.44分钟(lc方法a)。
[3718]
峰2:(14s)-8-叔丁基-16-(2,2-二甲基丙基)-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5(10),6,8,19(23),20-六烯-2,2,4-三酮(3.7mg,61%);esi-ms m/z计算值541.30865,实验值542.52(m 1)
;保留时间:2.45分钟(lc方法a)。
[3719]
实施例159:(14s)-7-苄基-8-[3-(2-{二螺[2.0.24.13]庚-7-基}乙氧基)-1h-吡唑-1-基]-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮(化合物427)的制备
[3720][3721]
步骤1:3-苄基-2,6-二氟-吡啶
[3722][3723]
在250-ml圆底烧瓶中,将(2,6-二氟-3-吡啶基)硼酸(3.1351g,19.73mmol)、苄基氯(2.64g,20.86mmol)和pd(pph3)4(0.5525g,0.4781mmol)与dme(80ml)和na2co3水溶液(40ml,2.0m,80.00mmol)混合。将所得混合物用氮气吹扫5分钟,并且然后在110℃下回流搅拌92小时。将其冷却至室温,并且通过硅藻土过滤(用100ml etoac冲洗)。将滤液用h2o(100ml)稀释,并且分离各层。将有机层置于一旁,并用etoac(100ml)萃取水层。将合并的有机萃取物用h2o(100ml)和盐水(100ml)洗涤,然后经na2so4干燥,过滤并真空蒸发。通过硅胶色谱法(220g二氧化硅),使用0至15%etoac/己烷的梯度洗脱来进行纯化,得到无色油状物3-苄基-2,6-二氟吡啶(2.6395g,65%)1h nmr(400mhz,dmso-d6)δ8.06(dt,j=9.9,8.0hz,1h),7.33-7.27(m,2h),7.26-7.20(m,3h),7.14(dd,j=8.0,2.7hz,1h),3.98(s,2h)。
[3724]
步骤2:5-苄基-2,6-二氟吡啶-3-甲酸
[3725][3726]
在100-ml圆底烧瓶中,将二异丙胺(3.0ml,21.41mmol)和thf(25ml)在氮气气氛下冷却至-78℃,向其中添加n-buli(8.0ml,2.5m,20.00mmol)的己烷溶液。将所得混合物在
–
78℃下搅拌15分钟,随后一次性添加3-苄基-2,6-二氟-吡啶(2.7675g,13.49mmol)的thf(10ml)溶液。将所得混合物在
–
78℃下搅拌1小时,随后将co2气流(由16号针历经10分钟注入的恒定流量)鼓入该混合物中。将所得混合物在-78℃下搅拌15分钟,随后在1小时内将其升温至室温。然后将其倒入含有1n hcl溶液(100ml)的烧瓶中,并用etoac(3
×
75ml)萃取混合物。将合并的有机萃取物用h2o(100ml)和盐水(100ml)洗涤,然后经na2so4干燥,过滤并真空蒸发,得到粘性黄色液体,将其在高真空下固化隔夜。所得产物可能仅为约50%纯度:5-苄基-2,6-二氟-吡啶-3-甲酸(3.7g,55%)。
[3727]
步骤3:(4s)-4-[3-[[6-[(5-苄基-2,6-二氟-吡啶-3-羰基)氨磺酰基]-2-吡啶基]氨基]丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯
[3728][3729]
在20-ml小瓶中,将5-苄基-2,6-二氟-吡啶-3-甲酸(402.5mg,0.8075mmol)与dcm(7.0ml)混合并冷却至0℃,向其中添加dmf(20μl,0.2583mmol)和草酰氯(200μl,2.293mmol)。将所得混合物在4小时内升温至室温。在验证确实形成酰氯后(使用吗啉将少量样品淬灭,得到(5-苄基-2,6-二氟-3-吡啶基)-吗啉基-甲酮),真空蒸发混合物。
[3730]
单独地,在20-ml微波小瓶中,制备(4s)-2,2-二甲基-4-[3-[(6-氨磺酰基-2-吡啶基)氨基]丙基]吡咯烷-1-甲酸叔丁酯(450mg,0.8574mmol)和dipea(1.0ml,5.741mmol)于dcm(6.0ml)中的溶液。将上述生成的粗制酰氯溶解于dcm(3.0ml)中并添加到磺酰胺溶液中。将所得混合物在室温下搅拌72小时。然后将其倒入0.5n hcl(20ml)中,并用etoac(3
×
10ml)萃取。将合并的有机萃取物用h2o(20ml)和盐水(20ml)洗涤,然后经na2so4干燥,过滤并真空蒸发。通过硅胶色谱法(24g二氧化硅),使用0至80%etoac/己烷的梯度洗脱来进行纯化,得到米色泡沫。这含有产物,但相当不纯(uplc测定约30%纯):(4s)-4-[3-[[6-[(5-苄基-2,6-二氟-吡啶-3-羰基)氨磺酰基]-2-吡啶基]氨基]丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(245.6mg,14%)esi-ms m/z计算值643.264,实验值644.3(m 1)
;保留时间:2.13分钟(lc方法a)。
[3731]
步骤4:(14s)-7-苄基-8-氟-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮
[3732][3733]
阶段1:在20-ml小瓶中,将(4s)-4-[3-[[6-[(5-苄基-2,6-二氟-吡啶-3-羰基)氨磺酰基]-2-吡啶基]氨基]丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(245.6mg,0.1145mmol)溶解于dcm(2.0ml)中,向其添加tfa(0.5ml,6.490mmol)。将所得溶液在室温下搅拌21小时。将其真空蒸发,再溶解于meoh(3.0ml)中,然后过滤并通过反相制备型色谱法,使用c
18
柱和含5mm hcl溶液的1%至60%mecn/h2o梯度洗脱进行纯化,得到不纯(约40%纯)的5-苄基-n-[[6-[3-[(3s)-5,5-二甲基吡咯烷-3-基]丙基氨基]-2-吡啶基]磺酰基]-2,6-二氟-吡啶-3-甲酰胺(盐酸盐)(156.1mg,94%);esi-ms m/z计算值543.21155,实验值544.2(m 1)
;保留时间:1.25分钟(lc方法a)。
[3734]
阶段2:在1打兰小瓶中,将来自步骤1的产物溶解于nmp(1.5ml)中,向其中添加k2co3(107.1mg,0.7749mmol)。将所得混合物在160℃下搅拌21.5小时。将其冷却至室温,然后倒入1n hcl(3ml)中。添加etoac(2ml)。将各相剧烈混合,并且然后使其沉降成两层。将有机层过滤,并且通过反相制备型色谱法使用c
18
柱和含有5mm hcl溶液的1%至99%乙腈/水梯度洗脱进行纯化,得到黄色固体(14s)-7-苄基-8-氟-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮(19.7mg,33%);1h nmr(400mhz,dmso-d6)δ12.54(s,1h),7.78(d,j=10.0hz,1h),7.57(dd,j=8.5,7.2hz,1h),7.35-7.27(m,2h),7.27-7.16(m,3h),7.05(d,j=7.1hz,1h),6.98(d,j=9.1hz,1h),6.71(d,j=8.5hz,1h),3.98-3.88(m,1h),3.88-3.77(m,2h),3.14-3.04(m,1h),2.98-2.89(m,1h),2.63(t,j=10.4hz,1h),2.15-2.00(m,1h),1.81(dd,j=11.9,5.3hz,1h),1.78-1.67(m,1h),1.61-1.55(m,1h),1.53(s,3h),1.52-1.46(m,1h),1.40(s,3h),1.38-1.17(m,2h)。esi-ms m/z计算值523.2053,实验值524.1(m 1)
;保留时间:1.98分钟(lc方法a)。
[3735]
步骤5:(14s)-7-苄基-8-[3-(2-{二螺[2.0.24.13]庚-7-基}乙氧基)-1h-吡唑-1-基]-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮(化合物427)
[3736][3737]
在1打兰小瓶中,将3-(2-二螺[2.0.24.13]庚-7-基乙氧基)-1h-吡唑(14.0mg,0.06854mmol)和(14s)-7-苄基-8-氟-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮(14.0mg,0.02674mmol)与k2co3(28.0mg,0.2026mmol)和nmp(200μl)混合,并将所得混合物在170℃下搅拌17小时。此后,将其冷却至室温,并添加第二份k2co3(28.0mg,0.2026mmol)。将所得混合
物在170℃下再搅拌26小时。将其冷却至室温,然后添加1n hcl(1ml),随后添加etoac(1ml)。将各相剧烈混合,并且然后使其沉降成两层。将有机层过滤,并通过反相制备型色谱法,使用c
18
柱和含5mm hcl溶液的30%至99%乙腈/水梯度洗脱进行纯化,得到米色粉末状(14s)-7-苄基-8-[3-(2-{二螺[2.0.24.13]庚-7-基}乙氧基)-1h-吡唑-1-基]-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮(7.8mg,41%);esi-ms m/z计算值707.3254,实验值708.3(m 1)
;保留时间:2.49分钟(lc方法a)。
[3738]
实施例160:8-[3-(2-{二螺[2.0.24.13]庚-7-基}乙氧基)-1h-吡唑-1-基]-12,12-二甲基-15-(2-苯乙基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5(10),6,8,19(23),20-六烯-2,2,4-三酮(化合物428)的制备
[3739][3740]
步骤1:2,2-二甲基-5-氧代-吡咯烷-1-甲酸叔丁酯
[3741][3742]
将5,5-二甲基吡咯啶-2-酮(10.6g,90.864mmol)溶解于ch3cn(110ml)中,并且在冰水浴中冷却混合物。添加boc2o(21.6g,98.970mmol)。将混合物在相同温度下搅拌15分钟。然后添加dmap(1.2g,9.8225mmol)。将混合物升温至室温并搅拌15小时。然后将其浓缩,并将残余物转移到etoac(150ml)中,用水(100ml
×
2)、盐水洗涤,经mgso4干燥,过滤并浓缩。将残余物通过硅胶色谱法,使用0-20%etoac/己烷进行纯化,得到呈白色固体状的所需产物:2,2-二甲基-5-氧代-吡咯烷-1-甲酸叔丁酯(14g,69%);esi-ms m/z计算值213.13649,实验值214.5(m 1)
;保留时间:2.86分钟(lc方法b)。
[3743]
步骤2:n,n-二苄基-3,3-二乙氧基丙-1-胺
[3744][3745]
在室温下,将3,3-二乙氧基丙-1-胺(11.034g,12.5ml,72.703mmol)溶解于etoh(56ml)和水(14ml)中。一次性添加na2co3(22.75g,214.65mmol),随后在40分钟内添加bnbr(41.995g,29.8ml,240.63mmol)于etoh(14ml)中的溶液。然后将混合物在83℃下加热48小时。然后将其冷却至室温并真空浓缩。将残余物在dcm(200ml)和水(200ml)之间分配。分离各层,并用更多dcm(60ml
×
3)萃取水层。合并的dcm溶液经mgso4干燥,过滤并浓缩。将残余物溶解于己烷(300ml)中并搅拌1小时。倾析上清液,并将残余物(粘性黄色物质)用己烷(50ml
×
2)冲洗。将合并的己烷溶液浓缩,并将残余物通过硅胶色谱法(120g柱),使用0-10%etoac/己烷进行纯化,得到呈无色液体状的所需产物,n,n-二苄基-3,3-二乙氧基-丙-1-胺(18.56g,74%):esi-ms m/z计算值327.21982,实验值328.6(m 1)
;保留时间:2.88分钟(lc方法b)。
[3746]
步骤3:3-(二苄基氨基)丙醛
[3747][3748]
在室温下,将n,n-二苄基-3,3-二乙氧基-丙-1-胺(10g,29.011mmol)溶解于thf(50ml)中。添加hcl水溶液(18ml,3m,54.000mmol)。将混合物在室温下搅拌4小时。然后将其用nahco3(饱和水溶液)中和,直到ph约8。添加etoac(30ml)。分离各层,并将etoac层用盐水洗涤,经mgso4干燥,过滤并浓缩。将残余物(约7.1g)溶解于甲苯(约40ml)中。将混合物短暂超声处理并浓缩至约5ml体积。该溶液直接用于下一步。3-(二苄基氨基)丙醛(7.1g,87%):esi-ms m/z计算值253.14667,实验值272.5(m h2o h=m 19)
;保留时间:2.37分钟(lc方法b)。
[3749]
步骤4:4-[3-(二苄基氨基)-1-羟基-丙基]-2,2-二甲基-5-氧代-吡咯烷-1-甲酸叔丁酯
[3750][3751]
将2,2-二甲基-5-氧代-吡咯烷-1-甲酸叔丁酯(8g,35.635mmol)溶解于thf(150ml)中,并在氮气气球下冷却至-78℃,搅拌20分钟。在5分钟内添加含lda的thf/庚烷/乙苯(19ml,2m,38.000mmol)。将混合物在-78℃下搅拌1小时。添加含3-(二苄基氨基)丙醛(7.1g,25.223mmol)的甲苯(10ml),随后用thf(10ml)冲洗。将混合物在相同温度下搅拌30分钟,并且然后缓慢升温至-50℃。添加nh4cl(2ml,饱和水溶液),随后添加水(20ml)和etoac(30ml)。分离各层。将有机层用盐水洗涤,经mgso4干燥,过滤并浓缩。残余物通过硅胶色谱法(40g柱),使用5%-50%etoac/己烷进行纯化,得到呈无色油状物的产物。4-[3-(二苄基氨基)-1-羟基-丙基]-2,2-二甲基-5-氧代-吡咯烷-1-甲酸叔丁酯(12.5g,96%):esi-ms m/z计算值466.28317,实验值467.5(m 1)
;保留时间:3.19分钟(lc方法b)。
[3752]
步骤5:3-[3-(二苄基氨基)-1-羟基-丙基]-5,5-二甲基-吡咯烷-2-酮
[3753][3754]
在室温下,将4-[3-(二苄基氨基)-1-羟基-丙基]-2,2-二甲基-5-氧代-吡咯烷-1-甲酸叔丁酯(12.5g,24.110mmol)溶解于dcm(50ml)中。添加tfa(14.800g,10ml,129.80mmol)。将混合物在室温下搅拌2小时。然后将其浓缩以移除大多数挥发物。将残余物溶解于dcm(100ml)中,并用nahco3(饱和水溶液)处理,直到水相ph变为碱性的。分离各层,并用更多dcm(30ml
×
2)萃取水层。合并的dcm溶液经mgso4干燥,过滤并浓缩,得到呈浅棕色油状物的所需产物。3-[3-(二苄基氨基)-1-羟基-丙基]-5,5-二甲基-吡咯烷-2-酮(9g,97%):esi-ms m/z计算值366.23074,实验值367.5(m 1)
;保留时间:2.58分钟(lc方法b)。
[3755]
步骤6:3-(二苄基氨基)-1-(5,5-二甲基吡咯烷-3-基)丙-1-醇
[3756][3757]
将两批3-[3-(二苄基氨基)-1-羟基-丙基]-5,5-二甲基-吡咯烷-2-酮(9g,23.329mmol和250mg,0.6480mmol)合并并溶解于thf(100ml)中。在冷却至0℃之后,以小份添加lah(4.8g,5.2345ml,120.14mmol)。然后将混合物在室温下搅拌30分钟,然后在氮气气球下将其经由回流冷凝器置于80℃油浴中。将反应物在80℃下搅拌24小时。然后将其冷却
至0℃,用乙醚(200ml)稀释,并且用饱和罗谢尔盐水溶液(约50ml)处理。分离各层。将有机层用盐水洗涤,经mgso4干燥,过滤并浓缩,得到呈无色油状物的粗产物。3-(二苄基氨基)-1-(5,5-二甲基吡咯烷-3-基)丙-1-醇(8.9g,97%):esi-ms m/z计算值352.25146,实验值353.7(m 1)
;保留时间:2.21分钟(lc方法b)。
[3758]
步骤7:4-[3-(二苄基氨基)-1-羟基-丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯
[3759][3760]
在室温下,将3-(二苄基氨基)-1-(5,5-二甲基吡咯烷-3-基)丙-1-醇(8.9g,22.723mmol)溶解于thf(100ml)中。一次性添加boc2o(5g,5.2632ml,22.910mmol)。将混合物在室温下搅拌4小时。然后将其浓缩,并将残余物通过硅胶色谱法(80g柱),使用0-30%etoac/己烷进行纯化,得到呈粘性无色油状/白色泡沫状的产物。4-[3-(二苄基氨基)-1-羟基-丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(8.98g,83%):esi-ms m/z计算值452.3039,实验值453.6(m 1)
;保留时间:3.2分钟(lc方法b)。
[3761]
步骤8:4-[3-(二苄基氨基)丙酰基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯
[3762][3763]
在室温下,将4-[3-(二苄基氨基)-1-羟基-丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(4.4g,9.2349mmol)溶解于dcm(50ml)中。以小份添加戴斯-马丁过碘烷(4.8g,10.751mmol)。将反应混合物在氮气下搅拌3小时。添加更多戴斯-马丁过碘烷(300mg,0.7073mmol)。将混合物再搅拌1小时。添加na2s2o3(5g于50ml饱和nahco3水溶液中)。将混合物搅拌30分钟。分离各层。dcm层经mgso4干燥,过滤并浓缩。残余物通过硅胶色谱法(80g柱),使用5%-40%etoac/己烷进行纯化,得到呈浅黄色油状物的产物。4-[3-(二苄基氨基)丙酰基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(2.78g,63%):esi-ms m/z计算值450.28824,实验值451.8(m 1)
;保留时间:3.25分钟(lc方法b)。
[3764]
步骤9:4-[1-[2-(二苄基氨基)乙基]-1-羟基-3-苯基-丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯
[3765][3766]
将4-[3-(二苄基氨基)丙酰基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(2.78g,5.8609mmol)溶解于thf(30ml)中,并将溶液冷却至-78℃,在氮气下搅拌。然后通过注射器
在5分钟内添加氯(2-苯乙基)镁于thf(23ml,1m,23.000mmol)中的溶液。将混合物在相同温度下搅拌10分钟,并且然后通过移除冷却浴来升温。在90分钟内将混合物升温至约0℃。添加nh4cl(10ml,饱和水溶液),随后添加etoac(50ml)。分离各层。将有机层用盐水洗涤,经mgso4干燥,过滤并浓缩。残余物通过硅胶色谱法(80g柱),使用0-30%etoac/己烷进行纯化,得到呈浅黄色油状物的产物。4-[1-[2-(二苄基氨基)乙基]-1-羟基-3-苯基-丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(2.43g,71%):esi-ms m/z计算值556.3665,实验值557.7(m 1)
;保留时间:3.65分钟(lc方法b)。
[3767]
步骤10:4-[1-[2-(二苄基氨基)乙基]-3-苯基-亚丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯
[3768][3769]
将4-[1-[2-(二苄基氨基)乙基]-1-羟基-3-苯基-丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(2.43g,4.1462mmol)溶解于吡啶(25ml)中。将混合物冷却至0℃并搅拌15分钟。逐滴添加socl2(4.8930g,3ml,41.128mmol)。将混合物在相同温度下搅拌2小时。添加etoac(80ml),随后添加水(30ml)和nahco3(30ml,饱和水溶液)。分离各层。将etoac层用更多nahco3(30ml
×
3,饱和水溶液)洗涤。然后将其浓缩。残余物通过硅胶色谱法(80g柱),使用0至30%etoac/己烷进行纯化,得到产物(浅黄色油状物)。呈烯烃异构体形式的4-[1-[2-(二苄基氨基)乙基]-3-苯基-亚丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(1.1g,47%):esi-ms m/z计算值538.35596,实验值539.7(m 1)
;保留时间:3.97分钟(lc方法b)。
[3770]
步骤11:4-[1-(2-氨基乙基)-3-苯基-丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯
[3771][3772]
将呈烯烃异构体混合物形式的4-[1-[2-(二苄基氨基)乙基]-3-苯基-亚丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(1.1g,1.9396mmol)溶解于meoh(12ml)中。添加pd(oh)2/碳(500mg,0.3560mmol)。将混合物抽真空,并在氢化烧瓶中用h2吹扫三次。然后将其在parr振荡器上以60psi h2压力氢化36小时。将混合物通过硅藻土垫过滤,然后用meoh(20ml
×
3)冲洗。将合并的meoh溶液浓缩,得到产物。呈非对映异构体混合物形式的4-[1-(2-氨基乙基)-3-苯基-丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯:esi-ms m/z计算值360.27768,实验值361.6(m 1)
;保留时间:3.19分钟和3.34分钟(lc方法b)。
[3773]
步骤12:2,2-二甲基-4-[1-(2-苯乙基)-3-[(6-氨磺酰基-2-吡啶基)氨基]丙基]
吡咯烷-1-甲酸叔丁酯;2,2-二甲基-4-[1-(2-苯乙基)-3-[(6-氨磺酰基-2-吡啶基)氨基]丙基]吡咯烷-1-甲酸叔丁酯
[3774][3775]
将呈非对映异构体混合物形式的4-[1-(2-氨基乙基)-3-苯基-丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(750mg,1.8722mmol)溶解于dmso(3ml)中。添加6-氟吡啶-2-磺酰胺(495mg,2.8098mmol),然后添加dipea(964.60mg,1.3ml,7.4635mmol)。将混合物在氮气下在115℃下加热24小时。然后将其冷却至室温,并用水(20ml)和etoac(30ml)稀释。分离各层,并将有机层用水(15ml
×
2)洗涤并浓缩。通过hplc,使用50%至100%乙腈/5mm hcl水溶液来纯化残余物,得到两种分离的异构体。
[3776]
非对映异构体1,2,2-二甲基-4-[1-(2-苯乙基)-3-[(6-氨磺酰基-2-吡啶基)氨基]丙基]吡咯烷-1-甲酸叔丁酯(179.6mg,18%);1h nmr(500mhz,dmso-d6)δ7.52(t,j=7.8,7.8hz,1h),7.31
–
7.10(m,5h),7.02(s,2h),6.99
–
6.84(m,2h),6.60(d,j=8.5hz,1h),3.67
–
3.44(m,1h),3.34
–
3.26(m,2h),2.82(dd,j=12.2,9.5hz,1h),2.71
–
2.58(m,1h),2.58
–
2.51(m,1h),2.24
–
2.07(m,1h),2.00
–
1.80(m,1h),1.72
–
1.30(m,18h),1.23(s,3h)。esi-ms m/z计算值516.27704,实验值517.4(m 1)
;保留时间:3.0分钟(lc方法h)。
[3777]
非对映异构体2,2,2-二甲基-4-[1-(2-苯乙基)-3-[(6-氨磺酰基-2-吡啶基)氨基]丙基]吡咯烷-1-甲酸叔丁酯(290.2mg,29%);1h nmr(500mhz,dmso-d6)δ7.52(dd,j=8.4,7.2hz,1h),7.29
–
7.10(m,5h),7.03(s,2h),6.97(d,j=7.2hz,1h),6.93(t,j=5.4,5.4hz,1h),6.61(d,j=8.4hz,1h),3.66
–
3.45(m,1h),3.39
–
3.31(m,2h),2.87(t,j=10.7,10.7hz,1h),2.70
–
2.51(m,2h),2.29
–
2.08(m,1h),1.98
–
1.76(m,1h),1.72
–
1.27(m,18h),1.23(s,3h)。esi-ms m/z计算值516.27704,实验值517.4(m 1)
;保留时间:3.15分钟(lc方法h)。
[3778]
步骤13:4-[1-({6-[({2-氯-6-[3-(2-{二螺[2.0.24.13]庚-7-基}乙氧基)-1h-吡唑-1-基]吡啶-3-基}甲酰胺基)磺酰基]吡啶-2-基}氨基)-5-苯基戊-3-基]-2,2-二甲基吡咯烷-1-甲酸叔丁酯
[3779][3780]
在20-ml小瓶中,将2-氯-6-[3-(2-二螺[2.0.24.13]庚-7-基乙氧基)吡唑-1-基]吡啶-3-甲酸(230.1mg,0.5756mmol)溶解于thf(5.0ml)中,向其添加cdi(150mg,0.9251mmol)。将所得混合物在室温下搅拌15小时。此后,添加2,2-二甲基-4-[1-(2-苯乙基)-3-[(6-氨磺酰基-2-吡啶基)氨基]丙基]吡咯烷-1-甲酸叔丁酯的非对映异构体2
(290.2mg,0.5397mmol)和dbu(500μl,3.343mmol),并将所得混合物在室温下搅拌24小时。此后,添加1n hcl(5ml),并将混合物用etoac(3
×
3ml)萃取。将合并的有机萃取物用h2o(5ml)和盐水(5ml)洗涤,然后经na2so4干燥,过滤并真空蒸发,得到约700mg棕色固体。通过硅胶色谱法(24g二氧化硅),使用0至70%etoac/己烷梯度洗脱进行纯化,得到4-[1-({6-[({2-氯-6-[3-(2-{二螺[2.0.24.13]庚-7-基}乙氧基)-1h-吡唑-1-基]吡啶-3-基}甲酰胺基)磺酰基]吡啶-2-基}氨基)-5-苯基戊-3-基]-2,2-二甲基吡咯烷-1-甲酸叔丁酯(294.6mg,60%);esi-ms m/z计算值857.3701,实验值858.7(m 1)
;保留时间:1.86分钟(lc方法g)。
[3781]
步骤14:8-[3-(2-{二螺[2.0.24.13]庚-7-基}乙氧基)-1h-吡唑-1-基]-12,12-二甲基-15-(2-苯乙基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5(10),6,8,19(23),20-六烯-2,2,4-三酮(化合物428a)和8-[3-(2-{二螺[2.0.24.13]庚-7-基}乙氧基)-1h-吡唑-1-基]-12,12-二甲基-15-(2-苯乙基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5(10),6,8,19(23),20-六烯-2,2,4-三酮(化合物428b)
[3782][3783]
阶段1:在20-ml小瓶中,将4-[1-({6-[({2-氯-6-[3-(2-{二螺[2.0.24.13]庚-7-基}乙氧基)-1h-吡唑-1-基]吡啶-3-基}甲酰胺基)磺酰基]吡啶-2-基}氨基)-5-苯基戊-3-基]-2,2-二甲基吡咯烷-1-甲酸叔丁酯(294.6mg,0.3226mmol)溶解于dcm(4.0ml)中。添加tfa(1.0ml,12.98mmol),并使所得溶液在室温下静置16小时。然后将混合物真空蒸发,与无水二噁烷(3ml)混合,并蒸发至干燥,得到约500mg(>100%)橙色油状物2-氯-n-[(6-{[3-(5,5-二甲基吡咯烷-3-基)-5-苯基戊基]氨基}吡啶-2-基)磺酰基]-6-[3-(2-{二螺[2.0.24.13]庚-7-基}乙氧基)-1h-吡唑-1-基]吡啶-3-甲酰胺(三氟乙酸盐)。
[3784]
阶段2:在20-ml微波小瓶中,将来自阶段1的产物溶解于nmp(5.0ml)中,并与k2co3(352.1mg,2.548mmol)混合。将所得混合物用微波盖封盖,并在150℃下搅拌20小时。然后将反应混合物冷却至室温,倒入1n hcl(10ml)中,并用etoac(3
×
10ml)萃取。将合并的有机萃取物用h2o(10ml)和盐水(10ml)洗涤,然后经na2so4干燥,过滤并真空蒸发。通过硅胶色谱法(24g二氧化硅),使用0至60%etoac/己烷的梯度洗脱来进行纯化,得到白色固体(143.1mg,61%产率)。将该产物溶解于meoh(约4.5ml)中,以达到约32mg/ml的浓度。对映异构体的分离通过sfc纯化法,使用chiralpak ig柱(250
×
21.2mm,5μm粒度),以流动相46%meoh( 20mm nh3) 54%co2,70ml/min流速,500μl进样体积和177巴压力来实现。收集的批次标记为“非对映异构体2峰1”(60.3mg,25%)和“非对映异构体2峰2”(58.9mg,25%)。
[3785]“非对映异构体2峰1”:8-[3-(2-{二螺[2.0.24.13]庚-7-基}乙氧基)-1h-吡唑-1-基]-12,12-二甲基-15-(2-苯乙基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5(10),6,8,19(23),20-六烯-2,2,4-三酮(铵盐)(60.3mg,25%)esi-ms m/z计算值721.341,实验值722.3(m 1)
;保留时间:2.57分钟(lc方法a)
[3786]“非对映异构体2峰2”:8-[3-(2-{二螺[2.0.24.13]庚-7-基}乙氧基)-1h-吡唑-1-基]-12,12-二甲基-15-(2-苯乙基)-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5(10),6,8,19(23),20-六烯-2,2,4-三酮(铵盐)(58.9mg,25%)1h nmr(400mhz,dmso-d6)δ12.73-12.24(bs,1h),8.19(d,j=2.7hz,1h),7.86-7.66(m,1h),7.64-7.49(m,1h),7.34-7.22(m,4h),7.21-7.13(m,1h),7.15-6.99(m,2h),6.94-6.82(m,1h),6.77-6.61(m,1h),6.06(s,1h),4.27-4.15(m,2h),3.84-3.61(m,1h),3.16-3.02(m,1h),2.98-2.75(m,1h),2.73-2.52(m,2h),2.22-2.09(m,1h),2.05-1.88(m,2h),1.81(q,j=6.7hz,2h),1.76-1.62(m,2h),1.57(s,3h),1.53(s,3h),1.50-1.42(m,2h),1.43-1.33(m,1h),0.89-0.77(m,4h),0.69-0.61(m,2h),0.54-0.45(m,2h)。[注意:产物(c
40h47
n7o4s)的总数47中缺少2h。]esi-ms m/z计算值721.341,实验值722.3(m 1)
;保留时间:2.57分钟(lc方法a)。
[3787]
实施例161:(14s)-8-[3-(2-{二螺[2.0.24.13]庚-7-基}乙氧基)-1h-吡唑-1-基]-12,12-二甲基-2λ
6-硫杂-3,7,9,11,18,23-六氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮(化合物429)的制备
[3788][3789]
步骤1:2,4-二氯嘧啶-5-羰基氯
[3790]
[3791]
向2,4-二氯嘧啶-5-甲酸(1g,5.1817mmol)中添加亚硫酰氯(13.120g,8ml,110.28mmol),并将所得悬浮液回流过夜。将反应混合物减压浓缩,得到2,4-二氯嘧啶-5-羰基氯(1.31g,114%)1h nmr(400mhz,cdcl3)δ9.26(s,1h)。
[3792]
步骤2:(4s)-4-[3-[[6-[(2,4-二氯嘧啶-5-羰基)氨磺酰基]-2-吡啶基]氨基]丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯
[3793][3794]
将(4s)-2,2-二甲基-4-[3-[(6-氨磺酰基-2-吡啶基)氨基]丙基]吡咯烷-1-甲酸叔丁酯(176mg,0.4266mmol)的dcm(12ml)逐滴添加到含2,4-二氯嘧啶-5-羰基氯(100mg,0.4730mmol)的dcm(12ml)中,然后添加tea(50.820mg,0.07ml,0.5022mmol),并将反应物在室温下搅拌4小时。添加更多tea(50.820mg,0.07ml,0.5022mmol),并将反应混合物再搅拌3小时。将反应混合物浓缩,然后在硅胶上使用0至100%乙酸乙酯/庚烷,然后用0至30%甲醇/dcm进行纯化,得到(4s)-4-[3-[[6-[(2,4-二氯嘧啶-5-羰基)氨磺酰基]-2-吡啶基]氨基]丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(150mg,54%):1h nmr(400mhz,dmso-d6)δ8.98(s,1h),7.62(t,j=7.8hz,1h),7.23(br.s.,1h),7.17(d,j=7.1hz,1h),6.74(d,j=8.3hz,1h),3.54-3.51(m,1h),3.24-3.19(m,2h),2.81-2.74(m,1h),2.13-2.01(m,1h),1.93-1.75(m,1h),1.58-1.43(m,2h),1.41-1.28(m,15h),1.22(s,3h)。esi-ms m/z计算值586.1532,实验值487.0(m
–
boc 2h=m
–
99)
;保留时间:2.29分钟(lc方法e)。
[3795]
步骤3:2,4-二氯-n-[[6-[3-[(3s)-5,5-二甲基吡咯烷-3-基]丙基氨基]-2-吡啶基]磺酰基]嘧啶-5-甲酰胺(盐酸盐)
[3796][3797]
在氮气下,在室温下将盐酸(4m于二噁烷中)(7.25ml,4m,29.000mmol)逐滴添加至(4s)-4-[3-[[6-[(2,4-二氯嘧啶-5-羰基)氨磺酰基]-2-吡啶基]氨基]丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(145mg,0.2468mmol)于dcm(7.25ml)中的溶液中。在搅拌15分钟后,减压浓缩得到2,4-二氯-n-[[6-[3-[(3s)-5,5-二甲基吡咯烷-3-基]丙基氨基]-2-吡啶基]磺酰基]嘧啶-5-甲酰胺(盐酸盐)(144mg,104%)esi-ms m/z计算值486.1008,实验值487.0(m 1)
;保留时间:1.32分钟(lc方法e)。
[3798]
步骤4:(14s)-8-氯-12,12-二甲基-2λ
6-硫杂-3,7,9,11,18,23-六氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮
[3799][3800]
在氮气下,在微波小瓶中,将dipea(20mg,0.0270ml,0.1547mmol)添加到2,4-二氯-n-[[6-[3-[(3s)-5,5-二甲基吡咯烷-3-基]丙基氨基]-2-吡啶基]磺酰基]嘧啶-5-甲酰胺(20mg,0.0410mmol)中,并且然后添加nmp(0.2ml)。将小瓶封盖,并将反应混合物加热到125℃持续1小时。lcms显示转化为所需产物(14s)-8-氯-12,12-二甲基-2λ
6-硫杂-3,7,9,11,18,23-六氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮。esi-ms m/z计算值450.12408,实验值451.2(m 1)
;保留时间:1.78分钟(lc方法e)。
[3801]
步骤5:(14s)-8-[3-(2-{二螺[2.0.24.13]庚-7-基}乙氧基)-1h-吡唑-1-基]-12,12-二甲基-2λ
6-硫杂-3,7,9,11,18,23-六氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮(化合物429)
[3802][3803]
在氮气气氛下,向(14s)-8-氯-12,12-二甲基-2λ
6-硫杂-3,7,9,11,18,23-六氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮(90mg,0.1996mmol)中添加3-(2-二螺[2.0.24.13]庚-7-基乙氧基)-1h-吡唑(125mg,0.6119mmol)、碳酸钾(58mg,0.4197mmol)、碳酸铯(201mg,0.6169mmol)并且然后添加dmso(0.5ml)。将反应混合物在油浴中加热至120℃过夜。将反应混合物冷却至室温,过滤,然后通过反相c
18
柱和60%至100%乙腈/水(0.1%,甲酸)的梯度进行纯化,得到所需产物(14s)-8-[3-(2-{二螺[2.0.24.13]庚-7-基}乙氧基)-1h-吡唑-1-基]-12,12-二甲基-2λ
6-硫杂-3,7,9,11,18,23-六氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮(33mg,26%):1h nmr(400mhz,dmso-d6)δ12.73(br.s.,1h),8.33(d,j=2.4hz,2h),7.58(t,j=7.8hz,1h),7.07(d,j=6.8hz,1h),7.00(br.s.,1h),6.72(d,j=8.6hz,1h),6.08(d,j=2.7hz,1h),4.22(t,j=6.7hz,2h),3.98-3.79(m,1h),3.29-3.22(m,1h),2.96(d,j=13.2hz,1h),2.75-2.61(m,1h),2.14(br.s.,1h),1.89(dd,j=11.5,4.4hz,1h),1.82(q,j=6.6hz,2h),1.79-1.70(m,1h),1.68-1.50(m,9h),1.46(t,j=6.5hz,1h),1.41-1.28(m,1h),0.86-0.75(m,4h),0.69-0.57(m,2h),0.54-0.43(m,2h)。esi-ms m/z计算值618.2737,实验值619.3(m 1)
;保留时间:4.91分钟(lc方法f)。
[3804]
实施例162:12-苄基-8-[3-(2-{二螺[2.0.24.13]庚-7-基}乙氧基)-1h-吡唑-1-基]-12-甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1
(23),5(10),6,8,19,21-六烯-2,2,4-三酮(化合物430)和12-苄基-8-[3-(2-{二螺[2.0.24.13]庚-7-基}乙氧基)-1h-吡唑-1-基]-12-甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮(化合物431)的制备
[3805][3806]
步骤1:(e)-(2-氧代四氢吡喃-3-亚基)甲醇盐
[3807]
[3808]
制备60%氢化钠(219.72g,5.4936mol)于乙醚(5l)中的浆液,然后在30分钟的过程中逐滴添加乙醇(23.007g,29.160ml,499.42mmol)。将所得混合物搅拌15分钟,然后在2.5小时内逐滴添加γ-戊内酯(500g,463.39ml,4.9942mol)和甲酸乙酯(443.95g,484.13ml,5.9930mol)的混合物。随着添加进行,浆液变得粘性更大,并用乙醚(10l)稀释,该乙醚经15分钟间隔以每份1l逐份添加。将所得混合物在室温下搅拌20小时,然后过滤。将收集的固体在真空烘箱中在20托和室温下干燥,得到呈白色固体状之(e)-(2-氧代四氢吡喃-3-亚基)甲醇盐(钠盐)(761g,102%)。
[3809]
步骤2:3-亚甲基四氢吡喃-2-酮
[3810][3811]
将(e)-(2-氧代四氢吡喃-3-亚基)甲醇盐(钠盐)(508g,3.3842mol)、4-叔丁基邻苯二酚(50mg,0.3008mmol)和多聚甲醛(508.07g,466.12ml,16.921mol)于thf(6l)中的浆液在氮气下加热至65℃持续21小时。将所得白色浆液冷却至室温,用乙酸乙酯(2l)稀释,然后用碳酸氢钠的饱和溶液(2l)萃取。分离各相,并用乙酸乙酯(2l)萃取水相。丢弃水相,并将合并的有机相经硫酸钠干燥并真空浓缩,得到呈黄色油状物的3-亚甲基四氢吡喃-2-酮。将粗产物通过硅胶色谱法(5%-45%乙酸乙酯/己烷)进行纯化,得到3-亚甲基四氢吡喃-2-酮(187g,47%)。esi-ms m/z计算值112.05243,实验值113.4(m 1)
;保留时间:1.51分钟(lc方法c)。
[3812]
步骤3:2-硝基丙基苯
[3813][3814]
将[(e)-2-硝基丙-1-烯基]苯(10g,61.285mmol)于1,4-二噁烷(100ml)中的溶液逐滴添加到硼氢化钠(5.1g,5.3968ml,134.80mmol)于1,4-二噁烷(100ml)和乙醇(35ml)的混合物中的浆液中。添加速率使得在添加过程中内部温度不超过30℃。将所得浓稠白色浆液在室温下搅拌1小时,然后用1:1(v/v)乙酸水溶液(100ml)淬灭反应物。真空移除有机溶剂,并用氯仿(3
×
50ml)萃取残余物。丢弃水相,并将合并的有机相用盐水(2
×
25ml)萃取,经硫酸钠干燥,并真空浓缩。将所得油状物通过硅胶色谱法(0-25%氯仿/己烷)进行纯化,得到2-硝基丙基苯(7.7g,73%)1h nmr(500mhz,dmso-d6)δ7.33
–
7.27(m,2h),7.27
–
7.19(m,3h),5.03
–
4.93(m,1h),3.21
–
3.04(m,2h),1.47(d,j=6.6hz,3h)。esi-ms m/z计算值165.07898,保留时间:2.29分钟(lc方法h)。
[3815]
步骤4:3-(2-甲基-2-硝基-3-苯基-丙基)四氢吡喃-2-酮
[3816][3817]
将3-亚甲基四氢吡喃-2-酮(15.05g,134.22mmol)溶解于acn(150ml)中的溶液以缓慢流添加到dbu(3.0540g,3ml,20.061mmol)和2-硝基丙基苯(26.62g,161.15mmol)的混
合物中。反应是放热的:添加速率使得在添加过程中内部温度保持低于35℃。将所得溶液在室温下搅拌6小时,然后真空浓缩。粗物质(46.17g)通过硅胶色谱法(330g sio2,0至30%etoac/己烷)进行纯化。混合的级分通过hplc,使用在60分钟内35%至85%乙腈/用0.1%tfa缓冲的水进行纯化。
[3818]
非对映异构体1,3-(2-甲基-2-硝基-3-苯基-丙基)四氢吡喃-2-酮(978mg,2%):1h nmr(500mhz,氯仿-d)δ7.34-7.26(m,3h),7.13-7.08(m,2h),4.42-4.24(m,2h),3.45(d,j=14.1hz,1h),3.07(d,j=14.1hz,1h),3.00(dd,j=15.3,5.0hz,1h),2.78-2.63(m,1h),2.18-2.03(m,1h),1.97-1.88(m,3h),1.53-1.46(m,4h)。esi-ms m/z计算值277.1314,实验值278.1(m 1)
;保留时间:5.01分钟(lc方法c)。
[3819]
非对映异构体2,3-(2-甲基-2-硝基-3-苯基-丙基)四氢吡喃-2-酮(5.26g,13%)1h nmr(500mhz,氯仿-d)δ7.34-7.26(m,3h),7.12-7.00(m,2h),4.33-4.25(m,2h),3.33(d,j=13.9hz,1h),3.06(d,j=13.9hz,1h),2.65(dd,j=14.9,5.2hz,1h),2.45-2.34(m,1h),2.28(dd,j=15.0,5.0hz,1h),2.11-1.99(m,1h),1.94-1.80(m,2h),1.55-1.49(m,4h)。esi-ms m/z计算值277.1314,实验值278.2(m 1)
;保留时间:5.2分钟(lc方法c)。
[3820]
步骤5:5-苄基-3-(3-羟丙基)-5-甲基-吡咯烷-2-酮
[3821][3822]
在parr反应器中,在80℃下在氢气(3巴)下,将3-(2-甲基-2-硝基-3-苯基-丙基)四氢吡喃-2-酮的非对映异构体2(6.4783g,22.193mmol)、雷尼镍(1.0g,11.404mmol)和etoh(42ml)一起搅拌22小时。添加硅藻土(10g),并过滤所得浆液。将固体用乙醇(3x50ml)洗涤并丢弃。将合并的滤液真空浓缩,得到浅棕色油状物。将其溶解于dcm(50ml)和1m hcl水溶液(10ml)中。分离各层。用dcm(50ml
×
3)萃取水层。合并的dcm层经无水硫酸钠干燥,过滤并真空浓缩。5-苄基-3-(3-羟丙基)-5-甲基-吡咯烷-2-酮(5.99g,104%):1h nmr(500mhz,氯仿-d)δ7.35-7.18(m,3h),7.19-7.13(m,2h),5.83(s,1h),3.65-3.56(m,2h),2.74(q,2h),2.36-2.27(m,1h),2.20-2.10(m,1h),1.91-1.78(m,1h),1.68-1.50(m,3h),1.46-1.36(m,1h),1.30-1.21(m,3h)。esi-ms m/z计算值247.15723,实验值248.3(m 1)
;保留时间:3.21分钟(lc方法c)。
[3823]
步骤6:3-(5-苄基-5-甲基-吡咯烷-3-基)丙-1-醇
[3824][3825]
在0℃下,向5-苄基-3-(3-羟丙基)-5-甲基-吡咯烷-2-酮(5.99g,23.007mmol)溶解于thf(180ml)中的溶液中逐份添加lah(5.5970g,6.1036ml,140.09mmol)。移除冰浴,并将所得灰色浆液在60℃下搅拌43小时。在冷却至室温之后,将反应物冷却至0℃。缓慢添加
h2o(10ml),并且缓慢添加在15%naoh的h2o(10ml)。再添加20ml的h2o。将淬灭的混合物用乙醚(200ml)稀释。移除冰浴;使混合物升温至室温并搅拌30分钟。混合物经由小硅藻土柱过滤。将固体用乙醚(2
×
200ml)洗涤,并将合并的滤液真空浓缩。3-(5-苄基-5-甲基-吡咯烷-3-基)丙-1-醇(6.87g,122%):1h nmr(500mhz,氯仿-d)δ7.37-7.09(m,5h),3.61(t,j=6.5,6.5hz,2h),3.23-3.08(m,1h),2.75-2.65(m,2h),2.65-2.56(m,1h),2.18-1.94(m,2h),1.86-1.83(m,1h),1.69-1.47(m,4h),1.45-1.39(m,2h),1.15-1.09(m,3h)。esi-ms m/z计算值233.17796,实验值234.2(m 1)
;保留时间:2.54分钟(lc方法c)。
[3826]
步骤7:2-苄基-4-(3-羟丙基)-2-甲基-吡咯烷-1-甲酸叔丁酯
[3827][3828]
将3-(5-苄基-5-甲基-吡咯烷-3-基)丙-1-醇(7.6753g,32.234mmol)和碳酸叔丁氧羰基叔丁酯(8.5794g,9.0309ml,39.311mmol)于dcm(130ml)中的溶液冷却至0℃。将naoh(2.7768g,69.425mmol)溶解于水(65ml)中,并将所得溶液添加到冷却的氨基醇溶液中。移除冰浴,并将反应混合物在室温下搅拌19小时。将混合物转移到分液漏斗中,分离各相,并用dcm(50ml)重新萃取水层。合并的dcm层经无水硫酸钠干燥,过滤并真空浓缩。对粗物质(12.82g,浅橙色油状物)进行硅胶色谱法(120g sio2,用0至45%etoac/己烷洗脱)。2-苄基-4-(3-羟丙基)-2-甲基-吡咯烷-1-甲酸叔丁酯(5.78g,51%):1h nmr(500mhz,氯仿-d)δ7.28-7.18(m,3h),7.16-7.06(m,2h),3.52-3.47(m,2h),3.41-3.16(m,1h),2.87-2.72(m,1h),2.72-2.62(m,1h),2.21-2.10(m,1h),1.60-1.30(m,16h),1.23-1.09(m,3h)。esi-ms m/z计算值333.2304,实验值334.2(m 1)
;保留时间:5.8分钟(lc方法c)。
[3829]
步骤8:2-苄基-2-甲基-4-(3-甲基磺酰氧基丙基)吡咯烷-1-甲酸叔丁酯
[3830][3831]
将2-苄基-4-(3-羟丙基)-2-甲基-吡咯烷-1-甲酸叔丁酯(5.78g,16.466mmol)和三乙胺(3.3396g,4.6ml,33.003mmol)溶解于dcm(42ml)中并冷却至0℃。在30分钟内逐滴添加甲磺酰氯(2.2200g,1.5ml,19.380mmol),然后将混合物在室温下搅拌1小时。然后用饱和碳酸氢钠水溶液(20ml)淬灭反应物。分离各相,并将有机相用饱和碳酸氢钠水溶液(20ml)洗涤,然后用h2o(2
×
10ml)洗涤。将水相丢弃,并将有机相经无水硫酸钠干燥,过滤,并真空浓缩,得到浅黄色油状物。2-苄基-2-甲基-4-(3-甲基磺酰氧基丙基)吡咯烷-1-甲酸叔丁酯(7.22g,101%):1h nmr(500mhz,氯仿-d)δ7.32-7.19(m,3h),7.16-7.05(m,2h),4.17-3.99(m,2h),3.51-3.39(m,1h),3.37-3.19(m,1h),2.99-2.93(m,3h),2.87-2.72(m,1h),2.71-2.62(m,1h),2.19-2.07(m,1h),1.61-1.39(m,15h),1.32-1.17(m,3h)。esi-ms m/z计算值411.20795,实验值412.3(m 1)
;保留时间:6.63分钟(lc方法c)。
[3832]
步骤9:4-(3-氨基丙基)-2-苄基-2-甲基-吡咯烷-1-甲酸叔丁酯
[3833][3834]
将2-苄基-2-甲基-4-(3-甲基磺酰氧基丙基)吡咯烷-1-甲酸叔丁酯(7.22g,16.666mmol)溶解于二噁烷(57ml)中,然后添加氢氧化铵(51.300g,57ml的29%w/v,1.4638mol)。将反应混合物在45℃下搅拌19小时。再添加29ml氢氧化铵(29%w/v),并使反应物在45℃下搅拌6小时。将混合物用naoh水溶液(1m,20ml)稀释并用醚(3x60ml)萃取。将合并的醚层用h2o(2
×
20ml)洗涤,并经无水硫酸钠干燥。粗产物通过硅胶色谱法(80g sio2,用0至100%etoac/己烷并且然后用10%meoh/经2%nh4oh水溶液缓冲的dcm洗脱)进行纯化。4-(3-氨基丙基)-2-苄基-2-甲基-吡咯烷-1-甲酸叔丁酯(3.13g,56%):1h nmr(500mhz,氯仿-d)δ7.31-7.16(m,3h),7.16-7.08(m,2h),3.51-3.44(m,1h),3.38(d,j=13.2hz,1h),3.35-3.28(m,1h),3.19(d,j=13.2hz,1h),2.82(t,j=9.9,9.9hz,1h),2.74(t,j=9.8,9.8hz,1h),2.69(t,j=13.0,13.0hz,1h),2.54(t,j=6.9,6.9hz,2h),2.12(dd,j=12.5,5.0hz,1h),1.52-1.36(m,11h),1.33-1.09(m,6h)。esi-ms m/z计算值332.24637,实验值333.4(m 1)
;保留时间:4.43分钟(lc方法c)。
[3835]
步骤10:2-苄基-2-甲基-4-[3-[(6-氨磺酰基-2-吡啶基)氨基]丙基]吡咯烷-1-甲酸叔丁酯
[3836][3837]
将4-(3-氨基丙基)-2-苄基-2-甲基-吡咯烷-1-甲酸叔丁酯(3.13g,9.4141mmol)、6-氟吡啶-2-磺酰胺(1.8788g,10.665mmol)和碳酸钠(3.0279g,28.568mmol)于二噁烷(20ml)中的浆液加热至100℃持续24小时。将混合物冷却至室温,用h2o(20ml)稀释,然后用乙醚(3
×
20ml)萃取。丢弃水相,并用h2o(2
×
10ml)萃取合并的有机相。丢弃水相,并将有机相经无水硫酸钠干燥,过滤,并真空浓缩。粗产物通过hplc,使用60%至100%乙腈/经0.1%tfa缓冲的水进行纯化。2-苄基-2-甲基-4-[3-[(6-氨磺酰基-2-吡啶基)氨基]丙基]吡咯烷-1-甲酸叔丁酯(3.2671g,68%)1h nmr(500mhz,dmso-d6)δ7.55-7.47(m,1h),7.32-7.24(m,2h),7.25-7.17(m,1h),7.13(d,j=6.8hz,2h),7.06(s,2h),6.96(d,j=6.7hz,1h),6.92-6.83(m,1h),6.63-6.50(m,1h),3.33-3.19(m,1h),3.20-3.08(m,2h),2.78-2.62(m,2h),2.19-2.11(m,1h),1.52-1.44(m,9h),1.42(s,2h),1.38(s,2h),1.34-1.02(m,6h)。esi-ms m/z计算值488.24573,实验值489.4(m 1)
;保留时间:2.81分钟(lc方法b)。
[3838]
步骤11:2-苄基-4-[3-[[6-[[2-氯-6-[3-(2-二螺[2.0.24.13]庚-7-基乙氧基)吡唑-1-基]吡啶-3-羰基]氨磺酰基]-2-吡啶基]氨基]丙基]-2-甲基-吡咯烷-1-甲酸叔丁酯
[3839][3840]
在20-ml小瓶中,将2-氯-6-[3-(2-二螺[2.0.24.13]庚-7-基乙氧基)吡唑-1-基]吡啶-3-甲酸(240.3mg,0.6011mmol)溶解于thf(5.0ml)中,向其添加cdi(166.1mg,1.024mmol)。将所得混合物在室温下搅拌16小时。此后,添加2-苄基-2-甲基-4-[3-[(6-氨磺酰基-2-吡啶基)氨基]丙基]吡咯烷-1-甲酸叔丁酯(295.2mg,0.5775mmol)和dbu(500μl,3.343mmol),并将所得混合物在室温下搅拌28小时。此后,添加1n hcl(5ml),并将混合物用etoac(3
×
3ml)萃取。将合并的有机萃取物用h2o(5ml)和盐水(5ml)洗涤,然后经na2so4干燥,过滤并真空蒸发,得到黄色泡沫状物。通过硅胶色谱法(24g二氧化硅),使用0-70%etoac/己烷梯度洗脱进行纯化,得到2-苄基-4-[3-[[6-[[2-氯-6-[3-(2-二螺[2.0.24.13]庚-7-基乙氧基)吡唑-1-基]吡啶-3-羰基]氨磺酰基]-2-吡啶基]氨基]丙基]-2-甲基-吡咯烷-1-甲酸叔丁酯(302.0mg,63%)esi-ms m/z计算值829.3388,实验值830.3(m 1)
;保留时间:2.3分钟(lc方法g)。
[3841]
步骤12:12-苄基-8-[3-(2-{二螺[2.0.24.13]庚-7-基}乙氧基)-1h-吡唑-1-基]-12-甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮(化合物430)(非对映异构体2,峰1),12-苄基-8-[3-(2-{二螺[2.0.24.13]庚-7-基}乙氧基)-1h-吡唑-1-基]-12-甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮(化合物431)(非对映异构体2,峰2)
[3842][3843]
阶段1:在20-ml小瓶中,将2-苄基-4-[3-[[6-[[2-氯-6-[3-(2-二螺[2.0.24.13]庚-7-基乙氧基)吡唑-1-基]吡啶-3-羰基]氨磺酰基]-2-吡啶基]氨基]丙基]-2-甲基-吡咯烷-1-甲酸叔丁酯(302.0mg,0.3637mmol)溶解于dcm(2.0ml)中。添加tfa(200μl,2.596mmol),并使所得溶液在室温下静置16小时。添加更多tfa(1.0ml,12.98mmol),并且将所得混合物在40℃下搅拌42小时(通过uplc确定完成不完全)。然后将混合物真空蒸发,溶解于1:1meoh:dmso(2ml)中,过滤,并且藉由反相制备型色谱法,使用c
18
柱和含5mm hcl溶液的30%至99%mecn/h2o梯度洗脱进行纯化,得到回收的起始物质(27.8mg,9%回收)以及灰白色固体n-[[6-[3-(5-苄基-5-甲基-吡咯烷-3-基)丙基氨基]-2-吡啶基]磺酰基]-2-氯-6-[3-(2-二螺[2.0.24.13]庚-7-基乙氧基)吡唑-1-基]吡啶-3-甲酰胺(盐酸盐)(111.8mg,40%)。
[3844]
阶段2:在20-ml微波小瓶中,将n-[[6-[3-(5-苄基-5-甲基-吡咯烷-3-基)丙基氨
基]-2-吡啶基]磺酰基]-2-氯-6-[3-(2-二螺[2.0.24.13]庚-7-基乙氧基)吡唑-1-基]吡啶-3-甲酰胺(盐酸盐)(111.8mg,0.1458mmol)溶解于nmp(3.0ml),向其中添加k2co3(302.8mg,2.191mmol)。将所得混合物用氮气冲洗,然后在150℃下搅拌70小时(通过uplc确定反应不完全)。在冷却至室温之后,将所得混合物用hcl水溶液(1n;8ml)淬灭,然后用etoac(3
×
5ml)萃取。将合并的有机萃取物用h2o(2
×
5ml)和盐水(5ml)洗涤,然后经na2so4干燥,过滤并真空蒸发,得到90mg深棕色油状物。通过硅胶色谱法(24g二氧化硅),使用0至50%etoac/己烷的梯度洗脱来进行纯化,得到作为2种立体异构体的混合物的55mg白色固体。对映异构体的分离用sfc纯化法,使用as-3柱和流动相20%-45%meoh( nh3改性剂)/co2,和60ml/min流速进行。获得两个峰,并根据其保留时间标记为“峰1”和“峰2”(峰1是自手性sfc首先洗脱的峰并且峰2是第二洗脱的峰)。
[3845]“非对映异构体2,峰1”:12-苄基-8-[3-(2-{二螺[2.0.24.13]庚-7-基}乙氧基)-1h-吡唑-1-基]-12-甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮(14.4mg,6%);1h nmr(400mhz,dmso-d6)δ12.56(s,1h),8.29(d,j=2.8hz,1h),7.95-7.73(m,1h),7.64-7.42(m,1h),7.29-7.13(m,3h),7.13-6.81(m,5h),6.76-6.53(m,1h),6.10(s,1h),4.22(t,j=6.6hz,2h),3.86-3.58(m,2h),3.16-2.95(m,1h),2.92-2.75(m,1h),2.74-2.60(m,1h),2.06(d,j=8.1hz,1h),1.82(q,j=6.6hz,2h),1.71-1.56(m,1h),1.55(s,3h),1.47(t,j=6.5hz,1h),1.44-1.26(m,3h),1.25-1.03(m,3h),0.90-0.79(m,4h),0.70-0.59(m,2h),0.55-0.43(m,2h)。esi-ms m/z计算值esi-ms m/z计算值693.30975,实验值694.3(m 1)
;保留时间:2.46分钟(lc方法a)。
[3846]“非对映异构体2,峰2”:12-苄基-8-[3-(2-{二螺[2.0.24.13]庚-7-基}乙氧基)-1h-吡唑-1-基]-12-甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5(10),6,8,19,21-六烯-2,2,4-三酮(14.7mg,6%);esi-ms m/z计算值693.30975,实验值694.3(m 1)
;保留时间:2.47分钟(lc方法a)。
[3847]
实施例163:(133s)-255-(3-(2-(二螺[2.0.244.133]庚-7-基)乙氧基)-1h-吡唑-1-基)
‑‑15
5,155-二甲基-5-硫杂-4,7-二氮杂-6(2,6)-吡啶杂-1(1,3)-吡咯啶杂-2(1,2)-苯杂环十蕃-3-酮5,5-二氧化物(化合物432)的制备
[3848][3849]
步骤1:2-氟-4-碘-苯甲酸叔丁酯
[3850][3851]
在室温下,向2-氟-4-碘-苯甲酸(1g,3.6841mmol)于thf(6ml)中的溶液中添加碳酸叔丁氧羰基叔丁酯(1g,4.5820mmol)、三乙胺(580.80mg,0.8ml,5.7397mmol)和dmap(135mg,1.1050mmol)。将反应混合物在室温下搅拌16小时。将反应混合物用etoac稀释,并用水(25ml)洗涤。将合并的有机层用盐水(25ml)洗涤,经无水硫酸钠干燥,过滤并减压浓缩。粗物质经由硅胶柱色谱法,使用0至30%etoac/庚烷梯度进行纯化,得到浅黄色油状物,2-氟-4-碘-苯甲酸叔丁酯(840mg,71%)。1h nmr(400mhz,cdcl3)δ7.60-7.48(m,3h),1.59(s,9h)。19f nmr(377mhz,cdcl3)δ
–
107.75
‑–
107.83(m,1f)。
[3852]
步骤2:4-[3-(2-二螺[2.0.24.13]庚-7-基乙氧基)吡唑-1-基]-2-氟-苯甲酸叔丁酯
[3853][3854]
在反应管中,在氮气下将2-氟-4-碘-苯甲酸叔丁酯(680mg,2.1110mmol)、3-(2-二螺[2.0.24.13]庚-7-基乙氧基)-1h-吡唑(520mg,2.5457mmol)、(1s,2s)-( )-1,2-二氨基环己烷(125mg,1.0947mmol)、碳酸钾(590mg,4.2690mmol)和碘化铜(i)(85mg,0.4463mmol)混合于二噁烷(9ml)中。将管密封并加热到100℃。将反应混合物在此温度下搅拌18小时。将反应混合物在硅藻土上过滤,并用etoac冲洗垫。将滤液真空浓缩,并将粗产物在c
18
上通过反相色谱法(5%至100%mecn/水)纯化,得到呈澄清油状物的4-[3-(2-二螺[2.0.24.13]庚-7-基乙氧基)吡唑-1-基]-2-氟-苯甲酸叔丁酯(800mg,90%),该油状物变成白色固体。1h nmr(400mhz,cdcl3)δ7.92(t,j=8.3hz,1h),7.76(d,j=2.7hz,1h),7.44-7.33(m,2h),5.94(d,j=2.7hz,1h),4.26(t,j=6.7hz,2h),1.91(q,j=6.6hz,2h),1.61(s,9h),1.27(t,j=7.1hz,1h),0.90-0.82(m,4h),0.71-0.61(m,2h),0.56-0.46(m,2h)。
19
f nmr(377mhz,cdcl3)δ
–
106.82(dd,j=12.3,8.2hz,1f)。esi-ms m/z计算值398.20056,实验值399.2(m 1)
;保留时间:2.41分钟(lc方法e)。
[3855]
步骤3:4-[3-(2-二螺[2.0.24.13]庚-7-基乙氧基)吡唑-1-基]-2-氟-苯甲酸
[3856][3857]
将4-[3-(2-二螺[2.0.24.13]庚-7-基乙氧基)吡唑-1-基]-2-氟-苯甲酸叔丁酯(800mg,1.8973mmol)溶解于二氯甲烷(15ml)中。然后,逐滴添加三氟乙酸(3.4040g,2.3ml,29.854mmol),并将反应物在室温下搅拌4小时。将溶剂蒸发,得到呈白色固体状的4-[3-(2-二螺[2.0.24.13]庚-7-基乙氧基)吡唑-1-基]-2-氟-苯甲酸(三氟乙酸盐)(810mg,90%)。1h nmr(400mhz,dmso-d6)δ13.14(br.s.,1h),8.49(d,j=2.7hz,1h),7.94(t,j=8.6hz,1h),7.70-7.62(m,2h),6.12(d,j=2.7hz,1h),4.21(t,j=6.7hz,2h),1.81(q,j=6.6hz,2h),1.46(t,j=6.4hz,1h),0.88-0.76(m,4h),0.70-0.60(m,2h),0.53-0.44(m,2h)。
19
f nmr(377mhz,dmso-d6)δ-107.51(dd,j=12.3,8.2hz,1f)。esi-ms m/z计算值342.13797,实验值343.2(m 1)
;保留时间:1.99分钟(lc方法e)。
[3858]
步骤4:(4s)-4-[3-[[6-[[4-[3-(2-二螺[2.0.24.13]庚-7-基乙氧基)吡唑-1-基]-2-氟-苯甲酰基]氨磺酰基]-2-吡啶基]氨基]丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯
[3859][3860]
在氮气下,向圆底烧瓶中装入4-[3-(2-二螺[2.0.24.13]庚-7-基乙氧基)吡唑-1-基]-2-氟-苯甲酸(520mg,1.4687mmol)和thf(7ml)。添加1,1'-羰基二咪唑(40mg,0.2467mmol),并且将混合物在室温下在氮气下搅拌2小时。在单独的烧瓶中,制备(4s)-2,2-二甲基-4-[3-[(6-氨磺酰基-2-吡啶基)氨基]丙基]吡咯烷-1-甲酸叔丁酯(500mg,1.2120mmol)于thf(5ml)中的溶液,并且将其经由注射器添加到活化的酸溶液中。添加1,8-二氮杂双环[5.4.0]十一碳-7-烯(509.0mg,0.5ml,3.3435mmol),并将反应混合物在氮气下在室温下搅拌18小时。之后,在减压下移除溶剂。粗产物通过反相色谱法,用mecn/水(含0.1%甲酸)(5%至100%)梯度洗脱直接纯化,得到呈浅棕色固体状的(4s)-4-[3-[[6-[[4-[3-(2-二螺[2.0.24.13]庚-7-基乙氧基)吡唑-1-基]-2-氟-苯甲酰基]氨磺酰基]-2-吡啶基]氨基]丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(500mg,56%)。1h nmr(400mhz,cdcl3)δ8.07-7.93(m,1h),7.81-7.74(m,1h),7.65-7.59(m,1h),7.56-7.46(m,2h),7.41(d,j=8.6hz,1h),6.58-6.54(m,1h),5.98-5.92(m,1h),4.80-4.78(m,1h),4.25(t,j=6.7hz,2h),3.85-3.74(m,1h),3.41-3.17(m,2h),2.91-2.76(m,1h),2.15-2.04(m,1h),1.95-1.78(m,3h),1.70-1.23(m,22h),0.89-0.81(m,4h),0.72-0.62(m,2h),0.57-0.49(m,2h)。
19
f nmr(377mhz,cdcl3)δ
–
108.64
‑–
108.96(m,1f)。esi-ms m/z计算值736.34186,实验值737.3(m 1)
;保留时间:2.32分钟(lc方法e)。
[3861]
步骤5:n-[[6-[3-[(3s)-5,5-二甲基吡咯烷-3-基]丙基氨基]-2-吡啶基]磺酰基]-4-[3-(2-二螺[2.0.24.13]庚-7-基乙氧基)吡唑-1-基]-2-氟-苯甲酰胺
[3862][3863]
在圆底烧瓶中,在室温下将(4s)-4-[3-[[6-[[4-[3-(2-二螺[2.0.24.13]庚-7-基乙氧基)吡唑-1-基]-2-氟-苯甲酰基]氨磺酰基]-2-吡啶基]氨基]丙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(500mg,0.6785mmol)在二氯甲烷(5ml)和4m hcl(于二噁烷中)(2.6ml,10.400mmol)中搅拌2小时。蒸发溶剂,得到呈浅棕色固体状的n-[[6-[3-[(3s)-5,5-二甲基吡咯烷-3-基]丙基氨基]-2-吡啶基]磺酰基]-4-[3-(2-二螺[2.0.24.13]庚-7-基乙氧基)吡唑-1-基]-2-氟-苯甲酰胺(盐酸盐)(450mg,89%)。1h nmr(400mhz,dmso-d6)δ9.10(br.s.,1h),8.96(br.s.,1h),8.53(d,j=2.9hz,1h),7.76-7.56(m,4h),7.15(d,j=7.1hz,1h),6.73(d,j=8.3hz,1h),6.13(d,j=2.9hz,1h),4.21(t,j=6.7hz,2h),3.56(s,6h),3.34-3.13(m,3h),1.88-1.75(m,3h),1.48-1.19(m,9h),0.86-0.79(m,4h),0.68-0.61(m,2h),0.52-0.46(m,2h)。
19
f nmr(377mhz,dmso-d6)δ
–
109.84(dd,j=12.3,8.2hz,1f)。
esi-ms m/z计算值636.2894,实验值637.2(m 1)
;保留时间:1.62分钟(lc方法e)。
[3864]
步骤6:(133s)-255-(3-(2-(二螺[2.0.244.133]庚-7-基)乙氧基)-1h-吡唑-1-基)
‑‑15
5,155-二甲基-5-硫杂-4,7-二氮杂-6(2,6)-吡啶杂-1(1,3)-吡咯啶杂-2(1,2)-苯杂环十蕃-3-酮5,5-二氧化物(化合物432)
[3865][3866]
将n-[[6-[3-[(3s)-5,5-二甲基吡咯烷-3-基]丙基氨基]-2-吡啶基]磺酰基]-4-[3-(2-二螺[2.0.24.13]庚-7-基乙氧基)吡唑-1-基]-2-氟-苯甲酰胺(盐酸盐)(160mg,0.2144mmol)溶解于dmso(3.2ml)中。添加碳酸铯(560mg,1.7188mmol)。将反应管密封,并将混合物在150℃下加热4天。将反应混合物通过c
18
反相色谱法,使用5%至100%乙腈/水梯度进行直接纯化,得到呈白色固体状的(133s)-255-(3-(2-(二螺[2.0.244.133]庚-7-基)乙氧基)-1h-吡唑-1-基)-155,155-二甲基-5-硫杂-4,7-二氮杂-6(2,6)-吡啶杂-1(1,3)-吡咯啶杂-2(1,2)-苯杂环十蕃-3-酮5,5-二氧化物(40mg,29%)。1h nmr(400mhz,dmso-d6)δ12.66(br.s.,1h),8.29(d,j=2.4hz,1h),7.57(t,j=7.7hz,1h),7.46-7.39(m,2h),7.09-6.94(m,3h),6.69(d,j=8.6hz,1h),6.01(d,j=2.7hz,1h),4.19(t,j=6.6hz,2h),3.89-3.85(m,1h),3.17-3.13(m,1h),3.00-2.81(m,2h),2.23-2.17(m,1h),1.93-1.89(m,1h),1.82(q,j=6.7hz,2h),1.74-1.56(m,3h),1.53(s,4h),1.46(t,j=6.6hz,1h),1.38(s,3h),1.33-1.28(m,1h),0.85-0.75(m,4h),0.66-0.60(m,2h),0.51-0.44(m,2h)。esi-ms m/z计算值616.2832,实验值617.3(m 1)
;保留时间:3.47分钟;lcms方法:xbridge c
18 4.6x75mm 5μm,初始梯度为95%nh4hco3/5%mecn,6分钟运行,1分钟平衡梯度0至3分钟95%mecn,并保持3分钟。流速1.5ml/min。
[3867]
实施例164:(14s)-8-[3-(2-{二螺[2.0.24.13]庚-7-基}乙氧基)-1h-吡唑-1-基]-12,12-二甲基-2λ
6-硫杂-3,9,11,17,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5,7,9,19,21-六烯-2,2,4-三酮(化合物433)的制备
[3868][3869]
步骤1:3-(2-甲基-2-硝基-丙基)四氢呋喃-2-酮
[3870][3871]
将3-亚甲基四氢呋喃-2-酮(101.11g,90.357ml,989.46mmol)溶解于乙腈(1.1l)中的溶液以缓慢流添加到dbu(23.414g,23ml,153.80mmol)和2-硝基丙烷(107.14g,108ml,1.2026mol)的混合物中。反应是放热的:添加速率使得在添加过程中内部温度保持低于35℃。将所得溶液在室温下搅拌19小时,然后真空浓缩,得到浅黄色固体。将粗产物在乙醚(500ml)中搅拌过夜,然后过滤。将固体溶解于dcm(500ml)中,并用3.0m hcl水溶液(2
×
500ml)、h2o(500ml)、饱和nahco3水溶液(500ml)和饱和nacl水溶液(500ml)洗涤。dcm层经无水硫酸镁干燥,过滤并真空浓缩,得到白色晶体固体。3-(2-甲基-2-硝基-丙基)四氢呋喃-2-酮(157.59g,82%):1h nmr(500mhz,dmso-d6)δ4.27(td,j=8.6,8.6,1.5hz,1h),4.15-4.00(m,1h),2.68(dddd,j=11.4,9.7,8.5,2.9hz,1h),2.43(dd,j=14.8,2.9hz,1h),2.34-2.23(m,1h),2.09-1.99(m,1h),1.85(qd,j=11.6,11.6,11.5,8.6hz,1h),1.59(s,3h),1.58(s,3h)。esi-ms m/z计算值187.08446,实验值188.2(m 1)
;保留时间:1.39分钟(lc方法b)。
[3872]
步骤2:(3r)-3-(2-甲基-2-硝基-丙基)四氢呋喃-2-酮和(3s)-3-(2-甲基-2-硝基-丙基)四氢呋喃-2-酮
[3873][3874]
通过手性sfc,使用ad-h(2x25cm)柱,并使用35%甲醇/100巴co2作为洗脱液分离3-(2-甲基-2-硝基-丙基)四氢呋喃-2-酮(173.55g,927.1mmol)的外消旋混合物。流速为70ml/min(220nm),并且进样体积为3ml的20mg/ml于甲醇:dcm中的溶液。在添加乙腈以防止在甲醇中浓缩的情况下冷干燥后,分离出呈固体状的两种异构体。
[3875]
峰1,(3r)-3-(2-甲基-2-硝基-丙基)四氢呋喃-2-酮(88g,50%)。1h nmr(400mhz,dmso-d6)δ4.27(td,j=8.6,1.5hz,1h),4.09(ddd,j=10.9,8.7,6.1hz,1h),2.76-2.63(m,1h),2.43(dd,j=14.8,2.9hz,1h),2.35-2.24(m,1h),2.04(dd,j=14.8,10.0hz,1h),1.94-1.79(m,1h),1.59(s,3h),1.58(s,3h)。esi-ms m/z计算值187.08446,保留时间:0.71分钟(质量未检测)(lc方法a)。
[3876]
峰2,(3s)-3-(2-甲基-2-硝基-丙基)四氢呋喃-2-酮(80g,46%)。1h nmr(400mhz,dmso-d6)δ4.27(td,j=8.6,1.5hz,1h),4.09(ddd,j=10.9,8.7,6.1hz,1h),2.76-2.62(m,1h),2.43(dd,j=14.8,2.9hz,1h),2.33-2.23(m,1h),2.04(dd,j=14.8,10.0hz,1h),1.91-1.78(m,1h),1.59(s,3h),1.58(s,3h)。esi-ms m/z计算值187.08446,保留时间:0.76分钟(质量未检测)(lc方法a)。
[3877]
步骤3:(3r)-3-(2-羟乙基)-5,5-二甲基-吡咯烷-2-酮
[3878][3879]
在parr反应器中,向(3r)-3-(2-甲基-2-硝基-丙基)四氢呋喃-2-酮(37g,197.66mmol)于乙醇(370.00ml)中的溶液中添加雷尼镍(8g,91.230mmol)。将反应器在80℃下在氢气(3巴)下搅拌48小时。添加硅藻土(10g),并过滤所得浆液。将固体用乙醇(2
×
150ml)洗涤并丢弃。将合并的滤液真空浓缩,得到黄色固体。然后将固体用乙醚研磨过夜,并且收集所得固体,得到呈白色固体状的(3r)-3-(2-羟乙基)-5,5-二甲基-吡咯烷-2-酮(26.9g,82%)。1h nmr(500mhz,dmso-d6)δ7.68(s,1h),4.54(m,1h),3.47(m,1h),3.41(m,1h),2.48-2.42(m,1h),2.04(m,1h),1.86(m,1h),1.42(m,1h),1.30(m,1h),1.18(s,3h),1.13(s,3h)。
[3880]
步骤4:2-[(3r)-5,5-二甲基吡咯烷-3-基]乙醇
[3881][3882]
将lah(40g,1.0539mol)以小份添加到(3r)-3-(2-羟乙基)-5,5-二甲基-吡咯烷-2-酮(31.5g,200.37mmol)于thf(350ml)中的冷却(0℃)溶液中。使所得浆液升温至室温并搅拌1小时。然后将其加热至70℃,持续48小时。在冷却至室温之后,使用冰浴将反应物冷却至0℃。缓慢添加水(40ml),随后添加15%w/v naoh水溶液(40ml)。再添加120ml水,并且移除冰浴。将淬灭的反应混合物用乙醚(200ml)稀释,并使其升温并在室温下搅拌30分钟。将混合物通过硅藻土过滤,并将固体用乙醚洗涤(2
×
100ml)。然后合并的滤液经无水硫酸钠干燥并过滤。将合并的滤液真空蒸发,得到呈浅黄色油状物的2-[(3r)-5,5-二甲基吡咯烷-3-基]乙醇(32g,100%)。1h nmr(500mhz,dmso-d6)δ4.40(s,1h),3.46
–
3.39(m,2h),2.97
–
2.90(m,1h),2.44
–
2.32(m,1h),2.19
–
2.00(m,1h),1.71
–
1.62(m,1h),1.49
–
1.35(m,2h),1.09
–
0.97(m,7h)。[注意:产物(c8h
17
no)中总计17个质子中缺少1h。]
[3883]
步骤5:(4r)-4-(2-羟乙基)-2,2-二甲基-吡咯烷-1-甲酸叔丁酯
[3884][3885]
将2-[(3r)-5,5-二甲基吡咯烷-3-基]乙醇(32g,203.31mmol)于dcm(160.00ml)中的溶液冷却至0℃,然后添加naoh(19g,475.03mmol)于h2o(160ml)中的溶液。将碳酸叔丁氧羰基叔丁酯(59g,62.105ml,270.34mmol)于dcm(160ml)中的溶液逐滴添加到冷却的胺混合物中,然后移除冰水浴,并使反应物在室温下搅拌22小时。然后分离各相:用dcm(150ml)萃取水相。有机相经硫酸钠干燥并真空浓缩,然后通过硅胶色谱法,使用3%meoh/dcm纯化,得到呈澄清油状物的(4r)-4-(2-羟乙基)-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(30.915g,60%)。1h nmr(500mhz,dmso-d6)δ4.42(t,j=5.1,1h),3.56(q,j=8.7hz,1h),3.42
–
3.36(m,2h),2.79(dt,j=12.8,10.6hz,1h),2.21
–
2.10(m,1h),1.92
–
1.84(m,1h),1.47
–
1.44(m,2h),1.37(m,13h),1.24(s,3h)。esi-ms m/z计算值243.18344,实验值244.5(m 1)
;保留时间:2.17分钟(lc方法h)。
[3886]
步骤6:(4r)-2,2-二甲基-4-(2-氧代乙基)吡咯烷-1-甲酸叔丁酯
[3887][3888]
通过将碳酸氢钠(9.53g,113.44mmol)溶解到次氯酸钠水溶液(136ml,1.6m,217.60mmol)中并在冰浴中搅拌来制备漂白剂的缓冲溶液。然后将该溶液逐滴添加到机械搅拌的第二溶液中,所述溶液通过将溴化钠(944mg,9.1745mmol)(溶解于水(5ml)中)和tempo(73mg,0.4672mmol)添加到保持在-12℃下的含(4r)-4-(2-羟乙基)-2,2-二甲基吡咯烷-1-甲酸叔丁酯(43.68g,179.50mmol)的dcm(570ml)中来预先制备。在将漂白剂缓冲溶液添加到底物溶液期间,将内部温度保持在-10℃以下。在完成添加后,将反应混合物保持在-14℃持续10分钟。用乙醇(2.3670g,3ml,51.380mmol)淬灭过量的漂白剂。将反应混合物在35℃下减压浓缩。将所得残余物在乙酸乙酯(200ml)和水(100ml)之间分配。将水相分离并
用乙酸乙酯(100ml)洗涤。将水相置于一旁。将有机物合并,用盐水(150ml)洗涤,用硫酸钠干燥,过滤并减压浓缩,得到(4r)-2,2-二甲基-4-(2-氧乙基)吡咯烷-1-甲酸叔丁酯(34.6g,69%)1h nmr(400mhz,cdcl3)δ9.78(s,1h),3.87-3.70(m,1h),3.01-2.82(m,1h),2.68-2.41(m,3h),2.07-1.94(m,1h),1.53-1.30(m,16h)。esi-ms m/z计算值241.1678,实验值186.2(m
–
tbu 2h=m
–
55)
;保留时间:1.79分钟(lc方法e)。
[3889]
步骤7:6-苄基硫基吡啶-2-甲酸甲酯
[3890][3891]
用氮气吹扫苯甲硫醇(55.70g,52.647ml,443.97mmol)于thf(1250ml)中的溶液。将溶液在0℃下搅拌,向其中逐份添加含氢化钠(22.58g,564.55mmol)的矿物油。添加后,将混合物升温至室温,并在氮气下搅拌0.5小时。然后,逐份添加6-溴吡啶-2-甲酸甲酯(100.82g,457.36mmol),并将反应物在室温下在氮气下搅拌1.5小时。将反应物用h2o(600ml)淬灭,并用etoac(3
×
500ml)萃取。将合并的etoac层用饱和nacl水溶液(500ml)洗涤,经无水硫酸钠干燥,过滤,并真空浓缩,得到6-苄基硫基吡啶-2-甲酸甲酯(112.47g,90%):esi-ms m/z计算值259.0667,实验值260.2(m 1)
;保留时间:2.95分钟(lc方法b)。
[3892]
步骤8:6-氯磺酰基吡啶-2-甲酸甲酯
[3893][3894]
将6-苄基硫基吡啶-2-甲酸甲酯(112.47g,412.02mmol)于dcm(850ml)和水(260ml)中的溶液冷却至0℃,并且在剧烈搅拌下,逐滴添加磺酰氯(228.14g,140ml,1.6396mol),同时保持温度低于5℃。将有机相分离,用h2o(2
×
300ml)洗涤,经无水硫酸钠干燥,过滤并真空浓缩。将残余物(117.47g)溶解于dcm(100ml)中。添加己烷(500ml),并蒸发约300ml溶剂。将所得白色沉淀真空过滤,并将固体用己烷(2
×
300ml)洗涤。将滤液真空浓缩并溶解于dcm(50ml)中。添加己烷(250ml),并将dcm缓慢蒸发。在真空过滤白色沉淀之前,将约150ml溶剂蒸发并收集。将固体用己烷(2
×
80ml)洗涤。得到呈浅黄色固体状的6-氯磺酰基吡啶-2-甲酸甲酯(67.70g,66%)。1h nmr(500mhz,氯仿-d)δ8.51-8.44(m,1h),8.32-8.26(m,1h),8.22(t,j=7.8,7.8hz,1h),4.06(s,3h)。
[3895]
步骤9:6-氨磺酰基吡啶-2-甲酸甲酯
[3896][3897]
向冷却至0℃的6-氯磺酰基吡啶-2-甲酸甲酯(67.6g,284.00mmol)于acn(1100ml)中的溶液中逐滴添加浓缩的氢氧化铵水溶液(45ml,12m,540.00mmol)。反应是放热的,因此逐滴添加保持在将内部温度维持于5℃以下的速率。在接近添加结束时,随着逐滴添加更多
氢氧化铵,内部温度降低。将反应物在0℃下搅拌15分钟。在消耗起始物质之后,将反应混合物用h2o(500ml)稀释,并用etoac(3
×
300ml)萃取。将合并的有机层经无水硫酸钠干燥,过滤并真空浓缩,得到白色固体:6-氨磺酰基吡啶-2-甲酸甲酯(60.49g,93%);1h nmr(500mhz,dmso-d6)δ8.30-8.22(m,2h),8.19-8.13(m,1h),7.63(s,2h),3.92(s,3h)。esi-ms m/z计算值216.02048,实验值217.3(m 1)
;保留时间:1.31分钟(lc方法b)。
[3898]
步骤10:6-(羟甲基)吡啶-2-磺酰胺
[3899][3900]
向6-氨磺酰基吡啶-2-甲酸甲酯(60.5g,263.03mmol)于thf(450ml)中的溶液中添加氯化钙(58.3g,525.30mmol)于无水乙醇(450ml)中的溶液。然后逐份添加硼氢化钠(30g,792.97mmol)。然后将反应物在室温下搅拌24小时。将反应物用nahco3(200ml)淬灭,以达到ph 8。然后将混合物过滤,并用etoac(200ml)分配滤液。将水层用etoac(10
×
250ml)萃取。将有机层合并,用无水硫酸钠干燥,过滤并减压浓缩,得到呈黄色固体状的6-(羟甲基)吡啶-2-磺酰胺(44.6g,86%)。1h nmr(500mhz,dmso-d6)δ8.04(t,j=7.7,7.7hz,1h),7.77(d,j=7.6hz,1h),7.68(d,j=7.8hz,1h),7.40(s,2h),5.59(t,j=5.8,5.8hz,1h),4.62(d,j=6.0hz,2h)。esi-ms m/z计算值188.02556,实验值189.1(m 1)
;保留时间:0.34分钟(lc方法h)。
[3901]
步骤11:甲磺酸(6-氨磺酰基-2-吡啶基)甲酯
[3902][3903]
向6-(羟甲基)吡啶-2-磺酰胺(36.5g,174.54mmol)于thf(600ml)中的悬浮液中添加三乙胺(36.300g,50ml,358.73mmol)。然后,在0℃下将甲磺酰氯(17.760g,12ml,155.04mmol)逐滴添加到反应混合物中。将反应物在0℃下搅拌1小时。将反应物用饱和碳酸氢钠(200ml)稀释,过滤,并用乙酸乙酯(3
×
150ml)萃取。将合并的有机层用盐水洗涤,经无水硫酸钠干燥并真空浓缩。残余物通过硅胶色谱法,使用0至10%甲醇/dcm进行纯化,得到呈米色固体状的甲磺酸(6-氨磺酰基-2-吡啶基)甲酯(19g,39%)。esi-ms m/z计算值266.0031,实验值267.0(m 1)
;保留时间:1.31分钟(lc方法b)。
[3904]
步骤12:偶氮基-[(6-氨磺酰基-2-吡啶基)甲基]胺
[3905][3906]
向甲磺酸(6-氨磺酰基-2-吡啶基)甲酯(19g,67.782mmol)于无水dmf(225ml)中的溶液中添加叠氮化钠(8.8g,135.36mmol)。将溶液在室温下搅拌2小时。然后将反应物用etoac(400ml)和饱和碳酸氢钠(200ml)稀释。过滤白色固体,然后用etoac(2
×
100ml)萃取
水层。然后将有机层合并,用盐水洗涤,用无水硫酸钠干燥,过滤并减压浓缩,得到呈米色固体状的偶氮基-[(6-氨磺酰基-2-吡啶基)甲基]胺(12.3g,80%)。esi-ms m/z计算值213.03204,实验值214.1(m 1)
;保留时间:1.38分钟(lc方法b)。
[3907]
步骤13:6-(氨基甲基)吡啶-2-磺酰胺
[3908][3909]
向偶氮基-[(6-氨磺酰基-2-吡啶基)甲基]胺(7.05g,31.081mmol)于meoh(2.75l)中的溶液中添加钯/碳(1.5g,14.095mmol)。将反应物在室温下在氢气气氛下搅拌2小时。将催化剂通过硅藻土垫滤出,并将滤液减压浓缩,得到呈黄色固体状的6-(氨基甲基)吡啶-2-磺酰胺(5.6g,77%)。esi-ms m/z计算值187.0415,实验值187.9(m 1)
;保留时间:0.87分钟(lc方法b)。
[3910]
步骤14:(4s)-2,2-二甲基-4-[2-[(6-氨磺酰基-2-吡啶基)甲基氨基]乙基]吡咯烷-1-甲酸叔丁酯
[3911][3912]
将三乙酰氧基硼氢化钠(2.75g,12.586mmol)添加到(4r)-2,2-二甲基-4-(2-氧代乙基)吡咯烷-1-甲酸叔丁酯(1.5g,6.2156mmol)和6-(氨基甲基)吡啶-2-磺酰胺(盐酸盐)(1.696g,7.2638mmol)于二氯甲烷(30ml)和甲醇(15ml)的混合物中的溶液中。将反应混合物在室温下搅拌2小时。将meoh(20ml)添加到反应混合物中,并将其真空蒸发。将残余物用饱和nahco3水溶液(25ml)、水(25ml)和etoac(50ml)处理。分离各层。用etoac(3
×
50ml)进一步萃取水层。将合并的有机萃取物用盐水(50ml)洗涤,经无水硫酸钠干燥,过滤并真空浓缩。粗产物通过硅胶色谱法,用0%至20%meoh/dcm梯度洗脱进行纯化,得到白色固体(4s)-2,2-二甲基-4-[2-[(6-氨磺酰基-2-吡啶基)甲基氨基]乙基]吡咯烷-1-甲酸叔丁酯(1.43g,56%);esi-ms m/z计算值412.21442,实验值413.2(m 1)
;保留时间:1.35分钟(lc方法e)。
[3913]
步骤15:(4s)-4-[2-[[6-[[2-氯-6-[3-(2-二螺[2.0.24.13]庚-7-基乙氧基)吡唑-1-基]吡啶-3-羰基]氨磺酰基]-2-吡啶基]甲基氨基]乙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯
[3914][3915]
向2-氯-6-[3-(2-二螺[2.0.24.13]庚-7-基乙氧基)吡唑-1-基]吡啶-3-甲酸(315mg,0.8755mmol)于thf(3ml)中的溶液中添加1,1'-羰基二咪唑(250mg,1.5418mmol),
并将混合物在室温下搅拌2小时。在单独的烧瓶中,制备(4s)-2,2-二甲基-4-[2-[(6-氨磺酰基-2-吡啶基)甲基氨基]乙基]吡咯烷-1-甲酸叔丁酯(300mg,0.7272mmol)于thf(3ml)中的溶液,并且随后将其添加到活化的酸溶液中。添加1,8-二氮杂双环[5.4.0]十一碳-7-烯(335.94mg,0.33ml,2.2067mmol),并将反应混合物在室温下搅拌18小时。之后,在减压下移除溶剂。粗产物通过反相色谱法,使用c
18
柱并用mecn/水(含0.1%甲酸)梯度洗脱进行纯化,并且然后通过硅胶色谱法,用meoh/二氯甲烷(0至20%)梯度洗脱进行纯化。由此得到黄色固体(4s)-4-[2-[[6-[[2-氯-6-[3-(2-二螺[2.0.24.13]庚-7-基乙氧基)吡唑-1-基]吡啶-3-羰基]氨磺酰基]-2-吡啶基]甲基氨基]乙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(353.3mg,42%);esi-ms m/z计算值753.30756,实验值754.2(m 1)
;保留时间:1.92分钟(lc方法e)。
[3916]
步骤16:2-氯-n-[[6-[[2-[(3s)-5,5-二甲基吡咯烷-3-基]乙基氨基]甲基]-2-吡啶基]磺酰基]-6-[3-(2-二螺[2.0.24.13]庚-7-基乙氧基)吡唑-1-基]吡啶-3-甲酰胺
[3917][3918]
在室温下,向(4s)-4-[2-[[6-[[2-氯-6-[3-(2-二螺[2.0.24.13]庚-7-基乙氧基)吡唑-1-基]吡啶-3-羰基]氨磺酰基]-2-吡啶基]甲基氨基]乙基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(350mg,0.3011mmol)于二氯甲烷(7ml)中的溶液中添加含4m hcl的二噁烷(1.25ml,5.00mmol),并将混合物搅拌2小时。然后将溶剂蒸发,并将粗混合物通过反相色谱法,用meoh/水(含有0.1%甲酸)梯度洗脱进行纯化。将溶剂真空移除,并且添加1n naoh水溶液(50ml)。将混合物用etoac(3
×
100ml)萃取,用盐水(100ml)洗涤,经无水硫酸钠干燥,过滤并真空浓缩,得到呈白色固体状的2-氯-n-[[6-[[2-[(3s)-5,5-二甲基吡咯烷-3-基]乙基氨基]甲基]-2-吡啶基]磺酰基]-6-[3-(2-二螺[2.0.24.13]庚-7-基乙氧基)吡唑-1-基]吡啶-3-甲酰胺(162.8mg,83%)。1h nmr(400mhz,dmso-d6)δ8.33(d,j=2.9hz,1h),8.14(d,j=8.3hz,1h),7.89-7.83(m,1h),7.76(d,j=6.8hz,1h),7.61(d,j=8.3hz,1h),7.45(d,j=7.6hz,1h),6.08(d,j=2.7hz,1h),4.22(t,j=6.6hz,2h),3.80(s,2h),3.35(br s,2h),3.19-3.08(m,1h),2.66-2.59(m,1h),2.35-2.21(m,1h),1.85-1.76(m,3h),1.54-1.43(m,3h),1.29-1.14(m,6h),1.11(s,3h),0.88-0.78(m,4h),0.67-0.61(m,2h),0.53-0.47(m,2h)。[注意:产物(c
32h40
cln7o4s)的总计40个质子中缺少1h。]esi-ms m/z计算值653.2551,实验值654.2(m 1)
;保留时间:1.49分钟(lc方法e)。
[3919]
步骤17:(14s)-8-[3-(2-{二螺[2.0.24.13]庚-7-基}乙氧基)-1h-吡唑-1-基]-12,12-二甲基-2λ
6-硫杂-3,9,11,17,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5,7,9,19,21-六烯-2,2,4-三酮(化合物433)
[3920]
[3921]
向2-氯-n-[[6-[[2-[(3s)-5,5-二甲基吡咯烷-3-基]乙基氨基]甲基]-2-吡啶基]磺酰基]-6-[3-(2-二螺[2.0.24.13]庚-7-基乙氧基)吡唑-1-基]吡啶-3-甲酰胺(150mg,0.2293mmol)于dmso(4ml)的溶液中添加碳酸钾(250mg,1.8089mmol),并将混合物在120℃下搅拌24小时。然后将混合物冷却至室温,并且通过反相色谱法,用mecn/水(含0.1%甲酸)(5%至100%)梯度洗脱直接纯化。由此得到(34.2mg)产物,混有二聚体副产物。然后将所得混合物通过反相色谱法(0%至95%h2o:ch3cn,含0.1%hco2h改性剂)再纯化。在蒸发后,添加1n naoh(10ml),并用etoac(3
×
20ml)萃取混合物。由此得到呈白色固体状的(14s)-8-[3-(2-{二螺[2.0.24.13]庚-7-基}乙氧基)-1h-吡唑-1-基]-12,12-二甲基-2λ
6-硫杂-3,9,11,17,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(23),5,7,9,19,21-六烯-2,2,4-三酮(8.6mg,3%)。1h nmr(400mhz,dmso-d6)δ8.15(d,j=2.7hz,1h),7.92-7.81(m,2h),7.53(d,j=8.3hz,1h),7.45(d,j=7.3hz,1h),6.76(d,j=8.1hz,1h),5.99(d,j=2.7hz,1h),4.19(t,j=6.7hz,2h),3.96-3.83(m,2h),3.30-3.28(m,1h),3.22-3.12(m,1h),2.46-2.41(m,1h),2.29-2.17(m,1h),2.15-2.04(m,1h),1.87-1.78(m,3h),1.72-1.64(m,1h),1.63-1.43(m,10h),0.85-0.82(m,4h),0.67-0.62(m,2h),0.53-0.46(m,2h)。[注意:产物(c
32h39
n7o4s)的总计39个质子中缺少1h。]esi-ms m/z计算值617.27844,实验值618.3(m 1)
;保留时间:3.41分钟(lc方法f)。
[3922]
实施例165:(14s)-16-(2,2-二甲基丙基)-8-[3-(2-{二螺[2.0.24.13]庚-7-基}乙氧基)-1h-吡唑-1-基]-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5(10),6,8,19(23),20-六烯-2,2,4-三酮(化合物434)、(14s)-16-(2,2-二甲基丙基)-8-[3-(2-{二螺[2.0.24.13]庚-7-基}乙氧基)-1h-吡唑-1-基]-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5(10),6,8,19(23),20-六烯-2,2,4-三酮(化合物435)和(14s)-16-(2,2-二甲基丙基)-8-[3-(2-{二螺[2.0.24.13]庚-7-基}乙氧基)-1h-吡唑-1-基]-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5(10),6,8,19(23),20-六烯-2,2,4-三酮(化合物436)的制备
[3923][3924]
步骤1:(4r)-4-(2-羟基-4,4-二甲基-戊基)-2,2-二甲基-吡咯烷-1-甲酸叔丁酯
[3925]
[3926]
在0℃下,向(4r)-2,2-二甲基-4-(2-氧代乙基)吡咯烷-1-甲酸叔丁酯(2g,7.5085mmol)于thf(32ml)中的溶液中逐滴添加新戊基氯化镁于thf(16.7ml,1m,16.700mmol)中的溶液。将混合物在0℃下搅拌1小时,然后用饱和氯化铵水溶液(25ml)淬灭。将混合物在乙酸乙酯(100ml)中稀释,并分离相。将水相用乙酸乙酯(2
×
50ml)萃取。合并的有机层经无水硫酸钠干燥,过滤并减压浓缩。将粗残余物通过硅胶色谱法,用0%至50%乙酸乙酯/庚烷洗脱进行纯化,得到呈白色固体状的(4r)-4-(2-羟基-4,4-二甲基戊基)-2,2-二甲基吡咯烷-1-甲酸叔丁酯(1.44g,61%)。esi-ms m/z计算值313.2617,实验值258.2(m
–
tbu 2h=m
–
55)
;保留时间:2.06分钟(lc方法e)。
[3927]
步骤2:(4r)-4-(4,4-二甲基-2-氧代-戊基)-2,2-二甲基-吡咯烷-1-甲酸叔丁酯
[3928][3929]
向(4r)-4-(2-羟基-4,4-二甲基戊基)-2,2-二甲基吡咯烷-1-甲酸叔丁酯(1.44g,4.5891mmol)于二氯甲烷(15ml)中的溶液中添加戴斯-马丁过碘烷(2.29g,5.3991mmol),并将混合物在室温下搅拌30分钟。将混合物用饱和碳酸氢钠水溶液(40ml)淬灭,并用二氯甲烷(2x40ml)萃取。将有机相用饱和碳酸氢钠水溶液(20ml)和盐水(20ml)洗涤,经硫酸钠干燥,过滤并浓缩至干燥。将粗物质通过硅胶色谱法,用0至40%乙酸乙酯/庚烷进行纯化,得到呈白色固体状的(4r)-4-(4,4-二甲基-2-氧代-戊基)-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(920mg,61%)。esi-ms m/z计算值311.24603,实验值334.2(m na=m 23)
;保留时间:2.11分钟(lc方法e)。
[3930]
步骤3:(4s)-4-(4,4-二甲基-2-亚甲基-戊基)-2,2-二甲基-吡咯烷-1-甲酸叔丁酯
[3931][3932]
在0℃下,在氮气下向甲基(三苯基)溴化鏻(1.64g,4.5910mmol)于thf(8.5ml)中的溶液中逐滴添加双(三甲基硅基)氨基钠于thf(4.6ml,1m,4.6000mmol)中的溶液,并将混合物在室温下搅拌1小时。将所得黄色溶液用含(4r)-4-(4,4-二甲基-2-氧代-戊基)-2,2-二甲基吡咯烷-1-甲酸叔丁酯(580mg,1.8268mmol)的thf(8.5ml)处理,并在70℃下搅拌16小时。冷却至室温后,添加水(30ml),并将混合物用乙酸乙酯(3
×
30ml)萃取。将合并的有机相用盐水(2
×
20ml)洗涤,经硫酸钠干燥,过滤并浓缩至干燥。将粗残余物在硅胶上通过硅胶色谱法,用0%至20%乙酸乙酯/庚烷洗脱进行纯化,得到呈无色油状物的(4s)-4-(4,4-二甲基-2-亚甲基-戊基)-2,2-二甲基吡咯烷-1-甲酸叔丁酯(444mg,77%)。esi-ms m/z计算值309.26678,实验值254.2(m
–
tbu 2h=m
–
55)
;保留时间:2.51分钟(lc方法e)。
[3933]
步骤4:(4s)-4-[2-(羟甲基)-4,4-二甲基-戊基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯
[3934][3935]
将(4s)-4-(4,4-二甲基-2-亚甲基-戊基)-2,2-二甲基吡咯烷-1-甲酸叔丁酯(444mg,1.3629mmol)于thf(15ml)中的溶液冷却至0℃,并添加含9-硼杂双环[3.3.1]壬烷溶液的thf(9.5ml,0.5m,4.7500mmol)。将所得混合物搅拌16小时。在0℃下缓慢添加1n naoh(6.9ml,6.9mmol)和过氧化氢(666mg,0.6000ml,6.8529mmol),并将混合物搅拌24小时。将混合物用水(30ml)稀释,并用乙酸乙酯(3
×
40ml)萃取。有机相经硫酸钠干燥,过滤并浓缩至干燥。将粗制油状物通过硅胶色谱法,使用0%至20%乙酸乙酯/庚烷梯度进行纯化,得到呈无色油状物的(4s)-4-[2-(羟甲基)-4,4-二甲基-戊基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(440mg,89%)。esi-ms m/z计算值327.27734,实验值272.2(m
–
tbu 2h=m
–
55)
;保留时间:2.08分钟(lc方法e)。
[3936]
步骤5:(4s)-4-[4,4-二甲基-2-(甲基磺酰氧基甲基)戊基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯
[3937][3938]
向(4s)-4-[2-(羟甲基)-4,4-二甲基-戊基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(440mg,1.2092mmol)于dcm(6.5ml)中的0℃溶液中添加三乙胺(159.72mg,0.22ml,1.5784mmol),并且然后添加甲磺酰氯(165.76mg,0.112ml,1.4470mmol)。移除冰浴,并将混合物搅拌2.5小时。将混合物在二氯甲烷(25ml)和水(20ml)之间分配。分离各相,并将水层用二氯甲烷(2
×
20ml)萃取。将有机相用盐水(2
×
20ml)洗涤,经硫酸钠干燥,过滤并浓缩至干燥,得到呈无色油状物的粗制(4s)-4-[4,4-二甲基-2-(甲基磺酰氧基甲基)戊基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(540mg,101%)。esi-ms m/z计算值405.25488,实验值350.2(m
–
tbu 2h=m
–
55)
;保留时间:2.09分钟(lc方法e)。
[3939]
步骤6:(4s)-4-[2-(叠氮基甲基)-4,4-二甲基-戊基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯
[3940][3941]
向(4s)-4-[4,4-二甲基-2-(甲基磺酰氧基甲基)戊基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(540mg,1.2169mmol)于dmf(8.5ml)中的溶液中添加叠氮化钠(175mg,2.6919mmol),并且将混合物在65℃下搅拌16小时。将混合物用水(25ml)稀释,并用乙酸乙酯(2
×
25ml)萃取。将有机相用盐水(3
×
25ml)洗涤,经硫酸钠干燥,过滤并浓缩至干燥,得到呈无色油状物的粗制(4s)-4-[2-(叠氮基甲基)-4,4-二甲基-戊基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(446mg,95%)。esi-ms m/z计算值352.2838,实验值253.4(m
–
boc 2h=m
–
99)
;保留时间:2.41分钟(lc方法e)。
[3942]
步骤7:(4s)-4-[2-(氨基甲基)-4,4-二甲基-戊基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯
[3943][3944]
通过鼓入氮气10分钟,使(4s)-4-[2-(叠氮基甲基)-4,4-二甲基-戊基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(446mg,1.1513mmol)于meoh(11ml)中的溶液脱气。向溶液中添加10%钯/碳(50%湿,230mg,0.1081mmol),并且将混合物再用氮气脱气10分钟。将氢气鼓泡至混合物持续10分钟,并且然后将混合物在室温下在氢气气氛下搅拌4小时。将混合物通过硅藻土过滤,并用甲醇(25ml)洗涤。将滤液减压浓缩,得到呈无色油状物的粗制(4s)-4-[2-(氨基甲基)-4,4-二甲基-戊基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(349mg,88%)。1h nmr(400mhz,cdcl3)δ3.78-3.59(m,1h),2.98-2.82(m,1h),2.66-2.54(m,1h),2.21-2.12(m,1h),1.95-1.88(m,1h),1.75-1.66(m,2h),1.53-1.34(m,16h),1.32-1.22(m,6h),0.91-0.88(m,9h)。esi-ms m/z计算值326.29333,实验值327.4(m 1)
;保留时间:1.51分钟(lc方法e)。
[3945]
步骤8:(4s)-4-[4,4-二甲基-2-[[(6-氨磺酰基-2-吡啶基)氨基]甲基]戊基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯
[3946][3947]
在惰性气氛下,向(4s)-4-[2-(氨基甲基)-4,4-二甲基-戊基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(349mg,1.0079mmol)于mecn(4.25ml)中的溶液中添加dipea(556.50mg,0.75ml,4.3058mmol)和6-氟吡啶-2-磺酰胺(1.9g,10.785mmol)。将小瓶密封,并将混合物在120℃下加热18小时。将所得混合物通过反相色谱法,用5%至100%甲醇/水洗脱进行直接纯化,得到呈白色固体状的(4s)-4-[4,4-二甲基-2-[[(6-氨磺酰基-2-吡啶基)氨基]甲基]戊基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(295mg,61%)。esi-ms m/z计算值482.29266,实验值427.2(m
–
tbu 2h=m
–
55)
;保留时间:4.8分钟(lc方法f)。
[3948]
步骤9:(4s)-4-[2-[[[6-[[2-氯-6-[3-(2-二螺[2.0.24.13]庚-7-基乙氧基)吡唑-1-基]吡啶-3-羰基]氨磺酰基]-2-吡啶基]氨基]甲基]-4,4-二甲基-戊基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯
[3949][3950]
向圆底烧瓶中装入2-氯-6-[3-(2-二螺[2.0.24.13]庚-7-基乙氧基)吡唑-1-基]
吡啶-3-甲酸(130mg,0.3035mmol)和thf(1.8ml)。添加羰基二咪唑(49mg,0.3022mmol),并且将混合物在室温下在氮气下搅拌2小时。在单独的烧瓶中,制备(4s)-4-[4,4-二甲基-2-[[(6-氨磺酰基-2-吡啶基)氨基]甲基]戊基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(90mg,0.1865mmol)于thf(1.2ml)中的溶液,并且将其经由注射器添加到活化的酸溶液中。添加1,8-二氮杂双环[5.4.0]十一碳-7-烯(1.7306g,1.7ml,11.368mmol),并将反应混合物在氮气下在室温下搅拌3小时。真空浓缩后,将粗物质通过反相色谱法,用5%至100%甲醇/水梯度洗脱进行纯化,得到呈白色固体状的(4s)-4-[2-[[[6-[[2-氯-6-[3-(2-二螺[2.0.24.13]庚-7-基乙氧基)吡唑-1-基]吡啶-3-羰基]氨磺酰基]-2-吡啶基]氨基]甲基]-4,4-二甲基-戊基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(142mg,88%)。1h nmr(400mhz,cdcl3)δ12.68-11.96(m,1h),8.36-8.27(m,1h),7.99-7.91(m,1h),7.72-7.52(m,3h),6.54-6.50(m,1h),5.95-5.91(m,1h),4.97-4.87(m,1h),4.38-4.21(m,3h),4.09-3.95(m,1h),3.73-3.67(m,1h),3.10-2.89(m,1h),2.83-2.76(m,1h),2.50-2.41(m,1h),2.25-2.17(m,1h),1.92-1.77(m,3h),1.69-1.61(m,1h),1.54-1.41(m,4h),1.36-1.22(m,14h),1.17-0.97(m,2h),0.84-0.82(m,9h),0.77-0.75(m,2h),0.67-0.64(m,2h),0.52-0.49(m,2h)。[注意:产物(c
42h58
cln7o6s)中总计58个质子中缺少1h。]
[3951]
步骤10:2-氯
‑‑
n-[[6-[[2-[[(3s)-5,5-二甲基吡咯烷-3-基]甲基]-4,4-二甲基-戊基]氨基]-2-吡啶基]磺酰基]-6-[3-(2-二螺[2.0.24.13]庚-7-基乙氧基)吡唑-1-基]吡啶-3-甲酰胺
[3952][3953]
向(4s)-4-[2-[[[6-[[2-氯-6-[3-(2-二螺[2.0.24.13]庚-7-基乙氧基)吡唑-1-基]吡啶-3-羰基]氨磺酰基]-2-吡啶基]氨基]甲基]-4,4-二甲基-戊基]-2,2-二甲基-吡咯烷-1-甲酸叔丁酯(142mg,0.1648mmol)于二氯甲烷(1.6ml)中的溶液中添加含4m hcl溶液的二噁烷(0.5ml,2.0mmol),并将混合物搅拌2小时。将混合物减压浓缩,得到呈白色固体状的2-氯-n-[[6-[[2-[[(3s)-5,5-二甲基吡咯烷-3-基]甲基]-4,4-二甲基-戊基]氨基]-2-吡啶基]磺酰基]-6-[3-(2-二螺[2.0.24.13]庚-7-基乙氧基)吡唑-1-基]吡啶-3-甲酰胺(盐酸盐)(135mg,103%)。1h nmr(400mhz,dmso-d6)δ12.71(br.s,1h),8.87-8.79(m,2h),8.42-8.39(m,1h),8.12-8.09(m,1h),7.75-7.69(m,1h),7.62(t,j=7.8hz,1h),7.22(br.s,1h),7.17(d,j=7.3hz,1h),6.81-6.77(m,1h),6.19-6.17(m,1h),4.27-4.22(m,4h),3.52-3.47(m,1h),3.36-3.22(m,2h),3.14-3.02(m,1h),2.86-2.72(m,1h),2.11-1.91(m,1h),1.82(q,j=6.3hz,2h),1.62-1.45(m,3h),1.38-1.23(m,8h),1.11-1.05(m,2h),0.85-0.79(m,11h),0.65-0.63(m,2h),0.51-0.48(m,2h)。esi-ms m/z计算值723.3334,实验值724.4(m 1)
;保留时间:1.86分钟(异构体1)(lc方法e)。esi-ms m/z计算值723.3334,实验值724.4(m 1)
;保留时间:1.91分钟(异构体2)(lc方法e)。
[3954]
步骤11:(14s)-16-(2,2-二甲基丙基)-8-[3-(2-{二螺[2.0.24.13]庚-7-基}乙氧基)-1h-吡唑-1-基]-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,
14.05,10]二十四碳-1(22),5(10),6,8,19(23),20-六烯-2,2,4-三酮(化合物434)
[3955][3956]
向2-氯-n-[[6-[[2-[[(3s)-5,5-二甲基吡咯烷-3-基]甲基]-4,4-二甲基-戊基]氨基]-2-吡啶基]磺酰基]-6-[3-(2-二螺[2.0.24.13]庚-7-基乙氧基)吡唑-1-基]吡啶-3-甲酰胺(盐酸盐)(132.4mg,0.1692mmol)于dmso(2.3ml)中的溶液中添加碳酸钾(185mg,1.3386mmol)。将反应管密封并在120℃下加热20小时。将混合物过滤并通过反相色谱法,使用5%至100%甲醇/水梯度进行直接纯化,得到呈灰白色固体状的(14s)-16-(2,2-二甲基丙基)-8-[3-(2-{二螺[2.0.24.13]庚-7-基}乙氧基)-1h-吡唑-1-基]-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5(10),6,8,19(23),20-六烯-2,2,4-三酮(51.5mg,44%)。1h nmr(400mhz,dmso-d6)δ8.15(d,j=2.0hz,1h),7.70-7.54(m,1h),7.43-7.31(m,1h),6.93-6.81(m,1h),6.74(d,j=7.8hz,1h),6.65-6.52(m,1h),6.45-6.31(m,1h),6.02-5.90(m,1h),4.19(t,j=6.2hz,2h),3.96-3.81(m,1h),3.57-3.46(m,1h),3.07-2.93(m,1h),2.78-2.65(m,1h),2.35-2.05(m,2h),1.92-1.71(m,4h),1.62-1.42(m,8h),1.38-1.12(m,4h),0.96-0.79(m,12h),0.70-0.57(m,2h),0.55-0.42(m,2h)[注意:产物(c
37h49
n7o4s)中总计49个质子中缺少1h。]主要异构体:esi-ms m/z计算值687.3567,实验值688.3(m 1)
;保留时间:4.53分钟(低离子化)(lc方法f)。次要异构体:esi-ms m/z计算值687.3567,实验值688.3(m 1)
;保留时间:4.48分钟(低离子化)(lc方法f)。
[3957]
步骤12:(14s)-16-(2,2-二甲基丙基)-8-[3-(2-{二螺[2.0.24.13]庚-7-基}乙氧基)-1h-吡唑-1-基]-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5(10),6,8,19(23),20-六烯-2,2,4-三酮(化合物435)和(14s)-16-(2,2-二甲基丙基)-8-[3-(2-{二螺[2.0.24.13]庚-7-基}乙氧基)-1h-吡唑-1-基]-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5(10),6,8,19(23),20-六烯-2,2,4-三酮(化合物436)
[3958][3959]
在35℃下,使用chiralpak ig柱(250x10mm;5μm)对(14s)-16-(2,2-二甲基丙基)-8-[3-(2-{二螺[2.0.24.13]庚-7-基}乙氧基)-1h-吡唑-1-基]-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5(10),6,8,19(23),20-六烯-2,2,4-三酮(42.1mg,0.06120mmol)(40:60非对映异构体混合物)进行手性sfc。流动相为26%meoh(含20mm nh3),74%co2,流速为10ml/min。样品浓度为24mg/ml于甲醇中(无改性剂),进样体积为70μl,出口压力为161巴,检测波长为210nm。蒸发溶剂,得到两种异构体。洗脱的第一异构体被指定为峰1,并且洗脱的第二异构体被指定为峰2。
jonge hr,bronsveld i,janssens hm,de winter-de groot km,brandsma am,de jong nwm,bijvelds mjc,scholte bj,nieuwenhuis ees,van den brink s,clevers h,van der ent ck,middendorp s和m beekman jm.a functional cftr assay using primary cystic fibrosis intestinal organoids.nat med.2013jul;19(7):939-45.)。
[3973]
肠样细胞收集和接种
[3974]
将细胞回收于细胞回收溶液中,通过在4℃下以650rpm离心5分钟收集,再悬浮于tryple中并且在37℃下温育5分钟。然后通过在4℃下以650rpm离心5分钟来收集细胞,并且将其再悬浮于含有10μm rock抑制剂(ri)的iemm中。使细胞悬浮液穿过40μm细胞过滤器,并且以1x106个细胞/ml再悬浮于含有10μm ri的iemm中。将细胞以5000个细胞/孔接种于多孔板中,并在测定之前在37℃、95%湿度和5%co2下温育过夜。
[3975]
校正剂测定a-膜电位染料测定
[3976]
在37℃、95%湿度和5%co2下,将肠样细胞与测试化合物一起在iemm中温育18-24小时。在化合物温育之后,采用膜电位染料测定,使用flipr tetra直接测量在急剧添加10μm毛喉素和300nm n-[2,4-双(1,1-二甲基乙基)-5-羟苯基]-1,4-二氢-4-氧代喹啉-3-甲酰胺之后该测试化合物对cftr介导的氯离子转运的效力和功效。简言之,将细胞在浸浴1缓冲液中洗涤5次。添加浸浴1染料溶液,并且将细胞在室温下温育25分钟。在染料温育之后,将细胞在无氯染料溶液中洗涤3次。通过添加无氯染料刺激溶液起始氯离子转运,并读取荧光信号15分钟。根据针对急剧毛喉素和300nm n-[2,4-双(1,1-二甲基乙基)-5-羟苯基]-1,4-二氢-4-氧代喹啉-3-甲酰胺刺激的荧光反应的auc测定在每种条件下cftr介导的氯离子转运。然后将氯离子转运表示为用1μm(14s)-8-[3-(2-{二螺[2.0.2.1]庚-7-基}乙氧基)-1h-吡唑-1-基]-12,12-二甲基-2λ
6-硫杂-3,9,11,18,23-五氮杂四环[17.3.1.111,14.05,10]二十四碳-1(22),5,7,9,19(23),20-六烯-2,2,4-三酮、3μm(r)-1-(2,2-二氟苯并[d][1,3]二氧环戊烯-5-基)-n-(1-(2,3-二羟丙基)-6-氟-2-(1-羟基-2-甲基丙-2-基)-1h-吲哚-5-基)环丙烷甲酰胺和300nm急剧n-[2,4-双(1,1-二甲基乙基)-5-羟苯基]-1,4-二氢-4-氧代喹啉-3-甲酰胺三重组合控制处理之后氯离子转运的百分比(活性%)。
[3977]
校正剂测定b-膜电位染料测定
[3978]
在37℃、95%湿度和5%co2下,将肠样细胞与测试化合物一起在iemm中温育18-24小时。在化合物温育之后,采用膜电位染料测定,使用flipr tetra直接测量在急剧添加10μm毛喉素和300nm n-[2,4-双(1,1-二甲基乙基)-5-羟苯基]-1,4-二氢-4-氧代喹啉-3-甲酰胺之后该测试化合物对cftr介导的氯离子转运的效力和功效。简言之,将细胞在浸浴1缓冲液中洗涤5次。添加浸浴1染料溶液,并且将细胞在室温下温育25分钟。在染料温育之后,将细胞在无氯染料溶液中洗涤3次。通过添加无氯染料刺激溶液起始氯离子转运,并读取荧光信号15分钟。根据针对急剧毛喉素和300nm n-[2,4-双(1,1-二甲基乙基)-5-羟苯基]-1,4-二氢-4-氧代喹啉-3-甲酰胺刺激的荧光反应的auc测定在每种条件下cftr介导的氯离子转运。然后将氯离子转运表示为用3m化合物a、3m(r)-1-(2,2-二氟苯并[d][1,3]二氧环戊烯-5-基)-n-(1-(2,3-二羟丙基)-6-氟-2-(1-羟基-2-甲基丙-2-基)-1h-吲哚-5-基)环丙烷甲酰胺和300nm急剧n-[2,4-双(1,1-二甲基乙基)-5-羟苯基]-1,4-二氢-4-氧代喹啉-3-甲酰胺三重组合控制处理后氯离子转运的百分比(活性%)。化合物a是:
[3979][3980]
下表表示使用本文所公开的一或多种测定产生的本发明的代表性化合物的cftr调节活性(ec
50
: 《1μm; 是1-3μm; 是》3μm;并且nd叔“在该测定中未检测”。活性%: 》60%; 是30-60%; 《30%。)。
[3981]
表3a:化合物1-298的生物活性
[3982]
[3983]
[3984]
[3985]
[3986]
[3987]
[3988]
[3989]
[3990]
[3991]
[3992]
[3993]
[3994]
[3995]
[3996]
[3997]
[3998]
[3999]
[4000]
[4001]
[4002]
[4003]
[4004]
[4005]
[4006]
[4007]
[4008]
[4009]
[4010]
[4011]
[4012]
[4013]
[4014]
[4015]
[4016]
[4017]
[4018]
[4019]
[4020]
[4021]
[4022]
[4023]
[4024]
[4025]
[4026]
[4027]
[4028]
[4029]
[4030]
[4031]
[4032]
[4033]
[4034]
[4035]
[4036]
[4037]
[4038]
[4039]
[4040]
[4041]
[4042][4043]
表3b:化合物299-397的生物活性
[4044]
[4045]
[4046]
[4047]
[4048]
[4049]
[4050]
[4051]
[4052]
[4053]
[4054]
[4055]
[4056]
[4057]
[4058]
[4059]
[4060]
[4061][4062]
实施例167:化合物398至436
[4063]
表4中描绘的化合物398至436均证实具有cftr校正活性。
[4064]
表4:化合物398-436
[4065]
[4066]
[4067]
[4068]
[4069]
[4070]
[4071]
[4072]
[4073][4074]
其他实施方案
[4075]
前述论述仅公开并描述了本公开的示例性实施方案。所属领域的技术人员将从此类论述以及从附图和权利要求书中容易地认识到,在不脱离如以下权利要求书中限定的本公开的精神和范围的情况下,可在其中进行各种改变、修改和变化。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。