1.本发明涉及将微流控芯片技术应用到肺部生理/病理研究的技术领域,具体 涉及一种基于微流控芯片技术的新冠肺炎模型构建方法。
背景技术:
2.现阶段,针对新型冠状病毒(sars-cov-2)感染的防治,科学家已取得诸多 重要进展。多个新冠病毒疫苗正处于第三阶段临床试验,然而对于新冠肺炎重 症患者的治疗仍缺少特效药。瑞德西韦、法匹拉韦、克力芝、羟氯喹等,陆续 有多种药物曾被寄予厚望,但最终证明有效的药物极少。目前,在新型冠状病 毒(sars-cov-2)感染的实际治疗中仍然以支持治疗为主。随着确诊病例的爆发 式快速增长,寻找新的有效治疗手段成为当前阶段的重要任务。
3.目前,传统的药物研发主要采用动物模型和体外二维细胞模型。动物实验 周期长,耗费高,在当前新冠疫情爆发急需特效药的大背景下,其广泛应用存 在诸多限制。目前报道的多数抗新型冠状病毒药物评价研究多采用二维细胞孔 板实验。体外细胞模型主要采用静态二维平面细胞培养方式为主,这种方式与 体内细胞所处细胞环境完全不同,也难以反映体内动态细胞生物力学环境,在 药物临床应用的可靠性和有效性方面尚存在诸多疑问,药物测试结果预测人体 反应的准确性并不高。例如:在之前的体外细胞试验中,人们发现氯喹与羟氯 喹可以抑制新冠病毒对非洲绿猴肾细胞(vero细胞)的感染。然而,在临床试 验中,目前还没有确定性的证据能证明这两款抗疟疾药物对新冠肺炎的疗效。 整体而言,现有药物评价研究在方法学与技术手段等方面存在一定的缺陷,在 很大程度上制约了新冠药物研发的进程。开发新型药物评价技术,克服简单细 胞模型的诸多局限,加快新冠药物开发进程成为当务之急。
4.为加快疫苗和抗病毒药物的研制进程,一种被称为“改变未来的颠覆性技 术”的新方法——器官芯片(organ-on-a-chip),开始应用于新冠病毒感染机制 研究,并用以缩短药物的临床试验周期。器官芯片是一种新兴的前沿科学技术, 也是一种多学科交叉汇聚技术。具体来说,器官芯片是一种将仿生生物学和微 加工技术相结合,利用微流控技术控制流体流动,结合细胞与细胞相互作用、 基质特性以及生物化学和生物力学特性,在数平方厘米大小的芯片上构建的人 体器官生理微系统。芯片往往含有多个通道结构,包含活细胞、3d培养、组织 界面、生物流体和机械力等器官微环境关键要素,并可反映人体器官的主要结 构功能单元特征和复杂的器官间联系。利用器官芯片技术能够将微组织器官的 直径控制在毫米甚至微米级别,微通道流体及多孔膜结构可增强细胞间营养交 换,更有利于维持组织微环境的稳态。由此可见,器官芯片既不用完全按照完 整的器官进行重建,又具有人体原来器官组织的生理活性和结构功能特征,能 够成为预测人体对药物反应和外界各类刺激反应的良好替代品。该方面研究国 内外尚无报道。
技术实现要素:
5.本发明的目的是提供一种基于微流控芯片技术的新冠肺炎模型构建方法, 特别针对模拟构建肺气血屏障和肺组织免疫微环境的主要细胞组成,该方法可 同时研究新冠病毒感染对肺细胞功能,组织屏障,炎症因子释放等多方面影响。
6.一种基于微流控芯片的新冠肺炎模型构建方法,该新冠肺炎模型构建方法 基于微流控芯片,模拟构建肺气血屏障和肺组织免疫微环境的细胞组成,感染 新冠病毒后出现的肺组织病理生理变化情况。
7.所述细胞包括肺泡上皮细胞,肺微血管内皮细胞及循环免疫细胞。
8.所述微流控芯片包含肺侧通道和血管侧通道,肺侧通道位置在上,血管侧 通道位置在下,两层通道间由聚二甲基硅氧烷楔形多孔膜隔开。
9.肺侧通道细胞表面暴露于新冠病毒颗粒(sars-cov-2)。
10.所述微流控芯片由上层芯片和下层芯片pdms粘合封接而成,上层芯片通 道的一端设有肺泡上皮细胞入口池1和废液池2;下层芯片通道的一端设有血管 内皮细胞入口池3和废液池4。
11.本发明提供一种基于微流控芯片技术的新冠肺炎模型构建方法,包含两种 肺细胞和循环免疫细胞,由新冠病毒颗粒暴露引起肺组织一系列病理变化及组 织损伤。
12.本发明提供的一种微流控芯片,该微流控芯片由上层芯片、聚二甲基硅氧 烷楔形多孔膜、下层芯片组成。上层芯片由肺泡上皮细胞入口池、上层芯片通 道、和废液池连接而成。下层芯片由血管内皮细胞入口池、下层芯片通道、和 废液池连接而成。上层芯片通道通过聚二甲基硅氧烷楔形多孔膜5与下层芯片 通道隔开。
13.本发明还提供了一种基于微流控芯片技术的新冠肺炎模型构建方法,方法 过程如下:
14.(1)芯片预处理
15.设计制作芯片,紫外照射除菌,20~200μg/ml i型胶原修饰芯片通道 10h-48h,pbs冲洗1-3次;
16.(2)细胞的接种与培养
17.肺微血管内皮细胞悬液调整至1~5
×
106cells/ml细胞密度,接种于芯片下层 通道,芯片倒置放入培养箱,2h后正置芯片;肺泡上皮细胞调整至1~5
×
10
6 cells/ml的细胞悬液,加入上层芯片主通道,细胞贴附于聚二甲基硅氧烷楔形多 孔膜界面生长,将芯片平移放入37℃培养箱中继续培养;12h后应用微流体驱 动方法进行持续灌流;
18.(3)外周血单个核提取:取抗凝外周血,与pbs按照1:1稀释,加至淋巴细胞 分离液ficoll表面,水平离心400g
×
30分钟,取单个核细胞层,pbs清洗2次, 加入1640 10%fbs培养基培养。使用时红色细胞膜染色,按照1x106/ml加至下 层通道;
19.(4)病毒感染:芯片上层通道加入新冠病毒,1h后冲洗,之后上下层通道每 日换液。
20.本发明提供的基于微流控芯片技术的新冠肺炎模型构建方法,可采用生物 学上常用的细胞检测手段对分别排列于多孔膜两侧的细胞进行检测,包括细胞 死活标记染色、细胞免疫荧光染色、基因表达检测、蛋白质检测。可以观察细 胞在新冠病毒作用下的形态变化,基因,蛋白表达差异,以及多种细胞的共同 培养对于刺激的不同反应等。本发明利用
微流控技术,以具有良好生物相容性, 透光性的pdms为芯片材料,设计的装置可用于模拟肺组织新冠病毒感染的典 型病理生理特征,探索肺组织多种细胞类型对病毒的不同响应及在病毒感染导 致肺损伤中的不同作用。功能完备,操作简单,并且在芯片上可以独立完成各 项信号检测,如细胞蛋白表达,细胞因子分泌,细胞增殖,凋亡检测等。
21.该微流控芯片由上层芯片、聚二甲基硅氧烷楔形多孔膜、下层芯片组成。 上层芯片由肺泡上皮细胞入口池、上层芯片通道、和废液池连接而成。下层芯 片由血管内皮细胞入口池、下层芯片通道、和废液池连接而成。上层芯片通道 通过聚二甲基硅氧烷楔形多孔膜与下层芯片通道隔开。
附图说明
22.构成本发明的一部分的说明书附图用来提供对本发明的进一步理解,本 发明的示意性实施例及其说明用于解释本发明,并不构成对本发明的不当限 定。以下,结合附图来详细说明本发明的实施方案,其中:
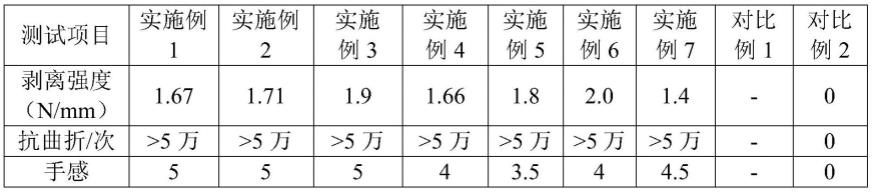
23.图1本发明微流控芯片整体结构示意图;
24.1肺泡上皮细胞入口池,2废液池,3血管内皮细胞入口池,4废液池,5聚 二甲基硅氧烷楔形多孔膜
25.图2微流控芯片分别加入血管内皮细胞和肺泡上皮细胞后,检测肺泡上皮 细胞钙粘蛋白e-cadherin表达和血管内皮细胞ve-cadherin表达,显示两种细胞 在通道内分别形成清晰的完整细胞层图示;
26.图3芯片细胞培养三天后的细胞形态及细胞层排列,肺泡上皮细胞钙粘蛋 白e-cadherin和血管内皮细胞ve-cadherin表达清晰,且位于细胞膜图示;
27.图4芯片肺气血屏障三维表征及新冠病毒感染;通过免疫荧光检测肺泡上 皮细胞钙粘蛋白e-cadherin表达和血管内皮细胞ve-cadherin表达图示。
28.其中,共聚焦显微镜扫描三维成像显示:肺泡上皮细胞和血管内皮细胞形 成完整的两层细胞层(三维图a,侧面图b)。新冠病毒感染后,病毒主要出现 于肺泡上皮细胞内,而血管内皮细胞未出现明显的新冠病毒感染阳性细胞,两 种细胞均未出现明显的细胞脱落(三维图c,侧面图d)。
29.图5加入外周血单个核细胞(pbmc)后,新冠病毒感染后图示;可引起pbmc 与内皮细胞粘附增多。
具体实施方式
30.下面的实施例将对本发明予以进一步的说明,但并不因此而限制本发明。
31.实施例1
32.自行设计并制作的微流控芯片,构型见图1。该微流控芯由上下两层pdms 粘合封接而成,包括1肺泡上皮细胞入口池,2废液池,3血管内皮细胞入口池, 4废液池,5聚二甲基硅氧烷楔形多孔膜
33.本发明提供的微流控芯片,所述微流控芯片通道高度为50-1000μm。
34.实施例2
35.一种基于微流控芯片技术的新冠肺炎模型构建方法,采用上述微流控芯片, 按照
以下步骤进行:
36.肺微血管内皮细胞悬液调整至1~5
×
106cells/ml细胞密度,接种于芯片下层通 道,芯片倒置放入培养箱,2h后正置芯片;肺泡上皮细胞调整至1~5
×
106cells/ml 的细胞悬液,加入上层芯片主通道,细胞贴附于聚二甲基硅氧烷楔形多孔膜界 面生长,将芯片平移放入37℃培养箱中继续培养;12h后应用微流体驱动方法 进行持续灌流,培养3天。采用肺泡上皮细胞钙粘蛋白e-cadherin和血管内皮细 胞ve-cadherin检测芯片肺气血屏障的完整性,其结果如图2所示,两种细胞在 通道内分别形成清晰的完整细胞层。如图3所示,细胞间连接蛋白分布于细胞 间,形成完整的细胞间连接。提取外周血单个核细胞,取抗凝外周血,与磷酸 盐缓冲液按照1:1稀释,加至淋巴细胞分离液ficoll表面,水平离心400g
×
30 分钟,取单个核细胞层,pbs清洗2次,加入1640 10%fbs培养基培养。使用 时红色细胞膜染色,按照1x106/ml加至下层通道。芯片上层通道加入新冠病毒, 1h后冲洗,之后上下层通道每日换液。新冠病毒感染2天后,采用免疫荧光检 测病毒颗粒spike蛋白,肺泡上皮细胞e-cadherin和血管内皮细胞ve-cadherin 蛋白表达。如图4所示,病毒主要出现于肺泡上皮细胞内,而血管内皮细胞未 出现明显的新冠病毒感染阳性细胞,两种细胞均未出现明显的细胞脱落。采用 绿色细胞膜染料标记血管内皮细胞,红色细胞膜染料标记外周血单个核细胞。 如图5所示,加入外周血单个核细胞(pbmc)后,新冠病毒感染可引起pbmc 与内皮细胞粘附增多。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。