1.本发明涉及医药技术领域,更具体的说是涉及一种治疗癌症的组合物及其应用和药物。
背景技术:
2.早在19世纪80年代,科学家就发现her2蛋白具有将正常成纤维细胞转化为癌细胞的能力,并定义her2为原癌基因(shih c,padhy lc,murray m, weinberg ra.transforming genes of carcinomas and neuroblastomas introducedinto mouse fibroblasts.nature 1981;290:261
–
264.)。此后大量的临床实验数据表明大约25-30%的乳腺癌和卵巢癌中存在her2的基因扩增和蛋白过表达。例如乳腺癌可以有多达25-50个her2基因拷贝数以及40-100倍的her2蛋白增量最终在肿瘤细胞表面形成200万个her2受体,远远高于正常的乳腺导管上皮细胞(venter dj,tuzi nl,kumar s,gullick wj.overexpression of thec-erbb-2oncoprotein in human breast carcinomas:immunohistological assessmentcorrelates with gene amplification.lancet 1987;2:69
–
72)。除基因扩增导致的her2蛋白表达量上调外,近年来研究发现her2酶活性组成激活型突变也在多种癌症中出现。高突变率(》10%)的癌种包括前列腺神经内分泌癌、转移性皮肤鳞状细胞癌和膀胱尿路上皮癌。此外,her2突变也出现在常见的癌症如肺癌、结直肠癌和乳腺癌中(connell cm,doherty gj.activating her2 mutations as emerging targets in multiple solid cancers.esmo open. 2017;2[5]:e000279.),而且her2的基因扩增以及组成型酶活性突变通常与肿瘤的不良预后相关。随后的大量研究表明her2的扩增以及激活型突变是肿瘤细胞生长所依赖的,敲低her2会抑制肿瘤细胞生长并引起肿瘤细胞死亡 (faltus t,yuan j,zimmer b,kramer a,loibl s,kaufmann et al..silencing ofthe her2/neu gene by sirna inhibits proliferation and induces apoptosis inher2/neuoverexpressing breast cancer cells.neoplasia 2004;6:786
–
795.)。以上这些研究表明her2是一个良好的肿瘤治疗靶点。因而围绕her2这一靶点开发出了以曲妥珠单抗为代表的单抗类her2抑制剂以及近年来开发的拉帕替尼,来那替尼,涂卡替尼等小分子抑制剂以及基于曲妥珠单抗的抗体偶联药物。这些药物的单独使用以及与经典化疗药物的联用显著改善了her2阳性癌症的治疗结局(baselga j,cortes j,kim sb,im sa,hegg r,im yh,et al. pertuzumab plus trastuzumab plus docetaxel for metastatic breast cancer.n engl jmed.2012;366[2]:109-19)。然而与其他靶向药在治疗癌症中所出现的问题一致,her2单抗以及tki类药物通常会出现耐药性,如何克服耐药性增强靶向药的杀伤性成为亟需解决的问题。
[0003]
肿瘤细胞不同于正常细胞的一个标志为癌细胞即便在氧气充足的条件下也优先使用有氧糖酵解来为肿瘤细胞提供能量。有氧糖酵解相比于氧化磷酸化产能效率低很多,这就需要肿瘤细胞转运葡萄糖的能力显著增强(hanahand et al,hallmarks of cancer:the next generation,cell,144(5):646-674(2011),这通过过表达质膜转运蛋白来实现
(ganapathy v,et al,nutrient transporters incancer:relevance to warburg hypothesis and beyond,pharmacology&therapeutics 121(1):29-40(2009)。葡萄糖共转运蛋白1(sglt1)为主动的葡萄糖转运蛋白,其依靠细胞外钠浓度将葡萄糖转运至细胞而不依赖于葡萄糖浓度(wrightem,et al,biology of human sodium glucose transporters,physiologicalreviews,91(2):733-794(2011))。研究表明sglt1在多种癌症中高表达且与癌症的不良预后相关,所述癌症包括乳腺癌、卵巢癌、口腔鳞状细胞癌、结直肠癌、胰腺癌和前列腺癌。sglt1可以结合并稳定egfr从而促进肿瘤细胞的生长,增殖,将根皮苷类sglt1抑制剂pholorizin与egfr抑制剂吉非替尼等联用可以使吉非替尼耐药细胞株再次对吉非替尼敏感(j,vrhovac i,gajski g,j,garajvrhovac v.apigenin:a dietary flavonoid withdiverse anticancer properties.cancer lett 2018;413:11-22.koepsell h.the na
ꢀ‑
d-glucose cotransporters sglt1 and sglt2 are targets for the treatment ofdiabetes and cancer.pharmacol ther 2017;170:148
–
65.yamazaki y,harada s, tokuyama s.sodium
–
glucose transporter as a novel therapeutic target in disease. eur j of pharmacol 2018;822:25
–
31)。因而sglt1抑制剂具有逆转与之相互作用的egfr抑制剂耐药性的能力。
[0004]
目前,还未见将sglt1抑制剂与小分子抑制剂以及单抗类药物组合使用用于解决本领域治疗耐受her2酪氨酸激酶抑制剂的癌症的报道。
技术实现要素:
[0005]
有鉴于此,本发明的目的在于提供一种治疗癌症的组合物,使得所述组合物中的her2抑制剂与sglt1抑制剂具有协同抗肿瘤效应;
[0006]
本发明的另外一个目的在于提供上述组合物在制备治疗癌症药物中的应用;
[0007]
本发明的另外一个目的在于提供包含上述组合物的治疗癌症的药物;
[0008]
为实现上述发明目的,本发明提供如下技术方案:
[0009]
一种治疗癌症的组合物,包括sglt1抑制剂和her2抑制剂。
[0010]
本发明发现sglt1与her2具有相互作用并促进肿瘤的发生发展,且这种相互作用对彼此的功能发挥具有重要作用,敲低her2不但会影响肿瘤细胞的增殖以及生长信号的转到同时也会影响sglt1功能,反之敲低sglt1 不但影响癌细胞在低糖条件下的生存也会影响her2信号通路以及细胞的增殖,因此本发明由此预期两者的抑制剂联合使用将会产生协同抗肿瘤的作用;经过实验验证,her2抑制剂以及sglt1抑制剂组成的组合物对肿瘤生长具有显著抑制作用,该组合物对肿瘤的抑制具有显著的协同增效作用。
[0011]
因此,本发明提供上述组合物在制备治疗癌症药物中的应用;所述癌症包括但不限于膀胱癌、血癌、骨癌、脑癌、乳腺癌、中枢神经系统癌症、宫颈癌、结肠癌、子宫内膜癌、食管癌、胆囊癌、胃肠道癌、外生殖器癌、泌尿生殖道癌、头癌、肾癌、喉癌、肝癌、肺癌、肌肉组织癌症、颈癌、口腔或鼻黏膜癌、卵巢癌、胰腺癌、前列腺癌、皮肤癌、脾癌、小肠癌、大肠癌、胃癌、睾丸癌和甲状腺癌。
[0012]
作为优选,所述组合物中0<sglt1抑制剂浓度为≤100μm,所述组合物中0<her2抑制剂浓度≤100μm。在本发明具体实施方式中,所述sglt1抑制剂浓度为5、10、20、30、40或
60μm,所述her2抑制剂浓度为0.1、 2.5、5、10、20、40、50、60、80或100μm。
[0013]
在本发明具体实施方式中,所述sglt1抑制剂选自索格列净、sy-009 (购自亚宝药业)、licogliflozin(购自诺华制药)中的一种或两种以上;所述her2抑制剂选自拉帕替尼、来那替尼、沙普替尼、波齐替尼、图卡替尼、二甲苯磺酸拉帕替尼以及靶向her2的单抗中的一种或两种以上。其中,靶向her2的单抗如曲妥珠单抗,但并不限于此,本领域技术人员认为可行的靶向her2的单抗均在本发明保护范围之内。
[0014]
根据本发明所提供的应用,本发明还提供了一种治疗癌症的药物,其包含本发明所述组合物以及药学上可接受的助剂。
[0015]
作为优选,药物剂型为口服药物的各种剂型,包括但不限于颗粒剂、丸剂、散剂、片剂、胶囊剂、口服液、糖浆剂等形式。
[0016]
由以上技术方案可知,本发明发现sglt1与her2具有相互作用并促进肿瘤的发生发展;同时,靶向her2的抑制剂与sglt1抑制剂的组合物具有协同抗肿瘤效应,可将靶向her2和sglt1的抑制剂组合物用于癌症治疗和抗癌药物的制备中。
附图说明
[0017]
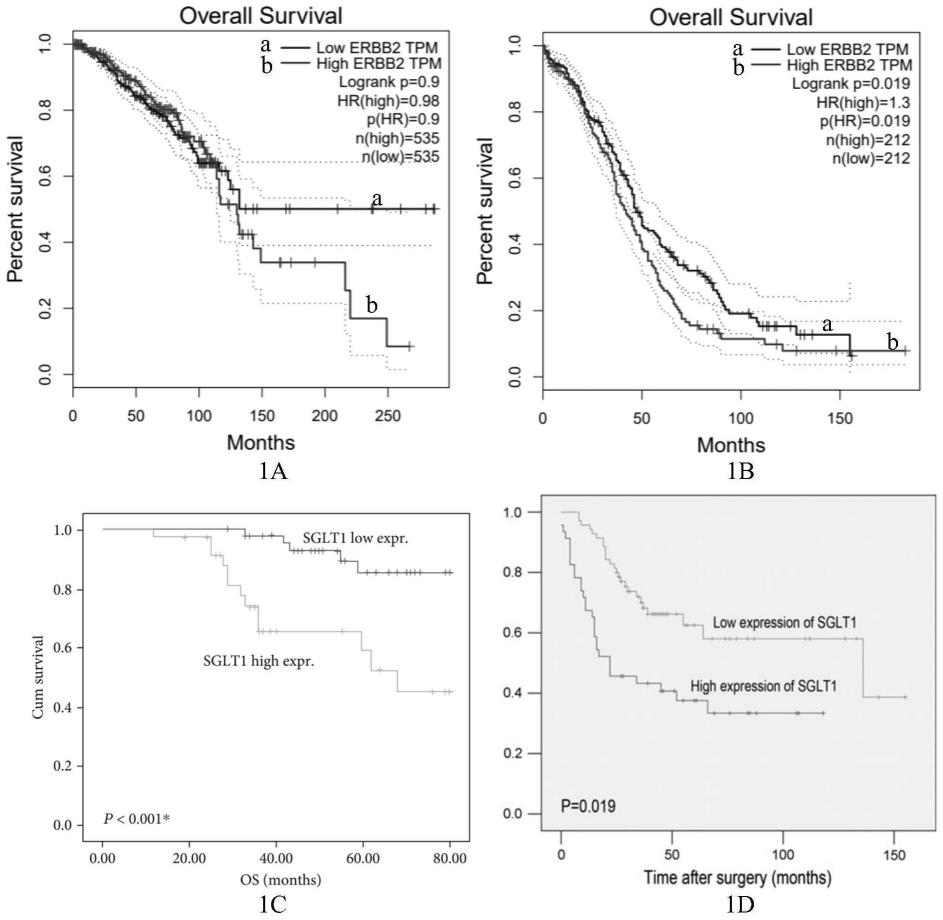
图1所示为her2(即图中erbb2)与sglt1高表达与乳腺癌、卵巢癌患者不良预后相关结果;其中,1a为her2高表达与乳腺癌患者预后的关系, 1b为her2高表达与卵巢癌患者预后关系,1c为sglt1高表达与乳腺癌患者预后的关系,1d为sglt1高表达与卵巢癌患者预后关系;
[0018]
图2所示her2(即图中erbb2)与sglt1(即图中slc5a1)、sglt2 (即图中slc5a2)在乳腺癌和卵巢癌中具有正相关性得结果;其中,2a为 her2与sglt1在乳腺癌中的表达具有正相关性,2b为her2与sglt1在卵巢癌中的表达具有正相关性;2c为her2与sglt2在乳腺癌中的表达具有正相关性,2d为her2与sglt2在卵巢癌中的表达具有正相关性;
[0019]
图3所示卵巢癌细胞系中敲除/过表达sglt1后对her2蛋白的水平影响;敲除sglt1后对her2蛋白的水平随之下降,过表达sglt1后her2 蛋白的水平随之增加;3a为敲除sglt1和sglt2后检测her2蛋白的水平, 3b为sglt1敲除效果检测,3c为过表达sglt1增加her2蛋白水平;其中, c是正常对照组,s1是敲低sglt1,s2是敲低sglt2,h1和h2是敲低 her2,mg132为阳性对照;
[0020]
图4所示为sglt1对her2蛋白稳定性的影响结果;4a为敲低sglt1 损伤her2蛋白的稳定性,4b为过表达sglt1后her2的蛋白稳定性增加;其中,此试验以蛋白合成抑制剂放线菌酮处理不同时长(0、2、4、8h)的细胞的her2蛋白水平变化来显示her2蛋白的稳定性;
[0021]
图5所示为敲低her2对细胞摄取葡萄糖的影响结果;其中,c表示正常对照组,h1表示敲低her2组;
[0022]
图6所示her2和sglt1抑制剂单用以及联用对her2信号通路的影响;其中,c为正常对照,t为her2抑制剂图卡替尼缩写,s为sglt1抑制剂索格列净的缩写,ts是两种抑制剂联用;
[0023]
图7所示her2与sglt1的免疫印迹试验结果;
[0024]
图8-14所示her2抑制剂图卡替尼以及sglt1抑制剂索格列净对多种癌细胞系的影响;图8示her2抑制剂以及sglt1抑制剂处理胃癌细胞系 hgc27;图9示her2抑制剂以及
sglt1抑制剂处理宫颈癌细胞系hela;图10示her2抑制剂以及sglt1抑制剂处理乳腺癌细胞系mcf-7;图11 示her2抑制剂以及sglt1抑制剂处理肝癌细胞系qgy-7703;图12示 her2抑制剂以及sglt1抑制剂处理前列腺癌细胞系du145;图13示 her2抑制剂以及sglt1抑制剂处理结食管癌细胞系kyse30;图14示 her2抑制剂以及sglt1抑制剂处理胆管癌细胞系rbe;其中,s表示索格列净,各图中等号后面所列数值为索格列净的浓度μm;
[0025]
图15-16所示为her2抑制剂图卡替尼以及多种sglt1抑制剂对肿瘤结直肠癌细胞系sw620的影响;其中,s表示索格列净、target3表示licogliflozin (诺华制药)、target5表示sy-009(亚宝药业),各图等号后的数值为对应 sglt1抑制剂的浓度μm;
[0026]
图17所示为多种her2抑制剂以及sglt1抑制剂索格列净处理高表达 her2的卵巢癌细胞系skov3的结果;10-1至10-5别示拉帕替尼(10-1)、来那替尼(10-2)、沙普替尼(10-3)、波齐替尼(10-4)、二甲苯磺酸拉帕替尼(10-5)与sglt1抑制剂索格列净联用的肿瘤抑制效果;其中,s表示索格列净,各图中等号后面所列数值为索格列净的浓度μm,浓度为0的柱型表示her2抑制剂以及sglt1抑制剂索格列净的浓度皆为0。
具体实施方式
[0027]
本发明公开了一种治疗癌症的组合物及其应用和药物,本领域技术人员可以借鉴本文内容,适当改进工艺参数实现。特别需要指出的是,所有类似的替换和改动对本领域技术人员来说是显而易见的,它们都被视为包括在本发明。本发明所述组合物及其应用和药物已经通过较佳实施例进行了描述,相关人员明显能在不脱离本发明内容、精神和范围内对本文所述组合物及其应用和药物进行改动或适当变更与组合,来实现和应用本发明技术。
[0028]
本发明经tcga数据分析恶性肿瘤的不良预后与表皮生长因子受体 2(her2)以及钠/葡萄糖共转运蛋白1(sglt1)的过表达相关。所述癌症包括乳腺癌、卵巢癌等多种癌症。
[0029]
本发明发现sglt1与her2具有相互作用,且这种相互作用对彼此的功能发挥具有重要作用,敲低her2不但会影响肿瘤细胞的增殖以及生长信号的转到同时也会影响sglt1功能,反之敲低sglt1不但影响癌细胞在低糖条件下的生存也会影响her2信号通路以及细胞的增殖。因此,her2抑制剂以及sglt1抑制剂组成的组合物对肿瘤生长具有显著抑制作用,该组合物对肿瘤的抑制具有显著的协同增效作用。
[0030]
在本发明具体实施方式中,进行了如下方面的试验验证:
[0031]
(1)在卵巢和乳腺癌中her2、sglt1、sglt2的高表达对癌症患者的不良预后的影响;
[0032]
(2)sglt1对her2信号通路的作用;
[0033]
(3)her2对sglt1功能正常发挥的作用;
[0034]
(4)her2与sglt1之间的相互作用;
[0035]
(5)her2与sglt1抑制剂单药以及组合物对肿瘤细胞的作用;
[0036]
上述试验中所涉及的实验操作和方法可参照如下:
[0037]
1、细胞和试剂
[0038]
本发明所用肝癌细胞系qgy7703;结直肠癌细胞系sw620、hct116、 sw480、lovo、ht29、dld1;宫颈癌hela;卵巢癌skov3;胃癌ngc27;胆管癌rbe;食管癌kyse30以及hek293t
细胞系均从美国典型培养物保藏中心(atcc)并在含有5%co2的37℃孵箱中培养,所述细胞系的维持培养基为补充有10%胎牛血清(gibico)和1%青霉素/链霉素(gibico)的dmem 或者rpmi 1640(gibico)中。小鼠抗flag标签抗体(f3165),flag抗体欧联m2 微珠购自sigma-aldrich(st.louis,mo),兔gapdh内参抗体以及辣根过氧化物酶标记的抗兔和小鼠二抗购自博奥龙公司。sotagliflozin、阿帕替尼和乐伐替尼均获自selleckchem(houston,tx)。抗perk的抗体(4370)获自cellsignaling(danvers,ma)。mtt试剂盒(目录号30-1010k)获自atcc。
[0039]
2、质粒构建
[0040]
将人野生型her2克隆至pcmv-tag2b载体,人野生型sglt1序列克隆至pegfp-n1载体中。将靶向如下sglt1-1 shrna序列:5
’‑ꢀ
aggagagcctatgacctattt-3’;sglt1-2 shrna序列:5
’‑
gcctgatg ctatcagtcatgc-3’;sglt2-1 shrna序列:5
’‑
gcatatttcctgc tggtcatt-3’;sglt2-2 shrna序列:5
’ꢀ‑
ggtcatcacgatgccacagta-3’;her2-1 shrna序列:5
’ꢀ‑
gatgaaagttaccagtctatt-3’;her2-2 shrna序列:5
’ꢀ‑
gctgacatgtacggtctatgc-3’序列的shrna构建到 plvx-shrna2-puro载体用于后续包被慢病毒构建sglt1、sglt2、her2敲低的细胞系。所有载体通过测序验证为正确质粒。
[0041]
3、瞬时转染和免疫共沉淀
[0042]
用表达flag标记的sglt1的质粒单独转染或与指定的gfp标记的 her2载体在无血清dmem培养基中混合并加入转染试剂pei后一起转染 hek293t细胞。在转染6小时之后更换为10%血清的培养基,更换培养基之后24小时,弃去培养基,用10毫升1
×
磷酸盐缓冲液中洗涤(pbs)将细胞吹起并1500转离心,弃去上清所得细胞团沉淀加入补充有蛋白酶抑制剂混合物的ripa缓冲液(50mm tris-hcl,ph 8.0,具有150mm氯化钠,1.0%igepalca-630(np-40),0.5%脱氧胆酸钠和0.1%十二烷基硫酸钠)并在摇床于4℃下裂解30分钟。然后,将细胞裂解物以12000
×
rpm离心10分钟。将上清液加入偶联有flag抗体的m2微珠于4℃孵育过夜。然后,将样品离心,用ripa 缓冲液洗涤三次,在laemmle缓冲液(biorad,ca)中煮沸,用8%sds page 胶进行蛋白质印记分析。
[0043]
4、蛋白质印记分析
[0044]
对于蛋白质印记(western blot)分析,将细胞用恰当体积的ripa缓冲液 (150mm nacl,50mm tris-hcl,ph 7.4,0.1%sds,1%tritonx-100,1mm edta,1mm pmsf,1%脱氧胆酸钠,1mm naf,1mm na3vo4,于去离子水中)在4℃条件下或者冰上裂解30分钟以上。12000
×
rpm离心10分钟,上清用bca试剂盒(thermo)测定蛋白浓度后加入5
×
loading buffer在100℃煮沸10分钟。短暂离心后,将样品通过10%sds-page进行电泳分离后转移至pvdf膜,随后用5%脱脂奶粉封闭一小时以上,然后在4℃下与一抗在最佳浓度过夜孵育。将膜用0.1%pbst(1
×
tbs,0.1%吐温-20)洗涤3次,每次10分钟,然后与二抗在室温孵育1小时。通过增强化学发光使信号可视化。
[0045]
5、细胞生长测定
[0046]
根据生产厂家提供的方案,检测原理为活细胞线粒体中的琥珀酸脱氢酶能使外源性mtt还原为水不溶性的蓝紫色结晶甲臜(formazan)并沉积在细胞中,而死细胞无此功能。二甲基亚砜(dmso)能溶解细胞中的甲臜,用酶联免疫检测仪在570nm波长处测定其光吸收值,可间接反映活细胞数量。在96 孔板中通过3-(4,5-二甲基噻唑-2-基)-2,5-二苯基溴化
四氮唑(mtt)测定来确定细胞生长。具体而言,细胞消化计数,将细胞重悬浮成每200μl培养基含5000 个细胞的体系,接种在在96孔板的每个孔中。第二天,将培养基用含有不同浓度的索格列净,her2抑制剂以及它们之间的组合物的培养基更换。在与药物孵育48或72小时之后,将20μl mtt试剂加入至每个孔中并孵育2小时。在弃去培养基之后,将细胞中的甲臜沉淀物溶解在100μl dmso中。通过酶标仪在570nm下测量吸光度。在每组中使用一式四份样品。
[0047]
7、统计分析
[0048]
将学生t检验用于评估索格列净,阿帕替尼,乐伐替尼等sglt1和her2 抑制剂不同浓度,不同组合条件处理下的细胞的生长差异以及裸鼠移植瘤生长差异。p值小于0.05被定义为具有统计显著性。
[0049]
本发明提供的治疗癌症的组合物及其应用和药物中所用试剂或仪器均可由市场购得;所进行对比实验除去应有的区别外,如无特殊说明其他实验条件保持一致,以便具有可对比性。
[0050]
下面结合实施例,进一步阐述本发明。
[0051]
实施例1:her2和sglt1高表达正相关且与癌症患者不良预后相关
[0052]
图1中,1a和1b通过对tcga数据库分析卵巢癌、乳腺癌患者癌组织中的 her2表达高低与患者总生存期的关联性得出her2高表达的患者总生存期更短;1c,1d通过对tcga数据库分析卵巢癌、乳腺癌癌患者癌组织中的sglt1 表达高低与患者总生存期的关联性得出sglt1高表达的患者总生存期更短;证明her2以及sglt1的高表达与这两种癌症患者的不良预后相关,说明二者在肿瘤细胞自身的表达中与预后的关系。
[0053]
本实施例通过挖掘tcga数据库将her2以及sglt1、sglt2的表达量与卵巢癌和结直肠癌患者的总生存期进行生存分析发现,her2以及sglt1的高表达与卵巢癌、乳腺癌患者的不良预后正相关。
[0054]
本实施例仅以举例方式证明her2以及sglt1的高表达与这两种癌症患者的不良预后相关,说明二者在肿瘤细胞自身的表达中与预后的关系。这并不能限制为本发明实施方案的组合物仅限于卵巢癌和结直肠癌。在本发明其他实施方案中组合物即对宫颈癌,前列腺癌,肝癌,结直肠癌,胃癌,食管癌,胆管癌细胞系等多种癌症具有显著抑制作用,如图8,图9所示。
[0055]
此外,本发明还通过皮尔森检验对从tcga数据库中获得的her2和 sglt1、sglt2在卵巢癌和乳腺癌患者中的表达量数据进行关联性分析发现 her2与sglt1的表达之间存在正相关性,而与sglt2之间的表达量无相关性,如图2a、2b、2c、2d所示。这说明her2与sglt1两者功能具有一定关联性。
[0056]
实施例2:her2与sglt1对彼此功能相互影响
[0057]
利用shrna技术从卵巢癌细胞系skov3中敲低sglt1、sglt2以及 her2后和利用外源载体过表达sglt1后,图3western检测结果显示, 3a,3c说明敲低sglt1,her2的蛋白水平随之降低,过表达sglt1,her2 的蛋白水平随之升高;但是,敲低sglt2,her2的蛋白水平并未产生变化。说明sglt1影响her2蛋白的功能,但是sglt2不影响her2蛋白的功能;
[0058]
此外,利用蛋白翻译抑制剂放线菌酮抑制蛋白翻译观察蛋白半衰期的办法,评价敲低或者过表达sglt1是否会相应缩短或延长her2半衰期。利用 shrna技术从卵巢癌细胞
系skov3中敲低sglt1以及利用外源载体过表达sglt1后,在细胞培养液中加入蛋白翻译抑制剂放线菌酮处理后观察 her2蛋白水平随着时间变化,结果如图4中4a和4b所示,敲低sglt1后her2的半衰期显著缩短,而过表达sglt1后her2半衰期显著延长。说明 sglt1对her2蛋白的稳定性至关重要,通过靶向sglt1可以实现her2的降解
[0059]
以上结果说明sglt1影响her2的蛋白质稳定性。为进一步确定her2 对sglt1的影响,利用shrna技术从卵巢癌细胞系skov3中敲低her2后利用fitc荧光偶联的葡萄糖类似物2-bndg处理细胞30分钟后,流式细胞仪检测fitc阳性细胞所占比例,经统计总结后结果如图5所示,敲除her2 后细胞对2-nbdg的摄取能力显著减弱,也即敲除her2影响了细胞对葡萄糖的摄取。这些结果表明her2反过来也会对sglt1的功能有一定影响,二者的功能是相互影响的。
[0060]
值得提出的是,本发明仅以卵巢癌skov3细胞为例敲低各基因评价它们之间的相互影响,本发明所得结论不应受限于此癌种和细胞系。
[0061]
实施例3:sglt1对her2信号通路的作用
[0062]
利用her2和sglt1抑制剂单独或者联合处理skov3细胞,检测 her2以及her2下游分子p-erk1/2。图6结果显示her2以及sglt1抑制剂联用可更好的抑制her2信号通路激活,说明联合用药的效果优于任一靶点抑制剂的单独使用。
[0063]
实施例4:her2与sglt1存在分子间的相互作用
[0064]
本实施例通过免疫共沉淀实验进一步确定her2与sglt1存在分子间的相互作用。利用免疫共沉淀的方法将flag标签的sglt1与ha标签的her2载体共转染293t细胞,24小时后裂解细胞,加入flag珠子结合5小时,利用ha抗体和flag抗体进行western检测,具体方法如下:
[0065]
用表达flag标记的sglt1的质粒单独转染或与指定的ha标记的 her2载体在无血清dmem培养基中混合并加入转染试剂pei后一起转染 hek293t细胞。在转染6小时之后更换为10%血清的培养基,更换培养基之后24小时,弃去培养基,用10毫升1
×
磷酸盐缓冲液中洗涤(pbs)将细胞吹起并1500转离心,弃去上清所得细胞团沉淀加入补充有蛋白酶抑制剂混合物的ripa缓冲液(50mm tris-hcl,ph 8.0,具有150mm氯化钠,1.0%igepal ca-630(np-40),0.5%脱氧胆酸钠和0.1%十二烷基硫酸钠)并在摇床于4℃下裂解30分钟。然后,将细胞裂解物以12000
×
rpm离心10分钟。将上清液加入偶联有flag抗体的m2微珠于4℃孵育过夜。然后,将样品离心,用ripa 缓冲液洗涤三次,在laemmle缓冲液(biorad,ca)中煮沸,用8%sds page 胶进行蛋白质印记分析。ip=免疫沉淀,以及input=在用于免疫沉淀的 hek293全细胞裂解物中指定的外源蛋白的表达水平。结果如图7所示,her2 与sglt1存在蛋白之间相互作用。
[0066]
实施例5:通过sglt1抑制剂抑制sglt1使癌细胞对her2抑制剂敏感
[0067]
图8-14仅以举例的方式说明了在肝癌细胞系qgy-7703,前列腺癌细胞系 du145以及其他5种常见癌症细胞系中评价her2抑制剂图卡替尼以及sglt1 抑制剂索格列净单药以及二者不同剂量组合物联合用药her2抑制剂图卡替尼的ic50值。结果说明,通过加入sglt1抑制剂索格列净与her2抑制剂图卡替尼联用,可以明显降低图卡替尼的ic50值,增加其对癌细胞的敏感性,说明两者联用存在协同作用;
[0068]
同时,使用her2抑制剂图卡替尼以及不同的sglt1抑制剂处理结直肠癌细胞系
sw620,利用mtt法分别测量her2抑制剂以及sglt1抑制剂单药以及二者不同剂量组合物联合用药her2抑制剂图卡替尼的ic50值。图15-16结果显示,除索格列净外的其他sglt1抑制剂组合物对结直肠癌细胞系同样具有协同作用且效果索格列净优于sy-009(亚宝药业)优于licogliflozin(诺华制药) 优于根皮苷(作为对照)。
[0069]
此外,利用多种her2抑制剂以及sglt1抑制剂处理高表达her2的卵巢癌细胞系skov3,检测多种her2抑制剂以及优选的sglt1抑制剂索格列净二者组合物联合用药对肿瘤生长的抑制效果。图17结果证明格列净与多种her2 抑制剂联用均能很好的发挥协同作用,组合物对肿瘤生长具有显著抑制作用,且her2抑制剂并不局限于图卡替尼。
[0070]
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
