1.本发明属于抗肿瘤纳米制剂技术领域,具体涉及一种分子信标修饰的纳米载体及及在制备抗肿瘤产品中的应用。
背景技术:
2.公开该背景技术部分的信息仅仅旨在增加对本发明的总体背景的理解,而不必然被视为承认或以任何形式暗示该信息构成已经成为本领域一般技术人员所公知的现有技术。
3.在化疗中,保证化疗效果的关键在于维持癌细胞内有效的化疗药物浓度。维持细胞内药物浓度通常受到两个关键因素的限制。一个是药物递送效率,受到部分化疗药物的水溶性、稳定性、非特异性递送和渗透效率的影响,不可避免地导致癌细胞内药物浓度不足;另一个是化疗后出现的耐药性,通常是由过表达的abc转运蛋白,特别是耐药癌细胞内mdr1 mrna编码的具有药物泵出作用的p-糖蛋白(p-glycoprotein,p-gp),造成的细胞内药物积累减少导致的。由于这两个因素的影响,耐药癌细胞内的药物浓度不足以达到致死阈值,最终导致治疗效果有限。因此,迫切需要开发用于有效递送药物并克服耐药性的新型给药系统,以确保有效治疗的细胞内药物浓度。
4.纳米材料的快速发展为利用创新的药物递送系统以绕过递送障碍带来了机会。介孔硅纳米颗粒(mesoporous silica nanoparticle,msn)是一种多孔纳米材料,在生物医学应用中引起了越来越多的关注。得益于其固有的孔体积大、孔径可调、表面易修饰、细胞摄取效率高、生物相容性高等特性,msn在制备高药物负载能力和递送效率的纳米载体中表现出巨大的优势。目前,已经报道了多种基于msn的纳米载体,例如,andre e.nel课题组开发了一种脂质包覆的介孔硅纳米载体,用于递送化疗药物治疗胰腺癌。这些载体可以有效地将药物递送到癌细胞中,但在耐药癌细胞中,纳米载体释放的药物依然会暴露于p-gp,并被排出细胞,降低细胞内药物浓度。因此,如何克服递送中的耐药性仍然是一个巨大的挑战。为了解决这个问题,利用msn表面丰富的活性位点和功能核酸分子(如反义寡核苷酸、sirna或适体)的可设计性,合理地构建集成的纳米载体,在有效递送药物和克服耐药性方面具有应用潜力。与此同时,实时可视化观察细胞内事件的能力是评估纳米载体的药物释放和基因沉默能力的另一个关键因素,但几乎没有被探索过。
技术实现要素:
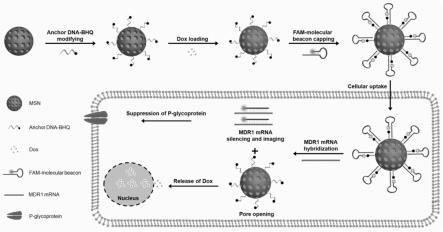
5.基于上述技术背景,本发明构建了一种多功能分子信标(molecular beacon,mb)修饰的介孔硅纳米载体,用于耐药癌细胞中的mdr1 mrna沉默、成像和药物递送。该纳米载体(dox@msn-ad-mbs)是通过在msn表面上修饰淬灭团标记的锚定dna(ad),将阿霉素(dox)包裹在内,然后用fam标记的分子信标封堵而构建的。在被耐药癌细胞摄取后,纳米载体表面的mb将与mdr1mrna杂交,同时与ad解杂交并从载体脱落。该杂交事件可以实现三重作用:一是沉默mdr1 mrna并下调p-糖蛋白(p-gp)表达水平;二是恢复fam荧光并对mdr1 mrna进
行原位成像;三是打开封堵的孔并释放dox,产生细胞毒性。qrt-pcr和western blot结果显示,与msn-ad-mbs共孵育后,hepg2/adr和mcf-7/adr细胞中mdr1 mrna和p-gp的表达均有所下降。荧光成像实验实现了mb和mdr1 mrna的细胞内杂交事件的可视化和mdr1 mrna表达水平的监测。通过细胞毒性试验考察了纳米载体的抑制耐药癌细胞的能力。与游离dox相比,dox@msn-ad-mbs对hepg2/adr细胞和mcf-7/adr细胞显示出更高的抑制效能。本发明为开发多功能纳米载体提供了新的思路,抑制癌细胞耐药性中具有应用潜力,具体提供以下技术方案:
6.本发明第一方面,提供一种分子信标修饰的纳米载体,所述纳米载体的主体为具孔载体,所述具孔载体中装载化疗药物,具孔载体表面修饰分子信标及锚定dna的杂交链;所述分子信标对具孔载体表面的通孔进行封堵,所述锚定dna通过化学键固定在具孔载体表面。
7.优选的,所述具孔载体为介孔硅纳米颗粒(msn),为表面具有通孔的空心球,所述空心球的空腔装载所述化疗药物,所述空心球体的粒径为120~150nm,所述通孔尺寸为2~3nm。
8.进一步的,上述介孔硅纳米颗粒采用溶胶-凝胶法合成,具体步骤如下:将十六烷基三甲基溴化铵(ctab)的水溶液缓慢加入碱液中升温至75~85℃,再缓慢加入正硅酸乙酯(teos)并维持75~85℃反应0.5~3h,获得白色沉淀即为介孔硅纳米载体。
9.应当明确的是,所述化疗药物为具有抗肿瘤活性的小分子化学实体,并不限于所述药物的治疗机制或种类,只要能够被装入具孔载体的空腔并通过通孔进行释放均可适用于上述纳米载体。本发明验证的一种实施方式中,所述化疗药物为阿霉素(dox)。进一步的,上述装载阿霉素的介孔硅纳米载体中,所述阿霉素通过扩散作用装载到介孔硅纳米颗粒的空腔中。
10.另外,第一方面所述分子信标及锚定dna杂交链的设计中,所述分子信标具有荧光染料修饰,所述锚定dna具有淬灭基团修饰,两条核苷酸链呈杂交状态时,上述纳米载体不显示荧光,当所述纳米载体被细胞摄取后肿瘤细胞后,分子信标与肿瘤细胞中的靶标具有高亲和性,脱离载体表面并通过荧光进行肿瘤细胞成像。
11.基于上述设计,所述分子信标的靶标可依据肿瘤细胞的类型及药物设计的目的进行调整,本发明优选的方式中,所述纳米载体应用于耐药性肿瘤的治疗,所述分子信标的靶标为耐药相关基因,具体的实例如mdr1,所述适体链与mdr1mrna具有较高的亲和性,能够沉默耐药肿瘤细胞中的mdr1 mrna,并进行成像。
12.进一步的,所述锚定dna的5’端通过化学键连接在纳米载体的表面,3’端标记淬灭基团;更进一步的,所述化学键为酰胺键,所述锚定dna的5’端具有氨基修饰,通过酰胺缩合作用与纳米载体表面的羧基连接;所述适体链的5’端部具有荧光基团标记;更进一步的,所述淬灭基团为bhq-1,所述荧光基团为fam。
13.上述优选技术方案的一种具体的实施方式中,所述分子信标的序列如下:
14.fam-aggtcggtaagcttcaagatccatcccgacctcgcgaatgattaggtcgataagctacaggaggctacatgacctcgcgaatgatt;
15.所述锚定dna的序列如下:
16.h2n-aatcattcgcg-bhq1。
17.上述方案中所述分子信标修饰的纳米载体,其制备方法如下:采用溶胶-凝胶法合成介孔硅纳米颗粒,在介孔硅纳米颗粒表面连接氨基得到氨基化的二氧化硅(msn-nh2),对msn-nh2进行羧基化得到羧基化的介孔硅纳米颗粒(msn-cooh);通过酰胺缩合反应将氨基化的锚定dna修饰在msn-cooh表面生成锚定dna修饰的msn(msn-ad);将dox溶于缓冲溶液中,加入msn-ad并在黑暗环境中搅拌反应以装载药物;继续向载药后的msn-ad的缓冲液中加入分子信标反应完成杂交即可得到所述分子标记修饰的纳米载体(dox@msn-ad-mbs)。
18.进一步的,上述制备方法中,在介孔硅颗粒表面连接氨基的方式如下:向msn的甲苯溶液中加入3-氨丙基三乙氧基硅烷(aptes),升温至110~120℃反应1~3h,获得固体部分,将所述固体部分洗涤后分散于盐酸甲醇溶液中回流14~18h后,得到所述msn-nh2。
19.进一步的,上述制备方法中,所述对msn-nh2羧基化的方式如下:将msn-nh2与丁二酸酐加入n,n-二甲基甲酰胺(dmf)中,室温反应7~9h,即可得到msn-cooh。
20.进一步的,上述制备方法中,所述msn-ad的制备方式如下:向msn-cooh的悬浮液中加入1-(3-二甲基氨基丙基)-3-乙基碳二亚胺(edc)和n-羟基硫代琥珀酰亚胺(sulfo-nhs),反应12~17min,对羧基进行活化;加入pbs和氨基化的锚定dna,继续反应24h,即可生成msn-ad。
21.进一步的,所述黑暗环境中搅拌反应的时间为10~14h。
22.进一步的,所述制备方法中,向载药后的msn-ad的缓冲液中加入分子信标反应4~8h。
23.本发明第二方面,提供第一方面所述分子信标修饰的纳米载体作为抗肿瘤活性成分的应用。
24.上述第二方面中,所述作为抗肿瘤活性成分的应用方式包括但不限于以下任意一种:
25.(1)将第一方面所述分子信标修饰的纳米载体施用于有治疗需求的个体;
26.(2)将第一方面所述分子信标修饰的纳米载体用于制备抗肿瘤产品;
27.(3)将第一方面所述分子信标修饰的纳米载体作为一种抗肿瘤模型药剂。
28.上述第(1)方面的应用中,所述“有治疗需求的个体”表示肿瘤相关疾病治疗需求的个体,优选的,为耐药型肿瘤治疗需求;所述“治疗”包括对疾病的缓解、抑制、改善以及治愈;另外,所述“个体”意指任意动物,优选为哺乳动物,包括选小鼠、大鼠、其它啮齿动物、兔、狗、猫、猪、牛、羊、马或灵长类动物,以及最优选为人类。
29.上述第(2)方面的应用中,所述抗肿瘤产品包括但不限于抗肿瘤药物、还包括具有抗肿瘤效果的保健品、特殊医用食品,及抗肿瘤治疗过程中应用的医疗器械等。
30.上述第(3)方面的应用中,所述“抗肿瘤模型药剂”包括在筛选抗肿瘤药物、评价其药效的体内外模型中涉及的药剂制剂。基于本发明第一方面的设计,所述分子信标脱离纳米载体后能够与mdr1 mrna进行杂交,同时实现肿瘤细胞原位成像,上述设计应用与抗肿瘤药物模型可以方便的通过荧光显微镜对药效发挥情况进行观察。
31.本发明第三方面,提供一种药物组合物,所述药物组合物中包括第一方面所述分子信标修饰的纳米载体。
32.优选的,上述药物组合物中包括其他活性成分和/或药学上所必需的辅料。
33.进一步的,所述其他活性成分包括但不限于抗肿瘤药物、抗炎药物、免疫调节药
物、镇痛药物、止血药物中的一种或几种。
34.本发明第四方面,提供一种耐药型肿瘤的治疗药物,所述药物中,第一方面所述分子信标修饰的纳米载体作为活性成分。
35.以上一个或多个技术方案的有益效果是:
36.本发明提供的一个方案中,利用含有mdr1 mrna反义序列的分子信标作为msn的门控,构建了一种多功能的介孔硅纳米载体,用于耐药癌细胞中mdr1mrna的沉默、成像和药物递送。通过对细胞内mdr1 mrna成像,该纳米载体可用于区分耐药癌细胞和非耐药癌细胞。mb作为mdr1 mrna反义序列,可以有效沉默mdr1 mrna,抑制其翻译并下调p-gp的表达,从而减少药物外排,用于对抗耐药性。与游离dox相比,dox@msn-ad-mbs对hepg2/adr细胞和mcf-7/adr细胞显示出显著增强的抑制效能。游离dox和dox@msn-ad-mbs对hepg2/adr细胞的ic
50
值分别为0.47μm与1.2μm,对mcf-7/adr细胞的ic
50
值分别为2.9μm和》5.0μm。通过集成癌症标志物成像,基因沉默和药物递送功能,该纳米载体为多功能药物递送系统的开发提供了新思路,在癌症的诊断治疗和耐药性抑制中具有应用潜力。
附图说明
37.构成本发明的一部分的说明书附图用来提供对本发明的进一步理解,本发明的示意性实施例及其说明用于解释本发明,并不构成对本发明的不当限定。
38.图1为本发明中所述分子信标修饰的介孔硅纳米载体用于耐药癌细胞中mdr1 mrna的沉默、成像和药物递送原理;
39.图2为实施例1中非变性page验证原理可行性;
40.泳道m:marker;泳道1:mdr1 mrna目标序列(500nm);泳道2:mb(500nm);泳道3:锚定dna(500nm);泳道4:mb(500nm) 锚定dna(500nm);泳道5:锚定dna-mb杂交体(500nm) mdr1 mrna目标序列(500nm);
41.图3为实施例1中所述msn-ad-mbs的构建和表征;
42.(a)msn的tem图像;(b)msn、msn-ad和msn-ad-mbs的水合粒径分布曲线;(c)msn的bet氮气吸附脱附曲线;(d)msn的孔径分布曲线;(e)msn、msn-nh2、msn-cooh、msn-ad和msn-ad-mbs的表面zeta电位;(f)msn、msn-nh2、msn-cooh和msn-ad-mbs的ft-ir图谱;
43.图4为实施例1中所述msn-cooh(左)和msn-ad(右)的照片;
44.图5为实施例1中所述mb的修饰量和dox的装载量结果;
45.(a)fam标记mb的荧光信号强度-浓度线性关系;(b)dox的荧光信号强度-浓度线性关系;(c)fam标记mb修饰前后溶液的荧光发射光谱;(d)dox装载前后溶液的荧光发射光谱;
46.图6为纳米载体的稳定性和dox体外释放考察结果;
47.(a)msn-ad-mbs在pbs缓冲液体系和含有谷胱甘肽、dnase i、mdr1mrna目标序列的pbs缓冲液体系中fam荧光信号恢复率-时间关系图;(b)dox@msn-ad-mbs与不同浓度mdr1 mrna共孵育的dox释放率-时间曲线;
48.图7为实施例1中所述qrt-pcr分析hepg2细胞、hepg2/adr细胞、mcf-7细胞和mcf-7/adr细胞中mdr1 mrna的相对表达水平;
49.图8为实施例1中所述msn-ad-mbs处理后hepg2细胞、hepg2/adr细胞、mcf-7细胞和mcf-7/adr细胞的共聚焦荧光成像图片;标尺为20μm;
50.图9为游离dox和dox@msn-ad-mbs处理不同肿瘤细胞后的共聚焦荧光成像图片;
51.其中,(a)为hepg2/adr细胞;(b)为mcf-7/adr细胞;标尺为20μm;
52.图10为qrt-pcr法分析不同浓度msn-ad-mbs(以mb浓度计)处理肿瘤细胞后,肿瘤细胞中mdr1 mrna的相对表达水平;
53.其中,(a)为hepg2/adr细胞;(b)为mcf-7/adr细胞;
54.图11为mtt法分析msn-ad-mbs,游离dox和dox@msn-ad-mbs(以dox浓度计)处理后肿瘤细胞的存活率;
55.其中,(a)为不同浓度上述药物处理后的hepg2/adr细胞;(b)为不同浓度上述药物处理后的mcf-7/adr细胞;(c)为相同浓度的上述药物处理后的hepg2/adr细胞;(d)为相同浓度的上述药物处理后的mcf-7/adr细胞存活率;hepg2/adr细胞和mcf-7/adr细胞所用的dox浓度分别为1.3μm和4.0μm。
具体实施方式
56.应该指出,以下详细说明都是例示性的,旨在对本发明提供进一步的说明。除非另有指明,本文使用的所有技术和科学术语具有与本发明所属技术领域的普通技术人员通常理解的相同含义。
57.需要注意的是,这里所使用的术语仅是为了描述具体实施方式,而非意图限制根据本发明的示例性实施方式。如在这里所使用的,除非上下文另外明确指出,否则单数形式也意图包括复数形式,此外,还应当理解的是,当在本说明书中使用术语“包含”和/或“包括”时,其指明存在特征、步骤、操作、器件、组件和/或它们的组合。
58.为了使得本领域技术人员能够更加清楚地了解本发明的技术方案,以下将结合具体的实施例详细说明本发明的技术方案。
59.实施例1
60.试剂和仪器
61.本实施例中用到的核酸(具体序列见表1和表2)购买自生工生物有限公司(中国上海)。四乙氧基硅烷(teos)购买自国药集团有限公司(中国上海)。胎牛血清(fbs)、十六烷基三甲基铵(ctab)和琥珀酸酐购买自索莱宝生物科技有限公司(中国北京)。1-乙基-3-(3-二甲氨基丙基)碳二亚胺盐酸盐(edc)购买自源叶生物科技有限公司(中国上海)。n-羟基磺基琥珀酰亚胺钠盐(sulfo-nhs)购买自bbi生物科学有限公司(中国上海)。3-氨基丙基-三乙氧基硅烷(aptes)购自麦考林生物科学有限公司(中国北京)。阿霉素(dox)购买自广东华丰制药有限公司(中国广东)。谷胱甘肽(gsh)购买自上海阿拉丁生化科技有限公司(中国北京)。dnase i购买自neb北京公司(中国北京)。胰蛋白酶、rpmi 1640、dmem和pbs缓冲液购买自biological工业有限公司(以色列)。四甲基偶氮唑蓝(mtt)购买自sigma-aldrich化学试剂有限公司(美国新泽西州)。本工作所用的试剂为分析纯,水溶液和缓冲液均使用超纯水配制。
62.表1本实施例用到的核酸序列
[0063][0064]
注:mb中的绿色部分代表mdr1 mrna识别序列,下划线部分代表发夹的茎部,fam代表fam荧光基团标记;ctrl-mb中的下划线部分代表发夹的茎部;锚定dna中的h2n代表氨基修饰,bhq-1代表bhq-1淬灭团标记。
[0065]
表2本实施例用到的qrt-pcr引物序列
[0066][0067]
采用jem2100显微镜(日本)拍摄透射电子显微镜(tem)图像。采用asap2020(美国)绘制brunauer-emmett-teller(bet)氮气吸附脱附等温线。采用malvern nano zs analyzer(英国)测量纳米颗粒的动态光散射(dls)和表面zeta电位数据。采用tensor ii光谱仪(德国)记录傅里叶变换红外(ft-ir)光谱图。采用f-7000日立荧光发射光谱仪(日本)测量荧光信号强度和采集荧光发射光谱。采用hitachi u-2910光谱仪(日本)采集uv-vis吸光光谱和测量吸光度。采用leica tcs sp8共聚焦激光扫描显微镜(clsm)(德国)拍摄荧光成像照片。采用tecan多模式酶标仪(瑞士)测量mtt实验数据。
[0068]
凝胶电泳实验
[0069]
通过聚丙烯酰胺凝胶电泳(page)验证分子信标(mb)与锚定dna的结合可行性以及mb对mdr1 mrna目标序列的识别能力。首先,制备12%的page凝胶,取丙烯酰胺溶液(7.5ml,40%)、5
×
tbe缓冲液(tris 88mm,硼酸88mm,edta 2.0mm,ph 8.3,5.0ml)、n,n,n',n'-四甲基乙二胺(18μl)、过硫酸铵溶液(0.1g ml-1
,180μl)和depc水(12.5ml)混匀后制胶。将样品
注入凝胶后,以恒定电流25ma,在15℃的1
×
tbe缓冲液中电泳1h。电泳结束后,取出凝胶,在sybr gold(十万分之一)溶液中避光染色40min。最后,将染色后的凝胶置于bio-rad凝胶成像系统中进行成像。
[0070]
氨基化介孔硅纳米颗粒的合成
[0071]
使用经典的溶胶-凝胶法合成msn。具体步骤为:将ctab(0.5g)溶解于去离子水(240ml)中,搅拌下缓慢加入naoh溶液(2.0m,1.8ml)。然后升温至80℃,缓慢加入teos(4.0ml),并维持80℃反应2h,产生白色沉淀。冷却至室温后,通过离心(12000rpm,6min)分离出白色沉淀,用乙醇和水洗涤后,置于烘箱中干燥。氨基的连接是通过后修饰法进行的。具体来说,将干燥后固体(400mg)悬浮于甲苯(40ml)中,搅拌条件下加入aptes(80μl),升温至110℃反应2h,即可得到氨基化的二氧化硅。将上述固体通过离心分离并用乙醇洗涤后,分散于盐酸甲醇溶液(盐酸37.4%2.0ml,甲醇160ml)中回流16h,以去除内部的ctab模板,即可得到氨基化的介孔硅纳米颗粒(msn-nh2)。将得到msn-nh2用乙醇洗涤后,置于烘箱中干燥后备用。
[0072]
msn-ad-mbs的制备
[0073]
在修饰dna之前,先对msn-nh2进行羧基化。羧基化是通过酸酐与氨基的反应得到的。具体来说,将msn-nh2(50mg)与丁二酸酐(500mg)加入n,n-二甲基甲酰胺(dmf,15ml)中,室温反应8h,即可得到羧基化的介孔硅纳米颗粒(msn-cooh)。将msn-cooh离心分离并用水洗涤后,重悬mes缓冲液(mes 100mm,ph 6.0,5.0ml)中,用于后续实验。
[0074]
通过酰胺缩合反应将氨基化的锚定dna修饰在msn-cooh表面。取上述msn-cooh(5.0mg,0.5ml)悬浮液,在搅拌条件下加入edc(15.0mg)和sulfo-nhs(25.0mg),反应15min,对羧基进行活化。加入pbs(1.0ml,ph 7.4)和氨基化的锚定dna(30μm,450μl),继续反应24h,即可生成锚定dna修饰的msn(msn-ad)。将msn-ad通过离心进行分离,用水洗涤后分散于pbs缓冲液中。
[0075]
msn-ad-mbs的制备是在msn-ad的基础上进行的。将上述msn-ad(22μl)悬浮液用pbs稀释至1.0ml,搅拌下加入mb(100μm,10μl),继续反应6h以完成杂交,制备纳米载体(msn-ad-mbs)。通过离心分离msn-ad-mbs,用pbs缓冲液洗涤。合并上清液和洗涤液,通过荧光法计算修饰过程中pbs缓冲液中mb的减少量,即为msn表面修饰的mb量。
[0076]
dox@msn-ad-mbs的制备
[0077]
将dox(1.0mg)溶解在pbs缓冲液(1.0ml)中,搅拌下加入msn-ad(200μl),在黑暗环境中搅拌反应12h以充分装载dox后,加入mb(100μm,45μl)。继续反应6h,即可得到载药的纳米载体(dox@msn-ad-mbs)。停止反应,通过离心将制备的dox@msn-ad-mbs分离出来,用pbs缓冲液洗涤后,将dox@msn-ad-mbs悬浮于pbs缓冲液(1.0ml)中备用。dox的携载量通过荧光法计算,装载前后dox的减少量即为msn中装载的dox量。
[0078]
dox体外释放考察
[0079]
dox的体外释放考察是通过半透膜袋扩散法进行。为了验证载药纳米载体释放dox的特异性,本实施例将不同浓度(0、1.0、2.0和4.0μm)的mdr1 mrna目标序列与dox@msn-ad-mbs混合后,37℃条件下以100rpm的速度振荡24h。振荡过程中,在预定时间点(0.5、1、2、3、4、5、6.5、8、12和24h)取样,每次取0.1ml,离心后对上清液中的dox进行定量分析。每次取样后加入pbs缓冲液(0.1ml)以确保总体积保持不变。dox是通过荧光法进行定量的。具体来
说,首先测量不同浓度dox溶液的荧光信号强度,绘制荧光信号强度与dox浓度的标准曲线,然后将根据标准曲线对dox浓度进行定量。
[0080]
纳米载体稳定性考察
[0081]
为了考察纳米载体的稳定性,本实施例将msn-ad-mbs分别与mdr1mrna目标序列(100nm)、gsh(15mm)、dnase i(3.5mu ml-1
)共孵育。在预定时间点(10、20、30、40、50和60min)取样,离心后测量fam基团的荧光信号强度。对fam定量后计算fam的荧光恢复率,并与空白组对比。
[0082]
细胞和细胞培养
[0083]
hepg2细胞购买自中国科学院,hepg2/adr细胞购买自爱燕生物科技公司,mcf-7细胞和mcf-7/adr细胞分别由山东师范大学化学化工与材料科学学院刘真真博士和山东大学齐鲁医学院药学院韩秀珍教授友情提供。hepg2细胞和hepg2/adr细胞用含有10%胎牛血清和1.0%抗生素的dmem培养基培养,mcf-7细胞和mcf-7/adr细胞用含有10%fbs和1.0%抗生素的rpmi 1640培养基培养。所有细胞均在37℃,含5.0%co2的培养箱中培养。
[0084]
细胞荧光成像实验
[0085]
将hepg2细胞、hepg2/adr细胞、mcf-7细胞和mcf-7/adr细胞分别接种到共聚焦培养皿中并孵育24h后,分别加入含有msn-ad-mbs(50μg ml-1
,150μl)的新鲜培养基,继续孵育4h后,置于荧光显微镜下进行成像。
[0086]
细胞内dox积累分析
[0087]
将hepg2/adr和mcf-7/adr细胞分别接种到共聚焦培养皿中,孵育24h后,弃去培养基。然后用pbs缓冲液洗涤细胞,并将细胞分成两组,将两组细胞分别与含有游离dox和dox@msn-ad-mbs(均含有1.0μm的dox)的培养基共孵育4h后,置于荧光显微镜下进行成像。
[0088]
mdr1 mrna表达水平分析
[0089]
用qrt-pcr法分析不同细胞中mdr1 mrna相对表达水平。将hepg2细胞、mcf-7细胞、hepg2/adr细胞和mcf-7/adr细胞接种于六孔板中,分别与不同浓度的msn-ad-mbs(含有0、50、100和200nm的mbs)培养基培养48h后(hepg2细胞和mcf-7细胞用培养基培养),用trizol试剂分别提取细胞的总rna。选择gapdh作为内参进行qrt-pcr实验,循环程序为95℃3min和60℃30s(45个循环)。通过2-δδct
法计算mdr1 mrna的相对表达水平。
[0090]
蛋白印迹分析
[0091]
将hepg2/adr细胞和mcf-7/adr细胞接种于六孔板中,分别与不同浓度的msn-ad-mbs(含有0、50、100和200nm的mb)孵育48h后,用温的生理盐水清洗细胞3次,去除培养液。接下来,加入含有蛋白酶和磷酸酶抑制剂的ripa裂解缓冲液,提取细胞的总蛋白质。提取的蛋白质加入蛋白样品上样缓冲液,加热至100℃维持5min使蛋白质变性,分装后保存于-20℃冰箱,以避免反复冻融。按照蛋白质印迹分析操作手册对p-糖蛋白(p-gp)的表达水平进行表征。具体步骤如下:
[0092]
首先,制作8.0%分离胶和4.0%积层胶,方法为:取去离子水(7.05ml),tris盐酸缓冲液(1.5m,ph 8.8,3.75ml),十二烷基硫酸钠溶液(10%,150μl),丙烯酰胺溶液(30%,4.95ml),n,n,n',n'-四甲基乙二胺(30μl)、过硫酸铵溶液(0.1g ml-1
,75μl)混合制作分离胶,在玻璃板中加入上述混合液后,小心加入0.1%十二烷基硫酸钠溶液,以保证胶面平整。静置1h后去除0.1%十二烷基硫酸钠溶液,再制备积层胶。去离子水(5.4ml),tris盐酸缓冲
液(1.5m,ph 6.8,2.5ml),十二烷基硫酸钠溶液(10%,100μl),丙烯酰胺溶液(30%,2.0ml),n,n,n',n'-四甲基乙二胺(20μl)、过硫酸铵溶液(0.1g ml-1
,50μl)混匀制作分离胶。将胶倒入玻璃板后,插入梳子,静置1h,凝胶制作完成。
[0093]
然后,加入上述总蛋白质提取液(上样量为30μg每泳道),进行电泳。初始电压为80v,观察到上样缓冲液的蓝色条带进入分离胶后,升高电压至120v,继续电泳,至蓝色条带完全跑出,结束电泳。电泳结束后,在转膜缓冲液中将蛋白质转移到pvdf膜上(millipore immobilon-p,0.45μm)。待转膜结束后,将pvdf膜置于tbst缓冲液(10mm tris,150mm nacl,0.05%tween-20,ph 7.2-7.5)溶解的5%脱脂牛奶中,在室温下轻摇孵育1h,以封闭膜上的非特异性蛋白结合位点。用tbst缓冲液清洗pvdf膜3次后,切割相应蛋白质位置的pvdf膜,并分别置于相应一抗孵育液中,维持4℃下孵育过夜。次日,将pvdf膜用tbst洗涤3次后,与辣根过氧化物标记的二抗于室温下轻摇孵育2h。
[0094]
最后,用tbst洗涤3次后,将pvdf膜置于成像仪中成像。
[0095]
细胞毒性考察
[0096]
首先,将hepg2/adr细胞和mcf-7/adr细胞接种到96孔板中,孵育24h后,弃去培养基。分别用含有不同浓度的游离dox、msn-ad-mbs和dox@msn-ad-mbs(hepg2/adr细胞的dox浓度为0.1、0.5、1.0、1.25和1.5μm,mcf-7/adr细胞的dox浓度为0.1、1.0、2.0、3.0和5.0μm,msn-ad-mbs的加入量与dox@msn-ad-mbs一致)的新鲜培养基孵育48h。弃去培养基后,用pbs洗涤细胞,并在每个孔中加入mtt溶液(0.5mg ml-1
,100μl)。继续孵育4h后,去除上清液并加入dmso(100μl每孔)。以溶解产生的甲瓒。振摇5min后,用酶标仪测量每个孔在570nm处的吸光度值。用下列公式计算细胞存活率(%):
[0097][0098]
其中a
sample
,a
control
和a
blank
代表样品,对照和空白的吸光度。
[0099]
为了进一步验证mb在增强对耐药癌细胞抑制效率方面的作用,本实施例分别用与载有mb和ctrl mb(含有8个mdr1 mrna错配碱基的mb)的纳米载体处理hepg2/adr细胞和mcf-7/adr细胞,并考察细胞存活率。细胞的前处理方法与上述细胞毒性考察方法相同,用pbs缓冲液洗涤细胞后,将hepg2/adr细胞和mcf-7/adr细胞分别在含有相同浓度的游离dox、dox@msn-ad-ctrl mbs和dox@msn-ad-mbs(hepg2/adr细胞的dox浓度为1.3μm,mcf-7/adr细胞的dox浓度为4.0μm)的培养基中孵育48h,经过相同处理后用酶标仪测量每个孔在570nm处的od值。细胞存活率计算公式同上。
[0100]
多功能分子信标修饰的介孔硅纳米载体用于耐药癌细胞中mdr1 mrna的沉默、成像和药物递送的设计原理
[0101]
多功能分子信标(mb)修饰的介孔硅纳米载体用于耐药癌细胞中mdr1mrna的沉默、成像和药物递送原理如图1所示。首先,通过扩散将小分子化疗药物dox装载到羧基化的介孔硅纳米颗粒(msn-cooh)孔腔中,形成装载dox的msn-cooh(dox@msn-cooh)。然后,通过酰胺缩合在dox@msn-cooh表面上修饰氨基和淬灭团(bhq-1)双标记的锚定dna(ad),构建dox@msn-ad。在此基础上,通过碱基互补配对连接fam标记的mb,制备载药的纳米载体(dox@msn-ad-mbs)。mb负责识别mdr1 mrna和封堵msn。当dox@msn-ad-mbs被耐药癌细胞摄取后,表面的mb与mdr1mrna杂交,与ad解杂交,从载体上脱落。mb与mdr1 mrna的杂交事件具有三重作
用:首先,mb与mdr1 mrna的杂交可以通过沉默mdr1 mrna和下调p-gp表达水平,用于抑制耐药性;其次,mb与mdr1 mrna的杂交事件可以使fam荧光团与bhq-1淬灭团远离,使荧光恢复,用于原位成像mdr1mrna;最后,mb的远离还可以解除msn的封闭,使msn的孔被打开,释放dox,发挥细胞毒性。本章构建的多功能mb修饰的介孔硅纳米载体用于癌症标志物传感和药物递送具有两点优势。第一,通过装载dox并修饰mb,纳米载体将耐药癌细胞中的mdr1 mrna的成像和药物递送功能结合了起来,有助于在实时原位分析癌症标志物表达信息的同时抑制癌细胞;第二,通过集成具有mdr1 mrna沉默作用的mb,纳米载体下调了mdr1 mrna和p-gp的表达水平,从而抑制了耐药癌细胞对药物的耐药性,有效增强了化疗药物的递送效率和耐药癌细胞的抑制效能。
[0102]
凝胶电泳表征
[0103]
采用非变性page验证mb与锚定dna杂交的可行性和mb对mdr1 mrna目标序列的结合能力。如图2所示,泳道1-3分别代表了mdr1 mrna目标序列条带、mb条带和锚定dna条带。将锚定dna和mb混合后,泳道4中出现一条清晰的条带,该条带的移动速度比单独的mb(泳道2)和锚定dna(泳道3)慢,为锚定dna与mb杂交条带,表明锚定dna能与mb杂交。泳道5为锚定dna-mb杂交体和mdr1 mrna目标序列混合后的电泳结果,泳道中锚定dna-mb杂交体条带(泳道4)消失,表明mdr1 mrna目标序列存在时,mdr1 mrna目标序列能竞争结合mb,形成mdr1 mrna-mb杂交体;同时出现锚定dna条带(泳道3),表明mdr1 mrna与mb的结合能使mb与锚定dna解离。page结果表明所设计核酸序列之间的相互作用符合设计要求。
[0104]
msn-ad-mbs的构建和表征
[0105]
tem图像(图3a)显示合成的msn是多孔的球形颗粒,平均粒径约为138.4nm。通过dls进一步测定了msn的平均水合粒径,约为146.9nm(图3b),略大于电镜下观测到的平均粒径,这是因为dls法测定的粒径为纳米颗粒在水溶液中被溶剂化后形成的水合离子的粒径,数值会略大于tem下直接观测到的msn粒径。研究显示,135-200nm粒径范围内的msn细胞毒性较小,且易被细胞摄取,在生物医学应用中有优势。此外,本实施例进行了bet氮气吸附脱附测试,msn的bet吸脱附等温线(图3c)为iv型等温线,表明msn具有介孔结构,进一步计算其平均孔径为2.3nm(图3d)。
[0106]
接下来,本实施例对纳米载体的制备过程进行了表征。通过dls法分别测定了msn,msn-ad和msn-ad-mbs的平均水合粒径。如图所示,msn-ad(155.5nm)和msn-ad-mbs(163.2nm)的平均水合粒径均大于msn,这也表明了锚定dna和mb的成功修饰。为了进一步证明这一点,本实施例测定了msn-ad-mbs制备过程中所出现结构的表面zeta电位值(图3e)。msn由于表面具有丰富的硅羟基呈现负电位;由于氨基易结合质子,msn-nh2的表面zeata电位呈现正电位;经羧基化和dna修饰后,由于羧基和核酸本身的负电性,msn-cooh和msn-ad-mbs表面zeta电位值为负值。上述表明zeta电位值的变化为羧基化和dna修饰的成功提供了佐证。接下来,本实施例对msn-nh2,msn-cooh和msn-ad-mbs进行了ft-ir的验证。如图3f所示,msn-nh2的ft-ir光谱图在1503cm-1
处出现吸收峰,为n-h键的弯曲振动峰,是氨基的特征吸收峰,证实了氨基的存在;msn-cooh的光谱图中出现酰胺键特征吸收峰(1556cm-1
,n-h振动峰)和羧基特征吸收峰(1720cm-1
,羧基中的羰基伸缩峰),表明羧基的成功连接;在msn-ad-mbs的光谱图中,1720cm-1
峰消失,仅余酰胺键特征吸收峰(1557cm-1
),这是因为羧基与氨基形成了酰胺键,进一步证明了msn-ad-mbs的成功制备。
[0107]
此外,在msn-cooh上修饰锚定dna后,本实施例分别对msn-cooh和msn-ad拍摄了照片。如图4所示,msn-cooh和msn-ad的颜色分别为白色和粉色,粉色是bhq-1标记的锚定dna的颜色,这种颜色的变化直观地证明了锚定dna成功的修饰。
[0108]
mb的修饰量和dox的装载量
[0109]
mb修饰量和dox装载量是采用减量法计算的。首先分别绘制fam标记的mb和dox的标准曲线。如图5a所示,在40-250nm浓度范围内,fam荧光信号强度(f
fam
)与mb浓度(c
mbs
)呈良好的线性关系,线性方程为f
fam
=29.2c
mbs
45.1(r2=0.999);在0.1-20μg ml-1
浓度范围内,dox荧光信号强度(f
dox
)与dox浓度(c
dox
)呈良好的线性关系(图5b),线性方程为f
dox
=10.9c
dox-1.18(r2=0.997)。然后分别测量修饰前后mb和装载前后dox的荧光信号强度(图5c和图5d),并根据工作曲线换算出mb和dox的浓度。修饰前后mb的减少量和装载前后dox的减少量即为mb修饰量和dox装载量,分别为4.2μmol g-1
和100.9mg g-1
。
[0110]
纳米载体的稳定性和dox体外释放考察
[0111]
由于细胞内酶和还原物质常导致纳米载体的非特异性降解或破坏,从而产生成像的假阳性信号或药物的非特异性释放,因此本实施例考察了msn-ad-mbs在不同环境中的稳定性。使用pbs缓冲液,含有dnase i和gsh的pbs缓冲液孵育msn-ad-mbs,分别模拟细胞内环境、细胞内酶环境和还原环境,测量fam荧光信号恢复率并通过与阳性样品(与含有mdr1 mrna目标序列孵育的培养基孵育)进行比较评估载体的稳定性。如图6a所示,与pbs缓冲液和含有dnase i、gsh的pbs缓冲液孵育60min后,msn-ad-mbs的荧光信号恢复率与阴性样品无显著差异,显著低于相同孵育条件的阳性样品,表明msn-ad-mbs对细胞内酶和还原物质具有较好的耐受性,载体具有良好的稳定性。这是因为msn的空间位阻作用能有效阻碍环境中的干扰物质如核酸酶对msn表面修饰核酸的降解,从而保证了纳米载体的结构完整性和稳定性。
[0112]
使用半透膜袋法考察了dox@msn-ad-mbs的体外释放情况,该方法的原理是半透膜袋允许dox透过而不允许msn透过。通过测试不同时间点的dox荧光信号强度并根据标准曲线换算为dox浓度,本实施例绘制了与不同浓度mdr1 mrna目标序列孵育的dox释放率-时间曲线。如图6b所示,在不存在mdr1 mrna的条件下,24h内dox的释放率为12.6%,显著低于mdr1 mrna目标序列存在时的释放率。相同时间点dox的释放率随mdr1 mrna目标序列浓度的增加而增加。在与4μm mdr1 mrna目标序列孵育24h后,dox的释放率达到83.2%。这些数据表明,纳米载体能够响应于mdr1 mrna目标序列释放携载的药物dox,dox的释放率随mdr1 mrna目标序列浓度升高而增加,与设计原理相符。
[0113]
细胞荧光成像研究
[0114]
为了验证msn-ad-mbs用于细胞内mdr1 mrna成像的可行性,本实施例选取了两组mdr1 mrna表达水平有显著差异的细胞系用于荧光成像实验,分别为hepg2细胞(人肝癌细胞系)和hepg2/adr细胞(人耐dox肝癌细胞系)、mcf-7细胞(人乳腺癌细胞)和mcf-7/adr细胞(人耐dox乳腺癌细胞系)。首先,本实施例通过qrt-pcr法考察了两组细胞中mdr1 mrna的相对表达水平。如图7所示,qrt-pcr结果显示耐药细胞系hepg2/adr细胞和mcf-7/adr细胞中mdr1 mrna的相对表达水平显着高于非耐药细胞系hepg2细胞和mcf-7细胞,与文献报道一致。
[0115]
然后,本实施例用荧光成像方法考察了纳米载体用于细胞内mdr1 mrna成像的情
况。如图8所示,与msn-ad-mbs孵育4h后,耐药细胞hepg2/adr细胞和mcf-7/adr细胞在共聚焦激光扫描显微镜(clsm)下用显示出强烈的fam荧光信号,显著高于相同方式处理的非耐药细胞系hepg2细胞和mcf-7细胞。荧光成像的结果与qrt-pcr检测结果一致,表明msn-ad-mbs可在活细胞中成像mdr1 mrna,并用于区分耐药癌细胞和非耐药癌细胞。原因是纳米载体被细胞摄取后,在mdr1 mrna的作用下mb从纳米载体脱落,远离淬灭基团恢复荧光,从而指示mdr1 mrna。
[0116]
如引言所述,耐药癌细胞中p-gp过度表达是导致细胞内药物积累不足的主要障碍之一。理论上,dox@msn-ad-mbs被耐药癌细胞摄取后,由于mb对mdr1 mrna的沉默作用,细胞中的p-gp表达水平被下调,可以减少dox的外排并增加dox在细胞内的累积。为了证明这一点,本实施例通过荧光成像实验考察了与含有游离dox和dox@msn-ad-mbs的培养基共孵育的耐药癌细胞中dox的累积情况,并与不加dox的空白细胞作对照。如图9所示,对照细胞中未观察到dox的荧光,表明细胞本身不产生干扰信号。dox@msn-ad-mbs处理的hepg2/adr细胞(图9a)中dox荧光信号显著强于相同浓度下游离dox处理的hepg2/adr细胞,表明载药的纳米载体能有效增强dox在耐药癌细胞中的累积,与实验原理相符。相似地,dox@msn-ad-mbs处理的mcf-7/adr细胞(图9b)显著强于相同浓度下游离dox处理的mcf-7/adr细胞,这进一步证明了上述结论。上述结果表明纳米载体在提高药物递送效率上有应用潜力。
[0117]
mdr1 mrna沉默考察
[0118]
研究表明,在有效递送至细胞内的前提下,反义寡核苷酸可以通过与mrna杂交来沉默相应mrna的表达,抑制翻译过程。本发明提出的纳米载体整合了包含mdr1 mrna反义序列的mb,因此,本实施例假设该纳米载体可用于沉默mdr1 mrna并下调p-gp表达。为了验证这一点,本实施例分别用qrt-pcr法和western blot法测定了msn-ad-mbs处理前后的hepg2/adr细胞和mcf-7/adr细胞中mdr1 mrna和p-gp的相对表达水平。如图10a和图10b所示,与msn-ad-mbs孵育48h后,hepg2/adr细胞和mcf-7/adr细胞内mdr1 mrna相对表达水平有所下降,且下降程度随着msn-ad-mbs浓度增加而增强,呈现浓度依赖关系。western blot实验表明,与msn-ad-mbs孵育48h后,hepg2/adr细胞和mcf-7/adr细胞内p-gp表达水平也出现下降,且下降程度同样随着msn-ad-mbs浓度增加而增加(图10c和图10d)。qrt-pcr和western blot实验结果表明msn-ad-mbs能有效沉默耐药癌细胞中mdr1mrna并相应下调p-gp的表达水平,与假设一致,说明该纳米载体在对抗癌细胞耐药性方面具有应用潜力。
[0119]
细胞毒性
[0120]
为了考察dox@msn-ad-mbs对抗耐药性和增强癌细胞抑制效能的能力,本实施例通过mtt法测定了不同条件处理的hepg2/adr细胞和mcf-7/adr细胞存活率,以考察纳米载体对耐药细胞的细胞毒性。在此基础上,本实施例计算了dox的半数抑制浓度(half maximal inhibitory concentration,ic
50
),以评估不同递送方式中dox抑制耐药癌细胞的效能。首先,本实施例测定了与不同浓度的msn-ad-mbs、游离dox和dox@msn-ad-mbs孵育24h后的hepg2/adr细胞和mcf-7/adr细胞的细胞存活率(图11a和图11b)。其中,msn-ad-mbs处理的hepg2/adr细胞和mcf-7/adr细胞,存活率均高于90%,表明纳米载体具有良好的安全性。在相同dox浓度下,dox@msn-ad-mbs处理的hepg2/adr细胞和mcf-7/adr细胞的细胞存活率均显著低于相同浓度游离dox处理的同种细胞的存活率。在dox浓度分别为1.5μm和5.0μm时,dox@msn-ad-mbs处理的hepg2/adr细胞和mcf-7/adr细胞的细胞存活率比游离dox处理的
hepg2/adr细胞和mcf-7/adr细胞分别低40.6%和73.1%。经计算,dox@msn-ad-mbs和游离dox对hepg2/adr细胞的ic
50
值分别为0.47μm和1.2μm,对mcf-7/adr细胞的ic
50
值分别为2.9μm和》5.0μm。上述结果显示,相同dox浓度下,dox@msn-ad-mbs对hepg2/adr细胞和mcf-7/adr细胞表现出更高的抑制效能,表明纳米载体能够有效增强药物对耐药癌细胞的抑制效能。纳米载体增强药物抑制耐药癌细胞效能的原因是纳米载体通过沉默mdr1 mrna下调了p-gp的表达水平,从而降低了耐药癌细胞对dox的外排效应并增加了细胞内dox的浓度。
[0121]
最后,为了进一步验证含有mdr1 mrna反义序列的mb在对抗耐药癌性的作用,本实施例设计了含有8个mdr1 mrna错配碱基的ctrl mb作为对照,测定了与含有游离dox、dox@msn-ad-ctrl mbs和dox@msn-ad-mbs(用于hepg2/adr细胞和mcf-7/adr细胞的dox浓度分别为1.3μm和4.0μm)的培养基共孵育的hepg2/adr细胞和mcf-7/adr细胞的细胞存活率。如图11c所示,与游离dox处理和dox@msn-ad-ctrl mbs处理的hepg2/adr细胞相比,dox@msn-ad-mbs处理的hepg2/adr细胞在相同浓度下显示出显着较低的细胞存活率,表明只有当含有mdr1 mrna反义序列的mb存在时,纳米载体才能对抗耐药性,增强化疗药物的抑制癌细胞效能。有趣的是,dox@msn-ad-ctrl mbs处理的hepg2/adr细胞的细胞存活率高于游离dox处理的hepg2/adr细胞的细胞存活率,这可能是因为dox@msn-ad-ctrl mbs不仅不具有沉默mdr1mrna的作用以对抗耐药性,还阻碍了药物从纳米载体中释放,进一步降低了细胞内dox的浓度。相似的结果也出现在了相同处理条件下的mcf-7/adr细胞中(图11d),同样说明只有当含有mdr1 mrna反义序列的mb存在时,载体才能抑制耐药性和增强药物抑制效能。该细胞毒性实验结果验证了含有mdr1mrna反义序列的mb对于抑制耐药性的必要性,与设计原理相符。
[0122]
以上所述仅为本发明的优选实施例而已,并不用于限制本发明,对于本领域的技术人员来说,本发明可以有各种更改和变化。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
