基于nico2o4@ni-mof@mno2的丝素蛋白检测用柔性电容型免疫传感器
1.技术领域
2.本发明涉及电容传感领域,尤其涉及一种基于nico2o4@ni-mof@mno2的丝素蛋白检测用柔性电容型免疫传感器。
3.
背景技术:
4.中国自古以来就是纺织品大国,生产的纺织品种类丰富,工艺精美,舒适透气。其中最负盛名的纺织品就是中国的丝绸,故中国又被称为“丝绸之国”。丝绸文物不仅具有科技、文化、艺术等多方面的价值,更是社会交替,人文交融的历史见证者。丝绸文物中丝绸的主要成分是桑蚕丝,桑蚕丝主要由丝素蛋白和丝胶两部分组成,丝素蛋白是蚕丝的主要组成部分,约占总重量的70%。但是,丝绸文物中的桑蚕丝作为一种有机高分子材料,由于常年处于地下墓葬环境中易受光、热、酸碱、微生物等的影响发生降解,从而造成结晶度、分子量等结构及性能的变化,另一方面,丝绸文物出土时往往会伴有许多杂质,真正的有效成分极少。而常规的丝素蛋白检测方法灵敏度低,受杂质干扰影响大,不适合对丝绸文物进行检测,因此需要开发一种灵敏度好,特异性强的检测古代丝织品的方法存在着很重要的意义。
5.国内外报道的纺织品残留物的分析方法主要有化学降解法和生物质谱法等。然而,古代纺织品成分复杂,微小的成分变化就会导致质谱测定的较大误差,而且整个实验过程也必须经过残留物提取、酶切、质谱分析、结果分析等实验步骤,较为繁琐。因此,寻找一种灵敏度极高、特异性极强、快速高效的方法对纺织品残留物进行鉴定显得尤为重要。超级电容器的电极材料主要可分为碳材料、金属氧化物以及导电聚合物三大类。由于过渡金属氧化物及其水合物在电极/溶液界面发生的可逆法拉第赝电容远大于碳材料引起的双电层电容。将电容量计算与生物免疫检测相结合,极大地减少了背景信号的干扰。此外,因其设备简单、成本低廉、灵敏度高的优点而引起了人们的广泛关注。
6.
技术实现要素:
7.为了解决上述技术问题,本发明提供了一种基于nico2o4@ni-mof@mno2的丝素蛋白检测用柔性电容型免疫传感器。本发明首先进行丝素蛋白的提取,接着合成nico2o4纳米线和ni-mof,并使au-mofs上负载ab2,之后电化学沉积mno2,最后通过逐层自组装工艺,制备得到丝素蛋白检测用柔性电容型免疫传感器。本发明在柔性碳布集流器上制造了无添加剂和无粘结剂的nico2o4@ni-mof混合阵列电极,nico2o4纳米线碳布作为优秀的导电支架,而密切固定的ni-mof拥有大表面积以及丰富的孔隙率,这确保了良好的电子传递动力学;纳米结构的mno2以其价廉易得、低毒环保、具有较大的比表面积及较高的赝电容等特点显示出
了其作为电极材料的优势;制备具有自支撑特性的电极材料,既可以简化制备工艺、进一步提高赝电容材料的比例,又能增强其与基体之间的相互作用;聚多巴胺可以在碱性环境中由多巴胺自发聚合。本发明电容式生物传感器可以由生物识别表面和目标分析物之间的亲和相互作用而调节电容的变化,从而产生高灵敏度和选择性。
8.本发明的具体技术方案为:一种基于nico2o4@ni-mof@mno2的丝素蛋白检测用柔性电容型免疫传感器,制备方法包括以下步骤:步骤1:丝素蛋白的提取:将蚕茧先在na2co3水溶液中煮沸,再冲洗去除丝胶蛋白;将所得的丝素蛋白纤维在干燥后溶解于氯化钙混合溶液中;经透析、离心、冷冻干燥和研磨后,得到丝素蛋白。
9.步骤2:碳布活化处理:将浓硫酸与浓硝酸均匀混合,然后将碳布加入到所得混合溶液中,再加入高锰酸钾进行反应;反应结束后,加水继续反应;然后清洗,干燥,获得活化的碳布,备用。
10.本发明使用碳布(cc)作为柔性衬底,碳布耐高温、耐腐蚀,并且在酸性或碱性电解质中能够保持稳定,不易受腐蚀,是理想的柔性电极衬底。
11.步骤3:手风琴状ti3c2t
x
粉末的制备:将lif与hcl溶液混合,在冰水浴下搅拌,直到 lif完全溶解;将ti3alc2加入到所得混合溶液中,搅拌,进行刻蚀反应;将所得黑色悬浮液用水离心洗涤,真空干燥,得到手风琴状ti3c2t
x
粉末,备用。
12.步骤4:cc/ti3c2t
x
电极的制备:将ti3c2t
x
粉末超声分散于水中;将活化的碳布放置于热台上,将所得ti3c2t
x
悬浮液以滴涂的方法逐滴加入到碳布表面;将所得cc-ti3c2t
x
真空干燥,备用。
13.步骤5:nico2o4纳米线阵列的合成:将ni(no3)2·
6h2o、co(no3)2·
6h2o和co(nh2)2搅拌溶解于水中,然后转移至高压釜中;将步骤4所得cc/ti3c2t
x
作为基质浸泡在所得溶液中,加热反应;将所得产物用水洗涤,然后在马弗炉中加热,取出。
14.本发明在柔性碳布上制造了无添加剂和无粘结剂的nico2o4纳米线作为优秀的导电支架,而密切固定的ni-mof拥有大表面积以及丰富的孔隙率,这确保了良好的电子传递动力学。
15.步骤6:nico2o4@ni-mof核/壳混合阵列的合成:将ni(no3)2·
6h2o和对苯二甲酸分别溶解在n-n二甲基甲酰胺中,在不断搅拌下,将ni(no3)2溶液滴加入对苯二甲酸溶液中;将所得混合溶液以及cc/ti3c2t
x
/nico2o4保存在100-120℃的反应高压釜中;结束后反复冲洗,干燥,得到cc-ti3c2t
x-nico2o4@ni-mof电极。
16.考虑到传统高赝电容物质大部分用的都是粉末状原料,需要通过乙炔黑和粘结剂涂覆在基材上制备工作电极,这种电极材料内阻大,电化学性能较差。本发明制备具有自支撑特性的电极材料,既可以简化制备工艺、进一步提高赝电容材料的比例,又能增强其与基体之间的相互作用。
17.步骤7:nico2o4@ni-mof@mno2的制备:将c4h6mn o4•
4h2o和na2so4溶于水中,搅拌后制得前驱体溶液;采用三电极体系,将前驱体溶液倒入电解池中,以ag/agcl为参比电极,pt片为对电极,步骤6制备的电极为工作电极,插入至上述电解池中并充分浸润,在cc-ti3c2t
x-nico2o4@ni-mof电极上沉积进行沉积mno2;用水冲洗,干燥。
18.本发明mno2电极材料具有电位窗口宽(约为 1 v)、原料来源广泛、对环境较为友
善的特点,并且纳米结构的mno2以其价廉易得、低毒环保、具有较大的比表面积及较高的赝电容等特点显示出了其作为电极材料的优势。
19.步骤8:au-mofs@ab2的制备:将2,5-二氨基对苯二甲酸溶于n,n-二甲基甲酰胺中,搅拌后,所得产物清洗,真空干燥,得到mofs材料;然后加热搅拌,将mofs材料和氯金酸溶液混合,超声分散,干燥,焙烧,得到粉末状的au-mofs;最后向bsa溶液中加入au-mofs和兔抗鼠抗丝素蛋白抗体ab2,孵育后得到au-mofs@ab2。
20.本发明考虑到生物探针的结合位点通常有限,mofs作为一种高效负载材料,通过将金属纳米材料与具有大表面积的mofs功能材料相结合,可以克服单一纳米材料自身性质的局限。ab2可以通过au-s键被固定在au-mofs上面。
21.步骤9:逐层自组装电容型免疫传感器:在室温下将多巴胺tris-hcl溶液滴到步骤7所得电极上以聚集聚多巴胺;用pbs缓冲液清洗,滴加步骤1所得丝素蛋白的cb液,使其与聚多巴胺静电结合,用pbs缓冲液清洗去除未结合的抗原后;用bsa溶液将电极封闭,以封闭电极表面可能存在的非特异性结合位点;随后用pbs缓冲液清洗,继续滴加鼠抗丝素蛋白抗体ab1溶液,置于25-35℃下50-70 min,用pbs缓冲液清洗去除未固定的鼠抗丝素蛋白抗体ab1,最后滴加步骤7所得au-mofs@ab2,置于25-35℃中50-70 min,用pbs缓冲液洗净未固定的au-mofs@ab2,即得到丝素蛋白检测用柔性电容型免疫传感器。
22.聚多巴胺可以在碱性环境中由多巴胺自发聚合。 它在良好的生物相容性和丰富的表面官能团(儿茶酚和胺基)方面表现出卓越的性能,这使得聚多巴胺纳米材料在电化学分析和生物分析中具有重要的应用价值。 聚多巴胺不仅可以通过迈克尔反应与氨基末端的生物分子偶联,还可以通过静电结合物理吸附抗体。
23.空间位阻效应是一种重要的信号放大策略,因为大多数生物分子如蛋白质分子的导电性较差。因此当目标分子(主要为蛋白质分子)修饰到电极表面上时,会在电极表面产生空间位阻效应,从而阻碍电子的转移和传递,进而影响电化学响应。本发明构建间接型免疫传感器,不同于常规的夹心型免疫传感器。
24.作为优选,步骤1具体包括:将1-3 g家蚕茧在100-120 ml 0.3-0.7wt%的na2co3水溶液中煮沸30-40 min,然后用蒸馏水冲洗3-5次,以完全去除丝胶蛋白;将丝素蛋白纤维在50-60℃下干燥24-30 h;将干燥的丝素蛋白纤维在96-100℃的80-120 ml氯化钙混合溶液中溶解1.5-2 h;使用截留分子量为8000-10000的纤维素透析袋对溶解后的混合溶液进行透析10-15次,每隔3-4 h更换一次蒸馏水;然后以6000-8000 r/min进行离心处理,取上清液冷冻干燥2-3天,研磨,得到丝素蛋白;所述氯化钙混合溶液中氯化钙,乙醇和蒸馏水的摩尔比为1:(1.5-2.5):(7-8)。
25.作为优选,步骤2具体包括:按体积比1.5-2.5:1将浓硫酸与浓硝酸均匀混合,然后将碳布加入到所得混合溶液中,再加入1.8-2 g高锰酸钾,在40-50℃下反应2-4h;反应结束后,加50-60 ml水继续反应2-3 h;然后用乙醇、水依次超声清洗5-10 min,干燥,获得活化的碳布,备用。
26.作为优选,步骤3具体包括:将3.2g lif与35-40 ml 9 m的hcl溶液混合,在冰水浴下搅拌10-15 min,直到 lif完全溶解;将1-1.5g ti3alc2缓慢加入到所得混合溶液中,调节反应温度至40-50℃,在搅拌下充分刻蚀反应24-28 h;反应结束后,将所得黑色悬浮液用超纯水离心洗涤,直到溶液的ph>6;将产物在50-60℃下真空干燥8-10 h,得到手风琴状
ti3c2t
x
粉末,备用。
27.作为优选,步骤4具体包括:将80-120 mg ti3c2t
x
粉末超声分散于20 ml水中;将步骤2活化的碳布放置于90-100℃的热台上,将所得ti3c2t
x
悬浮液以滴涂的方法逐滴加入到碳布表面,直到碳布的负载量达到1-3mg;将所得cc-ti3c2t
x
在50-60℃下真空干燥10-15h,备用。
28.作为优选,步骤5具体包括:将0.25-0.35 g ni(no3)2·
6h2o、0.55-0.65 g co(no3)2·
6h2o和0.70-0.75 g co(nh2)2搅拌溶解于70-80 ml水中,然后转移至特氟隆内衬不锈钢高压釜中;将步骤4所得cc/ti3c2t
x
作为基质浸泡在所得溶液中,在110-120℃下持续加热5-6 h;将所得产物用水洗涤3-5次,然后在300-350℃的马弗炉中加热2-2.5 h,取出。
29.作为优选,步骤6具体包括:将0.14-0.18g ni(no3)2·
6h2o和0.03-0.04 g对苯二甲酸分别溶解在20-25 ml n-n二甲基甲酰胺中,在不断搅拌下,以0.2-0.4 ml/min的速率将ni(no3)2溶液滴加入对苯二甲酸溶液中;将所得混合溶液以及ito/zno@nico2o4器件保存在100-120℃的反应高压釜中3-24 h;结束后用乙醇和dmf反复冲洗4-6次,最后在60-80℃下干燥过夜,得到cc-ti3c2t
x-nico2o4@ni-mof电极。
30.作为优选,步骤7具体包括:将4.8-5.0g c4h6mn o4•
4h2o和2.5-3.0g na2so4溶于180-200 ml水中,搅拌10-20 min后制得前驱体溶液;采用三电极体系,将前驱体溶液倒入电解池中,以ag/agcl为参比电极,pt片为对电极,步骤6制备的电极为工作电极,插入至上述电解池中并充分浸润;设置沉积电位为0.8-1.0v,沉积时间为600-1800s;在cc-ti3c2t
x-nico2o4@ni-mof电极上沉积进行沉积mno2;用水冲洗,干燥。
31.作为优选,步骤8具体包括:称取1.4-2.8mmol 2,5-二氨基对苯二甲酸溶于25-35 ml的n,n-二甲基甲酰胺中,搅拌1-2h后,所得产物依次用无水乙醇和n,n-二甲基甲酰胺清洗,真空干燥,得到mofs材料;然后在70-80℃搅拌下,将mofs材料和氯金酸溶液混合,超声分散,干燥后焙烧,得到粉末状的au-mofs;最后向18-22 ml 0.01 g/ml的bsa溶液中加入au-mofs和8-12ul 兔抗鼠抗丝素蛋白抗体ab2,置于25-35℃保温箱孵育0.5-1.5 h,得到au-mofs@ab2。
32.作为优选,步骤9具体包括:在室温下将10-20
ꢀµ
l 2-4mg ml-1
多巴胺tris-hcl溶液滴到步骤7所得电极上1-1.5 h以聚集聚多巴胺;用pbs缓冲液清洗,滴加10-20 ul 1ul/ml步骤1所得丝素蛋白的cb液,使其与聚多巴胺静电结合,用pbs缓冲液清洗去除未结合的抗原后;用10-20ul的0.8-1.2wt%的bsa溶液将电极封闭25-35 min,以封闭电极表面可能存在的非特异性结合位点;随后用pbs缓冲液清洗,继续滴加10-20ul 1ul/ml鼠抗丝素蛋白抗体ab1溶液,置于25-35℃下50-70 min,用pbs缓冲液清洗去除未固定的鼠抗丝素蛋白抗体ab1,最后滴加10-20 ul步骤7所得au-mofs@ab2,置于25-35℃中50-70 min,用pbs缓冲液洗净未固定的au-mofs@ab2,即得到丝素蛋白检测用柔性电容型免疫传感器。
33.与现有技术相比,本发明具有以下技术效果:(1)本发明以碳布作为柔性衬底,耐高温、耐腐蚀,并且在酸性或碱性电解质中能够保持稳定,不易受腐蚀。
34.(2)本发明在柔性碳布上制造了无添加剂和无粘结剂的nico2o4纳米线作为优秀的导电支架,而密切固定的ni-mof拥有大表面积以及丰富的孔隙率,这确保了良好的电子传递动力学。
35.(3)考虑到通常情况下高赝电容物质大部分用的都是粉末状原料,需要通过乙炔黑和粘结剂涂覆在基材上制备工作电极,这种电极材料内阻大,电化学性能较差,而本发明制备具有自支撑特性的电极材料,既可以简化制备工艺、进一步提高赝电容材料的比例,又能增强其与基体之间的相互作用。
36.(4)本发明mno2电极材料具有电位窗口宽(约为 1 v)、原料来源广泛、对环境较为友善的特点,并且纳米结构的mno2以其价廉易得、低毒环保、具有较大的比表面积及较高的赝电容等特点显示出了其作为电极材料的优势。
37.(5)本发明考虑到生物探针的结合位点通常有限,mofs作为一种高效负载材料,通过将金属纳米材料与具有大表面积的mofs功能材料相结合,可以克服单一纳米材料自身性质的局限。ab2可以通过au-s键被固定在au-mofs上面。
38.(6)聚多巴胺可以在碱性环境中由多巴胺自发聚合。它在良好的生物相容性和丰富的表面官能团(儿茶酚和胺基)方面表现出卓越的性能,这使得聚多巴胺纳米材料在电化学分析和生物分析中具有重要的应用价值。 聚多巴胺不仅可以通过迈克尔反应与氨基末端的生物分子偶联,还可以通过静电结合物理吸附抗体。
39.(7)空间位阻效应是一种重要的信号放大策略,因为大多数生物分子如蛋白质分子的导电性较差,所以,当目标分子(主要为蛋白质分子)修饰到电极表面上时,会在电极表面产生空间位阻效应,从而阻碍电子的转移和传递,进而影响电化学响应。本发明构建间接型免疫传感器,不同于常规的夹心型免疫传感器。
40.附图说明
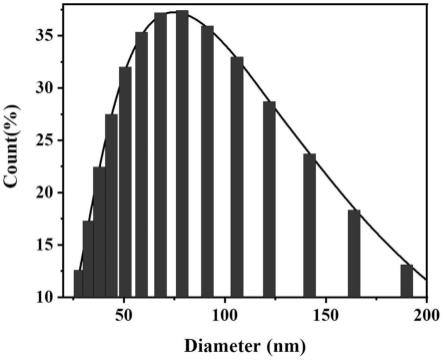
41.图1为实施例1所得au-mofs@ab2的粒径分布图。
42.具体实施方式
43.下面结合实施例对本发明作进一步的描述。
44.实施例1步骤1:丝素蛋白的提取:将1g家蚕茧在100 ml 0.5% na2co3水溶液中煮沸30 min,然后用蒸馏水冲洗3次,以完全去除丝胶蛋白;将脱胶的蚕丝纤维在50 ℃干燥箱中干燥24 h;将干燥的丝素蛋白纤维在98 ℃的100 ml氯化钙混合溶液中(氯化钙,乙醇和蒸馏水的摩尔比为1:2:8)溶解1.5 h;使用透析袋(截留分子量,mwco:8000)对溶解后的混合溶液进行10次透析,每隔3 h更换一次蒸馏水;使用离心机(6000 r/min)纯化获得的溶液;最后取上清液冷冻干燥,研磨,得到丝素蛋白;步骤2:碳布(cc)活化处理:将15 ml浓硫酸与浓硝酸(v1:v2=2:1)均匀混合在烧杯中,然后将0.3 g碳布 (1 cm
×
2 cm) 缓慢加入混合溶液中;再将1.8 g 高锰酸钾缓慢加入到上述溶液,40℃下反应 3 h;反应结束后,将50 ml去离子水加入烧杯中继续反应2 h;乙醇、去离子水依次超声清洗5 min,干燥,获得活化的碳布,备用;步骤3:手风琴状ti3c2t
x
粉末的制备:将3.2 g lif与 35 ml 9 m hcl 混合,在冰水浴下磁力搅拌10 min,直到 lif完全溶解;将1 g ti3alc2缓慢加入到上述混合溶液中,调
节反应温度至40℃,混合物在磁力搅拌下充分刻蚀24 h;反应结束后,将得到的黑色悬浮液用超纯水离心(6000 r/min)洗涤,重复5次,直到溶液的ph>6,将产物在 50℃下真空干燥 8 h得到手风琴状ti3c2t
x
粉末,备用;步骤4:cc/ti3c2t
x
电极的制备:将100 mg ti3c2t
x
粉末超声分散在 20 ml去离子水中,悬浮液的固含量为 5mg/ml;将步骤2活化后的碳布放置在热台上(热台温度 90℃),将ti3c2t
x
悬浮液以滴涂的方法逐滴加入到碳布表面,直到碳布的负载量达到 2mg;将制备好的cc-ti3c2t
x
在 50℃下真空干燥 12 h,备用;步骤5:nico2o4纳米线阵列的合成:将0.29 g ni(no3)2·
6h2o、0.58 g co(no3)2·
6h2o和0.72 g co(nh2)2搅拌溶解于70 ml去离子水中,然后转移到100 ml特氟隆内衬不锈钢高压釜中;将步骤4的cc/ti3c2t
x
器件作为基质浸泡在上述溶液中,在110℃的烘箱中持续加热5 h;将得到的样品用去离子水洗涤3次,然后在300℃的马弗炉中加热2 h,取出;步骤6:nico2o4@ni-mof核/壳混合阵列的合成:将0.16 g ni(no3)2·
6h2o和0.032 g对苯二甲酸(pta)分别溶解在25 ml n-n二甲基甲酰胺(dmf)溶液中,在不断搅拌下,将ni(no3)2溶液滴以0.3 ml/min的固定速率缓慢滴加入到对苯二甲酸溶液中;将上述混合溶液以及cc/ti3c2t
x
/nico2o4器件保存在100℃的反应高压釜中3 h;结束后用乙醇和dmf依次冲洗样品4次,最后在60℃下干燥过夜;步骤7:nico2o4@ni-mof@mno2的制备:称取4.90 g c4h6mn o4•
4h2o和2.84 g na2so4,溶于180 ml去离子水中,磁力搅拌10 min制备了0.1 m的前驱体溶液;采用三电极体系,将前驱体溶液倒入电解池中,ag/agcl为参比电极,pt片为对电极,步骤6制备的电极为工作电极,插入至上述电解池中并充分浸润;设置沉积电位为 0.9 v,沉积时间为600 s;在cc-ti3c2t
x-nico2o4@ni-mof电极上沉积进行沉积mno2;用去离子水将电极冲洗5次,置于烘箱中干燥 4 h;步骤8:au-mofs@ab2的制备:称取1.4 mmol 2,5-二氨基对苯二甲酸溶解于25 ml的n,n-二甲基甲酰胺中,搅拌1 h后,所得产物依次用无水乙醇和n,n-二甲基甲酰胺清洗,真空干燥,得到mofs材料;然后在70℃搅拌下,将mofs材料和氯金酸溶液混合,超声分散,干燥后焙烧,得到粉末状的au-mofs,最后向18 ml 0.01 g/ml的bsa溶液中加入au-mofs和8 兔抗鼠抗丝素蛋白抗体(ab2),置于25℃保温箱孵育0.5 h,得到au-mofs@ab2;步骤9:逐层自组装电容型免疫传感器:在室温下将约 10
ꢀµ
l 多巴胺 (3 mg ml-1
) tris-hcl 溶液 (2 m, ph 8.5) 滴到步骤7的电极上 1 h以聚集聚多巴胺 (pda);用pbs缓冲液清洗2次,滴加10 ul 1ul/ml的步骤1所得丝素蛋白的cb液,使其与pda静电结合,用pbs缓冲液清洗2次去除未结合的抗原后;用10 ul的0.8% bsa溶液在35℃下将电极封闭25 min,以封闭电极表面可能存在的非特异性结合位点;随后用pbs缓冲液清洗2次,继续滴加10 ul1ul/ml的鼠抗丝素蛋白抗体(ab1)溶液,置于25℃下50 min,用pbs缓冲液清洗2次去除未固定的ab1抗体,最后滴加10 ul步骤7所得au-mofs@ab2,置于25℃中50 min,用pbs缓冲液洗净未固定的au-mofs@ab2,即得到丝素蛋白检测用柔性电容型免疫传感器;步骤10:电化学测量:所有的电化学测量均以铂电极为对电极,以银/氯化银为参比电极的标准三电极系统中进行;采用chi660b电化学工作站对其电化学性能进行了表征,循环伏安法(cv)电压窗口为0-1v之间,扫描速率为10 mv/s;在20μa的不同电流下,测量0~1v电位范围内的静电整流充放电(gcd)试验;eis测量是在0.01hz-100khz的频率范围和开
路电位下进行的,交流扰动为5mv;根据实验数据计算质量比电容,超级电容器电极的质量比电容计算公式为cm= i
ꢀ×
δt/(m
×
δv),其中:i 为恒定电流;δt 为放电时间;m 为电极增加的总质量;δv 为放电过程中的电位差。
45.图1为实施例1所得au-mofs@ab2的粒径分布图。
46.实施例2步骤1:丝素蛋白的提取:将2 g家蚕茧在110 ml 0.5% na2co3水溶液中煮沸35 min,然后用蒸馏水冲洗4次,以完全去除丝胶蛋白;将脱胶的蚕丝纤维在55 ℃干燥箱中干燥27 h;将干燥的丝素蛋白纤维在98 ℃的100 ml氯化钙混合溶液中(氯化钙,乙醇和蒸馏水的摩尔比为1:2:8)溶解1.8 h;使用透析袋(截留分子量,mwco:8000)对溶解后的混合溶液进行13次透析,每隔3 h更换一次蒸馏水;使用离心机(7000 r/min)纯化获得的溶液;最后取上清液冷冻干燥,研磨,得到丝素蛋白;步骤2:碳布(cc)活化处理:将18 ml浓硫酸与浓硝酸(v1:v2=2:1)均匀混合在烧杯中,然后将0.3 g碳布 (1 cm
×
2 cm) 缓慢加入混合溶液中;再将1.9 g 高锰酸钾缓慢加入到上述溶液,45℃下反应 3 h;反应结束后,将55 ml去离子水加入烧杯中继续反应2 h;乙醇、去离子水依次超声清洗8 min,干燥,获得活化的碳布,备用;步骤3:手风琴状ti3c2t
x
粉末的制备:将3.2 g lif与 38 ml 9 m hcl 混合,在冰水浴下磁力搅拌12 min,直到 lif完全溶解;将1.3 g ti3alc2缓慢加入到上述混合溶液中,调节反应温度至45℃,混合物在磁力搅拌下充分刻蚀26 h;反应结束后,将得到的黑色悬浮液用超纯水离心(7000 r/min)洗涤,重复4次,直到溶液的ph>6,将产物在 55℃下真空干燥 9 h得到手风琴状ti3c2t
x
粉末,备用;步骤4:cc/ti3c2t
x
电极的制备:将100 mg ti3c2t
x
粉末超声分散在 20 ml去离子水中,悬浮液的固含量为 5mg/ml;将步骤2活化后的碳布放置在热台上(热台温度 95℃),将ti3c2t
x
悬浮液以滴涂的方法逐滴加入到碳布表面,直到碳布的负载量达到 2mg;将制备好的cc-ti3c2t
x
在 55℃下真空干燥 12 h,备用;步骤5:nico2o4纳米线阵列的合成:将0.29 g ni(no3)2·
6h2o、0.58 g co(no3)2·
6h2o和0.72 g co(nh2)2搅拌溶解于75 ml去离子水中,然后转移到100 ml特氟隆内衬不锈钢高压釜中;将步骤4的cc/ti3c2t
x
器件作为基质浸泡在上述溶液中,在115℃的烘箱中持续加热5.5 h;将得到的样品用去离子水洗涤4次,然后在330℃的马弗炉中加热2.3 h,取出;步骤6:nico2o4@ni-mof核/壳混合阵列的合成:将0.16 g ni(no3)2·
6h2o和0.032 g对苯二甲酸(pta)分别溶解在23 ml n-n二甲基甲酰胺(dmf)溶液中,在不断搅拌下,将ni(no3)2溶液滴以0.3 ml/min的固定速率缓慢滴加入到对苯二甲酸溶液中;将上述混合溶液以及cc/ti3c2t
x
/nico2o4器件保存在110℃的反应高压釜中12 h;结束后用乙醇和dmf依次冲洗样品5次,最后在70℃下干燥过夜;步骤7:nico2o4@ni-mof@mno2的制备:称取4.90 g c4h6mn o4•
4h2o和2.84 g na2so4,溶于190 ml去离子水中,磁力搅拌15 min制备了0.1 m的前驱体溶液;采用三电极体系,将前驱体溶液倒入电解池中,ag/agcl为参比电极,pt片为对电极,步骤6制备的电极为工作电极,插入至上述电解池中并充分浸润;设置沉积电位为 0.9 v,沉积时间为1200 s;在cc-ti3c2t
x-nico2o4@ni-mof电极上沉积进行沉积mno2;用去离子水将电极冲洗5次,置于烘箱中干燥 4.5h;
步骤8:au-mofs@ab2的制备:称取2 mmol 2,5-二氨基对苯二甲酸溶解于30 ml的n,n-二甲基甲酰胺中,搅拌1.5 h后,所得产物依次用无水乙醇和n,n-二甲基甲酰胺清洗,真空干燥,得到mofs材料;然后在75℃搅拌下,将mofs材料和氯金酸溶液混合,超声分散,干燥后焙烧,得到粉末状的au-mofs,最后向20 ml 0.01 g/ml的bsa溶液中加入au-mofs和10 ul 兔抗鼠抗丝素蛋白抗体(ab2),置于30℃保温箱孵育1 h,得到au-mofs@ab2;步骤9:逐层自组装电容型免疫传感器:在室温下将约 15
ꢀµ
l 多巴胺 (3 mg ml-1
) tris-hcl 溶液 (2 m, ph 8.5) 滴到步骤7的电极上 1.3 h以聚集聚多巴胺 (pda);用pbs缓冲液清洗2次,滴加15 ul 1ul/ml的步骤1所得丝素蛋白的cb液,使其与pda静电结合,用pbs缓冲液清洗2次去除未结合的抗原后;用15 ul的1.0% bsa溶液在35℃下将电极封闭30 min,以封闭电极表面可能存在的非特异性结合位点;随后用pbs缓冲液清洗2次,继续滴加15 ul1ul/ml的鼠抗丝素蛋白抗体(ab1)溶液,置于30℃下60 min,用pbs缓冲液清洗2次去除未固定的ab1抗体,最后滴加15 ul步骤7所得au-mofs@ab2,置于30℃中60 min,用pbs缓冲液洗净未固定的au-mofs@ab2,即得到丝素蛋白检测用柔性电容型免疫传感器;步骤10:电化学测量:所有的电化学测量均以铂电极为对电极,以银/氯化银为参比电极的标准三电极系统中进行;采用chi660b电化学工作站对其电化学性能进行了表征,循环伏安法(cv)电压窗口为0-1v之间,扫描速率为500mv/s;在40μa的不同电流下,测量0~1v电位范围内的静电整流充放电(gcd)试验;eis测0.01hz-100khz的频率范围和开路电位下进行的,交流扰动为5mv;根据实验数据计算质量比电容,超级电容器电极的质量比电容计算公式为cm= i
ꢀ×
δt/(m
×
δv),其中:i 为恒定电流;δt 为放电时间;m 为电极增加的总质量;δv 为放电过程中的电位差。
47.实施例3步骤1:丝素蛋白的提取:将3 g家蚕茧在120 ml 0.5% na2co3水溶液中煮沸40 min,然后用蒸馏水冲洗5次,以完全去除丝胶蛋白;将脱胶的蚕丝纤维在60 ℃干燥箱中干燥30 h;将干燥的丝素蛋白纤维在98 ℃的100 ml氯化钙混合溶液中(氯化钙,乙醇和蒸馏水的摩尔比为1:2:8)溶解2 h;使用透析袋(截留分子量,mwco:8000)对溶解后的混合溶液进行15次透析,每隔4 h更换一次蒸馏水;使用离心机(8000 r/min)纯化获得的溶液;最后取上清液冷冻干燥,研磨,得到丝素蛋白;步骤2:碳布(cc)活化处理:将20 ml浓硫酸与浓硝酸(v1:v2=2:1)均匀混合在烧杯中,然后将0.3 g碳布 (1 cm
×
2 cm) 缓慢加入混合溶液中;再将2 g 高锰酸钾缓慢加入到上述溶液,50℃下反应 3 h;反应结束后,将60 ml去离子水加入烧杯中继续反应3 h;乙醇、去离子水依次超声清洗10 min,干燥,获得活化的碳布,备用;步骤3:手风琴状ti3c2t
x
粉末的制备:将3.2 g lif与 40 ml 9 m hcl 混合,在冰水浴下磁力搅拌15 min,直到 lif完全溶解;将1.5 g ti3alc2缓慢加入到上述混合溶液中,调节反应温度至50℃,混合物在磁力搅拌下充分刻蚀28 h;反应结束后,将得到的黑色悬浮液用超纯水离心(8000 r/min)洗涤,重复5次,直到溶液的ph>6,将产物在 60℃下真空干燥 10 h得到手风琴状ti3c2t
x
粉末,备用;步骤4:cc/ti3c2t
x
电极的制备:将100 mg ti3c2t
x
粉末超声分散在 20 ml去离子水中,悬浮液的固含量为 5mg ml-1
;将步骤2活化后的碳布放置在热台上(热台温度 100℃),将ti3c2t
x
悬浮液以滴涂的方法逐滴加入到碳布表面,直到碳布的负载量达到 2mg;将制备
好的cc-ti3c2t
x
在 60℃下真空干燥 12 h,备用;步骤5:nico2o4纳米线阵列的合成:将0.29 g ni(no3)2·
6h2o、0.58 g co(no3)2·
6h2o和0.72 g co(nh2)2搅拌溶解于80 ml去离子水中,然后转移到100 ml特氟隆内衬不锈钢高压釜中;将步骤4的cc/ti3c2t
x
器件作为基质浸泡在上述溶液中,在120℃的烘箱中持续加热6 h;将得到的样品用去离子水洗涤5次,然后在350℃的马弗炉中加热2.5 h,取出;步骤6:nico2o4@ni-mof核/壳混合阵列的合成:将0.16 g ni(no3)2·
6h2o和0.032 g对苯二甲酸(pta)分别溶解在25 ml n-n二甲基甲酰胺(dmf)溶液中,在不断搅拌下,将ni(no3)2溶液滴以0.3 ml/min的固定速率缓慢滴加入到对苯二甲酸溶液中;将上述混合溶液以及cc/ti3c2t
x
/nico2o4器件保存在120℃的反应高压釜中24 h;结束后用乙醇和dmf依次冲洗样品6次,最后在80℃下干燥过夜;步骤7:nico2o4@ni-mof@mno2的制备:称取4.90 g c4h6mn o4•
4h2o和2.84 g na2so4,溶于200 ml去离子水中,磁力搅拌20 min制备了0.1 m的前驱体溶液;采用三电极体系,将前驱体溶液倒入电解池中,ag/agcl为参比电极,pt片为对电极,步骤6制备的电极为工作电极,插入至上述电解池中并充分浸润;设置沉积电位为 0.9 v,沉积时间为1800 s;在cc-ti3c2t
x-nico2o4@ni-mof电极上沉积进行沉积mno2;用去离子水将电极冲洗6次,置于烘箱中干燥 5h;步骤8:au-mofs@ab2的制备:称取2.8 mmol 2,5-二氨基对苯二甲酸溶解于35 ml的n,n-二甲基甲酰胺中,搅拌2 h后,所得产物依次用无水乙醇和n,n-二甲基甲酰胺清洗,真空干燥,得到mofs材料;然后在80℃搅拌下,将mofs材料和氯金酸溶液混合,超声分散,干燥后焙烧,得到粉末状的au-mofs,最后向20 ml 0.01 g ml-1
的bsa溶液中加入au-mofs和20 ul 兔抗鼠抗丝素蛋白抗体(ab2),置于35℃保温箱孵育1.5 h,得到au-mofs@ab2;步骤9:逐层自组装电容型免疫传感器:在室温下将约 20
ꢀµ
l 多巴胺 (3 mg ml-1
) tris-hcl 溶液 (2 m, ph 8.5) 滴到步骤7的电极上 1.5 h以聚集聚多巴(pda);用pbs缓冲液清洗3次,滴加20 ul 1ul/ml的步骤1所得丝素蛋白的cb液,使其与pda静电结合,用pbs缓冲液清洗3次去除未结合的抗原后;用20 ul的1.0% bsa溶液在40℃下将电极封闭35 min,以封闭电极表面可能存在的非特异性结合位点;随后用pbs缓冲液清洗3次,继续滴加20ul 1ul/ml的鼠抗丝素蛋白抗体(ab1)溶液,置于35℃下70 min,用pbs缓冲液清洗3次去除未固定的ab1抗体,最后滴加20 ul步骤7所得au-mofs@ab2,置于35℃中70 min,用pbs缓冲液洗净未固定的au-mofs@ab2,即得到丝素蛋白检测用柔性电容型免疫传感器;步骤10:电化学测量:所有的电化学测量均以铂电极为对电极,以银/氯化银为参比电极的标准三电极系统中进行;采用chi660b电化学工作站对其电化学性能进行了表征,循环伏安法(cv)电压窗口为0-1v之间,扫描速率为1000mv/s;在80μa的不同电流下,测量0~1v电位范围内的静电整流充放电(gcd)试验;eis测量是在0.01hz-100khz的频率范围和开路电位下进行的,交流扰动为5mv;根据实验数据计算质量比电容,超级电容器电极的质量比电容计算公式为cm= i
ꢀ×
δt/(m
×
δv),其中:i 为恒定电流;δt 为放电时间;m 为电极增加的总质量;δv 为放电过程中的电位差。
48.本发明中所用原料、设备,若无特别说明,均为本领域的常用原料、设备;本发明中所用方法,若无特别说明,均为本领域的常规方法。
49.以上所述,仅是本发明的较佳实施例,并非对本发明作任何限制,凡是根据本发明
技术实质对以上实施例所作的任何简单修改、变更以及等效变换,均仍属于本发明技术方案的保护范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。