1.本发明涉及一种中药的检测方法,具体涉及小柴胡胶囊成分的定量指纹图谱检测方法。
背景技术:
2.小柴胡胶囊是由柴胡、黄芩、甘草、党参、大枣、生姜、姜半夏七味药材通过煎煮、渗漉、浓缩等工艺精制而成的复方制剂,可用于外感病,邪犯少阳证,症见寒热往来、胸胁苦满、食欲不振、心烦喜呕、口苦咽干等。近年来,学术界对小柴胡制剂的研究呈现出逐年增加的趋势。2020版《中国药典》(一部)采用高效液相色谱法测定小柴胡胶囊中的黄芩苷含量用于其质量控制,同时采用柴胡、甘草、党参对照药材定性鉴别这三味药材。但是小柴胡胶囊由多种药材组成,仅仅依靠单一成分进行质量评价存在片面性。
3.目前对于小柴胡胶囊质控方法研究报道较少。指纹图谱是评价中药制剂的有效方法,采用适当数学方法处理指纹图谱的光谱或者色谱峰信息,就可以较好地反映中药整体质量,同时也可以用于反映中药制剂在生产中的量值传递规律。但目前也未见小柴胡胶囊的指纹图谱方法研究报道。所以总体来看,目前对小柴胡胶囊的质量检测方法研究仍十分欠缺。
技术实现要素:
4.本发明的主要目的是提供一种小柴胡胶囊成分的定量指纹图谱,该检测方法可以弥补现有分析方法对于药效成分质量控制的不足,从而更加全面地评价小柴胡胶囊的质量,对于控制小柴胡胶囊的质量和临床疗效有着重要作用。
5.为了实现上述目的,本发明采用以下技术方案:
6.本发明的目的之一:提供一种小柴胡胶囊成分的定量指纹图谱检测方法,所述的小柴胡胶囊包括以下药材:柴胡、黄芩、甘草、党参、大枣、生姜、姜半夏。所述的指纹图谱检测方法,包括以下步骤:
7.(1)对照品混合溶液以及供试品溶液的制备:
8.对照品混合溶液的制备:精密称定尿苷、腺嘌呤、5-羟甲基糠醛、鸟苷这四种成分作为对照品,置于容量瓶中,用5%甲醇溶液定容至刻度,摇匀,制成含46.04μg/ml尿苷、9.07μg/ml腺嘌呤、18.04μg/ml5-羟甲基糠醛、13.72μg/ml鸟苷组成的对照品混合溶液。
9.供试品溶液的制备:取小柴胡胶囊内容物于研钵中,研碎,精密称定,置于25ml容量瓶中,精密加入5%甲醇溶液,在室温下超声处理30min,放冷至室温,摇匀,离心,过0.22μm滤膜滤过,取续滤液,即得。
10.(2)超高效液相色谱测定
11.将步骤(1)中的对照品混合溶液和供试品溶液注入液相色谱分析测定,仪器为:waters acquity uplc超高效液相色谱仪;色谱条件为:色谱柱:waters acquity uplc hss t3色谱柱(100mm
×
2.1mm,1.8μm);以纯水作为流动相进行等度洗脱;洗脱方式:0-20min,水
100%;流量:0.25ml/min;柱温:26℃;检测波长:260nm~262nm,进样体积为1μl~3μl。
12.(3)建立定量指纹图谱并进行质量评价
13.取10个不同批次小柴胡胶囊按照步骤(1)方法制备得到10个不同批次的供试品溶液,按照步骤(2)进行高效液相色谱分析,记录色谱图;根据10个不同批次的色谱图,以不同批次共有的色谱峰确定共有峰。同时通过建立的指纹图谱相似度以及测定的四种成分含量对小柴胡胶囊进行质量评价。
14.优选的,步骤(2)中的检测波长为260nm,在该检测波长下,色谱峰分离较好,基线较为平稳,峰面积较大响应较好。
15.优选的,步骤(2)中的进样体积为3μl,在该进样体积下,峰面积较大响应较好。
16.优选的,步骤(3)中的定量检测指标为:尿苷、腺嘌呤、5-羟甲基糠醛、鸟苷。在本发明的检测条件下,上述四种成分可以充分分离。
17.优选的,步骤(3)中的共有峰数量为7。
18.本发明的目的之二:提供一种小柴胡胶囊成分的含量测定的方法。
19.色谱条件如下:仪器:waters acquity uplc超高效液相色谱仪;色谱柱:waters acquity uplc hss t3色谱柱(100mm
×
2.1mm,1.8μm);以纯水作为流动相进行等度洗脱;洗脱方式:0-20min,水100%;流量:0.25ml/min;柱温:26℃;检测波长:260nm,进样体积为3μl。
20.精密称定尿苷、腺嘌呤、5-羟甲基糠醛、鸟苷对照品适量,分别加5%甲醇稀释成不同浓度的溶液,注入超高效液相色谱进行分析,以各个化合物的浓度为横坐标,峰面积为纵坐标,绘制标准曲线,计算回归方程,计算不同批次样品中的指标成分含量。
21.本发明的目的之三:提供一种小柴胡胶囊成分的定量指纹图谱在小柴胡胶囊质量控制中的应用。
22.将10个批次的小柴胡胶囊的供试品溶液的色谱图导入“中药色谱指纹图谱相似度评价系统”(国家药典委员会2012版),生成对照指纹图谱,将不同批次的小柴胡胶囊的供试品溶液导入相似度评价软件,计算相似度,对相似度低于0.9的批次,认为质量差异较大,不建议放行。
23.对四种定量含量测定的成分设定含量下限形成企业内控标准,具体为:尿苷不低于200μg/g,腺嘌呤不低于10μg/g,5-羟甲基糠醛不低于100μg/g,鸟苷不低于20μg/g。低于下限的批次,认为其质量存在异常,不建议放行。
24.本发明的有益效果为:
25.本发明首次建立了小柴胡胶囊中四种强极性成分的定量指纹图谱,填补了现有方法对强极性成分控制不足的空白,所述的定量指纹图谱可用于全面评价小柴胡胶囊的质量。在本发明方法中,尿苷、腺嘌呤、鸟苷这三种成分与小柴胡胶囊治疗流行性感冒以及病毒性肝炎等临床治疗作用有着密切的关系,作为药效成分,对其进行较为全面的质量控制是十分必要的;且通过建立包括尿苷、腺嘌呤、鸟苷含量的指纹图谱,可以在色谱图中体现出姜半夏和大枣的部分质量信息;5-羟甲基糠醛的来源为糖类受热降解,故其可以体现药物在制药工艺中物料受热情况,所以也能从侧面体现出小柴胡胶囊的生产加工信息。
26.本发明创造性地采用水作为流动相,相比于传统的有机相与水结合的梯度洗脱方式,更有助于对小柴胡胶囊中水溶性的强极性成分进行检测和质量控制,同时用纯水作为
流动相,在进行仪器操作时更加简单。
附图说明
27.构成本发明的一部分的说明书附图用来提供对本发明的进一步理解,本发明的示意性实施例及其说明用来解释本发明,不构成对于本发明的不当限定。
28.图1(a)、(b)和(c)分别为小柴胡胶囊样品强极性成分部分化合物的uplc-q-tof-ms正、负离子下的总离子流图、uplc-uv色谱图。
29.图2为混合对照品(a)和样品(b)的色谱。
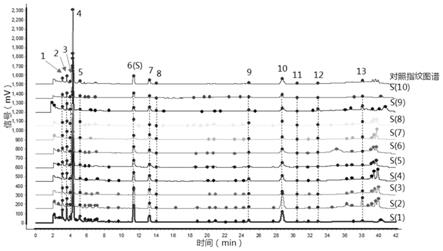
30.图3为10批小柴胡胶囊强极性成分uplc指纹图谱。
具体实施方式
31.应该指出,以下详细说明都是示例性的,旨在对本发明提供进一步的说明。除非另有指明,本文使用的所有技术和科学术语具有与本发明所属技术领域的普通技术人员通常理解的相同含义。
32.需要注意的是,这里所使用的术语仅是为了描述具体实施方式,而非意图限制根据本发明的示例性实施方式。此外,还应当理解的是,当在本说明书中使用术语“包含”和/或“包括”时,其指明存在特征、步骤、操作和/或它们的组合。
33.1.实验仪器与材料
34.1.1仪器
35.waters acquity uplc超高效液相色谱仪,配置acquity pda检测器、在线脱气机、四元泵、自动进样器、柱温箱以及waters色谱工作站(empower 3.0版)。uplc-q-tof-ms分析系统:超高液相色谱仪(waters acquity ultra型,美国waters公司)串联飞行时间质谱仪(triple tof 5600
型,美国abs sciex公司),带有analyst tf软件(version 1.6)采集数据,peak view软件(version 1.2)处理数据;色谱柱为waters acquity uplc hss t3色谱柱(100mm
×
2.1mm,1.8μm)。电子天平(ab204-n,mettler toledo公司)。小型高速离心机(ab204-n,mettler toledo公司)。指纹图谱相似度评价软件为“中药色谱指纹图谱相似度评价系统”(国家药典委员会2012版)。
36.1.2试剂
37.乙腈(色谱纯,德国merck公司),甲醇(色谱纯,德国merck公司),无水乙醇(批号:20200710,永华化学股份有限公司),水为mili-q超纯水。
38.尿苷对照品(纯度98%,上海旭硕生物科技有限公司,批号:dc17812),腺嘌呤对照品(纯度≥98%,上海旭硕生物科技有限公司,批号:dc14933),5-羟甲基糠醛对照品(纯度≥98%,上海旭硕生物科技有限公司,批号:dc13141),鸟苷对照品(纯度98%,上海旭硕生物科技有限公司,批号:dc17810)。采集了11批小柴胡胶囊,批号见表1。
39.表1小柴胡胶囊的批号和编号信息
[0040][0041]
2.实验条件
[0042]
2.1对照品混合溶液的制备
[0043]
对照品混合溶液的制备:精密称定尿苷、腺嘌呤、5-羟甲基糠醛、鸟苷对照品,置于容量瓶中,用5%甲醇溶液定容至刻度,摇匀,制成含46.04μg/ml尿苷、9.07μg/ml腺嘌呤、18.04μg/ml5-羟甲基糠醛、13.72μg/ml鸟苷组成的对照品混合溶液。
[0044]
2.2供试品的制备
[0045]
供试品的制备:精密称定2.4g小柴胡胶囊内容物,用5%甲醇定容至25ml容量瓶,超声30min,摇匀,12000rpm离心10min,过0.22μm滤膜后取续滤液进样分析。
[0046]
2.3色谱条件
[0047]
色谱条件为:色谱柱:waters acquity uplc hss t3色谱柱(100mm
×
2.1mm,1.8μm);以纯水作为流动相进行等度洗脱;洗脱方式:0-20min,水100%;流量:0.25ml/min;柱温:26℃;检测波长:260nm,进样体积为3μl。
[0048]
2.4 lc-q-tof-q-ms(液相色谱-三重四极杆-飞行时间质谱)条件
[0049]
以上述的液相色谱分析条件作为高分辨质谱分析的色谱条件。
[0050]
质谱条件如下:采用正负离子扫描模式;扫描范围:m/z 100-1500;雾化气(gs1):55psi;雾化气(gs2):55psi;气帘气(cur):35psi;离子源温度(tem):600℃(正)550℃(负);离子源电压(is):-4500v(负)5500v(正);一级扫描:去簇电压(dp):100v;聚焦电压(ce):10v;二级扫描:使用tof ms~product ion~ida模式采集质谱数据,cid能量为
±
40
±
20ev,进样前,用cds泵做质量轴校正,使质量轴误差小于2ppm。
[0051]
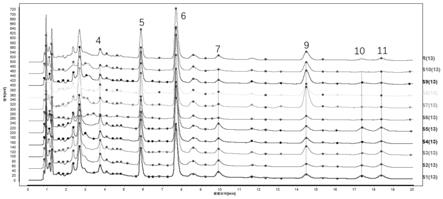
确定分析方法后,用高分辨质谱检测样品,得到样品的总离子流图。根据高分辨质谱得到的准确相对分子质量和二级质谱的裂解碎片信息,初步推测了其中的11个色谱峰的化学成分,结果见表2。
[0052]
表2小柴胡胶囊样品强极性成分部分化合物的uplc-q-tof-ms分析
[0053]
[0054]
[0055][0056]
*表示经与对照品比对确定的成分
[0057]
3.方法学验证
[0058]
3.1指纹图谱的方法学验证
[0059]
3.1.1实验方法
[0060]
指纹图谱的方法学验证主要包括进样精密度、重复性和样品稳定性考察。
[0061]
进样精密度实验:取同一份供试品溶液,连续进样6次。选择一个参照峰,分别计算各共有峰与参照峰的保留时间与峰面积的比值,得到各共有峰相对保留时间和相对峰面积的rsd(相对标准偏差)值。
[0062]
方法重复性实验:取六份平行制备的供试品溶液,分别进样分析。选择一个参照峰,分别计算各共有峰与参照峰的保留时间与峰面积的比值,得到各共有峰相对保留时间和相对峰面积的rsd值。
[0063]
样品稳定性实验:取同一份供试品溶液,于0,3,6,9,12,18,24h进样分析,选择一个参照峰,分别计算各共有峰与参照峰的保留时间与峰面积的比值,得到各共有峰相对保留时间和相对峰面积的rsd值。
[0064]
3.2.2实验结果
[0065]
测定了编号为s1-s10不同批次的小柴胡胶囊,在该条件下确定了7个共有峰,由于尿苷(5号峰)峰面积相对较大,且与相邻色谱峰的分离度较好,将其定为参照峰,分别计算进样精密度、重复性和样品稳定性实验项下各个色谱峰的相对保留时间的平均值和rsd值,结果见表3和4。在进样精密度和重复性条件下。各个色谱峰的相对保留时间和相对保留峰面积的rsd值均小于3%,符合指纹图谱要求。稳定性实验条件下,各个色谱峰的相对保留时间和相对保留峰面积的的rsd值均小于5%,说明供试品溶液在24h内稳定。
[0066]
表3进样精密度、重复性和样品稳定性实验各峰相对保留时间结果
[0067]
[0068][0069]
表4进样精密度、重复性和样品稳定性实验各峰相对峰面积结果
[0070][0071]
3.2含量测定方法学验证
[0072]
3.2.1实验方法
[0073]
该分析方法也适用于小柴胡胶囊中强极性类成分的含量测定,方法学验证包括各含量测定成分的线性、精密度、稳定性、重复性和加样回收实验的考察。
[0074]
线性考察:取系列不同浓度的对照品混合溶液,分别进样3μl分析。以各成分测定的峰面积为纵坐标,浓度为横坐标制作标准曲线,得到线性回归方程与分析范围。根据峰信噪比约为3:1与10:1时各成分的浓度分别确定检测限与定量限。
[0075]
进样精密度实验:取同一份供试品溶液以及与供试品溶液浓度相同的对照品溶液,连续进样6次,计算得到各成分峰面积以及保留时间的rsd值。
[0076]
重复性实验:取六份平行制备的供试品溶液,分别进样分析,计算得到各成分含量的rsd值。
[0077]
溶液稳定性实验:取同一份供试品溶液以及与其浓度相同的对照品混合溶液,于0,3,6,9,12,18,24h进样分析,计算得到各个成分含量的rsd值。
[0078]
加样回收实验:分别取已知含量的样品溶液9份,分为3组。设高、中、低三个浓度水平,控制对照品加入量与供试品中待测成分量之比分别在1.5:1.0,1.0:1.0,0.5:1.0左右,
每种浓度平行制备3份供试品溶液进行测定。精密加入1.2g样品与适量混合对照品贮备液,用5%甲醇定容至25ml,超声30min后,摇匀,离心,过0.22μm滤膜后取续滤液进样分析。
[0079]
3.2.2实验结果
[0080]
结合对照品比对,鉴定了5号、7号、9号和10号峰分别为尿苷、腺嘌呤、5-羟甲基糠醛和鸟苷。也最终确定了将这4个成分作为含量测定成分。
[0081]
尿苷、腺嘌呤、5-羟甲基糠醛、鸟苷的回归方程、线性范围以及检测限、定量限结果见表5,进样精密度实验结果见表6和表7,重复性实验结果见表8,溶液稳定性实验结果见表9,其中精密度、重复性、稳定性rsd均小于5%,符合中国药典的要求,说明该方法线性良好,且供试品溶液在24h内稳定。加样回收实验结果见表10,各成分平均回收率均满足要求,且rsd值均小于5%,证明该优化得到的方法准确可靠,可用于小柴胡胶囊中四种强极性成分的含量测定。
[0082]
表5各成分的回归方程、相关系数和线性分析范围
[0083][0084]
表6峰面积的进样精密度结果
[0085][0086]
表7保留时间的进样精密度结果
[0087]
[0088][0089]
表8重复性实验结果
[0090][0091]
表9溶液稳定性实验结果
[0092]
[0093][0094]
表10加样回收实验结果
[0095][0096]
3.3样品含量测定结果及质控示例
[0097]
11批供试品溶液的定量成分含量测定结果见表11。各个批次小柴胡胶囊中中尿苷含量在270.3~482.3μg/g,腺嘌呤含量在19.0~75.9μg/g,5-羟甲基糠醛含量在121.2~506.1μg/g,鸟苷含量均低于157.3μg/g,相差较大。其中,尿苷含量最高,腺嘌呤含量最低。
[0098]
根据上文设定的企业内控标准,发现s6、s8、s9、s11批次的鸟苷含量低于设定的20μg/g的标准,认为不符合内控标准,不建议放行。
[0099]
表11 11批供试品溶液定量成分含量测定结果
[0100][0101]
注:“0”表示该成分含量低于定量限
[0102]
3.4指纹图谱相似度评价及质控示例
[0103]
将10批正常批次(s1-s10)小柴胡胶囊的供试品的原始图谱数据导入中药色谱指纹图谱相似度评价系统软件,并生成对照谱图,如图3所示。将各供试品与对照谱图进行比较,相似度结果见表12。由表可知,各供试品指纹图谱与对照谱图的相似度均在0.90以上,各批次的小柴胡胶囊强极性成分具有较好的质量一致性。
[0104]
表12 10批正常批次小柴胡胶囊供试品溶液指纹图谱的相似度评价结果
[0105][0106][0107]
取另一新批次s11的样品与对照指纹图谱比对,计算所得相似度为0.676,相似度低于0.9,认为该批次小柴胡胶囊的质量与正常批次相差较大,建议不予放行。
[0108]
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式都包含在本发明的保护范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。