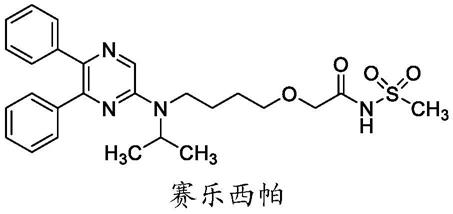
包含赛乐西帕的药物组合物
1.本发明涉及包含2-{4-[n-(5,6-二苯基吡嗪-2-基)-n-异丙基氨基]丁氧基}-n-(甲磺酰基)乙酰胺(赛乐西帕(selexipag)、ns-304、act-293987;下文中称为化合物)的药物组合物,这些药物组合物适用于口服施用(p.o.)。
[0002][0003]
赛乐西帕及其活性代谢物2-(4-((5,6二苯基吡嗪-2-基)(异丙基)氨基)丁氧基)乙酸(mre-269,act-333679)的制备和药用使用在以下文献中有所描述:wo2002/088084;wo2009/157396;wo2009/107736;wo2009/154246;wo2009/157397;wo2009/157398;wo2010/150865;wo2011/024874;nakamura等人,bioorg med chem(2007),15,7720-7725;kuwano等人,j pharmacol exp ther(2007),322(3),1181-1188;kuwano等人,j pharmacol exp ther(2008),326(3),691-699;o.sitbon等人,n engl j med(2015),373,2522-33;asaki等人,bioorg med chem(2007),15,6692-6704;asaki等人,j.med.chem.(2015),58,7128-7137。某些制剂公开于wo2013/024051、wo2014/069401和wo2018/162527中。
[0004]
赛乐西帕显示有益于治疗成人肺动脉高压。在iii期临床试验中,在肺动脉高压患者中,接受赛乐西帕的患者的与肺动脉高压有关的死亡或并发症的主要复合终点的风险显著低于接受安慰剂的患者。赛乐西帕例如在美国获得了市场批准,并且被指示用于治疗肺动脉高压(pah,who i组)以延迟疾病进展并降低因pah住院的风险。
[0005]
赛乐西帕被认为起前药的作用(同时保留自身对ip受体的某些激动活性),该前药可在哺乳动物尤其是人体内发挥活性代谢物2-(4-((5,6-二苯基吡嗪-2-基)(异丙基)氨基)丁氧基)乙酸的长效选择性ip受体激动剂活性。赛乐西帕的体内代谢可以有效地充当一类“缓释机制”,这类机制有可能延长活性并且减少与高浓度pgi2激动剂相关联的典型副作用(kuwano等人,j pharmacol exp ther(2007),322(3),1181-1188)。
[0006]
与pgi2激动剂相关联的副作用还通过特定的增加剂量(up-titration)安排来解决。成人口服赛乐西帕的推荐起始剂量为给予200微克每天两次。然后,剂量以200微克每天两次的增量,通常以一周为间隔,增加至高达1600微克每天两次的最高耐受剂量。如果患者不能达到耐受剂量,那么应将剂量降低至先前的耐受剂量。
[0007]
赛乐西帕是选择性ip受体激动剂,用于口服用,在患有pah的成人中具有经验证的有效性和安全性。迄今为止,赛乐西帕是全球唯一获批用于who fc ii-iii长期治疗的ip受体激动剂,并且在由于疾病控制不足而需要额外治疗的成年患者中,主要与目前的一线口服pah特异性药物联合使用。赛乐西帕代表这些患者的重要额外治疗选项。
[0008]
赛乐西帕是一种用于口服用的高选择性ip受体激动剂,并且在添加治疗中对pah疾病结果具有明显的益处,其可用性为在pah疾病的医学适当阶段启动前列环素途径治疗
提供了重要依据,而不会对患者的生活方式产生重大影响。
[0009]
儿科pah是一种与相当大的发病率和死亡率相关联的罕见的进行性疾病。儿科群体中的当前治疗推荐包括pde-5抑制剂、era和吸入、皮下和静脉内(i.v.)前列环素途径激动剂。然而,由于缺乏能够证明这些疗法在儿科患者中的有效性的随机对照临床试验,治疗算法是基于成人研究的证据。已经对塞西帕的成人和儿科剂量强度进行了生物比较研究(m.boehler等人,eur j drug metab pharmacokinet.2018feb;43(1):115-120.doi:10.1007/s13318-017-0424-z)。
[0010]
肝损伤患者或经历与cyp 2c8抑制剂发生药物-药物相互作用的患者也可能受益于对其病症的剂量适应。优选地,这些患者是成人。
[0011]
此外,不耐受200mcg的起始剂量的患者可以从新剂量中获益。
[0012]
因此,需要开发可以改善儿科患者或肝损伤患者或经历与cyp 2c8抑制剂发生药物-药物相互作用的患者(均患有pah和其他疾病)的疾病的治疗。此外,应允许根据体重给药。此外,治疗应该以儿童友好的形式进行,如迷你片剂。
[0013]
本发明提供了一种用于治疗患有例如pah的儿科患者的方法,该方法对例如≥2至《6岁、≥6至《12岁以及≥12至《18岁等不同年龄段的儿童均有效且安全。
[0014]
此外,本发明提供了一种用于治疗患有例如pah的患者的方法,这些患者患有肝损伤或经历与cyp 2c8抑制剂发生药物-药物相互作用。
[0015]
1)第一实施方案涉及一种药物组合物,该药物组合物包含80mcg至170mcg的量的式(i)的化合物
[0016][0017]
或其药学上可接受的盐、溶剂化物、水合物或形态学形式。
[0018]
由此,缩写“mcg”代表微克,即1
×
10-6
克。
[0019]
在优选的实施方案中,药物组合物包含80mcg至160mcg的量,更优选90mcg至110mcg和140mcg至160mcg的量,并且最优选93mcg至107mcg和143mcg至157mcg的量的式(i)的化合物,例如100mcg,公差为
±
7%和150mcg,公差为
±
7%。由此,将该公差应用于一组20个片剂。
[0020]
优选地,式(i)的化合物,即结晶形式、尤其基本上纯的结晶形式(优选地如wo2010/150865/ep2447254中所公开的基本上纯的结晶形式i或基本上纯的结晶形式ii)的化合物2-{4-[n-(5,6-二苯基吡嗪-2-基)-n-异丙基氨基]丁氧基}-n-(甲磺酰基)乙酰胺,用于制备所述组合物。
[0021]
2)另一个实施方案涉及根据实施方案1)所述的组合物,该组合物还包含选自由以下组成的组的中一种或多种:
[0022]
a)填料;
[0023]
b)崩解剂;
[0024]
c)粘结剂;和
[0025]
d)润滑剂。
[0026]
填料,也称为膨胀剂或稀释剂,具有若干功能,例如稀释药物组合物内的活性成分,它们可以确保长期稳定或可以赋予治疗增强作用,如促进药物吸收或提高溶解度。它们也可用于制造过程,以有助于处理活性物质。
[0027]
崩解剂在湿润时膨胀,导致片剂破裂,例如在消化过程的特定环节中,释放活性成分以供吸收。
[0028]
粘结剂将片剂中的成分保持在一起。它们确保片剂和颗粒剂可以形成所需的机械强度。
[0029]
润滑剂防止成分团聚在一起并且粘附到片剂冲头或胶囊填充机上。润滑剂还确保可以固体和模壁之间的低摩擦发生片剂形成和喷射。
[0030]
3)另一个实施方案涉及根据实施方案2)所述的药物组合物,其中
[0031]-如果存在填料的话,则所述填料是选自由以下组成的组中的一种或多种:d-甘露糖醇、玉米淀粉、乳糖、预胶凝化淀粉、二水合磷酸氢二钙(cahpo4
·
2h2o)、微晶纤维素和麦芽糖糊精;优选的填料是d-甘露糖醇和玉米淀粉;
[0032]-如果存在崩解剂的话,则所述崩解剂是选自由以下组成的组中的一种或多种:低取代的羟丙基纤维素、交联羧甲基纤维素钠、羟基乙酸淀粉钠和交联聚乙烯吡咯烷酮;优选的崩解剂是低取代的羟丙基纤维素;
[0033]-如果存在粘结剂的话,则所述粘结剂是选自由以下组成的组中的一种或多种:羟丙基纤维素、蔗糖、明胶、淀粉、预胶凝化淀粉、藻酸、藻酸钠、甲基纤维素、乙基纤维素、羟丙基甲基纤维素、聚乙烯吡咯烷酮、羧甲基纤维素钙、羧甲基纤维素钠、瓜尔胶、粘土、离子交换树脂和硅酸钙;优选的粘结剂是羟丙基纤维素;
[0034]-如果存在润滑剂的话,则所述润滑剂是选自由以下组成的组中的一种或多种:硬脂酸镁、硬脂酸铝、硬脂酸钙、硬脂酸、硬脂富马酸钠、滑石、苯甲酸钠、甘油单脂肪酸、聚乙二醇、氢化棉籽油、蓖麻籽油、蔗糖酯、硅酸钙和二氧化硅;优选的润滑剂是硬脂酸镁。
[0035]
所有列出的赋形剂都是可商购的并且为本领域技术人员所熟知。
[0036]
优选的崩解剂是低取代的羟丙基纤维素(l-hpc)。iupac名称:纤维素,2-羟丙基醚(低取代的)。特别优选的是具有7%至13%,特别是约10%至13%的羟基丙氧基含量的l-hpc(根据usp/nf方法)。
[0037]
优选的粘结剂是羟丙基纤维素(hpc),其由于纤维素主链中的大量羟基丙氧基基团而可溶于水。iupac名称:纤维素,2-羟丙基醚。特别优选的是20℃下2%水溶液中的粘度(mpa*s)为2.0至6.0,优选地为2.0至5.9,特别优选地为2.0至2.9。分子量(gpc方法)优选地为34000至110000,更优选地为40000至100000,最优选地为40000(
±
15%,优选地
±
10%)。
[0038]
对于本文提及的这些和其它药学上可接受的赋形剂和程序,参考关于该主题的大量文献,参见例如r.c.rowe,p.j.seskey,s.c.owen,handbook of pharmaceutical excipients,第5版(和第6版)pharmaceutical press 2006;remington,the science and practice of pharmacy,第21版(2005),第5部分,“制药制造(pharmaceutical manufacturing)”[由lippincott williams&wilkins公开]。此外,参考shin-etsu chemical co.,ltd的宣传册,纤维素和药用辅料部,05.8/1000。
[0039]
4)另一个实施方案涉及根据实施方案1)至实施方案3)中任一项所述的药物组合
物,该药物组合物包含:
[0040]-d-甘露糖醇和玉米淀粉;
[0041]-低取代的羟丙基纤维素;
[0042]-羟丙基纤维素;和
[0043]-硬脂酸镁。
[0044]
5)另一个实施方案涉及根据实施方案2)至实施方案4)中任一项所述的药物组合物,其中
[0045]
(i)填料以11.5mg至145.0mg,优选12.0mg至45.0mg,例如12.0mg至35.0mg的量被包含;
[0046]
(ii)崩解剂以0.6mg至8.5mg,优选0.6mg至2.5mg,例如0.7mg至2.0mg的量被包含;
[0047]
(iii)粘结剂以0.5mg至6.5mg,优选0.5mg至2.0mg,例如0.5mg至1.5mg的量被包含;并且
[0048]
(iv)润滑剂以0.2mg至2.5mg,优选0.2mg至0.7mg,例如0.2mg至0.5mg的量被包含。
[0049]
6)另一个实施方案涉及根据实施方案1)至实施方案5)中任一项所述的药物组合物,该药物组合物包含:
[0050]-7.0mg至90.0mg,优选7.0mg至25.0mg,例如7.0mg至20mg的量的d-甘露糖醇;
[0051]-4.5mg至60.0mg,优选4.5mg至20.0mg,例如4.5mg至15.0mg的量的玉米淀粉;
[0052]-0.6mg至9.0mg,优选0.6mg至3.0mg,例如0.7mg至1.8mg的量的低取代的羟丙基纤维素;
[0053]-0.5mg至6.5mg,优选0.5mg至2.0mg,例如0.5至1.5mg的量的羟丙基纤维素;以及
[0054]-硬脂酸镁以0.2mg至2.5mg,优选0.2mg至0.7mg,例如0.2mg至0.5mg的量被包含。
[0055]
7)根据实施方案1)至实施方案6)中任一项所述的药物组合物,该药物组合物为片剂或胶囊的形式。优选地,药物组合物为片剂的形式。
[0056]
片剂的形状可以变化,并且为例如圆形、椭圆形、长方形、圆筒形、三叶草形或任何其它合适的形状。优选地,片剂为圆形的。
[0057]
可被使用的程序可以是常规的或本领域已知的,或者基于此类程序,例如l.lachman等人,《工业药学理论与实践》,第3版,1986;h.sucker等人,pharmazeutische technologie,thieme,1991;《哈格斯的医药实践手册》,第4版(施普林格出版社,1971)和《雷明顿药物科学》,第13版,(mack publ.,co.,1970)或以后的版本。
[0058]
8)另一个实施方案涉及根据实施方案7)所述的药物组合物,其中该片剂被包衣,包衣材料包含选自由以下组成的组中的一种或多种:增塑剂、成膜剂和颜料。
[0059]
优选地,片剂是膜包衣的。
[0060]
成膜剂的示例是羟丙甲纤维素、邻苯二甲酸乙酸纤维素(cap)、丙烯酸酯聚合物、邻苯二甲酸羟丙基甲基纤维素(hpmcp)或邻苯二甲酸聚乙酸乙烯酯(pvap)。应注意,本列表不是限制性的。优选的成膜剂是羟丙甲纤维素(inn),也称为羟丙基甲基纤维素(hpmc)。
[0061]
将增塑剂添加到用作成膜剂的聚合物中,以使聚合物柔韧且柔软,从而增强膜的柔韧性和塑性。它们在胃滞留膜、眼膜、透皮膜、口腔膜、口腔分散膜等配方中发挥着至关重要的作用,并添加到这些产品中以降低玻璃化转变温度,从而促进药物和其它成分的热稳定性。
[0062]
优选地,增塑剂是亲水性增塑剂。亲水性增塑剂的示例是甘油、聚乙二醇、聚乙二醇单甲醚、丙二醇、山梨醇脱水山梨糖醇溶液和柠檬酸三乙酯。优选的是丙二醇。
[0063]
助流剂是为了改善粉末流动和减少颗粒之间的摩擦或粘聚而添加的物质。常见的示例是硬脂酸镁、气溶胶(胶体二氧化硅)、淀粉和滑石。助流剂的优选浓度为5%-10%。
[0064]
参考《奥顿药剂学》(药物的设计和制造),第5版(编辑:kevin taylor michael aulton),elsevier。
[0065]
本文使用的优选包衣方法是水生包衣。
[0066]
优选的颜料是二氧化钛或任何颜色的二氧化铁。
[0067]
此外,可以施用抛光剂,例如巴西棕榈蜡、蜂蜡或石蜡。巴西棕榈蜡是优选的。
[0068]
为了避免任何疑问,众所周知,如实施方案1)至实施方案9)中所定义的药物组合物)还可以包含另外的常规成分和/或添加剂,这些常规成分和/或添加剂可单独使用或组合使用。
[0069]
下表中指定了优选的赋形剂,它们都是药典的:
[0070]
表1
[0071][0072][0073]
另外的优选赋形剂是滑石,其用作助流剂。
[0074]
所有赋形剂均符合欧洲药典、美国药典和日本药典。
[0075]
9)另一个实施方案涉及根据实施方案7至实施方案9)中任一项所述的药物组合物,其中该片剂是直径为1.5mm至4mm,优选2.5mm至4mm,更优选2.7mm至3.5mm,最优选3mm
±
0.3mm的迷你片剂。
[0076]
根据前述实施方案所述的药物组合物,该药物组合物优选地为迷你片剂,具有12mg至小于50mg,优选12mg至47mg的重量。
[0077]
如果在一定时间段期间,式i的化合物或其药学上可接受的盐、溶剂化物、水合物或形态形式的初始含量在所述一定时间段内保持约70%,优选80%,更优选90%并且最优选95%的初始含量,则根据前述实施方案所述的药物组合物被认为是“稳定的”。
[0078]
药物组合物的稳定性可以常规方式测试,例如通过测量式i的化合物及其降解产物、溶解度、脆性、崩解时间、外观和/或显微镜检查,例如在25℃和60%相对湿度、30℃和75%相对湿度、和/或40℃和75%相对湿度下储存限定的时间段之后。
[0079]
优选地,当在5℃至50℃的温度下存放时,本发明的固体组合物应稳定至少6个或12个月。更优选地,当在15℃至45℃的温度下存放时,它们应稳定至少6个或12个月。更优选地,当在25℃至40℃的温度下存放时,它们应稳定至少12个或36个月。
[0080]
在更优选的实施方案中,药物组合物在一定时间段内稳定,例如1年,并且优选2年。更优选地,药物组合物稳定3到5年。
[0081]
在优选的实施方案中,根据本发明的迷你片剂表现出特定的稳定性。
[0082]
术语“药物组合物”可与术语“制剂”或“组合物”互换。
[0083]
无论何时使用词语“在
……
之间”或“至”来描述数值范围时,应当理解,所指出的范围的端点被明确地公开并且包括在这个范围内。例如:如果温度范围被描述为介于40℃与80℃之间(或40℃至80℃),这意味着端点40℃和80℃被包括在该范围内;或者如果变量被定义为介于1与4之间(或1至4)的整数,这意味着变量是整数1、2、3或4。
[0084]
10)根据前述实施方案所述的药物组合物可以用作药剂,优选地用于口服施用。
[0085]
11)根据前述实施方案所述的药物组合物可用作儿科药剂。优选地,儿科患者为≥2岁至《18岁。
[0086]
12)根据前述实施方案所述的药物组合物可以进一步用于肝损伤患者或经历与cyp 2c8抑制剂(如氯吡格雷)发生药物-药物相互作用的患者。
[0087]
药物组合物还可以用于不耐受200mcg的起始剂量的患者。
[0088]
13)根据前述实施方案所述的药物组合物适用于预防和/或治疗溃疡、指溃疡、糖尿病性坏疽、糖尿病足溃疡、压力性溃疡(褥疮)、高血压、肺高压、肺动脉高压、方坦病和与方坦病相关联的肺高压、结节病和与结节病相关联的肺高压、末梢循环障碍(例如,慢性动脉闭塞、间歇性跛行、外周栓塞、震动综合征、雷诺氏病)、结缔组织病(例如,系统性红斑狼疮、硬皮病、混合性结缔组织病、血管炎综合征)、经皮冠状动脉成形术(ptca)后再闭塞/再狭窄、动脉硬化、血栓形成(例如,急性期脑血栓形成、肺栓塞)、短暂性脑缺血发作(tia)、糖尿病性神经病变、缺血性病症(例如,脑梗死、心肌梗死)、心绞痛(例如,稳定型心绞痛、不稳定型心绞痛)、包括肾小球肾炎和处于任何阶段的糖尿病性肾病的慢性肾脏疾病、变态反应、支气管哮喘、冠状动脉介入诸如斑块切除术和支架植入术后再狭窄、因透析所致的血小板减少症、涉及器官或组织纤维化的疾病(例如,肾病诸如肾小管间质性肾炎)、呼吸系统疾病(例如,间质性肺炎、(特发性)肺纤维化、慢性阻塞性肺病)、消化系统疾病(例如,肝硬化、病毒性肝炎、慢性胰腺炎和硬性胃癌)、心血管疾病(例如,心肌纤维化)、骨和关节疾病(例如,骨髓纤维化和类风湿性关节炎)、皮肤疾病(例如,手术后瘢痕、烫伤瘢痕、瘢痕疙瘩和肥厚性瘢痕)、产科疾病(例如,子宫肌瘤)、泌尿系统疾病(例如,前列腺增生)、其它疾病(例如,阿尔茨海默病、硬化性腹膜炎、i型糖尿病和手术后器官粘连)、勃起功能障碍(例如,糖尿病性勃起功能障碍、心因性勃起功能障碍、精神病性勃起功能障碍、与慢性肾衰竭相关联的勃起功能障碍、用于除去前列腺的骨盆内手术后勃起功能障碍以及与衰老和动脉硬化相关联的血管性勃起功能障碍)、炎性肠病(例如,溃疡性结肠炎、克罗恩氏病、肠结核、缺血性结肠炎和与白塞病相关联的肠溃疡)、胃炎、胃溃疡、缺血性眼病(例如,视网膜动脉阻塞、视网膜静脉阻塞、缺血性视神经病变)、突发性耳聋、无血管性骨坏死、因施用非甾体消炎剂所致的肠损伤和与腰椎管狭窄症相关联的症状。
[0089]
优选地,根据前述实施方案中任一项所述的药物组合物可用于预防或治疗溃疡、
指溃疡、糖尿病性坏疽、糖尿病足溃疡、肺高压、肺动脉高压、方坦病和与方坦病相关联的肺高压、结节病和与结节病相关联的肺高压、末梢循环障碍、结缔组织病、包括肾小球肾炎和处于任何阶段的糖尿病性肾病的慢性肾脏疾病、涉及器官或组织纤维化的疾病、或呼吸系统疾病。
[0090]
优选地,根据前述实施方案中任一项所述的药物组合物可用于预防或治疗肺动脉高压(pah)。
[0091]
应理解,根据前述实施方案中任一项所述的药物组合物可用于制造药剂,特别是用于预防和/或治疗上述指示的药剂。
[0092]
还应理解,本发明还涉及一种用于预防和/或治疗实施方案13)的疾病的方法。
[0093]
14)本发明的另一个实施方案涉及一种用于制造根据实施方案1至实施方案9中任一项所述的药物组合物的方法,该方法包括以下步骤:
[0094]
(a)将式(i)的化合物或其药学上可接受的盐、溶剂化物、水合物或形态形式与填料混合;
[0095]
(b)将填料和崩解剂添加到步骤(a)的共混物中并将其混合;
[0096]
(c)用包含粘结剂的溶液将从步骤(b)接收的共混物湿法制粒;
[0097]
(d)干燥并研磨步骤(c)的颗粒;
[0098]
(e)在合适的共混机中用润滑剂来润滑该颗粒;
[0099]
(f)将该颗粒压缩成芯片剂。
[0100]
此外,片剂芯是膜包衣的、干燥的且抛光的。优选地,片剂是膜包衣的。
[0101]
以下非限制性实施例说明了本发明。
实施例
[0102]
缩写(如本文和上文描述中所使用):
[0103]
era内皮素受体拮抗剂
[0104]
ip受体前列腺素受体,也称为前列腺素i2受体
[0105]
mcg微克
[0106]
pah肺动脉高压
[0107]
pde-5抑制剂磷酸二酯酶五型抑制剂
[0108]
pgi2前列腺素i2
[0109]
who世界卫生组织
[0110]
1.化合物的制备:
[0111]
赛乐西帕(化合物:2-{4-[n-(5,6-二苯基吡嗪-2-基)-n-异丙基氨基]丁氧基}-n-(甲磺酰基)乙酰胺)的制备描述于wo2002/088084中。游离碱的多晶型形式即结晶形式i、ii和iii的制备公开于wo2010/150865;药学上可接受的盐的多晶型形式公开于wo2011/024874。化合物以游离碱尤其多晶型形式i的结晶的形式用于以下实施例和测定中。
[0112]
2.赛乐西帕膜包衣片剂的定量组合物
[0113]
表2:赛乐西帕膜包衣片剂的定量组合物
[0114][0115][0116]
表3:赛乐西帕膜包衣片剂的定量组合物
[0117][0118]
表2和表3中所示的膜包衣片剂是直径为大约3mm的迷你片剂,便于儿童吞咽。
[0119]
4.制造工艺
[0120]
i)混合
[0121]
将赛乐西帕和d-甘露糖醇在合适的共混机中混合。
[0122]
ii)混合
[0123]
然后将玉米淀粉和低取代的羟丙基纤维素添加到共混机中。将混合物共混。
[0124]
iii)湿法制粒
[0125]
将混合物转移到流体床制粒机/干燥器中,并且对羟丙基纤维素在水中的溶液进行喷雾,将产物维持在约30℃-35℃的温度。
[0126]
iv)干燥和研磨
[0127]
湿法制粒在流化床干燥器中干燥并研磨。
[0128]
v)润滑
[0129]
在合适的共混机中用硬脂酸镁润滑颗粒。
[0130]
vi)压缩
[0131]
将最终共混物压缩成芯片剂。
[0132]
vii)包衣
[0133]
将片剂芯装载到盘中,并且喷涂包衣混悬液直至达到片剂合格重量。将片剂冷却直到其完全干燥。
[0134]
viii)抛光
[0135]
使用巴西棕榈蜡对膜包衣片剂进行抛光。
[0136]
ix)包装
[0137]
膜包衣片剂包装在带有防儿童聚丙烯盖的高密度聚乙烯瓶中,并含有一种干燥剂。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。