治疗眼部病状的方法
1.本技术是申请日为2017年4月6日、中国申请号为201780034734.3、发明名称为“治疗眼部病状的方法”的发明申请的分案申请。
2.相关申请的交叉引用
3.本技术要求2016年4月7日提交的美国临时申请第62/319,648号的权益,此临时申请的内容以全文引用的方式并入本文中。
背景技术:
4.干眼病(“ded”)为影响全世界数百万人的病状。在北美,约4千万人患有某种形式的干眼,且全世界范围内更有数百万人罹患干眼。ded由眼表面上的天然泪膜受破坏而引起,且会导致眼部不适、视觉障碍和视觉相关的生活质量降低。ded重症患者处于诸如角膜溃疡的严重眼部健康缺陷的风险下,且可能经历与中度至重度心绞痛相当的生活质量缺陷。
技术实现要素:
5.本公开提供一种增加泪液产生的方法,其包括向有需要的个体的鼻腔中局部施用治疗有效量的(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
6.本公开提供一种治疗干眼的方法,其包括向有需要的个体的鼻腔中局部施用治疗有效量的(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
7.本公开提供一种改善眼部不适的方法,其包括向有需要的个体的鼻腔中局部施用治疗有效量的(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
8.在某些实施方案中,(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶呈游离碱形式施用。在某些实施方案中,(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶呈(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶的药学上可接受的盐的形式施用。在某些实施方案中,所述药学上可接受的盐为粘酸盐或柠檬酸盐。在某些实施方案中,所述药学上可接受的盐为粘酸盐。在某些实施方案中,所述药学上可接受的盐为柠檬酸盐。在某些实施方案中,所述药学上可接受的盐为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶单柠檬酸盐。
9.在某些实施方案中,(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐的剂量介于每剂量500微克与10毫克之间。
10.在某些实施方案中,所述方法还包括局部施用防止或减少烟碱乙酰胆碱受体进入减敏状态或促进外周烟碱乙酰胆碱受体从减敏状态恢复的一种或多种物质。在某些实施方案中,所述一种或多种物质选自由以下各项组成的组:蛋白激酶c(pkc)或者上调或向上调节pkc的因子、camp依赖性蛋白激酶(pka)或者上调或向上调节pka的因子和钙调磷酸酶抑制剂。在某些实施方案中,所述钙调磷酸酶抑制剂选自由以下各项组成的组:环孢霉素(cyclosporine)、吡美莫司(pimecrolimus)和他克莫司(tacrolimus)。在某些实施方案中,在没有任何形式的烟碱的情况下施用(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
11.在某些实施方案中,施用介于500微克与5毫克之间的(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。在某些实施方案中,施用少于5毫克的(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。在某些实施方案中,施用介于1毫克与3毫克之间的(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。在某些实施方案中,施用介于500微克与5毫克之间的(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。在某些实施方案中,施用介于1毫克与2毫克之间的(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。在某些实施方案中,施用约1毫克的(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。在某些实施方案中,施用约1.5毫克的(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。在某些实施方案中,施用约2毫克的(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
12.在某些实施方案中,响应于症状按需施用(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。在某些实施方案中,每日施用(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐至少一次。在某些实施方案中,每日施用(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐至少两次。在某些实施方案中,其中每周施用(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐至少一次。
13.在某些实施方案中,(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐呈液体、混悬剂、气雾剂、凝胶、软膏、干粉、乳膏、糊剂、洗剂或香膏的形式施用至鼻腔中。在某些实施方案中,通过注射器、滴管、瓶状雾化器、雾化泵、吸入器、喷粉装置、汽化器、贴片、施药棒、吸移管或液体喷射器将(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐施用至鼻腔中。在某些实施方案中,施用呈包含介于5mg/ml与200mg/ml之间的(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐的经鼻施用药物制剂形式的(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。在某些实施方案中,所述经鼻施用药物制剂包含介于10mg/ml与75mg/ml之间的(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。在某些实施方案中,所述经鼻施用药物制剂包含介于10mg/ml与50mg/ml之间的(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
14.本公开提供一种用于局部施用至个体鼻腔中的药物制剂,其包含(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐且被配制成经鼻施用。
15.本公开提供一种用于治疗干眼或眼部不适的药物制剂,所述制剂包含(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
16.在某些实施方案中,(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶被配制为呈游离碱形式。在某些实施方案中,所述药学上可接受的盐为粘酸盐或柠檬酸盐。在某些实施方案中,所述药学上可接受的盐为粘酸盐。在某些实施方案中,所述药学上可接受的盐为柠檬酸盐。在某些实施方案中,所述柠檬酸盐为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶单柠檬酸盐。在某些实施方案中,所述药物制剂被配制成施用介于每剂量500微克与10毫克之间的剂量。
17.在某些实施方案中,所述药物制剂还包含一种或多种选自由以下各项组成的组的物质:蛋白激酶c(pkc)或者上调或向上调节pkc的因子、camp依赖性蛋白激酶(pka)或者上调或向上调节pka的因子和钙调磷酸酶抑制剂。在某些实施方案中,所述钙调磷酸酶抑制剂
选自由以下各项组成的组:环孢霉素、吡美莫司和他克莫司。在某些实施方案中,所述药物制剂不含呈任何形式的烟碱。
18.在某些实施方案中,所述药物制剂包含介于5mg/ml与200mg/ml之间的(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。在某些实施方案中,所述药物制剂包含介于10mg/ml与75mg/ml之间的(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。在某些实施方案中,所述药物制剂包含介于10mg/ml与50mg/ml之间的(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。在某些实施方案中,所述药物制剂包含介于每剂量500微克与5毫克之间的(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。在某些实施方案中,所述药物制剂包含少于每剂量5毫克的(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。在某些实施方案中,所述药物制剂包含介于每剂量1毫克与3毫克之间的(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。在某些实施方案中,所述药物制剂包含介于每剂量1毫克与2毫克之间的(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。在某些实施方案中,所述药物制剂包含每剂量约1毫克的(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。在某些实施方案中,所述药物制剂包含每剂量约1.5毫克的(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。在某些实施方案中,所述药物制剂包含每剂量约2毫克的(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
19.在某些实施方案中,所述药物制剂被配制成响应于症状按需施用。在某些实施方案中,所述药物制剂被配制成每日施用至少一次。在某些实施方案中,所述药物制剂被配制成每日施用两次。在某些实施方案中,所述药物制剂被配制成每周施用至少一次。
20.在某些实施方案中,所述药物制剂被配制为液体、混悬剂、气雾剂、凝胶、软膏、干粉、乳膏、糊剂、洗剂或香膏。在某些实施方案中,所述药物制剂被配制成经由注射器、滴管、瓶状雾化器、雾化泵、吸入器、喷粉装置、汽化器、贴片、施药棒、吸移管或液体喷射器局部递送至鼻腔中。
21.本公开提供化合物(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐以用于治疗干眼或眼部不适,其被施用至有需要的个体的鼻腔中。
22.本公开提供化合物(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐以用于治疗干眼或眼部不适,其被施用至有需要的个体的鼻腔中,且其中所述眼部病状由眼科手术程序或眼科治疗引起。
23.在某些实施方案中,(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐的剂量介于每剂量500微克与10毫克之间。
24.本文中所描述的用于治疗眼部病状的方法包括将治疗有效量的式(i)、式(ii)、式(iiia)或式(iiib)化合物局部施用至有需要的个体的鼻腔中,其中所述式(i)、式(ii)、式(iiia)或式(iiib)化合物结合至外周烟碱乙酰胆碱受体以提供局部作用。尽管少量式(i)、式(ii)、式(iiia)或式(iiib)化合物可进入全身循环,但所述量足以引发全身药理学效应。此外,治疗有需要的个体的眼部病状所需的式(i)、式(ii)、式(iiia)或式(iiib)化合物的剂量的量实质上低于在此类个体中产生全身药理学效应所需的量。实际上,式(i)、式(ii)、式(iiia)或式(iiib)化合物在个体中产生全身药理学效应的量一般使所述个体鼻腔中的外周烟碱乙酰胆碱受体减敏,且从而不能有效地治疗眼部病状。
25.在一些实施方案中,本文中提供一种增加泪液产生的方法,其包括将治疗有效量的式(i)化合物局部施用至有需要的个体的鼻腔中,其中所述式(i)化合物结合至外周烟碱乙酰胆碱受体且所述式(i)化合物具有以下结构:
[0026][0027]
其中:
[0028]
波形线表示关于双键的e或z几何结构;
[0029]
x为n或cr3;
[0030]
r1为氢、c
1-6
烷基、卤素、-or4、-sr4或-nr5r6;
[0031]
r2为氢、c
1-6
烷基、芳基、-c
1-6
烷基-(芳基)、-芳基-(c
1-6
烷基)、杂芳基、-c
1-6
烷基-(杂芳基)、-杂芳基-(c
1-6
烷基)、杂环烷基、-c
1-6
烷基(杂环烷基)或环烷基;
[0032]
r3为氢、c
1-6
烷基、芳基、-c
1-6
烷基-(芳基)、-芳基-(c
1-6
烷基)、杂芳基、-c
1-6
烷基-(杂芳基)、-杂芳基-(c
1-6
烷基)、杂环烷基、-c
1-6
烷基(杂环烷基)、环烷基、-or7、-sr7、-nr8r9、-sor7或-so2r7,其中所述c
1-6
烷基、杂环烷基、杂芳基和芳基任选地被一个或多个选自以下的取代基取代:卤素、-cn、-no2、-nh2、-oh、-or7、-co2h、-c(o)or7、-o-c(o)r7、-nr8r9、-nhc(o)r7、-c(o)nr8r9、-sr7、-s(o)r7、-so2r7、-nhso2r7、-so2nr8r9、-c(s)nr8r9、-nhc(s)r7和-o-so2r7;
[0033]
r4、r5和r6独立地为氢或c
1-6
烷基;且
[0034]
r7、r8和r9为氢、c
1-6
烷基、芳基、-c
1-6
烷基-(芳基)、-芳基-(c
1-6
烷基)、杂芳基、-c
1-6
烷基-(杂芳基)、-杂芳基-(c
1-6
烷基)、杂环烷基、-c
1-6
烷基(杂环烷基)或环烷基,其中所述c
1-6
烷基、杂环烷基、杂芳基和芳基任选地被一个或多个选自以下的取代基取代:f、cl、br、i、r
10
、-nr
10r11
、-cf3、-cn、-no2、-c2r
10
、-n3、-so2ch3、-or
10
、-sr
10
、-c(o)nr
10r11
、-nr
10
c(=o)r
10
、-c(=o)r
10
、-c(=o)or
10
、-(ch2)or
10
、-(ch2)2or
10
、-oc(=o)r
10
、-oc(=o)nr
10r11
和-nr
10
c(=o)or
10
;
[0035]r10
和r
11
独立地为氢、c
1-6
烷基、吡啶基、喹啉基、嘧啶基、嘧啶基、苯基或苯甲基;或
[0036]
r8和r9或r
10
和r
11
与其所连接的氮一起任选地形成杂环烷基环;
[0037]
p为1、2、3或4;且
[0038]
q为1、2或3;
[0039]
或其对映异构体、非对映异构体、互变异构体或药学上可接受的盐。
[0040]
在一些实施方案中为一种增加泪液产生的方法,其包括将治疗有效量的式(i)化合物局部施用至有需要的个体的鼻腔中,其中x为n。在一些实施方案中为一种增加泪液产生的方法,其包括将治疗有效量的式(i)化合物局部施用至有需要的个体的鼻腔中,其中r2为氢。在一些实施方案中为一种增加泪液产生的方法,其包括将治疗有效量的式(i)化合物局部施用至有需要的个体的鼻腔中,其中r1为氢、c
1-6
烷基、-or4或-nr5r6。在一些实施方案中为一种增加泪液产生的方法,其包括将治疗有效量的式(i)化合物局部施用至有需要的个体的鼻腔中,其中r1为氢。在一些实施方案中为一种增加泪液产生的方法,其包括将治疗
有效量的式(i)化合物局部施用至有需要的个体的鼻腔中,其中q为1。在一些实施方案中为一种增加泪液产生的方法,其包括将治疗有效量的式(i)化合物局部施用至有需要的个体的鼻腔中,其中p为2。在一些实施方案中为一种增加泪液产生的方法,其包括将治疗有效量的式(i)化合物局部施用至有需要的个体的鼻腔中,其中波形线表示关于双键的e几何结构。在一些实施方案中为一种增加泪液产生的方法,其包括将治疗有效量的式(i)化合物局部施用至有需要的个体的鼻腔中,其中所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶。在一些实施方案中为一种增加泪液产生的方法,其包括将治疗有效量的式(i)化合物局部施用至有需要的个体的鼻腔中,其中所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶柠檬酸盐。在一些实施方案中为一种增加泪液产生的方法,其包括将治疗有效量的式(i)化合物局部施用至有需要的个体的鼻腔中,其中所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶单柠檬酸盐。在一些实施方案中为一种增加泪液产生的方法,其包括将治疗有效量的式(i)化合物局部施用至有需要的个体的鼻腔中,其中所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶hcl盐。在一些实施方案中为一种增加泪液产生的方法,其包括将治疗有效量的式(i)化合物局部施用至有需要的个体的鼻腔中,其中所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶粘酸盐。
[0041]
在一些实施方案中为一种增加泪液产生的方法,其包括将治疗有效量的式(i)化合物局部施用至有需要的个体的鼻腔中,其中所述式(i)化合物选择性地结合至外周烟碱乙酰胆碱受体且不会以药理学相关的浓度越过血脑屏障。在一些实施方案中为增加泪液产生的方法,其包括将治疗有效量的式(i)化合物局部施用至有需要的个体的鼻腔中,其中所述式(i)化合物选择性地结合至选自α3β4、α4β2和α7的外周烟碱乙酰胆碱受体亚型中的至少一者。在一些实施方案中为一种增加泪液产生的方法,其包括将治疗有效量的式(i)化合物局部施用至有需要的个体的鼻腔中,其中所述式(i)化合物选择性地结合至外周烟碱乙酰胆碱受体且以不具全身性生物可利用性的量施用。在一些实施方案中为一种增加泪液产生的方法,其包括将治疗有效量的式(i)化合物局部施用至有需要的个体的鼻腔中,其中所述式(i)化合物选择性地结合至外周烟碱乙酰胆碱受体且以不会引起不希望的精神副作用的量施用。在一些实施方案中为一种增加泪液产生的方法,其包括将治疗有效量的式(i)化合物局部施用至有需要的个体的鼻腔中,其中所述式(i)化合物选择性地结合至外周烟碱乙酰胆碱受体且以不会引起不希望的全身性副作用的量施用。在一些实施方案中为一种增加泪液产生的方法,其包括将治疗有效量的式(i)化合物局部施用至有需要的个体的鼻腔中,其中所述式(i)化合物选择性地结合至外周烟碱乙酰胆碱受体且以产生局部作用的量施用。
[0042]
在一些实施方案中,本文中还提供一种治疗干眼的方法,其包括将治疗有效量的式(i)化合物局部施用至有需要的个体的鼻腔中,其中所述式(i)化合物结合至外周烟碱乙酰胆碱受体且所述式(i)化合物具有以下结构:
[0043]
[0044]
其中:
[0045]
波形线表示关于双键的e或z几何结构;
[0046]
x为n或cr3;
[0047]
r1为氢、c
1-6
烷基、卤素、-or4、-sr4或-nr5r6;
[0048]
r2为氢、c
1-6
烷基、芳基、-c
1-6
烷基-(芳基)、-芳基-(c
1-6
烷基)、杂芳基、-c
1-6
烷基-(杂芳基)、-杂芳基-(c
1-6
烷基)、杂环烷基、-c
1-6
烷基(杂环烷基)或环烷基;
[0049]
r3为氢、c
1-6
烷基、芳基、-c
1-6
烷基-(芳基)、-芳基-(c
1-6
烷基)、杂芳基、-c
1-6
烷基-(杂芳基)、-杂芳基-(c
1-6
烷基)、杂环烷基、-c
1-6
烷基(杂环烷基)、环烷基、-or7、-sr7、-nr8r9、-sor7或-so2r7,其中所述c
1-6
烷基、杂环烷基、杂芳基和芳基任选地被一个或多个选自以下的取代基取代:卤素、-cn、-no2、-nh2、-oh、-or7、-co2h、-c(o)or7、-o-c(o)r7、-nr8r9、-nhc(o)r7、-c(o)nr8r9、-sr7、-s(o)r7、-so2r7、-nhso2r7、-so2nr8r9、-c(s)nr8r9、-nhc(s)r7和-o-so2r7;
[0050]
r4、r5和r6独立地为氢或c
1-6
烷基;且
[0051]
r7、r8和r9为氢、c
1-6
烷基、芳基、-c
1-6
烷基-(芳基)、-芳基-(c
1-6
烷基)、杂芳基、-c
1-6
烷基-(杂芳基)、-杂芳基-(c
1-6
烷基)、杂环烷基、-c
1-6
烷基(杂环烷基)或环烷基,其中所述c
1-6
烷基、杂环烷基、杂芳基和芳基任选地被一个或多个选自以下的取代基取代:f、cl、br、i、r
10
、-nr
10r11
、-cf3、-cn、-no2、-c2r
10
、-n3、-so2ch3、-or
10
、-sr
10
、-c(o)nr
10r11
、-nr
10
c(=o)r
10
、-c(=o)r
10
、-c(=o)or
10
、-(ch2)or
10
、-(ch2)2or
10
、-oc(=o)r
10
、-oc(=o)nr
10r11
和-nr
10
c(=o)or
10
;
[0052]r10
和r
11
独立地为氢、c
1-6
烷基、吡啶基、喹啉基、嘧啶基、嘧啶基、苯基或苯甲基;或
[0053]
r8和r9或r
10
和r
11
与其所连接的氮一起任选地形成杂环烷基环;
[0054]
p为1、2、3或4;且
[0055]
q为1、2或3;
[0056]
或其对映异构体、非对映异构体、互变异构体或药学上可接受的盐。
[0057]
在一些实施方案中为一种治疗干眼的方法,其包括将治疗有效量的式(i)化合物局部施用至有需要的个体的鼻腔中,其中x为n。在一些实施方案中为一种治疗干眼的方法,其包括将治疗有效量的式(i)化合物局部施用至有需要的个体的鼻腔中,其中r2为氢。在一些实施方案中为一种治疗干眼的方法,其包括将治疗有效量的式(i)化合物局部施用至有需要的个体的鼻腔中,其中r1为氢、c
1-6
烷基、-or4或-nr5r6。在一些实施方案中为一种治疗干眼的方法,其包括将治疗有效量的式(i)化合物局部施用至有需要的个体的鼻腔中,其中r1为氢。在一些实施方案中为一种治疗干眼的方法,其包括将治疗有效量的式(i)化合物局部施用至有需要的个体的鼻腔中,其中q为1。在一些实施方案中为一种治疗干眼的方法,其包括将治疗有效量的式(i)化合物局部施用至有需要的个体的鼻腔中,其中p为2。在一些实施方案中为一种治疗干眼的方法,其包括将治疗有效量的式(i)化合物局部施用至有需要的个体的鼻腔中,其中波形线表示关于双键的e几何结构。在一些实施方案中为一种治疗干眼的方法,其包括将治疗有效量的式(i)化合物局部施用至有需要的个体的鼻腔中,其中所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶。在一些实施方案中为一种治疗干眼的方法,其包括将治疗有效量的式(i)化合物局部施用至有需要的个体的鼻腔中,其中所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶柠檬酸盐。在一些实施方案中
为一种治疗干眼的方法,其包括将治疗有效量的式(i)化合物局部施用至有需要的个体的鼻腔中,其中所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶单柠檬酸盐。在一些实施方案中为一种治疗干眼的方法,其包括将治疗有效量的式(i)化合物局部施用至有需要的个体的鼻腔中,其中所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶hcl盐。在一些实施方案中为一种治疗干眼的方法,其包括将治疗有效量的式(i)化合物局部施用至有需要的个体的鼻腔中,其中所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶粘酸盐。
[0058]
在一些实施方案中为一种治疗干眼的方法,其包括将治疗有效量的式(i)化合物局部施用至有需要的个体的鼻腔中,其中所述式(i)化合物选择性地结合至外周烟碱乙酰胆碱受体且不会以药理学相关的浓度越过血脑屏障。在一些实施方案中为治疗干眼的方法,其包括将治疗有效量的式(i)化合物局部施用至有需要的个体的鼻腔中,其中所述式(i)化合物选择性地结合至选自α3β4、α4β2和α7的外周烟碱乙酰胆碱受体亚型中的至少一者。在一些实施方案中为一种治疗干眼的方法,其包括将治疗有效量的式(i)化合物局部施用至有需要的个体的鼻腔中,其中所述式(i)化合物选择性地结合至外周烟碱乙酰胆碱受体且以不具全身性生物可利用性的量施用。在一些实施方案中为一种治疗干眼的方法,其包括将治疗有效量的式(i)化合物局部施用至有需要的个体的鼻腔中,其中所述式(i)化合物选择性地结合至外周烟碱乙酰胆碱受体且以不会引起不希望的精神副作用的量施用。在一些实施方案中为一种治疗干眼的方法,其包括将治疗有效量的式(i)化合物局部施用至有需要的个体的鼻腔中,其中所述式(i)化合物选择性地结合至外周烟碱乙酰胆碱受体且以不会引起不希望的全身性副作用的量施用。在一些实施方案中为一种治疗干眼的方法,其包括将治疗有效量的式(i)化合物局部施用至有需要的个体的鼻腔中,其中所述式(i)化合物选择性地结合至外周烟碱乙酰胆碱受体且以产生局部作用的量施用。
[0059]
在一些实施方案中,本文中还提供一种改善眼部不适的方法,其包括将治疗有效量的式(i)化合物局部施用至有需要的个体的鼻腔中,其中所述式(i)化合物结合至外周烟碱乙酰胆碱受体且所述式(i)化合物具有以下结构:
[0060][0061]
其中:
[0062]
波形线表示关于双键的e或z几何结构;
[0063]
x为n或cr3;
[0064]
r1为氢、c
1-6
烷基、卤素、-or4、-sr4或-nr5r6;
[0065]
r2为氢、c
1-6
烷基、芳基、-c
1-6
烷基-(芳基)、-芳基-(c
1-6
烷基)、杂芳基、-c
1-6
烷基-(杂芳基)、-杂芳基-(c
1-6
烷基)、杂环烷基、-c
1-6
烷基(杂环烷基)或环烷基;
[0066]
r3为氢、c
1-6
烷基、芳基、-c
1-6
烷基-(芳基)、-芳基-(c
1-6
烷基)、杂芳基、-c
1-6
烷基-(杂芳基)、-杂芳基-(c
1-6
烷基)、杂环烷基、-c
1-6
烷基(杂环烷基)、环烷基、-or7、-sr7、-nr8r9、-sor7或-so2r7,其中所述c
1-6
烷基、杂环烷基、杂芳基和芳基任选地被一个或多个选自
以下的取代基取代:卤素、-cn、-no2、-nh2、-oh、-or7、-co2h、-c(o)or7、-o-c(o)r7、-nr8r9、-nhc(o)r7、-c(o)nr8r9、-sr7、-s(o)r7、-so2r7、-nhso2r7、-so2nr8r9、-c(s)nr8r9、-nhc(s)r7和-o-so2r7;
[0067]
r4、r5和r6独立地为氢或c
1-6
烷基;且
[0068]
r7、r8和r9为氢、c
1-6
烷基、芳基、-c
1-6
烷基-(芳基)、-芳基-(c
1-6
烷基)、杂芳基、-c
1-6
烷基-(杂芳基)、-杂芳基-(c
1-6
烷基)、杂环烷基、-c
1-6
烷基(杂环烷基)或环烷基,其中所述c
1-6
烷基、杂环烷基、杂芳基和芳基任选地被一个或多个选自以下的取代基取代:f、cl、br、i、r
10
、-nr
10r11
、-cf3、-cn、-no2、-c2r
10
、-n3、-so2ch3、-or
10
、-sr
10
、-c(o)nr
10r11
、-nr
10
c(=o)r
10
、-c(=o)r
10
、-c(=o)or
10
、-(ch2)or
10
、-(ch2)2or
10
、-oc(=o)r
10
、-oc(=o)nr
10r11
和-nr
10
c(=o)or
10
;
[0069]r10
和r
11
独立地为氢、c
1-6
烷基、吡啶基、喹啉基、嘧啶基、嘧啶基、苯基或苯甲基;或
[0070]
r8和r9或r
10
和r
11
与其所连接的氮一起任选地形成杂环烷基环;
[0071]
p为1、2、3或4;且
[0072]
q为1、2或3;
[0073]
或其对映异构体、非对映异构体、互变异构体或药学上可接受的盐。
[0074]
在一些实施方案中为一种改善眼部不适的方法,其包括将治疗有效量的式(i)化合物局部施用至有需要的个体的鼻腔中,其中x为n。在一些实施方案中为一种改善眼部不适的方法,其包括将治疗有效量的式(i)化合物局部施用至有需要的个体的鼻腔中,其中r2为氢。在一些实施方案中为一种改善眼部不适的方法,其包括将治疗有效量的式(i)化合物局部施用至有需要的个体的鼻腔中,其中r1为氢、c
1-6
烷基、-or4或-nr5r6。在一些实施方案中为一种改善眼部不适的方法,其包括将治疗有效量的式(i)化合物局部施用至有需要的个体的鼻腔中,其中r1为氢。在一些实施方案中为一种改善眼部不适的方法,其包括将治疗有效量的式(i)化合物局部施用至有需要的个体的鼻腔中,其中q为1。在一些实施方案中为一种改善眼部不适的方法,其包括将治疗有效量的式(i)化合物局部施用至有需要的个体的鼻腔中,其中p为2。在一些实施方案中为一种改善眼部不适的方法,其包括将治疗有效量的式(i)化合物局部施用至有需要的个体的鼻腔中,其中波形线表示关于双键的e几何结构。在一些实施方案中为一种改善眼部不适的方法,其包括将治疗有效量的式(i)化合物局部施用至有需要的个体的鼻腔中,其中所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶。在一些实施方案中为一种改善眼部不适的方法,其包括将治疗有效量的式(i)化合物局部施用至有需要的个体的鼻腔中,其中所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶柠檬酸盐。在一些实施方案中为一种改善眼部不适的方法,其包括将治疗有效量的式(i)化合物局部施用至有需要的个体的鼻腔中,其中所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶单柠檬酸盐。在一些实施方案中为一种改善眼部不适的方法,其包括将治疗有效量的式(i)化合物局部施用至有需要的个体的鼻腔中,其中所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶hcl盐。在一些实施方案中为一种改善眼部不适的方法,其包括将治疗有效量的式(i)化合物局部施用至有需要的个体的鼻腔中,其中所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶粘酸盐。
[0075]
在一些实施方案中为一种改善眼部不适的方法,其包括将治疗有效量的式(i)化合物局部施用至有需要的个体的鼻腔中,其中所述式(i)化合物选择性地结合至外周烟碱
乙酰胆碱受体且不会以药理学相关的浓度越过血脑屏障。在一些实施方案中为改善眼部不适的方法,其包括将治疗有效量的式(i)化合物局部施用至有需要的个体的鼻腔中,其中所述式(i)化合物选择性地结合至选自α3β4、α4β2和α7的外周烟碱乙酰胆碱受体亚型中的至少一者。在一些实施方案中为一种改善眼部不适的方法,其包括将治疗有效量的式(i)化合物局部施用至有需要的个体的鼻腔中,其中所述式(i)化合物选择性地结合至外周烟碱乙酰胆碱受体且以不具全身性生物可利用性的量施用。在一些实施方案中为一种改善眼部不适的方法,其包括将治疗有效量的式(i)化合物局部施用至有需要的个体的鼻腔中,其中所述式(i)化合物选择性地结合至外周烟碱乙酰胆碱受体且以不会引起不希望的精神副作用的量施用。在一些实施方案中为一种改善眼部不适的方法,其包括将治疗有效量的式(i)化合物局部施用至有需要的个体的鼻腔中,其中所述式(i)化合物选择性地结合至外周烟碱乙酰胆碱受体且以不会引起不希望的全身性副作用的量施用。在一些实施方案中为一种改善眼部不适的方法,其包括将治疗有效量的式(i)化合物局部施用至有需要的个体的鼻腔中,其中所述式(i)化合物选择性地结合至外周烟碱乙酰胆碱受体且以产生局部作用的量施用。
[0076]
在一些实施方案中,本文中还提供一种增加泪液产生的方法,其包括将治疗有效量的式(ii)化合物局部施用至有需要的个体的鼻腔中,其中所述式(ii)化合物结合至外周烟碱乙酰胆碱受体且所述式(ii)化合物具有以下结构:
[0077][0078]
其中:
[0079]
r1为c
1-6
烷基、c
2-6
烯基、c
2-6
炔基、c
3-8
杂环烷基、c
3-8
环烷基或杂芳基,其任选地被一个至三个独立地选自以下的非氢取代基取代:c
1-6
烷基、c
2-6
烯基、c
2-6
炔基、c
3-8
杂环烷基、c
3-8
环烷基、杂芳基、芳基、-c
1-6
烷基-(芳基)、-芳基-(c
1-6
烷基)、杂芳基、-c
1-6
烷基-(杂芳基)、-杂芳基-(c
1-6
烷基)、卤素、-cn、-no2、-or3、-nr4r5、-cf3、-c2r3、-sr3、-n3、-c(o)nr4r5、-nr4c(o)r3、-c(o)r3、-c(o)or3、-oc(o)r3、-oc(o)nr4r5、-nr4c(o)or3、-so2r3、-nr4so2r5和-so2nr4r5;
[0080]
r2为键或-ch
2-;
[0081]
r3为氢、c
1-6
烷基、c
3-8
环烷基、c
3-8
杂环烷基、芳基、-c
1-6
烷基-(芳基)、-芳基-(c
1-6
烷基)或杂芳基;且
[0082]
r4和r5独立地为氢、c
1-6
烷基、c
3-8
环烷基、c
3-8
杂环烷基、芳基、-c
1-6
烷基-(芳基)、-芳基-(c
1-6
烷基)或杂芳基;或r4和r5与其所连接的氮一起形成杂环烷基环;
[0083]
或其药学上可接受的盐。
[0084]
在一些实施方案中为一种增加泪液产生的方法,其包括将治疗有效量的式(ii)化合物局部施用至有需要的个体的鼻腔中,其中r1为任选地被一个至三个独立地选自以下的非氢取代基取代的杂芳基:c
1-6
烷基、c
2-6
烯基、c
2-6
炔基、c
3-8
杂环烷基、c
3-8
环烷基、杂芳基、芳基、-c
1-6
烷基-(芳基)、-芳基-(c
1-6
烷基)、杂芳基、-c
1-6
烷基-(杂芳基)、-杂芳基-(c
1-6
烷
基)、卤素、-cn、-or3、-nr4r5、-cf3、-c(o)nr4r5、-nr4c(o)r3、-c(o)r3、-c(o)or3、-oc(o)r3、-oc(o)nr4r5、-nr4c(o)or3、-so2r3、-nr4so2r5和-so2nr4r5。在一些实施方案中为一种增加泪液产生的方法,其包括将治疗有效量的式(ii)化合物局部施用至有需要的个体的鼻腔中,其中r1为2-呋喃基、3-呋喃基、2-噁唑基、4-噁唑基、5-噁唑基、3-异噁唑基、4-异噁唑基、5-异噁唑基、1,3,4-噁二唑-2-基、1,2,4-噁二唑-3-基、1,2,4-噁二唑-5-基、2-噻唑基、4-噻唑基、5-噻唑基、3-异噻唑基、4-异噻唑基、5-异噻唑基、1,3,4-噻二唑-2-基、1,2,4-噻二唑-3-基、1,2,4-噻二唑-5-基或4-吡啶基。在一些实施方案中为一种增加泪液产生的方法,其包括将治疗有效量的式(ii)化合物局部施用至有需要的个体的鼻腔中,其中r2为键。在一些实施方案中为一种增加泪液产生的方法,其包括将治疗有效量的式(ii)化合物局部施用至有需要的个体的鼻腔中,其中r2为-ch
2-。在一些实施方案中为一种增加泪液产生的方法,其包括将治疗有效量的式(ii)化合物局部施用至有需要的个体的鼻腔中,其中所述式(ii)化合物为n-(5-氯呋喃-2-基羰基)-3,7-二氮杂双环[3.3.0]辛烷。
[0085]
在一些实施方案中为一种增加泪液产生的方法,其包括将治疗有效量的式(ii)化合物局部施用至有需要的个体的鼻腔中,其中所述式(ii)化合物选择性地结合至外周烟碱乙酰胆碱受体且不会以药理学相关的浓度越过血脑屏障。在一些实施方案中为增加泪液产生的方法,其包括将治疗有效量的式(ii)化合物局部施用至有需要的个体的鼻腔中,其中所述式(ii)化合物选择性地结合至选自α3β4、α4β2和α7的外周烟碱乙酰胆碱受体亚型中的至少一者。在一些实施方案中为一种增加泪液产生的方法,其包括将治疗有效量的式(ii)化合物局部施用至有需要的个体的鼻腔中,其中所述式(ii)化合物选择性地结合至外周烟碱乙酰胆碱受体且以不具全身性生物可利用性的量施用。在一些实施方案中为一种增加泪液产生的方法,其包括将治疗有效量的式(ii)化合物局部施用至有需要的个体的鼻腔中,其中所述式(ii)化合物选择性地结合至外周烟碱乙酰胆碱受体且以不会引起不希望的精神副作用的量施用。在一些实施方案中为一种增加泪液产生的方法,其包括将治疗有效量的式(ii)化合物局部施用至有需要的个体的鼻腔中,其中所述式(ii)化合物选择性地结合至外周烟碱乙酰胆碱受体且以不会引起不希望的全身性副作用的量施用。在一些实施方案中为一种增加泪液产生的方法,其包括将治疗有效量的式(ii)化合物局部施用至有需要的个体的鼻腔中,其中所述式(ii)化合物选择性地结合至外周烟碱乙酰胆碱受体且以产生局部作用的量施用。
[0086]
在一些实施方案中,本文中还提供一种治疗干眼的方法,其包括将治疗有效量的式(ii)化合物局部施用至有需要的个体的鼻腔中,其中所述式(ii)化合物结合至外周烟碱乙酰胆碱受体且所述式(ii)化合物具有以下结构:
[0087][0088]
其中:
[0089]
r1为c
1-6
烷基、c
2-6
烯基、c
2-6
炔基、c
3-8
杂环烷基、c
3-8
环烷基或杂芳基,其任选地被一个至三个独立地选自以下的非氢取代基取代:c
1-6
烷基、c
2-6
烯基、c
2-6
炔基、c
3-8
杂环烷基、c3-8
环烷基、杂芳基、芳基、-c
1-6
烷基-(芳基)、-芳基-(c
1-6
烷基)、杂芳基、-c
1-6
烷基-(杂芳基)、-杂芳基-(c
1-6
烷基)、卤素、-cn、-no2、-or3、-nr4r5、-cf3、-c2r3、-sr3、-n3、-c(o)nr4r5、-nr4c(o)r3、-c(o)r3、-c(o)or3、-oc(o)r3、-oc(o)nr4r5、-nr4c(o)or3、-so2r3、-nr4so2r5和-so2nr4r5;
[0090]
r2为键或-ch
2-;
[0091]
r3为氢、c
1-6
烷基、c
3-8
环烷基、c
3-8
杂环烷基、芳基、-c
1-6
烷基-(芳基)、-芳基-(c
1-6
烷基)或杂芳基;且
[0092]
r4和r5独立地为氢、c
1-6
烷基、c
3-8
环烷基、c
3-8
杂环烷基、芳基、-c
1-6
烷基-(芳基)、-芳基-(c
1-6
烷基)或杂芳基;或r4和r5与其所连接的氮一起形成杂环烷基环;
[0093]
或其药学上可接受的盐。
[0094]
在一些实施方案中为一种治疗干眼的方法,其包括将治疗有效量的式(ii)化合物局部施用至有需要的个体的鼻腔中,其中r1为任选地被一个至三个独立地选自以下的非氢取代基取代的杂芳基:c
1-6
烷基、c
2-6
烯基、c
2-6
炔基、c
3-8
杂环烷基、c
3-8
环烷基、杂芳基、芳基、-c
1-6
烷基-(芳基)、-芳基-(c
1-6
烷基)、杂芳基、-c
1-6
烷基-(杂芳基)、-杂芳基-(c
1-6
烷基)、卤素、-cn、-or3、-nr4r5、-cf3、-c(o)nr4r5、-nr4c(o)r3、-c(o)r3、-c(o)or3、-oc(o)r3、-oc(o)nr4r5、-nr4c(o)or3、-so2r3、-nr4so2r5和-so2nr4r5。在一些实施方案中为一种治疗干眼的方法,其包括将治疗有效量的式(ii)化合物局部施用至有需要的个体的鼻腔中,其中r1为2-呋喃基、3-呋喃基、2-噁唑基、4-噁唑基、5-噁唑基、3-异噁唑基、4-异噁唑基、5-异噁唑基、1,3,4-噁二唑-2-基、1,2,4-噁二唑-3-基、1,2,4-噁二唑-5-基、2-噻唑基、4-噻唑基、5-噻唑基、3-异噻唑基、4-异噻唑基、5-异噻唑基、1,3,4-噻二唑-2-基、1,2,4-噻二唑-3-基、1,2,4-噻二唑-5-基或4-吡啶基。在一些实施方案中为一种治疗干眼的方法,其包括将治疗有效量的式(ii)化合物局部施用至有需要的个体的鼻腔中,其中r2为键。在一些实施方案中为一种治疗干眼的方法,其包括将治疗有效量的式(ii)化合物局部施用至有需要的个体的鼻腔中,其中r2为-ch
2-。在一些实施方案中为一种治疗干眼的方法,其包括将治疗有效量的式(ii)化合物局部施用至有需要的个体的鼻腔中,其中所述式(ii)化合物为n-(5-氯呋喃-2-基羰基)-3,7-二氮杂双环[3.3.0]辛烷。
[0095]
在一些实施方案中为一种治疗干眼的方法,其包括将治疗有效量的式(ii)化合物局部施用至有需要的个体的鼻腔中,其中所述式(ii)化合物选择性地结合至外周烟碱乙酰胆碱受体且不会以药理学相关的浓度越过血脑屏障。在一些实施方案中为治疗干眼的方法,其包括将治疗有效量的式(ii)化合物局部施用至有需要的个体的鼻腔中,其中所述式(ii)化合物选择性地结合至选自α3β4、α4β2和α7的外周烟碱乙酰胆碱受体亚型中的至少一者。在一些实施方案中为一种治疗干眼的方法,其包括将治疗有效量的式(ii)化合物局部施用至有需要的个体的鼻腔中,其中所述式(ii)化合物选择性地结合至外周烟碱乙酰胆碱受体且以不具全身性生物可利用性的量施用。在一些实施方案中为一种治疗干眼的方法,其包括将治疗有效量的式(ii)化合物局部施用至有需要的个体的鼻腔中,其中所述式(ii)化合物选择性地结合至外周烟碱乙酰胆碱受体且以不会引起不希望的精神副作用的量施用。在一些实施方案中为一种治疗干眼的方法,其包括将治疗有效量的式(ii)化合物局部施用至有需要的个体的鼻腔中,其中所述式(ii)化合物选择性地结合至外周烟碱乙酰胆碱受体且以不会引起不希望的全身性副作用的量施用。在一些实施方案中为一种治疗干眼的
方法,其包括将治疗有效量的式(ii)化合物局部施用至有需要的个体的鼻腔中,其中所述式(ii)化合物选择性地结合至外周烟碱乙酰胆碱受体且以产生局部作用的量施用。
[0096]
在一些实施方案中,本文中还提供一种改善眼部不适的方法,其包括将治疗有效量的式(ii)化合物局部施用至有需要的个体的鼻腔中,其中所述式(ii)化合物结合至外周烟碱乙酰胆碱受体且所述式(ii)化合物具有以下结构:
[0097][0098]
其中:
[0099]
r1为c
1-6
烷基、c
2-6
烯基、c
2-6
炔基、c
3-8
杂环烷基、c
3-8
环烷基或杂芳基,其任选地被一个至三个独立地选自以下的非氢取代基取代:c
1-6
烷基、c
2-6
烯基、c
2-6
炔基、c
3-8
杂环烷基、c
3-8
环烷基、杂芳基、芳基、-c
1-6
烷基-(芳基)、-芳基-(c
1-6
烷基)、杂芳基、-c
1-6
烷基-(杂芳基)、-杂芳基-(c
1-6
烷基)、卤素、-cn、-no2、-or3、-nr4r5、-cf3、-c2r3、-sr3、-n3、-c(o)nr4r5、-nr4c(o)r3、-c(o)r3、-c(o)or3、-oc(o)r3、-oc(o)nr4r5、-nr4c(o)or3、-so2r3、-nr4so2r5和-so2nr4r5;
[0100]
r2为键或-ch
2-;
[0101]
r3为氢、c
1-6
烷基、c
3-8
环烷基、c
3-8
杂环烷基、芳基、-c
1-6
烷基-(芳基)、-芳基-(c
1-6
烷基)或杂芳基;且
[0102]
r4和r5独立地为氢、c
1-6
烷基、c
3-8
环烷基、c
3-8
杂环烷基、芳基、-c
1-6
烷基-(芳基)、-芳基-(c
1-6
烷基)或杂芳基;或r4和r5与其所连接的氮一起形成杂环烷基环;
[0103]
或其药学上可接受的盐。
[0104]
在一些实施方案中为一种改善眼部不适的方法,其包括将治疗有效量的式(ii)化合物局部施用至有需要的个体的鼻腔中,其中r1为任选地被一个至三个独立地选自以下的非氢取代基取代的杂芳基:c
1-6
烷基、c
2-6
烯基、c
2-6
炔基、c
3-8
杂环烷基、c
3-8
环烷基、杂芳基、芳基、-c
1-6
烷基-(芳基)、-芳基-(c
1-6
烷基)、杂芳基、-c
1-6
烷基-(杂芳基)、-杂芳基-(c
1-6
烷基)、卤素、-cn、-or3、-nr4r5、-cf3、-c(o)nr4r5、-nr4c(o)r3、-c(o)r3、-c(o)or3、-oc(o)r3、-oc(o)nr4r5、-nr4c(o)or3、-so2r3、-nr4so2r5和-so2nr4r5。在一些实施方案中为一种改善眼部不适的方法,其包括将治疗有效量的式(ii)化合物局部施用至有需要的个体的鼻腔中,其中r1为2-呋喃基、3-呋喃基、2-噁唑基、4-噁唑基、5-噁唑基、3-异噁唑基、4-异噁唑基、5-异噁唑基、1,3,4-噁二唑-2-基、1,2,4-噁二唑-3-基、1,2,4-噁二唑-5-基、2-噻唑基、4-噻唑基、5-噻唑基、3-异噻唑基、4-异噻唑基、5-异噻唑基、1,3,4-噻二唑-2-基、1,2,4-噻二唑-3-基、1,2,4-噻二唑-5-基或4-吡啶基。在一些实施方案中为一种改善眼部不适的方法,其包括将治疗有效量的式(ii)化合物局部施用至有需要的个体的鼻腔中,其中r2为键。在一些实施方案中为一种改善眼部不适的方法,其包括将治疗有效量的式(ii)化合物局部施用至有需要的个体的鼻腔中,其中r2为-ch
2-。在一些实施方案中为一种改善眼部不适的方法,其包括将治疗有效量的式(ii)化合物局部施用至有需要的个体的鼻腔中,其中所述式(ii)化合物为n-(5-氯呋喃-2-基羰基)-3,7-二氮杂双环[3.3.0]辛烷。
so2nr4r5;
[0117]
r2为-ch
2-或-ch2ch
2-;
[0118]
r3为氢、c
1-6
烷基、c
2-6
烯基、c
2-6
炔基、c
3-8
环烷基、c
3-8
杂环烷基、芳基、-c
1-6
烷基-(芳基)、-芳基-(c
1-6
烷基)或杂芳基;且
[0119]
r4和r5独立地为氢、c
1-6
烷基、c
2-6
烯基、c
2-6
炔基、c
3-8
环烷基、c
3-8
杂环烷基、芳基、-c
1-6
烷基-(芳基)、-芳基-(c
1-6
烷基)或杂芳基;或r4和r5与其所连接的氮一起形成杂环烷基环;
[0120]
或其药学上可接受的盐。
[0121]
在一些实施方案中为一种增加泪液产生的方法,其包括将治疗有效量的化合物(iiia)或(iiib)局部施用至有需要的个体的鼻腔中,其中p为1且q为0。在一些实施方案中为一种增加泪液产生的方法,其包括将治疗有效量的化合物(iiia)或(iiib)局部施用至有需要的个体的鼻腔中,其中p为0且q为1。在一些实施方案中为一种增加泪液产生的方法,其包括将治疗有效量的式(iiia)或式(iiib)化合物局部施用至有需要的个体的鼻腔中,其中r2为-ch
2-。在一些实施方案中为一种增加泪液产生的方法,其包括将治疗有效量的式(iiia)或式(iiib)化合物局部施用至有需要的个体的鼻腔中,其中r2为-ch2ch
2-。在一些实施方案中为一种增加泪液产生的方法,其包括将治疗有效量的式(iiia)或式(iiib)化合物局部施用至有需要的个体的鼻腔中,其中z为氢。在一些实施方案中为一种增加泪液产生的方法,其包括将治疗有效量的式(iiia)或式(iiib)化合物局部施用至有需要的个体的鼻腔中,其中z为c
1-6
烷基。在一些实施方案中为一种增加泪液产生的方法,其包括将治疗有效量的式(iiia)或式(iiib)化合物局部施用至有需要的个体的鼻腔中,其中x为c(o)。
[0122]
在一些实施方案中为一种增加泪液产生的方法,其包括将治疗有效量的式(iiia)或式(iiib)化合物局部施用至有需要的个体的鼻腔中,其中所述式(iiia)或式(iiib)化合物选择性地结合至外周烟碱乙酰胆碱受体且不会以药理学相关的浓度越过血脑屏障。在一些实施方案中为增加泪液产生的方法,其包括将治疗有效量的式(iiia)或式(iiib)化合物局部施用至有需要的个体的鼻腔中,其中所述式(iiia)或式(iiib)化合物选择性地结合至选自α3β4、α4β2和α7的外周烟碱乙酰胆碱受体亚型中的至少一者。在一些实施方案中为一种增加泪液产生的方法,其包括将治疗有效量的式(iiia)或式(iiib)化合物局部施用至有需要的个体的鼻腔中,其中所述式(iiia)或式(iiib)化合物选择性地结合至外周烟碱乙酰胆碱受体且以不具全身性生物可利用性的量施用。在一些实施方案中为一种增加泪液产生的方法,其包括将治疗有效量的式(iiia)或式(iiib)化合物局部施用至有需要的个体的鼻腔中,其中所述式(iiia)或式(iiib)化合物选择性地结合至外周烟碱乙酰胆碱受体且以不会引起不希望的精神副作用的量施用。在一些实施方案中为一种增加泪液产生的方法,其包括将治疗有效量的式(iiia)或式(iiib)化合物局部施用至有需要的个体的鼻腔中,其中所述式(iiia)或式(iiib)化合物选择性地结合至外周烟碱乙酰胆碱受体且以不会引起不希望的全身性副作用的量施用。在一些实施方案中为一种增加泪液产生的方法,其包括将治疗有效量的式(iiia)或式(iiib)化合物局部施用至有需要的个体的鼻腔中,其中所述式(iiia)或式(iiib)化合物选择性地结合至外周烟碱乙酰胆碱受体且以产生局部作用的量施用。
[0123]
在一些实施方案中,本文中还提供一种治疗干眼的方法,其包括将治疗有效量的
式(iiia)或式(iiib)化合物局部施用至有需要的个体的鼻腔中,其中所述式(iiia)或式(iiib)化合物结合至外周烟碱乙酰胆碱受体且所述式(iiia)或式(iiib)化合物具有以下结构:
[0124][0125]
其中:
[0126]
x为c(o)、c(s)或s(o)n;
[0127]
z为氢、c
1-6
烷基或c
1-6
卤代烷基;
[0128]
n为1或2;
[0129]
p为0或1;
[0130]
q为0或1;
[0131]
当p为1时,则q为0;
[0132]
当q为1时,则p为0;
[0133]
r1为-or3、-nr4r5、c
1-6
烷基、c
2-6
烯基、c
2-6
炔基、c
3-8
杂环烷基、c
3-8
环烷基、芳基或杂芳基,其中c
1-6
烷基、c
2-6
烯基、c
2-6
炔基、c
3-8
杂环烷基、c
3-8
环烷基、芳基或杂芳基任选地被一个至三个独立地选自以下的非氢取代基取代:c
1-6
烷基、c
2-6
烯基、c
2-6
炔基、c
3-8
杂环烷基、c
3-8
环烷基、杂芳基、芳基、-c
1-6
烷基-(芳基)、-芳基-(c
1-6
烷基)、杂芳基、-c
1-6
烷基-(杂芳基)、-杂芳基-(c
1-6
烷基)、卤素、-cn、-no2、-or3、-nr4r5、-cf3、-c2r3、-sr3、-n3、-c(o)nr4r5、-nr4c(o)r3、-c(o)r3、-c(o)or3、-oc(o)r3、-oc(o)nr4r5、-nr4c(o)or3、-so2r3、-nr4so2r5和-so2nr4r5;
[0134]
r2为-ch
2-或-ch2ch
2-;
[0135]
r3为氢、c
1-6
烷基、c
2-6
烯基、c
2-6
炔基、c
3-8
环烷基、c
3-8
杂环烷基、芳基、-c
1-6
烷基-(芳基)、-芳基-(c
1-6
烷基)或杂芳基;且
[0136]
r4和r5独立地为氢、c
1-6
烷基、c
2-6
烯基、c
2-6
炔基、c
3-8
环烷基、c
3-8
杂环烷基、芳基、-c
1-6
烷基-(芳基)、-芳基-(c
1-6
烷基)或杂芳基;或r4和r5与其所连接的氮一起形成杂环烷基环;
[0137]
或其药学上可接受的盐。
[0138]
在一些实施方案中为一种治疗干眼的方法,其包括将治疗有效量的化合物(iiia)或(iiib)局部施用至有需要的个体的鼻腔中,其中p为1且q为0。在一些实施方案中为一种治疗干眼的方法,其包括将治疗有效量的化合物(iiia)或(iiib)局部施用至有需要的个体的鼻腔中,其中p为0且q为1。在一些实施方案中为一种治疗干眼的方法,其包括将治疗有效量的式(iiia)或式(iiib)化合物局部施用至有需要的个体的鼻腔中,其中r2为-ch
2-。在一些实施方案中为一种治疗干眼的方法,其包括将治疗有效量的式(iiia)或式(iiib)化合物局部施用至有需要的个体的鼻腔中,其中r2为-ch2ch
2-。在一些实施方案中为一种治疗干眼的方法,其包括将治疗有效量的式(iiia)或式(iiib)化合物局部施用至有需要的个体的鼻腔中,其中z为氢。在一些实施方案中为一种治疗干眼的方法,其包括将治疗有效量的式
(iiia)或式(iiib)化合物局部施用至有需要的个体的鼻腔中,其中z为c
1-6
烷基。在一些实施方案中为一种治疗干眼的方法,其包括将治疗有效量的式(iiia)或式(iiib)化合物局部施用至有需要的个体的鼻腔中,其中x为c(o)。
[0139]
在一些实施方案中为一种治疗干眼的方法,其包括将治疗有效量的式(iiia)或式(iiib)化合物局部施用至有需要的个体的鼻腔中,其中所述式(iiia)或式(iiib)化合物选择性地结合至外周烟碱乙酰胆碱受体且不会以药理学相关的浓度越过血脑屏障。在一些实施方案中为治疗干眼的方法,其包括将治疗有效量的式(iiia)或式(iiib)化合物局部施用至有需要的个体的鼻腔中,其中所述式(iiia)或式(iiib)化合物选择性地结合至选自α3β4、α4β2和α7的外周烟碱乙酰胆碱受体亚型中的至少一者。在一些实施方案中为一种治疗干眼的方法,其包括将治疗有效量的式(iiia)或式(iiib)化合物局部施用至有需要的个体的鼻腔中,其中所述式(iiia)或式(iiib)化合物选择性地结合至外周烟碱乙酰胆碱受体且以不具全身性生物可利用性的量施用。在一些实施方案中为一种治疗干眼的方法,其包括将治疗有效量的式(iiia)或式(iiib)化合物局部施用至有需要的个体的鼻腔中,其中所述式(iiia)或式(iiib)化合物选择性地结合至外周烟碱乙酰胆碱受体且以不会引起不希望的精神副作用的量施用。在一些实施方案中为一种治疗干眼的方法,其包括将治疗有效量的式(iiia)或式(iiib)化合物局部施用至有需要的个体的鼻腔中,其中所述式(iiia)或式(iiib)化合物选择性地结合至外周烟碱乙酰胆碱受体且以不会引起不希望的全身性副作用的量施用。在一些实施方案中为一种治疗干眼的方法,其包括将治疗有效量的式(iiia)或式(iiib)化合物局部施用至有需要的个体的鼻腔中,其中所述式(iiia)或式(iiib)化合物选择性地结合至外周烟碱乙酰胆碱受体且以产生局部作用的量施用。
[0140]
在一些实施方案中,本文中还提供一种改善眼部不适的方法,其包括将治疗有效量的式(iiia)或式(iiib)化合物局部施用至有需要的个体的鼻腔中,其中所述式(iiia)或式(iiib)化合物结合至外周烟碱乙酰胆碱受体且所述式(iiia)或式(iiib)化合物具有以下结构:
[0141][0142]
其中:
[0143]
x为c(o)、c(s)或s(o)n;
[0144]
z为氢、c
1-6
烷基或c
1-6
卤代烷基;
[0145]
n为1或2;
[0146]
p为0或1;
[0147]
q为0或1;
[0148]
当p为1时,则q为0;
[0149]
当q为1时,则p为0;
[0150]
r1为-or3、-nr4r5、c
1-6
烷基、c
2-6
烯基、c
2-6
炔基、c
3-8
杂环烷基、c
3-8
环烷基、芳基或杂芳基,其中c
1-6
烷基、c
2-6
烯基、c
2-6
炔基、c
3-8
杂环烷基、c
3-8
环烷基、芳基或杂芳基任选地被一
个至三个独立地选自以下的非氢取代基取代:c
1-6
烷基、c
2-6
烯基、c
2-6
炔基、c
3-8
杂环烷基、c
3-8
环烷基、杂芳基、芳基、-c
1-6
烷基-(芳基)、-芳基-(c
1-6
烷基)、杂芳基、-c
1-6
烷基-(杂芳基)、-杂芳基-(c
1-6
烷基)、卤素、-cn、-no2、-or3、-nr4r5、-cf3、-c2r3、-sr3、-n3、-c(o)nr4r5、-nr4c(o)r3、-c(o)r3、-c(o)or3、-oc(o)r3、-oc(o)nr4r5、-nr4c(o)or3、-so2r3、-nr4so2r5和-so2nr4r5;
[0151]
r2为-ch
2-或-ch2ch
2-;
[0152]
r3为氢、c
1-6
烷基、c
2-6
烯基、c
2-6
炔基、c
3-8
环烷基、c
3-8
杂环烷基、芳基、-c
1-6
烷基-(芳基)、-芳基-(c
1-6
烷基)或杂芳基;且
[0153]
r4和r5独立地为氢、c
1-6
烷基、c
2-6
烯基、c
2-6
炔基、c
3-8
环烷基、c
3-8
杂环烷基、芳基、-c
1-6
烷基-(芳基)、-芳基-(c
1-6
烷基)或杂芳基;或r4和r5与其所连接的氮一起形成杂环烷基环;
[0154]
或其药学上可接受的盐。
[0155]
在一些实施方案中为一种改善眼部不适的方法,其包括将治疗有效量的化合物(iiia)或(iiib)局部施用至有需要的个体的鼻腔中,其中p为1且q为0。在一些实施方案中为一种改善眼部不适的方法,其包括将治疗有效量的化合物(iiia)或(iiib)局部施用至有需要的个体的鼻腔中,其中p为0且q为1。在一些实施方案中为一种改善眼部不适的方法,其包括将治疗有效量的式(iiia)或式(iiib)化合物局部施用至有需要的个体的鼻腔中,其中r2为-ch
2-。在一些实施方案中为一种改善眼部不适的方法,其包括将治疗有效量的式(iiia)或式(iiib)化合物局部施用至有需要的个体的鼻腔中,其中r2为-ch2ch
2-。在一些实施方案中为一种改善眼部不适的方法,其包括将治疗有效量的式(iiia)或式(iiib)化合物局部施用至有需要的个体的鼻腔中,其中z为氢。在一些实施方案中为一种改善眼部不适的方法,其包括将治疗有效量的式(iiia)或式(iiib)化合物局部施用至有需要的个体的鼻腔中,其中z为c
1-6
烷基。在一些实施方案中为一种改善眼部不适的方法,其包括将治疗有效量的式(iiia)或式(iiib)化合物局部施用至有需要的个体的鼻腔中,其中x为c(o)。
[0156]
在一些实施方案中为一种改善眼部不适的方法,其包括将治疗有效量的式(iiia)或式(iiib)化合物局部施用至有需要的个体的鼻腔中,其中所述式(iiia)或式(iiib)化合物选择性地结合至外周烟碱乙酰胆碱受体且不会以药理学相关的浓度越过血脑屏障。在一些实施方案中为改善眼部不适的方法,其包括将治疗有效量的式(iiia)或式(iiib)化合物局部施用至有需要的个体的鼻腔中,其中所述式(iiia)或式(iiib)化合物选择性地结合至选自α3β4、α4β2和α7的外周烟碱乙酰胆碱受体亚型中的至少一者。在一些实施方案中为一种改善眼部不适的方法,其包括将治疗有效量的式(iiia)或式(iiib)化合物局部施用至有需要的个体的鼻腔中,其中所述式(iiia)或式(iiib)化合物选择性地结合至外周烟碱乙酰胆碱受体且以不具全身性生物可利用性的量施用。在一些实施方案中为一种改善眼部不适的方法,其包括将治疗有效量的式(iiia)或式(iiib)化合物局部施用至有需要的个体的鼻腔中,其中所述式(iiia)或式(iiib)化合物选择性地结合至外周烟碱乙酰胆碱受体且以不会引起不希望的精神副作用的量施用。在一些实施方案中为一种改善眼部不适的方法,其包括将治疗有效量的式(iiia)或式(iiib)化合物局部施用至有需要的个体的鼻腔中,其中所述式(iiia)或式(iiib)化合物选择性地结合至外周烟碱乙酰胆碱受体且以不会引起不希望的全身性副作用的量施用。在一些实施方案中为一种改善眼部不适的方法,其包括将
治疗有效量的式(iiia)或式(iiib)化合物局部施用至有需要的个体的鼻腔中,其中所述式(iiia)或式(iiib)化合物选择性地结合至外周烟碱乙酰胆碱受体且以产生局部作用的量施用。
[0157]
在任何上述实施方案的另一个实施方案中,所述方法还包括局部施用预防或促进烟碱乙酰胆碱受体从减敏状态恢复的一种或多种物质。在任何上述实施方案的另一个实施方案中,所述方法还包括局部施用防止或减少烟碱乙酰胆碱受体进入减敏状态或促进烟碱乙酰胆碱受体从减敏状态恢复的一种或多种物质。在一些实施方案中,所述一种或多种物质选自蛋白激酶c(pkc)或者上调或向上调节pkc的因子、camp依赖性蛋白激酶(pka)或者上调或向上调节pka的因子和钙调磷酸酶抑制剂。在一些实施方案中,所述钙调磷酸酶抑制剂选自由以下各项组成的组:环孢霉素、吡美莫司和他克莫司。
[0158]
在任何上述实施方案的另一个实施方案中,向鼻腔中施用少于5毫克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在任何上述实施方案的另一个实施方案中,向鼻腔中施用介于500微克与5毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在任何上述实施方案的另一个实施方案中,向鼻腔中施用介于1毫克与2毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在任何上述实施方案的另一个实施方案中,向鼻腔中施用约1毫克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在任何上述实施方案的另一个实施方案中,向鼻腔中施用约1.5毫克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在任何上述实施方案的另一个实施方案中,向鼻腔中施用约2毫克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。
[0159]
在任何上述实施方案的另一个实施方案中,每日施用式(i)、式(ii)、式(iiia)或式(iiib)化合物至少一次。在任何上述实施方案的另一个实施方案中,每日施用式(i)、式(ii)、式(iiia)或式(iiib)化合物至少两次。在任何上述实施方案的另一个实施方案中,施用式(i)、式(ii)、式(iiia)或式(iiib)化合物至少两天。
[0160]
在任何上述实施方案的另一个实施方案中,按需施用式(i)、式(ii)、式(iiia)或式(iiib)化合物。在任何上述实施方案的另一个实施方案中,响应于症状按需施用式(i)、式(ii)、式(iiia)或式(iiib)化合物。在任何上述实施方案的另一个实施方案中,设计或调节式(i)、式(ii)、式(iiia)或式(iiib)化合物的施用排程或频率以预防烟碱乙酰胆碱受体减敏。
[0161]
在任何上述实施方案的另一个实施方案中,式(i)、式(ii)、式(iiia)或式(iiib)化合物呈液体、混悬剂、气雾剂、凝胶、软膏、干粉、乳膏、糊剂、洗剂或香膏形式施用至鼻腔中。在任何上述实施方案的另一个实施方案中,通过注射器、滴管、瓶状雾化器、雾化泵、吸入器、喷粉装置、汽化器、贴片、施药棒、吸移管或液体喷射器将式(i)、式(ii)、式(iiia)或式(iiib)化合物施用至鼻腔中。
[0162]
在任何上述实施方案的另一个实施方案中,使三叉神经活化。在另一个实施方案中,使筛前神经活化。
[0163]
在任何上述实施方案的另一个实施方案中,使鼻泪反射活化。
[0164]
在一些实施方案中,本文中还提供一种用于局部施用至个体鼻腔中的药物制剂,其包含被配制成(a)用于经鼻施用和(b)预防外周烟碱乙酰胆碱受体减敏的式(i)化合物,其中所述式(i)化合物具有以下结构:
[0165][0166]
其中:
[0167]
波形线表示关于双键的e或z几何结构;
[0168]
x为n或cr3;
[0169]
r1为氢、c
1-6
烷基、卤素、-or4、-sr4或-nr5r6;
[0170]
r2为氢、c
1-6
烷基、芳基、-c
1-6
烷基-(芳基)、-芳基-(c
1-6
烷基)、杂芳基、-c
1-6
烷基-(杂芳基)、-杂芳基-(c
1-6
烷基)、杂环烷基、-c
1-6
烷基(杂环烷基)或环烷基;
[0171]
r3为氢、c
1-6
烷基、芳基、-c
1-6
烷基-(芳基)、-芳基-(c
1-6
烷基)、杂芳基、-c
1-6
烷基-(杂芳基)、-杂芳基-(c
1-6
烷基)、杂环烷基、-c
1-6
烷基(杂环烷基)、环烷基、-or7、-sr7、-nr8r9、-sor7或-so2r7,其中所述c
1-6
烷基、杂环烷基、杂芳基和芳基任选地被一个或多个选自以下的取代基取代:卤素、-cn、-no2、-nh2、-oh、-or7、-co2h、-c(o)or7、-o-c(o)r7、-nr8r9、-nhc(o)r7、-c(o)nr8r9、-sr7、-s(o)r7、-so2r7、-nhso2r7、-so2nr8r9、-c(s)nr8r9、-nhc(s)r7和-o-so2r7;
[0172]
r4、r5和r6独立地为氢或c
1-6
烷基;且
[0173]
r7、r8和r9为氢、c
1-6
烷基、芳基、-c
1-6
烷基-(芳基)、-芳基-(c
1-6
烷基)、杂芳基、-c
1-6
烷基-(杂芳基)、-杂芳基-(c
1-6
烷基)、杂环烷基、-c
1-6
烷基(杂环烷基)或环烷基,其中所述c
1-6
烷基、杂环烷基、杂芳基和芳基任选地被一个或多个选自以下的取代基取代:f、cl、br、i、r
10
、-nr
10r11
、-cf3、-cn、-no2、-c2r
10
、-n3、-so2ch3、-or
10
、-sr
10
、-c(o)nr
10r11
、-nr
10
c(=o)r
10
、-c(=o)r
10
、-c(=o)or
10
、-(ch2)or
10
、-(ch2)2or
10
、-oc(=o)r
10
、-oc(=o)nr
10r11
和-nr
10
c(=o)or
10
;
[0174]r10
和r
11
独立地为氢、c
1-6
烷基、吡啶基、喹啉基、嘧啶基、嘧啶基、苯基或苯甲基;或
[0175]
r8和r9或r
10
和r
11
与其所连接的氮一起任选地形成杂环烷基环;
[0176]
p为1、2、3或4;且
[0177]
q为1、2或3;
[0178]
或其对映异构体、非对映异构体、互变异构体或药学上可接受的盐。
[0179]
在一些实施方案中为一种用于局部施用至个体鼻腔中的药物制剂,其包含被配制成(a)用于经鼻施用和(b)预防外周烟碱乙酰胆碱受体减敏的式(i)化合物,其中x为n。在一些实施方案中为一种用于局部施用至个体鼻腔中的药物制剂,其包含被配制成(a)用于经鼻施用和(b)预防外周烟碱乙酰胆碱受体减敏的式(i)化合物,其中r2为氢。在一些实施方案中为一种用于局部施用至个体鼻腔中的药物制剂,其包含被配制成(a)用于经鼻施用和(b)预防外周烟碱乙酰胆碱受体减敏的式(i)化合物,其中r1为氢、c
1-6
烷基、-or4或-nr5r6。在一些实施方案中为一种用于局部施用至个体鼻腔中的药物制剂,其包含被配制成(a)用于经鼻施用和(b)预防外周烟碱乙酰胆碱受体减敏的式(i)化合物,其中r1为氢。在一些实施方案中为一种用于局部施用至个体鼻腔中的药物制剂,其包含被配制成(a)用于经鼻施用和(b)预防外周烟碱乙酰胆碱受体减敏的式(i)化合物,其中q为1。在一些实施方案中为
nr4c(o)r3、-c(o)r3、-c(o)or3、-oc(o)r3、-oc(o)nr4r5、-nr4c(o)or3、-so2r3、-nr4so2r5和-so2nr4r5;
[0185]
r2为键或-ch
2-;
[0186]
r3为氢、c
1-6
烷基、c
3-8
环烷基、c
3-8
杂环烷基、芳基、-c
1-6
烷基-(芳基)、-芳基-(c
1-6
烷基)或杂芳基;且
[0187]
r4和r5独立地为氢、c
1-6
烷基、c
3-8
环烷基、c
3-8
杂环烷基、芳基、-c
1-6
烷基-(芳基)、-芳基-(c
1-6
烷基)或杂芳基;或r4和r5与其所连接的氮一起形成杂环烷基环;
[0188]
或其药学上可接受的盐。
[0189]
在一些实施方案中为一种用于局部施用至个体鼻腔中的药物制剂,其包含被配制成(a)用于经鼻施用和(b)预防外周烟碱乙酰胆碱受体减敏的式(ii)化合物,其中r1为任选地被一个至三个独立地选自以下的非氢取代基取代的杂芳基:c
1-6
烷基、c
2-6
烯基、c
2-6
炔基、c
3-8
杂环烷基、c
3-8
环烷基、杂芳基、芳基、-c
1-6
烷基-(芳基)、-芳基-(c
1-6
烷基)、杂芳基、-c
1-6
烷基-(杂芳基)、-杂芳基-(c
1-6
烷基)、卤素、-cn、-or3、-nr4r5、-cf3、-c(o)nr4r5、-nr4c(o)r3、-c(o)r3、-c(o)or3、-oc(o)r3、-oc(o)nr4r5、-nr4c(o)or3、-so2r3、-nr4so2r5和-so2nr4r5。在一些实施方案中为一种用于局部施用至个体鼻腔中的药物制剂,其包含被配制成(a)用于经鼻施用和(b)预防外周烟碱乙酰胆碱受体减敏的式(ii)化合物,其中r1为2-呋喃基、3-呋喃基、2-噁唑基、4-噁唑基、5-噁唑基、3-异噁唑基、4-异噁唑基、5-异噁唑基、1,3,4-噁二唑-2-基、1,2,4-噁二唑-3-基、1,2,4-噁二唑-5-基、2-噻唑基、4-噻唑基、5-噻唑基、3-异噻唑基、4-异噻唑基、5-异噻唑基、1,3,4-噻二唑-2-基、1,2,4-噻二唑-3-基、1,2,4-噻二唑-5-基或4-吡啶基。在一些实施方案中为一种用于局部施用至个体鼻腔中的药物制剂,其包含被配制成(a)用于经鼻施用和(b)预防外周烟碱乙酰胆碱受体减敏的式(ii)化合物,其中r2为键。在一些实施方案中为一种用于局部施用至个体鼻腔中的药物制剂,其包含被配制成(a)用于经鼻施用和(b)预防外周烟碱乙酰胆碱受体减敏的式(ii)化合物,其中r2为-ch
2-。在一些实施方案中为一种用于局部施用至个体鼻腔中的药物制剂,其包含被配制成(a)用于经鼻施用和(b)预防外周烟碱乙酰胆碱受体减敏的式(ii)化合物,其中所述式(ii)化合物为n-(5-氯呋喃-2-基羰基)-3,7-二氮杂双环[3.3.0]辛烷。
[0190]
在一些实施方案中,本文中还提供一种用于局部施用至个体鼻腔中的药物制剂,其包含被配制成(a)用于经鼻施用和(b)预防外周烟碱乙酰胆碱受体减敏且剂量的量不具全身性生物可利用性的式(ii)化合物。在一些实施方案中为一种用于局部施用至个体鼻腔中的药物制剂,其包含被配制成(a)用于经鼻施用和(b)预防外周烟碱乙酰胆碱受体减敏且剂量的量不会引起不希望的精神副作用的式(ii)化合物。在一些实施方案中为一种用于局部施用至个体鼻腔中的药物制剂,其包含被配制成(a)用于经鼻施用和(b)预防外周烟碱乙酰胆碱受体减敏且剂量的量不会引起不希望的全身性副作用的式(ii)化合物。在一些实施方案中为一种用于局部施用至个体鼻腔中的药物制剂,其包含被配制成(a)用于经鼻施用和(b)预防外周烟碱乙酰胆碱受体减敏且剂量的量可产生局部作用的式(ii)化合物。
[0191]
在一些实施方案中,本文中还提供一种用于局部施用至个体鼻腔中的药物制剂,其包含被配制成(a)用于经鼻施用和(b)预防外周烟碱乙酰胆碱受体减敏的式(iiia)或式(iiib)化合物,其中所述式(iiia)或式(iiib)化合物具有以下结构:
[0192][0193]
其中:
[0194]
x为c(o)、c(s)或s(o)n;
[0195]
z为氢、c
1-6
烷基或c
1-6
卤代烷基;
[0196]
n为1或2;
[0197]
p为0或1;
[0198]
q为0或1;
[0199]
当p为1时,则q为0;
[0200]
当q为1时,则p为0;
[0201]
r1为-or3、-nr4r5、c
1-6
烷基、c
2-6
烯基、c
2-6
炔基、c
3-8
杂环烷基、c
3-8
环烷基、芳基或杂芳基,其中c
1-6
烷基、c
2-6
烯基、c
2-6
炔基、c
3-8
杂环烷基、c
3-8
环烷基、芳基或杂芳基任选地被一个至三个独立地选自以下的非氢取代基取代:c
1-6
烷基、c
2-6
烯基、c
2-6
炔基、c
3-8
杂环烷基、c
3-8
环烷基、杂芳基、芳基、-c
1-6
烷基-(芳基)、-芳基-(c
1-6
烷基)、杂芳基、-c
1-6
烷基-(杂芳基)、-杂芳基-(c
1-6
烷基)、卤素、-cn、-no2、-or3、-nr4r5、-cf3、-c2r3、-sr3、-n3、-c(o)nr4r5、-nr4c(o)r3、-c(o)r3、-c(o)or3、-oc(o)r3、-oc(o)nr4r5、-nr4c(o)or3、-so2r3、-nr4so2r5和-so2nr4r5;
[0202]
r2为-ch
2-或-ch2ch
2-;
[0203]
r3为氢、c
1-6
烷基、c
2-6
烯基、c
2-6
炔基、c
3-8
环烷基、c
3-8
杂环烷基、芳基、-c
1-6
烷基-(芳基)、-芳基-(c
1-6
烷基)或杂芳基;且
[0204]
r4和r5独立地为氢、c
1-6
烷基、c
2-6
烯基、c
2-6
炔基、c
3-8
环烷基、c
3-8
杂环烷基、芳基、-c
1-6
烷基-(芳基)、-芳基-(c
1-6
烷基)或杂芳基;或r4和r5与其所连接的氮一起形成杂环烷基环;
[0205]
或其药学上可接受的盐。
[0206]
在一些实施方案中为一种用于局部施用至个体鼻腔中的药物制剂,其包含被配制成(a)用于经鼻施用和(b)预防外周烟碱乙酰胆碱受体减敏的式(iiia)或式(iiib)化合物,其中p为1且q为0。在一些实施方案中为一种用于局部施用至个体鼻腔中的药物制剂,其包含被配制成(a)用于经鼻施用和(b)预防外周烟碱乙酰胆碱受体减敏的式(iiia)或式(iiib)化合物,其中p为0且q为1。在一些实施方案中为一种用于局部施用至个体鼻腔中的药物制剂,其包含被配制成(a)用于经鼻施用和(b)预防外周烟碱乙酰胆碱受体减敏的式(iiia)或式(iiib)化合物,其中r2为-ch
2-。在一些实施方案中为一种用于局部施用至个体鼻腔中的药物制剂,其包含被配制成(a)用于经鼻施用和(b)预防外周烟碱乙酰胆碱受体减敏的式(iiia)或式(iiib)化合物,其中r2为-ch2ch
2-。在一些实施方案中为一种用于局部施用至个体鼻腔中的药物制剂,其包含被配制成(a)用于经鼻施用和(b)预防外周烟碱乙酰胆碱受体减敏的式(iiia)或式(iiib)化合物,其中z为氢。在一些实施方案中为一种用于局部施用至个体鼻腔中的药物制剂,其包含被配制成(a)用于经鼻施用和(b)预防外周烟碱乙酰
胆碱受体减敏的式(iiia)或式(iiib)化合物,其中z为c
1-6
烷基。在一些实施方案中为一种用于局部施用至个体鼻腔中的药物制剂,其包含被配制成(a)用于经鼻施用和(b)预防外周烟碱乙酰胆碱受体减敏的式(iiia)或式(iiib)化合物,其中x为c(o)。在一些实施方案中,本文中还提供一种用于局部施用至个体鼻腔中的药物制剂,其包含被配制成(a)用于经鼻施用和(b)预防外周烟碱乙酰胆碱受体减敏且剂量的量不具全身性生物可利用性的式(iiia)或式(iiib)化合物。在一些实施方案中为一种用于局部施用至个体鼻腔中的药物制剂,其包含被配制成(a)用于经鼻施用和(b)预防外周烟碱乙酰胆碱受体减敏且剂量的量不会引起不希望的精神副作用的式(iiia)或式(iiib)化合物。在一些实施方案中为一种用于局部施用至个体鼻腔中的药物制剂,其包含被配制成(a)用于经鼻施用和(b)预防外周烟碱乙酰胆碱受体减敏且剂量的量不会引起不希望的全身性副作用的式(iiia)或式(iiib)化合物。在一些实施方案中为一种用于局部施用至个体鼻腔中的药物制剂,其包含被配制成(a)用于经鼻施用和(b)预防外周烟碱乙酰胆碱受体减敏且剂量的量可产生局部作用的式(iiia)或式(iiib)化合物。
[0207]
在一些实施方案中,所述药物制剂还包含选自蛋白激酶c(pkc)或者上调或向上调节pkc的因子、camp依赖性蛋白激酶(pka)或者上调或向上调节pka的因子和钙调磷酸酶抑制剂的一种或多种物质。在一些实施方案中,所述钙调磷酸酶抑制剂选自由以下各项组成的组:环孢霉素、吡美莫司和他克莫司。
[0208]
在一些实施方案中为一种用于局部施用至个体鼻腔中的药物制剂,其包含被配制成(a)用于经鼻施用和(b)预防外周烟碱乙酰胆碱受体减敏的式(i)、式(ii)、式(iiia)或式(iiib)化合物,其中所述药物制剂不含呈任何形式的烟碱。在一些实施方案中为一种用于局部施用至个体鼻腔中的药物制剂,其包含被配制成(a)用于经鼻施用和(b)预防外周烟碱乙酰胆碱受体减敏的式(i)、式(ii)、式(iiia)或式(iiib)化合物,其中所述药物制剂不含烟碱游离碱、烟碱盐、烟碱复合物或烟碱溶剂合物。在一些实施方案中为一种用于局部施用至个体鼻腔中的药物制剂,其包含被配制成(a)用于经鼻施用和(b)预防外周烟碱乙酰胆碱受体减敏的式(i)、式(ii)、式(iiia)或式(iiib)化合物,其中所述式(i)、式(ii)、式(iiia)或式(iiib)化合物选择性地结合至选自α3β4、α4β2和α7的外周烟碱乙酰胆碱受体亚型中的至少一者。在一些实施方案中,所述药物制剂包含约1mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在一些实施方案中,所述药物制剂包含约5mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在一些实施方案中,所述药物制剂包含每剂量少于5毫克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在一些实施方案中,所述药物制剂包含介于每剂量500微克与5毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在一些实施方案中,所述药物制剂包含介于每剂量1毫克与2毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在一些实施方案中,所述药物制剂包含每剂量约1毫克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在一些实施方案中,所述药物制剂包含每剂量约1.5毫克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在一些实施方案中,所述药物制剂包含每剂量约1毫克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在一些实施方案中,所述药物制剂包含每剂量约2毫克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在一些实施方案中,每日施用所述药物制剂至少一次。在一些实施方案中,每日施用所述药物制剂至少两次。在一些实施方案中,施用所述药物制剂至少两天。在一些实施方案中,所述药物制剂呈液体、混悬剂、气雾
剂、凝胶、软膏、干粉、乳膏、糊剂、洗剂或香膏形式施用至鼻腔中。在一些实施方案中,通过注射器、滴管、瓶状雾化器、雾化泵、吸入器、喷粉装置、汽化器、贴片、施药棒、吸移管或液体喷射器将所述药物制剂局部施用至鼻腔中。
[0209]
在一些实施方案中,本公开提供一种式(i)、式(ii)、式(iiia)或式(iiib)化合物(例如(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶)或其药学上可接受的盐,用于治疗干眼或眼部不适或增加泪液产生,所述化合物施用至有需要的个体的鼻腔中。
[0210]
在一些实施方案中,本公开提供一种式(i)、式(ii)、式(iiia)或式(iiib)化合物(例如(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶)或其药学上可接受的盐,用于制造用以治疗干眼或眼部不适或增加泪液产生的药剂,所述化合物施用至有需要的个体的鼻腔中。
[0211]
还应了解,出于清楚性的目的而于单独实施方案的内容中描述的某些本发明特征也可呈组合形式提供于单一实施方案中。相反,出于简便的目的而于单一实施方案的内容中描述的各种本发明特征也可单独或呈任何适合的子组合形式提供。
[0212]
本发明的其他实施方案、特征和优势将从以下详细描述和通过实践本发明而显而易知。
[0213]
为了简便起见,本说明书中所引用的出版物(包括专利)的公开内容以全文引用的方式并入本文中。
附图说明
[0214]
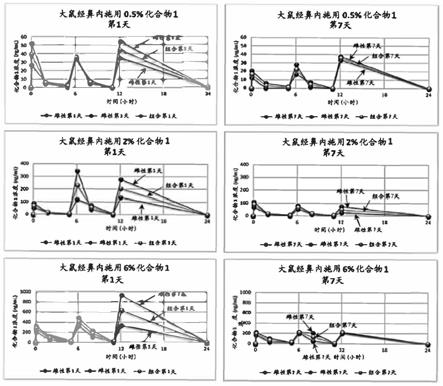
图1显示化合物1在第1天和第7天tid施用大鼠后的毒理动力学参数。
[0215]
图2显示用于测量荧光素吸收的角膜表面分区图。
[0216]
图3显示问卷的实例。
具体实施方式
[0217]
本文中所描述的用于治疗眼部病状的方法包括将治疗有效量的式(i)、式(ii)、式(iiia)或式(iiib)化合物局部施用至有需要的个体的鼻腔中,其中所述式(i)、式(ii)、式(iiia)或式(iiib)化合物结合至外周烟碱乙酰胆碱受体以提供局部作用。尽管少量式(i)、式(ii)、式(iiia)或式(iiib)化合物可进入全身循环,但所述量足以引发全身药理学效应。此外,治疗有需要的个体的眼部病状所需的式(i)、式(ii)、式(iiia)或式(iiib)化合物的剂量的量实质上低于在此类个体中产生全身药理学效应所需的量。实际上,式(i)、式(ii)、式(iiia)或式(iiib)化合物在个体中产生全身药理学效应的量一般使此类个体鼻腔中的外周烟碱乙酰胆碱受体减敏,且从而不能有效地治疗眼部病状。在一些实施方案中,所述式(i)、式(ii)、式(iiia)或式(iiib)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0218]
越来越更透彻理解ded的病因学。ded本质上为渐进性的,且基本上由眼睛表面上的泪液覆盖率不足引起。此不良泪液覆盖率预防眼表面的健康气体交换和营养输送,促进细胞干燥且引起不良视觉折射表面。不良泪液覆盖率典型地由以下引起:1)泪腺的水性泪液产生不足(例如继发于停经后激素缺乏、自体免疫疾病、lasik手术等);和/或2)由睑腺功能障碍引起水性泪液过度蒸发。低泪液体积引起高渗透压环境,从而诱导眼表面发炎状态。此炎性反应诱导表面细胞凋亡,由此又预防泪膜适当分布于眼表面上,因此致使任何指定
泪液体积均不太有效。此引发恶性循环,其中更大程度的炎症可能继而引起更大程度的表面细胞损伤等。另外,因为眼睛表面的感觉神经元受到损伤,故控制反射泪液激活的神经控制环受到破坏。因此,分泌较少泪液且发展第二恶性循环,由此导致疾病进一步进展(较少泪液引起神经细胞损失,由此产生较少泪液等)。
[0219]
对于ded存在多种治疗,然而,无一对治疗所述病状提供实质性功效。治疗选择包括:人工泪液替代物、软膏、凝胶、温热敷布、环境改变、局部环孢霉素、ω3脂肪酸补充剂、泪管栓塞和湿房镜。重症患者可进一步用泪管烧灼术、全身性胆碱激导性激动剂、全身性消炎剂、痰液溶解剂、自体血清泪液、prose巩膜隐形眼镜和睑缘缝合术加以治疗。尽管有这些治疗选择,但ded仍被视为受到最差治疗的眼科疾病之一。因此,将需要具备一种更有效的干眼治疗。
[0220]
烟碱乙酰胆碱受体为中枢神经系统(cns)、外周神经系统(pns)和骨骼肌中发现的胆碱激导性受体。这些受体为具有针对乙酰胆碱和其他分子的结合位点的配位体闸选离子通道。当烟碱乙酰胆碱受体激动剂结合至所述受体时,其使离子通道开放状态稳定,从而允许诸如钾、钙和钠离子的阳离子流入。
[0221]
作用于中枢神经系统,全身性烟碱乙酰胆碱受体激动剂作为多种病症,诸如阿尔茨海默氏病(alzheimer
′
s disease)、帕金森氏病(parkinson
′
s disease)、精神分裂症、注意力缺乏型多动症(adhd)和烟碱成瘾的药物候选物而受到注意。然而,这些中枢神经系统药剂的全身性暴露与多种不希望的精神副作用,包括焦虑、抑郁和烦躁相关。
[0222]
本文中描述治疗眼部病状和/或改善眼表面健康的方法,其包括将治疗有效量的烟碱乙酰胆碱受体激动剂局部施用至有需要的个体的鼻腔中,其中所述激动剂选择性地结合至外周烟碱乙酰胆碱受体且其中所述烟碱乙酰胆碱受体激动剂为式(i)、式(ii)、式(iiia)或式(iiib)化合物。在一些实施方案中,所述式(i)、式(ii)、式(iiia)或式(iiib)化合物结合至外周烟碱乙酰胆碱受体且不会以药理学相关的浓度越过血脑屏障。在一些实施方案中,所述式(i)、式(ii)、式(iiia)或式(iiib)化合物结合至外周烟碱乙酰胆碱受体且不会以药理学相关的浓度越过血脑屏障,并且以不具全身性生物可利用性的量施用。在一些实施方案中,所述式(i)、式(ii)、式(iiia)或式(iiib)化合物结合至外周烟碱乙酰胆碱受体且不会以药理学相关的浓度越过血脑屏障,并且以不会引起不希望的精神副作用的量施用。在一些实施方案中,所述式(i)、式(ii)、式(iiia)或式(iiib)化合物结合至外周烟碱乙酰胆碱受体且不会以药理学相关的浓度越过血脑屏障,并且以不会引起不希望的全身性副作用的量施用。在一些实施方案中,所述式(i)、式(ii)、式(iiia)或式(iiib)化合物结合至外周烟碱乙酰胆碱受体且不会以药理学相关的浓度越过血脑屏障,并且以产生局部作用的量施用。在一些实施方案中,所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0223]
长期或重复暴露于刺激往往导致所述受体对刺激的反应性降低,称为减敏。已报导,烟碱乙酰胆碱受体长期暴露于激动剂之后,激动剂本身会在受体中造成激动剂诱导的构形变化,从而导致受体减敏。
[0224]
本文中描述治疗眼部病状和/或改善眼表面健康的方法,其包括将治疗有效量的式(i)、式(ii)、式(iiia)或式(iiib)化合物局部施用至有需要的个体的鼻腔中,其中所述式(i)、式(ii)、式(iiia)或式(iiib)化合物选择性地结合至外周烟碱乙酰胆碱受体,所述
方法还包括局部施用预防或促进烟碱乙酰胆碱受体从减敏状态恢复的一种或多种物质。本文中还描述治疗眼部病状和/或改善眼表面健康的方法,其包括将治疗有效量的式(i)、式(ii)、式(iiia)或式(iiib)化合物局部施用至有需要的个体的鼻腔中,其中所述式(i)、式(ii)、式(iiia)或式(iiib)化合物选择性地结合至外周烟碱乙酰胆碱受体,所述方法还包括局部施用防止或减少烟碱乙酰胆碱受体进入减敏状态或促进烟碱乙酰胆碱受体从减敏状态恢复的一种或多种物质。在一些实施方案中,所述预防或促进烟碱乙酰胆碱受体从减敏状态恢复的一种或多种物质选自蛋白激酶c(pkc)或者上调或向上调节pkc的因子、camp依赖性蛋白激酶(pka)或者上调或向上调节pka的因子和钙调磷酸酶抑制剂。在一些实施方案中,所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0225]
本文中还描述用于局部施用至个体鼻腔中的药物制剂,其包含被配制成预防减敏的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在一些实施方案中,所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。本文中还描述用于局部施用至个体鼻腔中的药物制剂,其还包含预防或促进烟碱乙酰胆碱受体从减敏状态恢复的一种或多种物质。本文中还描述用于局部施用至个体鼻腔中的药物制剂,其还包含防止或减少烟碱乙酰胆碱受体进入减敏状态或促进烟碱乙酰胆碱受体从减敏状态恢复的一种或多种物质。本文中还描述用于局部施用至个体鼻腔中的药物制剂,其还包含预防或促进烟碱乙酰胆碱受体从减敏状态恢复的一种或多种物质,其中所述一种或多种物质选自蛋白激酶c(pkc)或者上调或向上调节pkc的因子、camp依赖性蛋白激酶(pka)或者上调或向上调节pka的因子和钙调磷酸酶抑制剂。本文中还描述用于局部施用至个体鼻腔中的药物制剂,其还包含防止或减少烟碱乙酰胆碱受体进入减敏状态或促进烟碱乙酰胆碱受体从减敏状态恢复的一种或多种物质,其中所述一种或多种物质选自蛋白激酶c(pkc)或者上调或向上调节pkc的因子、camp依赖性蛋白激酶(pka)或者上调或向上调节pka的因子和钙调磷酸酶抑制剂。
[0226]
增加泪液产生
[0227]
在一些实施方案中,本文中提供一种增加受试者的泪液产生的方法。在一些实施方案中为一种增加泪液产生的方法,其包括将治疗有效量的式(i)、式(ii)、式(iiia)或式(iiib)化合物局部施用至有需要的个体的鼻腔中,其中所述式(i)、式(ii)、式(iiia)或式(iiib)化合物选择性地结合至外周烟碱乙酰胆碱受体且不会以药理学相关的浓度越过血脑屏障。在一些实施方案中,所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。在一些实施方案中为增加泪液产生的方法,其包括将治疗有效量的式(i)、式(ii)、式(iiia)或式(iiib)化合物局部施用至有需要的个体的鼻腔中,其中所述式(i)、式(ii)、式(iiia)或式(iiib)化合物不会以药理学相关的浓度越过血脑屏障且选择性地结合至选自α3β4、α4β2和α7的外周烟碱乙酰胆碱受体亚型中的至少一者。在一些实施方案中为增加泪液产生的方法,其包括将治疗有效量的式(i)、式(ii)、式(iiia)或式(iiib)化合物局部施用至有需要的个体的鼻腔中,其中所述式(i)、式(ii)、式(iiia)或式(iiib)化合物不会以药理学相关的浓度越过血脑屏障且选择性地结合至外周烟碱乙酰胆碱受体亚型α3β4。在一些实施方案中为增加泪液产生的方法,其包括将治疗有效量的式(i)、式(ii)、式(iiia)或式(iiib)化合物局部施用至有需要的个体的鼻腔中,其中所述式
(i)、式(ii)、式(iiia)或式(iiib)化合物不会以药理学相关的浓度越过血脑屏障且选择性地结合至外周烟碱乙酰胆碱受体亚型α4β2。在一些实施方案中为增加泪液产生的方法,其包括将治疗有效量的式(i)、式(ii)、式(iiia)或式(iiib)化合物局部施用至有需要的个体的鼻腔中,其中所述式(i)、式(ii)、式(iiia)或式(iiib)化合物不会以药理学相关的浓度越过血脑屏障且选择性地结合至外周烟碱乙酰胆碱受体亚型α7。在一些实施方案中为一种增加泪液产生的方法,其包括将治疗有效量的式(i)、式(ii)、式(iiia)或式(iiib)化合物局部施用至有需要的个体的鼻腔中,其中所述式(i)、式(ii)、式(iiia)或式(iiib)化合物选择性地结合至外周烟碱乙酰胆碱受体且以不具全身性生物可利用性的量施用。在一些实施方案中为一种增加泪液产生的方法,其包括将治疗有效量的式(i)、式(ii)、式(iiia)或式(iiib)化合物局部施用至有需要的个体的鼻腔中,其中所述式(i)、式(ii)、式(iiia)或式(iiib)化合物选择性地结合至外周烟碱乙酰胆碱受体且以不会引起不希望的精神副作用的量施用。在一些实施方案中为一种增加泪液产生的方法,其包括将治疗有效量的式(i)、式(ii)、式(iiia)或式(iiib)化合物局部施用至有需要的个体的鼻腔中,其中所述式(i)、式(ii)、式(iiia)或式(iiib)化合物选择性地结合至外周烟碱乙酰胆碱受体且以不会引起不希望的全身性副作用的量施用。在一些实施方案中为一种增加泪液产生的方法,其包括将治疗有效量的式(i)、式(ii)、式(iiia)或式(iiib)化合物局部施用至有需要的个体的鼻腔中,其中所述式(i)、式(ii)、式(iiia)或式(iiib)化合物选择性地结合至外周烟碱乙酰胆碱受体且以产生局部作用的量施用。在一些实施方案中为一种增加泪液产生的方法,其还包括局部施用预防或促进烟碱乙酰胆碱受体从减敏状态恢复的一种或多种物质。在一些实施方案中为一种增加泪液产生的方法,其还包括局部施用防止或减少烟碱乙酰胆碱受体进入减敏状态或促进烟碱乙酰胆碱受体从减敏状态恢复的一种或多种物质。
[0228]
在本文中所描述的增加泪液产生的方法的一些实施方案中,所述式(i)、式(ii)、式(iiia)或式(iiib)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶(或化合物1)。在本文中所描述的方法的一些实施方案中,所述式(i)、式(ii)、式(iiia)或式(iiib)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。在本文中所描述的方法的一些实施方案中,所述式(i)、式(ii)、式(iiia)或式(iiib)化合物为呈游离碱形式的(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶。在本文中所描述的增加泪液产生的方法的一些实施方案中,所述式(i)、式(ii)、式(iiia)或式(iiib)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶柠檬酸盐。在本文中所描述的增加泪液产生的方法的一些实施方案中,所述式(i)、式(ii)、式(iiia)或式(iiib)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶单柠檬酸盐。在本文中所描述的增加泪液产生的方法的一些实施方案中,所述式(i)、式(ii)、式(iiia)或式(iiib)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶hcl盐。在本文中所描述的增加泪液产生的方法的一些实施方案中,所述式(i)、式(ii)、式(iiia)或式(iiib)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶粘酸盐。在本文中所描述的增加泪液产生的方法的一些实施方案中,所述式(i)、式(ii)、式(iiia)或式(iiib)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶半粘酸盐。在本文中所描述的增加泪液产生的方法的一些实施方案中,所述式(i)、式(ii)、式(iiia)或式(iiib)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶半粘酸盐单水合物。在本文中所描述的方法的一些实施方案中,所述式(i)、式(ii)、式(iiia)或式(iiib)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶半粘
酸盐二水合物。
[0229]
在一些实施方案中为一种增加泪液产生的方法,其还包括局部施用预防或促进烟碱乙酰胆碱受体从减敏状态恢复的一种或多种物质,所述一种或多种物质选自蛋白激酶c(pkc)或者上调或向上调节pkc的因子、camp依赖性蛋白激酶(pka)或者上调或向上调节pka的因子和钙调磷酸酶抑制剂。在一些实施方案中为一种增加泪液产生的方法,其还包括局部施用防止或减少烟碱乙酰胆碱受体进入减敏状态或促进烟碱乙酰胆碱受体从减敏状态恢复的一种或多种物质,所述一种或多种物质选自蛋白激酶c(pkc)或者上调或向上调节pkc的因子、camp依赖性蛋白激酶(pka)或者上调或向上调节pka的因子和钙调磷酸酶抑制剂。在一些实施方案中为一种增加泪液产生的方法,其还包括局部施用蛋白激酶c(pkc)或者上调或向上调节pkc的因子。在一些实施方案中为一种增加泪液产生的方法,其还包括局部施用camp依赖性蛋白激酶(pka)或者上调或向上调节pka的因子。在一些实施方案中为一种增加泪液产生的方法,其还包括局部施用钙调磷酸酶抑制剂。在一些实施方案中为一种增加泪液产生的方法,其还包括局部施用钙调磷酸酶抑制剂,其中所述钙调磷酸酶抑制剂选自环孢霉素、吡美莫司和他克莫司。在一些实施方案中为一种增加泪液产生的方法,其还包括局部施用环孢霉素。在一些实施方案中为一种增加泪液产生的方法,其还包括局部施用吡美莫司。在一些实施方案中为一种增加泪液产生的方法,其还包括局部施用他克莫司。
[0230]
在增加泪液产生的任何上述实施方案的另一个实施方案中,向鼻腔中施用至少1微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加泪液产生的任何上述实施方案的另一个实施方案中,向鼻腔中施用至少5微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加泪液产生的任何上述实施方案的另一个实施方案中,向鼻腔中施用至少10微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加泪液产生的任何上述实施方案的另一个实施方案中,向鼻腔中施用至少25微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加泪液产生的任何上述实施方案的另一个实施方案中,向鼻腔中施用至少50微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加泪液产生的任何上述实施方案的另一个实施方案中,向鼻腔中施用至少100微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加泪液产生的任何上述实施方案的另一个实施方案中,向鼻腔中施用至少250微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加泪液产生的任何上述实施方案的另一个实施方案中,向鼻腔中施用至少500微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加泪液产生的任何上述实施方案的另一个实施方案中,向鼻腔中施用至少750微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加泪液产生的任何上述实施方案的另一个实施方案中,向鼻腔中施用至少1000微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。
[0231]
在增加泪液产生的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于1微克与1000微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加泪液产生的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于5微克与1000微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加泪液产生的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于10微克与1000微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加泪液产生的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于5微克与100微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加泪液产生的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于5微克与50微克之间的式(i)、式(ii)、
式(iiia)或式(iiib)化合物。在增加泪液产生的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于10微克与50微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加泪液产生的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于25微克与1000微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加泪液产生的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于50微克与1000微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加泪液产生的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于100微克与1000微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加泪液产生的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于150微克与1000微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加泪液产生的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于100微克与750微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加泪液产生的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于150微克与750微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加泪液产生的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于150微克与600微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在一些实施方案中,所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0232]
在增加泪液产生的任何上述实施方案的另一个实施方案中,向鼻腔中施用少于100微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加泪液产生的任何上述实施方案的另一个实施方案中,向鼻腔中施用少于75微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加泪液产生的任何上述实施方案的另一个实施方案中,向鼻腔中施用少于50微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加泪液产生的任何上述实施方案的另一个实施方案中,向鼻腔中施用少于25微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加泪液产生的任何上述实施方案的另一个实施方案中,向鼻腔中施用少于15微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加泪液产生的任何上述实施方案的另一个实施方案中,向鼻腔中施用约75微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加泪液产生的任何上述实施方案的另一个实施方案中,向鼻腔中施用约50微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加泪液产生的任何上述实施方案的另一个实施方案中,向鼻腔中施用约25微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加泪液产生的任何上述实施方案的另一个实施方案中,向鼻腔中施用约10微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在一些实施方案中,所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0233]
在增加泪液产生的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于1微克与100微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加泪液产生的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于1微克与75微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加泪液产生的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于5微克与100微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加泪液产生的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于5微克与75微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加泪液产生的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于15微克与100微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加泪液产生的任何上述实施方案的另一个实施方案中,向
鼻腔中施用介于15微克与75微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加泪液产生的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于25微克与100微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加泪液产生的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于25微克与75微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加泪液产生的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于25微克与60微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在一些实施方案中,所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0234]
在增加泪液产生的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于500微克与10毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加泪液产生的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于500微克与5毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加泪液产生的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于500微克与3毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加泪液产生的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于500微克与2毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加泪液产生的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于1毫克与10毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加泪液产生的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于1毫克与5毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加泪液产生的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于1毫克与3毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加泪液产生的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于1毫克与2毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加泪液产生的任何上述实施方案的另一个实施方案中,向鼻腔中施用约500微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加泪液产生的任何上述实施方案的另一个实施方案中,向鼻腔中施用约1毫克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加泪液产生的任何上述实施方案的另一个实施方案中,向鼻腔中施用约1.5毫克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加泪液产生的任何上述实施方案的另一个实施方案中,向鼻腔中施用约2毫克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加泪液产生的任何上述实施方案的另一个实施方案中,向鼻腔中施用约2.5毫克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加泪液产生的任何上述实施方案的另一个实施方案中,向鼻腔中施用约3毫克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加泪液产生的任何上述实施方案的另一个实施方案中,向鼻腔中施用约4毫克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加泪液产生的任何上述实施方案的另一个实施方案中,向鼻腔中施用约5毫克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在一些实施方案中,所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0235]
在增加泪液产生的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于1微克与10毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加泪液产生的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于5微克与10毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加泪液产生的任何上述实施方案的另一个实施方
案中,向鼻腔中施用介于10微克与10毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加泪液产生的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于25微克与10毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加泪液产生的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于50微克与10毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加泪液产生的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于100微克与10毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加泪液产生的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于150微克与10毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在一些实施方案中,所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0236]
在增加泪液产生的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于1微克与10毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加泪液产生的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于1微克与5毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加泪液产生的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于1微克与4毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加泪液产生的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于1微克与3毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加泪液产生的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于1微克与2毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加泪液产生的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于1微克与1毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加泪液产生的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于1微克与750微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加泪液产生的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于1微克与600微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加泪液产生的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于1微克与100微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加泪液产生的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于1微克与50微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在一些实施方案中,所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0237]
在任何上述实施方案中,用于所述方法中的药物制剂包含约0.1mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含约0.2mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含约0.5mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含约1mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含约2mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含约3mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含约4mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含约5mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含约6mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包
含约7mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含约8mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含约9mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含约10mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含约12mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含约15mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含约20mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含约25mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含约30mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含约40mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含约50mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在一些实施方案中,所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0238]
在另一个实施方案中,用于所述方法中的药物制剂包含介于5mg/ml与200mg/ml之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含介于10mg/ml与200mg/ml之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含介于5mg/ml与100mg/ml之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含介于10mg/ml与75mg/ml之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含介于10mg/ml与50mg/ml之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含介于10mg/ml与30mg/ml之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含介于5mg/ml与50mg/ml之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在一些实施方案中,所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0239]
在另一个实施方案中,用于所述方法中的药物制剂包含介于10mg/ml与25mg/ml之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含介于10mg/ml与50mg/ml之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含介于20mg/ml与50mg/ml之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含介于30mg/ml与75mg/ml之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在一些实施方案中,所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0240]
在任何上述实施方案中,用于所述方法中的药物制剂以约10至200μl提供。在另一个实施方案中,用于所述方法中的药物制剂以约10至150μl提供。在另一个实施方案中,用于所述方法中的药物制剂以约10至100μl提供。在另一个实施方案中,用于所述方法中的药物制剂以约50至200μl提供。在另一个实施方案中,用于所述方法中的药物制剂以约100至
200μl提供。在另一个实施方案中,用于所述方法中的药物制剂以约50至100μl提供。在另一个实施方案中,用于所述方法中的药物制剂以约10至150μl提供。在另一个实施方案中,用于所述方法中的药物制剂以约10、20、30、40、50、60、70、80、90、100、110、120、130、140、150、160、170、180、190或200μl提供。在一些实施方案中,所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0241]
在增加泪液产生的任何上述实施方案的另一个实施方案中,每日施用式(i)、式(ii)、式(iiia)或式(iiib)化合物一次。在增加泪液产生的任何上述实施方案的另一个实施方案中,每日施用式(i)、式(ii)、式(iiia)或式(iiib)化合物至少一次。在增加泪液产生的任何上述实施方案的另一个实施方案中,每日施用式(i)、式(ii)、式(iiia)或式(iiib)化合物两次。在增加泪液产生的任何上述实施方案的另一个实施方案中,每日施用式(i)、式(ii)、式(iiia)或式(iiib)化合物至少两次。在增加泪液产生的任何上述实施方案的另一个实施方案中,每日施用式(i)、式(ii)、式(iiia)或式(iiib)化合物三次。在增加泪液产生的任何上述实施方案的另一个实施方案中,每日施用式(i)、式(ii)、式(iiia)或式(iiib)化合物至少三次。在增加泪液产生的任何上述实施方案的另一个实施方案中,施用式(i)、式(ii)、式(iiia)或式(iiib)化合物一天。在增加泪液产生的任何上述实施方案的另一个实施方案中,施用式(i)、式(ii)、式(iiia)或式(iiib)化合物至少两天。在增加泪液产生的任何上述实施方案的另一个实施方案中,施用式(i)、式(ii)、式(iiia)或式(iiib)化合物至少三天。在增加泪液产生的任何上述实施方案的另一个实施方案中,施用式(i)、式(ii)、式(iiia)或式(iiib)化合物至少四天。在增加泪液产生的任何上述实施方案的另一个实施方案中,施用式(i)、式(ii)、式(iiia)或式(iiib)化合物至少五天。在增加泪液产生的任何上述实施方案的另一个实施方案中,施用式(i)、式(ii)、式(iiia)或式(iiib)化合物至少七天。在增加泪液产生的任何上述实施方案的另一个实施方案中,施用式(i)、式(ii)、式(iiia)或式(iiib)化合物至少十天。在增加泪液产生的任何上述实施方案的另一个实施方案中,施用式(i)、式(ii)、式(iiia)或式(iiib)化合物至少十四天。在增加泪液产生的任何上述实施方案的另一个实施方案中,施用式(i)、式(ii)、式(iiia)或式(iiib)化合物至少二十一天。在增加泪液产生的任何上述实施方案的另一个实施方案中,施用式(i)、式(ii)、式(iiia)或式(iiib)化合物至少三十天。在一些实施方案中,所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0242]
在增加泪液产生的任何上述实施方案的另一个实施方案中,在交替鼻孔中施用式(i)、式(ii)、式(iiia)或式(iiib)化合物。举例来说,在一个鼻孔中,接着在预定量的时间之后在另一个鼻孔中施用式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,在两个鼻孔中施用式(i)、式(ii)、式(iiia)或式(iiib)化合物。举例来说,在一个鼻孔中,接着同时或在第一鼻孔之后立即在另一鼻孔中施用式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,在一个鼻孔中施用式(i)、式(ii)、式(iiia)或式(iiib)化合物。在一些实施方案中,所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0243]
在增加泪液产生的任何上述实施方案的另一个实施方案中,式(i)、式(ii)、式(iiia)或式(iiib)化合物呈液体、混悬剂、气雾剂、凝胶、软膏、干粉、乳膏、糊剂、洗剂或香膏形式施用至鼻腔中。在增加泪液产生的任何上述实施方案的另一个实施方案中,式(i)、
式(ii)、式(iiia)或式(iiib)化合物呈液体形式施用至鼻腔中。在增加泪液产生的任何上述实施方案的另一个实施方案中,式(i)、式(ii)、式(iiia)或式(iiib)化合物呈混悬剂形式施用至鼻腔中。在增加泪液产生的任何上述实施方案的另一个实施方案中,式(i)、式(ii)、式(iiia)或式(iiib)化合物呈气雾剂形式施用至鼻腔中。在增加泪液产生的任何上述实施方案的另一个实施方案中,式(i)、式(ii)、式(iiia)或式(iiib)化合物呈凝胶形式施用至鼻腔中。在增加泪液产生的任何上述实施方案的另一个实施方案中,式(i)、式(ii)、式(iiia)或式(iiib)化合物呈软膏形式施用至鼻腔中。在增加泪液产生的任何上述实施方案的另一个实施方案中,式(i)、式(ii)、式(iiia)或式(iiib)化合物呈干粉形式施用至鼻腔中。在增加泪液产生的任何上述实施方案的另一个实施方案中,式(i)、式(ii)、式(iiia)或式(iiib)化合物呈乳膏形式施用至鼻腔中。在增加泪液产生的任何上述实施方案的另一个实施方案中,式(i)、式(ii)、式(iiia)或式(iiib)化合物呈糊剂形式施用至鼻腔中。在增加泪液产生的任何上述实施方案的另一个实施方案中,式(i)、式(ii)、式(iiia)或式(iiib)化合物呈洗剂形式施用至鼻腔中。在增加泪液产生的任何上述实施方案的另一个实施方案中,式(i)、式(ii)、式(iiia)或式(iiib)化合物呈香膏形式施用至鼻腔中。在一些实施方案中,所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0244]
在增加泪液产生的任何上述实施方案的另一个实施方案中,通过注射器、滴管、瓶状雾化器、雾化泵、吸入器、喷粉装置、汽化器、贴片、施药棒、吸移管或液体喷射器将式(i)、式(ii)、式(iiia)或式(iiib)化合物施用至鼻腔中。在增加泪液产生的任何上述实施方案的另一个实施方案中,通过注射器将式(i)、式(ii)、式(iiia)或式(iiib)化合物施用至鼻腔中。在增加泪液产生的任何上述实施方案的另一个实施方案中,通过滴管将式(i)、式(ii)、式(iiia)或式(iiib)化合物施用至鼻腔中。在增加泪液产生的任何上述实施方案的另一个实施方案中,通过瓶状雾化器将式(i)、式(ii)、式(iiia)或式(iiib)化合物施用至鼻腔中。在增加泪液产生的任何上述实施方案的另一个实施方案中,通过雾化泵将式(i)、式(ii)、式(iiia)或式(iiib)化合物施用至鼻腔中。在增加泪液产生的任何上述实施方案的另一个实施方案中,通过吸入器将式(i)、式(ii)、式(iiia)或式(iiib)化合物施用至鼻腔中。在增加泪液产生的任何上述实施方案的另一个实施方案中,通过喷粉装置将式(i)、式(ii)、式(iiia)或式(iiib)化合物施用至鼻腔中。在增加泪液产生的任何上述实施方案的另一个实施方案中,通过汽化器将式(i)、式(ii)、式(iiia)或式(iiib)化合物施用至鼻腔中。在增加泪液产生的任何上述实施方案的另一个实施方案中,通过贴片将式(i)、式(ii)、式(iiia)或式(iiib)化合物施用至鼻腔中。在增加泪液产生的任何上述实施方案的另一个实施方案中,通过施药棒将式(i)、式(ii)、式(iiia)或式(iiib)化合物施用至鼻腔中。在增加泪液产生的任何上述实施方案的另一个实施方案中,通过吸移管将式(i)、式(ii)、式(iiia)或式(iiib)化合物施用至鼻腔中。在增加泪液产生的任何上述实施方案的另一个实施方案中,通过液体喷射器将式(i)、式(ii)、式(iiia)或式(iiib)化合物施用至鼻腔中。在一些实施方案中,所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0245]
在增加泪液产生的任何上述实施方案的另一个实施方案中,使三叉神经活化。在增加泪液产生的另一个实施方案中,使筛前神经活化。在增加泪液产生的任何上述实施方
案的另一个实施方案中,使鼻泪反射活化。在一些实施方案中,所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0246]
在增加泪液产生的任何上述实施方案的另一个实施方案中,通过增加泪液产生而得以减轻的病状为急性病状。急性病状是指存在具有健康影响的快速发作的病状,其被视为短暂而非长期的。急性病状可能由眼科手术程序或其他眼科治疗引起。在一些实施方案中,所述眼科手术程序为白内障手术(白内障摘除术和晶状体置换)、屈旋光性晶体置换、青光眼手术、lasik手术(雷射眼部手术)、玻璃体切除术、视网膜光凝固术、视网膜脱离修复、黄斑裂孔修复、虹膜后肿瘤或肿块移除、后巩膜切开术、视神经切开术或减少泪腺功能的其他治疗。在一些实施方案中,所述眼科治疗包括辐射疗法。在一些实施方案中,所述辐射疗法针对眼窝区域,例如与头和/或颈癌相关。在一些实施方案中,所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0247]
治疗干眼
[0248]
在一些实施方案中,本文中提供一种治疗受试者的干眼的方法。在一些实施方案中为一种治疗干眼的方法,其包括将治疗有效量的式(i)、式(ii)、式(iiia)或式(iiib)化合物局部施用至有需要的个体的鼻腔中,其中所述式(i)、式(ii)、式(iiia)或式(iiib)化合物选择性地结合至外周烟碱乙酰胆碱受体且不会以药理学相关的浓度越过血脑屏障。在一些实施方案中为治疗干眼的方法,其包括将治疗有效量的式(i)、式(ii)、式(iiia)或式(iiib)化合物局部施用至有需要的个体的鼻腔中,其中所述式(i)、式(ii)、式(iiia)或式(iiib)化合物不会以药理学相关的浓度越过血脑屏障且选择性地结合至选自α3β4、α4β2和α7的外周烟碱乙酰胆碱受体亚型中的至少一者。在一些实施方案中为治疗干眼的方法,其包括将治疗有效量的式(i)、式(ii)、式(iiia)或式(iiib)化合物局部施用至有需要的个体的鼻腔中,其中所述式(i)、式(ii)、式(iiia)或式(iiib)化合物不会以药理学相关的浓度越过血脑屏障且选择性地结合至外周烟碱乙酰胆碱受体亚型α3β4。在一些实施方案中为治疗干眼的方法,其包括将治疗有效量的式(i)、式(ii)、式(iiia)或式(iiib)化合物局部施用至有需要的个体的鼻腔中,其中所述式(i)、式(ii)、式(iiia)或式(iiib)化合物不会以药理学相关的浓度越过血脑屏障且选择性地结合至外周烟碱乙酰胆碱受体亚型α4β2。在一些实施方案中为治疗干眼的方法,其包括将治疗有效量的式(i)、式(ii)、式(iiia)或式(iiib)化合物局部施用至有需要的个体的鼻腔中,其中所述式(i)、式(ii)、式(iiia)或式(iiib)化合物不会以药理学相关的浓度越过血脑屏障且选择性地结合至外周烟碱乙酰胆碱受体亚型α7。在一些实施方案中为一种治疗干眼的方法,其包括将治疗有效量的式(i)、式(ii)、式(iiia)或式(iiib)化合物局部施用至有需要的个体的鼻腔中,其中所述式(i)、式(ii)、式(iiia)或式(iiib)化合物选择性地结合至外周烟碱乙酰胆碱受体且以不具全身性生物可利用性的量施用。在一些实施方案中为一种治疗干眼的方法,其包括将治疗有效量的式(i)、式(ii)、式(iiia)或式(iiib)化合物局部施用至有需要的个体的鼻腔中,其中所述式(i)、式(ii)、式(iiia)或式(iiib)化合物选择性地结合至外周烟碱乙酰胆碱受体且以不会引起不希望的精神副作用的量施用。在一些实施方案中为一种治疗干眼的方法,其包括将治疗有效量的式(i)、式(ii)、式(iiia)或式(iiib)化合物局部施用至有需要的个体的鼻腔中,其中所述式(i)、式(ii)、式(iiia)或式(iiib)化合物选择性地结合至外周烟碱乙酰胆碱受体且以不会引起不希望的全身性副作用的量施用。在一些实施方案中为一种治
疗干眼的方法,其包括将治疗有效量的式(i)、式(ii)、式(iiia)或式(iiib)化合物局部施用至有需要的个体的鼻腔中,其中所述式(i)、式(ii)、式(iiia)或式(iiib)化合物选择性地结合至外周烟碱乙酰胆碱受体且以产生局部作用的量施用。在一些实施方案中为一种治疗干眼的方法,其还包括局部施用预防或促进烟碱乙酰胆碱受体从减敏状态恢复的一种或多种物质。在一些实施方案中为一种治疗干眼的方法,其还包括局部施用防止或减少烟碱乙酰胆碱受体进入减敏状态或促进烟碱乙酰胆碱受体从减敏状态恢复的一种或多种物质。在一些实施方案中,所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0249]
在本文中所描述的治疗干眼的方法的一些实施方案中,所述式(i)、式(ii)、式(iiia)或式(iiib)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶(或化合物1)。在本文中所描述的方法的一些实施方案中,所述式(i)、式(ii)、式(iiia)或式(iiib)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。在本文中所描述的方法的一些实施方案中,所述式(i)、式(ii)、式(iiia)或式(iiib)化合物为呈游离碱形式的(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶。在本文中所描述的治疗干眼的方法的一些实施方案中,所述式(i)、式(ii)、式(iiia)或式(iiib)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶柠檬酸盐。在本文中所描述的治疗干眼的方法的一些实施方案中,所述式(i)、式(ii)、式(iiia)或式(iiib)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶单柠檬酸盐。在本文中所描述的治疗干眼的方法的一些实施方案中,所述式(i)、式(ii)、式(iiia)或式(iiib)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶hcl盐。在本文中所描述的治疗干眼的方法的一些实施方案中,所述式(i)、式(ii)、式(iiia)或式(iiib)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶粘酸盐。在本文中所描述的治疗干眼的方法的一些实施方案中,所述式(i)、式(ii)、式(iiia)或式(iiib)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶半粘酸盐。在本文中所描述的治疗干眼的方法的一些实施方案中,所述式(i)、式(ii)、式(iiia)或式(iiib)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶半粘酸盐单水合物。在本文中所描述的方法的一些实施方案中,所述式(i)、式(ii)、式(iiia)或式(iiib)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶半粘酸盐二水合物。
[0250]
在一些实施方案中为一种治疗干眼的方法,其还包括局部施用预防或促进烟碱乙酰胆碱受体从减敏状态恢复的一种或多种物质,所述一种或多种物质选自蛋白激酶c(pkc)或者上调或向上调节pkc的因子、camp依赖性蛋白激酶(pka)或者上调或向上调节pka的因子和钙调磷酸酶抑制剂。在一些实施方案中为一种治疗干眼的方法,其还包括局部施用防止或减少烟碱乙酰胆碱受体进入减敏状态或促进烟碱乙酰胆碱受体从减敏状态恢复的一种或多种物质,所述一种或多种物质选自蛋白激酶c(pkc)或者上调或向上调节pkc的因子、camp依赖性蛋白激酶(pka)或者上调或向上调节pka的因子和钙调磷酸酶抑制剂。在一些实施方案中为一种治疗干眼的方法,其还包括局部施用蛋白激酶c(pkc)或者上调或向上调节pkc的因子。在一些实施方案中为一种治疗干眼的方法,其还包括局部施用camp依赖性蛋白激酶(pka)或者上调或向上调节pka的因子。在一些实施方案中为一种治疗干眼的方法,其还包括局部施用钙调磷酸酶抑制剂。在一些实施方案中为一种治疗干眼的方法,其还包括局部施用钙调磷酸酶抑制剂,其中所述钙调磷酸酶抑制剂选自环孢霉素、吡美莫司和他克莫司。在一些实施方案中为一种治疗干眼的方法,其还包括局部施用环孢霉素。在一些实施
方案中为一种治疗干眼的方法,其还包括局部施用吡美莫司。在一些实施方案中为一种治疗干眼的方法,其还包括局部施用他克莫司。
[0251]
在治疗干眼的任何上述实施方案的另一个实施方案中,向鼻腔中施用至少1微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在治疗干眼的任何上述实施方案的另一个实施方案中,向鼻腔中施用至少5微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在治疗干眼的任何上述实施方案的另一个实施方案中,向鼻腔中施用至少10微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在治疗干眼的任何上述实施方案的另一个实施方案中,向鼻腔中施用至少25微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在治疗干眼的任何上述实施方案的另一个实施方案中,向鼻腔中施用至少50微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在治疗干眼的任何上述实施方案的另一个实施方案中,向鼻腔中施用至少100微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在治疗干眼的任何上述实施方案的另一个实施方案中,向鼻腔中施用至少250微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在治疗干眼的任何上述实施方案的另一个实施方案中,向鼻腔中施用至少500微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在治疗干眼的任何上述实施方案的另一个实施方案中,向鼻腔中施用至少750微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在治疗干眼的任何上述实施方案的另一个实施方案中,向鼻腔中施用至少1000微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在一些实施方案中,所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0252]
在治疗干眼的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于1微克与1000微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在治疗干眼的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于5微克与1000微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在治疗干眼的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于10微克与1000微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在治疗干眼的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于5微克与100微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在治疗干眼的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于5微克与50微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在治疗干眼的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于10微克与50微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在治疗干眼的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于25微克与1000微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在治疗干眼的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于50微克与1000微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在治疗干眼的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于100微克与1000微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在治疗干眼的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于150微克与1000微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在治疗干眼的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于100微克与750微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在治疗干眼的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于150微克与750微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在治疗干眼的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于150微克与600微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。
在一些实施方案中,所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0253]
在治疗干眼的任何上述实施方案的另一个实施方案中,向鼻腔中施用少于100微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在治疗干眼的任何上述实施方案的另一个实施方案中,向鼻腔中施用少于75微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在治疗干眼的任何上述实施方案的另一个实施方案中,向鼻腔中施用少于50微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在治疗干眼的任何上述实施方案的另一个实施方案中,向鼻腔中施用少于25微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在治疗干眼的任何上述实施方案的另一个实施方案中,向鼻腔中施用少于15微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在治疗干眼的任何上述实施方案的另一个实施方案中,向鼻腔中施用约75微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在治疗干眼的任何上述实施方案的另一个实施方案中,向鼻腔中施用约50微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在治疗干眼的任何上述实施方案的另一个实施方案中,向鼻腔中施用约25微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在治疗干眼的任何上述实施方案的另一个实施方案中,向鼻腔中施用约10微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在一些实施方案中,所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0254]
在治疗干眼的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于1微克与100微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在治疗干眼的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于1微克与75微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在治疗干眼的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于5微克与100微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在治疗干眼的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于5微克与75微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在治疗干眼的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于15微克与100微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在治疗干眼的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于15微克与75微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在治疗干眼的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于25微克与100微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在治疗干眼的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于25微克与75微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在治疗干眼的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于25微克与60微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。
[0255]
在治疗干眼的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于500微克与10毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在治疗干眼的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于500微克与5毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在治疗干眼的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于500微克与3毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在治疗干眼的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于500微克与2毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在治疗干眼的任何上述实施方案的另一个实施
方案中,向鼻腔中施用介于1毫克与10毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在治疗干眼的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于1毫克与5毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在治疗干眼的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于1毫克与3毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在治疗干眼的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于1毫克与2毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在治疗干眼的任何上述实施方案的另一个实施方案中,向鼻腔中施用约500微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在治疗干眼的任何上述实施方案的另一个实施方案中,向鼻腔中施用约1毫克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在治疗干眼的任何上述实施方案的另一个实施方案中,向鼻腔中施用约1.5毫克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在治疗干眼的任何上述实施方案的另一个实施方案中,向鼻腔中施用约2毫克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在治疗干眼的任何上述实施方案的另一个实施方案中,向鼻腔中施用约2.5毫克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在治疗干眼的任何上述实施方案的另一个实施方案中,向鼻腔中施用约3毫克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在治疗干眼的任何上述实施方案的另一个实施方案中,向鼻腔中施用约4毫克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在治疗干眼的任何上述实施方案的另一个实施方案中,向鼻腔中施用约5毫克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在一些实施方案中,所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0256]
在治疗干眼的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于1微克与10毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在治疗干眼的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于5微克与10毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在治疗干眼的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于10微克与10毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在治疗干眼的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于25微克与10毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在治疗干眼的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于50微克与10毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在治疗干眼的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于100微克与10毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在治疗干眼的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于150微克与10毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在一些实施方案中,所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0257]
在治疗干眼的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于1微克与10毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在治疗干眼的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于1微克与5毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在治疗干眼的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于1微克与4毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在治疗干眼的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于1微克与3毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在治疗干眼的任何上述实施方案的另一个实施方案
中,向鼻腔中施用介于1微克与2毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在治疗干眼的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于1微克与1毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在治疗干眼的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于1微克与750微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在治疗干眼的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于1微克与600微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在治疗干眼的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于1微克与100微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在治疗干眼的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于1微克与50微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在一些实施方案中,所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0258]
在任何上述实施方案中,用于所述方法中的药物制剂包含约0.1mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含约0.2mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含约0.5mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含约1mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含约2mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含约3mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含约4mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含约5mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含约6mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含约7mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含约8mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含约9mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含约10mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含约12mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含约15mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含约20mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含约25mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含约30mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含约40mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含约50mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在一些实施方案中,所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0259]
在另一个实施方案中,用于所述方法中的药物制剂包含介于5mg/ml与200mg/ml之
间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含介于10mg/ml与200mg/ml之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含介于5mg/ml与100mg/ml之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含介于10mg/ml与75mg/ml之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含介于10mg/ml与50mg/ml之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含介于10mg/ml与30mg/ml之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含介于5mg/ml与50mg/ml之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在一些实施方案中,所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0260]
在另一个实施方案中,用于所述方法中的药物制剂包含介于10mg/ml与25mg/ml之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含介于10mg/ml与50mg/ml之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含介于20mg/ml与50mg/ml之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含介于30mg/ml与75mg/ml之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在一些实施方案中,所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0261]
在任何上述实施方案中,用于所述方法中的药物制剂以约10至200μl提供。在另一个实施方案中,用于所述方法中的药物制剂以约10至150μl提供。在另一个实施方案中,用于所述方法中的药物制剂以约10至100μl提供。在另一个实施方案中,用于所述方法中的药物制剂以约50至200μl提供。在另一个实施方案中,用于所述方法中的药物制剂以约100至200μl提供。在另一个实施方案中,用于所述方法中的药物制剂以约50至100μl提供。在另一个实施方案中,用于所述方法中的药物制剂以约10至150μl提供。在另一个实施方案中,用于所述方法中的药物制剂以约10、20、30、40、50、60、70、80、90、100、110、120、130、140、150、160、170、180、190或200μl提供。在一些实施方案中,所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0262]
在治疗干眼的任何上述实施方案的另一个实施方案中,每日施用式(i)、式(ii)、式(iiia)或式(iiib)化合物一次。在治疗干眼的任何上述实施方案的另一个实施方案中,每日施用式(i)、式(ii)、式(iiia)或式(iiib)化合物至少一次。在治疗干眼的任何上述实施方案的另一个实施方案中,每日施用式(i)、式(ii)、式(iiia)或式(iiib)化合物两次。在治疗干眼的任何上述实施方案的另一个实施方案中,每日施用式(i)、式(ii)、式(iiia)或式(iiib)化合物至少两次。在治疗干眼的任何上述实施方案的另一个实施方案中,每日施用式(i)、式(ii)、式(iiia)或式(iiib)化合物三次。在治疗干眼的任何上述实施方案的另一个实施方案中,每日施用式(i)、式(ii)、式(iiia)或式(iiib)化合物至少三次。在治疗干眼的任何上述实施方案的另一个实施方案中,施用式(i)、式(ii)、式(iiia)或式(iiib)化合物一天。在治疗干眼的任何上述实施方案的另一个实施方案中,施用式(i)、式(ii)、式(iiia)或式(iiib)化合物至少两天。在治疗干眼的任何上述实施方案的另一个实施方案
中,施用式(i)、式(ii)、式(iiia)或式(iiib)化合物至少三天。在治疗干眼的任何上述实施方案的另一个实施方案中,施用式(i)、式(ii)、式(iiia)或式(iiib)化合物至少四天。在治疗干眼的任何上述实施方案的另一个实施方案中,施用式(i)、式(ii)、式(iiia)或式(iiib)化合物至少五天。在治疗干眼的任何上述实施方案的另一个实施方案中,施用式(i)、式(ii)、式(iiia)或式(iiib)化合物至少七天。在治疗干眼的任何上述实施方案的另一个实施方案中,施用式(i)、式(ii)、式(iiia)或式(iiib)化合物至少十天。在治疗干眼的任何上述实施方案的另一个实施方案中,施用式(i)、式(ii)、式(iiia)或式(iiib)化合物至少十四天。在治疗干眼的任何上述实施方案的另一个实施方案中,施用式(i)、式(ii)、式(iiia)或式(iiib)化合物至少二十一天。在治疗干眼的任何上述实施方案的另一个实施方案中,施用式(i)、式(ii)、式(iiia)或式(iiib)化合物至少三十天。在一些实施方案中,所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0263]
在治疗干眼的任何上述实施方案的另一个实施方案中,在交替鼻孔中施用式(i)、式(ii)、式(iiia)或式(iiib)化合物。举例来说,在一个鼻孔中,接着在预定量的时间之后在另一个鼻孔中施用式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,在两个鼻孔中施用式(i)、式(ii)、式(iiia)或式(iiib)化合物。举例来说,在一个鼻孔中,接着同时或在第一鼻孔之后立即在另一鼻孔中施用式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,在一个鼻孔中施用式(i)、式(ii)、式(iiia)或式(iiib)化合物。在一些实施方案中,所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0264]
在治疗干眼的任何上述实施方案的另一个实施方案中,式(i)、式(ii)、式(iiia)或式(iiib)化合物呈液体、混悬剂、气雾剂、凝胶、软膏、干粉、乳膏、糊剂、洗剂或香膏形式施用至鼻腔中。在治疗干眼的任何上述实施方案的另一个实施方案中,式(i)、式(ii)、式(iiia)或式(iiib)化合物呈液体形式施用至鼻腔中。在治疗干眼的任何上述实施方案的另一个实施方案中,式(i)、式(ii)、式(iiia)或式(iiib)化合物呈混悬剂形式施用至鼻腔中。在治疗干眼的任何上述实施方案的另一个实施方案中,式(i)、式(ii)、式(iiia)或式(iiib)化合物呈气雾剂形式施用至鼻腔中。在治疗干眼的任何上述实施方案的另一个实施方案中,式(i)、式(ii)、式(iiia)或式(iiib)化合物呈凝胶形式施用至鼻腔中。在治疗干眼的任何上述实施方案的另一个实施方案中,式(i)、式(ii)、式(iiia)或式(iiib)化合物呈软膏形式施用至鼻腔中。在治疗干眼的任何上述实施方案的另一个实施方案中,式(i)、式(ii)、式(iiia)或式(iiib)化合物呈干粉形式施用至鼻腔中。在治疗干眼的任何上述实施方案的另一个实施方案中,式(i)、式(ii)、式(iiia)或式(iiib)化合物呈乳膏形式施用至鼻腔中。在治疗干眼的任何上述实施方案的另一个实施方案中,式(i)、式(ii)、式(iiia)或式(iiib)化合物呈糊剂形式施用至鼻腔中。在治疗干眼的任何上述实施方案的另一个实施方案中,式(i)、式(ii)、式(iiia)或式(iiib)化合物呈洗剂形式施用至鼻腔中。在治疗干眼的任何上述实施方案的另一个实施方案中,式(i)、式(ii)、式(iiia)或式(iiib)化合物呈香膏形式施用至鼻腔中。在一些实施方案中,所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0265]
在治疗干眼的任何上述实施方案的另一个实施方案中,通过注射器、滴管、瓶状雾化器、雾化泵、吸入器、喷粉装置、汽化器、贴片、施药棒、吸移管或液体喷射器将式(i)、式
(ii)、式(iiia)或式(iiib)化合物施用至鼻腔中。在治疗干眼的任何上述实施方案的另一个实施方案中,通过注射器将式(i)、式(ii)、式(iiia)或式(iiib)化合物施用至鼻腔中。在治疗干眼的任何上述实施方案的另一个实施方案中,通过滴管将式(i)、式(ii)、式(iiia)或式(iiib)化合物施用至鼻腔中。在治疗干眼的任何上述实施方案的另一个实施方案中,通过瓶状雾化器将式(i)、式(ii)、式(iiia)或式(iiib)化合物施用至鼻腔中。在治疗干眼的任何上述实施方案的另一个实施方案中,通过雾化泵将式(i)、式(ii)、式(iiia)或式(iiib)化合物施用至鼻腔中。在治疗干眼的任何上述实施方案的另一个实施方案中,通过吸入器将式(i)、式(ii)、式(iiia)或式(iiib)化合物施用至鼻腔中。在治疗干眼的任何上述实施方案的另一个实施方案中,通过喷粉装置将式(i)、式(ii)、式(iiia)或式(iiib)化合物施用至鼻腔中。在治疗干眼的任何上述实施方案的另一个实施方案中,通过汽化器将式(i)、式(ii)、式(iiia)或式(iiib)化合物施用至鼻腔中。在治疗干眼的任何上述实施方案的另一个实施方案中,通过贴片将式(i)、式(ii)、式(iiia)或式(iiib)化合物施用至鼻腔中。在治疗干眼的任何上述实施方案的另一个实施方案中,通过施药棒将式(i)、式(ii)、式(iiia)或式(iiib)化合物施用至鼻腔中。在治疗干眼的任何上述实施方案的另一个实施方案中,通过吸移管将式(i)、式(ii)、式(iiia)或式(iiib)化合物施用至鼻腔中。在治疗干眼的任何上述实施方案的另一个实施方案中,通过液体喷射器将式(i)、式(ii)、式(iiia)或式(iiib)化合物施用至鼻腔中。在一些实施方案中,所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0266]
在治疗干眼的任何上述实施方案的另一个实施方案中,使三叉神经活化。在治疗干眼的另一个实施方案中,使筛前神经活化。在治疗干眼的任何上述实施方案的另一个实施方案中,使鼻泪反射活化。在一些实施方案中,所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0267]
在治疗干眼的任何上述实施方案的另一个实施方案中,通过治疗干眼而得以减轻的病状为急性病状。急性病状是指存在具有健康影响的快速发作的病状,其被视为短暂而非长期的。急性病状可能由眼科手术程序或其他眼科治疗引起。在一些实施方案中,所述眼科手术程序为白内障手术(白内障摘除术和晶状体置换)、屈旋光性晶体置换、青光眼手术、lasik手术(雷射眼部手术)、玻璃体切除术、视网膜光凝固术、视网膜脱离修复、黄斑裂孔修复、虹膜后肿瘤或肿块移除、后巩膜切开术、视神经切开术或减少泪腺功能的其他治疗。在一些实施方案中,所述眼科治疗包括辐射疗法。在一些实施方案中,所述辐射疗法针对眼窝区域,例如与头和/或颈癌相关。在一些实施方案中,所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0268]
改善眼部不适
[0269]
在一些实施方案中,本文中提供一种改善受试者的眼部不适的方法。在一些实施方案中为一种改善眼部不适的方法,其包括将治疗有效量的式(i)、式(ii)、式(iiia)或式(iiib)化合物局部施用至有需要的个体的鼻腔中,其中所述式(i)、式(ii)、式(iiia)或式(iiib)化合物选择性地结合至外周烟碱乙酰胆碱受体且不会以药理学相关的浓度越过血脑屏障。在一些实施方案中为改善眼部不适的方法,其包括将治疗有效量的式(i)、式(ii)、式(iiia)或式(iiib)化合物局部施用至有需要的个体的鼻腔中,其中所述式(i)、式(ii)、式(iiia)或式(iiib)化合物不会以药理学相关的浓度越过血脑屏障且选择性地结合至选
自α3β4、α4β2和α7的外周烟碱乙酰胆碱受体亚型中的至少一者。在一些实施方案中为改善眼部不适的方法,其包括将治疗有效量的式(i)、式(ii)、式(iiia)或式(iiib)化合物局部施用至有需要的个体的鼻腔中,其中所述式(i)、式(ii)、式(iiia)或式(iiib)化合物不会以药理学相关的浓度越过血脑屏障且选择性地结合至外周烟碱乙酰胆碱受体亚型α3β4。在一些实施方案中为改善眼部不适的方法,其包括将治疗有效量的式(i)、式(ii)、式(iiia)或式(iiib)化合物局部施用至有需要的个体的鼻腔中,其中所述式(i)、式(ii)、式(iiia)或式(iiib)化合物不会以药理学相关的浓度越过血脑屏障且选择性地结合至外周烟碱乙酰胆碱受体亚型α4β2。在一些实施方案中为改善眼部不适的方法,其包括将治疗有效量的式(i)、式(ii)、式(iiia)或式(iiib)化合物局部施用至有需要的个体的鼻腔中,其中所述式(i)、式(ii)、式(iiia)或式(iiib)化合物不会以药理学相关的浓度越过血脑屏障且选择性地结合至外周烟碱乙酰胆碱受体亚型α7。在一些实施方案中为一种改善眼部不适的方法,其包括将治疗有效量的式(i)、式(ii)、式(iiia)或式(iiib)化合物局部施用至有需要的个体的鼻腔中,其中所述式(i)、式(ii)、式(iiia)或式(iiib)化合物选择性地结合至外周烟碱乙酰胆碱受体且以不具全身性生物可利用性的量施用。在一些实施方案中为一种改善眼部不适的方法,其包括将治疗有效量的式(i)、式(ii)、式(iiia)或式(iiib)化合物局部施用至有需要的个体的鼻腔中,其中所述式(i)、式(ii)、式(iiia)或式(iiib)化合物选择性地结合至外周烟碱乙酰胆碱受体且以不会引起不希望的精神副作用的量施用。在一些实施方案中为一种改善眼部不适的方法,其包括将治疗有效量的式(i)、式(ii)、式(iiia)或式(iiib)化合物局部施用至有需要的个体的鼻腔中,其中所述式(i)、式(ii)、式(iiia)或式(iiib)化合物选择性地结合至外周烟碱乙酰胆碱受体且以不会引起不希望的全身性副作用的量施用。在一些实施方案中为一种改善眼部不适的方法,其包括将治疗有效量的式(i)、式(ii)、式(iiia)或式(iiib)化合物局部施用至有需要的个体的鼻腔中,其中所述式(i)、式(ii)、式(iiia)或式(iiib)化合物选择性地结合至外周烟碱乙酰胆碱受体且以产生局部作用的量施用。在一些实施方案中为一种改善眼部不适的方法,其还包括局部施用预防或促进烟碱乙酰胆碱受体从减敏状态恢复的一种或多种物质。在一些实施方案中为一种改善眼部不适的方法,其还包括局部施用防止或减少烟碱乙酰胆碱受体进入减敏状态或促进烟碱乙酰胆碱受体从减敏状态恢复的一种或多种物质。在一些实施方案中,所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0270]
在本文中所描述的改善眼部不适的方法的一些实施方案中,所述式(i)、式(ii)、式(iiia)或式(iiib)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶(或化合物1)。在本文中所描述的方法的一些实施方案中,所述式(i)、式(ii)、式(iiia)或式(iiib)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。在本文中所描述的改善眼部不适的方法的一些实施方案中,所述式(i)、式(ii)、式(iiia)或式(iiib)化合物为呈游离碱形式的(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶。在本文中所描述的改善眼部不适的方法的一些实施方案中,所述式(i)、式(ii)、式(iiia)或式(iiib)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶柠檬酸盐。在本文中所描述的改善眼部不适的方法的一些实施方案中,所述式(i)、式(ii)、式(iiia)或式(iiib)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶单柠檬酸盐。在本文中所描述的改善眼部不适的方法的一些实施方案中,所述式(i)、式(ii)、式(iiia)或式(iiib)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶hcl
盐。在本文中所描述的改善眼部不适的方法的一些实施方案中,所述式(i)、式(ii)、式(iiia)或式(iiib)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶粘酸盐。在本文中所描述的改善眼部不适的方法的一些实施方案中,所述式(i)、式(ii)、式(iiia)或式(iiib)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶半粘酸盐。在本文中所描述的改善眼部不适的方法的一些实施方案中,所述式(i)、式(ii)、式(iiia)或式(iiib)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶半粘酸盐单水合物。在本文中所描述的方法的一些实施方案中,所述式(i)、式(ii)、式(iiia)或式(iiib)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶半粘酸盐二水合物。
[0271]
在一些实施方案中为一种改善眼部不适的方法,其还包括局部施用预防或促进烟碱乙酰胆碱受体从减敏状态恢复的一种或多种物质,所述一种或多种物质选自蛋白激酶c(pkc)或者上调或向上调节pkc的因子、camp依赖性蛋白激酶(pka)或者上调或向上调节pka的因子和钙调磷酸酶抑制剂。在一些实施方案中为一种改善眼部不适的方法,其还包括局部施用防止或减少烟碱乙酰胆碱受体进入减敏状态或促进烟碱乙酰胆碱受体从减敏状态恢复的一种或多种物质,所述一种或多种物质选自蛋白激酶c(pkc)或者上调或向上调节pkc的因子、camp依赖性蛋白激酶(pka)或者上调或向上调节pka的因子和钙调磷酸酶抑制剂。在一些实施方案中为一种改善眼部不适的方法,其还包括局部施用蛋白激酶c(pkc)或者上调或向上调节pkc的因子。在一些实施方案中为一种改善眼部不适的方法,其还包括局部施用camp依赖性蛋白激酶(pka)或者上调或向上调节pka的因子。在一些实施方案中为一种改善眼部不适的方法,其还包括局部施用钙调磷酸酶抑制剂。在一些实施方案中为一种改善眼部不适的方法,其还包括局部施用钙调磷酸酶抑制剂,其中所述钙调磷酸酶抑制剂选自环孢霉素、吡美莫司和他克莫司。在一些实施方案中为一种改善眼部不适的方法,其还包括局部施用环孢霉素。在一些实施方案中为一种改善眼部不适的方法,其还包括局部施用吡美莫司。在一些实施方案中为一种改善眼部不适的方法,其还包括局部施用他克莫司。
[0272]
在改善眼部不适的任何上述实施方案的另一个实施方案中,所述眼部不适与干眼病相关。在改善眼部不适的任何上述实施方案的另一个实施方案中,所述眼部不适与干眼病的症状相关。在改善眼部不适的任何上述实施方案的另一个实施方案中,所述眼部不适与干眼病的症状相关;其中此类症状选自瘙痒、干燥、畏光、模糊、疼痛、粘感、灼热、刺痛和异物感。在一些实施方案中,所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0273]
在改善眼部不适的任何上述实施方案的另一个实施方案中,所述眼部不适与睑缘炎相关。在改善眼部不适的任何上述实施方案的另一个实施方案中,所述眼部不适与睑腺功能障碍相关。在改善眼部不适的任何上述实施方案的另一个实施方案中,所述眼部不适与过敏性结膜炎相关。在改善眼部不适的任何上述实施方案的另一个实施方案中,所述眼部不适与眼表面中毒和刺激相关。在改善眼部不适的任何上述实施方案的另一个实施方案中,所述眼部不适与泪排泄问题相关。在改善眼部不适的任何上述实施方案的另一个实施方案中,所述眼部不适与眼睑病症相关。在一些实施方案中,所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0274]
在改善眼部不适的任何上述实施方案的另一个实施方案中,所述眼部不适与急性病状相关。急性病状是指存在具有健康影响的快速发作的病状,其被视为短暂而非长期的。
急性病状可能由眼科手术程序或其他眼科治疗引起。在一些实施方案中,所述眼科手术程序为白内障手术(白内障摘除术和晶状体置换)、屈旋光性晶体置换、青光眼手术、lasik手术(雷射眼部手术)、玻璃体切除术、视网膜光凝固术、视网膜脱离修复、黄斑裂孔修复、虹膜后肿瘤或肿块移除、后巩膜切开术、视神经切开术或减少泪腺功能的其他治疗。在一些实施方案中,所述眼科治疗包括辐射疗法。在一些实施方案中,所述辐射疗法针对眼窝区域,例如与头和/或颈癌相关。在一些实施方案中,所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0275]
在改善眼部不适的任何上述实施方案的另一个实施方案中,向鼻腔中施用至少1微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在改善眼部不适的任何上述实施方案的另一个实施方案中,向鼻腔中施用至少5微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在改善眼部不适的任何上述实施方案的另一个实施方案中,向鼻腔中施用至少10微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在改善眼部不适的任何上述实施方案的另一个实施方案中,向鼻腔中施用至少25微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在改善眼部不适的任何上述实施方案的另一个实施方案中,向鼻腔中施用至少50微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在改善眼部不适的任何上述实施方案的另一个实施方案中,向鼻腔中施用至少100微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在改善眼部不适的任何上述实施方案的另一个实施方案中,向鼻腔中施用至少250微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在改善眼部不适的任何上述实施方案的另一个实施方案中,向鼻腔中施用至少500微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在改善眼部不适的任何上述实施方案的另一个实施方案中,向鼻腔中施用至少750微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在改善眼部不适的任何上述实施方案的另一个实施方案中,向鼻腔中施用至少1000微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在一些实施方案中,所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0276]
在改善眼部不适的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于1微克与1000微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在改善眼部不适的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于5微克与1000微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在改善眼部不适的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于10微克与1000微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在改善眼部不适的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于5微克与100微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在改善眼部不适的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于5微克与50微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在改善眼部不适的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于10微克与50微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在改善眼部不适的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于25微克与1000微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在改善眼部不适的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于50微克与1000微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在改善眼部不适的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于100微克与1000微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在
改善眼部不适的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于150微克与1000微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在改善眼部不适的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于100微克与750微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在改善眼部不适的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于150微克与750微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在改善眼部不适的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于150微克与600微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在一些实施方案中,所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0277]
在改善眼部不适的任何上述实施方案的另一个实施方案中,向鼻腔中施用少于100微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在改善眼部不适的任何上述实施方案的另一个实施方案中,向鼻腔中施用少于75微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在改善眼部不适的任何上述实施方案的另一个实施方案中,向鼻腔中施用少于50微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在改善眼部不适的任何上述实施方案的另一个实施方案中,向鼻腔中施用少于25微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在改善眼部不适的任何上述实施方案的另一个实施方案中,向鼻腔中施用少于15微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在改善眼部不适的任何上述实施方案的另一个实施方案中,向鼻腔中施用约75微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在改善眼部不适的任何上述实施方案的另一个实施方案中,向鼻腔中施用约50微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在改善眼部不适的任何上述实施方案的另一个实施方案中,向鼻腔中施用约25微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在改善眼部不适的任何上述实施方案的另一个实施方案中,向鼻腔中施用约10微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。
[0278]
在改善眼部不适的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于1微克与100微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在改善眼部不适的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于1微克与75微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在改善眼部不适的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于5微克与100微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在改善眼部不适的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于5微克与75微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在改善眼部不适的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于15微克与100微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在改善眼部不适的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于15微克与75微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在改善眼部不适的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于25微克与100微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在改善眼部不适的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于25微克与75微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在改善眼部不适的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于25微克与60微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在一些实施方案中,所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0279]
在改善眼部不适的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于500微克与10毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在改善眼部不适的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于500微克与5毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加改善眼部不适的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于500微克与3毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在改善眼部不适的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于500微克与2毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在改善眼部不适的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于1毫克与10毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在改善眼部不适的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于1毫克与5毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在改善眼部不适的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于1毫克与3毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在改善眼部不适的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于1毫克与2毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在改善眼部不适的任何上述实施方案的另一个实施方案中,向鼻腔中施用约500微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在改善眼部不适的任何上述实施方案的另一个实施方案中,向鼻腔中施用约1毫克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在改善眼部不适的任何上述实施方案的另一个实施方案中,向鼻腔中施用约1.5毫克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在改善眼部不适的任何上述实施方案的另一个实施方案中,向鼻腔中施用约2毫克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在改善眼部不适的任何上述实施方案的另一个实施方案中,向鼻腔中施用约2.5毫克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在改善眼部不适的任何上述实施方案的另一个实施方案中,向鼻腔中施用约3毫克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在改善眼部不适的任何上述实施方案的另一个实施方案中,向鼻腔中施用约4毫克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在改善眼部不适的任何上述实施方案的另一个实施方案中,向鼻腔中施用约5毫克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在一些实施方案中,所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0280]
在改善眼部不适的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于1微克与10毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在改善眼部不适的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于5微克与10毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在改善眼部不适的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于10微克与10毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在改善眼部不适的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于25微克与10毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在改善眼部不适的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于50微克与10毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在改善眼部不适的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于100微克与10毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在改善眼部不适的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于150微克与10毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在一些实施方案中,所述式(i)化
合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0281]
在改善眼部不适的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于1微克与10毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在改善眼部不适的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于1微克与5毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在改善眼部不适的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于1微克与4毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在改善眼部不适的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于1微克与3毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在改善眼部不适的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于1微克与2毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在改善眼部不适的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于1微克与1毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在改善眼部不适的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于1微克与750微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在改善眼部不适的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于1微克与600微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在改善眼部不适的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于1微克与100微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在改善眼部不适的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于1微克与50微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在一些实施方案中,所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0282]
在任何上述实施方案中,用于所述方法中的药物制剂包含约0.1mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含约0.2mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含约0.5mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含约1mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含约2mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含约3mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含约4mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含约5mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含约6mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含约7mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含约8mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含约9mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含约10mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含约12mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含约15mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含约20mg/ml的式(i)、式(ii)、式(iiia)或式
(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含约25mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含约30mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含约40mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含约50mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在一些实施方案中,所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0283]
在另一个实施方案中,用于所述方法中的药物制剂包含介于5mg/ml与200mg/ml之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含介于10mg/ml与200mg/ml之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含介于5mg/ml与100mg/ml之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含介于10mg/ml与75mg/ml之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含介于10mg/ml与50mg/ml之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含介于10mg/ml与30mg/ml之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含介于5mg/ml与50mg/ml之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在一些实施方案中,所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0284]
在另一个实施方案中,用于所述方法中的药物制剂包含介于10mg/ml与25mg/ml之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含介于10mg/ml与50mg/ml之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含介于20mg/ml与50mg/ml之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含介于30mg/ml与75mg/ml之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在一些实施方案中,所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0285]
在任何上述实施方案中,用于所述方法中的药物制剂以约10至200μl提供。在另一个实施方案中,用于所述方法中的药物制剂以约10至150μl提供。在另一个实施方案中,用于所述方法中的药物制剂以约10至100μl提供。在另一个实施方案中,用于所述方法中的药物制剂以约50至200μl提供。在另一个实施方案中,用于所述方法中的药物制剂以约100至200μl提供。在另一个实施方案中,用于所述方法中的药物制剂以约50至100μl提供。在另一个实施方案中,用于所述方法中的药物制剂以约10至150μl提供。在另一个实施方案中,用于所述方法中的药物制剂以约10、20、30、40、50、60、70、80、90、100、110、120、130、140、150、160、170、180、190或200μl提供。在一些实施方案中,所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0286]
在改善眼部不适的任何上述实施方案的另一个实施方案中,每日施用式(i)、式(ii)、式(iiia)或式(iiib)化合物一次。在改善眼部不适的任何上述实施方案的另一个实施方案中,每日施用式(i)、式(ii)、式(iiia)或式(iiib)化合物至少一次。在改善眼部不适
的任何上述实施方案的另一个实施方案中,每日施用式(i)、式(ii)、式(iiia)或式(iiib)化合物两次。在改善眼部不适的任何上述实施方案的另一个实施方案中,每日施用式(i)、式(ii)、式(iiia)或式(iiib)化合物至少两次。在改善眼部不适的任何上述实施方案的另一个实施方案中,每日施用式(i)、式(ii)、式(iiia)或式(iiib)化合物三次。在改善眼部不适的任何上述实施方案的另一个实施方案中,每日施用式(i)、式(ii)、式(iiia)或式(iiib)化合物至少三次。在改善眼部不适的任何上述实施方案的另一个实施方案中,施用式(i)、式(ii)、式(iiia)或式(iiib)化合物一天。在改善眼部不适的任何上述实施方案的另一个实施方案中,施用式(i)、式(ii)、式(iiia)或式(iiib)化合物至少两天。在改善眼部不适的任何上述实施方案的另一个实施方案中,施用式(i)、式(ii)、式(iiia)或式(iiib)化合物至少三天。在改善眼部不适的任何上述实施方案的另一个实施方案中,施用式(i)、式(ii)、式(iiia)或式(iiib)化合物至少四天。在改善眼部不适的任何上述实施方案的另一个实施方案中,施用式(i)、式(ii)、式(iiia)或式(iiib)化合物至少五天。在改善眼部不适的任何上述实施方案的另一个实施方案中,施用式(i)、式(ii)、式(iiia)或式(iiib)化合物至少七天。在改善眼部不适的任何上述实施方案的另一个实施方案中,施用式(i)、式(ii)、式(iiia)或式(iiib)化合物至少十天。在改善眼部不适的任何上述实施方案的另一个实施方案中,施用式(i)、式(ii)、式(iiia)或式(iiib)化合物至少十四天。在改善眼部不适的任何上述实施方案的另一个实施方案中,施用式(i)、式(ii)、式(iiia)或式(iiib)化合物至少二十一天。在改善眼部不适的任何上述实施方案的另一个实施方案中,施用式(i)、式(ii)、式(iiia)或式(iiib)化合物至少三十天。在一些实施方案中,所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0287]
在改善眼部不适的任何上述实施方案的另一个实施方案中,在交替鼻孔中施用式(i)、式(ii)、式(iiia)或式(iiib)化合物。举例来说,在一个鼻孔中,接着在预定量的时间之后在另一个鼻孔中施用式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,在两个鼻孔中施用式(i)、式(ii)、式(iiia)或式(iiib)化合物。举例来说,在一个鼻孔中,接着同时或在第一鼻孔之后立即在另一鼻孔中施用式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,在一个鼻孔中施用式(i)、式(ii)、式(iiia)或式(iiib)化合物。在一些实施方案中,所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0288]
在改善眼部不适的任何上述实施方案的另一个实施方案中,式(i)、式(ii)、式(iiia)或式(iiib)化合物呈液体、混悬剂、气雾剂、凝胶、软膏、干粉、乳膏、糊剂、洗剂或香膏形式施用至鼻腔中。在改善眼部不适的任何上述实施方案的另一个实施方案中,式(i)、式(ii)、式(iiia)或式(iiib)化合物呈液体形式施用至鼻腔中。在改善眼部不适的任何上述实施方案的另一个实施方案中,式(i)、式(ii)、式(iiia)或式(iiib)化合物呈混悬剂形式施用至鼻腔中。在改善眼部不适的任何上述实施方案的另一个实施方案中,式(i)、式(ii)、式(iiia)或式(iiib)化合物呈气雾剂形式施用至鼻腔中。在改善眼部不适的任何上述实施方案的另一个实施方案中,式(i)、式(ii)、式(iiia)或式(iiib)化合物呈凝胶形式施用至鼻腔中。在改善眼部不适的任何上述实施方案的另一个实施方案中,式(i)、式(ii)、式(iiia)或式(iiib)化合物呈软膏形式施用至鼻腔中。在改善眼部不适的任何上述实施方案的另一个实施方案中,式(i)、式(ii)、式(iiia)或式(iiib)化合物呈干粉形式施用至鼻
腔中。在改善眼部不适的任何上述实施方案的另一个实施方案中,式(i)、式(ii)、式(iiia)或式(iiib)化合物呈乳膏形式施用至鼻腔中。在改善眼部不适的任何上述实施方案的另一个实施方案中,式(i)、式(ii)、式(iiia)或式(iiib)化合物呈糊剂形式施用至鼻腔中。在改善眼部不适的任何上述实施方案的另一个实施方案中,式(i)、式(ii)、式(iiia)或式(iiib)化合物呈洗剂形式施用至鼻腔中。在改善眼部不适的任何上述实施方案的另一个实施方案中,式(i)、式(ii)、式(iiia)或式(iiib)化合物呈香膏形式施用至鼻腔中。在一些实施方案中,所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0289]
在改善眼部不适的任何上述实施方案的另一个实施方案中,通过注射器、滴管、瓶状雾化器、雾化泵、吸入器、喷粉装置、汽化器、贴片、施药棒、吸移管或液体喷射器将式(i)、式(ii)、式(iiia)或式(iiib)化合物施用至鼻腔中。在改善眼部不适的任何上述实施方案的另一个实施方案中,通过注射器将式(i)、式(ii)、式(iiia)或式(iiib)化合物施用至鼻腔中。在改善眼部不适的任何上述实施方案的另一个实施方案中,通过滴管将式(i)、式(ii)、式(iiia)或式(iiib)化合物施用至鼻腔中。在改善眼部不适的任何上述实施方案的另一个实施方案中,通过瓶状雾化器将式(i)、式(ii)、式(iiia)或式(iiib)化合物施用至鼻腔中。在改善眼部不适的任何上述实施方案的另一个实施方案中,通过雾化泵将式(i)、式(ii)、式(iiia)或式(iiib)化合物施用至鼻腔中。在改善眼部不适的任何上述实施方案的另一个实施方案中,通过吸入器将式(i)、式(ii)、式(iiia)或式(iiib)化合物施用至鼻腔中。在改善眼部不适的任何上述实施方案的另一个实施方案中,通过喷粉装置将式(i)、式(ii)、式(iiia)或式(iiib)化合物施用至鼻腔中。在改善眼部不适的任何上述实施方案的另一个实施方案中,通过汽化器将式(i)、式(ii)、式(iiia)或式(iiib)化合物施用至鼻腔中。在改善眼部不适的任何上述实施方案的另一个实施方案中,通过贴片将式(i)、式(ii)、式(iiia)或式(iiib)化合物施用至鼻腔中。在改善眼部不适的任何上述实施方案的另一个实施方案中,通过施药棒将式(i)、式(ii)、式(iiia)或式(iiib)化合物施用至鼻腔中。在改善眼部不适的任何上述实施方案的另一个实施方案中,通过吸移管将式(i)、式(ii)、式(iiia)或式(iiib)化合物施用至鼻腔中。在改善眼部不适的任何上述实施方案的另一个实施方案中,通过液体喷射器将式(i)、式(ii)、式(iiia)或式(iiib)化合物施用至鼻腔中。在一些实施方案中,所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0290]
在改善眼部不适的任何上述实施方案的另一个实施方案中,使三叉神经活化。在改善眼部不适的另一个实施方案中,使筛前神经活化。在改善眼部不适的任何上述实施方案的另一个实施方案中,使鼻泪反射活化。在一些实施方案中,所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0291]
改善眼表面健康
[0292]
在一些实施方案中,本文中提供一种改善受试者的眼表面健康的方法。在一些实施方案中为一种改善眼表面健康的方法,其包括将治疗有效量的式(i)、式(ii)、式(iiia)或式(iiib)化合物局部施用至有需要的个体的鼻腔中,其中所述式(i)、式(ii)、式(iiia)或式(iiib)化合物选择性地结合至外周烟碱乙酰胆碱受体且不会以药理学相关的浓度越过血脑屏障。在一些实施方案中为改善眼表面健康的方法,其包括将治疗有效量的式(i)、
式(ii)、式(iiia)或式(iiib)化合物局部施用至有需要的个体的鼻腔中,其中所述式(i)、式(ii)、式(iiia)或式(iiib)化合物不会以药理学相关的浓度越过血脑屏障且选择性地结合至选自α3β4、α4β2和α7的外周烟碱乙酰胆碱受体亚型中的至少一者。在一些实施方案中为改善眼表面健康的方法,其包括将治疗有效量的式(i)、式(ii)、式(iiia)或式(iiib)化合物局部施用至有需要的个体的鼻腔中,其中所述式(i)、式(ii)、式(iiia)或式(iiib)化合物不会以药理学相关的浓度越过血脑屏障且选择性地结合至外周烟碱乙酰胆碱受体亚型α3β4。在一些实施方案中为改善眼表面健康的方法,其包括将治疗有效量的式(i)、式(ii)、式(iiia)或式(iiib)化合物局部施用至有需要的个体的鼻腔中,其中所述式(i)、式(ii)、式(iiia)或式(iiib)化合物不会以药理学相关的浓度越过血脑屏障且选择性地结合至外周烟碱乙酰胆碱受体亚型α4β2。在一些实施方案中为改善眼表面健康的方法,其包括将治疗有效量的式(i)、式(ii)、式(iiia)或式(iiib)化合物局部施用至有需要的个体的鼻腔中,其中所述式(i)、式(ii)、式(iiia)或式(iiib)化合物不会以药理学相关的浓度越过血脑屏障且选择性地结合至外周烟碱乙酰胆碱受体亚型α7。在一些实施方案中为一种改善眼表面健康的方法,其包括将治疗有效量的式(i)、式(ii)、式(iiia)或式(iiib)化合物局部施用至有需要的个体的鼻腔中,其中所述式(i)、式(ii)、式(iiia)或式(iiib)化合物选择性地结合至外周烟碱乙酰胆碱受体且以不具全身性生物可利用性的量施用。在一些实施方案中为一种改善眼表面健康的方法,其包括将治疗有效量的式(i)、式(ii)、式(iiia)或式(iiib)化合物局部施用至有需要的个体的鼻腔中,其中所述式(i)、式(ii)、式(iiia)或式(iiib)化合物选择性地结合至外周烟碱乙酰胆碱受体且以不会引起不希望的精神副作用的量施用。在一些实施方案中为一种改善眼表面健康的方法,其包括将治疗有效量的式(i)、式(ii)、式(iiia)或式(iiib)化合物局部施用至有需要的个体的鼻腔中,其中所述式(i)、式(ii)、式(iiia)或式(iiib)化合物选择性地结合至外周烟碱乙酰胆碱受体且以不会引起不希望的全身性副作用的量施用。在一些实施方案中为一种改善眼表面健康的方法,其包括将治疗有效量的式(i)、式(ii)、式(iiia)或式(iiib)化合物局部施用至有需要的个体的鼻腔中,其中所述式(i)、式(ii)、式(iiia)或式(iiib)化合物选择性地结合至外周烟碱乙酰胆碱受体且以产生局部作用的量施用。在一些实施方案中为一种改善眼表面健康的方法,其还包括局部施用预防或促进烟碱乙酰胆碱受体从减敏状态恢复的一种或多种物质。在一些实施方案中为一种改善眼表面健康的方法,其还包括局部施用防止或减少烟碱乙酰胆碱受体进入减敏状态或促进烟碱乙酰胆碱受体从减敏状态恢复的一种或多种物质。在一些实施方案中,所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0293]
在本文中所描述的改善眼表面健康的方法的一些实施方案中,所述式(i)、式(ii)、式(iiia)或式(iiib)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶(或化合物1)。在本文中所描述的方法的一些实施方案中,所述式(i)、式(ii)、式(iiia)或式(iiib)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。在本文中所描述的改善眼表面健康的方法的一些实施方案中,所述式(i)、式(ii)、式(iiia)或式(iiib)化合物为呈游离碱形式的(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶。在本文中所描述的改善眼表面健康的方法的一些实施方案中,所述式(i)、式(ii)、式(iiia)或式(iiib)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶柠檬酸盐。在本文中所描述的改善眼表面健康的
方法的一些实施方案中,所述式(i)、式(ii)、式(iiia)或式(iiib)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶单柠檬酸盐。在本文中所描述的改善眼表面健康的方法的一些实施方案中,所述式(i)、式(ii)、式(iiia)或式(iiib)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶hcl盐。在本文中所描述的改善眼表面健康的方法的一些实施方案中,所述式(i)、式(ii)、式(iiia)或式(iiib)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶粘酸盐。在本文中所描述的改善眼表面健康的方法的一些实施方案中,所述式(i)、式(ii)、式(iiia)或式(iiib)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶半粘酸盐。在本文中所描述的改善眼表面健康的方法的一些实施方案中,所述式(i)、式(ii)、式(iiia)或式(iiib)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶半粘酸盐单水合物。在一些实施方案中,所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。在本文中所描述的方法的一些实施方案中,所述式(i)、式(ii)、式(iiia)或式(iiib)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶半粘酸盐二水合物。
[0294]
在一些实施方案中为一种改善眼表面健康的方法,其还包括局部施用预防或促进烟碱乙酰胆碱受体从减敏状态恢复的一种或多种物质,所述一种或多种物质选自蛋白激酶c(pkc)或者上调或向上调节pkc的因子、camp依赖性蛋白激酶(pka)或者上调或向上调节pka的因子和钙调磷酸酶抑制剂。在一些实施方案中为一种改善眼表面健康的方法,其还包括局部施用防止或减少烟碱乙酰胆碱受体进入减敏状态或促进烟碱乙酰胆碱受体从减敏状态恢复的一种或多种物质,所述一种或多种物质选自蛋白激酶c(pkc)或者上调或向上调节pkc的因子、camp依赖性蛋白激酶(pka)或者上调或向上调节pka的因子和钙调磷酸酶抑制剂。在一些实施方案中为一种改善眼表面健康的方法,其还包括局部施用蛋白激酶c(pkc)或者上调或向上调节pkc的因子。在一些实施方案中为一种改善眼表面健康的方法,其还包括局部施用camp依赖性蛋白激酶(pka)或者上调或向上调节pka的因子。在一些实施方案中为一种改善眼表面健康的方法,其还包括局部施用钙调磷酸酶抑制剂。在一些实施方案中为一种改善眼表面健康的方法,其还包括局部施用钙调磷酸酶抑制剂,其中所述钙调磷酸酶抑制剂选自环孢霉素、吡美莫司和他克莫司。在一些实施方案中为一种改善眼表面健康的方法,其还包括局部施用环孢霉素。在一些实施方案中为一种改善眼表面健康的方法,其还包括局部施用吡美莫司。在一些实施方案中为一种改善眼表面健康的方法,其还包括局部施用他克莫司。在一些实施方案中,所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0295]
在改善眼表面健康的任何上述实施方案的另一个实施方案中,向鼻腔中施用至少1微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在改善眼表面健康的任何上述实施方案的另一个实施方案中,向鼻腔中施用至少5微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在改善眼表面健康的任何上述实施方案的另一个实施方案中,向鼻腔中施用至少10微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在改善眼表面健康的任何上述实施方案的另一个实施方案中,向鼻腔中施用至少25微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在改善眼表面健康的任何上述实施方案的另一个实施方案中,向鼻腔中施用至少50微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在改善眼表面健康的任何上述实施方案的另一个实施方案中,向鼻腔中施用至少100微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在改善眼表面健康的任何上述实施方案的另一个实施方案中,向鼻腔中施
用至少250微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在改善眼表面健康的任何上述实施方案的另一个实施方案中,向鼻腔中施用至少500微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在改善眼表面健康的任何上述实施方案的另一个实施方案中,向鼻腔中施用至少750微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在改善眼表面健康的任何上述实施方案的另一个实施方案中,向鼻腔中施用至少1000微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在一些实施方案中,所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0296]
在改善眼表面健康的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于1微克与1000微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在改善眼表面健康的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于5微克与1000微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在改善眼表面健康的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于10微克与1000微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在改善眼表面健康的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于5微克与100微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在改善眼表面健康的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于5微克与50微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在改善眼表面健康的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于10微克与50微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在改善眼表面健康的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于25微克与1000微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在改善眼表面健康的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于50微克与1000微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在改善眼表面健康的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于100微克与1000微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在改善眼表面健康的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于150微克与1000微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在改善眼表面健康的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于100微克与750微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在改善眼表面健康的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于150微克与750微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在改善眼表面健康的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于150微克与600微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在一些实施方案中,所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0297]
在改善眼表面健康的任何上述实施方案的另一个实施方案中,向鼻腔中施用少于100微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在改善眼表面健康的任何上述实施方案的另一个实施方案中,向鼻腔中施用少于75微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在改善眼表面健康的任何上述实施方案的另一个实施方案中,向鼻腔中施用少于50微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在改善眼表面健康的任何上述实施方案的另一个实施方案中,向鼻腔中施用少于25微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在改善眼表面健康的任何上述实施方案的另一个实施方案中,向鼻腔中施用少于15微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在改善眼表面健康的任何
上述实施方案的另一个实施方案中,向鼻腔中施用约75微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在改善眼表面健康的任何上述实施方案的另一个实施方案中,向鼻腔中施用约50微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在改善眼表面健康的任何上述实施方案的另一个实施方案中,向鼻腔中施用约25微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在改善眼表面健康的任何上述实施方案的另一个实施方案中,向鼻腔中施用约10微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在一些实施方案中,所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0298]
在改善眼表面健康的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于1微克与100微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在改善眼表面健康的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于1微克与75微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在改善眼表面健康的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于5微克与100微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在改善眼表面健康的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于5微克与75微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在改善眼表面健康的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于15微克与100微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在改善眼表面健康的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于15微克与75微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在改善眼表面健康的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于25微克与100微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在改善眼表面健康的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于25微克与75微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在改善眼表面健康的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于25微克与60微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在一些实施方案中,所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0299]
在改善眼表面健康的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于500微克与10毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在改善眼表面健康的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于500微克与5毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在改善眼表面健康的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于500微克与3毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在改善眼表面健康的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于500微克与2毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在改善眼表面健康的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于1毫克与10毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在改善眼表面健康的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于1毫克与5毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在改善眼表面健康的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于1毫克与3毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在改善眼表面健康的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于1毫克与2毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在改善眼表面健康的任何上述实施方案的另一个实施方案中,向鼻腔中施用约500微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在改善眼表面
健康的任何上述实施方案的另一个实施方案中,向鼻腔中施用约1毫克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在改善眼表面健康的任何上述实施方案的另一个实施方案中,向鼻腔中施用约1.5毫克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在改善眼表面健康的任何上述实施方案的另一个实施方案中,向鼻腔中施用约2毫克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在改善眼表面健康的任何上述实施方案的另一个实施方案中,向鼻腔中施用约2.5毫克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在改善眼表面健康的任何上述实施方案的另一个实施方案中,向鼻腔中施用约3毫克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在改善眼表面健康的任何上述实施方案的另一个实施方案中,向鼻腔中施用约4毫克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在改善眼表面健康的任何上述实施方案的另一个实施方案中,向鼻腔中施用约5毫克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在一些实施方案中,所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0300]
在改善眼表面健康的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于1微克与10毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在改善眼表面健康的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于5微克与10毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在改善眼表面健康的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于10微克与10毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在改善眼表面健康的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于25微克与10毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在改善眼表面健康的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于50微克与10毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在改善眼表面健康的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于100微克与10毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在改善眼表面健康的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于150微克与10毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在一些实施方案中,所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0301]
在改善眼表面健康的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于1微克与10毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在改善眼表面健康的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于1微克与5毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在改善眼表面健康的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于1微克与4毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在改善眼表面健康的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于1微克与3毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在改善眼表面健康的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于1微克与2毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在改善眼表面健康的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于1微克与1毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在改善眼表面健康的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于1微克与750微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在改善眼表面健康的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于1微克与600微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在改善眼表面健康的任何上述实施方案的另一个实施方案中,
向鼻腔中施用介于1微克与100微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在改善眼表面健康的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于1微克与50微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在一些实施方案中,所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0302]
在任何上述实施方案中,用于所述方法中的药物制剂包含约0.1mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含约0.2mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含约0.5mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含约1mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含约2mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含约3mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含约4mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含约5mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含约6mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含约7mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含约8mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含约9mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含约10mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含约12mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含约15mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含约20mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含约25mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含约30mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含约40mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含约50mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在一些实施方案中,所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0303]
在另一个实施方案中,用于所述方法中的药物制剂包含介于5mg/ml与200mg/ml之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含介于10mg/ml与200mg/ml之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含介于5mg/ml与100mg/ml之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含介于10mg/ml与75mg/ml之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含介于10mg/ml与50mg/ml之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含
介于10mg/ml与30mg/ml之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含介于5mg/ml与50mg/ml之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在一些实施方案中,所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0304]
在另一个实施方案中,用于所述方法中的药物制剂包含介于10mg/ml与25mg/ml之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物在另一个实施方案中,用于所述方法中的药物制剂包含介于10mg/ml与50mg/ml之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含介于20mg/ml与50mg/ml之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含介于30mg/ml与75mg/ml之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在一些实施方案中,所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0305]
在任何上述实施方案中,用于所述方法中的药物制剂以约10至200μl提供。在另一个实施方案中,用于所述方法中的药物制剂以约10至150μl提供。在另一个实施方案中,用于所述方法中的药物制剂以约10至100μl提供。在另一个实施方案中,用于所述方法中的药物制剂以约50至200μl提供。在另一个实施方案中,用于所述方法中的药物制剂以约100至200μl提供。在另一个实施方案中,用于所述方法中的药物制剂以约50至100μl提供。在另一个实施方案中,用于所述方法中的药物制剂以约10至150μl提供。在另一个实施方案中,用于所述方法中的药物制剂以约10、20、30、40、50、60、70、80、90、100、110、120、130、140、150、160、170、180、190或200μl提供。在一些实施方案中,所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0306]
在改善眼表面健康的任何上述实施方案的另一个实施方案中,每日施用式(i)、式(ii)、式(iiia)或式(iiib)化合物一次。在改善眼表面健康的任何上述实施方案的另一个实施方案中,每日施用式(i)、式(ii)、式(iiia)或式(iiib)化合物至少一次。在改善眼表面健康的任何上述实施方案的另一个实施方案中,每日施用式(i)、式(ii)、式(iiia)或式(iiib)化合物两次。在改善眼表面健康的任何上述实施方案的另一个实施方案中,每日施用式(i)、式(ii)、式(iiia)或式(iiib)化合物至少两次。在改善眼表面健康的任何上述实施方案的另一个实施方案中,每日施用式(i)、式(ii)、式(iiia)或式(iiib)化合物三次。在改善眼表面健康的任何上述实施方案的另一个实施方案中,每日施用式(i)、式(ii)、式(iiia)或式(iiib)化合物至少三次。在改善眼表面健康的任何上述实施方案的另一个实施方案中,施用式(i)、式(ii)、式(iiia)或式(iiib)化合物一天。在改善眼表面健康的任何上述实施方案的另一个实施方案中,施用式(i)、式(ii)、式(iiia)或式(iiib)化合物至少两天。在改善眼表面健康的任何上述实施方案的另一个实施方案中,施用式(i)、式(ii)、式(iiia)或式(iiib)化合物至少三天。在改善眼表面健康的任何上述实施方案的另一个实施方案中,施用式(i)、式(ii)、式(iiia)或式(iiib)化合物至少四天。在改善眼表面健康的任何上述实施方案的另一个实施方案中,施用式(i)、式(ii)、式(iiia)或式(iiib)化合物至少五天。在改善眼表面健康的任何上述实施方案的另一个实施方案中,施用式(i)、式(ii)、式(iiia)或式(iiib)化合物至少七天。在改善眼表面健康的任何上述实施方案的另一个实施方案中,施用式(i)、式(ii)、式(iiia)或式(iiib)化合物至少十天。在改善眼表面健康的
任何上述实施方案的另一个实施方案中,施用式(i)、式(ii)、式(iiia)或式(iiib)化合物至少十四天。在改善眼表面健康的任何上述实施方案的另一个实施方案中,施用式(i)、式(ii)、式(iiia)或式(iiib)化合物至少二十一天。在改善眼表面健康的任何上述实施方案的另一个实施方案中,施用式(i)、式(ii)、式(iiia)或式(iiib)化合物至少三十天。在一些实施方案中,所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0307]
在改善眼表面健康的任何上述实施方案的另一个实施方案中,在交替鼻孔中施用式(i)、式(ii)、式(iiia)或式(iiib)化合物。举例来说,在一个鼻孔中,接着在预定量的时间之后在另一个鼻孔中施用式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,在两个鼻孔中施用式(i)、式(ii)、式(iiia)或式(iiib)化合物。举例来说,在一个鼻孔中,接着同时或在第一鼻孔之后立即在另一鼻孔中施用式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,在一个鼻孔中施用式(i)、式(ii)、式(iiia)或式(iiib)化合物。在一些实施方案中,所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0308]
在改善眼表面健康的任何上述实施方案的另一个实施方案中,式(i)、式(ii)、式(iiia)或式(iiib)化合物呈液体、混悬剂、气雾剂、凝胶、软膏、干粉、乳膏、糊剂、洗剂或香膏形式施用至鼻腔中。在改善眼表面健康的任何上述实施方案的另一个实施方案中,式(i)、式(ii)、式(iiia)或式(iiib)化合物呈液体形式施用至鼻腔中。在改善眼表面健康的任何上述实施方案的另一个实施方案中,式(i)、式(ii)、式(iiia)或式(iiib)化合物呈混悬剂形式施用至鼻腔中。在改善眼表面健康的任何上述实施方案的另一个实施方案中,式(i)、式(ii)、式(iiia)或式(iiib)化合物呈气雾剂形式施用至鼻腔中。在改善眼表面健康的任何上述实施方案的另一个实施方案中,式(i)、式(ii)、式(iiia)或式(iiib)化合物呈凝胶形式施用至鼻腔中。在改善眼表面健康的任何上述实施方案的另一个实施方案中,式(i)、式(ii)、式(iiia)或式(iiib)化合物呈软膏形式施用至鼻腔中。在改善眼表面健康的任何上述实施方案的另一个实施方案中,式(i)、式(ii)、式(iiia)或式(iiib)化合物呈干粉形式施用至鼻腔中。在改善眼表面健康的任何上述实施方案的另一个实施方案中,式(i)、式(ii)、式(iiia)或式(iiib)化合物呈乳膏形式施用至鼻腔中。在改善眼表面健康的任何上述实施方案的另一个实施方案中,式(i)、式(ii)、式(iiia)或式(iiib)化合物呈糊剂形式施用至鼻腔中。在改善眼表面健康的任何上述实施方案的另一个实施方案中,式(i)、式(ii)、式(iiia)或式(iiib)化合物呈洗剂形式施用至鼻腔中。在改善眼表面健康的任何上述实施方案的另一个实施方案中,式(i)、式(ii)、式(iiia)或式(iiib)化合物呈香膏形式施用至鼻腔中。在一些实施方案中,所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0309]
在改善眼表面健康的任何上述实施方案的另一个实施方案中,通过注射器、滴管、瓶状雾化器、雾化泵、吸入器、喷粉装置、汽化器、贴片、施药棒、吸移管或液体喷射器将式(i)、式(ii)、式(iiia)或式(iiib)化合物施用至鼻腔中。在改善眼表面健康的任何上述实施方案的另一个实施方案中,通过注射器将式(i)、式(ii)、式(iiia)或式(iiib)化合物施用至鼻腔中。在改善眼表面健康的任何上述实施方案的另一个实施方案中,通过滴管将式(i)、式(ii)、式(iiia)或式(iiib)化合物施用至鼻腔中。在改善眼表面健康的任何上述实
施方案的另一个实施方案中,通过瓶状雾化器将式(i)、式(ii)、式(iiia)或式(iiib)化合物施用至鼻腔中。在改善眼表面健康的任何上述实施方案的另一个实施方案中,通过雾化泵将式(i)、式(ii)、式(iiia)或式(iiib)化合物施用至鼻腔中。在改善眼表面健康的任何上述实施方案的另一个实施方案中,通过吸入器将式(i)、式(ii)、式(iiia)或式(iiib)化合物施用至鼻腔中。在改善眼表面健康的任何上述实施方案的另一个实施方案中,通过喷粉装置将式(i)、式(ii)、式(iiia)或式(iiib)化合物施用至鼻腔中。在改善眼表面健康的任何上述实施方案的另一个实施方案中,通过汽化器将式(i)、式(ii)、式(iiia)或式(iiib)化合物施用至鼻腔中。在改善眼表面健康的任何上述实施方案的另一个实施方案中,通过贴片将式(i)、式(ii)、式(iiia)或式(iiib)化合物施用至鼻腔中。在改善眼表面健康的任何上述实施方案的另一个实施方案中,通过施药棒将式(i)、式(ii)、式(iiia)或式(iiib)化合物施用至鼻腔中。在改善眼表面健康的任何上述实施方案的另一个实施方案中,通过吸移管将式(i)、式(ii)、式(iiia)或式(iiib)化合物施用至鼻腔中。在改善眼表面健康的任何上述实施方案的另一个实施方案中,通过液体喷射器将式(i)、式(ii)、式(iiia)或式(iiib)化合物施用至鼻腔中。在一些实施方案中,所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0310]
在改善眼表面健康的任何上述实施方案的另一个实施方案中,使三叉神经活化。在改善眼表面健康的另一个实施方案中,使筛前神经活化。在改善眼表面健康的任何上述实施方案的另一个实施方案中,使鼻泪反射活化。在一些实施方案中,所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0311]
在改善眼表面健康的任何上述实施方案的另一个实施方案中,通过改善眼表面健康而得以减轻的病状为急性病状。急性病状是指存在具有健康影响的快速发作的病状,其被视为短暂而非长期的。急性病状可能由眼科手术程序或其他眼科治疗引起。在一些实施方案中,所述眼科手术程序为白内障手术(白内障摘除术和晶状体置换)、屈旋光性晶体置换、青光眼手术、lasik手术(雷射眼部手术)、玻璃体切除术、视网膜光凝固术、视网膜脱离修复、黄斑裂孔修复、虹膜后肿瘤或肿块移除、后巩膜切开术、视神经切开术或减少泪腺功能的其他治疗。在一些实施方案中,所述眼科治疗包括辐射疗法。在一些实施方案中,所述辐射疗法针对眼窝区域,例如与头和/或颈癌相关。在一些实施方案中,所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0312]
在环境挑战性条件期间保护眼表面
[0313]
在一些实施方案中,本文中提供一种在环境挑战性条件期间保护受试者的眼表面的方法。在一些实施方案中为一种在环境挑战性条件期间保护眼表面的方法,其包括将治疗有效量的式(i)、式(ii)、式(iiia)或式(iiib)化合物局部施用至有需要的个体的鼻腔中,其中所述式(i)、式(ii)、式(iiia)或式(iiib)化合物选择性地结合至外周烟碱乙酰胆碱受体且不会以药理学相关的浓度越过血脑屏障。在一些实施方案中为在环境挑战性条件期间保护眼表面的方法,其包括将治疗有效量的式(i)、式(ii)、式(iiia)或式(iiib)化合物局部施用至有需要的个体的鼻腔中,其中所述式(i)、式(ii)、式(iiia)或式(iiib)化合物不会以药理学相关的浓度越过血脑屏障且选择性地结合至选自α3β4、α4β2和α7的外周烟碱乙酰胆碱受体亚型中的至少一者。在一些实施方案中为在环境挑战性条件期间保护眼表面的方法,其包括将治疗有效量的式(i)、式(ii)、式(iiia)或式(iiib)化合物局部施用至
有需要的个体的鼻腔中,其中所述式(i)、式(ii)、式(iiia)或式(iiib)化合物不会以药理学相关的浓度越过血脑屏障且选择性地结合至外周烟碱乙酰胆碱受体亚型α3β4。在一些实施方案中为在环境挑战性条件期间保护眼表面的方法,其包括将治疗有效量的式(i)、式(ii)、式(iiia)或式(iiib)化合物局部施用至有需要的个体的鼻腔中,其中所述式(i)、式(ii)、式(iiia)或式(iiib)化合物不会以药理学相关的浓度越过血脑屏障且选择性地结合至外周烟碱乙酰胆碱受体亚型α4β2。在一些实施方案中为在环境挑战性条件期间保护眼表面的方法,其包括将治疗有效量的式(i)、式(ii)、式(iiia)或式(iiib)化合物局部施用至有需要的个体的鼻腔中,其中所述式(i)、式(ii)、式(iiia)或式(iiib)化合物不会以药理学相关的浓度越过血脑屏障且选择性地结合至外周烟碱乙酰胆碱受体亚型α7。在一些实施方案中为一种在环境挑战性条件期间保护眼表面的方法,其包括将治疗有效量的式(i)、式(ii)、式(iiia)或式(iiib)化合物局部施用至有需要的个体的鼻腔中,其中所述式(i)、式(ii)、式(iiia)或式(iiib)化合物选择性地结合至外周烟碱乙酰胆碱受体且以不具全身性生物可利用性的量施用。在一些实施方案中为一种在环境挑战性条件期间保护眼表面的方法,其包括将治疗有效量的式(i)、式(ii)、式(iiia)或式(iiib)化合物局部施用至有需要的个体的鼻腔中,其中所述式(i)、式(ii)、式(iiia)或式(iiib)化合物选择性地结合至外周烟碱乙酰胆碱受体且以不会引起不希望的精神副作用的量施用。在一些实施方案中为一种在环境挑战性条件期间保护眼表面的方法,其包括将治疗有效量的式(i)、式(ii)、式(iiia)或式(iiib)化合物局部施用至有需要的个体的鼻腔中,其中所述式(i)、式(ii)、式(iiia)或式(iiib)化合物选择性地结合至外周烟碱乙酰胆碱受体且以不会引起不希望的全身性副作用的量施用。在一些实施方案中为一种在环境挑战性条件期间保护眼表面的方法,其包括将治疗有效量的式(i)、式(ii)、式(iiia)或式(iiib)化合物局部施用至有需要的个体的鼻腔中,其中所述式(i)、式(ii)、式(iiia)或式(iiib)化合物选择性地结合至外周烟碱乙酰胆碱受体且以产生局部作用的量施用。在一些实施方案中为一种在环境挑战性条件期间保护眼表面的方法,其还包括局部施用预防或促进烟碱乙酰胆碱受体从减敏状态恢复的一种或多种物质。在一些实施方案中,所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0314]
在本文中所描述的在环境挑战性条件期间保护眼表面的方法的一些实施方案中,所述式(i)、式(ii)、式(iiia)或式(iiib)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶(或化合物1)。在本文中所描述的方法的一些实施方案中,所述式(i)、式(ii)、式(iiia)或式(iiib)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。在本文中所描述的方法的一些实施方案中,所述式(i)、式(ii)、式(iiia)或式(iiib)化合物为呈游离碱形式的(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶。在本文中所描述的在环境挑战性条件期间保护眼表面的方法的一些实施方案中,所述式(i)、式(ii)、式(iiia)或式(iiib)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶柠檬酸盐。在本文中所描述的在环境挑战性条件期间保护眼表面的方法的一些实施方案中,所述式(i)、式(ii)、式(iiia)或式(iiib)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶单柠檬酸盐。在本文中所描述的在环境挑战性条件期间保护眼表面的方法的一些实施方案中,所述式(i)、式(ii)、式(iiia)或式(iiib)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶hcl盐。在本文中所描述的在环境挑战性条件期间保护眼表面的方法的一些实施方案中,所述式(i)、式(ii)、式
(iiia)或式(iiib)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶粘酸盐。在本文中所描述的在环境挑战性条件期间保护眼表面的方法的一些实施方案中,所述式(i)、式(ii)、式(iiia)或式(iiib)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶半粘酸盐。在本文中所描述的在环境挑战性条件期间保护眼表面的方法的一些实施方案中,所述式(i)、式(ii)、式(iiia)或式(iiib)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶半粘酸盐单水合物。在本文中所描述的方法的一些实施方案中,所述式(i)、式(ii)、式(iiia)或式(iiib)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶半粘酸盐二水合物。
[0315]
在一些实施方案中为一种在环境挑战性条件期间保护眼表面的方法,其还包括局部施用防止或减少烟碱乙酰胆碱受体进入减敏状态或促进烟碱乙酰胆碱受体从减敏状态恢复的一种或多种物质。在一些实施方案中为一种在环境挑战性条件期间保护眼表面的方法,其还包括局部施用预防或促进烟碱乙酰胆碱受体从减敏状态恢复的一种或多种物质,所述一种或多种物质选自蛋白激酶c(pkc)或者上调或向上调节pkc的因子、camp依赖性蛋白激酶(pka)或者上调或向上调节pka的因子和钙调磷酸酶抑制剂。在一些实施方案中为一种在环境挑战性条件期间保护眼表面的方法,其还包括局部施用防止或减少烟碱乙酰胆碱受体进入减敏状态或促进烟碱乙酰胆碱受体从减敏状态恢复的一种或多种物质,所述一种或多种物质选自蛋白激酶c(pkc)或者上调或向上调节pkc的因子、camp依赖性蛋白激酶(pka)或者上调或向上调节pka的因子和钙调磷酸酶抑制剂。在一些实施方案中为一种在环境挑战性条件期间保护眼表面的方法,其还包括局部施用蛋白激酶c(pkc)或者上调或向上调节pkc的因子。在一些实施方案中为一种在环境挑战性条件期间保护眼表面的方法,其还包括局部施用camp依赖性蛋白激酶(pka)或者上调或向上调节pka的因子。在一些实施方案中为一种在环境挑战性条件期间保护眼表面的方法,其还包括局部施用钙调磷酸酶抑制剂。在一些实施方案中为一种在环境挑战性条件期间保护眼表面的方法,其还包括局部施用钙调磷酸酶抑制剂,其中所述钙调磷酸酶抑制剂选自环孢霉素、吡美莫司和他克莫司。在一些实施方案中为一种在环境挑战性条件期间保护眼表面的方法,其还包括局部施用环孢霉素。在一些实施方案中为一种在环境挑战性条件期间保护眼表面的方法,其还包括局部施用吡美莫司。在一些实施方案中为一种在环境挑战性条件期间保护眼表面的方法,其还包括局部施用他克莫司。
[0316]
在环境挑战性条件期间保护眼表面的任何上述实施方案的另一个实施方案中,向鼻腔中施用至少1微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在环境挑战性条件期间保护眼表面的任何上述实施方案的另一个实施方案中,向鼻腔中施用至少5微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在环境挑战性条件期间保护眼表面的任何上述实施方案的另一个实施方案中,向鼻腔中施用至少10微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在环境挑战性条件期间保护眼表面的任何上述实施方案的另一个实施方案中,向鼻腔中施用至少25微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在环境挑战性条件期间保护眼表面的任何上述实施方案的另一个实施方案中,向鼻腔中施用至少50微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在环境挑战性条件期间保护眼表面的任何上述实施方案的另一个实施方案中,向鼻腔中施用至少100微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在环境挑战性条件期间保护眼表面的任何上述实施方案的另一个实施方案中,向鼻腔中施用至少250微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在环境
挑战性条件期间保护眼表面的任何上述实施方案的另一个实施方案中,向鼻腔中施用至少500微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在环境挑战性条件期间保护眼表面的任何上述实施方案的另一个实施方案中,向鼻腔中施用至少750微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在环境挑战性条件期间保护眼表面的任何上述实施方案的另一个实施方案中,向鼻腔中施用至少1000微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在一些实施方案中,所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0317]
在环境挑战性条件期间保护眼表面的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于1微克与1000微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在环境挑战性条件期间保护眼表面的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于5微克与1000微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在环境挑战性条件期间保护眼表面的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于10微克与1000微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在环境挑战性条件期间保护眼表面的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于5微克与100微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在环境挑战性条件期间保护眼表面的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于5微克与50微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在环境挑战性条件期间保护眼表面的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于10微克与50微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在环境挑战性条件期间保护眼表面的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于25微克与1000微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在环境挑战性条件期间保护眼表面的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于50微克与1000微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在环境挑战性条件期间保护眼表面的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于100微克与1000微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在环境挑战性条件期间保护眼表面的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于150微克与1000微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在环境挑战性条件期间保护眼表面的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于100微克与750微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在环境挑战性条件期间保护眼表面的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于150微克与750微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在环境挑战性条件期间保护眼表面的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于150微克与600微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在一些实施方案中,所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0318]
在环境挑战性条件期间保护眼表面的任何上述实施方案的另一个实施方案中,向鼻腔中施用少于100微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在环境挑战性条件期间保护眼表面的任何上述实施方案的另一个实施方案中,向鼻腔中施用少于75微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在环境挑战性条件期间保护眼表面的任何上述实施方案的另一个实施方案中,向鼻腔中施用少于50微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在环境挑战性条件期间保护眼表面的任何上述实施方案的另一个实施方案
中,向鼻腔中施用少于25微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在环境挑战性条件期间保护眼表面的任何上述实施方案的另一个实施方案中,向鼻腔中施用少于15微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在环境挑战性条件期间保护眼表面的任何上述实施方案的另一个实施方案中,向鼻腔中施用约75微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在环境挑战性条件期间保护眼表面的任何上述实施方案的另一个实施方案中,向鼻腔中施用约50微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在环境挑战性条件期间保护眼表面的任何上述实施方案的另一个实施方案中,向鼻腔中施用约25微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在环境挑战性条件期间保护眼表面的任何上述实施方案的另一个实施方案中,向鼻腔中施用约10微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在一些实施方案中,所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0319]
在环境挑战性条件期间保护眼表面的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于1微克与100微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在环境挑战性条件期间保护眼表面的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于1微克与75微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在环境挑战性条件期间保护眼表面的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于5微克与100微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在环境挑战性条件期间保护眼表面的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于5微克与75微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在环境挑战性条件期间保护眼表面的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于15微克与100微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在环境挑战性条件期间保护眼表面的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于15微克与75微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在环境挑战性条件期间保护眼表面的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于25微克与100微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在环境挑战性条件期间保护眼表面的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于25微克与75微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在环境挑战性条件期间保护眼表面的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于25微克与60微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。
[0320]
在环境挑战性条件期间保护眼表面的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于500微克与10毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在环境挑战性条件期间保护眼表面的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于500微克与5毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在环境挑战性条件期间保护眼表面的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于500微克与3毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在环境挑战性条件期间保护眼表面的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于500微克与2毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在环境挑战性条件期间保护眼表面的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于1毫克与10毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在环境挑战性条件期间保护眼表面的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于1毫克与5毫克之间的式(i)、式(ii)、式(iiia)或式
(iiib)化合物。在环境挑战性条件期间保护眼表面的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于1毫克与3毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在环境挑战性条件期间保护眼表面的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于1毫克与2毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在环境挑战性条件期间保护眼表面的任何上述实施方案的另一个实施方案中,向鼻腔中施用约500微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在环境挑战性条件期间保护眼表面的任何上述实施方案的另一个实施方案中,向鼻腔中施用约1毫克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在环境挑战性条件期间保护眼表面的任何上述实施方案的另一个实施方案中,向鼻腔中施用约1.5毫克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在环境挑战性条件期间保护眼表面的任何上述实施方案的另一个实施方案中,向鼻腔中施用约2毫克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在环境挑战性条件期间保护眼表面的任何上述实施方案的另一个实施方案中,向鼻腔中施用约2.5毫克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在环境挑战性条件期间保护眼表面的任何上述实施方案的另一个实施方案中,向鼻腔中施用约3毫克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在环境挑战性条件期间保护眼表面的任何上述实施方案的另一个实施方案中,向鼻腔中施用约4毫克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在环境挑战性条件期间保护眼表面的任何上述实施方案的另一个实施方案中,向鼻腔中施用约5毫克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在一些实施方案中,所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0321]
在环境挑战性条件期间保护眼表面的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于1微克与10毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在环境挑战性条件期间保护眼表面的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于5微克与10毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在环境挑战性条件期间保护眼表面的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于10微克与10毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在环境挑战性条件期间保护眼表面的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于25微克与10毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在环境挑战性条件期间保护眼表面的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于50微克与10毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在环境挑战性条件期间保护眼表面的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于100微克与10毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在环境挑战性条件期间保护眼表面的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于150微克与10毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在一些实施方案中,所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0322]
在环境挑战性条件期间保护眼表面的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于1微克与10毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在环境挑战性条件期间保护眼表面的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于1微克与5毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在环境挑战性条件期间保护眼表面的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于1微克与4毫克之
间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在环境挑战性条件期间保护眼表面的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于1微克与3毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在环境挑战性条件期间保护眼表面的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于1微克与2毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在环境挑战性条件期间保护眼表面的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于1微克与1毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在环境挑战性条件期间保护眼表面的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于1微克与750微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在环境挑战性条件期间保护眼表面的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于1微克与600微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在环境挑战性条件期间保护眼表面的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于1微克与100微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在环境挑战性条件期间保护眼表面的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于1微克与50微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在一些实施方案中,所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0323]
在任何上述实施方案中,用于所述方法中的药物制剂包含约0.1mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含约0.2mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含约0.5mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含约1mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含约2mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含约3mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含约4mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含约5mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含约6mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含约7mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含约8mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含约9mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含约10mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含约12mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含约15mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含约20mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含约25mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含约30mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含约40mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一
个实施方案中,用于所述方法中的药物制剂包含约50mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在一些实施方案中,所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0324]
在另一个实施方案中,用于所述方法中的药物制剂包含介于5mg/ml与200mg/ml之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含介于10mg/ml与200mg/ml之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含介于5mg/ml与100mg/ml之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含介于10mg/ml与75mg/ml之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含介于10mg/ml与50mg/ml之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含介于10mg/ml与30mg/ml之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含介于5mg/ml与50mg/ml之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在一些实施方案中,所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0325]
在另一个实施方案中,用于所述方法中的药物制剂包含介于10mg/ml与25mg/ml之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含介于10mg/ml与50mg/ml之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含介于20mg/ml与50mg/ml之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含介于30mg/ml与75mg/ml之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在一些实施方案中,所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0326]
在任何上述实施方案中,用于所述方法中的药物制剂以约10至200μl提供。在另一个实施方案中,用于所述方法中的药物制剂以约10至150μl提供。在另一个实施方案中,用于所述方法中的药物制剂以约10至100μl提供。在另一个实施方案中,用于所述方法中的药物制剂以约50至200μl提供。在另一个实施方案中,用于所述方法中的药物制剂以约100至200μl提供。在另一个实施方案中,用于所述方法中的药物制剂以约50至100μl提供。在另一个实施方案中,用于所述方法中的药物制剂以约10至150μl提供。在另一个实施方案中,用于所述方法中的药物制剂以约10、20、30、40、50、60、70、80、90、100、110、120、130、140、150、160、170、180、190或200μl提供。在一些实施方案中,所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0327]
在环境挑战性条件期间保护眼表面的任何上述实施方案的另一个实施方案中,每日施用式(i)、式(ii)、式(iiia)或式(iiib)化合物一次。在环境挑战性条件期间保护眼表面的任何上述实施方案的另一个实施方案中,每日施用式(i)、式(ii)、式(iiia)或式(iiib)化合物至少一次。在环境挑战性条件期间保护眼表面的任何上述实施方案的另一个实施方案中,每日施用式(i)、式(ii)、式(iiia)或式(iiib)化合物两次。在环境挑战性条件期间保护眼表面的任何上述实施方案的另一个实施方案中,每日施用式(i)、式(ii)、式(iiia)或式(iiib)化合物至少两次。在环境挑战性条件期间保护眼表面的任何上述实施方
案的另一个实施方案中,每日施用式(i)、式(ii)、式(iiia)或式(iiib)化合物三次。在环境挑战性条件期间保护眼表面的任何上述实施方案的另一个实施方案中,每日施用式(i)、式(ii)、式(iiia)或式(iiib)化合物至少三次。在环境挑战性条件期间保护眼表面的任何上述实施方案的另一个实施方案中,施用式(i)、式(ii)、式(iiia)或式(iiib)化合物一天。在环境挑战性条件期间保护眼表面的任何上述实施方案的另一个实施方案中,施用式(i)、式(ii)、式(iiia)或式(iiib)化合物至少两天。在环境挑战性条件期间保护眼表面的任何上述实施方案的另一个实施方案中,施用式(i)、式(ii)、式(iiia)或式(iiib)化合物至少三天。在环境挑战性条件期间保护眼表面的任何上述实施方案的另一个实施方案中,施用式(i)、式(ii)、式(iiia)或式(iiib)化合物至少四天。在环境挑战性条件期间保护眼表面的任何上述实施方案的另一个实施方案中,施用式(i)、式(ii)、式(iiia)或式(iiib)化合物至少五天。在环境挑战性条件期间保护眼表面的任何上述实施方案的另一个实施方案中,施用式(i)、式(ii)、式(iiia)或式(iiib)化合物至少七天。在环境挑战性条件期间保护眼表面的任何上述实施方案的另一个实施方案中,施用式(i)、式(ii)、式(iiia)或式(iiib)化合物至少十天。在环境挑战性条件期间保护眼表面的任何上述实施方案的另一个实施方案中,施用式(i)、式(ii)、式(iiia)或式(iiib)化合物至少十四天。在环境挑战性条件期间保护眼表面的任何上述实施方案的另一个实施方案中,施用式(i)、式(ii)、式(iiia)或式(iiib)化合物至少二十一天。在环境挑战性条件期间保护眼表面的任何上述实施方案的另一个实施方案中,施用式(i)、式(ii)、式(iiia)或式(iiib)化合物至少三十天。在一些实施方案中,所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0328]
在环境挑战性条件期间保护眼表面的任何上述实施方案的另一个实施方案中,在交替鼻孔中施用式(i)、式(ii)、式(iiia)或式(iiib)化合物。举例来说,在一个鼻孔中,接着在预定量的时间之后在另一个鼻孔中施用式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,在两个鼻孔中施用式(i)、式(ii)、式(iiia)或式(iiib)化合物。举例来说,在一个鼻孔中,接着同时或在第一鼻孔之后立即在另一鼻孔中施用式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,在一个鼻孔中施用式(i)、式(ii)、式(iiia)或式(iiib)化合物。在一些实施方案中,所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0329]
在环境挑战性条件期间保护眼表面的任何上述实施方案的另一个实施方案中,式(i)、式(ii)、式(iiia)或式(iiib)化合物呈液体、混悬剂、气雾剂、凝胶、软膏、干粉、乳膏、糊剂、洗剂或香膏形式施用至鼻腔中。在环境挑战性条件期间保护眼表面的任何上述实施方案的另一个实施方案中,式(i)、式(ii)、式(iiia)或式(iiib)化合物呈液体形式施用至鼻腔中。在环境挑战性条件期间保护眼表面的任何上述实施方案的另一个实施方案中,式(i)、式(ii)、式(iiia)或式(iiib)化合物呈混悬剂形式施用至鼻腔中。在环境挑战性条件期间保护眼表面的任何上述实施方案的另一个实施方案中,式(i)、式(ii)、式(iiia)或式(iiib)化合物呈气雾剂形式施用至鼻腔中。在环境挑战性条件期间保护眼表面的任何上述实施方案的另一个实施方案中,式(i)、式(ii)、式(iiia)或式(iiib)化合物呈凝胶形式施用至鼻腔中。在环境挑战性条件期间保护眼表面的任何上述实施方案的另一个实施方案中,式(i)、式(ii)、式(iiia)或式(iiib)化合物呈软膏形式施用至鼻腔中。在环境挑战性条
件期间保护眼表面的任何上述实施方案的另一个实施方案中,式(i)、式(ii)、式(iiia)或式(iiib)化合物呈干粉形式施用至鼻腔中。在环境挑战性条件期间保护眼表面的任何上述实施方案的另一个实施方案中,式(i)、式(ii)、式(iiia)或式(iiib)化合物呈乳膏形式施用至鼻腔中。在环境挑战性条件期间保护眼表面的任何上述实施方案的另一个实施方案中,式(i)、式(ii)、式(iiia)或式(iiib)化合物呈糊剂形式施用至鼻腔中。在环境挑战性条件期间保护眼表面的任何上述实施方案的另一个实施方案中,式(i)、式(ii)、式(iiia)或式(iiib)化合物呈洗剂形式施用至鼻腔中。在环境挑战性条件期间保护眼表面的任何上述实施方案的另一个实施方案中,式(i)、式(ii)、式(iiia)或式(iiib)化合物呈香膏形式施用至鼻腔中。在一些实施方案中,所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0330]
在环境挑战性条件期间保护眼表面的任何上述实施方案的另一个实施方案中,通过注射器、滴管、瓶状雾化器、雾化泵、吸入器、喷粉装置、汽化器、贴片、施药棒、吸移管或液体喷射器将式(i)、式(ii)、式(iiia)或式(iiib)化合物施用至鼻腔中。在环境挑战性条件期间保护眼表面的任何上述实施方案的另一个实施方案中,通过注射器将式(i)、式(ii)、式(iiia)或式(iiib)化合物施用至鼻腔中。在环境挑战性条件期间保护眼表面的任何上述实施方案的另一个实施方案中,通过滴管将式(i)、式(ii)、式(iiia)或式(iiib)化合物施用至鼻腔中。在环境挑战性条件期间保护眼表面的任何上述实施方案的另一个实施方案中,通过瓶状雾化器将式(i)、式(ii)、式(iiia)或式(iiib)化合物施用至鼻腔中。在环境挑战性条件期间保护眼表面的任何上述实施方案的另一个实施方案中,通过雾化泵将式(i)、式(ii)、式(iiia)或式(iiib)化合物施用至鼻腔中。在环境挑战性条件期间保护眼表面的任何上述实施方案的另一个实施方案中,通过吸入器将式(i)、式(ii)、式(iiia)或式(iiib)化合物施用至鼻腔中。在环境挑战性条件期间保护眼表面的任何上述实施方案的另一个实施方案中,通过喷粉装置将式(i)、式(ii)、式(iiia)或式(iiib)化合物施用至鼻腔中。在环境挑战性条件期间保护眼表面的任何上述实施方案的另一个实施方案中,通过汽化器将式(i)、式(ii)、式(iiia)或式(iiib)化合物施用至鼻腔中。在环境挑战性条件期间保护眼表面的任何上述实施方案的另一个实施方案中,通过贴片将式(i)、式(ii)、式(iiia)或式(iiib)化合物施用至鼻腔中。在环境挑战性条件期间保护眼表面的任何上述实施方案的另一个实施方案中,通过施药棒将式(i)、式(ii)、式(iiia)或式(iiib)化合物施用至鼻腔中。在环境挑战性条件期间保护眼表面的任何上述实施方案的另一个实施方案中,通过吸移管将式(i)、式(ii)、式(iiia)或式(iiib)化合物施用至鼻腔中。在环境挑战性条件期间保护眼表面的任何上述实施方案的另一个实施方案中,通过液体喷射器将式(i)、式(ii)、式(iiia)或式(iiib)化合物施用至鼻腔中。在一些实施方案中,所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0331]
在环境挑战性条件期间保护眼表面的任何上述实施方案的另一个实施方案中,使三叉神经活化。在环境挑战性条件期间保护眼表面的另一个实施方案中,使筛前神经活化。在环境挑战性条件期间保护眼表面的任何上述实施方案的另一个实施方案中,使鼻泪反射活化。在一些实施方案中,所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0332]
增加眼表面上的粘蛋白含量
[0333]
在一些实施方案中,本文中提供一种增加受试者的眼表面上的粘蛋白含量的方法。在一些实施方案中为一种增加眼表面上的粘蛋白含量的方法,其包括将治疗有效量的式(i)、式(ii)、式(iiia)或式(iiib)化合物局部施用至有需要的个体的鼻腔中,其中所述式(i)、式(ii)、式(iiia)或式(iiib)化合物选择性地结合至外周烟碱乙酰胆碱受体且不会以药理学相关的浓度越过血脑屏障。在一些实施方案中为增加眼表面上的粘蛋白含量的方法,其包括将治疗有效量的式(i)、式(ii)、式(iiia)或式(iiib)化合物局部施用至有需要的个体的鼻腔中,其中所述式(i)、式(ii)、式(iiia)或式(iiib)化合物不会以药理学相关的浓度越过血脑屏障且选择性地结合至选自α3β4、α4β2和α7的外周烟碱乙酰胆碱受体亚型中的至少一者。在一些实施方案中为增加眼表面上的粘蛋白含量的方法,其包括将治疗有效量的式(i)、式(ii)、式(iiia)或式(iiib)化合物局部施用至有需要的个体的鼻腔中,其中所述式(i)、式(ii)、式(iiia)或式(iiib)化合物不会以药理学相关的浓度越过血脑屏障且选择性地结合至外周烟碱乙酰胆碱受体亚型α3β4。在一些实施方案中为增加眼表面上的粘蛋白含量的方法,其包括将治疗有效量的式(i)、式(ii)、式(iiia)或式(iiib)化合物局部施用至有需要的个体的鼻腔中,其中所述式(i)、式(ii)、式(iiia)或式(iiib)化合物不会以药理学相关的浓度越过血脑屏障且选择性地结合至外周烟碱乙酰胆碱受体亚型α4β2。在一些实施方案中为增加眼表面上的粘蛋白含量的方法,其包括将治疗有效量的式(i)、式(ii)、式(iiia)或式(iiib)化合物局部施用至有需要的个体的鼻腔中,其中所述式(i)、式(ii)、式(iiia)或式(iiib)化合物不会以药理学相关的浓度越过血脑屏障且选择性地结合至外周烟碱乙酰胆碱受体亚型α7。在一些实施方案中为一种增加眼表面上的粘蛋白含量的方法,其包括将治疗有效量的式(i)、式(ii)、式(iiia)或式(iiib)化合物局部施用至有需要的个体的鼻腔中,其中所述式(i)、式(ii)、式(iiia)或式(iiib)化合物选择性地结合至外周烟碱乙酰胆碱受体且以不具全身性生物可利用性的量施用。在一些实施方案中为一种增加眼表面上的粘蛋白含量的方法,其包括将治疗有效量的式(i)、式(ii)、式(iiia)或式(iiib)化合物局部施用至有需要的个体的鼻腔中,其中所述式(i)、式(ii)、式(iiia)或式(iiib)化合物选择性地结合至外周烟碱乙酰胆碱受体且以不会引起不希望的精神副作用的量施用。在一些实施方案中为一种增加眼表面上的粘蛋白含量的方法,其包括将治疗有效量的式(i)、式(ii)、式(iiia)或式(iiib)化合物局部施用至有需要的个体的鼻腔中,其中所述式(i)、式(ii)、式(iiia)或式(iiib)化合物选择性地结合至外周烟碱乙酰胆碱受体且以不会引起不希望的全身性副作用的量施用。在一些实施方案中为一种增加眼表面上的粘蛋白含量的方法,其包括将治疗有效量的式(i)、式(ii)、式(iiia)或式(iiib)化合物局部施用至有需要的个体的鼻腔中,其中所述式(i)、式(ii)、式(iiia)或式(iiib)化合物选择性地结合至外周烟碱乙酰胆碱受体且以产生局部作用的量施用。在一些实施方案中为一种增加眼表面上的粘蛋白含量的方法,其还包括局部施用预防或促进烟碱乙酰胆碱受体从减敏状态恢复的一种或多种物质。在一些实施方案中,所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0334]
在本文中所描述的增加眼表面上的粘蛋白含量的方法的一些实施方案中,所述式(i)、式(ii)、式(iiia)或式(iiib)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶(或化合物1)。在本文中所描述的方法的一些实施方案中,所述式(i)、式(ii)、式(iiia)或式(iiib)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。在本文
中所描述的增加眼表面上的粘蛋白含量的方法的一些实施方案中,所述式(i)、式(ii)、式(iiia)或式(iiib)化合物为呈游离碱形式的(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶。在本文中所描述的增加眼表面上的粘蛋白含量的方法的一些实施方案中,所述式(i)、式(ii)、式(iiia)或式(iiib)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶柠檬酸盐。在本文中所描述的增加眼表面上的粘蛋白含量的方法的一些实施方案中,所述式(i)、式(ii)、式(iiia)或式(iiib)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶单柠檬酸盐。在本文中所描述的增加眼表面上的粘蛋白含量的方法的一些实施方案中,所述式(i)、式(ii)、式(iiia)或式(iiib)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶hcl盐。在本文中所描述的增加眼表面上的粘蛋白含量的方法的一些实施方案中,所述式(i)、式(ii)、式(iiia)或式(iiib)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶粘酸盐。在本文中所描述的增加眼表面上的粘蛋白含量的方法的一些实施方案中,所述式(i)、式(ii)、式(iiia)或式(iiib)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶半粘酸盐。在本文中所描述的增加眼表面上的粘蛋白含量的方法的一些实施方案中,所述式(i)、式(ii)、式(iiia)或式(iiib)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶半粘酸盐单水合物。在本文中所描述的方法的一些实施方案中,所述式(i)、式(ii)、式(iiia)或式(iiib)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶半粘酸盐二水合物。
[0335]
在一些实施方案中为一种增加眼表面上的粘蛋白含量的方法,其还包括局部施用防止或减少烟碱乙酰胆碱受体进入减敏状态或促进烟碱乙酰胆碱受体从减敏状态恢复的一种或多种物质。在一些实施方案中为一种增加眼表面上的粘蛋白含量的方法,其还包括局部施用预防或促进烟碱乙酰胆碱受体从减敏状态恢复的一种或多种物质,所述一种或多种物质选自蛋白激酶c(pkc)或者上调或向上调节pkc的因子、camp依赖性蛋白激酶(pka)或者上调或向上调节pka的因子和钙调磷酸酶抑制剂。在一些实施方案中为一种增加眼表面上的粘蛋白含量的方法,其还包括局部施用防止或减少烟碱乙酰胆碱受体进入减敏状态或促进烟碱乙酰胆碱受体从减敏状态恢复的一种或多种物质,所述一种或多种物质选自蛋白激酶c(pkc)或者上调或向上调节pkc的因子、camp依赖性蛋白激酶(pka)或者上调或向上调节pka的因子和钙调磷酸酶抑制剂。在一些实施方案中为一种增加眼表面上的粘蛋白含量的方法,其还包括局部施用蛋白激酶c(pkc)或者上调或向上调节pkc的因子。在一些实施方案中为一种增加眼表面上的粘蛋白含量的方法,其还包括局部施用camp依赖性蛋白激酶(pka)或者上调或向上调节pka的因子。在一些实施方案中为一种增加眼表面上的粘蛋白含量的方法,其还包括局部施用钙调磷酸酶抑制剂。在一些实施方案中为一种增加眼表面上的粘蛋白含量的方法,其还包括局部施用钙调磷酸酶抑制剂,其中所述钙调磷酸酶抑制剂选自环孢霉素、吡美莫司和他克莫司。在一些实施方案中为一种增加眼表面上的粘蛋白含量的方法,其还包括局部施用环孢霉素。在一些实施方案中为一种增加眼表面上的粘蛋白含量的方法,其还包括局部施用吡美莫司。在一些实施方案中为一种增加眼表面上的粘蛋白含量的方法,其还包括局部施用他克莫司。
[0336]
在增加眼表面上的粘蛋白含量的任何上述实施方案的另一个实施方案中,向鼻腔中施用至少1微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加眼表面上的粘蛋白含量的任何上述实施方案的另一个实施方案中,向鼻腔中施用至少5微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加眼表面上的粘蛋白含量的任何上述实施方案的另一个
实施方案中,向鼻腔中施用至少10微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加眼表面上的粘蛋白含量的任何上述实施方案的另一个实施方案中,向鼻腔中施用至少25微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加眼表面上的粘蛋白含量的任何上述实施方案的另一个实施方案中,向鼻腔中施用至少50微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加眼表面上的粘蛋白含量的任何上述实施方案的另一个实施方案中,向鼻腔中施用至少100微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加眼表面上的粘蛋白含量的任何上述实施方案的另一个实施方案中,向鼻腔中施用至少250微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加眼表面上的粘蛋白含量的任何上述实施方案的另一个实施方案中,向鼻腔中施用至少500微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加眼表面上的粘蛋白含量的任何上述实施方案的另一个实施方案中,向鼻腔中施用至少750微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加眼表面上的粘蛋白含量的任何上述实施方案的另一个实施方案中,向鼻腔中施用至少1000微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在一些实施方案中,所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0337]
在增加眼表面上的粘蛋白含量的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于1微克与1000微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加眼表面上的粘蛋白含量的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于5微克与1000微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加眼表面上的粘蛋白含量的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于10微克与1000微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加眼表面上的粘蛋白含量的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于5微克与100微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加眼表面上的粘蛋白含量的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于5微克与50微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加眼表面上的粘蛋白含量的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于10微克与50微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加眼表面上的粘蛋白含量的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于25微克与1000微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加眼表面上的粘蛋白含量的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于50微克与1000微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加眼表面上的粘蛋白含量的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于100微克与1000微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加眼表面上的粘蛋白含量的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于150微克与1000微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加眼表面上的粘蛋白含量的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于100微克与750微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加眼表面上的粘蛋白含量的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于150微克与750微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加眼表面上的粘蛋白含量的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于150微克与600微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在一些实施方案中,所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0338]
在增加眼表面上的粘蛋白含量的任何上述实施方案的另一个实施方案中,向鼻腔中施用少于100微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加眼表面上的粘蛋白含量的任何上述实施方案的另一个实施方案中,向鼻腔中施用少于75微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加眼表面上的粘蛋白含量的任何上述实施方案的另一个实施方案中,向鼻腔中施用少于50微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加眼表面上的粘蛋白含量的任何上述实施方案的另一个实施方案中,向鼻腔中施用少于25微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加眼表面上的粘蛋白含量的任何上述实施方案的另一个实施方案中,向鼻腔中施用少于15微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加眼表面上的粘蛋白含量的任何上述实施方案的另一个实施方案中,向鼻腔中施用约75微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加眼表面上的粘蛋白含量的任何上述实施方案的另一个实施方案中,向鼻腔中施用约50微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加眼表面上的粘蛋白含量的任何上述实施方案的另一个实施方案中,向鼻腔中施用约25微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加眼表面上的粘蛋白含量的任何上述实施方案的另一个实施方案中,向鼻腔中施用约10微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在一些实施方案中,所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0339]
在增加眼表面上的粘蛋白含量的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于1微克与100微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加眼表面上的粘蛋白含量的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于1微克与75微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加眼表面上的粘蛋白含量的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于5微克与100微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加眼表面上的粘蛋白含量的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于5微克与75微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加眼表面上的粘蛋白含量的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于15微克与100微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加眼表面上的粘蛋白含量的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于15微克与75微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加眼表面上的粘蛋白含量的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于25微克与100微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加眼表面上的粘蛋白含量的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于25微克与75微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加眼表面上的粘蛋白含量的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于25微克与60微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。
[0340]
在增加眼表面上的粘蛋白含量的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于500微克与10毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加眼表面上的粘蛋白含量的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于500微克与5毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加眼表面上的粘蛋白含量的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于500微克与3毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加眼表面上的粘蛋白含量的任何上述实施
方案的另一个实施方案中,向鼻腔中施用介于500微克与2毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加眼表面上的粘蛋白含量的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于1毫克与10毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加眼表面上的粘蛋白含量的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于1毫克与5毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加眼表面上的粘蛋白含量的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于1毫克与3毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加眼表面上的粘蛋白含量的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于1毫克与2毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加眼表面上的粘蛋白含量的任何上述实施方案的另一个实施方案中,向鼻腔中施用约500微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加眼表面上的粘蛋白含量的任何上述实施方案的另一个实施方案中,向鼻腔中施用约1毫克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加眼表面上的粘蛋白含量的任何上述实施方案的另一个实施方案中,向鼻腔中施用约1.5毫克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加眼表面上的粘蛋白含量的任何上述实施方案的另一个实施方案中,向鼻腔中施用约2毫克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加眼表面上的粘蛋白含量的任何上述实施方案的另一个实施方案中,向鼻腔中施用约2.5毫克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加眼表面上的粘蛋白含量的任何上述实施方案的另一个实施方案中,向鼻腔中施用约3毫克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加眼表面上的粘蛋白含量的任何上述实施方案的另一个实施方案中,向鼻腔中施用约4毫克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加眼表面上的粘蛋白含量的任何上述实施方案的另一个实施方案中,向鼻腔中施用约5毫克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在一些实施方案中,所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0341]
在增加眼表面上的粘蛋白含量的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于1微克与10毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加眼表面上的粘蛋白含量的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于5微克与10毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加眼表面上的粘蛋白含量的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于10微克与10毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加眼表面上的粘蛋白含量的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于25微克与10毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加眼表面上的粘蛋白含量的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于50微克与10毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加眼表面上的粘蛋白含量的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于100微克与10毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加眼表面上的粘蛋白含量的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于150微克与10毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在一些实施方案中,所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0342]
在增加眼表面上的粘蛋白含量的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于1微克与10毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加眼表
面上的粘蛋白含量的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于1微克与5毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加眼表面上的粘蛋白含量的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于1微克与4毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加眼表面上的粘蛋白含量的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于1微克与3毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加眼表面上的粘蛋白含量的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于1微克与2毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加眼表面上的粘蛋白含量的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于1微克与1毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加眼表面上的粘蛋白含量的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于1微克与750微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加眼表面上的粘蛋白含量的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于1微克与600微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加眼表面上的粘蛋白含量的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于1微克与100微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加眼表面上的粘蛋白含量的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于1微克与50微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在一些实施方案中,所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0343]
在任何上述实施方案中,用于所述方法中的药物制剂包含约0.1mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含约0.2mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含约0.5mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含约1mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含约2mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含约3mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含约4mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含约5mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含约6mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含约7mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含约8mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含约9mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含约10mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含约12mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含约15mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含约20mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含约25mg/ml的式(i)、
式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含约30mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含约40mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含约50mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在一些实施方案中,所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0344]
在另一个实施方案中,用于所述方法中的药物制剂包含介于5mg/ml与200mg/ml之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含介于10mg/ml与200mg/ml之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含介于5mg/ml与100mg/ml之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含介于10mg/ml与75mg/ml之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含介于10mg/ml与50mg/ml之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含介于10mg/ml与30mg/ml之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含介于5mg/ml与50mg/ml之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在一些实施方案中,所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0345]
在另一个实施方案中,用于所述方法中的药物制剂包含介于10mg/ml与25mg/ml之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物在另一个实施方案中,用于所述方法中的药物制剂包含介于10mg/ml与50mg/ml之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含介于20mg/ml与50mg/ml之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含介于30mg/ml与75mg/ml之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在一些实施方案中,所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0346]
在任何上述实施方案中,用于所述方法中的药物制剂以约10至200μl提供。在另一个实施方案中,用于所述方法中的药物制剂以约10至150μl提供。在另一个实施方案中,用于所述方法中的药物制剂以约10至100μl提供。在另一个实施方案中,用于所述方法中的药物制剂以约50至200μl提供。在另一个实施方案中,用于所述方法中的药物制剂以约100至200μl提供。在另一个实施方案中,用于所述方法中的药物制剂以约50至100μl提供。在另一个实施方案中,用于所述方法中的药物制剂以约10至150μl提供。在另一个实施方案中,用于所述方法中的药物制剂以约10、20、30、40、50、60、70、80、90、100、110、120、130、140、150、160、170、180、190或200μl提供。在一些实施方案中,所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0347]
在增加眼表面上的粘蛋白含量的任何上述实施方案的另一个实施方案中,每日施用式(i)、式(ii)、式(iiia)或式(iiib)化合物一次。在增加眼表面上的粘蛋白含量的任何上述实施方案的另一个实施方案中,每日施用式(i)、式(ii)、式(iiia)或式(iiib)化合物至少一次。在增加眼表面上的粘蛋白含量的任何上述实施方案的另一个实施方案中,每日
施用式(i)、式(ii)、式(iiia)或式(iiib)化合物两次。在增加眼表面上的粘蛋白含量的任何上述实施方案的另一个实施方案中,每日施用式(i)、式(ii)、式(iiia)或式(iiib)化合物至少两次。在增加眼表面上的粘蛋白含量的任何上述实施方案的另一个实施方案中,每日施用式(i)、式(ii)、式(iiia)或式(iiib)化合物三次。在增加眼表面上的粘蛋白含量的任何上述实施方案的另一个实施方案中,每日施用式(i)、式(ii)、式(iiia)或式(iiib)化合物至少三次。在增加眼表面上的粘蛋白含量的任何上述实施方案的另一个实施方案中,施用式(i)、式(ii)、式(iiia)或式(iiib)化合物一天。在增加眼表面上的粘蛋白含量的任何上述实施方案的另一个实施方案中,施用式(i)、式(ii)、式(iiia)或式(iiib)化合物至少两天。在增加眼表面上的粘蛋白含量的任何上述实施方案的另一个实施方案中,施用式(i)、式(ii)、式(iiia)或式(iiib)化合物至少三天。在增加眼表面上的粘蛋白含量的任何上述实施方案的另一个实施方案中,施用式(i)、式(ii)、式(iiia)或式(iiib)化合物至少四天。在增加眼表面上的粘蛋白含量的任何上述实施方案的另一个实施方案中,施用式(i)、式(ii)、式(iiia)或式(iiib)化合物至少五天。在增加眼表面上的粘蛋白含量的任何上述实施方案的另一个实施方案中,施用式(i)、式(ii)、式(iiia)或式(iiib)化合物至少七天。在增加眼表面上的粘蛋白含量的任何上述实施方案的另一个实施方案中,施用式(i)、式(ii)、式(iiia)或式(iiib)化合物至少十天。在增加眼表面上的粘蛋白含量的任何上述实施方案的另一个实施方案中,施用式(i)、式(ii)、式(iiia)或式(iiib)化合物至少十四天。在增加眼表面上的粘蛋白含量的任何上述实施方案的另一个实施方案中,施用式(i)、式(ii)、式(iiia)或式(iiib)化合物至少二十一天。在增加眼表面上的粘蛋白含量的任何上述实施方案的另一个实施方案中,施用式(i)、式(ii)、式(iiia)或式(iiib)化合物至少三十天。在一些实施方案中,所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0348]
在增加眼表面上的粘蛋白含量的任何上述实施方案的另一个实施方案中,在交替鼻孔中施用式(i)、式(ii)、式(iiia)或式(iiib)化合物。举例来说,在一个鼻孔中,接着在预定量的时间之后在另一个鼻孔中施用式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,在两个鼻孔中施用式(i)、式(ii)、式(iiia)或式(iiib)化合物。举例来说,在一个鼻孔中,接着同时或在第一鼻孔之后立即在另一鼻孔中施用式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,在一个鼻孔中施用式(i)、式(ii)、式(iiia)或式(iiib)化合物。在一些实施方案中,所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0349]
在增加眼表面上的粘蛋白含量的任何上述实施方案的另一个实施方案中,式(i)、式(ii)、式(iiia)或式(iiib)化合物呈液体、混悬剂、气雾剂、凝胶、软膏、干粉、乳膏、糊剂、洗剂或香膏形式施用至鼻腔中。在增加眼表面上的粘蛋白含量的任何上述实施方案的另一个实施方案中,式(i)、式(ii)、式(iiia)或式(iiib)化合物呈液体形式施用至鼻腔中。在增加眼表面上的粘蛋白含量的任何上述实施方案的另一个实施方案中,式(i)、式(ii)、式(iiia)或式(iiib)化合物呈混悬剂形式施用至鼻腔中。在增加眼表面上的粘蛋白含量的任何上述实施方案的另一个实施方案中,式(i)、式(ii)、式(iiia)或式(iiib)化合物呈气雾剂形式施用至鼻腔中。在增加眼表面上的粘蛋白含量的任何上述实施方案的另一个实施方案中,式(i)、式(ii)、式(iiia)或式(iiib)化合物呈凝胶形式施用至鼻腔中。在增加眼表面
上的粘蛋白含量的任何上述实施方案的另一个实施方案中,式(i)、式(ii)、式(iiia)或式(iiib)化合物呈软膏形式施用至鼻腔中。在增加眼表面上的粘蛋白含量的任何上述实施方案的另一个实施方案中,式(i)、式(ii)、式(iiia)或式(iiib)化合物呈干粉形式施用至鼻腔中。在增加眼表面上的粘蛋白含量的任何上述实施方案的另一个实施方案中,式(i)、式(ii)、式(iiia)或式(iiib)化合物呈乳膏形式施用至鼻腔中。在增加眼表面上的粘蛋白含量的任何上述实施方案的另一个实施方案中,式(i)、式(ii)、式(iiia)或式(iiib)化合物呈糊剂形式施用至鼻腔中。在增加眼表面上的粘蛋白含量的任何上述实施方案的另一个实施方案中,式(i)、式(ii)、式(iiia)或式(iiib)化合物呈洗剂形式施用至鼻腔中。在增加眼表面上的粘蛋白含量的任何上述实施方案的另一个实施方案中,式(i)、式(ii)、式(iiia)或式(iiib)化合物呈香膏形式施用至鼻腔中。在一些实施方案中,所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0350]
在增加眼表面上的粘蛋白含量的任何上述实施方案的另一个实施方案中,通过注射器、滴管、瓶状雾化器、雾化泵、吸入器、喷粉装置、汽化器、贴片、施药棒、吸移管或液体喷射器将式(i)、式(ii)、式(iiia)或式(iiib)化合物施用至鼻腔中。在增加眼表面上的粘蛋白含量的任何上述实施方案的另一个实施方案中,通过注射器将式(i)、式(ii)、式(iiia)或式(iiib)化合物施用至鼻腔中。在增加眼表面上的粘蛋白含量的任何上述实施方案的另一个实施方案中,通过滴管将式(i)、式(ii)、式(iiia)或式(iiib)化合物施用至鼻腔中。在增加眼表面上的粘蛋白含量的任何上述实施方案的另一个实施方案中,通过瓶状雾化器将式(i)、式(ii)、式(iiia)或式(iiib)化合物施用至鼻腔中。在增加眼表面上的粘蛋白含量的任何上述实施方案的另一个实施方案中,通过雾化泵将式(i)、式(ii)、式(iiia)或式(iiib)化合物施用至鼻腔中。在增加眼表面上的粘蛋白含量的任何上述实施方案的另一个实施方案中,通过吸入器将式(i)、式(ii)、式(iiia)或式(iiib)化合物施用至鼻腔中。在增加眼表面上的粘蛋白含量的任何上述实施方案的另一个实施方案中,通过喷粉装置将式(i)、式(ii)、式(iiia)或式(iiib)化合物施用至鼻腔中。在增加眼表面上的粘蛋白含量的任何上述实施方案的另一个实施方案中,通过汽化器将式(i)、式(ii)、式(iiia)或式(iiib)化合物施用至鼻腔中。在增加眼表面上的粘蛋白含量的任何上述实施方案的另一个实施方案中,通过贴片将式(i)、式(ii)、式(iiia)或式(iiib)化合物施用至鼻腔中。在增加眼表面上的粘蛋白含量的任何上述实施方案的另一个实施方案中,通过施药棒将式(i)、式(ii)、式(iiia)或式(iiib)化合物施用至鼻腔中。在增加眼表面上的粘蛋白含量的任何上述实施方案的另一个实施方案中,通过吸移管将式(i)、式(ii)、式(iiia)或式(iiib)化合物施用至鼻腔中。在增加眼表面上的粘蛋白含量的任何上述实施方案的另一个实施方案中,通过液体喷射器将式(i)、式(ii)、式(iiia)或式(iiib)化合物施用至鼻腔中。在一些实施方案中,所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0351]
在增加眼表面上的粘蛋白含量的任何上述实施方案的另一个实施方案中,使三叉神经活化。在增加眼表面上的粘蛋白含量的另一个实施方案中,使筛前神经活化。在增加眼表面上的粘蛋白含量的任何上述实施方案的另一个实施方案中,使鼻泪反射活化。在一些实施方案中,所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0352]
在增加眼表面上的粘蛋白含量的任何上述实施方案的另一个实施方案中,眼表面上的粘蛋白含量与急性病状相关。急性病状是指存在具有健康影响的快速发作的病状,其被视为短暂而非长期的。急性病状可能由眼科手术程序或其他眼科治疗引起。在一些实施方案中,所述眼科手术程序为白内障手术(白内障摘除术和晶状体置换)、屈旋光性晶体置换、青光眼手术、lasik手术(雷射眼部手术)、玻璃体切除术、视网膜光凝固术、视网膜脱离修复、黄斑裂孔修复、虹膜后肿瘤或肿块移除、后巩膜切开术、视神经切开术或减少泪腺功能的其他治疗。在一些实施方案中,所述眼科治疗包括辐射疗法。在一些实施方案中,所述辐射疗法针对眼窝区域,例如与头和/或颈癌相关。在一些实施方案中,所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0353]
增加一种或多种泪蛋白的量或浓度
[0354]
在一些实施方案中,本文中提供一种增加受试者的一种或多种泪蛋白的量或浓度的方法。在一些实施方案中为一种增加一种或多种泪蛋白的量或浓度的方法,其包括将治疗有效量的式(i)、式(ii)、式(iiia)或式(iiib)化合物局部施用至有需要的个体的鼻腔中,其中所述式(i)、式(ii)、式(iiia)或式(iiib)化合物选择性地结合至外周烟碱乙酰胆碱受体且不会以药理学相关的浓度越过血脑屏障。在一些实施方案中为增加一种或多种泪蛋白的量或浓度的方法,其包括将治疗有效量的式(i)、式(ii)、式(iiia)或式(iiib)化合物局部施用至有需要的个体的鼻腔中,其中所述式(i)、式(ii)、式(iiia)或式(iiib)化合物不会以药理学相关的浓度越过血脑屏障且选择性地结合至选自α3β4、α4β2和α7的外周烟碱乙酰胆碱受体亚型中的至少一者。在一些实施方案中为增加一种或多种泪蛋白的量或浓度的方法,其包括将治疗有效量的式(i)、式(ii)、式(iiia)或式(iiib)化合物局部施用至有需要的个体的鼻腔中,其中所述式(i)、式(ii)、式(iiia)或式(iiib)化合物不会以药理学相关的浓度越过血脑屏障且选择性地结合至外周烟碱乙酰胆碱受体亚型α3β4。在一些实施方案中为增加一种或多种泪蛋白的量或浓度的方法,其包括将治疗有效量的式(i)、式(ii)、式(iiia)或式(iiib)化合物局部施用至有需要的个体的鼻腔中,其中所述式(i)、式(ii)、式(iiia)或式(iiib)化合物不会以药理学相关的浓度越过血脑屏障且选择性地结合至外周烟碱乙酰胆碱受体亚型α4β2。在一些实施方案中为增加一种或多种泪蛋白的量或浓度的方法,其包括将治疗有效量的式(i)、式(ii)、式(iiia)或式(iiib)化合物局部施用至有需要的个体的鼻腔中,其中所述式(i)、式(ii)、式(iiia)或式(iiib)化合物不会以药理学相关的浓度越过血脑屏障且选择性地结合至外周烟碱乙酰胆碱受体亚型α7。在一些实施方案中为一种增加一种或多种泪蛋白的量或浓度的方法,其包括将治疗有效量的式(i)、式(ii)、式(iiia)或式(iiib)化合物局部施用至有需要的个体的鼻腔中,其中所述式(i)、式(ii)、式(iiia)或式(iiib)化合物选择性地结合至外周烟碱乙酰胆碱受体且以不具全身性生物可利用性的量施用。在一些实施方案中为一种增加一种或多种泪蛋白的量或浓度的方法,其包括将治疗有效量的式(i)、式(ii)、式(iiia)或式(iiib)化合物局部施用至有需要的个体的鼻腔中,其中所述式(i)、式(ii)、式(iiia)或式(iiib)化合物选择性地结合至外周烟碱乙酰胆碱受体且以不会引起不希望的精神副作用的量施用。在一些实施方案中为一种增加一种或多种泪蛋白的量或浓度的方法,其包括将治疗有效量的式(i)、式(ii)、式(iiia)或式(iiib)化合物局部施用至有需要的个体的鼻腔中,其中所述式(i)、式(ii)、式(iiia)或式(iiib)化合物选择性地结合至外周烟碱乙酰胆碱受体且以不会引起不希望的
全身性副作用的量施用。在一些实施方案中为一种增加一种或多种泪蛋白的量或浓度的方法,其包括将治疗有效量的式(i)、式(ii)、式(iiia)或式(iiib)化合物局部施用至有需要的个体的鼻腔中,其中所述式(i)、式(ii)、式(iiia)或式(iiib)化合物选择性地结合至外周烟碱乙酰胆碱受体且以产生局部作用的量施用。在一些实施方案中为一种增加一种或多种泪蛋白的量或浓度的方法,其中所述泪蛋白为上皮生长因子、乳铁素、催泪素、泌乳素、促肾上腺皮质素、亮氨酸脑啡肽、als2cl、arhgef19、kiaa1109、plxna1、polg、wipi1、zmiz2或泪液蛋白质组的其他蛋白质。在一些实施方案中为一种增加一种或多种泪蛋白的量或浓度的方法,其中至少一种泪蛋白为上皮生长因子。在一些实施方案中为一种增加一种或多种泪蛋白的量或浓度的方法,其中至少一种泪蛋白为乳铁素。在一些实施方案中为一种增加一种或多种泪蛋白的量或浓度的方法,其中至少一种泪蛋白为催泪素。在一些实施方案中为一种增加一种或多种泪蛋白的量或浓度的方法,其中至少一种泪蛋白为促乳素。在一些实施方案中为一种增加一种或多种泪蛋白的量或浓度的方法,其中至少一种泪蛋白为促肾上腺皮质素。在一些实施方案中为一种增加一种或多种泪蛋白的量或浓度的方法,其中至少一种泪蛋白为亮氨酸脑啡肽。在一些实施方案中为一种增加一种或多种泪蛋白的量或浓度的方法,其中至少一种泪蛋白为als2cl。在一些实施方案中为一种增加一种或多种泪蛋白的量或浓度的方法,其中至少一种泪蛋白为arhgef19。在一些实施方案中为一种增加一种或多种泪蛋白的量或浓度的方法,其中至少一种泪蛋白为kiaa1109。在一些实施方案中为一种增加一种或多种泪蛋白的量或浓度的方法,其中至少一种泪蛋白为plxna1。在一些实施方案中为一种增加一种或多种泪蛋白的量或浓度的方法,其中至少一种泪蛋白为polg。在一些实施方案中为一种增加一种或多种泪蛋白的量或浓度的方法,其中至少一种泪蛋白为wipi1。在一些实施方案中为一种增加一种或多种泪蛋白的量或浓度的方法,其中至少一种泪蛋白为zmiz2。在一些实施方案中为一种增加一种或多种泪蛋白的量或浓度的方法,其还包括局部施用预防或促进烟碱乙酰胆碱受体从减敏状态恢复的一种或多种物质。在一些实施方案中为一种增加一种或多种泪蛋白的量或浓度的方法,其还包括局部施用防止或减少烟碱乙酰胆碱受体进入减敏状态或促进烟碱乙酰胆碱受体从减敏状态恢复的一种或多种物质。在一些实施方案中,所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0355]
在本文中所描述的增加一种或多种泪蛋白的量或浓度的方法的一些实施方案中,所述式(i)、式(ii)、式(iiia)或式(iiib)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶(或化合物1)。在本文中所描述的方法的一些实施方案中,所述式(i)、式(ii)、式(iiia)或式(iiib)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。在本文中所描述的增加一种或多种泪蛋白的量或浓度的方法的一些实施方案中,所述式(i)、式(ii)、式(iiia)或式(iiib)化合物为呈游离碱形式的(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶。在本文中所描述的增加一种或多种泪蛋白的量或浓度的方法的一些实施方案中,所述式(i)、式(ii)、式(iiia)或式(iiib)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶柠檬酸盐。在本文中所描述的增加一种或多种泪蛋白的量或浓度的方法的一些实施方案中,所述式(i)、式(ii)、式(iiia)或式(iiib)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶单柠檬酸盐。在本文中所描述的增加一种或多种泪蛋白的量或浓度的方法的一些实施方案中,所述式(i)、式(ii)、式(iiia)或式(iiib)化合物为(r)-5-((e)-2-吡咯烷-3-基乙
烯基)嘧啶hcl盐。在本文中所描述的增加一种或多种泪蛋白的量或浓度的方法的一些实施方案中,所述式(i)、式(ii)、式(iiia)或式(iiib)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶粘酸盐。在本文中所描述的增加一种或多种泪蛋白的量或浓度的方法的一些实施方案中,所述式(i)、式(ii)、式(iiia)或式(iiib)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶半粘酸盐。在本文中所描述的增加一种或多种泪蛋白的量或浓度的方法的一些实施方案中,所述式(i)、式(ii)、式(iiia)或式(iiib)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶半粘酸盐单水合物。在本文中所描述的方法的一些实施方案中,所述式(i)、式(ii)、式(iiia)或式(iiib)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶半粘酸盐二水合物。
[0356]
在一些实施方案中为一种增加一种或多种泪蛋白的量或浓度的方法,其还包括局部施用预防或促进烟碱乙酰胆碱受体从减敏状态恢复的一种或多种物质,所述一种或多种物质选自蛋白激酶c(pkc)或者上调或向上调节pkc的因子、camp依赖性蛋白激酶(pka)或者上调或向上调节pka的因子和钙调磷酸酶抑制剂。在一些实施方案中为一种增加一种或多种泪蛋白的量或浓度的方法,其还包括局部施用防止或减少烟碱乙酰胆碱受体进入减敏状态或促进烟碱乙酰胆碱受体从减敏状态恢复的一种或多种物质,所述一种或多种物质选自蛋白激酶c(pkc)或者上调或向上调节pkc的因子、camp依赖性蛋白激酶(pka)或者上调或向上调节pka的因子和钙调磷酸酶抑制剂。在一些实施方案中为一种增加一种或多种泪蛋白的量或浓度的方法,其还包括局部施用蛋白激酶c(pkc)或者上调或向上调节pkc的因子。在一些实施方案中为一种增加一种或多种泪蛋白的量或浓度的方法,其还包括局部施用camp依赖性蛋白激酶(pka)或者上调或向上调节pka的因子。在一些实施方案中为一种增加一种或多种泪蛋白的量或浓度的方法,其还包括局部施用钙调磷酸酶抑制剂。在一些实施方案中为一种增加一种或多种泪蛋白的量或浓度的方法,其还包括局部施用钙调磷酸酶抑制剂,其中所述钙调磷酸酶抑制剂选自环孢霉素、吡美莫司和他克莫司。在一些实施方案中为一种增加一种或多种泪蛋白的量或浓度的方法,其还包括局部施用环孢霉素。在一些实施方案中为一种增加一种或多种泪蛋白的量或浓度的方法,其还包括局部施用吡美莫司。在一些实施方案中为一种增加一种或多种泪蛋白的量或浓度的方法,其还包括局部施用他克莫司。
[0357]
在增加一种或多种泪蛋白的量或浓度的任何上述实施方案的另一个实施方案中,向鼻腔中施用至少1微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加一种或多种泪蛋白的量或浓度的任何上述实施方案的另一个实施方案中,向鼻腔中施用至少5微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加一种或多种泪蛋白的量或浓度的任何上述实施方案的另一个实施方案中,向鼻腔中施用至少10微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加一种或多种泪蛋白的量或浓度的任何上述实施方案的另一个实施方案中,向鼻腔中施用至少25微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加一种或多种泪蛋白的量或浓度的任何上述实施方案的另一个实施方案中,向鼻腔中施用至少50微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加一种或多种泪蛋白的量或浓度的任何上述实施方案的另一个实施方案中,向鼻腔中施用至少100微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加一种或多种泪蛋白的量或浓度的任何上述实施方案的另一个实施方案中,向鼻腔中施用至少250微克的式(i)、式(ii)、式(iiia)或式
(iiib)化合物。在增加一种或多种泪蛋白的量或浓度的任何上述实施方案的另一个实施方案中,向鼻腔中施用至少500微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加一种或多种泪蛋白的量或浓度的任何上述实施方案的另一个实施方案中,向鼻腔中施用至少750微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加一种或多种泪蛋白的量或浓度的任何上述实施方案的另一个实施方案中,向鼻腔中施用至少1000微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在一些实施方案中,所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0358]
在增加一种或多种泪蛋白的量或浓度的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于1微克与1000微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加一种或多种泪蛋白的量或浓度的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于5微克与1000微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加一种或多种泪蛋白的量或浓度的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于10微克与1000微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加一种或多种泪蛋白的量或浓度的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于5微克与100微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加一种或多种泪蛋白的量或浓度的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于5微克与50微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加一种或多种泪蛋白的量或浓度的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于10微克与50微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加一种或多种泪蛋白的量或浓度的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于25微克与1000微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加一种或多种泪蛋白的量或浓度的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于50微克与1000微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加一种或多种泪蛋白的量或浓度的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于100微克与1000微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加一种或多种泪蛋白的量或浓度的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于150微克与1000微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加一种或多种泪蛋白的量或浓度的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于100微克与750微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加一种或多种泪蛋白的量或浓度的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于150微克与750微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加一种或多种泪蛋白的量或浓度的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于150微克与600微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在一些实施方案中,所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0359]
在增加一种或多种泪蛋白的量或浓度的任何上述实施方案的另一个实施方案中,向鼻腔中施用少于100微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加一种或多种泪蛋白的量或浓度的任何上述实施方案的另一个实施方案中,向鼻腔中施用少于75微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加一种或多种泪蛋白的量或浓度的任何上述实施方案的另一个实施方案中,向鼻腔中施用少于50微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加一种或多种泪蛋白的量或浓度的任何上述实施方案的另
一个实施方案中,向鼻腔中施用少于25微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加一种或多种泪蛋白的量或浓度的任何上述实施方案的另一个实施方案中,向鼻腔中施用少于15微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加一种或多种泪蛋白的量或浓度的任何上述实施方案的另一个实施方案中,向鼻腔中施用约75微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加一种或多种泪蛋白的量或浓度的任何上述实施方案的另一个实施方案中,向鼻腔中施用约50微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加一种或多种泪蛋白的量或浓度的任何上述实施方案的另一个实施方案中,向鼻腔中施用约25微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加一种或多种泪蛋白的量或浓度的任何上述实施方案的另一个实施方案中,向鼻腔中施用约10微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在一些实施方案中,所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0360]
在增加一种或多种泪蛋白的量或浓度的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于1微克与100微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加一种或多种泪蛋白的量或浓度的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于1微克与75微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加一种或多种泪蛋白的量或浓度的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于5微克与100微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加一种或多种泪蛋白的量或浓度的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于5微克与75微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加一种或多种泪蛋白的量或浓度的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于15微克与100微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加一种或多种泪蛋白的量或浓度的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于15微克与75微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加一种或多种泪蛋白的量或浓度的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于25微克与100微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加一种或多种泪蛋白的量或浓度的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于25微克与75微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加一种或多种泪蛋白的量或浓度的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于25微克与60微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在一些实施方案中,所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0361]
在增加一种或多种泪蛋白的量或浓度的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于500微克与10毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加一种或多种泪蛋白的量或浓度的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于500微克与5毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加一种或多种泪蛋白的量或浓度的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于500微克与3毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加一种或多种泪蛋白的量或浓度的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于500微克与2毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加一种或多种泪蛋白的量或浓度的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于1毫克与10毫克之间的式
(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加一种或多种泪蛋白的量或浓度的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于1毫克与5毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加一种或多种泪蛋白的量或浓度的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于1毫克与3毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加一种或多种泪蛋白的量或浓度的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于1毫克与2毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加一种或多种泪蛋白的量或浓度的任何上述实施方案的另一个实施方案中,向鼻腔中施用约500微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加一种或多种泪蛋白的量或浓度的任何上述实施方案的另一个实施方案中,向鼻腔中施用约1毫克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加一种或多种泪蛋白的量或浓度的任何上述实施方案的另一个实施方案中,向鼻腔中施用约1.5毫克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加一种或多种泪蛋白的量或浓度的任何上述实施方案的另一个实施方案中,向鼻腔中施用约2毫克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加一种或多种泪蛋白的量或浓度的任何上述实施方案的另一个实施方案中,向鼻腔中施用约2.5毫克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加一种或多种泪蛋白的量或浓度的任何上述实施方案的另一个实施方案中,向鼻腔中施用约3毫克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加一种或多种泪蛋白的量或浓度的任何上述实施方案的另一个实施方案中,向鼻腔中施用约4毫克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加一种或多种泪蛋白的量或浓度的任何上述实施方案的另一个实施方案中,向鼻腔中施用约5毫克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在一些实施方案中,所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0362]
在增加一种或多种泪蛋白的量或浓度的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于1微克与10毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加一种或多种泪蛋白的量或浓度的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于5微克与10毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加一种或多种泪蛋白的量或浓度的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于10微克与10毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加一种或多种泪蛋白的量或浓度的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于25微克与10毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加一种或多种泪蛋白的量或浓度的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于50微克与10毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加一种或多种泪蛋白的量或浓度的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于100微克与10毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加一种或多种泪蛋白的量或浓度的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于150微克与10毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在一些实施方案中,所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0363]
在增加一种或多种泪蛋白的量或浓度的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于1微克与10毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加一种或多种泪蛋白的量或浓度的任何上述实施方案的另一个实施方案中,向鼻腔中施用
介于1微克与5毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加一种或多种泪蛋白的量或浓度的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于1微克与4毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加一种或多种泪蛋白的量或浓度的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于1微克与3毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加一种或多种泪蛋白的量或浓度的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于1微克与2毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加一种或多种泪蛋白的量或浓度的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于1微克与1毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加一种或多种泪蛋白的量或浓度的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于1微克与750微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加一种或多种泪蛋白的量或浓度的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于1微克与600微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加一种或多种泪蛋白的量或浓度的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于1微克与100微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加一种或多种泪蛋白的量或浓度的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于1微克与50微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在一些实施方案中,所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0364]
在任何上述实施方案中,用于所述方法中的药物制剂包含约0.1mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含约0.2mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含约0.5mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含约1mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含约2mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含约3mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含约4mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含约5mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含约6mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含约7mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含约8mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含约9mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含约10mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含约12mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含约15mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含约20mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含约25mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包
含约30mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含约40mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含约50mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在一些实施方案中,所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0365]
在另一个实施方案中,用于所述方法中的药物制剂包含介于5mg/ml与200mg/ml之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含介于10mg/ml与200mg/ml之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含介于5mg/ml与100mg/ml之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含介于10mg/ml与75mg/ml之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含介于10mg/ml与50mg/ml之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含介于10mg/ml与30mg/ml之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含介于5mg/ml与50mg/ml之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在一些实施方案中,所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0366]
在另一个实施方案中,用于所述方法中的药物制剂包含介于10mg/ml与25mg/ml之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含介于10mg/ml与50mg/ml之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含介于20mg/ml与50mg/ml之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含介于30mg/ml与75mg/ml之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在一些实施方案中,所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0367]
在任何上述实施方案中,用于所述方法中的药物制剂以约10至200μl提供。在另一个实施方案中,用于所述方法中的药物制剂以约10至150μl提供。在另一个实施方案中,用于所述方法中的药物制剂以约10至100μl提供。在另一个实施方案中,用于所述方法中的药物制剂以约50至200μl提供。在另一个实施方案中,用于所述方法中的药物制剂以约100至200μl提供。在另一个实施方案中,用于所述方法中的药物制剂以约50至100μl提供。在另一个实施方案中,用于所述方法中的药物制剂以约10至150μl提供。在另一个实施方案中,用于所述方法中的药物制剂以约10、20、30、40、50、60、70、80、90、100、110、120、130、140、150、160、170、180、190或200μl提供。在一些实施方案中,所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0368]
在增加一种或多种泪蛋白的量或浓度的任何上述实施方案的另一个实施方案中,每日施用式(i)、式(ii)、式(iiia)或式(iiib)化合物一次。在增加一种或多种泪蛋白的量或浓度的任何上述实施方案的另一个实施方案中,每日施用式(i)、式(ii)、式(iiia)或式(iiib)化合物至少一次。在增加一种或多种泪蛋白的量或浓度的任何上述实施方案的另一个实施方案中,每日施用式(i)、式(ii)、式(iiia)或式(iiib)化合物两次。在增加一种或多
种泪蛋白的量或浓度的任何上述实施方案的另一个实施方案中,每日施用式(i)、式(ii)、式(iiia)或式(iiib)化合物至少两次。在增加一种或多种泪蛋白的量或浓度的任何上述实施方案的另一个实施方案中,每日施用式(i)、式(ii)、式(iiia)或式(iiib)化合物三次。在增加一种或多种泪蛋白的量或浓度的任何上述实施方案的另一个实施方案中,每日施用式(i)、式(ii)、式(iiia)或式(iiib)化合物至少三次。在增加一种或多种泪蛋白的量或浓度的任何上述实施方案的另一个实施方案中,施用式(i)、式(ii)、式(iiia)或式(iiib)化合物一天。在增加一种或多种泪蛋白的量或浓度的任何上述实施方案的另一个实施方案中,施用式(i)、式(ii)、式(iiia)或式(iiib)化合物至少两天。在增加一种或多种泪蛋白的量或浓度的任何上述实施方案的另一个实施方案中,施用式(i)、式(ii)、式(iiia)或式(iiib)化合物至少三天。在增加一种或多种泪蛋白的量或浓度的任何上述实施方案的另一个实施方案中,施用式(i)、式(ii)、式(iiia)或式(iiib)化合物至少四天。在增加一种或多种泪蛋白的量或浓度的任何上述实施方案的另一个实施方案中,施用式(i)、式(ii)、式(iiia)或式(iiib)化合物至少五天。在增加一种或多种泪蛋白的量或浓度的任何上述实施方案的另一个实施方案中,施用式(i)、式(ii)、式(iiia)或式(iiib)化合物至少七天。在增加一种或多种泪蛋白的量或浓度的任何上述实施方案的另一个实施方案中,施用式(i)、式(ii)、式(iiia)或式(iiib)化合物至少十天。在增加一种或多种泪蛋白的量或浓度的任何上述实施方案的另一个实施方案中,施用式(i)、式(ii)、式(iiia)或式(iiib)化合物至少十四天。在增加一种或多种泪蛋白的量或浓度的任何上述实施方案的另一个实施方案中,施用式(i)、式(ii)、式(iiia)或式(iiib)化合物至少二十一天。在增加一种或多种泪蛋白的量或浓度的任何上述实施方案的另一个实施方案中,施用式(i)、式(ii)、式(iiia)或式(iiib)化合物至少三十天。在一些实施方案中,所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0369]
在增加一种或多种泪蛋白的量或浓度的任何上述实施方案的另一个实施方案中,在交替鼻孔中施用式(i)、式(ii)、式(iiia)或式(iiib)化合物。举例来说,在一个鼻孔中,接着在预定量的时间之后在另一个鼻孔中施用式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,在两个鼻孔中施用式(i)、式(ii)、式(iiia)或式(iiib)化合物。举例来说,在一个鼻孔中,接着同时或在第一鼻孔之后立即在另一鼻孔中施用式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,在一个鼻孔中施用式(i)、式(ii)、式(iiia)或式(iiib)化合物。在一些实施方案中,所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0370]
在增加一种或多种泪蛋白的量或浓度的任何上述实施方案的另一个实施方案中,式(i)、式(ii)、式(iiia)或式(iiib)化合物呈液体、混悬剂、气雾剂、凝胶、软膏、干粉、乳膏、糊剂、洗剂或香膏形式施用至鼻腔中。在增加一种或多种泪蛋白的量或浓度的任何上述实施方案的另一个实施方案中,式(i)、式(ii)、式(iiia)或式(iiib)化合物呈液体形式施用至鼻腔中。在增加一种或多种泪蛋白的量或浓度的任何上述实施方案的另一个实施方案中,式(i)、式(ii)、式(iiia)或式(iiib)化合物呈混悬剂形式施用至鼻腔中。在增加一种或多种泪蛋白的量或浓度的任何上述实施方案的另一个实施方案中,式(i)、式(ii)、式(iiia)或式(iiib)化合物呈气雾剂形式施用至鼻腔中。在增加一种或多种泪蛋白的量或浓度的任何上述实施方案的另一个实施方案中,式(i)、式(ii)、式(iiia)或式(iiib)化合物
呈凝胶形式施用至鼻腔中。在增加一种或多种泪蛋白的量或浓度的任何上述实施方案的另一个实施方案中,式(i)、式(ii)、式(iiia)或式(iiib)化合物呈软膏形式施用至鼻腔中。在增加一种或多种泪蛋白的量或浓度的任何上述实施方案的另一个实施方案中,式(i)、式(ii)、式(iiia)或式(iiib)化合物呈干粉形式施用至鼻腔中。在增加一种或多种泪蛋白的量或浓度的任何上述实施方案的另一个实施方案中,式(i)、式(ii)、式(iiia)或式(iiib)化合物呈乳膏形式施用至鼻腔中。在增加一种或多种泪蛋白的量或浓度的任何上述实施方案的另一个实施方案中,式(i)、式(ii)、式(iiia)或式(iiib)化合物呈糊剂形式施用至鼻腔中。在增加一种或多种泪蛋白的量或浓度的任何上述实施方案的另一个实施方案中,式(i)、式(ii)、式(iiia)或式(iiib)化合物呈洗剂形式施用至鼻腔中。在增加一种或多种泪蛋白的量或浓度的任何上述实施方案的另一个实施方案中,式(i)、式(ii)、式(iiia)或式(iiib)化合物呈香膏形式施用至鼻腔中。在一些实施方案中,所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0371]
在增加一种或多种泪蛋白的量或浓度的任何上述实施方案的另一个实施方案中,通过注射器、滴管、瓶状雾化器、雾化泵、吸入器、喷粉装置、汽化器、贴片、施药棒、吸移管或液体喷射器将式(i)、式(ii)、式(iiia)或式(iiib)化合物施用至鼻腔中。在增加一种或多种泪蛋白的量或浓度的任何上述实施方案的另一个实施方案中,通过注射器将式(i)、式(ii)、式(iiia)或式(iiib)化合物施用至鼻腔中。在增加一种或多种泪蛋白的量或浓度的任何上述实施方案的另一个实施方案中,通过滴管将式(i)、式(ii)、式(iiia)或式(iiib)化合物施用至鼻腔中。在增加一种或多种泪蛋白的量或浓度的任何上述实施方案的另一个实施方案中,通过瓶状雾化器将式(i)、式(ii)、式(iiia)或式(iiib)化合物施用至鼻腔中。在增加一种或多种泪蛋白的量或浓度的任何上述实施方案的另一个实施方案中,通过雾化泵将式(i)、式(ii)、式(iiia)或式(iiib)化合物施用至鼻腔中。在增加一种或多种泪蛋白的量或浓度的任何上述实施方案的另一个实施方案中,通过吸入器将式(i)、式(ii)、式(iiia)或式(iiib)化合物施用至鼻腔中。在增加一种或多种泪蛋白的量或浓度的任何上述实施方案的另一个实施方案中,通过喷粉装置将式(i)、式(ii)、式(iiia)或式(iiib)化合物施用至鼻腔中。在增加一种或多种泪蛋白的量或浓度的任何上述实施方案的另一个实施方案中,通过汽化器将式(i)、式(ii)、式(iiia)或式(iiib)化合物施用至鼻腔中。在增加一种或多种泪蛋白的量或浓度的任何上述实施方案的另一个实施方案中,通过贴片将式(i)、式(ii)、式(iiia)或式(iiib)化合物施用至鼻腔中。在增加一种或多种泪蛋白的量或浓度的任何上述实施方案的另一个实施方案中,通过施药棒将式(i)、式(ii)、式(iiia)或式(iiib)化合物施用至鼻腔中。在增加一种或多种泪蛋白的量或浓度的任何上述实施方案的另一个实施方案中,通过吸移管将式(i)、式(ii)、式(iiia)或式(iiib)化合物施用至鼻腔中。在增加一种或多种泪蛋白的量或浓度的任何上述实施方案的另一个实施方案中,通过液体喷射器将式(i)、式(ii)、式(iiia)或式(iiib)化合物施用至鼻腔中。在一些实施方案中,所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0372]
在增加一种或多种泪蛋白的量或浓度的任何上述实施方案的另一个实施方案中,使三叉神经活化。在增加一种或多种泪蛋白的量或浓度的另一个实施方案中,使筛前神经活化。在增加一种或多种泪蛋白的量或浓度的任何上述实施方案的另一个实施方案中,使鼻泪反射活化。在一些实施方案中,所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯
基)嘧啶或其药学上可接受的盐。
[0373]
在增加一种或多种泪蛋白的量或浓度的任何上述实施方案的另一个实施方案中,一种或多种泪蛋白的量或浓度与急性病状相关。急性病状是指存在具有健康影响的快速发作的病状,其被视为短暂而非长期的。急性病状可能由眼科手术程序或其他眼科治疗引起。在一些实施方案中,所述眼科手术程序为白内障手术(白内障摘除术和晶状体置换)、屈旋光性晶体置换、青光眼手术、lasik手术(雷射眼部手术)、玻璃体切除术、视网膜光凝固术、视网膜脱离修复、黄斑裂孔修复、虹膜后肿瘤或肿块移除、后巩膜切开术、视神经切开术或减少泪腺功能的其他治疗。在一些实施方案中,所述眼科治疗包括辐射疗法。在一些实施方案中,所述辐射疗法针对眼窝区域,例如与头和/或颈癌相关。在一些实施方案中,所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0374]
增加泪液清除率
[0375]
在一些实施方案中,本文中提供一种增加受试者的泪液清除率的方法。在一些实施方案中为一种增加泪液清除率的方法,其包括将治疗有效量的式(i)、式(ii)、式(iiia)或式(iiib)化合物局部施用至有需要的个体的鼻腔中,其中所述式(i)、式(ii)、式(iiia)或式(iiib)化合物选择性地结合至外周烟碱乙酰胆碱受体且不会以药理学相关的浓度越过血脑屏障。在一些实施方案中为增加泪液清除率的方法,其包括将治疗有效量的式(i)、式(ii)、式(iiia)或式(iiib)化合物局部施用至有需要的个体的鼻腔中,其中所述式(i)、式(ii)、式(iiia)或式(iiib)化合物不会以药理学相关的浓度越过血脑屏障且选择性地结合至选自α3β4、α4β2和α7的外周烟碱乙酰胆碱受体亚型中的至少一者。在一些实施方案中为增加泪液清除率的方法,其包括将治疗有效量的式(i)、式(ii)、式(iiia)或式(iiib)化合物局部施用至有需要的个体的鼻腔中,其中所述式(i)、式(ii)、式(iiia)或式(iiib)化合物不会以药理学相关的浓度越过血脑屏障且选择性地结合至外周烟碱乙酰胆碱受体亚型α3β4。在一些实施方案中为增加泪液清除率的方法,其包括将治疗有效量的式(i)、式(ii)、式(iiia)或式(iiib)化合物局部施用至有需要的个体的鼻腔中,其中所述式(i)、式(ii)、式(iiia)或式(iiib)化合物不会以药理学相关的浓度越过血脑屏障且选择性地结合至外周烟碱乙酰胆碱受体亚型α4β2。在一些实施方案中为增加泪液清除率的方法,其包括将治疗有效量的式(i)、式(ii)、式(iiia)或式(iiib)化合物局部施用至有需要的个体的鼻腔中,其中所述式(i)、式(ii)、式(iiia)或式(iiib)化合物不会以药理学相关的浓度越过血脑屏障且选择性地结合至外周烟碱乙酰胆碱受体亚型α7。在一些实施方案中为一种增加泪液清除率的方法,其包括将治疗有效量的式(i)、式(ii)、式(iiia)或式(iiib)化合物局部施用至有需要的个体的鼻腔中,其中所述式(i)、式(ii)、式(iiia)或式(iiib)化合物选择性地结合至外周烟碱乙酰胆碱受体且以不具全身性生物可利用性的量施用。在一些实施方案中为一种增加泪液清除率的方法,其包括将治疗有效量的式(i)、式(ii)、式(iiia)或式(iiib)化合物局部施用至有需要的个体的鼻腔中,其中所述式(i)、式(ii)、式(iiia)或式(iiib)化合物选择性地结合至外周烟碱乙酰胆碱受体且以不会引起不希望的精神副作用的量施用。在一些实施方案中为一种增加泪液清除率的方法,其包括将治疗有效量的式(i)、式(ii)、式(iiia)或式(iiib)化合物局部施用至有需要的个体的鼻腔中,其中所述式(i)、式(ii)、式(iiia)或式(iiib)化合物选择性地结合至外周烟碱乙酰胆碱受体且以不会引起不希望的全身性副作用的量施用。在一些实施方案中为一种增加泪液清除率的方法,
其包括将治疗有效量的式(i)、式(ii)、式(iiia)或式(iiib)化合物局部施用至有需要的个体的鼻腔中,其中所述式(i)、式(ii)、式(iiia)或式(iiib)化合物选择性地结合至外周烟碱乙酰胆碱受体且以产生局部作用的量施用。在一些实施方案中为一种增加泪液清除率的方法,其还包括局部施用预防或促进烟碱乙酰胆碱受体从减敏状态恢复的一种或多种物质。在一些实施方案中为一种增加泪液清除率的方法,其还包括局部施用防止或减少烟碱乙酰胆碱受体进入减敏状态或促进烟碱乙酰胆碱受体从减敏状态恢复的一种或多种物质。在一些实施方案中,所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0376]
在本文中所描述的增加泪液清除率的方法的一些实施方案中,所述式(i)、式(ii)、式(iiia)或式(iiib)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶(或化合物1)。在本文中所描述的方法的一些实施方案中,所述式(i)、式(ii)、式(iiia)或式(iiib)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。在本文中所描述的增加泪液清除率的方法的一些实施方案中,所述式(i)、式(ii)、式(iiia)或式(iiib)化合物为呈游离碱形式的(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶。在本文中所描述的增加泪液清除率的方法的一些实施方案中,所述式(i)、式(ii)、式(iiia)或式(iiib)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶柠檬酸盐。在本文中所描述的增加泪液清除率的方法的一些实施方案中,所述式(i)、式(ii)、式(iiia)或式(iiib)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶单柠檬酸盐。在本文中所描述的增加泪液清除率的方法的一些实施方案中,所述式(i)、式(ii)、式(iiia)或式(iiib)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶hcl盐。在本文中所描述的增加泪液清除率的方法的一些实施方案中,所述式(i)、式(ii)、式(iiia)或式(iiib)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶粘酸盐。在本文中所描述的增加泪液清除率的方法的一些实施方案中,所述式(i)、式(ii)、式(iiia)或式(iiib)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶半粘酸盐。在本文中所描述的增加泪液清除率的方法的一些实施方案中,所述式(i)、式(ii)、式(iiia)或式(iiib)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶半粘酸盐单水合物。在本文中所描述的方法的一些实施方案中,所述式(i)、式(ii)、式(iiia)或式(iiib)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶半粘酸盐二水合物。
[0377]
在一些实施方案中为一种增加泪液清除率的方法,其还包括局部施用预防或促进烟碱乙酰胆碱受体从减敏状态恢复的一种或多种物质,所述一种或多种物质选自蛋白激酶c(pkc)或者上调或向上调节pkc的因子、camp依赖性蛋白激酶(pka)或者上调或向上调节pka的因子和钙调磷酸酶抑制剂。在一些实施方案中为一种增加泪液清除率的方法,其还包括局部施用防止或减少烟碱乙酰胆碱受体进入减敏状态或促进烟碱乙酰胆碱受体从减敏状态恢复的一种或多种物质,所述一种或多种物质选自蛋白激酶c(pkc)或者上调或向上调节pkc的因子、camp依赖性蛋白激酶(pka)或者上调或向上调节pka的因子和钙调磷酸酶抑制剂。在一些实施方案中为一种增加泪液清除率的方法,其还包括局部施用蛋白激酶c(pkc)或者上调或向上调节pkc的因子。在一些实施方案中为一种增加泪液清除率的方法,其还包括局部施用camp依赖性蛋白激酶(pka)或者上调或向上调节pka的因子。在一些实施方案中为一种增加泪液清除率的方法,其还包括局部施用钙调磷酸酶抑制剂。在一些实施方案中为一种增加泪液清除率的方法,其还包括局部施用钙调磷酸酶抑制剂,其中所述钙
调磷酸酶抑制剂选自环孢霉素、吡美莫司和他克莫司。在一些实施方案中为一种增加泪液清除率的方法,其还包括局部施用环孢霉素。在一些实施方案中为一种增加泪液清除率的方法,其还包括局部施用吡美莫司。在一些实施方案中为一种增加泪液清除率的方法,其还包括局部施用他克莫司。
[0378]
在增加泪液清除率的任何上述实施方案的另一个实施方案中,向鼻腔中施用至少1微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加泪液清除率的任何上述实施方案的另一个实施方案中,向鼻腔中施用至少5微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加泪液清除率的任何上述实施方案的另一个实施方案中,向鼻腔中施用至少10微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加泪液清除率的任何上述实施方案的另一个实施方案中,向鼻腔中施用至少25微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加泪液清除率的任何上述实施方案的另一个实施方案中,向鼻腔中施用至少50微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加泪液清除率的任何上述实施方案的另一个实施方案中,向鼻腔中施用至少100微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加泪液清除率的任何上述实施方案的另一个实施方案中,向鼻腔中施用至少250微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加泪液清除率的任何上述实施方案的另一个实施方案中,向鼻腔中施用至少500微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加泪液清除率的任何上述实施方案的另一个实施方案中,向鼻腔中施用至少750微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加泪液清除率的任何上述实施方案的另一个实施方案中,向鼻腔中施用至少1000微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在一些实施方案中,所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0379]
在增加泪液清除率的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于1微克与1000微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加泪液清除率的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于5微克与1000微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加泪液清除率的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于10微克与1000微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加泪液清除率的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于5微克与100微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加泪液清除率的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于5微克与50微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加泪液清除率的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于10微克与50微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加泪液清除率的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于25微克与1000微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加泪液清除率的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于50微克与1000微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加泪液清除率的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于100微克与1000微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加泪液清除率的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于150微克与1000微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加泪液清除率的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于100微克
与750微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加泪液清除率的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于150微克与750微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加泪液清除率的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于150微克与600微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在一些实施方案中,所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0380]
在增加泪液清除率的任何上述实施方案的另一个实施方案中,向鼻腔中施用少于100微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加泪液清除率的任何上述实施方案的另一个实施方案中,向鼻腔中施用少于75微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加泪液清除率的任何上述实施方案的另一个实施方案中,向鼻腔中施用少于50微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加泪液清除率的任何上述实施方案的另一个实施方案中,向鼻腔中施用少于25微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加泪液清除率的任何上述实施方案的另一个实施方案中,向鼻腔中施用少于15微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加泪液清除率的任何上述实施方案的另一个实施方案中,向鼻腔中施用约75微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加泪液清除率的任何上述实施方案的另一个实施方案中,向鼻腔中施用约50微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加泪液清除率的任何上述实施方案的另一个实施方案中,向鼻腔中施用约25微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加泪液清除率的任何上述实施方案的另一个实施方案中,向鼻腔中施用约10微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在一些实施方案中,所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0381]
在增加泪液清除率的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于1微克与100微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加泪液清除率的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于1微克与75微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加泪液清除率的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于5微克与100微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加泪液清除率的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于5微克与75微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加泪液清除率的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于15微克与100微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加泪液清除率的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于15微克与75微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加泪液清除率的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于25微克与100微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加泪液清除率的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于25微克与75微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加泪液清除率的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于25微克与60微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在一些实施方案中,所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0382]
在增加泪液清除率的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于
500微克与10毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加泪液清除率的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于500微克与5毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加泪液清除率的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于500微克与3毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加泪液清除率的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于500微克与2毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加泪液清除率的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于1毫克与10毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加泪液清除率的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于1毫克与5毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加泪液清除率的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于1毫克与3毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加泪液清除率的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于1毫克与2毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加泪液清除率的任何上述实施方案的另一个实施方案中,向鼻腔中施用约500微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加泪液清除率的任何上述实施方案的另一个实施方案中,向鼻腔中施用约1毫克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加泪液清除率的任何上述实施方案的另一个实施方案中,向鼻腔中施用约1.5毫克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加泪液清除率的任何上述实施方案的另一个实施方案中,向鼻腔中施用约2毫克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加泪液清除率的任何上述实施方案的另一个实施方案中,向鼻腔中施用约2.5毫克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加泪液清除率的任何上述实施方案的另一个实施方案中,向鼻腔中施用约3毫克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加泪液清除率的任何上述实施方案的另一个实施方案中,向鼻腔中施用约4毫克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加泪液清除率的任何上述实施方案的另一个实施方案中,向鼻腔中施用约5毫克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在一些实施方案中,所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0383]
在增加泪液清除率的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于1微克与10毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加泪液清除率的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于5微克与10毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加泪液清除率的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于10微克与10毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加泪液清除率的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于25微克与10毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加泪液清除率的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于50微克与10毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加泪液清除率的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于100微克与10毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加泪液清除率的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于150微克与10毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在一些实施方案中,所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0384]
在增加泪液清除率的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于1微克与10毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加泪液清除率的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于1微克与5毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加泪液清除率的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于1微克与4毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加泪液清除率的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于1微克与3毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加泪液清除率的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于1微克与2毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加泪液清除率的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于1微克与1毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加泪液清除率的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于1微克与750微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加泪液清除率的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于1微克与600微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加泪液清除率的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于1微克与100微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加泪液清除率的任何上述实施方案的另一个实施方案中,向鼻腔中施用介于1微克与50微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在一些实施方案中,所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0385]
在任何上述实施方案中,用于所述方法中的药物制剂包含约0.1mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含约0.2mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含约0.5mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含约1mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含约2mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含约3mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含约4mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含约5mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含约6mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含约7mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含约8mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含约9mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含约10mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含约12mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含约15mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含约20mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含约25mg/ml的式(i)、
式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含约30mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含约40mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含约50mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在一些实施方案中,所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0386]
在另一个实施方案中,用于所述方法中的药物制剂包含介于5mg/ml与200mg/ml之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含介于10mg/ml与200mg/ml之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含介于5mg/ml与100mg/ml之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含介于10mg/ml与75mg/ml之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含介于10mg/ml与50mg/ml之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含介于10mg/ml与30mg/ml之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含介于5mg/ml与50mg/ml之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在一些实施方案中,所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0387]
在另一个实施方案中,用于所述方法中的药物制剂包含介于10mg/ml与25mg/ml之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物在另一个实施方案中,用于所述方法中的药物制剂包含介于10mg/ml与50mg/ml之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含介于20mg/ml与50mg/ml之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,用于所述方法中的药物制剂包含介于30mg/ml与75mg/ml之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在一些实施方案中,所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0388]
在任何上述实施方案中,用于所述方法中的药物制剂以约10至200μl提供。在另一个实施方案中,用于所述方法中的药物制剂以约10至150μl提供。在另一个实施方案中,用于所述方法中的药物制剂以约10至100μl提供。在另一个实施方案中,用于所述方法中的药物制剂以约50至200μl提供。在另一个实施方案中,用于所述方法中的药物制剂以约100至200μl提供。在另一个实施方案中,用于所述方法中的药物制剂以约50至100μl提供。在另一个实施方案中,用于所述方法中的药物制剂以约10至150μl提供。在另一个实施方案中,用于所述方法中的药物制剂以约10、20、30、40、50、60、70、80、90、100、110、120、130、140、150、160、170、180、190或200μl提供。在一些实施方案中,所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0389]
在增加泪液清除率的任何上述实施方案的另一个实施方案中,每日施用式(i)、式(ii)、式(iiia)或式(iiib)化合物一次。在增加泪液清除率的任何上述实施方案的另一个实施方案中,每日施用式(i)、式(ii)、式(iiia)或式(iiib)化合物至少一次。在增加泪液清除率的任何上述实施方案的另一个实施方案中,每日施用式(i)、式(ii)、式(iiia)或式
(iiib)化合物两次。在增加泪液清除率的任何上述实施方案的另一个实施方案中,每日施用式(i)、式(ii)、式(iiia)或式(iiib)化合物至少两次。在增加泪液清除率的任何上述实施方案的另一个实施方案中,每日施用式(i)、式(ii)、式(iiia)或式(iiib)化合物三次。在增加泪液清除率的任何上述实施方案的另一个实施方案中,每日施用式(i)、式(ii)、式(iiia)或式(iiib)化合物至少三次。在增加泪液清除率的任何上述实施方案的另一个实施方案中,施用式(i)、式(ii)、式(iiia)或式(iiib)化合物一天。在增加泪液清除率的任何上述实施方案的另一个实施方案中,施用式(i)、式(ii)、式(iiia)或式(iiib)化合物至少两天。在增加泪液清除率的任何上述实施方案的另一个实施方案中,施用式(i)、式(ii)、式(iiia)或式(iiib)化合物至少三天。在增加泪液清除率的任何上述实施方案的另一个实施方案中,施用式(i)、式(ii)、式(iiia)或式(iiib)化合物至少四天。在增加泪液清除率的任何上述实施方案的另一个实施方案中,施用式(i)、式(ii)、式(iiia)或式(iiib)化合物至少五天。在增加泪液清除率的任何上述实施方案的另一个实施方案中,施用式(i)、式(ii)、式(iiia)或式(iiib)化合物至少七天。在增加泪液清除率的任何上述实施方案的另一个实施方案中,施用式(i)、式(ii)、式(iiia)或式(iiib)化合物至少十天。在增加泪液清除率的任何上述实施方案的另一个实施方案中,施用式(i)、式(ii)、式(iiia)或式(iiib)化合物至少十四天。在增加泪液清除率的任何上述实施方案的另一个实施方案中,施用式(i)、式(ii)、式(iiia)或式(iiib)化合物至少二十一天。在增加泪液清除率的任何上述实施方案的另一个实施方案中,施用式(i)、式(ii)、式(iiia)或式(iiib)化合物至少三十天。在一些实施方案中,所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0390]
在增加泪液清除率的任何上述实施方案的另一个实施方案中,在交替鼻孔中施用式(i)、式(ii)、式(iiia)或式(iiib)化合物。举例来说,在一个鼻孔中,接着在预定量的时间之后在另一个鼻孔中施用式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,在两个鼻孔中施用式(i)、式(ii)、式(iiia)或式(iiib)化合物。举例来说,在一个鼻孔中,接着同时或在第一鼻孔之后立即在另一鼻孔中施用式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,在一个鼻孔中施用式(i)、式(ii)、式(iiia)或式(iiib)化合物。在一些实施方案中,所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0391]
在增加泪液清除率的任何上述实施方案的另一个实施方案中,式(i)、式(ii)、式(iiia)或式(iiib)化合物呈液体、混悬剂、气雾剂、凝胶、软膏、干粉、乳膏、糊剂、洗剂或香膏形式施用至鼻腔中。在增加泪液清除率的任何上述实施方案的另一个实施方案中,式(i)、式(ii)、式(iiia)或式(iiib)化合物呈液体形式施用至鼻腔中。在增加泪液清除率的任何上述实施方案的另一个实施方案中,式(i)、式(ii)、式(iiia)或式(iiib)化合物呈混悬剂形式施用至鼻腔中。在增加泪液清除率的任何上述实施方案的另一个实施方案中,式(i)、式(ii)、式(iiia)或式(iiib)化合物呈气雾剂形式施用至鼻腔中。在增加泪液清除率的任何上述实施方案的另一个实施方案中,式(i)、式(ii)、式(iiia)或式(iiib)化合物呈凝胶形式施用至鼻腔中。在增加泪液清除率的任何上述实施方案的另一个实施方案中,式(i)、式(ii)、式(iiia)或式(iiib)化合物呈软膏形式施用至鼻腔中。在增加泪液清除率的任何上述实施方案的另一个实施方案中,式(i)、式(ii)、式(iiia)或式(iiib)化合物呈干
粉形式施用至鼻腔中。在增加泪液清除率的任何上述实施方案的另一个实施方案中,式(i)、式(ii)、式(iiia)或式(iiib)化合物呈乳膏形式施用至鼻腔中。在增加泪液清除率的任何上述实施方案的另一个实施方案中,式(i)、式(ii)、式(iiia)或式(iiib)化合物呈糊剂形式施用至鼻腔中。在增加泪液清除率的任何上述实施方案的另一个实施方案中,式(i)、式(ii)、式(iiia)或式(iiib)化合物呈洗剂形式施用至鼻腔中。在增加泪液清除率的任何上述实施方案的另一个实施方案中,式(i)、式(ii)、式(iiia)或式(iiib)化合物呈香膏形式施用至鼻腔中。在一些实施方案中,所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0392]
在增加泪液清除率的任何上述实施方案的另一个实施方案中,通过注射器、滴管、瓶状雾化器、雾化泵、吸入器、喷粉装置、汽化器、贴片、施药棒、吸移管或液体喷射器将式(i)、式(ii)、式(iiia)或式(iiib)化合物施用至鼻腔中。在增加泪液清除率的任何上述实施方案的另一个实施方案中,通过注射器将式(i)、式(ii)、式(iiia)或式(iiib)化合物施用至鼻腔中。在增加泪液清除率的任何上述实施方案的另一个实施方案中,通过滴管将式(i)、式(ii)、式(iiia)或式(iiib)化合物施用至鼻腔中。在增加泪液清除率的任何上述实施方案的另一个实施方案中,通过瓶状雾化器将式(i)、式(ii)、式(iiia)或式(iiib)化合物施用至鼻腔中。在增加泪液清除率的任何上述实施方案的另一个实施方案中,通过雾化泵将式(i)、式(ii)、式(iiia)或式(iiib)化合物施用至鼻腔中。在增加泪液清除率的任何上述实施方案的另一个实施方案中,通过吸入器将式(i)、式(ii)、式(iiia)或式(iiib)化合物施用至鼻腔中。在增加泪液清除率的任何上述实施方案的另一个实施方案中,通过喷粉装置将式(i)、式(ii)、式(iiia)或式(iiib)化合物施用至鼻腔中。在增加泪液清除率的任何上述实施方案的另一个实施方案中,通过汽化器将式(i)、式(ii)、式(iiia)或式(iiib)化合物施用至鼻腔中。在增加泪液清除率的任何上述实施方案的另一个实施方案中,通过贴片将式(i)、式(ii)、式(iiia)或式(iiib)化合物施用至鼻腔中。在增加泪液清除率的任何上述实施方案的另一个实施方案中,通过施药棒将式(i)、式(ii)、式(iiia)或式(iiib)化合物施用至鼻腔中。在增加泪液清除率的任何上述实施方案的另一个实施方案中,通过吸移管将式(i)、式(ii)、式(iiia)或式(iiib)化合物施用至鼻腔中。在增加泪液清除率的任何上述实施方案的另一个实施方案中,通过液体喷射器将式(i)、式(ii)、式(iiia)或式(iiib)化合物施用至鼻腔中。在一些实施方案中,所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0393]
在增加泪液清除率的任何上述实施方案的另一个实施方案中,使三叉神经活化。在增加泪液清除率的另一个实施方案中,使筛前神经活化。在增加泪液清除率的任何上述实施方案的另一个实施方案中,使鼻泪反射活化。
[0394]
在增加泪液清除率的任何上述实施方案的另一个实施方案中,通过增加泪液清除率而得以减轻的病状为急性病状。急性病状是指存在具有健康影响的快速发作的病状,其被视为短暂而非长期的。急性病状可能由眼科手术程序或其他眼科治疗引起。在一些实施方案中,所述眼科手术程序为白内障手术(白内障摘除术和晶状体置换)、屈旋光性晶体置换、青光眼手术、lasik手术(雷射眼部手术)、玻璃体切除术、视网膜光凝固术、视网膜脱离修复、黄斑裂孔修复、虹膜后肿瘤或肿块移除、后巩膜切开术、视神经切开术或减少泪腺功能的其他治疗。在一些实施方案中,所述眼科治疗包括辐射疗法。在一些实施方案中,所述
辐射疗法针对眼窝区域,例如与头和/或颈癌相关。在一些实施方案中,所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0395]
急性适应症
[0396]
本文中所公开的眼部病状可为急性病状。急性病状是指存在具有健康影响的快速发作的病状,其被视为短暂而非长期的。急性病状可能由眼科手术程序或其他眼科治疗引起。本公开提供一种治疗眼部病状的方法,其包括局部施用治疗有效量的所公开的化合物,其中所述眼部病状为急性病状。本公开还提供一种治疗眼部病状的方法,其包括局部施用治疗有效量的所公开的化合物,其中所述眼部病状由眼科手术程序或眼科治疗引起。
[0397]
在一些实施方案中,所述眼科手术程序为白内障手术(白内障摘除术和晶状体置换)、屈旋光性晶体置换、青光眼手术、lasik手术(雷射眼部手术)、玻璃体切除术、视网膜光凝固术、视网膜脱离修复、黄斑裂孔修复、虹膜后肿瘤或肿块移除、后巩膜切开术、视神经切开术或减少泪腺功能的其他治疗。
[0398]
在一些实施方案中,所述眼科治疗包括辐射疗法。在一些实施方案中,所述辐射疗法针对眼窝区域,例如与头和/或颈癌相关。
[0399]
某些术语
[0400]
除非另外陈述,否则本技术(包括说明书和权利要求)中所使用的以下术语具有以下所提供的定义。必须指出,除非上下文另外清楚指示,否则如本说明书和所附权利要求中所使用,单数形式“一个/种(a/an)”和“所述”包括复数个指示物。在本技术中,除非另外陈述,否则“或”或“和”的使用意谓“和/或”。此外,术语“包括(including)”以及其他形式(诸如“包括(include)”、“包括(includes)”和“包括(included)”的使用不具限制性。本文中所使用的部分标题仅出于组织目的,而不应被视为限制所描述的目标物。
[0401]
如本文中所使用,术语“共同施用”或其类似术语意欲涵盖向单一患者施用所选治疗剂,且意欲包括通过相同或不同的施用途径或者在相同或不同的时间施用药剂的治疗方案。
[0402]
如本文中所使用的术语“有效量”或“治疗有效量”是指足以在一定程度上减轻所治疗的疾病或病状的一种或多种症状的药剂或化合物施用量。结果可为疾病征象、症状或诱因的减少和/或减轻,或者生物系统的任何其他所需变化。举例来说,用于治疗用途的“有效量”为提供临床上显著的疾病症状减轻所需的包含如本文中所公开的烟碱乙酰胆碱受体激动剂式(i)、式(ii)、式(iiia)或式(iiib)化合物的药物制剂的量。在任何个别情况下,适当“有效”量可使用诸如剂量扩大研究的技术来确定。
[0403]
术语“个体”、“受试者”和“患者”涵盖哺乳动物和非哺乳动物。哺乳动物的实例包括但不限于哺乳动物类的任何成员:人、非人类灵长类,诸如黑猩猩和其他猿和猴物种;农畜,诸如牛、马、绵羊、山羊、猪;家畜,诸如兔、狗和猫;实验室动物,包括啮齿动物,诸如大鼠、小鼠和豚鼠和其类似物。在一个实施方案中,所述哺乳动物为人。
[0404]“组织”包含两个或更多个细胞。所述两个或更多个细胞可具有类似的功能和/或功能。所述组织可为结缔组织、上皮组织、肌肉组织或神经组织。替代地,所述组织为骨、腱(两者均称为肌肉骨骼移植物)、角膜、皮肤、心脏瓣膜或静脉。
[0405]“器官”包含两个或更多个组织。所述两个或更多个组织可执行一项特定功能或一组特定功能。在一些情况下,所述器官为肺、口、鼻、副甲状腺、松果腺、脑下腺、颈动脉体、唾
液腺、皮肤、胆囊、胰腺、小肠、胃、脾脏、脊髓、胸腺、甲状腺、气管、子宫或阑尾。替代地,所述器官为肾上腺、阑尾、脑、膀胱、肾脏、肠、大肠、小肠、肝脏、心脏或肌肉。
[0406]
术语“烟碱乙酰胆碱受体激动剂”涵盖烟碱乙酰胆碱受体的完全激动剂或部分激动剂。在本文中所描述的一些实施方案中,所述烟碱乙酰胆碱受体激动剂为式(i)、式(ii)、式(iiia)或式(iiib)化合物。
[0407]
如本文中所使用的术语“治疗”包括减轻、缓解或改善疾病或病状的至少一种症状、预防其他症状、预防所述病状进展、抑制所述疾病或病状(例如使所述疾病或病状的发展停滞)、减轻所述疾病或病状、使所述疾病或病状消退、减轻由所述疾病或病状引起的病状或者使所述疾病或病状的症状停止。在一个实施方案中,治疗为预防性治疗。在另一个实施方案中,治疗是指治疗性治疗。
[0408]
如本文中所使用的“不会以药理学相关的浓度越过血脑屏障”是指如本文中所公开的烟碱乙酰胆碱受体激动剂(即式(i)、式(ii)、式(iiia)或式(iiib)化合物)的量不足以通过血脑屏障以产生药理学反应。
[0409]
如本文中所使用的术语“不希望的精神副作用”是指脑中的非预定作用,包括但不限于焦虑、抑郁、幻觉、安乐感、成瘾、睡眠障碍/紊乱、失眠、异常梦和梦魇。
[0410]
如本文中所使用的术语“不希望的全身性副作用”是指体内的非预定作用,包括但不限于腹痛、呕吐、恶心、便秘、腹泻、胀气、消化不良和口干。
[0411]
如本文中所使用的术语“被配制成预防减敏”是指不会导致对烟碱乙酰胆碱受体激动剂(即式(i)、式(ii)、式(iiia)或式(iiib)化合物)的作用产生耐受、依赖、戒除或丧失敏感性的制剂。
[0412]
如本文中所使用的术语“产生局部作用”是指烟碱乙酰胆碱受体激动剂(即式(i)、式(ii)、式(iiia)或式(iiib)化合物)对外周烟碱乙酰胆碱受体的作用而非对中枢神经系统产生药理学反应。
[0413]
如本文中所使用的术语“环境挑战性条件”是指外部条件,包括天然和人为条件。天然存在的环境挑战性条件包括但不限于暴露于烟雾、风和干燥气候。人为环境挑战性条件包括但不限于暴露于来自汽车、工厂和飞机的污染,以及具有低湿度、高气流或不良空气质量的家庭/办公室。在一些实施方案中,“环境挑战性条件”是指通常用于干眼临床试验的受控挑战环境。
[0414]
术语“眼部不适”包括但不限于干眼病的症状,诸如瘙痒、干燥、畏光、模糊、疼痛、粘感、灼热、刺痛和异物感。在一些实施方案中,眼部不适与睑缘炎、睑腺功能障碍、过敏性结膜炎、眼表面中毒和刺激、泪排泄问题或眼睑病症相关。
[0415]
如本文中所使用的术语“软药”是指在达成治疗效果之后立即快速代谢成无活性形式的原料药。
[0416]
如本文中所使用,可基于化合物的任何形式,包括游离酸、游离碱或盐形式(例如药学上可接受的盐形式)来计算指定药剂的剂量。举例来说,在某些实施方案中,基于游离碱的分子量来计算剂量或浓度。同样,在一些实施方案中,基于如本文中所描述的盐形式(例如粘酸盐、半粘酸盐、柠檬酸盐、单柠檬酸盐等)的分子量来计算剂量或浓度。
[0417]
烟碱乙酰胆碱受体激动剂
[0418]
本文中所描述的方法包括将治疗有效量的烟碱乙酰胆碱受体激动剂局部施用至
有需要的个体的鼻腔中,其中所述烟碱乙酰胆碱受体激动剂为式(i)、式(ii)、式(iiia)或式(iiib)化合物。在本文中所描述的方法的一些实施方案中,所述式(i)、式(ii)、式(iiia)或式(iiib)化合物为完全激动剂。在本文中所描述的方法的一些实施方案中,所述式(i)、式(ii)、式(iiia)或式(iiib)化合物为部分激动剂。在本文中所描述的方法的一些实施方案中,所述式(i)、式(ii)、式(iiia)或式(iiib)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶(或化合物1)。在本文中所描述的方法的一些实施方案中,所述式(i)、式(ii)、式(iiia)或式(iiib)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。在本文中所描述的方法的一些实施方案中,所述式(i)、式(ii)、式(iiia)或式(iiib)化合物为呈游离碱形式的(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶。在本文中所描述的方法的一些实施方案中,所述式(i)、式(ii)、式(iiia)或式(iiib)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶柠檬酸盐。在本文中所描述的方法的一些实施方案中,所述式(i)、式(ii)、式(iiia)或式(iiib)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶单柠檬酸盐。在本文中所描述的方法的一些实施方案中,所述式(i)、式(ii)、式(iiia)或式(iiib)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶hcl盐。在本文中所描述的方法的一些实施方案中,所述式(i)、式(ii)、式(iiia)或式(iiib)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶粘酸盐。在本文中所描述的方法的一些实施方案中,所述式(i)、式(ii)、式(iiia)或式(iiib)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶半粘酸盐。在本文中所描述的方法的一些实施方案中,所述式(i)、式(ii)、式(iiia)或式(iiib)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶半粘酸盐单水合物。在本文中所描述的一些实施方案中,所述式(i)、式(ii)、式(iiia)或式(iiib)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶半粘酸盐二水合物。在本文中所描述的方法的一些实施方案中,所述式(i)、式(ii)、式(iiia)或式(iiib)化合物为n-(5-氯呋喃-2-基羰基)-3,7-二氮杂双环[3.3.0]辛烷。在本文中所描述的方法的一些实施方案中,不施用烟碱。wo 2010/065443提供额外描述,所述专利以全文引用的方式并入在此。
[0419]
在本文中所描述的方法的一些实施方案中,所述式(i)、式(ii)、式(iiia)或式(iiib)化合物为软药。
[0420]
在本文中所描述的方法的一些实施方案中为具有以下结构的式(i)化合物:
[0421]
或其药学上可接受的盐。
[0422]
在本文中所描述的方法的一些实施方案中为具有以下结构的式(i)化合物:
[0423]
半粘酸盐单水合物或二水合物。
[0424]
在本文中所描述的方法的一些实施方案中为具有以下结构的式(i)化合物:
[0425]
[0426]
在本文中所描述的方法的一些实施方案中为具有以下结构的式(i)化合物:
[0427][0428]
在本文中所描述的方法的一些实施方案中为具有以下结构的式(i)化合物:
[0429][0430]
在本文中所描述的方法的一些实施方案中为具有以下结构的式(ii)化合物:
[0431]
或其药学上可接受的盐。
[0432]
多晶型物
[0433]
本公开的化合物可呈多于一种形式结晶,此特征称为多晶型现象,且此种多晶形式(“多晶型物”)在本公开的范围内。多晶型现象一般可作为对温度、压力或两者的变化的反应而存在。多晶型现象还可由结晶过程中的变化引起。多晶型物可通过本领域中已知的多种物理性质,诸如xrpd图案(衍射图)、在不同溶剂中的溶解度和熔点来区分。
[0434]
本公开包括(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶的盐形式的各种多晶型物,包括此类盐的水合物和溶剂合物。此种多晶形式以其x射线粉末衍射(xrpd)图案(衍射图)为特征。
[0435]
本公开的一个实施方案包括(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶单柠檬酸盐结晶形式。本公开的另一个实施方案包括(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶单柠檬酸盐非晶形式。本公开的另一个实施方案包括(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶单柠檬酸盐非晶形式,其xrpd图案基本上对应于wo 2010/065443的图1中所示者,所述专利以全文引用的方式并入在此。
[0436]
本公开的一个实施方案包括(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶单柠檬酸盐多晶形式形式i,其以包括以下诸峰中至少一个的xrpd图案为特征:
[0437]
2θ5.2710.0313.7721.73
[0438]
本公开的另一个实施方案包括(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶单柠檬酸盐多晶形式形式i,其xrpd图案基本上对应于wo 2010/065443的图2中所示者,所述专利以全文引用的方式并入在此。
[0439]
本公开的一个实施方案包括(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶单柠檬酸盐形式ii多晶形式,其以包括以下诸峰中至少一个的粉末x射线衍射图案为特征:
[0440][0441][0442]
本公开的另一个实施方案包括(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶单柠檬酸盐多晶形式形式ii,其xrpd图案基本上对应于wo 2010/065443的图3中所示者,所述专利以全文引用的方式并入在此。
[0443]
本公开的一个实施方案包括(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶单柠檬酸盐多晶形式形式iii,其以包括以下诸峰中至少一个的xrpd图案为特征:
[0444]
2θ9.4312.2416.2418.3819.1819.4821.5222.8923.0824.2830.7731.2732.3633.0934.8637.2637.6339.47
[0445]
本公开的另一个实施方案包括(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶单柠檬酸盐多晶形式形式iii,其xrpd图案基本上对应于wo 2010/065443的图4中所示者,所述专利以全文引用的方式并入在此。
[0446]
本公开的一个实施方案包括(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶单柠檬酸盐
多晶形式形式iv,其以包括以下诸峰中至少一个的xrpd图案为特征:
[0447][0448][0449]
本公开的另一个实施方案包括(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶单柠檬酸盐多晶形式形式iv,其xrpd图案基本上对应于wo 2010/065443的图5中所示者,所述专利以全文引用的方式并入在此。
[0450]
本公开的一个实施方案包括(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶单乳清酸盐结晶形式。
[0451]
本公开的一个实施方案包括(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶单乳清酸盐多晶形式形式i,其以包括以下诸峰中至少一个的xrpd图案为特征:
[0452]
2θ2.556.548.6613.2614.5615.9817.4718.5319.3020.2621.0522.0223.1424.3225.5626.8727.8428.7629.53
[0453]
本公开的另一个实施方案包括(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶单乳清酸
盐多晶形式形式i,其xrpd图案基本上对应于wo 2010/065443的图6中所示者,所述专利以全文引用的方式并入在此。
[0454]
本公开的一个实施方案包括(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶单马来酸盐结晶形式。
[0455]
本公开的一个实施方案包括(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶单马来酸盐多晶形式形式i,其以包括以下诸峰中至少一个的xrpd图案为特征:
[0456]
2θ12.8116.0918.0019.0724.4926.4026.0427.88
[0457]
本公开的另一个实施方案包括(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶单马来酸盐多晶形式形式i,其xrpd图案基本上对应于wo 2010/065443的图7中所示者,所述专利以全文引用的方式并入在此。
[0458]
本公开的一个实施方案包括(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶单马来酸盐多晶形式形式ii,其以包括以下诸峰中至少一个的xrpd图案为特征:
[0459][0460][0461]
本公开的另一个实施方案包括(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶单马来酸
盐多晶形式形式ii,其xrpd图案基本上对应于wo 2010/065443的图8中所示者,所述专利以全文引用的方式并入在此。
[0462]
如所指出,(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶的盐形式可呈溶剂合物(例如水合物)以及非溶剂合物形式存在。本公开涵盖所有此类形式。
[0463]
本发明还包括同位素标记的化合物,其中一个或多个原子置换为具有与自然界中通常发现的原子质量或质量数不同的原子质量或质量数的原子。可并入本发明化合物中的同位素的实例包括氢、碳、氮、氧、磷、硫、氟和氯的同位素,诸如2h、3h、
13
c、
14
c、
15
n、
18
o和
17
o。此类同位素标记的化合物适用作研究或诊断工具。
[0464]
鼻内施用途径
[0465]
本文中所描述的方法包括将治疗有效量的烟碱乙酰胆碱受体激动剂局部施用至有需要的个体的鼻腔中。在一些实施方案中,本文中所描述的方法包括将治疗有效量的烟碱乙酰胆碱受体激动剂局部施用至有需要的个体的鼻腔中,其中所述烟碱乙酰胆碱受体激动剂为式(i)、式(ii)、式(iiia)或式(iiib)化合物。在一些实施方案中,本文中所描述的方法包括将治疗有效量的式(i)、式(ii)、式(iiia)或式(iiib)化合物局部施用至有需要的个体的鼻腔中,其中式(i)、式(ii)、式(iiia)或式(iiib)化合物呈液体、混悬剂、气雾剂、凝胶、软膏、干粉、乳膏、糊剂、洗剂或香膏形式施用至鼻腔中。在本文中所描述的方法的一些实施方案中,所述式(i)、式(ii)、式(iiia)或式(iiib)化合物呈液体形式施用至鼻腔中。在本文中所描述的方法的一些实施方案中,式(i)、式(ii)、式(iiia)或式(iiib)化合物呈混悬剂形式施用至鼻腔中。在本文中所描述的方法的一些实施方案中,式(i)、式(ii)、式(iiia)或式(iiib)化合物呈气雾剂形式施用至鼻腔中。在本文中所描述的方法的一些实施方案中,式(i)、式(ii)、式(iiia)或式(iiib)化合物呈凝胶形式施用至鼻腔中。在本文中所描述的方法的一些实施方案中,式(i)、式(ii)、式(iiia)或式(iiib)化合物呈软膏形式施用至鼻腔中。在本文中所描述的方法的一些实施方案中,式(i)、式(ii)、式(iiia)或式(iiib)化合物呈干粉形式施用至鼻腔中。在本文中所描述的方法的一些实施方案中,式(i)、式(ii)、式(iiia)或式(iiib)化合物呈乳膏形式施用至鼻腔中。在本文中所描述的方法的一些实施方案中,式(i)、式(ii)、式(iiia)或式(iiib)化合物呈糊剂形式施用至鼻腔中。在本文中所描述的方法的一些实施方案中,式(i)、式(ii)、式(iiia)或式(iiib)化合物呈洗剂形式施用至鼻腔中。在本文中所描述的方法的一些实施方案中,式(i)、式(ii)、式(iiia)或式(iiib)化合物呈香膏形式施用至鼻腔中。在一些实施方案中,所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0466]
在一些实施方案中,本文中所描述的方法包括将治疗有效量的式(i)、式(ii)、式(iiia)或式(iiib)化合物局部施用至有需要的个体的鼻腔中,其中通过注射器、滴管、瓶状雾化器、雾化泵、吸入器、喷粉装置、汽化器、贴片、施药棒、吸移管或液体喷射器将式(i)、式(ii)、式(iiia)或式(iiib)化合物施用至鼻腔中。在本文中所描述的方法的一些实施方案中,通过注射器将式(i)、式(ii)、式(iiia)或式(iiib)化合物施用至鼻腔中。在本文中所描述的方法的一些实施方案中,通过滴管将式(i)、式(ii)、式(iiia)或式(iiib)化合物施用至鼻腔中。在本文中所描述的方法的一些实施方案中,通过瓶状雾化器将式(i)、式(ii)、式(iiia)或式(iiib)化合物施用至鼻腔中。在本文中所描述的方法的一些实施方案中,通过雾化泵将式(i)、式(ii)、式(iiia)或式(iiib)化合物施用至鼻腔中。在本文中所描述的方
法的一些实施方案中,通过吸入器将式(i)、式(ii)、式(iiia)或式(iiib)化合物施用至鼻腔中。在本文中所描述的方法的一些实施方案中,通过喷粉装置将式(i)、式(ii)、式(iiia)或式(iiib)化合物施用至鼻腔中。在本文中所描述的方法的一些实施方案中,通过汽化器将式(i)、式(ii)、式(iiia)或式(iiib)化合物施用至鼻腔中。在本文中所描述的方法的一些实施方案中,通过贴片将式(i)、式(ii)、式(iiia)或式(iiib)化合物施用至鼻腔中。在本文中所描述的方法的一些实施方案中,通过施药棒将式(i)、式(ii)、式(iiia)或式(iiib)化合物施用至鼻腔中。在本文中所描述的方法的一些实施方案中,通过吸移管将式(i)、式(ii)、式(iiia)或式(iiib)化合物施用至鼻腔中。在本文中所描述的方法的一些实施方案中,通过液体喷射器将式(i)、式(ii)、式(iiia)或式(iiib)化合物施用至鼻腔中。在一些实施方案中,所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0467]
在另一个实施方案中,在交替鼻孔中施用式(i)、式(ii)、式(iiia)或式(iiib)化合物。举例来说,在一个鼻孔中,接着在预定量的时间之后在另一个鼻孔中施用式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,在两个鼻孔中施用式(i)、式(ii)、式(iiia)或式(iiib)化合物。举例来说,在一个鼻孔中,接着同时或在第一鼻孔之后立即在另一鼻孔中施用式(i)、式(ii)、式(iiia)或式(iiib)化合物。在另一个实施方案中,在一个鼻孔中施用式(i)、式(ii)、式(iiia)或式(iiib)化合物。在一些实施方案中,所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0468]
在一些实施方案中,所述式(i)、式(ii)、式(iiia)或式(iiib)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶(或化合物1)。在一些实施方案中,所述式(i)、式(ii)、式(iiia)或式(iiib)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。在一些实施方案中,所述式(i)、式(ii)、式(iiia)或式(iiib)化合物为呈游离碱形式的(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶。在一些实施方案中,所述式(i)、式(ii)、式(iiia)或式(iiib)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶柠檬酸盐。在一些实施方案中,所述式(i)、式(ii)、式(iiia)或式(iiib)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶单柠檬酸盐。在一些实施方案中,所述式(i)、式(ii)、式(iiia)或式(iiib)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶hcl盐。在一些实施方案中,所述式(i)、式(ii)、式(iiia)或式(iiib)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶粘酸盐。在一些实施方案中,所述式(i)、式(ii)、式(iiia)或式(iiib)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶半粘酸盐。在一些实施方案中,所述式(i)、式(ii)、式(iiia)或式(iiib)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶半粘酸盐单水合物。在本文中所描述的方法的一些实施方案中,所述式(i)、式(ii)、式(iiia)或式(iiib)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶半粘酸盐二水合物。
[0469]
药物制剂、给药方法和治疗方案
[0470]
本文中还提供用于局部施用至个体鼻腔中的烟碱乙酰胆碱受体激动剂的药物制剂。在一些实施方案中,本文中提供一种用于局部施用至个体鼻腔中的烟碱乙酰胆碱受体激动剂的药物制剂,其中所述烟碱乙酰胆碱受体激动剂为式(i)、式(ii)、式(iiia)或式(iiib)化合物。在一些实施方案中为一种用于局部施用至个体鼻腔中的药物制剂,其包含被配制成预防减敏且剂量的量不具全身性生物可利用性的式(i)、式(ii)、式(iiia)或式
(iiib)化合物。在一些实施方案中为一种用于局部施用至个体鼻腔中的药物制剂,其包含被配制成预防减敏且剂量的量不具全身性生物可利用性的式(i)、式(ii)、式(iiia)或式(iiib)化合物,其还包含选自蛋白激酶c(pkc)或者上调或向上调节pkc的因子、camp依赖性蛋白激酶(pka)或者上调或向上调节pka的因子和钙调磷酸酶抑制剂的一种或多种物质。在一些实施方案中为一种用于局部施用至个体鼻腔中的药物制剂,其包含被配制成预防减敏且剂量的量不具全身性生物可利用性的式(i)、式(ii)、式(iiia)或式(iiib)化合物,其还包含蛋白激酶c(pkc)或者上调或向上调节pkc的因子。在一些实施方案中为一种用于局部施用至个体鼻腔中的药物制剂,其包含被配制成预防减敏且剂量的量不具全身性生物可利用性的式(i)、式(ii)、式(iiia)或式(iiib)化合物,其还包含camp依赖性蛋白激酶(pka)或者上调或向上调节pka的因子。在一些实施方案中为一种用于局部施用至个体鼻腔中的药物制剂,其包含被配制成预防减敏且剂量的量不具全身性生物可利用性的式(i)、式(ii)、式(iiia)或式(iiib)化合物,其还包含钙调磷酸酶抑制剂。在一些实施方案中为一种用于局部施用至个体鼻腔中的药物制剂,其包含被配制成预防减敏且剂量的量不具全身性生物可利用性的式(i)、式(ii)、式(iiia)或式(iiib)化合物,其还包含钙调磷酸酶抑制剂,其中所述钙调磷酸酶抑制剂选自环孢霉素、吡美莫司和他克莫司。在一些实施方案中为一种用于局部施用至个体鼻腔中的药物制剂,其包含被配制成预防减敏且剂量的量不具全身性生物可利用性的式(i)、式(ii)、式(iiia)或式(iiib)化合物,其还包含钙调磷酸酶抑制剂,其中所述钙调磷酸酶抑制剂选自环孢霉素。在一些实施方案中为一种用于局部施用至个体鼻腔中的药物制剂,其包含被配制成预防减敏且剂量的量不具全身性生物可利用性的式(i)、式(ii)、式(iiia)或式(iiib)化合物,其还包含钙调磷酸酶抑制剂,其中所述钙调磷酸酶抑制剂为吡美莫司。在一些实施方案中为一种用于局部施用至个体鼻腔中的药物制剂,其包含被配制成预防减敏且剂量的量不具全身性生物可利用性的式(i)、式(ii)、式(iiia)或式(iiib)化合物,其还包含钙调磷酸酶抑制剂,其中所述钙调磷酸酶抑制剂为他克莫司。
[0471]
在一些实施方案中为一种用于局部施用至个体鼻腔中的药物制剂,其包含被配制成预防减敏且剂量的量不具全身性生物可利用性的式(i)、式(ii)、式(iiia)或式(iiib)化合物,其中所述式(i)、式(ii)、式(iiia)或式(iiib)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶。在一些实施方案中为一种用于局部施用至个体鼻腔中的药物制剂,其包含被配制成预防减敏且剂量的量不具全身性生物可利用性的式(i)、式(ii)、式(iiia)或式(iiib)化合物,其中所述式(i)、式(ii)、式(iiia)或式(iiib)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶柠檬酸盐。在一些实施方案中为一种用于局部施用至个体鼻腔中的药物制剂,其包含被配制成预防减敏且剂量的量不具全身性生物可利用性的式(i)、式(ii)、式(iiia)或式(iiib)化合物,其中所述式(i)、式(ii)、式(iiia)或式(iiib)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶单柠檬酸盐。在一些实施方案中为一种用于局部施用至个体鼻腔中的药物制剂,其包含被配制成预防减敏且剂量的量不具全身性生物可利用性的式(i)、式(ii)、式(iiia)或式(iiib)化合物,其中所述式(i)、式(ii)、式(iiia)或式(iiib)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶hcl盐。在一些实施方案中为一种用于局部施用至个体鼻腔中的药物制剂,其包含被配制成预防减敏且剂量的量不具全身性生物可利用性的式(i)、式(ii)、式(iiia)或式(iiib)化合物,其中所述式(i)、式(ii)、式(iiia)或式(iiib)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶粘酸盐。在一些实施
方案中为一种用于局部施用至个体鼻腔中的药物制剂,其包含被配制成预防减敏且剂量的量不具全身性生物可利用性的式(i)、式(ii)、式(iiia)或式(iiib)化合物,其中所述式(i)、式(ii)、式(iiia)或式(iiib)化合物为n-(5-氯呋喃-2-基羰基)-3,7-二氮杂双环[3.3.0]辛烷。在一些实施方案中为一种用于局部施用至个体鼻腔中的药物制剂,其包含被配制成预防减敏且剂量的量不具全身性生物可利用性的式(i)、式(ii)、式(iiia)或式(iiib)化合物,其中所述药物制剂不含呈任何形式的烟碱。在一些实施方案中为一种用于局部施用至个体鼻腔中的药物制剂,其包含被配制成预防减敏且剂量的量不具全身性生物可利用性的式(i)、式(ii)、式(iiia)或式(iiib)化合物,其中所述药物制剂不含烟碱游离碱、烟碱盐、烟碱复合物或烟碱溶剂合物。
[0472]
在一些实施方案中为一种用于局部施用至个体鼻腔中的药物制剂,其包含被配制成预防减敏且剂量的量不具全身性生物可利用性的式(i)、式(ii)、式(iiia)或式(iiib)化合物,其中所述式(i)、式(ii)、式(iiia)或式(iiib)化合物选择性地结合至选自α3β4、α4β2和α7的外周烟碱乙酰胆碱受体亚型中的至少一者。在一些实施方案中为一种用于局部施用至个体鼻腔中的药物制剂,其包含被配制成预防减敏且剂量的量不具全身性生物可利用性的式(i)、式(ii)、式(iiia)或式(iiib)化合物,其中所述式(i)、式(ii)、式(iiia)或式(iiib)化合物选择性地结合至外周烟碱乙酰胆碱受体亚型α3β4。在一些实施方案中为一种用于局部施用至个体鼻腔中的药物制剂,其包含被配制成预防减敏且剂量的量不具全身性生物可利用性的式(i)、式(ii)、式(iiia)或式(iiib)化合物,其中所述式(i)、式(ii)、式(iiia)或式(iiib)化合物选择性地结合至外周烟碱乙酰胆碱受体亚型α4β2。在一些实施方案中为一种用于局部施用至个体鼻腔中的药物制剂,其包含被配制成预防减敏且剂量的量不具全身性生物可利用性的式(i)、式(ii)、式(iiia)或式(iiib)化合物,其中所述式(i)、式(ii)、式(iiia)或式(iiib)化合物选择性地结合至外周烟碱乙酰胆碱受体亚型α7。在一些实施方案中,所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0473]
在一些实施方案中为一种用于局部施用至个体鼻腔中的药物制剂,其包含被配制成预防减敏且剂量的量不具全身性生物可利用性的式(i)、式(ii)、式(iiia)或式(iiib)化合物,其中所述式(i)、式(ii)、式(iiia)或式(iiib)化合物为软药。在一些实施方案中,所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0474]
在一些实施方案中为一种用于局部施用至个体鼻腔中的药物制剂,其包含被配制成预防减敏且剂量的量不具全身性生物可利用性的式(i)化合物,其中式(i)化合物具有以下结构:
[0475]
或其药学上可接受的盐。
[0476]
在一些实施方案中为一种用于局部施用至个体鼻腔中的药物制剂,其包含被配制成预防减敏且剂量的量不具全身性生物可利用性的式(i)化合物,其中式(i)化合物具有以下结构:
[0477]
半粘酸盐单水合物或二水合物;或其药学上可接受的盐。
[0478]
在一些实施方案中为一种用于局部施用至个体鼻腔中的药物制剂,其包含被配制成预防减敏且剂量的量不具全身性生物可利用性的式(i)化合物,其中式(i)化合物具有以下结构:
[0479][0480]
在一些实施方案中为一种用于局部施用至个体鼻腔中的药物制剂,其包含被配制成预防减敏且剂量的量不具全身性生物可利用性的式(i)化合物,其中式(i)化合物具有以下结构:
[0481][0482]
在一些实施方案中为一种用于局部施用至个体鼻腔中的药物制剂,其包含被配制成预防减敏且剂量的量不具全身性生物可利用性的式(ii)化合物,其中式(ii)化合物具有以下结构:
[0483][0484]
在一些实施方案中为一种用于局部施用至个体鼻腔中的药物制剂,其包含被配制成预防减敏且剂量的量不具全身性生物可利用性的式(ii)化合物,其中式(ii)化合物具有以下结构:
[0485]
或其药学上可接受的盐。
[0486]
在一些实施方案中,本文中还描述一种用于局部施用至个体鼻腔中的药物制剂,其包含被配制成预防减敏且剂量的量不会引起不希望的精神副作用的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在一些实施方案中为一种用于局部施用至个体鼻腔中的药物制剂,其包含被配制成预防减敏且剂量的量不会引起不希望的精神副作用的式(i)、式(ii)、式(iiia)或式(iiib)化合物,其还包含选自蛋白激酶c(pkc)或者上调或向上调节pkc的因子、camp依赖性蛋白激酶(pka)或者上调或向上调节pka的因子和钙调磷酸酶抑制剂的一种或多种物质。在一些实施方案中为一种用于局部施用至个体鼻腔中的药物制剂,其包含被配制成预防减敏且剂量的量不会引起不希望的精神副作用的式(i)、式(ii)、式(iiia)或式(iiib)化合物,其还包含蛋白激酶c(pkc)或者上调或向上调节pkc的因子。在一些实施方案中为一种用于局部施用至个体鼻腔中的药物制剂,其包含被配制成预防减敏且剂量的量不
会引起不希望的精神副作用的式(i)、式(ii)、式(iiia)或式(iiib)化合物,其还包含camp依赖性蛋白激酶(pka)或者上调或向上调节pka的因子。在一些实施方案中为一种用于局部施用至个体鼻腔中的药物制剂,其包含被配制成预防减敏且剂量的量不会引起不希望的精神副作用的式(i)、式(ii)、式(iiia)或式(iiib)化合物,其还包含钙调磷酸酶抑制剂。在一些实施方案中为一种用于局部施用至个体鼻腔中的药物制剂,其包含被配制成预防减敏且剂量的量不会引起不希望的精神副作用的式(i)、式(ii)、式(iiia)或式(iiib)化合物,其还包含钙调磷酸酶抑制剂,其中所述钙调磷酸酶抑制剂选自环孢霉素、吡美莫司和他克莫司。在一些实施方案中为一种用于局部施用至个体鼻腔中的药物制剂,其包含被配制成预防减敏且剂量的量不会引起不希望的精神副作用的式(i)、式(ii)、式(iiia)或式(iiib)化合物,其还包含钙调磷酸酶抑制剂,其中所述钙调磷酸酶抑制剂选自环孢霉素。在一些实施方案中为一种用于局部施用至个体鼻腔中的药物制剂,其包含被配制成预防减敏且剂量的量不会引起不希望的精神副作用的式(i)、式(ii)、式(iiia)或式(iiib)化合物,其还包含钙调磷酸酶抑制剂,其中所述钙调磷酸酶抑制剂为吡美莫司。在一些实施方案中为一种用于局部施用至个体鼻腔中的药物制剂,其包含被配制成预防减敏且剂量的量不会引起不希望的精神副作用的式(i)、式(ii)、式(iiia)或式(iiib)化合物,其还包含钙调磷酸酶抑制剂,其中所述钙调磷酸酶抑制剂为他克莫司。
[0487]
在一些实施方案中为一种用于局部施用至个体鼻腔中的药物制剂,其包含被配制成预防减敏且剂量的量不会引起不希望的精神副作用的式(i)、式(ii)、式(iiia)或式(iiib)化合物,其中所述式(i)、式(ii)、式(iiia)或式(iiib)化合物为软药。在一些实施方案中,所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0488]
在一些实施方案中为一种用于局部施用至个体鼻腔中的药物制剂,其包含被配制成预防减敏且剂量的量不会引起不希望的精神副作用的式(i)化合物,其中式(i)化合物具有以下结构:
[0489]
或其药学上可接受的盐。
[0490]
在一些实施方案中为一种用于局部施用至个体鼻腔中的药物制剂,其包含被配制成预防减敏且剂量的量不会引起不希望的精神副作用的式(i)化合物,其中式(i)化合物具有以下结构:
[0491]
半粘酸盐单水合物或二水合物;或其药学上可接受的盐。
[0492]
在一些实施方案中为一种用于局部施用至个体鼻腔中的药物制剂,其包含被配制成预防减敏且剂量的量不会引起不希望的精神副作用的式(i)化合物,其中式(i)化合物具有以下结构:
[0493][0494]
在一些实施方案中为一种用于局部施用至个体鼻腔中的药物制剂,其包含被配制成预防减敏且剂量的量不会引起不希望的精神副作用的式(i)化合物,其中式(i)化合物具有以下结构:
[0495][0496]
在一些实施方案中为一种用于局部施用至个体鼻腔中的药物制剂,其包含被配制成预防减敏且剂量的量不会引起不希望的精神副作用的式(i)化合物,其中式(i)化合物具有以下结构:
[0497][0498]
在一些实施方案中为一种用于局部施用至个体鼻腔中的药物制剂,其包含被配制成预防减敏且剂量的量不会引起不希望的精神副作用的式(ii)化合物,其中式(ii)化合物具有以下结构:
[0499]
或其药学上可接受的盐。
[0500]
在一些实施方案中为一种用于局部施用至个体鼻腔中的药物制剂,其包含被配制成预防减敏且剂量的量不会引起不希望的精神副作用的式(i)、式(ii)、式(iiia)或式(iiib)化合物,所述式(i)、式(ii)、式(iiia)或式(iiib)化合物选择性地结合至选自α3β4、α4β2和α7的外周烟碱乙酰胆碱受体亚型中的至少一者。在一些实施方案中为一种用于局部施用至个体鼻腔中的药物制剂,其包含被配制成预防减敏且剂量的量不会引起不希望的精神副作用的式(i)、式(ii)、式(iiia)或式(iiib)化合物,其中所述式(i)、式(ii)、式(iiia)或式(iiib)化合物选择性地结合至外周烟碱乙酰胆碱受体亚型α3β4。在一些实施方案中为一种用于局部施用至个体鼻腔中的药物制剂,其包含被配制成预防减敏且剂量的量不会引起不希望的精神副作用的式(i)、式(ii)、式(iiia)或式(iiib)化合物,所述式(i)、式(ii)、式(iiia)或式(iiib)化合物选择性地结合至外周烟碱乙酰胆碱受体亚型α4β2。在一些实施方案中为一种用于局部施用至个体鼻腔中的药物制剂,其包含被配制成预防减敏且剂量的量不会引起不希望的精神副作用的式(i)、式(ii)、式(iiia)或式(iiib)化合物,所述式(i)、式(ii)、式(iiia)或式(iiib)化合物选择性地结合至外周烟碱乙酰胆碱受体亚型α7。在一些实施方案中,所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0501]
在一些实施方案中,本文中还描述一种用于局部施用至个体鼻腔中的药物制剂,
其包含被配制成预防减敏且剂量的量不会引起不希望的全身性副作用的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在一些实施方案中为一种用于局部施用至个体鼻腔中的药物制剂,其包含被配制成预防减敏且剂量的量不会引起不希望的全身性副作用的式(i)、式(ii)、式(iiia)或式(iiib)化合物,其还包含选自蛋白激酶c(pkc)或者上调或向上调节pkc的因子、camp依赖性蛋白激酶(pka)或者上调或向上调节pka的因子和钙调磷酸酶抑制剂的一种或多种物质。在一些实施方案中为一种用于局部施用至个体鼻腔中的药物制剂,其包含被配制成预防减敏且剂量的量不会引起不希望的全身性副作用的式(i)、式(ii)、式(iiia)或式(iiib)化合物,其还包含蛋白激酶c(pkc)或者上调或向上调节pkc的因子。在一些实施方案中为一种用于局部施用至个体鼻腔中的药物制剂,其包含被配制成预防减敏且剂量的量不会引起不希望的全身性副作用的式(i)、式(ii)、式(iiia)或式(iiib)化合物,其还包含camp依赖性蛋白激酶(pka)或者上调或向上调节pka的因子。在一些实施方案中为一种用于局部施用至个体鼻腔中的药物制剂,其包含被配制成预防减敏且剂量的量不会引起不希望的全身性副作用的式(i)、式(ii)、式(iiia)或式(iiib)化合物,其还包含钙调磷酸酶抑制剂。在一些实施方案中为一种用于局部施用至个体鼻腔中的药物制剂,其包含被配制成预防减敏且剂量的量不会引起不希望的全身性副作用的式(i)、式(ii)、式(iiia)或式(iiib)化合物,其还包含钙调磷酸酶抑制剂,其中所述钙调磷酸酶抑制剂选自环孢霉素、吡美莫司和他克莫司。在一些实施方案中为一种用于局部施用至个体鼻腔中的药物制剂,其包含被配制成预防减敏且剂量的量不会引起不希望的全身性副作用的式(i)、式(ii)、式(iiia)或式(iiib)化合物,其还包含钙调磷酸酶抑制剂,其中所述钙调磷酸酶抑制剂选自环孢霉素。在一些实施方案中为一种用于局部施用至个体鼻腔中的药物制剂,其包含被配制成预防减敏且剂量的量不会引起不希望的全身性副作用的式(i)、式(ii)、式(iiia)或式(iiib)化合物,其还包含钙调磷酸酶抑制剂,其中所述钙调磷酸酶抑制剂为吡美莫司。在一些实施方案中为一种用于局部施用至个体鼻腔中的药物制剂,其包含被配制成预防减敏且剂量的量不会引起不希望的全身性副作用的式(i)、式(ii)、式(iiia)或式(iiib)化合物,其还包含钙调磷酸酶抑制剂,其中所述钙调磷酸酶抑制剂为他克莫司。
[0502]
在一些实施方案中为一种用于局部施用至个体鼻腔中的药物制剂,其包含被配制成预防减敏且剂量的量不会引起不希望的全身性副作用的式(i)、式(ii)、式(iiia)或式(iiib)化合物,其中所述式(i)、式(ii)、式(iiia)或式(iiib)化合物为软药。
[0503]
在一些实施方案中为一种用于局部施用至个体鼻腔中的药物制剂,其包含被配制成预防减敏且剂量的量不会引起不希望的全身性副作用的式(i)化合物,其中式(i)化合物具有以下结构:
[0504]
或其药学上可接受的盐。
[0505]
在一些实施方案中为一种用于局部施用至个体鼻腔中的药物制剂,其包含被配制成预防减敏且剂量的量不会引起不希望的全身性副作用的式(i)化合物,其中式(i)化合物具有以下结构:
[0506]
半粘酸盐单水合物或二水合物;或其药学上可接受的盐。
[0507]
在一些实施方案中为一种用于局部施用至个体鼻腔中的药物制剂,其包含被配制成预防减敏且剂量的量不会引起不希望的全身性副作用的式(i)化合物,其中式(i)化合物具有以下结构:
[0508][0509]
在一些实施方案中为一种用于局部施用至个体鼻腔中的药物制剂,其包含被配制成预防减敏且剂量的量不会引起不希望的全身性副作用的式(i)化合物,其中式(i)化合物具有以下结构:
[0510][0511]
在一些实施方案中为一种用于局部施用至个体鼻腔中的药物制剂,其包含被配制成预防减敏且剂量的量不会引起不希望的全身性副作用的式(i)化合物,其中式(i)化合物具有以下结构:
[0512][0513]
在一些实施方案中为一种用于局部施用至个体鼻腔中的药物制剂,其包含被配制成预防减敏且剂量的量不会引起不希望的全身性副作用的式(ii)化合物,其中式(ii)化合物具有以下结构:
[0514]
或其药学上可接受的盐。
[0515]
在一些实施方案中为一种用于局部施用至个体鼻腔中的药物制剂,其包含被配制成预防减敏且剂量的量不会引起不希望的全身性副作用的式(i)、式(ii)、式(iiia)或式(iiib)化合物,所述式(i)、式(ii)、式(iiia)或式(iiib)化合物选择性地结合至选自α3β4、α4β2和α7的外周烟碱乙酰胆碱受体亚型中的至少一者。在一些实施方案中为一种用于局部施用至个体鼻腔中的药物制剂,其包含被配制成预防减敏且剂量的量不会引起不希望的全身性副作用的式(i)、式(ii)、式(iiia)或式(iiib)化合物,其中所述式(i)、式(ii)、式(iiia)或式(iiib)化合物选择性地结合至外周烟碱乙酰胆碱受体亚型α3β4。在一些实施方案中为一种用于局部施用至个体鼻腔中的药物制剂,其包含被配制成预防减敏且剂量的量不会引起不希望的全身性副作用的式(i)、式(ii)、式(iiia)或式(iiib)化合物,所述式(i)、式(ii)、式(iiia)或式(iiib)化合物选择性地结合至外周烟碱乙酰胆碱受体亚型α4β
2。在一些实施方案中为一种用于局部施用至个体鼻腔中的药物制剂,其包含被配制成预防减敏且剂量的量不会引起不希望的全身性副作用的式(i)、式(ii)、式(iiia)或式(iiib)化合物,所述式(i)、式(ii)、式(iiia)或式(iiib)化合物选择性地结合至外周烟碱乙酰胆碱受体亚型α7。在一些实施方案中,所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0516]
在任何上述药物制剂实施方案的另一个实施方案中,所述药物制剂包含约0.1mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在任何上述药物制剂实施方案的另一个实施方案中,所述药物制剂包含约0.2mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在任何上述药物制剂实施方案的另一个实施方案中,所述药物制剂包含约0.5mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在任何上述药物制剂实施方案的另一个实施方案中,所述药物制剂包含约1mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在任何上述药物制剂实施方案的另一个实施方案中,所述药物制剂包含约2mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在任何上述药物制剂实施方案的另一个实施方案中,所述药物制剂包含约3mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在任何上述药物制剂实施方案的另一个实施方案中,所述药物制剂包含约4mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在任何上述药物制剂实施方案的另一个实施方案中,所述药物制剂包含约5mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在任何上述药物制剂实施方案的另一个实施方案中,所述药物制剂包含约6mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在任何上述药物制剂实施方案的另一个实施方案中,所述药物制剂包含约7mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在任何上述药物制剂实施方案的另一个实施方案中,所述药物制剂包含约8mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在任何上述药物制剂实施方案的另一个实施方案中,所述药物制剂包含约9mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在任何上述药物制剂实施方案的另一个实施方案中,所述药物制剂包含约10mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在任何上述药物制剂实施方案的另一个实施方案中,所述药物制剂包含约12mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在任何上述药物制剂实施方案的另一个实施方案中,所述药物制剂包含约15mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在任何上述药物制剂实施方案的另一个实施方案中,所述药物制剂包含约20mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在任何上述药物制剂实施方案的另一个实施方案中,所述药物制剂包含约25mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在任何上述药物制剂实施方案的另一个实施方案中,所述药物制剂包含约30mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在任何上述药物制剂实施方案的另一个实施方案中,所述药物制剂包含约40mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在任何上述药物制剂实施方案的另一个实施方案中,所述药物制剂包含约50mg/ml的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在一些实施方案中,所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0517]
在任何上述药物制剂实施方案的另一个实施方案中,所述药物制剂包含介于5mg/ml与200mg/ml之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在任何上述药物制剂实施方案的另一个实施方案中,所述药物制剂包含介于10mg/ml与200mg/ml之间的式(i)、式
(ii)、式(iiia)或式(iiib)化合物。在任何上述药物制剂实施方案的另一个实施方案中,所述药物制剂包含介于5mg/ml与100mg/ml之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在任何上述药物制剂实施方案的另一个实施方案中,所述药物制剂包含介于10mg/ml与75mg/ml之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在任何上述药物制剂实施方案的另一个实施方案中,所述药物制剂包含介于10mg/ml与50mg/ml之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在任何上述药物制剂实施方案的另一个实施方案中,所述药物制剂包含介于10mg/ml与30mg/ml之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在任何上述药物制剂实施方案的另一个实施方案中,所述药物制剂包含介于5mg/ml与50mg/ml之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在一些实施方案中,所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0518]
在任何上述药物制剂实施方案的另一个实施方案中,所述药物制剂包含介于10mg/ml与25mg/ml之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在任何上述药物制剂实施方案的另一个实施方案中,所述药物制剂包含介于10mg/ml与50mg/ml之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在任何上述药物制剂实施方案的另一个实施方案中,所述药物制剂包含介于20mg/ml与50mg/ml之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在任何上述药物制剂实施方案的另一个实施方案中,所述药物制剂包含介于30mg/ml与75mg/ml之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在一些实施方案中,所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0519]
在任何上述药物制剂实施方案的另一个实施方案中,所述药物制剂包含每剂量至少1微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在任何上述药物制剂实施方案的另一个实施方案中,所述药物制剂包含每剂量至少5微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在任何上述药物制剂实施方案的另一个实施方案中,所述药物制剂包含每剂量至少10微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在任何上述药物制剂实施方案的另一个实施方案中,所述药物制剂包含每剂量至少25微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在任何上述药物制剂实施方案的另一个实施方案中,所述药物制剂包含每剂量至少50微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在任何上述药物制剂实施方案的另一个实施方案中,所述药物制剂包含每剂量至少100微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在任何上述药物制剂实施方案的另一个实施方案中,所述药物制剂包含每剂量至少250微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在任何上述药物制剂实施方案的另一个实施方案中,所述药物制剂包含每剂量至少500微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在任何上述药物制剂实施方案的另一个实施方案中,所述药物制剂包含每剂量至少750微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在任何上述药物制剂实施方案的另一个实施方案中,所述药物制剂包含每剂量至少1000微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在任何上述药物制剂实施方案的另一个实施方案中,所述药物制剂包含每剂量介于1微克与1000微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在任何上述药物制剂实施方案的另一个实施方案中,所述药物制剂包含每剂量介于5微克与1000微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在任何上述药物制剂实施方案的另一个实施方案中,所述药物制剂包含每剂量介于10微克与1000微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在任何上述药物制剂
实施方案的另一个实施方案中,所述药物制剂包含每剂量介于5微克与100微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在任何上述药物制剂实施方案的另一个实施方案中,所述药物制剂包含每剂量介于5微克与50微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在任何上述药物制剂实施方案的另一个实施方案中,所述药物制剂包含每剂量介于10微克与50微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在任何上述药物制剂实施方案的另一个实施方案中,所述药物制剂包含每剂量介于25微克与1000微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在任何上述药物制剂实施方案的另一个实施方案中,所述药物制剂包含每剂量介于50微克与1000微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在任何上述药物制剂实施方案的另一个实施方案中,所述药物制剂包含每剂量介于100微克与1000微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在任何上述药物制剂实施方案的另一个实施方案中,所述药物制剂包含每剂量介于150微克与1000微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在任何上述药物制剂实施方案的另一个实施方案中,所述药物制剂包含每剂量介于100微克与750微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在任何上述药物制剂实施方案的另一个实施方案中,所述药物制剂包含每剂量介于150微克与750微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在任何上述药物制剂实施方案的另一个实施方案中,所述药物制剂包含每剂量介于150微克与600微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在一些实施方案中,所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0520]
在任何上述药物制剂实施方案的另一个实施方案中,所述药物制剂包含每剂量少于100微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在任何上述药物制剂实施方案的另一个实施方案中,所述药物制剂包含每剂量少于75微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在任何上述药物制剂实施方案的另一个实施方案中,所述药物制剂包含每剂量少于50微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在任何上述药物制剂实施方案的另一个实施方案中,所述药物制剂包含每剂量少于25微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在任何上述药物制剂实施方案的另一个实施方案中,所述药物制剂包含每剂量少于15微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在增加泪液清除率的任何上述实施方案的另一个实施方案中,向鼻腔中施用约75微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在任何上述药物制剂实施方案的另一个实施方案中,所述药物制剂包含每剂量约50微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在任何上述药物制剂实施方案的另一个实施方案中,所述药物制剂包含每剂量约25微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在任何上述药物制剂实施方案的另一个实施方案中,所述药物制剂包含每剂量约10微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在一些实施方案中,所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0521]
在任何上述药物制剂实施方案的另一个实施方案中,所述药物制剂包含每剂量介于1微克与100微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在任何上述药物制剂实施方案的另一个实施方案中,所述药物制剂包含每剂量介于1微克与75微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在任何上述药物制剂实施方案的另一个实施方
案中,所述药物制剂包含每剂量介于5微克与100微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在任何上述药物制剂实施方案的另一个实施方案中,所述药物制剂包含每剂量介于5微克与75微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在任何上述药物制剂实施方案的另一个实施方案中,所述药物制剂包含每剂量介于15微克与100微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在任何上述药物制剂实施方案的另一个实施方案中,所述药物制剂包含每剂量介于15微克与75微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在任何上述药物制剂实施方案的另一个实施方案中,所述药物制剂包含每剂量介于25微克与100微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在任何上述药物制剂实施方案的另一个实施方案中,所述药物制剂包含每剂量介于25微克与75微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在任何上述药物制剂实施方案的另一个实施方案中,所述药物制剂包含每剂量介于25微克与60微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在一些实施方案中,所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0522]
在任何上述药物制剂实施方案的另一个实施方案中,所述药物制剂包含每剂量介于500微克与10毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在任何上述药物制剂实施方案的另一个实施方案中,所述药物制剂包含每剂量介于500微克与5毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在任何上述药物制剂实施方案的另一个实施方案中,所述药物制剂包含每剂量介于500微克与3毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在任何上述药物制剂实施方案的另一个实施方案中,所述药物制剂包含每剂量介于500微克与2毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在任何上述药物制剂实施方案的另一个实施方案中,所述药物制剂包含每剂量介于1毫克与10毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在任何上述药物制剂实施方案的另一个实施方案中,所述药物制剂包含每剂量介于1毫克与5毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在任何上述药物制剂实施方案的另一个实施方案中,所述药物制剂包含每剂量介于1毫克与3毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在任何上述药物制剂实施方案的另一个实施方案中,所述药物制剂包含每剂量介于1毫克与2毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在任何上述药物制剂实施方案的另一个实施方案中,所述药物制剂包含每剂量约500微克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在任何上述药物制剂实施方案的另一个实施方案中,所述药物制剂包含每剂量约1毫克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在任何上述药物制剂实施方案的另一个实施方案中,所述药物制剂包含每剂量约1.5毫克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在任何上述药物制剂实施方案的另一个实施方案中,所述药物制剂包含每剂量约2毫克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在任何上述药物制剂实施方案的另一个实施方案中,所述药物制剂包含每剂量约2.5毫克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在任何上述药物制剂实施方案的另一个实施方案中,所述药物制剂包含每剂量约3毫克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在任何上述药物制剂实施方案的另一个实施方案中,所述药物制剂包含每剂量约4毫克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在任何上述药物制剂实施方案的另一个实施方案中,所述药物制剂包含每剂量约5毫克的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在一些实施方案中,所述式(i)化合物为
(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0523]
在任何上述药物制剂实施方案的另一个实施方案中,所述药物制剂包含每剂量介于1微克与10毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在任何上述药物制剂实施方案的另一个实施方案中,所述药物制剂包含每剂量介于5微克与10毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在任何上述药物制剂实施方案的另一个实施方案中,所述药物制剂包含每剂量介于10微克与10毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在任何上述药物制剂实施方案的另一个实施方案中,所述药物制剂包含每剂量介于25微克与10毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在任何上述药物制剂实施方案的另一个实施方案中,所述药物制剂包含每剂量介于50微克与10毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在任何上述药物制剂实施方案的另一个实施方案中,所述药物制剂包含每剂量介于100微克与10毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在任何上述药物制剂实施方案的另一个实施方案中,所述药物制剂包含每剂量介于150微克与10毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在一些实施方案中,所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0524]
在任何上述药物制剂实施方案的另一个实施方案中,所述药物制剂包含每剂量介于1微克与10毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在任何上述药物制剂实施方案的另一个实施方案中,所述药物制剂包含每剂量介于1微克与5毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在任何上述药物制剂实施方案的另一个实施方案中,所述药物制剂包含每剂量介于1微克与4毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在任何上述药物制剂实施方案的另一个实施方案中,所述药物制剂包含每剂量介于1微克与3毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在任何上述药物制剂实施方案的另一个实施方案中,所述药物制剂包含每剂量介于1微克与2毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在任何上述药物制剂实施方案的另一个实施方案中,所述药物制剂包含每剂量介于1微克与1毫克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在任何上述药物制剂实施方案的另一个实施方案中,所述药物制剂包含每剂量介于1微克与750微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在任何上述药物制剂实施方案的另一个实施方案中,所述药物制剂包含每剂量介于1微克与600微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在任何上述药物制剂实施方案的另一个实施方案中,所述药物制剂包含每剂量介于1微克与100微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在任何上述药物制剂实施方案的另一个实施方案中,所述药物制剂包含每剂量介于1微克与50微克之间的式(i)、式(ii)、式(iiia)或式(iiib)化合物。在一些实施方案中,所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0525]
在任何上述药物制剂实施方案的另一个实施方案中,每日施用所述药物制剂一次。在任何上述药物制剂实施方案的另一个实施方案中,每日施用所述药物制剂至少一次。在任何上述药物制剂实施方案的另一个实施方案中,每日施用所述药物制剂两次。在任何上述药物制剂实施方案的另一个实施方案中,每日施用所述药物制剂至少两次。在任何上述药物制剂实施方案的另一个实施方案中,每日施用所述药物制剂三次。在任何上述药物制剂实施方案的另一个实施方案中,每日施用所述药物制剂至少三次。在任何上述药物制
剂实施方案的另一个实施方案中,每日施用所述药物制剂四次。在任何上述药物制剂实施方案的另一个实施方案中,每日施用所述药物制剂至少四次。在任何上述药物制剂实施方案的另一个实施方案中,每日施用所述药物制剂五次。在任何上述药物制剂实施方案的另一个实施方案中,每日施用所述药物制剂至少五次。在任何上述药物制剂实施方案的另一个实施方案中,每日施用所述药物制剂六次。在任何上述药物制剂实施方案的另一个实施方案中,每日施用所述药物制剂至少六次。在任何上述药物制剂实施方案的另一个实施方案中,每日施用所述药物制剂七次。在任何上述药物制剂实施方案的另一个实施方案中,每日施用所述药物制剂至少七次。在任何上述药物制剂实施方案的另一个实施方案中,每日施用所述药物制剂八次。在任何上述药物制剂实施方案的另一个实施方案中,每日施用所述药物制剂至少八次。在任何上述药物制剂实施方案的另一个实施方案中,每日施用所述药物制剂九次。在任何上述药物制剂实施方案的另一个实施方案中,每日施用所述药物制剂至少九次。在任何上述药物制剂实施方案的另一个实施方案中,每日施用所述药物制剂十次。在任何上述药物制剂实施方案的另一个实施方案中,每日施用所述药物制剂至少十次。
[0526]
在任何上述药物制剂实施方案的另一个实施方案中,施用所述药物制剂一天。在任何上述药物制剂实施方案的另一个实施方案中,施用所述药物制剂至少两天。在任何上述药物制剂实施方案的另一个实施方案中,施用所述药物制剂至少三天。在任何上述药物制剂实施方案的另一个实施方案中,施用所述药物制剂至少四天。在任何上述药物制剂实施方案的另一个实施方案中,施用所述药物制剂至少五天。在任何上述药物制剂实施方案的另一个实施方案中,施用所述药物制剂至少七天。在任何上述药物制剂实施方案的另一个实施方案中,施用所述药物制剂至少十天。在任何上述药物制剂实施方案的另一个实施方案中,施用所述药物制剂至少十四天。在任何上述药物制剂实施方案的另一个实施方案中,施用所述药物制剂至少二十一天。在任何上述药物制剂实施方案的另一个实施方案中,施用所述药物制剂至少三十天。在一些实施方案中,所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0527]
在任何上述药物制剂实施方案的另一个实施方案中,在交替鼻孔中施用所述药物制剂。举例来说,在一个鼻孔中,接着在预定量的时间之后在另一个鼻孔中施用所述药物制剂。在另一个实施方案中,在两个鼻孔中施用所述药物制剂。举例来说,在一个鼻孔中,接着同时或在第一鼻孔之后立即在另一鼻孔中施用所述药物制剂。在另一个实施方案中,在一个鼻孔中施用所述药物制剂。在一些实施方案中,所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0528]
在某些实施方案中,施用本文中所描述的药物制剂以用于预防性和/或治疗性治疗。在某些治疗应用中,所述药物制剂以足以治愈或至少部分阻滞疾病或病状的至少一种症状的量施用给已罹患疾病或病状的患者。对此用途有效的量将视疾病或病状的严重程度和过程、先前疗法、患者的健康状态、体重和对药物的反应以及治疗医师的判断而定。任选地通过包括但不限于剂量递增临床试验的方法来确定治疗有效量。在一些实施方案中,所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0529]
在预防应用中,将本文中所描述的药物制剂施用给对特定疾病、病症或病状敏感或者处于风险下的患者。此种量定义为“预防有效量或剂量”。在此用途中,确切量还视患者
的健康状态、体重和其类似因素而定。当用于患者时,此用途的有效量将视疾病、病症或病状的严重程度和过程、先前疗法、患者的健康状态和对药物的反应以及治疗医师的判断而定。
[0530]
在某些实施方案中,其中患者的病状并未改善,在医生裁量后长期施用所述药物制剂,即,持续较长时间段,包括贯穿患者的生命持续时间,以便改善或以其他方式控制或限制患者疾病或病状的症状。
[0531]
在某些实施方案中,其中患者的状态并未改善,所施用的药物制剂剂量可暂时减少或暂时中断某一长度的时间(即,“药物假期”)。在特定实施方案中,药物假期的长度介于2天与1年之间,仅举例来说,包括2天、3天、4天、5天、6天、7天、10天、12天、15天、20天、28天或超过28天。仅举例来说,药物假期期间的剂量减少可为10%至100%,仅举例来说,包括10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%和100%。
[0532]
在某些实施方案中,所施用的药物制剂剂量可暂时减少或暂时中断某一长度的时间(即,“药物变更”)。在特定实施方案中,药物变更的长度介于2天与1年之间,仅举例来说,包括2天、3天、4天、5天、6天、7天、10天、12天、15天、20天、28天或超过28天。仅举例来说,药物变更期间的剂量减少可为10%至100%,仅举例来说,包括10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%和100%。在适合长度的时间之后,任选地恢复正常给药排程。
[0533]
在一些实施方案中,一旦患者的病状已出现改善,便在必要时施用维持剂量。随后,在特定实施方案中,随症状变化将施用剂量或频率或两者减至改善的疾病、病症或病状得以保持的水平。然而,在某些实施方案中,患者在症状的任何复发后均需要长期间歇性治疗。
[0534]
对应于此种量的指定药剂的量视诸多因素而变化,诸如特定药物制剂、疾病病状和其严重程度、需要治疗的受试者或宿主的特性(例如体重、性别),但仍可根据关于个例的特定情形来确定,包括例如正在施用的特定烟碱乙酰胆碱受体激动剂(即,式(i)、式(ii)、式(iiia)或式(iiib)化合物)、正在治疗的病状和正在治疗的受试者。
[0535]
如本文中所使用,药物制剂是指如本文中所描述的式(i)、式(ii)、式(iiia)或式(iiib)化合物与其他化学组分(即即,药学上可接受的非活性成分)的混合物,此类其他化学组分为诸如载体、赋形剂、粘合剂、填充剂、悬浮剂、崩解剂、分散剂、界面活性剂、润滑剂、着色剂、稀释剂、增溶剂、增湿剂、塑化剂、稳定剂、渗透增强剂、润湿剂、消泡剂、抗氧化剂、防腐剂或其一种或多种组合。在一些实施方案中,将本文中所描述的药物制剂与其他活性成分混合,如在组合疗法中。在一些实施方案中,所述药物制剂包括其他有治疗价值的物质。在其他实施方案中,所述药物制剂包括其他医用或药用试剂、载体、佐剂、防腐剂、稳定剂、润湿或乳化剂、溶解促进剂、用于调节渗透压的盐和/或缓冲剂。在一些实施方案中,所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0536]
在一些实施方案中,本文中所描述的药物制剂是指式(i)、式(ii)、式(iiia)或式(iiib)化合物与缓冲液的混合物。在一些实施方案中,本文中所描述的药物制剂是指式(i)、式(ii)、式(iiia)或式(iiib)化合物与磷酸盐缓冲液的混合物。在一些实施方案中,本文中所描述的药物制剂是指式(i)、式(ii)、式(iiia)或式(iiib)化合物与磷酸盐缓冲液的
混合物,其中所述磷酸盐缓冲液的ph值为约7.0。在一些实施方案中,本文中所描述的药物制剂是指式(i)、式(ii)、式(iiia)或式(iiib)化合物与磷酸盐-柠檬酸盐缓冲液的混合物。在一些实施方案中,本文中所描述的药物制剂是指式(i)、式(ii)、式(iiia)或式(iiib)化合物与磷酸盐-柠檬酸盐缓冲液的混合物,其中所述磷酸盐-柠檬酸盐缓冲液的ph值为约6.0。在一些实施方案中,本文中所描述的药物制剂是指式(i)、式(ii)、式(iiia)或式(iiib)化合物与磷酸盐-柠檬酸盐缓冲液的混合物。在一些实施方案中,本文中所描述的药物制剂是指式(i)、式(ii)、式(iiia)或式(iiib)化合物与磷酸盐-柠檬酸盐缓冲液的混合物,其中所述磷酸盐-柠檬酸盐缓冲液的ph值为约5.0。在一些实施方案中,所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0537]
所述药物制剂有助于向生物体施用所述化合物。在实施本文中所描述的方法时,治疗有效量的本文中所描述的式(i)、式(ii)、式(iiia)或式(iiib)化合物于药物制剂中施用患有欲治疗的疾病、病症或病状的哺乳动物。在一些实施方案中,所述哺乳动物为人。治疗有效量可视疾病的严重程度、受试者的年龄和相对健康状况、所使用的化合物的效力和其他因素而广泛变化。式(i)、式(ii)、式(iiia)或式(iiib)化合物可单独或与作为混合物组分的一种或多种治疗剂组合使用。在一些实施方案中,所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0538]
本文中所描述的药物制剂施用至受试者鼻腔中。本文中所描述的药物制剂包括但不限于液体、混悬剂、气雾剂、凝胶、软膏、干粉、乳膏、糊剂、洗剂或香膏。在一些实施方案中,所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0539]
以常规方式制造包括如本文中所描述的式(i)、式(ii)、式(iiia)或式(iiib)化合物的药物制剂。在一些实施方案中,所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0540]
所述药物制剂将包括呈游离酸或游离碱形式或者呈药学上可接受的盐形式的如本文中所描述的式(i)、式(ii)、式(iiia)或式(iiib)化合物作为活性成分。在一些实施方案中,所述式(i)、式(ii)、式(iiia)或式(iiib)化合物呈游离碱形式。在一些实施方案中,所述式(i)、式(ii)、式(iiia)或式(iiib)化合物呈药学上可接受的盐形式。在一些实施方案中,所述式(i)、式(ii)、式(iiia)或式(iiib)化合物呈游离碱形式。在一些实施方案中,所述式(i)、式(ii)、式(iiia)或式(iiib)化合物为hcl盐。在一些实施方案中,所述式(i)、式(ii)、式(iiia)或式(iiib)化合物为柠檬酸盐。在一些实施方案中,所述式(i)、式(ii)、式(iiia)或式(iiib)化合物为单柠檬酸盐。在一些实施方案中,所述式(i)、式(ii)、式(iiia)或式(iiib)化合物为粘酸盐。在一些实施方案中,所述式(i)、式(ii)、式(iiia)或式(iiib)化合物为半粘酸盐。在一些实施方案中,所述式(i)、式(ii)、式(iiia)或式(iiib)化合物为半粘酸盐单水合物。另外,本文中所描述的方法和药物制剂包括使用这些式(i)、式(ii)、式(iiia)或式(iiib)化合物的具有相同类型活性的n-氧化物(适当时)、结晶形式、非晶相以及活性代谢物。在一些实施方案中,本文中所描述的式(i)、式(ii)、式(iiia)或式(iiib)化合物可呈非溶剂合物形式或呈与诸如水、乙醇和其类似物的药学上可接受的溶剂的溶剂合物形式存在。本文中所提供的式(i)、式(ii)、式(iiia)或式(iiib)化合物的溶剂合物形式也被视为公开于本文中。在一些实施方案中,此类化合物可作为互变异构体存在。所有互变异构体均包括在本文中所提供的式(i)、式(ii)、式(iiia)或式(iiib)化合物的范
围内。在一些实施方案中,所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0541]
在一些实施方案中,式(i)、式(ii)、式(iiia)或式(iiib)化合物作为对映异构体、非对映异构体或其他立体异构体形式存在。本文中所公开的式(i)、式(ii)、式(iiia)或式(iiib)化合物包括所有对映异构体、非对映异构体和差向异构体形式以及其混合物。在一些实施方案中,所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0542]
在某些实施方案中,本文中所提供的药物制剂包括一种或多种防腐剂以抑制微生物活性。适合的防腐剂包括含汞物质,诸如硼酸苯汞和硫柳汞;稳定二氧化氯;和季铵化合物,诸如氯化苄烷铵、溴化十六烷基三甲基铵和氯化十六烷基吡啶。
[0543]
在一些实施方案中,本文中所描述的药物制剂受益于抗氧化剂、金属螯合剂、含硫醇化合物和其他通用稳定剂。此种稳定剂的实例包括但不限于:(a)约0.5%至约2%w/v甘油;(b)约0.1%至约1%w/v甲硫氨酸;(c)约0.1%至约2%w/v单硫代甘油;(d)约1mm至约10mmedta;(e)约0.01%至约2%w/v抗坏血酸;(f)0.003%至约0.02%w/v聚山梨醇酯80;(g)0.001%至约0.05%w/v聚山梨醇酯20;(h)精氨酸;(i)肝素;(j)聚葡萄糖硫酸酯;(k)环糊精;(1)戊聚糖聚硫酸酯和其他类肝素;(m)二价阳离子,诸如镁和锌;或(n)其组合。
[0544]
本文中所描述的药物制剂(包含式(i)、式(ii)、式(iiia)或式(iiib)化合物)被配制成任何适合的剂型,包括但不限于液体、混悬剂、气雾剂、凝胶、软膏、干粉、乳膏、糊剂、洗剂或香膏。本文中所描述的药物制剂(包含式(i)、式(ii)、式(iiia)或式(iiib)化合物)被配制成任何适合的剂型,通过注射器、滴管、瓶状雾化器、雾化泵、吸入器、喷粉装置、汽化器、贴片、施药棒、吸移管或液体喷射器施用至鼻腔中。在一些实施方案中,所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0545]
组合疗法
[0546]
在某些情况下,适于施用式(i)、式(ii)、式(iiia)或式(iiib)化合物与另一治疗剂的组合。在一些实施方案中,所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0547]
在一个实施方案中,本文中所描述的组合物和方法还适用于与由于对正在治疗的病状具有特定效用而选择的其他治疗剂联合使用。一般来说,本文中所描述的组合物与其他药剂(在采用组合疗法的实施方案中)不必于同一药物制剂或组合物中施用,且由于不同的物理和化学特征而通过不同的途径施用。在一个实施方案中,根据既定方案进行初始施用,接着基于所观测的效果,进一步调节剂量、施用模式和施用时间。
[0548]
在各种实施方案中,式(i)、式(ii)、式(iiia)或式(iiib)化合物与由于对正在治疗的病状具有特定效用而选择的其他治疗剂并行(例如同时、基本上同时或在同一治疗方案内)或相继施用。在某些实施方案中,基于对正在治疗的疾病和患者的状况的评估来确定各治疗剂在治疗方案期间的施用顺序和施用的重复次数。
[0549]
在一些实施方案中,式(i)、式(ii)、式(iiia)或式(iiib)化合物与用于治疗干眼病的另一治疗剂并行(例如同时、基本上同时或在同一治疗方案内)或相继施用。在一些实施方案中,式(i)、式(ii)、式(iiia)或式(iiib)化合物与点眼剂并行(例如同时、基本上同时或在同一治疗方案内)或相继施用。在一些实施方案中,式(i)、式(ii)、式
(iiia)或式(iiib)化合物与人工泪液并行(例如同时、基本上同时或在同一治疗方案内)或相继施用。在一些实施方案中,式(i)、式(ii)、式(iiia)或式(iiib)化合物与眼用类固醇并行(例如同时、基本上同时或在同一治疗方案内)或相继施用。
[0550]
对于本文中所描述的组合疗法,共施用化合物的剂量视所采用的共享药物类型、所采用的特定药物、正在治疗的疾病或病状等而变化。
[0551]
此种组合的个别化合物于单独或组合的药物制剂中相继或同时施用。在一个实施方案中,个别化合物将于组合的药物制剂中同时施用。本领域技术人员应了解已知治疗剂的适当剂量。
[0552]
本文中所提及的组合适宜呈药物组合物形式提供,以便与药学上可接受的稀释剂或载体一起使用。
[0553]
如本文中所使用,施用药剂组合包括所描述的药剂于单一组合物中或于组合疗法中施用,其中一种或多种药剂与至少一种其他药剂分开施用。
[0554]
在一些实施方案中,施用式(i)、式(ii)、式(iiia)或式(iiib)化合物与使用医疗装置的组合。在一些实施方案中,施用式(i)、式(ii)、式(iiia)或式(iiib)化合物与使用泪管栓塞的组合。
[0555]
例示性实施方案
[0556]
实施方案i-1.一种增加泪液产生的方法,其包括将治疗有效量的式(i)化合物局部施用至有需要的个体的鼻腔中,其中所述式(i)化合物结合至外周烟碱乙酰胆碱受体且所述式(i)化合物具有以下结构:
[0557][0558]
其中:
[0559]
波形线表示关于双键的e或z几何结构;
[0560]
x为n或cr3;
[0561]
r1为氢、c
1-6
烷基、卤素、-or4、-sr4或-nr5r6;
[0562]
r2为氢、c
1-6
烷基、芳基、-c
1-6
烷基-(芳基)、-芳基-(c
1-6
烷基)、杂芳基、-c
1-6
烷基-(杂芳基)、-杂芳基-(c
1-6
烷基)、杂环烷基、-c
1-6
烷基(杂环烷基)或环烷基;
[0563]
r3为氢、c
1-6
烷基、芳基、-c
1-6
烷基-(芳基)、-芳基-(c
1-6
烷基)、杂芳基、-c
1-6
烷基-(杂芳基)、-杂芳基-(c
1-6
烷基)、杂环烷基、-c
1-6
烷基(杂环烷基)、环烷基、-or7、-sr7、-nr8r9、-sor7或-so2r7,其中所述c
1-6
烷基、杂环烷基、杂芳基和芳基任选地被一个或多个选自以下的取代基取代:卤素、-cn、-no2、-nh2、-oh、-or7、-co2h、-c(o)or7、-o-c(o)r7、-nr8r9、-nhc(o)r7、-c(o)nr8r9、-sr7、-s(o)r7、-so2r7、-nhso2r7、-so2nr8r9、-c(s)nr8r9、-nhc(s)r7和-o-so2r7;
[0564]
r4、r5和r6独立地为氢或c
1-6
烷基;且
[0565]
r7、r8和r9为氢、c
1-6
烷基、芳基、-c
1-6
烷基-(芳基)、-芳基-(c
1-6
烷基)、杂芳基、-c
1-6
烷基-(杂芳基)、-杂芳基-(c
1-6
烷基)、杂环烷基、-c
1-6
烷基(杂环烷基)或环烷基,其中所述c1-6
烷基、杂环烷基、杂芳基和芳基任选地被一个或多个选自以下的取代基取代:f、cl、br、i、r
10
、-nr
10r11
、-cf3、-cn、-no2、-c2r
10
、-n3、-so2ch3、-or
10
、-sr
10
、-c(o)nr
10r11
、-nr
10
c(=o)r
10
、-c(=o)r
10
、-c(=o)or
10
、-(ch2)or
10
、-(ch2)2or
10
、-oc(=o)r
10
、-oc(=o)nr
10r11
和-nr
10
c(=o)or
10
;
[0566]r10
和r
11
独立地为氢、c
1-6
烷基、吡啶基、喹啉基、嘧啶基、嘧啶基、苯基或苯甲基;或
[0567]
r8和r9或r
10
和r
11
与其所连接的氮一起任选地形成杂环烷基环;
[0568]
p为1、2、3或4;且
[0569]
q为1、2或3;
[0570]
或其对映异构体、非对映异构体、互变异构体或药学上可接受的盐。
[0571]
实施方案i-2.一种治疗干眼的方法,其包括将治疗有效量的式(i)化合物局部施用至有需要的个体的鼻腔中,其中所述式(i)化合物结合至外周烟碱乙酰胆碱受体且所述式(i)化合物具有以下结构:
[0572][0573]
其中:
[0574]
波形线表示关于双键的e或z几何结构;
[0575]
x为n或cr3;
[0576]
r1为氢、c
1-6
烷基、卤素、-or4、-sr4或-nr5r6;
[0577]
r2为氢、c
1-6
烷基、芳基、-c
1-6
烷基-(芳基)、-芳基-(c
1-6
烷基)、杂芳基、-c
1-6
烷基-(杂芳基)、-杂芳基-(c
1-6
烷基)、杂环烷基、-c
1-6
烷基(杂环烷基)或环烷基;
[0578]
r3为氢、c
1-6
烷基、芳基、-c
1-6
烷基-(芳基)、-芳基-(c
1-6
烷基)、杂芳基、-c
1-6
烷基-(杂芳基)、-杂芳基-(c
1-6
烷基)、杂环烷基、-c
1-6
烷基(杂环烷基)、环烷基、-or7、-sr7、-nr8r9、-sor7或-so2r7,其中所述c
1-6
烷基、杂环烷基、杂芳基和芳基任选地被一个或多个选自以下的取代基取代:卤素、-cn、-no2、-nh2、-oh、-or7、-co2h、-c(o)or7、-o-c(o)r7、-nr8r9、-nhc(o)r7、-c(o)nr8r9、-sr7、-s(o)r7、-so2r7、-nhso2r7、-so2nr8r9、-c(s)nr8r9、-nhc(s)r7和-o-so2r7;
[0579]
r4、r5和r6独立地为氢或c
1-6
烷基;且
[0580]
r7、r8和r9为氢、c
1-6
烷基、芳基、-c
1-6
烷基-(芳基)、-芳基-(c
1-6
烷基)、杂芳基、-c
1-6
烷基-(杂芳基)、-杂芳基-(c
1-6
烷基)、杂环烷基、-c
1-6
烷基(杂环烷基)或环烷基,其中所述c
1-6
烷基、杂环烷基、杂芳基和芳基任选地被一个或多个选自以下的取代基取代:f、cl、br、i、r
10
、-nr
10r11
、-cf3、-cn、-no2、-c2r
10
、-n3、-so2ch3、-or
10
、-sr
10
、-c(o)nr
10r11
、-nr
10
c(=o)r
10
、-c(=o)r
10
、-c(=o)or
10
、-(ch2)or
10
、-(ch2)2or
10
、-oc(=o)r
10
、-oc(=o)nr
10r11
和-nr
10
c(=o)or
10
;
[0581]r10
和r
11
独立地为氢、c
1-6
烷基、吡啶基、喹啉基、嘧啶基、嘧啶基、苯基或苯甲基;或
[0582]
r8和r9或r
10
和r
11
与其所连接的氮一起任选地形成杂环烷基环;
[0583]
p为1、2、3或4;且
[0584]
q为1、2或3;
[0585]
或其对映异构体、非对映异构体、互变异构体或药学上可接受的盐。
[0586]
实施方案i-3.一种改善眼部不适的方法,其包括将治疗有效量的式(i)化合物局部施用至有需要的个体的鼻腔中,其中所述式(i)化合物结合至外周烟碱乙酰胆碱受体且所述式(i)化合物具有以下结构:
[0587][0588]
其中:
[0589]
波形线表示关于双键的e或z几何结构;
[0590]
x为n或cr3;
[0591]
r1为氢、c
1-6
烷基、卤素、-or4、-sr4或-nr5r6;
[0592]
r2为氢、c
1-6
烷基、芳基、-c
1-6
烷基-(芳基)、-芳基-(c
1-6
烷基)、杂芳基、-c
1-6
烷基-(杂芳基)、-杂芳基-(c
1-6
烷基)、杂环烷基、-c
1-6
烷基(杂环烷基)或环烷基;
[0593]
r3为氢、c
1-6
烷基、芳基、-c
1-6
烷基-(芳基)、-芳基-(c
1-6
烷基)、杂芳基、-c
1-6
烷基-(杂芳基)、-杂芳基-(c
1-6
烷基)、杂环烷基、-c
1-6
烷基(杂环烷基)、环烷基、-or7、-sr7、-nr8r9、-sor7或-so2r7,其中所述c
1-6
烷基、杂环烷基、杂芳基和芳基任选地被一个或多个选自以下的取代基取代:卤素、-cn、-no2、-nh2、-oh、-or7、-co2h、-c(o)or7、-o-c(o)r7、-nr8r9、-nhc(o)r7、-c(o)nr8r9、-sr7、-s(o)r7、-so2r7、-nhso2r7、-so2nr8r9、-c(s)nr8r9、-nhc(s)r7和-o-so2r7;
[0594]
r4、r5和r6独立地为氢或c
1-6
烷基;且
[0595]
r7、r8和r9为氢、c
1-6
烷基、芳基、-c
1-6
烷基-(芳基)、-芳基-(c
1-6
烷基)、杂芳基、-c
1-6
烷基-(杂芳基)、-杂芳基-(c
1-6
烷基)、杂环烷基、-c
1-6
烷基(杂环烷基)或环烷基,其中所述c
1-6
烷基、杂环烷基、杂芳基和芳基任选地被一个或多个选自以下的取代基取代:f、cl、br、i、r
10
、-nr
10r11
、-cf3、-cn、-no2、-c2r
10
、-n3、-so2ch3、-or
10
、-sr
10
、-c(o)nr
10r11
、-nr
10
c(=o)r
10
、-c(=o)r
10
、-c(=o)or
10
、-(ch2)or
10
、-(ch2)2or
10
、-oc(=o)r
10
、-oc(=o)nr
10r11
和-nr
10
c(=o)or
10
;
[0596]r10
和r
11
独立地为氢、c
1-6
烷基、吡啶基、喹啉基、嘧啶基、嘧啶基、苯基或苯甲基;或
[0597]
r8和r9或r
10
和r
11
与其所连接的氮一起任选地形成杂环烷基环;
[0598]
p为1、2、3或4;且
[0599]
q为1、2或3;
[0600]
或其对映异构体、非对映异构体、互变异构体或药学上可接受的盐。
[0601]
实施方案i-4.如实施方案i-1至i-3中任一项的方法,其中x为n。
[0602]
实施方案i-5.如实施方案i-1至i-4中任一项的方法,其中r2为氢。
[0603]
实施方案i-6.如实施方案i-1至i-5中任一项的方法,其中r1为氢、c
1-6
烷基、-or4或-nr5r6。
[0604]
实施方案i-7.如实施方案i-1至i-5中任一项的方法,其中r1为氢。
[0605]
实施方案i-8.如实施方案i-1至i-7中任一项的方法,其中q为1。
[0606]
实施方案i-9.如实施方案i-1至i-7中任一项的方法,其中p为2。
[0607]
实施方案i-10.如实施方案i-1至i-9中任一项的方法,其中波形线表示关于双键的e几何结构。
[0608]
实施方案i-11.如实施方案i-1至i-10中任一项的方法,其中所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶。
[0609]
实施方案i-12.如实施方案i-1至i-10中任一项的方法,其中所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶单柠檬酸盐。
[0610]
实施方案i-13.一种增加泪液产生的方法,其包括将治疗有效量的式(ii)化合物局部施用至有需要的个体的鼻腔中,其中所述式(ii)化合物结合至外周烟碱乙酰胆碱受体且所述式(ii)化合物具有以下结构:
[0611][0612]
其中:
[0613]
r1为c
1-6
烷基、c
2-6
烯基、c
2-6
炔基、c
3-8
杂环烷基、c
3-8
环烷基或杂芳基,其任选地被一个至三个独立地选自以下的非氢取代基取代:c
1-6
烷基、c
2-6
烯基、c
2-6
炔基、c
3-8
杂环烷基、c
3-8
环烷基、杂芳基、芳基、-c
1-6
烷基-(芳基)、-芳基-(c
1-6
烷基)、杂芳基、-c
1-6
烷基-(杂芳基)、-杂芳基-(c
1-6
烷基)、卤素、-cn、-no2、-or3、-nr4r5、-cf3、-c2r3、-sr3、-n3、-c(o)nr4r5、-nr4c(o)r3、-c(o)r3、-c(o)or3、-oc(o)r3、-oc(o)nr4r5、-nr4c(o)or3、-so2r3、-nr4so2r5和-so2nr4r5;
[0614]
r2为键或-ch
2-;
[0615]
r3为氢、c
1-6
烷基、c
3-8
环烷基、c
3-8
杂环烷基、芳基、-c
1-6
烷基-(芳基)、-芳基-(c
1-6
烷基)或杂芳基;且
[0616]
r4和r5独立地为氢、c
1-6
烷基、c
3-8
环烷基、c
3-8
杂环烷基、芳基、-c
1-6
烷基-(芳基)、-芳基-(c
1-6
烷基)或杂芳基;或r4和r5与其所连接的氮一起形成杂环烷基环;
[0617]
或其药学上可接受的盐。
[0618]
实施方案i-14.一种治疗干眼的方法,其包括将治疗有效量的式(ii)化合物局部施用至有需要的个体的鼻腔中,其中所述式(ii)化合物结合至外周烟碱乙酰胆碱受体且所述式(ii)化合物具有以下结构:
[0619][0620][0621]
其中:
[0622]
r1为c
1-6
烷基、c
2-6
烯基、c
2-6
炔基、c
3-8
杂环烷基、c
3-8
环烷基或杂芳基,其任选地被一个至三个独立地选自以下的非氢取代基取代:c
1-6
烷基、c
2-6
烯基、c
2-6
炔基、c
3-8
杂环烷基、c
3-8
环烷基、杂芳基、芳基、-c
1-6
烷基-(芳基)、-芳基-(c
1-6
烷基)、杂芳基、-c
1-6
烷基-(杂芳基)、-杂芳基-(c
1-6
烷基)、卤素、-cn、-no2、-or3、-nr4r5、-cf3、-c2r3、-sr3、-n3、-c(o)nr4r5、-nr4c(o)r3、-c(o)r3、-c(o)or3、-oc(o)r3、-oc(o)nr4r5、-nr4c(o)or3、-so2r3、-nr4so2r5和-so2nr4r5;
[0623]
r2为键或-ch
2-;
[0624]
r3为氢、c
1-6
烷基、c
3-8
环烷基、c
3-8
杂环烷基、芳基、-c
1-6
烷基-(芳基)、-芳基-(c
1-6
烷基)或杂芳基;且
[0625]
r4和r5独立地为氢、c
1-6
烷基、c
3-8
环烷基、c
3-8
杂环烷基、芳基、-c
1-6
烷基-(芳基)、-芳基-(c
1-6
烷基)或杂芳基;或r4和r5与其所连接的氮一起形成杂环烷基环;
[0626]
或其药学上可接受的盐。
[0627]
实施方案i-15.一种改善眼部不适的方法,其包括将治疗有效量的式(ii)化合物局部施用至有需要的个体的鼻腔中,其中所述式(ii)化合物结合至外周烟碱乙酰胆碱受体且所述式(ii)化合物具有以下结构:
[0628][0629]
其中:
[0630]
r1为c
1-6
烷基、c
2-6
烯基、c
2-6
炔基、c
3-8
杂环烷基、c
3-8
环烷基或杂芳基,其任选地被一个至三个独立地选自以下的非氢取代基取代:c
1-6
烷基、c
2-6
烯基、c
2-6
炔基、c
3-8
杂环烷基、c
3-8
环烷基、杂芳基、芳基、-c
1-6
烷基-(芳基)、-芳基-(c
1-6
烷基)、杂芳基、-c
1-6
烷基-(杂芳基)、-杂芳基-(c
1-6
烷基)、卤素、-cn、-no2、-or3、-nr4r5、-cf3、-c2r3、-sr3、-n3、-c(o)nr4r5、-nr4c(o)r3、-c(o)r3、-c(o)or3、-oc(o)r3、-oc(o)nr4r5、-nr4c(o)or3、-so2r3、-nr4so2r5和-so2nr4r5;
[0631]
r2为键或-ch
2-;
[0632]
r3为氢、c
1-6
烷基、c
3-8
环烷基、c
3-8
杂环烷基、芳基、-c
1-6
烷基-(芳基)、-芳基-(c
1-6
烷基)或杂芳基;且
[0633]
r4和r5独立地为氢、c
1-6
烷基、c
3-8
环烷基、c
3-8
杂环烷基、芳基、-c
1-6
烷基-(芳基)、-芳基-(c
1-6
烷基)或杂芳基;或r4和r5与其所连接的氮一起形成杂环烷基环;
[0634]
或其药学上可接受的盐。
[0635]
实施方案i-16.如实施方案i-13至i-15中任一项的方法,其中r1为任选地被一个至三个独立地选自以下的非氢取代基取代的杂芳基:c
1-6
烷基、c
2-6
烯基、c
2-6
炔基、c
3-8
杂环烷基、c
3-8
环烷基、杂芳基、芳基、-c
1-6
烷基-(芳基)、-芳基-(c
1-6
烷基)、杂芳基、-c
1-6
烷基-(杂芳基)、-杂芳基-(c
1-6
烷基)、卤素、-cn、-or3、-nr4r5、-cf3、-c(o)nr4r5、-nr4c(o)r3、-c(o)r3、-c(o)or3、-oc(o)r3、-oc(o)nr4r5、-nr4c(o)or3、-so2r3、-nr4so2r5和-so2nr4r5。
[0636]
实施方案i-17.如权利要求13至16中任一项的方法,其中r1为2-呋喃基、3-呋喃
基、2-噁唑基、4-噁唑基、5-噁唑基、3-异噁唑基、4-异噁唑基、5-异噁唑基、1,3,4-噁二唑-2-基、1,2,4-噁二唑-3-基、1,2,4-噁二唑-5-基、2-噻唑基、4-噻唑基、5-噻唑基、3-异噻唑基、4-异噻唑基、5-异噻唑基、1,3,4-噻二唑-2-基、1,2,4-噻二唑-3-基、1,2,4-噻二唑-5-基或4-吡啶基。
[0637]
实施方案i-18.如实施方案i-13至i-17中任一项的方法,其中r2为键。
[0638]
实施方案i-19.如实施方案i-13至i-17中任一项的方法,其中r2为-ch
2-。
[0639]
实施方案i-20.如实施方案i-13至i-17中任一项的方法,其中所述式(ii)化合物为n-(5-氯呋喃-2-基羰基)-3,7-二氮杂双环[3.3.0]辛烷。
[0640]
实施方案i-21.一种增加泪液产生的方法,其包括将治疗有效量的式(iiia)或式(iiib)化合物局部施用至有需要的个体的鼻腔中,其中所述式(iiia)或式(iiib)化合物结合至外周烟碱乙酰胆碱受体且所述式(iiia)或式(iiib)化合物具有以下结构:
[0641][0642]
其中:
[0643]
x为c(o)、c(s)或s(o)n;
[0644]
z为氢、c
1-6
烷基或c
1-6
卤代烷基;
[0645]
n为1或2;
[0646]
p为0或1;
[0647]
q为0或1;
[0648]
当p为1时,则q为0;
[0649]
当q为1时,则p为0;
[0650]
r1为-or3、-nr4r5、c
1-6
烷基、c
2-6
烯基、c
2-6
炔基、c
3-8
杂环烷基、c
3-8
环烷基、芳基或杂芳基,其中c
1-6
烷基、c
2-6
烯基、c
2-6
炔基、c
3-8
杂环烷基、c
3-8
环烷基、芳基或杂芳基任选地被一个至三个独立地选自以下的非氢取代基取代:c
1-6
烷基、c
2-6
烯基、c
2-6
炔基、c
3-8
杂环烷基、c
3-8
环烷基、杂芳基、芳基、-c
1-6
烷基-(芳基)、-芳基-(c
1-6
烷基)、杂芳基、-c
1-6
烷基-(杂芳基)、-杂芳基-(c
1-6
烷基)、卤素、-cn、-no2、-or3、-nr4r5、-cf3、-c2r3、-sr3、-n3、-c(o)nr4r5、-nr4c(o)r3、-c(o)r3、-c(o)or3、-oc(o)r3、-oc(o)nr4r5、-nr4c(o)or3、-so2r3、-nr4so2r5和-so2nr4r5;
[0651]
r2为-ch
2-或-ch2ch
2-;
[0652]
r3为氢、c
1-6
烷基、c
2-6
烯基、c
2-6
炔基、c
3-8
环烷基、c
3-8
杂环烷基、芳基、-c
1-6
烷基-(芳基)、-芳基-(c
1-6
烷基)或杂芳基;且
[0653]
r4和r5独立地为氢、c
1-6
烷基、c
2-6
烯基、c
2-6
炔基、c
3-8
环烷基、c
3-8
杂环烷基、芳基、-c
1-6
烷基-(芳基)、-芳基-(c
1-6
烷基)或杂芳基;或r4和r5与其所连接的氮一起形成杂环烷基环;
[0654]
或其药学上可接受的盐。
[0655]
实施方案i-22.一种治疗干眼的方法,其包括将治疗有效量的式(iiia)或式(iiib)化合物局部施用至有需要的个体的鼻腔中,其中所述式(iiia)或式(iiib)化合物结合至外周烟碱乙酰胆碱受体且所述式(iiia)或式(iiib)化合物具有以下结构:
[0656][0657][0658]
其中:
[0659]
x为c(o)、c(s)或s(o)n;
[0660]
z为氢、c
1-6
烷基或c
1-6
卤代烷基;
[0661]
n为1或2;
[0662]
p为0或1;
[0663]
q为0或1;
[0664]
当p为1时,则q为0;
[0665]
当q为1时,则p为0;
[0666]
r1为-or3、-nr4r5、c
1-6
烷基、c
2-6
烯基、c
2-6
炔基、c
3-8
杂环烷基、c
3-8
环烷基、芳基或杂芳基,其中c
1-6
烷基、c
2-6
烯基、c
2-6
炔基、c
3-8
杂环烷基、c
3-8
环烷基、芳基或杂芳基任选地被一个至三个独立地选自以下的非氢取代基取代:c
1-6
烷基、c
2-6
烯基、c
2-6
炔基、c
3-8
杂环烷基、c
3-8
环烷基、杂芳基、芳基、-c
1-6
烷基-(芳基)、-芳基-(c
1-6
烷基)、杂芳基、-c
1-6
烷基-(杂芳基)、-杂芳基-(c
1-6
烷基)、卤素、-cn、-no2、-or3、-nr4r5、-cf3、-c2r3、-sr3、-n3、-c(o)nr4r5、-nr4c(o)r3、-c(o)r3、-c(o)or3、-oc(o)r3、-oc(o)nr4r5、-nr4c(o)or3、-so2r3、-nr4so2r5和-so2nr4r5;
[0667]
r2为-ch
2-或-ch2ch
2-;
[0668]
r3为氢、c
1-6
烷基、c
2-6
烯基、c
2-6
炔基、c
3-8
环烷基、c
3-8
杂环烷基、芳基、-c
1-6
烷基-(芳基)、-芳基-(c
1-6
烷基)或杂芳基;且
[0669]
r4和r5独立地为氢、c
1-6
烷基、c
2-6
烯基、c
2-6
炔基、c
3-8
环烷基、c
3-8
杂环烷基、芳基、-c
1-6
烷基-(芳基)、-芳基-(c
1-6
烷基)或杂芳基;或r4和r5与其所连接的氮一起形成杂环烷基环;
[0670]
或其药学上可接受的盐。
[0671]
实施方案i-23.一种改善眼部不适的方法,其包括将治疗有效量的式(iiia)或式(iiib)化合物局部施用至有需要的个体的鼻腔中,其中所述式(iiia)或式(iiib)化合物结合至外周烟碱乙酰胆碱受体且所述式(iiia)或式(iiib)化合物具有以下结构:
[0672]
[0673]
其中:
[0674]
x为c(o)、c(s)或s(o)n;
[0675]
z为氢、c
1-6
烷基或c
1-6
卤代烷基;
[0676]
n为1或2;
[0677]
p为0或1;
[0678]
q为0或1;
[0679]
当p为1时,则q为0;
[0680]
当q为1时,则p为0;
[0681]
r1为-or3、-nr4r5、c
1-6
烷基、c
2-6
烯基、c
2-6
炔基、c
3-8
杂环烷基、c
3-8
环烷基、芳基或杂芳基,其中c
1-6
烷基、c
2-6
烯基、c
2-6
炔基、c
3-8
杂环烷基、c
3-8
环烷基、芳基或杂芳基任选地被一个至三个独立地选自以下的非氢取代基取代:c
1-6
烷基、c
2-6
烯基、c
2-6
炔基、c
3-8
杂环烷基、c
3-8
环烷基、杂芳基、芳基、-c
1-6
烷基-(芳基)、-芳基-(c
1-6
烷基)、杂芳基、-c
1-6
烷基-(杂芳基)、-杂芳基-(c
1-6
烷基)、卤素、-cn、-no2、-or3、-nr4r5、-cf3、-c2r3、-sr3、-n3、-c(o)nr4r5、-nr4c(o)r3、-c(o)r3、-c(o)or3、-oc(o)r3、-oc(o)nr4r5、-nr4c(o)or3、-so2r3、-nr4so2r5和-so2nr4r5;
[0682]
r2为-ch
2-或-ch2ch
2-;
[0683]
r3为氢、c
1-6
烷基、c
2-6
烯基、c
2-6
炔基、c
3-8
环烷基、c
3-8
杂环烷基、芳基、-c
1-6
烷基-(芳基)、-芳基-(c
1-6
烷基)或杂芳基;且
[0684]
r4和r5独立地为氢、c
1-6
烷基、c
2-6
烯基、c
2-6
炔基、c
3-8
环烷基、c
3-8
杂环烷基、芳基、-c
1-6
烷基-(芳基)、-芳基-(c
1-6
烷基)或杂芳基;或r4和r5与其所连接的氮一起形成杂环烷基环;
[0685]
或其药学上可接受的盐。
[0686]
实施方案i-24.如实施方案i-21至i-23中任一项的方法,其中p为1且q为0。
[0687]
实施方案i-25.如实施方案i-21至i-23中任一项的方法,其中p为0且q为1。
[0688]
实施方案i-26.如实施方案i-21至i-25中任一项的方法,其中r2为-ch
2-。
[0689]
实施方案i-27.如实施方案i-21至i-25中任一项的方法,其中r2为-ch2ch
2-。
[0690]
实施方案i-28.如实施方案i-21至i-27中任一项的方法,其中z为氢。
[0691]
实施方案i-29.如实施方案i-21至i-27中任一项的方法,其中z为c
1-6
烷基。
[0692]
实施方案i-30.如实施方案i-21至i-29中任一项的方法,其中x为c(o)。
[0693]
实施方案i-31.如实施方案i-1至i-30中任一项的方法,其中所述式(i)、式(ii)、式(iiia)或式(iiib)化合物不会以药理学相关的浓度越过血脑屏障。
[0694]
实施方案i-32.如实施方案i-1至i-31中任一项的方法,其中所述式(i)、式(ii)、式(iiia)或式(iiib)化合物选择性地结合至选自α3β4、α4β2和α7的外周烟碱乙酰胆碱受体亚型中的至少一者。
[0695]
实施方案i-33.如实施方案i-1至i-32中任一项的方法,其中所述式(i)、式(ii)、式(iiia)或式(iiib)化合物是以不具全身性生物可利用性的量施用。
[0696]
实施方案i-34.如实施方案i-1至i-33中任一项的方法,其中所述式(i)、式(ii)、式(iiia)或式(iiib)化合物选择性地结合至外周烟碱乙酰胆碱受体,其量不会引起不希望的精神副作用。
[0697]
实施方案i-35.如实施方案i-1至i-34中任一项的方法,其中所述式(i)、式(ii)、式(iiia)或式(iiib)化合物选择性地结合至外周烟碱乙酰胆碱受体,其量不会引起不希望的全身性副作用。
[0698]
实施方案i-36.如实施方案i-1至i-35中任一项的方法,其还包括局部施用防止或减少烟碱乙酰胆碱受体进入减敏状态或促进烟碱乙酰胆碱受体从减敏状态恢复的一种或多种物质。
[0699]
实施方案i-37.如实施方案i-36的方法,其中所述一种或多种物质选自蛋白激酶c(pkc)或者上调或向上调节pkc的因子、camp依赖性蛋白激酶(pka)或者上调或向上调节pka的因子和钙调磷酸酶抑制剂。
[0700]
实施方案i-38.如实施方案i-37的方法,其中所述钙调磷酸酶抑制剂选自环孢霉素、吡美莫司和他克莫司。
[0701]
实施方案i-39.如实施方案i-1至i-38中任一项的方法,其中在没有任何形式的烟碱的情况下施用所述式(i)、式(ii)、式(iiia)或式(iiib)化合物。
[0702]
实施方案i-40.如实施方案i-1至i-39中任一项的方法,其中将少于5毫克的所述式(i)、式(ii)、式(iiia)或式(iiib)化合物施用至鼻腔中。
[0703]
实施方案i-41.如实施方案i-1至i-39中任一项的方法,其中将介于500微克与5毫克之间的所述式(i)、式(ii)、式(iiia)或式(iiib)化合物施用至鼻腔中。
[0704]
实施方案i-42.如实施方案i-1至i-39中任一项的方法,其中将介于1毫克与2毫克之间的所述式(i)、式(ii)、式(iiia)或式(iiib)化合物施用至鼻腔中。
[0705]
实施方案i-43.如实施方案i-1至i-39中任一项的方法,其中将约1毫克的所述式(i)、式(ii)、式(iiia)或式(iiib)化合物施用至鼻腔中。
[0706]
实施方案i-44.如实施方案i-1至i-39中任一项的方法,其中将约1.5毫克的所述式(i)、式(ii)、式(iiia)或式(iiib)化合物施用至鼻腔中。
[0707]
实施方案i-45.如实施方案i-1至i-39中任一项的方法,其中将约2毫克的所述式(i)、式(ii)、式(iiia)或式(iiib)化合物施用至鼻腔中。
[0708]
实施方案i-46.如实施方案i-1至i-45中任一项的方法,其中每日施用所述式(i)、式(ii)、式(iiia)或式(iiib)化合物至少一次。
[0709]
实施方案i-47.如实施方案i-1至i-45中任一项的方法,其中每日施用所述式(i)、式(ii)、式(iiia)或式(iiib)化合物至少两次。
[0710]
实施方案i-48.如实施方案i-1至i-45中任一项的方法,其中每周施用所述式(i)、式(ii)、式(iiia)或式(iiib)化合物至少一次。
[0711]
实施方案i-49.如实施方案i-1至i-48中任一项的方法,其中将所述式(i)、式(ii)、式(iiia)或式(iiib)化合物呈液体、混悬剂、气雾剂、凝胶、软膏、干粉、乳膏、糊剂、洗剂或香膏形式施用至鼻腔中。
[0712]
实施方案i-50.如实施方案i-1至i-49中任一项的方法,其中通过注射器、滴管、瓶状雾化器、雾化泵、吸入器、喷粉装置、汽化器、贴片、施药棒、吸移管或液体喷射器将所述式(i)、式(ii)、式(iiia)或式(iiib)化合物施用至鼻腔中。
[0713]
实施方案i-51.如实施方案i-1至i-50中任一项的方法,其中使三叉神经活化。
[0714]
实施方案i-52.如实施方案i-51的方法,其中使筛前神经活化。
[0715]
实施方案i-53.如实施方案i-1至i-52中任一项的方法,其中使鼻泪反射活化。
[0716]
实施方案i-54.一种用于局部施用至个体鼻腔中的药物制剂,其包含被配制成(a)用于经鼻施用和(b)预防外周烟碱乙酰胆碱受体减敏的式(i)化合物,其中所述式(i)化合物具有以下结构:
[0717][0718]
其中:
[0719]
波形线表示关于双键的e或z几何结构;
[0720]
x为n或cr3;
[0721]
r1为氢、c
1-6
烷基、卤素、-or4、-sr4或-nr5r6;
[0722]
r2为氢、c
1-6
烷基、芳基、-c
1-6
烷基-(芳基)、-芳基-(c
1-6
烷基)、杂芳基、-c
1-6
烷基-(杂芳基)、-杂芳基-(c
1-6
烷基)、杂环烷基、-c
1-6
烷基(杂环烷基)或环烷基;
[0723]
r3为氢、c
1-6
烷基、芳基、-c
1-6
烷基-(芳基)、-芳基-(c
1-6
烷基)、杂芳基、-c
1-6
烷基-(杂芳基)、-杂芳基-(c
1-6
烷基)、杂环烷基、-c
1-6
烷基(杂环烷基)、环烷基、-or7、-sr7、-nr8r9、-sor7或-so2r7,其中所述c
1-6
烷基、杂环烷基、杂芳基和芳基任选地被一个或多个选自以下的取代基取代:卤素、-cn、-no2、-nh2、-oh、-or7、-co2h、-c(o)or7、-o-c(o)r7、-nr8r9、-nhc(o)r7、-c(o)nr8r9、-sr7、-s(o)r7、-so2r7、-nhso2r7、-so2nr8r9、-c(s)nr8r9、-nhc(s)r7和-o-so2r7;
[0724]
r4、r5和r6独立地为氢或c
1-6
烷基;且
[0725]
r7、r8和r9为氢、c
1-6
烷基、芳基、-c
1-6
烷基-(芳基)、-芳基-(c
1-6
烷基)、杂芳基、-c
1-6
烷基-(杂芳基)、-杂芳基-(c
1-6
烷基)、杂环烷基、-c
1-6
烷基(杂环烷基)或环烷基,其中所述c
1-6
烷基、杂环烷基、杂芳基和芳基任选地被一个或多个选自以下的取代基取代:f、cl、br、i、r
10
、-nr
10r11
、-cf3、-cn、-no2、-c2r
10
、-n3、-so2ch3、-or
10
、-sr
10
、-c(o)nr
10r11
、-nr
10
c(=o)r
10
、-c(=o)r
10
、-c(=o)or
10
、-(ch2)or
10
、-(ch2)2or
10
、-oc(=o)r
10
、-oc(=o)nr
10r11
和-nr
10
c(=o)or
10
;
[0726]r10
和r
11
独立地为氢、c
1-6
烷基、吡啶基、喹啉基、嘧啶基、嘧啶基、苯基或苯甲基;或
[0727]
r8和r9或r
10
和r
11
与其所连接的氮一起任选地形成杂环烷基环;
[0728]
p为1、2、3或4;且
[0729]
q为1、2或3;
[0730]
或其对映异构体、非对映异构体、互变异构体或药学上可接受的盐。
[0731]
实施方案i-55.如实施方案i-54的药物制剂,其中x为n。
[0732]
实施方案i-56.如实施方案i-54或实施方案i-55的药物制剂,其中r2为氢。
[0733]
实施方案i-57.如实施方案i-54至实施方案i-56中任一项的药物制剂,其中r1为氢、c
1-6
烷基、-or4或-nr5r6。
[0734]
实施方案i-58.如实施方案i-54至实施方案i-56中任一项的药物制剂,其中r1为氢。
[0735]
实施方案i-59.如实施方案i-54至实施方案i-58中任一项的药物制剂,其中q为1。
[0736]
实施方案i-60.如实施方案i-54至实施方案i-59中任一项的药物制剂,其中p为2。
[0737]
实施方案i-61.如实施方案i-54至实施方案i-60中任一项的药物制剂,其中波形线表示关于双键的e几何结构。
[0738]
实施方案i-62.如实施方案i-54至实施方案i-61中任一项的药物制剂,其中所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶。
[0739]
实施方案i-63.如实施方案i-54至实施方案i-61中任一项的药物制剂,其中所述式(i)化合物为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶单柠檬酸盐。
[0740]
实施方案i-64.一种用于局部施用至个体鼻腔中的药物制剂,其包含被配制成(a)用于经鼻施用和(b)预防外周烟碱乙酰胆碱受体减敏的式(ii)化合物,其中所述式(ii)化合物具有以下结构:
[0741][0742]
其中:
[0743]
r1为c
1-6
烷基、c
2-6
烯基、c
2-6
炔基、c
3-8
杂环烷基、c
3-8
环烷基或杂芳基,其任选地被一个至三个独立地选自以下的非氢取代基取代:c
1-6
烷基、c
2-6
烯基、c
2-6
炔基、c
3-8
杂环烷基、c
3-8
环烷基、杂芳基、芳基、-c
1-6
烷基-(芳基)、-芳基-(c
1-6
烷基)、杂芳基、-c
1-6
烷基-(杂芳基)、-杂芳基-(c
1-6
烷基)、卤素、-cn、-no2、-or3、-nr4r5、-cf3、-c2r3、-sr3、-n3、-c(o)nr4r5、-nr4c(o)r3、-c(o)r3、-c(o)or3、-oc(o)r3、-oc(o)nr4r5、-nr4c(o)or3、-so2r3、-nr4so2r5和-so2nr4r5;
[0744]
r2为键或-ch
2-;
[0745]
r3为氢、c
1-6
烷基、c
3-8
环烷基、c
3-8
杂环烷基、芳基、-c
1-6
烷基-(芳基)、-芳基-(c
1-6
烷基)或杂芳基;且
[0746]
r4和r5独立地为氢、c
1-6
烷基、c
3-8
环烷基、c
3-8
杂环烷基、芳基、-c
1-6
烷基-(芳基)、-芳基-(c
1-6
烷基)或杂芳基;或r4和r5与其所连接的氮一起形成杂环烷基环;
[0747]
或其药学上可接受的盐。
[0748]
实施方案i-65.如实施方案i-64的药物制剂,其中r1为任选地被一个至三个独立地选自以下的非氢取代基取代的杂芳基:c
1-6
烷基、c
2-6
烯基、c
2-6
炔基、c
3-8
杂环烷基、c
3-8
环烷基、杂芳基、芳基、-c
1-6
烷基-(芳基)、-芳基-(c
1-6
烷基)、杂芳基、-c
1-6
烷基-(杂芳基)、-杂芳基-(c
1-6
烷基)、卤素、-cn、-or3、-nr4r5、-cf3、-c(o)nr4r5、-nr4c(o)r3、-c(o)r3、-c(o)or3、-oc(o)r3、-oc(o)nr4r5、-nr4c(o)or3、-so2r3、-nr4so2r5和-so2nr4r5。
[0749]
实施方案i-66.如实施方案i-64或实施方案i-65的药物制剂,其中r1为2-呋喃基、3-呋喃基、2-噁唑基、4-噁唑基、5-噁唑基、3-异噁唑基、4-异噁唑基、5-异噁唑基、1,3,4-噁二唑-2-基、1,2,4-噁二唑-3-基、1,2,4-噁二唑-5-基、2-噻唑基、4-噻唑基、5-噻唑基、3-异噻唑基、4-异噻唑基、5-异噻唑基、1,3,4-噻二唑-2-基、1,2,4-噻二唑-3-基、1,2,4-噻二唑-5-基或4-吡啶基。
[0750]
实施方案i-67.如实施方案i-64至实施方案i-66中任一项的药物制剂,其中r2为键。
[0751]
实施方案i-68.如实施方案i-64至实施方案i-66中任一项的药物制剂,其中r2为-ch
2-。
[0752]
实施方案i-69.如实施方案i-64至实施方案i-66中任一项的药物制剂,其中所述式(ii)化合物为n-(5-氯呋喃-2-基羰基)-3,7-二氮杂双环[3.3.0]辛烷。
[0753]
实施方案i-70.一种用于局部施用至个体鼻腔中的药物制剂,其包含被配制成(a)用于经鼻施用和(b)预防外周烟碱乙酰胆碱受体减敏的式(iiia)或式(iiib)化合物,其中所述式(iiia)或式(iiib)化合物具有以下结构:
[0754][0755]
其中:
[0756]
x为c(o)、c(s)或s(o)n;
[0757]
z为氢、c
1-6
烷基或c
1-6
卤代烷基;
[0758]
n为1或2;
[0759]
p为0或1;
[0760]
q为0或1;
[0761]
当p为1时,则q为0;
[0762]
当q为1时,则p为0;
[0763]
r1为-or3、-nr4r5、c
1-6
烷基、c
2-6
烯基、c
2-6
炔基、c
3-8
杂环烷基、c
3-8
环烷基、芳基或杂芳基,其中c
1-6
烷基、c
2-6
烯基、c
2-6
炔基、c
3-8
杂环烷基、c
3-8
环烷基、芳基或杂芳基任选地被一个至三个独立地选自以下的非氢取代基取代:c
1-6
烷基、c
2-6
烯基、c
2-6
炔基、c
3-8
杂环烷基、c
3-8
环烷基、杂芳基、芳基、-c
1-6
烷基-(芳基)、-芳基-(c
1-6
烷基)、杂芳基、-c
1-6
烷基-(杂芳基)、-杂芳基-(c
1-6
烷基)、卤素、-cn、-no2、-or3、-nr4r5、-cf3、-c2r3、-sr3、-n3、-c(o)nr4r5、-nr4c(o)r3、-c(o)r3、-c(o)or3、-oc(o)r3、-oc(o)nr4r5、-nr4c(o)or3、-so2r3、-nr4so2r5和-so2nr4r5;
[0764]
r2为-ch
2-或-ch2ch
2-;
[0765]
r3为氢、c
1-6
烷基、c
2-6
烯基、c
2-6
炔基、c
3-8
环烷基、c
3-8
杂环烷基、芳基、-c
1-6
烷基-(芳基)、-芳基-(c
1-6
烷基)或杂芳基;且
[0766]
r4和r5独立地为氢、c
1-6
烷基、c
2-6
烯基、c
2-6
炔基、c
3-8
环烷基、c
3-8
杂环烷基、芳基、-c
1-6
烷基-(芳基)、-芳基-(c
1-6
烷基)或杂芳基;或r4和r5与其所连接的氮一起形成杂环烷基环;
[0767]
或其药学上可接受的盐。
[0768]
实施方案i-71.如实施方案i-70的药物制剂,其中p为1且q为0。
[0769]
实施方案i-72.如实施方案i-70的药物制剂,其中p为0且q为1。
[0770]
实施方案i-73.如实施方案i-70至实施方案i-72中任一项的药物制剂,其中r2为-ch
2-。
[0771]
实施方案i-74.如实施方案i-70至实施方案i-72中任一项的药物制剂,其中r2为-ch2ch
2-。
[0772]
实施方案i-75.如实施方案i-70至实施方案i-74中任一项的药物制剂,其中z为氢。
[0773]
实施方案i-76.如实施方案i-70至实施方案i-74中任一项的药物制剂,其中z为c
1-6
烷基。
[0774]
实施方案i-77.如实施方案i-70至实施方案i-76中任一项的药物制剂,其中x为c(o)。
[0775]
实施方案i-78.如实施方案i-54至实施方案i-77中任一项的药物制剂,其中所述式(i)、式(ii)、式(iiia)或式(iiib)化合物是以不会引起不希望的精神副作用的剂量的量进行配制。
[0776]
实施方案i-79.如实施方案i-54至实施方案i-78中任一项的药物制剂,其中所述式(i)、式(ii)、式(iiia)或式(iiib)化合物是以不具全身性生物可利用性的剂量的量进行配制。
[0777]
实施方案i-80.如实施方案i-54至实施方案i-79中任一项的药物制剂,其中所述式(i)、式(ii)、式(iiia)或式(iiib)化合物是以不会引起不希望的全身性副作用的剂量的量进行配制。
[0778]
实施方案i-81.如实施方案i-54至实施方案i-80中任一项的药物制剂,其还包含选自蛋白激酶c(pkc)或者上调或向上调节pkc的因子、camp依赖性蛋白激酶(pka)或者上调或向上调节pka的因子和钙调磷酸酶抑制剂的一种或多种物质。
[0779]
实施方案i-82.如实施方案i-81的药物制剂,其中所述钙调磷酸酶抑制剂选自环孢霉素、吡美莫司和他克莫司。
[0780]
实施方案i-83.如实施方案i-54至实施方案i-82中任一项的药物制剂,其中所述药物制剂不含呈任何形式的烟碱。
[0781]
实施方案i-84.如实施方案i-54至实施方案i-83中任一项的药物制剂,其中所述式(i)、式(ii)、式(iiia)或式(iiib)化合物选择性地结合至选自α3β4、α4β2和α7的外周烟碱乙酰胆碱受体亚型中的至少一者。
[0782]
实施方案i-85.如实施方案i-54至实施方案i-84中任一项的药物制剂,其中所述式(i)、式(ii)、式(iiia)或式(iiib)化合物包含约5mg/ml的所述烟碱乙酰胆碱受体激动剂。
[0783]
实施方案i-86.如实施方案i-54至实施方案i-84中任一项的药物制剂,其中所述式(i)、式(ii)、式(iiia)或式(iiib)化合物包含约10mg/ml的所述烟碱乙酰胆碱受体激动剂。
[0784]
实施方案i-87.如实施方案i-54至实施方案i-84中任一项的药物制剂,其包含每剂量少于5毫克的所述式(i)、式(ii)、式(iiia)或式(iiib)化合物。
[0785]
实施方案i-88.如实施方案i-54至实施方案i-84中任一项的药物制剂,其包含每剂量介于500微克与5毫克之间的所述式(i)、式(ii)、式(iiia)或式(iiib)化合物。
[0786]
实施方案i-89.如实施方案i-54至实施方案i-84中任一项的药物制剂,其包含每剂量介于1毫克与2毫克之间的所述式(i)、式(ii)、式(iiia)或式(iiib)化合物。
[0787]
实施方案i-90.如实施方案i-54至实施方案i-84中任一项的药物制剂,其包含每剂量约1毫克的所述式(i)、式(ii)、式(iiia)或式(iiib)化合物。
[0788]
实施方案i-91.如实施方案i-54至实施方案i-84中任一项的药物制剂,其包含每剂量约1.5毫克的所述式(i)、式(ii)、式(iiia)或式(iiib)化合物。
[0789]
实施方案i-92.如实施方案i-54至实施方案i-84中任一项的药物制剂,其包含每剂量约2毫克的所述式(i)、式(ii)、式(iiia)或式(iiib)化合物。
[0790]
实施方案i-93.如实施方案i-54至实施方案i-92中任一项的药物制剂,其中每日施用所述制剂至少一次。
[0791]
实施方案i-94.如实施方案i-54至实施方案i-92中任一项的药物制剂,其中每日施用所述制剂至少两次。
[0792]
实施方案i-95.如实施方案i-54至实施方案i-92中任一项的药物制剂,其中每周施用所述制剂至少一次。
[0793]
实施方案i-96.如实施方案i-50至实施方案i-92中任一项的药物制剂,其中所述制剂是呈液体、混悬剂、气雾剂、凝胶、软膏、干粉、乳膏、糊剂、洗剂或香膏形式施用至鼻腔中。
[0794]
实施方案i-97.如实施方案i-54至实施方案i-96中任一项的药物制剂,其中所述制剂是通过注射器、滴管、瓶状雾化器、雾化泵、吸入器、喷粉装置、汽化器、贴片、施药棒、吸移管或液体喷射器局部施用至鼻腔中。
[0795]
实施方案ii-1.一种增加泪液产生的方法,其包括向有需要的个体的鼻腔中局部施用治疗有效量的(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0796]
实施方案ii-2.一种治疗干眼的方法,其包括向有需要的个体的鼻腔中局部施用治疗有效量的(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0797]
实施方案ii-3.一种改善眼部不适的方法,其包括向有需要的个体的鼻腔中局部施用治疗有效量的(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0798]
实施方案ii-4.如实施方案ii-1至ii-3中任一项的方法,其中(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶是呈游离碱形式施用。
[0799]
实施方案ii-5.如实施方案ii-1至ii-3中任一项的方法,其中(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶是呈(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶的药学上可接受的盐的形式施用。
[0800]
实施方案ii-6.如实施方案ii-5的方法,其中所述药学上可接受的盐为粘酸盐或柠檬酸盐。
[0801]
实施方案ii-7.如实施方案ii-6的方法,其中所述药学上可接受的盐为粘酸盐。
[0802]
实施方案ii-8.如实施方案ii-6的方法,其中所述药学上可接受的盐为柠檬酸盐。
[0803]
实施方案ii-9.如实施方案ii-8的方法,其中所述药学上可接受的盐为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶单柠檬酸盐。
[0804]
实施方案ii-10.如实施方案ii-1至ii-3中任一项的方法,其中(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐的剂量介于每剂量500微克与10毫克之间。
((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐至少两次。
[0823]
实施方案ii-29.如实施方案ii-1至ii-26中任一项的方法,其中每周施用(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐至少一次。
[0824]
实施方案ii-30.如实施方案ii-1至ii-29中任一项的方法,其中(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐是呈液体、混悬剂、气雾剂、凝胶、软膏、干粉、乳膏、糊剂、洗剂或香膏的形式施用至鼻腔中。
[0825]
实施方案ii-31.如实施方案ii-1至ii-30中任一项的方法,其中(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐是通过注射器、滴管、瓶状雾化器、雾化泵、吸入器、喷粉装置、汽化器、贴片、施药棒、吸移管或液体喷射器施用至鼻腔中。
[0826]
实施方案ii-32.如实施方案ii-1至ii-31中任一项的方法,其中使三叉神经活化。
[0827]
实施方案ii-33.如实施方案ii-32的方法,其中使筛前神经活化。
[0828]
实施方案ii-34.如实施方案ii-1至ii-33中任一项的方法,其中使鼻泪反射活化。
[0829]
实施方案ii-35.如实施方案ii-1至ii-34中任一项的方法,其中所述(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐是于包含介于5mg/ml与200mg/ml之间的(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐的经鼻施用药物制剂中施用。
[0830]
实施方案ii-36.如实施方案ii-35的方法,其中所述经鼻施用药物制剂包含介于10mg/ml与75mg/ml之间的(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0831]
实施方案ii-37.如实施方案ii-36的方法,其中所述经鼻施用药物制剂包含介于10mg/ml与50mg/ml之间的(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0832]
实施方案ii-38.一种用于局部施用至个体鼻腔中的药物制剂,其包含(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐且被配制成经鼻施用。
[0833]
实施方案ii-39.如实施方案ii-38的药物制剂,其中(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶被配制为游离碱。
[0834]
实施方案ii-40.如实施方案ii-38的药物制剂,其中所述药学上可接受的盐为粘酸盐或柠檬酸盐。
[0835]
实施方案ii-41.如实施方案ii-40的药物制剂,其中所述药学上可接受的盐为粘酸盐。
[0836]
实施方案ii-42.如实施方案ii-40的药物制剂,其中所述药学上可接受的盐为柠檬酸盐。
[0837]
实施方案ii-43.如实施方案ii-42的药物制剂,其中所述柠檬酸盐为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶单柠檬酸盐。
[0838]
实施方案ii-44.如实施方案ii-38至ii-43中任一项的药物制剂,其中所述药物制剂被配制成施用介于每剂量500微克与10毫克之间的剂量。
[0839]
实施方案ii-45.如实施方案ii-38至ii-44中任一项的药物制剂,其中(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐是以不具全身性生物可利用性的剂量的量进行配制。
[0840]
实施方案ii-46.如实施方案ii-38至ii-44中任一项的药物制剂,其中(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐是以不会引起不希望的全身性副作用的剂量的量进行配制。
[0841]
实施方案ii-47.如实施方案ii-38至ii-46中任一项的药物制剂,其还包含一种或多种选自由以下各项组成的组的物质:蛋白激酶c(pkc)或者上调或向上调节pkc的因子、camp依赖性蛋白激酶(pka)或者上调或向上调节pka的因子和钙调磷酸酶抑制剂。
[0842]
实施方案ii-48.如实施方案ii-47的药物制剂,其中所述钙调磷酸酶抑制剂选自由以下各项组成的组:环孢霉素、吡美莫司和他克莫司。
[0843]
实施方案ii-49.如实施方案ii-38至ii-48中任一项的药物制剂,其中所述药物制剂不含呈任何形式的烟碱。
[0844]
实施方案ii-50.如权利要求38至49中任一项的药物制剂,其中所述药物制剂包含介于5mg/ml与200mg/ml之间的(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0845]
实施方案ii-51.如实施方案ii-50的药物制剂,其中所述药物制剂包含介于10mg/ml与75mg/ml之间的(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0846]
实施方案ii-52.如实施方案ii-51的药物制剂,其中所述药物制剂包含介于10mg/ml与50mg/ml之间的(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0847]
实施方案ii-53.如实施方案ii-38至ii-52中任一项的药物制剂,其包含每剂量介于500微克与5毫克之间的(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0848]
实施方案ii-54.如实施方案ii-38至ii-52中任一项的药物制剂,其包含每剂量少于5毫克的(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0849]
实施方案ii-55.如实施方案ii-38至ii-52中任一项的药物制剂,其包含每剂量介于1毫克与3毫克之间的(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0850]
实施方案ii-56.如实施方案ii-38至ii-52中任一项的药物制剂,其包含每剂量介于1毫克与2毫克之间的(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0851]
实施方案ii-57.如实施方案ii-38至ii-52中任一项的药物制剂,其包含每剂量约1毫克的(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0852]
实施方案ii-58.如实施方案ii-38至ii-52中任一项的药物制剂,其包含每剂量约1.5毫克的(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0853]
实施方案ii-59.如实施方案ii-38至ii-52中任一项的药物制剂,其包含每剂量约2毫克的(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0854]
实施方案ii-60.如实施方案ii-38至ii-59中任一项的药物制剂,其中所述药物制剂被配制成响应于症状按需施用。
[0855]
实施方案ii-61.如实施方案ii-38至ii-59中任一项的药物制剂,其中所述药物制剂被配制成每日施用至少一次。
[0856]
实施方案ii-62.如实施方案ii-38至ii-59中任一项的药物制剂,其中所述药物制剂被配制成每日施用两次。
[0857]
实施方案ii-63.如实施方案ii-38至ii-59中任一项的药物制剂,其中所述药物制
剂被配制成每周施用至少一次。
[0858]
实施方案ii-64.如实施方案ii-38至ii-63中任一项的药物制剂,其中所述药物制剂被配制为液体、混悬剂、气雾剂、凝胶、软膏、干粉、乳膏、糊剂、洗剂或香膏。
[0859]
实施方案ii-65.如实施方案ii-38至ii-64中任一项的药物制剂,其中所述药物制剂被配制成经由注射器、滴管、瓶状雾化器、雾化泵、吸入器、喷粉装置、汽化器、贴片、施药棒、吸移管或液体喷射器局部递送至鼻腔中。
[0860]
实施方案ii-66.一种治疗眼部病状的方法,其包括将治疗有效量的(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐局部施用至有需要的个体的鼻腔中,其中所述眼部病状为急性病状。
[0861]
实施方案ii-67.一种治疗眼部病状的方法,其包括将治疗有效量的(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐局部施用至有需要的个体的鼻腔中,其中所述眼部病状是由眼科手术程序或眼科治疗引起。
[0862]
实施方案iii-1.一种化合物(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐,其用于治疗干眼或眼部不适,所述化合物被施用至有需要的个体的鼻腔中。
[0863]
实施方案iii-2.一种化合物(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐,其用于治疗干眼或眼部不适,所述化合物被施用至有需要的个体的鼻腔中,且其中所述眼部病状是由眼科手术程序或眼科治疗引起。
[0864]
实施方案iii-3.如实施方案iii-1或iii-2的供使用的化合物,且其中(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐的剂量介于每剂量500微克与10毫克之间。
[0865]
实施方案iii-4.如任何前述实施方案的供使用的化合物,其中(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶是呈游离碱形式施用。
[0866]
实施方案iii-5.如任何前述实施方案的供使用的化合物,其中所述药学上可接受的盐为粘酸盐或柠檬酸盐。
[0867]
实施方案iii-6.如实施方案iii-5的供使用的化合物,其中所述药学上可接受的盐为(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶单柠檬酸盐。
[0868]
实施方案iii-7.如实施方案iii-1至iii-6中任一项的供使用的化合物,且其与防止或减少烟碱乙酰胆碱受体进入减敏状态或促进外周烟碱乙酰胆碱受体从减敏状态恢复的一种或多种物质一起施用。
[0869]
实施方案iii-8.如实施方案iii-7的供使用的化合物,其中所述一种或多种物质选自由以下各项组成的组:蛋白激酶c(pkc)或者上调或向上调节pkc的因子、camp依赖性蛋白激酶(pka)或者上调或向上调节pka的因子和钙调磷酸酶抑制剂。
[0870]
实施方案iii-9.如实施方案iii-8的供使用的化合物,其中所述钙调磷酸酶抑制剂选自由以下各项组成的组:环孢霉素、吡美莫司和他克莫司。
[0871]
实施方案iii-10如实施方案iii-1至iii-9中任一项的供使用的化合物,其在没有任何形式的烟碱的情况下施用。
[0872]
实施方案iii-11.如实施方案iii-1至iii-10中任一项的供使用的化合物,其是以介于500微克与5毫克之间的量施用。
[0873]
实施方案iii-12.如实施方案iii-1至iii-11中任一项的供使用的化合物,其是以
少于5毫克的量施用。
[0874]
实施方案iii-13.如实施方案iii-1至iii-11中任一项的供使用的化合物,其是以介于1毫克与3毫克之间的量施用。
[0875]
实施方案iii-14.如实施方案iii-1至iii-11中任一项的供使用的化合物,其是以介于500微克与5毫克之间的量施用。
[0876]
实施方案iii-15.如实施方案iii-1至iii-11中任一项的供使用的化合物,其是以介于1毫克与2毫克之间的量施用。
[0877]
实施方案iii-16.如实施方案iii-1至iii-11中任一项的供使用的化合物,其是以约1毫克的量施用。
[0878]
实施方案iii-17.如实施方案iii-1至iii-11中任一项的供使用的化合物,其是以约1.5毫克的量施用。
[0879]
实施方案iii-18.如实施方案iii-1至iii-11中任一项的供使用的化合物,其是以约2毫克的量施用。
[0880]
实施方案iii-19.如实施方案iii-1至iii-18中任一项的供使用的化合物,其是每日施用至少一次。
[0881]
实施方案iii-20.如实施方案iii-1至iii-18中任一项的供使用的化合物,其是每日施用至少两次。
[0882]
实施方案iii-21.如实施方案iii-1至iii-18中任一项的供使用的化合物,其是每周施用至少一次。
[0883]
实施方案iii-22.如实施方案iii-1至iii-21中任一项的供使用的化合物,其是呈液体、混悬剂、气雾剂、凝胶、软膏、干粉、乳膏、糊剂、洗剂或香膏的形式施用至鼻腔中。
[0884]
实施方案iii-23.如实施方案iii-1至iii-21中任一项的供使用的化合物,其是通过注射器、滴管、瓶状雾化器、雾化泵、吸入器、喷粉装置、汽化器、贴片、施药棒、吸移管或液体喷射器施用至鼻腔中。
[0885]
实施方案iii-24.如实施方案iii-1至iii-23中任一项的供使用的化合物,其是于包含介于5mg/ml与200mg/ml之间的量的(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐的经鼻施用药物制剂中施用。
[0886]
实施方案iii-25.如实施方案iii-24的供使用的化合物,其中所述经鼻施用药物制剂包含介于10mg/ml与75mg/ml之间的(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0887]
实施方案iii-26.如实施方案iii-24的供使用的化合物,其中所述经鼻施用药物制剂包含介于10mg/ml与50mg/ml之间的(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0888]
实施方案iii-27.一种用于治疗干眼或眼部不适的药物制剂,所述制剂包含(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶或其药学上可接受的盐。
[0889]
实施方案iii-28.一种根据实施方案iii-27使用的药物制剂,其中所述制剂包含如实施方案iii-1至iii-25中任一项中所定义的化合物。
[0890]
实施例
[0891]
以下特定实施例应被视为仅具说明性,且无论如何均不以任何方式限制本公开的
其余部分。
[0892]
实施例1:用以评估经鼻施用(r)-5-((e)-2-吡咯烷-3-基乙烯基)嘧啶(化合物1)对治疗干眼病(ded)的安全性和效力的临床试验
[0893]
目的:此研究评估化合物1 0.1%鼻用喷雾(oc-01)用于治疗成年患者的中度至严重ded的用途。此研究将研究使用oc-01诱导水性泪液产生和减轻ded症状的安全性和效力。
[0894]
患者:将征募患有中度至严重干眼且满足以下包括和排除准则的总计30名参与者。
[0895]
准则:
[0896]
纳入:
[0897]
·
年龄≥18岁的男性和女性
[0898]
·
愿意签署知情同意且被认为能够顺应研究方案的要求
[0899]
·
在第1次筛选访问时,至少一只眼睛的修门氏泪液测试(在局部麻醉的情况下)≤10mm/5分钟;
[0900]
·
在第1次筛选访问时,至少一只眼睛的修门氏测试(在局部麻醉和用棉拭子进行鼻刺激的情况下)比未受刺激的值高出至少7mm;
[0901]
·
基线眼表面疾病指数评分为至少23,在第一次筛选访问时有不超过3个反应“不适用”[0902]
·
正常眼睑/眼睫解剖学、眨眼功能和闭合
[0903]
排除:
[0904]
·
慢性或复发性鼻出血
[0905]
·
在过去1年内使用烟草或烟碱产品(香烟、雪茄、电子香烟)
[0906]
·
可能导致流血增加的凝固障碍,诸如血友病和血小板减少症
[0907]
·
泪腺、鼻或窦肿瘤形成或重大创伤;先前泪腺、鼻或窦手术或摘除术导致腺或鼻通道去神经化,如在棉拭子鼻刺激的情况下缺乏反应所证明。
[0908]
·
严重鼻气道堵塞(例如严重鼻中隔弯曲或下鼻甲肥大)
[0909]
·
距第一次筛选访问3个月内在任一只眼睛中进行眼部手术(诸如屈光手术或白内障手术);
[0910]
·
不稳定或研究者判断与参与研究或与研究所需的频繁评定不相容的全身性病状或疾病(例如,当前全身性感染、不受控制的自体免疫疾病、不受控制的免疫缺乏病、心肌梗塞史、不受控制的高血压等)
[0911]
·
任一只眼睛中可能会干扰研究结果解读或患者安全的任何眼部病症或病状的历史或存在,诸如明显角膜或结膜瘢痕、翼状胬肉或结节性睑裂斑;当前眼部感染或与干眼不相关的炎症;临床上显著的前(上皮)基底膜角膜营养不良或其他临床上显著的角膜营养不良或退化;临床上显著的睑缘炎;眼部疱疹感染等。
[0912]
·
已知对研究药物中会接触鼻粘膜的任何程序性药剂或材料过敏。
[0913]
·
在初步筛选时需要治疗(即,抗组织胺、去充血剂、口服或气雾剂类固醇)的活性或不受控制型严重全身性过敏、慢性季节性过敏、鼻炎或窦炎
[0914]
·
当前正在进行已知会引起眼部干燥的任何药物疗法(例如环孢霉素、抗组胺剂、三环抗抑郁剂、抗焦虑剂、抗毒蕈碱剂、β阻断剂、利尿剂、吩噻嗪、类固醇等),在第一次筛选
访问前未按稳定给药方案使用30天
[0915]
·
可溶性泪管栓塞(具有聚硅氧烷栓塞或泪管永久堵塞的参与者为合格的)
[0916]
·
主动隐形眼镜使用,除非第一次筛选访问前至少7天和研究持续时间内中止
[0917]
·
在过去3个月期间参与任何利用新活性物质或新装置的临床试验
[0918]
·
在研究开始时怀孕、计划怀孕或哺乳的妇女。将对育龄妇女施用尿液妊娠测试。
[0919]
·
已知对化合物1过敏或有不良反应。
[0920]
·
此研究过程中在研究者看来想要求患者寻求紧急医学治疗的任何不稳定或不受控制的心脏、肺、肾、肿瘤学、神经病学、代谢或其他全身性病状。此包括但不限于心脏心律不整、高血压、凝血病、肾衰竭和糖尿病。
[0921]
纳入/排除例外:
[0922]
研究者在其认为符合患者的最大利益时有权排除任何患者参与研究。
[0923]
纳入/排除准则的次要例外情况应提交至主办者且有望批准在需要时通知医学监测结果。
[0924]
影响患者安全/权利或数据有效性的主要例外情况应由研究者迅速报告给irb/ec。
[0925]
主要结果:此研究的设计将使得能够关于oc-01和泪液产生进行以下测量:
[0926]
·
与单次剂量oc-01相关的泪液产生变化
[0927]
次要结果:此研究的设计将使得能够关于oc-01和泪液产生进行以下测量:
[0928]
·
与单次剂量媒介物相关的泪液产生变化
[0929]
·
与单次剂量oc-01相关的症状变化
[0930]
·
与单次剂量oc-01相关的症状减轻持续时间
[0931]
·
与单次剂量媒介物相关的症状变化
[0932]
·
与单次剂量媒介物相关的症状减轻持续时间
[0933]
总之,这些比较将提供关于oc-01用于在干眼病患者中增加泪液产生的安全性和效力的有价值信息。
[0934]
此研究的主要安全性终点为发病率和不良事件(ae)相关性。将提供不良事件的描述性统计数据,同样将提供任何严重、意外或药物相关ae的叙说。在研究期间,出于患者安全安全考虑,将由合格专业人员监测鼻通道的完整性。
[0935]
研究设计:此研究为用于评估化合物10.1%鼻用喷雾在中度至严重干眼参与者中的安全性和效力的前瞻性单臂交叉研究。将征募多达30名参与者并追踪七天持续时间。0.1%鼻用喷雾是指在从其中汲出剂量的容器中的浓度。
[0936]
在第一次筛选访问时,所有合格参与者均愿意在研究持续时间内停止使用其当前人工泪液或润滑点眼液,且将提供单位剂量无防腐剂人工泪液以在其干眼症状无法忍受时使用。将在每一次研究访问时收集空单位剂量小瓶并计数。将告知患者在鼻用药物施用30分钟内或在研究访问2小时内不使用人工泪液。
[0937]
在第二次筛选访问/研究第0天时,将测试所有合格参与者对两种鼻用制剂的反应:oc-01和媒介物对照。将在递送各鼻内剂量之前和之后立即使用琼斯
·
修门氏测试评定两只眼睛的泪液产生。将随机指定各患者接受oc-01和媒介物制剂的顺序,且患者和检查人员将对鼻用制剂的特性不知情。泪液产生评定后至少90分钟,将评定响应于递送两种鼻用
制剂中的每一种的症状变化。症状评定将使用充分确立的环境挑战模型,即,由biocentric developments,llc制造的climatears护目镜系统来进行。
[0938]
在第0天进行测试之后,所有患者将收到一瓶oc-01以带回家且在第1天和第6天每日自我施用一次。在第7天,患者将返回门诊,在此将再次评定其在施用每一种鼻用制剂的情况下的泪液产生和症状。
[0939]
泪液评定
[0940]
将按所示顺序进行以下眼表面和泪膜评定:
[0941]
眼表面染色-使用荧光素进行角膜染色
[0942]
将评定使用荧光素和丽丝胺绿的眼表面染色且使用国家眼科研究所分级系统记录在病例报告表上每只眼睛的5个角膜区和6个结膜区的示意性图示中。病例报告表(crf)上包括图示性和描述性分级量表(等级0至3)。
[0943]
1.将使用1.0mg荧光素钠试片来评定角膜染色。
[0944]
2.在用一滴缓冲生理盐水润湿试片的末端后,利用急速轻弹将过量生理盐水振荡至废物箱中。
[0945]
3.接着将下眼睑拉下并且将顶端的平端轻轻施加至下脸板结膜,意图滴注极小体积的染料且不诱导反射性流泪。
[0946]
4.将告知患者自然地眨眼数次,而不强制闭合眼睑来分布荧光素。
[0947]
5.在允许荧光素保留在眼睛上至少一分钟之后,将使用使荧光观察最大化的黄色(wratten#12)屏障滤光片连同钴(蓝色)滤光片对5个角膜区域进行分等级。稍微掀起上眼睑以便对整个角膜表面进行分等级。为了增强对比,使黄色屏障滤光片位于反射光路径中(而非在入射光路径中)。
[0948]
泪膜破裂时间(tfbut)
[0949]
将使用狭缝灯活组织显微镜检查法根据以下步骤来评定tfbut:
[0950]
1.将狭缝灯设定至约10倍放大倍数。
[0951]
2.在充分荧光素就位(优选使用det试片)的情况下,将要求受试者笔直向前凝视而不眨眼,直至告知不必如此。所述测试应在室内在患者面上无直接空气的情况下进行。
[0952]
3.将使用秒表来记录最后一次完成眨眼与第一次出现指示泪膜破裂的生长微胶束之间的时间。
[0953]
注意:如果患者在泪膜破裂发展之前过早眨眼,则检查人员将继续试图获得读数。
[0954]
4.一旦观察到tfbut,便告知患者自由地眨眼。接着将在同一只眼睛上第二次重复此测试。
[0955]
5.如果第一读数与第二读数之间的差异相差超过两秒,则应进行第三次测量并记录。
[0956]
6.接着将在另一只眼睛中进行此程序。
[0957]
7.推荐在室内在约18℃的温度与约50%的湿度下进行tfbut。
[0958]
眼表面染色-使用丽丝胺绿的结膜染色
[0959]
将利用丽丝胺绿结膜染色来完成眼表面染色评定。
[0960]
1.将丽丝胺绿眼科试片用缓冲生理盐水润湿并施用至下睑板结膜。应小心地滴注充足染料。
[0961]
2.允许丽丝胺绿保留在眼睛上一分钟之后,将对六个鼻和颞结膜区进行分等级。
[0962]
3.为了对颞区进行分等级,应告知受试者看向鼻;为了对鼻区进行分等级,应告知受试者看向颞。
[0963]
4.接着将在另一只眼睛中完成此程序。
[0964]
修门氏测试
[0965]
在第1次筛选访问时,将进行一次基础琼斯
·
修门氏测试,继而进行利用棉拭子鼻刺激的修门氏测试。利用局部麻醉剂的琼斯
·
修门氏测试将用于评定泪液产生,使用以下步骤:
[0966]
1.诸如0.5%丙对卡因盐酸盐或等效物(akorn,lake forest,il)的局部麻醉点眼剂应滴注在患者的双眼中。
[0967]
2.将告知患者保持眼睛轻轻闭合一分钟。
[0968]
3.在睁开眼睛且允许眼睛再重新闭上约一分钟之后,用棉头涂药器轻轻地移除下穹窿中的过量水分。
[0969]
4.将修门氏试片(35mm
×
5mm尺寸滤纸试片)放在每一只眼睛中下眼睑中间三分之一与侧向三分之一的连接处。
[0970]
5.在环境光下,将告知患者在测试过程中正常地向前看和眨眼。所述测试应在室内在患者面上无直接空气的情况下进行。
[0971]
6.五分钟之后,将从双眼移出试片并且将记录润湿的量。应将试片用胶带贴至crf。注意:如果5分钟终点之前修门氏评分达到最大值,则可移出试片且记录其达到最大值所耗费的时间。然而,不应从对侧眼睛移出试片,直至其也在5分钟终点前达到最大评分。
[0972]
7.在进行多次修门氏测试时,应视需要添加新麻醉点眼剂。
[0973]
使用棉拭子鼻刺激的修门氏测试
[0974]
1.在第1次筛选访问时,将使用棉拭子鼻刺激来进行修门氏测试。在新试片就位的情况下,检查人员将在参与者的两个鼻孔中同时插入棉拭子且轻轻地探测两个中鼻甲约30秒。此后,检查人员可仅保持拭子就位,施加轻微压力,且视需要间歇性地重复探测。
[0975]
2.替代地,可告知参与者手持棉拭子且同时轻轻地探测两个鼻甲,在再次探测之前间歇性地休息。检查人员将连续指导参与者如何适当地进行此测试。
[0976]
3.修门氏试片将保持就位,直至已逝去五分钟或其已达到最大评分。
[0977]
将记录两个修门氏评分且验证其满足纳入准则。在进行两次修门氏测试时,应视需要滴注新麻醉点眼剂。
[0978]
利用两种鼻用喷雾应用中的每一者的修门氏测试
[0979]
在两种鼻用喷雾应用中的每一者的情况下,利用局部麻醉剂的琼斯
·
修门氏测试将用于评定泪液产生,使用以下步骤:
[0980]
1.对于每一种应用,诸如0.5%丙对卡因盐酸盐或等效物的局部麻醉点眼剂将滴注在参与者的双眼中。
[0981]
2.将告知参与者保持眼睛轻轻闭合一分钟。
[0982]
3.在睁开眼睛且再允许眼睛再重新闭上约一分钟之后,用矛状体轻轻地移除下穹窿中的过量水分。
[0983]
4.将修门氏试片(35mm
×
5mm尺寸滤纸试片)放在每一只眼睛中下眼睑中间三分之
一与侧向三分之一的连接处。
[0984]
5.在环境光下,将告知参与者在测试过程中正常地向前看和眨眼。所述测试应在室内在参与者面上无直接空气的情况下进行。
[0985]
6.五分钟之后,将从双眼移出试片并且将记录润湿的量。应将试片用胶带贴至crf。
[0986]
干眼刺激和症状评定
[0987]
将使用climatears护目镜系统(biocentric developments,llc)来降低眼周湿度并且在患者中诱导干眼症状。此系统设计用于标准化干眼患者临床研究的测试条件的目的。
[0988]
患者将连续配戴climatears护目镜多达90分钟,在测试时段期间每5分钟经由视觉模拟量表(vas)记录其症状。将要求受试者通过在水平线上置放垂直标记以指示不适水平来对其干燥症状(同时两只眼睛)进行分级。0对应于“无干燥”,且5对应于“最大干燥”。量表的评定线长度将为100mm。
[0989]
存在许多干眼症状,包括干燥、粘感、灼热、异物感、瘙痒、视力模糊、光敏感性和疼痛。请通过在以下在线绘出垂直线来对您当前“干燥”症状(而非其他)的严重程度进行分级:
[0990][0991]
在第0天,患者将开始配戴护目镜并且进行监测,直至其两个连续测量值达到45mm以上的症状评分,此时其将随机接受一剂量的oc-01鼻用喷雾或对照鼻用喷雾(安慰剂(oc-01媒介物鼻用喷雾)),在两个连续45mm测量值之后2.5分钟施用。将继续监测症状,直至患者的两个连续测量值再次达到45mm以上的评分,此时所述患者将接受第二鼻剂量的其第一次未接受的任何测试物品。在第二鼻剂量之后,将再次监测症状,直至患者的两个连续测量值达到45mm以上的评分。届时,将移除护目镜且测试将结束。如果仍继续,则测试将在暴露于护目镜环境90分钟之后终止。在此时段结束时,将要求各患者决定所制造的何种鼻用喷雾对其干眼症状提供更大程度的减轻作用。
[0992]
在第7天,患者将开始配戴护目镜且进行监测,直至其两个连续测量值达到45mm以上的症状评分,此时其将接受一剂量的oc-01鼻用喷雾。将继续监测症状,直至患者的两个连续测量值再次达到45mm以上的评分,此时将移除护目镜且测试将结束。如果仍继续,则测试将在暴露于护目镜环境90分钟之后终止。
[0993]
进入时具有超过45mm的基线症状评分的患者将具有等于此基线评分的治疗临限值,且将因此在大于或等于此值的两个连续症状测量值之后接受治疗。
[0994]
在测试开始之前和施用任一鼻用喷雾后、记录症状值之前给患者阅读说明(上文粗体)。
[0995]
实施例2:oc-01制剂
[0996]
oc-01含有处于由137mm氯化钠、2.7mm氯化钾和10mm磷酸盐缓冲液ph 7.4组成而无防腐剂的无菌磷酸盐缓冲生理盐水(pbs)中的0.1%w/v化合物1。所述制剂包装在20ml不透明聚乙烯鼻用喷雾瓶中,由此递送50微升的单位剂量。以相同包装供应媒介物对照。oc-01和媒介物两者均用表示包装内含物的代码加以标记,参与者或不知情研究人员将不知道包装内含物。
[0997]
实施例3:其他药物制剂
[0998]
为了制备适于经鼻施用的药物制剂,将50mg式(i)、式(ii)、式(iiia)或式(iiib)化合物溶解于10ml规定媒介物中。将1ml此溶液稀释于9ml媒介物中以获得“0.1x稀释”制剂。第一次稀释后,将1ml所述“0.1x稀释”制剂稀释于9ml媒介物中以获得“0.01x稀释”制剂。将具有不同浓度的烟碱乙酰胆碱受体激动剂的三种制剂储存在4℃下。
[0999]
实施例4:化合物1:具有抗异常疼痛活性的口服有效性选择性α4β2神经元烟碱受体激动剂
[1000]
本文中所报告的结果汇总新颖选择性α4β2 nnr激动剂化合物1的体外和体内概况,其显示有望用于在人体中进行神经性疼痛控制的总体临床前药物概况。化合物1对α4β2具有高结合亲和力(ki=27nm),且与烟碱相比,在α7 nnr或α3β2或α3β4 nachr下展现实质上较弱的活性。在功能上,显示化合物1在α4β2受体下(120%)和在da释放模型中(e
max
=烟碱的114%)为激动剂。此外,电生理学研究指示,化合物1在高敏感性和低敏感性含α4β2的nnr亚型下具有激动剂活性。其在口服施用后容易吸收且具有良好药代动力学性质。化合物1在急性和重复施用后在促进抗异常疼痛方面具有活性,在神经性疼痛动物模型中显示出有效性。特定来说,当急性施用(0.1和1mg/kg;口服)和重复施用(0.1-10mg/kg;口服)后,化合物1在糖尿病性神经病变模型(stz诱导)中显著逆转触觉异常疼痛。化合物1在化学疗法诱导的神经病模型(太平洋紫杉醇诱导;0.01-1mg/kg,口服)中在逆转触觉异常疼痛方面也是有效的。与加巴喷丁(gabapentin)相比,化合物1展现更快速的作用开始(即,30分钟)以及相当的效力和作用持续时间。所述化合物在临床前安全性研究,包括体外和体内心血管研究、急性和14天重复剂量研究、权威性90天研究和完全基因毒性补充研究中显示良好安全界限。总体上,利用化合物1进行的初步研究的结果证明神经元烟碱调节剂在控制神经性疼痛方面的潜在效力且与先前表征的经由烟碱或其他神经元机制起作用的止痛化合物相比具有优良综合概况。
[1001]
实施例5:化合物1性质
[1002]
化合物1:α4β2
[1003]
化合物1结合至含人α4β2的受体nachr,ki=17nm。
[1004]
化合物1在含人α4β2的nachr下为完全激动剂且比烟碱更有效(与烟碱相比,emax=120%;ec
50
=600nm)。
[1005]
存在两种类型含α4β2的nachr,视何种亚单位占据五聚复合物的第五亚单位而定。存在高敏感性亚型(α4β2)2β2和低敏感性亚型(α4β2)2α4。targacept使用初步测定以基于培育温度激励一种亚型的表达超过另一种。数据库概述指示化合物1为完全激动剂(emax=120%),其在高敏感性亚型和低敏感性亚型下具有类似的效力(对于hs,ec
50
=3300,且对于ls,ec
50
=5300)。根据数据库概述,化合物1以类似的效力完全抑制高敏感性亚型和低敏感性亚型(对于hs,ic
50
=430,且对于ls,ic
50
=450)。这些数据指示化合物1在高敏感性和低
敏感性α4β2 nachr下以类似方式起作用。
[1006]
化合物1:α3β4
[1007]
化合物1结合至含人α3β4的受体烟碱乙酰胆碱受体(nachr),ki=600nm。
[1008]
化合物1在含人α3β4的nachr下为激动剂且不如烟碱有效(在sh-sy5y细胞中,与烟碱相比emax=60%且ec
50
=18,000nm;在imr-32细胞中,与烟碱相比emax=79%且ec
50
=22,000nm)。
[1009]
化合物1:α7
[1010]
化合物1结合至人α7 nachr,ki=15,000nm。
[1011]
实施例6:测试一组具有不同受体结合概况的化合物
[1012]
测试一组具有不同受体结合概况的二十种化合物,包括其他烟碱乙酰胆碱受体(nachr)激动剂。在实验开始时,将50微升的0.01mg/ml化合物制剂经鼻内施用给三名受试者。各化合物的剂量呈对数增加,直至观察到对流泪和/或不适反应的效果为止,直至最大化合物浓度10mg/ml。记录各化合物对流泪和不适反应的效果,示于下表中。化合物1显示效力与耐受性的合意组合。
[1013][1014][1015]
nachr-烟碱乙酰胆碱受体;t2r-2型味觉受体;trpa1-瞬时受体电位阳离子通道蛋白亚家族a成员1;trpm7-瞬时受体电位阳离子通道蛋白亚家族m成员7;trpm8-瞬时受体电位阳离子通道蛋白亚家族m成员8;trpv1-瞬时受体电位阳离子通道蛋白亚家族v成员1;
trpv2-瞬时受体电位阳离子通道蛋白亚家族v成员2;trpv3-瞬时受体电位阳离子通道蛋白亚家族v成员3;h1-组织胺受体h1。
[1016]
实施例7:化合物1的药理学概述和药效学
[1017]
下表显示化合物1的药理学和药效学数据。
[1018]
主要药效学
[1019]
[1020]
[1021][1022]
次要药效学
[1023]
[1024]
[1025][1026]
安全性药理学
[1027]
[1028]
[1029][1030]
实施例8:化合物1的体外数据和汇总报告
[1031]
下表显示化合物1的体外数据和汇总报告。
[1032]
物种亚型ki(nm)测定类型组织类型人a4b217[3h]烟碱α4β2转染的sh-ep1细胞大鼠a4b234
ꢀꢀ
大鼠a4b227[3h]烟碱大鼠皮质膜人a3b227[3h]烟碱α3β2转染的hek细胞
人a6/a3b2b3240
ꢀꢀ
人a4b4680
ꢀꢀ
人a6b3b4a51100
ꢀꢀ
人a715000[3h]mlaα7转染的hek细胞大鼠a73500
ꢀꢀ
大鼠a75533[3h]mla大鼠海马体膜人神经节型(a3b4*)620[3h]地棘蛙素shsy5y细胞系膜人神经节型(a3b4*)8800
ꢀꢀ
人肌肉型36000[3h]地棘蛙素te671细胞系膜
[1033][1034][1035]
实施例9:化合物1(5-2-[(r)-吡咯烷-3-基]-乙烯基)-嘧啶半粘酸盐二水合物)的
临床前数据
[1036]
以下提供化合物1(5-2-[(r)-吡咯烷-3-基]-乙烯基)-嘧啶半粘酸盐二水合物)的临床前数据。
[1037]
化学名称和结构
[1038][1039]
剂型、施用途径和给药方案
[1040][1041]
化学制造和控制概述
[1042]
在cgmp条件下制造一批原料药且基于对先前批次的原料药进行的ich稳定性指定36个月的有效期。此批次将用于制造临床供应品以用于临床研究。该批次从制造开始便储存在受控环境条件下且具有超过36个月的有效期。因此,将对其进行测试以证实材料仍满足初始释放规定,接着将在ich实时条件下进行稳定性研究,以便在建议研究的过程中监测其稳定性。将混配药物产品鼻内制剂且在数周内使用,故原料药稳定性的任何长期下降均将带来极小风险。
[1043]
原料药
[1044]
用于化合物1鼻用喷雾的原料药先前作为口服制剂用于临床试验中。在临床研究中,化合物1被视为安全的,但未能达到效力终点。将化合物1重新配制为鼻用喷雾。
[1045]
以下汇总化合物1的一般性质和稳定性。
[1046]
一般性质
[1047][1048][1049]
制造方法的描述
[1050]
制造建议临床批次的原料药。制造方法描述于wo2010/065443中,所述专利以全文引用的方式并入本文中。
[1051]
规定
[1052]
针对表1中所描述的规定,在制造后释放原料药。将应用这些规定来再测试所述批次,从而执行那些稳定性指示测试:外观、测定、相关物质、手性纯度和水含量。在整个建议研究的过程中,将还使用这些稳定性指示测试和规定来监测原料药的稳定性。
[1053]
表1化合物1的规定
[1054][1055][1056]
批料释放
[1057]
针对本文中所描述的规定来测试并释放批料,且获得如表2中所示的以下结果。
[1058]
表2化合物1原料药的批料分析
[1059][1060][1061]
稳定性
[1062]
制造先前的cgmp批次的化合物1。化合物1的3年稳定性研究方案提供于以下表3中。
[1063]
表3化合物1的稳定性测试方案
[1064][1065]
a=测试:外观、测定、相关物质、水含量、手性纯度、粉末x射线
[1066]
b=测试:外观、测定、相关物质、水含量
[1067]
在25℃/60%rh下经36个月产生的稳定性数据指示原料药经历极小变化且在所评估的时间段内为稳定的。在6个月40℃/75%rh和9个月30℃/65%rh下,以下98%规定的测定值存在轻微下降。然而,基于在加速条件下的极小变化和实时数据的稳定性,原料药当前被视为稳定至少36个月。这些数据汇总于表4中。
[1068][1069]
药物产品
[1070]
化合物1的用于替代临床适应症的先前药物产品制剂包含处于口服给药的两片式
硬壳胶囊中的赋形剂掺合物。正在配制包含原料药于基于磷酸盐缓冲生理盐水的溶液中的基于水溶液的制剂以用于临床研究。此溶液将包装在透明玻璃小瓶中且用橡胶塞密封。在诊所将使用过滤针从小瓶中移出所指示量的溶液,以便经由雾化器将其递送至鼻腔中。
[1071]
临床材料的释放将经由表5中所示的规定来进行。
[1072]
将在制剂开发期间进行短期稳定性研究(约2周)以显示溶液的测定、非手性杂质和ph值保持在适合支持物质释放和给药的时限的规定内。
[1073]
表5关于化合物1的溶液的规定
[1074][1075]
临床前研究
[1076]
已用化合物1的口服制剂进行非临床研究,且其包括药理学、安全性药理学、药代动力学/药物代谢、毒理动力学(tk)、毒理学和基因毒性研究。迄今为止,尚未用化合物1进行致癌或生殖毒性研究。以下简单汇总有助于化合物1的全身性安全性的关键研究。
[1077]
主要药理学
[1078]
nachr为响应于来源于烟草的天然产物烟碱的一类神经传递质受体。其为由α与β亚单位的组合构成的受体大家族。显示化合物1在α4β2和α3β4烟碱受体亚型处为完全激动剂且在α3β2亚型处为部分激动剂。已描述自迷走神经运动背核突出的神经元中由α4β2受体介导的烟碱药理学作用;所述α3β4受体亚型存在于自主神经系统的神经节突触内。
[1079]
安全性药理学
[1080]
与ich s7“safety pharmacology studies for human pharmaceuticals”中的推荐一致,评估化合物1对心血管、呼吸道和cns系统的作用。在于大鼠中进行的一组安全性药理学研究中,化合物1在行为敏化、运动活性、一般行为、体温或促惊厥性质方面未显示显著变化。在100mg/kg下,注意到在呼吸速率方面的短暂不良作用。
[1081]
体外研究结果指示285μm的herg ic
50
;且在兔浦肯野纤维研究中,在30和100μm的浓度下存在动作电位时间延长(分别为7%和20%),但在任何浓度下均对静止膜电位和动作电位幅度无效果。
[1082]
在有意识的犬只中进行的遥测研究的结果指示在至多10mg/kg的口服剂量下收缩压和舒张压以及心率存在非剂量依赖性增加。在20mg/kg剂量下的发现类似,但在所述剂量水平下qt间隔稍微延长。犬只在所有剂量下均在给药后不久便展现呕吐,同时伴随最大心血管变化。先前一般毒理学研究已显示,犬只看似为对化合物1(以及其他烟碱激动剂)最敏感的物种,在给药时展现严重胃痛/呕吐。
[1083]
在猴中进行的遥测研究在直至30mg/kg的口服剂量下无显著变化。
[1084]
动物中的药代动力学和产品代谢
[1085]
已在小鼠、大鼠和猴中进行评估化合物1的药代动力学的研究。还在设计用于确定组织分布、药物代谢、排泄模式和血浆蛋白结合的众多体外和体内研究中研究了化合物1。以下汇总这些研究的结果。应注意,已进行一项评定由经鼻施用途径所产生的化合物1吸收的研究,其结果提供于本文中。
[1086]
吸收
[1087]
口服施用
[1088]
在单次剂量药代动力学研究中,在小鼠、大鼠和猴中,化合物1随时间快速吸收至体循环中,在0.167与2.25小时之间达到最大浓度(t
max
)。以1mg/kg口服给与小鼠时,终末消除半衰期为约0.5小时且脑暴露占约30%的血浆暴露。在使用口服给与0.3或3mg/kg的雄性sd大鼠的研究中,最大血浆浓度(c
max
)和自零至24小时的血浆浓度-时间曲线下面积(auc
0-24
)与剂量成比例地高于3mg/kg组。血浆和脑浓度快速降低,半衰期为1.4小时;脑暴露占约15%的血浆暴露。在猴研究中,以10mg/kg口服或以5mg/kg通过静脉内输注给与[
14
c]-化合物1。此研究中的口服生物利用度为约30%。对于无变化的亲本,在口服给药组中c
max
和auc
inf
分别为254ng/ml和969ng*h/ml;半衰期为1.9小时。在静脉内输注组中,c
max
和auc
inf
分别为2032ng/ml和1532ng*h/ml。
[1089]
化合物1口服或静脉内施用给小鼠、大鼠或猴之后的药代动力学参数汇总于表6中。
[1090]
表6在小鼠、大鼠和猴中在口服和静脉内施用化合物1后的药代动力学参数
[1091][1092][1093]
a:剂量=化合物1
[1094]
b:剂量=[
14
c]-化合物1
[1095]
c:t=24h
[1096]
d:t=168h
[1097]
e:f=口服生物利用度
[1098]
在大鼠2周和13周重复剂量tk研究中,以30、100或200mg/kg/天(2周研究)或30、100或300mg/kg/天(13周研究)对动物进行口服给药。在两个研究中化合物1均被快速吸收,t
max
为0.5至2小时。暴露参数(c
max
和auc
0-24
)在2周研究的第1天和第15天以及13周研究的第1天、第29天和第91天大致与剂量成比例地增加。在2周研究中,从第1天至第15天暴露增加
1.2至2.2倍。在13周研究中,从第1天至第29天存在大体增加且从第29天至第91天存在大致等效的暴露。在两个研究中,雌性中的暴露大体上高于雄性,尤其在2周研究中的200mg/kg/天剂量组中。
[1099]
在猴2周和13周重复剂量tk研究中,以10、30或100mg/kg/天(2周研究)或10、30或60mg/kg/天(13周研究)对动物进行口服给药。在两个研究中化合物1均被快速吸收,t
max
为0.5至6小时,且被快速清除。在2周研究中,暴露与第1天和第14天的10至30mg/kg/天的剂量大致成比例地增加,且在第1天和第14天自30至100mg/kg/天以低于比例的方式增加;100mg/kg/天剂量组中第1天6/6动物和第14天5/6动物呕吐可能归因于此。任何剂量组中从第1天至第14天几乎不存在累加作用。在13周研究中,暴露自10至30mg/kg/天以低于比例的方式增加且在30至60mg/kg/天下一般不增加。在任一个研究中观察到极小至无累加作用,且在任一个研究中未观察到性别影响。
[1100]
鼻内施用
[1101]
大鼠7天试验性鼻内毒性和毒理动力学研究中由经鼻施用途径产生的化合物1吸收提供于本文中。
[1102]
分布
[1103]
化合物1和[
14
c]-化合物1的结合显示在至多约113μm的浓度下小鼠、大鼠、豚鼠、犬只、猴和人血浆中存在低(<13%)血浆蛋白结合。化合物1与红血细胞的结合在达到峰值立即后为28%至54%且在达到峰值后0.5和1小时为41%至63%。血液/血浆比介于0.78至1.26的范围内,且大致与物种和浓度无关。
[1104]
在雄性le大鼠(1mg/kg,口服)以及雄性和雌性sd大鼠(30mg/kg,口服)中进行的分布研究显示[
14
c]-化合物1从胃肠道中快速吸收且分布在体内,一般在0.5至1小时内观测到最高放射性浓度。在雄性le大鼠中,所有组织中第一阶段消除发生在1与24小时之间,缓慢第二阶段消除发生在24与168小时之间,大部分在168小时展现高于lloq(9ng-eq/g)的放射性。肾上腺髓质在168小时的最终取样时间显示最高放射性浓度;具有相对较高auc值的其他组织包括葡萄膜、肾皮质髓质连接处、脾脏、肝脏、前列腺、肾盂、肾脏整体和小肠壁。在雄性和雌性sd大鼠中,组织分布看起来类似于le大鼠的组织分布。具有相对较高auc值的组织包括消除器官、唾液颌下腺、肾上腺髓质和前列腺(雄性);肾上腺髓质在24小时的最终取样时间显示最高放射性浓度。
[1105]
代谢
[1106]
体外代谢
[1107]
人肝微粒体、热处理人肝微粒体和人s9部分中的研究指示,化合物1在所有测试系统中相对稳定,表明细胞色素p450、含黄素的单加氧酶和单胺氧化酶在所述化合物的代谢中不起主要作用。在24小时培育中,来自大鼠、犬只、猴和人的低温贮藏肝细胞,[
14
c]-化合物1视物种而定被轻度至中度代谢,排列如下:大鼠>猴>人>犬只。在人和猴中,主要代谢途径为经由吡咯烷环氧化(代谢物m02),随后经由二氧化进一步代谢成m1或m3。在人中,母体占细胞外放射性的37%,m02为13.9%,m1为4.1%且m3为1.1%。在猴中,母体占14.2%,m02为5.0%,m1为5.8%且m3为29.4%。在大鼠中,主要代谢物为n-氧化物-嘧啶衍生物(m9);其占细胞外放射性的71.9%而母体仅占1.4%。
[1108]
体内代谢
[1109]
在大鼠中单次口服给与[
14
c]-化合物1后(30mg/kg),母体广泛代谢。血浆和尿液中的主要代谢物为m9;给药后6至24小时血浆中未知极性代谢物(m13)占总放射性中相当大一部分。在血浆中,母体占auc0-24总放射性的11.7%,m9占20.9%且m13占15.9%。在24小时时段的尿液(主要消除途径)中,母体占总放射性的17.8%,m9占37.7%且m13占0.7%。
[1110]
排泄
[1111]
在sd大鼠中在30mg/kg的单次口服剂量后和在猴中在10mg/kg的单次口服剂量和5mg/kg的单次静脉内输注后研究[
14
c]-化合物1放射性的排泄途径和程度。在大鼠中,排泄物中的几乎所有回收的放射性均在24小时内消除。平均91.2%的施用剂量在给药后168小时时段内回收(77.6%处于尿液中,10.9%处于粪便中,2.2%处于呼出co2中)。在猴中,排泄物中的几乎所有回收的放射性在24(静脉内)或48(口服)小时内消除。对于口服给药,平均90.3%的施用放射剂量在给药后168小时时段内回收(60.7%处于尿液中,12.8%处于粪便中,10.2%处于笼洗涤物中,且6.6%处于食物碎屑中)。对于静脉内给药,平均93.0%的施用放射剂量在给药后168小时时段内回收(70.7%处于尿液中,7.6%处于粪便中,7.6%处于笼洗涤物中,且6.9%处于食物碎屑中)。
[1112]
毒理学
[1113]
化合物1的非临床毒理学程序包括以下:大鼠、犬只和猴中的单次剂量总体毒性研究;大鼠和猴中在至多13周的持续时间中的重复剂量总体毒性研究;和基因毒性研究,包括艾姆斯测试、微核测试和染色体畸变测试。以下汇总得自13周重复剂量研究和基因毒理学研究的发现。
[1114]
大鼠中的13周重复剂量毒性
[1115]
经由口服管饲法以30、100或300mg/kg/天的剂量将化合物1给与大鼠,每日一次,持续至少13周。接受300mg/kg/天的15只雌性中有两只死亡。此高剂量组中雄性和雌性的临床征象包括:食物消耗减少、肛门生殖器沾污、流泪、血泪症和震颤。实验室结果包括与网织红细胞计数升高相关的略低rbc质量,可恢复;在整个给药时段内的肝酶和胆红素升高,有证据显示在恢复期间消退;尿液变化,包括尿量增加、尿蛋白升高以及较高胆红素和尿胆素原,在恢复期间消退。接受100mg/kg/天和更高剂量的大鼠具有的临床征象包括过度流涎、鼻口部棕褐色、眼睑闭合或部分闭合和体重减轻。实验室结果包括wbc(淋巴细胞和中性粒细胞)升高,可恢复;胆红素升高;和总血清蛋白(球蛋白和白蛋白)稍微降低。组织的肉眼和组织学检查显示肝脏重量略微升高。在≥100mg/kg/天的剂量时,观测到肝小叶中心细胞肥大、肾上腺髓质细胞肥大、小肠粘膜上皮细胞增生和脾脏红髓中骨髓外造血和血铁黄素沉积增加的微观发现。在300mg/kg/天的剂量下,组织的肉眼和组织学检查揭示脾脏重量升高伴随脾脏红髓和肝脏枯氏细胞中的血铁黄素沉积。30mg/kg/天的低剂量得到良好耐受,但在10只雄性中的7只中观察到极小程度的肝细胞肥大,而在雌性中未观察到。因此,noael被视为30mg/kg/天。化合物1在给药后被快速吸收,t
max
为0.5至2小时,且在给药后多达24小时在血浆中可检测到。auc和c
max
在第1天与第29天之间增加。auc在第29天与第91天之间保持恒定,表明截至第29天可达到稳态。在noael下,c
max
值介于2570ng/ml(对于雄性)至3150ng/ml(对于雌性)范围内。auc值介于12100ng*h/ml(对于雄性)至10200ng*h/ml(对于雌性)范围内。
[1116]
猴中的13周重复剂量毒性
[1117]
经由口服管饲法以10、30或60mg/kg/天的剂量将化合物1给与食蟹猕猴,每日一次,持续至少13周。在给药时段结束时,在高剂量组和对照剂量组中每种性别选择2只猴子用于恢复4周。一只接受60mg/kg/天的猴在第四周期间由于显著恶化,包括体重损失(相对于第1天值-22%)、运动活性降低、低反应性、低温和表明肾损伤的显著临床化学变化(尿氮和肌酸酐增加、低钠和钾、和氯减少)而被处死,所述临床化学变化与以嗜中性和单核性间质性炎症、肾小管内嗜中性炎症、肾小管上皮退化和再生以及肾小管圆柱矿化和扩张为特征的中度肾小管间质性肾炎的微观发现相关。在60mg/kg/天下幸存的猴中,临床观察包括呕吐、运动活性降低、体重损失、与心率稍微降低相关的qt(至多 16%)、qtcb(至多 9.2%)和qtcf(至多 11%)间隔轻微增加。截至4周恢复时段结束时,这些发现已消退。重要的是,迄今为止,利用化合物1的临床研究中未鉴定ecg测量值的显著变化。60mg/kg组中的微观评估揭示2只雄性中的1只和3雌性中的2只的心脏中存在轻度间质性空泡形成。在30mg/kg下,所有动物均有呕吐,但其与以60mg/kg给药的动物相比具有较少呕吐事件。30mg/kg的剂量被良好耐受且被视为noael。c
max
和auc在介于10与30mg/kg之间的剂量下以低于比例的方式增加。在介于30与60mg/kg之间的剂量下未观察到剂量效果,表明吸收饱和;血浆浓度的个体间变异性较高。在noael下,c
max
值介于382ng/ml(对于雄性)至696ng/ml(对于雌性)范围内。auc值介于1670ng*h/ml(对于雄性)至2440ng*h/ml(对于雌性)范围内。
[1118]
基因毒性研究
[1119]
化合物1对体外生物测定(包括艾姆斯测试、小鼠淋巴瘤细胞中的微核测试和使用培养人外周血淋巴细胞的染色体畸变测定)和体内大鼠骨髓微核测试中均对突变诱发呈阴性。
[1120]
鼻内毒理学研究
[1121]
可经由可能因物种而不同的用于施用测试物品的实验技术(例如每个鼻孔的剂量体积、递送装置)在啮齿动物(大鼠和小鼠)、兔和较大物种(包括犬只和非人类灵长类)中进行鼻内施用研究。分别最通常使用大鼠和犬只或猴用于在啮齿动物和非啮齿动物中评估鼻内药物产品。然而,还使用兔,且pereira等人已开发安全性评定研究中用于对兔鼻腔进行组织病理学评估的方法(pereira me,macri np,creasy dm.evaluation of the rabbit nasal cavity in inhalation studies and a comparison with other common laboratory species and man.toxicologic pathology.2011.39:893-900)。
[1122]
虽然先前在持续时间多达13周的glp口服施用研究中评估大鼠和猴中的全身性毒性,但选择大鼠和兔(新西兰)用于在鼻内毒性研究中评估化合物1。大鼠和兔中的鼻内毒性研究主要聚焦于使用临床相关剂量浓度的化合物1(以半粘酸盐计,至多6%)来评定局部毒性。因为利用化合物1的全身性毒性研究中先前未评估兔,故正在进行的glp 28天研究中还将进行完整全身性评估。
[1123]
完全毒理学研究
[1124]
在大鼠中通过经鼻内施用进行化合物1的7天试验性研究
[1125]
在大鼠7天鼻内施用研究中评定化合物1的潜在毒性和tk。研究设计如下:
[1126]
表7在大鼠中经鼻内施用化合物1-a的7天试验性研究的实验设计
[1127][1128]-=不适用。
[1129]a向各动物施用所述剂量体积,总施用体积在各鼻孔之间均等分配(30μl/鼻孔/剂量),每日3次。
[1130]b磷酸盐缓冲生理盐水(pbs)。
[1131]c以半粘酸盐计。
[1132]
此研究中评估以下参数和终点:临床征象、体重、体重增加、食物消耗、眼科学、毒理动力学参数、肉眼尸检发现、器官重量和所选组织的病理组织学检查(包括所有剂量组的第i至iv级鼻腔和详细眼组织病理学);第1组和第4组动物中的脑、咽、喉、气管、肺以及在大鼠glp 13周口服毒性研究(dse 2004-0356)中加以鉴定的所选目标组织(即,肾上腺、肝脏和脾脏)的组织病理学;和肉眼病变。
[1133]
以下提供化合物1全身性暴露的毒理动力学(图1和表8)。在给药前且在第1天和第7天在第一日剂量后0.083、2、5、6.083(第二日剂量后5分钟)、8、11、12.083(第三日剂量后5分钟)和24小时自3只大鼠/性别/组/时间点收集血液样品以用于血浆化合物1浓度分析。
[1134]
表8在第1天和第7天在大鼠中化合物1tid施用后的毒理动力学参数
[1135][1136][1137]a剂量浓度0.5%、2%和6%分别等效于0.9、3.6和10.8mg/天的半粘酸盐。
[1138]b剂量标准化(dn)auc
0-t
的单位为(ng*h/ml)/(mg)
[1139]cc
max
为最大浓度且t
max
为总血液收集时间跨度上的峰值浓度的时间
[1140]dc1、c2和c3为第1次、第2次和第3次滴注后的峰值浓度
[1141]
nr=由于用于确定auc0-t的连续浓度<3而不值得报告
[1142]
化合物1在经鼻内施用后被快速吸收且显示雄性和雌性中的全身性暴露随剂量增加而增加。在施用时间点后5分钟观察到化合物1在每一次滴注后的峰值全身性暴露。与最大观测暴露c
max
相关的t
max
通常在第二次或第三次滴注之后,有一个例外(第3组雄性第7天)。基于来源于限制取样的指示快速吸收和1.4小时半衰期的tk数据,不可能准确地确定当化合物1施用tid大鼠时是否存在化合物1的全身性累加作用或在7天内诱导清除。
[1143]
以0%、0.5%、2%和6%的剂量浓度每天3次持续7天向大鼠鼻内施用60μl化合物1使得所有预定施以安乐死的动物存活。存在统计上不同于其相应对照组的孤立体重、食物消耗和器官重量值;然而,无模式、倾向或相关数据表明这些值具有毒理学相关性。所观察的临床观察、眼睛、肉眼和微观发现被视为偶发性的,自然界中在此品系和年龄的大鼠中通常观测到,和/或在对照和经治疗动物中具有类似发病率,且因此被视为与施用化合物1-a无关。因此,未观测到不良作用的水平(noael)被视为每只动物每天180μl 6%化合物1。
[1144]
兔中的单次剂量耐受性和pk
[1145]
在2%或5%化合物1单次喷洒(100μl)于雄性新西兰白兔(n=36)的右鼻孔中后评定化合物1鼻用喷雾的潜在毒性和tk。磷酸盐缓冲溶液(pbs)充当对照且喷洒(100μl)在左鼻孔中。在治疗后1、3、6、9和24小时进行生物分析和组织病理学分析。在处死前,使用皮肤刺激评分用德莱兹分类系统来评定各动物的鼻内/鼻面积。
[1146]
在研究期间在任何动物中均未观察到临床征象,且在鼻内/鼻评定中未观察到红疹、水肿、焦痂形成或流脓的征象。在组织病理学上,不存在与2%或5%化合物1于鼻腔中进行测试物品应用有关的宏观或微观发现。
[1147]
正在进行的毒理学研究
[1148]
将进行评估化合物1鼻用喷雾的毒性的研究,并且将进行以下研究:
[1149]
·
大鼠28天重复剂量鼻内毒性研究;
[1150]
·
兔7天重复剂量耐受性和pk;
[1151]
·
兔28天重复剂量鼻内毒性研究。
[1152]
正在完全顺应性与优良实验室规范(glp)规则下进行意欲支持临床试验的关键毒性研究。以下提供各研究方案的简略简介。
[1153]
化合物1经鼻内施用大鼠的glp 28天重复剂量毒理学研究,4周恢复时段
[1154][1155][1156]
兔7天重复剂量耐受性和pk
[1157][1158]
化合物1通过鼻内喷洒施用新西兰白兔的glp 28天重复剂量毒性研究,4周恢复时段
[1159][1160]
临床前概要
[1161]
在大鼠和猴中进行化合物1的口服重复剂量毒性研究至多13周。化合物1在30mg/kg的剂量下在两种物种中得到良好耐受。大鼠13周研究中的主要毒性发现包括在300mg/kg的高剂量下死亡和在≥100mg/kg下的组织病理学发现(肾上腺、肝脏、小肠和脾脏)。在猴13周研究中,在研究第4周期间处于濒死状态而被处死的一只猴(60mg/kg)中观察到肾脏毒性,且在3只猴(60mg/kg)的心脏中观察到轻度间质性空泡形成。对于13周大鼠和猴研究,两个研究的noael均被视为30mg/kg。
[1162]
选择大鼠和兔用于在鼻内毒性研究中评估化合物1。因为先前在两个物种中评估全身性毒性,如以上所概述,故大鼠和兔鼻内毒性研究主要聚焦于使用化合物1-a的临床相关剂量浓度(至多6%)来评定局部毒性。选择关键glp研究的剂量水平以允许评估介于0.5%至6%范围内的预期临床剂量浓度。另外,计划给药频率(即,在大鼠中每天三次且在
兔中每天两次)以超过建议临床研究中的最高计划临床给药频率。
[1163]
用于进行中glp 28天大鼠和兔鼻内毒理学研究的化合物1剂量汇总于表9中,以mg/天、mg/kg/天和mg/cm2表示。
[1164]
表9进行中glp28天大鼠和兔鼻内毒理学研究中的化合物1剂量
[1165][1166]a0.5%=5μg/μl;2%=20μg/μl;6%=60μg/μl
[1167]b以半粘酸盐计
[1168]c重量假定值:0.25kg大鼠;2.5kg兔
[1169]d鼻表面积假定值:14cm2(两个鼻孔),大鼠;61cm2(两个鼻孔),兔;180cm2[1170]
(两个鼻孔),人
[1171]
表10进行中glp 28天大鼠和兔鼻内毒理学研究中的化合物1游离碱当量剂量
[1172][1173][1174]a0.28%=2.8μg/μl;1.1%=11.1μg/μl;3.3%=33.2μg/μl
[1175]b游离碱;半粘酸盐与游离碱的修正因子=0.554
[1176]c重量假定值:0.25kg大鼠;2.5kg兔
[1177]d鼻表面积假定值:14cm2(两个鼻孔),大鼠;61cm2(两个鼻孔),兔;180cm2(两个鼻孔),人
[1178]
用于人的鼻内剂量典型地介于每次喷雾50至100μl的范围内。作为一个实例,假定建议临床研究中两次喷洒(100μl/喷洒/鼻孔,总计200μl;对于60kg患者,等效于6.6mg/天或0.11mg/kg)3.3%(33.2μg/μl)化合物1鼻用喷雾(游离碱),大鼠和兔28天重复剂量研究在高剂量下的动物:人暴露界限将分别为10.8倍和5.5倍。以mg/m2计,大鼠和兔的安全性界限将大得多,分别为218倍和48.2倍。预期进行中关键大鼠和兔研究将为建议临床研究中的
最大临床剂量(待确定)提供足够安全性界限(以mg/cm2计,至少2-3倍)。
[1179]
临床研究
[1180]
已在若干临床试验中研究化合物1-a的口服形式化合物1。总计108名人类受试者已接受化合物1:第1期研究中的69名健康志工,第1b期胃轻瘫研究中的23名受试者,和第2a期研究中的16名便秘型大肠躁郁症(ibs-c)受试者。使受试者暴露于介于5mg至且包括200mg范围内的化合物1剂量。在身体检查、血液或尿液实验室测量或ecg测量中未鉴别临床显著变化。所有研究中报告的不良事件典型地与gi相关,且包括恶心、腹痛、呕吐和腹泻。
[1181]
实施例10:关于化合物1(5-2-[(r)-吡咯烷-3-基]-乙烯基)-嘧啶半粘酸盐二水合物)的建议第2期临床研究
[1182]
以下提供建议第2期研究的简介。
[1183]
[1184]
[1185]
[1186]
[1187][1188]
缩写列表
[1189][1190]
1.引言
[1191]
干眼为眼表面的多因素年龄相关病症,其导致严重疼痛、视觉缺陷、泪膜高渗透性和不稳定性、炎症和角膜创伤。尽管干眼盛行率由于变化的定义和诊断准则而难以报告,但据估计,世界上50岁以上群体中有5%至35%罹患此病状1。在美国,据估计在50岁以上人群中,有多达320万妇女和170万男性患有干眼,预计截至2030年,受影响的患者数目将增加40%。
[1192]
正在开发化合物1鼻用喷雾以用于通过靶向鼻泪反射途径来治疗干眼。鼻泪反射为鼻刺激藉以促进静止基础和成团泪液分泌的公认途径。所述反射在通过在受刺激物刺激后经由鼻泪管向鼻腔中分泌泪液而自鼻中排出外来体或刺激物方面起功能性作用。泪腺的反射激活也为解决眼表面干燥的身体主要代偿机制之一。令人遗憾的是,随时间推移,干燥环境和所引起的炎症导致支配角膜的传入神经受到破坏,从而牺牲反射性反应且最终导致眼表面甚至更干燥。
[1193]
化合物1通过活化烟碱乙酰胆碱受体(nachr)而充当鼻刺激。公认nachr可在三叉神经内介导传入信号,包括对烟碱鼻刺激的反应。这些传入信号形成引起泪液产生的鼻泪反射的基础。实际上,已知为了戒烟而开发的含烟碱鼻用喷雾的一种治疗副作用是增加流泪。因而,nachr为活化泪液反射以治疗干眼的逻辑标靶。
[1194]
此研究将利用受控不良环境(cae
sm
)模型来评定干眼症状。cae为通过调节湿度、温度、气流、照明条件和视觉任务使环境条件标准化的房间。使干眼患者暴露于cae多达两小时,在此期间,可在暴露之前、期间和之后评估主观和客观参数。cae代表干眼患者遭遇的日常情形,诸如强制风热系统、飞机旅行和计算机使用,且允许对这些影响因素进行标准化。
[1195]
2.研究目标
[1196]
此研究的目标在于评估化合物1鼻用喷雾与安慰剂相比对干眼病(ded)征象和症状的安全性和有效性。
[1197]
3.临床假设
[1198]
此研究的临床假设为化合物1鼻用喷雾在治疗ded的征象和症状方面优于安慰剂。
[1199]
4.总体研究设计
[1200]
此为设计用于评估化合物1鼻用喷雾在成年ded参与者中的安全性和效力的第2期多中心随机化双盲安慰剂对照研究。约200名存在受试者报告的干眼史且满足所有其他研究合格准则的至少22岁受试者将在第1次访问和第2次访问时随机接受施用化合物1或安慰剂。
[1201][1202][1203]
将要求在施用时段早期终止的参与者在研究退出前完成安全性评定(如果参与者同意)。不会替换在研究早期终止的参与者。
[1204]
5.研究群体
[1205]
5.1.受试者数目
[1206]
据估计,将在美国多达3个现场征募约200名参与者(每个顺序组约50名)。受试者将在第1次访问和第2次访问时随机接受低剂量、中剂量、高剂量(不超过3.3%,即,33.2μg/μl化合物1游离碱)或安慰剂。
[1207]
5.2.研究群体特征
[1208]
所有受试者必须为至少22岁、属于任一性别且属于任何种族,并且必须满足所有纳入准则且不满足任一排除准则。
[1209]
5.3.纳入准则
[1210]
受试者必须:
[1211]
1.在筛选访问时至少22岁
[1212]
2.第1次访问前6个月内已因干眼症状而使用和/或需要使用人工泪液替代物
[1213]
3.在筛选访问时具有≥23的评分与≤3个“n/a”反应
[1214]
4.在筛选访问时研究眼睛中具有所有以下各项:
[1215]
·
至少一个角膜区中的角膜荧光素染色评分≥2或所有角膜区的总和≥4
[1216]
·
基线修门氏测试(局部麻醉)评分≤10mm/5分钟与同一眼中的棉拭子鼻刺激修门氏测试评分高出至少7mm
[1217]
·
研究眼睛将定义为满足所有纳入准则的眼睛;如果两只眼睛均合格,则为筛选访问时在棉拭子刺激下具有最大泪液产生增加的眼睛,或如果所刺激的泪液产生无差异,则为筛选访问时具有较低基础修门氏评分的眼睛。如果任一度量均无差异,则将使用右眼作为研究眼睛。
[1218]
5.筛选访问时各眼睛的最佳矫正视力(bcva)为0.7logmar或更佳(logmar<0.7;斯内伦等效评分为20/100或更佳)
[1219]
6.如研究者所测定,具有正常眼睑/眼睫解剖学、眨眼功能和闭合
[1220]
7.不熟悉(例如知晓研究药物用于刺激泪液产生)或先前已使用研究药物
[1221]
8.有文化、能够讲英语且能够独立完成问卷
[1222]
9.第15天能够参与研究约连续四小时
[1223]
10.能够且愿意使用研究药物并参与所有研究评定和访问
[1224]
11.已提供口头和书面知情同意
[1225]
12.如果为可能生育的女性,则在第1天具有阴性尿妊娠测试
[1226]
5.4.排除准则
[1227]
受试者必须不:
[1228]
1.在研究第1天进行修门氏测试之前具有临床上显著的角膜上皮缺陷
[1229]
2.具有慢性或复发性鼻出血、凝固障碍或研究者认为可能导致临床上显著的流血增加风险的其他病状
[1230]
3.进行过鼻或窦手术(包括鼻烧灼术应用史)或这些区域的明显创伤
[1231]
4.如第1天前进行的鼻内检查所证实,具有血管化息肉、严重鼻中隔弯曲、慢性复发性鼻出血或严重鼻气管堵塞
[1232]
5.当前用经鼻持续气道正压(cpap)进行治疗
[1233]
6.进行过任何眼内手术(诸如白内障手术)、距第1次访问三个月内在任一只眼中进行过眼外手术(诸如睑成形术)或在十二个月内进行过屈光手术(例如lasik、lasek、prk或角膜移植)
[1234]
7.任一只或两只眼中进行过角膜移植
[1235]
8.第1次访问前7天内使用过隐形眼镜或预期在研究时段期间使用隐形眼镜
[1236]
9.任一眼睑中存在泪管或小管内栓塞(泪管永久堵塞的参与者为合格的)
[1237]
10.任一只眼中具有研究者认为可能会干扰研究结果解读或参与者安全的任何眼部病症或病状的历史或存在,诸如明显角膜或结膜瘢痕、翼状胬肉或结节性睑裂斑;当前眼部感染、结膜炎或与干眼不相关的炎症;前(上皮)基底膜角膜营养不良或其他临床上显著的角膜营养不良或退化;眼部疱疹感染;圆锥形角膜证据等。典型地与干眼病相关的不需治疗的睑缘炎和轻度睑板腺疾病为允许的
[1238]
11.患有不稳定或研究者判断与参与研究或与研究所需的漫长评定不相容的全身性病状或疾病(例如,当前全身性感染、不受控制的自体免疫疾病、不受控制的免疫缺乏病、心肌梗塞或心脏病史等)
[1239]
12.已知对任何程序药剂或研究药物组分过敏
[1240]
13.当前在研究期间或在先前30天内伴随使用鼻烟、嚼用烟草或香烟/雪茄
[1241]
14.当前或在先前30天内伴随使用烟碱乙酰胆碱受体激动剂[(烟碱)、(金雀花碱)和(伐尼克兰)]
[1242]
15.患有活性或不受控制性严重:
[1243]
·
全身性过敏
[1244]
·
在研究期间处于活性风险下的慢性季节性过敏
[1245]
·
筛选访问时需要诸如抗组织胺、去充血剂、口服或气雾剂类固醇的治疗的鼻炎或窦炎
[1246]
·
第1次访问时未加治疗的鼻感染
[1247]
16.具有研究者认为可能干扰受试者的研究顺应性、结果度量、安全性参数和/或一般医学状况的任何病状或历史
[1248]
17.第1访问时怀孕、正在照看婴儿或计划怀孕的女性
[1249]
18.当前参与研究药物或装置研究,或在第1次访问前30天内已使用过研究药物或装置
[1250]
5.5.退出准则(适用时)
[1251]
如果研究者在研究期间的任何时间确定受试者安全已受损,则受试者可退出研究。
[1252]
受试者可在任何时间撤回研究同意书。
[1253]
主办者和/或研究者在研究过程中可因不顺应或任何有效医学原因而中止任何受试者(参见第8.6.2部分)。
[1254]
6.研究参数
[1255]
6.1效力度量
[1256]
6.1.1.主要效力度量
[1257]
将测试以下主要终点:
[1258]
·
第1次访问时的修门氏测试
[1259]
·
第2次访问时的眼干燥度评分(eds)
[1260]
6.2.安全性度量
[1261]
·
不良事件
[1262]
6.3.其他度量
[1263]
·
ora calibra
tm
眼部不适量表
[1264]
·
尿液妊娠测试(第1天)
[1265]
7.研究材料
[1266]
7.1.研究药物
[1267]
7.1.1.制剂
[1268]
·
化合物1鼻用喷雾
[1269]
·
安慰剂(化合物1媒介物鼻用喷雾)
[1270]
7.1.2.分配程序
[1271]
·
在第1次访问时,将合格受试者随机化且将在办公室中施用第一剂研究药物。
[1272]
·
在第2次访问时,受试者将在cae
tm
暴露期间接受其第二剂研究药物。
[1273]
7.1.3.使用说明
[1274]
·
将视剂量组分配而定在磷酸盐缓冲生理盐水中以所要浓度将化合物1(和安慰剂)配制为无菌水溶液,且提供于以橡胶塞密封的单次使用玻璃小瓶中。
[1275]
·
所述产品无防腐剂且意欲仅用于鼻内使用。所述产品在混浊或存在粒子时不应使用。
[1276]
·
化合物1溶液将在不进行稀释的情况下施用。
[1277]
·
将经由5微米过滤针自玻璃小瓶中移出药物溶液。
[1278]
·
接着将5微米过滤针丢弃并且将使用所提供的单次使用注射器和单次使用鼻内雾化器来施用化合物1。
[1279]
7.2.其他研究供应
[1280]
·
尿液妊娠测试试剂盒
[1281]
·
荧光素钠溶液或荧光素试片
[1282]
·
修门氏测试片
[1283]
·
丙对卡因
[1284]
8.研究方法和程序
[1285]
8.1.参与者进入程序
[1286]
8.1.1.概述
[1287]
如第5.2、5.3和5.4部分中的准则所定义的参与者将考虑进入此研究。
[1288]
8.1.2.知情同意
[1289]
在参与者参与试验前(即,在研究相关程序前),将与各潜在参与者一起讨论所述研究且愿意参与的参与者必须被施用且使用irb批准的知情同意书(icf)提供书面知情同意。icf必须为已受到适当组成的机构审查委员会批准的最新版本。
[1290]
8.1.3.清除间隔
[1291]
禁止药物疗法、治疗和活性概述于排除准则(第5.4部分)中。
[1292]
8.1.4.最终研究进入的程序
[1293]
受试者必须满足所有纳入准则且不满足任何排除准则。
[1294]
8.1.5.分配至处理组的方法
[1295]
将给合格的各受试者指定筛选编号。将在一个现场按严格数字顺序指定所有筛选编号,且不会跳过或省略编号。如果在第1次访问时满足所有包括和排除准则,则接着将给
各合格受试者指定随机编号。
[1296]
将针对各研究地点提供随机化方案。将现场层选随机化方案,从而在每一个现场将大致相等数目的受试者分配至四个治疗组中的每一个中。现场工作人员将给患者分配经相应随机化编号标记的研究试剂盒。随机化编号将记录在患者的原始文件和ecrf上。在随机化过程期间和在整个研究中,主办者、研究者和研究工作人员将不知情。
[1297]
8.2.并行疗法
[1298]
任何并行药物疗法、处方药或非处方药的使用均将随采取药物疗法的原因一起记录在受试者的原始文件和相应电子病例报告表(ecrf)上。
[1299]
不允许并行参与另一研究药物或装置研究。
[1300]
8.2.1.禁止药物疗法/治疗
[1301]
研究期间不允许的药物疗法/治疗概述于排除准则(第5.4部分)中。
[1302]
8.2.2.回避药物疗法
[1303]
此研究不需要回避药物疗法。
[1304]
8.2.3.特殊饮食或活动
[1305]
此研究不需要特殊饮食或活动。
[1306]
8.3.检查程序
[1307]
8.3.1.与研究目标有关的每一次研究访问时将进行的程序
[1308]
将进行以下程序:
[1309]
第1次访问(第1次):筛选和修门氏测试评估
[1310]
筛选
[1311]
·
知情同意/健康信息流通与责任法案(hipaa)同意
[1312]
·
人口统计数据、医学/药物疗法和眼病史
[1313]
·
合格准则
[1314]
·
[1315]
·
eds(视觉模拟量表)
[1316]
·
ora calibra
tm
眼部不适量表
[1317]
·
最佳矫正视力
[1318]
·
狭缝灯活组织显微镜检查
[1319]
·
角膜荧光素染色
[1320]
·
修门氏测试
[1321]
·
利用鼻刺激(棉拭子)的修门氏测试
[1322]
·
鼻内检查
[1323]
·
尿液妊娠测试(适用时)
[1324]
·
伴随药物疗法
[1325]
·
不良事件
[1326]
治疗(修门氏测试评估)
[1327]
治疗前程序:
[1328]
·
随机化:将用低剂量、中剂量、高剂量(不超过3.3%,即,33.2μg/μl化合物1游离碱)或安慰剂治疗合格参与者。
[1329]
治疗程序:
[1330]
·
告知受试者关于研究药物/安慰剂施用
[1331]
·
治疗与并行修门氏测试
[1332]
·
研究药物/安慰剂施用
[1333]
治疗后程序
[1334]
·
最佳矫正视力(bcva)
[1335]
·
狭缝灯活组织显微镜检查
[1336]
·
鼻内内视镜检查
[1337]
·
伴随药物疗法
[1338]
·
不良事件
[1339]
·
第2次访问的预定参与者
[1340]
第2次访问(第15 4天):cae
[1341]
·
医学/药物疗法和眼病史更新
[1342]
·
眼干燥度量表(eds,视觉模拟量表)
[1343]
·
ora calibra
tm
眼部不适量表
[1344]
·
cae
sm
暴露约120分钟
[1345]
·
进入cae
sm
时和此后每5分钟收集eds。
[1346]
·
进入cae
sm
时和此后每5分钟的ora calibra
tm
眼部不适量表。
[1347]
·
将用低剂量、中剂量、高剂量(不超过3.3%,即,33.2μg/μl化合物1游离碱)或安慰剂治疗合格参与者。
[1348]
o使用ora calibra
tm
量表,当参与者在cae
sm
暴露期间在两个或更多个连续时间点报告至少一只眼睛的眼部不适评分≥3时,将施用用研究药物/安慰剂治疗(如果参与者在时间=0时眼部不适分级为3,则其必须在两次连续测量此眼睛时报告眼部不适等级4)。参与者将在施用结束之后每5分钟恢复症状评定1分钟。
[1349]
·
最佳矫正视力
[1350]
·
狭缝灯活组织显微镜检查
[1351]
·
鼻内内视镜检查
[1352]
·
尿液妊娠测试(适用时)
[1353]
·
伴随药物疗法
[1354]
·
不良事件
[1355]
·
研究退出
[1356]
8.4.访问、测量和给药排程
[1357]
8.4.1.定期访问
[1358]
参考本文中关于访问和测量排程的部分。
[1359]
8.4.2.不定期访问
[1360]
可进行这些访问以确保受试者安全。
[1361]
不定期访问时可进行的评估包括:
[1362]
·
狭缝灯活组织显微镜检查;
[1363]
·
视力;
[1364]
·
鼻内内视镜检查;
[1365]
·
尿液妊娠测试;
[1366]
·
不良事件评定;
[1367]
·
对并行药物疗法和/或治疗的评定;和
[1368]
·
研究者判断需要的任何其他评定。
[1369]
8.5.方案顺应性
[1370]
将在第1次和第2次访问时告知受试者关于如何施用研究药物且提供详细书面说明供回顾。
[1371]
给药顺应性将基于第1次和第2次访问时用过/未用过的研究药物。
[1372]
8.6.受试者素因
[1373]
8.6.1.完成的受试者
[1374]
完成的受试者为未中止研究的受试者。
[1375]
8.6.2.中止的受试者
[1376]
受试者可在其完成研究前由于以下因素而在任何时间中止:
[1377]
·
不良事件;
[1378]
·
在医学上有必要时知情;
[1379]
·
方案违规;
[1380]
·
管理原因(例如,不能继续、失去追踪);
[1381]
·
主办者终止研究;
[1382]
·
受试者选择(例如撤回同意书);和
[1383]
·
其他
[1384]
注意:另外,可在研究者(与主办者会诊之后)或主办者裁量后出于任何合理医学原因而中止任何受试者。
[1385]
受试者中止和中止原因的通知将清楚地存档。
[1386]
不会替换中止的受试者。
[1387]
8.7.研究终止
[1388]
研究可在适当通知的情况下在任何时间停止。
[1389]
8.8.研究持续时间
[1390]
个别受试者参与将包括在约2周(14天)内进行2次访问。
[1391]
8.9.监测和质量保证
[1392]
在研究过程中监测者或委任者将进行常规现场访问以审查方案顺应性、评定研究药物当责、受试者安全和确保研究正根据相关法规要求进行。将以充分维护受试者机密性的方式进行对受试者医学记录进行查阅。研究监测的更多细节将概述于监测计划中。
[1393]
9.不良事件
[1394]
9.1.不良事件
[1395]
不良事件定义为与在人中使用药物相关的任何不幸医疗现象,无论所述事件是否被视为药物相关的。不良事件因此可为受试者开始给与研究药物之后出现的任何不利未预期征象(例如,异常实验室发现)、症状或疾病,而不对因果关系进行任何判断。在施用研究药物之后发生恶化的任何预先存在的医学病状也将被视为新不良事件。
[1396]
研究药物包括评估中研究药物和安慰剂。
[1397]
应就研究者观测或受试者在间接询问后报告的任何病症或症状的性质、发作日期、结束日期、严重程度、与研究药物的关系、所采取的行动、严重性和结果对不良事件进行归档。
[1398]
9.1.1.严重程度
[1399]
不良事件的严重程度定义为对如由研究者确定或由患者/受试者报告给研究者的不良事件的强度程度的定性评定。严重程度的评定在不考虑与研究药物的关系或事件的严重性的情况下进行,且应根据以下量表进行评估:
[1400]
·
轻度:事件对受试者而言值得注意,但容易耐受且不干扰受试者的日常活动。
[1401]
·
中度:事件造成困扰,可能需要额外治疗,且可能干扰受试者的日常活动。
[1402]
·
严重:事件不可耐受,使得有必要进行额外治疗或改变疗法,并且干扰受试者的日常活动。
[1403]
9.1.2.与研究药物的关系
[1404]
将使用这些解释,由研究者(以不知情方式)确定各ae与研究产品的关系:
[1405]
·
确定:当有正当原因和充分归档证明研究产品与ae之间的直接因果关系时;
[1406]
·
大概:当有正当原因和充分归档在似真、可想到、可能但未必高概率的意义上假定因果关系时。
[1407]
·
可能:当信息足以接受在并非不可能和并非不会的意义上的因果关系的可能性,但联系不确定或可疑(例如由于缺失数据或证据不足)时。
[1408]
·
无:当信息足以接受缺乏在不可能和未必的意义上的因果关系时。
[1409]
·
未分类:当由于证据不足、数据矛盾或不良归档导致出于任何原因均不能得到因果关系时。
[1410]
9.1.3.预期
[1411]
将使用这些解释,基于关于研究药物的现存安全信息来确定不良事件的预期:
[1412]
·
非预期:观测到在研究者手册中未列出或者未以特异性或严重性列出的不良事件。
[1413]
·
预期:观测到研究者手册中以特异性或严重性列出的不良事件。
[1414]
·
不适用:与研究药物无关的任何不良事件。
[1415]
研究者手册中提及为在一类药物下发生或因药物的药理学性质而被预见到但未明确提及为在所研究的特定药物下发生的不良事件也被视为未预期的。
[1416]
研究者应对不良事件的预期进行初步分类,但最终分类服从医学监测器的测定。
[1417]
9.2.严重不良事件
[1418]
如果在研究者或主办者看来不良事件会导致任何以下结果,则其被视为严重的:
[1419]
·
死亡:
[1420]
·
危及生命的不良事件;
[1421]
注意:如果在研究者或主办者看来不良事件的出现将患者或受试者置于直接死亡风险下,则其被视为“危及生命的”。其不包括已以更严重形式出现、可能已导致死亡的不良事件。
[1422]
·
住院患者住院或延长现存住院;
[1423]
注意:术语“住院患者住院”是指任何住院患者入院(即使少于24小时)。对于慢性或长期住院患者,住院患者入院包括在医院内转移至加急/加护住院患者病房。住院患者住院不包括:急诊室就诊;门诊患者/同一天/不卧床程序;观察/短期停留病房;康复机构;安宁疗护机构;疗养院;或临床研究/第1期病房。
[1424]
注意:术语“延长现存住院”是指住院患者住院超出如研究者或治疗医师所确定的初始入院原因预期或需要的停留的任何延长。
[1425]
·
持续或显著无行为能力或进行正常生命功能的能力受到实质性破环;
[1426]
注意:特定来说与视觉威胁相关的严重不良事件将解释为对受试者眼睛的任何潜在损伤或破坏(例如出血、视网膜脱离、中心性角膜溃疡或视神经损伤)。
[1427]
·
先天性缺陷/出生缺陷。
[1428]
未必导致死亡、危及生命或需要住院的重要医学事件当基于适当医学判断,其可能危害患者或受试者且可能需要医学或手术干预以预防此定义中所列出的结果之一时,可被视为严重的。
[1429]
9.3.报告不良事件的程序
[1430]
必须报告并记录所有不良事件及其结果。
[1431]
9.3.1.报告疑似未预期不良反应
[1432]
将报告所有“疑似”和“未预期”不良事件。
[1433]
9.3.2.报告严重不良事件
[1434]
为了确保受试者安全,必须立即报告所有严重不良事件而不考虑与研究药物的关系。与严重不良事件有关的所有信息必须记录在适当病例报告表上。必须追踪所有经历严重不良事件的受试者且报告结果。
[1435]
为防止严重不良事件,研究者必须立即告知主办者;在其档案中获得并保留所有相关医学记录、信息以及来自参与治疗和追踪受试者的同事的医学判断;给主办者提供完整病历。
[1436]
9.3研究药物的知情程序
[1437]
参与进行研究的所有受试者、研究者和研究人员将对治疗分配不知情。当医学上有必要时,研究者可能需要确定已给受试者分配哪个治疗组。知情受试者将中止研究。
[1438]
9.5不良事件后对受试者进行的追踪的类型和持续时间
[1439]
研究者将追踪未消退的ae至消退,直至受试者失访或直至ae被另外分类。消退意谓受试者已返回基线健康状态,或研究者不预期ae的任何进一步改善或恶化。如果患者失访,则研究者将经由电话、公告或挂号信进行3次合理尝试来联系患者。所有追踪均将归档在受试者的原始文件中。
[1440]
如果研究者获悉关于存在sae的任何新信息(即,消退、状况变化或新治疗),则必须完成新sae/未预期报告表。不改变原始sae表。报告将描述事件是已消退或是继续和如何处理事件。
[1441]
10.统计假设和分析方法
[1442]
10.1.分析群体
[1443]
将考虑以下分析群体:
[1444]
·
意向治疗群体-意向治疗(itt)群体包括所有随机化受试者。itt群体中的受试
者将依随机化原样加以分析。
[1445]
·
符合方案群体-符合方案(pp)群体包括itt群体中不具有重大方案偏差且完成研究的受试者。方案偏差将在数据库锁定前加以评定且为知情的。pp群体中的受试者将依治疗原样加以分析。
[1446]
·
安全性群体-安全性群体包括已接受至少一剂研究产品的所有受试者。安全性群体中的受试者将依治疗原样加以分析。
[1447]
将对安全性群体进行安全性数据统计分析。将itt群体进行基线和效力数据分析。还将依敏感性分析对pp群体进行效力分析。
[1448]
10.2.统计假设
[1449]h01
:化合物1鼻用喷雾(低剂量、中剂量或高剂量)与安慰剂之间在相对于修门氏测试结果中的基线的变化方面不存在差异。
[1450]h11
:化合物1鼻用喷雾(低剂量、中剂量或高剂量)与安慰剂之间在相对于修门氏测试结果中的基线的变化方面存在差异。
[1451]h02
:化合物1鼻用喷雾(低剂量、中剂量或高剂量)与安慰剂之间在相对于治疗前后的eds变化方面不存在差异。
[1452]h12
:化合物1鼻用喷雾(低剂量、中剂量或高剂量)与安慰剂之间在相对于治疗前后的eds变化方面存在差异。
[1453]
成功的结果将为否定两个零假设(h
01
和h
02
)的结果。
[1454]
10.3.样品大小
[1455]
此研究的样品大小不基于统计检力考虑。预期四个治疗组各自将征募约50名受试者,总计约200名随机化受试者。假定5%退出率,预期每组有约47名受试者完成研究。
[1456]
10.4.统计分析
[1457]
10.4.1.总体考虑
[1458]
将使用受试者数目(n)、平均值、中值、标准偏差、最小值和最大值来概述定量变量。将使用计数和百分比来概述定性变量。
[1459]
所有概述将由治疗组提供。概述将提供人口统计数据、病史、伴随药物疗法和受试者素因。
[1460]
出于概述的目的,适当时将根据meddra和who药物字典对病史、伴随药物疗法和不良事件进行编代码。
[1461]
基线测量定义为开始研究治疗前的最后一次测量,通常在第1次访问筛选时。
[1462]
10.4.2.分析单位
[1463]
将分析两只眼睛的安全终点。对于效力终点,分析单位将为如以下所定义的研究眼睛:
[1464]
研究眼睛定义为满足所有包括/排除准则的眼睛;如果两只眼睛均合格,则为筛选访问时在棉拭子刺激下具有最大泪液产生增加的眼睛,或如果所刺激的泪液产生无差异,则为筛选时具有较低基础修门氏评分的眼睛。如果任一度量均无差异,则将使用右眼作为研究眼睛。
[1465]
10.4.3.缺失数据
[1466]
将使用所观测的数据(在不输入缺失数据的情况下)进行主要分析。将使用马可夫
链蒙地卡罗(mcmc)多重插补法来插补缺失数据而对主要效力分析进行敏感性分析。预期数据缺失率较低;然而,如果数据缺失率超过5%,则将采用其他缺失数据插补法(诸如临界端点分析)来理解缺失数据对主要结果的潜在影响。
[1467]
将仅使用观测数据进行其他效力分析。
[1468]
10.4.4.多重性考虑
[1469]
对于此早期研究,不会对多重测试实施调节。
[1470]
10.4.5.主要效力分析
[1471]
将对以下终点进行主要效力分析:
[1472]
·
第1次访问时的修门氏测试
[1473]
·
第2次访问时在cae期间的眼干燥度评分
[1474]
将通过访问、时间点(适当时)和治疗以定量描述性统计数据(n、平均值、中值、标准偏差、最小值和最大值)来概述修门氏测试和眼干燥度评分。
[1475]
将使用ancova模型在化合物1鼻用喷雾与安慰剂治疗组的各剂量之间比较与治疗并行的修门氏测试的结果。ancova模型将包括基线修门氏测试(筛选时获得)、治疗和研究地点作为共变量。将由此ancova模型计算各治疗的最小二乘平均值(ls平均值)、相应95%信赖区间(ci)以及化合物1鼻用喷雾与安慰剂的各剂量之间的估计治疗差异。另外,将在单独模型中研究治疗相互作用的研究地点,以评估治疗效果如何因研究地点而异。
[1476]
将使用ancova模型分析治疗前后的eds变化,以治疗前eds作为共变量且以治疗和时间点作为固定效应(解释重复测量)。将由此ancova模型计算各治疗的ls平均值、相应95%ci以及化合物1鼻用喷雾与安慰剂的各剂量之间的估计治疗差异。还将在单独模型中研究治疗相互作用的研究地点,以评估治疗效果如何因研究地点而异。
[1477]
将对itt群体的观测数据进行主要分析。将使用双样本t检验和非参数威尔克森秩和检验来比较治疗,作为未调节的敏感性分析。还将利用旨在插补缺失数据的多重插补(mi)对itt群体以及仅利用观测数据对pp群体进行敏感性分析。
[1478]
10.4.6.其他效力分析
[1479]
还将以类似于修门氏测试的主要分析的方式在各个别时间点分析治疗前后的eds变化。这些ancova模型将包括治疗前eds、治疗和研究地点作为共变量。
[1480]
将通过访问、时间点(适当时)和治疗以定量描述性统计数据来概述ora calibra眼部不适量表结果在治疗前后的变化,并且将以类似于eds的方式在各个别时间点进行分析。
[1481]
将仅对itt和pp群体的观测数据进行分析。
[1482]
10.4.7.安全性变量
[1483]
将使用meddra字典给不良事件编代码。受试者具有治疗后出现的不良事件(teae)、严重teae和引起过早中止的teae的频率和百分比将由治疗组提供。如果ae在第一剂研究治疗之后出现或恶化,则其为在治疗后出现的。此外,将通过系统器官类别、通过系统器官类别和优先项、通过系统器官类别、优先项和最大严重程度、通过系统器官类别、优先项和最强关系以及通过系统器官类别、优先项、最大严重程度和最强关系来考虑受试者的teae频率。将对眼部特有的和所有ae(包括全身性)进行单独的分析。
[1484]
将使用描述性统计数据由治疗组和访问汇总其他安全性终点,包括视敏度、狭缝
灯活组织显微镜检查和鼻内内视镜检查。适当时还将汇总相对于基线的变化。为了通过眼睛进行评定,将分别汇总研究眼睛和配对眼睛。另外,将汇总眼部安全性评定的自基线至最糟糕治疗值的变化。
[1485]
10.4.8.期间分析
[1486]
未针对此研究计划期间分析。
[1487]
11.优良临床规范遵从情况、伦理考虑和行政管理问题
[1488]
将遵从方案优良临床规范(gcp),包括国际协调会议(ich)指导方针且一般遵照赫尔辛基宣言来进行此研究。另外,将遵守与在所涉及国家中使用研究药物有关的所有适用地方、州和联邦要求。
[1489]
11.1.对人类受试者的保护
[1490]
11.1.1.受试者知情同意
[1491]
必须在开始任何研究特定程序之前取得知情同意/应允。在参与研究之前必须从各受试者和/或从受试者父母或法定监护人获得有签名和日期的书面知情同意。如果受试者低于同意的法定年龄,则必须由法定监护人或如州和/或地方法律和法规所要求来签署同意书。
[1492]
所有知情同意/应允书必须由主办者批准使用且在其使用前接受来自irb/iec的批准/赞成意见。如果同意书需要修订(例如由于方案修正或重要新安全信息),则研究者有责任确保修正的知情同意在提交至管理irb/iec前由ora审阅并批准,且其被所有后续参与研究的受试者以及当前参与研究的那些受试者阅读、签名和签署日期。
[1493]
11.1.2.机构审查委员会(irb)批准
[1494]
将根据机构审查委员会法规(美国21cfr第56.103部分)进行此研究。研究者必须在研究开始前获得适当irb批准且至少每年获得再次批准。
[1495]
将仅使用irb/erc批准版本的知情同意书。
[1496]
11.2.研究的伦理行为
[1497]
此研究将根据始从于赫尔辛基宣言的伦理原则来进行。
[1498]
11.3.受试者机密性
[1499]
出于此研究的目的而收集并处理的所有私人研究受试者数据将在具有充足预防措施确保数据机密性符合地方、州和联邦法律和法规的情况下由研究者和其工作人员加以维护。
[1500]
此研究结果的报告可公开或发送至可能最终销售研究药物的任何国家的适当健康当局,但这些文件中不会公开受试者身分。
[1501]
11.4.文件处理
[1502]
原始文件可包括受试者的医学记录、医院表格、门诊表格、研究者的研究受试者文档以及诊断测试(诸如x射线、实验室测试和ekg)的结果。病例报告表的研究者副本充当受试者研究相关数据的研究者记录。
[1503]
11.4.1.文件保留
[1504]
所有研究相关函件、受试者记录、同意书、所有研究药物分布和使用记录和病例报告表副本均将在最后一次批准在ich区域中进行销售应用后维持在文档上至少两年且直至在ich区域中不存在未决或预想的销售应用;或直至自正式中止研究药物的临床开发已过
iontophoresis of egp-437(dexamethasone phosphate)in dry eye patients:results of a randomized clinical trial.clin ophthalmol 201 1;5:633-43.
[1537]
15petrov a,perekhvatova n,skulachev m,stein l,ousler g.skq1 ophthalmic solution for dry eye treatment:results of a phase 2 safety and efficacy clinical study in the env ironment and during challenge in the controlled adverse environment model.advsnces in therapy 2016;33:96-115.
[1538]
16.sernba cp,torkildsen gl,lonsdale jd,et al.a phase 2 randomized,double-masked,placebo-controlled study of a novel integrin antagonist(sar 1118)for the treatment of dry eye.am j ophthalmol 2012;153:1050-60el.
[1539]
17.sosne g,ousler gw.thymosin beta 4 ophthalmic solution for dry eye:a randomized,placebo-controlled,phase ii clinical trial conducted using the controlled adverse environment(cae)model.clin ophthalmol 2015;9:877-84.
[1540]
18.ousler gw,gomes pj,welch d,abelson mb.methodologies for the study of ocular surface disease.ocul surf2005;3:143-54.
[1541]
访问和测量排程
[1542]
[1543][1544]
检查程序、测试、设备和技术
[1545]
此部分中列出以下检查程序、测试、设备和技术:
[1546]
视力程序
[1547]
必须使用etdrs视力表来评定logmar视力。所使用的程序将与针对使用etdrs视力表所提供的推荐一致。应在研究各访问开始时(即,在狭缝灯检查前)评估视力。参与者将使用最新矫正来获得其矫正远视力(cdva);如果其忘带眼镜,则可将此处方置于试镜架中。
[1548]
设备
[1549]
欲使用的视力表为etdrs视力表。如果使用较小翻印(18
″×
18
″
,例如得自于prevent blindness)壁挂式视力表,则参与者检视距离将刚好为10英尺(或如制造商所说明)。在所有情况下,出于使研究期间的测试条件标准化的目的,所有场所必须仅使用etdrs 2000系列视力表1和视力表2,并且将首先测试右眼。对于屈光(壁挂式)视力表,应将视力表置于前方且加以充分说明。
[1550]
测量技术
[1551]
视力表应在舒适视角下。应首先测试右眼。参与者将试图以视力表顶部第1行为起点从左至右逐行读取各字母。应告知参与者视力表仅有字母、无数字。如果参与者读出数字,则应提醒其视力表不含数字,且检查人员接着将要求以字母替代数字。应要求参与者缓慢读取,以达成对各字母的最佳鉴别。其不应继续下一字母,直至其已给出确切回答。
[1552]
如果参与者在其大声读出下一字母之前改变回答(例如,为“c”而非“o”),则必须接受改变。如果参与者在已读出下一字母的情况下改变回答,则不接受改变。在测试期间,检查人员应决不指向视力表或视力表上的特定字母。
[1553]
应作出最大努力以鉴别视力表上的每一个字母。当参与者说其无法读出字母时,应鼓励其猜测。如果参与者将一个字母鉴别为两个字母之一,则应要求其选择一个字母且必要时进行猜测。当明显无法给出其他有意义读数时,尽管鼓励读取或猜测,但检查人员将停止测试此眼睛。然而,应尝试最后一行上的所有字母,因为字母难度变化且最后一个可能为唯一被正确读出的字母。应指出缺失或未正确读出的字母的数目。
[1554]
logmar视力计算
[1555]
字母被正确读出的最后一行将作为基础logmar读数。此值将加上数字
″n×
0.02
″
,其中
′n′
表示直至且包括最后一行读数所缺失的字母的总数。此总和表示此眼睛的logmar视力。
[1556]
实施例:参与者正确读出第0.2行上5个字母中的4个和第0.1行上5个字母中的2个。
[1557]
基础logmar=0.1n(第0.2行以及第0.1行上不正确的字母总数)=4n
×
t(t=0.02)=0.08基础logmar (n
×
t)=0.1 0.08logmar视力=0.18
[1558]
对左眼重复所述程序。
[1559]
为了在研究期间提供标准化且充分受控的视力评定,单一现场的所有视力评定必须在整个研究期间在有可能时使用相同照明条件和相同矫正而一致地进行。如果无法使用相同矫正(即,参与者打碎其眼镜),则应记录矫正变化的原因。
[1560]
注意:得自于筛选访问(第1次访问)的临床上显著的视力降低(定义为logmar评分增加0.22以上)将由研究者评估为潜在ae。
[1561]
狭缝灯活组织显微镜检查
[1562]
将在研究期间进行狭缝灯活组织显微镜检查。观测结果将分等级为正常或异常。将描述临床上显著的异常发现。在每一次访问时将检查以下各项:
[1563]
·
角膜
[1564]
·
结膜
[1565]
·
前房
[1566]
·
眼睑
[1567]
角膜荧光素染色
[1568]
检查人员将5μl 2%无防腐剂荧光素钠溶液滴注至各眼睛的结膜下穹窿中。替代地,可使用1.0mg荧光素钠试片来评定角膜染色。在用无菌缓冲生理盐水润湿试片的顶端后,利用急速轻弹将过量生理盐水振荡至废物箱中。接着将下眼睑拉下并且将顶端的平端轻轻施加至下脸板结膜,意图不诱导反射性流泪且滴注极小体积的染料。
[1569]
将告知参与者自然地眨眼数次,而不强制闭合眼睑来分布荧光素。为了达成最大荧光,检查人员在滴注之后、评估角膜荧光素染色之前将等待至少两分钟。将使用拉登第12号黄色滤光片来增强对荧光素染色进行分等级的能力。将利用nei量表对染色进行分等级。稍微掀起上眼睑以便对整个角膜表面进行分等级。可获取荧光素染色的数字影像以用于数字分析。
[1570]
nei/工业工作坊规模
[1571]
用图2中所示的分等级系统对各眼睛角膜上的五个区域中的每一个进行评分。图2显示用于测量荧光素吸收的角膜表面分区图。将0-3标准化分等级系统用于各角膜上的五个区域中的每一个。当不存在染色时,将规定等级0。最大评分为15。
[1572]
鼻内检查
[1573]
本研究的合格参与者必须经历鼻内视镜检法检查以作出最终合格决定(例如,检查时所见的严重鼻气道堵塞(诸如严重鼻中隔弯曲或下鼻甲肥大)或血管化息肉为排除的原因)。为了出于参与者安全性的目的而在研究期间监测鼻粘膜完整性,将在筛选访问时经由内视照相机进行鼻腔检查(在已完成其他筛选程序之后)。此检查将由耳鼻喉(ent)专家、耳鼻喉科医师或其他合格开业医生(即,已训练过进行鼻内视镜检法的人士)来进行。可捕获静止影像或视频。应告知参与者在将进行鼻内视镜检法当天不进行鼻刺激。
[1574]
利用局部麻醉的修门氏测试
[1575]
在筛选访问时,将进行一次基础修门氏测试,继而在棉拭子鼻刺激下进行修门氏测试。利用局部麻醉剂的修门氏测试将用于评定泪液产生,使用以下步骤:
[1576]
1.诸如0.5%丙对卡因盐酸盐或等效物的局部麻醉点眼剂将滴注在参与者的双眼中。
[1577]
2.将告知参与者保持眼睛轻轻闭合一分钟。
[1578]
3.在睁开眼睛且再允许眼睛再重新闭上约一分钟之后,用矛状体轻轻地移除下穹窿中的过量水分。
[1579]
4.将修门氏试片(35mm
×
5mm尺寸滤纸试片)放在每一只眼睛中下眼睑中间三分之一与侧向三分之一的连接处。
[1580]
5.在环境光下,将告知参与者在测试过程中正常地向前看和眨眼。测试应在室内在参与者面上无直接空气的情况下进行。
[1581]
6.修门氏试片将保持就位,直至已逝去五分钟或两个试片均已达到最大评分。
[1582]
7.五分钟之后,将从双眼移出试片并且将记录润湿的量。应将试片用胶带贴至crf。
[1583]
使用棉拭子鼻刺激的修门氏测试
[1584]
在筛选访问时,将使用棉拭子鼻刺激来进行修门氏测试。在以上步骤1至步骤3中所规定的相同程序后将滴注新麻醉点眼剂。
[1585]
1.在新试片就位的情况下,检查人员将在参与者的两个鼻孔中同时插入棉拭子且轻轻地探测两个中鼻甲约30秒。此后,检查人员可仅保持拭子就位,施加轻微压力,且视需要间歇性地重复探测。
[1586]
2.替代地,可告知参与者手持棉拭子且同时轻轻地探测两个鼻甲,在再次探测之前间歇性地休息。检查人员将连续指导参与者如何适当地进行此测试。
[1587]
3.修门氏试片将保持就位,直至已逝去五分钟或两个试片均已达到最大评分。
[1588]
将记录两个修门氏评分且验证其满足纳入准则。
[1589]
眼表面疾病眼表面疾病
[1590]
为了减小偏差,将要求参与者在现场人员已提供说明之后独立地且私密地完成osdi问卷。
[1591]
osdi为由结果研究小组在allergan(irvine,ca)制作的12项问卷
22
,其要求参与者描述其刺激症状的严重程度和性质。参与者将通过圈出最能代表各回答的数字来回答12个问题:4(所有时间)、3(大部分时间)、2(一半时间)、1(有些时间)或0(全无时间)。如下计算问卷的最终评分:
[1592]
来自于第i部分、第ii部分和第iii部分的小计相加=a
[1593]
来自第i部分、第ii部分和第iii部分的确定回答问题总数(不包括n/a)=b
[1594]
最终osdi评分=a
×
25/b
[1595]
问卷的实例示于图3中。
[1596]
使用视觉模拟量表(vas)的眼干燥度评分(eds)
[1597]
将在cae
sm
暴露期间每5分钟询问参与者以下关于眼干燥度的问题。
[1598]
将要求参与者通过在水平线上置放垂直标记以指示不适水平来对其由于眼睛干燥所致的眼症状(两只眼睛同时)进行分级;0对应于“无不适”,且100对应于“最大不适”。量表的评定线长度将为100mm。
[1599]
请通过在以下在线画出垂直线对您当前眼干燥度进行分级:
[1600][1601]
eds为其他研究
23,24
中已使用的仪器。
[1602]
ora calibra
tm
眼部不适量表
[1603]
将由参与者根据以下量表对眼部不适评分进行主观分等级,从而单独地对每一只眼睛进行分级。
[1604]
0=无不适
[1605]
1=间歇性觉察
[1606]
2=持续性觉察
[1607]
3=间歇性不适
[1608]
4=持续性不适
[1609]
尽管本文中已显示并描述本发明的优选实施方案,但本领域技术人员将显而易见此类实施方案仅以实施例方式提供。本领域技术人员将在不背离本发明的情况下想到许多变更、变化和取代。应理解,本文中所描述的本发明实施方案的各种替代方案可用于实施本发明。预计以下权利要求界定本发明的范围且从而涵盖在这些权利要求的范围内的方法和结构及其等效内容。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
