1.本发明涉及药物技术领域,尤其是涉及一种治疗局部晚期(t4nxm0)微卫星稳定型(pmmr/mss)结直肠癌的药物组合物以及应用。
背景技术:
2.结直肠癌(colorectal cancer,crc)是人类最常见的恶性肿瘤之一。目前,根治性切除术-术前新辅助化疗治疗结直肠癌,仍然是nccn、esmo这两大国际指南以及中国的csco指南推荐的标准综合治疗模式。错配修复蛋白(mmr)表达和微卫星稳定性状态是影响免疫治疗疗效的重要因素。近两三年,pd-1单抗免疫治疗在dmmr/msi-h的晚期结直肠癌二线/一线治疗以及早期结肠癌新辅助治疗中疗效显著,均显示出非常好的疗效,且治疗安全、毒性可控,但这部分患者仅占所有结直肠癌的8-10%,而90%的结直肠癌患者属于微卫星稳定型(pmmr/mss)。
3.局部晚期结直肠癌(t4nxm0)因为局部肿瘤穿透浆膜层与腹壁或周围器官组织浸润侵犯,往往难以一期r0切除,而无法r0切除意味着患者肿瘤残留并且失去治愈的可能,生命进入倒计时状态。目前,对于微卫星不稳定(msi-h)的结直肠癌,单药pd-1或联合其它免疫治疗已经成为一线治疗首选。mfolfoxiri是目前局部晚期结直肠癌新辅或转化降期的常用方案之一,在局部晚期直肠癌中肿瘤降期率约为41%,但副作用相比mfolfox6较大。除此之外,亦有使用含卡培他滨类化疗药物(capeox)。卡培他滨 奥沙利铂用于一线治疗的反应率、疾病进展时间和总生存期与folfox6组合相似。除常规的化疗外,如今临床亦多使用新辅助化疗,指患者预备手术前行全身的化疗,新辅助化疗适用于手术切除难度较大,不易完全切除的肿瘤。目前对于局部晚期(t4nxm0)微卫星稳定(mss)结直肠癌的治疗尚无明确的标准方案。
技术实现要素:
4.本发明的目的在于克服上述现有技术的不足之处而提供一种治疗局部晚期(t4nxm0)微卫星稳定型(pmmr/mss)结直肠癌的药物组合物以及应用。
5.为实现上述目的,本发明采取的技术方案为:
6.第一目的,本发明提供一种治疗局部晚期(t4nxm0)微卫星稳定型(pmmr/mss)结直肠癌的药物组合物,其特征在于,包括mfolfox6、贝伐单抗和pd-1抑制剂。
7.作为本发明所述药物组合物的优选实施方式,mfolfox6包括奥沙利铂和氟尿嘧啶/卡培他滨。pd-1抑制剂包括pd-1抗体和pd-l1抗体。
8.作为本发明所述药物组合物的优选实施方式,所述药物组合物还包括药学上可接受的载体。
9.作为本发明所述药物组合物的优选实施方式,所述药物组合物的剂型为注射药剂型。更优选地,所述药物组合物由mfolfox6、贝伐珠单抗注射液和重组人源化抗pd-1单克隆
抗体注射液组成。
10.第二目的,本发明提供上述药物组合物在制备治疗局部晚期(t4nxm0)微卫星稳定型(pmmr/mss)结直肠癌药物中的应用。
11.作为本发明所述应用的优选实施方式,术前采用上述药物组合物治疗5疗程,术后三到四周若未达到病理完全缓解继续采用上述药物组合物治疗6疗程。
12.作为本发明所述应用的优选实施方式,所述药物组合物可以提高病理完全缓解率和主要病理缓解率。
13.作为本发明所述应用的优选实施方式,初始完成3个疗程如上述药物组合物治疗后进行影像及生物学疗效评估,若影像检查显示疗效为肿瘤退缩及肿瘤标记物检测值下降,则继续完成后续新辅助或转化治疗。
14.作为本发明所述应用的优选实施方式,所述疗效评估包括盆腔mr平扫 增强,胸部及上、下腹部ct平扫 增强,检测肿瘤标记物cea和ca19-9。
15.本发明的药物组合物包括mfolfox6、贝伐单抗和pd-1抑制剂,现有技术并未记载上述药物组合物可以治疗局部晚期(t4nxm0)微卫星稳定型(pmmr/mss)结直肠癌,经过实验验证,上述药物组合物治疗18例局部晚期的msscrc,14例达到主要病理缓解(肿瘤退缩均超过90%),其中10例病理完全缓解(无肿瘤细胞残留),肿瘤标记物均降至正常,无致死性sae事件,具有良好的安全性及有效性。因此,针对局部晚期(t4nxm0)微卫星稳定型结直肠癌患者,联合本发明的药物组合物以求尽可能使肿瘤退缩,从而尽可能提高r0切除率及pcr率(病理完全缓解率),以及避免三药化疗及同步放化疗的毒副作用。
16.本发明拟针对局部晚期mss结直肠癌患者联合使用上述药物组合物治疗的安全性及有效性的开放性、多中心、ⅱ期研究,从而为局部晚期微卫星稳定型结直肠癌患者最大程度的保功能、保器官并显著提高其生存质量,为结直肠癌患者个体化精准治疗提供确切的临床证据。
17.与现有技术相比,本发明具有以下有益效果:
18.本发明提供了一种药物组合物,其包括mfolfox6、贝伐单抗和pd-1抑制剂,该药物组合物可以用于治疗局部晚期(t4nxm0)微卫星稳定型(pmmr/mss)结直肠癌,能够同时提高pcr率(病理完全缓解率)和mpr率(主要病理缓解率),治疗效果安全且有效。
附图说明
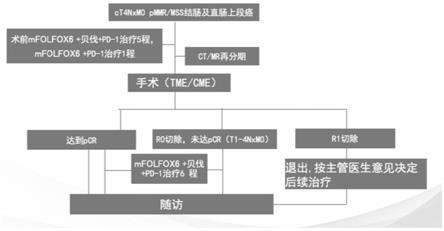
19.图1为本发明的实验流程图。
具体实施方式
20.为更好的说明本发明的目的、技术方案和优点,下面将结合附图和具体实施例对本发明作进一步说明。
21.在以下实施例中,所使用的实验方法如无特殊说明,均为常规方法,所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
22.实施例1
23.1、受试者入选标准:
24.1)组织学确认为结直肠腺癌(结肠、上段直肠);
25.2)肿瘤活检免疫组化提示pmmr,即msh1、msh2、msh6和pms2四种蛋白均有表达判定为微卫星稳定(microsatellite stability,mss);mri检查明确肿瘤下缘腹膜反折以上;
26.3)临床分期t4nxm0,伴或不伴mrf阳性,伴或不伴emvi阳性;
27.4)术前分期方法:所有患者采用增强ct进行术前分期,肠周转移性淋巴结:短径≥10mm淋巴结或者淋巴结形状及ct特征符合典型的淋巴结转移;术前胸、腹ct、盆腔mri排除远处转移;
28.5)无肠梗阻征象;或肠梗阻经近端结肠造瘘手术后梗阻已缓解者;
29.6)既往未接受过结直肠手术;既往未接受过化疗或放射治疗;既往未接受过生物药物治疗(如单克隆抗体)、免疫治疗(如抗pd-1抗体、抗pd-l1抗体、抗pd-l2抗体或抗ctla-4),或其它研究药物治疗;签署知情同意书。
30.7)受试者特征:年龄为18岁~80岁;活动状态评分参考ecog 0-1;期望寿命为大于2年;血液学:wbc》3
×
109/l、plt》80
×
109/l、hb》90g/l;肝功能:alt及ast小于正常值的2倍;胆红素小于正常值的1.5倍;肾功能:肌酐小于正常值的1.5倍或肌酐清除率(ccr)≥60ml/min。
31.2、受试者排除标准:入组的患者不可出现以下任一情况:
32.1)心律失常需要接受抗心律失常治疗(β-阻断剂或地高辛除外),症状性冠状动脉疾病或心肌局部缺血(最近6个月内的心肌梗塞)或充血性心力衰竭超过nyha ii级;
33.2)药物控制不良的严重高血压;
34.3)hiv感染史或活动期的慢性乙型或丙型肝炎(高拷贝病毒dna);
35.4)患有活动性肺结核(tb)的受试者,正在接受抗结核治疗或者筛选前1年内接受过抗结核治疗;
36.5)其他活动性临床严重感染(nci-ctc 5.0版);
37.6)术前已有证据表明有盆腔外的远处转移;
38.7)恶液质,器官功能失代偿;
39.8)有盆腔或腹部放疗史;
40.9)多原发结直肠癌;
41.10)癫痫发作需要进行处理的患者(例如类固醇类或抗癫痫治疗);
42.11)5年内有其他恶性肿瘤病史,已治愈的宫颈原位癌或皮肤基底细胞癌除外;
43.12)滥用药物以及医学、心理学或社会条件可能干扰患者参与研究或对研究结果的评估有影响;
44.13)受试者存在任何活动性自身免疫性疾病或有自身免疫性疾病病史(包括但不限于:间质性肺炎、葡萄膜炎、肠炎、肝炎、垂体炎、肾炎、甲状腺功能亢进、甲状腺功能降低;患有白癜风或在童年期哮喘已完全缓解,成人后无需任何干预的受试者可纳入;患有需要支气管扩张剂进行医学干预的哮喘则不能纳入);
45.14)入组前4周内接种过任何抗感染疫苗(如流感疫苗、水痘疫苗等);
46.15)患有需要长期使用免疫抑制药物治疗、或需要全身或局部使用具有免疫抑制作用剂量(剂量》10mg/天的泼尼松或其它等疗效激素)的皮质类固醇的合并症;
47.16)已知或怀疑对研究药物过敏或对给予的与本试验相关的任何药物过敏;任何不稳定的状况或可能危及患者安全性以及依从性的情况;妊娠或哺乳期妇女有生育能力而
未采取充分避孕措施者;拒绝签署知情同意书。
48.3、样本量的验证:
49.该研究采用simon最佳二阶段研究设计。
50.入组患者为mss结肠及直肠上段癌患者,参考foxtrot和本单位optical在局部进展期直肠癌治疗的pcr率4%,设定最大无效界值为0.2,最小有效界值为0.04,α=0.05,β=0.1,第一阶段样本量为19,其中少要有1人达到pcr,否则研究失败,有1人达到pcr就可以第二阶段招募受试者,第二阶段招募人数为19人。考虑到10%的病例脱失,计算得出需要的样本量为42例。
51.4、药物组合物组成:
52.本发明治疗局部晚期(t4nxm0)微卫星稳定型(pmmr/mss)结直肠癌的药物组合物由mfolfox6(奥沙利铂 氟尿嘧啶/卡培他滨)、贝伐珠单抗注射液和重组人源化抗pd-1单克隆抗体注射液组成。
53.上述贝伐珠单抗注射液和重组人源化抗pd-1单克隆抗体注射液均来源于信达生物制药(苏州)有限公司。
54.其中,重组人源化抗pd-1单克隆抗体注射液的成分为:重组全人源抗程序性死亡受体1单克隆抗体(100mg),140mmol/l甘露醇,25mmol/l组氨酸,20mmol/l二水枸橼酸钠,50mmol/l氯化钠,0.02mmol/l依地酸二钠(乙二胺四乙酸二钠),0.2mg/ml聚山梨酯80,ph值为6.0。
55.贝伐珠单抗注射液的成分为:贝伐珠单抗,醋酸钠、山梨醇、聚山梨酯80、冰醋酸、注射用水,ph值为6.0。
56.5、实验方法:
57.1)pmmr/mss结肠及直肠上段癌患者(2020年12月至2021年6月期间,本研究探索性招募了18例就诊于中山大学附属第六医院的临床分期为t4nxm0(ajcc第8版)的局部晚期结肠癌或上段直肠癌患者)签署知情同意书;
58.2)初始完成3疗程mfolfox6 贝伐单抗 pd-1抑制剂治疗(为保证根治性手术能如期进行,末次新辅助治疗未联合贝伐珠单抗注射液)后进行影像及生物学疗效评估,若影像检查显示疗效为肿瘤退缩及肿瘤标记物检测值下降,则继续完成后续新辅助或转化治疗;
59.3)所有患者在2周每疗程的第1天静脉滴注重组人源化抗pd-1单克隆抗体注射液200mg,滴注30~60分钟,q2w;完成6程术前治疗结束后,ct/mr再分期并安排手术,根治性切除手术计划在第1次新辅助治疗后12周左右进行;
60.4)术后病理证实pcr患者可选择术后三到四周继续mfolfox6 贝伐单抗 pd-1抑制剂(即上述的药物组合物)治疗6程;或者术后第一年每三个月复查,第二、三年每半年复查,第四五年每年复查;r0切除未达pcr患者术后三到四周继续mfolfox6 贝伐单抗 pd-1抑制剂(即上述的药物组合物)治疗6程,若术前6个疗程结束后因r1切除肿瘤术后残留需退出并按主管医生意见更改治疗方案;
61.5)每次疗效评价包括盆腔mr(平扫 增强),胸部及上、下腹部ct(平扫 增强),肿瘤标记物cea和ca19-9。本发明主要终点为队列患者的病理完全缓解(pcr)率。本发明还评估了主要病理缓解(mpr)率、放射学和病理回归、安全性、肿瘤突变负荷和肿瘤微环境(tme)分子。实验流程图参考图1。
62.注意本发明的pd-1抑制剂(信迪利单抗)不可静脉推注或快速注射,应建立外周或中央静脉通路。输注前,应准备好充足肾上腺素、静脉用盐酸苯海拉明或其它抗过敏药物以及复苏设备,以备严重的过敏反应发生及时使用。输注后,静脉通路应保持开放,以便需要时给药。如果没有出现并发症,输注结束后观察1个小时方可撤去静脉通路。参照2018年《esmo免疫治疗的毒性管理:esmo诊断治疗及随访临床实践指南》进行毒性的管理。
63.在治疗开始前积极的抗过敏预处理,加强心电监护、密切观察生命体征,若出现严重不良反应将尽快中止治疗,并进行心肺及肝肾功能保护支持、抗炎症风暴治疗等积极救治。在本发明中pd-1抑制剂无需调整剂量。如果受试者发生需要暂停给药的不良事件,受试者可以暂停研究治疗,信迪利单抗可因不良事件推迟最多7天,之后的给药计划顺延。推迟给药超过7天则认为此剂量缺失,受试者则根据原定的给药计划(自首次给药日算起)接受下一剂量治疗。如果受试者停药超过56天且研究者判断继续给予信迪利单抗治疗风险大于获益,则考虑永久退出研究治疗。
64.其中手术规范为:
65.结直肠癌手术:采用开腹或者腹腔镜手术。
66.以腹腔镜为例:气管内插管全身麻醉。前者取正中切口,后者通常采用4-5个trocar的技术:建立气腹、置入腹腔镜器械。
67.操作大致分为以下步骤:1)腹腔探查后,采取从内到外侧的入路,结扎并离断肠系膜下血管,注意保护左侧输尿管、生殖血管和上腹下神经;充分游离降结肠,必要时进行脾曲的游离。2)遵循cme/tme原则,进行结肠、全直肠系膜的锐性切除,并注意保护周围脏器如前列腺、阴道、盆从神经等。3)对于可通过双吻合器技术进行超低位前切除(lar)者不必行内括约肌切除(剔除病例),对必须行内括约肌切除者可转向经肛操作(同上)。
68.上述手术由胃肠外科副高以上医生操作,并具有主刀完成腹腔镜结直肠癌根治术5年以上临床经验;课题进入实施阶段前需经过统一培训。
69.手术后出院标准:患者一般情况良好,基本恢复正常饮食和肠道功能;体温正常,腹部检查无阳性体征;相关实验室检查结果基本正常;会阴部切口和/或腹部切口愈合良好(ii/甲或ii/乙)。
70.6实验结果的评价:
71.1)、病理完全缓解评估:
72.手术标本原发病灶及区域淋巴结均未见肿瘤细胞残留。邀请独立于该研究的第三方单位或个人(病理及影像学评估)进行独立盲态判断,并与本研究组内的判断结果进行一致性评估,研究结果报道时以本研究组内的分析判断结果为主,以第三方的分析判断结果为辅。
73.2)、局部复发或转移的评估:
74.当出现临床症状(肛门疼痛、便血、下肢水肿等)、cea进行性升高或在胸部或腹部影像中出现可疑征象时,需要进一步完善检查以期找到局部复发或疾病转移进展。局部区域复发主要是指手术操作的局部区域或附近淋巴流向区域以及临近脏器出现的肿瘤复发;远处转移是指上述区域以外的肿瘤复发。无病生存是指患者通过系统评估未发现肿瘤复发或新的结直肠癌的发生。
75.临床上复发转移的诊断必须符合至少下列一项:
76.①
影像学提示出现复发;(超声,ct,mri,pet-ct);
77.②
阳性细胞学检查活检;(出现腹水,吻合口复发,可疑的影像学表现);
78.上报的复发日期指采用上述诊断方法发现复发的日期。当出现复发时,研究者应当指明复发的部位及采用的诊断方法。当无法获得明确的影像学证据时,应当取得细胞学或活检的阳性结果。单纯cea升高不能作为直肠癌局部复发或转移的证据。
79.3)、生存期的计算
80.无病生存期(dfs)定义为,从入组开始到出现下段所述事件的时间间隔。必须在入组后每6个月或12个月,或在患者出现进展征兆(即出现临床指征)的时候进行肿瘤评估(腹部和盆腔的ct/mri或超声和胸部ct)和肿瘤标记物检测。由超声检查到的可疑病灶必须由ct/mri检查确认。所有的再次手术或者进一步的抗癌治疗也应记录在案。
81.根据本研究的目的,确定患者不再处于无病生存状态下的事件定义如下:
82.·
患者出现原有肿瘤复发、转移的迹象;
83.·
患者出现新的结直肠癌的迹象,
84.·
任何原因导致的死亡。
85.注:任何原有肿瘤的复发或新的结直肠癌的发生应由细胞学或组织学方法进行确认。如果没有其它针对性的检查结果做为支持性的证据(如放射学检查,组织学/细胞学检查),那么cea 的增加或无法解释的临床上的疾病恶化等孤立事件不能做为复发的判断依据。复发日期的定义为对针对性的检查结果的最后确认日期。此后患者将按计划进行生存随访。
86.如果在研究治疗期出现已确认的结直肠癌的复发或新的结直肠癌的发生,患者将退出研究治疗进行生存随访。如果在研究治疗期出现结直肠癌的复发或新的结直肠癌的发生,可根据研究者的指导对患者进行进一步治疗。
87.总生存期(os)定义为,从入组开始到患者死亡或者末次随访日期的时间间隔。全部受试患者将被随访至少5年。若做活检,则应当提供一份活检报告。总生存期指自入组至死亡的时间。无论死亡原因如何。对于临床数据库中。没有收集到死亡信息的患者,将以最后知晓仍然生存的最近日期为截点。若患者一直生存,则以其到最后一次随访的时间作为总生存期。
88.4)、新辅助治疗/辅助治疗毒副作用的评估
89.应用毒性评价根据ctcae标准(5.0版),评估患者安全性的随访应包括治疗期间及最后一周期结束后30天。
90.7、实验结果:
91.截止目前(2021年12月31日),本研究中位随访时间为4.5(1.5-9.4)个月,队列内所有患者均存活且无复发征象。所有患者均如期完成根治性切除手术,未发生根治性切除手术因新辅助治疗相关不良事件而推迟。所有患者的原发病灶均被完全切除。
92.术后病理学检测提示:18例切除肿瘤中有10例(56%)达到了pcr(无肿瘤细胞残留),4例(78%)达到了mpr(肿瘤退缩均超过90%)。本发明中有10%的患者发生了3级或以上新辅助治疗相关不良事件。在病理学检测提示pcr的患者中,有2例被发现存在pole突变。病理回归程度大于放射学回归程度。cd3 和cd3 /cd4 间质圆形肿瘤与pcr显著相关(p=均为0.024)。
93.上述实验说明mfolfox6(奥沙利铂 氟尿嘧啶/卡培他滨)、贝伐珠单抗注射液和重组人源化抗pd-1单克隆抗体注射液联合使用的新辅助治疗方案安全性与疗效较为出色,在发生较少新辅助治疗相关不良事件的同时能够实现56%pcr率和78%mpr率。基质下调cd3或cd3/cd4的表达与pcr相关(nct。)
94.最后所应当说明的是,以上实施例仅用以说明本发明的技术方案而非对本发明保护范围的限制,尽管参照较佳实施例对本发明作了详细说明,本领域的普通技术人员应当理解,可以对本发明的技术方案进行修改或者等同替换,而不脱离本发明技术方案的实质和范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。