1.本发明涉及中药现代化领域,具体涉及一种沙苑子标准汤剂及其制备方法和其检测方法。
背景技术:
2.沙苑子标准汤剂为豆科植物扁茎黄芪(astragalus com-planatus r.br.)种子的水提物。沙苑子为豆科植物扁茎黄芪(astvagalus complanatus r.br.)干燥成熟的种子,为我国的传统中药,主要产于陕西、山西、河北、内蒙古等地区,在历代本草中曾以沙苑蒺藜、沙蒺藜、沙苑蒺藜子、沙苑白蒺藜、白蒺藜、潼蒺藜、潼沙苑、夏黄草等名称入药。沙苑子主要含有黄酮类、三萜类、氨基酸类、微量元素等化学成分,具有抗氧化、抗肿瘤、保肝护肝、调节血脂、抑制血小板聚集、降血压、抗纤维化及改善血液流变学指标等作用。
3.标准汤剂又称标准煎液,是一种传统的临床广泛使用的用药形式,标准汤剂系遵循中医药理论,按照临床汤剂煎煮方法规范化煎煮,固液分离,经适当浓缩制备或经适宜方法干燥制得,作为衡量中药配方颗粒是否与临床汤剂基本一致的标准参照物。
4.由于标准汤剂是连接传统中药饮片和现代中药制剂的“桥梁”,为控制中药终端产品的质量提供了参照物,为标化中药不同用药形式,确保质量的均一性、疗效的一致性提供了参照物,为评价不同厂家产品质量的一致性提供了参照物,因此,中药标准汤剂质量标准的制定将为所有源于饮片的水煎剂的终产品的质量标准的制定提供基础。
技术实现要素:
5.为此,本发明所解决的技术问题是提供了一种沙苑子标准汤剂。
6.另一方面,本发明还提供所述沙苑子标准汤剂成分的检测方法,以实现对沙苑子配方颗粒的质量控制与标准研究进行规范。
7.本发明提供一种沙苑子标准汤剂,所述沙苑子标准汤剂含有:
8.杨梅素-3-o-β-d-吡喃葡萄糖苷、
9.山萘酚-3-o-[β-d-吡喃木糖-(1
→
2)]-β-d-吡喃葡萄糖苷、
[0010]
山萘酚-3-o-β-d-葡萄糖苷和
[0011]
沙苑子苷。
[0012]
优选地,所述沙苑子标准汤剂还含有:
[0013]
杨梅素-3-o-[β-d-吡喃木糖-(1
→
2)]-β-d-吡喃葡萄糖苷、
[0014]
沙苑子杨梅苷、
[0015]
鼠李柠檬素-3-o-[β-d-呋喃芹菜糖-(1
→
2)]-β-d-葡萄糖苷、
[0016]
鼠李柠檬素-3-o-[β-d-呋喃芹菜糖-(1
″′→2″
)-6
″-
乙酰基]-β-d-葡萄糖苷、乙酰基沙苑子苷、山萘酚-3-o-β-d-阿拉伯糖苷、
[0017]
鼠李柠檬素-3-o-[5”'-o-阿魏酰-β-d-呋喃芹菜糖-(1
”′→
2”)]-β-d-吡喃葡萄糖苷、
[0018]
或,鼠李柠檬素-3-o-[5”'-o-对香豆酰-β-d-呋喃芹菜糖-(1
”′→
2”)]-β-d-吡喃葡萄糖苷中的一种或两种以上的组合。
[0019]
本发明提供一种沙苑子标准汤剂的制备方法,包含下述步骤:
[0020]
(1)取沙苑子药材,加水煎煮,过滤得到滤液;
[0021]
(2)将步骤(1)中滤液浓缩干燥,然后进行冻干,所述冻干分成三个阶段:a.预冻:预冻温度为-50℃~-45℃;b.一次干燥:干燥温度为-20℃~0℃;c.二次干燥:干燥温度为5~25℃,得到沙苑子标准汤剂。
[0022]
本发明还提供一种沙苑子苷的检测方法,包含下述步骤:
[0023]
(1)对照品溶液的制备:
[0024]
取沙苑子苷对照品,加乙醇制成溶液;
[0025]
(2)供试品溶液的制备:
[0026]
取所述的沙苑子标准汤剂,加入溶剂进行提取;
[0027]
(3)超高效液相色谱分析
[0028]
吸取对照品溶液和供试品溶液注入超高效液相色谱仪,以十八烷基硅烷键合硅胶为填充剂,以乙腈为流动相a,以水相为流动相b进行检测,以a-b配比为22:78,得到沙苑子苷的含量。
[0029]
优选地,步骤(2)中,所述溶剂选自水、60%乙醇、75%乙醇、无水乙醇、60%甲醇、75%甲醇、甲醇中的一种,优选地,所述溶剂为甲醇;
[0030]
优选地,步骤(2)中,所述提取采用超声提取或溶解提取中的一种,
[0031]
优选地,所述提取采用超声提取,
[0032]
优选地,提取时间为10-45min,
[0033]
优选地,提取时间为30min;
[0034]
优选地,步骤(3)中,流动相a和流动相b的流速为0.9-1.1ml/min,
[0035]
优选地,所述流动相a和流动相b的流速为1.0ml/min,
[0036]
优选地,步骤(3)中,所述水相选自于水、0.1%的磷酸水溶液或者0.05%的磷酸水溶液,优选为0.1%的磷酸水溶液。
[0037]
本发明还提供一种沙苑子标准汤剂的特征图谱的检测方法,包含下述步骤:
[0038]
(1)参照物溶液的制备:
[0039]
分别称取沙苑子苷对照品,加乙醇制成溶液;
[0040]
(2)供试品溶液的制备:
[0041]
取所述的沙苑子标准汤剂,加入溶剂进行提取;
[0042]
(3)超高效液相色谱分析
[0043]
吸取对照品溶液和供试品溶液注入超高效液相色谱仪,以十八烷基硅烷键合硅胶为填充剂,以乙腈为流动相a,以水相为流动相b进行梯度洗脱,得到沙苑子标准汤剂的特征图谱。
[0044]
优选地,步骤(2)中,所述溶剂选自水、95%乙醇、75%乙醇、稀乙醇、甲醇、75%甲醇、50%甲醇中的一种,优选地,所述溶剂为75%甲醇,
[0045]
优选地,步骤(2)中,所述提取采用回流提取、超声提取或溶解提取中的一种,
[0046]
优选地,所述提取采用超声提取,
[0047]
优选地,提取时间为10-45min,
[0048]
优选地,提取时间为15min。
[0049]
优选地,步骤(3)中,流动相a和流动相b的流速为0.1-0.5ml/min,
[0050]
优选地,所述流动相a和流动相b的流速为03ml/min,
[0051]
优选地,所述梯度洗脱程序为:
[0052]
0-9min,流动相a的体积百分比为25
→
27.5%,流动相b的体积百分比为75
→
72.5%;
[0053]
9-17min,流动相a的体积百分比为27.5
→
28%,流动相b的体积百分比为72.5
→
72%;
[0054]
17-18min,流动相a的体积百分比为28
→
29%,流动相b的体积百分比为72
→
71%;
[0055]
18-35min,流动相a的体积百分比为29
→
38%,流动相b的体积百分比为71
→
62%;
[0056]
35-55min,流动相a的体积百分比为38
→
53%,流动相b的体积百分比为62
→
47%;
[0057]
55-55.1min,流动相a的体积百分比为53
→
25%,流动相b的体积百分比为47
→
75%;
[0058]
55.1-58min,流动相a的体积百分比为25-25%,流动相b的体积百分比为75-75%。
[0059]
优选地,步骤(3)中,所述水相选自于水、0.1%的磷酸水溶液或者0.05%的磷酸水溶液,优选为0.1%的磷酸水溶液。
[0060]
优选地,骤(3)中柱温为32-38℃,优选地,所述柱温为35℃。
[0061]
优选地,所述特征谱图的特征峰不少于10个,与参照物相应的沙苑子苷为s峰,计算各特征峰与s峰的相对保留时间,其相对保留时间在规定值的
±
10%之内,规定值含有0.212、0.243、0.312、0.570、0.628、0.777、0.964、1.103、1.128。
[0062]
在本发明的一个具体实施方式中,所述特征谱图的特征峰不少于10个,与参照物相应的峰8(沙苑子苷)为s峰,计算各特征峰与s峰的相对保留时间,其相对保留时间在规定值的
±
10%之内,规定值含有0.212(峰1)、0.243(峰2)、0.312(峰3)、0.570(峰4)、0.628(峰5)、0.777(峰6)、0.964(峰7)、1.103(峰9)、1.128(峰10)。
[0063]
优选的,所述特征峰不少于12,更优选地,所述特征峰不少于15。
[0064]
本发明所取得的有益效果:
[0065]
本发明建立的特征图谱方法,采用超高相液相色谱,具有简便、稳定、精密度高及重现性好等特点,而且所得标准汤剂指纹图谱的峰多,峰型好,易于鉴别,准确可靠。
附图说明
[0066]
图1所示为不同提取溶剂对沙苑子苷含量的影响;
[0067]
图2所示为不同提取方式的考察hplc图谱;
[0068]
图3所示为不同提取时间的考察hplc图谱;
[0069]
图4所示为沙苑子标准汤剂含量测定专属性考察;
[0070]
图5所示为沙苑子苷标准曲线图;
[0071]
图6所示为不同色谱柱耐用性考察hplc图;
[0072]
图7a所示为柱温为25℃耐用性考察hplc图;
[0073]
图7b所示为柱温为30℃耐用性考察hplc图;
[0074]
图7c所示为柱温为35℃耐用性考察hplc图;
[0075]
图8a所示为流速为0.9ml/min耐用性考察hplc图;
[0076]
图8b所示为流速为1.0ml/min耐用性考察hplc图;
[0077]
图8c所示为流速为1.1ml/min耐用性考察hplc图;
[0078]
图9a所示为流动相系统为甲醇-0.1%磷酸水的uplc图谱;
[0079]
图9b所示为流动相系统为乙腈-0.1%磷酸水的uplc图谱;
[0080]
图10a所示为流动相为甲醇-水对峰型的影响;
[0081]
图10b所示为流动相为甲醇-0.1%磷酸水对峰型的影响;
[0082]
图10c所示为流动相为乙腈-0.1%甲酸水对峰型的影响;
[0083]
图10d所示为流动相为乙腈-0.1%醋酸水对峰型的影响;
[0084]
图11a所示为水为提取溶剂考察的uplc图谱;
[0085]
图11b所示为95%乙醇为提取溶剂考察的uplc图谱;
[0086]
图11c所示为75%乙醇为提取溶剂考察的uplc图谱;
[0087]
图11d所示为稀乙醇为提取溶剂考察的uplc图谱;
[0088]
图11e所示为甲醇为提取溶剂考察的uplc图谱;
[0089]
图11f所示为75%甲醇为提取溶剂考察的uplc图谱;
[0090]
图11g所示为50%甲醇为提取溶剂考察的uplc图谱;
[0091]
图12所示为不同提取溶剂的提取效率对比(峰面积/称样量);
[0092]
图13a所示为超声提取方式考察的uplc图谱;
[0093]
图13b所示为回流提取方式考察的uplc图谱;
[0094]
图14所示为不同提取方式的提取效率对比(峰面积/称样量);
[0095]
图15a所示为超声提取15min考察的uplc图谱;
[0096]
图15b所示为超声提取30min考察的uplc图谱;
[0097]
图15c所示为超声提取45min考察的uplc图谱;
[0098]
图16所示为不同提取时间的提取效率对比图(峰面积/称样量);
[0099]
图17所示为沙苑子标准汤剂特征图谱专属性考察;
[0100]
图18所示为沙苑子标准汤剂特征图谱整体性考察;
[0101]
图19所示为中间精密度对比图(赛默飞);
[0102]
图20a所示为agilent c18色谱柱考察uplc图谱;
[0103]
图20b所示为dikma c18色谱柱考察uplc图谱;
[0104]
图20c所示为acquity uplcc18色谱柱考察uplc图谱;
[0105]
图21a所示为柱温为25℃考察uplc图谱;
[0106]
图21b所示为柱温为30℃考察uplc图谱;
[0107]
图21c所示为柱温为35℃考察uplc图谱;
[0108]
图22a所示为流速为0.25ml/min考察uplc图谱;
[0109]
图22b所示为流速为0.30ml/min考察uplc图谱;
[0110]
图22c所示为流速为0.35ml/min考察uplc图谱;
[0111]
图23所示为17批沙苑子标准汤剂的特征图谱;
[0112]
图24所示为沙苑子标准汤lc-ms质谱图;
[0113]
图24a所示为负离子模式bpi质谱图;
[0114]
图24b所示为266nm紫外色谱图;
[0115]
图25所示为峰1的dad图谱;
[0116]
图26所示为峰1的ms/ms质谱图;
[0117]
图27所示为峰2的dad图谱;
[0118]
图28所示为峰2的ms/ms质谱图;
[0119]
图29所示为峰3的dad图谱;
[0120]
图30所示为峰3的ms/ms质谱图;
[0121]
图31所示为峰4的dad图谱;
[0122]
图32所示为峰4的ms/ms质谱图;
[0123]
图33所示为峰5的dad图谱;
[0124]
图34所示为峰5的ms/ms质谱图;
[0125]
图35所示为峰6的dad图谱;
[0126]
图36所示为峰6的ms/ms质谱图;
[0127]
图37所示为峰7的dad图谱;
[0128]
图38所示为峰7的ms/ms质谱图;
[0129]
图39所示为峰9的dad图谱;
[0130]
图40所示为峰9的ms/ms质谱图;
[0131]
图41所示为峰10的dad图谱;
[0132]
图42所示为峰10的ms/ms质谱图;
[0133]
图43所示为峰11的dad图谱;
[0134]
图44所示为峰11的ms/ms质谱图;
[0135]
图45所示为峰12的dad图谱;
[0136]
图46所示为峰12的ms/ms质谱图;
[0137]
图47为峰2、峰3、峰5、峰8的进一步验证uplc图;
[0138]
图48所示为沙苑子标准汤剂的lc-ms质谱图;
[0139]
图49所示为沙苑子标准汤剂对照图谱。
具体实施方式
[0140]
术语“稀乙醇”是采用《中国药典一部》中附录xvb试液进行制备,即取乙醇529ml,加水稀释至1000ml,即得。本液在20℃时含c2h5oh应为49.5%~50.5%(ml/ml)。
[0141]
下面对本实施例所用的原料的生产厂家,进行说明如下,其中所述的化学物质没有标明的均为常规试剂的化学纯级别。实施例所用到的原料的信息和实验设备分别如表1和表2所示。
[0142]
表1实施例中所用到的原料的信息
[0143]
原料纯度/批号厂家沙苑子饮片201801陕西省渭南市蒲城县兴镇沙苑子苷对照品111803-201403中国食品药品检定研究院
[0144]
表2实施例中所用到的实验设备
[0145][0146]
实施例1
[0147]
1.沙苑子标准汤剂的制备方法
[0148]
取沙苑子饮片100g,置电陶瓷壶中,加水煎煮两次,第一次煎煮加水8倍,浸泡30分钟,武火(500w)煮沸后文火(200w)保持微沸60分钟,煎液经200目筛网趁热过滤,滤液迅速用冷水冷却。第二次加6倍量水,武火加热煮沸后文火保持微沸50分钟,煎液用200目筛网趁热过滤,滤液迅速用冷水冷却,合并两次煎液。将煎液转移至2000ml圆底烧瓶中,采用旋转蒸发仪减压低温浓缩(温度:65℃;真空度:-0.080
--
0.090mpa)至200ml的浸膏;在磁力搅拌下,分装至10ml棕色西林瓶中,每瓶分装体积为1.0ml,半加塞,分装完后转移至真空冷冻干燥机中冻干,冻干参数为,-45℃预冻240min后进行一次干燥,一次干燥参数为-30℃维持420min、-30℃维持120min、-10℃维持120min、0℃维持180min,然后进行解析干燥,参数为,5℃维持120min、15℃维持120min、25℃维持180min、取出,轧上铝盖,即得沙苑子标准汤剂。
[0149]
所得沙苑子标准汤剂出膏率的计算公式为:
[0150]
[0151]
经计算,沙苑子标准汤剂出膏率为13.8%。
[0152]
2.沙苑子标准汤剂中沙苑子苷含量测定分析方法的建立
[0153]
(1)对照品溶液的制备
[0154]
精密称取沙苑子苷对照品15mg,置100ml容量瓶中,加60%乙醇制成每1ml含0.15mg的母液。精密移取母液1ml,置10ml容量瓶中,加60%乙醇定容配制成每1ml含15μg沙苑子苷对照溶液,即得。
[0155]
(2)供试品溶液的制备
[0156]
取1中制备得到的沙苑子标准汤剂适量,研细,精密称定0.15g,置具塞锥形瓶中,精密加入溶剂25ml,密塞,称定重量,进行提取处理一段时间,放冷,再称定重量,用有机溶剂补足减失重量,摇匀,滤过,取滤液,即得。
[0157]
以十八烷基硅烷键合硅胶为填充剂,以水-乙腈为流动相,分别精密吸取对照品溶液及供试品溶液各10μl,注入液相色谱仪,进行测定。检测波长为266nm,理论塔板数按沙苑子苷峰计算应不低于4000。
[0158]
2.1对检测方法中的实验条件进行考察:
[0159]
a.提取溶剂考察
[0160]
取沙苑子标准汤剂适量,研细,取约0.15g,精密称定,平行7组,每组2份,置具塞锥形瓶中,分别精密加入水、60%乙醇、75%乙醇、无水乙醇、60%甲醇、75%甲醇、甲醇25ml,称定重量,超声处理(功率250w,频率40khz)30分钟,放冷,再称定重量,用相应的溶剂补足减失重量,摇匀,滤过,取续滤液。精密吸取10μl,注入液相色谱仪,测定,即得。实验结果见表3和图1。
[0161]
表3不同提取溶剂沙苑子标准汤剂沙苑子苷含量测定结果
[0162][0163]
通过对比7种提取溶剂样品中沙苑子苷含量,从表3和图1中可以看出,甲醇对沙苑子标准汤剂中沙苑子苷的提取率较高,因此选择甲醇作为沙苑子标准汤剂沙苑子苷含量测定的提取溶剂。
[0164]
b.提取方式考察
[0165]
取沙苑子标准汤剂适量,研细,取约0.15g,精密称定,平行2组,每组2份,置具塞锥形瓶中,精密加入甲醇25ml,称定重量,分别直接溶解、加热超声回流30分钟,取出放冷,再称定重量,用甲醇补足减失重量,摇匀,滤过,取续滤液。精密吸取10μl,注入液相色谱仪,测定,即得。实验结果见表4和图2。
[0166]
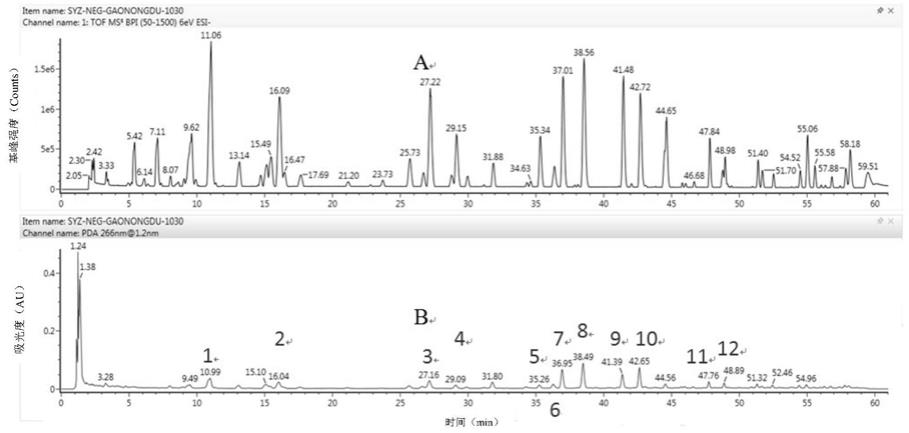
表4不同提取方式沙苑子标准汤剂沙苑子苷含量测定结果
[0167][0168]
由表4和图2可以看出,结合提取溶剂考察项下甲醇超声提取得含量可知,超声回
流提取的含量较高,且超声操作方便考虑,故选择超声回流作为提取方式。
[0169]
c.提取时间考察
[0170]
取沙苑子标准汤剂适量,研细,取约0.15g,精密称定,平行4组,每组2份,置具塞锥形瓶中,精密加入甲醇25ml,称定重量,分别超声处理(功率250w,频率40khz)15min、30min、45min、60min,取出放冷,再称定重量,用甲醇补足减失重量,摇匀,滤过,取续滤液。精密吸取10μl,注入液相色谱仪,测定,即得。实验结果见表5和图3。
[0171]
表5不同提取时间沙苑子标准汤剂沙苑子苷含量测定结果
[0172][0173][0174]
由表5和图3可以看出,通过对比不同超声时间的沙苑子苷含量,可发现超声时间对沙苑子苷含量影响较小,考虑操作方便,选取超声时间为30min。
[0175]
供试品溶液制备方法的确定
[0176]
根据样品前处理考察实验结果,供试品制备方法可确定为:
[0177]
取沙苑子标准汤剂适量,研细,取约0.15g,精密称定,置具塞锥形瓶中,精密加入甲醇25ml,称定重量,超声处理(功率250w,频率40khz)30分钟,放冷,再称定重量,用甲醇补足减失重量,摇匀,滤过,取续滤液,即得。
[0178]
2.2对检测方法的方法学的考察
[0179]
a.专属性考察
[0180]
精密吸取沙苑子标准汤剂供试品溶液、沙苑子苷对照品溶液与空白溶剂各10μl,注入液相色谱仪,按照上述色谱条件测定。结果见图4和表6。
[0181]
表6色谱峰系统适应性参数
[0182][0183]
从图4和表6可以看出,空白溶剂色谱中在与沙苑子苷相应的保留时间没有色谱峰,说明溶剂对沙苑子苷的测定无干扰,以本法测定沙苑子标准汤剂中沙苑子苷的含量具有专属性。
[0184]
b.线性考察
[0185]
分别精密吸取沙苑子苷对照品溶液(14.816μg/ml)1、4、8、12、16、20μl,注入液相色谱仪,按上述色谱条件测定,以峰面积积分值为纵坐标,沙苑子苷进样量(μg)为横坐标,绘制标准曲线,结果见下表7与图5。
[0186]
表7沙苑子苷线性考察结果
[0187][0188][0189]
由图5和表7所示,得到的线性回归方程为:y=33314x-5518.7,相关系数r2=1,表明在浓度为0.014816μg~0.29632μg的范围内沙苑子苷浓度与峰面积线性关系良好。
[0190]
c.精密度考察
[0191]
精密吸取沙苑子标准汤剂供试品溶液,重复进样6次,进样体积10μl。计算峰面积rsd,测定结果见表8。
[0192]
表8精密度考察结果
[0193][0194]
从表8可以看出,6个平行供试品溶液中沙苑子苷的含量较稳定,rsd%=0.788%,重复性良好,表明仪器精密度良好。
[0195]
d.稳定性考察
[0196]
精密吸取沙苑子标准汤剂供试品溶液,按照上述色谱条件,分别在0,2,4,6,8,10,12小时进样,进样体积10μl,测定供试品溶液中沙苑子苷的峰面积,计算峰面积rsd,测定结果见表9。
[0197]
表9稳定性考察结果
[0198][0199][0200]
由表9实验结果表明,12小时内的供试品峰面积rsd为2.65%。6小时以内的rsd为1.88%,说明供试品在6小时以内是稳定的。
[0201]
e.中间精密度考察
[0202]
由本项目组其他分析人员在不同日期和不同色谱仪下操作,取同一批沙苑子标准汤剂约0.15g,精密称定,平行6份,制备供试品溶液,按照上述色谱条件测定,结果见表10。
[0203]
表10中间精密度考察结果
[0204][0205]
由表10实验结果表明,不同分析人员在不同日期和不同色谱仪下操作,沙苑子苷含量结果rsd《2%,该分析方法中间精密度良好。
[0206]
f.耐用性考察
[0207]
(1)不同色谱柱考察
[0208]
比较了inertsil ods-hl、ymc-triar c18、ultimate xb-c18三种色谱柱对沙苑子标准汤剂沙苑子苷含量的影响。
[0209]
取沙苑子标准汤剂供试品溶液,按照上述色谱条件测定,实验结果见图6、表11。
[0210]
表11不同色谱柱系统适应性参数
[0211][0212]
由图6和表11可知,该方法使用色谱柱inertsil ods-hl时,分离度为1.38,而使用色谱柱ultimate xb-c18时,对称因子为1.34,这两根色谱柱系统适应性试验较差。所以测得含量rsd值较大。实验结果表明,该方法对色谱柱有一定的选择性。
[0213]
(2)不同色谱仪考察
[0214]
根据实验室现有设备,选取waters色谱仪与agilent色谱仪,比较两种色谱仪对沙
苑子标准汤剂沙苑子苷含量测定的影响。
[0215]
取沙苑子标准汤剂供试品溶液,按照上述色谱条件测定,实验结果如表12。
[0216]
表12不同色谱仪系统适应性参数
[0217][0218]
由表12实验结果表明,该分析方法不同色谱仪耐用性较好。色谱仪的变动能满足系统适应性要求。
[0219]
(3)不同柱温考察
[0220]
比较在25℃、30℃、35℃不同柱温沙苑子标准汤剂沙苑子苷含量测定的影响。
[0221]
取沙苑子标准汤剂,供试品溶液,按照上述色谱条件测定,实验结果图7a-图7c和表13。
[0222]
表13不同柱温系统适应性参数
[0223][0224]
由图7a-图7c和表13实验结果表明,25℃条件下的分离度为1.35,小于1.5,未达到要求。35℃条件下,目标峰和没有完全分离,25℃和35℃下,系统适应性试验均较差,所以含量rsd较大,表明该方法对柱温有选择性,该方法规定柱温为30℃。
[0225]
(4)不同流速考察
[0226]
比较在0.9ml/min、1.0ml/min、1.1ml/min不同流速对沙苑子标准汤剂沙苑子苷含量的影响。
[0227]
取沙苑子标准汤剂供试品溶液液,按上述色谱条件,实验结果图8a-图8c、表14。
[0228]
表14不同流速系统适应性参数
[0229][0230]
由图8a-图8c和表14实验结果表明,不同流速下沙苑子苷含量测定的rsd较大,表明该方法对流速有选择性,该方法规定流速为1.0ml/min。
[0231]
3.沙苑子标准汤剂特征图谱分析
[0232]
3.1对检测方法的条件的优化
[0233]
(1)参照物溶液的制备
[0234]
精密称取沙苑子苷对照品15mg,置100ml容量瓶中,加60%乙醇制成每1ml含0.15mg的母液。精密移取母液1ml,置10ml容量瓶中,加60%乙醇定容配制成每1ml含15μg沙苑子苷对照溶液,即得。
[0235]
(2)供试品溶液的制备
[0236]
取沙苑子标准汤剂适量,研细,取约0.15g,精密称定,置具塞锥形瓶中,精密加入甲醇25ml,称定重量,超声处理(功率250w,频率40khz)30分钟,放冷,再称定重量,用甲醇补足减失重量,摇匀,滤过,取滤液,即得。
[0237]
以十八烷基硅烷键合硅胶为填充剂;以乙腈-0.1%磷酸水(22:78)为流动相进行洗脱;检测波长为266nm。理论塔板数按沙苑子苷峰计算应不低于4000。
[0238]
下面对检测方法中的实验条件进行考察:
[0239]
i.流动相及梯度的选择
[0240]
①
大梯度考察a为有机相,b为水相。梯度如表15所示。
[0241]
表15
[0242][0243]
a为有机相,b为水相。考察a相为甲醇或乙腈,b相为水、0.1%磷酸水溶液、0.1%甲酸水溶液或0.1%醋酸水溶液对峰型的影响。
[0244]
由图9a和图9b可以看出,乙腈-0.1%磷酸水洗脱能力较甲醇-0.1%磷酸水强,但在后期条件摸索中由于采用乙腈-0.1%磷酸水某些色谱峰分离效果不理想,后换成甲醇-0.1%磷酸水分离效果有所改善,且使用甲醇较乙腈更加经济划算,故选择甲醇-0.1%磷酸水进行条件摸索,后期再对流动相中所用到的各种酸进行考察。
[0245]
②
调整梯度,并对加酸和不加酸的情况进行考察。a为有机相,b为含酸水相。梯度如表16所示。实验结果如图10a-图10d所示。
[0246]
表16
[0247]
[0248][0249]
从图10a-图10d可以看出,加酸比不加酸峰型好,但流动相为乙腈-0.1%磷酸水系统时峰型最佳,故选择乙腈-0.1%磷酸水进行洗脱。
[0250]
所以,得到如下的色谱条件:
[0251]
以十八烷基硅烷键合硅胶为填充剂(柱长为150mm,内径为2.1mm,粒径为1.7μm);以乙腈为流动相a,以0.1%磷酸水溶液为流动相b,按下表17中的规定进行梯度洗脱;柱温为35℃;流速为0.3ml/min;检测波长为266nm。理论板数按沙苑子苷计算应不低于4000。
[0252]
表17梯度洗脱程序
[0253][0254]
ii.供试品溶液前处理方法考察
[0255]
对沙苑子标准汤剂的提取溶剂、提取时间及提取方式进行考察,确定沙苑子标准汤剂特征图谱的样品前处理方法。
[0256]
a.提取溶剂考察
[0257]
本次实验分别考察了不同提取溶剂对沙苑子标准汤剂特征图谱的影响,选取水、乙醇、75%乙醇、稀乙醇、甲醇、75%甲醇、50%甲醇作为提取溶剂,通过暂时指认的15个色谱峰总峰面积/称样量及色谱图来比较不同提取溶剂特征图谱结果。
[0258]
取沙苑子标准汤剂适量,研细,取约0.14g,精密称定,置具塞锥形瓶中,分别精密加入水、乙醇、75%乙醇、稀乙醇、甲醇、75%甲醇、50%甲醇各25ml,称定重量,超声处理(功率500w,频率40khz)30分钟,放冷,用相应溶剂补足减失的重量,摇匀,滤过,取续滤液,即得。分别精密吸取各供试液20μl,注入液相色谱仪,按上述色谱条件测定,记录峰面积。结果见图11a-图11g和图12。
[0259]
从图11a-图11g和图12可以看出,提取溶剂为75%甲醇时色谱峰信息较多并且提取效率较高。
[0260]
b.提取方式考察
[0261]
本次实验分别考察了不同提取方式对沙苑子标准汤剂特征图谱的影响,选取超声、回流作为提取方式,通过暂时指认的15个色谱峰总峰面积/称样量及色谱图比较不同提取方式特征图谱结果。
[0262]
取沙苑子标准汤剂适量,研细,取约0.14g,精密称定,置具塞锥形瓶中,分别精密加入75%甲醇25ml,称定重量,分别采用超声、回流各处理30min,放冷,用75%甲醇补足减失的重量,摇匀,滤过,取续滤液,即得。分别精密吸取各供试液20μl,注入液相色谱仪,按上述色谱条件测定,记录峰面积。结果见图13a、图13b和图14。
[0263]
由图13a、图13b和图14实验结果表明,超声提取与回流提取相差不大,考虑到实际操作的简便性,故选择超声提取。
[0264]
c.提取时间考察
[0265]
本次实验分别考察了不同提取时间对沙苑子标准汤剂特征图谱的影响,选取考察15min、30min和45min三个不同提取时间,通过暂时指认的15个色谱峰总峰面积/称样量及色谱图比较不同提取时间特征图谱结果。
[0266]
取沙苑子标准汤剂适量,研细,取约0.14g,精密称定,置具塞锥形瓶中,精密加入75%甲醇25ml,称定重量,超声处理(功率500w,频率40khz)15min、30min、45min,放冷,分别用75%甲醇补足减失的重量,摇匀,滤过,取续滤液,即得。分别精密吸取各供试液20μl,注入液相色谱仪,按上述色谱条件测定,记录峰面积。结果见图15a-图15c和图16。
[0267]
从图15a-图15c和图16可以看出,采用超声处理15min、30min、45min,色谱峰面积差别不大。
[0268]
综上,沙苑子标准汤剂特征图谱样品前处理方法可确定为:
[0269]
将沙苑子标准汤剂溶于75%甲醇,超声处理15min,放冷,用75%甲醇补足减失的重量,摇匀,滤过,取续滤液用于测定特征图谱。
[0270]
3.2对检测方法的方法学的考察
[0271]
a.专属性考察
[0272]
精密吸取沙苑子标准汤剂供试品溶液、参照物溶液与空白溶剂各1μl,注入液相色谱仪进行测定。结果见图17。
[0273]
从图17可以看出,该分析方法能正确检测沙苑子苷,不受提取溶剂的干扰。
[0274]
b.整体性考察
[0275]
精密吸取沙苑子标准汤剂供试品溶液,注入液相色谱仪,按上述色谱条件测定,保持同一梯度,在梯度终点的流动相比例下延长洗脱一倍时间,分析特征图谱。结果见图18。
[0276]
由图18结果表明,该色谱条件延长一倍时间后无明显色谱峰,表明该色谱条件基本满足了信息量最大的原则。
[0277]
c.精密度考察
[0278]
取沙苑子标准汤剂供试品溶液,平行6份,进样体积1μl。以沙苑子苷峰为参照峰,计算相对保留时间及相对峰面积,实验结果见表18和表19。
[0279]
表18沙苑子标准汤剂特征图谱精密度结果(相对保留时间)
[0280][0281][0282]
表19沙苑子标准汤剂特征图谱精密度结果(相对峰面积)
[0283][0284]
由表18和表19实验结果表明,各色谱峰相对保留时间与相对峰面积的rsd《3.0%,该仪器精密度良好。
[0285]
d.稳定性考察
[0286]
取沙苑子标准汤剂供试品溶液,分别在0,2,4,8,12,24小时进样,进样体积1μl。以沙苑子苷峰为参照峰,计算相对保留时间及相对峰面积,结果见表20和表21。
[0287]
表20沙苑子标准汤剂特征图谱稳定性结果(相对保留时间)
[0288][0289]
表21沙苑子标准汤剂特征图谱稳定性结果(相对峰面积)
[0290]
[0291][0292]
由表20和表21实验结果表明,色谱峰相对保留时间与相对峰面积的rsd《5.0%,说明该样品溶液比较稳定。
[0293]
e.重复性考察
[0294]
取沙苑子标准汤剂约0.14g,精密称定,平行6份,分别制成样品供试品溶液,分别进样1μl。以沙苑子苷峰为参照峰,计算相对保留时间及相对峰面积,实验结果见表22和表23。
[0295]
表22沙苑子标准汤剂特征图谱重复性结果(相对保留时间)
[0296]
[0297][0298]
表23沙苑子标准汤剂特征图谱重复性结果(相对峰面积)
[0299]
[0300][0301]
由表22和表23实验结果表明,各色谱峰相对保留时间与相对峰面积的rsd《3.0%,说明该方法重复性良好。
[0302]
f.中间精密度考察
[0303]
由本项目组其他分析人员在不同日期和不同色谱仪(赛默飞)下操作,取沙苑子标准汤剂约0.14g,精密称定,平行6份,分别制成供试品溶液,分别进样1μl。以沙苑子苷峰为参照峰,计算相对保留时间及相对峰面积,实验结果见表24和表25和图19所示。
[0304]
表24沙苑子标准汤剂特征图谱中间精密度结果(相对保留时间)
[0305]
[0306][0307]
表25沙苑子标准汤剂特征图谱中间精密度结果(相对峰面积)
[0308]
[0309][0310]
由表24、表25和图19实验结果表明,不同分析人员在不同日期和不同色谱仪下操作,相对保留时间rsd<3.0%,说明该方法中间精密度良好。
[0311]
g.耐用性考察
[0312]
①
不同色谱柱的考察
[0313]
考察了3种色谱柱,分别是:色谱柱1-agilent c18(2.1*150mm,1.8μm);色谱柱2-dikma c18(2.1*150mm,1.8μm);色谱柱3-acquity uplc c18(2.1mm
×
150mm,1.7μm),考察三根色谱柱对沙苑子标准汤剂特征图谱耐用性的影响。
[0314]
取沙苑子标准汤剂约0.14g,精密称定,制成供试品溶液,分别进样1μl。实验结果见图20a-图20c。
[0315]
由图20a-图20c实验结果表明,采用色谱柱1-agilent c18(2.1*150mm,1.8μm)的超高效液相色谱柱进行洗脱,色谱峰峰型较好,因此建议本方法采用型号为agilent c18(2.1*150mm,1.8μm)的超高效液相色谱柱。
[0316]
②
不同柱温的考察
[0317]
比较不同柱温,分别是:25℃、30℃、35℃对沙苑子标准汤剂特征图谱耐用性影响。
[0318]
取沙苑子标准汤剂约0.14g,精密称定,制成试品溶液,分别进样1μl。实验结果见图21a-图21c。
[0319]
由图21a-图21c实验结果显示,柱温对出峰情况影响较大,柱温为35℃时分离效果最佳,峰型较好,因此建议使用柱温35℃进行测定。
[0320]
③
不同流速的考察
[0321]
比较不同流速,分别是:0.25ml/min、0.30ml/min、0.35ml/min对沙苑子标准汤剂特征图谱耐用性影响。
[0322]
取沙苑子标准汤剂约0.14g,精密称定,制成供试品溶液,分别进样1μl。实验结果图22a-图22c。
[0323]
由图22a-图22c实验结果显示,流速对出峰情况影响较大,当流速为0.3ml/min峰型最佳。因此建议使用0.3ml/min作为测定流速。
[0324]
实施例2
[0325]
1.沙苑子标准汤剂的制备
[0326]
取沙苑子饮片100g,置电陶瓷壶中,加水煎煮两次,第一次煎煮加水8倍,浸泡30分钟,武火(500w)煮沸后文火(200w)保持微沸60分钟,煎液经200目筛网趁热过滤,滤液迅速用冷水冷却。第二次加6倍量水,武火加热煮沸后文火保持微沸50分钟,煎液用200目筛网趁热过滤,滤液迅速用冷水冷却,合并两次煎液。将煎液转移至2000ml圆底烧瓶中,采用旋转蒸发仪减压低温浓缩(温度:65℃;真空度:-0.080
--
0.090mpa)至200ml的浸膏;在磁力搅拌下,分装至10ml棕色西林瓶中,每瓶分装体积为1.0ml,半加塞,分装完后转移至真空冷冻干燥机中冻干,冻干参数为,-45℃预冻240min后进行一次干燥,一次干燥参数为-30℃维持420min、-30℃维持120min、-10℃维持120min、0℃维持180min,然后进行解析干燥,参数为,5℃维持120min、15℃维持120min、25℃维持180min、取出,轧上铝盖,即得沙苑子标准汤剂。
[0327]
2.沙苑子苷含量测定及准确度实验
[0328]
(1)沙苑子苷含量测定
[0329]
取沙苑子标准汤剂约0.15g,精密称定,平行称定6份,置具塞锥形瓶中,精密加入甲醇25ml,称定重量,超声处理(功率250w,频率40khz)30分钟,放冷,再称定重量,用甲醇补足减失重量,摇匀,滤过,取续滤液,即得供试品溶液6份。ymc-triart c18色谱柱(4.6
×
250mm,5μm);以乙腈-0.1%磷酸水溶液(22:78)为流动相;检测波长266nm,进样量10μl,流速1.0ml/min,柱温30℃,每份精密吸取10μl,测定供试品溶液中沙苑子苷含量,计算rsd,测定结果见表26.
[0330]
表26重复性考察结果
[0331][0332]
实验结果表明该分析方法的重复性良好。
[0333]
(2)准确度实验
[0334]
取已知沙苑子苷含量的样品0.075g,沙苑子苷含量为0.487wt%,精密称定,分别加入沙苑子苷对照品溶液(0.148mg/ml)2.380ml,共6份,按供试品溶液制备方法制成供试品溶液,分别进样10μl,测定沙苑子苷峰面积,计算其含量,并按以下列公式计算回收率及rsd,结果见下表27。
[0335][0336]
表27准确度试验
[0337][0338]
实验结果显示沙苑子苷回收率为102.663%,根据《中国药典》2015版四部“药品质量标准分析方法验证指导原则”规定样品中待测成分含量为0.1-1.0%时,回收率限度为92%~105%,表明回收率良好。
[0339]
实施例3
[0340]
1.沙苑子标准汤剂的制备
[0341]
取17份沙苑子饮片,每份100g,置电陶瓷壶中,加水煎煮两次,第一次煎煮加水8倍,浸泡30分钟,武火(500w)煮沸后文火(200w)保持微沸60分钟,煎液经200目筛网趁热过滤,滤液迅速用冷水冷却。第二次加6倍量水,武火加热煮沸后文火保持微沸50分钟,煎液用200目筛网趁热过滤,滤液迅速用冷水冷却,合并两次煎液。将煎液转移至2000ml圆底烧瓶中,采用旋转蒸发仪减压低温浓缩(温度:65℃;真空度:-0.080
--
0.090mpa)至200ml的浸膏;在磁力搅拌下,分装至10ml棕色西林瓶中,每瓶分装体积为1.0ml,半加塞,分装完后转移至真空冷冻干燥机中冻干,冻干参数为,-45℃预冻240min后进行一次干燥,一次干燥参数为-30℃维持420min、-30℃维持120min、-10℃维持120min、0℃维持180min,然后进行解析干燥,参数为,5℃维持120min、15℃维持120min、25℃维持180min、取出,轧上铝盖,即得沙苑子标准汤剂。
[0342]
2.沙苑子标准汤剂的特征图谱测定
[0343]
取实施例一中制备得到的17批沙苑子标准汤剂适量,研细,各取约0.14g,精密称定,置具塞锥形瓶中,精密加入75%甲醇25ml,称定重量,超声处理15min,超声功率为500w,频率为40khz,放冷,用75%甲醇补足减失的重量,摇匀,滤过,取续滤液以如下条件测定特征图谱。
[0344]
以十八烷基硅烷键合硅胶为填充剂(柱长为150mm,内径为2.1mm,粒径为1.7μm);以乙腈为流动相a,以0.1%磷酸水溶液为流动相b,按表4中的规定进行梯度洗脱;柱温为35℃;流速为0.3ml/min;检测波长为266nm。理论板数按沙苑子苷计算应不低于4000。测得的特征图谱如图23所示。测得的17批沙苑子标准汤剂特征图谱相对保留时间和相对峰面积如表28和表29所示。
[0345]
从图23可以看出,17批沙苑子标准汤剂的特征图谱中共有峰为10个,以沙苑子苷峰对应的峰8为s峰,各特征峰与s峰的相对保留时间应在规定值的
±
10%之内。通过分析,可确定的共有峰为:0.212(峰1)、0.243(峰2)、0.312(峰3)、0.570(峰4)、0.628(峰5)、0.777
(峰6)、0.964(峰7)、沙苑子苷(峰s)、1.103(峰9)、1.128(峰10)。
[0346]
表28 17批沙苑子标准汤剂特征图谱相对保留时间
[0347][0348]
表29 17批沙苑子标准汤剂特征图谱相对峰面积
[0349]
[0350][0351]
实施例4
[0352]
一、.沙苑子标准汤剂的制备
[0353]
取沙苑子饮片100g,置电陶瓷壶中,加水煎煮两次,第一次煎煮加水8倍,浸泡30分钟,武火(500w)煮沸后文火(200w)保持微沸60分钟,煎液经200目筛网趁热过滤,滤液迅速用冷水冷却。第二次加6倍量水,武火加热煮沸后文火保持微沸50分钟,煎液用200目筛网趁热过滤,滤液迅速用冷水冷却,合并两次煎液。将煎液转移至2000ml圆底烧瓶中,采用旋转蒸发仪减压低温浓缩(温度:65℃;真空度:-0.080
--
0.090mpa)至200ml的浸膏;在磁力搅拌下,分装至10ml棕色西林瓶中,每瓶分装体积为1.0ml,半加塞,分装完后转移至真空冷冻干燥机中冻干,冻干参数为,-45℃预冻240min后进行一次干燥,一次干燥参数为-30℃维持
420min、-30℃维持120min、-10℃维持120min、0℃维持180min,然后进行解析干燥,参数为,5℃维持120min、15℃维持120min、25℃维持180min、取出,轧上铝盖,即得沙苑子标准汤剂。
[0354]
二、.特征峰指认
[0355]
1、lc-ms分析条件
[0356]
①
uplc条件:
[0357]
waters acquity uplc色谱仪;色谱柱:agilent sb-c18色谱柱(2.1*150mm,1.8μm);流动相系统:甲醇(a):0.1%甲酸水(b);按照表30梯度程序洗脱;流速:0.25ml/min;检测波长270,266,210nm;柱温:30℃;进样量:3μl;0.8μl(对照品),梯度程序洗脱;流速:0.4ml/min;检测波长270,254,210nm;柱温:30℃;进样量:2.5μl(样品),0.2μl(对照品)。
[0358]
表30梯度洗脱程序
[0359][0360]
②
质谱条件:waters xevo g2-xs qtof质谱仪,esi离子源负离子检测;源电压:2.5kv,n2流速:800l/h,碰撞气体为氮气;毛细管温度400℃;锥孔气体流速:100l/h;气源温度:120℃;采用全扫描方式,分子量扫描范围50~1500;碰撞诱导解离电压:6v(低能量)、30~60v(高能量);
[0361]
③
供试品处理:取1中制备得到的沙苑子标准汤冻干粉,约0.20g,精密称定,置具塞锥形瓶中,精密加入75%甲醇25ml,称定重量,超声处理15min,放冷,摇匀,滤过,取续滤液过0.22μm滤膜,即得。
[0362]
④
对照品处理:沙苑子苷对照品溶液(浓度15.6μg/ml),取紫云英苷(批号dst171212-001,成都德思特生物有限公司,纯度≥98%)和杨梅素-3-o-β-d-葡萄糖苷(批号dst181109-272,成都德思特生物有限公司,纯度≥98%)适量,用50%甲醇溶解,配制混标。
[0363]
2、lc-ms分析结果
[0364]
2.1lc-ms质谱轮廓图
[0365]
得到的沙苑子标准汤剂lc-ms质谱图如图24所示,其中图24a所示为负离子模式bpi质谱图,图24b所示为266nm紫外色谱图。
[0366]
从266nm紫外色谱图来看,lc-ms质谱图色谱峰1-12疑似与特征指纹图谱1-12号峰一致。下面对该12个色谱峰的紫外光谱图及质谱图进行分析。
[0367]
各色谱峰的dad紫外图(200-400nm):图25、图27、图29、图31、图33、图35、图37、图
39、图41、图43和图45为特征峰1~7、9~12在两个不同的仪器及方法上的dad紫外吸收对比图。
[0368]
2.2紫外266nm下主要色谱峰的鉴定:
[0369]
2.21峰1
[0370]
峰1的保留时间为10.99min:dad图谱显示最大吸收波长为254和354nm,提示为黄酮类成分。由质谱图显示,m/z 611.12565为其准分子离子峰,m/z 461.07255为脱去一分子木糖的离子峰[m-132-18],m/z 316.02224为脱去一分子木糖和一份子葡萄糖形成的苷元准分子离子峰[m-h-132-162],提示为杨梅素糖苷,因此,该峰为鉴定为杨梅素-3-o-[β-d-吡喃木糖-(1
→
2)]-β-d-吡喃葡萄糖苷。图25所示为峰1的dad图谱。图26所示为峰1的ms/ms质谱图。
[0371]
2.2.2峰2
[0372]
峰2的保留时间为16.04min,dad图谱显示最大吸收波长为254和354nm,提示为黄酮类成分。由质谱图显示,m/z 479.08262为其准分子离子峰,m/z 316.02206为脱去一份子葡萄糖形成的苷元准分子离子峰[m-h-162],提示为杨梅素糖苷,因此,该峰为鉴定为杨梅素-3-o-β-d-吡喃葡萄糖苷或杨梅素-3-o-β-d-吡喃半乳糖苷。图27所示为峰2的dad图谱。图28所示为峰2的ms/ms质谱图。
[0373]
2.2.3峰3
[0374]
峰3的保留时间为27.16min,dad图谱显示最大吸收波长为265和346nm,提示为黄酮类成分。由质谱图显示,m/z 579.13581为其准分子离子峰,m/z 429.08282为脱去一分子木糖的离子峰[m-132-18],m/z 284.03252为脱去一分子木糖和一份子葡萄糖形成的苷元准分子离子峰[m-h-132-162],提示为山萘酚糖苷,因此,该峰为鉴定为山萘酚-3-o-[β-d-吡喃木糖-(1
→
2)]-β-d-吡喃葡萄糖苷。图29所示为峰3的dad图谱。图30所示为峰3ms/ms质谱图。
[0375]
2.2.4峰4
[0376]
峰4的保留时间为29.09min,dad图谱显示最大吸收波长为265和346nm,提示为黄酮类成分。由质谱图显示,m/z 493.09818为其准分子离子峰,m/z 330.03806为脱去一分子葡萄糖[m-162]的苷元离子峰,m/z 315.01432为苷元脱去一分子甲基形成的离子峰,因此,该峰为鉴定为沙苑子杨梅苷。图31所示为峰4的dad图谱。图32所示为峰4的ms/ms质谱图。
[0377]
2.2.5峰5
[0378]
峰5的保留时间为35.26min,dad图谱显示最大吸收波长为264和343nm,提示为黄酮类成分。由质谱图显示,m/z 447.09264为其准分子离子峰,m/z 284.03239为脱去一分子葡萄糖[m-162]的苷元离子峰,该峰为鉴定为山萘酚-3-o-β-d-葡萄糖苷。图33所示为峰5的dad图谱。图34所示为峰5的ms/ms质谱图。
[0379]
2.2.6峰6
[0380]
峰6的保留时间为36.29min,dad图谱显示最大吸收波长为263和350nm,提示为黄酮类成分。由质谱图显示,m/z 417.08232为其准分子离子峰,m/z 284.03282为脱去一分子阿拉伯糖[m-132]的苷元离子峰,该峰为鉴定为山奈酚-3-o-β-d-阿拉伯糖苷。图35所示为峰6的dad图谱。图36所示为峰6的ms/ms质谱图。
[0381]
2.2.7峰7
[0382]
峰7的保留时间为36.95min,dad图谱显示最大吸收波长为266和333nm,提示为黄酮类成分。由质谱图显示,m/z 593.15156为其准分子离子峰,m/z 461.10988为脱去一分子阿拉伯糖[m-132]的离子峰,298.04824为脱去一分子木糖和一分子葡萄糖[m-h-132-162]的苷元准分子离子峰,因此确定该成分为鼠李柠檬素糖苷,鉴定为鼠李柠檬素-3-o-[β-d-呋喃芹菜糖-(1
→
2)]-β-d-葡萄糖苷。图37所示为峰7的dad图谱。图38所示为峰7的ms/ms质谱图。
[0383]
2.2.8峰8
[0384]
峰8的保留时间为38.49min,通过对照品比对,确定为沙苑子苷。
[0385]
2.2.9峰9
[0386]
峰9的保留时间为41.39min,dad图谱显示最大吸收波长为266和321nm,提示为黄酮类成分。由质谱图显示,m/z 593.15156为其准分子离子峰,m/z 298.04842为鼠李柠檬素苷元,提示该峰也为鼠李柠檬素糖苷,其分子量比峰7多42,提示乙酰化,m/z 593.15333为其脱去一分子乙酰基的离子峰,因此该成分,鉴定为鼠李柠檬素-3-o-[β-d-呋喃芹菜糖-(1
″′→2″
)-6
″-
乙酰基]-β-d-葡萄糖苷。图39所示为峰9的dad图谱。图40所示为峰9的ms/ms质谱图。
[0387]
2.2.10峰10
[0388]
峰10的保留时间为42.65min,dad图谱显示最大吸收波长为265和333nm,提示为黄酮类成分。由质谱图显示,m/z 665.17244为其准分子离子峰,m/z 299.05557为鼠李柠檬素苷元,提示该峰也为鼠李柠檬素糖苷,其分子量比沙苑子苷多42,提示乙酰化,503.11901为脱去一分子葡萄糖[m-162]的离子峰,m/z 461.10840为其脱去一分子乙酰基的离子峰,因此该成分鉴定为乙酰基沙苑子苷。图41所示为峰10的dad图谱。图42所示为峰10的ms/ms质谱图。
[0389]
2.2.11峰11
[0390]
峰11的保留时间为47.76min,dad图谱显示最大吸收波长为268和329nm,提示为黄酮类成分。由质谱图显示,m/z 769.19919为其准分子离子峰,m/z 299.05557为鼠李柠檬素苷元,提示该峰也为鼠李柠檬素糖苷,m/z193.05082为阿魏酸准分子离子峰,提示结构中含有一分子阿魏酰,593.15173为脱去一分子阿魏酰[m-176]的离子峰,575.14110为脱去一分子阿魏酸[m-h-194]的离子峰,443.09878为脱去一分子阿魏酰和一分子芹菜糖形成的离子峰,在此基础上再脱去一分子葡萄糖形成苷元的准分子离子峰m/z298.04833。因此确定该成分为鼠李柠檬素-3-o-[5”'-o-阿魏酰-β-d-呋喃芹菜糖-(1”'
→
2”)]-β-d-吡喃葡萄糖苷。图43所示为峰11的dad图谱。图44所示为峰11的ms/ms质谱图。
[0391]
2.2.12峰12
[0392]
峰12的保留时间为48.89min,dad图谱显示最大吸收波长为267和311nm,提示为黄酮类成分。由质谱图显示,m/z 739.18871为其准分子离子峰,m/z 298.04848为鼠李柠檬素苷元,提示该峰也为鼠李柠檬素糖苷,m/z167.05096提示分子中含有一分子香豆酰,593.15216为脱去一分子香豆酰形成的离子峰,575.14154为脱去一分子香豆酸形成的离子峰,在此基础上脱去一分子芹菜糖形成离子m/z 461.10961,再脱去一分子葡萄糖形成苷元准分子离子峰m/z 298.04848。因此该成分鉴定为鼠李柠檬素-3-o-[5”'-o-对香豆酰-β-d-呋喃芹菜糖-(1”'-2”)]-β-d-吡喃葡萄糖苷.图45所示为峰12的dad图谱。图46所示为峰12
的ms/ms质谱图。
[0393]
峰2、峰3、峰5、峰8的进一步验证
[0394]
为了进一步验证,再次用沙苑子标准汤剂特征图谱的条件进行峰2(杨梅素-3-o-β-d-吡喃葡萄糖苷)、峰3(山奈酚-3-o-[β-d-吡喃木糖-(1
→
2)]-β-d-吡喃葡萄糖苷)、峰5(山奈酚-3-o-β-d-葡萄糖苷)、峰8(沙苑子苷)的指认,分离的峰2、3、5、8保留时间一致,结果如图47所示。
[0395]
经指认,如图48中所示:
[0396]
峰1的保留时间为10.99min,该峰为杨梅素-3-o-[β-d-吡喃木糖-(1
→
2)]-β-d-吡喃葡萄糖苷;
[0397]
峰2的保留时间为16.04min,该峰为杨梅素-3-o-β-d-吡喃葡萄苷;
[0398]
峰3的保留时间为23.16min,该峰为山萘酚-3-o-[β-d-吡喃木糖-(1
→
2)]-β-d-吡喃葡萄糖苷;
[0399]
峰4的保留时间为29.09min,该峰为沙苑子杨梅苷;
[0400]
峰5的保留时间为35.26min,该峰为山萘酚-3-o-β-d-葡萄糖苷;
[0401]
峰6的保留时间为36.28min,该峰为山奈酚-3-o-β-d-阿拉伯糖苷;
[0402]
峰7的保留时间为36.95min,该峰为鼠李柠檬素-3-o-[β-d-呋喃芹菜糖-(1
→
2)]-β-d-葡萄糖苷;
[0403]
峰8的保留时间为38.49min,该峰为沙苑子苷;
[0404]
峰9的保留时间为41.39min,该峰为鼠李柠檬素-3-o-[β-d-呋喃芹菜糖-(1
″′→2″
)-6
″-
乙酰基]-β-d-葡萄糖苷;
[0405]
峰10的保留时间为42.65min,该峰为乙酰基沙苑子苷;
[0406]
峰11的保留时间为47.76min,该峰为鼠李柠檬素-3-o-[5”'-o-阿魏酰-β-d-呋喃芹菜糖-(1
”′→
2”)]-β-d-吡喃葡萄糖苷;
[0407]
峰12的保留时间为48.89min,该峰为鼠李柠檬素-3-o-[5”'-o-对香豆酰-β-d-呋喃芹菜糖-(1
”′→
2”)]-β-d-吡喃葡萄糖苷。
[0408]
以上所述,仅是本发明实施的较佳实施例,并非对本发明做任何形式上的限制,凡在本发明的精神和原则之内所做的修改、等同替换和改进等,均需要包含在本发明的保护范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。