1.本发明涉及肝素样物质的制造方法、重组细胞及其制造方法。
背景技术:
2.肝素作为抗凝血药,是在人工透析、体外循环等医疗现场使用的不可或缺的药剂。肝素例如可作为血栓栓塞症的预防或治疗药以可注射的形态使用。另外,肝素还可用于例如在肾脏透析机等各种实验用和医疗用装置上形成抗凝剂表面。
3.肝素是作为糖胺聚糖(以下也简记为gag)的4个主要亚家族之一的多糖类。gag是由重复二糖单元构成的长的多糖。gag主要分为(1)硫酸乙酰肝素(以下也简记为hs)/肝素、(2)硫酸角质素(ks)、(3)硫酸软骨素/硫酸皮肤素(cs/ds)、(4)透明质酸或玻尿酸(ha)这4个亚家族。
4.gag的亚家族的单糖成分、糖苷键以及糖的位置和程度相互不同。除了ha以外,gag与核心蛋白共价结合,gag与核心蛋白共价结合而成的物质作为蛋白聚糖已知。
5.肝素和hs为酸性粘多糖类的非均质混杂物,肝素为hs的一种。肝素/hs是以糖醛酸(β-d-葡糖醛酸和α-l-艾杜糖醛酸)与葡糖胺(d-n-乙酰基葡糖胺和d-n-硫酸葡糖胺)的二糖为1单元、它们重复数十至数百次α或β-1,4结合而成的直链状的多糖。分子量根据链长的差异而多种多样,为3~30kda,平均为12~15kda。作为针对肝素/hs的修饰,可列举例如糖醛酸的2位的o-硫酸化、葡糖胺的3位和6位的o-硫酸化、2位的氨基的n-硫酸化。
6.几乎所有的哺乳动物细胞都产生会被整合到存在于胞外基质的细胞相关糖链中的蛋白聚糖中、从而规定组织形态和功能的gag。hs通过调节成纤维细胞生长因子(fgf)家族、血小板衍生生长因子(pdgf)和血管内皮细胞生长因子(vegf)等生长因子来调节细胞的增殖和发育。另一方面,肝素主要由肥大细胞产生。
7.用于药品等的肝素主要从猪小肠或牛肺中提取、纯化。但是,由这些供给源得到的肝素由于过硫酸化硫酸软骨素的混入而与一些有害事件相关(非专利文献1)。另外,从动物组织中分离肝素的操作存在从动物向人传播例如病毒、细菌和传染性海绵状脑病(transmissible spongiform encephalopathy)之类的疾病病原体的风险。因此,期望开发出不使用动物来源组织的肝素的新生产技术。虽然也可以利用化学方法或化学酶法来合成肝素,但是难以制造动物来源的肝素中存在的非均质结构群。
8.另一方面,黏结蛋白聚糖是具有所保持的细胞质膜结构域和细胞质结构域的细胞表面的4种蛋白聚糖家族。胞外结构域中存在共价结合的糖胺聚糖链。它们主要为硫酸乙酰肝素(hs),也包含硫酸软骨素(cs)(非专利文献2)。
9.现有技术文献
10.非专利文献
11.非专利文献1:guerrini et al,nat.biotechnol.,2008,26,pp.669-675
12.非专利文献2:trends in glycoscience and glycotechnology,1993,vol.5,no.22,pp.107-120
技术实现要素:
13.发明所要解决的问题
14.如上所述,期望开发出不使用动物来源组织的肝素的新生产技术。本发明人尝试了使用产生肝素样物质的哺乳动物细胞来产生肝素样物质,结果发现,含有由该哺乳动物细胞生产的肝素样物质的蛋白聚糖附着于细胞膜,难以分泌到培养上清中。因此,需要复杂的纯化步骤,在肝素样物质的工业生产化时成为重大课题。因此,本发明的目的在于,提供在不使用动物来源组织的情况下高效地生产肝素样物质的制造方法。
15.用于解决问题的方法
16.本发明人发现,通过向产生肝素样物质的哺乳动物细胞中导入编码黏结蛋白聚糖的胞外结构域的基因,能够解决上述课题,从而完成了本发明。
17.本发明如下所述。
18.1.一种肝素样物质的制造方法,其包括以下的步骤(1)~(3)。
19.(1)制备产生肝素样物质的哺乳动物细胞的步骤
20.(2)制备在步骤(1)中制备的产生肝素样物质的哺乳动物细胞中导入了编码黏结蛋白聚糖(以下简记为sdc)的胞外结构域的基因的重组细胞的步骤
21.(3)将步骤(2)中制备的重组细胞在培养基中培养并从得到的培养上清中回收肝素样物质的步骤
22.2.根据上述1所述的制造方法,其中,上述产生肝素样物质的哺乳动物细胞为导入了编码双功能性硫酸乙酰肝素n-脱乙酰酶/n-磺基转移酶(以下简记为ndst2)的基因和编码硫酸乙酰肝素葡糖胺3磺基转移酶1(以下简记为hs3st1)的基因中的至少一者的细胞。
23.3.根据上述1或2所述的制造方法,其中,上述哺乳动物细胞为来源于中国仓鼠的卵巢(以下简记为cho)细胞。
24.4.根据上述2或3所述的制造方法,其中,ndst2为含有以下的(1a)~(1c)中的任一种氨基酸序列且具有ndst2的功能的蛋白质。
25.(1a)序列号2记载的氨基酸序列
26.(1b)序列号2记载的氨基酸序列中缺失、置换或添加了1至数个氨基酸的氨基酸序列
27.(1c)与序列号2记载的氨基酸序列具有80%以上的同源性的氨基酸序列
28.5.根据上述2~4中任一项所述的制造方法,其中,hs3st1为含有以下的(2a)~(2c)中的任一种氨基酸序列且具有hs3st1的功能的蛋白质。
29.(2a)序列号3记载的氨基酸序列
30.(2b)序列号3记载的氨基酸序列中缺失、置换或添加了1至数个氨基酸的氨基酸序列
31.(2c)与序列号3记载的氨基酸序列具有80%以上的同源性的氨基酸序列
32.6.根据上述1~5中任一项所述的制造方法,其中,sdc的胞外结构域为含有以下的(3a)~(3c)中的任一种氨基酸序列且具有sdc的胞外结构域的功能的蛋白质。
33.(3a)序列号1记载的氨基酸序列
34.(3b)序列号1记载的氨基酸序列中缺失、置换或添加了1至数个氨基酸的氨基酸序列
35.(3c)与序列号1记载的氨基酸序列具有80%以上的同源性的氨基酸序列
36.7.根据上述2~6中任一项所述的制造方法,其中,ndst2和hs3st1来源于小鼠或人。
37.8.根据上述2~7中任一项所述的制造方法,其中,编码ndst2的基因含有以下的(1a)~(1d)中的任一碱基序列,且所述碱基序列编码具有ndst2的功能的蛋白质的氨基酸序列。
38.(1a)序列号4记载的碱基序列
39.(1b)序列号4记载的碱基序列中缺失、置换或添加了1至数个碱基的碱基序列
40.(1c)与序列号4记载的碱基序列的互补碱基序列在严格条件下杂交的碱基序列
41.(1d)与序列号4记载的碱基序列具有80%以上的同源性的碱基序列
42.9.根据上述2~8中任一项所述的制造方法,其中,编码hs3st1的基因含有以下的(2a)~(2d)中的任一碱基序列,且所述碱基序列编码具有hs3st1的功能的蛋白质的氨基酸序列。
43.(2a)序列号5记载的碱基序列
44.(2b)序列号5记载的碱基序列中缺失、置换或添加了1至数个碱基的碱基序列
45.(2c)与序列号5记载的碱基序列的互补碱基序列在严格条件下杂交的碱基序列
46.(2d)与序列号5记载的碱基序列具有80%以上的同源性的碱基序列
47.10.根据上述1~9中任一项所述的制造方法,其中,编码sdc的胞外结构域的基因含有以下的(3a)~(3d)中的任一碱基序列,且所述碱基序列编码具有sdc的胞外结构域的功能的蛋白质的氨基酸序列。
48.(3a)序列号6记载的碱基序列
49.(3b)序列号6记载的碱基序列中缺失、置换或添加了1至数个碱基的碱基序列
50.(3c)与序列号6记载的碱基序列的互补碱基序列在严格条件下杂交的碱基序列
51.(3d)与序列号6记载的碱基序列具有80%以上的同源性的碱基序列
52.11.一种重组细胞,其是在产生肝素样物质的哺乳动物细胞中导入了编码sdc的胞外结构域的基因的重组细胞。
53.12.根据上述11所述的重组细胞,其中,上述产生肝素样物质的哺乳动物细胞为导入了编码ndst2的基因和编码hs3st1的基因中的至少一者的细胞。
54.13.根据上述11或12所述的重组细胞,其中,上述哺乳动物细胞为cho细胞。
55.14.一种分泌产生肝素样物质的细胞的制造方法,其包括向产生肝素样物质的哺乳动物细胞中导入含有编码sdc的胞外结构域的基因的重组表达载体的步骤。
56.发明效果
57.根据本发明的肝素样物质的制造方法,通过向产生肝素样物质的哺乳动物细胞中导入编码黏结蛋白聚糖的胞外结构域的基因,从而使肝素样物质分泌生产到培养上清中,能够从该培养上清中回收肝素样物质。由此解决作为产物的肝素样物质附着于细胞膜的问题,不需要复杂的纯化步骤。因此,根据本发明的制造方法,能够在不使用动物来源组织的情况下高效地生产肝素样物质。
附图说明
58.图1为示出通过sgag分析测定cho/nh-srgn细胞和cho/nh-sdc细胞的培养上清中的sgag量的结果的图。
59.图2为示出通过hplc测定cho/nh-srgn细胞和cho/nh-sdc细胞的培养上清中的sgag量的结果的图。
60.图3(a)和(b)为示出使用hplc分析cho/nh-srgn细胞和cho/nh-sdc细胞的培养上清中的肝素的糖链结构的结果的图。图3(a)表示对肝素样糖链浓度进行定量的结果,图3(b)表示对硫酸化中所占的比例进行定量的结果。
61.图4为示出测定无血清驯化后的sgag量的结果的图。
62.图5为示出计算无血清驯化后的sgag的产生速率的结果的图。
63.图6为示出通过elisa测定目标蛋白质的表达量的结果的图。
64.图7(a)~(c)为通过qrt-pcr测定所导入的基因的表达量的结果。图7(a)示出ndst2基因的表达量,图7(b)示出hs3st1基因的表达量,图7(c)示出sdc基因的表达量。
65.图8示出对利用hplc的糖链结构的分析中使用的样品的sgag进行定量的结果。
66.图9为示出标准肝素来源不饱和二糖(hs-标准品(standards))和由各试样得到的hplc色谱图的图。
67.图10(a)和(b)为示出使用hplc分析各细胞的培养上清中的肝素的糖链结构的结果的图。图10(a)示出对肝素样糖链浓度进行定量的结果,图10(b)示出对硫酸化中所占的比例进行定量的结果。
68.图11示出抗凝活性的评价中使用的校正曲线。
具体实施方式
69.以下,本说明书中使用的术语只要没有特别提及则具有该领域中通常使用的含义。
70.<肝素样物质的制造方法>
71.本发明的肝素样物质的制造方法的特征在于,包括以下的步骤(1)~(3)。
72.(1)制备产生肝素样物质的哺乳动物细胞的步骤
73.(2)制备在步骤(1)中制备的产生肝素样物质的哺乳动物细胞中导入了编码黏结蛋白聚糖的胞外结构域的基因的重组细胞的步骤
74.(3)将步骤(2)中制备的重组细胞在培养基中培养并从得到的培养上清中回收肝素样物质的步骤
75.以下对各步骤进行说明。
76.步骤(1):制备产生肝素样物质的哺乳动物细胞的步骤
77.步骤(1)是通过将编码肝素生物合成所必需的蛋白质的基因导入到成为宿主的哺乳动物细胞中而制备产生肝素样物质的哺乳动物细胞的步骤。
78.本发明中,“肝素样物质”是指肝素与hs的混合物。
79.作为哺乳动物细胞,可列举例如中国仓鼠卵巢细胞cho细胞[journal of experimental medicine,108,945(1958);proc.natl.acad.sci.usa,60,1275(1968);genetics,55,513(1968);chromosoma,41,129(1973);methods in cell science,18,115
molecular biology,john wiley&sons(1987-1997)、nucleic acids research,10,6487(1982)、proc.natl.acad.sci.usa,79,6409(1982)、gene,34,315(1985)、nucleic acids research,13,4431(1985)、proc.natl.acad.sci.usa,82,488(1985)]等,向编码含有例如序列号1~3的氨基酸序列的多肽的dna中导入位点特异性变异,从而得到。
[0091]
氨基酸序列的“1至数个氨基酸的缺失、置换、添加”中的“1至数个”的范围没有特别限定,例如,将氨基酸序列中的氨基酸数100个作为一单位时,是指相对于该一单位为1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19或20个,优选为1、2、3、4、5、6、7、8、9或10个左右,更优选为1、2、3、4或5个左右。
[0092]“氨基酸的缺失”是指序列中的氨基酸残基的脱落或消失,“氨基酸的置换”是指序列中的氨基酸残基被置换为其它氨基酸残基,“氨基酸的添加”是指以插入的方式向序列中添加了新的氨基酸残基。
[0093]
作为“1至数个氨基酸的缺失、置换、添加”的具体方式,有将1至数个氨基酸用其它的化学上类似的氨基酸置换的方式。例如,可以列举将某个疏水性氨基酸置换为其它疏水性氨基酸的情况、将某个极性氨基酸置换为具有相同电荷的其它极性氨基酸的情况等。这样的化学上类似的氨基酸对于每个氨基酸而言在该技术领域中是已知的。
[0094]
若列举具体例,作为非极性(疏水性)氨基酸,可列举丙氨酸、缬氨酸、甘氨酸、异亮氨酸、亮氨酸、脯氨酸、色氨酸、苯丙氨酸、甲硫氨酸等。作为极性(中性)氨基酸,可列举丝氨酸、苏氨酸、酪氨酸、谷氨酰胺、天冬酰胺、半胱氨酸等。作为带正电荷的碱性氨基酸,可列举精氨酸、组氨酸、赖氨酸等。另外,作为带负电荷的酸性氨基酸,可列举天冬氨酸、谷氨酸等。
[0095]
作为成为对象的蛋白质所具有的氨基酸序列中具有1至数个氨基酸的缺失、置换、添加等的氨基酸序列,可列举与成为对象的蛋白质所具有的氨基酸序列具有一定以上的序列一致性的氨基酸序列,例如可列举与成为对象的蛋白质所具有的氨基酸序列具有60%以上、优选为65%以上、优选为70%以上、优选为75%以上、优选为80%以上、优选为85%以上、更优选为90%以上、进一步优选为95%以上的序列一致性的氨基酸序列。
[0096]
作为编码ndst2的基因,可列举含有以下的(1-a)~(1-d)中的任一碱基序列的基因,并且所述碱基序列编码具有ndst2的功能的蛋白质的氨基酸序列。
[0097]
(1-a)序列号4记载的碱基序列或ncbi登录号nm_003635.3的碱基序列
[0098]
(1-b)序列号4记载的碱基序列或ncbi登录号nm_003635.3的碱基序列中缺失、置换或添加了1至数个碱基的碱基序列
[0099]
(1-c)与序列号4记载的碱基序列或ncbi登录号nm_003635.3的碱基序列的互补碱基序列在严格条件下杂交的碱基序列
[0100]
(1-d)与序列号4记载的碱基序列或ncbi登录号nm_003635.3的碱基序列具有至少60%以上的同源性的碱基序列、优选具有80%以上的同源性的碱基序列、进一步优选具有95%以上的同源性的碱基序列
[0101]
作为编码hs3st1的基因,可列举含有以下(2-a)~(2-d)中的任一碱基序列的基因,并且所述碱基序列编码具有hs3st1的功能的蛋白质的氨基酸序列。
[0102]
(2-a)序列号5记载的碱基序列或ncbi登录号nm_010474.2的碱基序列
[0103]
(2-b)序列号5记载的碱基序列或ncbi登录号nm_010474.2的碱基序列中缺失、置换或添加了1至数个碱基的碱基序列
[0104]
(2-c)与序列号5记载的碱基序列或ncbi登录号nm_010474.2的碱基序列的互补碱基序列在严格条件下杂交的碱基序列
[0105]
(2-d)与序列号5记载的碱基序列或ncbi登录号nm_010474.2的碱基序列具有至少60%以上的同源性的碱基序列、优选具有80%以上的同源性的碱基序列、进一步优选具有95%以上的同源性的碱基序列
[0106]
作为在严格条件下杂交的碱基序列,是指通过使用含有成为对象的碱基序列的dna作为探针的、菌落杂交法、噬菌斑杂交法、southern印迹杂交法或dna微阵列法等得到的能够杂交的dna的碱基序列。
[0107]
具体而言,可列举能够通过如下操作鉴定的dna的碱基序列:使用固定化有进行了杂交的菌落或噬菌斑来源的dna、或具有该序列的pcr产物或寡dna的过滤器或玻片,在0.7~1.0mol/l的氯化钠存在下在65℃下进行杂交法[molecular cloning,a laboratory manual,second edition,cold spring harbor laboratory press(1989)、current protocols in molecular biology,john wiley&sons(1987-1997)、dna cloning 1:core techniques,a practical approach,second edition,oxford university,(1995)]后,使用0.1~2倍浓度的ssc溶液(1倍浓度的ssc溶液的组成由150mmol/l氯化钠、15mmol/l柠檬酸钠构成),在65℃条件下洗涤过滤器或玻片,由此鉴定。
[0108]
作为含有在严格条件下杂交的碱基序列的dna,可列举与作为探针使用的具有成为对象的基因的碱基序列的dna的碱基序列具有一定以上的序列一致性的dna。例如,可列举与成为对象的碱基序列具有至少60%以上的同源性的dna、优选具有80%以上的同源性的dna、进一步优选具有95%以上的同源性的dna。另外,可列举例如:将碱基序列中的碱基数100个作为一单位时,含有在成为对象的基因的碱基序列中相对于该一单位具有1至数个、优选为1~40个、优选为1~35个、优选为1~30个、优选为1~25个、优选为1~20个、更优选为1~15个、进一步优选为1、2、3、4、5、6、7、8、9或10个、还进一步优选为1、2、3、4或5个碱基的缺失、置换、添加等的碱基序列的dna。
[0109]“碱基的缺失”是指序列中的碱基有脱落或消失,“碱基的置换”是指序列中的碱基被置换为其它碱基,“碱基的添加”是指以插入的方式添加了新的碱基。
[0110]
在真核生物的编码蛋白质的基因的碱基序列中经常可看到基因的多态性。关于本发明中使用的基因,由于这样的多态性而在碱基序列中产生了小规模变异的基因也包括在该基因中。
[0111]
除了特别声明的情况以外,本发明中的同源性的数值可以是使用本领域技术人员公知的同源性检索程序计算出的数值,但对于碱基序列,可列举在blast[j.mol.biol.,215,403(1990)]中使用默认参数计算出的数值等,对于氨基酸序列,可列举在blast2[nucleic acids res.,25,3389(1997),genome res.,7,649(1997),https://blast.ncbi.nlm.nih.gov/blast.cgi?page_type=blastsearch&blas t_spec=blast2seq&link_loc=align2seq]中使用默认参数计算出的数值等。
[0112]
作为默认参数,g(cost to open gap)在碱基序列的情况下为5、在氨基酸序列的情况下为11,-e(cost to extend gap)在碱基序列的情况下为2、在氨基酸序列的情况下为1,-q(penalty for nucleotide mismatch)为-3,-r(reward for nucleotide match)为1、-e(expect value)为10,-w(wordsize)在碱基序列的情况下为11个残基、在氨基酸序列
的情况下为3个残基,-y[dropoff(x)for blast extensions in bits]在blastn的情况下为20、在blastn以外的程序中为7,-x(x dropoff value for gapped alignment in bits)为15,和-z(final x dropoff value for gapped alignment in bits)在blastn的情况下为50、在blastn以外的程序中为25(https://blast.ncbi.nlm.nih.gov/blast.cgi?page_type=blastsearch)。
[0113]
产生肝素样物质的哺乳动物细胞可以通过将含有编码肝素生物合成所必需的蛋白质的全长或其部分长度的cdna的重组载体导入到成为宿主细胞的哺乳动物细胞中而得到。
[0114]
作为重组载体,只要能够在使用的宿主细胞中自主复制或能够整合到染色体中、在能够转录编码多肽的dna的位置含有适当的启动子就都可以使用。
[0115]
重组载体中,转录终止序列未必是必需的,但优选在紧邻结构基因的下游配置转录终止序列。进而,该重组载体中可以含有控制启动子的基因。
[0116]
作为重组载体,优选使用在起始密码子周围适当地配置有作为核糖体结合序列的kozak序列的质粒。
[0117]
dna的碱基序列中,可以以成为最适合在宿主内表达的密码子的方式置换碱基,由此能够提高作为目标的ndst2和hs3st1的生产率。
[0118]
作为重组载体,只要是能够在动物细胞中发挥作用的重组载体都可以使用,可列举例如pcdna i、pcdm8(
フナコシ
公司)、page107[日本特开平03-22979号公报;cytotechnology,3,133(1990)]、pas3-3(日本特开平02-227075号公报)、pcdm8[nature,329,840(1987)]、pcdna i/amp(
インビトロジェン
公司)、pcdna3.1(
インビトロジェン
公司)、prep4(
インビトロジェン
公司)、page103[j.biochemistry,101,1307(1987)]、page210、pme18sfl3、pkantex93(国际公开第97/10354号)、n5kg1val(美国专利第6001358号说明书)、inpep4(biogen-idec公司)和转座子载体(国际公开第2010/143698号)等。
[0119]
作为启动子,只要是能够在动物细胞中发挥作用的启动子就都可以使用,可列举例如巨细胞病毒(cmv)的(immediate early,ie,即刻早期)基因的启动子、sv40的早期启动子、逆转录病毒的启动子、金属硫蛋白启动子、热休克启动子、srα启动子、或莫洛尼小鼠白血病病毒的启动子或增强子。另外,也可以将人cmv的ie基因的增强子与启动子一起使用。
[0120]
重组载体有时含有选择标记。“选择标记”为能够选择含有基因的细胞的基因。“正向选择”是指发生正向选择、选择含有选择标记的细胞的过程。药剂抗性为正向选择标记的一例,含有标记的细胞在含药剂的培养用培养基中存活,没有标记的细胞死亡。作为选择标记,可列举:提供g418抗性的neo;提供潮霉素抗性的hygr;和提供嘌呤霉素抗性的puro等药剂抗性基因。其它的正向选择标记基因包括能够进行含有标记的细胞的鉴定或筛选的基因。作为这些基因,尤其可列举荧光蛋白(gfp和gfp样发色团、荧光素酶)基因、lacz基因、碱性磷酸酶基因和cd8等表面标记。“负向选择”是指暴露于适当的负向选择药剂中而使含有负向选择标记的细胞死亡的过程。例如,含有单纯疱疹病毒胸苷激酶(hsv-tk)基因的细胞[wigler et al,cell 11:223(1977)]对药剂更昔洛韦(ganc)敏感。同样,gpt基因使细胞对6-硫黄嘌呤敏感。
[0121]
作为向宿主细胞中导入重组载体的方法,只有是能够向动物细胞中导入dna的方法就都可以使用。例如,可列举电穿孔法[cytotechnology、3、133(1990)]、磷酸钙法(日本
特开平02-227075号公报)或脂质体转染法[proc.natl.acad.sci.usa,84,7413(1987)]等。
[0122]
步骤(2):制备在步骤(1)中制备的产生肝素样物质的哺乳动物细胞中导入了编码黏结蛋白聚糖的胞外结构域的基因的重组细胞的步骤
[0123]
步骤(2)是将含有编码黏结蛋白聚糖的胞外结构域的基因的重组载体导入到步骤(1)中制备的产生肝素样物质的哺乳动物细胞中而制备重组细胞的步骤。
[0124]
黏结蛋白聚糖的结构包含胞外结构域、跨膜结构域和细胞质结构域。其中,黏结蛋白聚糖的胞外结构域含有糖胺聚糖结合部位。作为黏结蛋白聚糖的胞外结构域,优选至少具有糖胺聚糖结合部位。黏结蛋白聚糖的胞外结构域优选来源于哺乳动物,更优选来源于小鼠或人。
[0125]
作为黏结蛋白聚糖的胞外结构域,可列举含有以下的(3-a)~(3-c)中的任一种氨基酸序列且具有黏结蛋白聚糖的胞外结构域的功能的蛋白质。
[0126]
(3-a)序列号1记载的氨基酸序列或ncbi登录号np_001006947.1的氨基酸序列
[0127]
(3-b)序列号1记载的氨基酸序列中缺失、置换或添加了1至数个氨基酸的氨基酸序列
[0128]
(3-c)与序列号1记载的氨基酸序列具有60%以上、优选为80%以上、进一步优选为90%以上、最优选为95%以上的同源性的氨基酸序列
[0129]
序列号1记载的氨基酸序列为ncbi登录号np_001006947.1的氨基酸序列(全长310个氨基酸)的n末端起第1~229位的氨基酸序列。
[0130]
作为编码黏结蛋白聚糖的胞外结构域的基因,可列举含有以下的(3-a)~(3-d)中的任一碱基序列的基因,并且所述碱基序列编码具有黏结蛋白聚糖的胞外结构域的功能的蛋白质的氨基酸序列。
[0131]
(3-a)序列号6记载的碱基序列或ncbi登录号nm_001006946.1的碱基序列
[0132]
(3-b)序列号6记载的碱基序列或ncbi登录号nm_001006946.1的碱基序列中缺失、置换或添加了1至数个碱基的碱基序列
[0133]
(3-c)与序列号6记载的碱基序列或ncbi登录号nm_001006946.1的碱基序列的互补碱基序列在严格条件下杂交的碱基序列
[0134]
(3-d)与序列号6记载的碱基序列或ncbi登录号nm_001006946.1的碱基序列具有至少60%以上的同源性的碱基序列、优选具有80%以上的同源性的碱基序列、进一步优选具有95%以上的同源性的碱基序列
[0135]
步骤(2)中,通过将含有编码黏结蛋白聚糖的胞外结构域的基因、编码黏结蛋白聚糖的胞外结构域的全长或其部分长度的cdna的重组载体导入到步骤(1)中制备的产生肝素样物质的哺乳动物细胞中,得到能够将肝素样物质分泌到培养上清中的重组细胞。
[0136]
作为重组载体和向宿主细胞中导入重组载体的方法,与步骤(1)相同。
[0137]
(3)将步骤(2)中制备的重组细胞在培养基中培养并从得到的培养上清中回收肝素样物质的步骤
[0138]
步骤(3)是将步骤(2)中制备的重组细胞在培养基中培养,从而使重组细胞向培养基中分泌生产肝素样物质、并从得到的培养上清中回收肝素样物质的步骤。
[0139]
步骤(3)中,优选在促进肝素样物质的产生的条件下培养重组细胞。具体而言,例如优选在能够进行重组细胞的肝素样物质的产生、且促进肝素样物质从重组细胞向培养上
清的分泌的培养基中培养重组细胞。
[0140]
培养基优选至少含有足以能维持细胞的存活率、表达肝素样物质的碳、氮、氧和其它营养素、生长因子、缓冲剂、辅因子和其它任意物质。在编码肝素样物质的基因处于诱导性启动子的控制下或者含有诱导性启动子的实施方式中,培养基可以还含有诱导物。
[0141]
作为培养基,可列举例如添加了10%胎牛血清(fcs)的rpmi或dmem、以及添加了抗菌剂、生长因子、其它细胞因子等因子的组织培养用培养基中(例如cell biology(third edition)a laboratory handbook,vol.1,2006,elsevier inc.)。具体而言,可列举例如本领域技术人员公知的培养基制剂、例如rpmi、imdm、dmem、dmem/f12、无血清或低血清的emem。这些培养基可以含有抗生素、脂质、转铁蛋白、胰岛素、氨基酸等追加的营养辅助食品和根据需要使用的辅因子。
[0142]
从促进肝素样物质的产生的观点出发,培养基优选含有选自葡萄糖、硫酸盐和磷酸中的至少一种。培养基中的葡萄糖的浓度通常优选为5~75mm,更优选为10~60mm,进一步优选为15~35mm。培养基中的硫酸盐的浓度通常优选为0.5~50mm,更优选为10~50mm,进一步优选为30~50mm。培养基中的磷酸盐的浓度通常优选为0.5~50mm,更优选为1~50mm,进一步优选为10~50mm。
[0143]
通过在培养上清中生成蓄积肝素样物质并从培养上清中采集,可以制造肝素样物质。关于在培养基中培养重组细胞的方法,可以按照通常的方法进行。培养通常在ph6~8、30~40℃、5%co2存在下等条件下进行1~7天。
[0144]
从重组细胞分泌生产肝素样物质这一点可以如下确认:如实施例中后述那样,向培养上清中添加含有肝素裂解酶i、ii、iii的酶溶液进行酶处理后,利用不饱和二糖分析用hplc进行定量,由此进行确认。具体而言,与作为对照(野生型)的细胞的培养上清相比,重组细胞的培养上清中的、选自在葡糖胺的氨基和6位上结合有3个硫酸基的2sns6、在葡糖醛酸2位和葡糖胺氨基上结合有硫酸基的2sns、在葡糖胺的氨基和6位上结合有2个硫酸的ns6s、在葡糖胺n上结合有硫酸基的ns中的至少1种的量增加的情况下,视为从重组细胞向培养上清中分泌生产了肝素样物质。从重组细胞分泌生产肝素样物质这一点也可以如实施例中后述那样通过测定培养上清中的sgag(硫酸化gag)量来确认。
[0145]
步骤(3)中,从重组细胞向培养上清中分泌作为含有结合在作为gag的肝素样物质上的核心蛋白的糖蛋白的糖胺聚糖。从培养上清分离蛋白质的操作可通过该领域中以往公知的方法来进行。例如,可以使用亲和标签之类的使肝素样物质的分离容易进行的标签。作为标签,可列举例如聚组氨酸(his6标签)、镍基质、几丁质结合蛋白(cbp)、麦芽糖结合蛋白(mbp)、谷胱甘肽-s-转移酶(gst)、flag标签或表位标签。
[0146]
从核心蛋白分离肝素样物质的操作可通过该技术领域中以往公知的方法来进行。例如,可列举使用肝素酶的酶消化法、利用氢氧化钠或碱金属硼氢化物的处理。
[0147]
被分离的肝素样物质优选含有优选50%以上、更优选60%以上、进一步优选70%以上、特别优选80%以上的硫酸化二糖类。
[0148]
被分离的肝素样物质含有例如以下的(1)~(20)。
[0149]
(1)10~50%的三硫酸化二糖、30~50%的二硫酸化二糖和10~30%的一硫酸化二糖。
[0150]
(2)10~40%的三硫酸化二糖、35~45%的二硫酸化二糖和10~25%的一硫酸化
二糖。
[0151]
(3)15~40%的三硫酸化二糖、35~45%的二硫酸化二糖和10~25%的一硫酸化二糖。
[0152]
(4)5~25%的三硫酸化二糖、30~50%的二硫酸化二糖和10~20%的一硫酸化二糖。
[0153]
(5)1~30%的三硫酸化二糖、25~55%的二硫酸化二糖和5~40%的一硫酸化二糖。
[0154]
(6)15~40%的三硫酸化二糖类。
[0155]
(7)35~45%的二硫酸化二糖类。
[0156]
(8)10~25%的一硫酸化二糖类。
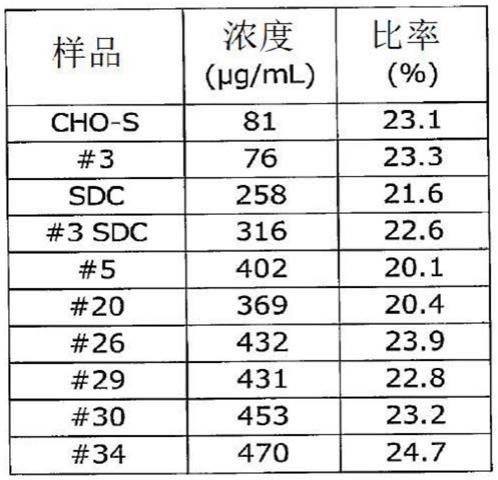
[0157]
(9)10~50%的三硫酸化二糖类。
[0158]
(10)30~50%的二硫酸化二糖类。
[0159]
(11)10~30%的一硫酸化二糖类。
[0160]
(12)15~30%的三硫酸化二糖类。
[0161]
(13)40~45%的二硫酸化二糖类。
[0162]
(14)10~15%的一硫酸化二糖类。
[0163]
(15)5~25%的三硫酸化二糖类。
[0164]
(16)1~30%的三硫酸化二糖类。
[0165]
(17)30~50%的二硫酸化二糖类。
[0166]
(18)25~55%的二硫酸化二糖类。
[0167]
(19)10~20%的一硫酸化二糖类。
[0168]
(20)5~40%的一硫酸化二糖类。
[0169]
肝素样物质可含有各种长度的二糖单元的重复结构。肝素样物质优选含有ua-glcnac(6s)、ua(2s)-glcnac、ua-(2s)-glcnac(6s)、ua-glcns、ua-glcns(6s)、ua(2s)-glcns、ua(2s)-glcns(6s)中的任一者,这些可以以任意顺序存在于肝素样物质中。
[0170]
上述中,ua为糖醛酸残基(即,葡糖醛酸或艾杜糖醛酸),ac为乙酰基,glcnac为n-乙酰基葡糖胺,glcns为葡糖胺-n-硫酸,2s为2-o-硫酸盐,6s为6-o-硫酸盐。
[0171]
<重组细胞>
[0172]
作为本发明的一个方式,可列举在产生肝素样物质的哺乳动物细胞中导入了编码sdc的胞外结构域的基因的重组细胞。该重组细胞可以通过与<肝素样物质的制造方法>项的步骤(1)和步骤(2)中所述的步骤同样地制备产生肝素样物质的哺乳动物细胞、向该哺乳动物细胞中导入编码黏结蛋白聚糖的胞外结构域的基因来制作。
[0173]
<分泌产生肝素样物质的细胞的制造方法>
[0174]
作为本发明的一个方式,可列举分泌产生肝素样物质的细胞的制造方法,其包括向产生肝素样物质的哺乳动物细胞中导入含有编码sdc的胞外结构域的基因的重组表达载体的步骤。该制造方法可以通过与<肝素样物质的制造方法>项的步骤(1)和步骤(2)中所述的步骤同样地制备产生肝素样物质的哺乳动物细胞、向该哺乳动物细胞中导入编码黏结蛋白聚糖的胞外结构域的基因来实施。
[0175]
<药物组合物>
transposon vector pb513b-1为基础且具有中国仓鼠的ef1α启动子、ires元件、c末端的mychis标签序列的载体。载体pb513b-1_srgn-ires-egfp中,以在ef1α启动子的控制下使编码hsrgn的dna(序列号7所示的碱基序列)与作为筛选标记的egfp基因和嘌呤霉素抗性基因共表达的方式进行了导入。
[0190]
制作使用载体pb513b-1_srgn-ires-egfp在cho/nh#3细胞中导入了编码人丝甘蛋白聚糖(srgn)的dna(序列号7所示的碱基序列)的cho/nh-srgn细胞、使用载体pb513b-1_sdc-ires-egfp在cho/nh#3细胞中导入了人黏结蛋白聚糖(sdc)的胞外结构域的dna(序列号6所示的碱基序列)的cho/nh-sdc细胞。
[0191]
cho/nh-sdc细胞的制作中使用的载体pb513b-1_sdc-ires-egfp是以piggybac transposon vector pb513b-1为基础且具有中国仓鼠的ef1α启动子、ires元件、c末端的mychis标签序列的载体。载体pb513b-1_sdc-ires-egfp中,以在ef1α启动子的控制下使编码srgn的dna(序列号7所示的碱基序列)与作为筛选标记的egfp基因和嘌呤霉素抗性基因进行共表达的方式进行了导入。
[0192]
分析如上制作的各细胞的培养上清,进行肝素生产能力的评价。
[0193]
<cho/nh-srgn细胞和cho/nh-sdc细胞的培养上清中的sgag量的测定>
[0194]
以增殖性良好的状态培养各细胞后,以0.6
×
106个细胞/孔接种到6孔板中,不进行培养基交换,将3天后回收的培养上清作为试样,通过sgag分析来测定sgag量。sgag分析是指使用与硫酸化糖链特异性结合的染料(1,9-二甲基亚甲蓝)对溶液中的总sgag量进行比色定量的分析。将结果示于图1。
[0195]
<利用hplc的糖链结构的分析结果>
[0196]
由于sgag分析暗示了向培养上清中的肝素产生,因此对该样品进行了利用hplc的糖链结构的分析。将分析中使用的样品的sgag定量结果示于图2。需要说明的是,cho/nh-sdc细胞的样品的浓度低,未能确认是否存在足以进行分析的糖链,因此进行了利用离心柱的浓缩操作。
[0197]
关于肝素产生的确认,首先,直接取试样溶液20μl,添加缓冲液10μl、含有肝素裂解酶i、ii、iii各10mu的酶溶液10μl,在37℃下进行3小时酶处理,反应结束后,以100℃、5分钟使酶失活,冷冻干燥后加入20μl的水,使用不饱和二糖分析用hplc进行定量。将结果示于图3(a)和(b)。
[0198]
图3(a)和(b)中,wt表示野生型cho细胞,#3表示cho-nh#3细胞,srgn表示使用载体pb513b-1_srgn-ires-egfp在cho细胞中导入了编码srgn的dna(序列号7所示的碱基序列)的cho-srgn细胞,#3srgn表示cho/nh-srgn细胞,sdc表示使用载体pb513b-1_sdc-ires-egfp在cho细胞中导入了sdc的胞外结构域的dna(序列号6所示的碱基序列)的cho-sdc细胞。
[0199]
如图3(a)和(b)所示,srgn导入细胞(srgn、#3srgn)的培养上清中,与wt或#3相比,未检测到肝素样物质的检出的增加。另一方面,sdc导入细胞(sdc、#3sdc)的培养上清中,肝素样物质的产生与wt或#3相比增加。根据以上结果认为,cho/nh-sdc细胞是更适合于肝素样物质的产生的细胞,实施克隆和各克隆的分析。
[0200]
2.无血清驯化后的gag量的测定结果
[0201]
由于观察到肝素特征性的糖链结构,因此实施了cho/nh-sdc细胞的克隆和各克隆
的分析。
[0202]
<克隆和无血清驯化>
[0203]
使用加入了血清的培养基将cho/nh-sdc细胞培养至粘附状态,通过极限稀释法用胶原蛋白包被96孔板进行克隆。此时,由于从1个细胞开始进行培养,因此考虑到对细胞的毒性,在不添加药剂的情况下进行培养。放大为胶原蛋白包被24、6孔板,培养多个克隆,由此建立了36个克隆。之后将各细胞以0.6
×
106个细胞/孔接种到常规6孔板中,不进行培养基交换,将3天后回收的培养上清作为试样,测定培养上清中的sgag量,对于排前6的克隆(#5、#20、#26、#29、#30、#34)进行无血清驯化。
[0204]
<无血清驯化后的sgag量、sgag产生速率、sdc量的测定>
[0205]
无血清驯化后,将各细胞以0.6
×
106个细胞/孔接种到常规6孔板中,不进行培养基交换,将3天后回收的培养上清作为试样,测定培养上清中的sgag量。将结果示于图4。另外,将计算sgag的产生速率而得到的结果示于图5,将利用elisa定量培养上清中的sdc量的结果示于图6。
[0206]
如图6所示,所评价的6个克隆与cho/nh-sdc细胞相比具有同等以上的sdc的分泌产生能力,#5显示出cho/nh-sdc细胞的1.5倍以上的最高表达量。
[0207]
<利用qrt-pcr的导入基因表达量的分析>
[0208]
将各细胞以0.6
×
106个细胞/孔接种到6孔板中,由不进行培养基交换地培养了3天的细胞进行rna的提取和cdna的制作,利用qrt-pcr对导入基因(ndst2、hs3st1和sdc)的表达量进行定量。图7(a)示出ndst2基因的表达量,图7(b)示出hs3st1基因的表达量,图7(c)示出sdc基因的表达量。
[0209]
如图7(a)~(c)所示,在#5中可确认各基因的高表达水平,另一方面在#26中未确认到表达。#26在抗凝活性方面也显示出比其它克隆低的活性,暗示了利用ndst2和hs3st1形成了atiii识别特异性序列。
[0210]
3.利用hplc的糖链结构的分析
[0211]
利用hplc对各种cho细胞所产生的肝素样物质的糖链结构进行分析。
[0212]
<分析条件>
[0213]
作为试样的预处理,将各种cho细胞的培养上清400μl以10000rpm离心分离10分钟,向所得的上层中加入400μl的双蒸水(double distilled water、ddw),进行冷冻干燥。之后从40μl的样品分取出20μl,进行肝素裂解酶i、ii和iii处理后,加入80μl的ddw,将20μl供于hplc。
[0214]
利用特异性分解酶的处理如下进行。同时加入乙酸缓冲液[0.1mch3coona、10mm(ch3coo)2ca(ph7.0)]20μl、0.5mu/μl肝素酶5μl、0.5mu/μl乙酰肝素酶i 5μl、0.5mu/μl乙酰肝素酶ii 5μl,在37℃下温育16小时,由此将肝素样糖链分解为不饱和二糖。在沸水浴中加热3分钟而使酶失活,冷冻干燥后溶解于水,供于利用hplc的不饱和二糖分析。
[0215]
<hs和cs的二糖组成分析>
[0216]
使用下述所示的装置和分析软件进行hs和cs的二糖组成分析。
[0217]
洗脱液的泵:岛津制作所制造的liquid chromatography lc-10ai
[0218]
检测器:jasco制造的智能荧光检测器fp-920s
[0219]
后反应用泵:日本精密科学株式会社制造的minichemi pump np-fx(ii)-1u
[0220]
积分器:日立制作所制造的色谱积分器d-2500
[0221]
进样器:reodyne公司制造的进样器(型号7725)
[0222]
柱:
センシュー
科学制造的senshu pak docosil(4.6mm i.d.
×
150mm)
[0223]
柱温箱:日立制作所制造的l-7300
[0224]
干式反应槽:岛村计器制作所制造的干式反应槽db-5
[0225]
分析软件:株式会社
ランタイムインスツルメンツ
制造的chromato-pro
[0226]
将利用hplc对用于分析的试样中的sgag进行定量的结果示于图8,将由标准肝素来源不饱和二糖(hs-标准品)和试样得到的色谱图示于图9。另外,将利用hplc对肝素样糖链的含量、各糖链在硫酸化中所占的比例进行定量的结果分别示于图10(a)和(b)。表1示出检测到的肝素样物质中硫酸化糖链(hs)的浓度和硫酸化糖链的比率。
[0227]
[表1]
[0228][0229]
如表1所示,从由制作的克隆(#5、#20、#26、#29、#30、#34)得到的样品检测到的糖链的硫酸化度与肝素为同等程度,肝素样糖链的产生与对照(cho-s、sdc)相比显著增加。
[0230]
<抗因子xa活性的测定>
[0231]
使用积水医疗株式会社制造的
テストチーム
肝素s测定试剂盒(http://www.info.pmda.go.jp/tgo/pack/13a2x00197218081_a_01_10/)进行测定。标准品肝素使用医疗用肝素(101iu/mg)来制备。测定原理的概要如下所述。
[0232]
构成试剂名、成分:
[0233]
1.底物剂:n-苯甲酰-l-异亮氨酰-l-谷氨酰(γ-or)-甘氨酰-l-精氨酰-对硝基苯胺盐酸盐(s-2222)
[0234]
2.抗凝血酶iii剂:抗凝血酶iii(人来源)
[0235]
3.因子xa剂:因子xa(牛来源)
[0236]
4.缓冲液:2-氨基-2-羟甲基-1,3-丙二醇缓冲液
[0237]
5.正常血浆剂:人正常血浆
[0238]
抗凝能力的验证
[0239]
对于上述hplc结果中硫酸化度高的克隆(#20、#26、#29、#30、#34),使用图11所示
的校正曲线调查抗凝活性(抗fxa活性9。将结果示于表2。
[0240]
[表2]
[0241][0242]
如表2所示,由#20、#29、#30、#34得到的试样中,可确认到每1ml培养基大约为0.1iu的抗fxa活性。根据该结果暗示了,通过ndst2和hs3st1的导入使得抗凝血酶结合性序列含有在培养上清中的肝素样糖链中。
[0243]
使用特定方式详细说明了本发明,但可以在不脱离本发明的意图和范围的情况下进行各种变更和变形,这对于本领域技术人员而言是显而易见的。需要说明的是,本技术基于2019年10月2日提出的日本专利申请(日本特愿2019-182467),通过引用而援引其整体。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。