1.本发明属于肉加工储存技术领域,特别涉及一种肌原纤维蛋白的性能提升方法。
背景技术:
2.肉类和肉类制品是补充人类高营养蛋白质来源的关键,含有多种肽、可消化赖氨酸以及所有必需氨基酸;肌原纤维蛋白(mp)约占肌肉总蛋白的55~60%,是肌肉的主要结构成分,具有乳化、糊化和保水等重要功能特性。特别是,肌原纤维蛋白(mp)在热加工过程中形成的三维凝胶网络结构(凝胶特性)是固定脂肪颗粒和水、截留风味物质的基础,从而赋予肉制品适口性、多汁性和风味;然而,在生肉加工和储存过程中,肌原纤维蛋白(mp)的凝胶形成能力容易受到物理或化学因素的影响,最终导致最终肌肉食品的质量恶化。其中,氧化是公认的主要因素。
3.在生肉的整个加工过程和储存过程中,肌原纤维蛋白(mp)容易受到氧化攻击,导致氨基酸侧链的修饰、肽主链的破坏以及蛋白质分子内和分子间的交联,从而破坏蛋白质分子原有的高级空间构象,损害肌原纤维蛋白(mp)的功能特性和加工肉的质量,最终造成巨大的经济损失;植物多酚的抗氧化策略已经成为一个研究热点,但已经证明植物多酚对氧化引起的肉蛋白凝胶性能劣化的影响通常是有限的。
技术实现要素:
4.针对现有技术中存在的技术问题,本发明提供了一种肌原纤维蛋白的性能提升方法,以解决现有的肌原纤维蛋白易受氧化攻击,提高肌原纤维蛋白氧化稳定性和凝胶性能的技术问题。
5.为达到上述目的,本发明采用的技术方案为:
6.本发明提供了一种肌原纤维蛋白的性能提升方法,包括以下步骤:
7.步骤1、提取肌原纤维蛋白,得到肌原纤维蛋白膏;
8.步骤2、利用缓冲液,对肌原纤维蛋白膏进行稀释,得到肌原纤维蛋白稀释液;
9.步骤3、在肌原纤维蛋白稀释液中,加入ε-聚赖氨酸,得到肌原纤维蛋白/ε-聚赖氨酸复合溶胶体系;
10.步骤4、向肌原纤维蛋白/ε-聚赖氨酸复合溶胶体系中,加入芬顿氧化体系,进行氧化反应,得到复合肌原纤维蛋白溶胶;
11.步骤5、将复合肌原纤维蛋白溶胶置于密封容器中,水浴蒸煮,冷却,得到热诱导蛋白凝胶,即为性能提升后的肌原纤维蛋白。
12.进一步的,步骤1中,提取肌原纤维蛋白,得到肌原纤维蛋白膏的过程,具体包括以下步骤:
13.步骤11、将外脊肉去除脂肪及结缔组织,切条备用;
14.步骤12、在切条后的外脊肉中加入僵直液,均浆捣碎,离心,得到沉淀物;
15.步骤13、在步骤12的沉淀物中加入nacl溶液,均浆搅拌,过滤,得到滤液;
16.步骤14,调节滤液ph至6.20-6.25,离心,得到沉淀物,所述沉淀物为肌原纤维蛋白;
17.步骤15,肌原纤维蛋白提取过程在0-4℃下进行,并在48-50h内使用。
18.进一步的,步骤2中,缓冲液采用哌嗪-1,4-二乙磺酸缓冲液;其中,哌嗪-1,4-二乙磺酸缓冲液的浓度为15mm。
19.进一步的,步骤2中,肌原纤维蛋白膏稀释液中,肌原纤维蛋白的浓度为45-50mg/ml。
20.进一步的,步骤3中,肌原纤维蛋白/ε-聚赖氨酸复合溶胶体系中ε-聚赖氨酸的质量百分数为0.005%-0.030%,肌原纤维蛋白的浓度为30-35mg/ml。
21.进一步的,步骤4中,芬顿氧化体系采用fecl3、抗坏血酸及h2o2混合得到;其中,fecl3的浓度为10-12μmol/l,抗坏血酸的浓度为100-120μmol/l,h2o2的浓度为10-11mmol/l。
22.进一步的,步骤4中,进行氧化反应的条件为:在0-4℃环境中,氧化反应8-12h。
23.进一步的,步骤4中,采用加入浓度为1-1.2mm的trolox终止氧化反应。
24.进一步的,步骤5中,水浴蒸煮条件为:以1-2℃/min的温升速度,使水浴温度从20-25℃加热至75-80℃,并在75-80℃处保温10-15min。
25.进一步的,步骤5中,冷却过程采用在冰水浴中,冷却30-40min后得到热诱导蛋白凝胶;将所述热诱导蛋白凝胶放置于0-4℃条件下,冷藏处理8-12h后备用。
26.与现有技术相比,本发明的有益效果为:
27.本发明提供了一种肌原纤维蛋白的性能提升方法,通过在肌原纤维蛋白稀释液中加入ε-聚赖氨酸,并加入芬顿氧化体系进行氧化反应,通过ε-聚赖氨酸诱导的物理化学变化降低了巯基和溶解度损失,以及氧化诱导的蛋白质交联和聚集,形成更精细、更均匀的三维网络结构,显著提高了热诱导氧化肌原纤维蛋白的凝胶强度和持水性,有效改善了肉蛋白的氧化稳定性和凝胶形成能力;有利于显著提高了热诱导氧化肌原纤维蛋白的凝胶强度和持水性,有效改善了肉蛋白的氧化稳定性和凝胶形成能力;同时,表明ε-聚赖氨酸作为食品添加剂,可增强加工肉的氧化稳定性、质构特性、营养价值和货架期。
28.进一步的,肌原纤维蛋白/ε-聚赖氨酸复合溶胶体系中ε-聚赖氨酸的质量百分数为0.005%-0.030%,肌原纤维蛋白的浓度为30-35mg/ml,巯基损失最高降低了9.72%,溶解度损失最高降低了41.9%。
附图说明
29.图1为本发明所述的肌原纤维蛋白的性能提升方法的流程图;
30.图2为对比例1-2及实施例1-4中氧化条件下,经ε-聚赖氨酸处理的肌原纤维蛋白的总巯基(sh)的柱状图;
31.图3为对比例1-2及实施例1-4中氧化条件下,经ε-聚赖氨酸处理的肌原纤维蛋白的sds-page图谱;
32.图4为对比例1-2及实施例1-4中氧化条件下,经ε-聚赖氨酸处理的肌原纤维蛋白凝胶蒸煮损失、凝胶强度和白度图;
33.图5为对比例1-2及实施例1-4中氧化条件下,经ε-聚赖氨酸处理的肌原纤维蛋白
凝胶的扫描电镜图。
具体实施方式
34.为了使本发明所解决的技术问题,技术方案及有益效果更加清楚明白,以下具体实施例,对本发明进行进一步的详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限定本发明。
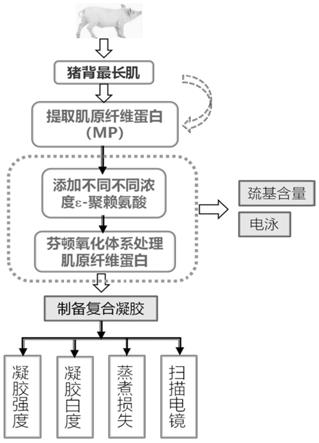
35.如附图1所示,本发明提供了一种肌原纤维蛋白的性能提升方法,包括以下步骤:
36.步骤1、在0-4℃条件下,提取肌原纤维蛋白,得到肌原纤维蛋白膏;其中,提取过程,具体包括以下步骤:
37.步骤11、切条:将猪肉外脊肉去除脂肪及结缔组织,切成条状称重备用;
38.步骤12、分离:将处理好的条状外脊肉置于组织捣碎机中,加入四倍体积的僵直液,均浆捣碎后离心,得到初次沉淀物;在初次沉淀物中加入四倍体积的僵直液,重复均浆捣碎、离心3-4次,得到沉淀物;其中,僵直液中,nacl的浓度为0.1-0.15mol/l,mgcl2的浓度为2-3mmol/l,na2hpo4的浓度为10-11mmol/l,egta的浓度为1-1.5mmol/l,ph为7.0-7.05;均浆捣碎条件为15s
×
4次;离心过程采用在0-4℃,2000g条件下,离心15-20min;
39.步骤13、过滤:在步骤12的沉淀物中加入四倍体积的nacl溶液,均浆搅拌后,经四层纱布过滤,得到滤液;采用hcl溶液,将滤液ph调节至6.20-6.25;再次离心后,得到沉淀物,沉淀物即为mp;其中,nacl溶液的浓度为0.1-0.12mol/l,hcl溶液的浓度为0.1-0.12mol/l;
40.步骤14、储存:将所得肌原纤维蛋白膏置于塑料离心杯中,并于碎冰中保存,并于48小时内使用;
41.步骤15、测定蛋白质浓度:以bsa作为标准蛋白,采用双缩脲法测定肌原纤维蛋白膏中蛋白质浓度。
42.步骤2、制备不同肌原纤维蛋白和ε-聚赖氨酸复合溶胶体系及氧化处理,具体包括以下步骤:
43.步骤21、采用哌嗪-1,4-二乙磺酸(pipes)缓冲液,对肌原纤维蛋白膏进行稀释,得到肌原纤维蛋白稀释液;其中,pipes缓冲液的浓度为15-20mmol/l,ph为6.20-6.25;pipes缓冲液中nacl的浓度为0.6-0.65mol/l;肌原纤维蛋白稀释液的浓度为40-45mg/ml;
44.步骤22、在肌原蛋白稀释液中加入ε-聚赖氨酸及芬顿氧化体系,得到蛋白氧化体系;氧化体系中肌原纤维蛋白的浓度为30-35mg/ml;其中,芬顿氧化体系中fecl3的浓度为10-12μmol/l,抗坏血酸的浓度为100-120μmol/l,h2o2的浓度为10-11mmol/l;ε-聚赖氨酸的质量百分数为0.005%-0.030%;
45.步骤23、将蛋白氧化体系置于0-4℃中,进行氧化反应,反应时间为8-12h,得到复合肌原纤维蛋白溶胶;在蛋白氧化体系中加入trolox,终止氧化反应;其中,trolox的浓度为1-1.2mmol/l。
46.步骤3、热诱导凝胶制备;具体包括以下步骤:
47.将步骤2中制备的肌原纤维蛋白溶胶放入玻璃瓶中,采用保鲜膜密封后,置于水浴锅中,水浴蒸煮,冷却,得到热诱导蛋白凝胶;其中,水浴蒸煮条件为:以1-2℃/min的温升速度,使水浴温度从20-25℃加热至75-80℃,并在75℃处保温10-15min;冷却过程,采用在冷
水浴中,冷却30-40min后,放置于0-4℃条件下冷藏处理8-12h。
48.对比例1
49.对比例1中提供了一种肌原纤维蛋白的性能提升方法,包括以下步骤:
50.步骤1、将外脊肉去除脂肪及结缔组织等,切成条状称重备用,将处理好的条状外脊肉置于组织捣碎机中,加入四倍体积的僵直液,均浆捣碎后离心,得到初次沉淀物;在初次沉淀物中加入四倍体积的僵直液,重复均浆捣碎、离心3-4次,得到沉淀物;在沉淀物中加入四倍体积的nacl溶液,均浆搅拌后,经四层纱布过滤,得到滤液,采用hcl溶液,将滤液ph调节至6.20-6.25,再次离心后,得到沉淀物;其中,沉淀物为mp,即得到肌原纤维蛋白膏;以bsa作为标准蛋白,采用双缩脲法测定肌原纤维蛋白膏中蛋白质浓度。
51.步骤2、采用pipes缓冲液,对肌原纤维蛋白膏进行稀释,得到肌原纤维蛋白稀释液,稀释液的浓度为30-35mg/ml;0-4℃储存8-12h,得到肌原纤维蛋白溶胶;在蛋白氧化体系中加入1-1.2mmol/l的trolox,以确保条件的一致性。
52.步骤3、将制备的肌原纤维蛋白溶胶放入玻璃瓶中(5-5.2g),采用保鲜膜密封后,置于水浴锅中,水浴蒸煮,冷却,得到热诱导凝胶;之后放置于0-4℃条件下冷藏处理8-12h。
53.对比例2
54.对比例2中提供了一种肌原纤维蛋白的性能提升方法,包括以下步骤:
55.步骤1、将外脊肉去除脂肪及结缔组织等,切成条状称重备用,将处理好的条状外脊肉置于组织捣碎机中,加入四倍体积的僵直液,均浆捣碎后离心,得到初次沉淀物。在初次沉淀物中加入四倍体积的僵直液,重复均浆捣碎、离心3-4次,得到沉淀物。在沉淀物中加入四倍体积的nacl溶液,均浆搅拌后,经四层纱布过滤,得到滤液,采用hcl溶液,将滤液ph调节至6.20-6.25,再次离心后,得到沉淀物;其中,沉淀物为mp,即得到肌原纤维蛋白膏;以bsa作为标准蛋白,采用双缩脲法测定肌原纤维蛋白膏中蛋白质浓度。
56.步骤2、采用pipes缓冲液,对肌原纤维蛋白膏进行稀释,得到肌原纤维蛋白稀释液,稀释液的浓度为40-45mg/ml;在肌原蛋白稀释液中,加入芬顿氧化体系,得到蛋白氧化体系;其中,芬顿氧化体系中fecl3的浓度为10-12μmol/l,抗坏血酸的浓度为100-120μmol/l,h2o2的浓度为10-11mmol/l;蛋白氧化体系中肌原纤维蛋白的浓度为30-35mg/ml;将蛋白置于氧化体系进行氧化反应,0-4℃反应8-12h,得到复合肌原纤维蛋白溶胶;在蛋白氧化体系中加入1-1.2mmol/l的trolox,终止氧化反应。
57.步骤3、将制备的肌原纤维蛋白溶胶放入玻璃瓶中(5-5.2g),采用保鲜膜密封后,置于水浴锅中,水浴蒸煮,冷却,得到热诱导凝胶;之后放置于0-4℃条件下冷藏处理8-12h。
58.实施例1
59.实施例1中提供了提供了一种肌原纤维蛋白的性能提升方法,包括以下步骤:
60.步骤1、将外脊肉去除脂肪及结缔组织等,切成条状称重备用,将处理好的条状外脊肉置于组织捣碎机中,加入四倍体积的僵直液,均浆捣碎后离心,得到初次沉淀物。在初次沉淀物中加入四倍体积的僵直液,重复均浆捣碎、离心3-4次,得到沉淀物。在沉淀物中加入四倍体积的nacl溶液,均浆搅拌后,经四层纱布过滤,得到滤液,采用hcl溶液,将滤液ph调节至6.20-6.25,再次离心后,得到沉淀物,沉淀物即为mp;其中,沉淀物为mp,即得到肌原纤维蛋白膏;以bsa作为标准蛋白,采用双缩脲法测定肌原纤维蛋白膏中蛋白质浓度。
61.步骤2、采用pipes缓冲液,对肌原纤维蛋白膏进行稀释,得到肌原纤维蛋白稀释
液,稀释液的浓度为40-45mg/ml;在肌原蛋白稀释液中加入ε-聚赖氨酸及芬顿氧化体系,得到蛋白氧化体系;其中,ε-聚赖氨酸浓度为0.005%;芬顿氧化体系中fecl3的浓度为10-12μmol/l,抗坏血酸的浓度为100-120μmol/l,h2o2的浓度为10-11mmol/l;氧化体系中肌原纤维蛋白的浓度为30-35mg/ml;将肌原纤维蛋白置于氧化体系进行氧化反应,0-4℃反应8-12h,得到复合肌原纤维蛋白溶胶;在蛋白氧化体系中加入1-1.2mmol/l的trolox,终止氧化反应。
62.步骤3、将制备的肌原纤维蛋白溶胶放入玻璃瓶中(5-5.2g),采用保鲜膜密封后,置于水浴锅中,水浴蒸煮,冷却,得到热诱导凝胶,之后放置于0-4℃条件下冷藏处理8-12h。
63.实施例2
64.实施例2中提供了一种肌原纤维蛋白的性能提升方法,包括以下步骤:
65.步骤1、将外脊肉去除脂肪及结缔组织等,切成条状称重备用,将处理好的条状外脊肉置于组织捣碎机中,加入四倍体积的僵直液,均浆捣碎后离心,得到初次沉淀物。在初次沉淀物中加入四倍体积的僵直液,重复均浆捣碎、离心3-4次,得到沉淀物。在沉淀物中加入四倍体积的nacl溶液,均浆搅拌后,经四层纱布过滤,得到滤液,采用hcl溶液,将滤液ph调节至6.20-6.25,再次离心后,得到沉淀物,沉淀物即为mp;其中,沉淀物为mp,即得到肌原纤维蛋白膏;以bsa作为标准蛋白,采用双缩脲法测定肌原纤维蛋白膏中蛋白质浓度。
66.步骤2、采用pipes缓冲液,对肌原纤维蛋白膏进行稀释,得到肌原纤维蛋白稀释液,稀释液的浓度为40-45mg/ml。在肌原蛋白稀释液中加入ε-聚赖氨酸及芬顿氧化体系,得到蛋白氧化体系;其中,ε-聚赖氨酸浓度为0.010%;芬顿氧化体系中,fecl3的浓度为10-12μmol/l,抗坏血酸的浓度为100-120μmol/l,h2o2的浓度为10-11mmol/l;蛋白氧化体系中,肌原纤维蛋白的浓度为30-35mg/ml;将肌原纤维蛋白置于氧化体系进行氧化反应,0-4℃反应8-12h,得到复合肌原纤维蛋白溶胶;在蛋白氧化体系中,加入1-1.2mmol/l的trolox,终止氧化反应。
67.步骤3、将制备的肌原纤维蛋白溶胶放入玻璃瓶中(5-5.2g),采用保鲜膜密封后,置于水浴锅中,水浴蒸煮,冷却,得到热诱导凝胶;之后,放置于0-4℃条件下冷藏处理8-12h。
68.实施例3
69.实施例3中提供了一种肌原纤维蛋白的性能提升方法,包括以下步骤:
70.步骤1、将外脊肉去除脂肪及结缔组织等,切成条状称重备用,将处理好的条状外脊肉置于组织捣碎机中,加入四倍体积的僵直液,均浆捣碎后离心,得到初次沉淀物。在初次沉淀物中加入四倍体积的僵直液,重复均浆捣碎、离心3-4次,得到沉淀物。在沉淀物中加入四倍体积的nacl溶液,均浆搅拌后,经四层纱布过滤,得到滤液,采用hcl溶液,将滤液ph调节至6.20-6.25,再次离心后,得到沉淀物,沉淀物即为mp;其中,沉淀物为mp,即得到肌原纤维蛋白膏;以bsa作为标准蛋白,采用双缩脲法测定肌原纤维蛋白膏中蛋白质浓度。
71.步骤2、采用pipes缓冲液,对肌原纤维蛋白膏进行稀释,得到肌原纤维蛋白稀释液,稀释液的浓度为40-45mg/ml。在肌原蛋白稀释液中加入ε-聚赖氨酸及芬顿氧化体系,得到蛋白氧化体系;其中,ε-聚赖氨酸浓度为0.020%;芬顿氧化体系中,fecl3的浓度为10-12μmol/l,抗坏血酸的浓度为100-120μmol/l,h2o2的浓度为10-11mmol/l);蛋白氧化体系中肌原纤维蛋白的浓度为30-35mg/ml;将肌原纤维蛋白置于氧化体系进行氧化反应,0-4℃反应
8-12h,得到复合肌原纤维蛋白溶胶;在蛋白氧化体系中加入1-1.2mmol/l的trolox,终止氧化反应。
72.步骤3、将制备的肌原纤维蛋白溶胶放入玻璃瓶中(5-5.2g),采用保鲜膜密封后,置于水浴锅中,水浴蒸煮,冷却,得到热诱导凝胶;之后放置于0-4℃条件下冷藏处理8-12h。
73.实施例4
74.实施例4中提供了一种肌原纤维蛋白的性能提升方法,包括以下步骤:
75.步骤1、将外脊肉去除脂肪及结缔组织等,切成条状称重备用,将处理好的条状外脊肉置于组织捣碎机中,加入四倍体积的僵直液,均浆捣碎后离心,得到初次沉淀物。在初次沉淀物中加入四倍体积的僵直液,重复均浆捣碎、离心3-4次,得到沉淀物。在沉淀物中加入四倍体积的nacl溶液,均浆搅拌后,经四层纱布过滤,得到滤液,采用hcl溶液,将滤液ph调节至6.20-6.25,再次离心后,得到沉淀物,沉淀物即为mp;其中,沉淀物为mp,即得到肌原纤维蛋白膏;以bsa作为标准蛋白,采用双缩脲法测定肌原纤维蛋白膏中蛋白质浓度。
76.步骤2、采用pipes缓冲液,对肌原纤维蛋白膏进行稀释,得到肌原纤维蛋白稀释液,稀释液的浓度为40-45mg/ml。在肌原蛋白稀释液中加入ε-聚赖氨酸及芬顿氧化体系,得到蛋白氧化体系;其中,ε-聚赖氨酸浓度为0.030%;芬顿氧化体系中,fecl3的浓度为10-12μmol/l,抗坏血酸的浓度为100-120μmol/l,h2o2的浓度为10-11mmol/l);蛋白氧化体系中肌原纤维蛋白的浓度为30-35mg/ml;将肌原纤维蛋白置于氧化体系进行氧化反应,0-4℃反应8-12h,得到复合肌原纤维蛋白溶胶;在蛋白氧化体系中加入1-1.2mmol/l的trolox,终止氧化反应。
77.步骤3、将制备的肌原纤维蛋白溶胶放入玻璃瓶中(5-5.2g),采用保鲜膜密封后,置于水浴锅中,水浴蒸煮,冷却,得到热诱导凝胶;之后,放置于0-4℃条件下冷藏处理8-12h。
78.实验方法
79.总巯基含量测定
80.使用15mm的pipes缓冲液,将处理后的样品稀释为蛋白浓度2mg/ml,准确吸取0.5ml于玻璃试管中;其中,pipes缓冲液中nacl的浓度为0.6m,ph为6.20-6.25;
81.先后加入2.0ml尿素-sds溶液以及0.5ml的10mmol/ldtnb试剂;
82.其中,尿素-sds溶液包括0.1mol/l的磷酸钠缓冲液、含8mol/l尿素、3%的sds,尿素-sds溶液的ph为7.4;其中,ldtnb试剂为将ldtnb溶解于0.1mol/l磷酸钠缓冲液中,ldtnb试剂的ph为7.4;
83.涡旋混匀后,室温下避光反应15min,于412nm处测定吸光度值;
84.以0.5ml磷酸钠缓冲液代替蛋白液作为试剂空白;其中,磷酸钠缓冲液的浓度为0.1mol/l,ph为7.4。
85.采用摩尔消光系数13600m-1
cm-1
计算总巯基含量;本发明附图2-5中,非氧化表示为nonox;氧化表示为ox;pl-1、pl-2、pl-3和pl-4表示为分别在氧化前添加0.005%、0.010%、0.020%和0.030%的ε-聚赖氨酸。
86.聚丙烯酰氨凝胶电泳(sds-page)
87.氧化诱导的蛋白交联和聚集分别在还原( dtt)和非还原(-dtt)条件下采用sds-page电泳分析,浓缩胶和分离胶浓度分别选用4%和12%,每孔上样量25μl;染色脱色后拍
照并对电泳条带进行分析。
88.肌原纤维蛋白凝胶性能测定
89.在测定凝胶性能之前,需要将凝胶样品在室温下平衡2h。蒸煮损失的测定:先用小铲将凝胶与小玻璃瓶壁轻轻地分开(避免瓶壁的牵引力),然后倒于滤纸上静置20min,待蒸煮汁液流尽之后称量凝胶的质量。将蒸煮损失定义如下:
[0090][0091]
凝胶强度的测定:样品凝胶强度用ta-xt plus物性分析仪进行测定。测定模式:测前速率为1mm/s;测中速率为1mm/s;测后速率为5mm/s;下压距离为8mm,探头型号为p/0.5。凝胶强度定义为刺破凝胶所需的初始压力(n)。
[0092]
凝胶白度测定:分光测色计经自检及零点、白板校正后,进行样品测定。每个样品三组平行,取平均值;凝胶白度值按下式计算:
[0093][0094]
其中,l*为亮度值;a*为红度值,a*为正值时表示偏红,a*为负值时表示偏绿;b*为黄度值,b*为正值表示偏黄,b*为负值表示偏蓝。
[0095]
扫描电镜
[0096]
将制备的肌原纤维蛋白凝胶切块,用2.5%的固定4h,其中,戊二醛溶于ph为7.4的磷酸盐缓冲液;用ph为7.4的磷酸盐缓冲液清洗一次;按照乙醇浓度为50%、70%、90%、95%和100%的梯度进行脱水,脱水时间为每次30min;叔丁醇置换30min,-80℃冷冻干燥,粘样,喷金后用扫描电镜对肌原纤维蛋白凝胶微观结构进行观察,放大倍数15000倍。
[0097]
实验结果
[0098]
总巯基含量
[0099]
半胱氨酸是mp中对氧化修饰最敏感的氨基酸之一,当它被氧化时,巯基很容易转化为二硫键和其他氧化产物;因此,总巯基含量是评估蛋白质氧化修饰程度的一个重要参数;图2所示,当暴露于
·
oh生成系统时,mp中的总巯基含量从69.2nmol/mg蛋白显著降低至60.7nmol/mg蛋白;ε-聚赖氨酸显著抑制了氧化诱导的巯基损失,且呈剂量依赖性;添加0.030%的ε-聚赖氨酸再氧化处理的mp的总巯基含量为66.6nmol/mg蛋白,比氧化对照高9.72%,表明ε-聚赖氨酸能有效抑制
·
oh诱导的蛋白质修饰;其保护作用可归因于其螯合亚铁离子和清除羟基自由基和其他自由基的能力。
[0100]
肌原纤维蛋白交联聚集情况
[0101]
使用sds-page研究了mp在
·
oh中存在或不存在ε-聚赖氨酸的交联和聚集行为;如附图3所示,与未氧化对照组相比,氧化mp显示出相对较低的肌球蛋白重链(mhc)和肌动蛋白(actin)条带强度;同时,大量聚合物聚集在堆叠凝胶的顶部。用还原剂dtt处理后,大部分生成的聚合物消失,大部分丢失的mhc和肌动蛋白恢复,表明二硫键是参与氧化诱导蛋白质交联的主要共价力;ε-聚赖氨酸的添加显著抑制了
·
oh诱导的蛋白质交联和聚集,表明ε-聚赖氨酸的存在阻止了部分巯基转化为二硫键,这也证明了ε-聚赖氨酸的加入减轻了氧化应激下mp的sh损失。
[0102]
蒸煮损失、凝胶强度和白度
[0103]
蒸煮损失与mp在加热过程中的持水能力密切相关。如图4所示,由于氧化作用,mp凝胶的蒸煮损失显著提高了122.7%;ε-聚赖氨酸的添加明显抑制了氧化诱导的蒸煮损失,且呈剂量依赖性。含0.030%的ε-聚赖氨酸的氧化mp凝胶的蒸煮损失与未氧化对照相当,这是由于高浓度ε-聚赖氨酸的添加显著抑制了蛋白质氧化。
[0104]
相应地,氧化也破坏了mp的凝胶形成;与未氧化对照组相比,受到
·
oh攻击后,凝胶强度降低36.6%。ε-聚赖氨酸的添加显著增强了由氧化mp凝胶。随着ε-聚赖氨酸浓度从0%增加到0.020%,氧化对照的凝胶强度从0.69n明显增加到0.95n。
[0105]
未氧化对照的凝胶白度为65.6,暴露于
·
oh时降低了5.6%,这种现象可能是由于氧化诱导的蛋白质变性。ε-聚赖氨酸的添加对凝胶白度几乎没有影响。
[0106]
mp凝胶的扫描电镜
[0107]
扫描电镜用于分析不同处理对mp凝胶微观结构的影响,如附图5所以;附图5中给出了对比例1-2及实施例1-4中氧化条件下,经ε-聚赖氨酸处理的肌原纤维蛋白凝胶的扫描电镜图;从附图5中可以看出,未氧化mp凝胶呈现多孔微观结构,具有均匀致密的三维网络;然而,氧化mp凝胶的微观结构极为疏松和不均匀,并带有不规则的大孔,这解释了凝胶强度降低和蒸煮损失增加,如附图4所示;ε-聚赖氨酸的添加改善了氧化mp凝胶的微观结构,当ε-聚赖氨酸的添加量为0.020%时,观察到精细、均匀和致密的微观结构,表现出最佳性能。这些结果与凝胶强度一致,如附图4所示,并证明添加0.020%ε-聚赖氨酸可有效提高氧化mp的凝胶质量。
[0108]
上述实施例仅仅是能够实现本发明技术方案的实施方式之一,本发明所要求保护的范围并不仅仅受本实施例的限制,还包括在本发明所公开的技术范围内,任何熟悉本技术领域的技术人员所容易想到的变化、替换及其他实施方式。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。