pi3k/atk信号通路激活剂在制备预防或治疗心脏疾病药物的用途、药物组合物
技术领域
1.本发明涉及生物医药工程技术领域,具体涉及pi3k/atk信号通路激活剂在制备预防或治疗心脏疾病药物的用途、药物组合物。
背景技术:
2.临床上多种心脏疾病如心肌梗死,脓毒症,心力衰竭等均可引起心肌细胞的损伤,因此在临床心脏疾病的治疗中,通过抑制或减轻心肌细胞损伤的治疗方式尤为重要,而在细胞损伤中自噬与凋亡发挥着重要作用。研究显示,抑制自噬、促进细胞凋亡,可加重缺血引起的心肌损伤。在缺血再灌注诱导的心肌损伤中,通过调控tsc2-mtor信号通路抑制自噬,抑制心肌细胞增殖,增强心肌细胞凋亡。越来越多的研究表明,自噬的“适应性”诱导可促进心肌细胞存活,具有心脏保护作用。心肌梗死、病毒性心肌炎、药物中毒引起的心肌炎等心脏疾病均会伴随炎症性心肌细胞损伤,如何通过调控炎症性心肌细胞的自噬和凋亡,抑制炎症性心肌细胞损伤,对治疗心肌梗死、病毒性心肌炎、药物中毒性心肌炎等心脏疾病发挥重要的作用
3.mirna是一类非编码短链rna,可参与细胞增殖、凋亡、分化等生理或病理过程,随着近年来mirna研究的热潮,这种内源性非编码小rna已经作为一种基因表达调节的中心因子显露。对于mirna来说,其调控方式的特点决定了它的靶基因不会只有一个,而是一对多的方式,这就使得mirna的功能研究内容非常丰富。许多研究表明,mirna对于维持心脏正常生理功能具有重要作用,心脏中的mirna异常表达与许多心脏疾病的发生相关,因此,将mirna作为心脏疾病治疗的靶点,开发相关药物具有潜在的临床应用价值。
4.尽管越来越多的mirna作为人类疾病的生物标志物及治疗靶点被发现,但在伴随有炎症性心肌损伤的心脏疾病中的关键mirna仍没有确定。
技术实现要素:
5.为了克服现有技术的缺陷,本发明的目的之一在于提供pi3k/atk信号通路激活剂在制备预防或治疗心脏疾病药物的用途,其中pi3k/atk信号通路激活剂通过过表达mirna-130a-3p,激活pi3k/akt信号通路,能够调节细胞的自噬与凋亡,减轻炎症性的心肌细胞损伤。
6.同时本发明还在于提供一种药物组合物,以过表达mirna-130a-3p,激活pi3k/akt信号通路为治疗靶点,减轻炎症性的心肌细胞损伤。
7.为了实现上述目的,本发明采用的技术方案如下:
8.pi3k/atk信号通路激活剂在制备治疗心脏疾病药物方面的用途,所述微小rna为mirna-130a-3p;所述心脏疾病为伴随有炎症性心肌损伤的心脏疾病。
9.可选的,所述pi3k/atk信号通路激活剂为mirna-130a-3p、和/或mirna-130a-3p模拟物、和/或促进mirna-130a-3p表达的活性成分。
10.一种药物组合物,其活性成分包括pi3k/atk信号通路激活剂,和/或mirna-130a-3p模拟物、和/或促进mirna-130a-3p表达的活性成分。
11.进一步的上述药物组合物还包括药学上可接受的载体或辅料。作为举例说明,药学上可接受的载体或辅料选自壳聚糖、胆固醇、脂质体、环糊精、微球和微囊。
12.本发明通过构建脂多糖lps诱导的炎症性心肌细胞损伤模型,通过过表达mirna-130a-3p、抑制pi3k/akt信号通路和正常对照组对比试验验证结果显示,与lps模型组相比较,过表达mirna-130a-3p后细胞活性升高,细胞中促凋亡蛋白bax蛋白,cleaved caspase-3蛋白显著降低,抑凋亡蛋白bcl-2蛋白的表达显著升高;自噬相关蛋白p62蛋白的表达显著降低,lc3ii/i的比率显著升高;同时,细胞培养液中tnf-α,il-6,il-1β及ldh的含量显著降低,sod的含量显著提高;
13.lps模型细胞中mirna-130a-3p mrna水平,p-pi3k蛋白与p-akt蛋白的水平显著低于正常对照组,过表达mirna-130a-3p后细胞中p-pi3k,p-akt蛋白的表达显著升高;增加pi3k/akt通路的阻断剂后,可部分逆转过表达mirna-130a-3p对lps模型细胞的作用;
14.本发明的上述试验结果表明mirna-130a-3p可部分通过激活pi3k/akt信号通路,促进细胞自噬,抑制细胞凋亡,提高细胞活性,减轻lps诱导的炎症性心肌细胞损伤。即表明mirna-130a-3p可以作为炎症性细胞损伤的治疗靶点,mirna-130a-3p、mirna-130a-3p模拟物、促进mirna-130a-3p表达的活性成可以作为pi3k/atk信号通路激活剂,通过激活pi3k/atk信号通路,减轻炎症性心肌细胞损伤,能够应用于治疗伴随有炎症性心肌损伤的心脏疾病。
附图说明
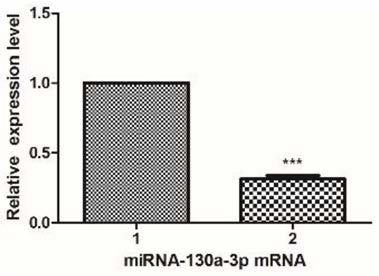
15.图1为正常对照组与模型组h9c2细胞中mirna-130a-3p mrna水平对比图;1为正常对照、2为模型组,
***
p《0.001;
16.图2为正常对照组、模型组、lps mirna阴性对照组和lps mirna-130a-3p mimics组h9c2细胞中p-pi3k蛋白表达量对比图;其中1为正常对照组、2为模型组、3为lps mirna阴性对照组、4为lps mirna-130a-3p mimics组,
#
p《0.05,
##
p《0.01
17.图3为正常对照组、模型组、lps mirna阴性对照组和lps mirna-130a-3p mimics组h9c2细胞中p-akt蛋白表达量对比图;其中1为正常对照组、2为模型组、3为lps mirna阴性对照组、4为lps mirna-130a-3p mimics组;
18.图4为利用western blot检测正常对照组、模型组、lps mirna阴性对照组、lps mirna-130a-3p mimics组、lps mirna-130a-3p mimics ly294002组h9c2细胞中bax、bcl-2、cleaved-caspase-3蛋白表达量示意图;其中1为正常对照组、2为模型组、3为lps mirna阴性对照组、4为lps mirna-130a-3p mimics组、5为mirna-130a-3pmimics ly294002组;
19.图5为正常对照组、模型组、lps mirna阴性对照组、lps mirna-130a-3p mimics组、lps mirna-130a-3p mimics ly294002组h9c2细胞中bax蛋白表达量对比图;其中1为正常对照组、2为模型组、3为lps mirna阴性对照组、4为lps mirna-130a-3pmimics组、5为mirna-130a-3p mimics ly294002组;
***
p《0.001;
##
p《0.01,
###
p《0.001;
△
p《0.05;
20.图6为正常对照组、模型组、lps mirna阴性对照组、lps mirna-130a-3p mimics组、lps mirna-130a-3p mimics ly294002组h9c2细胞中cleaved-caspase-3蛋白表达量对
比图;其中1为正常对照组、2为模型组、3为lps mirna阴性对照组、4为lps mirna-130a-3p mimics组、5为mirna-130a-3p mimics ly294002组;
***
p《0.001;
##
p《0.01,
###
p《0.001;
△
p《0.05;
21.图7为正常对照组、模型组、lps mirna阴性对照组、lps mirna-130a-3p mimics组、lps mirna-130a-3p mimics ly294002组h9c2细胞中bcl-2蛋白表达量对比图;其中1为正常对照组、2为模型组、3为lps mirna阴性对照组、4为lps mirna-130a-3pmimics组、5为mirna-130a-3p mimics ly294002组;
***
p《0.001;
##
p《0.01,
###
p《0.001;
△
p《0.05;
22.图8为利用western blot检测正常对照组、模型组、lps mirna阴性对照组、lps mirna-130a-3p mimics组、lps mirna-130a-3p mimics ly294002组h9c2细胞中lc3ⅰ、lc3ⅱ、p62蛋白表达量示意图;其中1为正常对照组、2为模型组、3为lps mirna阴性对照组、4为lps mirna-130a-3p mimics组、5为mirna-130a-3p mimics ly294002组;
23.图9为正常对照组、模型组、lps mirna阴性对照组、lps mirna-130a-3p mimics组、lps mirna-130a-3p mimics ly294002组h9c2细胞中lc3ⅱ/ⅰ蛋白表达量对比图;其中1为正常对照组、2为模型组、3为lps mirna阴性对照组、4为lps mirna-130a-3pmimics组、5为mirna-130a-3p mimics ly294002组;
***
p《0.001;
##
p《0.01,
###
p《0.001;
△
p《0.05;
24.图10为正常对照组、模型组、lps mirna阴性对照组、lps mirna-130a-3p mimics组、lps mirna-130a-3p mimics ly294002组h9c2细胞中p62蛋白表达量对比图;其中1为正常对照组、2为模型组、3为lps mirna阴性对照组、4为lps mirna-130a-3pmimics组、5为mirna-130a-3p mimics ly294002组;
***
p《0.001;
##
p《0.01,
###
p《0.001;
△
p《0.05;
25.图11为正常对照组、模型组、lps mirna阴性对照组、lps mirna-130a-3p mimics组、lps mirna-130a-3p mimics ly294002组h9c2细胞活性对比图;其中1为正常对照组、2为模型组、3为lps mirna阴性对照组、4为lps mirna-130a-3p mimics组、5为mirna-130a-3p mimics ly294002组;
***
p《0.001;
##
p《0.01,
###
p《0.001;
△
p《0.05。
具体实施方式
26.下面结合具体实施例对本发明做进一步的详细说明。除特殊说明的之外,各实施例及试验例中所用的设备和试剂均可从商业途径得到。
27.下述实施例通过构建炎症性心肌细胞损伤模型,设计实验验证mirna-130a-3p可以作为炎症性心肌细胞损伤的治疗靶点,过表达mirna-130a-3p能够减轻炎症性心肌细胞损伤。
28.下述实施例使用的实验材料包括:
29.1、实验细胞大鼠心肌细胞h9c2购自于北京协和细胞库。
30.2、主要试剂:
31.阴性对照mirna购自上海吉玛制药技术有限公司
32.mirna-130a-3p mimics购自上海吉玛制药技术有限公司
33.pi3k/atk信号通路阻断剂(ly294002)购自于碧云天生物技术有限公司;
34.sod检测试剂盒,ldh检测试剂盒,elisa检测试剂盒(tnf-α,il-6,il-1β),cck-8检测试剂盒购自于碧云天生物技术有限公司;
35.p-pi3k抗体,p-akt抗体购自于cst公司;
36.bax抗体,bcl-2抗体,cleaved-caspase-3抗体购自于abcam公司;
37.lc3抗体、p62抗体,gapdh抗体购自于武汉三鹰生物技术有限公司;
38.trizol试剂购自于invitrogen公司;
39.rt-qpcr检测试剂盒购自于北京全式金生物技术有限公司。
40.实施例1实验分组及模型构建
41.1.1细胞培养:
42.将h9c2细胞正常培养于含10%胎牛血清的dmem培养基,37℃、5%co2的恒温培养箱中恒温培养,2~3d传代1次,培养至对数生长期作为各组实验用h9c2细胞;
43.1.2实验分组:
44.正常对照组:以培养至对数生长期的h9c2细胞作为正常对照组;
45.模型组(lps组):按照上述方法培养至对数生长期后,将终浓度为10ug/ml的lps加入培养基中继续培养24h;
46.lps mirna阴性对照组:利用lipo3000将阴性对照mirna转染至培养至对数生长期的h9c2细胞,然后将终浓度为10ug/ml的lps加入培养基中继续培养24h;
47.lps mirna-130a-3p mimics组:利用lipo3000将mirna-130a-3p mimics转染至培养至对数生长期的h9c2细胞,然后将终浓度为10ug/ml的lps加入培养基中继续培养24h;
48.lps mirna-130a-3p mimics ly294002组:利用lipo3000将mirna-130a-3p mimics转染至培养至对数生长期的h9c2细胞,同时在培养中加入10μmol/l(终浓度)的ly294002,培养24h后,再将浓度为10μg/ml的lps加入培养基中培养24h。
49.实施例2各实验组细胞的各项性能检测
50.2.1实时荧光定量pcr(rt-qpcr)对细胞中mirna-130a-3p mrna水平的检测
51.利用trizol提取细胞中总rna,将其逆转录为cdna,以cdna为模板,应用qrt-pcr检测试剂盒进行pcr扩增反应,最后以2
-δδct
法对获取的相应数据实施相对定量分析。
52.2.2利用cck-8实验对细胞活性的检测
53.将h9c2细胞接种于96孔板中,按照实施例1实验分组所述的方法分为5组处理后,每孔加入10μl的cck-8溶液,培养箱中继续孵育2h,在酶标仪450nm处测吸光度(od值)。
54.2.3细胞培养液中sod和ldh的含量的检测
55.收集各组细胞培养液,按照试剂盒说明书操作,测定细胞培养液中超氧化物歧化酶(sod)、乳酸脱氢酶(ldh)的含量,酶标仪490nm处检测吸光度值,计算二者的含量。
56.2.4细胞培养液中炎性因子含量的测定
57.收集各组细胞的培养液上清,严格按照elisa检测试剂盒操作步骤检测培养液中细胞因子的含量(tnf-α,il-6,il-1β),酶标仪450nm处检测吸光度值,计算各组细胞培养液中细胞因子的含量。
58.2.5利用western blot检测细胞中蛋白的表达
59.收集细胞,ripa裂解液裂解细胞,提取各组细胞的总蛋白,常规电泳、转膜后,i抗孵育:p-pi3k抗体(1:1000),p-akt抗体(1:1000),bax抗体(1:500),bcl-2抗体(1:500),cleaved-caspase-3抗体(1:500),lc3抗体(1:500),p62抗体(1:500),gapdh抗体(1:1000),4℃孵育12h以上;ⅱ抗gapdh室温避光孵育2h,曝光,采集图像,image j软件分析灰度值。
60.实施例3过表达mirna-130a-3p,激活pi3k/akt信号通路,减轻炎症性心肌细胞损
伤
61.3.1结果统计
62.利用spss22.0软件对实施例2各项检测数据分析,计量资料以均数
±
标准差表示,两组间比较采用t检验,多组间显著性检验采用单因素方差分析,p《0.05表示差异具有统计学意义。
63.3.2结果分析:
64.3.2.1 h9c2细胞中mirna-130a-3p,p-pi3k,p-akt的表达情况
65.如图1所示,rt-qpcr检测结果显示,与正常对照组相比较,lps组细胞中mirna-130a-3p mrna显著降低;
66.如图2和图3所示,western blot检测结果显示,与正常对照组相比较,lps组细胞中p-pi3k,p-akt蛋白的表达显著降低。而与lps组相比较,mirna-130a-3p mimics组细胞中p-pi3k,p-akt蛋白的表达显著升高,表明过表达mirna-130a-3p可以激活pi3k/akt信号通路。
67.3.2.2过表达mirna-130a-3p对细胞凋亡相关蛋白bax、cleaved caspase-3和bcl-2表达量的影响
68.如图4~7所示,与正常对照组相比较,lps组细胞中bax、cleaved caspase-3蛋白显著升高,bcl-2蛋白显著降低;与lps组相比较,mirna-130a-3p mimics组细胞中bax、cleaved caspase-3蛋白显著降低,bcl-2蛋白显著升高;而增加ly294002(pi3k/akt信号通路抑制剂)后,可逆转过表达mirna-130a-3p对细胞凋亡相关蛋白bax、cleaved caspase-3和bcl-2表达量的调控作用,促进bax、cleaved caspase-3蛋白的表达,抑制bcl-2蛋白的表达,该结果表明,过表达mirna-130a-3p可通过激活pi3k/akt信号通路抑制细胞凋亡。
69.3.2.3过表达mirna-130a-3p对自噬相关蛋白p62、lc3表达量的影响
70.如图8~10所示,与正常对照组相比较,lps组细胞中p62蛋白显著升高,lc3ii/i的比率显著降低;与lps组相比较,mirna-130a-3p mimics组细胞中p62蛋白显著降低,lc3ii/i的比率显著升高;而增加ly294002(pi3k/akt信号通路抑制剂)后,可逆转过表达mirna-130a-3p对细胞自噬相关蛋白p62、lc3的作用,促进p62蛋白的表达,降低lc3ii/i的比率,该结果表明,过表达mirna-130a-3p可通过激活pi3k/akt信号通路促进细胞自噬。
71.3.2.4过表达mirna-130a-3p mimics对细胞活性的影响
72.如图11所示,cck-8结果显示,与正常对照组相比较,lps组细胞活性显著降低,而与lps组相比较,mirna-130a-3p mimics组细胞活性显著升高,而与mirna-130a-3p mimics组相比较,mirna-130a-3p mimics ly294002组细胞活性显著下降,该结果表明,过表达mirna-130a-3p可通过激活pi3k/akt信号通路提高细胞活性。
73.3.2.5过表达mirna-130a-3p对sod和ldh含量的影响
74.如表1所示,与正常对照组相比较,lps组细胞培养液中ldh含量显著升高,sod含量显著降低,而与lps组相比较,mirna-130a-3p mimics组细胞培养液中ldh含量显著降低,sod含量显著升高;与mirna-130a-3p mimics组相比较,mirna-130a-3p mimics ly294002组细胞培养液中ldh含量显著升高,sod含量显著降低,该结果表明,过表达mirna-130a-3p可通过激活pi3k/akt信号通路减轻心肌细胞损伤。
75.表1不同实验组细胞中sod和ldh含量
76.组别sod(u/l)ldh(u/l)1112.88
±
3.2444.65
±
4.21282.18
±
2.33
**
89.27
±
6.29
**
382.37
±
2.7988.84
±
6.03498.46
±
3.22
#
62.28
±
5.14
#
586.11
±
2.73
△
76.81
±
4.57
△
77.其中1为正常对照组、2为模型组、3为lps mirna阴性对照组、4为lps mirna-130a-3p mimics组、5为mirna-130a-3p mimics ly294002组;
***
p《0.001;
##
p《0.01,
###
p《0.001;
△
p《0.05
78.3.2.6过表达mirna-130a-3p对细胞炎症反应的影响
79.如表2所示,与正常对照组相比较,lps组细胞培养液中tnf-α,il-6,il-1β含量显著升高,而与lps组相比较,mirna-130a-3p mimics组细胞培养液中tnf-α,il-6,il-1β含量显著降低;与mirna-130a-3p mimics组相比较,mirna-130a-3p mimics ly294002组细胞培养液中tnf-α,il-6,il-1β含量显著升高,过表达mirna-130a-3p可通过激活pi3k/akt信号通路减轻心肌细胞的炎症反应。
80.表2不同实验组细胞中tnf-α,il-6和il-1β含量
81.组别tnf-α(pg/ml)il-6(pg/ml)il-1β(pg/ml)130.23
±
1.6746.52
±
3.4910.94
±
1.992147.36
±
5.81
**
233.24
±
8.37
**
134.48
±
7.23
**
3147.67
±
5.37234.44
±
8.20135.12
±
7.34484.54
±
3.62
##
103.63
±
6.88
#
54.37
±
3.26
##
5123.51
±
4.39
△
186.57
±
7.26
△
90.29
±
5.64
△
82.其中1为正常对照组、2为模型组、3为lps mirna阴性对照组、4为lps mirna-130a-3p mimics组、5为mirna-130a-3p mimics ly294002组;
***
p《0.001;
##
p《0.01,
###
p《0.001;
△
p《0.05
83.上述实施例的验证结果显示,lps模型细胞中mirna-130a-3p mrna水平,p-pi3k蛋白与p-akt蛋白的水平显著低于正常对照组,过表达mirna-130a-3p后细胞中p-pi3k,p-akt蛋白的表达显著升高,这就提示mirna-130a-3p可通过调节pi3k/akt信号通路而发挥作用。作为pi3k/akt通路的抑制剂,ly294002能有效阻断pi3k/akt的激活,增加ly294002后,可部分逆转过表达mirna-130a-3p对细胞的作用;
84.与lps模型组相比较,过表达mirna-130a-3p后细胞活性升高,细胞中促凋亡蛋白bax蛋白,cleaved caspase-3蛋白显著降低,抑凋亡蛋白bcl-2蛋白的表达显著升高;自噬相关蛋白p62蛋白的表达显著降低,lc3ii/i的比率显著升高;同时,细胞培养液中tnf-α,il-6,il-1β及ldh的含量显著降低,sod的含量显著提高;
85.上述结果表明,mirna-130a-3p可部分通过激活pi3k/akt信号通路,促进细胞自噬,抑制细胞凋亡,提高细胞活性,减少炎性因子的释放,减轻炎症性心肌细胞损伤,从而发挥心肌保护作用。表明以过表达mirna-130a-3p,激活pi3k/akt信号通路可以作为伴随有炎症性心肌损伤的心脏疾病的治疗靶点。
86.最后应说明的是:以上实施例仅用以说明本发明的技术方案,而非对其限制;尽管
参照前述实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的精神和范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。