用于预防和/或治疗非酒精性脂肪肝病的化合物(特别是ripa-56)
技术领域
1.本发明涉及化合物和包括所述化合物的组合物用于预防和/或治疗非酒精性脂肪性肝病(nafld),特别是肝脂肪变性或非酒精性脂肪性肝炎(nash) 的用途。
背景技术:
2.非酒精性脂肪性肝病(nafld)与世界范围内肥胖症的增加相伴而生,已成为最常见的慢性肝病,目前影响西方国家多达三分之一的成年人口。该实体包括肝脂肪变性和脂肪性肝炎。肝脂肪变性是肝脏中脂质的异常滞留。它反映了合成和消除甘油三酯脂肪的正常过程的损伤。与脂肪变性(其中,脂肪的细胞内储存不会驱动脂毒性或器官损伤的机制)相反,脂肪性肝炎可发展为肝硬化并最终发展为终末期肝病,因此携带了大部分与nafld相关的肝脏相关发病率和死亡率。肝脂肪变性和脂肪性肝炎之间的区别在形态学上是基于小叶或门静脉炎症和肝细胞损伤的存在来定义的,但对脂肪性肝炎中细胞损伤和死亡的机制决定因素知之甚少。
3.肝细胞死亡是所有慢性炎症性肝病进展中的关键事件。直到最近,人们才认识到两种主要的细胞死亡形式:以高度可控的方式发生的细胞凋亡和意外触发的坏死。然而,在过去几年中,很明显程序性细胞死亡不仅限于细胞凋亡,还包括其他形式的调节性细胞死亡。坏死性凋亡就是其中之一,它将外在凋亡途径的分子机制与类似于坏死的执行相结合,包括肿瘤、细胞器扩张和质膜破裂。与需要激活天冬氨酸特异性蛋白酶(称为半胱天冬酶)的细胞凋亡不同,坏死性凋亡由受体相互作用蛋白激酶(ripk)1和3以及混合谱系激酶结构域样假激酶(mlkl)的激活驱动。激活后,ripk1、ripk3和mlkl形成坏死体。与细胞凋亡(一种通常沉默的细胞死亡模式)不同,坏死性凋亡可通过释放损伤相关分子模式(damps)和激活坏死体依赖性炎症小体导致大规模炎症,这触发了pro-il-1β和pro-il-18(两种高度促炎细胞因子)的成熟。
4.先前临床前和临床研究的结果表明,通过泛半胱天冬酶抑制剂预防细胞凋亡能够减少nash中的肝损伤,尽管程度有限,这表明可能涉及其他细胞死亡模式。此外,在存在泛半胱天冬酶抑制剂的情况下,死亡受体的刺激导致坏死性凋亡的优先激活。因此,半胱天冬酶抑制可以诱导坏死性凋亡,从而实际上可能有利于nash中的持续损伤。还证明了nash患者的肝细胞中的坏死性凋亡被激活(gautheron等人,embo mol med 2014;6:1062-1074)。
5.因此,仍然真正需要有效预防或治疗nafld,特别是肝脂肪变性或nash。
6.相信本发明通过提供用于预防和/或治疗nafld的化合物和组合物满足了这种需要。
技术实现要素:
7.令人惊讶地,发明人观察到ripa-56,一种高度特异性的ripk1抑制剂,对减少肝脏的脂肪变性、炎症和纤维化具有积极作用。
8.在这方面,本发明涉及式(i)的化合物或其药学上可接受的盐或水合物,用于预防和/或治疗nafld,特别是非酒精性肝脂肪变性或nash的用途。
[0009][0010]
其中:
[0011]
r1是苯基,可选地氟化的或甲基化的,
[0012]
r2是1,1-二甲基丙基,可选地氟化的。本发明还涉及包括至少一种如上定义的化合物作为活性成分和至少一种药学上可接受的赋形剂的组合物,用于预防和/或治疗nafld,特别是非酒精性肝脂肪变性或nash的用途。
[0013]
本发明进一步涉及通过向有此需要的患者给药有效量的如上定义的化合物,来预防和/或治疗nafld,特别是非酒精性肝脂肪变性或nash的方法。
[0014]
本发明进一步涉及如上定义的化合物在制备用于预防和/或治疗nafld,特别是非酒精性肝脂肪变性或nash的药物中的用途。
[0015]
在本发明中,“药学上可接受的”意指在药物组合物的制备中有用的,通常是安全的、无毒的,并且在生物学上或其他方面都不是不合需要的,并且对于兽用和人用的药物用途都是可接受的。
[0016]
化合物的“药学上可接受的盐”意指如本文所定义的药学上可接受的,并且具有母体化合物的期望药理学活性的盐。药学上可接受的盐包括用相对无毒的酸或碱制备的活性化合物的盐。
[0017]
本发明的化合物可以以非溶剂化形式以及溶剂化形式存在,包括水合形式。通常,溶剂化形式等同于非溶剂化形式并且旨在涵盖在本发明的范围内。一般而言,所有物理形式对于本发明所关注的用途都是等效的并且旨在落入本发明的范围内。
[0018]
根据本发明,“药学上可接受的赋形剂”是指用于制造药物组合物的非药物活性添加剂,该非药物活性添加剂允许将药物活性成分制造成药物制剂或盖仑 (galenic)制剂,该药物制剂或盖仑制剂在给予药物组合物后为患者提供药物的必要生物利用度。赋形剂优选与组合物的其他成分相容,并且当将其给药至人或动物时不会产生副作用、过敏反应或其他不良反应。
[0019]
在本发明中,术语“非酒精性脂肪性肝病”或“nafld”是指过量脂肪储存在肝脏中的状态。这种脂肪堆积不是由大量饮酒引起的。在nafld的范围内,存在从简单的肝脂肪变性到非酒精性脂肪性肝炎(nash)的实体。
[0020]
在本发明中,术语“肝脂肪变性”,也称为“单纯性脂肪肝”,是指nafld 的一种形式,其中存在肝脏脂肪的异常堆积,在肥胖症、二型糖尿病或代谢综合征的其他症状的情况下这会导致并发症。
[0021]
在本发明中,术语“非酒精性脂肪性肝炎(nash)”是指脂肪变性与肝脏炎症和肝细胞损伤共存的nafld的一种形式。炎症和肝细胞损伤可导致肝脏纤维化或结疤。nash可导致肝硬化或肝癌。
[0022]
根据本发明,“治疗”是指疾病、病症或一种或多种体征和/或症状的减少或消失。
具体而言,nafld的治疗对应于肝脏中脂肪异常积累的减少或抑制,并且在nash的情况下,对应于肝脏的炎症、纤维化和/或结疤的抑制或减少。
[0023]
根据本发明,“预防”是指预防疾病、病症或一种或多种体征和/或症状的出现。具体而言,nafld的预防对应于肝脏中脂肪异常积累的预防,并且在nash 的情况下,对应于肝脏的炎症、纤维化和/或结疤的预防。
[0024]
根据本发明的预防和治疗适用于人或动物。
[0025]
在一些实施方式中,根据本发明的化合物是:
[0026][0027]
(n-苄基-n-羟基-2,2-二甲基丁酰胺或“ripa-56”)或其药学上可接受的盐或水合物。
[0028]
化合物“ripa-56”是对受体相互作用蛋白激酶1(ripk1)有选择性的且代谢稳定的抑制剂(ren等人,j med chem 2017;60(3):972-986)。
[0029]
在一些实施方式中,本发明涉及化合物ripa-56或其药学上可接受的盐或水合物,用于预防和/或治疗nafld的用途。
[0030]
在一些实施方式中,本发明涉及化合物ripa-56或其药学上可接受的盐或水合物,用于预防和/或治疗肝脂肪变性的用途。
[0031]
在一些实施方式中,本发明涉及化合物ripa-56或其药学上可接受的盐或水合物,用于预防和/或治疗nash的用途。
[0032]
在一些实施方式中,根据本发明的化合物是受体相互作用蛋白激酶1 (ripk1)的选择性抑制剂。ripk1的选择性抑制可以通过结合测定来证明。
[0033]
本发明的化合物可以通过它们有活性的任何途径以任何常规方式给药(单独给药或与其它药物联合给药)。例如,给药可以是但不限于通过肠内途径,特别是通过口服或直肠给药,或通过肠胃外途径,特别是通过注射。具体给药途径和剂量方案的选择,将由临床医生根据临床医生已知的方法调整或滴定,以获得期望的临床反应。
[0034]
根据本发明的化合物或组合物可以是允许将其给药至患者的任何形式,例如溶液、食物、饮料、丸剂、片剂、糖浆、贴剂、胶姆剂(gum)、霜剂、凝胶,乳剂(lotion)、软膏、散剂、胶囊、小瓶剂(a vial)、栓剂,等等。
[0035]
在优选的实施方式中,根据本发明的化合物或组合物是允许口服给药的形式。
[0036]
给药量取决于化合物制剂、所治疗病症的严重程度、宿主、给药途径等。通常凭经验确定并且可以在常规试验中进行调整。
[0037]
通常,根据具体应用,单位剂量制剂中活性化合物的量可以在约1至 1000mg之间变化或调整。
[0038]
在一个实施方式中,根据本发明的化合物或组合物被配制成1-1000mg,特别是50-500mg,更特别是100-300mg所述化合物的单位剂型。
[0039]
在一个实施方式中,根据本发明的化合物或组合物被配制成1、2、3、4、 5、6、7、8、9、10、20、30、40、50、60、70、80、90、100、150、200、250、 300、350、400、450、500、550、600、650、700、750、800、850、900、950或 1000mg所述化合物的单位剂型。
[0040]
在一个实施方式中,根据本发明的化合物或组合物以1-1000mg/kg,特别是 50-500mg/kg,更特别是100-300mg/kg的方案给药至患者。
[0041]
根据本发明的化合物或组合物可以每天给药一次或多次。本领域技术人员或临床医生可以容易地调整方案。
[0042]
在一个实施方式中,根据本发明的化合物或组合物每天一次、每天两次、每天三次或每天四次给药。
[0043]
在一个实施方式中,根据本发明的化合物或组合物每周一次、每周两次、每周三次或每周四次给药。
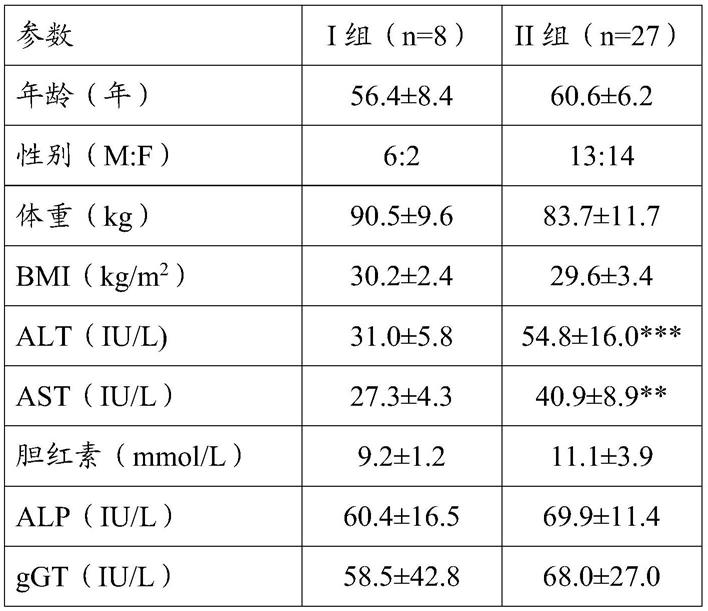
[0044]
在一个实施方式中,根据本发明的化合物或组合物在用餐期间给药,优选以食物或饮料的形式。
[0045]
在另一个方面,本发明进一步涉及ripk1和/或mlkl的血清浓度作为生物标志物以检测患者的nash的用途。
[0046]
事实上,发明人惊奇地观察到,在nash患者的血清中,蛋白质ripk1和 mlkl的浓度增加,并且与转氨酶活性相关。
[0047]
因此,本发明提供了一种有用的工具来区分nafld患者的nash与单纯性肝脂肪变性。
[0048]
因此另一方面涉及用于诊断患者的nash的体外或离体方法,包括以下步骤:
[0049]-确定所述患者的血清样品中蛋白质ripk1和/或mlkl的浓度;和
[0050]-将获得的值与参考值进行比较;
[0051]
其中,与参考值相比,患者血清样品中蛋白质ripk1和/或mlkl的浓度增加,表明nash。
[0052]
在一个实施方式中,所述患者已经被诊断为患有nafld。
[0053]
在一个实施方式中,参考值对应于健康个体的血清样品中ripk1和/或 mlkl的浓度。
[0054]
在一个实施方式中,参考值对应于nafld患者血清样品中ripk1和/或 mlkl的浓度。
[0055]
在一个实施方式中,参考值对应于单纯性肝脂肪变性患者的血清样品中 ripk1和/或mlkl的浓度。
[0056]
在一个实施方式中,蛋白质ripk1和/或mlkl的浓度通过免疫测定法确定,优选通过elisa。
[0057]
在一个实施方式中,与参考值相比,患者血清样品中蛋白质ripk1和/或 mlkl的浓度增加至少2倍表明nash。
[0058]
在一个实施方式中,与参考值相比,患者血清样品中蛋白质ripk1和/或 mlkl的浓度增加至少3倍表明nash。
[0059]
在一个实施方式中,与参考值相比,患者血清样品中蛋白质ripk1和/或 mlkl的浓度增加至少4倍表明nash。
[0060]
提出以下实施例是为了向本领域普通技术人员提供关于如何实施和使用本发明的完整公开和描述,并不旨在限制发明人认为的发明范围,也不旨在表示以下实验是全部或唯一进行的实验。尽管已经参照其特定实施方式描述了本发明,但是本领域技术人员应
该理解,在不背离本发明的真实精神和范围的情况下,可以进行各种改变和等效物替换。此外,可以进行许多修改,以使特定情况、材料、物质组成、过程、过程步骤或步骤适应本发明的目标、精神和范围。所有这些修改都旨在落入所附权利要求书的范围内。
附图说明
[0061]
图1.在半胱天冬酶抑制和tnf刺激后,ripa-56阻止了l929细胞中 ripk1依赖的细胞死亡。在有或没有tnf(50ng/ml)的情况下孵育之前,l929 细胞用ripa-56(20μm)、nec-1(20μm)或载体处理2小时,并在有或没有 tnf的情况下孵育20小时后,用mtt测定分析(a)形态和(b)细胞存活; (c)在有tnf孵育的不同时间点进行蛋白质印迹分析。结果表示为平均值
±
sem;n.s.为不显著;****p《0.0001。数据代表三次独立的实验。
[0062]
图2.ripa-56治疗改善了hfd喂养小鼠的肝脏炎症和纤维化。用正常对照饮食(ncd)或补充或不补充ripa-56的高脂肪饮食(hfd),喂养六周龄的雄性c57bl/6j小鼠(每组n=5),根据预防性治疗(“pro”)或治愈性治疗(“cur”) 设计,喂养持续16周,这是炎症和纤维化反应发展所必需的时间。通过方差分析(anova)和bonferroni的多重比较来确定小鼠之间的差异。(a)实验设计的示意图;(b)对喂食ncd(1至3)、hfd(4至6)、有ripa-56“pro”的 hfd(7至9)或有ripa-56“cur”的hfd(10至12)的小鼠的全肝蛋白提取物进行免疫印迹分析,使用针对ripk1、mlkl、ripk3的抗体,并使用gapdh 作为上样对照;(c)alt的血清分析;(d)对来自每组小鼠的代表性肝组织切片进行f4/80的免疫组织化学分析;(e)使用imagej软件,定量分析f4/80
病灶(foci),对每只小鼠的10张图片进行量化;(f)通过rt-qpcr评估f4/80、 mcp-1和tnf的mrna水平;(g)各组小鼠肝组织切片的代表性天狼星红染色;(h)光偏振天狼星红图片的量化,对每只小鼠的10张图片进行分析;(i) 通过rt-qpcr评估col1a1 mrna水平。所有数据均表示为平均值
±
sem; *p《0.05;**p《0.01;***p《0.001。比例尺表示50μm。
[0063]
图3.在hfd下,预防性和治愈性治疗的小鼠与对照小鼠相比,肝脏中 mlkl、ripk3和ripk1的mrna表达水平。通过rt-qpcr评估mlkl、ripk3 和ripk1的mrna水平,并相对于ncd喂养的小鼠来表示。组(n=5)之间的差异是通过单向方差分析和bonferroni的多重比较来确定的。结果表示为平均值
±
sem;**p《0.01;n.s.为不显著。
[0064]
图4.在hfd下,预防性治疗和治愈性治疗小鼠与对照组小鼠相比,肝脏中炎症标记物的mrna表达。通过rt-qpcr评估cd38、ccl20、nlrp3、caspase
‑ꢀ
1和il-1b的mrna水平,并相对于ncd喂养的小鼠来表示。组(n=5)间差异通过单向方差分析和bonferroni的多重比较确定。结果表示为平均值
±
sem; **p《0.01;n.s.为不显著。
[0065]
图5.ripa-56治疗改善hfd诱导的小鼠肥胖症和脂肪变性。如图2a所示,给六周龄的雄性c57bl/6j小鼠(每组n=5)喂食ncd或补充或不补充 ripa-56的hfd 16周,以分析小鼠的代谢状态。(a)4组小鼠体重增加。4组小鼠的(b)食物摄入、(c)自发运动活动或(d)呼吸交换率(rer)没有显著变化;(e)评估4组小鼠白天和夜间的整体能量消耗;(f)4组小鼠肝组织切片的代表性h&e染色。比例尺,50μm;(g)对肝组织切片的脂肪变性评分进行盲法评估;(h)在每只小鼠的两个肝脏样本中测量肝内甘油三酯含量。结果表示为平均值
±
sem;*p《0.05;**p《0.01;***p《0.001。
[0066]
图6.与hfd下的对照小鼠相比,预防性治疗和治愈性治疗小鼠的脂肪量和瘦体量。
对hfd喂养的小鼠,使用mri分析评估(a)体脂肪量和相对体脂肪含量,以及(b)瘦体量和相对瘦体含量。所有结果均表示为平均值
±
sem;每组n=5;*p《0.05。组间差异通过单向方差分析和bonferroni的多重比较来确定。
[0067]
图7.ripa-56处理诱导原代人肝细胞中的脂肪消耗。从nafld患者(n=5) 的脂肪变性人肝脏中分离原代人肝细胞(a-c),或从非脂肪变性人肝脏中分离原代人肝细胞,并与游离脂肪酸孵育以诱导脂肪变性,或者不与(w/o)游离脂肪酸孵育(n=5)(d-g),并用ripa-56(20μm)或dmso(载体)处理24 小时。(a、d)代表油红o和dapi图像;(b、e)根据dapi染色的细胞核数量,标准化(normalized)的油红o染色的量化;(c、f)根据蛋白质含量,标准化的细胞内甘油三酯的量化;(g)通过rt-qpcr评估cpt1a、mttp和 apob100的mrna水平,并相对于dmso处理的肝细胞表示。结果表示为平均值
±
sem;n.s.为不显著;*p《0.05;**p《0.01;比例尺,100μm。这些实验结果代表了五次独立的细胞制备。
[0068]
图8.使用游离脂肪酸诱导原代人肝细胞脂肪变性48小时。(a)有或没有 ffa(油酸和棕榈酸)孵育的phh的代表性图像;油红o染色(b)和细胞内甘油三酯含量(c)的量化;(d)使用mtt测定法进行细胞活力分析。结果表示为平均值
±
sem;n.s.为不显著;****p《0.0001。数据代表五次独立实验。在没有ffa和有ffa之间的差异是使用学生t检验确定的。
[0069]
图9.mlkl控制肝细胞中的肝内甘油三酯含量。(a-d)从非脂肪变性人肝脏中分离出原代人肝细胞,并与游离脂肪酸一起孵育以诱导脂肪变性,或不与(w/o)游离脂肪酸一起孵育,并用坏死磺胺(nsa)(20μm)或dmso(载体)处理24小时。(a)代表油红o和dapi图像;(b)根据dapi染色的细胞核数量,标准化的油红o染色的量化;(c)根据蛋白质含量,标准化的细胞内甘油三酯的量化。(d)通过rt-qpcr评估cpt1a、mttp和apob100的 mrna水平,并相对于dmso处理的肝细胞表示;(e-h)aml-12细胞被敲除 (ko)了mlkl,并与对照(ctl)细胞进行比较,后者经历了与ko细胞类似的crispr-cas9选择;(e)从ctl和mlkl-ko aml-12细胞中提取了全细胞裂解物,并使用针对mlkl、微管蛋白和gapdh的抗体通过蛋白质印迹法进行分析;(f)代表油红o和dapi图像;(g)油红o染色和(h)载脂细胞系中甘油三酯的量化。结果表示为平均值
±
sem;n.s.为不显著;*p《0.05; **p《0.01;***p《0.001;比例尺,100μm。这些实验代表了五次独立的细胞制备。
[0070]
图10.mlkl调节鼠肝细胞中的线粒体呼吸。aml-12细胞被敲除(ko) 了mlkl,并与对照(ctl)细胞进行比较,对照(ctl)细胞经历了与ko细胞类似的crispr-cas9选择。(a)使用mtt法分析细胞活力;使用(b)brdu 掺入和(c)实时细胞分析(xcelligencecim-plate 96)分析细胞增殖。每个细胞系接种在六个繁殖孔中;(d)使用mitotracker red-probe评估线粒体质量,重复三次;(e)通过rt-qpcr评估pgcla、cptla和acoxl的mrna水平,重复三次;(f)使用seahorse细胞外通量分析仪测定细胞的呼吸通量曲线,连续测量12次耗氧率(ocr)。每个细胞系接种在八个繁殖孔中;(g)基础线粒体 ocr、atp连接的ocr、最大ocr表示为倍数激活(fold activation)。结果表示为8次重复的平均值
±
sem;n.s.为不显著;*p《0.05;**p《0.01;***p《0.001; ****p《0.0001。使用学生t检验确定ctl和ko细胞之间的差异。所有实验都代表三次独立的细胞制备。
[0071]
图11.喂食cdaa的ripk3缺陷小鼠的线粒体生物能量增强。(a)使用针对p-mlkl、mlkl、ripk3的抗体,并使用gapdh作为上样对照,对喂食cdaa 32周的wt小鼠(1至3)和ripk3-/-小鼠(4至6)的全肝蛋白提取物进行免疫印迹分析;(b)wt与ripk3-/-小鼠(n=7)中
的柠檬酸合酶(cs)和线粒体呼吸链 (mrc)活性,小鼠被喂食cdaa 32周或66周;(c)通过rt-qpcr评估pgcla和 acoxl的mrna水平,并相对于wt小鼠(n=7)表示。所有数据均表示为平均值
±
sem;*p《0.05;**p《0.01;***p《0.001。wt和ripk3-/-小鼠之间的差异使用学生t检验来确定。
[0072]
图12.ripk1和mlkl在坏死性凋亡过程中释放到细胞外。(a-b)nafld 受试者血清中ripk1和mlkl蛋白水平的elisa分析,以及组织学活性评分 《2(n=8)或≥2(n=27);**p《0.01;(c-d)所有受试者ripk1或mlkl与alt 水平之间的相关图分析,r2值用pearson相关系数计算;(e)用泛胱天蛋白酶抑制剂zvad(20μm)、ripa-56(20μm)、necrostatin-1(nec-1,20μm)或载体 (dmso)处理2小时,然后用或不用tnfα(25ng/ml)孵育6小时,清除了 l929细胞碎片的上清液中ripkl的elisa分析。结果表示为6次重复的平均值
±
sem。
[0073]
图13.mlkl调节胰岛素信号。(a)用胰岛素(10nm)刺激15分钟的 aml-12
ctl
和aml-12
mlkl-ko
细胞中的免疫印迹分析。(b)免疫印迹胰岛素刺激细胞(n=3)的半定量分析。结果表示为平均值
±
sem;*p《0.05。使用学生t 检验确定aml-12
ctl
和aml-12
mlkl-ko
细胞之间的差异。数据代表三次独立的实验。
具体实施方式
[0074]
实施例
[0075]
材料与方法
[0076]
ripa-56喂养实验
[0077]
给六周龄的雄性c57bl/6j小鼠(查尔斯河实验室,埃库利,法国(charlesriver laboratories,ecully,france))喂食高脂肪饮食(hfd-45kcal%脂肪)或正常食物饮食(ncd)(ssniffgmbh,soest,德国)16周(炎症和纤维化反应发展所必需的时间)。如最初所述,评估高效和高度特异性的ripk1 激酶抑制剂(称为ripa-56)的作用,通过将其以300mg/kg剂量掺入hfd。
[0078]
患者
[0079]
血清样本取自35名nafld受试者(表1)。根据活性程度的组织学评分 (即肝细胞气球样变和小叶炎症的总和),研究人群分为两组。第一组包括得分 《2的受试者,第二组包括得分≥2的受试者。人体样本由生物资源中心bio-ican、心脏代谢和营养研究所(ihu-ican,anr-10-iahu-05,法国巴黎)处理和储存。所有受试者在参与研究之前都给出了书面知情同意书。
[0080]
原代人肝细胞(phh)的分离和培养
[0081]
个人保护委员会(cpp ile de france iii)和法国卫生部(n
°
:col2929和 col2930)授予了分离人肝细胞的伦理批准。从进行了部分肝切除术以治疗结肠直肠癌转移的受试者,获得肝组织。如前所述,在人类hepcell平台(ihu
‑ꢀ
ican,法国巴黎)上进行细胞分离。
[0082]
实时定量pcr(rt-qpcr)
[0083]
使用rneasy柱(qiagen,courtaboeuf,法国)提取总rna。在通过使用δδct方法根据hprt、hmbs或gapdh标准化后,计算所选基因的mrna水平。
[0084]
统计分析
[0085]
使用大小功效分析方法(graphpad statmate)计算样本量,以基于先前实验的标准偏差进行先验确定。每组的最小样本量计算为五只动物。使用相同性别和相同年龄的动物以尽量减少生理变化性。学生t检验或方差分析(anova) 分别用于比较两组和三组或更多组。graphpad prism软件(6.0版)用于计算统计显著性。如图例中所述,使用统计检验,统计显著性如下所示:*p《0.05; **p《0.01;***p《0.001;****p《0.0001;n.s.为不显著。所有数据均表示为平均值
±
sem。
[0086]
ripa-56喂养实验
[0087]
根据标准化方案,将ripa-56(medchemexpress,stockholm,瑞典)掺入由ssniffgmbh(soest,德国)提供的饮食中。ssniff公司是一家获得批准的实验动物饲料制造商,并拥有根据指令2001/82/ec为实验动物生产药用饲料的许可。在饲养期结束前,将小鼠单独关在代谢笼中一周,使用 labmaster间接量热系统(tse systems gmbh,bad homburg,德国)测量食物摄入、呼吸交换率(rer)、能量消耗和自发运动活动。在麻醉下处死小鼠并通过心内穿刺程序收集血液。组织样本要么直接在液氮中快速冷冻用于分子分析,要么固定在4%pfa中并包埋在石蜡中进行组织学分析。所有实验均在crsa 的spf动物设施(协议号c-75-12-01)中进行,根据欧洲共同体理事会关于实验程序中动物的护理和使用的指令(2010/63/ue),并遵守在《comit
éꢀ
nationalde r
é
flexion ethique sur l’experimentation animale》(法兰西岛,巴黎,n
°
5)注册的法国动物实验伦理委员会《charles darwin》的规定。所有程序均由该委员会批准(编号b751201)。
[0088]
ripk3 ko小鼠喂养实验
[0089]
7至8周龄的雄性c57bl/6野生型和ripk3-ko小鼠被喂食缺乏胆碱、氨基酸限定的饮食(cdaa;envigo,madison,usa)32周(以诱导nash)或 66周。每个实验组包括七只动物。在指定的时间点,将动物禁食4小时并用过量的co2处死,然后放血。取出肝脏并收集一瓣肝叶,在生理盐水中冲洗并立即在液氮中快速冷冻以进行进一步的分子分析。根据欧盟指令(2010/63/eu)、葡萄牙法律(dl 113/2013)和所有相关法规,所有动物实验均在当地动物伦理委员会的许可下进行。实验方案得到了葡萄牙食品和兽医总局(geraldee veterin
á
ria)的批准。动物在12小时明暗循环的温控环境中接受人道护理,符合研究所的指导方针,并如在国家科学院编制和国家卫生研究所出版的“实验室动物护理和使用指南”(nih出版物86-23,1985年修订)中所概述。
[0090]
细胞系和试剂
[0091]
l929细胞(lgc standards,莫尔斯海姆,法国)在dulbecco改良eagle培养基(dmem)(thermofisher,马萨诸塞州,usa)中培养,该dmem中补充有10%胎牛血清(eurobio,courtaboeuf,法国)、青霉素(100iu/ml)、链霉素 (0.1mg/ml)和l-谷氨酰胺(0.03%)(thermofisher)。l929细胞用zvad(#sc
‑ꢀ
3067,20μm;santa cruz biotechnologies,达拉斯,usa)、nec-1(#sc-200142, 20μm)、ripa-56(#hy-101032,20
□
m;medchemexpress,索伦蒂纳,瑞典) 和tnfα(#315-01a,20ng/ml;peprotech,塞纳河畔纳伊,法国)处理。在补充有10%胎牛血清(eurobio)、10μg/ml胰岛素、5.5μg/ml转铁蛋白、5ng/ml硒和40ng/ml地塞米松(sigma,密苏里州,usa)的dmem/f12培养基 (thermofisher)中,培养aml-12(α小鼠肝脏-12)肝细胞(lgc standards)。
[0092]
crispr/cas9介导的mlkl缺失
[0093]
pspcas9(bb)-2a-gfp(px458)用于通过cas9以及靶向引导rna(grna) 转染aml-12细胞。设计并检查了引导rna的效率和特异性。随后,将引导 rna克隆到质粒中,并根据制造商的说明,使用turbofect(thermofisher,马萨诸塞州,usa)转染试剂转染到细胞中。转染48小时后,通过流式细胞仪(细胞分选核心设施,圣安东尼研究中心)对细胞进行分选,最终将具有最高gfp 阳性的细胞作为单细胞转移到96孔板中并增殖。
[0094]
原代人肝细胞(phh)的分离和培养
[0095]
肝脏碎块最初用预热(37℃)的无钙缓冲液灌注,该缓冲液补充有5mmol/l 乙二醇四乙酸(sigma);然后用预热(37℃)的缓冲液灌注,该缓冲液含有 6mmol/l钙(cacl2)和胶原酶0.05%(5mg/ml)(sigma)。然后轻轻摇动肝脏碎块以将肝细胞分散在肝细胞洗涤培养基(life technologies,villebon-sur-yvette,法国)中。通过纱布衬里的漏斗,过滤所得到的细胞悬液。然后以低速离心细胞。去除含有受损或死亡的肝细胞、非实质细胞和碎片的上清液,并将沉淀的肝细胞(pelleted hepatocytes)重新悬浮在肝细胞洗涤培养基中。使用台盼蓝拒染法测定活细胞计数。将新鲜分离的正常(脂肪变性《5%)或脂肪变性(》10%) 肝细胞重悬于williams培养基e(life technologies)中,该培养基含有10%胎牛血清(eurobio)、青霉素(200u/ml)-链霉素(200μg/ml)、两性霉素b(2.5 μg/ml)和胰岛素(0.1u/ml)(life technologies)。将细胞分别以0.78
×
106、 0.4
×
106和0.5
×
105个活细胞/孔的密度接种在12、24和96孔板中,这些板预涂有i型胶原蛋白,并且在37℃、5%co2气氛中孵育过夜。用补充有1μmol/l 氢化可的松半琥珀酸盐(laboratoires serb,巴黎,法国)的新鲜完全肝细胞培养基,替换培养基,并将肝细胞保持在该培养基中。为了在正常肝细胞中诱导脂肪变性,phh分别用摩尔比为2:1(500:250μmol/l)的油酸和棕榈酸的游离脂肪酸(ffa)混合物,以及1%的无脂肪酸的bsa,孵育48小时。
[0096]
蛋白质印迹
[0097]
使用组织研磨杵(kimble,rockwood,usa)或使用珠磨均质器12(omniinternational,georgia,usa),在np-40裂解缓冲液中,均质化组织样品以获得蛋白质裂解物。通过sds-page分离来自细胞或组织匀浆的30μg蛋白质提取物,转移到聚偏二氟乙烯膜上并通过免疫印迹法进行分析。用以下抗体探测膜:抗ripk3(#nbpl-77299;novus,centennial,usa)或(#ahp1797,abdserotec,bio-rad laboratories,hercules,usa)、抗ripk1(#3493;cell signaling,马萨诸塞州,usa)、抗磷酸化mlkl小鼠(#37333;cell signaling)或(#ab 196436,abcam,cambridge,uk)、抗磷酸化akt ser473(#4060;cell signaling)、抗akt(#4691;cell signaling);抗gapdh(#97166;cell signaling)或(#sc
‑ꢀ
23233,santa cruz biotechnology);抗mlkl(#abl72868;abeam)或(#sab1302339,sigma)和抗微管蛋白(#66031-1-lg;proteintech,伊利诺斯州,usa)。所有一抗,均以1:2000的稀释度使用。作为二抗,使用抗兔辣根过氧化物酶 (hrp)(#na934v;ge healthcare,芝加哥,usa)和抗小鼠hrp(#na931v; ge healthcare)。所有二抗,均以1:10000的稀释度使用。
[0098]
实时定量pcr(rt-qpcr)
[0099]
使用trizol试剂(thermofisher)和rneasymini试剂盒(qiagen,courtaboeuf,法国)从肝组织中纯化总rna。rna的数量和质量使用超微量分光光度计 (nanodrop)(thermofisher)进行光谱测定。根据制造商的方案,使用m-mlv 逆转录酶试剂盒
(thermofisher),使用总rna(2μg)合成cdna。在罗氏仪器lightcycler 96上,使用sybr green reagent(roche diagnostics,meylan,法国)和特异性引物,使用cdna样品(2μl)进行rt-qpcr,总体积为10μl。所有rt-qpcr均重复进行两次。使用lightcycler 96软件1.1.0生成和分析数据。所有值均针对甘油醛-3-磷酸脱氢酶(gapdh)、羟甲基胆烷合酶(hmbs) 或次黄嘌呤鸟嘌呤磷酸核糖转移酶(hprt)的mrna水平进行了标准化。
[0100]
组织学和免疫组织化学
[0101]
石蜡切片用苏木精和伊红(h&e)、天狼星红(sr)染色,或与各种一抗和二抗孵育。福尔马林(4%)固定和石蜡包埋的肝组织切片在bond一抗稀释剂(leica biosystems,wetzlar,德国)中孵育,并使用针对3,3'-二氨基联苯胺(dab) 的bond聚合物精制检测溶液,在bond-max免疫组织化学机器人(feicabiosystems)上进行染色。抗f4/80抗体(spring bioscience,亚利桑那州,usa) 用作一抗。在nanozoomer s360切片扫描仪(hamamatsu photonics,hamamatsu,日本)上进行图像采集。h&e和sr染色由经验丰富的病理学家在不知情的情况下进行评估,并根据nas评分系统进行nafld的组织学评分系统。使用 fiji软件对染色进行密度定量(每个总组织面积中染色的面积),并标准化为总组织面积。
[0102]
线粒体呼吸测定
[0103]
mitotracker red探针用于测量线粒体质量。细胞在96孔板中培养,使用在 dmem/f12中的mitotracker(500nmol/l)(thermofisher)洗涤并使用其在37℃下孵育2小时。用荧光读板机(tecan,瑞士)在激发波长575nm/ 发射波长620nm处分析mitotracker染料的染料荧光。根据dapi荧光,对结果进行标准化。根据制造商的说明,使用seahorse xf24 cell mito应激测试试剂盒(seahorse biosciences,马萨诸塞州,usa)进行线粒体呼吸测定。简而言之,将aml-12细胞以每孔50000个细胞的优化密度接种在24孔seahorse细胞培养板中,并孵育过夜。每个细胞系接种在八个繁殖孔中(n=8)。24小时后,使用seahorse xfe24细胞外通量分析仪和xfewave软件测量每个孔的耗氧率 (ocr)。对每个孔进行了连续的ocr测量,由以下测量组成:三次基础ocr 测量、自动注射1μmol/l寡霉素后的三次ocr测量、注射1μm羰基氰对三氟甲氧基苯腙(fccp)后的三次ocr测量,以及在两次注射1μm鱼藤酮后的最后三次ocr测量。在ocr测量之后,在每个孔中评估总细胞蛋白提取物,以确保对照细胞和ko细胞之间的细胞接种是相同的。
[0104]
肝线粒体的分离和mrc酶测定
[0105]
用机械珠均质器(retsch-mm301 gmbh,verder scientific,haan,德国),均质化以每450μl缓冲液50mg肝组织的比例在分离缓冲液(225mm甘露醇、 75mm蔗糖、0.1mm edta和10mm tris-hcl ph 7.2)中的冷冻肝脏样品来制备小鼠肝脏的核后上清液。在4℃下以800g离心10分钟后,保留上清液,弃去沉淀物(pellet)。通过pierce bca蛋白质测定试剂盒(thermo scientific
tm
)测定蛋白质浓度,使用bsa作为标准,每次测定使用20μl等分试样(2μg/μl)。如下所述,对呼吸复合物i、ii、组合的ii iii、iv和柠檬酸合酶的活性进行分析。
[0106]
复合物i(nadh泛醌氧化还原酶)的比活性,由nadh氧化导致的340nm 处的nadh吸光度降低来确定。将分离的核后上清液(40μg)添加到两个1ml 比色皿中的950μl反应缓冲液(50mm磷酸钾ph 7.5、3.75mg/ml bsa、100μm 癸基泛醌)中。鱼藤酮(12.5μm)在两个比色皿之一中用作复合物i活性的抑制剂。在340nm和37℃的条件下,对空气进行初始校准,并将
比色皿在分光光度计(beckman coulter du 800)中孵育5分钟。然后在添加100μm nadh后的3分钟内每15秒测量一次nadh的氧化速率。复合物i的比活性是鱼藤酮敏感活性,该活性是通过从总nadh泛醌氧化还原酶活性中减去鱼藤酮不敏感活性来计算的。
[0107]
复合物ii(琥珀酸泛醌氧化还原酶)的比活性,通过由于2,6-二氯酚吲哚酚的还原而导致的在600nm处的吸光度降低来评估。将肝脏的核后上清液(40μg) 添加到976μl反应缓冲液(25mm磷酸钾ph 7.5、20mm琥珀酸盐、1mm kcn、 100μm atp、2mg/ml bsa、50μm 2,6-二氯酚吲哚酚钠盐)中,并在每个比色皿中在37℃下平衡5分钟。对空气进行初始校准,并在3分钟内每15秒测量一次基线。在加入4μl的25mm癸基泛醌后开始反应,保持在室温,并在37℃下3分钟内每15秒测量一次在600nm处的吸光度。
[0108]
复合物ii iii(琥珀酸细胞色素c氧化还原酶)的组合活性,通过由于细胞色素c的还原而导致的在550nm处的吸光度增加来测量。将核后上清液(40μg) 添加到880μl的反应缓冲液中(20mm琥珀酸盐、20mm磷酸钾ph 7.5、100μm 细胞色素c、1mm kcn、2mg/ml bsa、100μm atp),然后在37℃下平衡5分钟。对空气进行初始校准,并在3分钟内每15秒在550nm处测量一次基线。在加入100μl的1mm细胞色素c后开始反应,保持在室温下,在37℃下3分钟内每20秒测量一次在550nm处的吸光度。
[0109]
复合物iv(细胞色素c氧化酶)的比活性是通过由于还原的细胞色素c的氧化而导致的在550nm处吸光度的降低来测量的。使用在50mm磷酸钾ph 7.0 中的100μm还原的细胞色素c,制备初始细胞色素c溶液。使用初始细胞色素 c溶液,在1ml比色皿中,分别用少量铁氰化钾和连二亚硫酸钠,制备100%氧化的和还原的细胞色素c溶液。在对空气获得空白后,在550nm处测量100%氧化溶液的吸光度,然后在用100%氧化溶液重新空白后测量100%还原溶液。将100%还原溶液的等分试样,逐渐添加到初始细胞色素c溶液中,直到达到还原溶液吸光度的90-95%的吸光度。然后,将980μl还原的细胞色素c初始溶液,在1ml比色皿中于37℃下孵育5分钟。初始校准是对空气进行的。通过添加核后上清液(40μg)开始反应,并在37℃下在3分钟内每10秒在550nm处测量一次吸光度。
[0110]
柠檬酸合酶(cs)的活性通过硫代硝基苯甲酸阴离子形成的改变来评估。将肝脏核后上清液(40μg)添加到930μl反应缓冲液(100mm tris/hcl ph 8.1、 100μm 5,5'-二硫代双-2-硝基苯甲酸酯、300μm乙酰辅酶a、500μm草酰乙酸和 0.1%triton x100)中。然后在37℃下在4分钟内每20秒在412nm处测量一次吸光度。
[0111]
所有测量的活性均表示为nmol/min/mg蛋白质。
[0112]
细胞增殖测定
[0113]
将aml-12细胞(每孔5000个)接种在96孔板中,并在37℃下在补充有 10%胎牛血清(eurobio)的dmem/f12培养基(thermofisher)中孵育过夜。根据制造商的说明,在接种后0、2、4、8、12和24小时,通过brdu比色elisa 测定(roche diagnostics,meylan,法国)或xcelligence实时细胞分析测量细胞增殖。
[0114]
细胞活力测定
[0115]
通过使用3-(4,5-二甲基噻唑-2-基)-5-(3-羧基甲氧基-苯基)-2-(4-磺基苯基)
‑ꢀ
2h-四唑(mtt)比色法(thermofisher)测定细胞活力,该比色法测量细胞代谢活动。它基于烟酰胺腺嘌呤二核苷酸磷酸(nadph)将mtt还原为其不溶性甲臜最终产物(呈紫色)的能力。将细胞与0.5mg/ml的mtt试剂 (thermofisher)一起孵育2小时。一旦mtt晶体在光学显微镜
下生成并被控制,将它们溶解在dmso中,并通过测量540nm处的吸光度来进行量化。
[0116]
油红o染色、图像处理,和量化
[0117]
细胞内脂质通过油红o(sigma)染色。用磷酸盐缓冲盐水(pbs)洗涤细胞,并用4%多聚甲醛的pbs溶液固定10分钟。固定的细胞在室温下用油红o 溶液孵育30分钟,然后用4',6-二脒基-2-苯基吲哚(dapi)(life technologies) 孵育5分钟。荧光图像用ix83 olympus显微镜观察,用cell-sens v1.6采集,并用fiji软件分析。使用mcherry滤光片,通过荧光显微镜,观察每种条件下 8-10个不同区域的图像,然后使用fiji软件进行计算机图像分析。简而言之,通过把8位红-绿-蓝图像阈值转换为二进制图像进行分析,该图像仅由代表脂滴的像素组成。对于每组实验,定义了脂滴信号的颜色饱和度的一个阈值,即红色像素。重要的是,分离后,手动将二进制图像与原始图像进行比较,以确保一致性和正确的二进制转换。图像中脂滴占据的区域由fiji软件显示为以μm2计的表面积,并通过dapi染色细胞核的半自动计数将其标准化为细胞数。部分的放大视图由白色方块表示。
[0118]
细胞内甘油三酯含量的量化
[0119]
使用己烷/异丙醇(3:2)从原代人肝细胞中提取细胞内脂质。洗涤细胞,用每孔500μl(在12孔培养板中)的己烷/异丙醇(3:2,体积/体积)在振荡器(80 rpm/分钟)中室温孵育60分钟。然后将所有孔的内容物转移到玻璃管中,用氮气蒸发有机溶剂。蒸发后,将脂质重新悬浮在异丙醇中,并转移到一式两份的 96孔板中,以备干燥后进行分析。根据制造商的说明,使用infinitytm甘油三酯试剂盒(thermofisher)测量甘油三酯。使用tecan酶标仪(tecan)测量每个孔的吸光度,并根据标准曲线转换为浓度。将结果标准化为细胞蛋白质含量。
[0120]
使用tissue-lyser匀浆器(qiagen)将肝组织(20-30mg)在1ml pbs中匀浆三个循环,每个循环30秒。将匀浆转移到透明玻璃管(labelians group, nemours,法国)中。将匀浆与5ml氯仿和甲醇(2:1,体积/体积)混合。将混合物剧烈涡旋,并在冰上孵育15分钟以允许分离成两相。通过在4℃下以1650g 离心10分钟,将脂质提取物浓缩在底部相。在氮气下蒸发有机溶剂相的等分试样。将肝组织的脂质提取物溶解在200μl含1%triton x-100的异丙醇中。对于测定本身,将10μl甘油三酯标准品或肝脂质提取物添加到96孔板中,将200μl 的infinitytm甘油三酯试剂(thermofisher)添加到微孔板中。通过bca测定试剂盒(thermofisher)测定裂解物中的蛋白质浓度。使用tecan酶标仪测量吸光度。将肝甘油三酯水平标准化为蛋白质含量。
[0121]
elisa分析
[0122]
根据制造商的说明,通过elisa试剂盒测定人ripk1(see640hu;could
‑ꢀ
clone corp.,得克萨斯州,usa)、人mlkl(ser645hu;could-clone corp.) 和鼠ripk1(csb-el019735mo;cusabio,得克萨斯州,usa)的蛋白质浓度。
[0123]
实施例1-ripk1抑制剂减少hfd喂养小鼠的坏死性炎症和纤维化nash 特征
[0124]
ripa-56是一种高效、选择性和代谢稳定的ripk1抑制剂,能够防止mlkl 活化和mlkl介导的细胞死亡,正如本文使用完善的tnfα诱导的细胞死亡的细胞模型(即l929细胞)证实的那样(图1a-c)。为了探索ripk1抑制在nash 中的治疗潜力,ripa-56在hfd小鼠模型中进行了测试。给六周龄的雄性 c57bl/6j小鼠喂食ncd或hfd16周。hfd喂养的小鼠没有接受额外的治疗或ripa-56,ripa-56从hfd喂养开始时给予或hfd喂养12周后给予,分别模拟
56处理的脂肪变形肝细胞经历了细胞内脂滴(图7a-b)和甘油三酯含量(图7c)的显著减少。为了深入了解潜在机制,还使用了原代人肝细胞,其中通过用游离脂肪酸混合物(油酸和棕榈酸,摩尔比为2:1)孵育48小时来诱导脂肪变性。在不影响细胞活力的情况下,游离脂肪酸诱导的脂滴在48小时内增加了大约2到3倍(图8a-d)。类似于从脂肪变形肝分离出的肝细胞,在体外诱导脂肪变性的原代人肝细胞,响应于ripa
‑ꢀ
56经历了细胞内脂滴(图7d-e)和甘油三酯含量(图7f)的显著降低。这与 cpt1a、apob100和mttp表达的上调同时存在,表明增加的脂肪酸β-氧化和 /或甘油三酯输出有助于ripa-56的抗脂肪变性作用(图7g)。
[0132]
实施例4-ripk1的下游靶标mlkl调节肝细胞中的甘油三酯含量
[0133]
mlkl是ripk1的下游靶标,其磷酸化和活化在数小时内被ripa-56抑制 (图1)。此外,经过数周的ripa-56治疗后,喂食hfd的小鼠肝脏中mlkl 的表达下调(图2b和图3)。因此,假设mlkl抑制可能是ripa-56在脂肪变性肝细胞中诱导的脂肪消耗的原因,并测试了坏死磺胺(人mlkl的特异性抑制剂)是否减少了人脂肪变性肝细胞中的细胞脂肪。图9示出坏死磺胺显著降低细胞内脂滴(图9a-b)和甘油三酯含量(图9c),并上调cpt1a表达(图 9d)。还确定了mlkl消融是否会重现在暴露于坏死性磺胺的肝细胞中看到的脱脂效果。使用crispr-cas9敲除(ko)mlkl的永生化鼠肝细胞(aml-12 细胞系),其中脂肪酸代谢与原代肝细胞的代谢非常相似。通过蛋白质印迹分析证实了有效的ko(图9e)。在用游离脂肪酸孵育48小时后,mlkl-ko细胞中的细胞内甘油三酯积累显著低于对照(图9f-h)。总体而言,这些结果表明,通过抑制ripk1或最终的刽子手mlkl,或通过去除mlkl,来破坏坏死体的稳定性,足以降低肝细胞中的甘油三酯含量。因此,ripk1/mlkl轴似乎是 nafld中肝脏脂质积累的主要途径。
[0134]
实施例5-mlkl调节线粒体生物量和活性
[0135]
为了进一步了解ripk1/mlkl轴控制肝细胞中脂肪储存的机制,检查了 mlkl-ko细胞中的线粒体活性。mlkl-ko细胞表现出明显的活力增加,如通过mtt测定所评估的(图10a)。这种效果与增殖无关,增殖在ko和对照细胞之间没有差异,如brdu测定(图10b)和xcelligence实时细胞分析(图 10c)所示。mtt在代谢活跃的细胞中减少,部分是由于线粒体脱氢酶的作用。测量了线粒体质量,发现与对照相比,ko细胞有适度但显著的增加(图10d)。同样,在ko细胞中,线粒体生物发生的主要调节因子pgcla的mrna水平显著增加(图10e)。基于这些发现,预计ko细胞系中的线粒体活性会增加。测量了参与脂肪酸β氧化的基因(cptla,acoxl)的表达,发现与对照相比,它们在ko细胞中过表达(图10e)。比较这些细胞的生物能量状态并进行线粒体呼吸测试。mlkl-ko细胞具有比对照细胞显著更高的基础线粒体呼吸(图10f
‑ꢀ
g)。为了区分用于atp合成的耗氧量与通过线粒体内膜的自然质子泄漏导致的耗氧量,添加了atp合酶抑制剂寡霉素,结果表明ko细胞中atp相关的呼吸作用增加(图10f-g)。添加促进剂离子载体fccp(这导致快速消耗氧气而不产生atp)表明ko细胞的最大呼吸率明显高于对照细胞(图10f-g)。最后,评估了与wt小鼠相比,患有由胆碱缺乏、氨基酸限定(cdaa)饮食诱导的 nash的ripk3-ko小鼠是否也显示出改善的线粒体生物能量(图11a-c)。首先,发现与喂食相同饮食的wt小鼠相比,ripk3-ko小鼠的磷酸化mlkl(p
‑ꢀ
mlkl)水平显著降低(图11a)。随着mlkl降低的激活,肝线粒体中柠檬酸合酶(cs)和线粒体呼吸链(mrc)复合物,特别是复合物ii iii的活性,在 ripk3-ko小鼠中显著增强(图11b),与wt小鼠相比。wt和ko小鼠之间的这些差异在较长的喂养期后甚至更加显著(图11b)。同样,在32
周时,与 wt小鼠相比,ripk3-ko小鼠中pgcla和acoxl的mrna水平均显著增加(图 11c)。总的来说,这些结果表明通过调节线粒体呼吸激活mlkl的新功能。
[0136]
实施例6-ripk1和mlkl在nash患者的血清中增加
[0137]
先前发现,在脓毒症引起的组织损伤患者中,介导坏死性凋亡的蛋白质的血清浓度升高,这增加了nafld患者也可能由于坏死性炎症活动而发生这种情况的可能性。在35名nafld患者中测定了ripk1和mlkl蛋白的血清浓度,发现它们在活性疾病患者的血清中浓度显著升高(组织学活性评分≥2vs.《2) (表1和图12a-b)。两种蛋白质的血清浓度与alt呈正相关(图12c-d)。为了证实坏死性凋亡的介质,在坏死性凋亡过程中,可能释放在细胞外环境中,测试了暴露于tnfα的l929细胞,是否在其上清液中释放了ripk1。发现在暴露于tnfα的l929细胞的上清液中释放了ripk1,特别是在存在zvad的情况下,但当坏死性凋亡被细胞的ripa-56或nec-1处理所消除时,仍然无法检测到ripk1(图12e)。总之,这些结果表明坏死性凋亡有助于nafld的发病机制,并且ripk1和mlkl释放到体循环中,反映了人nafld的坏死性炎症活动。
[0138]
[0139][0140]
表1.nafld研究人群的特征。数据表示为平均值
±
sem;**p《0.01; ***p《0.001;m,男;f,女;bmi,体重指数;aft,丙氨酸氨基转移酶;ast,天冬氨酸氨基转移酶;afp,磷酸酶碱性;ggt,γ谷氨酰转肽酶;hba1c,糖化血红蛋白;apo a,载脂蛋白a。i组:炎症评分《2的nafld患者;ii组:炎症评分≥2分的nafld患者。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。