利福昔明液体制剂
1.相关申请本技术要求2019年9月24日提交的美国临时申请号62/904,790和2020年6月26日提交的美国临时申请号63/044,447的优先权,它们中的每一篇的整个内容通过引用并入本文。
背景技术:
2.利福昔明(例如,xifaxan
®
)是一种对革兰氏阳性的和革兰氏阴性的好氧性和厌氧性细菌具有抗菌活性的口服广谱抗生素。利福昔明目前被指示用于治疗旅行性腹泻(td)、用于维持肝性脑病(he)的缓解和用于治疗肠易激综合征伴腹泻(ibs-d)。利福昔明的其它用途包括例如治疗艰难梭菌(c. difficile)感染、传染性腹泻、小肠细菌过度生长(sibo)、炎性疾病、炎性肠病(ibd)和憩室病。因为利福昔明在很大程度上不溶于水且吸收不良,因此全身作用不常见。例如,口服时小于0.5%的利福昔明被吸收到血流中。这转化为与安慰剂相当的非常有利的安全性谱。但是,利福昔明越来越溶于胆汁。这导致更高的管腔浓度和增强的对肠道细菌的抗微生物作用。还看到在小肠中的较大作用以及低微生物抗性和对结肠微生物菌群的最小影响。因此,利福昔明非常适合用于对抗与小肠相关的病症以及用于长期使用(例如,6个月或更长或在细菌抗性受到关注的情况下)。
3.但是,即使具有这些有益特性,超过90%的利福昔明几乎完全以原形药物形式从粪便中排出。此外,由于全身利用率低,利福昔明传统上被忽视用于治疗由侵入性生物引起的全身感染。患者依从性是另一个忧虑,因为低吸附会导致更大的、更频繁的定量施用。目前,利福昔明被制造为200 mg和550 mg片剂,并被批准以600 mg(用于td)或1650 mg(用于he)的日剂量施用。
4.需要改善可溶性利福昔明对胃、小肠和/或大肠的利用度的利福昔明制剂。
技术实现要素:
5.在一个实施方案中,本文描述的发明包括包含利福昔明、氢化蓖麻油和至少一种另外的增溶赋形剂的组合物。在某些实施方案中,本文描述的组合物包括低剂量利福昔明。在某些实施方案中,本文描述的组合物可以是药学上可接受的组合物。在一个实施方案中,本文描述的发明包括药学上可接受的组合物,其包含低剂量利福昔明、氢化蓖麻油和至少一种另外的增溶赋形剂。
6.在某些实施方案中,所述氢化蓖麻油可以是聚氧乙烯40氢化蓖麻油(例如,cremophor
®
rh-40)。
7.在某些实施方案中,所述氢化蓖麻油可以以在所述组合物重量的从约25%至约65%范围内的量存在。
8.在某些实施方案中,所述氢化蓖麻油可以以在所述组合物重量的从约25%至约50%范围内的量存在。
9.在某些实施方案中,所述氢化蓖麻油可以以在所述组合物重量的从约30%至约45%
范围内的量存在。
10.在某些实施方案中,所述氢化蓖麻油可以以在所述组合物重量的从约35%至约40%范围内的量存在。在某些实施方案中,所述氢化蓖麻油可以以所述组合物重量的约35%或约40%的量存在。
11.在某些实施方案中,所述氢化蓖麻油可以以在所述组合物重量的从约45%至约65%范围内的量存在。
12.在某些实施方案中,所述至少一种另外的增溶赋形剂可以是多种另外的增溶赋形剂。在某些实施方案中,所述至少一种另外的增溶赋形剂可以选自水溶性的有机溶剂、非离子型表面活性剂、不溶于水的脂质、长链甘油三酯及其组合。在某些实施方案中,所述至少一种另外的增溶赋形剂可以包含水溶性的有机溶剂、非离子型表面活性剂、不溶于水的脂质和长链甘油三酯中的一种或多种。在某些实施方案中,所述至少一种另外的增溶赋形剂可以选自聚乙二醇600、辛酸甘油酯、聚山梨酯80、蓖麻油、苯甲醇、聚乙二醇400、二乙二醇单乙基醚、单油酸甘油酯、三甘醇、己二酸二异丙酯、癸二酸二乙酯、油醇(olelyl alcohol)及其组合。在某些实施方案中,所述至少一种另外的增溶赋形剂可以包含聚乙二醇600、辛酸甘油酯、聚山梨酯80、蓖麻油、苯甲醇、聚乙二醇400、二乙二醇单乙基醚、单油酸甘油酯、三甘醇、己二酸二异丙酯、癸二酸二乙酯和油醇中的一种或多种。
13.在某些实施方案中,所述至少一种另外的增溶赋形剂可以是一种或多种另外的增溶赋形剂,其允许或以其它方式提供利福昔明在所述组合物中大于约10重量%的利福昔明饱和溶解度。在某些实施方案中,所述至少一种另外的增溶赋形剂可以是一种或多种另外的增溶赋形剂,其允许或以其它方式提供利福昔明在所述组合物中大于约14重量%的利福昔明饱和溶解度。
14.在某些实施方案中,所述至少一种另外的增溶赋形剂可以选自聚乙二醇600、辛酸甘油酯、聚山梨酯80、蓖麻油、苯甲醇、聚乙二醇400、二乙二醇单乙基醚、单油酸甘油酯、三甘醇、己二酸二异丙酯、癸二酸二乙酯、油醇、聚山梨酯20、油酸、辛酸癸酸甘油三酯、丙二醇、芝麻油、大豆油、玉米油及其组合。在某些实施方案中,所述至少一种另外的增溶赋形剂可以包含聚乙二醇600、辛酸甘油酯、聚山梨酯80、蓖麻油、苯甲醇、聚乙二醇400、二乙二醇单乙基醚、单油酸甘油酯、三甘醇、己二酸二异丙酯、癸二酸二乙酯、油醇、聚山梨酯20、油酸、辛酸癸酸甘油三酯、丙二醇、芝麻油、大豆油和玉米油中的至少一种。
15.在某些实施方案中,所述至少一种另外的增溶赋形剂可以选自蓖麻油、辛酸甘油酯、聚山梨酯80、癸二酸二乙酯、二乙二醇单乙基醚及其组合。在某些实施方案中,所述至少一种另外的增溶赋形剂可以包含蓖麻油、辛酸甘油酯、聚山梨酯80和癸二酸二乙酯中的一种或多种。
16.在某些实施方案中,所述至少一种另外的增溶赋形剂可以以在所述组合物重量的从约25%至约65%范围内的量存在。
17.在某些实施方案中,所述至少一种另外的增溶赋形剂可以以在所述组合物重量的从约30%至约65%范围内的量存在。
18.在某些实施方案中,所述至少一种另外的增溶赋形剂可以以在所述组合物重量的从约35%至约65%范围内的量存在。
19.在某些实施方案中,所述至少一种另外的增溶赋形剂可以以在所述组合物重量的
从约40%至约65%范围内的量存在。
20.在某些实施方案中,所述至少一种另外的增溶赋形剂可以以在所述组合物重量的从约45%至约65%范围内的量存在。
21.在某些实施方案中,所述至少一种另外的增溶赋形剂可以以在所述组合物重量的从约50%至约65%范围内的量存在。
22.在某些实施方案中,所述至少一种另外的增溶赋形剂可以以在所述组合物重量的从约50%至约60%范围内的量存在。
23.在某些实施方案中,所述至少一种另外的增溶赋形剂可以以在所述组合物重量的从约55%至约60%范围内的量存在。
24.在某些实施方案中,所述至少一种另外的增溶赋形剂可以以在所述组合物重量的从约55%至约65%范围内的量存在。
25.在某些实施方案中,所述至少一种另外的增溶赋形剂可以以在所述组合物重量的从约60%至约65%范围内的量存在。
26.在某些实施方案中,所述至少一种另外的增溶赋形剂可以以在所述组合物重量的从约62%至约63%范围内的量存在。
27.在某些实施方案中,所述至少一种另外的增溶赋形剂可以是至少两种另外的增溶赋形剂的组合。在某些实施方案中,所述至少一种另外的增溶赋形剂可以是至少三种另外的增溶赋形剂的组合。在某些实施方案中,所述至少一种另外的增溶赋形剂包含蓖麻油和辛酸甘油酯。在某些实施方案中,所述至少一种另外的增溶赋形剂包含蓖麻油和聚山梨酯80。在某些实施方案中,所述至少一种另外的增溶赋形剂包含辛酸甘油酯和聚山梨酯80。在某些实施方案中,所述至少一种另外的增溶赋形剂包含蓖麻油、辛酸甘油酯和聚山梨酯80。在某些实施方案中,所述至少一种另外的增溶赋形剂是蓖麻油、辛酸甘油酯和聚山梨酯80的组合。
28.在某些实施方案中,本文描述的组合物包括在所述组合物重量的从约5%至约15%范围内的量的蓖麻油;在所述组合物重量的从约5%至约15%范围内的量的辛酸甘油酯;和在所述组合物重量的从约20%至约40%范围内的量的聚山梨酯80。
29.在某些实施方案中,本文描述的组合物包括在所述组合物重量的从约5%至约15%范围内的量的蓖麻油;在所述组合物重量的从约5%至约15%范围内的量的辛酸甘油酯;和在所述组合物重量的从约20%至约40%范围内的量的聚山梨酯80。
30.在某些实施方案中,本文描述的组合物包括在所述组合物重量的从约8%至约12%范围内的量的蓖麻油;在所述组合物重量的从约10%至约14%范围内的量的辛酸甘油酯;和在所述组合物重量的从约30%至约35%范围内的量的聚山梨酯80。
31.在某些实施方案中,本文描述的组合物包括在所述组合物重量的从约10%至约20%范围内的量的蓖麻油;在所述组合物重量的从约5%至约15%范围内的量的辛酸甘油酯;和在所述组合物重量的从约20%至约40%范围内的量的聚山梨酯80。
32.在某些实施方案中,本文描述的组合物包括在所述组合物重量的从约13%至约18%范围内的量的蓖麻油;在所述组合物重量的从约10%至约14%范围内的量的辛酸甘油酯;和在所述组合物重量的从约30%至约35%范围内的量的聚山梨酯80。
33.在某些实施方案中,本文描述的组合物包括在所述组合物重量的从约5%至约15%
范围内的量的蓖麻油;在所述组合物重量的从约10%至约15%范围内的量的辛酸甘油酯;和在所述组合物重量的从约35%至约45%范围内的量的聚山梨酯80。
34.在某些实施方案中,本文描述的组合物包括在所述组合物重量的从约8%至约12%范围内的量的蓖麻油;在所述组合物重量的从约10%至约15%范围内的量的辛酸甘油酯;和在所述组合物重量的从约38%至约42%范围内的量的聚山梨酯80。
35.在某些实施方案中,所述至少一种另外的增溶赋形剂包含癸二酸二乙酯和二乙二醇单乙基醚。在某些实施方案中,所述至少一种另外的增溶赋形剂包含癸二酸二乙酯和二乙二醇单乙基醚。在某些实施方案中,所述至少一种另外的增溶赋形剂是癸二酸二乙酯和二乙二醇单乙基醚的组合。在某些实施方案中,所述至少一种另外的增溶赋形剂是癸二酸二乙酯和二乙二醇单乙基醚的组合。
36.在某些实施方案中,本文描述的组合物包括在所述组合物重量的从约20%至约35%范围内的量的癸二酸二乙酯;和在所述组合物重量的从约20%至约35%范围内的量的二乙二醇单乙基醚。在某些实施方案中,本文描述的组合物包括在所述组合物重量的从约20%至约35%范围内的量的癸二酸二乙酯;和在所述组合物重量的从约20%至约35%范围内的量的二乙二醇单乙基醚。
37.在某些实施方案中,本文描述的组合物包括在所述组合物重量的从约25%至约30%范围内的量的癸二酸二乙酯;和在所述组合物重量的从约25%至约30%范围内的量的二乙二醇单乙基醚。在某些实施方案中,本文描述的组合物包括在所述组合物重量的从约25%至约30%范围内的量的癸二酸二乙酯;和在所述组合物重量的从约25%至约30%范围内的量的二乙二醇单乙基醚。
38.在某些实施方案中,本文描述的组合物包括在所述组合物重量的从约10%至约20%范围内的量的癸二酸二乙酯;和在所述组合物重量的从约30%至约45%范围内的量的二乙二醇单乙基醚。在某些实施方案中,本文描述的组合物包括在所述组合物重量的从约10%至约20%范围内的量的癸二酸二乙酯;和在所述组合物重量的从约30%至约45%范围内的量的二乙二醇单乙基醚。
39.在某些实施方案中,本文描述的组合物包括在所述组合物重量的从约14%至约18%范围内的量的癸二酸二乙酯;和在所述组合物重量的从约36%至约40%范围内的量的二乙二醇单乙基醚。在某些实施方案中,本文描述的组合物包括在所述组合物重量的从约14%至约18%范围内的量的癸二酸二乙酯;和在所述组合物重量的从约36%至约40%范围内的量的二乙二醇单乙基醚。
40.在某些实施方案中,本文描述的组合物可以包括抗氧化剂和/或螯合剂。在某些实施方案中,本文描述的组合物可以包括选自以下的抗氧化剂和/或螯合剂:抗坏血酸棕榈酸酯、丁基化羟基茴香醚、丁基化羟基甲苯(bht)、柠檬酸、偏亚硫酸氢钾、偏亚硫酸氢钠、半胱氨酸、没食子酸丙酯、硫代硫酸钠、维生素e、3,4-二羟基苯甲酸及其组合。在某些实施方案中,本文描述的组合物可以包括抗坏血酸棕榈酸酯、丁基化羟基茴香醚、丁基化羟基甲苯(bht)、柠檬酸、偏亚硫酸氢钾、偏亚硫酸氢钠、没食子酸丙酯、硫代硫酸钠、半胱氨酸、维生素e和3,4-二羟基苯甲酸中的一种或多种。
41.在某些实施方案中,本文描述的组合物可以包括在所述组合物重量的从约0.01%至约0.1%范围内的量的抗氧化剂。
42.在某些实施方案中,本文描述的组合物可以包括bht。
43.在某些实施方案中,本文描述的组合物可以包括在所述组合物重量的从约0.01%至约0.1%范围内的量的bht。
44.在某些实施方案中,本文描述的组合物可以包括柠檬酸。
45.在某些实施方案中,本文描述的组合物可以包括在所述组合物重量的从约0.01%至约0.1%范围内的量的柠檬酸。
46.在某些实施方案中,本文描述的组合物可以包括抗坏血酸棕榈酸酯。
47.在某些实施方案中,本文描述的组合物可以包括在所述组合物重量的从约0.05%至约0.15%范围内的量的抗坏血酸棕榈酸酯。
48.在某些实施方案中,本文描述的组合物可以包括bht和柠檬酸。
49.在某些实施方案中,本文描述的组合物可以包括各自在所述组合物重量的从约0.01%至约0.1%范围内的量的bht和柠檬酸。
50.在某些实施方案中,本文描述的组合物可以包括bht、柠檬酸和抗坏血酸棕榈酸酯。
51.在某些实施方案中,本文描述的组合物可以包括各自在所述组合物重量的从约0.05%至约0.15%范围内的量的bht、柠檬酸和抗坏血酸棕榈酸酯。
52.在某些实施方案中,本文描述的组合物可以包括在所述组合物重量的从约2.5%至约15%范围内的量的利福昔明。
53.在某些实施方案中,本文描述的组合物可以包括在所述组合物重量的从约2.5%至约12%范围内的量的利福昔明。
54.在某些实施方案中,本文描述的组合物可以包括在所述组合物重量的从约5%至约10%范围内的量的利福昔明。
55.在某些实施方案中,本文描述的组合物可以包括在所述组合物重量的从约1.0%至约15%范围内的量的利福昔明。
56.在某些实施方案中,本文描述的组合物可以包括在所述组合物重量的从约1.0%至约5%范围内的量的利福昔明。
57.在某些实施方案中,本文描述的组合物可以包括小于约125 mg的量的利福昔明。在某些实施方案中,本文描述的组合物可以包括在从约10 mg至约125 mg范围内的量的利福昔明。在某些实施方案中,本文描述的组合物可以包括在从约25 mg至约125 mg范围内的量的利福昔明。在某些实施方案中,本文描述的组合物可以包括在从约25 mg至约75 mg范围内的量的利福昔明。在某些实施方案中,本文描述的组合物可以包括在从约75 mg至约125 mg范围内的量的利福昔明。在某些实施方案中,本文描述的组合物可以包括约50 mg的量的利福昔明。在某些实施方案中,本文描述的组合物可以包括约100 mg的量的利福昔明。
58.在某些实施方案中,本文描述的组合物可以包括小于约125 mg的量的利福昔明。在某些实施方案中,本文描述的组合物可以包括在从约1 mg至约50 mg范围内的量的利福昔明。在某些实施方案中,本文描述的组合物可以包括在从约1 mg至约25 mg范围内的量的利福昔明。在某些实施方案中,本文描述的组合物可以包括在从约1 mg至约10 mg范围内的量的利福昔明。在某些实施方案中,本文描述的组合物可以包括在从约1 mg至约5 mg范围内的量的利福昔明。在某些实施方案中,本文描述的组合物可以包括在从约2 mg至约5 mg
范围内的量的利福昔明。在某些实施方案中,本文描述的组合物可以包括约3 mg至约4 mg的量的利福昔明。
59.在一个实施方案中,本发明可以包括组合物,按所述组合物的重量计,所述组合物包含约10%利福昔明、约10%蓖麻油、约12%辛酸甘油酯、约33%聚山梨酯80和约35%聚氧乙烯40氢化蓖麻油。在一个实施方案中,本发明可以包括组合物,按所述组合物的重量计,所述组合物包含约10%利福昔明、约10%蓖麻油、约12%辛酸甘油酯、约33%聚山梨酯80和约35%聚氧乙烯40氢化蓖麻油。
60.在一个实施方案中,本发明可以包括组合物,按所述组合物的重量计,所述组合物包含约10%利福昔明、约35%聚氧乙烯40氢化蓖麻油、约27.5%癸二酸二乙酯和约27.5%二乙二醇单乙基醚。
61.在一个实施方案中,本发明可以包括组合物,按所述组合物的重量计,所述组合物包含约5%利福昔明、约15%蓖麻油、约12%辛酸甘油酯、约33%聚山梨酯80和约35%聚氧乙烯40氢化蓖麻油。
62.在一个实施方案中,本发明可以包括组合物,按所述组合物的重量计,所述组合物包含约10%利福昔明、约40%聚氧乙烯40氢化蓖麻油、约16.5%癸二酸二乙酯和约38.5%二乙二醇单乙基醚。
63.在一个实施方案中,本发明可以包括组合物,按所述组合物的重量计,所述组合物包含约2.5%利福昔明、约10%蓖麻油、约12%辛酸甘油酯、约40%聚山梨酯80和约35%聚氧乙烯40氢化蓖麻油。
64.在某些实施方案中,本文描述的组合物是液体组合物。在某些实施方案中,本文描述的组合物可以以软胶囊剂型配制。在某些实施方案中,本文描述的组合物可以是以软胶囊剂型配制的液体组合物。在某些实施方案中,本文描述的组合物可以以硬胶囊剂型配制。在某些实施方案中,本文描述的组合物可以是以硬胶囊剂型配制的液体组合物。在某些实施方案中,本文描述的组合物可以以明胶胶囊剂剂型配制。在某些实施方案中,本文描述的组合物可以是以明胶胶囊剂剂型配制的液体组合物。
65.在一个实施方案中,本发明包括在有此需要的受试者中治疗一种或多种疾病的方法,所述方法包括下述步骤:给所述受试者施用治疗有效量的如本文中所述的组合物。在某些实施方案中,所述一种或多种疾病可以包括肠相关的或肝功能障碍。在某些实施方案中,本发明包括在有此需要的受试者中治疗一种或多种肠相关的或肝功能障碍的方法,所述方法包括下述步骤:给所述受试者施用治疗有效量的如本文中所述的组合物。在某些实施方案中,所述一种或多种肠相关的或肝功能障碍可以选自肠易激综合征(ibs)诸如ibs-d、腹泻、微生物相关的腹泻、传染性腹泻、艰难梭菌(clostridium difficile)感染和症状、旅行性腹泻、小肠细菌过度生长(sibo)、克罗恩氏病、憩室病、胰腺炎、胰腺功能不全、肠炎、溃疡性结肠炎、抗生素相关的结肠炎、肝性脑病、胃消化不良、肝硬化、多囊性肝病、贮袋炎、腹膜炎、炎性肠病、红斑痤疮、镰刀形细胞病、幽门螺杆菌(h. pylori)感染及其组合。
附图说明
66.图1显示了与安慰剂(即,无利福昔明) 5425-67b、xifaxan 550 mg (欧巴代ii)和在wo 2018/064472 (也参见美国申请公开号2019-0224175,其整个内容通过引用并入本
文)中描述的40 mg和80 mg固体分散制剂相比,发明组合物5425-67a的溶出度结果。
67.图2显示了与安慰剂(即,无利福昔明) 5425-66b、xifaxan 550 mg (欧巴代ii)和在wo 2018/064472中描述的40 mg和80 mg固体分散制剂相比,发明组合物5425-66a的溶出度结果。
68.图3显示了与安慰剂(即,无利福昔明) 5425-68b、xifaxan 550 mg (欧巴代ii)和在wo 2018/064472中描述的40 mg和80 mg固体分散制剂相比,发明组合物5425-68a在ph 7.4的溶出度结果。
69.图4显示了与安慰剂(即,无利福昔明) 5425-68b、xifaxan 550 mg (欧巴代ii)和在wo 2018/064472中描述的40 mg和80 mg固体分散制剂相比,发明组合物5425-68a在ph 4.5的溶出度结果。
70.图5显示了与安慰剂(即,无利福昔明) 5425-68b, xifaxan 550 mg (欧巴代ii),和在wo 2018/064472中描述的40 mg和80 mg固体分散制剂相比,发明组合物5425-68a在0.1n hcl的溶出度结果。
71.图6显示了与安慰剂(即,无利福昔明) 5425-66b、xifaxan 550 mg (欧巴代ii)和在wo 2018/064472中描述的40 mg和80 mg固体分散制剂相比,发明组合物5425-70a、5425-70b和5425-70c在ph 7.4的溶出度结果。
72.图7显示了与安慰剂(即,无利福昔明) 5425-66b、xifaxan 550 mg (欧巴代ii)和在wo 2018/064472中描述的40 mg和80 mg固体分散制剂相比,发明组合物5425-70a、5425-70b和5425-70c在ph 4.5的溶出度结果。
73.图8显示了与安慰剂(即,无利福昔明) 5425-66b、xifaxan 550 mg (欧巴代ii)和在wo 2018/064472中描述的40 mg和80 mg固体分散制剂相比,发明组合物5425-70a、5425-70b和5425-70c在0.1n hcl的溶出度结果。
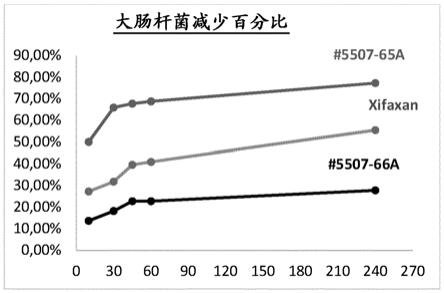
74.图9显示了与安慰剂和xifaxan 550 mg相比,在用发明制剂5507-65a处理后,大肠杆菌(e. coli)的减少百分比,作为时间(分钟)的函数。
75.图10显示了与安慰剂和xifaxan 550 mg相比,在用发明制剂5507-65a处理后,猪霍乱沙门氏菌(salmonella choleraesuis)的减少百分比,作为时间(分钟)的函数。
76.图11显示了与安慰剂和xifaxan 550 mg相比,在用发明制剂5507-65a处理后,弗氏志贺氏菌(shigella flexneri)的减少百分比,作为时间(分钟)的函数。
具体实施方式
77.除非另外定义,否则在本文中使用的所有技术和科学术语具有本发明所属领域的普通技术人员通常理解的相同的含义。
78.当本文使用范围来描述例如特定化合物或成分的量时,意图包括范围的所有组合和子组合以及在其中的具体实施方案。当提及数字或数值范围时,术语“约”的应用是指,所提及的数字或数值范围是在实验变异性内(或在统计实验误差内)的近似值,且因此所述数字或数值范围可以变化。术语“包含”(以及相关术语,诸如“含有”或“具有”或“包括”)包括这样的实施方案,例如,“由所描述的特征组成”或“基本上由所描述的特征组成”的物质、方法或过程的任何组合物的一个实施方案。
79.1. 定义“利福昔明”表示抗生素4-脱氧-4'-甲基吡啶并[1',2'-1,2]咪唑并[5,4-c]利福霉素sv,其具有在式i中所示的化学结构:(i)。
[0080]
使用利福昔明的形式、制剂和方法描述在例如美国专利号7,045,620、7,906,542、7,915,275、8,193,196、8,309,569、8,518,949、8,741,904、9,737,610中,它们的整个内容通过引用并入本文。
[0081]
术语“低剂量利福昔明”是指,利福昔明以150 mg或更低的量存在。
[0082]“增溶赋形剂”表示被包括在所公开的组合物中并且具有增溶活性药物成分(api)诸如利福昔明的能力的无活性物质。增溶赋形剂可以用于例如口服和注射剂型中。在一个方面,“增溶赋形剂”表示提供大于约10%w/w的利福昔明饱和溶解度的赋形剂。参见,例如,下面例证部分中的溶解度配制前程序。增溶赋形剂包括、但不限于ph调节剂、有机溶剂(例如,水溶性的有机溶剂)、表面活性剂(例如,非离子型表面活性剂)、脂质(例如,水溶性的脂质)、长链甘油三酯、有机液体/半固体)、环糊精和磷脂。
[0083]
术语“增溶”是指使特定化合物诸如利福昔明可溶或增加其溶解度。
[0084]
本文中使用的“抗氧化剂”表示抑制利福昔明的氧化的那些物质,例如在所公开的组合物中。
[0085]“肝性脑病”或简写的“he”定义为这样的精神状态改变:其被诊断为he并被定义为conn评分增加至≥2级(即0或1至≥2)。根据与其相关的症状的严重程度,he可以被视为“隐蔽的”或“明显的”he(分别为che或ohe)。he可以被描述为由west haven标准(whc)表示的连续体:0级
‑ꢀ
轻度肝性脑病,其症状可能包括受损的复杂性和持续性注意力;1级(che)
ꢀ‑
症状包括觉醒、欣快或焦虑的轻微缺乏,缩短的注意力持续时间,加法或减法障碍,以及改变的睡眠节律,其中临床发现包括轻微的扑翼样震颤或震颤;2级(ohe)
ꢀ‑ꢀ
症状包括嗜睡或情感淡漠、时间感消失、明显的人格改变和不当行为,其中临床发现包括明显的扑翼样震颤、运动障碍和言语不清;3级(ohe)
ꢀ‑ꢀ
症状包括昏昏欲睡至半静呆状态、对刺激有反应、意识模糊、严重定向障碍和奇怪行为,其中临床发现包括肌肉强直、阵挛和反射亢进;和4级(ohe)
ꢀ‑ꢀ
症状包括昏迷,其中临床发现包括去脑姿势。也可以在肝性脑病分级仪(hegi)上观察ohe,该仪器使用临床发现(存在至少1小时)来测量患者的定向障碍并从而测量he发作的严重程度(在2级至4级的量表上)
ꢀ‑ꢀ
4级是最严重的,且2级是最不严重的。
[0086]“食管静脉曲张破裂出血”或简写的“evb”被定义为发生临床上显著的胃肠道出血,后者被定义为1)在内窥镜检查时从食管或胃静脉曲张出血,或2)存在大静脉曲张,胃中有明显血液,且在内窥镜检查期间未观察到其它可识别的出血原因,并且存在至少一项或
多项以下标准:i)入院后前48小时内大于2 g/dl的血红蛋白下降,ii)入院24小时内需要输血2个单位的血液或更多,iii)收缩血压小于100 mm hg,或iv)在入院时脉率大于100次/分钟。
[0087]“特发性细菌性腹膜炎或简写的“sbp”被定义为大于250个多形核(pmn)细胞/mm3和/或在腹水液中的阳性单微生物培养。
[0088]“肝肾综合征”(hrs)被定义为i)血清肌酸酐的进行性升高(>1.5 mg/dl),停用利尿剂和白蛋白容积扩张至少2天后无改善,ii)无实质肾脏疾病,iii)少尿,iv)没有休克,以及v)当前或近期(在随机分组前3个月内)未接受肾毒性药物治疗。
[0089]
术语“有效量”或“治疗有效量”表示本文描述的组合物的量,该量将引起受试者的生物学或医学应答,例如,具有约0.001至约100 mg/kg体重/天的利福昔明剂量的组合物。
[0090]
本文中使用的术语”受试者”和“患者”可以互换使用,并且是指需要治疗的哺乳动物,例如,伴侣动物(例如,狗、猫等)、耕作动物(例如,牛、猪、马、绵羊、山羊等)和实验动物(例如,大鼠、小鼠、豚鼠等)。通常,受试者是需要治疗的人。
[0091]“药学上可接受的”是指,当施用于适当的动物或人时,不产生不利的、变应性的或其它不良的反应的分子实体和组合物。
[0092]
术语“治疗”表示逆转、减轻疾病或障碍或其一种或多种症状,降低其发生可能性,或抑制其进展,如本文所述。在某些实施方案中,可以在一种或多种症状已经发生之后施用治疗,即治疗性治疗。在其它实施方案中,可以在没有症状存在下施用治疗。例如,可以在症状发作之前对易感个体施用治疗(例如,考虑到症状史和/或考虑到遗传或其它易感性因素),即预防性治疗。在症状已经消退后也可以继续治疗,例如预防或延迟其复发。
[0093]
2. 组合物本文公开了与xifaxan
®
粉末相比,其中可溶性利福昔明的肠道水平显著提高的药物组合物。参见例如,表8,其中与xifaxan
®
粉末相比,表现出超过150倍的溶解度增加。如本文证实的,在ph 7.4的磷酸盐缓冲液中观察了可用的可溶性利福昔明的百分比。在肠液中也观察到使用所公开的组合物的溶解度增加。参见例如,表6a和6b。此外,探讨了抗氧化添加剂的作用,并在表7中证明。
[0094]
本文所述的溶解度结果和其它数据提示,所公开的组合物提供了用于施用较低剂量的利福昔明而不损害治疗效果的方式。这样的组合物包括,例如,包含利福昔明(例如、低剂量利福昔明)、氢化蓖麻油和至少一种另外的增溶赋形剂的药学上可接受的组合物。还提供了包含所公开的组合物中的一种或多种的制剂,和它们在治疗肠相关障碍或肝功能障碍中的用途。
[0095]
利福昔明、氢化蓖麻油和至少一种另外的增溶赋形剂在第一个实施方案中,本文提供了药学上可接受的组合物,其包含利福昔明、氢化蓖麻油和至少一种另外的增溶赋形剂。可替换地,作为第一个实施方案的一部分,所述利福昔明可以是低剂量利福昔明。
[0096]
在第二个实施方案中,在所公开的组合物(例如,如在第一个实施方案中)中的氢化蓖麻油选自聚氧乙烯8氢化蓖麻油、聚氧乙烯10氢化蓖麻油、聚氧乙烯16氢化蓖麻油、聚氧乙烯20氢化蓖麻油、聚氧乙烯25氢化蓖麻油、聚氧乙烯35氢化蓖麻油、聚氧乙烯40氢化蓖麻油(例如,cremophor
®
rh-40)、聚氧乙烯45氢化蓖麻油、聚氧乙烯50氢化蓖麻油、聚氧乙
烯54氢化蓖麻油、聚氧乙烯55氢化蓖麻油、聚氧乙烯60氢化蓖麻油、聚氧乙烯65氢化蓖麻油、聚氧乙烯80氢化蓖麻油、聚氧乙烯100氢化蓖麻油和聚氧乙烯200氢化蓖麻油及其组合。可替换地,作为第二个实施方案的一部分,在所公开的组合物(例如,如在第一个实施方案中)中的氢化蓖麻油是聚氧乙烯60氢化蓖麻油或聚氧乙烯40氢化蓖麻油。在另一个替代方案中,作为第二个实施方案的一部分,在所公开的组合物(例如,如在第一个实施方案中)中的氢化蓖麻油是聚氧乙烯40氢化蓖麻油(例如,cremophor
®
rh-40)。
[0097]
在第三个实施方案中,按所述组合物的重量计,在所公开的组合物(例如,如在第一个实施方案或第二个实施方案中)中的氢化蓖麻油以在从约25%至约65%、约25%至约60%、约25%至约55%、约25%至约50%、约30%至约45%、约35%至约40%、约30%至约40%、约31%至约39%、约32%至约38%、约33%至约37%、约34%至约36%、约40%至约50%、约41%至约49%、约42%至约48%、约43%至约47%、或约44%至约46%范围内的量存在;或以至少约25%、至少约26%、至少约27%、至少约28%、至少约29%、至少约30%、至少约31%、至少约32%、至少约33%、至少约34%、至少约35%、至少约36%、至少约37%、至少约38%、至少约39%、至少约40%、至少约41%、至少约42%、至少约43%、至少约44%、至少约45%、至少约46%、至少约47%、至少约48%、至少约49%或至少约50%的量存在;或以至多约25%、至多约26%、至多约27%、至多约28%、至多约29%、至多约30%、至多约31%、至多约32%、至多约33%、至多约34%、至多约35%、至多约36%、至多约37%、至多约38%、至多约39%、至多约40%、至多约41%、至多约42%、至多约43%、至多约44%、至多约45%、至多约46%、至多约47%、至多约48%、至多约49%或至多约50%;或约25%、约26%、约27%、约28%、约29%、约30%、约31%、约32%、约33%、约34%、约35%、约36%、约37%、约38%、约39%、约40%、约41%、约42%、约43%、约44%、约45%、约46%、约47%、约48%、约49%或约50%的量存在;或以约25%、约26%、约27%、约28%、约29%、约30%、约31%、约32%、约33%、约34%、约35%、约36%、约37%、约38%、约39%、约40%、约41%、约42%、约43%、约44%、约45%、约46%、约47%、约48%、约49%或约50%的量存在。
[0098]
在替代性的第三个实施方案中,按照所述组合物中利福昔明、氢化蓖麻油和至少一种另外的增溶赋形剂的总重量的重量比计,在所公开的组合物(例如,如在第一个实施方案或第二个实施方案中)中的氢化蓖麻油以在从约25%至约65%、约25%至约60%、约25%至约55%、约25%至约50%、约30%至约45%、约35%至约40%、约30%至约40%、约31%至约39%、约32%至约38%、约33%至约37%、约34%至约36%、约40%至约50%、约41%至约49%、约42%至约48%、约43%至约47%、或约44%至约46%范围内的量存在;或以至少约25%、至少约26%、至少约27%、至少约28%、至少约29%、至少约30%、至少约31%、至少约32%、至少约33%、至少约34%、至少约35%、至少约36%、至少约37%、至少约38%、至少约39%、至少约40%、至少约41%、至少约42%、至少约43%、至少约44%、至少约45%、至少约46%、至少约47%、至少约48%、至少约49%或至少约50%的量存在;或以至多约25%、至多约26%、至多约27%、至多约28%、至多约29%、至多约30%、至多约31%、至多约32%、至多约33%、至多约34%、至多约35%、至多约36%、至多约37%、至多约38%、至多约39%、至多约40%、至多约41%、至多约42%、至多约43%、至多约44%、至多约45%、至多约46%、至多约47%、至多约48%、至多约49%或至多约50%;或约25%、约26%、约27%、约28%、约29%、约30%、约31%、约32%、约33%、约34%、约35%、约36%、约37%、约38%、约39%、约40%、约41%、约42%、约43%、约44%、约45%、约46%、约47%、约48%、约49%或约50%的量存在;或以约25%、约26%、约27%、约28%、约29%、约30%、约31%、约32%、约33%、约34%、约35%、约36%、约37%、约38%、约
39%、约40%、约41%、约42%、约43%、约44%、约45%、约46%、约47%、约48%、约49%或约50%的量存在。
[0099]
在第四个实施方案中,在所公开的组合物(例如,如在第一至第三个实施方案中的任一个中)中的至少一种另外的增溶赋形剂选自水溶性的有机溶剂(例如,聚乙二醇(例如,peg 300、peg 400和peg 600)、乙醇、丙二醇、苯甲醇、油醇、三甘醇、正甲基-2-吡咯烷酮、二甲基乙酰胺、二甲基亚砜、二乙二醇单乙基醚(例如,transcutol
®
hp和p级)、己二酸二异丙酯和癸二酸二乙酯)、非离子型表面活性剂(例如,peg-8蓖麻油、peg-9蓖麻油、peg-10蓖麻油、peg-11蓖麻油、peg-15蓖麻油、peg-16蓖麻油、peg-20蓖麻油、peg-25蓖麻油、peg-26蓖麻油、peg-29蓖麻油、peg-40蓖麻油、peg-44蓖麻油、peg-50蓖麻油、peg-54蓖麻油、peg-55蓖麻油、peg-60蓖麻油、peg-75蓖麻油、peg-80蓖麻油、peg-100蓖麻油、peg-200蓖麻油、琥珀酸聚乙二醇1000、聚山梨酯20、聚山梨酯80、12-羟基硬脂酸的聚氧乙烯酯、脱水山梨糖醇单油酸酯、泊洛沙姆407、油酰基聚乙二醇-6/聚氧乙烯-6甘油酯、辛酸癸酸聚乙二醇-8/聚氧乙烯-8甘油酯、peg-6辛酸/癸酸甘油酯、月桂酰基聚氧乙烯-32甘油酯、以及peg 300、peg 400或peg 1750的单-和二-脂肪酸酯)、不溶于水的脂质(例如,蓖麻油、玉米油、棉籽油、橄榄油、花生油、薄荷油、红花油、芝麻油、大豆油、氢化植物油、氢化大豆油、以及椰子油和棕榈油的中链甘油三酯)、有机液体/半固体(例如,蜂蜡、d-α-生育酚、油酸和中链甘油一酯、甘油二酯和甘油三酯(例如,辛酸甘油酯、单油酸甘油酯、单亚油酸甘油酯和辛酸癸酸甘油三酯))、环糊精(例如,α-环糊精、β-环糊精和羟丙基-β-环糊精)和磷脂(例如,氢化大豆磷脂酰胆碱)。
[0100]
在第五个实施方案中,在所公开的组合物(例如,如在第一至第四个实施方案中的任一个中)中的至少一种另外的增溶赋形剂选自水溶性的有机溶剂、非离子型表面活性剂、不溶于水的脂质和长链甘油三酯、及其组合。可替换地,作为第四个实施方案的一部分,在所公开的组合物(例如,如在第一至第四个实施方案中的任一个中)中的至少一种另外的增溶赋形剂选自聚乙二醇600、辛酸甘油酯、聚山梨酯80、蓖麻油、苯甲醇、聚乙二醇400、二乙二醇单乙基醚、单油酸甘油酯、三甘醇、己二酸二异丙酯、癸二酸二乙酯、油醇、聚山梨酯20、油酸、辛酸癸酸甘油三酯、丙二醇、芝麻油、大豆油和玉米油、及其组合。
[0101]
在第六个实施方案中,在所公开的组合物(例如,如在第一至第五个实施方案中的任一个中)中的至少一种另外的增溶赋形剂是这样的增溶赋形剂:其允许大于约10%w/w (例如,大于约11%w/w、大于约12%w/w、大于约13%w/w、大于约14%w/w、大于约15%w/w、大于约16%w/w、大于约17%w/w、大于约18%w/w、大于约19%w/w或大于约20%w/w)的利福昔明饱和溶解度。可替换地,作为第六个实施方案的一部分,在所公开的组合物(例如,如在第一至第五个实施方案中的任一个中)中的至少一种另外的增溶赋形剂是这样的增溶赋形剂:其允许从约10%w/w至约25%w/w、从约12%w/w至约25%w/w、从约12%w/w至约23%w/w、从约13%w/w至约23%w/w或从约14%w/w至约22%w/w的利福昔明饱和溶解度。
[0102]
在第七个实施方案中,在所公开的组合物(例如,如在第一至第六个实施方案中的任一个中)中的至少一种另外的增溶赋形剂选自聚乙二醇600、辛酸甘油酯、聚山梨酯80、蓖麻油、苯甲醇、聚乙二醇400、二乙二醇单乙基醚、单油酸甘油酯、三甘醇、己二酸二异丙酯、癸二酸二乙酯、油醇、及其组合。可替换地,作为第七个实施方案的一部分,在所公开的组合物(例如,如在第一至第六个实施方案中的任一个中)中的至少一种另外的增溶赋形剂选自
蓖麻油、辛酸甘油酯、聚山梨酯80、癸二酸二乙酯和二乙二醇单乙基醚、及其组合。
[0103]
在第八个实施方案中,按所述组合物的重量计,在所公开的组合物(例如,如在第一至第七个实施方案中的任一个中)中的至少一种另外的增溶赋形剂以在从约25%至约70%、约25%至约65%、约30%至约65%、约35%至约65%、约40%至约65%、约40%至约70%、约45%至约65%、约46%至约65%、约47%至约65%、约48%至约65%、约49%至约65%、约50%至约65%、约45%至约60%、约46%至约60%、约47%至约60%、约48%至约60%、约49%至约60%、约50%至约60%、约51%至约60%、约52%至约60%、约53%至约60%、约54%至约60%或约55%至约60%范围内的量存在;或以至少约25%、至少约26%、至少约27%、至少约28%、至少约29%、至少约30%、至少约31%、至少约32%、至少约33%、至少约34%、至少约35%、至少约36%、至少约37%、至少约38%、至少约39%、至少约40%、至少约41%、至少约42%、至少约43%、至少约44%、至少约45%、至少约46%、至少约47%、至少约48%、至少约49%、至少约50%、至少约51%、至少约52%、至少约53%、至少约54%、至少约55%、至少约56%、至少约57%、至少约58%、至少约59%、至少约60%、至少约61%、至少约62%、至少约63%、至少约64%、至少约65%、至少约66%、至少约67%、至少约68%、至少约69%或至少约70%的量存在;或以至多约25%、至多约26%、至多约27%、至多约28%、至多约29%、至多约30%、至多约31%、至多约32%、至多约33%、至多约34%、至多约35%、至多约36%、至多约37%、至多约38%、至多约39%、至多约40%、至多约41%、至多约42%、至多约43%、至多约44%、至多约45%、至多约46%、至多约47%、至多约48%、至多约49%、至多约50%、至多约51%、至多约52%、至多约53%、至多约54%、至多约55%、至多约56%、至多约57%、至多约58%、至多约59%、至多约60%、至多约61%、至多约62%、至多约63%、至多约64%、至多约65%、至多约66%、至多约67%、至多约68%、至多约69%或至多约70%的量存在;或以约25%、约26%、约27%、约28%、约29%、约30%、约31%、约32%、约33%、约34%、约35%、约36%、约37%、约38%、约39%、约40%、约41%、约42%、约43%、约44%、约45%、约46%、约47%、约48%、约49%、约50%、约51%、约52%、约53%、约54%、约55%、约56%、约57%、约58%、约59%、约60%、约61%、约62%、约63%、约64%、约65%、约66%、约67%、约68%、约69%或约70%的量存在。可替换地,作为第八个实施方案的一部分,在所公开的组合物(例如,如在第一至第七个实施方案中的任一个中)中的至少一种另外的增溶赋形剂以在所述组合物重量的从约51%至约59%、约52%至约58%、约53%至约57%或约54%至约56%范围内的量存在。可替换地,作为第八个实施方案的一部分,在所公开的组合物(例如,如在第一至第七个实施方案中的任一个中)中的至少一种另外的增溶赋形剂以在所述组合物重量的从约59%至约66%、约60%至约65%、约61%至约64%或约62%至约63%范围内的量存在。
[0104]
在替代性的第八个实施方案中,按照所述组合物中利福昔明、氢化蓖麻油和至少一种另外的增溶赋形剂的总重量的重量比计,在所公开的组合物(例如,如在第一至第七个实施方案中的任一个中)中的至少一种另外的增溶赋形剂以在从约40%至约70%、约45%至约65%、约46%至约65%、约47%至约65%、约48%至约65%、约49%至约65%、约50%至约65%、约45%至约60%、约46%至约60%、约47%至约60%、约48%至约60%、约49%至约60%、约50%至约60%、约51%至约60%、约52%至约60%、约53%至约60%、约54%至约60%、约55%至约65%、约62%至约63%或约55%至约60%范围内的量存在;或以至少约40%、至少约41%、至少约42%、至少约43%、至少约44%、至少约45%、至少约46%、至少约47%、至少约48%、至少约49%、至少约50%、至少约51%、至少约52%、至少约53%、至少约54%、至少约55%、至少约56%、至少约57%、至少约58%、至少约59%、至少约60%、至少约61%、至少约62%、至少约63%、至少约64%、至少约65%、至少约66%、至
少约67%、至少约68%、至少约69%或至少约70%的量存在;或以至多约40%、至多约41%、至多约42%、至多约43%、至多约44%、至多约45%、至多约46%、至多约47%、至多约48%、至多约49%、至多约50%、至多约51%、至多约52%、至多约53%、至多约54%、至多约55%、至多约56%、至多约57%、至多约58%、至多约59%、至多约60%、至多约61%、至多约62%、至多约63%、至多约64%、至多约65%、至多约66%、至多约67%、至多约68%、至多约69%或至多约70%的量存在;或以约40%、约41%、约42%、约43%、约44%、约45%、约46%、约47%、约48%、约49%、约50%、约51%、约52%、约53%、约54%、约55%、约56%、约57%、约58%、约59%、约60%、约61%、约62%、约63%、约64%、约65%、约66%、约67%、约68%、约69%或约70%的量存在。可替换地,作为第八个实施方案的一部分,按照所述组合物中利福昔明、氢化蓖麻油和至少一种另外的增溶赋形剂的总重量的重量比计,在所公开的组合物(例如,如在第一至第七个实施方案中的任一个中)中的至少一种另外的增溶赋形剂以在从约51%至约59%、约52%至约58%、约53%至约57%或约54%至约56 %范围内的量存在。
[0105]
在第一至第八个实施方案中的任一个的某些实施方案中,按氢化蓖麻油和至少一种另外的增溶赋形剂的重量计,氢化蓖麻油和至少一种另外的增溶赋形剂可以分别以约1:3和约1.5:1的比例提供。在第一至第八个实施方案中的任一个的某些实施方案中,按氢化蓖麻油和至少一种另外的增溶赋形剂的重量计,氢化蓖麻油和至少一种另外的增溶赋形剂可以分别以约1:3至约1.5:1的比例提供。
[0106]
在第一至第八个实施方案中的任一个的某些实施方案中,按氢化蓖麻油和至少一种另外的增溶赋形剂的重量计,氢化蓖麻油和至少一种另外的增溶赋形剂可以分别以约1:1和约1:2.5的比例提供。在第一至第八个实施方案中的任一个的某些实施方案中,按氢化蓖麻油和至少一种另外的增溶赋形剂的重量计,氢化蓖麻油和至少一种另外的增溶赋形剂可以分别以约1:1至约1:2.5的比例提供。
[0107]
利福昔明、氢化蓖麻油、蓖麻油、辛酸甘油酯和聚山梨酯80在第九个实施方案中,在所公开的组合物(例如,如在第一至第八个实施方案中的任一个中)中的至少一种另外的增溶赋形剂是蓖麻油、辛酸甘油酯和聚山梨酯80的组合。
[0108]
在第十个实施方案中,在所公开的组合物(例如,如在第一至第九个实施方案中的任一个中)中的至少一种另外的增溶赋形剂是蓖麻油、辛酸甘油酯和聚山梨酯80的组合, 其中:按所述组合物的重量计,所述蓖麻油以在从约5%至约15%、或约6%至约14%、或约7%至约13%、或约8%至约12%、或约9%至约11%范围内的量存在;或以至少约5%、至少约6%、至少约7%、至少约8%、至少约9%、至少约10%、至少约11%、至少约12%、至少约13%、至少约14%、或至少约15%的量存在;或以至多约5%、至多约6%、至多约7%、至多约8%、至多约9%、至多约10%、至多约11%、至多约12%、至多约13%、至多约14%、或至多约15%的量存在;或以约5%、约6%、约7%、约8%、约9%、约10%、约11%、约12%、约13%、约14%、或约15%的量存在;按所述组合物的重量计,所述辛酸甘油酯以在从约5%至约15%、或约10%至约15%、或约38%至约42%、或约6%至约14%、或约7%至约13%、或约8%至约12%、或约9%至约11%范围内的量存在;或以至少约5%、至少约6%、至少约7%、至少约8%、至少约9%、至少约10%、至少约11%、至少约12%、至少约13%、至少约14%或至少约15%的量存在;或以至多约5%、至多约6%、至多约7%、至多约8%、至多约9%、至多约10%、至多约11%、至多约12%、至多约13%、至多约14%或
至多约15%的量存在;或以约5%、约6%、约7%、约8%、约9%、约10%、约11%、约12%、约13%、约14%或约15%的量存在;和按所述组合物的重量计,所述聚山梨酯80以在从约20%至约40%、35%至约45%、或约25%至约40%、或约27%至约40%、或约25%至约37%、或约27%至约37%、或约28%至约36%、或约30%至约35%、或约32%至约35%范围内的量存在;或以至少约25%、至少约26%、至少约27%、至少约28%、至少约29%、至少约30%、至少约31%、至少约32%、至少约33%、至少约34%、至少约35%、至少约36%、至少约37%、至少约38%、至少约39%或至少约40%的量存在;或以至多约25%、至多约26%、至多约27%、至多约28%、至多约29%、至多约30%、至多约31%、至多约32%、至多约33%、至多约34%、至多约35%、至多约36%、至多约37%、至多约38%、至多约39%或至多约40%的量存在;或以约25%、约26%、约27%、约28%、约29%、约30%、约31%、约32%、约33%、约34%、约35%、约36%、约37%、约38%、约39%或约40%的量存在。
[0109]
可替换地,作为第十个实施方案的一部分,在所公开的组合物(例如,如在第一至第九个实施方案中的任一个中)中的至少一种另外的增溶赋形剂是蓖麻油、辛酸甘油酯和聚山梨酯80的组合, 其中所述蓖麻油以在所述组合物重量的从约8%至约12%范围内的量存在;所述辛酸甘油酯以在所述组合物重量的从约10%至约14%范围内的量存在;且所述聚山梨酯80以在所述组合物重量的从约30%至约35%范围内的量存在。在另一个替代方案中,作为第十个实施方案的一部分,在所公开的组合物(例如,如在第一至第九个实施方案中的任一个中)中的至少一种另外的增溶赋形剂是蓖麻油、辛酸甘油酯和聚山梨酯80的组合, 其中:按所述组合物的重量计,所述蓖麻油以在从约10%至约20%(例如,约11%至约19%、约12%至约18%、约13%至约17%或约14%至约16%)范围内的量存在,或以至少约10%、至少约11%、至少约12%、至少约13%、至少约14%、至少约15%、至少约16%、至少约17%、至少约18%、至少约19%或至少约20%的量存在,或以至多约10%、至多约11%、至多约12%、至多约13%、至多约14%、至多约15%、至多约16%、至多约17%、至多约18%、至多约19%或至多约20%的量存在,或以约10%、约11%、约12%、约13%、约14%、约15%、约16%、约17%、约18%、约19%或约20%的量存在;按所述组合物的重量计,所述辛酸甘油酯以在从约5%至约15%(例如,约6%至约14%、约7%至约13%、约8%至约12%或约9%至约11%)范围内的量存在,或以至少约5%、至少约6%、至少约7%、至少约8%、至少约9%、至少约10%、至少约11%、至少约12%、至少约13%、至少约14%或至少约15%的量存在,或以至多约5%、至多约6%、至多约7%、至多约8%、至多约9%、至多约10%、至多约11%、至多约12%、至多约13%、至多约14%或至多约15%的量存在,或以约5%、约6%、约7%、约8%、约9%、约10%、约11%、约12%、约13%、约14%或约15%的量存在;且按所述组合物的重量计,所述聚山梨酯80以在从约20%至约40%(例如,约25%至约40%、约27%至约40%、约25%至约37%、约27%至约37%、约28%至约36%、约30%至约35%或约32%至约35%)范围内的量存在,或以至少约20%、至少约21%、至少约22%、至少约23%、至少约24%、至少约25%、至少约26%、至少约27%、至少约28%、至少约29%、至少约30%、至少约31%、至少约32%、至少约33%、至少约34%、至少约35%、至少约36%、至少约37%、至少约38%、至少约39%或至少约40%的量存在,或以至多约20%、至多约21%、至多约22%、至多约23%、至多约24%、至多约25%、至多约26%、至多约27%、至多约28%、至多约29%、至多约30%、至多约31%、至多约32%、至多约33%、至多约34%、至多约35%、至多约36%、至多约37%、至多约38%、至多约39%或至多约
40%的量存在,或以约20%、约21%、约22%、约23%、约24%、约25%、约26%、约27%、约28%、约29%、约30%、约31%、约32%、约33%、约34%、约35%、约36%、约37%、约38%、约39%或约40%的量存在。
[0110]
在另一个替代方案中,作为第十个实施方案的一部分,在所公开的组合物(例如,如在第一至第九个实施方案中的任一个中)中的至少一种另外的增溶赋形剂是蓖麻油、辛酸甘油酯和聚山梨酯80的组合, 其中所述蓖麻油以在所述组合物重量的从约13%至约18%范围内的量存在;所述辛酸甘油酯以在所述组合物重量的从约10%至约14%范围内的量存在;且所述聚山梨酯80以在所述组合物重量的从约30%至约35%范围内的量存在。
[0111]
在替代性的第十个实施方案中,在所公开的组合物(例如,如在第一至第九个实施方案中的任一个中)中的至少一种另外的增溶赋形剂是蓖麻油、辛酸甘油酯和聚山梨酯80的组合, 其中:按照利福昔明、氢化蓖麻油、辛酸甘油酯和聚山梨酯80的总重量的重量比计,所述蓖麻油以在从约5%至约15%、或约6%至约14%、或约7%至约13%、或约8%至约12%、或约9%至约11%范围内的量存在;或以至少约5%、至少约6%、至少约7%、至少约8%、至少约9%、至少约10%、至少约11%、至少约12%、至少约13%、至少约14%、或至少约15%的量存在;或以至多约5%、至多约6%、至多约7%、至多约8%、至多约9%、至多约10%、至多约11%、至多约12%、至多约13%、至多约14%、或至多约15%的量存在;或以约5%、约6%、约7%、约8%、约9%、约10%、约11%、约12%、约13%、约14%、或约15%的量存在;按照利福昔明、氢化蓖麻油、辛酸甘油酯和聚山梨酯80的总重量的重量比计,所述辛酸甘油酯以在从约5%至约15%、或约6%至约14%、或约7%至约13%、或约8%至约12%、或约9%至约11%范围内的量存在;或以至少约5%、至少约6%、至少约7%、至少约8%、至少约9%、至少约10%、至少约11%、至少约12%、至少约13%、至少约14%、或至少约15%的量存在;或以至多约5%、至多约6%、至多约7%、至多约8%、至多约9%、至多约10%、至多约11%、至多约12%、至多约13%、至多约14%、或至多约15%的量存在;或以约5%、约6%、约7%、约8%、约9%、约10%、约11%、约12%、约13%、约14%、或约15%的量存在;和按照利福昔明、氢化蓖麻油、辛酸甘油酯和聚山梨酯80的总重量的重量比计,所述聚山梨酯80以在从约20%至约40%、或约25%至约40%、或约27%至约40%、或约25%至约37%、或约27%至约37%、或约28%至约36%、或约30%至约35%、或约32%至约35%范围内的量存在;或以至少约25%、至少约26%、至少约27%、至少约28%、至少约29%、至少约30%、至少约31%、至少约32%、至少约33%、至少约34%、至少约35%、至少约36%、至少约37%、至少约38%、至少约39%或至少约40%的量存在;或以至多约25%、至多约26%、至多约27%、至多约28%、至多约29%、至多约30%、至多约31%、至多约32%、至多约33%、至多约34%、至多约35%、至多约36%、至多约37%、至多约38%、至多约39%或至多约40%的量存在;或以约25%、约26%、约27%、约28%、约29%、约30%、约31%、约32%、约33%、约34%、约35%、约36%、约37%、约38%、约39%或约40%的量存在。
[0112]
可替换地,作为第十个实施方案的一部分,在所公开的组合物(例如,如在第一至第九个实施方案中的任一个中)中的至少一种另外的增溶赋形剂是蓖麻油、辛酸甘油酯和聚山梨酯80的组合, 其中按照利福昔明、氢化蓖麻油、辛酸甘油酯和聚山梨酯80的总重量的重量比计,所述蓖麻油以在从约8%至约12%范围内的量存在;按照利福昔明、氢化蓖麻油、辛酸甘油酯和聚山梨酯80的总重量的重量比计,所述辛酸甘油酯以在从约10%至约14%范围内的量存在;和按照利福昔明、氢化蓖麻油、辛酸甘油酯和聚山梨酯80的总重量的重量比
计,所述聚山梨酯80以在从约30%至约35%范围内的量存在。在另一个替代方案中,作为第十个实施方案的一部分,在所公开的组合物(例如,如在第一至第九个实施方案中的任一个中)中的至少一种另外的增溶赋形剂是蓖麻油、辛酸甘油酯和聚山梨酯80的组合, 其中:按照利福昔明、氢化蓖麻油、辛酸甘油酯和聚山梨酯80的总重量的重量比计,所述蓖麻油以在从约10%至约20%(例如,约11%至约19%、约12%至约18%、约13%至约17%、或约14%至约16%)范围内的量存在,或以至少约10%、11%、12%、13%、14%、15%、16%、17%、18%、19%或20%的量存在,或以至多约10%、11%、12%、13%、14%、15%、16%、17%、18%、19%或20%的量存在,或以约10%、11%、12%、13%、14%、15%、16%、17%、18%、19%或20%的量存在;按照利福昔明、氢化蓖麻油、辛酸甘油酯和聚山梨酯80的总重量的重量比计,所述辛酸甘油酯以在从约5%至约15%(例如,约6%至约14%、约7%至约13%、约8%至约12%或约9%至约11%)范围内的量存在,或以至少约5%、至少约6%、至少约7%、至少约8%、至少约9%、至少约10%、至少约11%、至少约12%、至少约13%、至少约14%或至少约15%的量存在,或以至多约至多约5%、至多约6%、至多约7%、至多约8%、至多约9%、至多约10%、至多约11%、至多约12%、至多约13%、至多约14%或至多约15%的量存在,或以约5%、约6%、约7%、约8%、约9%、约10%、约11%、约12%、约13%、约14%或约15%的量存在;和按照利福昔明、氢化蓖麻油、辛酸甘油酯和聚山梨酯80的总重量的重量比计,所述聚山梨酯80以在从约20%至约40%(例如,约25%至约40%、约27%至约40%、约25%至约37%、约27%至约37%、约28%至约36%、约30%至约35%、或约32%至约35%)范围内的量存在,或以至少约20%、至少约21%、至少约22%、至少约23%、至少约24%、至少约25%、至少约26%、至少约27%、至少约28%、至少约29%、至少约30%、至少约31%、至少约32%、至少约33%、至少约34%、至少约35%、至少约36%、至少约37%、至少约38%、至少约39%、或至少约40%的量存在,或以至多约20%、至多约21%、至多约22%、至多约23%、至多约24%、至多约25%、至多约26%、至多约27%、至多约28%、至多约29%、至多约30%、至多约31%、至多约32%、至多约33%、至多约34%、至多约35%、至多约36%、至多约37%、至多约38%、至多约39%、或至多约40%的量存在,或以约20%、约21%、约22%、约23%、约24%、约25%、约26%、约27%、约28%、约29%、约30%、约31%、约32%、约33%、约34%、约35%、约36%、约37%、约38%、约39%、或约40%的量存在。
[0113]
在另一个替代方案中,作为第十个实施方案的一部分,在所公开的组合物(例如,如在第一至第九个实施方案中的任一个中)中的至少一种另外的增溶赋形剂是蓖麻油、辛酸甘油酯和聚山梨酯80的组合, 其中按照利福昔明、氢化蓖麻油、辛酸甘油酯和聚山梨酯80的总重量的重量比计,所述蓖麻油以在从约13%至约18%范围内的量存在;所述辛酸甘油酯以在所述组合物重量的从约10%至约14%范围内的量存在;且按照利福昔明、氢化蓖麻油、辛酸甘油酯和聚山梨酯80的总重量的重量比计,所述聚山梨酯80以在从约30%至约35%范围内的量存在。
[0114]
在另一个替代方案中,作为第十个实施方案的一部分,在所公开的组合物(例如,如在第一至第九个实施方案中的任一个中)中的至少一种另外的增溶赋形剂是蓖麻油、辛酸甘油酯和聚山梨酯80的组合, 其中所述蓖麻油以在所述组合物重量的从约5%至约15%范围内的量存在;所述辛酸甘油酯以在所述组合物重量的从约10%至约15%范围内的量存在;且所述聚山梨酯80以在所述组合物重量的从约35%至约45%范围内的量存在。
[0115]
在另一个替代方案中,作为第十个实施方案的一部分,在所公开的组合物(例如,
如在第一至第九个实施方案中的任一个中)中的至少一种另外的增溶赋形剂是蓖麻油、辛酸甘油酯和聚山梨酯80的组合, 其中所述蓖麻油以在所述组合物重量的从约8%至约12%范围内的量存在;所述辛酸甘油酯以在所述组合物重量的从约10%至约15%范围内的量存在;且所述聚山梨酯80以在所述组合物重量的从约38%至约42%范围内的量存在。
[0116]
利福昔明、氢化蓖麻油、癸二酸二乙酯和二乙二醇单乙基醚在第十一个实施方案中,在所公开的组合物(例如,如在第一至第八个实施方案中的任一个中)中的至少一种另外的增溶赋形剂是癸二酸二乙酯和二乙二醇单乙基醚的组合。可替换地,作为第十一个实施方案的一部分,所述二乙二醇单乙基醚是二乙二醇单乙基醚。
[0117]
在第十二个实施方案中,在所公开的组合物(例如,如在第一至第八个和第十一个实施方案中的任一个中)中的至少一种另外的增溶赋形剂是癸二酸二乙酯和二乙二醇单乙基醚的组合,其中:按所述组合物的重量计,所述癸二酸二乙酯以在从约20%至约35%、或约21%至约34%、或约22%至约33%、或约23%至约32%、或约24%至约31%、或约25%至约30%、或约26%至约29%、或约26%至约38%、或约27%至约28%范围内的量存在,或以至少约20%、至少约21%、至少约22%、至少约23%、至少约24%、至少约25%、至少约26%、至少约27%、至少约28%、至少约29%、至少约30%、至少约31%、至少约32%、至少约33%、至少约34%、或至少约35%的量存在,或以至多约20%、至多约21%、至多约22%、至多约23%、至多约24%、至多约25%、至多约26%、至多约27%、至多约28%、至多约29%、至多约30%、至多约31%、至多约32%、至多约33%、至多约34%、或至多约35%的量存在,或以约20%、约21%、约22%、约23%、约24%、约25%、约26%、约27%、约28%、约29%、约30%、约31%、约32%、约33%、约34%、或约35%的量存在;和按所述组合物的重量计,所述二乙二醇单乙基醚以在从约20%至约35%、或约21%至约34%、或约22%至约33%、或约23%至约32%、或约24%至约31%、或约25%至约30%、或约26%至约29%、或约26%至约38%、或约27%至约28%范围内的量存在,或以至少约20%、至少约21%、至少约22%、至少约23%、至少约24%、至少约25%、至少约26%、至少约27%、至少约28%、至少约29%、至少约30%、至少约31%、至少约32%、至少约33%、至少约34%、或至少约35%的量存在,或以至多约20%、至多约21%、至多约22%、至多约23%、至多约24%、至多约25%、至多约26%、至多约27%、至多约28%、至多约29%、至多约30%、至多约31%、至多约32%、至多约33%、至多约34%、或至多约35%的量存在,或以约20%、约21%、约22%、约23%、约24%、约25%、约26%、约27%、约28%、约29%、约30%、约31%、约32%、约33%、约34%、或约35%的量存在。
[0118]
可替换地,作为第十二个实施方案的一部分,在所公开的组合物(例如,如在第一至第八个和第十一个实施方案中的任一个中)中的至少一种另外的增溶赋形剂是癸二酸二乙酯和二乙二醇单乙基醚的组合,其中所述癸二酸二乙酯以在所述组合物重量的从约25%至约30%范围内的量存在;且所述二乙二醇单乙基醚以在所述组合物重量的从约25%至约30%范围内的量存在。在另一个替代方案中,作为第十二个实施方案的一部分,在所公开的组合物(例如,如在第一至第八个和第十一个实施方案中的任一个中)中的至少一种另外的增溶赋形剂是癸二酸二乙酯和二乙二醇单乙基醚的组合,其中:按所述组合物的重量计,所述癸二酸二乙酯以在从约10%至约20%、或约11%至约19%、或约12%至约18%、或约13%至约18%、或约14%至约18%、或约15%至约18%、或约16%至约
18%、或约16%至约17%范围内的量存在,或以至少约10%、至少约11%、至少约12%、至少约13%、至少约14%、至少约15%、至少约16%、至少约17%、至少约18%、至少约19%、或至少约20%的量存在,或以至多约10%、至多约11%、至多约12%、至多约13%、至多约14%、至多约15%、至多约16%、至多约17%、至多约18%、至多约19%、或至多约20%的量存在,或以约10%、约11%、约12%、约13%、约14%、约15%、约16%、约17%、约18%、约19%、或约20%的量存在;且按所述组合物的重量计,所述二乙二醇单乙基醚以在从约30%至约45%、或约31%至约44%、或约32%至约43%、或约33%至约42%、或约34%至约41%、或约35%至约40%、或约36%至约49%、或约37%至约49%范围内的量存在,或以至少约30%、至少约31%、至少约32%、至少约33%、至少约34%、至少约35%、至少约36%、至少约37%、至少约38%、至少约39%、至少约40%、至少约41%、至少约42%、至少约43%、至少约44%、或至少约45%的量存在,或以至多约30%、至多约31%、至多约32%、至多约33%、至多约34%、至多约35%、至多约36%、至多约37%、至多约38%、至多约39%、至多约40%、至多约41%、至多约42%、至多约43%、至多约44%、或至多约45%的量存在,或以约30%、约31%、约32%、约33%、约34%、约35%、约36%、约37%、约38%、约39%、约40%、约41%、约42%、约43%、约44%、或约45%的量存在。
[0119]
在另一个替代方案中,作为第十二个实施方案的一部分,在所公开的组合物(例如,如在第一至第八个和第十一个实施方案中的任一个中)中的至少一种另外的增溶赋形剂是癸二酸二乙酯和二乙二醇单乙基醚的组合,其中所述癸二酸二乙酯以在所述组合物重量的从约14%至约18%范围内的量存在;且所述二乙二醇单乙基醚以在所述组合物重量的从约36%至约40%范围内的量存在。
[0120]
在替代性的第十二个实施方案中,在所公开的组合物(例如,如在第一至第八个和第十一个实施方案中的任一个中)中的至少一种另外的增溶赋形剂是癸二酸二乙酯和二乙二醇单乙基醚的组合,其中:按照利福昔明、氢化蓖麻油、癸二酸二乙酯和二乙二醇单乙基醚的总重量的重量比计,所述癸二酸二乙酯以在从约20%至约35%、或约21%至约34%、或约22%至约33%、或约23%至约32%、或约24%至约31%、或约25%至约30%、或约26%至约29%、或约26%至约38%、或约27%至约28%范围内的量存在,或以至少约20%、至少约21%、至少约22%、至少约23%、至少约24%、至少约25%、至少约26%、至少约27%、至少约28%、至少约29%、至少约30%、至少约31%、至少约32%、至少约33%、至少约34%、或至少约35%的量存在,或以至多约20%、至多约21%、至多约22%、至多约23%、至多约24%、至多约25%、至多约26%、至多约27%、至多约28%、至多约29%、至多约30%、至多约31%、至多约32%、至多约33%、至多约34%、或至多约35%的量存在,或以约20%、约21%、约22%、约23%、约24%、约25%、约26%、约27%、约28%、约29%、约30%、约31%、约32%、约33%、约34%、或约35%的量存在;且按照利福昔明、氢化蓖麻油、癸二酸二乙酯和二乙二醇单乙基醚的总重量的重量比计,所述二乙二醇单乙基醚以在从约20%至约35%、或约21%至约34%、或约22%至约33%、或约23%至约32%、或约24%至约31%、或约25%至约30%、或约26%至约29%、或约26%至约38%、或约27%至约28%范围内的量存在,或以至少约20%、至少约21%、至少约22%、至少约23%、至少约24%、至少约25%、至少约26%、至少约27%、至少约28%、至少约29%、至少约30%、至少约31%、至少约32%、至少约33%、至少约34%、或至少约35%的量存在,或以至多约20%、至多约21%、至多约22%、至多约23%、至多约24%、至多约25%、至多约26%、至多约27%、至多约28%、至多约29%、
至多约30%、至多约31%、至多约32%、至多约33%、至多约34%、或至多约35%的量存在,或以约20%、约21%、约22%、约23%、约24%、约25%、约26%、约27%、约28%、约29%、约30%、约31%、约32%、约33%、约34%、或约35%的量存在。
[0121]
可替换地,作为第十二个实施方案的一部分,在所公开的组合物(例如,如在第一至第八个和第十一个实施方案中的任一个中)中的至少一种另外的增溶赋形剂是癸二酸二乙酯和二乙二醇单乙基醚的组合,其中按照利福昔明、氢化蓖麻油、癸二酸二乙酯和二乙二醇单乙基醚的总重量的重量比计,所述癸二酸二乙酯以在从约25%至约30%范围内的量存在;且按照利福昔明、氢化蓖麻油、癸二酸二乙酯和二乙二醇单乙基醚的总重量的重量比计,所述二乙二醇单乙基醚以在从约25%至约30%范围内的量存在。在另一个替代方案中,作为第十二个实施方案的一部分,在所公开的组合物(例如,如在第一至第八个和第十一个实施方案中的任一个中)中的至少一种另外的增溶赋形剂是癸二酸二乙酯和二乙二醇单乙基醚的组合,其中:按照利福昔明、氢化蓖麻油、癸二酸二乙酯和二乙二醇单乙基醚的总重量的重量比计,所述癸二酸二乙酯以在从约10%至约20%、或约11%至约19%、或约12%至约18%、或约13%至约18%、或约14%至约18%、或约15%至约18%、或约16%至约18%、或约16%至约17%范围内的量存在,或以至少约10%、至少约11%、至少约12%、至少约13%、至少约14%、至少约15%、至少约16%、至少约17%、至少约18%、至少约19%、或至少约20%的量存在,或以至多约10%、至多约11%、至多约12%、至多约13%、至多约14%、至多约15%、至多约16%、至多约17%、至多约18%、至多约19%、或至多约20%的量存在,或以约10%、约11%、约12%、约13%、约14%、约15%、约16%、约17%、约18%、约19%、或约20%的量存在;且按照利福昔明、氢化蓖麻油、癸二酸二乙酯和二乙二醇单乙基醚的总重量的重量比计,所述二乙二醇单乙基醚以在从约30%至约45%、或约31%至约44%、或约32%至约43%、或约33%至约42%、或约34%至约41%、或约35%至约40%、或约36%至约49%、或约37%至约49%范围内的量存在,或以至少约30%、至少约31%、至少约32%、至少约33%、至少约34%、至少约35%、至少约36%、至少约37%、至少约38%、至少约39%、至少约40%、至少约41%、至少约42%、至少约43%、至少约44%、或至少约45%的量存在,或以至多约30%、至多约31%、至多约32%、至多约33%、至多约34%、至多约35%、至多约36%、至多约37%、至多约38%、至多约39%、至多约40%、至多约41%、至多约42%、至多约43%、至多约44%、或至多约45%的量存在,或以约30%、约31%、约32%、约33%、约34%、约35%、约36%、约37%、约38%、约39%、约40%、约41%、约42%、约43%、约44%、或约45%的量存在。
[0122]
在另一个替代方案中,作为第十二个实施方案的一部分,在所公开的组合物(例如,如在第一至第八个和第十一个实施方案中的任一个中)中的至少一种另外的增溶赋形剂是癸二酸二乙酯和二乙二醇单乙基醚的组合,其中按照利福昔明、氢化蓖麻油、癸二酸二乙酯和二乙二醇单乙基醚的总重量的重量比计,所述癸二酸二乙酯以在从约14%至约18%范围内的量存在;且按照利福昔明、氢化蓖麻油、癸二酸二乙酯和二乙二醇单乙基醚的总重量的重量比计,所述二乙二醇单乙基醚以在从约36%至约40%范围内的量存在。
[0123]
抗氧化剂/螯合剂在第十三个实施方案中,本文描述的组合物(例如,如在第一至第十二个实施方案中的任一个中)进一步包含抗氧化剂和/或螯合剂。
[0124]
在第十四个实施方案中,本文描述的组合物(例如,如在第一至第十三个实施方案中的任一个中)进一步包含选自以下的抗氧化剂和/或螯合剂:抗坏血酸棕榈酸酯、丁基化羟基茴香醚、丁基化羟基甲苯(bht)、柠檬酸、偏亚硫酸氢钠、半胱氨酸、偏亚硫酸氢钾、没食子酸丙酯、硫代硫酸钠、维生素e和3,4-二羟基苯甲酸。不受限于本发明的任何理论,bht和柠檬酸,例如,可以用作抗氧化剂和/或螯合剂以使通过氧化对利福昔明的潜在降解最小化。
[0125]
可替换地,作为第十四个实施方案的一部分,本文描述的组合物(例如,如在第一至第十三个实施方案中的任一个中)进一步包含bht。在另一个替代方案中,作为第十四个实施方案的一部分,按所述组合物的重量计,本文描述的组合物(例如,如在第一至第十三个实施方案中的任一个中)进一步包含小于约1%(例如,小于约0.5%、小于约0.1%、小于约0.08%、小于约0.06%、小于约0.04%)的量的bht。
[0126]
在另一个替代方案中,作为第十四个实施方案的一部分,本文描述的组合物(例如,如在第一至第十三个实施方案中的任一个中)进一步包含在所述组合物重量的从约0.01%至约0.1%、从约0.02%至约0.08%、从约0.025%至约0.06%、从约0.03%至约0.06%、从约0.03%至约0.05%、从约0.05%至约0.15%或从约0.03%至约0.04%范围内的量的bht。
[0127]
可替换地,作为第十四个实施方案的一部分,本文描述的组合物(例如,如在第一至第十三个实施方案中的任一个中)进一步包含柠檬酸。在另一个替代方案中,作为第十四个实施方案的一部分,按所述组合物的重量计,本文描述的组合物(例如,如在第一至第十三个实施方案中的任一个中)进一步包含小于约1%(例如,小于约0.5%、小于约0.1%、小于约0.08%、小于约0.06%、小于约0.04%)的量的柠檬酸。
[0128]
在另一个替代方案中,作为第十四个实施方案的一部分,本文描述的组合物(例如,如在第一至第十三个实施方案中的任一个中)进一步包含在所述组合物重量的从约0.01%至约0.1%、从约0.02%至约0.08%、从约0.025%至约0.06%、从约0.03%至约0.06%、从约0.03%至约0.05%或从约0.03%至约0.04%范围内的量的柠檬酸。
[0129]
可替换地,作为第十四个实施方案的一部分,本文描述的组合物(例如,如在第一至第十三个实施方案中的任一个中)进一步包含抗坏血酸棕榈酸酯。可替换地,作为第十四个实施方案的一部分,本文描述的组合物(例如,如在第一至第十三个实施方案中的任一个中)进一步包含在所述组合物重量的从约0.05%至约0.15%、从约0.06%至约0.14%、从约0.07%至约0.13%、从约0.08%至约0.12%或从约0.08%至约0.12%范围内的量的抗坏血酸棕榈酸酯。
[0130]
可替换地,作为第十四个实施方案的一部分,本文描述的组合物(例如,如在第一至第十三个实施方案中的任一个中)进一步包含bht和柠檬酸。在另一个替代方案中,作为第十四个实施方案的一部分,按所述组合物的重量计,本文描述的组合物(例如,如在第一至第十三个实施方案中的任一个中)进一步包含各自小于约1%(例如,小于约0.5%、小于约0.1%、小于约0.08%、小于约0.06%、小于约0.04%)的量的bht和柠檬酸。
[0131]
在另一个替代方案中,作为第十四个实施方案的一部分,本文描述的组合物(例如,如在第一至第十三个实施方案中的任一个中)进一步包含各自在所述组合物重量的从约0.01%至约0.1%、从约0.02%至约0.08%、从约0.025%至约0.06%、从约0.03%至约0.06%、从约0.03%至约0.05%或从约0.03%至约0.04%范围内的量的bht和柠檬酸。
mg、约35 mg至约65 mg、约40 mg至约60 mg、约45 mg至约55 mg、约75 mg至约125 mg、约80 mg至约120 mg、85 mg至约115 mg、约90 mg至约110 mg、或约95 mg至约105 mg)。可替换地,作为第十六个实施方案的一部分,在所公开的组合物(例如,如在第一至第十五个实施方案中的任一个中)中的利福昔明的总量(以毫克为单位)为约1、约1.5、约2、约2.5、约3、约3.5、约4、约4.5、约5、约5.5、约6、约6.5、约7、约7.5、约8、约8.5、约9、约9.5、约10、约10.5、约11、约11.5、约12、约12.5、约13、约13.5、约14、约14.5、约15、约16、约17、约18、约19、约20、约21、约22、约23、约24、约25、约26、约27、约28、约29、约30、约31、约32、约33、约34、约35、约36、约37、约38、约39、约40、约41、约42、约43、约44、约45、约46、约47、约48、约49、约50、约51、约52、约53、约54、约55、约56、约57、约58、约59、约60、约61、约62、约63、约64、约65、约66、约67、约68、约69、约70、约71、约72、约73、约74、约75、约76、约77、约78、约79、约80、约81、约82、约83、约84、约85、约86、约87、约88、约89、约90、约91、约92、约93、约94、约95、约96、约97、约98、约99、约100、约101、约102、约103、约104、约105、约106、约107、约108、约109、约110、约111、约112、约113、约114、约115、约116、约117、约118、约119、约120、约121、约122、约123、约124或约125 mg;或至少约1、至少约1.5、至少约2、至少约2.5、至少约3、至少约3.5、至少约4、至少约4.5、至少约5、至少约5.5、至少约6、至少约6.5、至少约7、至少约7.5、至少约8、至少约8.5、至少约9、至少约9.5、至少约10、至少约10.5、至少约11、至少约11.5、至少约12、至少约12.5、至少约13、至少约13.5、至少约14、至少约14.5、至少约15、至少约16、至少约17、至少约18、至少约19、至少约20、至少约21、至少约22、至少约23、至少约24、至少约25、至少约26、至少约27、至少约28、至少约29、至少约30、至少约31、至少约32、至少约33、至少约34、至少约35、至少约36、至少约37、至少约38、至少约39、至少约40、至少约41、至少约42、至少约43、至少约44、至少约45、至少约46、至少约47、至少约48、至少约49、至少约50、至少约51、至少约52、至少约53、至少约54、至少约55、至少约56、至少约57、至少约58、至少约59、至少约60、至少约61、至少约62、至少约63、至少约64、至少约65、至少约66、至少约67、至少约68、至少约69、至少约70、至少约71、至少约72、至少约73、至少约74、至少约75、至少约76、至少约77、至少约78、至少约79、至少约80、至少约81、至少约82、至少约83、至少约84、至少约85、至少约86、至少约87、至少约88、至少约89、至少约90、至少约91、至少约92、至少约93、至少约94、至少约95、至少约96、至少约97、至少约98、至少约99、至少约100、至少约101、至少约102、至少约103、至少约104、至少约105、至少约106、至少约107、至少约108、至少约109、至少约110、至少约111、至少约112、至少约113、至少约114、至少约115、至少约116、至少约117、至少约118、至少约119、至少约120、至少约121、至少约122、至少约123、至少约124或至少约125 mg;或至多约1、至多约1.5、至多约2、至多约2.5、至多约3、至多约3.5、至多约4、至多约4.5、至多约5、至多约5.5、至多约6、至多约6.5、至多约7、至多约7.5、至多约8、至多约8.5、至多约9、至多约9.5、至多约10、至多约10.5、至多约11、至多约11.5、至多约12、至多约12.5、至多约13、至多约13.5、至多约14、至多约14.5、至多约15、至多约16、至多约17、至多约18、至多约19、至多约20、至多约21、至多约22、至多约23、至多约24、至多约25、至多约26、至多约27、至多约28、至多约29、至多约30、至多约31、至多约32、至多约33、至多约34、至多约35、至多约36、至多约37、至多约38、至多约39、至多约40、至多约41、至多约42、至多约43、至多约44、至多约45、至多约46、至多约47、至多约48、至多约49、至多约50、至多约51、至多约52、至多约53、至多约54、至多约55、至多约56、至多约57、至多约
58、至多约59、至多约60、至多约61、至多约62、至多约63、至多约64、至多约65、至多约66、至多约67、至多约68、至多约69、至多约70、至多约71、至多约72、至多约73、至多约74、至多约75、至多约76、至多约77、至多约78、至多约79、至多约80、至多约81、至多约82、至多约83、至多约84、至多约85、至多约86、至多约87、至多约88、至多约89、至多约90、至多约91、至多约92、至多约93、至多约94、至多约95、至多约96、至多约97、至多约98、至多约99、至多约100、至多约101、至多约102、至多约103、至多约104、至多约105、至多约106、至多约107、至多约108、至多约109、至多约110、至多约111、至多约112、至多约113、至多约114、至多约115、至多约116、至多约117、至多约118、至多约119、至多约120、至多约121、至多约122、至多约123、至多约124或至多约125 mg。
[0136]
可替换地,作为另外的实施方案的一部分,在所公开的组合物(例如,如在第一至第十六个实施方案中的任一个中)中的利福昔明的总量(以毫克为单位)为至少约0.5、至少约1.0、至少约1.5、至少约2.0、至少约2.5、至少约3.0、至少约3.5、至少约4.0、至少约4.5、至少约5.0、至少约5.5、至少约6.0、至少约6.5、至少约7.0、至少约7.5、至少约8.0、至少约8.5、至少约9.0、至少约9.5、至少约10.0、至少约10.5或至少约11 mg,或至多约0.5、至多约1.0、至多约1.5、至多约2.0、至多约2.5、至多约3.0、至多约3.5、至多约4.0、至多约4.5、至多约5.0、至多约5.5、至多约6.0、至多约6.5、至多约7.0、至多约7.5、至多约8.0、至多约8.5、至多约9.0、至多约9.5、至多约10.0、至多约10.5或至多约11 mg,或约0.5、约1.0、约1.5、约2.0、约2.5、约3.0、约3.5、约4.0、约4.5、约5.0、约5.5、约6.0、约6.5、约7.0、约7.5、约8.0、约8.5、约9.0、约9.5、约10.0、约10.5或约11mg。
[0137]
液体组合物在第十七个实施方案中,本文描述的组合物(例如,如在第一至第十六个实施方案中的任一个中)是液体组合物。
[0138]
3. 剂型为了施用的目的,在某些实施方案中,本文描述的组合物可以按原样施用或配制为替代剂型,例如用于口服递送。用于口服递送的制剂可以是锭剂、水性或油性混悬液、乳剂、胶囊剂、糖浆剂或酏剂的形式。口服施用的组合物可以包含一种或多种任选的试剂,例如,甜味剂诸如果糖、阿司帕坦或糖精;矫味剂诸如薄荷、冬青油或樱桃;着色剂;和防腐剂,以提供药学上可口的制品。可以对组合物进行包衣以延迟在胃肠道中的崩解和吸收,从而在延长的时间段内提供持续的作用。
[0139]
在某些实施方案中,将所公开的组合物配制成胶囊剂型。在某些实施方案中,将所公开的组合物配制成软或硬胶囊剂型。在某些实施方案中,将所公开的组合物配制成软或硬明胶胶囊剂型。
[0140]
应当指出,用于任何特定患者的具体剂量和治疗方案将取决于多种因素,包括年龄、体重、一般健康、性别、饮食、施用时间、排泄速率、药物组合、治疗医师的判断、以及正在治疗的特定疾病的严重程度。
[0141]
4. 使用方法本文描述的组合物可以用在治疗或预防疾病的方法中。例如,本文描述的发明包括在有此需要的受试者中治疗或预防疾病或障碍的方法。这样的方法可以包括给所述受试者施用治疗有效量的任何前述组合物中的一种或多种的步骤,所述组合物可以是单位剂
型。
[0142]
本文描述的组合物可用于治疗一种或多种肠相关障碍或肝功能障碍。这样的障碍包括,例如,肠易激综合征(ibs) (例如,ibs-d)、腹泻、微生物相关的腹泻、传染性腹泻、艰难梭菌感染和症状(例如,艰难梭菌有关的腹泻)、旅行性腹泻、小肠细菌过度生长(sibo)、克罗恩氏病、憩室病、胰腺炎(包括慢性)、胰腺功能不全、肠炎、结肠炎(例如,溃疡性结肠炎、抗生素相关的结肠炎和显微镜下结肠炎)、肝性脑病(或导致氨水平增加的其它疾病)及其症状、胃消化不良、肝硬化(例如,酒精性肝硬化)、多囊性肝病、贮袋炎、腹膜炎、短肠综合征、炎性肠病、红斑痤疮、镰刀形细胞病和幽门螺杆菌感染。
[0143]
在某些实施方案中,本文描述的组合物可用于治疗和/或预防肝性脑病。例如,本文描述的组合物可用于治疗肝性脑病复发;和/或用于治疗明显的肝性脑病;和/或用于预防明显的肝性脑病。
[0144]
本文描述的组合物可用于肝移植准备。
[0145]
本文描述的组合物可用于治疗心血管病症(例如,动脉粥样硬化性心血管疾病)。
[0146]
本文描述的组合物可用于治疗影响中枢神经系统的障碍以及与认知损害相关的障碍,诸如帕金森病、阿尔茨海默氏病和孤独症。
[0147]
本文描述的组合物可用于治疗某些癌症,诸如急性髓样白血病。
[0148]
本文描述的组合物可用于治疗镰刀形细胞病和/或与其相关的症状。
[0149]
因此,提供了在有此需要的受试者中治疗本文所述的一种或多种肠相关障碍或肝功能障碍的方法,包括给所述受试者施用治疗有效量的所公开的组合物。还提供了所公开的组合物在制备药物中的用途,所述药物用于治疗本文所述的一种或多种肠相关障碍或肝功能障碍。进一步提供了所公开的组合物用于治疗本文所述的一种或多种肠相关障碍或肝功能障碍的用途。
[0150]
在某些实施方案中,本文所述的方法可以包括qd、bid、tid或qid给受试者施用前述组合物以给所述受试者提供以下量的利福昔明每日剂量(以毫克为单位):至少约1.0、至少约1.5、至少约2.0、至少约2.5、至少约3.0、至少约3.5、至少约4.0、至少约4.5、至少约5.0、至少约5.5、至少约6.0、至少约6.5、至少约7.0、至少约7.5、至少约8.0、至少约8.5、至少约9.0、至少约9.5、至少约10.0、至少约10.5、至少约11.0、至少约11.5、至少约12.0、至少约12.5、至少约13.0、至少约13.5、至少约14.0、至少约14.5、至少约15.0、至少约15.5、至少约16.0、至少约16.5、至少约17.0、至少约17.5、至少约18.0、至少约18.5、至少约19.0、至少约19.5、至少约20.0、至少约20.5、至少约21.0、至少约21.5、至少约22.0、至少约22.5、至少约23.0、至少约23.5、至少约24.0、至少约24.5、至少约25.0、至少约25.5、至少约26.0、26.5、至少约27.0、至少约27.5、至少约28.0、至少约28.5、至少约29.0、至少约29.5、至少约30.0、至少约30.5、至少约31.0、至少约31.5、至少约32.0、至少约32.5、至少约33.0、至少约33.5、至少约34.0、至少约34.5、至少约35.0、至少约35.5、至少约36.0、至少约36.5、至少约37.0、至少约37.5、至少约38.0、至少约38.5、至少约39.0、至少约39.5或至少约40.0 mg。在某些实施方案中,本文所述的方法可以包括qd、bid、tid或qid给受试者施用前述组合物以给所述受试者提供以下量(以毫克为单位)的利福昔明每日剂量:至多约1.0、至多约1.5、至多约2.0、至多约2.5、至多约3.0、至多约3.5、至多约4.0、至多约4.5、至多约5.0、至多约5.5、至多约6.0、至多约6.5、至多约7.0、至多约7.5、至多约8.0、至多约8.5、至多约9.0、至
多约9.5、至多约10.0、至多约10.5、至多约11.0、至多约11.5、至多约12.0、至多约12.5、至多约13.0、至多约13.5、至多约14.0、至多约14.5、至多约15.0、至多约15.5、至多约16.0、至多约16.5、至多约17.0、至多约17.5、至多约18.0、至多约18.5、至多约19.0、至多约19.5、至多约20.0、至多约20.5、至多约21.0、至多约21.5、至多约22.0、至多约22.5、至多约23.0、至多约23.5、至多约24.0、至多约24.5、至多约25.0、至多约25.5、至多约26.0、26.5、至多约27.0、至多约27.5、至多约28.0、至多约28.5、至多约29.0、至多约29.5、至多约30.0、至多约30.5、至多约31.0、至多约31.5、至多约32.0、至多约32.5、至多约33.0、至多约33.5、至多约34.0、至多约34.5、至多约35.0、至多约35.5、至多约36.0、至多约36.5、至多约37.0、至多约37.5、至多约38.0、至多约38.5、至多约39.0、至多约39.5或至多约40.0 mg。在某些实施方案中,本文所述的方法可以包括qd、bid、tid或qid给受试者施用前述组合物以给所述受试者提供以下量(以毫克为单位)的利福昔明每日剂量:约1.0、约1.5、约2.0、约2.5、约3.0、约3.5、约4.0、约4.5、约5.0、约5.5、约6.0、约6.5、约7.0、约7.5、约8.0、约8.5、约9.0、约9.5、约10.0、约10.5、约11.0、约11.5、约12.0、约12.5、约13.0、约13.5、约14.0、约14.5、约15.0、约15.5、约16.0、约16.5、约17.0、约17.5、约18.0、约18.5、约19.0、约19.5、约20.0、约20.5、约21.0、约21.5、约22.0、约22.5、约23.0、约23.5、约24.0、约24.5、约25.0、约25.5、约26.0、26.5、约27.0、约27.5、约28.0、约28.5、约29.0、约29.5、约30.0、约30.5、约31.0、约31.5、约32.0、约32.5、约33.0、约33.5、约34.0、约34.5、约35.0、约35.5、约36.0、约36.5、约37.0、约37.5、约38.0、约38.5、约39.0、约39.5或约40.0 mg。
[0151]
在某些实施方案中,本文所述的方法可以包括bid以3.5 mg或7.0 mg或10.5 mg的剂量施用前述组合物以给所述受试者分别提供约7.0 mg或14.0 mg或21.0 mg的量的利福昔明每日剂量。
[0152]
在某些实施方案中,通过视情况而定每个剂量或每天给受试者施用至少1、2、3、4、5、6、7、8、9或10个单位剂型的组合物(例如,胶囊剂),可以提供前述剂量或每日剂量。在某些实施方案中,通过视情况而定每个剂量或每天给受试者施用至多1、2、3、4、5、6、7、8、9或10个单位剂型的组合物(例如,胶囊剂),可以提供前述剂量或每日剂量。在某些实施方案中,通过视情况而定每个剂量或每天给受试者施用约1、2、3、4、5、6、7、8、9或10个单位剂型的组合物(例如,胶囊剂),可以提供前述剂量或每日剂量。
[0153]
尽管上面已经描述和/或举例说明了本发明的某些实施方案,但是各种其它实施方案对于本领域技术人员来说将是从本公开内容显而易见的。因此,本发明不限于所描述的和/或举例说明的特定实施方案,而是能够在不背离所附权利要求的范围和精神的情况下进行相当大的变化和修改。
[0154]
例证下面的代表性实施例意图帮助说明本公开内容,并且无意、也不应将其解释为限制本发明的范围。
[0155]
1. 配制前研究a. 溶解度通过在每种增溶赋形剂中加入过量的利福昔明以确定饱和溶解度,研究利福昔明在不同增溶赋形剂中的溶解度。通过hplc分析溶解的利福昔明的量。溶解度筛选的结果显示在下表1中。
[0156]
表1b. 赋形剂相容性为了确定赋形剂相容性,将预定量的利福昔明添加到每种溶剂中,并将所得溶液置于不同温度条件下至多4周。然后通过hplc分析化学纯度,其结果如表2所示。
[0157]
表2
c. 与明胶壳的相容性研究了单一赋形剂与明胶壳基质的物理相容性。对于硬明胶胶囊,将溶剂填充到硬胶囊中并放入闪烁瓶中。对于软明胶胶囊,将每个胶囊浸入赋形剂中并然后放入闪烁瓶中。然后将小瓶置于各种温度条件至多4周。然后评价胶囊的物理变化(胶囊壳的软化或硬化)。
[0158]
硬凝胶胶囊购自购自vwr (目录号70102),体积为0.68 ml,直径为6.63 mm,长度为19.0 mm,且尺寸为1。软凝胶胶囊是advil液体凝胶,200 mg强度,80计数。结果显示在表3和4中。
[0159]
表3
ꢀ‑ꢀ
硬凝胶胶囊
表4
ꢀ‑ꢀ
软凝胶胶囊
2. 制剂研究a. 可用的可溶性药物的百分比的评价使用以下标准研究了可溶于磷酸盐缓冲液(ph ~ 6.8)或模拟肠液(sif, ph ~ 6.8)中的药物(利福昔明)的百分比。对照物质是xifaxan
®
片剂(200 mg)或xifaxan
®
粉末(200 mg api 二硬脂酸甘油酯
‑ꢀ
以代表肠溶包衣片剂)。添加剂(如注明)包括胆汁酸(胆酸)、丁基化羟基甲苯(bht)和丙烯酸异辛酯/丙烯酰胺/乙酸乙烯酯共聚物(kollidon
®
va64)。
[0160]
通过称重氢化蓖麻油和至少一种另外的增溶赋形剂并然后混合,制备组合物。在适用时,然后将bht添加到混合物中并溶解。最后加入利福昔明。
[0161]
进行溶出度研究以评价与在ph 7.4缓冲液、37摄氏度下的xifaxan相比,在一段时间内从利福昔明sedds制剂中溶解的药物百分比。通过hplc分析样品。将结果显示于下面表5以及图1和图2中。如图所示,本发明的制剂(5425-66a;70 mg利福昔明和5425-67a;35 mg利福昔明)的溶出明显快于先前公开的40 mg利福昔明ir和80 mg利福昔明ser固体分散体组合物(参见wo 2018/064472)和xifaxan 550 mg。
[0162]
表5
对于sif,将原型组合物(总共1克,各自包含100 mg api)或xifaxan
®
粉末在sif (100 ml)中在37℃混合1小时。然后将混合物离心20分钟并通过hplc分析。结果如下表6a和6b所示。
[0163]
表6a
–
在磷酸盐缓冲液中的可溶性药物百分比
表6b
–
在sif中的可溶性药物百分比
加入某些添加剂诸如丁基化羟基甲苯(bht)、结晶抑制剂(ci)和胆汁酸的影响如表7所示。与上述类似,表7中的发明组合物总共包含1克,各自包含100 mg利福昔明。
[0164]
表7
ꢀ‑ꢀ
添加剂的影响
b. 原型与明胶壳的相容性研究了某些发明组合物与明胶壳基质的相容性。胶囊尺寸为1,vwr目录号70102。然后将小瓶置于各种温度条件下达5周。然后评价胶囊的物理变化(胶囊壳的软化或硬化)。该研究的结果是如下表8所示。表7中的发明组合物包含共1克,各自包含50 mg或100 mg利福昔明。
[0165]
表8
如上所示,发明组合物在与体内存在的条件相似的条件下显著改善了利福昔明的溶解度。在某些情况下,与商购可得的xifaxan
®
相比,这种效果代表可溶性利福昔明百分比的超过150倍增加。
[0166]
3. 另外的制剂另外的制剂如下表9所示。
[0167]
表9
可以将组合物放入非肠溶包衣胶囊(诸如quali-g, 尺寸4, 140 mg填充物)中。在各种ph条件下,5425-68a、5425-70a、5425-70b和5425-70c的溶出度结果显示在图3-8中,与之前公开的40 mg利福昔明ir和80 mg利福昔明ser固体分散体组合物(参见wo 2018/064472)和xifaxan 550 mg进行了对比。
[0168]
4. 抗细菌活性如本文所述检查代表性组合物的抗细菌性能。
[0169]
通过接种大豆酪蛋白消化琼脂(tsa)平板的表面制备生物体,在30-35℃温育18至24小时。温育时段之后,将平板用无菌血清学盐水溶液(serological saline solution)洗涤以收获所使用的微生物,并用盐水稀释,铺板在tsa上并在30-35℃温育18-24小时以确定浓度。然后将接种物水平调整至10^ cfw ml以用作储备悬浮液。在每个接种间期将储备悬浮液充分混合和均质化。
[0170]
在此杀灭时间(kill time)研究中使用了以下微生物:大肠杆菌atcc 8739、弗氏志贺氏菌atcc 12022和猪霍乱沙门氏菌atcc 10708。在开始和完成时通过倾倒铺板进行阳性对照,以在试验期间计数接种物水平并验证培养物纯度,并进行阴性对照以确定在开始时使用的培养基、试剂和材料的无菌性。使用改良的letheen液体培养基(mlb)的中和剂适用性与杀灭时间试验并行进行,以确认在产品存在的情况下继代培养物培养基中试验生物体的《100 cfu的回收率。
[0171]
称量1.0克制剂(5507-65a)。在单独的容器中,制备70 ml 0.1 n盐酸(ph 1.1)和30 ml 0.20 m磷酸三钠的混合物,并将ph调至约6.8。将混合物加入制剂并在室温下搅拌1小时。然后将混合物通过0.45微米过滤器过滤以除去任何沉淀物并收集滤液。为每个处理过的样本或材料浓度准备一式两份10 ml容器,平衡至25
±
2℃,并向每个容器中加入0.1 ml接种物以达到产品中10^ cfu/ml的最终浓度。
[0172]
使用在9ml mlb中的1ml接种的试验产品以10分钟、30分钟、45分钟、1小时、2小时、3小时和4小时的时间间隔从每个重复进行系列稀释,从1:10至1:1000000。随后,将来自每个稀释液的1 ml一式两份用tsa倾倒铺板,在30-35℃温育48小时。温育时段后,对所有平板进行计数以确定微生物的数量,将结果取平均值并报告为对数减少。以相同方式制备制剂5507-65a的安慰剂对照(5507-66a)。安慰剂不含利福昔明并且包含44.90%wt/wt的聚氧乙烯40氢化蓖麻油而不是34.90%wt/wt。还试验和对比了xifaxan 550 mg片剂。结果显示在图9-11中。
[0173]
5. 稳定性研究进行稳定性研究以确定利福昔明在储存期间是否会在本文所述的代表性液体组合物中降解。将表10的制剂在5℃和在25℃(在60%rh)储存,并在0.5和1.0个月时检查目测外观和利福昔明浓度(通过lc-ms)的变化。这样的研究的结果显示在表11中,其指示,在代表性液体组合物中几乎没有观察到或没有观察到利福昔明的降解。
[0174]
表10表11
贯穿本技术引用的所有参考文献(包括参考文献、授权的专利、公布的专利申请和共同未决的专利申请)的内容特此通过引用明确地整体并入本文。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。