用于治疗广泛期小细胞肺癌(es-sclc)的组合物和方法
技术领域
1.本发明总体上涉及基于使用度伐鲁单抗(durvalumab)与铂-依托泊苷的组合来治疗广泛期sclc患者的方法。
背景技术:
2.肺癌是男性和女性癌症死亡的主要原因,约占所有癌症死亡的五分之一。肺癌大致可分为非小细胞肺癌(nsclc)和小细胞肺癌(sclc),后者占所有确诊肺癌的13%-17%并且其特征在于快速增殖、高生长率和较早发生广泛转移(oronsky等人what
′
s new in sclc?a review[sclc的新发现?综述].neoplasia[瘤形成]2017;19(10):842-847;wang等人survival changes in patients with small cell lung cancer and disparities between different sexes,socioeconomic statuses and ages[小细胞肺癌患者的生存变化以及不同性别、社会经济状况和年龄之间的差异].sci rep[科学报告]2017;7:1339)。确诊后5年内,不到7%的sclc患者存活(byers等人small cell lung cancer:where do we go from here?[小细胞肺癌:我们该何去何从?]cancer[癌症]2015 1;121(5):664-72;wang等人,2017)。肿瘤已广泛扩散至肺部或人体其他部位的广泛期sclc(es-sclc)约占所有sclc病例的三分之二(oronsky等人,2017)。预后非常差,因为所有sclc患者中只有6%在诊断后5年仍可存活。
[0003]
三十多年来,es-sclc的标准护理(一线治疗)由4-6个周期的依托泊苷加顺铂或卡铂(ep)之一组成,替代方案有限(pietanza等人small cell lung cancer:will recent progress lead to improved outcomes?[小细胞肺癌:近期进展会导致改善的结果吗?]clin cancer res[临床癌症研究]2015;21:2244-55;fr
ü
h等人small-cell lung cancer(sclc):esmo clinical practice guidelines for diagnosis,treatment and follow-up[小细胞肺癌(sclc):esmo的诊断、治疗和随访临床实践指南].ann oncol[肿瘤学年鉴]2013;24(增刊6):vi99-105;rudin等人treatment of small-cell lung cancer:american society of clinical oncology endorsement of the american college of chest physicians guideline[小细胞肺癌的治疗:美国临床医师学会认可的美国胸科医师学会指南].j clin oncol[临床肿瘤学杂志]2015 8;33(34):4106-11;japan lung cancer society:lung cancer practice guidelines 2018 version iii[日本肺癌学会:肺癌实践指南2018年第iii版].small cell lung cancer(sclc)[小细胞肺癌(sclc)])。尽管接受ep治疗的患者的初次缓解高达78%(farago等人current standards for clinical management of small cell lung cancer[小细胞肺癌临床管理的现行标准].transl lung cancer res[转化性肺癌研究]2018;7(1):69-79;fukuoka等人randomized trial of cyclophosphamide,doxorubicin,and vincristine versus cisplatin and etoposide versus alternation of these regimens in small-cell lung cancer[小细胞肺癌中环磷酰胺、阿霉素和长春新碱对比顺铂、依托泊苷对比这些方案的替代方案的随机试验].j natl cancer inst[美国国家癌症研究所杂志]1991;9;83(12):855-61),但大多数患者在
完成初始治疗后的6个月内复发,并且中位总生存期(os)约为10个月(farago等人,2018;rossi等人carboplatin-or cisplatin-based chemotherapy in first-line treatment of small-cell lung cancer:the cocis meta-analysis of individual patient data[基于卡铂或顺铂的一线治疗小细胞肺癌的化学疗法:个体患者数据的cocis荟萃分析].j clin oncol[临床肿瘤学杂志].2012;30:1692-98;pietanza等人,2015)。在日本以外的地区,目前在二线治疗中采用的标准护理是拓扑替康(fr
ü
h等人,2013;rudin等人,2015),这与不良结果相关(铂类难治性疾病患者的缓解率为5%且一年生存率为9%)(horita等人topotecan for relapsed small-cell lung cancer:systematic review and meta-analysis of 1347 patients[拓扑替康用于复发性小细胞肺癌:1347名患者的系统评价和荟萃分析].sci rep[科学报告]2015;5:15437),强调了对改善一线疗法的显著未满足需求。
[0004]
最近,靶向程序性细胞死亡1(pd-1)和程序性细胞死亡配体1(pd-l1)途径的免疫疗法(包括作为一线治疗)已证明对es-sclc患者具有临床活性(horn等人first-line atezolizumab plus chemotherapy in extensive-stage small-cell lung cancer[广泛期小细胞肺癌中一线阿特珠单抗联合化学疗法].n engl j med[新英格兰医学杂志]2018;379:2220-9)。度伐鲁单抗,一种选择性、高亲和力的人igg1单克隆抗体,可阻断pd-l1与pd-1和cd80的结合(stewart等人identification and characterization of durvalumab,an antagonistic anti-pd-l1 monoclonal antibody[拮抗性抗pd-l1单克隆抗体度伐鲁单抗的鉴定与表征].cancer immunol res[癌症免疫学研究]2015;3:1052-62),适用于治疗铂基放化疗后不可切除的iii期非小细胞肺癌患者(antonia等人durvalumab after chemoradiotherapy in stage iii non-small-cell lung cancer[iii期非小细胞肺癌放化疗后用度伐鲁单抗].n engl j med[新英格兰医学杂志]2017;377:1919-1929;antonia等人overall survival with durvalumab after chemoradiotherapy in stage iii nsclc[iii期nsclc放化疗后用度伐鲁单抗的总生存期].n engl j med[新英格兰医学杂志]2018;379:2342-2350)。在早期临床试验中,度伐鲁单抗作为单一疗法以及与抗细胞毒性t淋巴细胞相关抗原4(ctla-4)抗体曲美木单抗组合使用都在经预治疗的es-sclc患者(包括患有复发性或难治性疾病的患者)中显示出持久的临床活性和可控的安全性特征(cho等人safety and clinical activity of durvalumab in combination with tremelimumab in extensive disease small-cell lung cancer[度伐鲁单抗与曲美木单抗组合治疗广泛疾病小细胞肺癌的安全性和临床活性].j clin oncol[临床肿瘤学杂志]2018;36(15_增刊;摘要8517);goldman等人safety and antitumor activity of durvalumab monotherapy in patients with pretreated extensive disease small-cell lung cancer[度伐鲁单抗单一疗法对经预治疗的广泛疾病小细胞肺癌患者的安全性和抗肿瘤活性].j clin oncol[临床肿瘤学杂志]2018;36(15_增刊;摘要8518);bondarenko等人preliminary efficacy of durvalumab plus tremelimumab in platinum-refractory/resistant extensive disease-small cell lung cancer from cohort a of the phase 2 baltic study[baltic 2期研究组群a的度伐鲁单抗加曲美木单抗在铂类难治性/耐药性广泛疾病-小细胞肺癌中的初步疗效].ann oncol[肿瘤学年鉴]2018;29(增刊_8):viii596-viii602(摘要1665pd))。
[0005]
为了解决对改善一线疗法的显著未满足需求,本披露内容提供了包括将度伐鲁单抗(联合曲美木单抗或不联合曲美木单抗)与ep组合施用以对es-sclc患者进行一线治疗的方法。如本文披露的,这些方法为es-sclc患者的一线治疗提供了显著且出乎意料的进展。
技术实现要素:
[0006]
本披露内容总体上涉及作为一线疗法治疗患者的广泛期小细胞肺癌(es-sclc)的方法,其中这些方法包括将抑制pd1/pd-l1活性的抗体与依托泊苷和铂基治疗剂(platinum-based therapeutic agent)组合施用,以及任选地施用抑制ctla-4的抗体。
[0007]
在第一方面,本披露内容提供了延长患有广泛期小细胞肺癌(es-sclc)的患者的无进展生存期(pfs)的方法,该方法包括用a)人抗pd-l1抗体以及b)依托泊苷和铂基治疗剂(ep)治疗该患者。在该第一方面的一个实施例中,铂基治疗剂包含顺铂和/或卡铂。在该第一方面的另一个实施例中,人抗pd-l1抗体包含:含有seq id no:1的氨基酸序列的轻链可变结构域和含有seq id no:2的氨基酸序列的重链可变结构域。在该第一方面的一个实施例中,人抗pd-l1抗体包含具有seq id no:3的氨基酸序列的vh cdr1;和具有seq id no:4的氨基酸序列的vh cdr2;和具有seq id no:5的氨基酸序列的vh cdr3;和具有seq id no:6的氨基酸序列的vl cdr1;和具有seq id no:7的氨基酸序列的vl cdr2;和具有seq id no:8的氨基酸序列的vl cdr3。在该第一方面的一个实施例中,人抗pd-l1抗体为度伐鲁单抗、阿维鲁单抗(avelumab)、或阿特珠单抗。在该第一方面的另一个实施例中,人抗pd-l1抗体按照q3w以1500mg的固定剂量静脉内施用。在该第一方面的另一个实施例中,人抗pd-l1抗体按照q3w以20mg/kg的剂量静脉内施用。在该第一方面的另一个实施例中,方法包括施用4个周期的人抗pd-l1抗体。在该第一方面的一个实施例中,每个剂量的人抗pd-l1抗体静脉内施用ep的剂量为80-100mg/m2的依托泊苷和曲线下面积5-6mg/ml/min的卡铂或75-80mg/m2的顺铂。
[0008]
在该第一方面的一个实施例中,方法进一步包括在完成q3w的4个周期后,按照q4w静脉内施用1500mg人抗pd-l1抗体。
[0009]
在该第一方面的一个实施例中,方法进一步包括按照q3w静脉内施用人抗ctla-4抗体。在一个实施例中,人抗ctla-4抗体为曲美木单抗。在另一个实施例中,以75mg的固定剂量或以1mg/kg的剂量施用曲美木单抗。
[0010]
在该第一方面的一个实施例或其其他实施例中,方法进一步包括向患者施用预防性头颅照射。
[0011]
在该第一方面的一个实施例或其其他实施例中,方法进一步包括用人抗pd-1抗体治疗患者。在一个实施例中,人抗pd-1抗体包含派姆单抗或纳武单抗
[0012]
在该第一方面的另一个实施例中,与单独使用ep治疗相比,pfs增加了至少约五个月。
[0013]
在第二方面,本披露内容提供了延长患有广泛期小细胞肺癌(es-sclc)的患者的总生存期(os)的方法,该方法包括用a)人抗pd-l1抗体以及b)依托泊苷和铂基治疗剂(ep)治疗该患者。在该第二方面的一个实施例中,铂基治疗剂包含顺铂和/或卡铂。在该第二方
面的另一个实施例中,人抗pd-l1抗体包含:含有seq id no:1的氨基酸序列的轻链可变结构域和含有seq id no:2的氨基酸序列的重链可变结构域。在该第二方面的一个实施例中,人抗pd-l1抗体包含具有seq id no:3的氨基酸序列的vh cdr1;和具有seq id no:4的氨基酸序列的vh cdr2;和具有seq id no:5的氨基酸序列的vh cdr3;和具有seq id no:6的氨基酸序列的vl cdr1;和具有seq id no:7的氨基酸序列的vl cdr2;和具有seq id no:8的氨基酸序列的vl cdr3。在该第二方面的一个实施例中,人抗pd-l1抗体为度伐鲁单抗、阿维鲁单抗、或阿特珠单抗。在该第二方面的另一个实施例中,人抗pd-l1抗体按照q3w以1500mg的固定剂量静脉内施用。在该第二方面的另一个实施例中,人抗pd-l1抗体按照q3w以20mg/kg的剂量静脉内施用。在该第二方面的另一个实施例中,方法包括施用4个周期的人抗pd-l1抗体。在该第二方面的一个实施例中,每个剂量的人抗pd-l1抗体静脉内施用ep的剂量为80-100mg/m2的依托泊苷和曲线下面积5-6mg/ml/min的卡铂或75-80mg/m2的顺铂。
[0014]
在该第二方面的一个实施例中,方法进一步包括在完成q3w的4个周期后,按照q4w静脉内施用1500mg人抗pd-l1抗体。
[0015]
在该第二方面的一个实施例中,方法进一步包括按照q3w静脉内施用人抗ctla-4抗体。在一个实施例中,人抗ctla-4抗体为曲美木单抗。在另一个实施例中,以75mg的固定剂量或以1mg/kg的剂量施用曲美木单抗。
[0016]
在该第二方面的一个实施例或其其他实施例中,方法进一步包括向患者施用预防性头颅照射。
[0017]
在该第二方面的一个实施例或其其他实施例中,方法进一步包括用人抗pd-1抗体治疗患者。在一个实施例中,人抗pd-1抗体包含派姆单抗或纳武单抗
[0018]
在该第二方面的另一个实施例中,与单独使用ep治疗相比,os延长了至少约三个月。
[0019]
在第三方面,本披露内容提供了改善患有广泛期小细胞肺癌(es-sclc)的患者的总体缓解率(orr)的方法,该方法包括用a)人抗pd-l1抗体以及b)依托泊苷和铂基治疗剂(ep)治疗该患者。在该第三方面的一个实施例中,铂基治疗剂包含顺铂和/或卡铂。在该第三方面的另一个实施例中,人抗pd-l1抗体包含:含有seq id no:1的氨基酸序列的轻链可变结构域和含有seq id no:2的氨基酸序列的重链可变结构域。在该第三方面的一个实施例中,人抗pd-l1抗体包含具有seq id no:3的氨基酸序列的vh cdr1;和具有seq id no:4的氨基酸序列的vh cdr2;和具有seq id no:5的氨基酸序列的vh cdr3;和具有seq id no:6的氨基酸序列的vl cdr1;和具有seq id no:7的氨基酸序列的vl cdr2;和具有seq id no:8的氨基酸序列的vl cdr3。在该第三方面的一个实施例中,人抗pd-l1抗体为度伐鲁单抗、阿维鲁单抗、或阿特珠单抗。在该第三方面的另一个实施例中,人抗pd-l1抗体按照q3w以1500mg的固定剂量静脉内施用。在该第三方面的另一个实施例中,人抗pd-l1抗体按照q3w以20mg/kg的剂量静脉内施用。在该第三方面的另一个实施例中,方法包括施用4个周期的人抗pd-l1抗体。在该第三方面的一个实施例中,每个剂量的人抗pd-l1抗体静脉内施用ep的剂量为80-100mg/m2的依托泊苷和曲线下面积5-6mg/ml/min的卡铂或75-80mg/m2的顺铂。
[0020]
在该第三方面的一个实施例中,方法进一步包括在完成q3w的4个周期后,按照q4w静脉内施用1500mg人抗pd-l1抗体。
[0021]
在该第三方面的一个实施例中,方法进一步包括按照q3w静脉内施用人抗ctla-4抗体。在一个实施例中,人抗ctla-4抗体为曲美木单抗。在另一个实施例中,以75mg的固定剂量或以1mg/kg的剂量施用曲美木单抗。
[0022]
在该第三方面的一个实施例或其其他实施例中,方法进一步包括向患者施用预防性头颅照射。
[0023]
在该第三方面的一个实施例或其其他实施例中,方法进一步包括用人抗pd-1抗体治疗患者。在一个实施例中,人抗pd-1抗体包含派姆单抗或纳武单抗
[0024]
在该第三方面的另一个实施例中,与单独使用ep治疗相比,orr增加了至少10%。
[0025]
在第四方面,本披露内容提供了在有需要的患者中治疗es-sclc的方法,该方法包括向该患者施用度伐鲁单抗和ep以及任选地向该患者施用曲美木单抗,其中该度伐鲁单抗和ep作为一线治疗施用。
[0026]
在前述方面或其实施例中的任一个的一些实施例中,患者可以表达与对包含人抗pd-1抗体的疗法的治疗响应相关的基因(即,具有表型)。在一些方面,患者是pd-l1( )。在其他方面,患者是pd-l1(-)。在一些方面,患者是egfr突变型( )。在其他方面,患者是egfr突变型(-)或野生型。在一些方面,患者可以表达pd-l1和egfr突变型表型的任何组合。
[0027]
本披露内容提供的其他特征、方面、实施例和优点将从下文的具体实施方式中变得清楚。
附图说明
[0028]
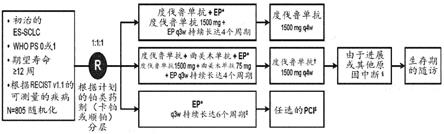
图1示出了本披露内容的研究设计。*ep由80-100mg/m2的依托泊苷、以及auc 5-6的卡铂或75-80mg/m2的顺铂之一组成。者在ep后接受了另一剂量的曲美木单抗。者可以在对照组中接受2个周期的ep(总共长达6个周期),以及接受pci。
§
患者继续治疗,直到确认疾病进展、不可接受的毒性、新pns证据或现有pns恶化、怀孕或打算怀孕、开始替代性抗癌疗法(包括另一种研究药剂)、不依从或撤回同意书。在具有根据recist v1.1的(未确认的和确认的)疾病进展的所有组中的患者将继续从其分配到的治疗中受益,并且只要在进行性疾病的治疗中符合治疗标准的患者被判断可以获得临床益处,这些患者就可以继续接受其分配到的治疗。这包括ep;然而,ep对于免疫疗法组的患者而言限制为最多4个周期,而对于对照组的患者而言限制为最多6个周期。auc,曲线下面积;ct,化学疗法;es-sclc,广泛期小细胞肺癌;ep,铂-依托泊苷;pci,预防性头颅照射;pd,进行性疾病;pns,副肿瘤综合征;ps,行为状态;q3w,每3周一次;q4w,每4周一次;recist,实体瘤缓解评估标准;who,世界卫生组织。
[0029]
图2示出了具有把关策略的分级多重测试程序,该策略用于在本披露内容中以两侧5%显著水平来控制i型错误。使用具有α穷举性再循环策略的多重测试程序来测试假设(burman等人a recycling framework for the construction of bonferroni-based multiple tests[用于构建基于邦费罗尼的多重测试的再循环框架].stat med[医学统计
学]2009;28:739-61)。该策略用于测试os的两个主要分析和pfs的两个次要分析。因此,只有在两个os主要分析均达到显著性的情况下,才可以在多重测试程序中对pfs进行测试。总体5%α在主要端点之间分配:4%的α水平用于分析度伐鲁单抗加ep对比ep的os,1%的α水平用于分析度伐鲁单抗加曲美木单抗加ep对比ep的os。ep,铂-依托泊苷;h,假设;itt,意向治疗;os,总生存期;pfs,无进展生存期。
[0030]
图3示出了意向治疗群体的总生存期。(3a)度伐鲁单抗加曲美木单抗加ep对比ep的卡普兰-迈耶(kaplan-meier)图;(3b)度伐鲁单抗加ep对比ep的卡普兰-迈耶图;(3c)度伐鲁单抗加ep对比ep的亚组分析。ci,置信区间;ep,铂-依托泊苷;os,总生存期;pfs,无进展生存期。
[0031]
图4示出了意向治疗群体的无进展生存期和缓解持续时间。(4a)度伐鲁单抗加曲美木单抗加ep对比ep的无进展生存期的卡普兰-迈耶图;(4b)度伐鲁单抗加ep对比ep的无进展生存期的卡普兰-迈耶图;(4c)度伐鲁单抗加曲美木单抗加ep对比ep的缓解持续时间的卡普兰-迈耶图;(4d)度伐鲁单抗加ep对比ep的缓解持续时间的卡普兰-迈耶图。
[0032]
图5示出了靶病灶大小相比基线的最佳百分比变化。(5a)度伐鲁单抗加曲美木单抗加ep对比ep;(5b)度伐鲁单抗加ep对比ep。
[0033]
图6示出了确认的客观缓解。图6示出了根据recist v1.1的总体缓解率。图6b示出了缓解持续时间(dor)。or,优势比。d ep,度伐鲁单抗和ep(依托泊苷和卡铂或顺铂)。
具体实施方式
[0034]
除非另外定义,本文使用的所有技术和科学术语具有本发明所属领域的技术人员通常理解的含义。
[0035]
以下的参考文献为技术人员提供了本发明所用的多个术语的通用定义:singleton等人,dictionary of microbiology and molecular biology[微生物学和分子生物学词典](第2版,1994);the cambridge dictionary of science and technology[剑桥科学与技术词典](walker编辑,1988);the glossary of genetics[遗传学词汇],第5版,rieger等人(编辑),springer verlag[施普林格出版社](1991);以及hale与marham,the harper collins dictionary of biology[哈珀柯林斯生物学词典](1991)。除非另外指明,否则如本文所用的以下术语具有以下赋予它们的含义。
[0036]
在本披露内容中,“包含(comprises、comprising)”、“含有(containing)”和“具有(having)”等可以具有美国专利法赋予它们的意义并且可以意指“包括(includes、including)”等。术语“基本上由......组成(consisting essentially of或consists essentially)”同样具有美国专利法赋予的含义并且该术语是开放性的,允许超出所叙述的存在,只要所叙述的基本或新颖特征不被超过叙述的存在改变,但是排除现有技术方面。
[0037]
除非明确声明或从上下文显而易见,如本文所用的,术语“或”被理解为包括在内。除非明确规定或从上下文显而易见,否则如本文所用的,术语“一个、一种(a、an)”和“该(the)”被理解为单数的或复数的。
[0038]
除非明确声明或从上下文显而易见,否则如本文所用的术语“约(about)”被理解为在本领域的正常公差范围内,例如,在平均数的2个标准偏差之内。术语“约”可以被理解为在声明值的10%、9%、8%、7%、6%、5%、4%、3%、2%、1%、0.5%、0.1%、0.05%、或
0.01%之内。除非从上下文显而易见,本文提供的所有数值被该术语约修饰。
[0039]
在本文中在变量的任何定义中对化学基团清单的叙述包括将该变量定义为任何单个基团或所列基团的组合。在本文中对变量或方面的方面的叙述包括作为任何单个方面或与任何其他方面或其部分组合的方面。
[0040]
可以将本文提供的任何组合物或方法与本文提供的任何其他组合物和方法中的一种或多种进行组合。
[0041]
本文提供的范围被理解为对该范围内的所有值的简写。例如,1到50的范围应当理解为包括来自下组的任何数字、数字的组合或子范围,该组由以下组成:1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、和50。
[0042]“抗pd-l1抗体”意指选择性结合pd-l1多肽的抗体或其抗原结合片段。示例性抗pd-l1抗体描述于例如美国专利号8,779,108和9,493,565,将其通过引用并入本文。在一些方面,度伐鲁单抗、阿维鲁单抗和阿特珠单抗是示例性pd-l1抗体。在另外方面,度伐鲁单抗是示例性pd-l1抗体。
[0043]
如本文所用,术语“度伐鲁单抗”是指选择性结合pd-l1并阻断pd-l1与pd-1和cd80受体结合的抗体,如在美国专利号9,493,565(称为“2.14h9opt”)中披露的,将其通过引用以其全文并入本文。度伐鲁单抗的片段可结晶(fc)结构域在igg1重链的恒定结构域中含有三重突变,该三重突变减少与负责介导抗体依赖性细胞介导的细胞毒性(adcc)的补体组分c1q和fcγ受体的结合。度伐鲁单抗可以在体外解除pd-l1介导的对人t细胞活化的抑制,并且经由t细胞依赖性机制在异种移植模型中抑制肿瘤生长。
[0044]
通过“抗pd-1抗体”意指选择性结合pd-1多肽的抗体或其抗原结合片段。在一些方面,纳武单抗或派姆单抗是示例性pd-1抗体。
[0045]
如本文所用,术语“曲美木单抗”是指选择性结合ctla-4多肽的抗体,如在美国专利号8,491,895(称为克隆11.2.1)中披露的,将其通过引用以其全文并入本文。曲美木单抗对人ctla-4特异,并且与相关的人蛋白质无交叉反应性。曲美木单抗阻断ctla-4的抑制作用,因此增强t细胞活化。曲美木单抗显示与fc受体的特异性结合最小,不诱导自然杀伤(nk)抗体依赖性细胞介导的细胞毒性(adcc)活性,并且在板结合聚集后不传递抑制信号。
[0046]“完全缓解”(cr)是指所有病灶(无论是可测量的或不可测量的)消失,并且没有新的病灶。可以使用自第一次记载日期起不小于四周的重复连续评估来获得确认。新的不可测量的病灶排除cr。
[0047]“部分缓解”(pr)是指相对于基线,肿瘤负荷减小250%。可使用自第一次记载日期起至少4周的连续重复评定来获得确认。
[0048]“进行性疾病”(pd)是指相对于所记录的最小值(最低点),肿瘤负荷增加225%。可以通过自第一次记载日期起至少4周的连续重复评估来获得确认。新的不可测量的病灶没有定义pd。
[0049]“稳定疾病”(sd)是指不满足cr、pr或pd的标准。sd是指相对于基线无法建立50%的肿瘤负荷的减小,并且无法建立与最低点相比25%的增加。
[0050]
如本文所指,“pd-l1”可以指与pd-l1序列具有至少约85%、95%或100%序列同一性的多肽或多核苷酸序列或其片段。pd-l1在本领域中也称为b7-h1。在一些方面,pd-l1多
肽或其片段与ncbi登录号np_001254635具有至少约85%、95%或100%序列同一性,并且具有pd-1和cd80结合活性。
[0051]
pd-l1多肽序列(ncbi登录号np_001254635;seq id no:9):
[0052][0053]
在一些方面,“pd-l1核酸分子”包含编码pd-l1多肽的多核苷酸。示例性pd-l1核酸分子序列以ncbi登录号nm_001267706提供。
[0054]
pd-l1核酸序列(ncbi登录号nm_001267706 mrna;seq id no:10):
[0055]
complex between programmed death-1(pd-1)and its ligand pd-l2[程序性死亡1(pd-1)及其配体pd-l2之间的复合物的晶体结构],”proc.natl.acad.sci.(usa)[美国国家科学院院刊]105(30):10483-10488)。经由pd-l1的过表达在许多肿瘤中利用该过程,导致免疫应答受到抑制。
[0058]
pd-1是肿瘤学中免疫介导疗法的充分验证的靶标,其中临床试验在治疗黑色素瘤和非小细胞肺癌(nsclc)等其他方面具有阳性。拮抗性抑制pd-1/pd-l1相互作用增加t细胞活化,从而增强宿主免疫系统对肿瘤细胞的识别和消除。已经提出使用抗pd-1抗体来治疗感染和肿瘤并上调适应性免疫应答。
[0059]
如在本披露内容中所用的,术语“抗体”是指免疫球蛋白或其片段或衍生物,并且涵盖包含抗原结合位点的任何多肽,无论它是在体外或在体内产生的。该术语包括但不限于:多克隆、单克隆、单特异性、多特异性、非特异性、人源化、单链、嵌合、合成、重组、杂交、突变、以及移植抗体。除非用术语“完整”另外修饰,如在“完整抗体”中,出于本披露内容的目的,术语“抗体”还包括抗体片段例如fab、f(ab
′
)2、fv、scfv、fd、dab以及保留抗原结合功能(例如,特异性结合pd-l1的能力)的其他抗体片段。通常,此类片段将包含抗原结合结构域。
[0060]
术语“抗原结合结构域”、“抗原结合片段”和“结合片段”是指抗体分子的包含负责抗体和抗原之间特异性结合的氨基酸的一部分。例如,在抗原很大的情况下,抗原结合结构域可只结合抗原的一部分。抗原分子的负责与抗原结合结构域特异性相互作用的一部分被称为“表位”或“抗原决定簇”。抗原结合结构域通常包含抗体轻链可变区(vl)和抗体重链可变区(vh);但是,其不一定必须包含两者。例如,所谓的fd抗体片段仅由vh结构域组成,但是仍然保留完整抗体的一些抗原结合功能。
[0061]
抗体的结合片段通过重组dna技术或通过完整抗体的酶促或化学裂解来产生。结合片段包括fab、fab
′
、f(ab
′
)2、fv以及单链抗体。除了“双特异性”或“双功能”抗体以外,抗体应理解为其每个结合位点是相同的。使用酶(木瓜蛋白酶)来消化抗体的结果是两个同一的抗原结合片段,又称为“fab”片段和“fc”片段,它们不具有抗原结合活性但具有结晶的能力。用酶(胃蛋白酶)来消化抗体的结果是f(ab
′
)2片段,其中该抗体分子的两个臂保持连接并且包含两个抗原结合位点。f(ab
′
)2片段具有交联抗原的能力。当本文使用时,“fv”是指保留了抗原识别和抗原结合位点两者的抗体的最小片段。当本文使用时,“fab”是指抗体的包含轻链的恒定结构域和重链的chi结构域的片段。
[0062]
术语“mab”是指单克隆抗体。本发明的抗体包含但不限于全天然抗体、双特异性抗体;嵌合抗体;fab、fab
′
、单链v区片段(scfv)、融合多肽以及非常规抗体。
[0063]
术语“分离的”、“纯化的”或“生物学上纯的”是指在不同程度上不含在其天然状态下发现的通常伴随其的组分的材料。“分离”表示与初始来源或环境的分开程度。“纯化”表示高于分离的分开程度。“纯化的”或“生物上纯的”蛋白质充分不含其他材料,这样使得任何杂质不实质上影响蛋白质的生物特性或导致其他不利后果。
[0064]“特异性结合”意指识别并结合一种分子(例如,多肽),但是基本上不识别和不结合样品(例如,生物样品)中的其他分子的化合物(例如,抗体)。例如,特异性结合的两个分子形成在生理条件下相对稳定的复合物。特异性结合的特征在于区别于非特异性结合的高亲和力和低等至中等容量,非特异性结合通常具有低亲和力以及中等至高等容量。通常,当
亲和力常数ka高于10
6 m-1
,或更优选地高于108m-1
时,结合被认为是特异的。如果需要的话,可以通过改变结合条件来减少非特异性结合,基本上不影响特异性结合。如抗体浓度、溶液的离子强度、温度、允许结合的时间、封闭剂(例如,血清白蛋白、乳酪蛋白)的浓度等适当的结合条件,可被熟练的技术人员使用常规技术来优化。
[0065]
如本文通常所用的,术语“治疗(treat、treating、treatment等)”是指减少、改善或减缓障碍或疾病的进展和/或与障碍或疾病相关的症状。将被理解的是,尽管不能排除,但是治疗障碍、疾病或病症并不要求完全地消除该障碍、疾病或病症或与其相关的症状。在特定方面和与nsclc有关的方面中,“治疗(treat、treating、treatment)”可以指实现主要或次要临床终点中的任一个或组合。
[0066]
序列
[0067]
度伐鲁单抗轻链可变区氨基酸序列提供为seq id no:1。
[0068]
度伐鲁单抗重链可变区氨基酸序列提供为seq id no:2。
[0069]
度伐鲁单抗的cdr1、cdr2和cdr3重链可变区氨基酸序列提供为seq id no:3(cdr1)、seq id no:4(cdr2)、和seq id no:5(cdr3)。
[0070]
度伐鲁单抗的cdr1、cdr2和cdr3轻链可变区氨基酸序列提供为seq id no:6(cdr1)、seq id no:7(cdr2)、和seq id no:8(cdr3)。
[0071]
本披露内容涉及治疗患有广泛期小细胞肺癌(es-sclc)的患者的方法,这些方法包括将人抗pd-l1抗体与依托泊苷和铂基治疗剂组合施用至该患者。此外,该方法还可包括施用人抗ctla-4抗体。特别地,从本文披露的临床结果得到的数据提供了改善的治疗方法,并大体上重新定义了es-sclc的现有护理标准(一线治疗)。所披露的治疗方法可以明显改善患者的总生存期(os)、无进展生存期(pfs)、总体缓解率(orr)、缓解持续时间(dor)、或死亡时间。
[0072]
因此,在本文所述的各个方面,所披露的方法提供了用于治疗es-sclc患者的新的一线治疗选择。
[0073]
在第一方面,本披露内容提供了延长患有广泛期小细胞肺癌(es-sclc)的患者的无进展生存期(pfs)的方法,该方法包括用a)人抗pd-l1抗体以及b)依托泊苷和铂基治疗剂(ep)治疗该患者。在该第一方面的一个实施例中,铂基治疗剂包含顺铂和/或卡铂。在该第一方面的另一个实施例中,人抗pd-l1抗体包含:含有seq id no:1的氨基酸序列的轻链可变结构域和含有seq id no:2的氨基酸序列的重链可变结构域。在该第一方面的一个实施例中,人抗pd-l1抗体包含具有seq id no:3的氨基酸序列的vh cdr1;和具有seq id no:4的氨基酸序列的vh cdr2;和具有seq id no:5的氨基酸序列的vh cdr3;和具有seq id no:6的氨基酸序列的vl cdr1;和具有seq id no:7的氨基酸序列的vl cdr2;和具有seq id no:8的氨基酸序列的vl cdr3。在该第一方面的一个实施例中,人抗pd-l1抗体为度伐鲁单抗、阿维鲁单抗(avelumab)、或阿特珠单抗。在该第一方面的另一个实施例中,人抗pd-l1抗体按照q3w以1500mg的固定剂量静脉内施用。在该第一方面的另一个实施例中,人抗pd-l1抗体按照q3w以20mg/kg的剂量静脉内施用。在该第一方面的另一个实施例中,方法包括施用4个周期的人抗pd-l1抗体。在该第一方面的一个实施例中,每个剂量的人抗pd-l1抗体静脉内施用ep的剂量为80-100mg/m2的依托泊苷和曲线下面积5-6mg/ml/min的卡铂或75-80mg/m2的顺铂。
[0074]
在该第一方面的一个实施例中,方法进一步包括在完成q3w的4个周期后,按照q4w静脉内施用1500mg人抗pd-l1抗体。
[0075]
在该第一方面的一个实施例中,方法进一步包括按照q3w静脉内施用人抗ctla-4抗体。在一个实施例中,人抗ctla-4抗体为曲美木单抗。在另一个实施例中,以75mg的固定剂量或以1mg/kg的剂量施用曲美木单抗。
[0076]
在该第一方面的一个实施例或其其他实施例中,方法进一步包括向患者施用预防性头颅照射。
[0077]
在该第一方面的一个实施例或其其他实施例中,方法进一步包括用人抗pd-1抗体治疗患者。在一个实施例中,人抗pd-1抗体包含派姆单抗或纳武单抗
[0078]
在该第一方面的另一个实施例中,与单独使用ep治疗相比,pfs增加了至少约五个月。
[0079]
在第二方面,本披露内容提供了延长患有广泛期小细胞肺癌(es-sclc)的患者的总生存期(os)的方法,该方法包括用a)人抗pd-l1抗体以及b)依托泊苷和铂基治疗剂(ep)治疗该患者。在该第二方面的一个实施例中,铂基治疗剂包含顺铂和/或卡铂。在该第二方面的另一个实施例中,人抗pd-l1抗体包含:含有seq id no:1的氨基酸序列的轻链可变结构域和含有seq id no:2的氨基酸序列的重链可变结构域。在该第二方面的一个实施例中,人抗pd-l1抗体包含具有seq id no:3的氨基酸序列的vh cdr1;和具有seq id no:4的氨基酸序列的vh cdr2;和具有seq id no:5的氨基酸序列的vh cdr3;和具有seq id no:6的氨基酸序列的vl cdrl;和具有seq id no:7的氨基酸序列的vl cdr2;和具有seq id no:8的氨基酸序列的vl cdr3。在该第二方面的一个实施例中,人抗pd-l1抗体为度伐鲁单抗、阿维鲁单抗、或阿特珠单抗。在该第二方面的另一个实施例中,人抗pd-l1抗体按照q3w以1500mg的固定剂量静脉内施用。在该第二方面的另一个实施例中,人抗pd-l1抗体按照q3w以20mg/kg的剂量静脉内施用。在该第二方面的另一个实施例中,方法包括施用4个周期的人抗pd-l1抗体。在该第二方面的一个实施例中,每个剂量的人抗pd-l1抗体静脉内施用ep的剂量为80-100mg/m2的依托泊苷和曲线下面积5-6mg/ml/min的卡铂或75-80mg/m2的顺铂。
[0080]
在该第二方面的一个实施例中,方法进一步包括在完成q3w的4个周期后,按照q4w静脉内施用1500mg人抗pd-l1抗体。
[0081]
在该第二方面的一个实施例中,方法进一步包括按照q3w静脉内施用人抗ctla-4抗体。在一个实施例中,人抗ctla-4抗体为曲美木单抗。在另一个实施例中,以75mg的固定剂量或以1mg/kg的剂量施用曲美木单抗。
[0082]
在该第二方面的一个实施例或其其他实施例中,方法进一步包括向患者施用预防性头颅照射。
[0083]
在该第二方面的一个实施例或其其他实施例中,方法进一步包括用人抗pd-1抗体治疗患者。在一个实施例中,人抗pd-1抗体包含派姆单抗或纳武单抗
[0084]
在该第二方面的另一个实施例中,与单独使用ep治疗相比,os延长了至少约三个
月。
[0085]
在第三方面,本披露内容提供了改善患有广泛期小细胞肺癌(es-sclc)的患者的总体缓解率(orr)的方法,该方法包括用a)人抗pd-l1抗体以及b)依托泊苷和铂基治疗剂(ep)治疗该患者。在该第三方面的一个实施例中,铂基治疗剂包含顺铂和/或卡铂。在该第三方面的另一个实施例中,人抗pd-l1抗体包含:含有seq id no:1的氨基酸序列的轻链可变结构域和含有seq id no:2的氨基酸序列的重链可变结构域。在该第三方面的一个实施例中,人抗pd-l1抗体包含具有seq id no:3的氨基酸序列的vh cdr1;和具有seq id no:4的氨基酸序列的vh cdr2;和具有seq id no:5的氨基酸序列的vh cdr3;和具有seq id no:6的氨基酸序列的vl cdr1;和具有seq id no:7的氨基酸序列的vl cdr2;和具有seq id no:8的氨基酸序列的vl cdr3。在该第三方面的一个实施例中,人抗pd-l1抗体为度伐鲁单抗、阿维鲁单抗、或阿特珠单抗。在该第三方面的另一个实施例中,人抗pd-l1抗体按照q3w以1500mg的固定剂量静脉内施用。在该第三方面的另一个实施例中,人抗pd-l1抗体按照q3w以20mg/kg的剂量静脉内施用。在该第三方面的另一个实施例中,方法包括施用4个周期的人抗pd-l1抗体。在该第三方面的一个实施例中,每个剂量的人抗pd-l1抗体静脉内施用ep的剂量为80-100mg/m2的依托泊苷和曲线下面积5-6mg/ml/min的卡铂或75-80mg/m2的顺铂。
[0086]
在该第三方面的一个实施例中,方法进一步包括在完成q3w的4个周期后,按照q4w静脉内施用1500mg人抗pd-l1抗体。
[0087]
在该第三方面的一个实施例中,方法进一步包括按照q3w静脉内施用人抗ctla-4抗体。在一个实施例中,人抗ctla-4抗体为曲美木单抗。在另一个实施例中,以75mg的固定剂量或以1mg/kg的剂量施用曲美木单抗。
[0088]
在该第三方面的一个实施例或其其他实施例中,方法进一步包括向患者施用预防性头颅照射。
[0089]
在该第三方面的一个实施例或其其他实施例中,方法进一步包括用人抗pd-1抗体治疗患者。在一个实施例中,人抗pd-1抗体包含派姆单抗或纳武单抗
[0090]
在该第三方面的另一个实施例中,与单独使用ep治疗相比,orr增加了至少10%。
[0091]
在第四方面,本披露内容提供了在有需要的患者中治疗es-sclc的方法,该方法包括向该患者施用度伐鲁单抗和ep以及任选地向该患者施用曲美木单抗,其中该度伐鲁单抗和ep作为一线治疗施用。
[0092]
在前述方面或其实施例中的任一个的一些实施例中,患者可以表达与对包含人抗pd-1抗体的疗法的治疗响应相关的基因(即,具有表型)。在一些方面,患者是pd-l1( )。在其他方面,患者是pd-l1(-)。在一些方面,患者是egfr突变型( )。在其他方面,患者是egfr突变型(-)或野生型。在一些方面,患者可以表达pd-l1和egfr突变型表型的任何组合。
[0093]
除上述方面外,本文披露的治疗可包括每2周、3周或4周一次以10mg/kg或20mg/kg的剂量静脉内施用抗pd-l1抗体或其抗原结合片段。
[0094]
除上述方面外,本文披露的治疗可包括每2周、3周或4周一次以200、250、500、1000、或1500mg的固定剂量静脉内施用抗pd-l1抗体或其抗原结合片段。
[0095]
在上述方面的方面中,患者可以表达与对包含人抗pd-l1抗体的疗法的治疗响应相关的基因(即,具有表型)。在一些方面,患者是pd-l1( )。在其他方面,患者是pd-l1(-)。如果样品含有25%或更多的具有pd-l1膜染色的肿瘤细胞,则样品被确定为“pd-l1阳性”。先前已经确定了度伐鲁单抗的截止值和评分算法(研究cp1 108;美国临床试验数据库编号nct01693562)。
[0096]
在一些方面,患者是egfr突变型( )。在其他方面,患者是egfr突变型(-)或野生型。在一些方面,患者可以表达pd-l1和egfr突变型表型的任何组合。
[0097]
除上述方面外,本文披露的治疗可包括大约每14天、每3周或每4周施用给定剂量的治疗剂(抗体和/或化学治疗剂)持续多达52周或更长时间。
[0098]
总生存期(os)与从治疗日期到(因任何原因导致的)死亡日期的时间段有关。os可以指一段时间(例如12个月、18个月、24个月等)内的总生存期。此类时间段可以被识别为例如“os24”,其是指根据24个月总生存期的卡普兰-迈耶估计,在治疗开始后24个月还存活的患者人数(%)。
[0099]
无进展生存期(pfs)与从治疗日期到客观疾病进展(recist 1.1)或(无进展情况下因任何原因导致的)死亡日期的时间段有关。在一些方面,方法提供了pfs的增加。在一些方面,方法提供了至少9个月至至少约24个月(例如,至少9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24个月或更长时间,且最长约5年)的pfs。
[0100]
缓解持续时间(dor)是指从首次记录的完全缓解(cr)或部分缓解(pr)日期到首次记录的根据recist 1.1的进展缓解或无进展情况下的死亡的时间。在方面,方法提供了dor增加至少约9个月至至少约36个月。
[0101]
客观缓解率(orr)是指至少一次访视完全缓解(cr)或部分缓解(pr)(根据recist 1.1)的患者数(%)。在方面,方法提供了dor增加至少约9个月至至少约36个月。
[0102]
所披露的方法包括将免疫治疗剂(例如,人抗pd-l1抗体或人抗pd-1抗体)与化学治疗剂(例如依托泊苷和铂基治疗剂,例如像顺铂和/或卡铂)组合施用。
[0103]
如上所提及的并且如本文所述,这些方法治疗患有es-sclc的患者。
[0104]
可以使用本领域通常已知和接受的任何测试来进行癌症分期。在某些方面,癌症分期可以包括美国癌症联合委员会(ajcc)的tnm系统。通常,tnm系统会提供各种测试和扫描结果,以确定原发性肿瘤(肿瘤(tumor),t)的大小和位置;确定癌症是否已经扩散到淋巴结,以及如果已经扩散到淋巴结,确定受影响的淋巴结(结(node),n)的位置和数量;和确定癌症是否已经扩散到身体的其他部位,以及如果已经扩散到身体的其他部位,确定远处癌的范围和位置(转移(metastasis),m)。尽管每种类型的癌症都有其特定系统,但tnm分期系统通常使用每个字母的量表分数。
[0105]
对于肿瘤,“t”与数字(例如0到4)相关联以描述肿瘤的总体大小、位置以及是否侵入附近组织。更大或更多的侵入性肿瘤的编号更高,根据癌症的不同,可以添加小写字母,例如“a”、“b”或“m”(表示多个)以提供更多细节。
[0106]
类似地,对于节,“n”与数字(例如,0至3)相关联以描述是否在淋巴结中发现了癌症,并且还可以指示含有癌症的淋巴结的数目。当癌症累及更多的淋巴结时,分配的数字更大。
[0107]
对于转移,“m”指示癌症是否已扩散到身体的其他部位,并标记为m0表示未扩散,
或标记为m1(如果扩散)。
[0108]
将t、n和m结果结合起来以确定癌症的时期,通常是以下四个时期之一:i期(一)至iv期(四)。一些癌症也具有0期(零)。0期描述保留在原始组织局部而没有扩散到附近组织的原位癌。这一时期的癌症经常是高度治愈的,通常可以通过手术切除整个肿瘤。i期或早期癌症通常用于描述尚未深入附近组织并且尚未扩散到淋巴结或身体其他部位的小的癌症或肿瘤。ii期和iii期描述了已深入生长到附近组织、并且可能已经扩散到淋巴结但未转移到其他组织的较大的癌症或肿瘤。iv期描述了已经扩散到身体其他器官或部位的癌症,并且通常被确定为晚期癌症或转移性癌症。
[0109]
分期可以包括对预后因素进行选择性分析,以提供恢复的机会和推荐的疗法。预后因素可以包括基于癌细胞的外观对癌症进行分级;肿瘤标记物表达分析;和肿瘤遗传学分析。
[0110]
tnm系统可用于sclc和nsclc两者,但sclc通常使用不同的系统进行分期。
[0111]
sclc的分期
[0112]
sclc分为两个时期:“局限期”和“广泛期”。局限期sclc指示癌症仅存在于一例胸部,并且可以用单个辐射野进行治疗。通常,局限期sclc包括仅存在于一个肺中并且可能已经到达胸部同一侧的淋巴结的癌症。例外情况是sclc中肿瘤扩散到整个单肺,使得癌症没有局限在足够小的区域,以便在一个“端口”中用放射疗法进行治疗。即使仅存在于一侧,此类癌症也被认为是广泛期癌症。
[0113]
sclc的第二期或“广泛期”sclc是肿瘤扩散到一个端口的放射疗法区域外的那些sclc癌症,如已广泛扩散到整个单肺、另一肺、胸部另一例的淋巴结、身体的其他部位、或肺周围的液体的癌症。
[0114]
抗pd-l1抗体
[0115]
特异性地结合且抑制pd-l1活性(例如,结合到pd-1和/或cd80)的抗体可用于本文披露的方法。
[0116]
度伐鲁单抗是示例性抗pd-l1抗体,其对pd-l1具有选择性并且阻断pd-l1与pd-1和cd80受体的结合。度伐鲁单抗可以在体外解除pd-l1介导的对人t细胞活化的抑制,并且经由t细胞依赖性机制在异种移植模型中抑制肿瘤生长。可用于所披露的方法中的其他药剂包括抑制pd-l1和/或pd-1的药剂,例如像人抗pd-l1抗体阿维鲁单抗和阿特珠单抗、或人抗pd-1抗体纳武单抗和派姆单抗。
[0117]
在某些方面,在本文披露的方法中使用的抗体是破坏pd-1/pd-l1轴的任何药剂。
[0118]
关于用于在本文提供的方法中使用的度伐鲁单抗(或其片段)的信息可以发现于美国专利号8,779,108和9,493,565,将其披露内容通过引用以其全文并入本文。度伐鲁单抗的片段可结晶(fc)结构域在igg1重链的恒定结构域中含有三重突变,该三重突变减少与负责介导抗体依赖性细胞介导的细胞毒性(adcc)的补体组分c1q和fcy受体的结合。
[0119]
用于在本文提供的方法中使用的度伐鲁单抗和其抗原结合片段包含重链和轻链或重链可变区和轻链可变区。在一个特定方面,用于在本文提供的方法中使用的度伐鲁单抗或其抗原结合片段包含轻链可变区和重链可变区,该轻链可变区包含seq id no:1的氨基酸序列,该重链可变区包含seq id no:2的氨基酸序列。在一个特定方面,用于在本文提供的方法中使用的度伐鲁单抗或其抗原结合片段包含重链可变区和轻链可变区,其中该重
链可变区包含seq id no:3-5的卡巴特(kabat)定义的cdr1、cdr2和cdr3序列,并且其中该轻链可变区包含seq id no:6-8的卡巴特定义的cdr1、cdr2和cdr3序列。本领域普通技术人员将能够容易地鉴定本领域普通技术人员已知的乔西亚(chothia)定义的、abm定义的或其他的cdr定义。在一个特定方面,用于在本文提供的方法中使用的度伐鲁单抗或其抗原结合片段包括如在美国专利号8,779,108和9,493,565(将其通过引用以其全文并入本文)中披露的2.14h9opt抗体的可变重链和可变轻链cdr序列。
[0120]
如本文披露的,可以向患有es-sclc的患者施用治疗剂以治疗es-sclc,这些治疗剂是例如抗pd-1抗体和/或其抗原结合片段、和/或抗pd-l1抗体(例如度伐鲁单抗)和/或其抗原结合片段连同ep,以及任选的抗ctla-4抗体和/或其抗原结合片段。这些治疗剂中的一些或全部可以在持续两周、三周、四周或六周(或更短或更长时间)的周期中一次施用,并且只要治疗为患者带来益处,就可以一直重复每个周期。在另外方面,可以在一个或多个含有一些或所有这些治疗剂以及治疗剂子集(例如,仅单个治疗剂)的周期完成后,向患者施用另外的后续剂量。可以取决于患者的年龄、体重、临床评估、肿瘤负荷和/或其他因素(包括主治医师的判断),以不同时间间隔施用后继剂量。
[0121]
在某些方面,剂量之间的间隔可以是每三周。在某些方面,剂量之间的间隔可以是每四周。在另外方面,剂量之间的间隔可以是每两个月(例如,在后续给药期和/或维持期期间)。
[0122]
有待向患者施用的度伐鲁单抗或其抗原结合片段的量可作调整并可取决于不同参数,如患者的年龄、体重、临床评估、肿瘤负荷和/或其他因素(包括主治医师的判断)。在一些方面,剂量是固定剂量。
[0123]
在某些方面,向患者施用一个或多个剂量的度伐鲁单抗,其中该剂量为约1mg/kg。在某些方面,向患者施用一个或多个剂量的度伐鲁单抗,其中该剂量为约3mg/kg。在某些方面,向患者施用一个或多个剂量的度伐鲁单抗,其中该剂量为约10mg/kg。在某些方面,向患者施用一个或多个剂量的度伐鲁单抗,其中该剂量为约15mg/kg。在某些方面,向患者施用一个或多个剂量的度伐鲁单抗,其中该剂量为约20mg/kg。
[0124]
在某些方面,向患者施用一个或多个剂量的度伐鲁单抗,其中该剂量为1500mg的固定剂量。
[0125]
在某些方面,每四周向患者施用1500mg度伐鲁单抗。
[0126]
在一些实施例中,施用抗pd-l1抗体像度伐鲁单抗是以1500mg的固定剂量施用,而曲美木单抗是以75mg的固定剂量施用。
[0127]
在一些实施例中,施用抗pd-l1抗体像度伐鲁单抗是以基于体重的剂量20mg/kg施用,而曲美木单抗是以基于体重的剂量1mg/kg施用。
[0128]
在一些实施例中,按照q3w向患者静脉内施用1500mg剂量的度伐鲁单抗,任选地75mg剂量的曲美木单抗、80-100mg/ml剂量的依托泊苷、以及5-6mg/ml/min auc剂量的卡铂或75-80mg/m2剂量的顺铂之一。
[0129]
在某些方面,本文披露的治疗剂的施用是经由肠胃外施用。例如,可以通过静脉内输注或通过皮下注射来施用度伐鲁单抗或其抗原结合片段以及ep。在一些发明,通过静脉内输注进行施用。
[0130]
在某些方面,根据本文提供的方法将度伐鲁单抗或其抗原结合片段连同ep、与另
外的癌症疗法组合或结合施用。此类疗法包括但不限于化学治疗剂如威罗菲尼、埃罗替尼、阿法替尼、西妥昔单抗、贝伐单抗、埃罗替尼或培美曲塞或其他化学治疗剂,以及辐射或任何其他抗癌治疗。
[0131]
本文提供的方法可以提供除数据明确识别和说明的那些以外的其他临床益处,包括例如肿瘤大小减小、肿瘤生长延迟或维持稳态。在某些方面,基于适当的统计分析,肿瘤大小的减少可以是显著的。可以通过与基线处的患者肿瘤的大小、针对预期的肿瘤大小、针对基于大的患者群体的预期的肿瘤大小或针对对照群体的肿瘤大小进行比较来测量肿瘤大小的减少。在本文提供的某些方面,将度伐鲁单抗与依托泊苷和顺铂和/或卡铂一起施用可以使肿瘤尺寸减少至少25%、至少50%、或至少75%。
[0132]
本文提供的方法可以减弱或延迟肿瘤生长。在一些方面,减少或延迟可以是统计学上显著的。可以通过与基线处的患者肿瘤的生长、针对预期的肿瘤生长、针对基于大的患者群体的预期肿瘤生长或针对对照群体的肿瘤生长进行比较来测量肿瘤生长的减少。
[0133]
根据本文提供的方法,施用抗pd-l1抗体(例如度伐鲁单抗或其抗原结合片段)可以产生希望的药物代谢动力学参数。可以使用“曲线下面积”(auc)来估计总药物暴露。“auc(τ)”是指直到给药周期结束的auc,而“auc(inf)”是指直到无穷时间的auc。施用可以产生约100至约2,500d
·
1-g/ml的auc(τ)。施用可以产生约15至约3501-g/ml的观察到的最大浓度(cmax)。度伐鲁单抗或其抗原结合片段的半衰期可以是约5天至约25天。另外,度伐鲁单抗或其抗原结合片段的清除率可以是约1-10毫升/天/千克。
[0134]
如本文所提供的,度伐鲁单抗或其抗原结合片段还可以降低游离pd-l1水平。游离pd-l1是指没有(例如,通过度伐鲁单抗)结合的pd-l1。在一些方面,pd-l1水平降低至少80%。在一些方面,pd-l1水平降低至少90%。在一些方面,pd-l1水平降低至少95%。在一些方面,pd-l1水平降低至少99%。在一些方面,在施用度伐鲁单抗或其抗原结合片段之后,pd-l1水平被消除。在一些方面,例如与施用度伐鲁单抗或其抗原结合片段之前的pd-l1水平的增长率相比,施用度伐鲁单抗或其抗原结合片段使pd-l1水平的增长率降低。
[0135]
除非另外指明,本文披露的方法的实施采用很好地处在普通技术人员能力范围之内的分子生物学(包括重组技术)、微生物学、细胞生物学、生物化学和免疫学的常规技术。此类技术在文献中已被充分解释,例如“molecular cloning:a laboratory manual[分子克隆:实验室手册]”,第二版(sambrook,1989);“oligonucleotide synthesis[寡核苷酸合成]”(gait,1984);“animal cell culture[动物细胞培养]”(freshney,1987);“methods in enzymology[酶学方法]”“handbook of experimental immunology[实验免疫学手册]”(weir,1996);“gene transfer vectors for mammalian cells[用于哺乳动物细胞的基因转移载体]”(miller和calos,1987);“current protocols in molecular biology[当前分子生物学方法]”(ausubel,1987);“pcr:the polymerase chain reaction[pcr:聚合酶链式反应]”,(mullis,1994);“current protocols in immunology[免疫学现代实验方案]”(coligan,1991)。
[0136]
以下实例提供上文所述的方面和方面中的一部分的说明,并且不旨在限制要求保护的发明的范围。
[0137]
实例
[0138]
实例1:度伐鲁单抗(联合或不联合曲美木单抗)与ep组合用于es-sclc患者的一线
治疗的临床评估
[0139]
大多数sclc患者在诊断时患有广泛期(es)疾病,且预后不良。最近,免疫疗法已证明在es-sclc中具有临床活性。该实例提供了一项3期随机、开放标签、申办者盲法试验(caspian,美国临床试验数据库(clinicaltrials.gov)编号nct03043872)的结果,该试验评估了度伐鲁单抗(联合或不联合曲美木单抗)与ep组合用于es-sclc患者的一线治疗的疗效和安全性。
[0140]
患者
[0141]
符合条件的患者包括具有组织学或细胞学记录的es-sclc且为初治的成年人。患者的世界卫生组织(who)行为状态评分为0或1、具有根据recist v1.1的可测量的疾病、并且自研究开始起期望寿命≥12周。有脑转移的患者是符合条件的,前提是他们在进入研究前至少1个月无症状或已接受治疗且可以通过类固醇和抗惊厥药稳定下来。
[0142]
关键排除标准包括胸部放疗史或计划的巩固胸部放疗;活动性或先前的自身免疫或炎性障碍;需要全身治疗的自身免疫性副肿瘤综合征;活动性原发性免疫缺陷病史;不受控制的并发疾病或主动感染。
[0143]
设计与治疗
[0144]
将患者以1∶1∶1的比例被随机化以接受度伐鲁单抗1500mg加ep、度伐鲁单抗1500mg加曲美木单抗75mg加ep、或ep(图1)。在所有三个研究组中,化学疗法由80-100mg/m2依托泊苷(每个周期的第1至3天施用),与曲线下面积5-6mg/ml/min的卡铂或75-80mg/m2的顺铂之一(在每个周期的第1天施用)组成。根据计划的铂类药剂进行分层随机化。免疫疗法组的患者每3周(q3w)接受多达4个周期的ep加度伐鲁单抗,然后每4周(q4w)维持1500mg度伐鲁单抗。ep组的患者可以接受另外2个周期的ep(总共长达6个周期)和预防性头颅照射(pci)。患者继续进行治疗,直到出现1.1版的实体瘤缓解评估标准(recist v1.1)定义的疾病进展、不可接受的毒性或其他中断标准为止。如果有临床益处的证据,则允许在疾病进展后继续研究治疗(图1)。不允许从ep组到免疫疗法加ep组的研究内交叉。通用给药方案如表1所示。
[0145]
表1.给药方案。
[0146][0147]
*对于剂量延迟的情况,化学疗法后可以施用多于一个度伐鲁单抗 曲美木单抗组合剂量,以确保在组1中施用多达5个组合剂量。**在组3中,如果在患者进入随访前有临床症状,则可在第12周和第15周(即随机化后总共6个周期)按照q3w再施用2个周期的ep。还可以提供pci。对于组3的患者,这不会改变从第12周开始的计划的扫描时间表q8w。在化学疗法期间和化学疗法后,度伐鲁单抗的剂量为1500mg;在化学疗法期间和化学疗法后,曲美木单抗的剂量为75mg。注意:体重降至30kg或以下的患者接受基于体重的剂量,相当于20mg/kg的度伐鲁单抗和1mg/kg的曲美木单抗,直到体重增加至>30kg,此时患者开始接受1500mg固定剂量的度伐鲁单抗和75mg固定剂量的曲美木单抗。ep,依托泊苷和铂基化学疗法;durva,度伐鲁单抗;pd,进行性疾病;treme,曲美木单抗;q3w,每3周一次;q4w,每4周一次。
[0148]
终点和评价
[0149]
在最初的12周中每6周进行一次肿瘤显像,之后每8周进行一次肿瘤显像,直到确认的客观疾病进展。治疗中断后每2个月评估存活。不良事件(ae)根据美国国立癌症研究所不良事件通用术语标准4.03版进行分级。
[0150]
主要终点为os(从随机化到因任何原因死亡的时间)。次要终点包括无进展生存期(pfs;从随机化到客观疾病进展或(无进展情况下因任何原因导致的)死亡的时间)、客观缓解率(orr)、18和24个月的os、6和12个月的pfs、以及安全性。根据recist v1.1评估pfs和orr。
[0151]
统计学分析
[0152]
如果与单独使用ep相比,使用度伐鲁单抗加ep、或度伐鲁单抗加曲美木单抗加ep的os明显更长,则认为研究为阳性。为了将i型错误控制在5%(双侧),在主要os分析和次要pfs分析中使用了具有把关策略的分层多重测试程序(图2)。分别将4%和1%α分配到度伐鲁单抗加ep对比ep的os主要终点、和度伐鲁单抗加曲美木单抗加ep对比ep的os的主要终点。只有在两个os主要分析均为显著性的情况下,才可以在多重测试程序中对pfs进行正式测试。
[0153]
需要约795名患者进行1∶1∶1随机化,以获得度伐鲁单抗加ep组和ep组的425个事件,以及获得度伐鲁单抗加曲美木单抗加ep组和ep组的425个事件(成熟度为80%),以进行os的最终分析。表2中详细列出了样本量假设。
[0154]
表2.样本量假设。
[0155][0156]
*使用近似于奥布莱恩-弗莱明(o
′
brien-fleming)方法的lan demets消耗函数,针对一个os中期分析(在75%的靶os事件发生时计划)和os最终分析调整,以解释多重比较(lan k-kg等人discrete sequential boundaries for clinical trials[临床试验的离散序列边界]biometrika[生物计量学]1983;70:659-63)。ep,铂-依托泊苷;hr,危险比;os,总生存期。
[0157]
以意向治疗基础(包括所有随机化的患者,无论是否实际接受治疗)分析疗效数据。所有接受至少一个剂量研究治疗的患者均纳入安全性分析。使用分层时序检验(针对计划的铂类药剂(卡铂或顺铂)进行调整)分析os和pfs,并使用考克斯(cox)比例风险模型估计hr和95%置信区间(ci)。卡普兰-迈耶方法用于估计os和pfs的生存曲线。os灵敏度分析包括检查删失模式(censoring pattern)以排除损耗偏倚。pfs的敏感度包括评估损耗偏倚和评价时间偏倚(evaluation-time bias)。使用逻辑回归模型(针对计划的铂类药剂进行调整),计算用于比较治疗组之间orr的优势比和95%ci。
[0158]
结果
[0159]
患者与治疗
[0160]
在研究期间,筛查了972名患者,其中167名被排除,805名被随机分配为d t ep(n=268)、d ep(n=268)和单独使用ep(n=269)。基线人口统计在各组之间总体平衡良好(表3)。在所有组中,中位年龄为63岁(iqr 57-68),并且大多数患者为男性(576占805的[72%])、现在或之前为吸烟者(753[94%])、以及诊断患有iv期疾病(735[91%])。在数值上,与d ep组和ep组相比,d t ep组基线时有更多的患者who行为状态评分为0、为男性、具有脑或cns转移以及肝转移。
[0161]
表3.基线患者人口统计学和疾病特征。*
[0162]
[0163][0164]
数据为中位数(iqr)或n(%)。ep=依托泊苷加顺铂或卡铂之一。
[0165]
*所有患者均被确认患有广泛期小细胞肺癌
[0166]
在795名接受化学疗法的患者中,有618名(78%)接受卡铂,而198名(25%)接受顺铂。在d t ep组、d ep组和ep组中,化学疗法的中位(iqr)总治疗持续时间分别为12.3(12.0-13.5)、12.1(12.0-13.1)、和19.0(12.6-20.3)周(表4)。每个治疗组中80%以上的患者接受了至少四个化学疗法周期。与d ep组患者相比,d t ep组患者的度伐鲁单抗暴露降低(表4)。d t ep组中用度伐鲁单抗治疗的中位(iqr)总持续时间为23.1(14.1-38.3)周,而d ep组则为28.0(20.0-43.9)周。d t ep组的中位(iqr)度伐鲁单抗剂量数为6(4-10),而d ep为7(6-11)。d t ep组的266名接受治疗的患者中,有161名(61%)接受了计划的五个剂量的曲美木单抗(表4)。
[0167]
表4.化学疗法方案和治疗持续时间(安全性群体)
[0168]
[0169][0170]
疗效
[0171]
在中期分析中,度伐鲁单抗加ep的确认的orr高于ep(67.9%对比57.6%;优势比1.56;95%ci 1.095-2.218)(图6和表5)。6名(2.2%)用度伐鲁单抗加ep治疗的患者和2名(0.7%)用ep治疗的患者获得了确认的完全缓解。用度伐鲁单抗加ep治疗和用ep治疗的患者的中位缓解持续时间均为5.1个月。在那些有缓解的患者中,用度伐鲁单抗加ep的患者在12个月时保持缓解的比例高于用ep的患者(22.7%对比6.3%)。
[0172]
表5.中期分析的总体缓解
[0173][0174]
[0175]
*根据recist v1.1的orr定义为至少一次访视完全缓解或部分缓解的患者人数(%)。所包括的数据用于确认的缓解。使用逻辑回归模型(针对计划的铂类药剂(卡铂或顺铂)进行调整),计算用于比较治疗组之间orr的优势比和95%ci。
[0176]
当数据截止时,删失患者的os随访中位持续时间为25.1个月(iqr 22.3-27.9),d t ep组268名患者中有30名(11%)以及d ep组268名患者中有32名(12%)继续接受度伐鲁单抗治疗。d t ep组268名患者中有117名(44%)、d ep组268名患者中有123名(46%),以及ep组269名患者中有125名(46%)接受了至少一种后续的全身性抗癌治疗疗法,并且几乎所有患者都接受了化学疗法(表6)。一小部分患者接受了后续的免疫疗法:d t ep组中3名(1%),d ep组中6名(2%),ep组中17名(6%)。与d ep(51[19%])组和ep(49[18%])组相比,d t ep组(31[12%]患者)中观察到的两个或更多个后续线全身性抗癌疗法的使用在数值上更低。ep组269名患者中有22名(8%)在化学疗法后接受pci。此外,d t ep组268名患者中有7名(3%)报告了中断研究治疗后使用pci。
[0177]
表6.后续抗癌疗法
[0178]
[0179][0180]
在最终分析数据截止时,d t ep组和ep组中有438例死亡(成熟度为81.6%);d t ep组中有207名患者死亡(77%),以及ep组中有231名患者死亡(86%)。基于数据截止时观察到的事件数,在os的最终分析中,d t ep与ep相比,经过多重调整的两侧α消耗为4.18%(即,p值小于0.0418被认为具有统计学显著性)。与ep相比,d t ep的os有了数值上的改善;hr 0.82(95%ci 0.68-1.00;p=0.0451;图3a)。d t ep对比ep,中位os分别为10.4个月(95%ci 9.6-12.0)和10.5个月(9.3-11.2),18个月os率分别为30.7%(25.2-36.4)和24.8%(19.7-30.1),以及24个月os率分别为23.4%(18.4-28.8)和14.4%(10.3-19.2)。
[0181]
在数据截止时,d t ep组268名患者中有229名(85%)以及ep组269名患者中有236名(88%)具有疾病进展或死亡。d t ep对比ep的pfs的hr为0.84(95%ci 0
·
70-1
·
01;图4a)。d t ep对比ep,中位pfs分别为4.9个月(95%ci 4.7-5.9)和5.4个月(4.8-6.2),12个月pfs率分别为16.9%(12.6-21.7)和5.3%(2.9-8.8),以及24个月pfs率分别为11.5%
(7.9-15.8)和2.9%(1.2-5.8)。
[0182]
对于由研究者评估的未确认的客观缓解的患者比例,d t ep(267名患者中198名[74%])与ep(269名患者中190名[71%])类似,优势比[or]为1.19(95%ci 0.82-1.75;表7)。对于确认的客观缓解(事后分析)的患者比例,d t ep组(267名患者中156名[58%])与ep组(269名患者中156名[58%])相同;or为1.02(0.72-1.44)。对于靶病灶大小相比基线的中位(iqr)最佳减少,d t ep组为-59.3%(-73.6,-40.0),而ep组为-55.9%(-71.3,-35.8)。缓解的深度在图5a中示出。在确认缓解的患者中,d t ep组(5.2个月[95%ci 4.9-5.6])和ep组(5.1个月[4.8-5
·
3])的中位缓解持续时间类似(图4c)。对于保持缓解的患者的估计百分比,d t ep对比ep在12个月(24.9%[18.4-3.0]对比7.3%[3.8-12.4])和24个月(17.2%[11.4-24.0]对比3.9%[1.4-8.4])都较高。
[0183]
在最终分析数据截止时,d ep组和ep组中有441例死亡(成熟度为82.1%);d ep组中有210名患者死亡(78%),以及ep组中有231名患者死亡(86%)。与ep相比,d ep在中期分析中观察到的os益处持续了另外11个月的随访;在该更新的分析中,os的hr为0.75(95%ci 0.62-0.91;标称p=0.0032;图3b)。d ep的中位os为12.9个月(95%ci 11.3-14.7),而24个月os率为22.2%(17.3-27.5)。在所有预先指定的患者亚组(如在中期分析中观察到的)以及基线时肝转移所定义的事后亚组中,与ep相比,os的hr始终倾向于d ep(图3c)。
[0184]
在数据截止时,d ep组268名患者中有234名(87%)具有疾病进展或死亡。与ep相比,pfs更倾向于d ep,其中hr为0.80(95%ci 0.66-0.96;图4b)。d ep的中位pfs为5.1个月(95%ci 4.7-6.2),而12个月和24个月pfs率为17.9%(13.5-22.8)和11.0%(7.5-15.2)。
[0185]
对于确认的客观缓解的患者比例,d ep(268名患者中182名[68%])比ep(58%)高;or为1.53(95%ci 1.08-2.18;表6)。对于靶病灶大小相比基线的中位(iqr)最佳减少,d ep组为-60.4%(-72.9,-44.3)。缓解的深度在图5b中示出。在确认缓解的患者中,d ep和ep组的中位缓解持续时间相同(图4d)。对于保持缓解的患者比例,在12个月和24个月的两个时间点d ep(23.2%[95%ci 17.3-29.7]和13.5%[8.7-19.3])都高于ep(7.3%和3.9%;见上文)。
[0186]
表7.肿瘤缓解汇总。
[0187]
[0188][0189]
除非另有说明,否则所包括的数据用于确认的缓解。ep=依托泊苷加顺铂或卡铂之一。
[0190]
*研究者根据1.1版实体瘤缓解评估标准审查的客观缓解定义为至少一次访视时有完全缓解或部分缓解的患者(未确认的缓解);对于确认的缓解,必须在初次缓解后不超过4周进行确认扫描。
[0191][0192]
使用针对计划的铂类(卡铂或顺铂)调整的逻辑回归模型计算优势比和95%ci,优势比>1倾向于免疫疗法。
§
包括一名具有未确认的缓解的患者(由于没有进一步评价,因此不可评估)。
[0193]
使用卡普兰-迈耶方法进行估计。
[0194]
安全性
[0195]
表8中描述了治疗相关的ae、严重ae和导致中断的ae。
[0196]
表8.治疗相关的不良事件(安全性群体)
[0197]
[0198][0199]
列出的是研究者评估的所有可能与任何研究治疗相关的不良事件,这些不良事件发生在治疗期间至最后一剂研究治疗后90天内或至任何后续疗法开始之前(以先发生者为准)。
[0200]
ep=依托泊苷加顺铂或卡铂之一。
[0201]
导致死亡的治疗相关的不良事件是:在度伐鲁单抗加曲美木单抗加ep组中,死
亡、发热性中性粒细胞减少、和肺栓塞各发生在两名患者中,以及小肠结肠炎、总体身体健康恶化/多器官功能障碍综合征、肺炎、局限性肺炎/肝炎、呼吸衰竭和猝死各发生在一名患者中;在度伐鲁单抗加ep组中,心脏停搏、脱水、肝中毒、间质性肺病、全血细胞减少和败血症各发生在一名患者中;以及在ep组中,全血细胞减少和血小板减少/出血各发生在一名患者中。
[0202]
所有治疗组中的事件均按频率降序列出。
[0203]
讨论
[0204]
caspian是第一个证明pd-1/pd-l1阻断组合依托泊苷和选择卡铂或顺铂化学疗法具有显著生存益处的关键试验。鉴于近年来(2014-2016年)全球不同地区27%-42%的es-sclc患者的一线治疗使用了含顺铂的化学疗法,这代表了重要的治疗进展(dibonaventura md,shah-manek b,higginbottom k,penrod jr,yuan y.adherence to recommended clinical guidelines in extensive disease small-cell lung cancer across the us,europe,and japan[坚持美国、欧洲和日本推荐的广泛疾病小细胞肺癌临床指南].ther clin risk manag[治疗学和临床风险管理]2019;15:355-66)。
[0205]
在计划的中期分析中,d ep对比单独使用ep达到了改善的生存期的主要终点(paz-ares l,dvorkin m,chen y等人durvalumab plus platinum-etoposide versus platinum-etoposide infirst-line treatment of extensive-stage small-cell lung cancer(caspian):a randomised,controlled,open-label,phase 3 trial[在广泛期小细胞肺癌的一线治疗(caspian)中度伐鲁单抗加铂-依托泊苷对比铂-依托泊苷:一项随机、对照、开放标签的3期临床试验].lancet[柳叶刀]2019;394:1929-39)。这项更新的分析具有超过2年的中位随访,证明了d ep的持续os改善。在所有界标(landmark)时间点,d ep的存活患者比例在数值上均高于ep;对于24个月os率,d ep为22.2%对比ep为14.4%,并且卡普兰-迈耶曲线的分离一直维持到随访结束。d ep对比ep的os益处在所有患者亚组(包括那些用顺铂治疗的患者和那些在基线具有脑转移的患者)中都得到了一致的证明。在更新的分析中,相比于ep组,pfs仍倾向于d ep组,且hr为0.80(95%ci 0.66-0.96)。d ep组对比ep组的pfs率在12个月(17.9%对比5.3%)和24个月(11.0%对比2.9%)在数值上更高。与中期分析一致,d ep组对比ep组的未确认和确认的客观缓解率两者均高约10%。此外,对于保持缓解的患者比例,d ep对比ep在12个月(23.2%对比7.3%)和24个月(13.5%对比3.9%)都较高。在另外一年随访之后,d ep继续证明具有可控的安全性特征,这与中期分析和个体药剂的既定安全性特征一致。
[0206]
两个免疫疗法组的os卡普兰-迈耶曲线的尾部类似,其中每组有超过20%的患者在24个月时存活。这表明,ep加度伐鲁单抗然后维持每4周方便地给药度伐鲁单抗对es-sclc患者具有持续、持久的益处。对于在过去很难显示长期生存益处的这种侵袭性疾病而言,持续的益处尤其值得注意。免疫疗法组之间的类似性在可见于pfs卡普兰-迈耶(kapan-meier)曲线的尾部。两个度伐鲁单抗组中观察到近20%的患者在12个月时无进展(相比ep组中为5%),并且其中许多患者甚至在24个月时仍无进展,这表明有一部分es-sclc患者通过d ep获得长期临床益处。
[0207]
这也是第一个3期试验的报告,评估了双重免疫检查点阻断组合化学疗法治疗es-sclc。尽管d t ep的中位os与ep类似,但d t ep组的卡普兰-迈耶曲线在10个月后开始与ep
曲线分离;并且值得注意的是,d t ep的24个月os率为23.4%,对比ep组为14.4%。d t ep组对比ep组的pfs的hr为0.84,并且相关的95%ci跨过1(0.70-1.01)。类似于os,卡普兰-迈耶曲线分离较晚,且d t ep组对比ep组在12个月和24个月的pfs率在数值上更高(分别为16.9%对比5.3%和11.5%对比2.9%)。d t ep组与ep组在确认的客观缓解率或中位缓解持续时间方面类似。然而,对于保持缓解的患者比例,d t ep在12个月和24个月都比ep高。
[0208]
总之,这项随机、开放标签、3期试验的结果表明,与稳健对照组相比,ep加度伐鲁单抗在es-sclc患者中具有持续的os益处。所有组的安全性特征与已知的个体药物的安全性特征一致。这些结果支持将d ep用作es-sclc一线治疗的新护理标准,使患者和医师可以灵活选择铂并且提供了扩展治疗选项的每4周一次的维持给药时间表。
[0209]
其他方面
[0210]
从前述说明中,将显而易见的是,可以对本文所述的发明作出变更和修改以使其适应于各种用途和状况。这些方面也在以下权利要求的范围内。
[0211]
本文中在变量的任何定义中对要素清单的叙述包括将该变量定义为任何单个要素或所列要素的组合(或次组合)。在本文中方面的叙述包括作为任何单个方面或与任何其他方面或其部分组合的方面。
[0212]
本说明书中提及的全部专利和出版物通过引用以相同的程度并入本文,如同每份单独的专利和出版物具体地且个别地指出通过引用并入。
[0213]
序列表
[0214]
seq id no:1-[0215][0216]
seq id no:2-[0217][0218]
seq id no:3-vh cdr1-gftfsrywms
[0219]
seq id no:4-vh cdr2-nikqdgsekyyvdsvkg
[0220]
seq id no:5-vh cdr3-eggwfgelafdy
[0221]
seq id no:6-vl cdr1-rasqrvsssyla
[0222]
seq id no:7-vl cdr2-dassrat
[0223]
seq id no:8-vl cdr3-qqygslpwt
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。