1.本发明涉及一种免疫检查方法及浓缩用夹具。
背景技术:
2.免疫检查方法(尤其,免疫层析法)由于操作简便且能够在短时间内进行测定,因此近来被频繁利用。
3.例如,在用免疫层析法检测流感病毒等抗原的情况下,进行如下操作。
4.首先,准备用抗体修饰的标记(标记抗体),并与含有抗原的试样混合。标记抗体与抗原结合,形成复合体。在该状态下,当在具有涂布有与抗原特异性反应的抗体的检测线的不溶性载体上展开时,复合体在检测线(测试线)上与抗体反应而被捕捉,通过肉眼等确认检测。
5.作为这种免疫层析法,例如可举出专利文献1中公开的免疫层析法。
6.现有技术文献
7.专利文献
8.专利文献1:日本专利第5728453号公报
技术实现要素:
9.发明要解决的技术课题
10.近来,期待也可适用于抗原的浓度极淡的被检体液的免疫诊断法。因此,对于免疫层析法等免疫检查方法,也要求比专利文献1中公开的以往的方法更高灵敏度的方法。
11.因此,鉴于上述情况,本发明的目的在于提供检测灵敏度高的免疫检查方法。
12.用于解决技术课题的手段
13.本发明人等对上述课题进行深入研究,结果发现通过使用通过规定的方法浓缩的被检体液能够解决上述课题,从而完成了本发明。
14.即,本发明人等发现通过以下结构能够解决上述课题。
15.(1)一种免疫检查方法,其包括:
16.浓缩工序,通过混合可含有抗原的液体和高吸水性聚合物,浓缩上述可含有抗原的液体而获得抗原浓缩液;及
17.检测工序,使用抗原抗体反应检测上述抗原浓缩液中的抗原,
18.上述高吸水性聚合物的溶胀比大于0.2g/g且小于800g/g,
19.用于上述抗原抗体反应的抗体是单克隆抗体。
20.(2)根据上述(1)所述的免疫检查方法,其中,上述高吸水性聚合物是聚丙烯酸系、聚丙烯酰胺系、纤维素系或聚环氧乙烷系的聚合物。
21.(3)根据上述(1)或(2)所述的免疫检查方法,其中,上述可含有抗原的液体是尿。
22.(4)根据上述(3)所述的免疫检查方法,其中,上述抗原浓缩液中的尿素的浓度为上述可含有抗原的液体中的尿素的浓度的5倍以下。
23.(5)根据上述(1)至(4)中任一项所述的免疫检查方法,其中,上述高吸水性聚合物的粒径为5mm以下。
24.(6)根据上述(1)至(5)中任一项所述的免疫检查方法,其中,上述高吸水性聚合物的吸水速度为每1g高吸水性聚合物0.01g/分钟以上且40g/分钟以下。
25.(7)根据上述(1)至(6)中任一项所述的免疫检查方法,其为免疫层析法。
26.(8)根据上述(7)所述的免疫检查方法,其中,
27.上述检测工序包括:
28.展开工序,在形成作为上述抗原浓缩液中的抗原和用能够与上述抗原结合的第1结合物质修饰的金粒子即修饰金粒子的复合体的金粒子复合体的状态下,在具有固定有能够与上述抗原结合的第2结合物质的反应部位的不溶性载体上展开;
29.捕捉工序,在上述不溶性载体的反应部位捕捉上述金粒子复合体;及
30.银扩增工序,对在上述捕捉工序中捕捉到的金粒子复合体进行银扩增。
31.(9)一种浓缩用夹具,其在上述(1)至(8)中任一项所述的免疫检查方法的浓缩工序中使用,
32.所述浓缩用夹具具备容纳上述高吸水性聚合物的容器,
33.上述容器具有用于吸入上述可含有抗原的液体的吸入部和用于排出上述抗原浓缩液的排出部。
34.(10)根据上述(9)所述的浓缩用夹具,其具备作为上述容器的气缸和能够插入到上述气缸的活塞。
35.(11)根据上述(9)所述的浓缩用夹具,其具备作为上述容器的内筒和能够插入及取出上述内筒的外筒。
36.(12)根据上述(9)所述的浓缩用夹具,其呈具有管部和泵部的滴管状,上述管部是上述容器。
37.(13)根据上述(1)至(8)中任一项所述的免疫检查方法,其中,在上述浓缩工序中,使用上述(9)至(12)中任一项所述的浓缩用夹具。
38.发明效果
39.如下所述,根据本发明,能够提供检测灵敏度高的免疫检查方法及该免疫检查方法中使用的浓缩用夹具。
附图说明
40.图1是本发明的方法中使用的不溶性载体的一个方式的示意图。
41.图2是本发明的浓缩用夹具的优选的方式1的一个方式的示意性剖视图。
42.图3是本发明的浓缩用夹具的优选的方式2的一个方式的示意性剖视图。
43.图4是本发明的浓缩用夹具的优选的方式3的一个方式的示意性剖视图。
具体实施方式
44.以下,对本发明的免疫检查方法及本发明的免疫检查方法中使用的浓缩用夹具进行说明。
45.另外,在本说明书中,使用“~”表示的数值范围是指将记载于“~”的前后的数值
作为下限值及上限值而包含的范围。
46.并且,在本说明书中,各成分可以单独使用一种,也可以同时使用两种以上。在此,在对各成分同时使用两种以上的情况下,只要没有特别说明,该成分的含量是指合计含量。
47.并且,在本说明书中,将“检测灵敏度及s/n比(信号/噪声比)进一步提高”也称为“本发明的效果等更优异”。
48.[1]免疫检查方法
[0049]
本发明的免疫检查方法(以下,也称为“本发明的方法”)是一种免疫检查方法,其包括:
[0050]
浓缩工序,通过混合可含有抗原的液体和高吸水性聚合物,浓缩上述可含有抗原的液体而获得抗原浓缩液;及
[0051]
检测工序,使用抗原抗体反应检测上述抗原浓缩液中的抗原,
[0052]
上述高吸水性聚合物的溶胀比大于0.2g/g且小于800g/g,
[0053]
用于上述抗原抗体反应的抗体是单克隆抗体。
[0054]
由于本发明的方法采用这种结构,因此推测能够获得上述效果。其理由尚不明确,但大致认为如下。
[0055]
如上所述,在本发明的方法中,使用特定的溶胀比的高吸水性聚合物来浓缩可含有抗原的液体(被检体液)。在将被检体液和高吸水性聚合物混合的情况下,被检体液中的水被高吸水性聚合物吸入,与此相对,被检体液中的抗原具有某种程度的流体力学半径,因此高吸水性聚合物的表面的网眼结构产生筛子效果,难以被高吸水性聚合物吸入。作为结果,被检体液中的抗原被浓缩,从而提高检测灵敏度。
[0056]
另一方面,被检体液中通常含有低分子成分或盐等掺杂物。例如,在被检体液为尿的情况下,含有尿素等掺杂物。根据本发明人等的研究发现,在这些掺杂物与抗原一起被浓缩的情况下,抗原抗体反应受到阻碍,检测灵敏度下降。即,可知不能充分获得通过浓缩的检测灵敏度的提高效果。
[0057]
本发明的方法基于上述见解等。即,在本发明的方法中,由于使用特定的溶胀比的高吸水性聚合物作为高吸水性聚合物,因此这些掺杂物与水一起被高吸水性聚合物吸入。因此,难以产生如上述那样的检测灵敏度的下降。作为结果,认为能够实现极高的检测灵敏度。
[0058]
以下,对本发明的方法所包括的各工序进行说明。
[0059]
[浓缩工序]
[0060]
浓缩工序是通过混合可含有抗原的液体(被检体液)和高吸水性聚合物,浓缩被检体液,获得抗原浓缩液(抗原被浓缩的液体)的工序。其中,上述高吸水性聚合物的溶胀比大于0.2g/g且小于800g/g。
[0061]
〔被检体液〕
[0062]
在浓缩工序中使用的被检体液只要是可含有抗原的液体,则没有特别限制。作为这种液体,例如能够举出生物学试样、尤其动物(尤其人)的体液(例如,血液、血清、血浆、脑脊液、泪液、汗、尿、脓、鼻涕或痰液)、漱口液等。
[0063]
从本发明的效果更优异的理由考虑,被检体液优选为尿。
[0064]
在被检体液是尿的情况下,从本发明的效果等更优异的理由考虑,在浓缩工序中
获得的抗原浓缩液中的尿素的浓度优选为被检体液中的尿素的浓度的5倍以下。
[0065]
<抗原>
[0066]
作为抗原,例如可举出菌、细菌(例如,结核菌、结核菌所含有的脂阿拉伯甘露聚糖(lam))、细菌、病毒(例如,流感病毒)或它们的核蛋白质等。另外,lam是结核中的主要抗原,是细胞膜及细胞壁的主要构成成分即糖脂。
[0067]
从本发明的效果等更优异的理由考虑,抗原更优选为病毒(尤其,流感病毒)或lam,进一步优选为lam。
[0068]
<被检体液的预处理>
[0069]
上述被检体液能够直接使用被检体液,或以使用适当的提取用溶剂提取抗原而获得的提取液的形式,进而以将提取液用适当的稀释剂稀释而获得的稀释液的形式、或以将提取液用适当的方法浓缩的形式使用。
[0070]
作为上述提取用溶剂,也能够使用通常的免疫学分析法中使用的溶剂(例如,水、生理食盐水或缓冲液等),或者通过利用该溶剂稀释而能够直接实施抗原抗体反应的水混和性有机溶剂。
[0071]
〔高吸水性聚合物〕
[0072]
在浓缩工序中使用的高吸水性聚合物是溶胀比大于0.2g/g且小于800g/g的聚合物(以下,也称为“特定高吸水性聚合物”)。其中,溶胀比是定义为“1g高吸水性聚合物所保持的水的质量(g)”的值。
[0073]
特定高吸水性聚合物只要溶胀比大于0.2g/g且小于800g/g,则没有特别限制,但从本发明的效果等更优异的理由考虑,优选为聚丙烯酸系、聚丙烯酰胺系、纤维素系或聚环氧乙烷系的聚合物。
[0074]
<溶胀比>
[0075]
如上所述,特定高吸水性聚合物的溶胀比大于0.2g/g且小于800g/g。其中,从本发明的效果等更优异的理由考虑,优选为1.0g/g以上且600g/g以下,更优选为10g/g以上且500g/g以下,进一步优选为20g/g以上且100g/g以下。
[0076]
(溶胀比的测定方法)
[0077]
测定在25℃5%rh(相对湿度)下保管10天的高吸水性聚合物的质量,然后立即浸渍在大量蒸馏水中。120分钟后,取出高吸水性聚合物,去除表面的水,再次测定质量,使用以下计算式测定溶胀比。
[0078]
{(吸水后的质量(g)-吸水前的初始质量(g))/吸水前的初始质量(g)}
[0079]
将溶胀比调整到上述特定的范围的方法没有特别限制,可举出变更聚合物的种类、变更聚合物的分子量、变更交联度、变更粒径等方法。
[0080]
<吸水速度>
[0081]
特定高吸水性聚合物的吸水速度没有特别限制,但从本发明的效果等更优异的理由考虑,优选为每1g高吸水性聚合物0.01g/分钟以上且40g/分钟以下,更优选为每1g高吸水性聚合物0.02g/分钟以上且40g/分钟以下。
[0082]
上述吸水速度如下测定。
[0083]
测定在25℃5%rh(相对湿度)下保管10天的高吸水性聚合物的质量(质量m0、单位g),然后立即浸渍在大量蒸馏水中。10分钟后,取出高吸水性聚合物,去除表面的水,测定质
量(质量m
10
)。测定质量后,立即再次浸渍在大量蒸馏水中。10分钟后,取出高吸水性聚合物,去除表面的水,再次测定质量(质量m
20
)。测定质量m
20
后,立即再次浸渍在大量蒸馏水中。10分钟后,取出高吸水性聚合物,去除表面的水,再次测定质量(质量m
30
)。
[0084]
如下定义吸水量。
[0085]
10分钟的吸水量:δm10=(m
10-m0)/m020分钟的吸水量:δm20=(m
20-m0)/m030分钟的吸水量:δm30=(m
30-m0)/m0[0086]
使用如上所述定义的吸水量,如下求出吸水速度。
[0087]
在x-y平面上绘制3点作为横轴时间(x=10,20,30;单位分)和纵轴吸水量(y=δm10、δm20、δm30;单位g水/g聚合物量),将吸水量相对于使用最小二乘法的时间的直线近似式的斜率作为每单位时间(分)的吸水速度。
[0088]
<粒径>
[0089]
特定高吸水性聚合物优选为粒子状,从本发明的效果等更优异的理由考虑,此时的粒径优选为10mm以下,更优选为8mm以下,进一步优选为5mm以下。从本发明的效果等更优异的理由考虑,特定高吸水性聚合物的粒径的下限优选为0.001mm以上,更优选为0.005mm以上,进一步优选为0.01mm以上。作为粒子状的特定高吸水性聚合物的粒径的测定方法,能够通过光学显微镜测定50个粒子状的聚合物的直径,将其算术平均值作为粒径。
[0090]
<使用量>
[0091]
特定高吸水性聚合物的使用量没有特别限制,但从本发明的效果等更优异的理由考虑,相对于被检体液1ml,优选为0.01~100g,更优选为0.1~50g。
[0092]
〔浓缩工序的步骤〕
[0093]
浓缩工序的步骤没有特别限制,例如可举出混合被检体液和特定高吸水性聚合物,回收未被特定高吸水性聚合物吸收的被检体液(抗原浓缩液)的方法等。
[0094]
混合被检体液和特定高吸水性聚合物的方法也没有特别限制,例如可举出在被检体液中将特定高吸水性聚合物进行配合、搅拌并静置的方法等。
[0095]
从本发明的效果等更优异的理由考虑,浓缩工序优选使用后述的浓缩用夹具。
[0096]
[检测工序]
[0097]
检测工序是使用抗原抗体反应,检测在上述浓缩工序中获得的抗原浓缩液中的抗原的工序。其中,用于抗原抗体反应的抗体是单克隆抗体。因此,本发明的方法成为假阳性的可能性低。
[0098]
检测工序只要使用抗原抗体反应,则没有特别限制,例如可举出酶免疫测定法(eia)、固相酶免疫测定法(elisa)、放射线免疫测定法(ria)、荧光免疫测定法(fia)、蛋白质印迹法、免疫层析法等。其中,从本发明的效果等更优异的理由考虑,优选为免疫层析法。即,本发明的方法优选为免疫层析法。
[0099]
以下,对检测工序为免疫层析法时的优选的方式进行说明。
[0100]
从本发明的效果等更优异的理由考虑,检测工序优选包括:
[0101]
展开工序,在形成作为上述抗原浓缩液中的抗原和用能够与上述抗原结合的第1结合物质修饰的金粒子即修饰金粒子的复合体的金粒子复合体的状态下,在具有固定有能够与上述抗原结合的第2结合物质的反应部位的不溶性载体上展开;
[0102]
捕捉工序,在上述不溶性载体的反应部位捕捉上述金粒子复合体;及
[0103]
银扩增工序,对在上述捕捉工序中捕捉到的金粒子复合体进行银扩增。
[0104]
其中,上述第1结合物质及上述第2结合物质中的至少一者是单克隆抗体。从本发明的效果等更优异的理由考虑,优选上述第1结合物质及上述第2结合物质这两者均为单克隆抗体。
[0105]
以下,对上述优选的方式所包括的各工序进行说明。
[0106]
[展开工序]
[0107]
展开工序是在形成作为在上述浓缩工序中获得的抗原浓缩液中的抗原和用能够与上述抗原结合的第1结合物质修饰的金粒子即修饰金粒子的复合体的金粒子复合体的状态下,在具有固定有能够与上述抗原结合的第2结合物质的反应部位的不溶性载体上展开的工序。
[0108]
〔金粒子复合体〕
[0109]
如上所述,在展开工序中,首先,形成作为在上述浓缩工序中获得的抗原浓缩液中的抗原和用能够与上述抗原结合的第1结合物质修饰的金粒子即修饰金粒子的复合体的金粒子复合体。
[0110]
<修饰金粒子>
[0111]
修饰金粒子是用能够与上述抗原结合的第1结合物质修饰的金粒子。
[0112]
(金粒子)
[0113]
金粒子没有特别限制。
[0114]
金粒子在后述的银扩增工序中作为还原银离子的催化剂发挥作用。
[0115]
从本发明的效果等更优异的理由考虑,上述金粒子的粒径优选为100nm以下,更优选为50nm以下,进一步优选为30nm以下,尤其优选为15nm以下。
[0116]
上述金粒子的粒径的下限没有特别限制,但从本发明的效果等更优异的理由考虑,优选为1nm以上,更优选为2nm以上,进一步优选为5nm以上。
[0117]
另外,粒径能够用市售的粒度分布计等进行测量。作为粒度分布的测定法,已知有光学显微镜法、共焦激光显微镜法、电子显微镜法、原子间力显微镜法、静态光散射法、激光衍射法、动态光散射法、离心沉降法、电脉冲测量法、层析法、超声波衰减法等,与各个原理对应的装置已有市售。作为粒径的测定方法,从粒径范围及测定的容易度考虑,能够优选使用动态光散射法。作为使用了动态光散射的市售的测定装置,可举出nanotrac upa(nikkiso co.,ltd.)、动态光散射式粒径分布测定装置lb-550(horiba,ltd.)、浓厚系粒径分析仪fpar-1000(otsukaelectronicsco.,ltd)等,在本发明中,作为在25℃的测定温度下测定的中值粒径(d=50)的值求出。
[0118]
(第1结合物质)
[0119]
第1结合物质只要能够与上述抗原结合,则没有特别限制,但从本发明的效果等更优异的理由考虑,优选为蛋白质,更优选为抗体(例如,多克隆抗体、或者单克隆抗体),从实现更高的检测灵敏度的观点出发,进一步优选为单克隆抗体。
[0120]
上述抗体没有特别限制,例如能够使用由被抗原免疫的动物的血清制备的抗血清或由抗血清提纯的免疫球蛋白组分,并且能够使用通过使用被抗原免疫的动物的脾脏细胞的细胞融合而获得的单克隆抗体、或者它们的片段[例如,f(ab’)2、fab、fab’、或fv]。这些抗体的制备能够通过常规方法进行。
[0121]
作为抗原为lam时的第1结合物质的一例,可举出国际公开2017/139153号中记载的a194-01抗体。关于a194-01抗体的国际公开2017/139153号中记载的内容全部作为本说明书的公开的一部分引用于本说明书中。
[0122]
作为抗原为lam时的第1结合物质的另一例,能够举出具有在国际公开2013/129634号的[0080]段中记载为moab1的序列的抗体。关于moab1抗体的国际公开2013/129634号中记载的内容全部作为本说明书的公开的一部分引用于本说明书中。
[0123]
(修饰金粒子的制造方法)
[0124]
制造上述修饰金粒子的方法没有特别限制,能够使用公知的方法。
[0125]
例如,可举出通过利用金与sh基化学键合,将sh基导入到抗体后,用在与金粒子接近时sh键断裂而在au表面上生成的au-s键进行固定等化学键合方法。
[0126]
〔不溶性载体〕
[0127]
上述不溶性载体是具有反应部位(测试线)的不溶性载体,该反应部位(测试线)上固定有能够与上述抗原结合的第2结合物质。不溶性载体可以根据抗原的种类具有多个测试线(例如,流感a型病毒用测试线和流感b型用测试线)。并且,为了确认上述金粒子复合体的展开,不溶性载体可以在比测试线更靠下游侧具有控制线。并且,在后述的银扩增工序中使用还原剂液的情况下,为了检测还原剂液,可以在比测试线更靠下游侧具有显色试剂固定化线。
[0128]
作为上述不溶性载体的具体的方式,例如,如图1所示,可举出从上游侧起具有金胶体保持垫1、测试线2、控制线3、显色试剂固定化线4的硝基纤维素膜100。其中,金胶体保持垫1是保持用第1结合物质修饰的金粒子(修饰金粒子)的垫片,测试线2是固定有第2结合物质的线,控制线3是用于确认展开的线,显色试剂固定化线4是用于检测后述的还原剂液的线。在此,上游侧、下游侧是指在金粒子复合体展开时,表示从上游侧向下游侧展开的记载。
[0129]
作为上述不溶性载体(或具有该不溶性载体的免疫层析试剂盒)的更具体的方式,例如可举出日本专利第5728453号公报中记载的不溶性载体及免疫层析试剂盒,关于不溶性载体及免疫层析试剂盒的日本专利第5728453号公报中记载的内容全部作为本说明书的公开的一部分引用于本说明书中。
[0130]
<不溶性载体>
[0131]
不溶性载体优选为多孔性载体。尤其,从本发明的效果等更优异的理由考虑,优选为硝基纤维素膜(硝基纤维素膜)、纤维素膜、乙酰纤维素膜、聚砜膜、聚醚砜膜、尼龙膜、玻璃纤维、无纺布、布、或丝等,更优选为硝基纤维素膜。
[0132]
<第2结合物质>
[0133]
第2结合物质只要能够与上述抗原结合,则没有特别限制。
[0134]
第2结合物质的具体例及优选的方式与上述第1结合物质相同。
[0135]
另外,上述第2结合物质可以与上述第1结合物质相同或不同,但从本发明的效果等更优异的理由考虑,优选为不同的物质的方式。
[0136]
并且,在第1结合物质及第2结合物质为抗体的情况下,从本发明的效果等更优异的理由考虑,作为第1结合物质的抗体和作为第2结合物质的抗体优选为不同的方式。
[0137]
并且,在第1结合物质及第2结合物质为抗体的情况下,从本发明的效果等更优异
的理由考虑,第1结合物质的表位(第1结合物质识别的抗原的一部分)和第2结合物质的表位(第2结合物质识别的抗原的一部分)优选为不同的方式。抗体的表位不同能够通过例如elisa(enzyme-linked immuno sorbent assay:酶联免疫物质分析)来确认。
[0138]
〔展开〕
[0139]
在形成金粒子复合体的状态下在具有测试线的不溶性载体上展开的方法没有特别限制,例如可举出准备如上述图1所示的硝基纤维素膜100(或具有该硝基纤维素膜100的免疫层析试剂盒),将在上述浓缩工序中获得的抗原浓缩液滴加到金胶体保持垫上,如图1所示利用毛细管现象使其从上游侧向下游侧移动的方法等。
[0140]
[捕捉工序]
[0141]
捕捉工序是在上述不溶性载体的反应部位捕捉上述金粒子复合体的工序。
[0142]
如上所述,由于在不溶性载体的反应部位固定有能够与抗原结合的第2结合物质,因此在上述展开工序中在不溶性载体上展开的金粒子复合体(抗原和修饰金粒子的复合体)在不溶性载体的反应部位(测试线)被捕捉。
[0143]
另外,在被检体液不含有抗原的情况下,不形成上述金粒子复合体,因此金粒子复合体在不溶性载体的反应部位不会被捕捉。
[0144]
[银扩增工序]
[0145]
银扩增工序是对在上述捕捉工序中捕捉到的金粒子复合体进行银扩增的工序。
[0146]
银扩增工序是通过对上述捕捉工序后的不溶性载体赋予银离子,在不溶性载体的反应部位捕捉到的金粒子复合体中形成大的银粒子的工序。更详细而言,是将上述金粒子复合体的金粒子作为催化剂还原银离子,形成银粒子(例如,直径10μm以上)的工序。
[0147]
由此,所捕捉到的金粒子复合体的检测灵敏度显著提高。
[0148]
〔优选的方式〕
[0149]
对上述捕捉工序后的不溶性载体赋予银离子的方法没有特别限制,但从本发明的效果等更优异的理由考虑,优选使用下述还原剂液及下述银扩增液的方法。
[0150]
并且,除了还原剂液及银扩增液以外,为了通过特异性的结合反应以外清洗残留在不溶性载体中的复合体,也可以使用清洗液。上述还原剂液也可以兼作清洗液。
[0151]
<还原剂液>
[0152]
上述还原剂液含有能够还原银离子的还原剂。能够还原银离子的还原剂只要能够将银离子还原为银,则能够使用无机
·
有机的任何材料或其混合物。作为无机还原剂,能够优选举出通过fe
2
、v
2
及ti
3
等金属离子能够改变化合价的还原性金属盐、还原性金属络合物盐。在使用无机还原剂时,需要将被氧化的离子进行络合形成或进行还原而去除或使之无害。例如,在使用fe
2
作为还原剂的体系中,能够使用柠檬酸或乙二胺四乙酸(edta)形成作为氧化物的fe
3
的络合物,使其无害。在本发明中,优选使用这种无机还原剂,作为本发明的更优选的方式,优选使用fe
2
的金属盐作为还原剂。
[0153]
另外,在湿式卤化银照片感光材料中使用的显影主剂(例如没食子酸甲酯盐、氢醌、取代氢醌、3-吡唑烷酮类、对氨基苯酚类、对苯二胺类、受阻酚类、偕胺肟类、吖嗪类、儿茶酚类、连苯三酚类、抗坏血酸(或其衍生物)及无色染料类)及对于本领域的技术熟练者而言很明显的其他材料,例如在美国专利第6,020,117号中记载的材料与能够作为还原剂使用。
[0154]
作为还原剂,也优选为抗坏血酸还原剂。有用的抗坏血酸还原剂含有抗坏血酸及其类似物、异构体及其衍生物,能够优选举出例如d-或l-抗坏血酸及其糖衍生物(例如γ-乳糖酸抗坏血酸、葡糖酸抗坏血酸、藻酸抗坏血酸、葡庚糖酸抗坏血酸、麦芽糖酸抗坏血酸)、抗坏血酸的钠盐、抗坏血酸的钾盐、异抗坏血酸(或l-红霉素抗坏血酸)及其盐(例如碱金属盐、铵盐或该技术领域中已知的盐)、烯二醇型抗坏血酸、烯胺醇型抗坏血酸、硫醇烯醇型抗坏血酸等,尤其优选d、l或d,l-抗坏血酸(及其碱金属盐)或异抗坏血酸(或其碱金属盐),钠盐为优选的盐。根据需要,能够使用这些还原剂的混合物。
[0155]
从本发明的效果等更优异的理由考虑,还原剂液优选以展开工序中的展开方向与还原剂液的展开方向之间的角度成为0度~150度的方式流动,更优选以展开工序中的展开方向与还原剂液的展开方向之间的角度成为0度~135度的方式流动。
[0156]
另外,作为调节展开工序中的展开方向与还原剂液的展开方向之间的角度的方法,例如可举出日本特开2009-150869号公报的实施例中记载的方法等。
[0157]
<银扩增液>
[0158]
上述银扩增液是含有包含银离子的化合物的液体。作为含有银的化合物,例如能够使用有机银盐、无机银盐或银络合物。优选可举出作为在水等溶剂中溶解度高的含银离子的化合物的硝酸银、乙酸银、乳酸银、丁酸银及硫代硫酸银等。尤其优选为硝酸银。作为银络合物,优选在具有羟基和砜基等水溶性基团的配体上配位的银络合物,可举出羟基硫醚银等。
[0159]
有机银盐、无机银盐或银络合物作为银在银扩增液中以0.001mol/l~5mol/l的浓度含有,优选为以0.005mol/l~3mol/l的浓度含有,更优选为以0.01mol/l~1mol/l的浓度含有。
[0160]
作为银扩增液的助剂,可举出缓冲剂、防腐剂,例如抗氧化剂或有机稳定剂、速度调节剂等。作为缓冲剂,例如能够使用乙酸、柠檬酸、氢氧化钠或这些盐中的一种、或使用三(羟甲基)氨基甲烷的缓冲剂、其他通常的化学实验中使用的缓冲剂。适当使用这些缓冲剂,能够将其调节至最适合其扩增溶液的ph。并且,作为防雾剂,能够使用烷基胺作为助剂,尤其优选为十二烷基胺。并且,为了提高这些助剂的溶解性,能够使用表面活性剂,尤其优选为c9h
19-c6h
4-o-(ch2ch2o)
50
h。
[0161]
从本发明的效果等更优异的理由考虑,银扩增液优选从与上述展开工序相反的方向流动,更优选以展开工序中的展开方向与还原剂液的展开方向之间的角度成为45度~180度的方式流动。
[0162]
另外,作为调节展开工序中的展开方向与银扩增液的展开方向之间的角度的方法,例如可举出日本特开2009-150869号公报的实施例中记载的方法等。
[0163]
[2]浓缩用夹具
[0164]
本发明的浓缩用夹具是在上述浓缩工序中使用的浓缩用夹具,所述浓缩用夹具具备容纳上述特定高吸水性聚合物的容器,上述容器具有用于吸入上述可含有抗原的液体的吸入部和用于排出上述抗原浓缩液的排出部。
[0165]
通过在上述浓缩工序中使用本发明的浓缩用夹具,能够缩短浓缩液的回收时间,并且能够在短时间内结束浓缩工序。而且,能够定量地获取抗原浓缩液,能够将每次测定的浓缩率的偏差抑制得较低。此外,通过能够控制浓缩时间和浓缩量及浓缩率,能够更简便且
重复再现性高地进行浓缩。
[0166]
以下,对本发明的浓缩用夹具的优选的方式进行说明。
[0167]
[优选的方式1]
[0168]
本发明的浓缩用夹具的优选的方式1是具备作为上述容器的气缸和能够插入到上述气缸的活塞的浓缩用夹具。
[0169]
使用附图,对上述优选的方式1进行说明。
[0170]
图2是作为上述优选的方式1的一个方式的浓缩用夹具的示意性剖视图。
[0171]
如图2(a)所示,浓缩用夹具200具备气缸10和能够插入到气缸10的活塞20。
[0172]
其中,气缸10具有喷嘴部12、开口部14及刻度16,容纳特定高吸水性聚合物30。
[0173]
〔浓缩工序的步骤〕
[0174]
首先,将可含有抗原的液体(被检体液)40吸入到气缸10中。
[0175]
作为吸入被检体液40的方法,例如可举出(i)在喷嘴部12设置塞子后从开口部14向气缸10中加入被检体液40的方法、(ii)在气缸10中插入活塞20后将喷嘴部12浸渍在被检体液40中,在该状态下通过拉拽活塞,从喷嘴部12向气缸10吸入被检体液40的方法等。
[0176]
在上述(i)的情况下,开口部14成为上述吸入部。并且,在上述(ii)的情况下,喷嘴部12成为上述吸入部。
[0177]
此时,将被检体液40吸入到气缸10的规定的位置(例如,刻度16的上端)。如此,能够将规定量的被检体液40吸入到气缸10中(图2(b))。
[0178]
另外,在图2中,在气缸10上标注有刻度16,但也可以代替刻度16而具有用于吸入规定量的被检体液40的挡块。
[0179]
接着,在图2(b)的状态下放置规定的时间。由此,被检体液40中主要是液体(尤其水)及掺杂物被特定高吸水性聚合物30吸收,被检体液40被浓缩而成为抗原浓缩液42(特定高吸水性聚合物30成为溶胀的特定高吸水性聚合物32)(图2(c))。
[0180]
并且,通过从图2(c)的状态压入活塞20,从喷嘴部12排出抗原浓缩液42(图2(d))。通过回收所排出的抗原浓缩液42获得抗原浓缩液42。
[0181]
在排出抗原浓缩液42时,利用气缸10的刻度16排出规定量的抗原浓缩液42。或者,排出全部抗原浓缩液42。如此,能够回收规定量的抗原浓缩液42。
[0182]
另外,在图2中,在气缸10上标注有刻度16,但也可以代替刻度16而具有用于排出规定量的抗原浓缩液42的挡块。
[0183]
〔气缸〕
[0184]
如上所述,气缸10具有喷嘴部12、开口部14及刻度16,容纳特定高吸水性聚合物30。
[0185]
<材质>
[0186]
气缸10的材质没有特别限制,但从能够射出成型、廉价且能够大量生产的方面考虑,优选为热塑性树脂。从具有某种程度的硬度的方面考虑,具体而言,优选为聚丙烯、丙烯酸、聚缩醛、聚酰胺、聚乙烯、聚对苯二甲酸乙二酯、聚碳酸酯、聚苯乙烯、聚苯硫醚、聚丁烯对苯二酸酯、聚氯乙烯、abs树脂(丙烯腈-丁二烯-苯乙烯共聚树脂)、as树脂(丙烯腈-苯乙烯共聚树脂)。
[0187]
<排出部>
[0188]
喷嘴部12是排出抗原浓缩液42的部分。
[0189]
喷嘴部12优选具有不排出特定高吸水性聚合物30的结构。作为形成这种结构的方法,例如可举出使喷嘴部12的内径12a小于特定高吸水性聚合物30(溶胀前)的粒径30a的方法(优选为粒径30a的1.5分之1以下,更优选为粒径30a的2分之1以下,进一步优选为粒径30a的5分之1以下)、设置用于防止从喷嘴部12排出特定高吸水性聚合物30的筛网(筛网的孔径小于特定高吸水性聚合物30(溶胀前)的粒径30a,优选为粒径30a的1.5分之1以下,更优选为粒径30a的2分之1以下,进一步优选为粒径30a的5分之1以下)的方法、在喷嘴部12设置塞子的方法(在回收抗原浓缩液42时拔掉塞子)及组合它们的方法等。
[0190]
从容易回收抗原浓缩液42的观点出发,喷嘴部12的末端优选倾斜。
[0191]
〔活塞〕
[0192]
如上所述,浓缩用夹具200具备活塞20。
[0193]
<材质>
[0194]
活塞20的材质没有特别限制,其优选的方式与上述气缸10相同。优选在活塞20的插入气缸的一侧的末端部22上附着有橡胶材料(例如,硅酮制的橡胶)。
[0195]
<直径>
[0196]
活塞20的末端部22的直径22a没有特别限制,但优选为特定高吸水性聚合物30的粒径30a的5倍以上,更优选为10倍以上,进一步优选为20倍以上。
[0197]
[优选的方式2]
[0198]
本发明的浓缩用夹具的优选的方式2是具备作为上述容器的内筒和能够插入及取出上述内筒的外筒的浓缩用夹具。
[0199]
使用附图,对上述优选的方式2进行说明。
[0200]
图3是上述优选的方式2的一个方式的示意性剖视图。
[0201]
如图3(a)所示,浓缩用夹具300具备内筒50和能够插入及取出内筒50的外筒60。
[0202]
其中,内筒50的底面52的至少一部分是筛网状(未图示)。并且,内筒50容纳特定高吸水性聚合物30。
[0203]
并且,外筒60具有刻度16。外筒60的一端被底面62封闭,另一端空着。
[0204]
〔浓缩工序的步骤〕
[0205]
首先,向内筒50吸入被检体液40。
[0206]
作为吸入被检体液40的方法,例如可举出(i)在内筒50在其上方具有开口部(未图示)的情况下,从内筒50的开口部向内筒50加入被检体液40的方法、(ii)在从外筒60取出内筒50的状态下,从外筒60的开口部64加入被检体液40,然后将内筒50插入外筒60,由此从内筒50的筛网状的部分向内筒50吸入被检体液40的方法等。
[0207]
在上述(i)的情况下,内筒50的开口部成为上述吸入部。并且,在上述(ii)的情况下,内筒50的筛网状的部分成为吸入部。
[0208]
此时,将被检体液40吸入到外筒60的规定的位置(例如,刻度16的上端)。如此,能够将规定量的被检体液40吸入到内筒50中(图3(b))。
[0209]
接着,在图3(b)的状态下放置规定的时间。由此,被检体液40中主要是液体(尤其水)及掺杂物被特定高吸水性聚合物30吸收,被检体液40被浓缩而成为抗原浓缩液42(特定高吸水性聚合物30成为溶胀的特定高吸水性聚合物32)(图3(c))。
[0210]
并且,通过从图3(c)的状态取出内筒50,从内筒50的筛网状的部分排出抗原浓缩液42。所排出的抗原浓缩液42积存在外筒60中。如此,能够回收规定量的抗原浓缩液42。
[0211]
〔内筒〕
[0212]
如上所述,内筒50的底面52的至少一部分是筛网状(未图示)。并且,内筒50容纳特定高吸水性聚合物30。
[0213]
优选内筒50的整个底面52为筛网状。并且,内筒50的侧面54也优选为筛网状,但在用上述(i)的方法吸入被检体液40的情况下,从将被检体液40从内筒50的开口部加入到内筒50时防止被检体液40从内筒50流出的理由考虑,优选内筒50中插入到外筒60时从外筒60露出的部分(上侧的部分)不是筛网状。
[0214]
<材质>
[0215]
内筒50的材质没有特别限制,但从本发明的效果等更优异的理由考虑,优选为金属、热塑性树脂(优选的方式与上述气缸10相同)、布,更优选为热塑性树脂。
[0216]
<筛网>
[0217]
从本发明的效果等更优异的理由考虑,内筒50的筛网状的部分的孔径优选小于特定高吸水性聚合物30(溶胀前)的粒径30a,更优选为粒径30a的1.5分之1以下,进一步优选为粒径30a的2分之1以下,尤其优选为粒径30a的5分之1以下。
[0218]
从本发明的效果等更优异的理由考虑,上述筛网状的部分的孔径优选为0.1μm~5mm,更优选为0.2μm~2mm。
[0219]
〔外筒〕
[0220]
如上所述,浓缩用夹具300具备外筒60。
[0221]
<材质>
[0222]
外筒60的材质没有特别限制,其优选的方式与上述气缸10相同。
[0223]
另外,内筒50和/或外筒60可以具有挡块,以使内筒50的底面52与外筒60的底面62不接触。
[0224]
[优选的方式3]
[0225]
本发明的浓缩用夹具的优选的方式3是呈具有管部和泵部的滴管状的浓缩用夹具。其中,上述管部是上述容器。
[0226]
使用附图,对上述优选的方式3进行说明。
[0227]
图4是上述优选的方式3的一个方式的示意性剖视图。
[0228]
如图4所示,浓缩用夹具400呈具有管部70和泵部80的滴管状。
[0229]
其中,管部70具有喷嘴部72和刻度16,容纳特定高吸水性聚合物30。
[0230]
〔浓缩工序的步骤〕
[0231]
首先,向管部70吸入被检体液40。具体而言,在按压泵部80的状态下将喷嘴部72浸渍在被检体液40中,在该状态下解除泵部80的按压,由此从喷嘴部72向管部70吸入被检体液40。
[0232]
此时,将被检体液40吸入到管部70的规定的位置(例如,刻度16)。如此,能够将规定量的被检体液40吸入到管部70中。
[0233]
接着,将其放置规定的时间。由此,被检体液40中主要是液体(尤其水)及掺杂物被特定高吸水性聚合物30吸收,被检体液40被浓缩而成为抗原浓缩液(特定高吸水性聚合物
30成为溶胀的特定高吸水性聚合物)。
[0234]
并且,通过按压泵部80,从喷嘴部72排出抗原浓缩液。通过回收所排出的抗原浓缩液获得抗原浓缩液。
[0235]
在排出抗原浓缩液时,将抗原浓缩液全部排出或排出到规定的刻度(除了刻度16以外的刻度)(未图示)。如此,能够回收规定量的抗原浓缩液。
[0236]
如上所述,由于从喷嘴部72向管部70吸入被检体液40,从喷嘴部72排出抗原浓缩液,因此喷嘴部72是上述吸入部且上述排出部。
[0237]
〔管部〕
[0238]
如上所述,管部70具有喷嘴部72和刻度16,容纳特定高吸水性聚合物30。
[0239]
<材质>
[0240]
管部70的材质没有特别限制,其优选的方式与上述气缸10相同。
[0241]
<特定高吸水性聚合物>
[0242]
如上所述,管部70容纳特定高吸水性聚合物30。
[0243]
特定高吸水性聚合物30优选配置成停留在管部70的内部,更优选存在于管部70的内壁。作为将特定高吸水性聚合物30配置成停留在管部70的方法,例如可举出用粘接剂将特定高吸水性聚合物30固定在管部70的内壁的方法、使喷嘴部72的内径小于特定高吸水性聚合物30的粒径的方法、在喷嘴部设置孔径小于特定高吸水性聚合物30的粒径的筛网的方法等。
[0244]
并且,容纳有特定高吸水性聚合物30的位置优选比吸入被检体液的规定的位置(例如,刻度16)更靠喷嘴部72侧。通过设为这种方式,能够使所容纳的所有的特定高吸水性聚合物30与被检体液40接触,能够实现再现性良好的浓缩率。
[0245]
〔泵部〕
[0246]
如上所述,浓缩用夹具400具备泵部80。
[0247]
<材质>
[0248]
泵部80的材质没有特别限制,其优选的方式与上述气缸10相同。
[0249]
除了管部70以外,泵部80也可以容纳有特定高吸水性聚合物30,但在该情况下,优选以被检体液40与容纳在泵部80中的特定高吸水性聚合物30接触的方式吸入被检体液40。
[0250]
实施例
[0251]
以下,通过实施例对本发明进一步详细地进行说明,但本发明并不限定于此。
[0252]
[a]抗原为流感病毒的例子
[0253]
[被检体液的制备]
[0254]
使用quick s-influ a
·
b“生研”阴性/阳性对照液(产品编号;322968、denka seiken co.,ltd.制造)制备出被检体液(可含有抗原的液体)。
[0255]
具体而言,将上述阳性对照液用含有0.1质量%bsa(bovine serum albumin)的pbs(phosphate buffered salts)缓冲液各稀释10倍,制成各稀释率的被检体液(可含有抗原的液体)。
[0256]
[实施例a1]
[0257]
如下进行了实施例a1的免疫层析法。
[0258]
〔浓缩工序〕
[0259]
将市售的sap(高吸水性聚合物)粒子(型号197-12451:fujifilm wako pure chemical corporation制造)进行分粒,制成在浓缩工序中使用的高吸水性聚合物。上述高吸水性聚合物的粒径为0.05mm,溶胀比为600g/g,吸水速度为20g/分钟。
[0260]
在上述被检体液6ml中滴加1g上述高吸水性聚合物。滴加后,用刮勺搅拌10秒左右,并静置。静置时间10分钟后,用吸液管(eppendorf公司制造)回收未被高吸水性聚合物吸收的液体(流感病毒浓缩液)(抗原浓缩液)。
[0261]
〔展开工序〕
[0262]
如图1所示,准备从上游侧起具有金胶体保持垫1、测试线2、控制线3、显色试剂固定化线4的硝基纤维素膜100。另外,金胶体保持垫1是保持用抗流感a型单克隆抗体修饰的金胶体(修饰金粒子)的垫片,测试线2是固定有抗流感a型单克隆抗体的线,控制线3是用于确认展开的线,显色试剂固定化线4是用于检测后述的还原剂液的线。
[0263]
将上述流感病毒浓缩液滴加到金胶体保持垫上。由此,形成了作为液体中的流感a型病毒和金胶体保持垫中的用抗流感a型单克隆抗体修饰的金胶体粒子(修饰金粒子)的复合体的金粒子复合体。在该状态下,向上述硝基纤维素膜的下游侧展开。
[0264]
〔捕捉工序〕
[0265]
在展开工序中展开的金粒子复合体在测试线上被捕捉。
[0266]
〔银扩增工序〕
[0267]
如下实施了银扩增工序。
[0268]
<还原剂液的制备>
[0269]
在290g水中溶解了通过将硝酸铁(iii)九水合物(fujifilm wako pure chemical corporation制造)溶解于水中而制作的1mol/l硝酸铁水溶液23.6ml及柠檬酸(fujifilm wako pure chemical corporation制造)13.1g。全部溶解后,一边用搅拌器搅拌,一边加入硝酸(10质量%)36ml,并且加入硫酸铵铁(ii)六水合物(fujifilm wako pure chemical corporation制造)60.8g,将其作为还原剂液。
[0270]
<银扩增液的制备>
[0271]
在水66g中添加了硝酸银溶液8ml(含有10g硝酸银)和1mol/l硝酸铁水溶液24ml。此外,将该溶液与预先在47.6g水中溶解硝酸(10质量%)5.9ml、十二烷基胺(fujifilm wako pure chemical corporation制造)0.1g、表面活性剂c
12h25-c6h
4-o-(ch2ch2o)
50
h 0.1g而成的溶液进行混合,将其作为银扩增液。
[0272]
<还原剂液的展开>
[0273]
在硝基纤维素膜中,使如上所述制备的还原剂液从与上述展开工序相同的方向(从更上游侧)流动。
[0274]
<银扩增液的展开>
[0275]
在显色试剂固定化线变色后,使如上所述制备的银扩增液从与展开工序中的展开方向相反的方向(从下游侧)流动。如此,对在测试线上捕捉到的金粒子复合体进行了银扩增。
[0276]
〔评价〕
[0277]
通过肉眼确认测试线的着色,并调查了确认到着色的最小的稀释率(最小检测灵敏度)。将结果示于表1。最小检测灵敏度越小,表示即使是抗原的浓度淡的试样也能够检测
抗原,并且表示检测灵敏度越高。
[0278]
[实施例a2]
[0279]
在浓缩工序中,使用了下述高吸水性聚合物,除此以外,按照与实施例a1相同的步骤实施免疫层析法,进行了评价。将结果示于表1。
[0280]
〔实施例a2中使用的高吸水性聚合物〕
[0281]
将市售的sap(高吸水性聚合物)粒子(m2 polymer technologies inc.制造;sap sphere 2.5mm)进行分粒,制成在浓缩工序中使用的高吸水性聚合物。上述高吸水性聚合物的粒径为2.5mm,溶胀比为13g/g,吸水速度为0.5g/分钟。
[0282]
[实施例a3]
[0283]
在浓缩工序中,使用了下述高吸水性聚合物,除此以外,按照与实施例a1相同的步骤实施免疫层析法,进行了评价。将结果示于表1。
[0284]
〔实施例a3中使用的高吸水性聚合物〕
[0285]
参考日本特表2015-536375号公报中记载的实施例1及比较例1的方法制备sap(高吸水性聚合物)粒子,关于粒径不同的粒子,通过使用0.5mm的筛子进行分级,获得了粒径0.5mm、溶胀比30g/g的高吸水性聚合物粒子。
[0286]
[实施例a4]
[0287]
在浓缩工序中,使用了下述高吸水性聚合物,除此以外,按照与实施例a1相同的步骤实施免疫层析法,进行了评价。将结果示于表1。
[0288]
〔实施例a4中使用的高吸水性聚合物〕
[0289]
在实施例a3中使用的高吸水性聚合物的制备中,使用了0.1mm的筛子,除此以外,按照相同的步骤制备出高吸水性聚合物。结果,获得了粒径0.1mm、溶胀比90g/g的高吸水性聚合物粒子。
[0290]
[比较例a1]
[0291]
不进行浓缩工序,在展开工序中使用上述被检体液本身来代替流感病毒浓缩液,除此以外,按照与实施例a1相同的步骤实施免疫层析法,进行了评价。将结果示于表1。
[0292]
[比较例a2]
[0293]
在浓缩工序中,使用了下述高吸水性聚合物,除此以外,按照与实施例a1相同的步骤实施免疫层析法,进行了评价。
[0294]
其结果,在比较例a2中没能确认着色。推测是因为抗体抗原反应被掺杂物阻碍。
[0295]
〔比较例a2中使用的高吸水性聚合物〕
[0296]
将fujifilm wako pure chemical corporation制造的聚丙烯酸5000进行分粒,制成在浓缩工序中使用的高吸水性聚合物。上述高吸水性聚合物的粒径为0.01mm,溶胀比为1,000g/g,吸水速度为60g/分钟。
[0297]
[比较例a3]
[0298]
在浓缩工序中,使用了下述高吸水性聚合物,除此以外,按照与实施例a1相同的步骤实施免疫层析法,进行了评价。将结果示于表1。
[0299]
〔比较例a3中使用的高吸水性聚合物〕
[0300]
制备10质量%的pva(聚乙烯醇)溶液,将其滴加到1m hcl中,由此制备出粒子。将所获得的粒子进行分粒,制成在浓缩工序中使用的高吸水性聚合物。上述高吸水性聚合物
的粒径为0.5mm,溶胀比为0.2g/g,吸水速度为0.01g/分钟。
[0301]
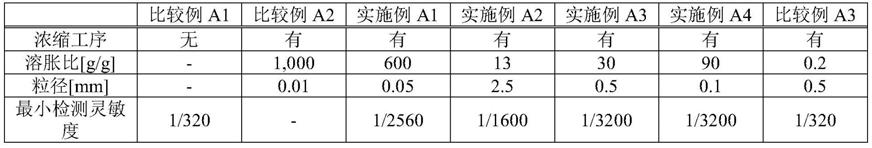
[表1]
[0302][0303]
由表1等可知,与未进行浓缩工序的比较例a1及使用溶胀比在特定的范围外的高吸水性聚合物进行浓缩工序的比较例a2~a3相比,使用溶胀比在特定的范围内的高吸水性聚合物(特定高吸水性聚合物)进行浓缩工序的实施例a1~a4显示出较高的检测灵敏度。其中,特定高吸水性聚合物的溶胀比为20g/g以上的实施例a1及实施例a3~a4显示出更高的检测灵敏度。其中,特定高吸水性聚合物的溶胀比为500g/g以下的实施例a3~a4显示出更加高的检测灵敏度。
[0304]
[b]抗原为lam时
[0305]
[被检体液的制备]
[0306]
将从结核菌提取的脂阿拉伯甘露聚糖(lam)(02249-61,nacalai tesque inc.)添加到贮存了健康人的尿被检体(bioreclamationivt公司)的尿被检体中,制备出表2中记载的lam浓度的被检体液(可含有抗原的液体)。
[0307]
[实施例b1]
[0308]
如下进行了实施例b1的免疫层析法。
[0309]
〔浓缩工序〕
[0310]
在上述被检体液6ml中滴加1g与在上述实施例a1中使用的高吸水性聚合物相同的高吸水性聚合物。滴加后,搅拌10秒钟,并静置。静置时间10分钟后,用吸液管(eppendorf公司制造)回收未被高吸水性聚合物吸收的液体(lam浓缩液)(抗原浓缩液)。lam浓缩液中的尿素的浓度为被检体液中的尿素的浓度的5倍以下。
[0311]
〔展开工序〕
[0312]
如图1所示,准备从上游侧起具有金胶体保持垫1、测试线2、控制线3、显色试剂固定化线4的硝基纤维素膜100。另外,金胶体保持垫1是保持用抗lam单克隆抗体修饰的金胶体(修饰金粒子)的垫片,测试线2是固定有抗lam单克隆抗体的线,控制线3是用于确认展开的线,显色试剂固定化线4是用于检测后述的银扩增工序的还原剂液的线。
[0313]
将上述lam浓缩液滴加到金胶体保持垫上。由此,形成了作为液体中的lam和用抗lam单克隆抗体修饰的金胶体粒子(修饰金粒子)的复合体的金粒子复合体。在该状态下,从上述硝基纤维素膜的上游侧向下游侧展开。
[0314]
〔捕捉工序〕
[0315]
在展开工序中展开的金粒子复合体在测试线上被捕捉。
[0316]
〔银扩增工序〕
[0317]
按照与实施例a1相同的步骤实施银扩增工序。
[0318]
如此,对在测试线上捕捉到的金粒子复合体进行了银扩增。
[0319]
〔评价〕
[0320]
通过肉眼确认测试线的着色,按以下基准进行了评价。
[0321]
:着色浓
[0322]
:有着色
[0323]
:有淡的着色
[0324]-:无着色
[0325]
将结果示于表2。评价为 、 或 的被检体液的lam浓度中最小的lam浓度(最小检测灵敏度)越小,表示检测灵敏度越高。
[0326]
[实施例b2]
[0327]
在浓缩工序中,使用了与在上述实施例a2中使用的高吸水性聚合物相同的高吸水性聚合物,除此以外,按照与实施例b1相同的步骤实施免疫层析法,进行了评价。将结果示于表2。另外,lam浓缩液中的尿素的浓度为被检体液中的尿素的浓度的5倍以下。
[0328]
[实施例b3]
[0329]
在浓缩工序中,使用了与在上述实施例a3中使用的高吸水性聚合物相同的高吸水性聚合物,除此以外,按照与实施例b1相同的步骤实施免疫层析法,进行了评价。将结果示于表2。另外,lam浓缩液中的尿素的浓度为被检体液中的尿素的浓度的5倍以下。
[0330]
[实施例b4]
[0331]
在浓缩工序中,使用了与在上述实施例a4中使用的高吸水性聚合物相同的高吸水性聚合物,除此以外,按照与实施例b1相同的步骤实施免疫层析法,进行了评价。将结果示于表2。另外,lam浓缩液中的尿素的浓度为被检体液中的尿素的浓度的5倍以下。
[0332]
[比较例b1]
[0333]
不进行浓缩工序,在展开工序中使用上述被检体液本身来代替lam浓缩液,除此以外,按照与实施例b1相同的步骤实施免疫层析法,进行了评价。将结果示于表2。
[0334]
[比较例b2]
[0335]
在浓缩工序中,使用了与在上述比较例a2中使用的高吸水性聚合物相同的高吸水性聚合物,除此以外,按照与实施例b1相同的步骤实施免疫层析法,进行了评价。将结果示于表2。
[0336]
在比较例b2中没能确认着色。推测是因为抗体抗原反应被尿素等掺杂物阻碍。
[0337]
[比较例b3]
[0338]
在浓缩工序中,使用了与在上述比较例a3中使用的高吸水性聚合物相同的高吸水性聚合物,除此以外,按照与实施例b1相同的步骤实施免疫层析法,进行了评价。将结果示于表2。
[0339]
[表2]
[0340][0341]
由表2等可知,与未进行浓缩工序的比较例b1及使用溶胀比在特定的范围外的高吸水性聚合物进行浓缩工序的比较例b2~b3相比,使用溶胀比在特定的范围内的高吸水性聚合物(特定高吸水性聚合物)进行浓缩工序的实施例b1~b4显示出较高的检测灵敏度。其中,特定高吸水性聚合物的溶胀比为20g/g以上的实施例b1及实施例b3~b4显示出更高的检测灵敏度。其中,特定高吸水性聚合物的溶胀比为500g/g以下的实施例b3~b4显示出更加高的检测灵敏度。
[0342]
[c]假阳性评价
[0343]
[假阳性评价1]
[0344]
用实施例b1的方法浓缩未添加lam的单独尿(bioreclamationivt公司),以相同的方式进行了评价。使用5人份的单独尿,用该方法进行评价,调查假阳性的可能性。将结果示于表3。
[0345]
:有着色
[0346]-:无着色
[0347]
[假阳性评价2]
[0348]
用实施例b1的方法浓缩未添加lam的单独尿(bioreclamationivt公司),使用抗lam多克隆抗体来代替抗lam单克隆抗体,除此以外,以与实施例b1相同的方式进行了评价。使用5人份的单独尿,用该方法进行评价,调查假阳性的可能性。将结果示于表3。
[0349]
:有着色
[0350]-:无着色
[0351]
[表3]
[0352][0353]
由表3可知,在使用单克隆抗体的情况下,未观察到假阳性,但在使用多克隆抗体的情况下,观察到假阳性。
[0354]
[d]使用浓缩用夹具的免疫层析法
[0355]
如下,在浓缩工序中使用浓缩用夹具进行了免疫层析法。
[0356]
[浓缩用夹具的准备]
[0357]
准备如图2(a)所示的注射器状的浓缩用夹具200。
[0358]
其中,气缸10的内径10a为长度10a为100mm,喷嘴部12的内径12a为并且,在气缸10中容纳有与上述实施例a1中使用的高吸水性聚合物相同的高吸水性聚合物(1g)。并且,在喷嘴部12设置有塞子。
[0359]
并且,在活塞20的末端部22上附着有硅酮制的橡胶。
[0360]
[实施例d1]
[0361]
如下进行了浓缩工序,除此以外,按照与实施例a1相同的步骤,实施了免疫层析法。其结果,与实施例a1同样地显示出高的检测灵敏度。
[0362]
〔浓缩工序〕
[0363]
用吸液管从如上所述准备的浓缩用夹具200的开口部14添加上述被检体液(被检体液40)6ml(图2(b))。
[0364]
接着,在图2(b)的状态下静置10分钟。由此,被检体液中主要是水及掺杂物被高吸水性聚合物吸收,被检体液成为被浓缩的抗原浓缩液42。并且,将活塞20从开口部14安装在气缸10上(图2(c))。
[0365]
并且,从图2(c)的状态,拔掉喷嘴部12的塞子,压入活塞20,由此从喷嘴部12回收200μl抗原浓缩液42(图2(d))。
[0366]
[回收时间]
[0367]
在上述实施例d1的在浓缩工序中,测量回收抗原浓缩液42所需的时间(回收时间)。另外,合计进行10次上述浓缩工序,分别测量回收时间。并且,求出回收时间的平均(平均回收时间)。
[0368]
并且,对于上述实施例a1也同样地求出平均回收时间。
[0369]
将结果示于下述表4中。
[0370]
[浓缩率的变动系数]
[0371]
评价上述实施例d1的浓缩工序中的浓缩率。关于浓缩率,使用稀释成2倍、4倍、8倍、10倍、16倍、20倍、32倍、
……
的检查液进行了评价。与浓缩前的被检体液的可检测的检查液的稀释倍率相比,对浓缩后的被检体液调查可检测的检查液的稀释倍率,由此计算重复实验的各自的浓缩率。
[0372]
浓缩率=(浓缩后的可检测稀释倍率)/(浓缩前的可检测稀释倍率)用n10评价用实施例a1的方式和实施例d1的方式回收的液体的浓缩率。
[0373]
n10的结果的变动系数能够从以下式导出。
[0374]
标准偏差σ为σ=√{(1/n)σ(x_av.-xi)2},变动系数cv为cv=σ/x_av.,其中,x_av.为10次测定的平均值。
[0375]
[表4]
[0376] 实施例a1实施例d1平均回收时间1分钟20秒钟浓缩率的变动系数0.590.28
[0377]
由表4可知,在实施例a1的方法中,平均回收时间为1分钟,但通过使用注射器状的浓缩用夹具,平均回收时间缩短为20秒,能够缩短回收抗原浓缩液的时间。并且,关于重复
进行10次相同的操作时的浓缩后的流感病毒浓度的偏差,浓缩率的变动系数从60%减少到30%,因此可知将每次测定的偏差抑制得较低,是测定精度优异的方法。
[0378]
并且,使用图3所示的浓缩用夹具及图4所示的浓缩用夹具同样地进行浓缩工序,求出平均回收时间及浓缩率的变动系数,结果确认到与实施例d1同样地,能够缩短回收抗原浓缩液的时间,是测定精度优异的方法。
[0379]
与如上所述进行的使用浓缩用夹具的免疫层析法同样地,准备浓缩用夹具,按照与实施例b1相同的步骤,在实施例d1中进行的浓缩工序和免疫层析法中,实施免疫层析法,求出抗原浓缩液的回收时间和浓缩率的变动系数,结果在尿被检体中的脂阿拉伯甘露聚糖(lam)浓度的检测中也确认到相同的效果。
[0380]
符号说明
[0381]
1金胶体保持垫
[0382]
2测试线
[0383]
3控制线
[0384]
4显色试剂固定化线
[0385]
100硝基纤维素膜
[0386]
10气缸
[0387]
12喷嘴部
[0388]
14开口部
[0389]
16刻度
[0390]
20活塞
[0391]
22末端部
[0392]
30特定高吸水性聚合物
[0393]
32溶胀的特定高吸水性聚合物
[0394]
40可含有抗原的液体(被检体液)
[0395]
42抗原浓缩液
[0396]
50内筒
[0397]
52底面
[0398]
54侧面
[0399]
60外筒
[0400]
62底面
[0401]
64开口部
[0402]
70管部
[0403]
72喷嘴部
[0404]
80泵部
[0405]
200、210、220、230、300、310、320、330、400浓缩用夹具
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。