t-型钙通道调节剂的制剂及其使用方法
1.相关申请的交叉引用
2.本技术要求2019年7月11日提交的美国临时专利申请号62/873,022、2019年11月13日提交的美国临时专利申请号62/934,820和2020年1月9日提交的美国临时专利申请号62/958,923的优先权和权益,它们中的每一篇通过引用整体并入本文。
背景技术:
3.t-型钙通道是介导钙流入细胞的低压活化离子通道。这些离子通道的异常功能与几种疾病或病症有关,包括精神病学障碍(例如,心境障碍(例如,严重抑郁障碍))、疼痛、震颤(例如,特发性震颤)、癫痫或癫痫综合征(例如,失神性癫痫发作和青少年肌阵挛型癫痫)。因此,选择性地调节哺乳动物中的t-型钙通道的化合物可用于治疗这样的疾病状态。
技术实现要素:
4.本文描述了可用于预防和/或治疗与t-型钙通道的异常功能相关的疾病或病症的组合物和剂型,诸如癫痫和癫痫综合征(例如,失神性癫痫发作、青少年肌阵挛型癫痫或遗传性癫痫)和心境障碍(例如,严重抑郁障碍)。本发明还包括用于调节t-型钙通道的功能的方法。
5.在一个方面,本发明提供了一种包含式(i)的化合物或其药学上可接受的盐和赋形剂的药物组合物,所述赋形剂的功能是改变式(i)的化合物或其药学上可接受的盐的释放速率。
6.在一个方面,本发明提供了一种口服剂型,其包含:式(i)的化合物或其药学上可接受的盐;和调释聚合物(例如,控释聚合物,亲水基质聚合物,例如,作为亲水基质聚合物的hpmc聚合物,疏水基质聚合物(例如,乙基纤维素(ethyl cellulose),乙基纤维素(ethocel)),或聚丙烯酸酯聚合物(例如,eudragit rl100、eudragit rs100))。在某些实施方案中,所述剂型包含约0.9重量%至约40重量%的式(i)的化合物或其药学上可接受的盐(例如,式(ii)的化合物)。在其它实施方案中,所述剂型包含约1mg至约40mg(例如,约5mg、约10mg、约15mg、约20mg、约25mg、约30mg、约35mg、约40mg)的式(i)的化合物或其药学上可接受的盐(例如,式(ii)的化合物)。
7.本文中公开的剂型可以包含约10重量%至约70重量%的调释聚合物。本文中公开的剂型可以包含稀释剂(例如,微晶纤维素)。
8.在另一个方面,本发明公开了一种口服剂型,其包含:约15mg至25mg式(i)的化合物或其药学上可接受的盐(例如,式(ii)的化合物);和约55mg至65mg hpmc聚合物。
9.在另一个方面,本发明提供了一种口服剂型,其包含:约14重量%至约25重量%的式(i)的化合物或其药学上可接受的盐(例如,式(ii)的化合物);和约53重量%至约64重量%的hpmc聚合物。
10.本文还提供了一种口服剂型,其包含:约3mg至8mg式(i)的化合物或其药学上可接受的盐(例如,式(ii)的化合物);和约55mg至65mg hpmc聚合物。
11.在一个方面,本文提供了一种口服剂型,其包含:约3重量%至约8重量%的式(i)的化合物或其药学上可接受的盐(例如,式(ii)的化合物);和约53%至约64重量%的hpmc聚合物。
12.本发明部分地提供了一种口服(例如,微粒)组合物,其包含:式(i)的化合物或其药学上可接受的盐(例如,式(ii)的化合物);和调释聚合物(例如,控释聚合物,亲水基质聚合物,例如,hpmc聚合物,疏水基质聚合物(例如,乙基纤维素(ethyl cellulose),乙基纤维素(ethocel)),或聚丙烯酸酯聚合物(例如,eudragit rl100、eudragit rs100))。
13.在某些实施方案中,所述组合物包含约0.9重量%至约40重量%的式(i)的化合物或其药学上可接受的盐(例如,式(ii)的化合物)。在某些实施方案中,所述组合物包含约1mg至约40mg(例如,约5mg、约10mg、约15mg、约20mg、约25mg、约30mg、约35mg、约40mg)式(i)的化合物或其药学上可接受的盐(例如,式(ii)的化合物)。
14.本文还提供了一种口服(例如,微粒)组合物,其包含:约15mg至25mg式(i)的化合物或其药学上可接受的盐(例如,式(ii)的化合物);和约55mg至65mg hpmc。
15.在另一个方面,本发明提供了一种口服(例如,微粒)组合物,其包含:约14重量%至约25重量%的式(i)的化合物或其药学上可接受的盐(例如,式(ii)的化合物);和约53%至约64重量%的hpmc聚合物。
16.在本文中部分地提供了一种口服(例如,微粒)组合物,其包含:约3mg至8mg式(i)的化合物或其药学上可接受的盐(例如,式(ii)的化合物);和约55mg至65mg hpmc。
17.本发明部分地公开了一种口服(例如,微粒、可溶胀芯)组合物,其包含:约3重量%至约8重量%的式(i)的化合物或其药学上可接受的盐(例如,式(ii)的化合物);和约53%至约64重量%的hpmc聚合物。
18.在一个方面,本发明提供了式(i)的化合物或其药学上可接受的盐(例如,式(ii)的化合物)的晶型,其中所述晶型表现出包含在下述衍射角(2θ)处的峰的x-射线粉末衍射图样:16.2
±
0.2、17.4
±
0.2和26.6
±
0.2。
19.在另一个方面,本发明提供了式(i)的化合物或其药学上可接受的盐(例如,式(ii)的化合物)的晶型,其中所述晶型表现出包含在下述衍射角(2θ)处的峰的x-射线粉末衍射图样:21.9
±
0.2、18.5
±
0.2和17.8
±
0.2。
20.本发明部分地提供了在有此需要的受试者中治疗神经学障碍的方法,其中所述方法包括给所述受试者施用本文中公开的口服剂量、组合物或晶型。在某些实施方案中,所述神经学障碍是癫痫。在其它实施方案中,所述癫痫是青少年癫痫。在某些实施方案中,所述癫痫是遗传性癫痫(例如,cacna1g相关的遗传性全身性癫痫)。在某些实施方案中,所述神经学障碍是失神性癫痫发作。在其它实施方案中,所述神经学障碍是失神性癫痫(例如,cacna1h相关的失神性癫痫)。在某些实施方案中,所述神经学障碍是与cacna1g、h或i有关的癫痫。在某些实施方案中,所述癫痫是儿童期失神性癫痫(cae)。在其它实施方案中,所述癫痫是青少年失神性癫痫(jae)。在某些实施方案中,所述癫痫是lenox-gastaut综合征。在某些实施方案中,所述神经学障碍是疼痛(例如,急性疼痛、慢性疼痛、神经性疼痛、炎症性疼痛、伤害性疼痛、中枢性疼痛;例如,丘脑疼痛;或偏头痛)。在其它实施方案中,所述神经学障碍是震颤(例如,特发性震颤、帕金森氏病震颤或小脑性震颤、cacna1g相关的震颤)。在某些实施方案中,所述神经学障碍是共济失调(例如,脊髓小脑性共济失调或伴有cacna1g
突变的脊髓小脑性共济失调)。在其它实施方案中,所述神经学障碍是耳鸣。在一些实施方案中,所述神经学障碍是失眠障碍。
21.在另一个方面,本文提供了在有此需要的受试者中治疗精神病学障碍的方法,其中所述方法包括给所述受试者施用本文中公开的口服剂量、组合物或晶型。在某些实施方案中,所述精神病学障碍是心境障碍。在其它实施方案中,所述心境障碍是严重抑郁障碍。
22.在本文所述的方法的某些实施方案中,每天一次将所述剂型施用给受试者。可以每天两次将所述剂型施用给受试者。可以每隔一天将所述剂型施用给受试者。
23.在本文所述的方法的某些实施方案中,可以每天将约15mg至25mg(例如,约20mg)式(i)的化合物或其药学上可接受的盐(例如,式(ii)的化合物)施用给受试者,或每天将约30mg至50mg(例如,约40mg)式(i)的化合物或其药学上可接受的盐(例如,式(ii)的化合物)施用给受试者。
24.在本文所述的方法的某些实施方案中,所述剂型在施用给受试者后可以具有比参考口服剂型(例如,具有任何预期释放速率曲线例如调释速率曲线的剂型,不具有调释速率曲线的剂型,不具有调释聚合物例如hpmc聚合物的剂型)减小的c
max
值。在本文公开的方法的其它实施方案中,所述剂型在施用给受试者后可以具有比参考口服剂型(例如,具有任何预期释放速率曲线例如调释速率曲线的剂型,不具有调释速率曲线的剂型,不具有调释聚合物例如hpmc聚合物的剂型)更大的t
max
值。
25.本文还提供了在有此需要的患者中治疗全身性癫痫综合征伴失神性癫痫发作的方法,其包括给所述患者施用足够量的式(i)的化合物或其药学上可接受的盐(例如,式(ii)的化合物)(例如,本文中公开的口服剂型、组合物或晶型),其导致癫痫发作次数的减少。
26.在一个方面,本文提供了在有此需要的患者中治疗全身性癫痫综合征伴失神性癫痫发作的方法,其包括给所述患者施用足够量的式(i)的化合物或其药学上可接受的盐(例如,式(ii)的化合物)(例如,本文中公开的口服剂型、组合物或晶型),其导致如通过脑电图(eeg)所测量的癫痫发作密度的减小。
27.在本文中部分地提供了在有此需要的患者中治疗全身性癫痫综合征伴失神性癫痫发作的方法,其包括给所述患者施用足够量的式(i)的化合物或其药学上可接受的盐(例如,式(ii)的化合物)(例如,本文中公开的口服剂型、组合物或晶型),其导致如通过eeg所测量的平均癫痫发作持续时间的减小。
28.在另一个方面,本文中公开了在有此需要的患者中治疗全身性癫痫综合征伴失神性癫痫发作的方法,其包括给所述患者施用足够量的式(i)的化合物或其药学上可接受的盐(例如,式(ii)的化合物)(例如,本文中公开的口服剂型、组合物或晶型),其导致如通过eeg所测量的累积癫痫发作持续时间的减小。
29.在本文中部分地提供了在有此需要的患者中治疗全身性癫痫综合征伴失神性癫痫发作的方法,其包括给所述患者施用足够量的式(i)的化合物或其药学上可接受的盐(例如,式(ii)的化合物)(例如,本文描述的口服剂量、组合物或晶型),其导致如通过eeg所测量的在过度换气和光刺激挑战后具有2.5-4hz棘波放电的总时间的减小。
30.在另一个方面,本文提供了在有此需要的患者中治疗全身性癫痫综合征伴失神性癫痫发作的方法,其包括给所述患者施用足够量的式(i)的化合物或其药学上可接受的盐
(例如,式(ii)的化合物)(例如,口服剂型、组合物或晶型),其导致如通过临床总体印象-严重程度(cgi-s)或临床总体印象-改善(cgi-i)评分所测量的总体严重程度的下降。
31.本文还提供了在有此需要的患者中治疗特发性震颤的方法,其包括给所述患者施用足够量的式(i)的化合物或其药学上可接受的盐(例如,式(ii)的化合物)(例如,本文中公开的口服剂型、组合物或晶型),其导致如通过特发性震颤等级评定评估量表(tetras)评分所评估的特发性震颤的减轻。在某些实施方案中,通过特发性震颤等级评定评估量表(tetras)上肢评分评估特发性震颤的减轻。在其它实施方案中,通过tetras-adl(日常生活活动)评估特发性震颤的减轻。通过tetras表现子量表评分或tetras表现个别项目评估特发性震颤的减轻。
32.本文还提供了在有此需要的患者中治疗特发性震颤的方法,其包括给所述患者施用足够量的式(i)的化合物或其药学上可接受的盐(例如,式(ii)的化合物)(例如,本文中公开的口服剂量、组合物或晶型),其导致如通过基于加速度计的上肢评分所评估的特发性震颤的减轻。
33.在另一个方面,本文提供了在有此需要的患者中治疗特发性震颤的方法,其包括给所述患者施用足够量的式(i)的化合物或其药学上可接受的盐(例如,式(ii)的化合物)(例如,本文中公开的口服剂型、组合物或晶型),其导致σ频带的减少。在某些实施方案中,所述特发性震颤是上肢震颤。
34.本领域技术人员考虑随后的附图简要描述、详细描述、实施例和权利要求会明白其它目的和优点。
附图说明
35.图1是式(ii)的化合物的形式c的粉末x-射线衍射图。
36.图2是式(ii)的化合物的形式c的示差扫描量热法(dsc)热分析图。
37.图3是式(ii)的化合物的形式c的热重量分析法(tga)热分析图。
38.图4是式(ii)的化合物的形式c的热台显微术(hsm)显微照片。
39.图5的图显示了在式(ii)的化合物的调释片剂和立即释放胶囊剂的单次20mg口服剂量以后,式(i)的化合物的平均浓度-时间曲线。
40.图6显示了在施用式(ii)的化合物的情况下在阿基米德螺旋任务中震颤的减少。
41.图7是式(ii)的化合物的型式b的粉末x-射线衍射图。
42.图8是式(ii)的化合物的型式b的示差扫描量热法(dsc)热分析图。
43.图9是式(ii)的化合物的型式b的热重量分析法(tga)热分析图。
44.图10是式(ii)的化合物的型式b的热台显微术(hsm)显微照片。
45.图11显示了在5mg片剂制剂4的单次口服剂量以后的平均(
±
sd)浓度。
46.图12显示了在健康志愿者中的1期睡眠eeg(nremσ)。
具体实施方式
47.如本文一般所述,本发明提供了可用于预防和/或治疗与t-型钙通道的功能相关的疾病或病症的组合物或剂型(例如,包括式(i)的化合物或其药学上可接受的盐),例如,癫痫或癫痫综合征(例如,失神性癫痫发作、青少年肌阵挛型癫痫或遗传性癫痫)。还提供了
用于治疗心境障碍(例如,抑郁症、严重抑郁障碍、心境恶劣障碍(例如,轻性抑郁症)、双相型障碍(例如,i和/或ii)、焦虑障碍(例如,广泛性焦虑障碍(gad)、社交焦虑障碍)、应激、创伤后应激障碍(ptsd)、强迫性障碍(例如,强迫症(ocd))的方法。还提供了可用于调节t-型钙通道的功能的方法。还提供了用于治疗疼痛(例如,急性疼痛、慢性疼痛、神经性疼痛、炎症性疼痛、伤害性疼痛、中枢性疼痛;例如,丘脑疼痛;或偏头痛)的方法。还提供了用于治疗震颤(例如,特发性震颤、帕金森氏病震颤或小脑性震颤)的方法。还提供了用于治疗共济失调(例如,脊髓小脑性共济失调、小脑性共济失调或伴有cacna1g突变的脊髓小脑性共济失调)的方法。还提供了用于治疗耳鸣的方法。还提供了用于治疗失眠症的方法。
48.定义
49.一般而言,化合物的“有效量”表示足以引发期望的生物应答的量。本领域普通技术人员会理解,本发明的化合物的有效量可以随诸如以下因素变化:期望的生物学终点、化合物的药代动力学、所治疗的疾病、施用模式以及受试者的年龄、健康和状况。有效量包括治疗性和预防性处理。
50.如本文中使用的,且除非另外指出,否则化合物的“治疗有效量”是这样的量:其足以在疾病、障碍或病症的治疗中提供治疗益处,或延迟或最小化与疾病、障碍或病症相关的一种或多种症状。化合物的治疗有效量是指单独的或与其它疗法组合的治疗剂的量,其在疾病、障碍或病症的治疗中提供治疗益处。术语“治疗有效量”可以包括这样的量:其改善总体治疗,减少或避免疾病或病症的症状或起因,或增强另一种治疗剂的治疗效果。
51.本文中使用的术语“难治的”表示不易对疗法或治疗屈服或应答、或者不受疗法或治疗控制的疾病、障碍或病症。在某些实施方案中,本文描述的疾病、障碍或病症是难治的(例如,难治的癫痫或难治的失神性癫痫发作)并且对标准疗法或治疗没有应答。
52.如本文中使用的,考虑给其施用的“受试者”包括、但不限于人类(即,任何年龄组的男性或女性,例如,儿科受试者(例如,婴儿、儿童、青少年)或成年受试者(例如,年轻成人、中年成人或老年成人))和/或非人类动物,例如,哺乳动物诸如灵长类动物(例如,食蟹猴、恒河猴)、牛、猪、马、绵羊、山羊、啮齿类动物、猫和/或狗。在某些实施方案中,所述受试者是人。在某些实施方案中,所述受试者是非人动物。术语“人”、“患者”和”受试者”在本文中可互换地使用。
53.术语“疾病”、“障碍”和“病症”在本文中可互换地使用。
54.如本文中使用的,且除非另外指出,否则术语”治疗”和“处理”涵盖在受试者正在遭受特定疾病、障碍或病症时发生的动作,其降低疾病、障碍或病症的严重程度,或延缓或减慢疾病、障碍或病症的进展(“治疗性处理”),并且还涵盖在受试者开始遭受特定疾病、障碍或病症之前发生的动作(“预防性处理”)。
55.本文中使用的术语“药学上可接受的盐”表示这样的盐:其在合理的医学判断范围内,适合用于接触人类和低等动物的组织,没有不适当的毒性、刺激、变应性应答等,且与合理的收益/风险比相称。药学上可接受的盐是本领域众所周知的。例如,berge等人在j.pharmaceutical sciences(1977)66:1-19中详细描述了药学上可接受的盐。本发明的化合物的药学上可接受的盐包括衍生自合适的无机和有机酸和碱的那些盐。药学上可接受的无毒的酸加成盐的例子是氨基与以下酸形成的盐:无机酸诸如盐酸、氢溴酸、磷酸、硫酸和高氯酸,或有机酸诸如乙酸、草酸、马来酸、酒石酸、柠檬酸、琥珀酸或丙二酸,或通过使用本
领域所用的其它方法(诸如离子交换)。其它药学上可接受的盐包括:己二酸盐、海藻酸盐、抗坏血酸盐、天冬氨酸盐、苯磺酸盐、苯甲酸盐、硫酸氢盐、硼酸盐、丁酸盐、樟脑酸盐、樟脑磺酸盐、柠檬酸盐、环戊烷丙酸盐、二葡萄糖酸盐、十二烷基硫酸盐、乙磺酸盐、甲酸盐、富马酸盐、葡庚糖酸盐、甘油磷酸盐、葡萄糖酸盐、半硫酸盐、庚酸盐、己酸盐、氢碘酸盐、2-羟基-乙磺酸盐、乳糖酸盐、乳酸盐、月桂酸盐、月桂基硫酸盐、苹果酸盐、马来酸盐、丙二酸盐、甲磺酸盐、2-萘磺酸盐、烟酸盐、硝酸盐、油酸盐、草酸盐、棕榈酸盐、扑酸盐、果胶酸盐、过硫酸盐、3-苯基丙酸盐、磷酸盐、苦味酸盐、新戊酸盐、丙酸盐、硬脂酸盐、琥珀酸盐、硫酸盐、酒石酸盐、硫氰酸盐、对甲苯磺酸盐、十一烷酸盐、戊酸盐、其立体异构体(例如,对映异构体、非对映异构体)等。其它药学上可接受的盐包括,在适当时,使用抗衡离子诸如卤素离子、氢氧根、羧酸根、硫酸根、磷酸根、硝酸根、低级烷基磺酸根和芳基磺酸根形成的无毒铵、季铵和胺阳离子。
56.术语“调释聚合物”表示在制剂(例如,片剂和胶囊剂)中使用的在药物施用给受试者后改变释放速率的聚合物。例如,调释聚合物用于随着时间的推移溶解药物,以便更缓慢地和更稳定地释放到血流中。例如,调释聚合物是控释聚合物。例如,调释聚合物或控释聚合物是hpmc聚合物。在某些实施方案中,调释聚合物可以包括亲水基质聚合物(例如,羟丙甲纤维素、hpmc(羟基-丙基甲基纤维素))、疏水基质聚合物(例如,乙基纤维素(ethyl cellulose),乙基纤维素(ethocel)),或聚丙烯酸酯聚合物(例如,eudragit rl100、eudragit rs100)。
57.本文中使用的术语“稀释剂”表示用于增加重量和改善含量均匀度的赋形剂。例如,稀释剂包括纤维素衍生物(例如,微晶纤维素)、淀粉(例如,水解淀粉和部分地预胶化的淀粉)、无水乳糖、乳糖一水合物、磷酸二钙(dcp)、糖醇(例如,山梨醇、木糖醇和甘露醇))。
58.本文中使用的术语“助流剂”表示用于通过减少颗粒间摩擦和粘结力来促进粉末流动的赋形剂。例如,助流剂包括烟雾硅胶(例如,胶态二氧化硅)、滑石粉和碳酸镁。
59.本文中使用的术语“润滑剂”表示用于防止成分结块和粘到片剂冲头或胶囊填充机上的赋形剂。润滑剂还用于确保在固体和模具壁之间的低摩擦下可以发生片剂形成和排出。例如,润滑剂包括硬脂酸镁、硬脂酸钙、硬脂酸、滑石粉、二氧化硅和脂肪(例如植物硬脂精)。
60.本文中使用的术语“包衣剂”表示保护片剂成分免于因空气中的水分而变质并使大的或味道难闻的片剂更容易吞咽的赋形剂。这些和其它示例性取代基更详细地描述在详细描述、实施例和权利要求中。本发明不无意以任何方式受限于上述示例性的取代基列表。
61.剂型和组合物
62.在一个方面,本发明表征了用于调节t-型钙通道、以及与其功能有关的疾病、障碍或病症(例如,心境障碍(例如,严重抑郁障碍)、癫痫或癫痫综合征,例如,失神性癫痫发作、青少年肌阵挛型癫痫、癫痫持续状态或遗传性癫痫)的剂型或组合物。
63.在另一个方面,本发明提供了一种剂型,其包含式(i)的化合物:
64.或其药学上可接受的盐(例如,共晶)或溶剂
化物。
65.在另一个方面,本发明提供了包含式(ii)的化合物的剂型:
[0066][0067]
调释剂型和组合物
[0068]
在一个方面,本发明提供了一种包含式(i)的化合物或其药学上可接受的盐和赋形剂的药物组合物,所述赋形剂的功能是改变式(i)的化合物或其药学上可接受的盐的释放速率。在某些实施方案中,所述药物组合物可以是可溶胀芯技术制剂。
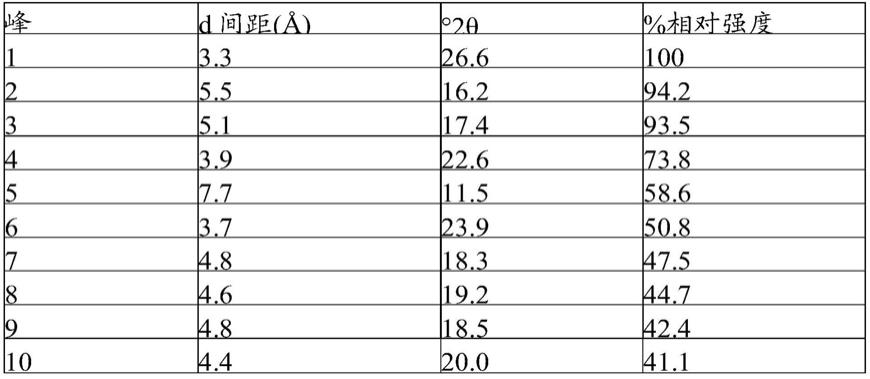
[0069]
在一个方面,本公开内容提供了一种口服剂型,其包含:式(i)的化合物或其药学上可接受的盐(例如,式(ii)的化合物);和调释聚合物(例如,控释聚合物,亲水基质聚合物,例如,hpmc聚合物,疏水基质聚合物(例如,乙基纤维素(ethyl cellulose),乙基纤维素(ethocel)),或聚丙烯酸酯聚合物(例如,eudragit rl100、eudragit rs100))。
[0070]
在一个方面,本发明提供了一种剂型或组合物,其包含式(i)的化合物或其药学上可接受的盐(例如,式(ii)的化合物)和调释聚合物(例如,控释聚合物,亲水基质聚合物,例如,hpmc聚合物,疏水基质聚合物(例如,乙基纤维素(ethyl cellulose),乙基纤维素(ethocel)),或聚丙烯酸酯聚合物(例如,eudragit rl100、eudragit rs100)),例如,其量足以在施用给受试者后改变式(i)的化合物或其药学上可接受的盐(例如,式(ii)的化合物)的释放速率。
[0071]
在某些实施方案中,所述剂型包含约0.9重量%至约40重量%(例如,约0.9重量%至约30%、约1重量%至约25重量%、约2重量%至约25重量%、约3重量%至约20重量%、约4重量%至约20重量%、约5重量%至约20重量%、约5重量%至约15重量%、约5重量%至约10重量%或按重量计约0.9%、约1%、约2%、约3%、约4%、约5%、约6%、约7%、约8%、约9%、约10%、约11%、约12%、约13%、约14%、约15%、约16%、约17%、约18%、约19%、约20%、约21%、约22%、约23%、约24%、约25%、约26%、约27%、约28%、约29%、约30%、约40%)的式(i)的化合物或其药学上可接受的盐(例如,式(ii)的化合物)。在某些实施方案中,所述剂型包含约30重量%至约40重量%的式(i)的化合物或其药学上可接受的盐(例如,式(ii)的化合物)。
[0072]
在某些实施方案中,所述剂型包含约14重量%至约25重量%的式(i)的化合物或其药学上可接受的盐(例如,式(ii)的化合物)。在某些实施方案中,所述剂型包含约19重量%至约20重量%的式(i)的化合物或其药学上可接受的盐(例如,式(ii)的化合物)。在某些实施方案中,所述剂型包含约21重量%至约22重量%的式(i)的化合物或其药学上可接受的盐(例如,式(ii)的化合物)。在某些实施方案中,所述剂型包含约4重量%至约15重量%的式(i)的化合物或其药学上可接受的盐(例如,式(ii)的化合物)。在某些实施方案中,所述剂型包含约4重量%至约10重量%的式(i)的化合物或其药学上可接受的盐(例如,式(ii)的化合物)。在某些实施方案中,所述剂型包含约4重量%至约5重量%的式(i)的化合物或其药学上可接受的盐(例如,式(ii)的化合物)。在某些实施方案中,所述剂型包含约5重量%至约6重量%的式(i)的化合物或其药学上可接受的盐(例如,式(ii)的化合物)。在
某些实施方案中,所述剂型包含约9重量%至约10重量%的式(i)的化合物或其药学上可接受的盐(例如,式(ii)的化合物)。
[0073]
在另一个方面,本发明提供了一种剂型或组合物,其包含约1mg至约40mg(例如,约5mg、约10mg、约15mg、约20mg、约25mg、约30mg、约35mg、约40mg)式(i)的化合物或其药学上可接受的盐(例如,式(ii)的化合物)和调释聚合物(例如,控释聚合物,亲水基质聚合物,例如,hpmc聚合物,疏水基质聚合物(例如,乙基纤维素(ethyl cellulose),乙基纤维素(ethocel)),或聚丙烯酸酯聚合物(例如,eudragit rl100、eudragit rs100)),例如,其量足以在施用给受试者后改变式(i)的化合物或其药学上可接受的盐(例如,式(ii)的化合物)的释放速率。
[0074]
在其它实施方案中,所述剂型包含约4mg至约6mg(例如,约5mg)式(i)的化合物或其药学上可接受的盐(例如,式(ii)的化合物)。在某些实施方案中,所述剂型包含约15mg至约25mg(例如,约20mg)式(i)的化合物或其药学上可接受的盐(例如,式(ii)的化合物)。在一些实施方案中,所述剂型包含约5mg至约15mg(例如,约10mg)式(i)的化合物或其药学上可接受的盐(例如,式(ii)的化合物)。在其它实施方案中,所述剂型包含约25mg至约35mg(例如,约30mg)式(i)的化合物或其药学上可接受的盐(例如,式(ii)的化合物)。在某些实施方案中,所述剂型包含约35mg至约45mg(例如,约40mg)式(i)的化合物或其药学上可接受的盐(例如,式(ii)的化合物。
[0075]
在某些实施方案中,所述剂型包含约55mg至65mg调释聚合物(例如,hpmc聚合物)。在某些实施方案中,所述剂型包含约10重量%至约70重量%的调释聚合物(例如,hpmc聚合物)。在某些实施方案中,所述剂型包含约50重量%至约60重量%的调释聚合物(例如,hpmc聚合物)。
[0076]
在某些实施方案中,所述剂型进一步包含稀释剂。在某些实施方案中,所述稀释剂包含微晶纤维素。在某些实施方案中,所述剂型包含约15mg至40mg(例如,约15mg至约25mg、约20mg至约25mg、约25mg至约30mg、约30mg至约40mg)微晶纤维素。在某些实施方案中,所述剂型包含约15mg至约25mg微晶纤维素。在某些实施方案中,所述剂型包含约30mg至约40mg微晶纤维素。在某些实施方案中,所述剂型包含约15%至约35重量%(例如,约15%至约20%、约20%至约25%、25%至约30%、30%至约35重量%)微晶纤维素。
[0077]
在某些实施方案中,所述剂型进一步包含助流剂。在某些实施方案中,所述助流剂包含胶态二氧化硅。在某些实施方案中,所述剂型进一步包含润滑剂。在某些实施方案中,所述润滑剂包含硬脂酸镁。在某些实施方案中,所述剂型进一步包含包衣剂。
[0078]
在某些实施方案中,约80%的式(i)的化合物在施用给受试者后在7小时内释放。在某些实施方案中,约80%的式(i)的化合物使用usp设备类型-i、含有900ml 0.1m hcl的介质和100rpm的平桨速度在7小时中释放。
[0079]
在某些实施方案中,在施用给受试者后,所述剂型具有比参考口服剂型(例如,具有任何预期释放速率曲线例如调释速率曲线的剂型,不具有调释速率曲线的剂型,不具有调释聚合物例如hpmc聚合物的剂型)减小的c
max
值。在某些实施方案中,在施用给受试者后,所述剂型具有比参考口服剂型(例如,具有任何预期释放速率曲线例如调释速率曲线的剂型,不具有调释速率曲线的剂型,不具有调释聚合物例如hpmc聚合物的剂型)更大的t
max
值。
[0080]
在其它实施方案中,将所述剂型施用给患者每天一次。在某些实施方案中,将所述
剂型施用给患者每天两次。在某些实施方案中,所述剂型是片剂。在其它实施方案中,所述剂型是胶囊剂。在某些实施方案中,所述剂型是混悬液。
[0081]
在另一个方面,本发明提供了一种口服剂型,其包含:约15mg至25mg式(i)的化合物或其药学上可接受的盐(例如,式(ii)的化合物);和约55mg至65mg hpmc聚合物。
[0082]
在另一个方面,本发明提供了一种口服剂型,其包含:约14重量%至约25重量%的式(i)的化合物或其药学上可接受的盐(例如,式(ii)的化合物);和约53%至约64重量%的hpmc聚合物。
[0083]
在另一个方面,本发明提供了一种口服剂型,其包含:约3mg至8mg式(i)的化合物或其药学上可接受的盐(例如,式(ii)的化合物);和约55mg至65mg hpmc聚合物。
[0084]
在另一个方面,本发明提供了一种口服剂型,其包含:约3重量%至约8重量%的式(i)的化合物或其药学上可接受的盐(例如,式(ii)的化合物);和约53%至约64重量%的hpmc聚合物。
[0085]
在另一个方面,本发明提供了一种口服(例如,微粒)组合物,其包含:式(i)的化合物或其药学上可接受的盐(例如,式(ii)的化合物);和调释聚合物(例如,控释聚合物,例如,作为亲水基质聚合物的hpmc聚合物)。
[0086]
在某些实施方案中,所述组合物包含约0.9重量%至约40重量%的式(i)的化合物或其药学上可接受的盐(例如,式(ii)的化合物)。在某些实施方案中,所述组合物包含约14重量%至约25重量%的式(i)的化合物或其药学上可接受的盐(例如,式(ii)的化合物)。在某些实施方案中,所述组合物包含约19重量%至约20重量%的式(i)的化合物或其药学上可接受的盐(例如,式(ii)的化合物)。在某些实施方案中,所述组合物包含约21重量%至约22重量%的式(i)的化合物或其药学上可接受的盐(例如,式(ii)的化合物)。在某些实施方案中,所述组合物包含约4重量%至约15重量%的式(i)的化合物或其药学上可接受的盐(例如,式(ii)的化合物)。在某些实施方案中,所述组合物包含约4重量%至约10重量%的式(i)的化合物或其药学上可接受的盐(例如,式(ii)的化合物)。在某些实施方案中,所述组合物包含约4重量%至约5重量%的式(i)的化合物或其药学上可接受的盐(例如,式(ii)的化合物)。在某些实施方案中,所述组合物包含约5重量%至约6重量%的式(i)的化合物或其药学上可接受的盐(例如,式(ii)的化合物)。在某些实施方案中,所述组合物包含约9重量%至约10重量%的式(i)的化合物或其药学上可接受的盐(例如,式(ii)的化合物)。
[0087]
在一些实施方案中,所述组合物包含约1mg至约40mg(例如,约5mg、约10mg、约15mg、约20mg、约25mg、约30mg、约35mg、约40mg)式(i)的化合物或其药学上可接受的盐(例如,式(ii)的化合物)。在某些实施方案中,所述组合物包含约4mg至约6mg(例如,约5mg)式(i)的化合物或其药学上可接受的盐(例如,式(ii)的化合物)。在其它实施方案中,所述组合物包含约15mg至约25mg(例如,约20mg)式(i)的化合物或其药学上可接受的盐(例如,式(ii)的化合物)。
[0088]
在某些实施方案中,所述组合物包含约55mg至65mg调释聚合物。在某些实施方案中,所述组合物包含约10重量%至约70重量%的调释聚合物。在某些实施方案中,所述组合物包含约50重量%至约60重量%的调释聚合物。
[0089]
在某些实施方案中,所述组合物包含稀释剂。在某些实施方案中,所述稀释剂包含微晶纤维素。在其它实施方案中,所述组合物包含约15mg至40mg(例如,约15mg至约25mg、约
20mg至约25mg、约25mg至约30mg、约30mg至约40mg)微晶纤维素。在某些实施方案中,所述组合物包含约15%至约35重量%(例如,约15%至约20%、约20%至约25%、25%至约30%、30%至约35重量%)微晶纤维素。
[0090]
在某些实施方案中,所述组合物包含约15mg至约25mg微晶纤维素。在某些实施方案中,所述组合物包含约30mg至约40mg微晶纤维素。在某些实施方案中,所述组合物进一步包含助流剂。在某些实施方案中,所述助流剂包含胶态二氧化硅。在某些实施方案中,所述组合物进一步包含润滑剂。在某些实施方案中,所述润滑剂包含硬脂酸镁。在某些实施方案中,所述组合物进一步包含包衣剂。在某些实施方案中,式(i)或(ii)的化合物在制剂内在约25℃在60%相对湿度稳定至少24个月。在某些实施方案中,所述化合物在约25℃在60%相对湿度稳定至少36个月。在某些实施方案中,所述化合物在约25℃在60%相对湿度稳定至少48个月。在其它实施方案中,所述化合物在约25℃在60%相对湿度稳定至少60个月。在某些实施方案中,所述化合物在约40℃在75%相对湿度稳定至少6个月。
[0091]
在另一个方面,本发明提供了一种口服(例如,微粒)组合物,其包含:约15mg至25mg式(i)的化合物或其药学上可接受的盐(例如,式(ii)的化合物);和约55mg至65mg hpmc。
[0092]
在另一个方面,本发明提供了一种口服(例如,微粒)组合物,其包含:约14重量%至约25重量%的式(i)的化合物或其药学上可接受的盐(例如,式(ii)的化合物);和约53%至约64重量%的hpmc聚合物。
[0093]
在另一个方面,本发明提供了一种口服(例如,微粒)组合物,其包含:约3mg至8mg式(i)的化合物或其药学上可接受的盐(例如,式(ii)的化合物);和约55mg至65mg hpmc。
[0094]
在另一个方面,本发明提供了一种口服(例如,微粒)组合物,其包含:约3重量%至约8重量%的式(i)的化合物或其药学上可接受的盐(例如,式(ii)的化合物);和约53%至约64重量%的hpmc聚合物。
[0095]
在本文描述的口服剂型或组合物的某些实施方案中,式(i)的化合物或其药学上可接受的盐(例如,式(ii)的化合物)是晶型。在某些实施方案中,所述晶型是如本文中所述的晶型。
[0096]
式(ii)的化合物的晶型
[0097]
本文还提供了式(ii)的化合物的晶型,其中所述晶型表现出包含在下述衍射角(2θ)处的峰的x-射线粉末衍射图样:16.2
±
0.2、17.4
±
0.2和26.6
±
0.2。
[0098]
在某些实施方案中,所述晶型表现出包含在下述衍射角(2θ)处的峰的x-射线粉末衍射图样:11.5
±
0.2、16.2
±
0.2、17.4
±
0.2、22.6
±
0.2和26.6
±
0.2。在其它实施方案中,所述晶型表现出包含在下述衍射角(2θ)处的峰的x-射线粉末衍射图样:11.5
±
0.2、16.2
±
0.2、17.4
±
0.2、18.3
±
0.2、18.5
±
0.2、19.2
±
0.2、20.0
±
0.2、22.6
±
0.2、23.9
±
0.2和26.6
±
0.2。在某些实施方案中,所述晶型具有与在图1中所示基本上相同的x-射线粉末衍射图样。在某些实施方案中,使用cu kα辐射得到粉末x-射线衍射图样。在某些实施方案中,所述晶型具有如通过示差扫描量热法所确定的在约226.6℃的熔点起始。在某些实施方案中,所述晶型具有与在图2中所示基本上相同的示差扫描量热法曲线。
[0099]
在另一个方面,本文提供了式(ii)的化合物的晶型,其中所述晶型表现出包含在下述衍射角(2θ)处的峰的x-射线粉末衍射图样:21.9
±
0.2、18.5
±
0.2和17.8
±
0.2。
[0100]
在某些实施方案中,所述晶型表现出包含在下述衍射角(2θ)处的峰的x-射线粉末衍射图样:21.9
±
0.2、18.5
±
0.2、17.8
±
0.2、10.2
±
0.2和20.5
±
0.2。在其它实施方案中,所述晶型表现出包含在下述衍射角(2θ)处的峰的x-射线粉末衍射图样:21.9
±
0.2、18.5
±
0.2、17.8
±
0.2、10.2
±
0.2、20.5
±
0.2、25.2
±
0.2、16.9
±
0.2、24.2
±
0.2、28.6
±
0.2和21.2
±
0.2。在某些实施方案中,所述晶型具有与在图7中所示基本上相同的x-射线粉末衍射图样。在某些实施方案中,使用cu kα辐射得到粉末x-射线衍射图样。在某些实施方案中,所述晶型具有如通过示差扫描量热法所确定的在约97.9、131.6、223.7、83.8、128.9、168.9或224.4℃的熔点起始。在某些实施方案中,所述晶型具有与在图8中所示基本上相同的示差扫描量热法曲线。
[0101]
立即释放制剂
[0102]
在另一个方面,本发明提供了一种剂型或组合物,其包含式(i)的化合物或其药学上可接受的盐(例如,式(ii)的化合物),其中式(i)的化合物或其药学上可接受的盐(例如,式(ii)的化合物)在施用给受试者后立即释放。
[0103]
本文还提供了一种用于立即释放的口服胶囊剂,其包含:约15mg至约20mg式(i)的化合物或其药学上可接受的盐(例如,式(ii)的化合物);和约75mg至85mg稀释剂;约2mg至10mg粘合剂;约1%至约5%崩解剂;和约0.1mg至5mg润滑剂。
[0104]
施用
[0105]
在某些实施方案中,将所述剂型每天给受试者施用超过一次(例如,每天两次、每天三次或每天四次)。
[0106]
在某些实施方案中,将所述剂型每天给受试者施用一次(例如,每天一个20mg片剂、每天两个20mg片剂、每天三个20mg片剂)。在某些实施方案中,将所述剂型每天给受试者施用两次。在某些实施方案中,每隔一天将所述剂型施用给受试者。在某些实施方案中,每天给受试者施用约1mg至40mg式(i)的化合物或其药学上可接受的盐(例如,式(ii)的化合物)。在其它实施方案中,每天给受试者施用约15mg至25mg式(i)的化合物或其药学上可接受的盐(例如,式(ii)的化合物)。在某些实施方案中,每天给受试者施用约30mg至40mg式(i)的化合物或其药学上可接受的盐(例如,式(ii)的化合物)。
[0107]
在某些实施方案中,在施用给受试者后,所述剂型具有比参考口服剂型(例如,具有任何预期释放速率曲线例如调释速率曲线的剂型,不具有调释速率曲线的剂型,不具有调释聚合物例如hpmc聚合物的剂型)减小的c
max
值。在某些实施方案中,在施用给受试者后,所述剂型具有比参考口服剂型(例如,具有任何预期释放速率曲线例如调释速率曲线的剂型,不具有调释速率曲线的剂型,不具有调释聚合物例如hpmc聚合物的剂型)更大的tmax值。
[0108]
治疗方法
[0109]
本文描述了包括式(i)的化合物或其药学上可接受的盐(例如,式(ii)的化合物)的组合物和它们用于治疗与t-型钙通道的功能有关的疾病、障碍或病症的用途。
[0110]
在一个方面,本文提供了在有此需要的受试者中治疗神经学障碍的方法,其中所述方法包括给所述受试者施用本文中公开的口服剂型或口服组合物。在某些实施方案中,所述受试者具有在t-型钙通道基因cacna1h和cacna1g中的一个或两个中的突变。在某些实施方案中,所述神经学障碍是癫痫。在某些实施方案中,所述癫痫是青少年癫痫。在某些实
施方案中,所述癫痫是遗传性癫痫。在某些实施方案中,所述神经学障碍是失神性癫痫发作。在某些实施方案中,所述神经学障碍是疼痛(例如,急性疼痛、慢性疼痛、神经性疼痛、炎症性疼痛、伤害性疼痛、中枢性疼痛;例如,丘脑疼痛;或偏头痛)。在某些实施方案中,所述神经学障碍是震颤(例如,特发性震颤、帕金森氏病震颤或小脑性震颤)。在其它实施方案中,所述神经学障碍的特征在于震颤,但是帕金森病并非震颤本身。在一些实施方案中,所述神经学障碍是共济失调(例如,脊髓小脑性共济失调或伴有cacna1g突变的脊髓小脑性共济失调)。在某些实施方案中,所述神经学障碍是耳鸣。在某些实施方案中,所述神经学障碍是失眠障碍。
[0111]
在某些实施方案中,本发明提供的组合物有效地治疗震颤(例如,特发性震颤)。在某些实施方案中,本发明提供的组合物有效地治疗癫痫或癫痫综合征,例如,失神性癫痫发作、青少年肌阵挛型癫痫、癫痫持续状态或遗传性癫痫。本发明的组合物也可以调节所有的t-型钙通道,例如,cav3.1、cav3.2和/或cav3.3。在某些实施方案中,本发明提供的组合物有效地治疗精神病学障碍,例如,心境障碍,例如,严重抑郁障碍。
[0112]
在另一个方面,本文提供了在有此需要的受试者中治疗精神病学障碍的方法,其中所述方法包括给所述受试者施用本文中公开的口服剂型。在某些实施方案中,所述精神病学障碍是心境障碍。在某些实施方案中,所述心境障碍是严重抑郁障碍。
[0113]
癫痫和癫痫综合征
[0114]
本文描述的组合物可用于治疗癫痫和癫痫综合征。癫痫是一种中枢神经系统障碍,其中脑中的神经细胞活性被破坏,导致癫痫发作,其可以表现为异常运动、阶段性异常行为、感觉和有时意识丧失。癫痫发作症状差异很大,从简单的空白凝视几秒钟到在癫痫发作期间其手臂或腿的反复抽搐。
[0115]
癫痫可能涉及全身性癫痫发作或部分或局灶性癫痫发作。全身性癫痫发作涉及脑的所有区域。经历全身性癫痫发作的人可能会哭泣或发出一些声音,僵硬几秒钟到一分钟,然后具有手臂和腿的节律性运动。眼睛通常是睁开的,这个人可能看起来没有呼吸,实际上变成蓝色。意识的恢复是渐进的,并且这个人可能感到困惑几分钟到几小时。以下是全身性癫痫发作的主要类型:强直-阵挛、强直、阵挛、肌阵挛、肌阵挛-强直-阵挛、肌阵挛-无强直、无强直和失神(典型、非典型、肌阵挛、眼睑肌阵挛)癫痫发作和癫痫痉挛。在部分或局灶性癫痫发作中,仅涉及脑的一部分,因此仅影响身体的一部分。根据具有异常电活动的脑部分,症状可能会有所不同。
[0116]
如本文所述,癫痫包括全身性、部分性、复杂部分性(例如,仅涉及脑的部分、但其中意识受损的癫痫发作)、强直阵挛性、阵挛性、强直性、难治性癫痫发作、癫痫持续状态、失神性癫痫发作、热性癫痫发作或颞叶癫痫。
[0117]
本文描述的组合物还可用于治疗癫痫综合征。至少部分地由癫痫的某些方面引起的伴有弥散性脑功能障碍的严重综合征也称为癫痫性脑病。这些与对治疗有抗性的频繁癫痫发作和严重认知功能障碍(例如韦斯特综合征)有关。
[0118]
在某些实施方案中,所述癫痫综合征包含癫痫性脑病、dravet综合征、angelman综合征、cdkl5障碍、额叶癫痫、婴儿痉挛、韦斯特综合征、青少年肌阵挛型癫痫、landau-kleffner综合征、lennox-gastaut综合征、ohtahara综合征、pcdh19癫痫或glut1缺乏。在某些实施方案中,所述癫痫综合征是儿童期失神性癫痫(cae)。在某些实施方案中,所述癫痫
综合征是青少年失神性癫痫(jae)。在某些实施方案中,所述癫痫综合征是lennox-gastaut综合征。在某些实施方案中,所述癫痫综合征是slc6a1癫痫性脑病。在某些实施方案中,所述癫痫综合征与编码t-型钙通道的基因(例如,对于遗传性全身性癫痫(gge)为cacna1g、eef1a2和gabrg2,和对于非获得性病灶性癫痫(nafe)为lgi1、trim3和gabrg2)中的突变有关。am j hum genet.2019aug 1;105(2):267-28。在某些实施方案中,所述癫痫综合征是doose综合征或肌阵挛不稳定型癫痫。在某些实施方案中,所述癫痫综合征是伴有在睡眠中的连续峰和波(csws)的癫痫性脑病。在某些实施方案中,所述癫痫综合征是landau kleffner综合征(lks)。在某些实施方案中,所述癫痫综合征是jeavons综合征。
[0119]
失神性癫痫发作
[0120]
失神性癫痫发作是在具有特发性全身性癫痫(ige)的患者中最常见的癫痫发作类型之一(berg等人,epilepsia 2000)。失神性癫痫发作是相对短暂的非抽搐性癫痫发作,其特征是突然发生觉醒和应答性的丧失,通常持续10-30秒,迅速恢复正常意识而没有发作后的意识错乱。在伴随的eeg记录上,癫痫发作的特征是广泛的1-6hz(例如,3hz)峰和波放电的突然发生和偏移。失神性癫痫发作经常每天发生多次,中断学习和心理社会功能,并且由于觉醒丧失的频繁发作而存在受伤风险。通常,失神性癫痫发作始于幼童时期,并在青少年时期缓解。但是,在少数患者中,他们会持续到成年,并且他们经常产生抗药性,并且可能伴有其它癫痫发作类型,诸如全身性强直阵挛发作。在这些成年患者中,失神性癫痫发作通常是高度致残的,特别是通过使患者丧失获得机动车执照的资格或从事其中癫痫发作相关的觉醒丧失阶段构成安全风险的职业和爱好的资格,并与严重的心理社会无能有关(wirrell等人,1997)。
[0121]
虽然人们普遍认为失神性癫痫发作相对“容易”治疗,但在具有儿童期失神性癫痫的患者中的随机对照试验表明,即使最有效的抗癫痫药物乙琥胺和丙戊酸盐也仅在16周时分别完全控制了53%和58%的患者的癫痫发作(如通过视频-eeg记录所评估的)(glauser等人,2010),在12个月时分别为45%和44%(glauser等人,2013)。拉莫三嗪是另一种常用于治疗失神性癫痫发作的aed,在16周时仅控制了29%的患者的癫痫发作,且在12个月时控制了21%的患者。此外,乙琥胺和丙戊酸盐通常都与无法忍受的副作用相关(发生在24%的用这些药物中的任一种治疗的患者中)(glauser等人,2010),并且后者现在通常被认为在女孩和具有怀孕可能的女性中禁用。失神性癫痫发作的其它治疗选择是有限的,仅苯并二氮杂环庚三烯类具有确定的效力—并且由于镇静和认知副作用,这些通常耐受性差。持续到成年期的失神性癫痫发作特别难以治疗,患者经常接受多种药物治疗,导致严重的副作用而无法实现癫痫发作控制。
[0122]
大量证据表明,低阈值(t-型)钙通道在失神性癫痫发作的产生和维持中起关键作用,是在失神性癫痫发作期间在丘脑皮质神经元中发生的振荡簇状发放的关键组成部分(pinault和o’brien,1997)。在某些实施方案中,本发明表征了用本文描述的组合物治疗失神性癫痫发作的方法。在某些实施方案中,所述失神性癫痫发作是难治的失神性癫痫发作。在某些实施方案中,所述失神性癫痫发作是抗癫痫药物(例如,乙琥胺、丙戊酸或拉莫三嗪)难治的。
[0123]
在某些实施方案中,所述受试者具有癫痫。在某些实施方案中,所述失神性癫痫发作是非典型失神性癫痫发作。在某些实施方案中,所述失神性癫痫发作包含成年失神性癫
痫发作、青少年失神性癫痫发作或儿童期失神性癫痫发作。
[0124]
在某些实施方案中,本文所述的方法进一步包括鉴定具有失神性癫痫发作的受试者。
[0125]
在另一个方面,本公开内容提供了一种在有此需要的患者中治疗全身性癫痫综合征伴失神性癫痫发作的方法,其包括给所述患者施用足够量的式(i)的化合物或其药学上可接受的盐(例如,式(ii)的化合物),其导致癫痫发作次数的减少。
[0126]
本文还提供了在有此需要的患者中治疗全身性癫痫综合征伴失神性癫痫发作的方法,其包括给所述患者施用足够量的式(i)的化合物或其药学上可接受的盐(例如,式(ii)的化合物),其导致平均或总癫痫发作持续时间的减小。
[0127]
本文还提供了在有此需要的患者中治疗全身性癫痫综合征伴失神性癫痫发作的方法,其包括给所述患者施用足够量的式(i)的化合物或其药学上可接受的盐(例如,式(ii)的化合物),其导致如通过脑电图(eeg)所测量的癫痫发作频率、持续时间或二者的减小。
[0128]
涵盖的方法包括在有此需要的患者中治疗全身性癫痫综合征伴失神性癫痫发作的方法,其包括给所述患者施用足够量的式(i)的化合物或其药学上可接受的盐(例如,式(ii)的化合物),其导致如通过eeg所测量的平均癫痫发作持续时间的减小。
[0129]
在本文中部分地提供了在有此需要的患者中治疗全身性癫痫综合征伴失神性癫痫发作的方法,其包括给所述患者施用足够量的式(i)的化合物或其药学上可接受的盐(例如,式(ii)的化合物),其导致如通过eeg所测量的累积癫痫发作持续时间的减小。
[0130]
在一个方面,本公开内容提供了一种在有此需要的患者中治疗全身性癫痫综合征伴失神性癫痫发作的方法,其包括给所述患者施用足够量的式(i)的化合物或其药学上可接受的盐(例如,式(ii)的化合物),其导致如通过eeg所测量的在过度换气和光刺激挑战后具有2.5-4hz棘波放电的总时间的减小。
[0131]
本文还提供了在有此需要的患者中治疗全身性癫痫综合征伴失神性癫痫发作的方法,其包括给所述患者施用足够量的式(i)的化合物,其导致如通过临床总体印象-严重程度(cgi-s)或临床总体印象-改善(cgi-i)评分所测量的总体严重程度的下降。cgi-s是一种7-点量表试验,用于相对于临床医师在过去对具有相同诊断的患者的经验对在评估时患者的疾病的严重程度评级。cgi-i是一种7-点量表试验,用于相对于基线评价患者的疾病的改善。
[0132]
在另一个方面,本公开内容提供了一种在有此需要的患者中治疗全身性癫痫综合征伴失神性癫痫发作的方法,其包括给所述患者施用足够量的式(i)的化合物或其药学上可接受的盐(例如,式(ii)的化合物),其导致癫痫发作次数的减少。
[0133]
本文还提供了在有此需要的患者中治疗全身性癫痫综合征伴失神性癫痫发作的方法,其包括给所述患者施用足够量的式(i)的化合物或其药学上可接受的盐(例如,式(ii)的化合物),其导致如通过脑电图(eeg)所测量的癫痫发作密度的减小。
[0134]
涵盖的方法包括在有此需要的患者中治疗全身性癫痫综合征伴失神性癫痫发作的方法,其包括给所述患者施用足够量的式(i)的化合物或其药学上可接受的盐(例如,式(ii)的化合物),其导致如通过eeg所测量的平均癫痫发作持续时间的减小。
[0135]
在本文中部分地提供了在有此需要的患者中治疗全身性癫痫综合征伴失神性癫
痫发作的方法,其包括给所述患者施用足够量的式(i)的化合物或其药学上可接受的盐(例如,式(ii)的化合物),其导致如通过eeg所测量的累积癫痫发作持续时间的减小。
[0136]
在一个方面,本公开内容提供了一种在有此需要的患者中治疗全身性癫痫综合征伴失神性癫痫发作的方法,其包括给所述患者施用足够量的式(i)的化合物或其药学上可接受的盐(例如,式(ii)的化合物),其导致如通过eeg所测量的在过度换气和光刺激挑战后具有2.5-4hz棘波放电的总时间的减小。
[0137]
本文还提供了在有此需要的患者中治疗全身性癫痫综合征伴失神性癫痫发作的方法,其包括给所述患者施用足够量的式(i)的化合物,其导致如通过临床总体印象-严重程度(cgi-s)或临床总体印象-改善(cgi-i)评分所测量的总体严重程度的下降。cgi-s是一种7-点量表试验,用于相对于临床医师在过去对具有相同诊断的患者的经验对在评估时患者的疾病的严重程度评级。cgi-i是一种7-点量表试验,用于相对于基线评价患者的疾病的改善。
[0138]
在另一个方面,本公开内容提供了一种在有此需要的患者中治疗全身性癫痫综合征伴失神性癫痫发作的方法,其包括给所述患者施用足够量的式(i)的化合物或其药学上可接受的盐(例如,式(ii)的化合物),其导致癫痫发作次数的减少。
[0139]
本文还提供了在有此需要的患者中治疗全身性癫痫综合征伴失神性癫痫发作的方法,其包括给所述患者施用足够量的式(i)的化合物,其导致通过脑电图(eeg)测量的癫痫发作密度的减小。
[0140]
涵盖的方法包括在有此需要的患者中治疗全身性癫痫综合征伴失神性癫痫发作的方法,其包括给所述患者施用足够量的式(i)的化合物或其药学上可接受的盐(例如,式(ii)的化合物),其导致如通过eeg所测量的平均癫痫发作持续时间的减小。
[0141]
在本文中部分地提供了在有此需要的患者中治疗全身性癫痫综合征伴失神性癫痫发作的方法,其包括给所述患者施用足够量的式(i)的化合物或其药学上可接受的盐(例如,式(ii)的化合物),其导致如通过eeg所测量的累积癫痫发作持续时间的减小。
[0142]
在一个方面,本公开内容提供了一种在有此需要的患者中治疗全身性癫痫综合征伴失神性癫痫发作的方法,其包括给所述患者施用足够量的式(i)的化合物或其药学上可接受的盐(例如,式(ii)的化合物),其导致如通过eeg所测量的在过度换气和光刺激挑战后具有2.5-4hz棘波放电的总时间的减小。
[0143]
本文还提供了在有此需要的患者中治疗全身性癫痫综合征伴失神性癫痫发作的方法,其包括给所述患者施用足够量的式(i)的化合物或其药学上可接受的盐(例如,式(ii)的化合物),其导致如通过临床总体印象-严重程度(cgi-s)或临床总体印象-改善(cgi-i)评分所测量的总体严重程度的下降。cgi-s是一种7-点量表试验,用于相对于临床医师在过去对具有相同诊断的患者的经验对在评估时患者的疾病的严重程度评级。cgi-i是一种7-点量表试验,用于相对于基线评价患者的疾病的改善。
[0144]
遗传性癫痫
[0145]
在某些实施方案中,所述癫痫或癫痫综合征是遗传性癫痫或遗传性癫痫综合征。在某些实施方案中,所述癫痫或癫痫综合征是遗传性全身性癫痫。在某些实施方案中,癫痫或癫痫综合征包含癫痫性脑病,具有scn1a、scn2a、scn8a突变的癫痫性脑病,早期幼儿癫痫性脑病,dravet综合征,具有scn1a突变的dravet综合征,具有热性癫痫发作的全身性癫痫,
具有全身强直阵挛发作的难治性儿童期癫痫,婴儿痉挛,良性家族性新生儿-幼儿癫痫发作,scn2a癫痫性脑病,具有scn3a突变的病灶性癫痫,具有scn3a突变的隐发性儿科部分癫痫,scn8a癫痫性脑病,癫痫中突发意外死亡,rasmussen脑炎,婴儿期的恶性移行性部分性癫痫发作,常染色体显性夜间额叶癫痫,在癫痫中的突发预期死亡(sudep),kcnq2癫痫性脑病,和kcnt1癫痫性脑病。
[0146]
在某些实施方案中,本文所述的方法进一步包括,在施用本文描述的组合物之前,鉴定具有癫痫或癫痫综合征(例如,癫痫性脑病,具有scn1a、scn2a、scn8a突变的癫痫性脑病,早期幼儿癫痫性脑病,dravet综合征,具有scn1a突变的dravet综合征,具有热性癫痫发作的全身性癫痫,具有全身强直阵挛发作的难治性儿童期癫痫,婴儿痉挛,良性家族性新生儿-幼儿癫痫发作,scn2a癫痫性脑病,具有scn3a突变的病灶性癫痫,具有scn3a突变的隐发性儿科部分癫痫,scn8a癫痫性脑病,癫痫中突发意外死亡,rasmussen脑炎,婴儿期的恶性移行性部分性癫痫发作,常染色体显性夜间额叶癫痫,在癫痫中的突发预期死亡(sudep),kcnq2癫痫性脑病,和kcnt1癫痫性脑病)的受试者。
[0147]
在一个方面,本发明表征了治疗癫痫或癫痫综合征(例如,癫痫性脑病,具有scn1a、scn2a、scn8a突变的癫痫性脑病,早期幼儿癫痫性脑病,dravet综合征,具有scn1a突变的dravet综合征,具有热性癫痫发作的全身性癫痫,具有全身强直阵挛发作的难治性儿童期癫痫,婴儿痉挛,良性家族性新生儿-幼儿癫痫发作,scn2a癫痫性脑病,具有scn3a突变的病灶性癫痫,具有scn3a突变的隐发性儿科部分癫痫,scn8a癫痫性脑病,癫痫中突发意外死亡,rasmussen脑炎,婴儿期的恶性移行性部分性癫痫发作,常染色体显性夜间额叶癫痫,在癫痫中的突发预期死亡(sudep),kcnq2癫痫性脑病,和kcnt1癫痫性脑病)的方法,其包括给有此需要的受试者施用本文描述的组合物。
[0148]
本发明的组合物也可以用于治疗癫痫性脑病,其中所述受试者具有在aldh7a1、alg13、arhgef9、arx、asah1、cdkl5、chd2、chrna2、chrna4、chrnb2、cln8、cntnap2、cpa6、cstb、depdc5、dnm1、eef1a2、epm2a、epm2b、gabra1、gabrb3、gabrg2、gnao1、gosr2、grin1、grin2a、grin2b、hcn1、ier3ip1、kcna2、kcnb1、kcnc1、kcnma1、kcnq2、kcnq3、kcnt1、kctd7、lgi1、mef2c、nhlrc1、pcdh19、plcb1、pnkp、pnpo、prickle1、prickle2、prrt2、reln、scarb2、scn1a、scn1b、scn2a、scn8a、scn9a、siat9、sik1、slc13a5、slc25a22、slc2a1、slc35a2、slc6a1、snip1、sptan1、srpx2、st3gal3、strada、stx1b、stxbp1、syn1、syngap1、szt2、tbc1d24和wwox中的一个或多个中的突变。
[0149]
在某些实施方案中,本文所述的方法进一步包括在施用本文描述的组合物之前鉴定具有在aldh7a1、alg13、arhgef9、arx、asah1、cdkl5、chd2、chrna2、chrna4、chrnb2、cln8、cntnap2、cpa6、cstb、depdc5、dnm1、eef1a2、epm2a、epm2b、gabra1、gabrb3、gabrg2、gnao1、gosr2、grin1、grin2a、grin2b、hcn1、ier3ip1、kcna2、kcnb1、kcnc1、kcnma1、kcnq2、kcnq3、kcnt1、kctd7、lgi1、mef2c、nhlrc1、pcdh19、plcb1、pnkp、pnpo、prickle1、prickle2、prrt2、reln、scarb2、scn1a、scn1b、scn2a、scn8a、scn9a、siat9、sik1、slc13a5、slc25a22、slc2a1、slc35a2、slc6a1、snip1、sptan1、srpx2、st3gal3、strada、stx1b、stxbp1、syn1、syngap1、szt2、tbc1d24、wwox、cacna1g、cacna1h和cacna1i中的一个或多个中的突变的受试者。
[0150]
本发明的组合物也可以用于治疗癫痫性脑病,其中所述受试者具有在adsl、aldh5a1、aldh7a1、alg13、arg1、arhgef9、arx、atp1a2、atp1a3、atrx、brat1、c12orf57、
cacna1a、cacna2d2、cars2、cask、cdkl5、chd2、chrna2、chrna4、chrnb2、clcn4、cln2(tpp1)、cln3、cln5、cln6、cln8、cntnap2、cstb、ctsd、ddc、depdc5、dnajc5、dnm1、dock7、dyrk1a、eef1a2、efhc1、ehmt1、epm2a、fars2、folr1、foxg1、frrs1l、gabbr2、gabra1、gabrb2、gabrb3、gabrg2、gamt、gatm、glra1、gnao1、gosr2、grin1、grin2a、grin2b、hcn1、hnrnpu、ier3ip1、iqsec2、itpa、jmjd1c、kansl1、kcna2、kcnb1、kcnc1、kcnh2、kcnj10、kcnma1、kcnq2、kcnq3、kcnt1、kctd7、lgi1、lias、mbd5、mecp2、mef2c、mfsd8、mocs1、mocs2、mtor、nedd4l、nexmif、ngly1、nhlrc1、nprl3、nrxn1、pacs1、pcdh19、piga、pign、pigo、plcb1、pnkd、pnkp、pnpo、polg、ppt1、prickle1、prima1、prrt2、pura、qars、reln、rogdi、satb2、scarb2、scn1a、scn1b、scn2a、scn3a、scn8a、scn9a、丝氨酸蛋白酶抑制蛋白i1、sgce、sik1、slc12a5、slc13a5、slc19a3、slc25a12、slc25a22、slc2a1、slc35a2、slc6a1、slc6a8、slc9a6、smc1a、snx27、spata5、sptan1、st3gal5、strada、stx1b、stxbp1、suox、syn1、syngap1、synj1、szt2、tbc1d24、tcf4、tpk1、tsc1、tsc2、ube3a、wdr45、wwox、zdhhc9、zeb2、abat、arhgef15、atp6ap2、cacna1h、cacnb4、casr、cers1、cntn2、cpa6、diaph1、fasn、gabrd、gal、gphn、kcna1、kcnd2、kcnh5、kpna7、lmnb2、necap1、pigg、pigq、pik3ap1、prdm8、prickle2、rbfox1、rbfox3、ryr3、scn5a、setd2、slc35a3、snap25、srpx2、st3gal3、tbl1xr1、amt、gcsh、gldc、flna、pten和ranbp2中的一个或多个中的突变。
[0151]
在某些实施方案中,本文所述的方法进一步包括鉴定具有在adsl、aldh5a1、aldh7a1、alg13、arg1、arhgef9、arx、atp1a2、atp1a3、atrx、brat1、c12orf57、cacna1a、cacna2d2、cars2、cask、cdkl5、chd2、chrna2、chrna4、chrnb2、clcn4、cln2(tpp1)、cln3、cln5、cln6、cln8、cntnap2、cstb、ctsd、ddc、depdc5、dnajc5、dnm1、dock7、dyrk1a、eef1a2、efhc1、ehmt1、epm2a、fars2、folr1、foxg1、frrs1l、gabbr2、gabra1、gabrb2、gabrb3、gabrg2、gamt、gatm、glra1、gnao1、gosr2、grin1、grin2a、grin2b、hcn1、hnrnpu、ier3ip1、iqsec2、itpa、jmjd1c、kansl1、kcna2、kcnb1、kcnc1、kcnh2、kcnj10、kcnma1、kcnq2、kcnq3、kcnt1、kctd7、lgi1、lias、mbd5、mecp2、mef2c、mfsd8、mocs1、mocs2、mtor、nedd4l、nexmif、ngly1、nhlrc1、nprl3、nrxn1、pacs1、pcdh19、piga、pign、pigo、plcb1、pnkd、pnkp、pnpo、polg、ppt1、prickle1、prima1、prrt2、pura、qars、reln、rogdi、satb2、scarb2、scn1a、scn1b、scn2a、scn3a、scn8a、scn9a、丝氨酸蛋白酶抑制蛋白i1、sgce、sik1、slc12a5、slc13a5、slc19a3、slc25a12、slc25a22、slc2a1、slc35a2、slc6a1、slc6a8、slc9a6、smc1a、snx27、spata5、sptan1、st3gal5、strada、stx1b、stxbp1、suox、syn1、syngap1、synj1、szt2、tbc1d24、tcf4、tpk1、tsc1、tsc2、ube3a、wdr45、wwox、zdhhc9、zeb2、abat、arhgef15、atp6ap2、cacna1h、cacnb4、casr、cers1、cntn2、cpa6、diaph1、fasn、gabrd、gal、gphn、kcna1、kcnd2、kcnh5、kpna7、lmnb2、necap1、pigg、pigq、pik3ap1、prdm8、prickle2、rbfox1、rbfox3、ryr3、scn5a、setd2、slc35a3、snap25、srpx2、st3gal3、tbl1xr1、amt、gcsh、gldc、flna、pten和ranbp2中的一个或多个中的突变的受试者。
[0152]
本发明的组合物也可以用于治疗癫痫性脑病,其中所述受试者具有在adsl、aldh5a1、aldh7a1、alg13、arhgef9、arx、asns、atp1a2、atp1a3、atp6ap2、atrx、brat1、cacna1a、cask、cdkl5、chd2、chrna2、chrna4、chrna7、chrnb2、clcn4、cln3、cln5、cln6、cln8、cntnap2、cstb、ctnnb1、ctsd(cln10)、ctsf、ddx3x、depdc5、dnajc5(cln4b)、dnm1、dyrk1a、eef1a2、ehmt1、epm2a、flna、folr1、foxg1、frrs1l、gabbr2、gabra1、gabrb2、
gabrb3、gabrg2、gamt、gatm、gldc、gnao1、gosr2、grin1、grin2a、grin2b、hnrnpu、iqsec2、kansl1、kcna2、kcnb1、kcnc1、kcnh1、kcnj10、kcnma1、kcnq2、kcnq3、kcnt1、kctd7(cln14)、kdm6a、kiaa2022、lgi1、magi2、mbd5、mecp2、mef2c、mfsd8(cln7)、nalcn、ngly1、nhlrc1(epm2b)、nprl3.nr2f1、nrxn1、pacs1、pcdh19、piga pigo、pigv、plcb1、pnkp、pnpo、polg、ppp2r5d、ppt1(cln1)、prrt2、pura、qars、satb2、scarb2、scn1a、scn1b、scn2a、scn8a、slc13a5、slc19a3、slc25a22、slc2a1、slc6a1、slc6a8、slc9a6、smc1a、spata5、sptan1、stx1b、stxbp1、syngap1、szt2、tbc1d24、tbl1xr1、tcf4、tpp1(cln2)、tsc1、tsc2、ube3a、wdr45、wwox和zeb2中的一个或多个中的突变。
[0153]
在某些实施方案中,本文所述的方法进一步包括鉴定具有在adsl、aldh5a1、aldh7a1、alg13、arhgef9、arx、asns、atp1a2、atp1a3、atp6ap2、atrx、brat1、cacna1a、cask、cdkl5、chd2、chrna2、chrna4、chrna7、chrnb2、clcn4、cln3、cln5、cln6、cln8、cntnap2、cstb、ctnnb1、ctsd(cln10)、ctsf、ddx3x、depdc5、dnajc5(cln4b)、dnm1、dyrk1a、eef1a2、ehmt1、epm2a、flna、folr1、foxg1、frrs1l、gabbr2、gabra1、gabrb2、gabrb3、gabrg2、gamt、gatm、gldc、gnao1、gosr2、grin1、grin2a、grin2b、hnrnpu、iqsec2、kansl1、kcna2、kcnb1、kcnc1、kcnh1、kcnj10、kcnma1、kcnq2、kcnq3、kcnt1、kctd7(cln14)、kdm6a、kiaa2022、lgi1、magi2、mbd5、mecp2、mef2c、mfsd8(cln7)、nalcn、ngly1、nhlrc1(epm2b)、nprl3.nr2f1、nrxn1、pacs1、pcdh19、piga pigo、pigv、plcb1、pnkp、pnpo、polg、ppp2r5d、ppt1(cln1)、prrt2、pura、qars、satb2、scarb2、scn1a、scn1b、scn2a、scn8a、slc13a5、slc19a3、slc25a22、slc2a1、slc6a1、slc6a8、slc9a6、smc1a、spata5、sptan1、stx1b、stxbp1、syngap1、szt2、tbc1d24、tbl1xr1、tcf4、tpp1(cln2)、tsc1、tsc2、ube3a、wdr45、wwox和zeb2中的一个或多个中的突变的受试者。
[0154]
本发明的组合物也可以用于治疗癫痫性脑病,其中所述受试者具有在aldh7a1、arhgef9、arx、atp13a2、atp1a2、cacna1a、cask、cdkl5、chd2、chrna2、chrna4、chrnb2、cln3、cln5、cln6、cln8、cntnap2、crh、cstb、ctsd、ctsf、dcx、depdc5、dnajc5、dnm1、dync1h1、dyrk1a、eef1a2、epm2a、flna、folr1、foxg1、gabra1、gabrb3、gabrg2、gamt、gatm、gnao1、gosr2、grin1、grin2a、grin2b、grn、hcn1、hnrnpu、iqsec2、kcna2、kcnc1、kcnj10、kcnq2、kcnq3、kcnt1、kctd7、kiaa2022、lgi1、mecp2、mef2c、mfsd8、nhlrc1、nrxn1、pcdh19、piga、plcb1、pnkp、pnpo、polg、ppt1、prickle1、prrt2、pura、scarb2、scn1a、scn1b、scn2a、scn8a、sik1、slc13a5、slc25a22、slc2a1、slc35a2、slc6a1、slc9a6、smc1a、snap25、sptan1、st3gal3、stx1b、stxbp1、syn1、syngap1、szt2、tbc1d24、tbl1xr1、tcf4、tpp1、tsc1、tsc2、ube3a、wdr45和zeb2中的一个或多个中的突变。
[0155]
在某些实施方案中,本文所述的方法进一步包括鉴定具有在aldh7a1、arhgef9、arx、atp13a2、atp1a2、cacna1a、cask、cdkl5、chd2、chrna2、chrna4、chrnb2、cln3、cln5、cln6、cln8、cntnap2、crh、cstb、ctsd、ctsf、dcx、depdc5、dnajc5、dnm1、dync1h1、dyrk1a、eef1a2、epm2a、flna、folr1、foxg1、gabra1、gabrb3、gabrg2、gamt、gatm、gnao1、gosr2、grin1、grin2a、grin2b、grn、hcn1、hnrnpu、iqsec2、kcna2、kcnc1、kcnj10、kcnq2、kcnq3、kcnt1、kctd7、kiaa2022、lgi1、mecp2、mef2c、mfsd8、nhlrc1、nrxn1、pcdh19、piga、plcb1、pnkp、pnpo、polg、ppt1、prickle1、prrt2、pura、scarb2、scn1a、scn1b、scn2a、scn8a、sik1、slc13a5、slc25a22、slc2a1、slc35a2、slc6a1、slc9a6、smc1a、snap25、sptan1、st3gal3、
stx1b、stxbp1、syn1、syngap1、szt2、tbc1d24、tbl1xr1、tcf4、tpp1、tsc1、tsc2、ube3a、wdr45和zeb2中的一个或多个中的突变的受试者。
[0156]
心境障碍
[0157]
本文还提供了用于治疗精神病学障碍的方法,所述精神病学障碍是诸如心境障碍,例如临床抑郁症、出生后抑郁症或产后抑郁症、围产期抑郁症、非典型抑郁症、忧郁型抑郁症、精神病性重性抑郁症、紧张型抑郁症、季节性情感障碍、心境恶劣、双重抑郁症、抑郁型人格障碍、反复发作的短暂性抑郁症、轻度抑郁障碍、双相型障碍或躁狂抑郁障碍、由慢性医学病症造成的抑郁症、治疗抗性抑郁症、难治性抑郁症、自杀倾向、自杀观念或自杀行为。在某些实施方案中,本文描述的方法为遭受抑郁症(例如,中等或严重抑郁症)的受试者提供了治疗效果。在某些实施方案中,所述心境障碍与本文描述的疾病或障碍(例如,神经内分泌疾病和障碍、神经变性疾病和障碍(例如,癫痫)、运动障碍、震颤(例如,帕金森病)、女性的健康障碍或病症)有关。
[0158]
临床抑郁症也被称作重性抑郁症、严重抑郁障碍(mdd)、严重抑郁症、单相抑郁、单相障碍和复发性抑郁症,并且表示以普遍且持续的低情绪为特征的精神障碍,伴有低自尊心和在正常的愉快的活动中的兴趣或快乐的丧失。有些临床抑郁症患者睡眠困难,体重减轻,并且一般感到焦虑和易怒。临床抑郁症影响个体如何感觉、思考和行动,并可能导致多种情绪和身体问题。患有临床抑郁症的个体可能难以进行日常活动,并使个体感觉如同生命不值得活一样。
[0159]
围产期抑郁症表示在妊娠中的抑郁症。症状包括易怒、哭泣、感觉不安、难以睡眠、极度衰竭(情绪和/或身体)、食欲改变、聚焦困难、焦虑和/或担心增加、与婴儿和/或胎儿的分离感以及对从前令人快乐的活动失去兴趣。
[0160]
出生后抑郁症(pnd)也被称作产后抑郁症(ppd),并且表示一类影响分娩后女性的临床抑郁症。症状可以包括悲伤、疲劳、睡眠和饮食习惯的改变、性欲减退、哭泣发作、焦虑和易怒。在某些实施方案中,pnd是治疗抗性抑郁症(例如,如本文中所述的治疗抗性抑郁症)。在某些实施方案中,所述pnd是难治性抑郁症(例如,如本文中所述的难治性抑郁症)。
[0161]
在某些实施方案中,患有pnd的受试者在妊娠期中也经历抑郁症或抑郁症的症状。这种抑郁症在本文中被称作围产期抑郁症。在一个实施方案中,经历围产期抑郁症的受试者处于增加的经历pnd的风险中。
[0162]
非典型抑郁症(ad)的特征在于情绪反应性(例如,反常快感缺失)和积极性,显著的体重增加或食欲增加。患有ad的患者还可能具有过度的睡眠或嗜睡(睡眠过度)、肢体沉重感以及作为对感知的人际间排斥的超敏反应的结果的显著社会障碍。
[0163]
忧郁型抑郁症的特征在于在大多数或所有活动中丧失快乐(快感缺失),对愉悦刺激没有反应,抑郁情绪比悲伤或损失情绪更明显,过度体重减轻或过度内疚。
[0164]
精神病性重性抑郁症(pmd)或精神病性抑郁症表示重度抑郁发作,特别是忧郁症性质,其中个体经历精神病性症状诸如妄想和幻觉。
[0165]
紧张型抑郁症表示涉及运动行为和其它症状的紊乱的重性抑郁症。个体可能变得沉默和木僵,并且是不动的或展示无意义或奇怪的运动。
[0166]
季节性情感障碍(sad)表示一类季节性抑郁症,其中个体在秋季或冬季有抑郁发作的季节性模式。
[0167]
心境恶劣表示一种与单相抑郁相关的病症,其中相同的身体和认知问题是明显的。它们不那么严重,且往往更持久(例如,至少2年)。
[0168]
双重抑郁症表示持续至少2年的相当抑郁的情绪(心境恶劣),并且被重性抑郁症的阶段突显。
[0169]
抑郁型人格障碍(dpd)表示具有抑郁特征的人格障碍。
[0170]
反复发作的短暂性抑郁症(rbd)表示其中个体具有约每个月一次的抑郁发作的病症,每次发作持续2周或更少,且通常小于2-3天。
[0171]
轻度抑郁障碍或轻性抑郁表示其中存在至少2种症状达2周的抑郁症。
[0172]
双相型障碍或躁狂抑郁障碍造成极端心境不稳,包括情绪高涨(躁狂症或轻躁狂)和低落(抑郁症)。在躁狂症期间,个体可能异常感到或表现出快乐、精力充沛或易怒。他们经常做出缺乏深思熟虑的决定,而很少考虑后果。睡眠需求通常减少。在抑郁症期间,可能有哭泣,与他人的眼神交流不佳,以及对生活的消极看法。患有这种障碍的人在20年内自杀的风险很高,超过6%,而自残的发生率为30-40%。其它心理健康问题,诸如焦虑障碍和物质使用障碍通常与双相型障碍有关。
[0173]
由慢性医学病症造成的抑郁症表示由慢性医学病症(诸如癌症或慢性疼痛、化学疗法、慢性应激)造成的抑郁症。
[0174]
治疗抗性抑郁症表示其中已经对个体治疗抑郁症但是症状没有改善的病症。例如,抗抑郁药或心理咨询(心理疗法)不能缓解患有治疗抗性抑郁症的个体的抑郁症状。在一些情况下,具有治疗抗性抑郁症的个体改善症状,但复发。难治性抑郁症发生在对标准药理学治疗(包括三环抗抑郁药、maoi、ssri、以及双重和三重摄取抑制剂和/或抗焦虑药物)、以及非药理学治疗(例如,心理疗法、电惊厥疗法、迷走神经刺激和/或经颅磁刺激)具有抗性的患有抑郁症的患者中。
[0175]
手术后抑郁症表示在外科手术后的抑郁情感(例如,因为必须面对人的死亡)。例如,个体可能持久地感觉到悲伤或空虚的情绪,对平常喜欢的爱好及活动失去快乐或兴趣,或持久的无价值或绝望感。
[0176]
与女性健康的病症或障碍相关的心境障碍表示与女性健康的病症或障碍(例如,如本文中所述的)相关(例如由其引起)的心境障碍(例如,抑郁症)。
[0177]
自杀倾向、自杀观念、自杀行为表示个体发生自杀的倾向。自杀观念涉及对自杀的想法或不寻常的关注。自杀观念的范围极大地变化,从例如短暂的想法到广泛的想法、详细的计划、角色扮演、不完全尝试。症状包括谈论自杀、获得自杀的手段、退出社交联系、关注死亡、感觉陷入被困或无望的境地、酒精或毒品使用增加、做有风险或自我毁灭的事情、告别别人如同他们不会再见面一样。
[0178]
抑郁症的症状包括持续的焦虑或悲伤感觉、无助、绝望、悲观、无价值的感觉、低能量、不安、睡眠困难、失眠、易怒、疲劳、运动挑战、对快乐活动或爱好的兴趣丧失、丧失专注力、丧失活力、自尊心差、缺乏积极的想法或计划、嗜睡、过量进食、食欲下降、失眠症、自我伤害、自杀想法和自杀企图。症状的存在、严重程度、频率和持续时间可以随个例而变化。抑郁症的症状及其缓解可以由医师或心理学家确定(例如,通过精神状态检查)。
[0179]
在某些实施方案中,所述心境障碍选自抑郁症、严重抑郁障碍、双相型障碍、心境恶劣障碍、焦虑障碍、应激、创伤后应激障碍、双相型障碍和强迫性障碍。在某些实施方案
中,所述心境障碍是严重抑郁障碍。
[0180]
在某些实施方案中,所述方法包括用已知的抑郁症量表监测受试者,所述已知的抑郁症量表是例如hamilton抑郁症(ham-d)量表、临床总体印象-改善量表(cgi)和montgomery-asberg抑郁症评级量表(madrs)。在某些实施方案中,通过受试者表现出的hamilton抑郁症(ham-d)总评分的减小,可以确定治疗效果。可以在指定的治疗期评估治疗效果。例如,通过在施用本文描述的组合物以后(例如,施用后12、24或48小时;或24、48、72或96小时或更多;或1天、2天、14天、21天或28天;或1周、2周、3周或4周;或1个月、2个月、6个月或10个月;或1年、2年或终身)ham-d总评分从基线的下降,可以确定治疗效果。
[0181]
在某些实施方案中,所述受试者具有轻性抑郁障碍,例如,轻性严重抑郁障碍。在某些实施方案中,所述受试者具有中等抑郁障碍,例如,中等严重抑郁障碍。在某些实施方案中,所述受试者具有重性抑郁障碍,例如,重性严重抑郁障碍。在某些实施方案中,所述受试者具有极重性抑郁障碍,例如,极重性严重抑郁障碍。在某些实施方案中,受试者的基线ham-d总评分(即,在用本文描述的组合物治疗之前)是至少24。在某些实施方案中,受试者的基线ham-d总评分是至少18。在某些实施方案中,受试者的基线ham-d总评分是在14和18之间且包括端值。在某些实施方案中,受试者的基线ham-d总评分是在19和22之间且包括端值。在某些实施方案中,在用本文描述的组合物治疗之前受试者的ham-d总评分大于或等于23。在某些实施方案中,所述基线评分是至少10、15或20。在某些实施方案中,在用本文描述的组合物治疗之后受试者的ham-d总评分是约0至10(例如,小于10;0至10、0至6、0至4、0至3、0至2或1.8)。在某些实施方案中,在用本文描述的组合物治疗之后的ham-d总评分小于10、7、5或3。在某些实施方案中,ham-d总评分的下降是从约20至30(例如,22至28、23至27、24至27、25至27、26至27)的基线评分至在用本文描述的组合物治疗之后约0至10(例如,小于10;0至10、0至6、0至4、0至3、0至2或1.8)的ham-d总评分。在某些实施方案中,基线ham-d总评分至在用本文描述的组合物治疗之后的ham-d总评分的下降是至少1、2、3、4、5、7、10、25、40或50)。在某些实施方案中,基线ham-d总评分至在用本文描述的组合物治疗之后的ham-d总评分的下降百分比是至少50%(例如,60%、70%、80%或90%)。在某些实施方案中,将治疗效果测量为在用本文描述的组合物治疗之后的ham-d总评分相对于基线ham-d总评分的下降。
[0182]
在某些实施方案中,治疗抑郁障碍(例如,严重抑郁障碍)的方法在14、10、4、3、2或1天或24、20、16、12、10或8小时或更短时间内提供治疗效果(例如,如通过hamilton抑郁症评分(ham-d)的减小所测量的)。在某些实施方案中,治疗抑郁障碍(例如,严重抑郁障碍)的方法在用本文描述的组合物治疗的第一天或第二天内在内提供治疗效果(例如,如通过统计上显著的ham-d总评分减小所确定的)。在某些实施方案中,治疗抑郁障碍(例如,严重抑郁障碍)的方法在从用本文描述的组合物治疗开始后小于或等于14天内提供治疗效果(例如,如通过统计上显著的ham-d总评分减小所确定的)。在某些实施方案中,治疗抑郁障碍(例如,严重抑郁障碍)的方法在从用本文描述的组合物治疗开始后小于或等于21天内提供治疗效果(例如,如通过统计上显著的ham-d总评分减小所确定的)。在某些实施方案中,治疗抑郁障碍(例如,严重抑郁障碍)的方法在从用本文描述的组合物治疗开始后小于或等于28天内提供治疗效果(例如,如通过统计上显著的ham-d总评分减小所确定的)。在某些实施方案中,所述治疗效果是在用本文描述的组合物治疗之后ham-d总评分从基线的下降。在某
些实施方案中,在用本文描述的组合物治疗之前受试者的ham-d总评分是至少24。在某些实施方案中,在用本文描述的组合物治疗之前受试者的ham-d总评分是至少18。在某些实施方案中,在用本文描述的组合物治疗之前受试者的ham-d总评分是在14和18之间且包括端值。在某些实施方案中,在用本文描述的组合物治疗受试者之后ham-d总评分相对于基线ham-d总评分的下降是至少10。在某些实施方案中,在用本文描述的组合物治疗受试者之后ham-d总评分相对于基线ham-d总评分的下降是至少15。在某些实施方案中,与用本文描述的组合物治疗受试者有关的ham-d总评分不超过在6至8范围内的数字。在某些实施方案中,与用本文描述的组合物治疗受试者有关的ham-d总评分不超过7。
[0183]
在某些实施方案中,所述方法在14、10、4、3、2或1天或24、20、16、12、10或8小时或更短时间内提供治疗效果(例如,如通过临床总体印象-改善量表(cgi)的减小所测量的)。在某些实施方案中,所述cns障碍是抑郁障碍,例如,严重抑郁障碍。在某些实施方案中,治疗抑郁障碍(例如,严重抑郁障碍)的方法在治疗期的第二天内提供治疗效果。在某些实施方案中,所述治疗效果是在治疗期末期(例如,施用后14天)cgi评分从基线的下降。
[0184]
在某些实施方案中,所述cns障碍是抑郁障碍,例如,严重抑郁障碍。在某些实施方案中,治疗抑郁障碍(例如,严重抑郁障碍)的方法在治疗期的第二天内提供治疗效果。在某些实施方案中,所述治疗效果是在治疗期末期(例如,施用后14天)madrs评分从基线的下降。
[0185]
通过受试者表现出的montgomery-asberg抑郁症评级量表(madrs)评分的减小,可以确定严重抑郁障碍的治疗效果。例如,madrs评分可以在4、3、2或1天或96、84、72、60、48、24、20、16、12、10、8小时或更短时间内减小。montgomery-抑郁症评级量表(madrs)是十项诊断问卷调查(关于明显的悲伤、报告的悲伤、内心紧张、睡眠减少、食欲下降、注意力不集中、疲倦、感觉丧失、悲观想法和自杀念头),精神科医师用它来衡量心境障碍患者的抑郁发作的严重程度。
[0186]
疼痛
[0187]
本文描述的剂型和组合物可用于治疗疼痛。在某些实施方案中,所述疼痛包含急性疼痛、慢性疼痛、神经性疼痛、炎症性疼痛、伤害性疼痛、中枢性疼痛(例如,丘脑疼痛)或偏头痛。在某些实施方案中,所述疼痛包含急性疼痛或慢性疼痛。在某些实施方案中,所述疼痛包含神经性疼痛、炎症性疼痛或伤害性疼痛。在某些实施方案中,所述疼痛包含中枢性疼痛(例如,丘脑疼痛)。在某些实施方案中,所述疼痛包含偏头痛。
[0188]
在某些实施方案中,本文所述的方法进一步包括,在施用本文描述的剂型或组合物(例如,包括式(i)的化合物或其药学上可接受的盐(例如,式(ii)的化合物)的剂型或组合物)之前,鉴定具有疼痛(例如,急性疼痛、慢性疼痛、神经性疼痛、炎症性疼痛、伤害性疼痛、中枢性疼痛(例如,丘脑疼痛)或偏头痛)的受试者。
[0189]
震颤
[0190]
本文所述的方法可以用于治疗震颤,例如本文中公开的剂量或组合物可以用于治疗小脑性震颤或意向性震颤、张力障碍性震颤、特发性震颤、直立性震颤、帕金森病震颤、生理性震颤或红核震颤。震颤包括遗传性、退行性和特发性障碍,分别诸如威尔森氏病、帕金森病和特发性震颤;代谢疾病;周围神经病(与夏科-马里-图斯三氏病(charcot-marie-tooth)、罗-雷二氏病(roussy-levy)、糖尿病、复杂性局部疼痛综合征相关);毒素(烟碱、
汞、铅、co、锰、砷、甲苯);药物诱导(神经安定药三环类、锂、可卡因、酒精、肾上腺素、支气管扩张剂、茶碱、咖啡因、类固醇、丙戊酸盐、胺碘酮、甲状腺激素、长春新碱);和心理性障碍。临床震颤可以分类为生理性震颤、增强型生理性震颤、特发性震颤综合征(包括经典特发性震颤、原发性直立性震颤以及任务和位置特异性震颤)、张力障碍性震颤、帕金森病震颤、小脑性震颤、holmes氏震颤(即,红核震颤)、腭震颤、神经病性震颤、中毒性或药物诱发的震颤和心理性震颤。震颤可能是家族性震颤。
[0191]
震颤是不自主的、节律性的肌肉收缩和放松,其可以涉及一个或多个身体部位(例如,手、臂、眼、面部、头、声带、躯干、腿)的振动或颤搐。
[0192]
小脑性震颤或意向性震颤是在有目的的运动之后发生的肢体的缓慢、广泛的震颤。小脑性震颤由小脑中的病变或对小脑的损伤引起,所述病变或损伤源自例如肿瘤、中风或其它局灶性病变疾病(例如,多发性硬化)或神经变性疾病。
[0193]
张力障碍性震颤发生在受张力失常(一种运动障碍,其中持续的无意识肌肉收缩造成扭转和重复运动和/或疼痛的和异常的姿势或位置)影响的个体中。张力障碍性震颤可能影响身体内的任何肌肉。张力障碍性震颤不规则地发生,并且经常可以通过完全休息或某些感觉操作来缓解。
[0194]
特发性震颤或良性特发性震颤是最常见的震颤类型。特发性震颤可以是轻度的,并且一些是非进展性的,并且可以是缓慢进展的,从身体的一侧开始,但通常影响两侧。手最常受影响,但头、声音、舌、腿和躯干也可能累及。震颤频率可能随着人年龄下降,但严重程度可能增加。加重的情绪、应激、发热、身体疲惫或低血糖可能触发震颤和/或增加其严重程度。症状通常随时间进展且在发生后可为明显的和持续的。
[0195]
直立性震颤的特征在于快速(例如,大于12hz)节律性肌肉收缩,其在站立后立即发生在腿和躯干中。在大腿和腿部感觉到痉挛,并且当被要求站在一个地点时,患者可能无法控制地摇晃。直立性震颤可发生在患有特发性震颤的患者中。
[0196]
帕金森病震颤由对脑内控制运动的结构的损伤引起。帕金森病震颤通常被视为手的“滚丸”动作,其也可能影响下巴、唇、腿和躯干。帕金森病震颤的发作通常在60岁后开始。运动开始于一个肢体或身体的一侧,并且可以进展到包括另一侧。
[0197]
红核震颤的特征在于粗略的慢震颤,其可以在静息、处于姿势和有意的情况下存在。震颤与影响中脑中的红核的病症(诸如中风)相关。
[0198]
在某些实施方案中,所述震颤选自特发性震颤、帕金森氏病震颤或小脑性震颤。
[0199]
在另一个方面,本文提供了在有此需要的患者中治疗特发性震颤的方法,其包括给所述患者施用足够量的式(i)的化合物,其导致如通过特发性震颤等级评定评估量表(tetras)评分所评估的特发性震颤的减轻。本文中使用的术语“特发性震颤等级评定评估量表(tetras)”表示为量化特发性震颤的严重程度及其对日常活动的影响而开发的量表。它具有一个日常生活活动(adl)部分和一个表现部分。adl部分具有12个评级在0到4之间的项目,且表现部分具有9个评级在0到4之间的项目。
[0200]
在某些实施方案中,通过特发性震颤等级评定评估量表(tetras)上肢评分评估特发性震颤的减轻。
[0201]
在某些实施方案中,通过tetras表现子量表评分或tetras表现个别项目评估特发性震颤的减轻。
[0202]
在另一个方面,本文提供了在有此需要的患者中治疗特发性震颤的方法,其包括给所述患者施用足够量的式(i)的化合物,其导致通过基于加速度计的评分(例如,基于加速度计的上肢评分)所评估的特发性震颤的减轻。
[0203]
在某些实施方案中,所述特发性震颤是上肢震颤。
[0204]
在另一个方面,本文提供了在有此需要的患者中治疗特发性震颤的方法,其包括给所述患者施用足够量的式(i)的化合物,其导致如通过cgi评分所评估的特发性震颤的减轻。
[0205]
通过在下述参考文献中描述的方法,可以测量本文描述的化合物或组合物用于治疗特发性震颤的效力:ferreira,j.j.等人,“mds evidence-based review of treatments for essential tremor.”mov.disord.2019年7月;34(7):950-958;elble,r.等人,“task force report:scales for screening and evaluating tremor.”mov.disord.2013年11月;28(13):1793-800.deuschl g.等人.“treatment of patients with essential tremor.”lancet neurol.2011;10:148-61.reich s.g.等人.“essential tremor.”med.clin.n.am.103(2019)351-356。参考文献的公开内容以它们的整体并入本文中。
[0206]
共济失调
[0207]
共济失调,包括小脑性共济失调和脊髓性共济失调(例如,后脊髓性共济失调),通常涉及协调的丧失或失败。表现出共济失调的患者可能难以调节在姿势、平衡和肢体运动中所涉及的力、范围、方向、速度和节奏。例如,躯干的共济失调可以导致姿势晃动增加,并且不能将重心保持在支撑底部之上。共济失调以及共济失调步态和四肢震颤的原发或继发症状可能伴有言语紊乱、吞咽困难、通气和言语异常以及不自主的眼球运动、张力失常、锥体或锥体外系症状,从而严重干扰日常生活的活动。
[0208]
如上面所指出的,共济失调可能由患者中的多种潜在疾病和病症引起,包括小脑和神经变性障碍以及由慢性或长期暴露于毒素引起的疾病。共济失调的症状可能由多种疾病、障碍和环境因素引起,包括感染性疾病、代谢疾病、神经变性疾病、遗传性疾病、血管疾病、赘生性疾病、脱髓鞘疾病、神经肌肉疾病以及由长期或慢性暴露于毒素(包括药物和酒精)引起的疾病等;在一个实施方案中,例如,共济失调是代谢疾病、神经变性疾病、血管疾病、神经肌肉疾病或由长期或长期或慢性暴露于毒素引起的疾病的结果。可能导致可用根据本文所述的方法治疗的共济失调症状的疾病、障碍、综合征和病症包括、但不限于:肌萎缩性侧索硬化,良性阵发性体位性眩晕,小脑性共济失调1型(常染色体隐性的),小脑性共济失调(常染色体隐性的),小脑性共济失调(显性纯的),小脑皮质萎缩,小脑变性(亚急性),小脑功能障碍,小脑发育不全,小脑发育不全(骨内膜硬化),小脑发育不全(视网膜毯层变性),小脑实质常染色体隐性障碍3,小脑实质障碍v,小脑发育不全(脑积水),脑淀粉样蛋白血管病(家族性),脑性瘫痪,脱髓鞘障碍,脊柱病症,自主神经机能异常,平衡失调综合征,dysethesis,内分泌疾病,由慢性暴露于毒素(例如,酒精、药物、抗癫痫药、神经安定药)造成的疾病,脆性x染色体/震颤共济失调综合征,弗里德赖希氏共济失调,额叶功能障碍,遗传性疾病,中枢神经系统的肉芽肿性血管炎,哈-斯二氏病,遗传性运动与感觉神经病,脑积水(例如,低或常压),张力过低,先天性眼球震颤,共济失调和异常的听性脑干反应,幼儿发作型脊髓小脑性共济失调,machado-joseph病,梅尼埃病,代谢障碍,miller fisher综合征,水俣病,多发性硬化,肌营养不良,肌阵挛-共济失调,神经变性疾病,橄榄体脑桥小脑萎
缩,副肿瘤性障碍,帕金森症(非典型的),腓侧肌萎缩,苯妥英毒性,具有色素性视网膜炎的后柱共济失调,脊髓灰质炎后综合征,对脑的严重损伤(例如,由头损伤、脑外科手术、多发性硬化或脑性瘫痪、慢性酒精/药物滥用、慢性暴露于毒素、病毒感染或脑肿瘤造成),痉挛性轻偏瘫,痉挛性截瘫23,痉挛性截瘫青光眼性早熟,spg,脊髓小脑性共济失调,脊髓小脑性共济失调(肌萎缩—耳聋),脊髓小脑性共济失调(畸形),脊髓小脑性共济失调11,脊髓小脑性共济失调17,脊髓小脑性共济失调20,脊髓小脑性共济失调25,脊髓小脑性共济失调29,脊髓小脑性共济失调42,脊髓小脑性共济失调3,脊髓小脑性共济失调(常染色体隐性的1),脊髓小脑性共济失调(常染色体隐性的3),脊髓小脑性共济失调(常染色体隐性的4),脊髓小脑性共济失调(常染色体隐性的5),脊髓小脑性共济失调(常染色体隐性的,具有轴突神经病),脊髓小脑性共济失调(machado-joseph ii型),脊髓小脑性共济失调(x-连锁的,2),脊髓小脑性共济失调(x-连锁的,3),脊髓小脑性共济失调(x-连锁的,4),脊髓小脑变性(书型),中风(例如,急性或出血性),椎动脉解剖,椎骨底动脉循环不全,和由维生素缺乏造成的疾病,等。在一个实施方案中,所述共济失调是选自脊髓小脑性共济失调、friedriech氏共济失调和脆性x染色体/震颤共济失调综合征的疾病的结果。在另一个特定实施方案中,所述共济失调是脊髓小脑性共济失调或脆性x染色体/震颤共济失调综合征的结果。
[0209]
耳鸣
[0210]
提供了使用所公开的剂型或组合物在有此需要的受试者中治疗耳鸣的方法。耳鸣是这样的病症:其中当没有外部声音存在时,受影响的人在一只或两只耳朵或头部感知声音。经常被称为耳中“鸣”,耳鸣可以间歇性地或持续地发生,感知音量的范围从低到痛苦的高。但是,耳鸣的感知音量可能因患者而异,其中一个患者的耳鸣音量的客观量度可能被认为是痛苦的,但在另一位患者中,相同的音量可能被认为是微妙的。
[0211]
睡眠障碍
[0212]
本文提供了使用本文中公开的剂量或组合物治疗或预防睡眠障碍(例如,发作性睡病)的方法。例如,睡眠障碍可以是嗜睡病的中枢障碍、i型发作性睡病、ii型发作性睡病、特发性睡眠过度、kleine-levin综合征、由医学障碍引起的睡眠过度、由药物或物质引起的睡眠过度、与精神病学障碍相关的睡眠过度、睡眠不足综合征、昼夜节律睡眠-觉醒障碍、延迟的睡眠-觉醒期障碍、晚期睡眠-觉醒期障碍、不规则的睡眠-觉醒节律、非-24-小时睡眠-觉醒节律障碍、轮班工作障碍、时差综合症障碍、无特殊说明的(nos)昼夜节律睡眠-觉醒障碍。
[0213]
联合疗法
[0214]
本文描述的剂型或组合物(例如,用于调节t-型钙离子通道)可以与另一种药剂或疗法联合施用。要施用本文公开的化合物的受试者可能患有将受益于用另一种药剂或疗法治疗的疾病、障碍或病症或其症状。这些疾病或病症可以与癫痫或癫痫综合征(例如,失神性癫痫发作、青少年肌阵挛型癫痫或遗传性癫痫)或震颤(例如,特发性震颤)有关。
[0215]
抗癫痫剂
[0216]
抗癫痫剂包括布瓦西坦、卡马西平、氯巴占、氯硝西泮、地西泮、双丙戊酸钠、艾司利卡西平、乙琥胺、依佐加滨、非尔氨酯、加巴喷丁、拉科酰胺、拉莫三嗪、左乙拉西坦、劳拉西泮、奥卡西平、吡仑帕奈(permpanel)、苯巴比妥、苯妥英、普瑞巴林、扑米酮、卢非酰胺、噻加宾(tigabine)、托吡酯、丙戊酸、氨己烯酸、唑尼沙胺。
[0217]
镇痛药
[0218]
镇痛药是用于缓解疼痛的治疗剂。镇痛药的例子包括阿片剂和拟吗啡样物质,诸如芬太尼和吗啡;对乙酰氨基酚;非甾体抗炎药和cox-2抑制剂。鉴于本发明的化合物通过抑制t-型钙通道(例如,cav3.1、cav3.2和cav3.3)治疗疼痛的能力,特别设想与镇痛药的组合。
[0219]
震颤药物
[0220]
震颤药物包括普萘洛尔、扑米酮、氯硝西泮、地西泮、劳拉西泮、阿普唑仑、加巴喷丁、托吡酯、妥泰、neurontin、阿替洛尔、klonopin、阿普唑仑、奈必洛尔、卡比多巴/左旋多巴、氯硝西泮、氢氯噻嗪/美托洛尔、加巴喷丁酯、拉贝洛尔、乳果糖、拉莫三嗪、美托洛尔、纳多洛尔、氢氯噻嗪和唑尼沙胺。
[0221]
实施例
[0222]
为了可以更充分地理解本文描述的发明,阐述了下述实施例。提供在本技术中描述的合成和生物学实施例来举例说明本文提供的化合物、药物组合物和方法,并且不应以任何方式解释为限制它们的范围。
[0223]
实施例1:通过x-射线粉末衍射分析式(ii)的化合物的结晶度
[0224]
进行式(ii)的化合物的多晶型物筛选,并鉴定出稳定的固态形式(被称作形式c)。通过x-射线粉末衍射(xrpd)分析形式c的结晶度。
[0225]
使用bruker d8 advance和下述条件进行xrpd分析。
[0226]
bragg brentano几何形状。
[0227]
2θ范围:3
°
至40
°
。
[0228]
步长:0.02
°
。
[0229]
步时间:0.25sec。
[0230]
狭缝:0.3。
[0231]
样品转速:15rpm。
[0232]
铜k
α
辐射。
[0233]
使用zero背景硅填充的样品支架。
[0234]
式(ii)的化合物的形式c的粉末x-射线衍射图显示在图1中。形式c的xrpd图样的10个最大峰的位置和相对强度显示在表1中。样品是高度结晶性的且没有显示出指示显著无定形性(amorphicity)的任何基线偏移的证据。
[0235]
表1.形式c的xrpd峰值罗列(10个最强反射)
[0236][0237]
形式c的制备
[0238]
在1小时内将式(i)的化合物的游离碱溶液冷却至0℃至10℃。在30分钟内将乙酸乙酯/hcl(10-12%,53.5l,在内部从乙酸乙酯和无水hcl气体制备)缓慢添加到该批料中,同时维持温度在0℃和10℃之间。在1.25小时内将该批料温热至25℃至30℃,并在该温度保持4小时。施加真空(600-700mmhg)并将该批料在33℃以下蒸馏6.25小时,在此时馏出液的体积为115l。将该批料冷却至25℃至30℃,并加入二异丙基醚(53.5l,5体积)。将该批料在搅拌下在25℃至30℃保持2小时,然后在氮气气氛下通过nutsche过滤器nf202过滤并吸干30分钟。将滤饼用二异丙基醚(10.7l,1体积)浆化/洗涤两次并吸干30分钟至1小时。将该物质在真空干燥器vd201中在65℃至70℃在真空(600-650mmhg)下干燥12小时,直到滤饼的含水量不超过2.0重量%,得到式(ii)的化合物的形式c(10.01kg,90%收率,0.45%水,按kf计)。
[0239]
多晶型物筛选鉴定出另一种稳定的固态形式(被称作型式b)。通过x-射线粉末衍射(xrpd)分析形式b的结晶度。
[0240]
使用bruker d8 advance和与上述相同的条件进行xrpd分析。
[0241]
式(ii)的化合物的形式b的粉末x-射线衍射图显示在图7中。形式c的xrpd图样的10个最大峰的位置和相对强度显示在表2中。样品是高度结晶性的且没有显示出指示显著无定形性(amorphicity)的任何基线偏移的证据。
[0242]
表2.形式b的xrpd峰值罗列(10个最强反射)
[0243]
[0244][0245]
形式b的制备
[0246]
通过受控溶剂蒸发从乙酸乙酯制备显示衍射图样b的物质.
[0247]
将大约200mg式(ii)的化合物置于30至50ml玻璃瓶/烧杯中。添加20ml乙酸乙酯并将样品涡旋混合/超声处理大约一分钟,直到获得澄清溶液。通过注射器式滤器(来自millipore的durapore pvdf 0.22μm离心过滤器)过滤溶液以除去输入固态形式的潜在种子。然后将溶液在环境条件下向环境开放搅拌48小时。
[0248]
实施例2:式(ii)的化合物的形式c和型式b的热性能
[0249]
通过示差扫描量热法(dsc)、热重量分析法(tga)和热台显微术(hsm)进一步分析式(ii)的化合物的形式c。所述化合物具有高熔点,且在180℃以下不会发生任何物理或化学变化。
[0250]
dsc
[0251]
使用perkin elmer diamond dsc和下述条件分析式(ii)的化合物的形式c的dsc。
[0252]
在氮气净化气体下的铝盘。
[0253]
样品大小:1至5mg。
[0254]
温度范围:25℃至250℃。
[0255]
加热速率:2℃/min、5℃/min、10℃/min。
[0256]
式(ii)的化合物的形式c的dsc热分析图显示在图2中。得到的数据的总结显示在表3中。得到的热分析图显示了由于形式c的熔化而产生的单个急剧吸热,其起始温度为226.6℃。
[0257]
表3.关于式(ii)的化合物的形式c得到的dsc数据
[0258][0259][0260]
tga
[0261]
使用perkin elmer pyris1和下述条件进行tga分析。
[0262]
在氮气净化气体下的铂盘。
[0263]
样品大小:2至4mg。
[0264]
温度范围:环境温度至300℃。
[0265]
加热速率:10℃/min。
[0266]
tga热分析图(图3)显示,当从环境温度加热至150℃时大约0.8%w/w的重量减轻,表明式(ii)的化合物的形式c不是水合物或溶剂化物(一水合物的理论重量减轻为4.1%w/w)。
[0267]
表4.关于式(ii)的化合物的形式c得到的tga数据
[0268]
事件重量减轻10.8%w/w(环境温度至150℃)220.0%w/w(175℃至300℃)
[0269]
hsm
[0270]
以10℃/min或20℃/min加热速率在环境温度至300℃(无样品平衡)进行式(ii)的化合物的形式c的hsm。图4显示了式(ii)的化合物的形式c的hsm显微照片。实验证实,该物质直到大约180℃保持不变。该物质在大约201℃开始熔化,且最终颗粒的熔化在大约215℃结束。在具有227℃起始温度的dsc热分析图中看到的吸热事件对应于熔化。通过示差扫描量热法(dsc)、热重量分析法(tga)和热台显微术(hsm)进一步分析了式(ii)的化合物的型式b。
[0271]
在10℃/min和2℃/min的加热速率下型式b物质的dsc热分析图显示在图8中。得到的数据的总结显示在表4中。具有10℃/min加热速率的dsc热分析图显示了三个吸热事件。具有约98℃起始温度的第一个吸热可归因于在tga实验(75℃至125℃)中看到的重量减轻事件,可能是由于水或溶剂损失。使用2℃/min的较慢加热速率来研究在较高温度下观察到的热事件。以得到的2℃/min加热速率记录的dsc热分析图显示了四个主要事件:三个吸热事件和一个放热事件。第一个吸热事件(起始温度84℃)可能是由于水或溶剂损失。第二个事件(起始温度129℃)是由于化合物的脱水或脱溶剂化形式的熔化。在此熔化之后观察到放热事件(起始温度169℃),其对应于在hsm中看到的结晶(可能产生型式c物质)。最终的吸热事件(起始温度224℃)通过hsm证实为熔化并且对应于型式c物质的熔化。
[0272]
表4.关于式(ii)的化合物的型式b得到的dsc数据10℃/min加热速率
[0273]
参数事件1(吸热)事件2(吸热)事件3(吸热)起始温度(℃)97.9131.6223.7峰温度(℃)117.1139.9226.6δh(j/g)111.314.02.3
[0274]
2℃/min加热速率
[0275]
参数事件1(吸热)事件2(吸热)事件3(放热)事件4(吸热)起始温度(℃)83.8128.9168.9224.4峰温度(℃)99.1133.9184.6226.5δh(j/g)134.037.5-43.261.6
[0276]
型式b物质的tga热分析图显示在图9中。得到的数据的总结显示在表5中。tga热分析图显示了在75℃至125℃的温度范围内,水合物典型的逐步重量减轻为大约4.0%w/w。一
水合物的理论重量为4.1%;表明型式b是一种可能的水合物。它不太可能是溶剂化物,因为它来自不同的溶剂,并且不同的溶剂化物不太可能产生相同的衍射图样。该重量减轻事件对应于在dsc热分析图中观察到的第一个吸热。在195℃至300℃的温度范围内观察到大约17%w/w的显著重量减轻。对实验残余物的检查表明,它是棕色物质,指示降解已经发生。热台显微术证实在大约200℃熔化,然后分解。
[0277]
表5.关于式(ii)的化合物的型式b得到的tga数据
[0278]
事件重量减轻14.0%w/w(75℃至125℃)217.4%w/w(195℃至300℃)
[0279]
型式b物质的hsm显示物质的外观在直到128℃的温度保持不变。该物质在128℃开始熔化,且最终颗粒的熔化在大约135℃的温度结束(见图10)。这证实了在dsc中观察到的起始温度为227℃的事件是由于熔化。
[0280]
在161℃至175℃之间观察到从熔化物重结晶,而在189℃至195℃之间观察到的熔化物颜色的变化与重结晶固体的熔化同时发生。
[0281]
与dsc相比,在hsm期间化合物的降解可能不同。在空气气氛下进行hsm;在惰性氮气气氛下进行dsc。因此,在hsm期间可能会发生氧化过程,而在dsc期间不会发生。
[0282]
实施例3:式(ii)的化合物的调释片剂制剂
[0283]
制剂
[0284]
在阶段1中,立即释放(“ir”)胶囊剂中枢神经系统(cns)相关事件和精神病学相关不利事件的单次递增剂量研究是最常报告的不利事件,并且通常发生在最大血浆浓度的时间(tmax)附近。在同一研究的后续组群中,40mg ir胶囊剂作为四次10-mg剂量以2小时间隔的施用将平均cmax值减小了在式(ii)的化合物的单次口服40-mg剂量施用后观察到的值的约50%,并且轻度头痛和轻度瞌睡是分次剂量后报告的唯一不利事件。鉴于这些发现,开发了式(ii)的化合物的调释(“mr”)片剂制剂以尝试在维持总auc的同时减小给定剂量的cmax。
[0285]
式(ii)的化合物的立即释放胶囊剂的组成提供于下表6中。
[0286]
表6.用于立即释放胶囊剂的式(ii)的化合物的制剂
[0287][0288]
制备了具有不同释放速率曲线的式(ii)的化合物(形式c)的三种初始片剂制剂:制剂1(约80%的式(i)的化合物在施用给受试者后2小时内释放),制剂2(5小时的80%释放速率),和制剂3(7小时的80%释放速率)。制剂的组成显示在表7中。每个片剂含有20mg式(ii)的化合物。
[0289]
表7.用于调释片剂的式(ii)的化合物的制剂
[0290][0291][0292]
制备方法
[0293]
制备调释片剂的方法有6个连续步骤组成:1)筛选所有成分(式(i)的化合物或其药学上可接受的盐例如式(ii)和赋形剂),2)将式(i)的化合物或其药学上可接受的盐例如式(ii)的化合物与赋形剂掺合(包括颗粒内润滑),3)碾压(包括研磨),4)颗粒外润滑,5)压片,和6)片剂包衣。
[0294]
实施例4:调释片剂的药代动力学研究
[0295]
开发了式(ii)的化合物的调释片剂以试图减轻用式(ii)的化合物的立即释放胶囊剂观察到的一些不利影响。在1期研究中在健康志愿者的禁食条件下,相对于式(ii)的化合物的立即释放胶囊制剂,评价了式(ii)的化合物的三种调释片剂制剂的c
max
降低和t
max
延迟。
[0296]
1期研究是一项随机的、标签公开的、4路交叉研究。将合格的受试者随机分配到4个治疗序列中的1个,并在禁食状态下接受式(ii)的化合物的立即释放胶囊制剂的单次20-mg剂量(式(ii)的化合物)和式(ii)的化合物的下述3种调释片剂制剂的单次20-mg剂量:制剂1(在2小时内80%释放速率)、制剂2(在5小时内80%释放速率)和制剂3(在7小时内80%释放速率)。在4次分开的研究访问中施用研究治疗,每次访问与前一次间隔最小1-周清除期。
[0297]
图5显示了在式(ii)的化合物的调释片剂和立即释放胶囊剂的单次20-mg口服剂量后,式(i)的化合物的平均浓度-时间曲线。
[0298]
在禁食状态下施用20mg式(ii)的化合物以后,在禁食状态下施用式(ii)的化合物的每个调释片剂制剂以后0.75小时之前和在施用立即释放胶囊制剂以后,式(i)的化合物的血浆浓度是可量化的(图5)。在达到c
max
后,式(i)的化合物的血浆浓度在禁食状态下施用立即释放胶囊剂和制剂1片剂以后以双相方式下降。血浆浓度在达到c
max
后趋于平稳,并然后在禁食状态下施用制剂2和制剂3片剂后以单相方式下降。式(i)的化合物在施用立即释放胶囊剂和制剂1片剂后至少36小时内以及在施用制剂2和制剂3片剂后48-小时取样阶段的持续时间内保持可量化。
[0299]
处于进食状态的制剂3片剂在达到c
max
后具有以双相方式下降的血浆浓度。式(i)的化合物在进食状态下施用制剂3片剂后48-小时取样阶段的持续时间内保持可量化。(图5)。
[0300]
表8总结了立即释放胶囊剂、制剂1片剂(2小时的释放速率)、制剂2片剂(5小时的释放速率)和制剂3片剂(7小时的释放速率)的中位t
max
、观察到的几何平均c
max
、观察到的几何平均auc
最后
和auc
inf
。与立即释放胶囊剂相比,具有较长释放速率的调释制剂提供延迟的t
max
值和减小的c
max
浓度,同时保持通过auc
最后
评估的总体暴露。所有制剂在大约8至10小时时观察到的t
1/2
是相似的。没有证据表明吸收速率影响t
1/2
。在三种调释片剂制剂中,与auc
最后
相关的受试者内变异性是相似的。
[0301]
表8.在调释片剂和立即释放胶囊剂的单次口服20mg剂量以后式(ii)的化合物的药代动力学参数的几何平均值(cv%几何平均)(研究阶段1)
[0302][0303]
缩写:auc
外推
,在最后一个可量化的血浆浓度以后外推的面积的百分比;auc
inf
,从施用时至无穷大在血浆浓度-时间曲线下的面积;auc
最后
,从施用时至最后一个可测量的浓度在血浆浓度-时间曲线下的面积;c
max
,最大(峰)血浆药物浓度;cl/f,在口服施用后的表观血浆清除率;cv%,表示为百分比的变动系数;t1/2,终末消除半衰期;mr-调释,t
lag
,在第一个可测量的(非零)浓度之前的时间;t
max
,达到最大(峰)血浆药物浓度的时间;v
z/f
,口服施用后的表观分布容积。1中位值(范围)。
[0304]
在禁食状态接受3种调释片剂制剂(制剂1-3)或ir胶囊的单次口服20-mg剂量的18位受试者(参见实施例4)中,17位受试者(94.4%)在施用任一种制剂以后经历至少一种不利事件(表9)。在18位受试者中的15位中报告了至少一种药物相关的不利事件(83.3%)。没有报告严重或重度不利事件,且没有受试者因为不利事件而中断研究药物的治疗。
[0305]
与mr片剂相对于ir胶囊剂的式(i)的化合物的预期较低cmax暴露相一致,经历至少一种不利事件的受试者的百分比和经历至少一种药物相关的不利事件的受试者的百分比在施用每个mr片剂以后比在施用ir胶囊剂以后更少(表9)。在mr片剂中,经历任何不利事件的受试者的百分比和经历任何药物相关的不利事件的受试者的百分比对于制剂3而言是最小的:
[0306]
·
在施用制剂3片剂以后在33.3%的受试者中,在施用制剂2以后在44.4%的受试者中,在施用制剂1片剂以后在61.1%的受试者中,和在施用ir胶囊剂以后在72.2%的受试者中,报告了至少一种不利事件。
[0307]
·
在施用制剂3以后在16.7%的受试者中,在施用制剂2以后在44.4%的受试者中,在施用制剂1以后在44.4%的受试者中,和在施用ir胶囊剂以后在72.2%的受试者中,报告了至少一种药物相关的不利事件。
[0308]
经历任何不利事件和任何药物相关的不利事件的受试者的百分比的增加是浓度依赖性的,并且通常与cmax的排序(制剂3《制剂2《制剂1《ir胶囊剂)”相关。
[0309]
表9.在禁食状态下片剂(制剂1-3)和立即释放胶囊剂的单次口服20-mg剂量后治疗-紧急不利事件的总体总结(安全人群)
[0310][0311][0312]
缩写:ir=立即释放,mr=调释,sae=严重不利事件,teae=治疗-紧急不利事件
[0313]
1药物相关的不利事件是研究人员尽可能、尽力或尽量评估与研究药物的关联的那些。来源
[0314]
实施例5:调释片剂的药代动力学研究
[0315]
存在2-部分、1期双盲、安慰剂对照的试验来评估20mg片剂(制剂3)的单次递增(部分a:20、40和60mg)和多次递增(部分b:20和40mg,共8天)剂量在健康参与者中的安全性、耐受性、pk和pd(包括kss、kdt、sqsq和24-小时eeg读出)。基于该试验的结果,在20mg片剂制剂(制剂3)的单次口服剂量后,在从20mg至60mg的剂量范围内,向式(i)的化合物的暴露随剂量增加。在20mg片剂制剂(制剂3)的单次口服剂量后,cmax和auc的变异性随着剂量的增加而增加。
[0316]
在这项研究中,20和40mg的单次和多次剂量(每天,共8天)被较好耐受。对6位健康志愿者施用的单次60mg没有被耐受。6位参与者中的5位发生恶心,且6位参与者中的3位发生呕吐。
[0317]
表10.20mg片剂制剂3的单次口服剂量以后的几何平均值(几何cv%)(部分a)
[0318][0319][0320]
auc
24
=从施用时至施用后24小时在血浆浓度-时间曲线下的面积,auc
inf
=从施用时至无穷大在血浆浓度-时间曲线下的面积,auc
最后
=从施用时至最后一个可测量的浓度在血浆浓度-时间曲线下的面积,c
max
=最大(峰)血浆药物浓度,cl/f=在口服施用以后药物从血浆的表观总体清除率,cv%=变动系数百分比,%auc
外推
=从时间t至无穷大外推的在血浆浓度-时间曲线下的面积,作为总曲线下面积的百分比,mr=调释,t1/2=消除半衰期,t
lag
=延迟时间,t
max
=最大(峰)血浆药物浓度的时间,v
z/f
=在口服施用后末期的表观分布容积。1中位值(范围)。2n=5。
[0321]
在施用的第1天和第8天测定20mg片剂(制剂3)的多个20和40mg剂量的药代动力学性能(表11)。基于该试验的结果,在每天一次施用20mg片剂制剂8天后,在20至40mg的剂量范围内,向式(ii)的化合物的暴露随着剂量的增加而增加。cmax和auc的变异性在研究的剂量范围内有所增加。在20至40mg剂量范围内的重复每日施用的第5天之前达到稳态。在施用的8天内观察到cmax的约2倍增加。
[0322]
表11:20mg片剂制剂(制剂3)的单次和多次口服剂量以后的几何平均值(几何cv%)血浆药代动力学参数(部分b)
[0323][0324][0325]
缩写:auc
24
=从施用时至施用后24小时在血浆浓度-时间曲线下的面积,auc
τ
=在施用间隔中在血浆浓度-时间曲线下的面积,c
avg
=在多剂量施用过程中的平均药物浓度,c
max
=最大(峰)血浆药物浓度,c
min
=最小血浆药物浓度,cl/f=在口服施用以后药物从血浆的表观总体清除率,cv%=变动系数百分比,mr=调释,na=不适用,nc=未计算,rac auc=从auc
τ,ss
和auc
τ
计算的累积比率,rac c
max
=从c
max,ss
计算的累积比率,ss=稳态,t1/2=消除半衰期,t
lag
=延迟时间,t
max
=最大(峰)血浆药物浓度的时间,v
z/f
=在口服施用后末期的表观分布容积。1中位值(范围)。2标记为在第1天的auc
24
[0326]
在丘脑中表达的t-型钙通道与睡眠梭状波的产生和调节密切相关,睡眠梭状波是在nrem睡眠期间显著的丘脑皮质振动。在eeg中睡眠梭状波被检测为σ频带(11-15hz)(图12)。因此,在该试验中σ频带中的功率降低指示式(i)的化合物介导了丘脑皮质回路中t-型
钙通道的阻断。
[0327]
实施例6:式(i)的化合物的调释片剂制剂4和5
[0328]
作为包衣基质调释(mr)片剂提供的制剂4和5被设计成在7小时内释放大约80%的药物物质。产品(制剂4和5)的临床批的组成显示在表12中。每个活性片剂将含有相当于5或20mg式(i)的化合物的药物物质,分别对应于约5.475mg或21.90mg式(ii)的化合物。
[0329]
表12.含有5mg或20mg式(i)的化合物的调释片剂的式(i)的化合物的制剂
[0330][0331]a关于游离碱调节式(i)的量
[0332]b根据式(i)的量补偿微晶纤维素(avicel ph101)的量
[0333]
用于评估释放的溶出度方法是使用usp设备类型-i的色谱检测方法。用于评估释放的溶出度参数和高效液相色谱法(hplc)条件如下所示。
[0334]
表13.溶出度参数
[0335][0336]
表14.色谱条件
[0337]
[0338][0339]
表15.梯度程序
[0340]
时间(分钟)流动相-a%流动相-b%0.0067331.5067334.0055454.1067338.006733
[0341]
制备方法
[0342]
通过筛选和掺合赋形剂(包括润滑剂)来制备mr片剂。通过碾压和研磨带状致密物将掺合物造粒。将颗粒润滑,并然后压制成片剂。然后将片剂包裹薄膜包衣。
[0343]
在过程中、在释放试验期间和在稳定性方面,对许多质量属性进行监测。这些包括硬度、脆碎度、外观、测定(assay)、相关物质、含量均匀度、含水量和溶出度。
[0344]
另外的制剂(制剂6-9)提供在表16中。
[0345]
表16.含有10、15、30和40mg式(i)的化合物的调释片剂的式(i)的化合物的制剂
[0346][0347][0348]a关于游离碱调节式(i)的量
[0349]b根据式(i)的量补偿微晶纤维素(avicel ph101)的量
[0350]
在给健康志愿者施用式(ii)的化合物(制剂4)的单次5mg剂量以后,在施用式(ii)的化合物的调释片剂制剂以后0.50小时之前,式(i)的化合物的游离碱(即,式(ii)的化合物)的血浆浓度是可量化的。血浆浓度在达到cmax后趋于平稳,并然后在施用制剂4以后24小时前下降。在施用制剂4的5mg剂量之后,在24小时取样阶段的持续时间内,作为游离碱的式(i)的化合物(即,式(ii)的化合物)保持可量化。图11显示了在5mg片剂制剂4的单次口服剂量以后的平均(
±
sd)浓度。
[0351]
表17.在5mg片剂制剂4的单次口服剂量以后的几何平均值(几何cv%)
[0352][0353]
auc
24
=从施用时至施用后24小时在血浆浓度-时间曲线下的面积,c
max
=最大(峰)血浆药物浓度,cv%=变动系数百分比,mr=调释,t
lag
=延迟时间,t
max
=最大(峰)血浆药物浓度的时间。1中位值(范围)。
[0354]
实施例7:式(ii)的化合物在制剂中的长期稳定性
[0355]
药物产品在25℃/60%rh化学上和物理上稳定长达48个月(表11),或者在加速条件(40℃/75%rh)下化学上和物理上稳定长达6个月(表19)。基于目前可得到的稳定性数据,包装在40cc高密度聚乙烯(hdpe)瓶子中的20mg药物产品(制剂3)当根据美国药典(usp)对受控室温的定义在20℃至25℃之间储存时贮存期限为60个月。基于20mg药物产品的至少48个月的出色稳定性和5mg药物产品的基本相同组成,包装在40cc高密度聚乙烯(hdpe)瓶子中的5mg药物产品(制剂4)当在20℃至25℃之间储存时贮存期限为24个月。
[0356]
在25℃/60%rh进行包含式ii的化合物的mr片剂的稳定性研究。批大小为10,000片。每个薄膜包衣片剂含有20mg式ii的化合物。将片剂包装在具有crc盖的含有30片的40cc hdpe瓶子中(表19)。
[0357]
表19.mr片剂制剂3(含有20mg式(ii)的化合物)在25℃/60%在48个月中的稳定性研究数据
[0358][0359]
nmt-不超过;rh-相对湿度
[0360]
在40℃/75%rh进行包含式ii的化合物的mr片剂的稳定性研究。批大小为10,000片。每个薄膜包衣片剂含有20mg式ii的化合物。将片剂包装在具有crc盖的含有30片的40cc hdpe瓶子中(表20)。
[0361]
表20.在加速条件下mr片剂制剂3(含有20mg式(ii)的化合物)的稳定性研究数据
[0362][0363]
nmt-不超过;rh-相对湿度
[0364]
在25℃/60%rh进行包含式(ii)的化合物的制剂4的片剂的稳定性研究。批大小为30,000片。将片剂包装在具有crc盖的含有30片的40cc hdpe瓶子中(表21)。
[0365]
表21.片剂(制剂4)在25℃/60%rh在3个月中的稳定性研究数据
[0366][0367]
实施例8:递增多次口服剂量在患有全身性癫痫综合征伴失神性癫痫发作的成年人中的安全性、耐受性、药代动力学和效力的评估
[0368]
这项标签公开mad试验将主要评估20mg片剂(制剂3)的每天20mg和每天两次20mg剂量作为护理标准辅助的安全性和耐受性。次要目的包括表征pk、pd(在nrem睡眠期间的σ频率功率)和片剂对癫痫发作频率的影响(制剂3)。
[0369]
受试者
[0370]
本研究的受试者是年龄在18至60岁之间的男性或女性。受试者具有癫痫综合征(包括、但不限于,儿童期失神性癫痫发作、青少年失神性癫痫发作、青少年肌阵挛型癫痫或jeavons综合征)临床诊断,其中失神性癫痫发作符合国际抗癫痫联盟修订的癫痫发作分类(2017),尽管记录了用至少一种标准抗癫痫治疗的试验,但失神性癫痫发作持续存在,并且具有失神性癫痫的病史和电图证据。
[0371]
方法论:
[0372]
每个参与者将完成3个研究阶段:筛选、治疗期(至多2个剂量水平,然后逐渐减少)和安全性随访。
[0373]
所有参与者将接受式(ii)的化合物的两周施用,然后逐渐减少:
[0374]
·
剂量水平1:每天一次20mg(制剂3)持续7天,和直到14天,如果20mg每天两次没有被耐受。
[0375]
·
剂量水平2:每天两次20mg(制剂3)持续7天。
[0376]
·
逐渐减少:如果参与者耐受每天两次20mg完整7天,逐渐减少将是每天20mg持续2天(第15和16天),随后每隔一天20mg持续5天(第17、19和
[0377]
21天)。如果参与者仅耐受每天一次20mg,逐渐减少将是每隔一天20mg持续7天(第15天至第21天)。
[0378]
安全性和耐受性
[0379]
安全性变量包括临床实验室评价、体格检查、生命体征、12-导程ecg、c-ssrs和ae评估,包括事件类型、频率、严重性、严重程度、时机和与ip的关系。
[0380]
药代动力学
[0381]
药代动力学参数将包括:最大观察浓度(cmax)和在稳态时(cmax,ss)、cmax的时间(tmax)和cmax、ss(tmax,ss)、在施用间隔内在浓度-时间曲线下的面积(auctau或aucss)、在稳态的总体清除率(clss)。如果可行,将计算其它参数,诸如半衰期、累积和在稳态时的分布容积(vss)。
[0382]
效力
[0383]
如下评价效力:a)参与者报告的癫痫发作日记的癫痫发作次数,包括失神性癫痫发作、全身强直阵挛发作和肌阵挛型癫痫发作,b)式(i)的化合物的癫痫发作活性和药效动力学作用的eeg测量,包括:癫痫发作密度(包括由光刺激和过度换气诱导的癫痫发作在内的大约24小时时段内大约2.5-5hz》3秒的两侧同步对称棘波放电的次数),平均癫痫发作持续时间(在24小时时段的持续时间中大于3秒的2.5-5hz放电的平均持续时间),累积癫痫发作持续时间(癫痫发作密度和平均癫痫发作持续时间的乘积),在过度换气和光刺激挑战后具有2.5-4hz棘波放电的总时间,和c)通过cgi-s和cgi-i评分测量的总体严重程度。
[0384]
实施例9:式(i)的化合物或其药学上可接受的盐在特发性震颤中的效力、安全性、耐受性和药代动力学的评价
[0385]
进行随机对照试验以研究式(i)的化合物在特发性震颤中的效力、安全性和耐受性。每位患者完成3个研究阶段:筛选、治疗期(21或28天)和安全性随访。
[0386]
患者为年龄在18至75岁之间的男性和女性,并且已被诊断患有特发性震颤至少3年。在整个临床试验期间,患者接受稳定剂量的1种震颤药物。具有心理性震颤的临床证据、可能解释或造成震颤的其它内科、神经学或精神病学病症史、先前由于特发性震颤进行磁共振引导的聚焦超声或外科手术干预、在筛选前6个月内由于特发性震颤进行肉毒杆菌毒素注射的患者被排除在研究之外。
[0387]
患者口服地接受20mg式(i)的化合物(制剂3)每天一次持续14天和每天两次持续7天(部分a)或口服地接受20mg式(i)的化合物(制剂3)每天一次持续14天和每天两次持续14天或安慰剂(部分b)。
[0388]
在第21天(部分a)和第28天(部分b),在基线通过特发性震颤等级评定评估量表(tetras)上肢评分评估式(i)的化合物对上肢震颤的效力。
[0389]
在第21天(部分a)和第28天(部分b),在基线通过tetras表现子量表评分和tetras表现个别项目评估式(i)的化合物对震颤严重程度的其它量度的效力。
[0390]
通过对以下终点的综合分析评估式(i)的化合物的安全性和耐受性:患者和临床医师报告的不利事件,生命体征,临床实验室结果,心电图(ecg),和在基线、在第1天、第7天、第14天、第21天和第28天(仅部分b)的哥伦比亚自杀严重程度评级量表(c-ssrs)。
[0391]
实施例10:式(i)的化合物在特发性震颤中的效力、安全性、耐受性和药代动力学的评价
[0392]
进行临床研究以探究式(i)的化合物在特发性震颤中的效力、安全性和耐受性。一位被诊断患有特发性震颤的患者完成了3个研究期:筛查、治疗期(14天)和安全性随访。在整个临床试验期间,患者接受了稳定剂量的1种震颤药物。患者接受每天一次口服20mg式(i)的化合物(一片制剂5)持续7天和每天一次口服40mg式(i)的化合物(两片20mg制剂5)持续7天(共连续14天)。
[0393]
在基线、第7天和第14天通过特发性震颤等级评定评估量表(tetras)上肢评分评估式(i)的化合物对上肢震颤的效力。
[0394]
在基线、第7天和第14天,通过tetras表现子量表评分、tetras表现个别项目和加速度计评估式(i)的化合物对震颤严重程度的其它量度的效力。
[0395]
通过对以下终点的综合分析评估式(i)的化合物的安全性和耐受性:患者和临床医生报告的不利事件(例如,头晕或头痛),生命体征,临床实验室结果,心电图(ecg),和在基线、在第1天、第7天、第14天和第21天的哥伦比亚自杀严重程度评级量表(c-ssrs)。
[0396]
与基线相比,在施用20mg(制剂5)持续7天后(第7天),在tetras上的上肢震颤评分降低,并且在施用40mg(两片20mg制剂5)另外7天后(第14天)观察到进一步降低。在第14天,与基线相比,上肢震颤评分降低了至少25%。值得注意的是,在清除7天后,上肢评分与上述第14天的上肢评分相比增加,表明逐渐恢复到基线功能障碍。
[0397]
与基线相比,在施用20mg(制剂5)持续7天后(第7天),tetras表现评分降低,并且在施用40mg(两片20mg制剂5)另外7天后(第14天)观察到进一步降低。在第14天,与基线相比,tetras表现评分降低了至少25%。值得注意的是,在清除7天后,表现评分与上述第14天的表现评分相比增加,表明逐渐恢复到基线功能障碍。
[0398]
图6证实了在施用式(i)的化合物(制剂5)的情况下阿基米德螺旋任务中震颤的减少。
[0399]
在施用20mg持续7天后(第7天),kinesia one(上肢震颤的加速度计和陀螺仪评估)与基线相比降低,并且在施用40mg另外7天后(第14天)观察到进一步降低。在第14天,与基线相比,通过加速度计测量的震颤振幅减小了至少25%。值得注意的是,在清除7天后,通过加速度计测量的震颤振幅与上述第14天的震颤振幅相比增加,表明逐渐恢复到基线功能障碍。
[0400]
新出现的数据表明,式(i)的化合物被良好耐受并且可以减小上肢震颤振幅并改善adl,诸如写作技巧。医师评级量表、基于加速度计的震颤评估工具和患者症状评级量表都已经一致地证明式(i)的化合物(制剂5)施用对症状的减轻。此外,参与者的轶事提示,曾
经失去的能力,如携带具有食品或饮料的托盘,在服用式(i)的化合物(制剂5)后可以恢复。
[0401]
进行非随机、非对照和标签公开试验以研究式(i)的化合物在特发性震颤中的效力、安全性和耐受性。每位患者完成3个研究期:筛查、治疗期(14天)和安全性随访。在筛选期间完成tetras性能子量表的视频。
[0402]
患者为年龄在18至75岁之间的男性和女性,并已被诊断出特发性震颤。在整个临床试验期间,患者接受稳定剂量的1种震颤药物。具有心理性震颤的临床证据、可能解释或造成震颤的其它内科、神经学或精神病学病症史、先前由于特发性震颤进行磁共振引导的聚焦超声或外科手术干预、在筛选前6个月内由于特发性震颤进行肉毒杆菌毒素注射的患者被排除在研究之外。
[0403]
患者接受每天一次口服20mg式(i)的化合物(制剂5)持续7天和每天一次口服40mg式(i)的化合物(两片20mg制剂5)持续7天(共连续14天)。
[0404]
在基线、第7天和第14天通过特发性震颤等级评定评估量表(tetras)上肢评分评估式(i)的化合物对上肢震颤的效力。
[0405]
在基线、第7天和第14天,通过tetras表现子量表评分、tetras表现个别项目和加速度计评估式(i)的化合物对震颤严重程度的其它量度的效力。
[0406]
通过临床总体印象(cgi)、临床总体印象-严重程度(cgi-s)、临床总体印象-改善(cgi-i)和患者总体变化印象(pgi-c),也可以评估式(i)的化合物的效力。
[0407]
也可以通过本文所述的任何方法评估式(i)的化合物的效力。
[0408]
通过对以下终点的综合分析评估式(i)的化合物的安全性和耐受性:患者和临床医生报告的不利事件(例如,头晕或头痛),生命体征,临床实验室结果,心电图(ecg),和在基线、在第1天、第7天、第14天和第21天的哥伦比亚自杀严重程度评级量表(c-ssrs)。
[0409]
等同方案和范围
[0410]
在权利要求书中,冠词诸如“一个”、“一种”和“所述”可以是指一个/种或超过一个/种,除非指示相反情形或以其它方式从上下文显而易见。如果群体成员中的一个、超过一个或所有成员存在于指定的产品或过程中、在指定的产品或过程中使用、或以其它方式与指定的产品或过程相关,则认为满足在一组的一个或多个成员之间包括“或”的权利要求或描述,除非指示相反情形或以其它方式从上下文显而易见。本发明包括这样的实施方案,其中所述组的刚好一个成员存在于给定产品或方法中、用于给定产品或方法中或者以其它方式与给定产品或方法相关。本发明包括这样的实施方案,其中所述组成员中的超过一个或全部都存在于给定产品或方法中、用于给定产品或方法中或者以其它方式与给定产品或方法相关。
[0411]
此外,本发明涵盖所有变体、组合和排列,其中将来自一项或多项所列权利要求的一个或多个限制、要素、条款和描述性术语引入另一项权利要求中。例如,从属于另一项权利要求的任何权利要求可以修改为包括在从属于同一基本权利要求的任何其它权利要求中发现的一个或多个限制。在将要素呈现为列表的情况下,例如,以马库什群组格式,还公开了要素的每个亚组,并且可以从群组中移除任何要素。应当理解,一般而言,在本发明或本发明的方面被称作包含特定要素和/或特征的情况下,本发明的某些实施方案或本发明的方面由这样的要素和/或特征组成,或基本上由这样的要素和/或特征组成。为简单起见,那些实施方案并未在本文中用这种话具体阐述。还应注意,术语“包含”和“含有”意图是开
放的,并且允许包括额外的要素或步骤。在给出范围的情况下,包括端点。此外,除非另外指示或以其它方式从上下文和本领域普通技术人员的理解显而易见,否则表示为范围的值可以在本发明的不同实施方案中假定为在所述范围内的任何具体值或子范围,其精确至该范围的下限单位的十分之一,除非上下文另外清楚地指明。
[0412]
本技术涉及各种已授权的专利、公开的专利申请、期刊文章和其它出版物,它们都通过引用并入本文。如果任何并入的参考文献与本说明书之间存在冲突,则以说明书为准。另外,落入现有技术内的本发明的任何特定实施方案可以明确地从任意一项或多项权利要求排除。因为这样的实施方案被认为是本领域普通技术人员已知的,所以即使在本文中没有明确阐述排除,它们也可以被排除。出于任何原因,无论是否与现有技术的存在相关,可以从任何权利要求中排除本发明的任何特定实施方案。
[0413]
本领域技术人员会认识到或能够使用不超过例行实验确定本文描述的具体实施方案的许多等同方案。本文描述的本实施方案的范围无意限于以上描述,而是如所附权利要求所述。本领域普通技术人员会明白,可以对本说明书做出各种改变和修改,而不背离如所下述权利要求书所限定的本发明的精神或范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
