包含萘普生和维生素b6的固体口服剂型
技术领域
1.本发明涉及萘普生用于治疗疼痛的用途。
背景技术:
2.作为世界上最常见的病痛之一,腰背痛(low back pain)是活动受限和没法工作的主要原因,给个人、家庭、社区、行业和政府带来了沉重的经济负担。
3.腰背部包括腰区中的五块椎骨(称为l1至l5)。椎骨之间的空间由称为椎间盘的圆形橡胶状垫来维持,椎间盘在身体移动时充当整个脊柱的减震器来缓冲骨骼。被称为韧带的组织带将椎骨保持在适当的位置,并且肌腱将肌肉附着至脊柱。三十一对神经扎根于脊髓,并且它们控制身体运动并将信号从身体传递到脑(参见“low back pain fact sheet”,national institute of neurological disorders and stroke,nih出版号15-5161,2014)。
4.目前建立的全球临床实践指南一致推荐使用对乙酰氨基酚作为一线治疗。作为腰背痛的二线治疗,施用萘普生是一个值得注意的选项。
5.尽管对乙酰氨基酚和萘普生都有良好确定的功效和安全性,但对于尽管接受了最大限度的疗法但疼痛仍未得到控制的患者来说,仍有大量未满足的需求。
6.最近的研究已经强调b族维生素在解决腰背痛和改善全球临床成果方面的作用。维生素b复合物中的维生素可以在nutritional products,switzerland处商购获得。
7.虽然维生素b复合物治疗腰背痛的功效的确切机制仍然很大程度上未知,但普遍的假设涉及增加脊髓处的伤害性神经元的传入抑制控制,改善感觉神经传导速度,并通过改变受损背根神经节中的钠电流来降低神经元过度兴奋性(q.fu等人,b vitamins suppress spinal dorsal horn nociceptive neurons in the cat.neurosci lett1988;95:192-197;c.jolivalt等人,b vitamins alleviate indices of neuropathic pain in diabetic rats.eur j pharmacol 2009;612:41-47;x.song等人,hiamine suppresses thermal hyperalgesia inhibits hyperexcitability,and lessens alterations of sodium currents in injured dorsal root ganglion neurons in rats.anesthesiology 2009;110:387-400)。
8.萘普生和维生素b复合物中的维生素都是商购可得的。为了提高患者依从性,需要萘普生与维生素b复合物中的至少一种维生素的固定剂量复合剂(fixed-dose combination,fdc)。fdc应该是一种固体口服剂型,该固体口服剂型比仅萘普生更有效地治疗腰背痛,提高患者依从性,无副作用或具有较小的副作用,储存稳定,易于吞咽,易于制造和/或符合制药行业的质量标准。
技术实现要素:
9.将萘普生压缩成片剂是非常困难的,或甚至是不可能的。因此,萘普生在压制成片
剂之前先被造粒。
10.提供萘普生和维生素b6的固定剂量复合剂(fixed-dose combination,fdc)的最简单方式将是使用水作为湿法造粒的加工溶剂,将水溶性萘普生钠与水溶性维生素b6一起造粒。然后可将如此获得的颗粒压制成片剂。与使用有机溶剂作为加工溶剂相比,含水湿法造粒更具成本效益且更可持续。此外,当使用水代替有机溶剂时,没有爆炸风险。
11.然而,发明人已经选择了不同的方法。
12.本发明涉及一种制备固体口服剂型的方法,所述方法包括向颗粒内组合物中颗粒外(extragranular)添加维生素b6,其中所述颗粒内组合物包含萘普生或其药学上可接受的盐。当遵循这种方法时,可以制造出具有所需硬度、脆碎度和/或含量均匀性的固体口服剂型,使得该固体口服剂型满足制药行业的质量标准。
13.当应用本发明的方法时,获得了包含a)颗粒和b)维生素b6的共混物,其中所述颗粒包含萘普生或其药学上可接受的盐和至少一种粘合剂。所述共混物然后可以填充到胶囊或容器中,或者可以压制成片剂。
14.在压制片剂时,可能会发生顶裂。当片剂的上部部分或下部部分水平地分离,部分或完全离开主体以在从压机中弹出时或在处理过程期间形成帽时,使用术语“顶裂”。有各种可以避免和减少顶裂的方法,例如修改工具、调整压机设置、改善重量控制或改变粉末特性。
15.令人惊讶的是,在萘普生和维生素b6的固定剂量复合剂(fdc)的情况下,当萘普生钠和维生素b6没有一起造粒时,可以避免或减少顶裂。
16.本发明的固定剂量复合剂(fdc)比仅萘普生更有效地治疗腰背痛和/或改善患者依从性。因此,本发明还涉及本文所述的用于治疗腰背痛的固体口服剂型。
具体实施方式
17.定义
18.本发明涉及萘普生或其药学上可接受的盐(例如碱金属盐)。本发明的优选实施方式涉及萘普生钠。萘普生钠是一种可溶于水的白色至乳白色结晶粉末。商购可得的萘普生片剂(例如and)包含萘普生钠。
19.直接压制是生产片剂的最短、最有效并且最简单的方式。制造商可以压制药物和赋形剂的共混物。不需要附加的加工步骤。不幸的是,即使在共混物中包含易压实的粘合剂/粘结剂,一些粉末也难以压制,但是同一粉末的颗粒通常更易压制。
[0020]“颗粒”是通过造粒形成的。造粒是形成颗粒的过程,并且涉及将细粒子附聚成较大的颗粒。湿法造粒和干法造粒是两种类型的造粒技术。本发明的颗粒优选通过湿法造粒形成。湿法造粒需要加工溶剂。在本发明的上下文中,水是优选的加工溶剂。为了将细粒子附聚成较大的颗粒,可能需要粘合剂。当进行湿法造粒时,粘合剂必须适合于所选的加工溶剂。本发明的颗粒优选通过湿法造粒形成,其中水用作加工溶剂,并且其中使用适合于含水湿法造粒的粘合剂。通常,此类粘合剂可溶于水。优选的粘合剂是pvp(聚乙烯吡咯烷酮,通常也称为聚烯吡酮或聚维酮)和hpmc(羟丙基甲基纤维素;简称;羟丙甲纤维素)。
[0021]
当制造固体药物剂型时,特定化合物可以在造粒之前与其他成分共混,由此掺入到所获得的颗粒内。这被称为“颗粒内添加”。或者,特定化合物(或化合物的混合物)可以与
已经存在的预制颗粒混合。这被称为“颗粒外添加”。在颗粒外添加之后,所获得的共混物可以被进一步加工(例如,可以被压制成片剂或者可以被填充到囊剂中)。因此,“颗粒外”化合物不是颗粒的一部分(即在颗粒之外),而“颗粒内”化合物是颗粒的组成部分。“颗粒内组合物”是通过造粒过程获得的组合物。颗粒内组合物的一个示例是本文所述的颗粒。
[0022]
本发明涉及一种固定剂量复合剂(fdc),所述fdc包含至少一种b族维生素。在本发明的上下文中,术语“b族维生素”和“b族复合物中的维生素”可互换使用,并且优选指维生素b1、维生素b6和维生素b12。
[0023]
特定维生素的“同效维生素”是缓解缺乏维生素的生物系统中的特定维生素缺乏的化合物。因此,它们是具有特定维生素活性的化合物。通常,特定维生素的同效维生素具有相似的分子结构。
[0024]
在本发明的上下文中,术语“维生素b1”是指维生素b1的任何同效维生素。因此,术语“维生素b1”包括硫胺素、硫胺素的磷酸化衍生物和硫胺素的合成衍生物,例如苯磷硫胺。通常,衍生物是通过化学反应从类似化合物衍生出的化合物。在本发明的一个优选实施方式中,术语“维生素b1”是指盐酸硫胺素、单硝酸硫胺素、苯磷硫胺或它们的混合物。最优选的维生素b1是盐酸硫胺素。
[0025]
在本发明的上下文中,术语“维生素b6”是指维生素b6的任何同效维生素。因此,术语“维生素b6”包括吡哆醇、吡哆醇的盐和吡哆醇的衍生物。在本发明的一个优选实施方式中,术语“维生素b6”是指吡哆醇的盐。最优选地,术语“维生素b6”是指盐酸吡哆醇。
[0026]
维生素b12是众所周知的水溶性维生素。在本发明的上下文中,术语“维生素b12”是指维生素b12的任何同效维生素,并且包括维生素b12衍生物和/或维生素b12代谢物。然而,优选地,术语“维生素b12”是指氰钴胺。氰钴胺可以通过使用合适的微生物进行发酵来生产。“结晶维生素b12”包含基于晶体的总重量至少98重量%的维生素b12。优选地,本发明的共混物不包含任何结晶维生素b12。本发明的优选实施方式涉及一种包含经喷雾干燥的维生素b12制剂的共混物。表述“经喷雾干燥的维生素b12制剂”是指可通过将包含维生素b12和至少一种赋形剂的水溶液喷雾干燥获得的粉末,其中所述至少一种赋形剂优选选自由以下项组成的组:柠檬酸钠、柠檬酸三钠、柠檬酸、麦芽糖糊精和改性食物淀粉。在本发明的优选实施方式中,表述“经喷雾干燥的维生素b12制剂”是指可通过将包含氰钴胺和至少一种赋形剂的水溶液喷雾干燥获得的粉末,其中所述至少一种赋形剂优选选自由以下项组成的组:柠檬酸钠、柠檬酸三钠、柠檬酸、麦芽糖糊精和改性食物淀粉。
[0027]
由于至少一种赋形剂的存在,基于经喷雾干燥的制剂的总重量,经喷雾干燥的维生素b12制剂包含小于90重量%的维生素b12。经喷雾干燥的维生素b12制剂中的维生素b12的准确浓度取决于经喷雾干燥的制剂中的赋形剂的量。优选地,基于经喷雾干燥的制剂的总重量,本发明的经喷雾干燥的维生素b12制剂包含1重量%或更少的维生素b12。本领域技术人员应理解,不含维生素b12的经喷雾干燥的维生素b12制剂被排除。因此,基于经喷雾干燥的维生素b12制剂的总重量,经喷雾干燥的维生素b12制剂优选包含0.01重量%至1重量%,更优选0.05重量%至0.5重量%,最优选0.1重量%的维生素b12。同样优选地,在本发明的上下文中使用的经喷雾干燥的维生素b12制剂是水溶性或水分散性粉末,基于粉末的总重量,该粉末包含1重量%或更少的氰钴胺。本领域技术人员应理解,不含维生素b12的粉末被排除。因此,经喷雾干燥的维生素b12制剂优选为水溶性或水分散性粉末,基于粉末的
national academies press.https://doi.org/10.17226/6015。
[0035]
在本发明的一个实施方式中,本发明的固体口服剂型优选包含为rda的50-120%,更优选50-100%,最优选80-100%的维生素b6。一名患者在24小时内可服用最多3片萘普生片剂(例如)。发明人建议用3种固定剂量复合剂剂型代替这3片萘普生片剂,每种种固定剂量复合剂剂型包含rda的约1/3的相应b族维生素。因此,在本发明的一个优选实施方式中,本发明的固体口服剂型优选包含为rda的20-50%,更优选20-35%,最优选25-33.3%的维生素b6。在本发明的一个实施方式中,本发明的固体口服剂型包含萘普生钠和维生素b6,其中有200mg标签声明的维生素b6。
[0036]
这在细节上作必要修改后也适用于维生素b1和维生素b12。在本发明的一个实施方式中,本发明的固体口服剂型包含为rda的优选50-120%,更优选50-100%,最优选80-100%的维生素b1,和/或包含为rda的优选50-120%,更优选50-100%,最优选80-100%的维生素b12。在本发明的一个优选实施方式中,本发明的固体口服剂型包含为rda的优选20-50%,更优选20-35%,最优选25-33.3%的维生素b1,和/或包含为rda的优选20-50%,更优选20-35%,最优选25-33.3%的维生素b12。
[0037]
维生素b12的优选来源是氰钴胺。经喷雾干燥的氰钴胺制剂可在nutritional products,switzerland以药品级获得。在本发明的一个实施方式中,本发明的固体口服剂型包含萘普生钠和10μg-1000μg,优选100μg-500μg,最优选180μg-300μg的维生素b12。在该实施方式中,本发明的固体口服剂型优选为压制片剂。
[0038]
维生素b6的优选来源是盐酸吡哆醇。药品级盐酸吡哆醇可在nutritional products,switzerland获得。维生素b6的水平可以在0.5mg至300mg的范围内,对应于每份0.67mg至401.12mg的盐酸吡哆醇水平。在本发明的一个实施方式中,本发明的固体口服剂型包含萘普生钠和100mg-400mg,优选150mg-300mg,最优选200mg-270mg的盐酸吡哆醇。在该实施方式中,本发明的固体口服剂型优选为压制片剂。
[0039]
在本发明的另一个优选实施方式中,本发明的固体口服剂型是水溶性或水分散性粉末,该粉末优选包含至少一种掩味剂,例如甜味剂(例如三氯蔗糖)、酸(例如柠檬酸或苹果酸)和/或调味剂(例如柠檬香精或覆盆子香精)。因此,本发明的一个实施方式涉及一种粉末,所述粉末包含萘普生钠和0.67mg至401.12mg的盐酸吡哆醇以及优选至少一种掩味剂。
[0040]
在本发明的另一个优选实施方式中,本发明的固体口服剂型是胶囊,其中每个胶囊包含优选110mg的萘普生钠。服用份量为2粒胶囊,加起来可达220mg萘普生钠(标签声明)。因此,本发明的一个实施方式涉及一种胶囊,所述胶囊包含100mg至120mg的萘普生钠和10mg-250mg,优选75mg-150mg,最优选100mg-135mg的盐酸吡哆醇。
[0041]
在本发明的一个实施方式中,本发明的固体口服剂型优选包含萘普生钠(220mg标签声明的萘普生钠或200mg标签声明的萘普生)、维生素b1(标签声明100mg)、维生素b6(标签声明200mg)和维生素b12(标签声明200μg)。对于维生素来说,高于标签声明的超额是可接受的,甚至是推荐的。对于一些维生素来说,高于标签声明的超额可能甚至是必需的。
[0042]
一些维生素(尤其是维生素b12)是光敏性的。因此,建议保护本发明的固体口服剂型免受光照。在一个实施方式中,本发明的片剂用提供光保护的包衣进行包衣,所述包衣为例如包衣(可在colorcon商购获得)。本发明的优选实施方式涉及一种包衣片剂,
所述包衣片剂包含萘普生钠、维生素b6、维生素b1和维生素b12,其中所述片剂的包衣包含至少一种光保护剂,所述光保护剂优选为二氧化钛。
[0043]
这在细节上作必要修改后适用于本发明的胶囊。在一个实施方式中,本发明的胶囊包含提供光保护的胶囊壳。具有定制颜色的胶囊壳可在处获得。
[0044]
另外或替代地,可以使用光保护包装材料。提供光保护的包装材料的示例是铝和高密度聚乙烯(high density polyethylene,hdpe)。因此,一个实施方式涉及包含本发明的固体口服剂型的高密度聚乙烯(hdpe)瓶。另一个实施方式涉及一种泡罩,其中所述泡罩提供光保护,并且其中所述泡罩封装本发明的片剂或胶囊。
[0045]
大多数囊剂和棒状包装也提供光保护。这尤其适用于包含至少一层铝的囊剂、袋和棒状包装。因此,一个实施方式涉及一种包封本发明的固体口服剂型的囊剂、袋或棒状包装,其中所述囊剂、袋或棒状包装保护包封的固体口服剂型免受光照,并且其中所述固体口服剂型优选为水溶性或水分散性粉末。
[0046]
本发明还涉及一种治疗方法,其中将本发明的固体口服剂型施用于需要萘普生钠的患者,例如患有疼痛的患者。本发明的优选实施方式涉及一种治疗方法,其中将本发明的固体口服剂型施用于患有选自关节炎疼痛、头痛、肌肉痛、牙痛、背痛、腰背痛和/或痛经的疼痛的患者。最优选地,本发明涉及一种治疗方法,其中将本发明的固体口服剂型施用于患有腰背痛的患者。
[0047]
另一个实施方式涉及本发明的固体口服剂型用作药物。一个优选的实施方式涉及本发明的固体口服剂型用于治疗需要萘普生钠的患者和/或用于治疗疼痛。更优选的实施方式涉及本发明的固体口服剂型用于治疗关节炎疼痛、头痛、肌肉痛、牙痛、背痛、腰背痛和/或痛经。甚至更优选的实施方式涉及本发明的固体口服剂型用于治疗腰背痛。最优选的实施方式涉及本发明的固体口服剂型用于治疗腰背痛,其中所述固体口服剂型是包含至少220mg的萘普生钠、90mg至150mg的维生素b1、180mg至300mg的维生素b6和180μg至300μg的维生素b12的片剂。
[0048]
本发明的共混物
[0049]
本发明还涉及一种适用于制备本文所述的固体口服剂型的共混物。所述共混物通常是至少两种固体化合物的混合物。优选地,本发明的共混物包含颗粒和至少一种颗粒外维生素b6源,其中所述颗粒包含萘普生或其药学上可接受的盐和至少一种粘合剂。
[0050]
在固体口服剂型是片剂的情况下,片剂可通过将本发明的共混物压制成片剂获得。为了进行压制,可以使用配备有3/8
″
圆形标准凹面工具的piccola“b”压机或任何其他压片机。在固体口服剂型是胶囊的情况下,胶囊可通过将本发明的共混物填充到空胶囊壳(例如“00”号或“0”号)胶囊壳中获得。在固体口服剂型是粉末的情况下,将本发明的共混物填充到容器中,所述容器优选为袋、囊剂或棒状包装。
[0051]
本发明的一个实施方式涉及一种共混物,所述共混物包含:
[0052]
a)颗粒,和
[0053]
b)维生素b6
[0054]
其中所述颗粒包含萘普生或其药学上可接受的盐和至少一种粘合剂,并且其中所述共混物进一步包含至少一种药学上可接受的赋形剂。本领域技术人员应理解,在该实施方式中,维生素b6是颗粒外维生素b6。因此,可替代地,相同的实施方式可以被重新表述为
一种共混物,所述共混物包含:
[0055]
a)颗粒,和
[0056]
b)颗粒外维生素b6
[0057]
其中所述颗粒包含萘普生或其药学上可接受的盐和至少一种粘合剂,并且其中所述共混物进一步包含至少一种药学上可接受的赋形剂。这在细节上作必要修改后也适用于以下实施方式。
[0058]
药学上可接受的赋形剂的选择取决于共混物的用途。
[0059]
在共混物意欲被压制成片剂的情况下,共混物进一步优选包含至少一种稀释剂(例如微晶纤维素、磷酸二钙、乳糖、麦芽糖糊精、甘露醇以及它们的混合物),任选的至少一种崩解剂(例如交联羧甲基纤维素钠、淀粉、交联聚维酮、羟基乙酸淀粉钠以及它们的混合物)和至少一种润滑剂(例如硬脂酸镁、聚乙二醇(peg)、硬脂酸钙、滑石、硬脂酰延胡索酸钠以及它们的混合物)。因此,本发明的优选实施方式涉及一种共混物,所述共混物包含:
[0060]
a)颗粒,和
[0061]
b)颗粒外盐酸吡哆醇
[0062]
其中所述颗粒包含萘普生钠和至少一种粘合剂,并且其中所述共混物进一步包含至少一种稀释剂(优选微晶纤维素)和至少一种润滑剂(优选硬脂酸镁)。
[0063]
在共混物意欲被填充到胶囊壳中的情况下,所述共混物包含任选的至少一种流动剂,例如二氧化硅;润滑剂的添加也是任选的。
[0064]
因此,本发明的优选实施方式涉及一种共混物,所述共混物包含:
[0065]
a)颗粒,和
[0066]
b)颗粒外盐酸吡哆醇
[0067]
其中所述颗粒包含萘普生钠和至少一种粘合剂,并且其中所述共混物优选不含任何润滑剂。
[0068]
在共混物意欲被填充到囊剂、棒状包装等中的情况下,所述共混物进一步包含优选至少一种水溶性稀释剂例如甘露醇和/或至少一种掩味剂,例如甜味剂(例如三氯蔗糖)、酸(例如柠檬酸或苹果酸)或调味剂(例如柠檬香精或覆盆子香精)。因此,本发明的另一个优选实施方式涉及一种共混物,所述共混物包含:
[0069]
a)颗粒,和
[0070]
b)颗粒外盐酸吡哆醇
[0071]
其中所述颗粒包含萘普生钠和至少一种粘合剂,并且其中所述共混物进一步包含至少一种水溶性稀释剂和至少一种掩味剂,所述掩味剂优选为甜味剂、至少一种可食用酸和至少一种药学上可接受的调味剂的组合。
[0072]
通常,颗粒的大小不取决于共混物的用途。
[0073]
在一个实施方式中,基于颗粒的总重量,至少80重量%,优选至少85重量%,最优选至少90重量%的颗粒通过16目筛网,和/或基于颗粒的总重量,至少80重量%,优选至少85重量%,最优选至少90重量%的颗粒被200目筛网保留。在替代实施方式中,基于颗粒的总重量,至少80重量%,优选至少85重量%,最优选至少90重量%的颗粒通过18目筛网,和/或基于颗粒的总重量,至少80重量%,优选至少85重量%,最优选至少90重量%的颗粒被200目筛保留。在又一个实施方式中,基于颗粒的总重量,至少80重量%,优选至少85重
量%,最优选至少90重量%的颗粒通过16目筛网,和/或基于颗粒的总重量,至少80重量%,优选至少85重量%,最优选至少90重量%的颗粒被170目筛网保留。在又一个实施方式中,基于颗粒的总重量,至少80重量%,优选至少85重量%,最优选至少90重量%的颗粒通过18目筛网,和/或基于颗粒的总重量,至少80重量%,优选至少85重量%,最优选至少90重量%的颗粒被170目筛网保留。
[0074]
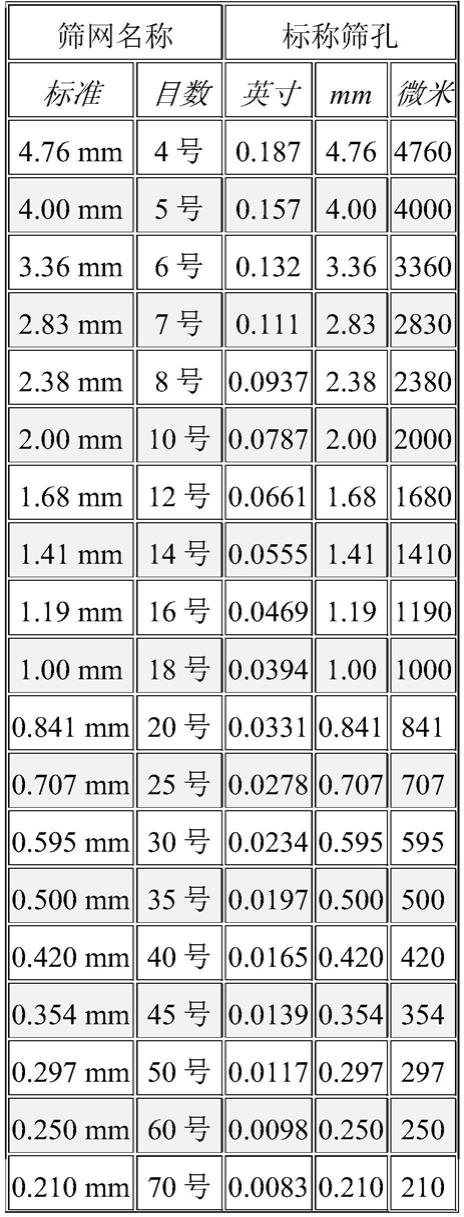
粒径转换表如下给出:
[0075]
[0076][0077]
根据本发明的方法,维生素b6是颗粒外化合物。然而,尽管不是优选的,但这并不排除本文所述的颗粒包含少量维生素b6的可能性。在一个实施方式中,基于颗粒的总重量,本文所述的颗粒包含小于10重量%,优选小于5重量%,更优选小于1重量%,最优选小于0.1重量%的维生素b6。本发明的优选实施方式涉及一种共混物,所述共混物包含:
[0078]
a)颗粒,和
[0079]
b)颗粒外维生素b6,所述颗粒外维生素b6优选为盐酸吡哆醇
[0080]
其中所述颗粒包含萘普生钠和至少一种粘合剂,并且其中所述颗粒包含小于1重量%,优选小于0.1重量%的维生素b6,并且
[0081]
其中所述共混物进一步包含至少一种药学上可接受的赋形剂。
[0082]
可以使用任何适用于萘普生造粒的粘合剂。在萘普生钠的情况下,用水作为加工溶剂的湿法造粒是优选的,并且因此,粘合剂优选是水溶性的。特别优选的粘合剂是水溶性聚乙烯吡咯烷酮,例如pvp k30。
[0083]
在一个优选实施方式中,除了维生素b6之外,本发明的共混物还包含至少一种附加b族维生素,例如维生素b1或维生素b12。
[0084]
如果存在的话,则维生素b1优选是颗粒内化合物。当将这种共混物压制成片剂时,维生素b1的颗粒内添加增加了所获得的片剂的硬度。此外,可以通过省略稀释剂或通过减少稀释剂的量来减小片剂的大小。
[0085]
如果存在的话,则维生素b12优选为颗粒外化合物,因为这简化了萘普生钠的造粒。因此,本发明的一个实施方式涉及一种共混物,所述共混物包含:
[0086]
a)颗粒,
[0087]
b)颗粒外维生素b6,
[0088]
c)任选的颗粒外维生素b12,并且
[0089]
其中所述颗粒包含萘普生钠、维生素b1和至少一种粘合剂。优选地,基于颗粒的总
重量,本发明的颗粒包含5重量%至80重量%,优选20重量%至60重量%,更优选30重量%至55重量%,最优选35重量%至50重量%的维生素b1。
[0090]
根据本发明的优选方法,维生素b6是颗粒外化合物,而维生素b1是颗粒内化合物。然而,尽管不是优选的,这并不排除共混物包含少量颗粒内维生素b6和/或少量颗粒外维生素b1的可能性。在一个实施方式中,基于颗粒的总重量,本文所述的颗粒包含小于10重量%,优选小于5重量%,更优选小于1重量%,最优选小于0.1重量%的维生素b6。在另一个实施方式中,基于共混物的总重量,本文所述的共混物包含小于10重量%,优选小于5重量%,更优选小于1重量%,最优选小于0.1重量%的颗粒外维生素b1。本发明的优选实施方式涉及一种共混物,所述共混物包含:
[0091]
a)颗粒,
[0092]
b)颗粒外维生素b6,
[0093]
c)任选的颗粒外维生素b12,并且
[0094]
其中所述颗粒包含萘普生钠、维生素b1和至少一种粘合剂,并且
[0095]
其中基于所述颗粒的总重量,所述颗粒包含小于1重量%,优选小于0.1重量%的维生素b6,并且
[0096]
其中所述共混物包含小于1重量%,优选小于0.1重量%的颗粒外维生素b1。
[0097]
本发明更优选的实施方式涉及一种共混物,所述共混物包含:
[0098]
a)颗粒,和
[0099]
b)颗粒外盐酸吡哆醇
[0100]
c)颗粒外维生素b12,并且
[0101]
其中所述颗粒包含萘普生钠、维生素b1和至少一种水溶性粘合剂,并且
[0102]
其中基于所述颗粒的总重量,所述颗粒包含小于1重量%,优选小于0.1重量%的维生素b6,
[0103]
其中基于所述共混物的总重量,所述共混物包含小于1重量%,优选小于0.1重量%的颗粒外维生素b1,并且
[0104]
其中所述共混物进一步包含至少一种药学上可接受的赋形剂。
[0105]
根据本发明的方法,维生素b12是颗粒外化合物。然而,尽管不是优选的,但这并不排除本文所述的颗粒包含少量维生素b12的可能性。在一个实施方式中,基于颗粒的总重量,本文所述的颗粒包含小于1重量%,优选小于0.1重量%,更优选小于0.01重量%,最优选小于0.001重量%的维生素b12。
[0106]
将维生素b12添加到固定剂量复合剂中是挑战性的。结晶维生素b12是商购可得的,但对光非常敏感。因此,除非使用非常大量的包装,否则当使用结晶维生素b12时,将不会达到所需的保质期。此外,需要添加的维生素b12的量(基于rda)非常少。在大多数情况下,200μg或更少就足够了。由于量少,所以很难甚至不可能达到可接受的含量均匀性。因此,当添加结晶维生素b12时,存在维生素b12含量将因片剂而异的高风险。维生素b12的颗粒外添加允许使用经喷雾干燥的维生素b12制剂。使用经喷雾干燥的维生素b12制剂,例如“维生素b12 0.1%ws”(可在nutritional products,switzerland获得)提高了维生素b12含量均匀性和稳定性。因此,本发明的优选实施方式涉及一种共混物,所述共混物包含:
[0107]
a)颗粒,
[0108]
b)颗粒外盐酸吡哆醇,和
[0109]
c)经喷雾干燥的维生素b12制剂,并且
[0110]
其中所述颗粒包含萘普生钠、维生素b1和至少一种水溶性粘合剂,并且
[0111]
其中基于所述共混物的总重量,所述共混物包含小于1重量%,优选小于0.1重量%的颗粒外维生素b1,并且
[0112]
其中基于所述颗粒的总重量,所述颗粒包含小于1重量%,优选小于0.1重量%的维生素b6,并且
[0113]
其中所述共混物进一步包含至少一种药学上可接受的赋形剂。
[0114]
本发明的最优选固体口服剂型是一种片剂,所述片剂包含至少220mg的萘普生钠并且可通过压制共混物获得,其中所述共混物包含:
[0115]
a)颗粒,
[0116]
b)颗粒外盐酸吡哆醇,和
[0117]
c)经喷雾干燥的维生素b12制剂,并且
[0118]
其中所述颗粒包含萘普生钠、维生素b1和至少一种水溶性粘合剂,并且
[0119]
其中所述维生素b1优选为盐酸硫胺素、单硝酸硫胺素或苯磷硫胺,并且其中所述维生素b1最优选为盐酸硫胺素,并且
[0120]
其中基于所述共混物的总重量,所述共混物包含小于1重量%,优选小于0.1重量%的颗粒外维生素b1,并且
[0121]
其中基于所述颗粒的总重量,所述颗粒包含小于1重量%,优选小于0.1重量%的维生素b6,并且
[0122]
其中所述共混物进一步包含至少一种稀释剂、至少一种崩解剂和至少一种润滑剂。
[0123]
制备本发明的固体口服剂型的方法
[0124]
本发明还涉及一种制备固体口服剂型的方法,所述固体口服剂型包含萘普生或其药学上可接受的盐、维生素b6和任选的至少一种附加维生素b。因此,本发明还涉及制备萘普生和维生素b复合物中的至少一种维生素的固定剂量复合剂(fdc)的方法。
[0125]
本发明的方法优选涉及湿法造粒,优选使用水作为加工溶剂的湿法造粒。对于造粒,可以使用任何合适的设备,例如使用kitchenaid professional 600混合器进行湿法造粒。
[0126]
本发明的方法包括向颗粒内组合物中颗粒外添加维生素b6,其中所述颗粒内组合物包含萘普生或其药学上可接受的盐和至少一种粘合剂。在该实施方式中,所述方法优选包括以下步骤:
[0127]
a)在至少一种粘合剂的存在下,用水作为加工溶剂将萘普生或其药学上可接受的盐进行湿法造粒,以获得颗粒
[0128]
b)干燥步骤a)中获得的颗粒
[0129]
c)任选地研磨步骤b)中获得的颗粒
[0130]
d)将步骤c)中获得的颗粒与维生素b6和至少一种药学上可接受的赋形剂混合,以及
[0131]
e)任选地,将步骤d)中获得的共混物压制成片剂,或者将步骤d)中获得的共混物填充到胶囊中,或者将步骤d)中获得的共混物填充到容器中,所述容器优选为袋子、囊剂或棒状包装。
[0132]
在一个优选实施方式中,本发明涉及一种制备固体口服剂型的方法,所述固体口服剂型包含萘普生或其药学上可接受的盐、维生素b6、维生素b1和任选的至少一种附加b族维生素。在该实施方式中,本发明的方法包括向颗粒内组合物中颗粒外添加维生素b6,其中所述颗粒内组合物包含萘普生或其药学上可接受的盐、维生素b1和至少一种粘合剂。因此,所述方法优选包括以下步骤:
[0133]
a)在至少一种粘合剂和维生素b1的存在下,用水作为加工溶剂将萘普生或其药学上可接受的盐进行湿法造粒,以获得颗粒
[0134]
b)干燥步骤a)中获得的颗粒
[0135]
c)任选地研磨步骤b)中获得的颗粒
[0136]
d)将步骤c)中获得的颗粒与维生素b6和至少一种药学上可接受的赋形剂混合,以及
[0137]
e)任选地,将步骤d)中获得的共混物压制成片剂,或者将步骤d)中获得的共混物填充到胶囊中,或者将步骤d)中获得的共混物填充到容器中,所述容器优选为袋子、囊剂或棒状包装。
[0138]
在又一个优选实施方式中,本发明涉及一种制备固体口服剂型的方法,所述固体口服剂型包含萘普生或其药学上可接受的盐、维生素b6、维生素b12和任选的至少一种附加b族维生素。在该实施方式中,本发明的方法包括向颗粒内组合物中颗粒外添加维生素b6和维生素b12,其中所述颗粒内组合物包含萘普生或其药学上可接受的盐和至少一种粘合剂。因此,所述方法优选包括以下步骤:
[0139]
a)在至少一种粘合剂的存在下,用水作为加工溶剂将萘普生或其药学上可接受的盐进行湿法造粒,以获得颗粒
[0140]
b)干燥步骤a)中获得的颗粒
[0141]
c)任选地研磨步骤b)中获得的颗粒
[0142]
d)将步骤c)中获得的颗粒与维生素b6、至少一种药学上可接受的赋形剂和至少一种经喷雾干燥的维生素b12制剂混合,以及
[0143]
e)任选地,将步骤d)中获得的共混物压制成片剂,或者将步骤d)中获得的共混物填充到胶囊中,或者将步骤d)中获得的共混物填充到容器中,所述容器优选为袋子、囊剂或棒状包装。
[0144]
在更优选的实施方式中,本发明涉及制备固体口服剂型的方法,所述固体口服剂型包含萘普生或其药学上可接受的盐、维生素b6、维生素b1和维生素b12。在该实施方式中,本发明的方法包括向颗粒内组合物中颗粒外添加维生素b6和维生素b12,其中所述颗粒内组合物包含萘普生或其药学上可接受的盐、维生素b1和至少一种粘合剂。因此,所述方法优选包括以下步骤:
[0145]
a)在至少一种粘合剂和维生素b1的存在下,用水作为加工溶剂将萘普生或其药学上可接受的盐进行湿法造粒,以获得颗粒
[0146]
b)干燥步骤a)中获得的颗粒
[0147]
c)任选地研磨步骤b)中获得的颗粒
[0148]
d)将步骤c)中获得的颗粒与维生素b6、至少一种药学上可接受的赋形剂和至少一种经喷雾干燥的维生素b12制剂混合,以及
[0149]
e)任选地,将步骤d)中获得的共混物压制成片剂,或者将步骤d)中获得的共混物填充到胶囊中,或者将步骤d)中获得的共混物填充到容器中,所述容器优选为袋子、囊剂或棒状包装。
[0150]
优选的萘普生是萘普生钠。优选的维生素b6是盐酸吡哆醇。维生素b1优选为盐酸硫胺素、单硝酸硫胺素、苯磷硫胺或它们的混合物。最优选的维生素b1是盐酸硫胺素。因此,本发明的方法更优选包括以下步骤:
[0151]
a)在至少一种粘合剂和盐酸硫胺素的存在下,用水作为加工溶剂将萘普生钠进行湿法造粒,以获得颗粒
[0152]
b)干燥步骤a)中获得的颗粒
[0153]
c)任选地研磨步骤b)中获得的颗粒
[0154]
d)将步骤c)中获得的颗粒与至少一种药学上可接受的赋形剂、盐酸吡哆醇和至少一种经喷雾干燥的维生素b12制剂混合,以及
[0155]
e)任选地,将步骤d)中获得的共混物压制成片剂,或者将步骤d)中获得的共混物填充到胶囊中,或者将步骤d)中获得的共混物填充到容器中,所述容器优选为袋子、囊剂或棒状包装。
附图说明
[0156]
图1示出了实施例9中制造的片剂。
[0157]
图2示出了实施例11中制备的饮料。
[0158]
实施例
[0159]
实施例1(对照;仅萘普生钠)
[0160]
实施例1是仅涉及萘普生钠(即不含任何维生素)的对照实验。首先,评估萘普生钠的物理性质(来源:中国西安沃顿生物科技有限公司(xi’an wharton biological technology co.,ltd.,china))。这种评估的结果在下表1中显示。
[0161]
表1.萘普生钠的物理性质
[0162]
材料bd(g/ml)td(g/ml)卡尔指数描述萘普生钠0.300.5545非常成块的
[0163]
表1显示了堆积密度(bulk density,bd)、振实密度(tapped density,td)和卡尔指数。卡尔指数是通过公式100
×
(1-bd/td)计算的,并用作流动性的指示。大于25的卡尔指数被认为是不良流动性的标志。如从表1中可以看出,萘普生钠是一种具有不良流动性的块状粉末。该初步评估表明,萘普生钠不适合直接压制。
[0164]
因此,使用聚乙烯吡咯烷酮(polyvinylpyrrolidone,pvp)作为粘合剂,对萘普生钠进行湿法造粒。为此,将干燥的萘普生钠放入造粒机中。然后,逐渐添加包含pvp k30(可在ashland获得)和水的粘合剂水溶液,并给颗粒捏合留出一些时间。然后将湿颗粒物质转移到托盘上展开。将颗粒首先在86℃干燥2.5小时,然后在50℃干燥过夜。基于湿颗粒的总重量,颗粒的干燥损失(loss on drying,lod)值在3-4重量%之间。最后,使用配备有4mm筛
网的fitz磨机(研磨速度:20-30hz;刀片向前)研磨经干燥的颗粒。对粒子进行分类,直到保留在20目筛网上的颗粒少于30%。如此获得的萘普生钠颗粒的组成如下表2所示,当靶向包含221.11mg的萘普生钠的片剂(对应于标签声明220mg的萘普生)时,以mg/片剂表示。
[0165]
表2.造粒试验的配方(mg/片剂)
[0166][0167]
纯度是一个无量纲因子。
[0168]
如此获得的经干燥的颗粒具有比未造粒的萘普生钠高得多的密度和小得多的卡尔指数。下表3显示了可适用测试的结果。
[0169]
表3.湿法造粒试验和原材料的物理性质
[0170][0171]
为了生产片剂,将所获得的萘普生钠颗粒与以下合适赋形剂共混:作为稀释剂的微晶纤维素(microcrystalline cellulose,mcc);作为崩解剂的交联羧甲基纤维素钠;和作为润滑剂的硬脂酸镁。片剂是在配备有3/8
″
标准凹圆工具的piccola b转盘压片机上以25rpm的压制速度生产的。将萘普生片剂(标签声明:200mg)用不同的压制力(1000lbs.、2000lbs.和3000lbs.)压制。这种压片试验的结果在表4中显示。
[0172]
表4.萘普生钠颗粒的压片试验
[0173][0174]
如此获得的萘普生片剂的硬度通过检查断裂力用sotax ht10硬度试验机测量,并且范围从4.9kp至9.0kp(1kp=1kg力=9.8n)。实施例1表明所选择的赋形剂、设备和工艺条件适合于制造包含萘普生钠的固体口服剂型。
[0175]
实施例2(比较例;维生素b6的颗粒内添加)
[0176]
在实施例2中,重复实施例1的压片试验。然而,在实施例2中,将萘普生钠与维生素b6一起造粒。使用盐酸吡哆醇(可在nutritional products,switzerland获得)作为维生素b6的来源。如此获得的颗粒的组成如下表5所示,以mg/片剂表示。
[0177]
表5.造粒试验的配方(mg/片剂)
[0178][0179]
超额是指膳食成分例如维生素的量超过目标量。其表示为基于目标量的重量的重
量%。在上表5中,267.41mg的盐酸吡哆醇*0.8227=220mg盐酸吡哆醇已被放入每个片剂中。这相当于超额10重量%(200mg 10重量%=220mg)。通常,超额是为了补偿由于制造或储存期间的降解造成的损失。
[0180]
与未造粒的萘普生钠和未造粒的盐酸吡哆醇相比,如此获得的经干燥的颗粒具有高得多的密度和小得多的卡尔指数。结果在下表6中显示。
[0181]
表6.湿法造粒试验和原材料的物理性质
[0182][0183]
初步评估表明,所获得的包含萘普生钠和盐酸吡哆醇的颗粒适合于直接压制。然后以与实施例1相同的方式压制片剂。该压片试验的结果在下表7中显示。
[0184]
表7.包含萘普生钠和盐酸吡哆醇的颗粒的压片试验
[0185]
[0186]
尽管已经测量到小于25的卡尔指数(这表明颗粒应适合于直接压制),但令人惊讶的是,不可能压制出无顶裂的片剂。由于顶裂,无法测量片剂的硬度。
[0187]
实施例3(维生素b6的颗粒外添加)
[0188]
重复实施例2。然而,在实施例3中,盐酸吡哆醇不与萘普生钠一起造粒。取而代之的是,使用实施例1的萘普生钠颗粒,然后将盐酸吡哆醇与所需的赋形剂一起添加。该压片试验的结果在下表8中显示。
[0189]
表8.仅包含萘普生钠的颗粒;然后将盐酸吡哆醇与所需的赋形剂一起添加的压片试验
[0190][0191]
在实施例3中,尽管使用了相同量的相同成分(即与实施例2中相同),但没有观察到顶裂。除了这一令人惊讶的结果之外,在所有测试的压制力下,片剂硬度比对照(参见实施例1,表4)稍高。
[0192]
实施例4(维生素b1的颗粒外添加)
[0193]
在实施例4中,制备萘普生钠和维生素b1的固定剂量复合剂。作为维生素b1的来源,使用盐酸硫胺素(可在nutritional products,switzerland获得)。考虑到实施例2中的失败,重复实施例3的方法。因此,使用实施例1的萘普生钠颗粒,然后将盐酸硫胺素与所需的赋形剂一起添加。该压片试验的结果在下表9中显示。
[0194]
表9.仅包含萘普生钠的颗粒;然后将盐酸硫胺素与所需的赋形剂一起添加的压片试验
[0195][0196]
实施例4不成功,因为共混物太蓬松而无法用3/8
″
标准凹圆工具达到目标片剂重量。因此,当用维生素b1代替维生素b6时,实施例3的方法失败了。
[0197]
实施例5(维生素b1的颗粒内添加)
[0198]
在实施例5中,重复实施例2的压片试验,其中维生素b6被维生素b1代替。因此,将萘普生钠与维生素b1一起造粒。测试了三种不同的维生素b1来源:盐酸硫胺素、单硝酸硫胺素(二者均可在nutritional products,switzerland获得)和苯磷硫胺(可在中国西安沃顿生物科技有限公司获得)。如此获得的颗粒的组成如下表10所示,以mg/片剂表示。b1的标签声明为100mg。对应的转换因子基于来自历史批次的分子量、效力和水分含量。对于所有b1形式存在10重量%过量。
[0199]
表10.造粒试验的配方(mg/片剂)
[0200][0201]
与未造粒的萘普生钠和未造粒的维生素b1相比,如此获得的经干燥的颗粒具有高得多的密度和小得多的卡尔指数。结果在下表11中显示。
[0202]
表11.湿法造粒试验和原材料的物理性质
[0203][0204]
评估表明,无论使用哪种维生素b1来源,所获得的包含萘普生钠和维生素b1的颗粒都适合于直接压制。然后以与实施例1和实施例2相同的方式压制片剂。三种片剂的组成在以下表12a、表12b和表12c中显示。
[0205]
表12a.包含萘普生钠和盐酸硫胺素的颗粒的压片试验
[0206][0207]
表12b.包含萘普生钠和单硝酸硫胺素的颗粒的压片试验
[0208][0209]
表12c.包含萘普生钠和苯磷硫胺的颗粒的压片试验
[0210][0211][0212]
无论使用哪种维生素b1来源,压片试验都是成功的。令人惊讶的是,当维生素b1与萘普生钠一起进行造粒时,可压制性得到了显著改善。所有测试的维生素b1来源都发生了这种效应,但当使用盐酸硫胺素或苯磷硫胺作为维生素b1来源时,这种效应尤其强烈。在
2000lbs.时,所获得的片剂的硬度从8.5kp(对照;实施例1,表4)针对盐酸硫胺素增大到16kp,并且针对苯磷硫胺增大到17.2kp。这与对照组相比增加了约100%。
[0213]
实施例6(减小片剂大小;维生素b1)
[0214]
在实施例6中,重复实施例5的压片试验。然而,随着发现b1提高萘普生可压制性,将稀释剂(mcc 200)从片剂中完全去除。使用最有前途的维生素b1来源(即盐酸硫胺素和苯磷硫胺;参见实施例5)。这一非常艰巨的压片试验的结果在以下表13a和表13b中显示。
[0215]
表13a.包含萘普生钠和盐酸硫胺素,但不含mcc 200的颗粒的压片试验
[0216][0217][0218]
表13b.包含萘普生钠和苯磷硫胺,但不含mcc 200的颗粒的压片试验
[0219][0220]
无论是使用盐酸硫胺素还是苯磷硫胺作为维生素b1来源,实施例6中的压片试验都是成功的。尽管缺少稀释剂,但是所获得的片剂仍具有比对照更高的硬度(参见实施例1,表4)。因此,实施例6表明,当将萘普生钠与维生素b1一起造粒时,可以显著减少稀释剂的量。稀释剂量的减少对于包含相对大量的各种药物活性成分(api)的固定剂量复合剂非常有意义。在盐酸硫胺素作为维生素b1来源的情况下,在不改变标签声明的情况下,片剂重量可从447.18mg降至375.71mg。这相当于片剂重量减少了16%。在苯磷硫胺作为维生素b1来源的情况下,片剂重量降低较小,但仍然有意义(在不改变标签声明的情况下,从494.73mg降低14.4%至423.26mg)。因此,在本发明的上下文中,盐酸硫胺素是优选的维生素b1来源。
[0221]
实施例7(维生素b12的颗粒内添加)
[0222]
维生素b12晶体可在nutritional products,switzerland商购获得。还提供了经喷雾干燥的形式的维生素b12。在实施例7中,经喷雾干燥的维生素b12制剂用于(i)增加固定剂量复合剂的保质期和(ii)提高含量均匀性。
[0223]
在实施例7中,重复实施例2的压片试验。然而,在实施例7中,将维生素b6用经喷雾干燥的维生素b12制剂代替。因此,将萘普生钠与经喷雾干燥的维生素b12制剂一起造粒。
[0224]
实施例7失败是因为经喷雾干燥的维生素制剂在干燥步骤中熔化,即颗粒在干燥步骤中形成无用的糊状物。因此,所测试的经喷雾干燥的维生素b12制剂不适合于湿法造粒,因为湿法造粒涉及干燥步骤。
[0225]
实施例8(维生素b12的颗粒外添加)
[0226]
在实施例8中,制备了萘普生钠和维生素b12的固定剂量复合剂。使用经喷雾干燥的维生素b12制剂(可在nutritional products以商品名维生素b12 0.1%ws获得)作为维生素b12来源。考虑到实施例7中的失败,重复实施例3的方法。因此,使用实施例1的
萘普生钠颗粒,然后将经喷雾干燥的维生素b12制剂与所需的赋形剂一起添加。该压片试验的结果在下表14中显示。
[0227]
表14.仅包含萘普生钠的颗粒;然后将维生素b12来源与所需的赋形剂一起添加的压片试验
[0228][0229][0230]
实施例8是成功的。无论施加1000lbs.、2000lbs.还是3000lbs.的压制力,都获得了相当硬的片剂。
[0231]
实施例9(具有断裂缺口的片剂)
[0232]
在实施例9中,制备了包含萘普生和三种不同的b族维生素的片剂。首先,类似于实施例5,制备包含萘普生钠和维生素b1的颗粒(参见表10)。然后将如此获得的颗粒与维生素b6、经喷雾干燥的维生素b12制剂和所需的赋形剂共混。然后将共混物压制成目标片剂重量为1100mg的片剂。如此获得的片剂的组成在下表15中显示。
[0233]
表15.包含萘普生(200mg)、维生素b1(100mg)、维生素b6(200mg)和维生素b12(200μg)的片剂
[0234]
[0235][0236]
所述片剂是在配备有带有标志的0.3543
×
0.7480
″
椭圆形工具的piccola“b”压机上生产的。压制力为4000lbs.。片剂硬度为12.9kp,脆碎度为0.49%。
[0237]
通过将最少10片片剂和最少6.5g片剂放入sotax f1脆碎机中,然后将片剂翻滚100圈来测量脆碎度。重量损失/初始重量
×
100%是脆碎度。这是根据usp第1216章,2017年。
[0238]
在sotax dt2崩解装置(纯净水,根据usp第1216章,2017年)上测量崩解。崩解时间短至1分50秒。单独片剂重量差异(rsd)为1.57%(基于10片片剂计算的)。实施例9的片剂的图像在图1中示出。
[0239]
实施例10(胶囊)
[0240]
在实施例10中,制备了包含萘普生和三种不同的b族维生素的硬壳胶囊。首先,类似于实施例5,制备包含萘普生钠和维生素b1的颗粒。然后将如此获得的颗粒与维生素b6、经喷雾干燥的维生素b12制剂和所需的赋形剂共混。然后将共混物填充到胶囊中。如此获得的胶囊的组成在下表16中显示。
[0241]
表16.包含萘普生(200mg)、维生素b1(100mg)、维生素b6(200mg)和维生素b12(200μg)的胶囊
[0242][0243]
与实施例9的片剂制剂相比,mcc 200的量显著减少,因为它是硬壳胶囊制剂而不是片剂。完全省略了交联羧甲基纤维素钠和硬脂酸镁。服用份量是一个或多个胶囊中的910mg粉末。“0”号胶囊壳中共混物的填充重量范围为335.3mg至456.8mg。“00”号胶囊壳中共混物的填充重量范围为445.6mg至615.3mg。因此,在“0”或“00”号胶囊壳中,胶囊的服用份量都是2粒胶囊。
[0244]
实施例11(rtm棒状包装)
[0245]
在实施例11中,制备了包含萘普生和三种不同的b族维生素的rtm(即混)棒状包装。首先,类似于实施例5,制备包含萘普生钠和维生素b1的颗粒。然后将如此获得的颗粒与维生素b6、经喷雾干燥的维生素b12制剂和其它合适的赋形剂共混。然后将共混物填充到棒状包装中。如此获得的棒状包装中的共混物的组成在下表17中显示。
[0246]
表17.包含萘普生(200mg)、维生素b1(100mg)、维生素b6(200mg)和维生素b12(200μg)的rtm
[0247][0248]
除了活性物质,还添加了香料和酸来改善味道;甘露醇用作稀释剂。服用份量为待分散在8oz水中的2g/棒状包装。饮料的图像可以在图2中看到。这种饮料的粉红色和它的味道很相配。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
