1.本发明涉及一种以火龙果茎尖为材料的染色体及核型分析方法,属于植物细胞学及细胞遗传学领域研究。
背景技术:
2.植物染色体是植物细胞中包含重要遗传信息的聚合体,其在细胞分裂时期易于被碱性染料染色并可以在显微镜下观察呈现出棒状或圆柱状。染色体核型分析就是通过染色体数量、形态特征、着丝点位置、端粒有无等染色体特征信息进行观察研究,对染色体信息进行分析的方法。
3.火龙果是仙人掌科(cactaceae)量天尺属(hylocereus)或蛇鞭柱属(seleniereus)的新型热带特色水果,起源于中美洲热带雨林地区。量天尺属植物的染色体基数是11,并且大对数品种都属于二倍体(2n=2x=22),同时通过种质收集、人工杂交育种等研究,已经获得了三倍体、四倍体、五倍体、六倍体火龙果植株(刘顺枝,刘政浩,林润仪等.白肉火龙果染色体制片技术及核型分析[j].广东农业科学,2015,42(03):115-118 193.)。针对火龙果的染色体相关研究,还处于发展阶段,核型分析研究的报道也很少。关于火龙果的核型分析研究方法,基本都是用常规的根尖压片法或者火龙果气生根压片法,相对于根尖压片法,火龙果气生根压片法更方便,但是火龙果气生根的催生并不稳定,材料难以获得,而根尖取材也相对比较麻烦,实验成功率不高。因此建立一种更方便、更稳定的火龙果染色体核型研究的方法,将对火龙果的染色体观察与核型分析、种质资源分类的倍性鉴定及育种工作提供重要的技术支撑。
技术实现要素:
[0004]
为了上述问题,本发明的目的在于提供一种以火龙果茎尖为材料的染色体核型分析研究方法,使得在显微镜下可以清晰观察各种染色体形态,进行核型与倍性研究。
[0005]
为了达到以上目的,本发明提供技术方法如下:步骤1:取材、预处理选取健康、幼嫩的火龙果茎尖,并将其解剖得到火龙果植株中心茎尖;
[0006]
步骤2:浓缩将解剖得到的火龙果茎尖放入0.2%秋水仙素与0.002m的8-羟基喹啉混合液中,常温下放置至少2h。
[0007]
步骤3:前低渗浓缩后的茎尖用0.075m的kcl在常温下浸泡。
[0008]
步骤4:前固定将茎尖放入卡诺氏固定液(无水乙醇:冰醋酸=3:1)中,放置4℃冷藏固定4h以上。
[0009]
步骤5:解离将洗去卡诺氏固定液后的茎尖放入1m的hcl中,进行解离。
[0010]
步骤6:酶解将解离后的茎尖放入2.5%纤维素酶和2.5%果胶酶的混合液中,在常温下放置至少1h。
[0011]
步骤7:后低渗将经过酶解的茎尖清洗放入双蒸馏水中低渗10-30min。
[0012]
步骤8:后固定将后低渗的茎尖放入卡诺氏固定液中,在4℃下冷藏固定20—30min,如不能及时制片使用,可将茎尖漂洗之后放入75%的酒精中,4℃保存。
[0013]
步骤9:染色、制片将茎尖置于载玻片上,切取1-2mm,滴加10%改良苯酚品红染色液,盖上盖玻片,染色20-40min,染色结束后用蒸馏水洗去多余染料,并用滤纸吸去多余液体;压片过程中使用带有橡皮的铅笔轻轻敲击盖玻片,使得茎尖组织和细胞可以均匀的分散在载玻片上。
[0014]
步骤10:镜检使用光学显微镜进行观察,先用低倍镜进行观察,找到合适的视野及分裂相后转到高倍镜进行观察、拍照。
[0015]
进一步的:步骤1中选用火龙果植株健康、幼嫩的茎尖为材料,并将其进行解剖。
[0016]
进一步的:步骤2具体操作过程为,将解剖得到的火龙果植株茎尖放入0.2%秋水仙素与0.002m的8-羟基喹啉混合液中,常温下放置2h。
[0017]
进一步的:步骤3具体操作过程为,使用0.075m的kcl将茎尖浸泡120min。
[0018]
进一步的:步骤4具体操作过程为,将茎尖放入卡诺氏固定液中于4℃下冷藏4h以上,卡诺氏固定液为无水乙醇:冰醋酸=3:1。
[0019]
进一步的:步骤5具体操作过程为,将洗去卡诺氏固定液后的茎尖放入1m的hcl中,常温下放置90min,进行解离。
[0020]
进一步的:步骤6具体操作过程为,将解离后的茎尖放入2.5%纤维素酶和2.5%果胶酶的混合液中,在常温下放置1h。
[0021]
进一步的:步骤7具体操作过程为,将经过酶解的茎尖清洗放入双蒸馏水中低渗30min。
[0022]
进一步的:步骤8具体操作过程为,将后低渗的茎尖放入卡诺氏固定液中,在4℃下冷藏固定30min,如不能及时制片使用,可将茎尖漂洗之后放入75%的酒精中,4℃保存。
[0023]
进一步的:步骤9具体操作过程为,将茎尖置于载玻片上,轻轻切取2mm,滴加10%改良苯酚品红染色液,盖上盖玻片,染色40min,染色结束后用蒸馏水洗去多余染料,并用滤纸吸去多余液体;压片过程中使用带有橡皮的铅笔轻轻敲击盖玻片,使得茎尖组织和细胞可以均匀的分散在载玻片上。
附图说明
[0024]
图1为本发明实施例1中未解剖的火龙果茎尖照片。
[0025]
图2为本发明实施例1中解剖后的火龙果茎尖照片。
[0026]
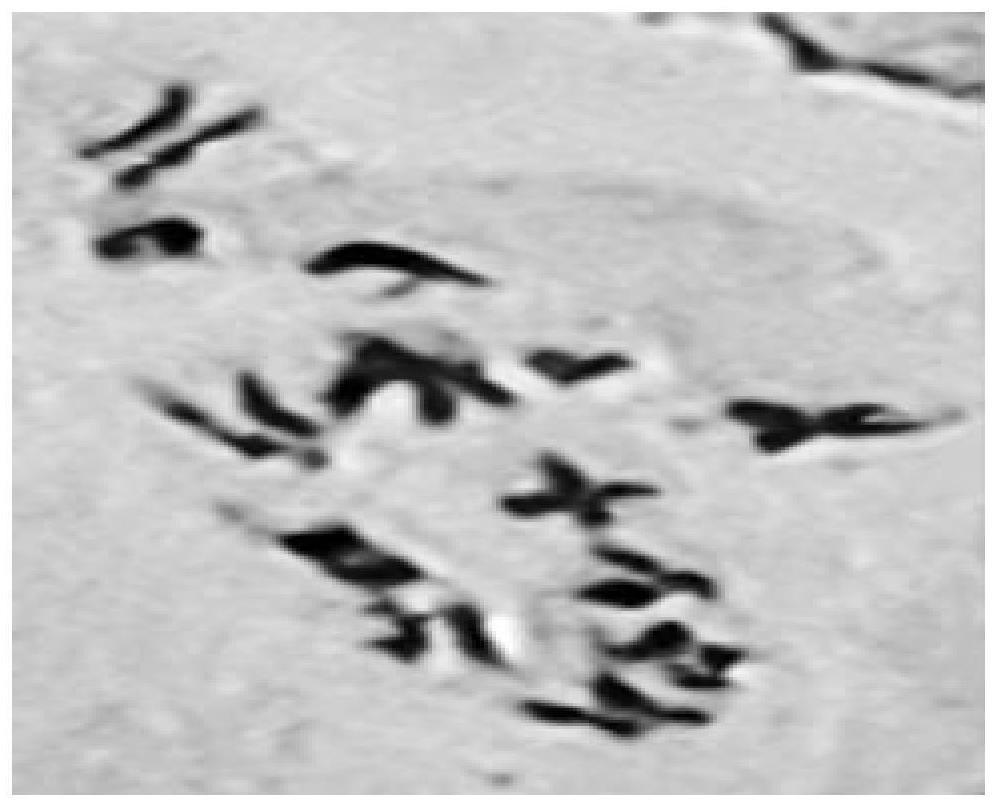
图3为本发明实施例1中火龙果茎尖染色体压片细胞外视野下100倍镜检照片。
[0027]
图4为本发明中火龙果根尖、气生根与解剖后的火龙果茎尖对比图。
[0028]
图5为本发明对比例1中火龙果根尖在显微镜下的照片。
[0029]
图6为本发明对比例1中火龙果气生根染色体压片细胞外视野下100倍镜检照片。
[0030]
图7为本发明实施例2中
‘
白肉’火龙果的茎尖染色体压片细胞外视野下100倍镜检照片。
[0031]
图8为本发明实施例2中
‘
金都一号’火龙果的茎尖染色体压片细胞外视野下100倍镜检照片。
具体实施方式
[0032]
下面结合附图和具体的实施例对本发明做进一步说明,应理解这些实施方式仅用于说明本发明而不用于限制本发明的范围。
[0033]
实施例1选取火龙果茎尖为实验材料,具体操作步骤如下:步骤1:取材、预处理选取健康、幼嫩的火龙果茎尖,并将其解剖得到火龙果植株中心茎尖。
[0034]
步骤2:浓缩将解剖得到的火龙果茎尖放入0.2%秋水仙素与0.002m的8-羟基喹啉混合液中,常温下放置2h。
[0035]
步骤3:前低渗浓缩后的茎尖用0.075m的kcl在常温下浸泡。
[0036]
步骤4:前固定将茎尖放入卡诺氏固定液(无水乙醇:冰醋酸=3:1)中,放置4℃冷藏固定4h以上。
[0037]
步骤5:解离将洗去卡诺氏固定液后的茎尖放入1m的hcl中,进行解离。
[0038]
步骤6:酶解将解离后的茎尖放入2.5%纤维素酶和2.5%果胶酶的混合液中,在常温下放置1h。
[0039]
步骤7:后低渗将经过酶解的茎尖清洗放入双蒸馏水中低渗10-30min。
[0040]
步骤8:后固定将后低渗的茎尖放入卡诺氏固定液中,在4℃下冷藏固定30min,如不能及时制片使用,可将茎尖漂洗之后放入75%的酒精中,4℃保存。
[0041]
步骤9:染色、制片将茎尖置于载玻片上,轻轻切取1-2mm,滴加10%改良苯酚品红染色液,盖上盖玻片,染色20-40min,染色结束后用蒸馏水洗去多余染料,并用滤纸吸去多余液体;压片过程中使用带有橡皮的铅笔轻轻敲击盖玻片,使得茎尖组织和细胞可以均匀的分散在载玻片上。
[0042]
步骤10:镜检使用光学显微镜进行观察,先用低倍镜进行观察,找到合适的视野及分裂相后转到高倍镜进行拍照,如图3所示,为100倍油镜下拍摄所得,根据图片对染色体进行计数。
[0043]
对比例1选取火龙果根尖以及火龙果气生根为实验材料,具体操作如下;
步骤1:取材选取火龙果植株的根尖进行清洗,气生根留用。
[0044]
步骤2:浓缩将火龙果的根尖和气生根放入0.2%秋水仙素与0.002m的8-羟基喹啉混合液中,常温下放置2h。
[0045]
步骤3:前低渗浓缩后的根尖与气生根用0.075m的kcl在常温下浸泡30min。
[0046]
步骤4:前固定将根尖与气生根放入卡诺氏固定液(无水乙醇:冰醋酸=3:1)中,放置4℃冷藏固定4h以上。
[0047]
步骤5:解离将洗去卡诺氏固定液后的根尖与气生根放入1m的hcl中,常温下解离50min。
[0048]
步骤6:酶解将解离后的根尖与气生根放入2.5%纤维素酶和2.5%果胶酶的混合液中,在常温下处理1h。
[0049]
步骤7:后低渗将经过酶解的根尖与气生根清洗放入双蒸馏水中低渗10min。
[0050]
步骤8:后固定将后低渗的根尖与气生根放入卡诺氏固定液中,在4℃下冷藏固定30min,如不能及时制片使用,可将根尖与气生根漂洗之后放入75%的酒精中,4℃保存。
[0051]
步骤9:染色、制片将根尖与气生根置于载玻片上,轻轻切取1-2mm,滴加10%改良苯酚品红染色液,盖上盖玻片,染色40min,染色结束后用蒸馏水洗去多余染料,并用滤纸吸去多余液体;压片过程中使用带有橡皮的铅笔轻轻敲击盖玻片,使得根尖与气生根组织和细胞可以均匀的分散在载玻片上。
[0052]
步骤10:镜检使用光学显微镜进行观察,先用低倍镜进行观察,找到合适的视野及分裂相后转到高倍镜进行拍照,如图5所示,为100倍油镜下拍摄所得。
[0053]
结果火龙果植株的根比较细小,主根少须根多;火龙果本身生长缓慢,从种植到可以稳定收集根尖需要较长的时间,而且采集根尖容易对火龙果植株造成损伤;由于火龙果的根尖较为细小,导致无法准确的切取根系的分生区以及不容易获得更为分散的分裂相,造成一般要用多条根尖才能制备1个玻片标本。我们通过沙培和水培来培养火龙果种子,发现由于火龙果种子较小,导致根系较弱,从沙培中取出容易断裂;水培下的种子根系虽然不会断裂,但是又过于小,操作不方便。气生根的整体效果要较优于火龙果根尖,但是火龙果气生根培养的手段不成熟,致使无法大批量的稳定获得气生根。植物染色体的观察与核型分析都需要20个以上的细胞,根尖与气生根的方法都导致获得优质的玻片需要较长的时间,选取根尖与气生根为材料,大大增加了工作量。
[0054]
结论
与火龙果根尖与气生根的制片技术相比,使用火龙果幼嫩的茎尖为材料的染色体制片与核型分析方法,具有取样方便、易于获得更多的分裂相等特点,且不会影响火龙果植株本身的生长发育状况。同时也可以获得更高的工作效率,减少工作人员的工作量。
[0055]
实施例2选取
‘
白肉’和
‘
金都一号’作为本实验实例的实验材料,具体操作如下:步骤1:取材、预处理选取健康、幼嫩的火龙果茎尖,并将其解剖得到火龙果植株中心茎尖。
[0056]
步骤2:浓缩将解剖得到的火龙果茎尖放入0.2%秋水仙素与0.002m的8-羟基喹啉混合液中,常温下放置2h。
[0057]
步骤3:前低渗浓缩后的茎尖用0.075m的kcl在常温下浸泡120min。
[0058]
步骤4:前固定将茎尖放入卡诺氏固定液(无水乙醇:冰醋酸=3:1)中,放置4℃冷藏固定4h以上。
[0059]
步骤5:解离将洗去卡诺氏固定液后的茎尖放入1m的hcl中,常温下解离90min。
[0060]
步骤6:酶解将解离后的茎尖放入2.5%纤维素酶和2.5%果胶酶的混合液中,在常温下处理1h。
[0061]
步骤7:后低渗将经过酶解的茎尖清洗放入双蒸馏水中低渗30min。
[0062]
步骤8:后固定将后低渗的茎尖放入卡诺氏固定液中,在4℃下冷藏固定30min,如不能及时制片使用,可将茎尖漂洗之后放入75%的酒精中,4℃保存。
[0063]
步骤9:染色、制片将茎尖置于载玻片上,轻轻切取1-2mm,滴加10%改良苯酚品红染色液,盖上盖玻片,染色40min,染色结束后用蒸馏水洗去多余染料,并用滤纸吸去多余液体;压片过程中使用带有橡皮的铅笔轻轻敲击盖玻片,使得茎尖组织和细胞可以均匀的分散在载玻片上。
[0064]
步骤10:镜检使用光学显微镜进行观察,先用低倍镜进行观察,找到合适的视野及分裂相后转到高倍镜进行拍照,如图7、8所示,为100倍油镜下拍摄所得,根据图片对染色体进行计数。
[0065]
综上所述,本发明的技术方案可以充分有效地实现上述发明目的,且本发明涉及的顺序和步骤及功能原理均在实施例中得到充分的验证,能达到预期的功效和目的。
[0066]
本发明有益效果如下:取材为幼嫩的火龙果茎尖,可以直接取材,取材容易,不受生长时期限制,相比根尖取材,对植株无破坏性,也不用培育种子发芽,方便快捷。
[0067]
浓缩使用秋水仙素和8-羟基喹啉的混合液可得到更多的分裂相。
[0068]
解离使用酸解法,解离时间短,效果好。
[0069]
本实验中,茎尖用纤维素酶和果胶酶的混合液进行处理,可有效去除火龙果茎尖中过多的果胶,使镜检更加清晰。
[0070]
后低渗有助于染色体的分散,但时间过长在制片时容易造成细胞破碎。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
