一种太子参均一多糖的hplc-fld检测方法
技术领域
1.本发明属于多糖荧光检测技术领域,具体涉及一种太子参均一多糖的hplc-fld检测方法。
背景技术:
2.多糖是构成生命科学的三大物质之一,广泛存在于中药之中。多糖具有免疫调节、抗肿瘤、降血糖、降血脂、抗氧化、抗衰老、抗病毒等多种生物学活性,药理研究被广泛证实。
3.由于多糖缺乏生色团(uv条件下吸收很弱)所致的检测困难,使得糖类分子在生物化学领域研究一直无法突破,多糖在体内以何种分子形态吸收、转运、传递等机制一直不甚清楚。
4.多糖的检测通常用质谱或是还原端进行荧光标记后用荧光检测器进行检测,凡是具有半羧醛羟基的糖链都可以通过还原胺化反应来实现荧光衍生化。常用的荧光衍生化试剂2-氨基联苯胺(2-ab),适用性强,应用广泛,标记试剂盒已经商品化。
技术实现要素:
5.本发明的目的在于提供一种太子参均一多糖的hplc-fld检测方法,用2-氨基联苯胺对太子参均一多糖进行荧光标记,建立高效液相色谱-荧光检测器(hplc-fld)检测方法,应用于生物样本细胞培养液的测定,研究其在caco-2细胞的吸收转运特征。
6.为实现上述目的,本发明采用如下技术方案:一种太子参均一多糖的hplc-fld检测方法,用2-氨基联苯胺对太子参均一多糖进行荧光标记,以葡聚糖为标准品,采用hplc-fld定量分析太子参均一多糖。
7.上述的检测方法在生物样本细胞培养液中的应用。
8.本发明的有益效果在于:用2-氨基联苯胺对太子参均一多糖进行荧光标记,建立高效液相色谱-荧光检测器(hplc-fld)检测方法,应用于生物样本细胞培养液的测定,研究其在caco-2细胞的吸收转运特征。方法简单且准确,应用前景广阔。
附图说明
9.图1为多糖2-ab的薄层色谱鉴别。左图t-1为太子参均一多糖,t-2为葡聚糖对照品,t-3和t-4为硼氢化钠和空白溶剂;中图显示2-ab标记后的葡聚糖t-500、t-70、t-40和t-10对照品荧光斑点;右图矩形显示2-ab标记后的均一多糖的荧光斑点,在每块tcl板中,最上面的斑点均为2-ab荧光斑点。
10.图2为2-ab衍生化多糖的化学结构。2-ab葡聚糖标准品(a),2-ab太子参均一多糖(b)。
11.图3为岀峰时间与logm的线性关系图。
12.图4为2-ab荧光标记的葡聚糖标准品和多糖样品的hplc色谱图。
具体实施方式
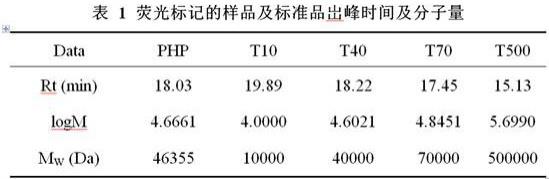
13.为了使本发明所述的内容更加便于理解,下面结合具体实施方式对本发明所述的技术方案做进一步的说明,但是本发明不仅限于此。
14.一、太子参均一多糖(php)2-ab荧光标记1. 2-ab-phps制备取dmso 350μl溶解350mg tbaf,加入120μl ac。混匀后加入5mg 0.5m多糖,涡旋30min,65℃溶解1h,直至澄清;加入20mg 2-ab,混溶;加入10mg氰基硼氢化钠混匀,在65℃下孵育4h。薄层色谱图见图1,化学结构见图2a。
15.2. 2-ab-葡聚糖制备取dmso 350μl,加入150μl ac混合。用混合液溶解25mg 2-ab,加入30mg氰基硼氢化钠,混匀,加入5mg葡聚糖,65℃孵育4h;标记多糖的处理:反应结束后,加入3.5ml无水乙醇淬灭,终止反应;3000r/min,离心10min,移除上清液,加入1ml蒸馏水,复溶多糖。重复以上步骤三次,直到上清液中检测不到2-ab;反应产物冻干后,待检测。薄层色谱图见图1,化学结构见图2b。
16.二、2-ab标记荧光多糖分子量测定1. 色谱条件岛津lc、ultrahydrogeltm1000凝胶柱、岛津rf-10axl检测器;流动相为0.1mol/lnano3水溶液;柱温为35℃;流速为0.5ml/min;进样量20μl。
17.分子量测定2-ab-phps配制成为240μg/ml溶液;2-ab-t-10配制成为12μg/ml溶液;2-ab-t-40配制成120μg/ml溶液、2-ab-t-70、2-ab-t-500配制成为240μg/ml溶液,进行排阻色谱分析。
18.荧光标记的均一样品及标准品岀峰时间及分子量、岀峰时间与logm的线性关系图,分别见表1和图3。根据公式logm=a+brt,荧光凝胶色谱法测定的两批2-ab标记的太子参均一多糖平均分子量为46355。
19.三、hplc-fld的2-ab-多糖分析制备240μg/ml的多糖-2-ab溶液。同时制备t40-2-ab浓度为240μg/ml对照品溶液。由于t40分子量与php相似,灵敏性较高,因此选择它作为标准。建立了hplc-fld法定量测定多糖-2-ab。流动相(硝酸钠)、t40溶液在紫外光诱导下不能发出荧光。php-2-ab、2-ab色谱图中分别发现了荧光特征峰,其保留时间为13.5min和94.0min。以t40-2-ab为对照,对php0
ꢀ‑
2-ab进行定量分析,php
ꢀ‑
2-ab的检出限为8.84μg/ml,线性范围29.45
–
683.28μg/ml,见图4。
20.四、太子参均一多糖在caco-2细胞模型转运吸收的研究细胞接种将消化好的单细胞悬液,对细胞进行计数,将细胞浓度为2
×
105个/ml的细胞液接种在transwell聚碳酯膜24孔板的ap侧,每孔加入0.5ml培养基至聚碳酯膜的ap侧,每孔加入1ml培养基至聚碳酯膜bl侧,直至第21天。
21.样品用hbss溶液定容至浓度为100、200、400μg/ml。将teer值在500ω
·
cm2左右的细胞孔培养液弃去,将预热好的hbss溶液加入细胞孔中清洗,重复2次,平衡30min。弃去hbss溶液,加入样品溶液,样品浓度分别为0、100、200、400μg/ml,每个浓度复孔3个。向供给侧即ap侧加入0.5ml的样品溶液。向接收侧即bl侧加入1ml的空白hbss溶液,以此检测药物由绒毛面(ap)吸收转运至基底面(bl)的转运量。向供给侧即bl侧加入1ml的样品溶液,向接收侧即ap侧加入0.5ml的空白hbss溶液,以此检测药物由基底面(bl)吸收转运至绒毛面(ap)的转运量。分别于30、60、120min从接收测取出待测溶液100μl,同时向接收测补入100μl的预热好的hbss溶液。待测溶液于1000rpm离心5min,样品-80℃保存用于hplc-fld检测。
22.在相同的液相条件下,荧光多糖的浓度比与液相检测峰面积的比是一致的,在加入荧光多糖的一侧检测时,此时的峰面积就代表加入荧光多糖的浓度,在没加荧光多糖的一侧检测时,此时荧光强度为零,在30、60、120min后检测bl面的峰强就可以得出在某个时间段多糖透过细胞的数量,就可以得出转运量,以及细胞转运的规律。结果见表2。
23.由表2可以看出,php的双向转运,p
app
值ap
→
bl大于bl
→
ap,表明php的转运方式均为被动转运。papp值大于1
×
106,说明多糖对细胞的渗透性和吸收能力较强。
24.本发明所建立的检测方法,可用于细胞培养液中太子参均一多糖的测定。
25.以上所述仅为本发明的较佳实施例,凡依本发明申请专利范围所做的均等变化与修饰,皆应属本发明的涵盖范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。