br-pl-cooh。
10.进一步,以柠檬酸为水化介质采用改良乙醇注入法制备peg化空白脂质体pl和羧基端空白脂质体pl-cooh,包括:
11.按照hspc/ch比为2-4:1,mpeg
2000-dspe/dspe-peg
2000-cooh比为1:1.5-2.5混合,加入乙醇,在50-75摄氏度下水浴加热,挥干乙醇,加入预热至相同温度的柠檬酸-柠檬酸钠缓冲液,水浴搅拌得空白脂质体初品;
12.以超声波细胞粉碎机处理空白脂质体初品,并依次通过0.8μm、0.45μm、0.22μm微孔滤膜进行整粒,分别制得peg化空白脂质体pl和羧基端空白脂质体pl-cooh。
13.进一步,利用盐酸调解羧基端空白脂质体pl-cooh的ph值为7,取梯度的peg化空白脂质体pl,按照药脂比1:15-25加入盐酸小檗碱br溶液,得到br-pl和br-pl-cooh脂质体,包括:
14.将磷酸钠溶液与羧基端空白脂质体pl-cooh混悬液混合,并调节外水相ph为7;
15.取梯度空白脂质体pl,按药脂比1:15-25加入盐酸小檗碱br溶液,在45-60℃恒温孵育至少15min,冰水浴终止载药得br-pl和br-pl-cooh脂质体。
16.进一步,在br-pl-cooh脂质体中加入雷公藤甲素tp溶液进行载药时,载药温度为55摄氏度;载药时间为15min,药脂比为l:20。
17.进一步,还包括:将tp-br-pl-cooh过葡聚糖凝胶sephadex g-100微柱除去未包封的游离药物,在冰水浴条件下,向其中加入edc水溶液和nhs水溶液,磁力搅拌活化至少0.5h至室温后加入脑靶向配体lf,加入tea,反应至少4h后终止反应,得到脑靶向雷公藤甲素和小檗碱共载隐形化纳米脂质体tp-br-lf。
18.进一步,按照hspc/ch比为3:1,mpeg
2000-dspe/dspe-peg
2000-cooh比为1:2混合。
19.进一步,还包括:梯度空白脂质体pl的制备方法包括:
20.以(阴阳离子交换纤维柱除盐建立梯度,得最终磷脂浓度约为20mg/ml的具有(nh4)2so4跨膜离子梯度的空白脂质体pl混悬液。
21.进一步,采用y迷宫实验测定tp-br-lf对ad模型小鼠行为学能力影响的测定:
22.侧脑室注射aβ
1-42
建立ad小鼠模型;
23.将小鼠放入a臂末端,可自由出入a、b、c三个臂,记录小鼠5min内进入三个臂的总次数n及进臂顺序,以连续进入三个不同的臂为一次正确交替反应,记录正确交替反应次数ns,其中,迷宫实验装置由三个夹角为120
°
的支臂组成,分别为a、b、c三臂;
24.用自发交替反应率alternation behavior%反映小鼠空间工作记忆能力,则alternation behavior(%)=ns/(n-2)
×
100%。
25.进一步,还包括:
26.采用考马斯亮蓝法测定脑靶向雷公藤甲素和小檗碱共载隐形化纳米脂质体tp-br-lf中lf连接百分率。
27.进一步,采用考马斯亮蓝法测定脑靶向雷公藤甲素和小檗碱共载隐形化纳米脂质体tp-br-lf中lf连接百分率:包括:
28.tp-br-lf反应液2份,一份过葡聚糖凝胶sephadex g-100微柱除去未反应lf,另一份不过柱,加入考马斯亮蓝g250显色液,于紫外分光光度计595nm处测定吸光度a
after
和a
before
,根据公式计算lf接枝率:lf
grafed
=a
after
/a
before
×
100%。
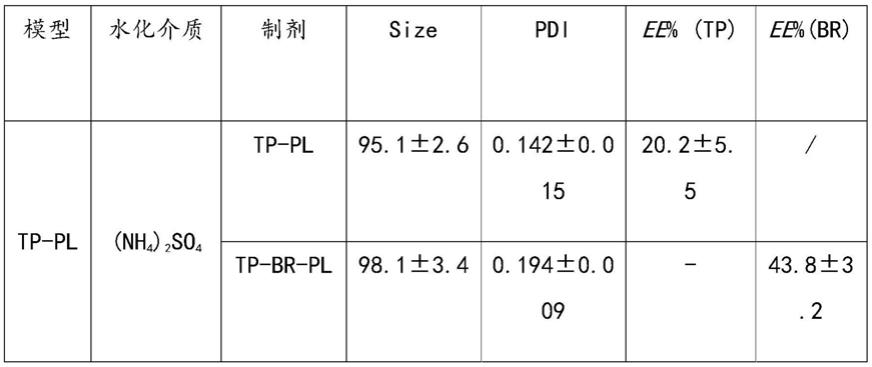
29.本发明另一目的在于提供小檗碱长循环纳米脂质体br-pl的制备方法,包括:选择以柠檬酸为水化介质的改良乙醇注入法和硫酸铵梯度法;hspc/ch比为3:1;乙醇10%(v/v);mpeg2000-dspe/dspe-peg2000-cooh比为1:2;65℃水浴搅拌20min;载药温度为55℃;载药时间为15min;药脂比为l:20。
30.进一步,所述小檗碱长循环纳米脂质体br-pl的制备方法采用柠檬酸为水化介质的改良乙醇注入法制备peg化空白脂质体pl和羧基端pl-cooh,磷酸钠调节外水相ph梯度法制备小檗碱peg化脂质体br-pl和br-pl-cooh具体包括:
31.以柠檬酸为水化介质,采用改良乙醇注入法制备空白脂质体。分别精确称量取处方量膜材于西林瓶内,hspc/ch比为3:1,mpeg2000-dspe/dspe-peg2000-cooh比为1:2,混以乙醇10%(v/v),65℃水浴加热,挥干大部分乙醇,加入预热至相同温度的柠檬酸溶液,水浴搅拌20min,得空白脂质体初品。以超声波细胞粉碎机处理后,依次通过微孔滤膜进行整粒,分别制定得peg化空白脂质体pl和羧基端pl-cooh。
32.进一步,br-pl和br-pl-cooh脂质体的制备
33.取一定量空白脂质体混悬液,加入一定量的磷酸钠溶液(500mm)调节外水相ph为7。取梯度脂质体pl适量,按药脂比1:20(w/w)加入6.0mg/ml的盐酸小檗碱溶液,55℃恒温孵育15min,冰水浴终止载药,即得br-pl和br-pl-cooh脂质体。
34.本发明另一目的在于确定tp-br-pl的制备方法,具体包括:分别采用tp脂质体载br和br脂质体载tp的方法尝试制备tp-br-pl纳米脂质体,以脂质体中tp和br的包封率为衡量指标,确实共载脂质体制备方法。
35.采用(nh4)2so4或edtanh4梯度法,利用tp-pl为模型进行共载药尝试。
36.采用乙醇注入法制备雷公藤甲素隐形化脂质体tp-pl。精密称取处方量膜材于10ml西林瓶中,加入tp乙醇溶液,于45℃条件下溶解膜材,待膜材完全溶解后挥去大部分乙醇,加入预热至相同温度的(nh4)2so4溶液。水化孵育20min后,探头超声后过微孔滤膜整粒,即得tp-pl。tp脂质体采用阴阳离子限位柱除盐建立梯度。阴阳混合离子交换纤维柱顶端[阴:阳=2:1(v/v)],加入0.1ml重蒸水,停留10min,2000r/min离心4min,重复操作3次,合并洗脱液,混匀,得具有(nh4)2so4跨膜离子梯度的脂质体混悬液。
[0037]
tp脂质体载br:取具有(nh4)2so4跨膜离子梯度的tp脂质体混悬液适量,按药脂比1:10(w/w)加入6.0mg/ml的br溶液,50℃恒温孵育10min,冰水浴终止载药,即得共载脂质体tp-br-pl。
[0038]
以edtanh4为水化介质制备脂质体,阴阳离子纤维除盐建立梯度,药脂比1:10载药br,操作方法同上。
[0039]
进一步,采用(nh4)2so4或edtanh4梯度法利用br-pl为模型进行共载药尝试
[0040]
空白脂质体的制备:以(nh4)2so4为水化介质,采用改良乙醇注入法制备空白脂质体。分别精确称量取处方量膜材于西林瓶内,hspc/ch比为3:1,mpeg2000-dspe/dspe-peg2000-cooh比为1:2,混以乙醇10%(v/v),65℃水浴加热,挥干大部分乙醇,加入预热至相同温度的(nh4)2so4溶液,水浴搅拌20min,得空白脂质体初品。以超声处理后过微孔滤膜进行整粒,得peg化空白脂质体pl和pl-cooh。
[0041]
除盐建立梯度载br:空白脂质体混悬液0.2ml,阴阳离子纤维除盐建立梯度,得最终磷脂浓度约为20mg/ml的具有(nh4)2so4跨膜离子梯度的脂质体混悬液。取梯度脂质体pl
或和pl-cooh适量,按药脂比1:10(w/w)加入6.0mg/ml的盐酸小檗碱溶液,50℃恒温孵育10min,冰水浴终止载药,即得br-pl和br-pl-cooh脂质体。
[0042]
br脂质体载tp:取具有(nh4)2so4跨膜离子梯度的br脂质体混悬液适量,按药脂比1:20(w/w)加入2.0mg/ml的tp溶液,机械搅拌,50℃恒温孵育30min,冰水浴终止载药,即得共载脂质体。
[0043]
以edtanh4为水化介质制备脂质体,阴阳离子纤维除盐建立梯度,药脂比1:20载药tp,操作方法同上。
[0044]
比较制备tp-br-pl共载脂质体的粒径和包封率,确定tp-br-pl的制备方法:以br-pl为模型,药脂比1:10载药br,tp在包载完br之后利用机械搅拌进行被动包封。
[0045]
本发明另一目的在于优化tp-br-pl的制备工艺,采用先主动载药br再被动载药tp进行tp-br-pl共载脂质体的制备,以脂质体的粒径分布和包封率为考察指标,以br-pl脂质体制备工艺优化条件为基础,对共载脂质体制备进行单因素考察。保持其他条件不变,考察不同梯度建立方式和水化介质、tp被动载药温度和时间对tp-br-pl共载脂质体的影响,具体包括:
[0046]
以优化条件制备br-pl纳米脂质体,药脂比l:20、载药温度55℃、载药时间为15min。以(nh4)2so4为水化介质,采用改良乙醇注入法制备空白脂质体。阴阳离子交换纤维柱[阴:阳=2:1(v/v)]除盐建立梯度,得最终磷脂浓度约为20mg/ml的具有(nh4)2so4跨膜离子梯度的脂质体混悬液。取梯度脂质体pl适量,按药脂比1:20(w/w)加入6.0mg/ml的盐酸小檗碱溶液,55℃恒温孵育15min,冰水浴终止载药,制得br-pl脂质体。取具有(nh4)2so4跨膜离子梯度的br脂质体混悬液适量,按药脂比1:10(w/w)加入2.0mg/ml的tp溶液,机械搅拌,50℃恒温孵育30min,冰水浴终止载药,即得共载脂质体tp-br-pl。
[0047]
以(nh4)2so4为水化介质制备脂质体,采用改良乙醇注入法制备空白脂质体。分别用透析除盐、葡聚糖凝胶g100除盐建立梯度,按照(1)中条件制备br-pl脂质体。药脂比1:20载药br后,加入2.0mg/ml的tp溶液,机械搅拌,50℃恒温孵育30min,冰水浴终止载药,制得共载脂质体tp-br-pl。
[0048]
以柠檬酸为水化介质制备脂质体,磷酸钠调节外水相ph建立梯度,按照(1)中条件制备br-pl脂质体。取一定量空白脂质体混悬液,加入一定量的磷酸钠溶液(500mm)调节外水相ph为7。药脂比1:20载药br后,加入2.0mg/ml的tp溶液,机械搅拌,50℃恒温孵育30min,冰水浴终止载药,制得共载脂质体tp-br-pl。
[0049]
根据以上实验确定的有效方法建立梯度,优化制备br-pl脂质体后,将tp被动载入,保持其他条件不变,分别考察不同孵育温度和时间对tp包封率的影响。制备工艺优化确定以柠檬酸为水化介质制备脂质体,磷酸钠调节外水相ph建立梯度,药脂比1:20载药br,tp在包载完br之后利用机械搅拌进行被动包封,载药温度为50℃,孵育时间为1h。
[0050]
本发明另一目的在于提供一种脑靶向雷公藤甲素和小檗碱共载隐形化纳米脂质体tp-br-lf的制备方法,包括:磁力搅拌活化0.5h,lf用量为6mg,孵育时间4.0h。
[0051]
进一步,所述脑靶向雷公藤甲素和小檗碱共载隐形化纳米脂质体tp-br-lf的制备方法,具体包括:
[0052]
精密移取前述优化制备的羧基端tp-br-pl-cooh脂质体置于10ml西林瓶中,冰水浴条件下,向其中加入edc水溶液和nhs水溶液,磁力搅拌活化0.5h,撤去冰水浴使反应体系
恢复至室温。分别向其中继续加入6mg lf,待lf充分溶解后,加入tea。反应4h后冰水浴终止反应,即得tp-br-lf。
[0053]
本发明另一目的在于提供一种脑靶向雷公藤甲素和小檗碱共载隐形化纳米脂质体tp-br-lf的lf连接百分率的测定方法,包括:根据脂质体和lf分子量的不同,采用基于分子筛原理的葡聚糖凝胶微柱将二者分离,lf的连接率采用考马斯亮蓝法进行测定。
[0054]
进一步,考马斯亮蓝法测定lf的连接率,具体包括:
[0055]
采用考马斯亮蓝法测定lf连接率。取100μl br-lf反应液2份,一份过葡聚糖凝胶sephadex g-100微柱除去未反应lf,另一份不过柱,具体操作为:0.1ml lf-tp-pl加入5ml酸性考马斯亮蓝g250显色液,混匀,于紫外-可见分光光度计595nm处测定吸光度aafter和abefore,根据公式计算lf接枝率:lfgrafed=aafter/abefore
×
100%。
[0056]
本发明另一目的在于提供一种脑靶向雷公藤甲素和小檗碱共载隐形化纳米脂质体tp-br-lf对ad模型小鼠行为学能力影响的测定,采用y迷宫实验测定,具体包括:
[0057]
侧脑室注射aβ1-42建立ad小鼠模型。y迷宫实验装置由三个夹角为120
°
的支臂组成,分别为a、b、c三臂。适应性训练结束后,将动物放入a臂末端,让其自由出入三个臂,记录小鼠5min内进入三个臂的总次数(n)及进臂顺序,以连续进入三个不同的臂为一次正确交替反应,记录正确交替反应次数(ns)。实验过程及时清理排泄物,消除遗留的气味。用自发交替反应率(alternation behavior%)反映小鼠空间工作记忆能力,按照如下公式计算:alternation behavior(%)=ns/(n-2)
×
100%。
[0058]
本发明另一目的在于提供一种脑靶向雷公藤甲素和小檗碱共载隐形化纳米脂质体tp-br-lf抗ad机制探讨,包括试剂盒检测、免疫组织化学法、酶联免疫吸附法(elisa)和蛋白免疫印迹检测法(western blot)法,测定tp-br-lf对炎性因子、炎性小体、乙酰胆碱酯酶活性、tau蛋白过度磷酸化和神经元细胞调亡的影响,具体包括:
[0059]
elisa法测定ad模型小鼠海马神经炎性因子tnf
ɑ
、il-1β和il-6含量。实验前30min将试剂盒从冰箱中取出,以平衡至室温(20-25℃)。根据试验孔(空白和标准品)数量,确定所需的板条数目。加样,酶标板加上封板膜,系列反应结束后,用酶标仪在450nm测定od值,绘制标曲并计算炎症因子tnf
ɑ
、il-1β和il-6含量。
[0060]
western blot法检测tp和br单载及共载脂质体对ad模型小鼠海马神经炎性小体的影响。将待测定的空白对照组、模型组及tp-lf、br-lf和tp-br-lf脂质体组小鼠海马的总蛋白提取后,按照bca蛋白浓度测定试剂盒说明书进行蛋白定量。用超敏发光液显示免疫反应得到的条带,移入凝胶成像分析仪曝光显影,采用image j软件进行灰度分析,采用spss 21.0软件进行统计分析。
[0061]
试剂盒检测乙酰胆碱酯酶活性,取出于-80℃冻存的小鼠海马组织,按1:10(10μl/mg组织)比例加入组织裂解液,于低温条件下利用超声波细胞粉碎机制备组织匀浆。组织匀浆于冰浴中静置1h后,12000
×
r/min,4℃离心20min,取上清液进行含量测定,按照试剂盒步骤进行操作。计算组织中ache活力。
[0062]
免疫组织化学法观察了小鼠海马组织磷酸化tau蛋白在thr231位点的表达情况。石蜡切片脱蜡水化;枸橼酸盐热抗原修复;过氧化氢阻断内源性过氧化物酶;bsa封闭,室温湿盒内封闭30min;甩去多余液体,不洗。分别加入一抗和二抗,37℃烘箱湿盒内孵育30min。pbs轻摇5min
×
3次。dab显色;苏木素复染;脱水封片;显微镜下观察目标区域,采用imagej
软件对其阳性表达区域进行分析。
[0063]
蛋白免疫印迹检测法(western blot)。从-80℃冰箱中取出备用的小鼠大脑海马组织,提取总蛋白后,按照bca蛋白浓度测定试剂盒说明书进行蛋白定量。依次加入一抗和二抗。pbs洗膜3次,每次10min。用超敏发光液显示免疫反应得到的条带,移入凝胶成像分析仪曝光显影,采用ipp图像分析软件进行分析,对样品中目标蛋白进行定量,并以β-actin为内参来确定组间目标蛋白表达的差异和变化。
[0064]
本发明实施例的有益效果是:根据ad的多个病理机制假说:炎症假说、tau蛋白假说、胆碱能假说和细胞凋亡假说,本发明从中药治疗ad的研究中发现,雷公藤甲素兼备抗炎免疫活性和神经元细胞凋亡的神经保护作用,小檗碱兼备抗tau蛋白磷酸化、抑制乙酰胆碱酯酶活性和神经元细胞凋亡的神经保护作用,有望成为多靶点治疗ad的潜在药物。本发明制备了多靶点抗ad的tp和br共载脑靶向纳米载体药物:以纳米脂质体为药物载体;用聚乙二醇(polyethylene glycol,peg)进行隐形化修饰,延长体内循环时间,降低肝、脾、肾等组织的药物分布;选用乳铁蛋白对peg化脂质体进行脑靶向修饰提高隐形化br纳米脂质体的脑靶向性;进一步,共载tp和br两种药物,在协同作用下,提高抗ad药效。
[0065]
本发明通过对制备工艺的优化,成功制备了粒径分布均匀、包封率较高、稳定性好的脑靶向雷公藤甲素和小檗碱共载隐形化纳米脂质体tp-br-lf,相关结果未见文献报道。
[0066]
本发明确定了雷公藤甲素和小檗碱共载隐形化纳米脂质体tp-br-pl的制备方法。分别采用tp脂质体载br和br脂质体载tp的方法尝试制备tp-br-pl纳米脂质体,考察不同载药顺序和水化介质对脂质体中tp和br的包封率的影响,确定以先主动载药br再被动载药tp进行tp-br-pl共载脂质体的制备。
[0067]
本发明优化了雷公藤甲素和小檗碱共载隐形化纳米脂质体tp-br-pl的制备工艺:采用先主动载药br再被动载药tp进行tp-br-pl共载脂质体的制备,以脂质体的粒径分布和包封率为考察指标,以br-pl脂质体制备工艺优化条件为基础,对共载脂质体制备进行单因素考察。保持其他条件不变,考察不同梯度建立方式和水化介质、tp被动载药时间对tp-br-pl共载脂质体包封率的影响。制备方法的筛选中,制备脂质体的水化介质选择柠檬酸,磷酸钠溶液调节外水相ph值建立梯度;br-pl纳米脂质体选择主动载药法;脂质体制备最佳制备条件:载药温度为55℃、载药时间为15min、药脂比为l:20;tp被动载药选择机械搅拌法,载药温度为50℃,孵育时间为1h。
[0068]
本发明优化了具有脑靶向功能的雷公藤甲素和小檗碱共载隐形化纳米脂质体tp-br-lf的制备工艺:将tp-br-pl-cooh过葡聚糖凝胶sephadex g-100微柱除去未包封的游离药物;冰水浴条件下,加入edc水溶液和nhs水溶液;磁力搅拌活化时间为0.5h;mpeg
2000-dspe/dspe-peg
2000-cooh比为1:2,lf用量为6mg。
[0069]
按照优化的制备条件,制备的雷公藤甲素和小檗碱共载普通脂质体tp-br-cl、peg化脂质体tp-br-pl和乳铁蛋白修饰的peg化脂质体tp-br-lf平均粒径分别为112.0
±
3.7、109.5
±
3.4和120.1
±
4.3nm;pi分别为0.212
±
0.006、0.225
±
0.008和0.198
±
0.007;tp-br-cl中tp包封率为38.2
±
2.2%、br包封率94.7
±
5.1%,tp-br-pl中tp包封率为37.6
±
3.9%、br包封率95.2
±
4.2%,tp-br-lf中tp包封率为35.8
±
2.4%、br包封率93.2
±
3.0%,lf的接枝率为62.5
±
3.1%。
[0070]
本发明采用y迷宫实验观察tp-br-lf脂质体对ad小鼠行为学能力的影响;通过评
价tp-br-lf对ad模型小鼠海马组织抗炎因子、炎性小体、ache活性、tau蛋白磷酸化、凋亡蛋白bcl-2和bax表达的影响,探讨br-lf抗ad机制。证明了tp-br-lf可能通过抑制炎性因子和炎性小体表达、ache活性、拮抗tau蛋白过度磷酸化和抑制细胞凋亡,改善ad模型小鼠行为学能力,tp和br共载脂质体抗ad性能显著由于单子脂质体,有望成为多靶点抗ad的理想药物。为ad治疗提供新药物新方法、开辟新思路,具有重要的研究价值和广阔的应用前景。
附图说明
[0071]
为了更清楚地说明本发明实施例中的技术方案,下面将对实施例描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
[0072]
图1是本发明实施例提供的不同制备方法对tp-br-pl共载脂质体包封率的影响统计图。
[0073]
图2是本发明实施例提供的不同载药时间对tp-br-pl共载脂质体包封率的影响统计图。
[0074]
图3是本发明实施例提供的共载脂质体透射电镜图片。
[0075]
图4是本发明实施例提供的tp和br单载及共载脂质体对自发交替反应率的影响统计图。
[0076]
图5(a)和图5(b)是本发明实施例提供的tp和br单载及共载脂质体对新物体的优先指数的影响统计图。
[0077]
图6(a)、图6(b)和图6(c)分别是本发明实施例提供的tp和br单载及共载脂质体对ad模型小鼠海马神经炎性因子tnf
ɑ
、il-1β和il-6含量的影响统计图。
[0078]
图7(a)、图7(b)和图7(c)分别是本发明实施例提供的tp和br单载及共载脂质体对ad模型小鼠海马神经炎性小体的影响统计图。
[0079]
图8(a)和图8(b)分别是是本发明实施例提供的tp和br单载及共载脂质体对ad模型小鼠胶质细胞异常活化的影响统计图。
[0080]
图9(a)和图9(b)分别是本发明实施例提供的tp和br单载及共载脂质体对ad模型小鼠胶质细胞异常活化的影响统计图。
[0081]
图10是本发明实施例提供的tp和br单载及共载脂质体对ad模型小鼠大脑皮层ache活性的影响统计图。
[0082]
图11(a)和图11(b)分别是本发明实施例提供的tp和br单载及共载脂质体对ad模型小鼠大脑皮层thr231位点ca1区tau蛋白磷酸化水平的影响统计图。
[0083]
图12(a)和图12(b)分别是本发明实施例提供的tp和br单载及共载脂质体对ad模型小鼠大脑皮层thr231位点ca3区tau蛋白磷酸化水平的影响统计图。
[0084]
图13(a)、图13(b)和图13(c)分别是本发明实施例提供的tp和br单载及共载脂质体对ad模型小鼠海马组织细胞凋亡蛋白bax、bcl-2蛋白表达的影响统计图。
具体实施方式
[0085]
为了使本技术领域的人员更好地理解本发明方案,下面将结合本发明实施例中的
pl-cooh。
[0098]
步骤四、将tp-br-pl-cooh过葡聚糖凝胶sephadex g-100微柱除去未包封的游离药物,然后精密移取1ml置于10ml西林瓶中,冰水浴条件下,向其中加入1ml edc水溶液(8mg/ml,40μmol)和1ml nhs水溶液(2.4mg/ml,20μmol),磁力搅拌活化0.5h,撤去冰水浴使反应体系恢复至室温,向其中继续加入6mglf,待lf充分溶解后,加入1.4μl(0.4μmol)tea。反应4h后冰水浴终止反应,即得tp-br-lf。
[0099]
本发明实施例提供一种脑靶向雷公藤甲素和小檗碱共载隐形化纳米脂质体tp-br-lf的lf连接百分率的测定方法,包括:根据脂质体和lf分子量的不同,采用基于分子筛原理的葡聚糖凝胶微柱将二者分离,lf的连接率采用考马斯亮蓝法进行测定。
[0100]
采用考马斯亮蓝法测定lf连接率。取100μl br-lf反应液2份,一份过葡聚糖凝胶sephadex g-100微柱除去未反应lf,另一份不过柱,具体操作为:0.1ml lf-tp-pl加入5ml酸性考马斯亮蓝g250显色液,混匀,于紫外-可见分光光度计595nm处测定吸光度a
after
和a
before
,根据公式计算lf接枝率:lf
grafed
=a
after
/a
before
×
100%。
[0101]
本发明实施例提供一种脑靶向雷公藤甲素和小檗碱共载隐形化纳米脂质体tp-br-lf对ad模型小鼠行为学能力影响的测定,采用y迷宫实验,具体包括:
[0102]
y迷宫实验装置由三个夹角为120
°
的支臂组成,分别为a、b、c三臂。适应性训练结束后,将动物放入a臂末端,让其自由出入三个臂,记录小鼠5min内进入三个臂的总次数(n)及进臂顺序,以连续进入三个不同的臂为一次正确交替反应,记录正确交替反应次数(ns)。实验过程及时清理排泄物,消除遗留的气味。用自发交替反应率(alternation behavior%)反映小鼠空间工作记忆能力,按照如下公式计算:alternation behavior(%)=ns/(n-2)
×
100%。
[0103]
本发明实施例提供一种脑靶向雷公藤甲素和小檗碱共载隐形化纳米脂质体tp-br-lf抗ad分子机制探讨,包括试剂盒检测、免疫组织化学法、酶联免疫吸附法(elisa)和蛋白免疫印迹检测法(western blot)法,测定tp-br-lf对炎性因子、炎性小体、乙酰胆碱酯酶活性、tau蛋白过度磷酸化和神经元细胞调亡的影响,具体包括:
[0104]
elisa法测定ad模型小鼠海马神经炎性因子tnf
ɑ
、il-1β和il-6含量。实验前30min将试剂盒从冰箱中取出,以平衡至室温(20-25℃)。根据试验孔(空白和标准品)数量,确定所需的板条数目。加样,酶标板加上封板膜,系列反应结束后,用酶标仪在450nm测定od值,绘制标曲并计算炎症因子tnf
ɑ
、il-1β和il-6含量。
[0105]
western blot法检测tp和br单载及共载脂质体对ad模型小鼠海马神经炎性小体的影响。将待测定的空白对照组、模型组及tp-lf、br-lf和tp-br-lf脂质体组小鼠海马的总蛋白提取后,按照bca蛋白浓度测定试剂盒说明书进行蛋白定量。用超敏发光液显示免疫反应得到的条带,移入凝胶成像分析仪曝光显影,采用image j软件进行灰度分析,采用spss 21.0软件进行统计分析。
[0106]
试剂盒检测乙酰胆碱酯酶活性,取出于-80℃冻存的小鼠海马组织,按1:10(10μl/mg组织)比例加入组织裂解液,于低温条件下利用超声波细胞粉碎机制备组织匀浆。组织匀浆于冰浴中静置1h后,12000
×
r/min,4℃离心20min,取上清液进行含量测定,按照试剂盒步骤进行操作。计算组织中ache活力。
[0107]
免疫组织化学法观察了小鼠海马组织磷酸化tau蛋白在thr231位点的表达情况。
石蜡切片脱蜡水化;枸橼酸盐热抗原修复;过氧化氢阻断内源性过氧化物酶;bsa封闭,室温湿盒内封闭30min;甩去多余液体,不洗。分别加入一抗和二抗,37℃烘箱湿盒内孵育30min。pbs轻摇5min
×
3次。dab显色;苏木素复染;脱水封片;显微镜下观察目标区域,采用imagej软件对其阳性表达区域进行分析。
[0108]
蛋白免疫印迹检测法(western blot)。从-80℃冰箱中取出备用的小鼠大脑海马组织,提取总蛋白后,按照bca蛋白浓度测定试剂盒说明书进行蛋白定量。依次加入一抗和二抗。pbs洗膜3次,每次10min。用超敏发光液显示免疫反应得到的条带,移入凝胶成像分析仪曝光显影,采用ipp图像分析软件进行分析,对样品中目标蛋白进行定量,并以β-actin为内参来确定组间目标蛋白表达的差异和变化。下面结合附图及具体实施例对本发明的应用原理作进一步描述。
[0109]
实施例1
[0110]
材料与仪器:雷公藤甲素(tp,纯度>98%,pi&pi生物技术有限公司);盐酸小檗碱(含量>98%,上海同田生物技术有限公司);氢化大豆磷脂(hspc,德国lucas meyer公司);胆固醇(ch,南京新百药业有限公司);聚乙二醇单甲醚2000-二硬脂酰磷脂酰乙醇胺(mpeg2000-dspe,美国genzyme公司);二硬脂酰磷脂酰乙醇胺-聚乙二醇2000-羧基偶联物(dspe-peg2000-cooh,艾伟拓医药科技有限公司);乳铁蛋白(lf,日本和光纯药有限公司);甲醇(色谱纯,山东禹王实业有限公司化工分公司);1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(edc
·
hcl,美国sigma公司);n-羟基琥珀酰亚胺(nhs,美国sigma公司);三乙胺(tea,天津市博迪化工有限公司);磷酸(分析纯,天津市大茂化学试剂厂);硫酸铵((nh4)2so4,分析纯,西陇化工股份有限公司);edta(分析纯,天津市大茂化学试剂厂);无水乙醇(药用,安徽安特生物化学有限公司);重蒸水(娃哈哈集团有限公司);考马斯亮蓝g250(如吉生物科技有限公司);灭菌注射用水(北京双鹤医药技术有限公司)。
[0111]
agilent 1260infinity高效液相色谱仪(美国agilent公司);uv5100型紫外-可见分光光度计(安徽皖仪科技股份有限公司);df-101s集热式恒温加热磁力搅拌器(巩义市英峪予华仪器厂);anke tdl80-2b离心机(上海安亭科学仪器厂);bs124s电子分析天平(德国sartorius公司);jy92-ii超声波细胞粉碎机(宁波科技生物科技有限公司);nicomp-380粒度zeta电位测定仪(美国particle sizing systems公司);732型阳离子交换纤维(国药集团化学试剂有限公司);717型阴离子交换纤维(国药集团化学试剂有限公司);聚偏乙烯微孔滤膜(上海摩速科学器材有限公司);超滤装置(amicon,美国millipore公司);超滤膜(mw:10、20kda,pes,美国sepro公司)。
[0112]
1.1.tp-br-pl纳米脂质体的制备工艺研究
[0113]
1.1.1tp-br-pl纳米脂质体制备方法的确定
[0114]
方法:分别采用tp脂质体载br和br脂质体载tp的方法尝试制备tp-br-pl纳米脂质体,以脂质体中tp和br的包封率为衡量指标,确定tp-br-pl的制备方法。
[0115]
(1)采用(nh4)2so4或edtanh4梯度法,利用tp-pl为模型进行共载药尝试
[0116]
tp-pl的制备:采用乙醇注入法制备tp-pl。按表6精密称取处方量膜材于10ml西林瓶中,加入400μl tp乙醇溶液,于45℃条件下溶解膜材,待膜材完全溶解后挥去大部分乙醇,加入4ml预热至相同温度的200mmol/l的(nh4)2so4溶液。水化孵育20min后,探头超声后过微孔滤膜整粒,即得tp-pl。
[0117]
tp脂质体除盐建立梯度:离心预处理,阴阳离子纤维柱装柱,2000r/min离心处理使阴离子:阳离子约为2:1。取tp脂质体混悬液0.2ml,上样于经离心预处理的3ml阴阳混合离子交换纤维柱顶端[阴:阳=2:1(v/v)],同时加入0.2ml重蒸水,停留10min 2000r/min离心4min,再于柱顶端加入0.1ml重蒸水2000r/min离心4min洗脱,合并洗脱液,混匀,得最终磷脂浓度约为20mg/ml的具有(nh4)2so4跨膜离子梯度的脂质体混悬液。
[0118]
tp脂质体载br:取具有(nh4)2so4跨膜离子梯度的tp脂质体混悬液适量,按药脂比1:10(w/w)加入6.0mg/ml的br溶液,50℃恒温孵育10min,冰水浴终止载药,即得共载脂质体。
[0119]
以edtanh4为水化介质制备脂质体,阴阳离子纤维除盐建立梯度,药脂比1:10载药br,操作方法同上。
[0120]
(2)采用(nh4)2so4或edtanh4梯度法利用br-pl为模型进行共载药尝试
[0121]
空白脂质体的制备:以(nh4)2so4为水化介质,采用改良乙醇注入法制备空白脂质体。分别精确称量取处方量膜材于西林瓶内,hspc/ch比为3:1,混以乙醇10%(v/v),65℃水浴加热,挥干大部分乙醇,加入预热至相同温度的200mm的(nh4)2so4溶液3ml,水浴搅拌20min,得空白脂质体初品。以超声处理后过微孔滤膜进行整粒,得空白peg化空白脂质体(pl)。
[0122]
除盐建立梯度载br:空白脂质体混悬液0.2ml,上样于经离心预处理的3ml阴阳混合离子交换纤维柱顶端[阴:阳=2:1(v/v)],同时加入0.2ml重蒸水,停留10min,2000r/min离心4min,再于柱顶端加入0.1ml重蒸水2000r/min离心4min洗脱,合并洗脱液,混匀,得最终磷脂浓度约为20mg/ml的具有(nh4)2so4跨膜离子梯度的脂质体混悬液。取梯度脂质体pl适量,按药脂比1:10(w/w)加入6.0mg/ml的盐酸小檗碱溶液,50℃恒温孵育10min,冰水浴终止载药,即得br-pl脂质体。
[0123]
br脂质体载tp:取具有(nh4)2so4跨膜离子梯度的br脂质体混悬液适量,按药脂比1:20(w/w)加入2.0mg/ml的tp溶液,机械搅拌,50℃恒温孵育30min,冰水浴终止载药,即得共载脂质体。以edtanh4为水化介质制备脂质体,阴阳离子纤维除盐建立梯度,药脂比1:20载药tp,操作方法同上。
[0124]
(3)比较制备tp-br-pl共载脂质体的粒径和包封率,确定制备方法。
[0125]
采用基于动态光散射原理的nicomp-380粒径测定脂质体的粒径。
[0126]
tp-br-pl共载脂质体中tp包封率:取脂质体置于5ml ep管中,用灭菌注射用水稀释混匀,上样于超滤装置中,压力0.5bar,弃去初滤液0.5ml,接收续滤液,采用hplc法在218nm处进样测定,记录峰面积,代入标准曲方程计算浓度,记为c1。另取脂质体置于2ml量瓶中,加入甲醇超声溶解并稀释至刻度,采用hplc法在218nm处进样测定,代入标准曲线方程计算浓度,记为ctot,按照公式计算包封率。
[0127]
tp-br-pl共载脂质体中br包封率:取两份脂质体,一份加入甲醇定容至10ml破坏脂质体;另一份上样于阳离子交换纤维柱顶端,2000r/min离心4min;继续加0.4ml重蒸水连续操作3次,合并洗脱液,甲醇定容至10ml破坏脂质体,摇匀。采用hplc法在212nm处进样测定,记录峰面积为atot和a1,代入标准曲线计算浓度,记为ctot和c1。根据公式计算包封率。
[0128]
结果:
[0129]
分别采用(nh4)2so4或edtanh4梯度法,以tp-pl或br-pl为模型进行共载药尝试,制
备的tp-br-pl共载脂质体粒径及tp、br包封率见表1。
[0130]
表1 tp-br-pl共载脂质体粒径及包封率
[0131][0132][0133]
以tp-pl为模型、(nh4)2so4梯度法制备的tp-br-pl共载脂质体,与单载药脂质体相比,测定tp包封率时液相中未出峰,br载药也出现包封率低的问题,说明此种方法不适用于共载脂质体制备。采用不同梯度进行方法改良,以edtanh4为水化介质制备tp-pl脂质体,阴阳离子纤维除盐建立梯度,药脂比1:10载药br,结果并没有改善br包封率,且tp依旧没有出峰。
[0134]
更改载药顺序,以br-pl为模型、(nh4)2so4或edtanh4为水化介质制备脂质体,阴阳
离子纤维除盐建立梯度,药脂比1:10载药br,tp在包载完br之后利用机械搅拌进行被动包封,制备的tp-br-pl共载脂质体br包封率变化不大,分别为32.9
±
4.4%或35.5
±
4.2%。但是提高了tp包封率,分别为23.4
±
3.8%或26.9
±
3.2%。两种水化介质的不同对tp和br包封率的影响不大。
[0135]
水化介质和载药顺序不同对制备的共载脂质体粒径影响不大,但是载药顺序变化改善了tp的包封率,本研究准备以先主动载药br再被动载药tp进行tp-br-pl共载脂质体的制备。
[0136]
1.1.2tp-br-pl纳米脂质体制备工艺优化
[0137]
方法:采用先主动载药br再被动载药tp进行tp-br-pl共载脂质体的制备,以脂质体的粒径分布和包封率为考察指标,以br-pl脂质体制备工艺优化条件为基础,对共载脂质体制备进行单因素考察。保持其他条件不变,考察不同梯度建立方式和水化介质、tp被动载药温度和时间对tp-br-pl共载脂质体的影响。
[0138]
(1)以1.2中优化条件制备br-pl纳米脂质体,药脂比l:20、载药温度55℃、载药时间为15min。以(nh4)2so4为水化介质,采用改良乙醇注入法制备空白脂质体。取空白脂质体混悬液上样于经离心预处理的3ml阴阳混合离子交换纤维柱顶端[阴:阳=2:1(v/v)],同时加入0.2ml重蒸水,停留10min,2000r/min离心4min,再于柱顶端加入0.1ml重蒸水2000r/min离心4min洗脱,合并洗脱液,混匀,得最终磷脂浓度约为20mg/ml的具有(nh4)2so4跨膜离子梯度的脂质体混悬液。取梯度脂质体pl适量,按药脂比1:20(w/w)加入6.0mg/ml的盐酸小檗碱溶液,55℃恒温孵育15min,冰水浴终止载药,制得br-pl脂质体。取具有(nh4)2so4跨膜离子梯度的br脂质体混悬液适量,按药脂比1:10(w/w)加入2.0mg/ml的tp溶液,机械搅拌,50℃恒温孵育30min,冰水浴终止载药,即得共载脂质体。
[0139]
(2)以(nh4)2so4为水化介质制备脂质体,采用改良乙醇注入法制备空白脂质体。分别用透析除盐、葡聚糖凝胶g100除盐建立梯度,按照(1)中条件制备br-pl脂质体。透析除盐:配置10%蔗糖溶液,透析介质和脂质体体积比大于1:200,使用25kda透析袋。透析时长为2h,每半小时更换一次透析介质。葡聚糖凝胶g100除盐:葡聚糖凝胶g100经活化预处理后,填柱体积约2ml;取空白脂质体混悬液上样于经离心预处理的g100微柱顶端,2000rpm离心4min,再于柱顶端加入重蒸水,2000rpm离心4min洗脱,重复操作3次,合并洗脱液混匀。药脂比1:20载药br后,加入2.0mg/ml的tp溶液,机械搅拌,50℃恒温孵育30min,冰水浴终止载药,制得共载脂质体。
[0140]
(3)以柠檬酸为水化介质制备脂质体,磷酸钠调节外水相ph建立梯度,按照(1)中条件制备br-pl脂质体。水化介质:精密称取4.20g柠檬酸,适量蒸馏水溶解,naoh溶液调节ph至4.0,转移至100ml量瓶,蒸馏水稀释至刻线,过0.22μm滤膜,即得ph 4.0、浓度为200mm的柠檬酸-柠檬酸钠缓冲液。外水相ph调节剂:精密称取4.75g磷酸钠于25.0ml量瓶,蒸馏水溶解并稀释至刻线,过0.22μm滤膜,即得500mm的磷酸钠溶液。取一定量空白脂质体混悬液,加入一定量的磷酸钠溶液(500mm)调节外水相ph为7。药脂比1:20载药br后,加入2.0mg/ml的tp溶液,机械搅拌,50℃恒温孵育30min,冰水浴终止载药,制得共载脂质体。
[0141]
(4)根据以上实验确定的有效方法建立梯度,优化制备br-pl脂质体后,将tp被动载入,保持其他条件不变,分别考察不同孵育温度和时间对tp包封率的影响。
[0142]
结果:
[0143]
采用优化条件制备br-pl纳米脂质体,以不同的梯度建立方式、tp被动载入孵育温度和时间,制备的tp-br-pl共载脂质体粒径及tp、br包封率见表12。
[0144]
不同制备方法对tp-br-pl共载脂质体包封率的影响见图1,可见降低药脂质比后,br包封率出现较大程度上升。采用主动载药法进行br的包封时,需要有足够的内外离子梯度,在梯度足够大的时候包封率就会上升。所以重点在于如何除尽外水相中离子,因此筛选了不同的梯度建立方式。相比之下,透析方式并没有提高br的包封率,葡聚糖凝胶g100除盐建立梯度和ph梯度法可以有效提高br的包封率。经过上述实验,确定了俩种有效的载药方法,一种为以(nh4)2so4为水化介质制备脂质体,葡聚糖凝胶g100除盐建立梯度,药脂比1:20载药br,tp在包载完br之后利用机械搅拌进行被动包封。另一种为以柠檬酸为水化介质制备脂质体,磷酸钠调节外水相ph建立梯度,药脂比1:20载药br,tp在包载完br之后利用机械搅拌进行被动包封。
[0145]
表2不同制备方法制得的tp-br-pl共载脂质体粒径及包封率
[0146]
[0147][0148]
在进行tp的包封时,因为tp为小分子,容易从脂质体内部穿出,如果先进行tp包封,将会导致tp包封率低,无法满足实验要求,所以将被动包封放在br包封以后,以提高包封效率。在相变温度之上,脂质膜的间隙比较大,通过机械搅拌,将tp被动载入。保持其他条件不变,考察不同孵育时间对tp包封率的影响,结果见图2。
[0149]
综上制备工艺优化实验,确定以柠檬酸为水化介质制备脂质体,磷酸钠溶液调节外水相ph建立梯度,药脂比1:20载药br,tp在包载完br之后利用机械搅拌进行被动包封,载药温度为50℃,孵育时间为1h。
[0150]
1.2.tp-br-lf纳米脂质体的制备
[0151]
方法:
[0152]
按照上述优化条件制备共载脂质体tp-br-cl、tp-br-pl和tp-br-pl-cooh。将tp-br-pl-cooh过葡聚糖凝胶sephadex g-100微柱除去未包封的游离药物,然后精密移取1ml置于10ml西林瓶中,冰水浴条件下,向其中加入edc水溶液和nhs水溶液,磁力搅拌活化0.5h,撤去冰水浴使反应体系恢复至室温。向其中继续加入适量的乳铁蛋白lf,待lf充分溶解后,加入1.4μl tea。反应4h后冰水浴终止反应,即得tp-br-lf。
[0153]
测定共载脂质体中br包封率:分别取优化制备的共载脂质体tp-br-cl、tp-br-pl和tp-br-lf各两份,一份加入甲醇破坏脂质体,采用紫外分光光度计在420nm下测定吸光度值记为atot。另一份上样于阳离子交换树脂柱顶端,2000rpm离心4min;继续加0.2ml重蒸水于阳离子交换树脂柱的顶端,2000rpm离心4min,连续操作3次,合并洗脱液,加入甲醇破坏脂质体,采用紫外分光光度计在420nm下测定吸光度值记为a1。按照公式:ee%=a1/atot
×
100%。
[0154]
测定共载脂质体中tp包封率:分别取优化制备的共载脂质体tp-br-cl、tp-br-pl和tp-br-lf各两份,一份上样于超滤装置中(超滤膜截留分子量为20kda),压力0.5bar,弃去初滤液0.5ml,取续滤液,采用hplc法在218nm处进样测定,记录峰面积为a1。另一份加入甲醇超声溶解并稀释至刻度,过0.22μm微孔滤膜后,采用hplc法在218nm处进样测定,记录峰面积为atot,带入标曲方程求得c1和ctot。按照公式计算tp包封率。
[0155]
采用考马斯亮蓝法测定tp-lf脂质体中lf连接率。取100μl tp-br-lf反应液2份,一份过葡聚糖凝胶sephadex g-100微柱除去未反应lf,另一份不过柱,将5ml酸性考马斯亮蓝g250显色液加入tp-br-lf中,混匀,于紫外-可见分光光度计595nm处测定吸光度aafter和abefore,根据公式计算lf接枝率:根据公式计算lf接枝率:lf
grafed
=a
after
/a
before
×
100%。
[0156]
采用基于动态光散射原理的nicomp-380粒度zeta电位测定仪测定脂质体的粒径,
透射电镜观察脂质体微观结构。
[0157]
结果:
[0158]
优化制备的共载脂质体tp-br-cl、tp-br-pl和tp-br-lf粒径、tp包封率、br包封率和lf连接率检测结果见表3,可见三种共载脂质体的粒径分别为112.0
±
3.7、109.5
±
3.4、120.1
±
4.3nm,粒径分布均匀。tp包封率接近40%,br包封率90%以上,tp-br-lf中lf的接枝率为62.5
±
3.1%,初步实现了tp和br的共载制备。
[0159]
表3不同共载脂质体粒径、包封率和lf连接率
[0160][0161]
透射电镜观察tp-br-cl、tp-br-pl和tp-br-lf的微观结构,结果见图3,可见三种脂质体均为具有明显的双分子层膜的圆形单室脂质体,分布较均匀,粒径与nicomp-380粒径仪测定的数据基本吻合。
[0162]
2隐形化脑靶向雷公藤甲素-小檗碱共载纳米脂质体(tp-br-lf)的抗ad性能研究
[0163]
材料与仪器:
[0164]
雷公藤甲素(tp,纯度>98%,pi&pi生物技术有限公司);盐酸小檗碱(含量>98%,上海同田生物技术有限公司);氢化大豆磷脂(hspc,德国lucas meyer公司);胆固醇(ch,南京新百药业有限公司);聚乙二醇单甲醚2000-二硬脂酰磷脂酰乙醇胺(mpeg2000-dspe,美国genzyme公司);二硬脂酰磷脂酰乙醇胺-聚乙二醇2000-羧基偶联物(dspe-peg2000-cooh,艾伟拓医药科技有限公司);乳铁蛋白(lf,日本和光纯药有限公司);1,1'-双十八烷基-3,3,3',3'-四甲基吲哚三碳菁碘(1,1
’‑
dioctadecyl-3,3,3’,3
’‑
tetramethyl-indotricarbocyanine iodide,dir,美国att bioquest公司);无水乙醇(分析纯,天津科密欧化学试剂开发中心);灭菌注射用水(北京双鹤医药技术有限公司);重蒸水(杭州娃哈哈集团有限公司);硫酸铵((nh4)2so4(分析纯,西陇化工股份有限公司);柠檬酸(c6h8o7·
h2o,天津大茂化学试剂厂);磷酸钠(na3po3,天津大茂化学试剂厂);edta(分析纯,天津市大茂化学试剂厂);氨水(天津富宇精细化工有限公司)。pbs缓冲液(上海尚宝生物科技有限公司);1,1'-二十八烷基-3,3,3',3'四甲基吲哚羰花青高氯酸盐(dii,大连美仑生物技术有限公司);aβ1-42(sigma-aldrich公司);dab显色试剂盒(北京中山金桥生物
科技有限公司);苏木精(北京九洲博林生物科技有限公司);中性树胶(上海标本模型厂);ripa裂解缓冲液(上海贝奥蒂姆生物技术有限公司);nlrp1抗体(proteintech中国公司);nlrp3抗体(万类生物科技有限公司);hrp标记山羊抗兔igg(h l)(万类生物科技有限公司);goat anti-mouse igg(h l)(thermo科技有限公司);goat anti-rb igg(h l)(美国invitrogen公司);tnf
ɑ
试剂盒(博士德生物);il-1β试剂盒(absin上海生物有限公司);il-6试剂盒(absin上海生物有限公司);bcl-2抗体(英国abcam公司);bax抗体(美国proteintech集团公司);tau-ser396抗体(英国abcam公司);tau抗体(美国invitrogen公司);β
‑‑
actin抗体(santacruz生物技术有限公司);caspase-3试剂盒(上海beyotime生物技术有限公司);caspase-9试剂盒(上海beyotime生物技术有限公司);乙酰胆碱酯酶试剂盒(南京建成生物工程研究所)。
[0165]
icr小鼠(23-25克,2个月,雄性,辽宁长生生物技术有限公司)自由饮用水和12小时循环光。所有涉及动物的程序均严格按照《中华人民共和国实验动物使用和护理法》以及沈阳药科大学实验动物研究所制定的指南进行。
[0166]
agilent 1260infinity高效液相色谱仪(美国agilent公司);uv5100型紫外-可见分光光度计(安徽皖仪科技股份有限公司);df-101s集热式恒温加热磁力搅拌器(巩义市英峪予华仪器厂);anke tdl80-2b离心机(上海安亭科学仪器厂);bs124s电子分析天平(德国sartorius公司);jy92-ii超声波细胞粉碎机(宁波科技生物科技有限公司);全波长多功能酶标仪(美国thermo scientific公司);小动物活体成像仪(美国bruker公司);bcn-1360b超净工作台(苏州净化有限公司);倒置显微镜(xds-1b,重庆光电仪器有限公司)。动物脑立体定位仪(sr-5n,日本narishige);生物组织包埋机(yd-6d,金华市益迪医疗设备有限公司)。
[0167]
实施例2
[0168]
tp-br-lf纳米脂质体对ad模型小鼠行为学能力的影响
[0169]
2.1.1y迷宫实验
[0170]
方法:
[0171]
y迷宫实验检测tp-br-lf纳米脂质体对ad模型小鼠行为学能力的影响。将小鼠分为5组,即空白对照组、模型组、tp-lf、br-lf和tp-br-lf组,每组9只,(n=9)。侧脑室注射aβ1-42致ad小鼠模型建立成功后,各组开始尾静脉注射给药,br浓度为10mg/kg,隔天1次,共7次。
[0172]
y迷宫实验步骤同2.3.1。实验过程及时清理排泄物,消除遗留的气味。用自发交替反应率(alternation behavior%)反映小鼠空间工作记忆能力,按照如下公式计算:alternation behavior(%)=ns/(n-2)
×
100%。
[0173]
结果:
[0174]
本研究采用y迷宫实验检测单载和共载脂质体对ad模型小鼠工作记忆能力的影响,结果显示,与空白对照组相比,侧脑室注射aβ1-42显著降低小鼠的自发交替反应率(p《0.01),证实aβ1-42诱导小鼠工作记忆和空间记忆能力损伤。与模型组相比,tp-lf、br-lf和tp-br-lf脂质体组自发交替反应率均有所提高,其中tp-lf(p《0.05)、br-lf组(p《0.01)和tp-br-lf组(p《0.01)差异显著。并且tp-br-lf组自发交替反应率显著高于tp-lf(p《0.05)组和br-lf(p《0.05)组。
[0175]
2.1.2.新物体辨别实验
[0176]
方法:
[0177]
新物体辨别实验时将两个相同物品(a1、a2)放置在距开放场边缘相等距离处,把经过适应阶段的小鼠放在距两物品相等距离的任意位置,并记录在5min内小鼠探索两个物品的时间,放小鼠回鼠笼。1小时后,将其中任一物品换成与之材质、颜色、形状都不相同的新物品b,再一次将小鼠放在装置内,并记录5min内探索这两个物体的时间(t
a1
、tb)。24小时后,把b换成与之完全不同的c物品,再一次将小鼠放入装置内,并记录5min内探索这两个物体所需时间(t
a1
,tc)。探索的判定标准是小鼠鼻子朝向物体并距物体少于1厘米,或者触及鼻子、舔物体、用前爪触碰物体。实验过程及时清理排泄物,消除遗留的气味并保持环境较安静,光线略暗。按照下列公式计算对新物体的优先指数(preferential index):
[0178][0179]
结果:
[0180]
新物体辨别实验结果见图5,可见各组小鼠对两个相同物体的辨别时间无显著差异,说明实验小鼠对两物体的位置不存在偏好。与空白对照组相比,模型组小鼠测试阶段1h及24h对新物体的优先指数显著降低(p《0.01)。组间相比,tp-lf组和br-lf组测试阶段1h及24h对新物体的优先指数无显著差异;tp-lf组(p《0.05)和br-lf组(p《0.01)显著高于模型组;tp-br-lf组显著高于tp-lf组(p《0.05)和br-lf组(p《0.05)。与y迷宫自发交替反应实验结果基本相符。
[0181]
综合tp和br单载及共载脂质体对ad细胞模型生长和ad小鼠模型行为学能力的影响结果可见,由于tp和br的协同作用,共载脂质体的药效要优于单载脂质体。将药物、生物共载于脂质体中组成脂质体共递送系统具有许多优势。首先,在脂质体表面可进行多种靶向修饰,使共载药脂质体携带的药物富集于病灶组织;其次,脂质体中药物的释放速度具有可控性,可使药物间的比例长时间维持在脂质体共递送系统中的比例,从而更好地发挥协同作用。ruttala等报道了转铁蛋白配体修饰的脂质体(tl-ddac),能够将dox和cddp释放到细胞质中,结果证明,因dox和cddp对dna的双重作用,共载dox与cddp的脂质体在所有制剂中表现出最佳治疗效果。cheng等制备了共载cddp和姜黄素的脂质体用于肝癌治疗,姜黄素可通过刺激活性氧水平升高和调控多种信号通路以增强肝癌对ddp的敏感性,当ddp和姜黄素的摩尔比为1:8时,两者的协同效应最为显著。chen等构建了叶酸修饰的ph响应性伊马替尼(im)和dox共载脂质体,im可结合atp结合盒家族蛋白的atp结合部位,导致其外排作用减弱,以此降低耐药性。qu等在peg化阳离子脂质体中共载多烯紫杉醇(dtx)和bcl-2sirna(lipo-dtx/sirna),证明了共载脂质体相比于单载脂质体对肿瘤细胞的毒性大幅增强。
[0182]
2.2.tp-br-lf纳米脂质体抗ad作用机制探讨
[0183]
2.2.1.tp-br-lf对ad模型小鼠抗炎免疫活性的影响
[0184]
方法:
[0185]
行为学实验结束后将所有小鼠分成两部分,一部分灌流取脑,4%多聚甲醛中于4℃冰箱中固定48小时后,不同浓度的酒精脱水,二甲苯透明,浸蜡,包埋待用。另一部分直接取脑迅速分离海马和皮层于ep管中,液氮速冻后,置于-80℃冰箱中保存。
[0186]
(1)酶联免疫吸附法(elisa)检测tp和br单载及共载脂质体对ad模型小鼠海马神
br-lf中都发挥了良好的抗ad性能,显著抑制ad模型小鼠海马组织ache活性,降低tau蛋白过度磷酸化表达。
[0207]
2.2.4.tp-br-lf对ad模型小鼠海马组织细胞凋亡的影响
[0208]
方法:
[0209]
小鼠海马区bax、bcl-2蛋白表达采用蛋白免疫印迹检测法。将待测定的空白对照组、模型组及lf修饰的不同单载共载脂质体组小鼠海马的总蛋白提取后,按照bca蛋白浓度测定试剂盒说明书进行蛋白定量。每组蛋白上样量为40μg,经sds-聚丙烯酰胺凝胶(sds-page)电泳分离后取出凝胶,随后进行蛋白质电转印,在转膜缓冲液中将蛋白转移至0.45μm的pvdf膜。取出膜,放入5%脱脂奶粉封闭液中,室温摇床轻摇2h。分别加一抗和二抗后,用超敏发光液显示免疫反应得到的条带,移入凝胶成像分析仪曝光显影,采用ipp图像分析软件进行分析,对样品中目标蛋白进行定量,并以β-actin为内参来确定组间目标蛋白表达的差异和变化。
[0210]
结果:
[0211]
western blot法检测tp和br单载及共载脂质体对ad模型小鼠海马区细胞凋亡蛋白bax、bcl-2蛋白表达的影响,结果见图13。与空白对照组比,模型组小鼠海马组织bcl-2蛋白表达明显减少,bax蛋白表达明显增加(p《0.01),提示aβ1-42诱导的神经毒性可促进细胞凋亡。与模型组比较,tp-lf、br-lf、tp-br-lf脂质体组小鼠海马组织bcl-2蛋白表达均有所增加,bax蛋白表达减少(p《0.05);与tp-lf和br-lf组相比,tp-br-lf提高bcl-2和降低bax蛋白表达更加显著(p《0.01)。
[0212]
小檗碱通过抑制起细胞凋亡执行者作用的caspase-3蛋白,增加抑制凋亡蛋白bcl-2和促凋亡蛋白bax的表达比例,发挥抗神经细胞凋亡作用。雷公藤甲素可以通过抑制星形胶质细胞活化,减少细胞凋亡,保护神经细胞。本实验中tp和br单载脂质体小鼠海马组织bcl-2蛋白表达增加,bax蛋白表达减少。这种抗凋亡作用在tp和br共载脂质体中由于二者的协同作用而更加显著。
[0213]
本研究所有实验结果均采用spss 21.0软件进行统计分析,采用独立样本one-way anova检验分析。实验数据用mean
±
sd表示,p《0.05表示统计学上有显著差异。
[0214]
以上所述仅是本发明的部分实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
