1.本发明涉及功能纳米材料及肿瘤治疗制剂领域,尤其涉及一种掺杂型金属硫化物及其制备和应用。
背景技术:
2.癌症是21世纪威胁人类健康的主要疾病之一。目前主流的治疗方法,包括手术、化疗、放疗,都存在不同程度的副作用,对转移灶的治疗也存在很大局限性,严重影响了患者的生活质量。
3.声动力疗法(sonodynamic therapy,sdt)是一种新型的高渗透性肿瘤治疗方法,其主要的杀伤机制是声敏剂在超声作用下产生的活性氧(ros)和超声辐照产生的空化效应。ros包括羟基自由基(
·
oh)、单线态氧(1o2)等,可引起细胞内线粒体膜电位降低、dna断裂、细胞骨架收缩、染色质浓缩等一系列生化反应,导致肿瘤细胞凋亡。
4.现有的声敏剂主要包括卟啉及其衍生物等有机声敏剂和以二氧化钛(tio2)为代表的无机声敏剂。然而,有机声敏剂不易溶于水,且具有一定的光毒性,而无机声敏剂由于声动力学效率低,并且长期在体内滞留,具有较大的潜在毒性。因此,开发一种安全、高效的肿瘤声敏制剂,是声动力治疗癌症过程中需要解决的关键问题。
技术实现要素:
5.为解决上述技术问题,本发明的目的是提供一种掺杂型金属硫化物及其制备和应用,本发明的掺杂型金属硫化物可用于制备声敏剂,其既可以对肿瘤具有良好杀伤作用,同时又具有良好的生物安全性及生物可降解性。
6.本发明的第一个目的是提供一种掺杂型金属硫化物的制备方法,包括以下步骤:
7.在保护气氛下,将掺杂金属源与被掺杂金属源在油相中于100~160℃下混合均匀,然后将得到的混合物与硫源反应,反应温度为240~320℃,反应完全后得到所述掺杂型金属硫化物;
8.其中,所述掺杂金属源为铁盐、锰盐和铜盐中的一种或几种;
9.所述被掺杂金属源为钒盐、钛盐和钼盐中的一种或几种。
10.优选地,掺杂金属源为铁盐,被掺杂金属源为钒盐,所制备的掺杂型金属硫化物为fe-vs2,vs2作为一种半导体材料,通过掺杂与其原子半径和电负性均相近的元素,可以降低其在外界能量激发下的带隙,进而提高其声动力学效应。本发明的fe-vs2的带隙约为2.33ev,而vs2的带隙约为2.48ev。
11.此外,掺杂元素fe不仅可以提高声动力学效应,同时还具有一些治疗效果,如参与芬顿反应,将肿瘤细胞中高浓度过氧化氢(h2o2)转化为羟基自由基,进而达到杀伤肿瘤细胞的作用。
12.进一步地,掺杂金属源中的金属与被掺杂金属源中的金属的摩尔比为1:(4~10)。
13.进一步地,铁盐选自三氯化铁、乙酰丙酮铁和乙酰丙酮亚铁中的一种或几种。优选
地,铁盐为三氯化铁。
14.进一步地,钒盐选自氯化钒(vcl4)和/或乙酰丙酮钒。优选地,钒盐为氯化钒。
15.进一步地,所述硫源选自硫单质和/或硫代乙酰胺。优选地,硫源为硫单质。
16.进一步地,硫源与被掺杂金属源中的金属的摩尔比为(2~5):1。
17.进一步地,所述油相包括油胺和十八烯。
18.进一步地,所述油胺和十八烯的的摩尔比为1:(0.5~1.5)。
19.进一步地,与硫源反应的反应温度为300~320℃,反应时间为0.5~2h。
20.进一步地,保护气氛为氮气等惰性气体氛围。
21.进一步地,反应完全后还包括向产物中加入乙醇,离心取沉淀并进行洗涤的步骤。
22.优选地,掺杂型金属硫化物的制备方法,包括以下步骤:
23.a)将掺杂金属源、油胺和十八烯混合均匀,加热至120~160℃;
24.b)保持温度在120~160℃,加入被掺杂金属源,反应得到初级反应物;
25.c)加热至240~320℃,加入硫源,反应后得到掺杂型金属硫化物。在以上温度下,硫源可直接与金属发生反应。
26.本发明的第二个目的是提供一种上述制备方法所制备的掺杂型金属硫化物,所述掺杂型金属硫化物的粒径为80~150纳米。
27.优选地,本发明的掺杂型金属硫化物为fe掺杂的vs2(fe-vs2)。
28.本发明的第三个目的是公开上述掺杂型金属硫化物在制备声敏剂中的应用。
29.进一步地,掺杂型金属硫化物连接有两亲性高分子,所述两亲性高分子的亲水链段的分子量为2kda-5kda。由于掺杂型金属硫化物表面为疏水性,在实际应用时,两亲性高分子的疏水端与金属硫化物表面的疏水端通过静电相互作用,亲水端包裹在两亲性高分子的疏水端与金属硫化物的外部。这样既可以提高掺杂型金属硫化物的水溶性,又可以提高其生物相容性。
30.进一步地,两亲性高分子的疏水链段为c
18-pmh。亲水端为聚乙二醇(peg)。
31.优选地,两亲性高分子为c
18-pmh-peg,其合成方法参考文献“wang,c.,cheng,l.,&liu,z..(2011).drug delivery with upconversion nanoparticles for multi-functional targeted cancer cell imaging and therapy.biomaterials,32(4),1110-1120”。
32.进一步地,声敏剂用于肿瘤的声动力治疗。
33.进一步地,声动力治疗的超声功率为2~10w/cm2,频率为10~50khz,作用时间为1~30min。实际应用中用超声探头作为触发器用于超声辐照的声源。
34.进一步地,肿瘤包括乳腺癌、结肠癌、膀胱癌等。
35.在外界能量激发下,如超声条件下,价带(vb)中的电子被激发到导带(cb)中,在价带上形成空穴。为了成为自由电子或空穴,束缚电子必须获得足够的能量从价带过渡到导带。这个能量的最小值是带隙。带隙越小,电子跃迁越容易。本发明的掺杂金属源和被掺杂金属源均为过渡金属元素。被掺杂金属的硫化物为半导体,通过与其原子半径和电负性均相近的元素,通过掺杂与其原子半径和电负性均相近的元素,可以降低其在外界能量激发下的带隙,进而提高其声动力学效应。
36.含本发明的掺杂型金属硫化物的声敏剂通过静脉注射并到达病灶部位后,通过超
声辐照,能够显著抑制肿瘤生长,这种掺杂型金属硫化物声敏剂在癌症的治疗方面展现了巨大的应用价值。
37.借由上述方案,本发明至少具有以下优点:
38.(1)本发明制备的掺杂型金属硫化物具有较低的带隙,具有良好的声动力学效应。
39.(2)本发明得到的掺杂型金属硫化物作为声敏剂时,对肿瘤具有良好杀伤作用。
40.(3)本发明得到的掺杂型金属硫化物作为声敏剂时,可生物代谢,具有良好的生物安全性。
41.上述说明仅是本发明技术方案的概述,为了能够更清楚了解本发明的技术手段,并可依照说明书的内容予以实施,以下以本发明的较佳实施例并配合详细附图说明如后。
附图说明
42.图1是实施例一中合成fe掺杂的vs2声敏剂透射电子显微镜图像;
43.图2是实施例一中合成fe掺杂的vs2声敏剂x-射线衍射图谱;
44.图3是实施例一中合成fe掺杂的vs2声敏剂的元素tem-mapping表征结果;
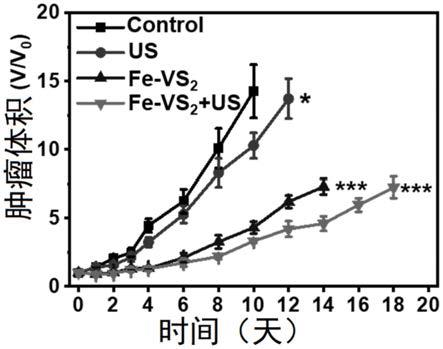
45.图4是实施例二中用dpbf探针检测fe掺杂的vs2声敏剂在超声辐照下的ros释放;
46.图5是实施例二中用tmb探针检测fe掺杂的vs2声敏剂在超声辐照下的ros释放;
47.图6是实施例三中不同浓度fe掺杂的vs2声敏剂对人脐静脉内皮细胞的杀伤作用;
48.图7是实施例三中不同浓度fe掺杂的vs2声敏剂联合超声辐照对小鼠乳腺癌细胞的杀伤作用;
49.图8是实施例四中静脉注射fe掺杂的vs2声敏剂后小鼠在不同时间点的磁共振成像图片;
50.图9是实施例四中静脉注射fe掺杂的vs2声敏剂后小鼠在不同时间点的磁共振信号强度;
51.图10是实施例四中静脉注射fe掺杂的vs2声敏剂后小鼠在不同时间点的光声成像图片;
52.图11是实施例四中细静脉注射fe掺杂的vs2声敏剂后小鼠在不同时间点的光声信号强度;
53.图12是实施例五中静脉注射fe掺杂的vs2声敏剂后小鼠肿瘤生长曲线;
54.图13是实施例五中静脉注射fe掺杂的vs2声敏剂后小鼠生存曲线;
55.图14是实施例五中静脉注射fe掺杂的vs2声敏剂4天后肿瘤苏木精-伊红染色图像;
56.图15是实施例六中静脉注射fe掺杂的vs2声敏剂0.5天、1天、7天和30天后小鼠主要脏器中fe掺杂的vs2声敏剂的含量;
57.图16是实施例六中静脉注射pbs和静脉注射fe掺杂的vs2声敏剂7天和30天后小鼠主要脏器苏木精-伊红染色图像;
58.图17是实施例六中静脉注射pbs和静脉注射fe掺杂的vs2声敏剂7天和30天后小鼠血生化指标和血常规检测数据。
具体实施方式
59.下面结合实施例,对本发明的具体实施方式作进一步详细描述。以下实施例用于说明本发明,但不用来限制本发明的范围。
60.实施例一:合成和表征fe掺杂的vs2声敏剂:
61.通过高温油相法法合成fe掺杂的vs2声敏剂,步骤如下:
62.第一步,将掺杂金属源fecl3、油胺和十八烯均匀混合(油胺与十八烯的摩尔比为:1:0.5~1.5),在氮气保护下加热反应体系至120℃;
63.第二步,保持体系温度在120℃,向上述混合物中加入被掺杂金属源vcl4;其中,vcl4和fecl3的摩尔比为9.5:1;
64.第三步,继续加热反应体系至300℃,向上述混合物中加入硫源(溶解于油胺中的单质硫),硫源中的s与vcl4的摩尔比为2.5:1,然后在320℃下充分反应1小时,停止加热,待反应体系温度降至室温;
65.第四步,向反应产物中加入无水乙醇,离心取沉淀,用环己烷反复多次洗涤,得到粒径为80~150纳米的fe掺杂的vs2声敏剂。
66.然后对fe掺杂的vs2声敏剂进行表征,透射电子显微镜图像如图1显示,结果表明,fe掺杂的vs2声敏剂为二维纳米片结构。fe掺杂的vs2声敏剂的x-射线衍射图谱如图2,结果显示fe掺杂的vs2声敏剂存在明显的vs2特征峰。fe掺杂的vs2声敏剂的元素tem-mapping表征结果如图3所示,图3a为图3b-d的元素合并图,图3b、c、d依次为fe元素、s元素、v元素图,结果表明三种元素均在其中均匀分布,证明fe成功被掺杂到了vs2当中。
67.实施例二:fe掺杂的vs2声敏剂修饰及超声辐照下ros释放
68.将10mg实施例一制备的fe掺杂的vs2超声分散在二氯甲烷中,加入20mgc
18-pmh-peg,在室温搅拌反应30分钟,除去二氯甲烷后超声分散在水中,得到fe掺杂的vs
2-peg水溶液。
69.用1,3-联苯基异香豆酮2,5-二苯基-3,4-苯并呋喃(dpbf)和3,3',5,5'-四甲基联苯胺(tmb)两种探针检测上述fe掺杂的vs
2-peg声敏剂在超声辐照下的ros释放,其中超声辐照条件为40khz,3w/cm2,声敏剂的浓度为5μg/ml。结果如图4所示,在超声辐照下,fe掺杂的vs2声敏剂可以产生单线态氧,使dpbf在416纳米处的紫外吸收特征峰降低;如图5所示在超声辐照下,fe掺杂的vs2声敏剂可以产生羟基自由基,使tmb在654纳米处的紫外吸收特征峰升高。且图4-5中,随着超声辐照时间的延长,dpbf在416纳米处的紫外吸收特征峰越低、tmb在654纳米处的紫外吸收特征峰越高,说明超声辐照时间越长,单线态氧和羟基自由基的产量越多。
70.实施例三:fe掺杂的vs2声敏剂对肿瘤细胞的杀伤:
71.将实施例二制备的不同浓度的fe掺杂的vs
2-peg声敏剂与人脐静脉内皮细胞(huvec)和小鼠乳腺癌细胞(4t1)孵育12小时,分别记为huvec组和fe-vs2组。另外,部分孵育后小鼠乳腺癌细胞用功率为4.5w/cm2超声探头辐照5分钟,记为fe-vs2 us组。结果如图6和7所示,在3.13-100μg/ml浓度下,fe掺杂的vs2声敏剂对正常细胞(人脐静脉内皮细胞)没有显著的细胞毒性。而对小鼠乳腺癌细胞具有较强的细胞杀伤效果,且随着fe掺杂的vs2声敏剂的浓度的升高,对小鼠乳腺癌细胞的杀伤力越大。此外,从图7中可看出,fe-vs2 us组对小鼠乳腺癌细胞的杀伤力高于不加超声探头辐照的fe-vs2组。
72.实施例四:fe掺杂的vs2声敏剂在肿瘤内的滞留成像:
73.通过静脉注射的方式将实施例二制备的fe掺杂的vs
2-peg声敏剂水溶液注射到皮下乳腺癌模型的小鼠中,将肿瘤部位暴露于超声辐照,测试其磁共振信号,其中声敏剂浓度为1mg/ml,注射剂量为150μl,磁共振条件为tr(重复时间)3000ms,te(回波时间)82ms。如图8和9所示在注射前(图8a,图9中pre)、后(图8b,图9中post(i.v.))小鼠肿瘤部位可以观察到明显的磁共振信号;在不同时间点,光声成像如图10和11,图10a、b、c、d分别为磁共振测试第0h、2h、12h、24h的结果,结果显示fe掺杂的vs2声敏剂可以很快富集到肿瘤部位。
74.实施例五:fe掺杂的vs2声敏剂对肿瘤的声动力治疗
75.设置四组实验组,分别为对照组(control组)、us组、fe-vs2组和fe-vs2 us组。其中,对照组通过静脉注射的方式将pbs注射到皮下乳腺癌模型的小鼠中。fe-vs2组和fe-vs2 us组是将实施例二制备的fe掺杂的vs
2-peg声敏剂水溶液,其中声敏剂浓度为1mg/ml,注射剂量为150μl,fe-vs2 us组另外在40khz,6.5w/cm2条件下进行辐照10分钟。us组也在相同的条件下进行辐照10分钟。
76.在不同时间点使用游标卡尺测量不同实验组小鼠的肿瘤体积。小鼠肿瘤的生长曲线如图12显示,相对于control组,只进行超声辐照(us组)对肿瘤没有明显的抑制作用;fe掺杂的vs2声敏剂处理(fe-vs2组)对肿瘤生长有一定的抑制作用;fe掺杂的vs2声敏剂结合超声辐照处理(fe-vs2 us组)对中的生长有明显的抑制作用。小鼠生存曲线如图13显示,fe掺杂的vs2声敏剂结合超声辐照(fe-vs2 us组)可以大幅延长小鼠的生存期。在小鼠治疗4天后的肿瘤进行he染色如图12示,图12a、b、c、d依次为control组、us组、fe-vs2组和fe-vs2 us组的试验结果,结果表明,fe掺杂的vs2声敏剂结合超声辐照处理后小鼠的肿瘤细胞核固缩,表明癌细胞凋亡。
77.实施例六:fe掺杂的vs2声敏剂的生物相容性及降解性能评价
78.通过静脉注射的方式将pbs和实施例二制备的fe掺杂的vs
2-peg声敏剂注射到健康小鼠体内,其中声敏剂浓度为1mg/ml,注射剂量为200μl。注射pbs的小鼠记为对照组(control组)。注射后0.5天、1天、7天和30天随机处死小鼠,解剖后取出心脏组织、肝脏组织、脾脏组织、肺组织和肾脏组织,并各分为两份,将一份的器官固定在4%甲醛溶液(福尔马林)中,嵌入石蜡,按常规程序进行进一步h&e染色,评定fe掺杂的vs2声敏剂注射后的安全性。将各器官和组织的另一份,在王水中溶解,然后测定各器官中钒元素的含量。同时采集血样进行血生化和血常规检测。钒元素在小鼠不同器官中的含量测试结果表明,随着时间的增加,小鼠各器官和组织中的钒元素含量明显下降,表明fe掺杂的vs2声敏剂会逐渐从小鼠机体中代谢出去(图15)。同时,对主要器官的组织学检查进一步证实,fe掺杂的vs2声敏剂注射后对小鼠无明显副作用(图16),图16a1-a5中0天的结果为对照组的结果。与对照组相比,fe掺杂的vs2声敏剂注射后小鼠的血生化指标和血液学检测数据均为正常(图17)。以上结果均证明了fe掺杂的vs2声敏剂的生物安全性和生物可降解性。
79.以上所述仅是本发明的优选实施方式,并不用于限制本发明,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明技术原理的前提下,还可以做出若干改进和变型,这些改进和变型也应视为本发明的保护范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。