1.本公开涉及一种含有7-[4-(4-苯并[b]噻吩-4-基-哌嗪-1-基)丁氧基]-1h-喹啉-2-酮的经口药物组合物(更优选控释经口药物组合物)等。本说明书中提及的所有文件的内容通过引用并入本文。
背景技术:
[0002]
7-[4-(4-苯并[b]噻吩-4-基-哌嗪-1-基)丁氧基]-1h-喹啉-2-酮(以下也称为化合物(i)或依匹哌唑)或其盐具有多巴胺d2受体部分激动作用、5-羟色胺5-ht
2a
受体拮抗作用和肾上腺素能α1受体拮抗作用。除这些作用之外,化合物(i)或其盐还具有5-羟色胺摄取抑制作用(或5-羟色胺再摄取抑制作用),并且已知对中枢神经系统(cns)疾病(特别是精神分裂症)具有广泛的治疗谱(专利文献(ptl)1)。
[0003]
现有技术文献
[0004]
专利文献
[0005]
ptl1:jp2006-316052a
技术实现要素:
[0006]
技术问题
[0007]
在cns疾病例如精神分裂症的治疗中,通常重要的是药物在血浆中以治疗有效浓度长时间存在。因此,可以低频率施用的经口施用药物组合物由于增加患者依从性并降低治疗期间的复发率而是有用的。为了获得可以低频率施用的经口施用药物组合物,可以考虑制造含有高剂量活性成分的组合物。然而,为了维持治疗有效的血液浓度,活性成分需要以适当的速率从组合物中持续释放,同时防止在施用后由于生物体方面的因素而过度释放。
[0008]
在使用化合物(i)或其盐治疗精神分裂症时,目前推荐每天一次经口施用。然而,每天一次经口施用给许多需要长期施用的患者带来了过度的负担。因此,需要一种适合于施用频率低于每天一次施用的可经口施用药物组合物。
[0009]
技术解决方案
[0010]
本发明人进行了广泛的研究以提供一种适合于施用频率低于每天一次施用的可经口施用药物组合物。结果,本发明人发现,化合物(i)的富马酸盐和基于纤维素的水溶性聚合物的组合可能会提供表现出优异的过饱和溶出浓度曲线的经口固体药物组合物。
[0011]
本公开包括例如以下各项中描述的主题。
[0012]
项1.
[0013]
一种控释经口固体药物组合物,其包含7-[4-(4-苯并[b]噻吩-4-基-哌嗪-1-基)丁氧基]-1h-喹啉-2-酮的富马酸盐作为活性成分,并且还包含基于纤维素的水溶性聚合物。
[0014]
项2.
[0015]
根据项1所述的组合物,其中所述基于纤维素的水溶性聚合物是选自羟丙基甲基纤维素、羟丙基纤维素和甲基纤维素的至少一种。
[0016]
项3.
[0017]
根据项1或2所述的组合物,所述组合物是渗透泵型组合物。
[0018]
项4.
[0019]
根据项1或2所述的组合物,所述组合物是水凝胶持续释放制剂。
[0020]
项5.
[0021]
根据项4所述的组合物,所述组合物包含肠溶包衣。
[0022]
项6.
[0023]
根据项1至5中任一项所述的组合物,其中所述7-[4-(4-苯并[b]噻吩-4-基-哌嗪-1-基)丁氧基]-1h-喹啉-2-酮的富马酸盐的含量以游离碱的重量计为5mg至60mg。
[0024]
项7.
[0025]
根据项1至6中任一项所述的组合物,其中当经口施用于人时,7-[4-(4-苯并[b]噻吩-4-基-哌嗪-1-基)丁氧基]-1h-喹啉-2-酮的稳态血液浓度被维持在15ng/ml至400ng/ml的范围内历时1周。
[0026]
项8.
[0027]
根据项1至7中任一项所述的组合物,所述组合物用于每周一次施用以游离碱的重量计剂量为5mg至60mg的所述7-[4-(4-苯并[b]噻吩-4-基-哌嗪-1-基)丁氧基]-1h-喹啉-2-酮的富马酸盐。
[0028]
项9
[0029]
根据项1至8中任一项所述的组合物,所述组合物用于预防或治疗中枢神经系统(cns)疾病。
[0030]
项10.
[0031]
根据项9所述的组合物,其中所述组合物用于预防或治疗选自以下的cns疾病:精神分裂症,治疗抵抗性、难治性或慢性精神分裂症,情感障碍,精神病性障碍,情绪障碍,双相障碍,抑郁症,内源性抑郁症,重度抑郁症,忧郁症和治疗抵抗性抑郁症,心境恶劣障碍,循环性情感障碍,焦虑障碍,躯体形式障碍,做作性障碍,分离性障碍,性障碍,进食障碍,睡眠障碍,适应障碍,物质相关障碍,快感缺乏症,谵妄,认知障碍,神经变性疾病伴发的认知障碍,神经变性疾病导致的认知障碍,精神分裂症的认知障碍,治疗抵抗性、难治性或慢性精神分裂症引起的认知障碍,呕吐,晕动病,肥胖,偏头痛,疼痛,智力低下,自闭性障碍,图雷特障碍,抽动障碍,注意力缺陷多动障碍,品行障碍,唐氏综合症,痴呆伴发的冲动症状,以及边缘型人格障碍。
[0032]
项a-1.
[0033]
根据项1至10中任一项所述的组合物,其包含7-[4-(4-苯并[b]噻吩-4-基-哌嗪-1-基)丁氧基]-1h-喹啉-2-酮的盐作为活性成分,其中所述组合物在5小时至30小时的时期内以持续的方式释放所述活性成分。
[0034]
项a-2.
[0035]
根据项3所述的组合物,其是包含芯制剂的组合物,所述芯制剂包含药物层和推动层,其中
[0036]
所述药物层包含
[0037]
以游离碱的重量计为5mg至200mg的7-[4-(4-苯并[b]噻吩-4-基-哌嗪-1-基)丁氧基]-1h-喹啉-2-酮的富马酸盐,
[0038]
基于药物层的重量为5质量%至94质量%的亲水性聚合物,
[0039]
基于药物层的重量为5质量%至40质量%的基于纤维素的水溶性聚合物,
[0040]
基于药物层的重量为1质量%至50质量%的渗透压调节剂,
[0041]
基于药物层的重量为0.1质量%至5质量%的润滑剂,和
[0042]
基于药物层的重量为0.1质量%至5质量%的流化剂,
[0043]
所述推动层包含
[0044]
基于推动层的重量为50质量%至90质量%的高溶胀性聚合物,
[0045]
基于推动层的重量为5质量%至50质量%的渗透压调节剂,
[0046]
基于推动层的重量为0.1质量%至5质量%的润滑剂,和
[0047]
基于推动层的重量为0.1质量%至2质量%的颜料,
[0048]
基于100质量份的所述芯制剂,所述芯制剂质量份包含5至25质量份的半透膜和1质量份至15质量份的水溶性聚合物膜,
[0049]
基于半透膜的重量,所述半透膜包含70质量%至100质量%的基于纤维素的聚合物和0.01质量%至30质量%的水溶性通量调节剂,并且
[0050]
所述组合物任选包含彩色包衣层。
[0051]
项a-3.
[0052]
根据项4所述的组合物,其包含以游离碱的重量计为5mg至200mg的7-[4-(4-苯并[b]噻吩-4-基-哌嗪-1-基)丁氧基]-1h-喹啉-2-酮的富马酸盐,
[0053]
基于片芯的重量为30质量%至90质量%的控释基质材料;
[0054]
基于片芯的重量为1质量%至50质量%的水合促进剂,
[0055]
基于片芯的重量为0.1质量%至5质量%的润滑剂,以及
[0056]
基于100质量份的芯制剂为1质量份至40质量份的肠溶包衣。
[0057]
有利效果
[0058]
根据本公开,可以提供一种手段,所述手段防止活性成分(即,化合物(i)的盐)从药物组合物中的初期过度释放,即使当所述组合物以高剂量施用时也是如此;并且允许所述活性成分在长时间内以治疗有效量持续释放。这可以长时间维持所述活性成分的治疗有效的血液浓度。因此,根据本公开,对化合物(i)的盐有反应的疾病(例如精神分裂症)可以通过比常规方法更低频率的施用来治疗,因此本发明有效改善患者的用药依从性。
[0059]
对化合物(i)或其盐有反应的疾病的实例包括多种cns疾病,例如:精神分裂症,治疗抵抗性、难治性或慢性精神分裂症,情感障碍,精神病性障碍,情绪障碍,双相障碍(例如,双相i型障碍和双相ii型障碍),抑郁症,内源性抑郁症,重度抑郁症,忧郁症和治疗抵抗性抑郁症,心境恶劣障碍,循环性情感障碍,焦虑障碍(例如惊恐发作、惊恐障碍、广场恐惧症、社交恐惧症、强迫性障碍、创伤后应激障碍、广泛性焦虑障碍和急性应激障碍),躯体形式障碍(例如癔症、躯体化障碍、转换障碍、疼痛障碍和疑病症),做作性障碍,分离性障碍,性障碍(例如性功能障碍、性欲障碍、性唤起障碍和勃起功能障碍),进食障碍(例如神经性厌食症和神经性贪食症),睡眠障碍,适应障碍,物质相关障碍(例如酒精滥用、酒精中毒和药物
成瘾、安非他明成瘾和麻醉剂成瘾),快感缺乏症(例如,快感丧失、快感缺乏症、医源性快感缺乏症、精神或精神原因的快感缺乏症、抑郁症伴发的快感缺乏症、精神分裂症伴发的快感缺乏症),谵妄,认知障碍,阿尔茨海默病、帕金森病和其它神经变性疾病伴发的认知障碍,阿尔茨海默病、帕金森病和其它神经变性疾病引起的认知障碍,精神分裂症的认知障碍,治疗抵抗性、难治性或慢性精神分裂症引起的认知障碍,呕吐,晕动病,肥胖,偏头痛,疼痛,智力低下,自闭性障碍(自闭症),图雷特综合征,抽动障碍,注意力缺陷多动障碍,品行障碍,唐氏综合症,痴呆伴发的冲动症状(例如阿尔茨海默病伴发的焦躁)和边缘型人格障碍等。
附图说明
[0060]
图1a显示了含有化合物(i)的富马酸盐或化合物(i)的经口药物组合物(渗透泵型制剂)的溶出试验结果。
[0061]
图1b显示了含有化合物(i)的富马酸盐或化合物(i)的经口药物组合物(渗透泵型制剂)的溶出试验结果。
[0062]
图2a显示了含有化合物(i)的富马酸盐的经口药物组合物(渗透泵型制剂)的溶出试验结果。
[0063]
图2b显示了含有化合物(i)的富马酸盐的经口药物组合物(渗透泵型制剂)的溶出试验结果。
[0064]
图3显示了含有化合物(i)的富马酸盐的经口药物组合物(水凝胶持续释放制剂)的溶出试验结果。
[0065]
图4a显示了化合物(i)的富马酸盐的红外吸收光谱。
[0066]
图4b显示了化合物(i)的富马酸盐的粉末x射线衍射图谱。
[0067]
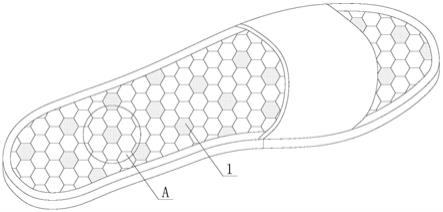
图5显示了渗透泵型组合物的示例,它是控释经口药物组合物的一个实施方式。
具体实施方式
[0068]
本公开优选包括经口药物组合物、所述经口药物组合物的制造方法等。然而,本公开不限于此,本发明所公开的以及本领域技术人员可以认识到的全部包括在内。
[0069]
本公开的经口药物组合物包含化合物(i)的盐。所述经口药物组合物可被称为“本公开的经口药物组合物”。化合物(i)是指由下式(i)表示的化合物。化合物(i)或其盐可以通过jp2006-316052a(其全部内容通过引用并入本文)中公开的方法或与其类似的方法制造。
[0070][0071]
所述化合物(i)的盐没有特别限制,只要它是药学上可接受的盐即可。实例包括各种金属盐、无机碱盐、有机碱盐、无机酸盐、有机酸盐等。金属盐的实例包括碱金属盐(例如钠盐和钾盐)、碱土金属盐(例如钙盐和镁盐)等。无机碱盐的实例包括铵盐以及碱金属碳酸
盐(例如碳酸锂、碳酸钾、碳酸钠和碳酸铯)、碱金属碳酸氢盐(例如碳酸氢锂、碳酸氢钠和碳酸氢钾)、碱金属氢氧化物(例如氢氧化锂、氢氧化钠、氢氧化钾和氢氧化铯)等无机碱盐。有机碱盐的实例包括三(低级)烷基胺(例如三甲胺、三乙胺和n-乙基二异丙胺)、吡啶、喹啉、哌啶、咪唑、甲基吡啶、二甲氨基吡啶、二甲基苯胺、n-(低级)烷基-吗啉(例如n-甲基吗啉)、1,5-二氮杂双环[4.3.0]壬烯-5(dbn)、1,8-二氮杂双环[5.4.0]十一碳烯-7(dbu)、1,4-二氮杂双环[2.2.2]辛烷(dabco)等有机碱盐。无机酸盐的实例包括盐酸盐、氢溴酸盐、氢碘酸盐、硫酸盐、硝酸盐、磷酸盐等。有机酸盐的实例包括甲酸盐、乙酸盐、丙酸盐、草酸盐、丙二酸盐、琥珀酸盐、富马酸盐、马来酸盐、乳酸盐、苹果酸盐、柠檬酸盐、酒石酸盐、碳酸盐、苦味酸盐、甲磺酸盐、乙磺酸盐、对甲苯磺酸盐、谷氨酸盐、苯甲酸盐等。其中,优选盐酸盐、硫酸盐、富马酸盐、磷酸盐、柠檬酸盐和酒石酸盐。特别优选富马酸盐。
[0072]
化合物(i)的盐的实例包括酸酐、与溶剂的溶剂化物(例如水合物、甲醇化物、乙醇化物和乙腈化物)、各种结晶形态的酸酐和溶剂化物,及其混合物。化合物(i)或其盐也包括例如几何异构体、立体异构体和光学异构体等的异构体。
[0073]
所述化合物(i)的盐可以是药学上可接受的共晶盐。如本文所用的术语“共晶”或“共晶盐”是指由两种或多种在室温下具有不同物理特性(例如结构、熔点和熔化热)的独特固体构成的结晶性材料。共晶和共晶盐可以通过已知的共结晶方法制造。
[0074]
本公开的经口药物组合物适合于维持化合物(i)的盐的恒定的溶出浓度,即使在胃肠道下部。此外,优选地,本公开的经口药物组合物适合于长时间以恒定速率释放化合物(i)的盐。更具体地,所述经口药物组合物适合于用作控释经口药物组合物。
[0075]
可以通过按照日本药典中的溶出试验的第二法(桨法),使用达到漏槽条件的ph 5.0或更低的缓冲液(具体地,0.05mol/l乙酸缓冲液(ph 4.3,乙酸,乙酸钠))作为试验液,来测量化合物(ⅰ)的溶出度和持续释放时间,从而计算所述经口药物组合物的溶出度和持续释放时间。
[0076]“溶出度”是指溶解的化合物(i)的盐与经口药物组合物中所含的化合物(i)的盐总量的比率。因此,溶出度可以解释为溶解(溶出)的化合物(i)与经口药物组合物中所含化合物(i)的总量的比率。“持续释放时间”是指从溶出试验的测量开始直至达到最终溶出度的时间。“最终溶出度”是指当溶出试验中达到平台期时的溶出度,“最终溶出量”是指当溶出试验中达到最终溶出度时的溶出量。在溶出试验中,当将某个时间点(基准时间点)的溶出度与基准时间点后两小时的溶出度进行比较、并且如果基准时间点后两小时的溶出度落入基准时间点的溶出度
±
1%的范围内时(优选地,当将某个时间点(基准时间点)的溶出度与基准时间点后多于两小时的溶出度进行比较、并且如果基准时间点后多于两小时的溶出度落入基准时间点的溶出度
±
1%的范围内时),则认为在从试验开始起时间最短的该基准时间点达到平台期。然而,基准时间点的溶出度应超过20%(换言之,当溶出度不超过20%时,不认为是平台期)。
[0077]
所述持续释放时间优选为5小时或更长。所述持续释放时间优选为30小时或更短。更优选地,所述持续释放时间为5小时至30小时。所述持续释放时间范围的上限或下限是,例如,6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28或29小时。所述持续释放时间例如更加优选为10小时至24小时,进一步更加优选为15小时至24小时。
[0078]
本公开的经口药物组合物的最终溶出量优选为经口药物组合物(典型地,经口药物制剂)中所含的化合物(i)的盐的总量的80质量%或更多。更优选地,最终溶出量为81、82、83、84、84、85、85、86、87、88、89或90质量%或更多。
[0079]
在胃肠道下部是否维持恒定的溶出浓度可以根据日本药典的溶出试验的第二法(桨法),使用模拟胃肠道下部的ph 7左右的磷酸盐缓冲液作为试验液,测量化合物(i)的盐随溶出时间的过饱和溶出浓度曲线来评价。
[0080]
在实现“持续释放”中,化合物(i)的盐从组合物中的初期溶出上升可在溶出试验开始后立即实现,或在测量开始后经过一定时间(例如1至3小时)实现。然而,要花费超过5小时方能使溶出量达到最终溶出量的5质量%或更多,是不希望的。
[0081]“过饱和溶出曲线”可以通过在使用上述ph 7左右的磷酸盐缓冲溶液(模拟消化道下部的试验液)的桨法溶出试验中,随时间定量暂时以高于化合物(i)的溶解度水平溶解的药物浓度来评价。优选的过饱和溶出曲线是在溶出试验开始后4小时至18小时之间的时间点达到溶出度峰值的曲线。以化合物(i)(游离碱)计,所述峰值优选为1或1.5μg/ml或更高,更优选2、2.5或3μg/ml或更高,更加优选3.5、4、4.5、5、5.5或6μg/ml或更高。过饱和浓度越高越有助于胃肠道下部的吸收,因此有望增加ba(生物利用度)和降低ptf(峰谷比)。这样的ba提高或ptf降低使其更容易符合pk(药代动力学)目标范围。
[0082]
化合物(i)的盐从所述经口药物组合物中以均一的速率长时间释放的方式没有特别限制,并且可以通过持续释放制剂领域中已知的种种技术来实现。优选的持续释放途径是,例如,利用扩散控制组合物、溶解控制组合物或渗透泵型控释组合物的那些。其中,更优选的持续释放途径是,例如,渗透泵型控释(尤其是渗透控释经口递送系统(osmotic controlled release oral delivery system):oros)组合物、和水凝胶持续释放组合物。从易于操作的观点考虑,这样的经口药物组合物优选是经口固体药物组合物(特别是固体制剂)。
[0083]
本公开的经口药物组合物优选含有基于纤维素的水溶性聚合物。所述基于纤维素的水溶性聚合物优选包含在含有药物的组合物中。可以优选使用的基于纤维素的水溶性聚合物是,例如,制药领域中已知的基于纤维素的水溶性聚合物。例如,其结构中纤维素的oh基的一部分氢原子被甲基和/或羟丙基置换的基于纤维素的水溶性聚合物是优选的。优选的基于纤维素的水溶性聚合物的具体实例包括羟丙基甲基纤维素、羟丙基纤维素、甲基纤维素等。这样的基于纤维素的水溶性聚合物可以单独使用,或两种或更多种组合使用。
[0084]
特别地,当富马酸盐用作化合物(i)的盐时,化合物(i)的富马酸盐和基于纤维素的水溶性聚合物的组合可以提供表现出极为优异的过饱和溶出曲线的经口固体药物组合物。
[0085]
下面参照渗透泵型控释组合物更详细地描述本公开,所述组合物是一种优选的经口固体药物组合物。所述渗透泵型控释组合物的制剂可以称为渗透泵型制剂。
[0086]
渗透泵型组合物一般具有这样的结构:其中药物和任选的产生渗透压的盐类等物质(渗透剂)被半透膜包围;并且半透膜具有可以释放所述药物的孔。流体(例如水)根据渗透压进入半透膜,将其中的药物和渗透剂溶解,这增加了跨半透膜的渗透压梯度并引起更多的流体流入半透膜,从而进一步溶解和释放药物。渗透泵型组合物的优点在于,由于药物的释放速率不依赖于环境的ph,即使该组合物通过胃肠道并遇到显著不同的ph环境,该组
合物也可以长时间根据渗透压以恒定的速率持续释放药物。
[0087]
对于本公开的经口药物组合物的一个实施方式,即渗透泵型组合物,下面参照附图进行说明。在图5中,渗透泵型组合物1(以下有时简称为制剂1)包括围绕内部隔室5的壁2,所述内部隔室中存在含有化合物(i)的盐的组合物。壁2具有至少一个将外部环境与内部隔室连通的药物释放口3。内部隔室5包括双层压缩芯,所述芯包含药物层6和推动层7。药物释放口3优选设置在壁2中,以使内部隔室5在药物层6侧与外部环境连通。可以提供一个或多个药物释放口3。例如,所述壁可具有两个或三个药物释放口3。
[0088]
壁2为半透膜,水和外部液体透过,但药物、渗透剂等透不过。药物层6包含呈与一种或多种添加剂的混合物形式的化合物(i)的盐。推动层7不包含任何化合物(i)的盐,而包含渗透剂和高溶胀性聚合物。渗透剂是指在药物制剂中具有水溶性并提高电解质浓度的成分,例如无机盐和糖类和/或糖醇。高溶胀性聚合物是指吸收液体并溶胀的聚合物(优选分子量比较大的聚合物)。高溶胀性聚合物吸收液体并溶胀,从而通过药物释放口3释放化合物(i)的盐。药物层6和推动层7还包含添加剂,例如亲水性聚合物、渗透压调节剂、水合促进剂、ph调节剂、粘合剂、流化剂、抗氧化剂、润滑剂和颜料。
[0089]
在渗透泵型组合物中,经口摄入后,液体,例如水,透过半透膜并被吸收到所述组合物中。由于所产生的渗透压效应,所述药物层中的化合物(i)的盐变得可释放,而所述推动层中的高溶胀性聚合物同时溶胀。随着体液继续渗入所述内部隔室,可释放的化合物(i)的盐可以通过释放口3释放。化合物(i)的盐的释放导致体液的进一步渗入和所述推动层的进一步溶胀,从而实现化合物(i)的盐的持续释放。
[0090]
优选地,所使用的半透膜对外部液体例如水和生物体液具有高透过性,但对化合物(i)的盐、渗透压调节剂、高溶胀性聚合物等是基本上不透过的。优选地,所述半透膜是基本上不可侵蚀的且在体内是不可溶的。
[0091]
用于形成半透膜的典型聚合物的实例包括半透性单聚物、半透性共聚物等。实例包括基于纤维素的聚合物,例如纤维素酯、纤维素醚和纤维素酯-醚。具体实例包括纤维素酰化物、纤维素二酰化物、纤维素三酰化物、乙酸纤维素、二乙酸纤维素、三乙酸纤维素、单-、二-和三-纤维素烷基化物、单-、二-和三-烯基化物、单-、二-和三-合金化物等。其中,乙酸纤维素是优选的。所述半透膜可以通过已知的方法由这样的聚合物制备。
[0092]
除上述之外,用于形成渗透泵型组合物的半透膜的半透性聚合物的其它实例包括以下:纤维素乙醛乙酸二甲酯;乙酸纤维素氨基甲酸乙酯;乙酸纤维素氨基甲酸甲酯;二甲基氨基乙酸纤维素;半透性聚氨酯;半透性磺化聚苯乙烯;如美国专利号3,173,876、3,276,586、3,541,005、3,541,006和3,546,142中公开的,由阴离子和阳离子共沉淀形成的交联选择性半透性聚合物;如美国专利号3,133,132中公开的半透性聚合物;半透性聚苯乙烯衍生物;半透性聚(苯乙烯磺酸钠);半透性聚(乙烯基苄基三甲基氯化铵);以及根据在透过半透性壁时每个大气压的流体静压差或渗透压差显示液体渗透率为10-5
至10-2
(cc ml/cm hr atm)的半透性聚合物。
[0093]
上述用于形成半透膜的示例性聚合物可以单独使用,或两种或更多种组合使用。
[0094]
所述半透膜可含有通量调节剂(flux-regulating agent)。通量调节剂是指为了帮助调节通过半透膜的液体渗透率或液量而添加的物质。通量调节剂包括提高通量的物质(以下称为通量增强剂)和降低通量的物质(以下称为通量降低剂)。通量增强剂本质上是亲
水性的,而通量降低剂本质上是疏水性的。
[0095]
通量调节剂的实例包括多元醇、聚烷撑二醇(polyalkylene glycol)、聚亚烷基二醇(polyalkylene diol)、烷撑二醇的聚酯等。
[0096]
代表性的通量增强剂的实例包括平均分子量为190至9000的聚乙二醇,例如聚乙二醇300、400、600、1500、3000、3350、4000、6000或8000;低分子量二醇,例如聚丙二醇、聚丁二醇和聚戊二醇;聚亚烷基二醇,例如聚(1,3-丙烷二醇)、聚(1,4-丁烷二醇)和聚(1,6-己烷二醇);脂肪酸,例如1,3-丁二醇、1,4-戊二醇和1,4-己二醇;亚烷基三醇,例如甘油、1,2,3-丁三醇、1,2,4-己三醇和1,3,6-己三醇;酯,例如乙二醇二丙酸酯、乙二醇丁酸酯、丁二醇二丙酸酯和甘油乙酸酯。优选的通量增强剂包括被称为pluronics(basf)的双官能嵌段共聚物丙二醇的聚氧化烯衍生物等。
[0097]
典型的通量降低剂包括被烷基或烷氧基、或同时被烷基和烷氧基取代的邻苯二甲酸酯,例如邻苯二甲酸二乙酯、邻苯二甲酸二甲氧基乙酯、邻苯二甲酸二甲酯和[邻苯二甲酸二(2-乙基己基)酯];邻苯二甲酸芳基酯,例如邻苯二甲酸三苯酯和邻苯二甲酸丁基苄酯;不溶性盐,例如硫酸钙、硫酸钡和磷酸钙;不溶性氧化物,例如二氧化钛;呈例如粉末或颗粒形式的聚合物,例如聚苯乙烯、聚甲基丙烯酸甲酯、聚碳酸酯和聚砜;酯,例如用长链烷基进行酯化的柠檬酸酯;惰性且不透水的填充剂;与基于纤维素的壁形成材料相容的树脂;等等。
[0098]
上述用于形成半透膜的示例性通量调节剂可以单独使用,或两种或更多种组合使用。
[0099]
所述半透膜可包含其他物质,例如,以赋予半透膜柔软性和伸长性质、使半透膜不那么脆、或赋予半透膜撕裂强度。为此目的适当添加的材料的实例包括增塑剂。具体实例包括邻苯二甲酸酯增塑剂,例如邻苯二甲酸二苄酯、邻苯二甲酸二己酯、邻苯二甲酸辛基丁酯、c
6-c
11
直链邻苯二甲酸酯、邻苯二甲酸二异壬酯、邻苯二甲酸二异癸酯等。增塑剂的其它实例包括非邻苯二甲酸酯,例如三醋精、壬二酸二辛酯、环氧化妥尔酸酯、偏苯三酸三异辛酯、偏苯三酸三异壬酯、乙酸异丁酸蔗糖酯和环氧化大豆油。在半透膜中存在例如上述那些的增塑剂时,增塑剂的量基于半透膜的全部组分的总量为约0.01质量%至30质量%或更多。
[0100]
所述推动层含有用于推动化合物(i)的盐的组合物,并且以分层排列与药物层接触,如图5所示。如上所述,所述推动层包含高溶胀性聚合物,其吸收水性液体或生物流体,并溶胀以通过制剂的释放口挤出化合物(i)的盐。所述高溶胀性聚合物优选是可溶胀的亲水性聚合物,其与水或水性生物流体相互作用,并且高度溶胀或膨胀;通常表现出2至50倍的体积增加。所述高溶胀性聚合物可以是交联的或非交联的。在一个优选的实施方式中,所述聚合物优选地至少交联到产生太大而不能离开所述制剂的扩展聚合物网络的程度。因此,在一个优选的实施方式中,所述可溶胀的组合物在其有效寿命期间保留在所述制剂中。
[0101]
高溶胀性聚合物的实例包括数均分子量为10000至15000000的聚(环氧烷),例如聚环氧乙烷,和数均分子量为500000至3500000的聚(羧甲基纤维素碱)(其中碱为钠、钾或锂)。高溶胀性聚合物的其它实例包括形成水凝胶的聚合物,例如carbopol(注册商标)、酸性羧基聚合物、与聚烯丙基蔗糖交联的丙烯酸类聚合物(也称为羧聚乙烯)、和分子量为250000至4000000的羧乙烯基聚合物;cyanamer(注册商标)聚丙烯酰胺;交联水溶胀性茚马
来酸酐聚合物;分子量为80000至200000的good-rite(注册商标)聚丙烯酸;aqua-keeps(注册商标),由缩合葡萄糖单元构成的丙烯酸酯聚合物多糖,例如二酯交联聚葡聚糖;等等。美国专利号3,865,108、4,002,173、4,207,893等中公开了形成水凝胶的聚合物。
[0102]
上述示例性的高溶胀性聚合物可以单独使用,或两种或更多种组合使用。
[0103]
所述渗透压调节剂(有时称为渗透溶质或渗透有效剂)可存在于药物层和推动层二者中。渗透压调节剂没有特别限制,只要它表现出跨半透膜的渗透活性梯度即可。其实例包括无机盐、无机酸、有机盐、有机酸、糖、糖醇等。无机盐的实例包括氯化钠、碳酸氢钠、碳酸钠、磷酸钠(磷酸三钠)、磷酸钾(磷酸三钾)、磷酸氢钠(磷酸二氢钠、磷酸氢二钠)、磷酸氢钾(磷酸二氢钾、磷酸氢二钾)、氯化钾、氯化锂、硫酸镁、氯化镁、硫酸钾、硫酸钠、亚硫酸氢钠、亚硫酸氢钾、硫酸锂、酸性磷酸钾等。无机酸的实例包括形成上述无机盐的酸。有机盐的实例包括富马酸钠(富马酸二钠)、酒石酸氢钠、富马酸氢钠(富马酸一钠)、酒石酸氢钾、酒石酸钠、酒石酸钾钠、苹果酸钠(苹果酸二钠)、琥珀酸氢钠、琥珀酸钠(琥珀酸二钠)、马来酸氢钠、马来酸钠(马来酸二钠)、柠檬酸氢钠(柠檬酸二氢钠、柠檬酸氢二钠)、柠檬酸钠(柠檬酸三钠)等。有机酸的实例包括形成上述有机盐的酸。糖和糖醇的实例包括甘露糖醇、葡萄糖、乳糖、果糖、蔗糖、山梨糖醇、木糖醇、赤藓糖醇、乳糖等。这些可以是酸酐或溶剂化物(例如水合物)。这些可以单独使用,或两种或更多种组合使用。
[0104]
药物层优选包含含有与化合物的(i)的盐共同的离子的添加剂。例如,当化合物(i)的盐是富马酸盐时,具有共同离子的添加剂的实例包括富马酸、富马酸一钠、富马酸二钠等。在这种情况下,共同离子是富马酸根离子。本领域技术人员会理解,根据所使用的化合物(i)的盐的种类,与化合物(i)的盐共同的离子是什么,并且将能使用含有该共同离子的添加剂。可以使用的含有与化合物(i)的盐共同的离子的其它添加剂实例如上所述。
[0105]
适合用于制造渗透泵型组合物或其组分的溶剂的实例包括不会不利地影响所述组合物中使用的物质的水性或惰性有机溶剂。这样的溶剂的实例包括选自水性溶剂、醇、酮、酯、醚、脂族烃、卤代溶剂、脂环族溶剂、芳香族溶剂或杂环溶剂及其混合物中的至少一种。
[0106]
代表性溶剂的实例包括丙酮、双丙酮醇、甲醇、乙醇、异丙醇、丁醇、乙酸甲酯、乙酸乙酯、乙酸异丙酯、乙酸正丁酯、甲基异丁基酮、甲基丙基酮、正己烷、正庚烷、乙二醇单乙醚、乙二醇单乙醚乙酸酯、二氯甲烷、二氯乙烷、二氯丙烷、四氯化碳、硝基乙烷、硝基丙烷、四氯乙烷、乙醚、异丙醚、环己烷、环辛烷、苯、甲苯、石脑油、1,4-二烷、四氢呋喃、二甘醇二甲醚、水、含有无机盐例如氯化钠或氯化钙的水性溶剂、及其混合物(例如丙酮和水的混合物、丙酮和甲醇的混合物、丙酮和乙醇的混合物、二氯甲烷和甲醇的混合物、以及二氯乙烷和甲醇的混合物);等等。
[0107]
所述药物层包含治疗有效量的化合物(i)的盐以及载体。所述载体可以包含亲水性聚合物。所述亲水性聚合物可以提供,例如,药物组合物中有助于化合物(i)的盐的均匀释放速率和受控释放模式的亲水性聚合物粒子。这些聚合物的实例包括数均分子量为100000至750000的聚(环氧烷),例如聚(环氧乙烷)、聚(氧化亚甲基)、聚(环氧丁烷)和聚(环氧己烷);以及数均分子量为40000至400000的聚(羧甲基纤维素),例如聚(羧甲基纤维素碱)、聚(羧甲基纤维素钠)、聚(羧甲基纤维素钾)、聚(羧甲基纤维素锂)等。所述药物组合物可含有数均分子量为9200至125000的羟丙基烷基纤维素,例如羟丙基乙基纤维素、羟丙
基甲基纤维素、羟丙基丁基纤维素和羟丙基戊基纤维素,以改善所述组合物的释放性质;以及数均分子量为7000至75000的聚(乙烯基吡咯烷酮),以改善所述组合物的流动性质。在这些聚合物之中,数均分子量为100000至300000的聚(环氧乙烷)是优选的。
[0108]
可以存在于所述药物层中的其它载体包括当单独使用或与其它渗透压调节剂一起使用时表现出充分的渗透活性的碳水化合物。这样的碳水化合物包括单糖、二糖和多糖。代表性的实例包括糖类,例如麦芽糖糊精(即通过玉米淀粉的水解产生的葡萄糖聚合物)、乳糖、葡萄糖、棉子糖、蔗糖、甘露糖醇和山梨糖醇。优选的麦芽糖糊精是葡萄糖当量(de)为20或更低、优选de为约4至约20、更优选de为9至20的那些。优选使用de为9至12的麦芽糖糊精。碳水化合物(优选麦芽糖糊精)是优选的,因为它们无需添加其它渗透压调节剂即可用于所述药物层中,并赋予所述组合物长期稳定性。
[0109]
所述药物层是,例如,通过压缩载体和药物形成的均匀干燥组合物。所述药物层可以由粉碎的药物和添加的聚合物的粒子形成。可以使用已知技术进行制粒,例如制粒、喷雾干燥、筛分、冻干、破碎、粉碎、切碎等。这样的制粒可以使用装置例如高速搅拌制粒机、挤压制粒机、流化床制粒机和辊压机进行。
[0110]
所述药物层可含有一种或多种表面活性剂,以及一种或多种崩解剂。这样的表面活性剂的实例包括hlb值为约10至25的表面活性剂(具体而言,聚乙二醇400单硬脂酸酯、聚氧乙烯-4-脱水山梨糖醇单月桂酸酯、聚氧乙烯-20-脱水山梨糖醇单油酸酯、聚氧乙烯-20-脱水山梨糖醇单棕榈酸酯、聚氧乙烯-20-单月桂酸酯、聚氧乙烯-40-硬脂酸酯、油酸钠等)。崩解剂的实例包括淀粉、粘土、纤维素、藻胶、树胶、交联淀粉、纤维素、聚合物等。优选的崩解剂包括玉米淀粉、马铃薯淀粉、交联羧甲基纤维素、交联聚维酮、羟基乙酸淀粉钠、veegum hv、甲基纤维素、琼脂、膨润土、羧甲基纤维素、藻酸、瓜尔豆胶等。
[0111]
所述药物层还可含有轻质无水硅酸等。
[0112]
所述半透膜可以在所述双层压缩芯的表面上形成,例如通过锅包衣。更具体地,所述半透膜可以通过将用于形成半透膜的组合物喷洒到在旋转锅中翻滚的包含药物层和推动层的压缩双层芯的表面上来形成。锅包衣之外的包衣技术也可以用于包衣压缩芯。例如,可以通过使用空气悬浮程序的技术来形成半透膜。该程序由将压缩芯悬浮在空气和半透膜形成组合物的流中、并翻滚它直至在所述芯上形成半透膜所组成。所述空气悬浮程序非常适合独立形成半透膜。这样的空气悬浮技术是公知的(例如,美国专利号2,799,241)。也可以使用wurster(注册商标)空气悬浮包衣机,或aeromatic(注册商标)空气悬浮包衣机。
[0113]
用所述半透膜包覆后,将半透膜干燥,例如在强制通风炉中、或在控制温度和湿度的炉中干燥,从而除去溶剂。干燥条件可以考虑可用的设备、环境条件、溶剂、包衣材料、包衣厚度等进行适当的选择。
[0114]
本公开的经口药物组合物可以通过利用已知的制剂技术来制造。例如,可以通过现有的湿法制粒技术或干法制粒技术来制造所述经口药物组合物。更具体地,例如,在湿法制粒技术的情况下,使用有机溶剂、例如变性无水乙醇作为制粒溶液;并将药物和添加剂在制粒机中混合并使用所述溶剂连续制粒,从而获得颗粒。添加制粒溶液直至形成湿混合物,然后将该混合物湿块通过预先安装在烤箱托盘上的筛网。然后将该混合物在强制通风炉中干燥。另一种制粒方法是在流化床制粒机中进行各层的粉末组分的制粒操作。粉末组分在制粒机中干式混合后,将制粒液体喷洒到粉末上。将包衣的粉末在制粒机中干燥。通过这些
方法获得的干颗粒在具有粉碎机构的制粒机中确定尺寸。然后添加润滑剂,例如硬脂酸镁,并使用掺合机(例如,v型掺合机,或可搬运的掺合机(tote掺合机))混合成颗粒。使用例如manesty(注册商标)压机或korsch lct压机,通过压制使如此获得的组合物成为层状。为了产生两层芯,首先压制含药层;然后将通过湿法制粒技术以类似方式制造的推动层的湿混合物紧压在所述含药层上。如有必要,将压缩的双层芯用水溶性聚合物包衣,然后用如上所述的半透膜材料包衣。在组合物的药物层端部提供一个或多个出口(孔)。如有必要,可施加水溶性外被层,所述外被包衣可以是着色的或透明的。
[0115]
此外,例如,当使用干法制粒技术作为替代方法时,使用辊式压缩成型机将预混合的组合物形成为层状产物,使用带有粉碎机构的筛分研磨机将所述层状产物粉碎成颗粒并确定尺寸。以与上述相同的方式将润滑剂例如硬脂酸镁添加到确定尺寸的颗粒中,使用掺合机混合成颗粒,并以与上述制造方法相同的方式进行压制。
[0116]
所述渗透泵型组合物设有至少一个释放口。所述释放口在所述组合物制造期间或由所述组合物在使用时在液体环境中进行药物递送期间提供。“释放口”的表述包括例如通道、开口、孔口和内腔(孔)的含义。该表述还包括由外壁的物质或聚合物侵蚀、溶解或浸出而形成的细孔。这样的物质或聚合物包括,例如,所述半透膜中的可侵蚀性聚(乙醇酸)或聚(乳酸);凝胶状纤丝;水可去除的聚(乙烯醇);和浸出性化合物,例如选自无机盐、有机盐、氧化物和碳水化合物的流体可去除的细孔形成物质。所述释放口可以例如通过浸出选自山梨糖醇、甘露糖醇、乳糖、果糖、麦芽糖醇、麦芽糖、糊精、葡萄糖、甘露糖、半乳糖、塔罗糖、氯化钠、氯化钾和柠檬酸钠中的至少一种物质来提供具有适合于药物均匀释放的孔隙尺寸的口。所述释放口可以具有任何形状,例如圆形、长方形、正方形或椭圆形,只要药物可以以均一的速率从所述组合物中释放即可。所述渗透泵型组合物可以具有一个或多个以一定间隔设置的释放口。所述释放口的孔口尺寸没有特别限制,只要可以与压缩芯协作控制药物的释放即可。优选地,所述释放口的孔口尺寸为0.1mm至3mm。为了形成释放口,例如,可以使用机械钻孔和激光钻孔等钻穿半透膜的技术。用于形成这样的释放口的装置是已知的(例如,美国专利号3,916,899和美国专利号4,088,864)。
[0117]
所述经口药物组合物中化合物(i)的盐的量例如在每种剂型以化合物(i)的游离碱的重量计小于约1mg至约200mg或更多的范围内。例如,下文实施例中所述的渗透泵型组合物的药物层含有的化合物(i)的量为30mg(以游离碱计)。所述渗透泵型组合物的t
90
值为约10小时或更长。化合物(i)的盐在施用后约3至4小时内开始以均一的速率释放,并且所述以均一的速率释放持续至少约12小时的长时间。此后药物释放进一步持续数小时,直至所述制剂被消耗。
[0118]
本公开的经口药物组合物优选地在长时间内以相对均一的释放速率释放药物。当施用本公开的经口药物组合物时,峰值出现比施用常规药剂(例如立即释放制剂)后稳态峰值血浆浓度出现的时间晚,并且该峰值小于施用常规药剂后观察到的峰值;因此,所述组合物可以提供治疗有效的平均稳态血液浓度。
[0119]
本公开包括通过向患者经口施用本公开的经口药物组合物来治疗对用化合物(i)治疗有反应的疾病状态和病状的方法。该方法用适合于在至少约4小时、优选5小时至30小时、更优选10小时至24小时、更加优选15小时至24小时的时间段内以均一的释放速率释放化合物(i)的制剂来实施。
[0120]
对于精神分裂症的治疗,实施上述方法对于以低于每天一次的频率给患者经口施用本公开的经口药物组合物的目的是优选的。临床上可能诊断为精神分裂症症状的其它疾病状态和病状可以用本公开的控释经口药物组合物治疗。
[0121]
尽管这不是限制性的,但本公开的经口药物组合物当经口施用于人(特别是成人)时,优选将化合物(i)的稳态血液浓度维持在例如15ng/ml至400ng/ml或50ng/ml至300ng/ml范围内历时1周。
[0122]
含有化合物(i)的普通片剂(非控释制剂)以0.5mg、1mg、2mg片剂的形式已在包括日本、美国、欧洲等的多个国家上市。临床试验已确认了普通片剂对精神分裂症等的cns疾病是安全有效的;并已经进行了详细的药代动力学分析。考虑到关于普通片剂的这类信息,可以理解,当施用于人类时能够将化合物(i)的稳态血液浓度维持在例如15ng/ml至400ng/ml、或50ng/ml至300ng/ml范围内的任何经口药物组合物,均可以用于以与已经上市的普通片剂相同的方式预防或治疗精神分裂症等的cns疾病。
[0123]
因此,本公开的经口药物组合物可以以低于每天一次的频率经口施用;例如,可以每周一次经口施用。本公开的经口药物组合物可以一次施用一片,或一次施用两片以上;例如,可以一次施用两片、三片、四片或五片。本领域技术人员将能够根据例如普通片剂的药代动力学信息以及基于对本公开的经口药物组合物单剂施用方案和多剂施用方案的评价来适当确定本公开的经口药物组合物的剂量以达到上述血液浓度。例如,以化合物(i)的游离碱的重量计,单次给药剂量可以为约5mg至60mg、约10mg至60mg、约20mg至60mg或约45mg至60mg。
[0124]
如上所述,在本公开的经口药物组合物当中,一个特别优选的实施方式是渗透泵型控释系统的经口固体药物制剂。在所述渗透泵型控释系统的经口固体药物制剂中,以下更详细地描述了特别优选的实施方式。注意,以下描述可能与以上的描述部分重叠。以下描述不妨碍以上的描述的适用性。
[0125]
所述渗透泵型控释系统的经口固体药物制剂优选具有这样的结构:其中用半透膜包衣由将药物层和推动层层叠而形成的芯制剂包衣,并且所述药物层包含化合物(i)的盐。所述制剂的一个实施方式包括图5中所示的制剂。
[0126]
药物层与推动层的质量比为,例如,每100质量份药物层约20至125质量份推动层。该范围的上限或下限是,例如,25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、105、110、115或120质量份。所述范围可以是,例如,35质量份至100质量份、或40质量份至60质量份。
[0127]
药物层与推动层的质量比可以在,例如,0.8至5的范围内。所述质量比的上限或下限可以是,例如,0.9、1、1.1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9、2、2.1、2.2、2.3、2.4、2.5、2.6、2.7、2.8、2.9、3、3.1、3.2、3.3、3.4、3.5、3.6、3.7、3.8、3.9、4、4.1、4.2、4.3、4.4、4.5、4.6、4.7、4.8或4.9。例如,药物层与推动层的质量比可以在约1至4、或约2至3的范围内。更具体地,所述质量比可以是2.0、2.1、2.2、2.3、2.4、2.5、2.6、2.7、2.8、2.9或3.0。
[0128]
所述化合物(i)的盐没有特别限制,只要它是药学上可接受的盐即可。实例包括上述各种的金属盐、无机碱盐、有机碱盐、无机酸盐、有机酸盐等。例如,所述盐优选是富马酸盐、盐酸盐、硫酸盐等,特别优选富马酸盐。
[0129]
所述盐包括盐的溶剂化物,并且可以在药物制剂中以溶剂化物的形式存在。溶剂
化物的实例包括水合物、甲醇溶剂化物、乙醇溶剂化物等。溶剂化物可以是单溶剂化物、二溶剂化物、三溶剂化物等。例如,溶剂化物可以是一水合物、二水合物、三水合物等。这样的盐的溶剂化物的特别优选的实例是例如富马酸盐一水合物。
[0130]
所述药物层中化合物(i)的盐的量,例如,以游离碱的重量计可以在约5mg至约200mg的范围内。该范围的上限或下限是,例如,10、15、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、105、110、115、120、125、130、135、140、145、150、155、160、165、170、175、180、185、190或195mg。例如,化合物(i)的盐的量,以游离碱的重量计可以在约5mg至60mg、约15mg至150mg或约20mg至100mg的范围内。
[0131]
所述药物层中所含的化合物(i)的盐的量可以占例如药物层的约1质量%至35质量%。所述范围的上限或下限是,例如,2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33或34质量%。所述范围可以是例如约2质量%至30质量%、或约5质量%至20质量%。
[0132]
除所述盐之外,所述药物层还可以含有添加剂,例如渗透压调节剂和亲水性聚合物。
[0133]
所述药物层中所含的渗透压调节剂没有特别限制,只要它表现出通过半透膜的渗透压梯度即可。实例包括无机盐、无机酸、有机盐、有机酸、糖、糖醇等。无机盐的实例包括氯化钠、碳酸氢钠、碳酸钠、磷酸钠(磷酸三钠)、磷酸钾(磷酸三钾)、磷酸氢钠(磷酸二氢钠,磷酸氢二钠)、磷酸氢钾(磷酸二氢钾,磷酸氢二钾)、氯化钾、氯化锂、硫酸镁、氯化镁、硫酸钾、硫酸钠、亚硫酸氢钠、亚硫酸氢钾、硫酸锂、酸性磷酸钾等。无机酸的实例包括形成上述无机盐的酸。有机盐的实例包括富马酸钠(富马酸二钠)、富马酸氢钠(富马酸一钠)、酒石酸氢钠、酒石酸氢钾、酒石酸钠、酒石酸钾钠、苹果酸钠(苹果酸二钠)、琥珀酸氢钠、琥珀酸钠(琥珀酸二钠)、马来酸氢钠、马来酸钠(马来酸二钠)、柠檬酸氢钠(柠檬酸二氢钠、柠檬酸氢二钠)、柠檬酸钠(柠檬酸三钠)等。有机酸的实例包括形成上述有机盐的酸。糖和糖醇的实例包括甘露糖醇、葡萄糖、乳糖、果糖、蔗糖、山梨糖醇、木糖醇、赤藓糖醇、乳糖等。这些可以是酸酐或溶剂化物(例如水合物)。这些可以单独使用,或两种或更多种组合使用。所述药物层中所含的渗透压调节剂优选含有与化合物(i)的盐共同的离子。例如,当所述盐是富马酸盐时,含有与所述富马酸盐共同的离子的渗透压调节剂的实例包括富马酸、富马酸一钠、富马酸二钠等。所述渗透压调节剂可以单独使用,或两种或更多种组合使用。
[0134]
基于药物层的重量,所述药物层中渗透压调节剂的含量为例如约1质量%至50质量%。所述范围的上限或下限是,例如,2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48或49质量%。例如,所述范围可以是10质量%至38质量%或15质量%至35质量%。
[0135]
所述药物层中所含的亲水性聚合物的实例包括聚环氧乙烷、聚乙二醇等。优选地,所述聚环氧乙烷是低粘度聚环氧乙烷。更具体地,所述聚环氧乙烷优选是平均分子量为约10万至30万的聚环氧乙烷,更优选平均分子量为约15万至25万、或18万至22万的聚氧乙烯醚。优选地,所述聚乙二醇是例如其中平均聚合了约4000至8000、优选约4500至7500、约5000至7000或约5500至6500个环氧乙烷单元的聚乙二醇。为了抑制制剂中药物的再结晶,所述药物层可含有基于纤维素的水溶性聚合物例如甲基纤维素、羟丙基纤维素、羟丙基烷
基纤维素(例如,羟丙基乙基纤维素、羟丙基甲基纤维素、羟丙基丁基纤维素和羟丙基戊基纤维素)、聚乙烯醇、聚乙烯醇/聚乙二醇接枝共聚物、聚乙烯吡咯烷酮、共聚维酮等作为亲水性聚合物。所述羟丙基烷基纤维素特别优选是羟丙基甲基纤维素。所述羟丙基甲基纤维素优选甲氧基含量为例如约16%至30%,更优选约27%至30%。这样的亲水性聚合物可以单独使用,或两种或更多种组合使用。
[0136]
如上所述,本公开的经口药物组合物优选包含含有纤维素水溶性聚合物的含药组合物。因此,所述药物层优选含有基于纤维素的水溶性聚合物作为亲水性聚合物。
[0137]
所述药物层的亲水性聚合物含量为,例如,药物层的约5质量%至94质量%。该范围的上限或下限是,例如,6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50、51、52、53、54、55、55、56、57、58、59、60、61、62、63、64、65、66、和67、68、69、70、71、72、73、74、75、76、77、78、79、80、81、82、83、84、84、85、86、87、88、89、90、91、92或93质量%。例如,该范围可从20质量%至90质量%。
[0138]
当所述含药组合物特别含有基于纤维素的水溶性聚合物时,基于药物层的重量,所述药物层中基于纤维素的水溶性聚合物的含量为例如约5质量%至40质量%、或约10质量%至30质量%、或约10质量%至20质量%。
[0139]
当所述药物层特别是同时含有(i)聚环氧乙烷和(ii)选自羟丙基纤维素、甲基纤维素、羟丙基烷基纤维素、聚乙烯醇、聚乙烯醇-聚乙二醇接枝共聚物、聚乙烯吡咯烷酮和共聚维酮中的至少一种作为亲水性聚合物时,基于药物层的重量,组分(i)的含量可以为10质量%至60质量%,组分(ii)的含量可以为5质量%至40质量%。
[0140]
所述药物层还可含有其它添加剂。这样的添加剂的实例包括润滑剂、流化剂等。优选的润滑剂的实例包括硬脂酸镁。优选的流化剂的实例包括二氧化硅(特别是轻质无水硅酸)。
[0141]
基于药物层的重量,所述药物层含有例如约0.1质量%至5质量%或约0.2质量%至3质量%的量的润滑剂(特别是硬脂酸镁)。基于药物层的重量,所述药物层可以含有例如0.1质量%至5质量%或约0.1质量%至3质量%的量的流化剂(特别是二氧化硅)。
[0142]
所述推动层还包含用于挤出化合物(i)的盐的组分。所述组分的实例包括高溶胀性聚合物。高溶胀性聚合物的实例包括聚环氧烷,更具体地包括聚环氧乙烷。优选地,所述推动层中所含的聚环氧乙烷为高粘度聚环氧乙烷;更具体地是,例如,平均分子量为例如约300万至700万、约400万至700万或约400万至600万的聚环氧乙烷。
[0143]
所述推动层中的高溶胀性聚合物的量可能因药物层中药物的性质和含量等因素而不同;但是,它可以是允许通过溶胀以期望的释放速率从药物层溶出药物的任何量。例如,基于推动层的重量,所述高溶胀性聚合物的含量为50质量%至90质量%、50质量%至85质量%、50质量%至80质量%、55质量%至75质量%、或约60质量%至70质量%。
[0144]
所述推动层也可含有其它添加剂。例如,所述推动层可以含有渗透压调节剂。所述推动层中的渗透压调节剂的实例包括无机盐、无机酸、有机盐、有机酸、糖、糖醇等。无机盐的实例包括氯化钠、碳酸氢钠、碳酸钠、磷酸钠(磷酸三钠)、磷酸氢钠(磷酸二氢钠,磷酸氢二钠)、磷酸氢钾(磷酸二氢钾,磷酸氢二钾)、磷酸钾(磷酸三钾)、氯化钾、氯化锂、硫酸镁、氯化镁、硫酸钾、硫酸钠、亚硫酸氢钠、亚硫酸氢钾、硫酸锂、酸性磷酸钾等。无机酸的实例包
括形成上述无机盐的酸。有机盐的实例包括富马酸钠(富马酸二钠)、富马酸氢钠(富马酸一钠)、酒石酸氢钠、酒石酸氢钾、酒石酸钠、酒石酸钾钠、苹果酸钠(苹果酸二钠)、琥珀酸氢钠、琥珀酸钠(琥珀酸二钠)、马来酸氢钠、马来酸钠(马来酸二钠)、柠檬酸氢钠(柠檬酸二氢钠、柠檬酸氢二钠)、柠檬酸钠(柠檬酸三钠)等。有机酸的实例包括形成上述有机盐的酸。糖和糖醇的实例包括甘露糖醇、葡萄糖、乳糖、果糖、蔗糖、山梨糖醇、木糖醇、赤藓糖醇、乳糖等。这些可以是酸酐或溶剂化物(例如水合物)。
[0145]
所述推动层中所含渗透压调节剂的优选实例包括氯化钠、氯化钾、富马酸氢钠、富马酸钠、碳酸氢钠、碳酸钠、磷酸氢钠、磷酸钠、磷酸氢钾、磷酸钾、硫酸钠、果糖、蔗糖、木糖醇、山梨糖醇、葡萄糖、甘露糖醇、赤藓糖醇和乳糖。特别优选碳酸氢钠。这样的渗透压调节剂可以单独使用,或两种或更多种组合使用。
[0146]
在所述推动层中,基于推动层的重量,所述渗透压调节剂优选以例如5质量%至50质量%、15质量%至50质量%、20质量%至50质量%、25质量%至45质量%或约30质量%至40质量%的量存在。
[0147]
所述推动层还可含有其它添加剂。这样的添加剂的实例包括润滑剂、流化剂、颜料等。优选的润滑剂的实例包括硬脂酸镁。优选的流化剂的实例包括二氧化硅(特别是轻质无水硅酸)。优选的颜料的实例包括氧化铁。
[0148]
基于推动层的重量,所述推动层可以含有例如0.1质量%至5质量%的量的润滑剂(特别是硬脂酸镁)。基于推动层的重量,所述推动层可以含有例如0.1质量%至5质量%或约0.1质量%至3质量%的量的流化剂(特别是二氧化硅)。此外,所述推动层可以含有例如0.1质量%至2质量%的量的颜料(特别是氧化铁)。
[0149]
包衣所述芯制剂的半透膜包含,例如,如上所述的基于纤维素的聚合物,优选乙酸纤维素。所述半透膜也可含有通量调节剂。如上所述,所述通量调节剂优选是例如聚乙二醇(特别是平均分子量为约2000至6000、约3000至5000或约3000至6000的聚乙二醇)。
[0150]
基于半透膜的重量,所述半透膜可以含有例如约70质量%至100质量%、或75质量%至95质量%的纤维素聚合物。基于半透膜的重量,所述半透膜可以含有例如约0.01质量%至30质量%或约5质量%至25质量%的通量调节剂。
[0151]
所述半透膜的包衣量优选是允许高度渗透例如水和生物流体的外部流体、并且基本上不渗透化合物(i)的盐、渗透压调节剂、高溶胀性聚合物等的量。所述半透膜的量例如可以是每100质量份的芯制剂约5质量份至25质量份的量。该范围的上限或下限是,例如,6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23或24质量份。例如,该范围可以是约5质量份至25重量份。
[0152]
在渗透泵型控释系统的经口固体药物制剂中,在芯制剂和半透膜之间可施加水溶性聚合物包衣。换言之,所述制剂可以具有这样的结构,其中水溶性聚合物膜和半透膜依次层叠(优选涂敷进行包衣)在芯制剂上。
[0153]
所述水溶性聚合物膜可含有上述作为可以包含在药物层中的亲水性聚合物的那些,作为水溶性聚合物。在这样的聚合物之中,例如,羟丙基甲基纤维素、聚乙烯醇、聚乙烯醇-聚乙二醇接枝共聚物和聚乙烯吡咯烷酮是优选的。这样的水溶性聚合物可以单独使用,或两种或更多种组合使用。当所述水溶性聚合物膜含有羟丙基甲基纤维素时,例如,所述水溶性聚合物膜的60质量%至100质量%可以是羟丙基甲基纤维素。当所述水溶性聚合物膜
含有聚乙烯吡咯烷酮时,例如,所述水溶性聚合物膜的0质量%至40质量%可以是聚乙烯吡咯烷酮。
[0154]
水溶性聚合物膜可以以例如每100质量份的芯制剂约1质量份至15质量份的量存在。
[0155]
本公开的经口固体药物制剂可以例如作为含有上述组分且没有彩色包衣层的裸片使用。例如,从赋予制剂识别性或长期储存稳定性和防止对光降解的角度来看,优选制备包被彩色包衣层的片剂。如有必要,所述包衣层还可含有通常用于经口施用药品的包衣处理(膜形成)的药品添加剂,例如包衣剂、增塑剂、分散剂和消泡剂。如果提供彩色包衣层,上述彩色包衣层优选为最外层。已知的包衣剂可以用于所述彩色包衣层。例如,代表性的预混添加剂,例如opadry,可以用作包衣剂。优选的包衣剂的实例包括包含羟丙基甲基纤维素、聚乙烯醇、聚乙烯醇-聚乙二醇接枝共聚物、聚乙烯醇-丙烯酸-甲基丙烯酸甲酯共聚物等作为基质材料并且还包含着色剂、润滑剂、增塑剂等的包衣剂。
[0156]
本公开的渗透泵型控释系统的经口固体药物制剂的优选实例是一种包含芯制剂的制剂,所述芯制剂包含药物层和推动层,
[0157]
其中
[0158]
所述药物层包含
[0159]
以游离碱的重量计为5mg至200mg的化合物(i)的盐,
[0160]
基于药物层的重量为5质量%至94质量%的亲水性聚合物(含有基于药物层的重量为5质量%至40质量%的基于纤维素的水溶性聚合物),
[0161]
基于药物层的重量为1质量%至50质量%的渗透压调节剂,
[0162]
基于药物层的重量为0.1质量%至5质量%的润滑剂,和
[0163]
基于药物层的重量为0.1质量%至5质量%的流化剂,
[0164]
所述推动层包含
[0165]
基于推动层的重量为50质量%至90质量%的高溶胀性聚合物,
[0166]
基于推动层的重量为5质量%至50质量%的渗透压调节剂,
[0167]
基于推动层的重量为0.1质量%至5质量%的润滑剂,和
[0168]
基于推动层的重量为0.1质量%至2质量%的颜料,
[0169]
基于100质量份的芯制剂,所述芯制剂包含5质量份至25质量份的半透膜和1质量份至15质量份的水溶性聚合物膜,
[0170]
基于半透膜的重量,所述半透膜包含70质量%至100质量%的基于纤维素的聚合物和0.01质量%至30质量%的水溶性通量调节剂,并且
[0171]
所述制剂任选包含彩色包衣层。
[0172]
如上所述,本公开的经口药物组合物的另一个优选实施方式可以是例如水凝胶持续释放组合物。更具体而,本公开的水凝胶持续释放组合物(水凝胶持续释放制剂)优选含有化合物(i)的富马酸盐作为活性成分,并且还含有基于纤维素的水溶性聚合物。所述水凝胶持续释放组合物优选是例如水凝胶骨架片。水凝胶骨架片是一种已知的技术,其中由水凝胶控制药物的释放,水凝胶是通过(在肠溶包衣片的情况下,由于胃排泄后ph升高导致包衣膜溶解,于是)吸收胃肠道中的水分而形成的。
[0173]
作为所述水凝胶骨架片中的持续释放基质(水凝胶形成基质),例如,可以使用上
述亲水性聚合物。可用的基质的具体实例包括基于纤维素的水溶性聚合物、聚环氧烷(例如聚环氧乙烷)、聚烷撑二醇(例如聚乙二醇)、聚乙烯醇等。作为持续释放基质材料,上述亲水性聚合物可以单独使用,或两种或更多种组合使用。特别优选所述持续释放基质材料含有至少一种基于纤维素的水溶性聚合物。当主要使用基于纤维素的水溶性聚合物以外的亲水性聚合物(例如聚环氧乙烷)作为持续释放基质时,所述亲水性聚合物优选与至少一种基于纤维素的水溶性聚合物组合。
[0174]
作为基于纤维素的水溶性聚合物,可以优选使用例如制药领域中已知的基于纤维素的水溶性聚合物。优选的实例包括其结构中纤维素的一部分oh基中的氢原子被甲基和/或羟丙基置换的基于纤维素的水溶性聚合物。具体实例包括羟丙基甲基纤维素、羟丙基纤维素、甲基纤维素等。基于纤维素的水溶性聚合物可以单独使用,或两种或更多种组合使用。
[0175]
所述基于纤维素的水溶性聚合物可以是任何基于纤维素的水溶性聚合物。例如,可以使用以2%水溶液形式测得的粘度为2.5mm2/s至35000mm2/s的纤维素水溶性聚合物。特别优选使用粘度为2.5mm2/s至17.5mm2/s的基于纤维素的水溶性聚合物。
[0176]
当基于纤维素的水溶性聚合物(例如羟丙甲纤维素)主要用作持续释放基质时,所述基于纤维素的水溶性聚合物以2%水溶液形式测量,粘度为80mm2/s至35000mm2/s。本文中“主要”使用亲水性聚合物的短语是指基于持续释放基质的总质量,亲水性聚合物的量为50质量%或更多,例如,80质量%或更多、或90质量%或更多。
[0177]
基于片芯的重量,所述片芯可以含有例如约30质量%至90质量%、或约50质量%至80质量%的量的持续释放基质。
[0178]
所述水凝胶骨架片还可以含有其它添加剂。这样的添加剂的实例包括水合促进剂、润滑剂、流化剂等。
[0179]
所述水合促进剂的实例包括无机盐、无机酸、有机盐、有机酸、糖、糖醇等。无机盐的实例包括氯化钠、碳酸氢钠、碳酸钠、磷酸钠(磷酸三钠)、磷酸钾(磷酸三钾)、磷酸氢钠(磷酸二氢钠,磷酸氢二钠)、磷酸氢钾(磷酸二氢钾,磷酸氢二钾)、氯化钾、氯化锂、硫酸镁、氯化镁、硫酸钾、硫酸钠、亚硫酸氢钠、亚硫酸氢钾、硫酸锂、酸性磷酸钾等。无机酸的实例包括形成上述无机盐的酸。有机盐的实例包括富马酸钠(富马酸二钠)、富马酸氢钠(富马酸一钠)、酒石酸氢钠、酒石酸氢钾、酒石酸钠、酒石酸钾钠、苹果酸钠(苹果酸二钠)、琥珀酸氢钠、琥珀酸钠(琥珀酸二钠)、马来酸氢钠、马来酸钠(马来酸二钠)、柠檬酸氢钠(柠檬酸二氢钠、柠檬酸氢二钠)、柠檬酸钠(柠檬酸三钠)等。有机酸的实例包括形成上述有机盐的酸。糖和糖醇的实例包括甘露糖醇、葡萄糖、乳糖、果糖、蔗糖、山梨糖醇、木糖醇、赤藓糖醇、乳糖等。这些可以是酸酐或溶剂化物(例如水合物)。这些可以单独使用,或两种或更多种组合使用。所述水合促进剂优选是含有与化合物(i)的富马酸盐共同的离子的化合物。实例包括富马酸、富马酸一钠、富马酸二钠等。基于片芯的重量,所述水合促进剂优选含有例如约1质量%至50质量%、或约10质量%至30质量%的量的水合促进剂。
[0180]
优选的润滑剂的实例包括硬脂酸镁。基于片芯的重量,所述水凝胶骨架片可以含有例如约0.1质量%至5质量%、或约0.2质量%至3质量%的量的润滑剂。优选的流化剂的实例包括二氧化硅(特别是轻质无水硅酸)。基于片芯的质量,所述水凝胶骨架片可以含有例如约0.1质量%至5质量%、或约0.1质量%至3质量%的量的流化剂。
[0181]
所述水凝胶骨架片更优选包含肠溶包衣。肠溶包衣可以使用已知的肠溶包衣组合物。例如,可以优选使用含有eudragit等的肠溶基质、柠檬酸三乙酯等的增塑剂、和滑石粉等的润滑剂的肠溶包衣组合物。所述水凝胶骨架片可以优选以例如每100质量份的片芯约1质量份至40质量份、或约10质量份至30质量份的量含有肠溶包衣。
[0182]
本公开的水凝胶持续释放制剂的优选实例是如下所述的制剂,其含有以游离碱的重量计5mg至200mg的化合物(i)的富马酸盐;还含有基于片芯的重量为30质量%至90质量%的持续释放基质材料、基于片芯的重量为1质量%至50质量%的水合促进剂和基于片芯的重量为0.1质量%至5质量%的润滑剂;并且还包含基于100质量份芯制剂为1质量份至40质量份的量的肠溶包衣。
[0183]
在本说明书中,术语“包括”包括“基本上由
……
组成”和“由
……
组成”。此外,本公开包括本文描述的构成要素的任何和所有组合。
[0184]
在本公开的上述实施方式中描述的各种特性(性质、结构、功能等)可以任何方式组合,来指定本公开所包括的主题。也就是说,本公开包括包含本文所述的可组合性质的任何组合的所有主题。
[0185]
实施例
[0186]
下面参照实施例、试验例等对本发明进行更具体的说明。然而,本公开不限于这些示例。化合物(i)是指7-[4-(4-苯并[b]噻吩-4-基-哌嗪-1-基)丁氧基]-1h-喹啉-2-酮。
[0187]
7-[4-(4-苯并[b]噻吩-4-基-哌嗪-1-基)丁氧基]-1h-喹啉-2-酮富马酸盐的制备
[0188]
将4.22kg富马酸在32.5l水中和22.16kg乙醇中的悬浮液在回流下搅拌以溶解富马酸(回流温度:约82℃)。将得到的溶液在用11.86kg乙醇洗涤的同时过滤,得到富马酸溶液。将15.0kg的7-[4-(4-苯并[b]噻吩-4-基-哌嗪-1-基)丁氧基]-1h-喹啉-2-酮在25.96kg水、8.32kg乙酸和34.0l乙醇中的悬浮液在回流下搅拌以溶解7-[4-(4-苯并[b]噻吩-4-基-哌嗪-1-基)丁氧基]-1h-喹啉-2-酮(回流温度:约83℃)。将得到的溶液添加到富马酸溶液中,然后在用11.86kg乙醇洗涤的同时过滤。将滤液在回流下搅拌15分钟(回流温度:约82℃),然后冷却至30℃以下,进行固液分离。得到的固体用水洗涤,80℃干燥,然后加湿,得到16.86kg的7-[4-(4-苯并[b]噻吩-4-基-哌嗪-1-基)丁氧基]-1h-喹啉-2-酮富马酸盐。
[0189]
红外吸收光谱
[0190]
上述方法制备的富马酸盐的ir光谱使用由岛津制作所社制造的傅里叶变换红外分光光度计(irprestige-21),通过kbr片剂法测量。如图4a所示,红外光谱显示出在波数3657cm-1
、1711cm-1
、1643cm-1
、1416cm-1
、1227cm-1
和839cm-1
处的吸收。
[0191]
粉末x射线衍射
[0192]
上述方法制备的富马酸盐的粉末x射线衍射使用由bruker axs制造的x射线衍射仪(d8 advance)进行测量。图4b显示了富马酸盐的粉末x射线衍射图谱。如图4b所示,在2θ=7.6
°
、15.1
°
、17.7
°
、18.9
°
和19.2
°
处观察到衍射峰。在2θ=9.8
°
、11.3
°
、12.2
°
、14.0
°
、16.5
°
、17.0
°
、21.2
°
、22.3
°
、22.7
°
、23.8
°
、24.2
°
、24.7
°
、25.4
°
、26.5
°
、26.9
°
、27.9
°
、28.9
°
、31.9
°
、32.3
°
、32.6
°
和34.2
°
处观察到其它峰。
[0193]
含水量测量
[0194]
测量所制备的富马酸盐的含水量。具体而言,使用metrohm制造的含水量测量装置(titrando 852),通过karl fischer法(库仑滴定法)测量含水量。结果确认所述富马酸盐
的含水量为3.01重量%。
[0195]
药物持续释放制剂的制备以及评价1
[0196]
根据已知的一般制备方法制备包含双层压缩芯的渗透泵型控释组合物(制剂),所述双层压缩芯包含用于提供化合物(i)的盐的持续释放的药物层以及推动层。更具体地,分别制造含有化合物(i)的盐和其它惰性剂的药物层组合物、以及含有渗透剂和高粘性聚合物的推动层组合物;然后利用已知的芯压缩技术将各组合物压缩成双层片芯。
[0197]
随后,用包含水溶性聚合物的组合物包衣所述双层压缩芯。作为水溶性聚合物的组合物,将羟丙甲纤维素(羟丙基甲基纤维素;tc-5,信越化学工业株式会社制造)和聚维酮(聚乙烯吡咯烷酮;kollidon k30,basf)(70:30(w/w%))溶解在水中至以固体含量计为8%,制备包衣溶液。使用锅包衣机将该水溶性聚合物包衣溶液包衣在如上制备的双层压缩芯上,直到所述包衣组分占双层压缩芯质量的10%。
[0198]
进一步地,用半透膜组合物包衣所得到的水溶性包衣双层压缩芯。作为半透膜组合物,将乙酸纤维素和聚乙二醇4000(85:15(w/w%))在作为溶剂的丙酮/水(95:5(w/w%))中溶解至以固体含量计为5%(95:5(w/w%)),从而得到包衣溶液。使用锅包衣机将该包衣溶液包衣在如上制造的水溶性包衣双层压缩芯上,直到所述包衣组分占双层压缩芯质量的10%。将包衣的芯从锅包衣机中取出,然后使用架式干燥机在40℃下进行24小时的干燥处理。
[0199]
使用自动激光器在如此包衣的双层压缩芯的药物层侧表面上提供直径为0.8mm的药物释放口以制备渗透泵型制剂。
[0200]
下面的表1a和表1b显示了渗透泵型制剂的组分。
[0201]
表1a
[0202][0203]
表1b
[0204][0205]
对实施例中获得的制剂进行以下试验例1,并进行评价。
[0206]
作为低粘度聚环氧乙烷,使用polyox(商标)wsr n-80(平均分子量:约200000,粘度:55至90mpa
·
s(5%w/v水溶液,25℃))。作为高密度聚环氧乙烷,使用polyox(注册商标)wsr coagulant(平均分子量:5000000,粘度:5500至7500mpa
·
s(1%w/v水溶液,25℃))。
[0207]
试验例1:过饱和溶出浓度曲线的测量
[0208]
通过在18或24小时内以1或2小时的间隔测量化合物(i)的每种盐的溶出度来评价实施例中获得的制剂的释放速率。所述溶出试验按照第15版日本药典溶出试验第二法(桨法)进行。作为试验液,使用日本药典中收录的溶出试验第二液(ph约7,磷酸二氢钾,磷酸氢二钠)900ml,并在37℃和50rpm的桨转速下进行所述试验。随时间进行取样,用uv检测器(吸光度测量波长:323nm和380nm)来定量所述取样溶液中的化合物(i)(游离碱)。第一波长(323nm)设置为可以检测到主药吸最大光度的波长,第二波长(380nm)设置为检测不到主药吸光度的波长。图中,溶解的(μg/ml)表示溶出(溶解)的化合物(i)(游离碱)的浓度。
[0209]
在试验例1中,溶出液的ph约为7。在试验例1中评价的溶出试验的结果表明了所述经口药物组合物被经口施用并通过胃后,化合物(i)的盐在胃肠道下部的溶出水平。在试验例1中,观察到以下现象:由于化合物(i)的盐的溶解度高于化合物(i)的溶解度,因此来自所述制剂中的化合物(i)的盐的溶出浓度一度超过化合物(i)的溶解度而呈过饱和浓度,然后随化合物(i)的重结晶,所述溶出浓度降低。在那时获得的曲线被定义为过饱和溶出曲线,并且可以作为胃肠道下部吸收性的指标进行评价。
[0210]
各例中得到的制剂的试验例1结果如图1(a)或图1(b)所示。与比较例的制剂(含有游离碱的化合物(i)的制剂)相比,实施例的制剂(含有化合物(i)的富马酸盐的制剂)显示出优异的过饱和溶出曲线。
[0211]
药物持续释放制剂的制备以及评价2
[0212]
进行了研究以开发表现出优异的过饱和溶出曲线的经口药物组合物。结果发现,当通过化合物(i)的富马酸盐与水溶性聚合物的组合制备含药物的组合物时,该组合物可能表现出特别优异的过饱和溶出曲线。因此,将化合物(i)的富马酸盐与各种水溶性聚合物组合;并使用这些组合,按照表2所示的组成以与上述相同的方式制备渗透泵型制剂。表2中,metolose sm-4是甲基纤维素,hpc-sl为羟丙基纤维素,pvp kollidon25是聚乙烯吡咯烷酮,kollicoat ir是聚乙烯醇-聚乙二醇接枝共聚物。
[0213]
表2
[0214][0215][0216]
本实施例中获得的各制剂的过饱和溶出曲线也以与上述试验例1相同的方式确定。图2a显示了结果。本实施例中获得的所有制剂均显示出优于实施例1-1制剂的过饱和溶出曲线的过饱和溶出曲线(特别是峰值更高)。此外,特别是在使用基于纤维素的水溶性聚合物的实施例中,过饱和溶出曲线的峰值比较高,因此优选使用基于纤维素的水溶性聚合物。
[0217]
此外,这些制剂的释放速率如下述试验例2进行研究。
[0218]
试验例2:释放速率的测量
[0219]
通过在24小时内以30分钟至2小时的间隔测量化合物(i)的盐的溶出度来评价各
实施例或比较例的制剂的释放速率。所述溶出试验按照第15版日本药典溶出试验第二法(桨法)进行。作为试验液,使用900ml乙酸缓冲液(ph约4.3,乙酸,乙酸钠),在37℃和桨转速50rpm下进行试验。随时间进行取样,用uv检测器(吸光度测量波长:323nm和380nm)来定量所述取样溶液中的化合物(i)(游离碱)。将溶出的(溶解的)化合物(i)(游离碱)相对于制剂中所含的化合物(i)(游离碱)的总量(质量)作为100%的质量比(%)定义为溶出度。当将制剂中所含的化合物(i)的盐的总量(质量)作为100%时,溶出度值与化合物(i)的溶出(溶解)盐的质量比(%)相同。因此,该值也可以用作化合物(i)的盐的溶出度。在显示所述结果的图中,溶解(%)表示溶出度。
[0220]
在试验例2中,溶出液的ph为约4.3。试验例2中的溶出试验的评价结果是经口施用所述经口药物组合物后化合物(i)的盐将在整个胃肠道中溶解的程度的指标。所述经口药物组合物的持续释放时间可以从获得的曲线来评价。
[0221]
图2b显示了结果。图2b显示本实施例中获得的所有制剂都具有优异的持续释放性。
[0222]
药物持续释放制剂的制备以及评价3
[0223]
根据表3所示的组成制备水凝胶持续释放制剂(水凝胶骨架片)。更具体地说,将所述组分混合并进行流化床制粒,然后压缩成水凝胶骨架片(无包衣片剂)。水凝胶骨架片是一种已知技术,其中由水凝胶控制药物的释放,水凝胶是通过(在肠溶包衣片的情况下,由于胃排泄后ph升高导致包衣膜溶解,于是)吸收胃肠道中的水分而形成的。在表3所示的实施例3-1的组合物中,使用聚环氧乙烷和羟丙甲纤维素作为持续释放基质(水凝胶形成基质);在比较例3-2组合物中,使用聚环氧乙烷作为持续释放基质(水凝胶形成基质)。
[0224]
表3
[0225]
制剂(mg/单位)实施例3-1比较例3-2化合物(i)的富马酸盐39.2739.27聚环氧乙烷99.73119.73富马酸氢钠
‑‑
羟丙甲纤维素tc-5r20.00-硬脂酸镁1.001.00总计160.00160.00
[0226]
还以与上述试验例1中相同的方式测量每种获得的制剂的过饱和溶出曲线。图3显示了结果。实施例的制剂比比较例的制剂具有更好的过饱和溶出曲线。
[0227]
渗透泵型制剂的制剂例
[0228]
表4显示了含有本公开的经口药物组合物的渗透泵制剂的制剂例。表4中,药物层和推动层的组分量以质量份数表示,而包衣层的组分量以基于100质量份的芯部分的质量份数表示。“芯部分”在此是指包含药物层和推动层的组合的部分。
[0229][0230]
人经口施用后化合物(i)的血液浓度评价
[0231]
基于以下单剂施用方案和多剂施用方案评价人经口施用本公开的经口药物组合
物后,化合物(i)的稳态血液浓度。本评价所用制剂(试验制剂)是本公开制备的渗透泵型制剂,其含有化合物(i)的富马酸盐作为活性成分。下表所示片剂的剂量和含量均以游离碱、即化合物(i)的重量计。在单剂施用方案中,24mg试验制剂(1片24mg片剂)空腹施用一次。然后,在洗脱期后,将48mg试验制剂(两片24mg片剂)空腹施用一次。在多剂施用方案中,试验制剂通过以下施用方法1至5中任一种空腹反复施用。在每个方案中,分析化合物(i)的pk参数。观察结果显示,作为每周施用一次的药物,所述制剂维持化合物(i)的理想的稳态血液浓度(例如,15ng/ml至400ng/ml)。
[0232]
表5
[0233]
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。