检测目标抗-carp抗体的均相免疫检测试剂套装及其应用
1.本技术为申请号为201810142718.2、申请日为2018年02月11日、发明名称为“检测目标抗-carp抗体的均相免疫检测试剂盒及其应用”的分案申请。
技术领域
2.本发明属于免疫分析技术领域,具体涉及一种检测目标抗-carp抗体的均相免疫检测试剂盒及其制备方法和使用方法。
背景技术:
3.抗氨甲酰化蛋白抗体(anti-carbamylated protein antibody,anti-carp ab)是最近几年发现的与类风湿性关节炎(rheumatoid arthritis,ra)疾病诊断和病程监控的密切相关的一个新的生物标志物。氨甲酰化是一种非酶介导的蛋白质翻译后修饰方式,其具体过程是蛋白质的赖氨酸残基在尿素的衍生物一氰酸酯或氰酸盐的作用下转变成高瓜氨酸残基。该过程能打破人体免疫耐受并诱导自身免疫抗体抗-carp抗体(anti-carp ab)的产生。
4.专利wo2012/105838a1及wo2016/014612a2中公开的anti-carp ab的检测方法分别为以氨甲酰化胎牛血清(car-fcs)和氨甲酰化人类α1抗胰蛋白酶(car-halat)作为抗原,采用免疫印迹法(immunoblotting)及酶联免疫吸附法(elisa)进行测定。
5.专利wo2012/105838a1中的检测方法存在的缺陷是:1、人体内的anti-carp ab是针对自身体内氨甲酰化蛋白所产生的抗体,而氨甲酰化胎牛血清(car-fcs)作为动物源性的抗原,与人体自身氨甲酰化蛋白所具有的抗原表位并不完全相同;2、氨甲酰化胎牛血清中包含大量可与人类血清样本中anti-carp ab抗体及其他免疫球蛋白非特异性相互作用的蛋白质及其它复杂组分,导致实验的背景值高,从而对结果分析产生干扰;3、氨甲酰化胎牛血清难以重复制备,存在着批间差异,可能会对实验结果复现性产生影响;4、检测的anti-carp ab的亚型仅为iga和igg、并未对igm和igd型抗体进行检测;5、采用免疫印迹法(immunoblotting)进行检测时实验步骤较为复杂、不同检测机构的实验操作标准不一、耗时长、不能实现全自动高通量分析及采用动物血清作为二抗进行检测时在印迹膜上产生的非特异性检测条带对实验结果的干扰。
6.专利wo2016/014612a2中的检测方法存在的缺陷是采用的是elisa间接法对anti-carp ab进行检测,检测背景值较高、灵敏度较低、线性范围窄、易产生假阳性的实验结果;同时针对检测不同亚型的抗体,需要采用相应的酶标二抗进行检测,实验操作较为繁琐。同时在检测过程中为避免样本中非特异性的免疫球蛋白g(immunoglobulin g,igg)(非特异性igg是指除抗氨甲酰化蛋白抗体之外的其它igg)对测试结果产生的干扰,需要增大酶标二抗的加入量,且在反应完成后进行洗涤以除去结合了其它非特异性igg酶标二抗。
7.此外,以上两种方法还存在共同的缺陷是,两者检测手段均为非均相反应体系,相较于均相反应体系,其选择性、灵敏性,及反应速度等均不及后者。
8.因此,为了克服现有检测技术中存在的上述缺陷,需要研究开发出一种抗原特异
性强、信号放大效果好、灵敏度高、免清洗、线性范围宽、操作简单、测试更稳定的用于检测anti-carp ab的均相免疫试剂盒。
技术实现要素:
9.本发明所要解决的技术问题是针对现有技术的不足提供一种检测目标抗-carp抗体的均相免疫检测试剂盒及其应用,该试剂盒采用竞争法反应模式,该反应模式能特异性检测出igg、iga、igm等anti-carp ab,并省略传统间接法中需要洗涤的过程。其与传统间接法相比的既省时又免清洗,操作简便。
10.为此,本发明第一方面提供了一种用于检测目标抗-carp抗体的均相免疫检测试剂套装,其包括:
11.组分a,其包含能够与目标抗-carp抗体和第二抗-carp抗体特异性结合的抗原;
12.组分b,其包含第二抗-carp抗体。
13.本发明中,所述抗原或所述第二抗-carp抗体与受体相结合;所述受体能够与单线态氧反应生成可检测的化学发光信号。
14.在本发明的一些优选的实施例中,所述抗原与受体相结合。
15.在本发明的一些实施例中,所述受体包含烯烃化合物和金属螯合物,其为非粒子形式,且在含水介质中可溶;和/或,所述受体为填充有发光化合物和镧系元素的高分子微粒。
16.根据本发明,所述试剂套装还包含组分c,其包含能够在激发状态产生单线态氧的供体。
17.在本发明的一些实施例中,所述供体与特异性结合配对物中的一员结合,而特异性结合配对物中的另一员与所述抗原或所述第二抗-carp抗体相结合。
18.在本发明的一些具体优选的实施例中,所述供体与链霉亲和素结合,相应地抗原或所述第二抗-carp抗体与生物素结合。
19.在本发明的一些实施例中,所述供体为光活化的或化学活化的敏化剂,其为非粒子形式,且在含水介质中可溶;和/或,所述供体为填充有感光化合物的高分子微粒,在光激发下能够产生单线态氧。
20.在本发明的一些实施方式中,所述第二抗-carp抗体为多克隆抗体和/或单克隆抗体。
21.在本发明的一些优选的实施方式中,所述第二抗-carp抗体为单克隆抗体。
22.在本发明的一些实施方式中,所述抗原选自合成的氨甲酰化肽段、由至少2个单一氨甲酰化肽段合成在一条肽链上形成的多肽、含有至少2个单一氨甲酰化肽段的氨甲酰化肽段混合物和氨甲酰化蛋白。
23.在本发明的一些优选的实施方式中,所述抗原选自合成的氨甲酰化肽段、由至少2个单一氨甲酰化肽段合成在一条肽链上形成的多肽和含有至少2个单一氨甲酰化肽段的氨甲酰化肽段混合物。
24.在本发明的一些优选的实施例中,所述抗原为由2-4个氨甲酰化肽段合成在一条肽链上形成的多肽或含有2-4单一氨甲酰化肽段的氨甲酰化肽段混合物;优选所述氨甲酰化肽段选自seq id no.2-5。
25.在本发明的一些进一步优选的实施方式中,所述抗原通过中间体与受体相结合,所述中间体为亲水性高分子物质。
26.在本发明的一些优选的实施例中,所述中间体为蛋白质,优选选自血蓝蛋白、卵清蛋白、牛血清白蛋白或牛甲状腺球蛋白。
27.在本发明的另一些优选的实施例中,所述中间体选自树枝状大分子、聚羧酸酯、聚巯基和聚乙二醇。
28.在本发明的一些实施例中,所述抗原以及与之结合的受体的总浓度为0.005-0.1μg/ml。
29.在本发明的一些实施例中,所述第二抗-carp抗体以及与之结合的特异性结合配对物中的一员总的浓度为0.025-0.1μg/ml。
30.在本发明的一些实施例中,所述供体以及与之结合的特异性结合配对物中的另一员的总浓度为5-20μg/ml。
31.本发明第二方面提供了一种用于检测目标抗-carp抗体的均相免疫检测试剂盒,其包含本发明第一方面所述的均相免疫检测试剂套装。
32.本发明第三方面提供了一种如本发明第一方面提供的均相免疫检测试剂套装或如本发明第二方面提供的均相免疫检测试剂盒用于检测待测样本中目标抗-carp抗体的免疫测定方法,其包括如下步骤:
33.m1,使第二抗-carp抗体和待测样本中的目标抗-carp抗体竞争与抗原的表位结合,分别通过抗原表位与抗原形成由抗原-第二抗-carp抗体构成的第一免疫复合物和由抗原-抗-carp抗体构成的第二免疫复合物;
34.m2,检测第二免疫复合物是否存在;如果第二免疫复合物存在,则表明待测样本中存在抗-carp抗体。
35.根据本发明的一些实施方式,所述步骤m1包括将第二抗-carp抗体、待测样本和抗原混合均匀,反应,使第二抗-carp抗体和待测样本中的目标抗-carp抗体竞争与抗原的表位结合,分别通过抗原表位与抗原形成由抗原-第二抗-carp抗体构成的第一免疫复合物和由抗原-目标抗-carp抗体构成的第二免疫复合物。
36.在本发明的一些实施例中,将第二抗-carp抗体、待测样本和抗原混合均匀的步骤包括将第二抗-carp抗体、待测样本和抗原同时混合均匀。
37.在本发明的另一些实施例中,将第二抗-carp抗体、待测样本和抗原混合均匀的步骤包括先将第二抗-carp抗体与待测样本混合形成第1混合物,再将抗原与第1混合物混合。
38.根据本发明的另一些实施方式,所述步骤m1包括以下步骤:
39.p1,将抗原与待测样本混合,反应,使待测样本中的目标抗-carp与抗原的表位结合形成由抗原-目标抗-carp抗体构成的第二免疫复合物,获得第11混合物;
40.p2,将第二抗-carp抗体与第11混合物混合,反应,使第二抗-carp抗体与第11混合物中的未与待测样本中的目标抗-carp结合的抗原的表位结合,形成由抗原-第二抗-carp抗体构成的第一免疫复合物。
41.根据本发明方法,步骤m2中通过化学发光的方法检测第二免疫复合物是否存在。
42.在本发明的一些实施例中,步骤m2包括将第1混合物的化学发光信号值与由与步骤m1中等量的抗原和第二抗-carp抗体形成的对照免疫复合物的化学发光信号值进行比
较,由此判断第二免疫复合物是否存在。
43.在本发明的一些具体实施例中,所述抗原与受体结合,所述第二抗-carp抗体与生物素结合,所述受体能够与单线态氧反应生成可检测的化学发光信号。
44.根据本发明的又一些实施方式,在步骤m1之前还包括步骤m0,利用样品稀释液按照1:(4-20)的体积比稀释待测样本;优选地,利用样品稀释液按照1:(6-16)的体积比稀释待测样本;更优选地,利用样品稀释液按照1:(8-12)的体积比稀释待测样本。
45.在本发明的一些具体的实施例中,所述方法包括所述方法包括如下步骤:
46.r1,将与生物素结合的第二抗-carp抗体同待测样本混合形成第2混合物;
47.r2,将结合有受体的抗原与第2混合物混合,使与生物素结合的第二抗-carp抗体和待测样本中的目标抗-carp抗体竞争与结合有受体的抗原的表位结合,分别通过抗原表位与结合有受体的抗原形成由受体-抗原-第二抗-carp抗体-生物素构成的第三免疫复合物和由受体-抗原-抗-carp抗体构成的第四免疫复合物,从而形成第3混合物;
48.r3,将与链霉亲和素结合的供体与第3混合物混合,使与链霉亲和素结合的供体与第三免疫复合物中的生物素结合,形成由受体-抗原-第二抗-carp抗体-生物素-链霉亲和素-供体所构成的第五免疫复合物,从而形成第4混合物;
49.r4,用能量或者活性化合物激发供体产生单线态氧,所述受体与单线态氧反应生成可检测的化学发光信号;检测第四免疫复合物是否存在;如果第四免疫复合物存在,则待测样本中存在目标抗-carp抗体。
50.在本发明的一些实施例中,所述方法还包括在步骤r1之前制作目标抗-carp抗体标准工作曲线的步骤。
51.在本发明的一些实施例中,在步骤r4,检测所述化学发光信号的强度,并基于抗-carp抗体标准工作曲线来确定待测样品中抗-carp抗体的含量。
52.在本发明的一些实施例中,利用600-700nm波长的激发光照射第4混合物,激发第五免疫复合物中的供体产生单线态氧,受体与接触到的单线态氧反应生成520-620nm的发射光,检测第4混合物的发射光的信号值,并将其与步骤r2中等量的抗原和第二抗-carp抗体形成的对照免疫复合物的化学发光信号值进行比较,由此判断测待测样本中是否存在抗-carp抗体和/或抗-carp抗体的浓度。
53.在本发明的一些具体的实施例中,所述方法包括所述方法包括如下步骤:
54.t1,将结合有受体的抗原与待测样本混合,反应,使待测样本中的目标抗-carp与结合有受体的抗原的表位结合形成由受体-抗原-抗-carp抗体构成的第四免疫复合物,获得第12混合物;
55.t2,将与生物素结合的第二抗-carp抗体与第12混合物混合,反应,使与生物素结合的第二抗-carp抗体竞争与第12混合物中的未结合待测样本中的抗-carp的结合有受体的抗原的表位结合,形成由结合有受体的抗原-第二抗-carp抗体-生物素构成的第三免疫复合物,从而形成第13混合物;
56.t3,将与链霉亲和素结合的供体与第13混合物混合,使与链霉亲和素结合的供体与第三免疫复合物中的生物素结合,形成由受体-抗原-第二抗-carp抗体-生物素-链霉亲和素-供体所构成的第五免疫复合物,从而形成第14混合物;
57.t4,用能量或者活性化合物激发供体产生单线态氧,所述受体与单线态氧反应生
成可检测的化学发光信号;检测第四免疫复合物是否存在;如果第四免疫复合物存在,则待测样本中存在抗-carp抗体。
58.在本发明的一些实施例中,所述方法还包括在步骤t1之前制作目标抗-carp抗体标准工作曲线的步骤。
59.在本发明的一些实施例中,在步骤t4,检测所述化学发光信号的强度,并基于抗-carp抗体标准工作曲线来确定待测样品中抗-carp抗体的含量。
60.在本发明的一些实施例中,利用600-700nm波长的激发光照射第14混合物,激发第五免疫复合物中的供体产生单线态氧,受体与接触到的单线态氧反应生成520-620nm的发射光,检测第14混合物的发射光的信号值,并将其与步骤t1中等量的抗原和步骤t2中等量的第二抗-carp抗体形成的对照免疫复合物的化学发光信号值进行比较,由此判断测待测样本中是否存在抗-carp抗体和/或抗-carp抗体的浓度。
61.本发明第四方面提供了一种如本发明第一方面所述的均相免疫检测试剂套装或如本发明第二方面所述的均相免疫检测试剂盒或如本发明第三方面所述的方法在检测待测样品中目标抗-carp抗体的存在和/或含量中的应用,其中,所述待测样品选自血液、血液衍生物、血清、血浆、尿液、脑脊髓液、唾液、滑液和肺气肿积液。
62.本发明第五方面提供了一种如本发明第一方面所述的试剂套装在制备用于检测怀疑患有类风湿性关节炎的受治疗者的待测样品中的目标抗-carp抗体,由此确定所述待测样品中目标抗-carp抗体的水平,并将因此确定的水平与受治疗者的类风湿性关节炎的存在、风险、潜在性或倾向性相关联的试剂盒中的应用。
63.本发明的有益效果:
64.1)该试剂盒所采用的检测技术为均相免疫分析法,相较于现有的非均相反应体系检测方法,存在着无需清洗、包被/标记工艺对抗原抗体的活性无影响、特异性高、灵敏度好、线性范围宽、背景干扰小、反应速度快、操作简便、技术要求不高等优点,并可实现全自动化高通量测试。
65.2)在本技术中,意外的发现,采用氨甲酰化人血清白蛋白作为抗原,相较于氨甲酰化胎牛血清,其在抗原特异性、抗原纯度、批间差异上存在着明显优势。即以人自身性氨甲酰化蛋白作为抗原的特异性更强,明显提高了人血清/血浆样本中的anti-carp ab的检出率。而且,选用的人血清白蛋白为纯化后产物,其纯度》95%,不会与人血清/血浆样本中的其它物质发生非特异性相互作用,检测受到的干扰小。此外,人血清白蛋白的提取和纯化工艺成熟可靠,批间差异小,能稳定获得。
66.3)本发明方法能特异性检测出igg、iga、igm等anti-carp ab,并省略传统间接法中需要洗涤的过程。与传统间接法相比既省时又免清洗步骤的复杂繁琐的工艺。
附图说明
67.为使本发明容易理解,下面结合附图来说明本发明。
68.图1示出采用本发明中的一步法竞争法对样本进行抗-carp抗体的均相免疫检测时,阳性结果和阴性结果的分布对比。
69.图2示出采用本发明中的二步法竞争法对样本进行抗-carp抗体的均相免疫检测时,阳性结果和阴性结果的分布对比。
70.图3示出采用实施例1制备的试剂盒进行临床血清样本测试时anti-carp ab诊断水平升高为ra疾病的受试者工作特征曲线(roc)。
71.图4示出采用实施例1制备的试剂盒进行临床血清样本测试时,非ra患者和ra患者体内anti-carp ab含量的分布对比。
72.图5示出采用实施例2制备的试剂盒进行临床血清样本测试时anti-carp ab诊断水平升高为ra疾病的受试者工作特征曲线(roc)。
73.图6示出采用实施例2制备的试剂盒进行临床血清样本测试时,非ra患者和ra患者体内anti-carp ab含量的分布对比。
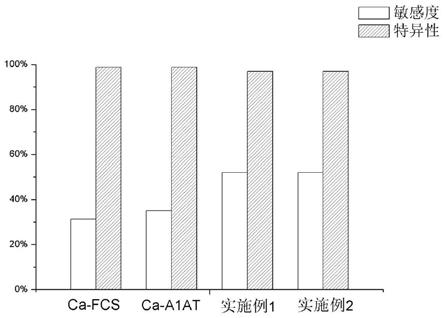
74.图7示出对比例中采用实施例1和实施例2制备的试剂盒进行临床血清样本测试时与专利wo2012/105838a1、专利wo2016/014612a2中anti-carp ab的检测方法用于ra诊断的敏感度和特异性进行对比。
具体实施方式
75.为使本发明容易理解,下面将详细说明本发明。但在详细描述本发明前,应当理解本发明不限于描述的具体实施方式。还应当理解,本文中使用的术语仅为了描述具体实施方式,而并不表示限制性的。
76.在提供了数值范围的情况下,应当理解所述范围的上限和下限和所述规定范围中的任何其他规定或居间数值之间的每个居间数值均涵盖在本发明内。这些较小范围的上限和下限可以独立包括在较小的范围中,并且也涵盖在本发明内,服从规定范围中任何明确排除的限度。在规定的范围包含一个或两个限度的情况下,排除那些包括的限度之任一或两者的范围也包含在本发明中。
77.除非另有定义,本文中使用的所有术语与本发明所属领域的普通技术人员的通常理解具有相同的意义。虽然与本文中描述的方法和材料类似或等同的任何方法和材料也可以在本发明的实施或测试中使用,但是现在描述了优选的方法和材料。
[0078]ⅰ、术语
[0079]“待测主体”、“受治疗者”和“患者”可互换使用,在没有特别说明或限定的情况下,是指哺乳动物,诸如人和非人灵长类、以及兔、大鼠、小鼠、山羊、猪和其它哺动物物种。
[0080]
本发明所述用语“均相”所对应的英文定义为“homogeneous”,其是指无须对结合的抗原抗体复合物和剩余的游离抗原或抗体进行分离既可进行检测。
[0081]
本发明所述用语“待测样本”是指可能含有被分析物的一种混合物,被分析物包括但不限于蛋白质、激素、抗体或抗原。可以被用在本发明公开的方法中的典型待测样本包括体液,如血液、血液衍生物、血清、血浆、尿液、脑脊髓液、唾液、滑液和肺气肿积液等。待测样本可以是在使用前根据需要利用稀释液或缓冲溶液对可能含有被分析物的样本进行稀释后的溶液。例如,为了避免hook效应,可以在上机检测前使用样本稀释液将被分析物进行稀释后再在检测仪器上进行检测,此时可能含有被分析物的稀释后的溶液均统称为待测样本。
[0082]
本发明所述用语“抗体”和“免疫球蛋白”以最广含义使用,包括任何同种型的抗体或免疫球蛋白,保留对抗原的特异性结合的抗体片段,包括但不限于fab、fv、scfv、和fd片段、嵌合抗体、人源化抗体、单链抗体、双特异性抗体、和包含抗体的抗原结合部分和非抗体
蛋白的融合蛋白。在任何需要的情况下,抗体可以进一步与其它部分,诸如特异性结合配对物,例如生物素或链霉亲和素(生物素-链霉亲和素特异性结合配对物中的一员)等缀合。
[0083]
本发明所述用语“第二抗-carp抗体”指的是能够与待测样品中的抗-carp抗体竞争结合抗原的物质。
[0084]
本发明所述用语“单克隆抗体”是指由单克隆的b淋巴细胞分泌的免疫球蛋白,其可以通过本领域技术人员所公知的方法来制备得到。
[0085]
本发明所述用语“多克隆抗体”是指由一个以上的b淋巴细胞克隆产生的免疫球蛋白集合,其可以通过本领域技术人员所公知的方法来制备得到。
[0086]
本发明所述用语“抗原”是指能够刺激机体产生免疫应答,并能与免疫应答产物抗体和致敏淋巴细胞在体内外结合,发生免疫效应的物质。例如,本发明所述抗原为能够与抗-carp抗体的抗原表位结合位点特异性结合的抗原。
[0087]
本发明所述用语“结合”指由于例如共价、静电、疏水、离子和/或氢键等相互作用,包括但不限于如盐桥和水桥等相互作用引起的两个分子间的直接联合。
[0088]
本发明所述用语“特异性结合”,是指两种物质之间的相互辨别和选择性结合反应,从立体结构角度上说就是相应的反应物之间构象的对应性。
[0089]
本发明所述用语“特异性结合配对物”是指这样一对分子,它们能够相互特异性结合,例如,酶-底物、抗原-抗体、配基-受体。一个具体的特异性结合配对物对的例子是生物素-链霉亲和素系统,其中“生物素”广泛存在于动植物组织中,其分子上有两个环状结构,分别为咪唑酮环和噻吩环,其中咪唑酮环是与链霉亲和素结合的主要部位。活化的生物素可以在蛋白质交联剂的介导下,与已知的几乎所有生物大分子偶联,包括蛋白质、核酸、多糖和脂类等;而“链霉亲和素”是由链霉菌分泌的一种蛋白质,分子量为65kd。“链霉亲和素”分子由4条相同的肽链组成,其中每条肽链都能结合一个生物素。因此每个抗原或抗体可同时偶联多个生物素分子,从而产生“触手效应”提高分析灵敏度。在任何需要的情况下,本发明中所用任何试剂,包括抗原、抗体、受体或供体,可以根据实际需要缀合生物素-链霉亲和素特异性结合配对物中的任一员。
[0090]
本发明所述用语“供体”是指通过能量或者活性化合物的激活后能够产生与受体反应的诸如单线态氧的活性中间体的敏化剂。供体可以是光活化的(如染料和芳香化合物)或者化学活化的(如酶、金属盐等)。在本发明一些具体实施例中,所述供体是光敏剂,所述光敏剂可以是本领域已知的光敏剂,优选相对光稳定且不与单线态氧有效反应的化合物,其非限定性的例子包括例如美国专利us5709994(该专利文献在此全文引为参考)公开的亚甲基蓝、玫瑰红、卟啉、酞菁和叶绿素等化合物,以及这些化合物的具有1-50个原子取代基的衍生物,所述取代基用于使得这些化合物更具有亲脂性或更具有亲水性、和/或作为连接至特异性结合配对物的连接基团。本领域技术人员已知的其他光敏剂的例子也可以在本发明中使用,例如美国专利us6406913中记载的内容,该专利文献并入本文以供参考。在本发明另一些具体实施例中,所述供体是化学活化的其他敏化剂,其非限定性的例子是某些化合物,它们催化过氧化氢转化为单线态氧和水。其他一些供体的例子包括:1,4-二羧基乙基-1,4-萘内过氧化物、9,10-二苯基蒽-9,10-内过氧化物等,加热这些化合物或者这些化合物直接吸收光会释放单线态氧。
[0091]
本发明所述用语“受体”是指能够与单线态氧反应可以产生可检测信号的物质。供
体被能量或者活性化合物诱导激活并释放高能态的单线态氧,该高能态的单线态氧被近距离的受体俘获,从而传递能量以激活所述受体。在本发明的一些具体实施例中,所述受体是这样的物质,其经历与单线态氧的化学反应以形成不稳定的亚稳态中间体,所述亚稳态中间体可以分解,同时或随后发光。这些物质的典型例子包括但不限于:烯醇醚、烯胺、9-烷叉黄原胶、9-烷叉-n-烷基吖啶满、芳乙烯醚、双环氧乙烯、二甲基噻吩、芳香性咪唑或光泽精。在本发明的另一些具体实施例中,所述受体是能够与单线态氧反应以形成可以分解成酮类或羧酸衍生物的氢过氧化物或二氧环丁烷的烯烃类;可以通过光的作用分解的稳定二氧环丁烷;可以与单线态氧反应以形成二酮类的乙炔类;可以形成偶氮化合物或偶氮羰基化合物的腙类或酰肼类,诸如鲁米诺;和可以形成内过氧化物类的芳族化合物。可以根据本公开和要求保护的发明利用的受体的具体的、非限制性实例记载于美国专利号us5340716(该专利文献在此全文引为参考)。在本发明另一些具体实施例中,所述受体包含烯烃化合物和金属螯合物,其是非粒子化的并且在含水介质中可溶,这种受体的情况可参见专利pct/us2010/025433(该专利文献在此全文引为参考)。
[0092]
在本发明中所述“供体”可以是通过功能基团被包被在基体上形成填充有感光化合物的高分子微粒,在光激发下能够产生单线态氧;和/或,所述“受体”可以是通过功能基团被包被在基体上形成填充有发光化合物和镧系元素的高分子微粒。
[0093]
在本发明中,所述供体可以是通过功能基团被包被在基体上形成填充有感光化合物的高分子微粒,在光激发下能够产生单线态氧,此时供体也可以称为感光微球或感光微粒,包含这种感光微球或感光微粒的溶液可以称为感光液或通用液;和/或,所述受体可以是通过功能基团被包被在基体上形成填充有发光化合物和镧系元素的高分子微粒,此时可以称为发光微球或发光微粒。在本技术中,系统基于包被在基体表面的发光物质经光激发和能量传递诱导发光信号,能量传递依赖于抗原-抗体结合导致感光微球和发光微球相互靠近而实现。因此无需分离过程。纳米微球的直径更小,其悬浮性能更强,同时采用了三级放大发光系统,因而具有更高的分析灵敏度;整个检测过程无需清洗,即无需分离结合标记和结合标记物,因此反应时间更短;示踪物质(感光剂和发光剂)标记在基体上,而不是标记在生物分子上,对生物分子的活性没有影响,同时,因基体存在较大的比表面积,故其表面上能够包被更多的示踪物质及生物分子,致其在试剂的有效浓度和灵敏度及检测背景等方面的表现会更优。
[0094]
本发明所述“基体”是本领域技术人员所公知的微球或微粒,其可以是任何尺寸的,优选纳米级尺寸,其可以是有机的或是无机的,其可以是可膨胀或不可膨胀的,其可以是多孔的或非多孔的,其具有任何密度,但优选具有和水接近的密度,优选能漂浮于水中,且由透明、部分透明或不透明的材料构成。所述基体可以有或没有电荷,当带有电荷时,优选是负电荷。所述基体可以是固体(如聚合物、金属、玻璃、有机和无机物诸如矿物、盐和硅藻)、小油滴(如碳氢化合物、碳氟化合物、硅质流体)、囊泡(如合成的诸如磷脂、或天然的诸如细胞、及细胞器官)。基体可以是乳胶颗粒或是含有有机或无机聚合物的其他颗粒、脂双层如脂质体、磷脂囊泡、小油滴、硅颗粒、金属溶胶、细胞和微晶染料。基体通常具有多功能性,或者能够通过特异或非特异的共价或非共价相互作用而结合到供体或受体上。有许多官能团是可用的或者将其合并进来。典型的官能团包括羧酸、乙醛、氨基、氰基、乙烯基、羟基、巯基等。适用于本发明的基体的一个非限制性的例子是羧基或醛基改性的乳胶颗粒。这
种基体的详细情况可参见美国专利us5709994与us5780646(这两篇专利文献在此全文引为参考)。
[0095]
本发明所述用语“表位”是指能够特异性结合免疫球蛋白或者t细胞受体的任何蛋白决定簇。在本发明的一些具体实施例中,表位是抗原表面能够被抗体特异性集合的区域。表位决定簇通常可以包括分子的化学活性表面基团,例如但不限于:氨基酸、糖侧链、磷酰基和/或磺酰基。在本发明的其他一些具体实施例中,表位可以具体特定三位结构特征以及特定电荷特征。
[0096]
本发明所述用语“均相免疫检测试剂套装”是指均相免疫检测所必须使用的全部试剂或药剂的组合。
[0097]
本发明所述用语“氨甲酰化肽段混合物”指由至少2个单一氨甲酰化肽段混合后形成的混合物。
[0098]ⅱ、实施方案
[0099]
本发明所基于的原理是:一定量包被受体的氨甲酰化抗原和生物素标记的兔抗氨甲酰化蛋白抗体、样本加入反应体系中,生物素标记的兔抗氨甲酰化蛋白抗体和样本中的特异性抗体竞争结合包被受体的氨甲酰化抗原,形成抗原抗体-免疫复合物,随后加入过量的链霉亲和素标记的供体,免疫复合物上的生物素与链霉亲和素标记的供体发生特异性结合,在激光的激发下,发生微粒之间离子氧的能量转移,进而产生高能级的红光,通过单光子计数器和数学拟合将光子数换算为靶分子浓度。在检测过程中不受非特异性抗体的干扰而可以省略传统间接法中需要洗涤的过程,该试剂盒特异性高、灵敏度好、线性范围宽、反应速度快、操作简便,并可实现全自动化高通量测试。
[0100]
因此,本发明第一方面提供了一种用于检测抗-carp抗体的均相免疫检测试剂套装,其包括:
[0101]
组分a,其包含能够与目标抗-carp抗体和第二抗-carp抗体特异性结合的抗原;
[0102]
组分b,其包含第二抗-carp抗体;
[0103]
组分c,其包含能够在激发状态产生单线态氧的供体。
[0104]
本发明中,所述抗原或所述第二抗-carp抗体与受体相结合;所述受体能够与单线态氧反应生成可检测的化学发光信号。
[0105]
在本发明的一些优选的实施例中,所述抗原与受体相结合。
[0106]
在本发明的一些实施例中,所述受体包含烯烃化合物和金属螯合物,其为非粒子形式,且在含水介质中可溶;和/或,所述受体为填充有发光化合物和镧系元素的高分子微粒。
[0107]
在本发明的一些优选的实施例中,所述受体为填充有发光化合物和镧系元素的高分子微粒。
[0108]
在本发明的一些实施例中,所述供体与特异性结合配对物中的一员结合,而特异性结合配对物中的另一员与所述抗原或所述第二抗-carp抗体相结合。
[0109]
在本发明的一些具体优选的实施例中,所述供体与链霉亲和素结合,相应地抗原或所述第二抗-carp抗体与生物素结合。
[0110]
在本发明的一些实施例中,所述供体为光活化的或化学活化的敏化剂,其为非粒子形式,且在含水介质中可溶;和/或,所述供体为填充有感光化合物的高分子微粒,在光激
发下能够产生单线态氧。
[0111]
在本发明的一些优选的实施例中,所述供体为填充有感光化合物的高分子微粒。
[0112]
在本发明的一些实施方式中,所述第二抗-carp抗体为多克隆抗体和/或单克隆抗体。例如,在本发明的一些优选的实施方式中,所述第二抗-carp抗体为单克隆抗体。
[0113]
在本发明中对多克隆抗体的制备方法没有特别的限制,可以采用本领域常规的制备方法制备,例如所述多克隆抗体的制备方法包括:用氨甲酰化抗原对动物进行免疫,获取含有所述多克隆抗体的动物血清;所述动物血清经亲和层析纯化得到特异性识别氨甲酰化抗原的多克隆抗体。
[0114]
在本发明中对单克隆抗体的制备方法没有特别的限制,可以采用本领域常规的制备方法制备,例如所述单克隆抗体的制备方法包括:所述单克隆抗体的制备方法包括:将经氨甲酰化抗原免疫后的兔的脾脏细胞与兔骨髓瘤细胞融合后进行培养,对细胞培养上清液进行检测,保留阳性细胞株。
[0115]
根据本发明,所述抗原为氨甲酰化抗原。
[0116]
在本发明的一些实施方式中,所述抗原选自合成的氨甲酰化肽段、由至少2个单一氨甲酰化肽段合成在一条肽链上形成的多肽、含有至少2个单一氨甲酰化肽段的氨甲酰化肽段混合物和氨甲酰化蛋白。
[0117]
在本发明的一些优选的实施方式中,所述抗原选自合成的氨甲酰化肽段、由至少2个单一氨甲酰化肽段合成在一条肽链上形成的多肽和含有至少2个单一氨甲酰化肽段的氨甲酰化肽段混合物;优选地,所述抗原为由2-4个氨甲酰化肽段合成在一条肽链上形成的多肽或含有2-4单一氨甲酰化肽段的氨甲酰化肽段混合物。
[0118]
在本发明的一些优选的实施例中,所述氨甲酰化肽段选自seq id no.2-5。
[0119]
在本发明的一些实施例中,对于由至少2个单一氨甲酰化肽段合成在一条肽链上形成的多肽,所述第一抗原中多个不同肽段相互之间的摩尔比相同。
[0120]
在本发明的另一些实施例中,对于含有至少2个单一氨甲酰化肽段的氨甲酰化肽段混合物,所述第一抗原中多个不同肽段相互之间的质量比相同。
[0121]
本领域技术人员应该了解的是,对于选自合成的氨甲酰化肽段、由至少2个单一氨甲酰化肽段合成在一条肽链上形成的多肽和含有至少2个单一氨甲酰化肽段的氨甲酰化肽段混合物的第一抗原,为减少空间位阻,所述第一抗原优选通过中间体与受体相结合,所述中间体为亲水性高分子物质。
[0122]
在本发明的一些实施例中,所述中间体为蛋白质,优选选自血蓝蛋白、卵清蛋白、牛血清白蛋白或牛甲状腺球蛋白。
[0123]
在本发明的另一些实施例中,所述中间体选自树枝状大分子、聚羧酸酯、聚巯基和聚乙二醇。
[0124]
本发明中对于含有至少2个单一氨甲酰化肽段的氨甲酰化肽段混合物的第一抗原偶联中间体的方式没有特别的限制,既可以是各单一氨甲酰化肽段分别先偶联中间体,然后混合形成偶联中间体的氨甲酰化肽段混合物;也可以是各单一甲酰化肽段混合后形成甲酰化肽段混合物,然后再偶联中间体形成偶联中间体的氨甲酰化肽段混合物;优选地,各单一甲酰化肽段混合后形成甲酰化肽段混合物,然后再偶联中间体形成偶联中间体的氨甲酰化肽段混合物。
[0125]
在本发明的一些实施例中,所述抗原以及与之结合的受体的总浓度为0.005-0.1μg/ml;所述第二抗-carp抗体以及与之结合的特异性结合配对物中的一员总的浓度为0.025-0.1μg/ml;所述供体以及与之结合的特异性结合配对物中的另一员的总浓度为5-20μg/ml。
[0126]
本发明第二方面提供了一种用于检测目标抗-carp抗体的均相免疫检测试剂盒,其包含本发明第一方面所述的均相免疫检测试剂套装。其可以通过将所述用于检测目标抗-carp抗体的均相免疫检测试剂套装装入试剂盒中制得。
[0127]
具体地,本发明提供的用于检测目标抗-carp抗体的均相免疫检测试剂盒,其包括anti-carp ab校准品、包被受体(发光微粒)的氨甲酰化抗原、生物素标记兔抗氨甲酰化蛋白抗体、供体(感光液)以及样本稀释液。
[0128]
在一个具体实施方式中,所述氨甲酰化抗原为氨甲酰化人血清白蛋白,所述人血清白蛋白如seq id no.1所示。
[0129]
在一个具体实施方式中,所述氨甲酰化抗原为多个氨甲酰化肽段序列合成在一条肽链上或偶联于牛血清白蛋白(bovine serum albumin,bsa)上。所述肽段和bsa如seq id no.2-seq id no.5所示。
[0130]
在一个具体实施方式中,所述受体(发光微粒)选自含醛基活性基团。
[0131]
在一个具体实施方式中,所述标记物选自生物素。
[0132]
在一个具体实施方式中,所述供体(感光液)包括如下组分:表面包被有感光物质酞箐及链霉亲和素。
[0133]
在一个具体实施方式中,所述样本稀释液包括如下组分:0.02m磷酸盐、0.15m氯化钠、0.5%吐温-20及2%牛血清白蛋白片段5。
[0134]
在本发明的一个具体的实施方式中,本发明提供了制备上述试剂盒的方法,其包括如下步骤:
[0135]
1)配制anti-carp ab校准品;
[0136]
2)以氨甲酰化抗原包被受体(发光微粒);
[0137]
3)以兔抗氨甲酰化蛋白抗体标记生物素;
[0138]
4)配制样本稀释液。
[0139]
在一个具体实施方式中,所述抗原被氨甲酰化的步骤如下:
[0140]
i)采用kocn溶液对抗原进行体外氨甲酰化修饰;
[0141]
ii)将氨甲酰化修饰完后的所述抗原进行透析,以除去残留的kocn。
[0142]
其中,在步骤i)中,1-10mg的所述抗原加入至0.5-2m的kocn进行36-38℃反应24-36h。例如,将1mg的人血清白蛋白加入至1m的kocn(采用0.2m的pb缓冲液配制,ph=7.2)中进行37℃反应24h。
[0143]
在步骤ii)中,在2-8℃条件下采用0.1-0.25m的pb缓冲液透析48-72h以除去残留的kocn。例如,在2-8℃条件下采用0.2m的pb缓冲液透析48h以除去残留的kocn。
[0144]
在一个具体实施方式中,还可以步骤5)分装上述anti-carp ab校准品、氨甲酰化抗原包被受体(发光微粒)、氨甲酰化抗原标记生物素和样本稀释液,最后将各组分组装为成品。
[0145]
在一个具体实施方式中,所述多个氨甲酰化肽段序列合成在一条肽链上或偶联于
牛血清白蛋白(bovine serum albumin,bsa)步骤如下:
[0146]
表1
[0147]
序列号序列seq id no.2hqchqest-hcit-gkskgkcgksgsseq id no.3ckaaatq-hcit-kvercarrrseq id no.4nean-hcit-yqisvn-hcit-yrgseq id no.5neegffsa-hcit-ghrpldkk
[0148]
将以上四个肽段,采用以下方式合成制备氨甲酰化抗原:
[0149]
1、将四个肽单独合成,按照肽段合成方法获得,由上海某生物科技有限公司合成,经高效液相色谱-质谱联用(hplc-ms)检测纯度为90%以上。
[0150]
2、将四个肽段合成一条肽,获得合成多肽。按照肽段合成方法获得,由上海某生物科技有限公司合成,经hplc-ms检测纯度为90%以上。
[0151]
3、将四个肽段合成一条肽,获得合成多肽。按照肽段合成方法获得,由上海某生物科技有限公司合成,经hplc-ms检测纯度为90%以上。将其与bsa进行偶联,偶联的步骤为:
[0152]
(1)4-8mg的4-(n-马来酰亚胺甲基)环己烷-1-羧酸磺酸基琥珀酰亚胺酯钠盐(sulfo-smcc)溶解于640-1280μl二甲基亚砜(dmso)中,使其终浓度为20mm。
[0153]
(2)1-5mg干粉状的合成多肽溶解于200-1000μl纯化水中,使其终浓度为5mg/ml。
[0154]
(3)10-50mgbsa溶解于200-1000μl纯化水中,使其终浓度为50mg/ml
[0155]
(4)将合成多肽溶液与bsa溶液按照质量比1:1充分混合溶解于5倍体积的pbs-edta溶液中,室温静置1h。
[0156]
(5)在上述混合溶液中加入100μl smcc溶液,室温条件下过夜反应。
[0157]
(6)将上述反应完成的反应液转移至交联透析缓冲液(0.1m pbs ph7.4)透析去除游离多肽,纯化获得氨甲酰化合成多肽-bsa。
[0158]
在一个具体实施方式中,anti-carp ab校准品的制备包括以下步骤:
[0159]
a1)校准品缓冲液的制备:准确称取hepes 4.77g、nacl 1.7g,添加纯化水160ml混匀30min,调节ph值至7.4
±
0.2,继续添加proclin300 0.1g、bsa 30g、1m mgcl
2 0.5ml、0.1m zncl
2 0.1ml,搅拌30min后添加纯化水定容至200ml,复测ph值后,2-8c备用;
[0160]
b1)校准品的配制:将已知活性浓度的anti-carp ab加入至步骤a1)中所述缓冲液,配制成具备一定浓度梯度的标准品。至少配制3个浓度,优选配制5个浓度。
[0161]
在一个具体实施方式中,氨甲酰化抗原包被的受体(发光微粒)包括以下步骤:
[0162]
氨甲酰化人血清白蛋白包被的受体(发光微粒):
[0163]
a2)取氨甲酰化人血清白蛋白进行透析,采用1l交联透析缓冲液在2-8℃条件下进行透析,透析时间不少于5h,每2h更换一次透析液(配方为:1.54g na2co3、2.94g nahco3溶解于1l纯化水中,调节ph值9.0
±
0.05),换液2-3次;
[0164]
b2)将透析好的氨甲酰化人血清白蛋白吸出转移至干净离心管中,并取样测定蛋白浓度,蛋白浓度的测定方法为紫外光谱吸收法或采用bca蛋白定量分析试剂盒;
[0165]
c2)取一定量的受体(发光微粒)加入离心管中,并对受体(发光微粒)进行洗涤。清洗方法为12000rpm离心10min,弃上清,向离心管中加入10-20倍体积的交联透析缓冲液(配方为:1.54g na2co3、2.94g nahco3溶解于1l纯化水中,调节ph值9.0
±
0.05),并采用超声波
清洗5min。再次离心,重复以上清洗步骤2次。
[0166]
d2)将步骤c2)中洗涤完毕的受体(发光微粒)置于分析天平上进行调零,将步骤a2)中透析后的0.01-0.1倍受体(发光微粒)质量的氨甲酰化人血清白蛋白全部加入至洗涤完毕的受体(发光微粒)中并计算体积(密度按1g/ml计算),补充一定体积的交联透析缓冲液至受体(发光微粒)中,使总体积为200μl。氨甲酰化人血清白蛋白与受体(发光微粒)混匀后将离心管置于37℃垂直旋转混合器上25-40rpm过夜反应。
[0167]
e2)将步骤d2)中反应完成的离心管置于2-8℃条件下冷却10min,取0.1-0.5倍受体(发光微粒)质量的nabh4,加入至离心管中并混匀,随后将离心管置于2-8℃垂直旋转混合器上25-40rpm反应2小时。
[0168]
f2)在步骤e2)中反应完成的离心管中加入1-3倍受体(发光微粒)质量的gly,室温条件下垂直旋转混合器上25-40rpm反应1小时。
[0169]
g2)洗涤步骤f2)中氨甲酰化人血清白蛋白包被的受体(发光微粒),清洗方法为12000rpm离心10min,弃上清,向离心管中加入200μl的清洗缓冲液(配方为:2.90g na2hpo4·
12h2o、0.296g nah2po4·
2h2o溶解于1l纯化水中),并采用超声波清洗5min。再次离心,重复以上清洗步骤2次,最后使用微粒保存液(配方为:2.5g hepes、17.5g nacl、1.0g吐温-20、10g牛血清白蛋白片段5溶解于1l纯化水中)清洗一次。
[0170]
h2)加入200μl微粒保存液保存氨甲酰化人血清白蛋白包被的受体(发光微粒),保存在2-8℃备用。
[0171]
氨甲酰化合成多肽-bsa包被的受体(发光微粒):
[0172]
a3)取氨甲酰化合成多肽-bsa进行透析,采用1l交联透析缓冲液在2-8℃条件下进行透析,透析时间不少于5h,每2h更换一次透析液(配方为:1.54g na2co3、2.94g nahco3溶解于1l纯化水中,调节ph值9.0
±
0.05),换液2-3次;
[0173]
b3)将透析好的氨甲酰化合成多肽-bsa吸出转移至干净离心管中,并取样测定蛋白浓度,蛋白浓度的测定方法为紫外光谱吸收法或采用bca蛋白定量分析试剂盒;
[0174]
c3)取一定量的受体(发光微粒)加入离心管中,并对受体(发光微粒)进行洗涤。清洗方法为12000rpm离心10min,弃上清,向离心管中加入10-20倍体积的交联透析缓冲液(配方为:1.54g na2co3、2.94g nahco3溶解于1l纯化水中,调节ph值9.0
±
0.05),并采用超声波清洗5min。再次离心,重复以上清洗步骤2次。
[0175]
d3)将步骤c3)中洗涤完毕的受体(发光微粒)置于分析天平上进行调零,将步骤a2)中透析后的0.01-0.1倍受体(发光微粒)质量的氨甲酰化合成多肽-bsa全部加入至洗涤完毕的受体(发光微粒)中并计算体积(密度按1g/ml计算),补充一定体积的交联透析缓冲液至受体(发光微粒)中,使总体积为200μl。氨甲酰化合成多肽-bsa与受体(发光微粒)混匀后将离心管置于37℃垂直旋转混合器上25-40rpm过夜反应。
[0176]
e3)将步骤d3)中反应完成的离心管置于2-8℃条件下冷却10min,取0.1-0.5倍受体(发光微粒)质量的nabh4,加入至离心管中并混匀,随后将离心管置于2-8℃垂直旋转混合器上25-40rpm反应2小时。
[0177]
f3)在步骤e3)中反应完成的离心管中加入1-3倍受体(发光微粒)质量的gly,室温条件下垂直旋转混合器上25-40rpm反应1小时。
[0178]
g3)洗涤步骤f3)中氨甲酰化合成多肽-bsa包被的受体(发光微粒),清洗方法为
12000rpm离心10min,弃上清,向离心管中加入200μl的清洗缓冲液(配方为:2.90g na2hpo4·
12h2o、0.296g nah2po4·
2h2o溶解于1l纯化水中),并采用超声波清洗5min。再次离心,重复以上清洗步骤2次,最后使用微粒保存液(配方为:2.5g hepes、17.5g nacl、1.0g吐温-20、10g牛血清白蛋白片段5溶解于1l纯化水中)清洗一次。
[0179]
h3)加入200μl微粒保存液保存氨甲酰化氨甲酰化合成多肽-bsa包被的受体(发光微粒),保存在2-8℃备用。
[0180]
在一个具体实施方式中,兔抗氨甲酰化蛋白抗体标记生物素包括以下步骤:
[0181]
a4)取一定量的兔抗氨甲酰化蛋白抗体进行透析,采用1l交联透析缓冲液在2-8℃条件下进行透析,透析时间不少于5h,每2h更换一次透析液,换液2-3次。
[0182]
b4)将透析好的兔抗氨甲酰化蛋白抗体吸出转移至干净离心管中,并取样测定蛋白浓度,蛋白浓度的测定方法为紫外光谱吸收法或采用bca蛋白定量分析试剂盒。
[0183]
c4)取一定量的兔抗氨甲酰化蛋白抗体至离心管中,按两者之间标记的分子质量比大致为1:30加入生物素,加入生物素后迅速混匀,补充一定体积的标记缓冲液使总体积为200μl。将离心管置于2-8℃垂直旋转混合器上25-40rpm过夜反应。
[0184]
d4)将步骤c4)中标记完成的生物素化兔抗氨甲酰化蛋白抗体进行透析,采用1l标记透析缓冲液在2-8℃条件下进行透析,透析时间不少于5h,每2h更换一次透析液,换液2-3次。
[0185]
e4)将步骤d4)中生物素化兔抗氨甲酰化蛋白抗体转移至干净离心管中,取样测定蛋白浓度后保存在2-8℃备用。
[0186]
样本稀释液的配制包括以下步骤:
[0187]
采用精密天平精确称量2.90g na2hpo4·
12h2o、0.296g nah2po4·
2h2o、添加纯化水800ml混匀30min,调节ph值至7.2
±
0.2,继续添加8.5g nacl、5g吐温-20及20g牛血清白蛋白片段5,搅拌30min后添加纯化水定容至1l,复测ph值后,2-8c备用。
[0188]
在本发明第三方面,本发明所涉及的检测待测样本中目标抗-carp抗体的均相免疫检测方法包括使用如本发明第一方面提供的均相免疫检测试剂套装来判断测待测样品中是否存在目标抗-carp抗体和/或确定目标抗-carp抗体的含量。
[0189]
类似地,本发明所涉及的检测待测样品中目标抗-carp抗体的均相免疫检测方法,还包括使用如本发明第二方面所述的均相免疫检测试剂盒来判断测待测样品中是否存在目标抗-carp抗体和/或确定目标抗-carp抗体的含量。
[0190]
在本发明的一些实施方式中,所述检测待测样品中目标抗-carp抗体的均相免疫检测方法包括:
[0191]
m1,使第二抗-carp抗体和待测样本中的目标抗-carp抗体竞争与抗原的表位结合,分别通过抗原表位与抗原形成由抗原-第二抗-carp抗体构成的第一免疫复合物和由抗原-目标抗-carp抗体构成的第二免疫复合物;
[0192]
m2,检测第二免疫复合物是否存在;如果第二免疫复合物存在,则表明待测样本中存在抗-carp抗体。
[0193]
根据本发明的一些实施方式,采用采用一步法竞争法进行目标抗-carp抗体的均相免疫检测时,所述步骤m1包括将第二抗-carp抗体、待测样本和抗原混合均匀,反应,使第二抗-carp抗体和待测样本中的目标抗-carp抗体竞争与抗原的表位结合,分别通过抗原表
位与抗原形成由抗原-第二抗-carp抗体构成的第一免疫复合物和由抗原-抗-carp抗体构成的第二免疫复合物。
[0194]
本发明中采用一步法竞争法进行目标抗-carp抗体的均相免疫检测时,对于第二抗-carp抗体、待测样本和抗原的加入方式没有特别的限制,例如,在本发明的一些实施例中,可以将第二抗-carp抗体、待测样本和抗原混合均匀的步骤包括将第二抗-carp抗体、待测样本和抗原同时混合均匀;而在本发明的另一些实施例中,可以将第二抗-carp抗体、待测样本和抗原混合均匀的步骤包括先将第二抗-carp抗体与待测样本混合形成第1混合物,再将抗原与第1混合物混合。
[0195]
在本发明的一些优选的实施例中,采用一步法竞争法进行目标抗-carp抗体的均相免疫检测时,将第二抗-carp抗体、待测样本和抗原混合均匀的步骤包括先将第二抗-carp抗体与待测样本混合形成第1混合物,再将抗原与第1混合物混合。
[0196]
根据本发明的另一些实施方式,采用二步法竞争法进行目标抗-carp抗体的均相免疫检测,所述步骤m1包括以下步骤:
[0197]
p1,将抗原与待测样本混合,反应,使抗原与待测样本中的目标抗-carp结合形成由抗原-目标抗-carp抗体构成的第二免疫复合物,获得第11混合物;
[0198]
p2,将第二抗-carp抗体与第11混合物混合,反应,使第二抗-carp抗体竞争与第11混合物中的未与待测样本中的目标抗-carp结合的抗原结合,形成由抗原-第二抗-carp抗体构成的第一免疫复合物。
[0199]
本发明中,步骤m2中通过化学发光的方法检测第二免疫复合物是否存在。
[0200]
在本发明的一些实施例中,步骤m2包括将第1混合物的化学发光信号值与由与步骤m1中等量的抗原和第二抗-carp抗体形成的对照免疫复合物的化学发光信号值进行比较,由此判断第二免疫复合物是否存在。
[0201]
在本发明的一些具体实施例中,所述抗原与受体结合,所述第二抗-carp抗体与生物素结合,所述受体能够与单线态氧反应生成可检测的化学发光信号。
[0202]
根据本发明的又一些实施方式,在步骤m1之前还包括步骤m0,利用样品稀释液按照1:(4-20)的体积比稀释待测样本;优选地,利用样品稀释液按照1:(6-16)的体积比稀释待测样本;更优选地,利用样品稀释液按照1:(8-12)的体积比稀释待测样本。
[0203]
在本发明的一些具体的实施例中,采用一步法竞争法进行目标抗-carp抗体的均相免疫检测,所述方法包括所述方法包括如下步骤:
[0204]
r1,将与生物素结合的第二抗-carp抗体同待测样本混合形成第2混合物;
[0205]
r2,将结合有受体的抗原与第2混合物混合,使与生物素结合的第二抗-carp抗体和待测样本中的目标抗-carp抗体竞争与结合有受体的抗原结合,分别形成由受体-抗原-第二抗-carp抗体-生物素构成的第三免疫复合物和由受体-抗原-抗-carp抗体构成的第四免疫复合物,从而形成第3混合物;
[0206]
r3,将与链霉亲和素结合的供体与第3混合物混合,使与链霉亲和素结合的供体与第三免疫复合物中的生物素结合,形成由受体-抗原-第二抗-carp抗体-生物素-链霉亲和素-供体所构成的第五免疫复合物,从而形成第4混合物;
[0207]
r4,用能量或者活性化合物激发供体产生单线态氧,所述受体与单线态氧反应生成可检测的化学发光信号;检测第四免疫复合物是否存在;如果第四免疫复合物存在,则待
测样本中存在目标抗-carp抗体。
[0208]
在本发明的一些实施例中,所述方法还包括在步骤r1之前制作目标抗-carp抗体标准工作曲线的步骤。
[0209]
在本发明的一些实施例中,在步骤r4,检测所述化学发光信号的强度,并基于抗-carp抗体标准工作曲线来确定待测样品中目标抗-carp抗体的含量。
[0210]
在本发明的一些优选的具体实施例中,在步骤r1之前还包括步骤r0,利用样品稀释液按照1:(4-20)的体积比稀释待测样本;优选地,利用样品稀释液按照1:(6-16)的体积比稀释待测样本;更优选地,利用样品稀释液按照1:(8-12)的体积比稀释待测样本。
[0211]
在本发明的一些实施例中,利用600-700nm波长的激发光照射第4混合物,激发第五免疫复合物中的供体产生单线态氧,受体与接触到的单线态氧反应生成520-620nm的发射光,检测第4混合物的发射光的信号值,并将其与步骤r2中等量的抗原和第二抗-carp抗体形成的对照免疫复合物的化学发光信号值进行比较,由此判断测待测样本中是否存在目标抗-carp抗体和/或目标抗-carp抗体的浓度。
[0212]
在本发明的一些优选的实施例中,利用680nm波长的激发光照射第4混合物,激发第五免疫复合物中供体产生单线态氧,受体与接触到的单线态氧反应生成612nm的发射光,检测第4混合物的发射光的信号值,并将其与步骤r2中等量的抗原和第二抗-carp抗体形成的对照免疫复合物的化学发光信号值进行比较,从而判断测待测样本中是否存在目标抗-carp抗体和/或目标抗-carp抗体的浓度。
[0213]
在本发明的一些具体的实施例中,采用二步法竞争法进行抗-carp抗体的均相免疫检测,所述方法包括如下步骤:
[0214]
t1,将结合有受体的抗原与待测样本混合,反应,使结合有受体的抗原与待测样本中的目标抗-carp结合形成由受体-抗原-目标抗-carp抗体构成的第四免疫复合物,获得第12混合物;
[0215]
t2,将与生物素结合的第二抗-carp抗体与第12混合物混合,反应,使与生物素结合的第二抗-carp抗体竞争与第12混合物中的未结合待测样本中的目标抗-carp的结合有受体的抗原结合,形成由结合有受体的抗原-第二抗-carp抗体-生物素构成的第三免疫复合物,从而形成第13混合物;
[0216]
t3,将与链霉亲和素结合的供体与第13混合物混合,使与链霉亲和素结合的供体与第三免疫复合物中的生物素结合,形成由受体-抗原-第二抗-carp抗体-生物素-链霉亲和素-供体所构成的第五免疫复合物,从而形成第14混合物;
[0217]
t4,用能量或者活性化合物激发供体产生单线态氧,所述受体与单线态氧反应生成可检测的化学发光信号;检测第四免疫复合物是否存在;如果第四免疫复合物存在,则待测样本中存在抗-carp抗体。
[0218]
在本发明的一些实施例中,所述方法还包括在步骤t1之前制作目标抗-carp抗体标准工作曲线的步骤。
[0219]
在本发明的一些实施例中,在步骤t4,检测所述化学发光信号的强度,并基于抗-carp抗体标准工作曲线来确定待测样品中目标抗-carp抗体的含量。
[0220]
在本发明的一些优选的具体实施例中,在步骤t1之前还包括步骤t0,利用样品稀释液按照1:(4-20)的体积比稀释待测样本;优选地,利用样品稀释液按照1:(6-16)的体积
比稀释待测样本;更优选地,利用样品稀释液按照1:(8-12)的体积比稀释待测样本。
[0221]
在本发明的一些实施例中,利用600-700nm波长的激发光照射第14混合物,激发第五免疫复合物中的供体产生单线态氧,受体与接触到的单线态氧反应生成520-620nm的发射光,检测第14混合物的发射光的信号值,并将其与步骤t1中等量的抗原和步骤t2中等量的第二抗-carp抗体形成的对照免疫复合物的化学发光信号值进行比较,由此判断测待测样本中是否存在目标抗-carp抗体和/或目标抗-carp抗体的浓度。
[0222]
在本发明的一些优选的实施例中,利用680nm波长的激发光照射第波长混合物,激发第五免疫复合物中供体产生单线态氧,受体与接触到的单线态氧反应生成612nm的发射光,检测第的发混合物的发射光的信号值,并将其与步骤t1中等量的抗原和步骤t2中等量的第二抗-carp抗体形成的对照免疫复合物的化学发光信号值进行比较,由此判断测待测样本中是否存在目标抗-carp抗体和/或目标抗-carp抗体的浓度。
[0223]
在本技术中,系统基于包被在供体-受体表面的发光物质经光激发和能量传递诱导发光信号,能量传递依赖于抗原-抗体结合导致供体-受体相互靠近而实现。因此无需分离过程,纳米微粒的直径更小,其悬浮性能更强,同时采用了三级放大发光系统,因而具有更高的分析灵敏度;整个检测过程无需清洗,即无需分离结合标记为和结合标记物,因此反应时间更短;示踪物质(感光剂和发光剂)标记在固相微球上,而不是标记在生物分子上,对生物分子的活性没有影响,同时,因固相微球存在较大的比表面积,故其表面上能够包被更多的示踪物质及生物分子,所致其在试剂的有效浓度和灵敏度及检测背景等方面的表现会更优。
[0224]
发明人进一步对上述检测待测样品中目标抗-carp抗体的均相免疫检测方法进行考察研究。在一个实施例中,采用一步竞争法进行目标抗-carp抗体的均相免疫检测,将包被氨甲酰化bsa的受体、样本及生物素标记的兔抗氨甲酰化赖氨酸抗体一同加入中反应体系中。此时,样本中的目标抗carp抗体与生物素标记的兔抗氨甲酰化赖氨酸抗体同时竞争结合限量的氨甲酰化bsa。发明人一共测试6例阴性样本,16例阳性样本。以b/b0《0.8为阴阳判断标准(b为加入样本后的测试发光值,b0为不加样本的对照组发光值,当b/b0的发光值下降时,表明样本中存在目标抗carp抗体与兔抗氨甲酰化赖氨酸抗体竞争结合限量的氨甲酰化bsa)。结果如图1所示,从图1可以看出,所有阴性样本均被判定为阴性,16例阳性样本中13例被判定为阳性。这说明,一步竞争法检测阴性样本和阳性样本存在明显区分,但灵敏度偏低,部分阳性样本无法检出。
[0225]
在另一个实施例中,采用二步竞争法进行目标抗-carp抗体的均相免疫检测,将包被氨甲酰化bsa的受体、样本一同加入反应体系中预先反应5分钟,反应完成后再加入生物素标记的兔抗氨甲酰化赖氨酸抗体。此种反应模式下,样本中的目标抗carp抗体先结合氨甲酰化bsa上的部分抗原表位,随后,生物素标记的兔抗氨甲酰化赖氨酸抗体结合氨甲酰化bsa上剩余抗原表位。发明人一共测试7例阴性样本,16例阳性样本。以b/b0《0.8为阴阳判断标准。结果如图2所示,从图2可以看出,所有阴性样本均被判定为阴性,所有的阳性样本均被判定为阳性。这说明,两步竞争法测试结果明显优于一步竞争法,灵敏度更佳。
[0226]
在本发明第四方面,本发明所涉及的如本发明第一方面所述的均相免疫检测试剂套装在检测待测样品中目标抗-carp抗体的存在和/或含量中的应用,可以理解为利用本发明第二方面所提供的均相免疫检测试剂套装来判断测待测样品中是否存在目标抗-carp抗
体和/或确定目标抗-carp抗体的含量的方法,其中,所述待测样品选自血液、血液衍生物、血清、血浆、尿液、脑脊髓液、唾液、滑液和肺气肿积液,优选所述待测样品选自血液、血浆和血清,进一步优选所述待测样品为血清。
[0227]
同样地,本发明所提供的如本发明第二方面所提供的均相免疫检测试剂盒在检测待测样品中抗-carp抗体的存在和/或含量中的应用,可以理解为利用本发明第二方面所提供的均相免疫检测试剂盒来判断测待测样品中是否存在目标抗-carp抗体和/或确定目标抗-carp抗体的含量的方法,其中,所述待测样品选自血液、血液衍生物、血清、血浆、尿液、脑脊髓液、唾液、滑液和肺气肿积液,优选所述待测样品选自血液、血浆和血清,进一步优选所述待测样品为血清。
[0228]
类似地,本发明所提供的如本发明第三方面所提供的均相免疫检测方法在检测待测样品中目标抗-carp抗体的存在和/或含量中的应用,可以理解为利用本发明第一方面所提供的均相免疫检测试剂套装,并采用如本发明第三方面所述的均相免疫检测方法来判断测待测样品中是否存在目标抗-carp抗体和/或确定目标抗-carp抗体的含量的方法,其中,所述待测样品选自血液、血液衍生物、血清、血浆、尿液、脑脊髓液、唾液、滑液和肺气肿积液,优选所述待测样品选自血液、血浆和血清,进一步优选所述待测样品为血清。
[0229]
类似地,本发明所提供的如本发明第三方面所提供的均相免疫检测方法在检测待测样品中目标抗-carp抗体的存在和/或含量中的应用,可以理解为利用本发明第二方面所提供的均相免疫检测试剂盒,并采用如本发明第三方面所述的均相免疫检测方法来判断测待测样品中是否存在目标抗-carp抗体和/或确定目标抗-carp抗体的含量的方法,其中,所述待测样品选自血液、血液衍生物、血清、血浆、尿液、脑脊髓液、唾液、滑液和肺气肿积液,优选所述待测样品选自血液、血浆和血清,进一步优选所述待测样品为血清。
[0230]
本发明第五方面涉及如本发明第一方面所述的试剂套装在制备用于检测怀疑患有类风湿性关节炎的受治疗者的待测样品中的目标抗-carp抗体,由此确定所述待测样品中目标抗-carp抗体的水平,并将因此确定的水平与受治疗者的类风湿性关节炎的存在、风险、潜在性或倾向性相关联的试剂盒中的应用,其包括:
[0231]
步骤n1,提供来自待测主体的待测样品;
[0232]
步骤n2,判断测待测样品中是否存在目标抗-carp抗体和/或确定目标抗-carp抗体的含量;
[0233]
步骤n3,将其与正常对照样品、类风湿性关节炎对照样品、或来自同一待测主体的治疗前的样品中所述抗-carp抗体的含量比较;
[0234]
其中,所述待测样品选自血液、血液衍生物、血清、血浆、尿液、脑脊髓液、唾液、滑液和肺气肿积液。
[0235]
在本发明的一些实施方式中,与正常对照样样品相比,所述待测样品中目标抗-carp抗体的存在是所述待测主体中类风湿性关节炎的诊断性指示物。
[0236]
在本发明的另一些实施方式中,与正常对照样样品相比,所述待测样品中目标抗-carp抗体的含量的增加是所述待测主体中类风湿性关节炎的诊断性指示物。
[0237]
在本发明的又一些实施方式中,与正常对照样样品相比,所述待测样品中目标抗-carp抗体的含量不低于123.5u/ml是所述待测主体中类风湿性关节炎的诊断性指示物。
[0238]
在本发明中,与类风湿性关节炎对照样品相比,所述待测样品中目标抗-carp抗体
的相对含量是所述待测主体中类风湿性关节炎的预后性指示物。
[0239]
在本发明一些实施方式中,与来自同一待测主体的治疗前的样品相比,所述待测样品中目标抗-carp抗体的相对含量指示治疗方案的效力。
[0240]
根据本发明方法,在步骤n2中,采用如本发明第四方面所述的方法来判断测待测样品中是否存在目标抗-carp抗体和/或确定目标抗-carp抗体的含量。
[0241]ⅲ.实施例
[0242]
为使本发明更加容易理解,下面将结合实施例来进一步详细说明本发明,这些实施例仅起说明性作用,并不局限于本发明的应用范围。本发明中所使用的原料或组分若无特殊说明均可以通过商业途径或常规方法制得。
[0243]
实施例1:
[0244]
试剂及实验材料:
[0245]
试剂i为:氨甲酰化人血清白蛋白包被表面含有醛基活性基团的受体(发光微粒);
[0246]
试剂ii为:生物素标记兔抗氨甲酰化蛋白抗体。
[0247]
各种缓冲液的配制如下:
[0248]
校准品缓冲液:采用精密天平精确称量hepes 4.77g、nacl 1.7g,添加纯化水160ml混匀30min,调节ph值至7.4
±
0.2,继续添加proclin300 0.1g、bsa 30g、1m mgcl
2 0.5ml、0.1m zncl
2 0.1ml,搅拌30min后添加纯化水定容至200g,复测ph值后,2-8c备用。
[0249]
kocn溶液:采用精密天平精确称量kocn 8.112g、na2hpo4·
12h2o 5.9g、kh2po
4 0.488g、纯化水定容至100ml,调节ph值7.2
±
0.05。
[0250]
交联透析缓冲液1:采用精密天平精确称量na2co31.54 g、nahco32.94 g,加入纯化水定容至1l,调节ph值9.0
±
0.05。
[0251]
交联透析缓冲液2:采用精密天平精确称量4.875g mes溶解于1l纯化水中,调节ph值5.0
±
0.05。
[0252]
清洗缓冲液:采用精密天平精确称量2.90g na2hpo4·
12h2o、0.296g nah2po4·
2h2o,添加纯化水定容至100ml。
[0253]
微粒保存液:采用精密天平精确称量2.5g hepes、17.5g nacl、1.0g吐温-20、10g牛血清白蛋白片段5,添加纯化水定容至100ml。
[0254]
氨甲酰化人血清白蛋白的制备,包括以下步骤:
[0255]
1)将1mg的人血清白蛋白加入至1m的kocn溶液中进行37℃反应24h。
[0256]
2)反应完成后在2-8℃条件下采用超纯水透析48h以除去残留的kocn,2-8℃保存备用。
[0257]
在以上氨甲酰化人血清白蛋白中,存在着一个或多个赖氨酸残基被氨甲酰化,对应存在着一个或多个anti-carp ab的结合位点。
[0258]
anti-carp ab光激化学发光免疫分析检测试剂盒的制备方法,包括以下操作步骤:
[0259]
一、制备校准品工作液
[0260]
1、校准品缓冲液的制备:准确称取hepes 4.77g、nacl 1.7g,添加纯化水160ml混匀30min,调节ph值至7.4
±
0.2,继续添加proclin300 0.1g、bsa 30g、1m mgcl
2 0.5ml、0.1m zncl
2 0.1ml,搅拌30min后添加纯化水定重至200g,复测ph值后,2-8c备用。
[0261]
2、校准品的配制:将浓度为500u/ml的anti-carpab,配制成40u/ml的溶液,随后依次稀释为1、2.5、8、20u/ml,加上40u/ml浓度点和0u/ml浓度点(缓冲液),共得到a:0u/ml、b:1u/ml、c:2.5u/ml、d:8u/ml、e:20u/ml、f:40u/ml,合计共6个浓度的校准品。
[0262]
二、制备氨甲酰化人血清白蛋白包被的受体(发光微粒)(试剂i)
[0263]
氨甲酰化人血清白蛋白包被含有醛基活性基团的受体(发光微粒):
[0264]
1、取0.2mg氨甲酰化人血清白蛋白进行透析,采用1l交联透析缓冲液1在2-8℃条件下进行透析,透析时间不少于5h,每2h更换一次透析液,换液2-3次。
[0265]
2、将步骤1中透析完成的氨甲酰化人血清白蛋白吸出转移至干净离心管中,并取样测定蛋白浓度,蛋白浓度的测定方法为紫外光谱吸收法或采用bca蛋白定量分析试剂盒。
[0266]
3、取2mg的受体(发光微粒)加入离心管中,并对受体(发光微粒)进行洗涤。洗涤方法为12000rpm离心10min,弃上清,向离心管中加入200μl的交联透析缓冲液,采用超声波清洗5min。再次离心弃上清,重复以上清洗步骤2次。
[0267]
4、将步骤3中洗涤完毕的受体(发光微粒)置于分析天平上进行调零,取步骤1中透析后的0.1mg氨甲酰化人血清白蛋白全部加入至装有受体(发光微粒)的离心管中并计算体积(密度按1g/ml计算),补充一定体积的交联透析缓冲液至受体(发光微粒)中,使总体积为200μl,其中微粒的浓度为10mg/ml。将离心管中两者充分混匀后置于37℃垂直旋转混合器上25-40rpm过夜反应。
[0268]
5、准确称取8mg的kbh4,溶解于标记缓冲液中,终浓度为8mg/ml。
[0269]
6、将步骤4中反应完成的离心管置于2-8℃条件下冷却10min,取4μl的步骤5中的nabh4溶液,加入至离心管中并混匀,随后将离心管置于2-8℃垂直旋转混合器上25-40rpm反应2小时。
[0270]
7、在步骤6中反应完成的离心管中加入32μl的75mg/ml甘氨酸溶液(准确称取75mg甘氨酸,溶解于纯化水中,终浓度为75mg/ml),室温条件下垂直旋转混合器上25-40rpm反应1小时。
[0271]
8、洗涤步骤7中氨甲酰化人血清白蛋白包被的受体(发光微粒),清洗方法为12000rpm离心10min,弃上清,向离心管中加入200μl的清洗缓冲液,并采用超声波清洗5min。再次离心弃上清,重复以上清洗步骤2次,最后使用微粒保存液清洗一次。
[0272]
9、加入微粒保存液(2.5g hepes、17.5g nacl、1.0g吐温-20、10g牛血清白蛋白片段5,添加纯化水定容至100ml)保存氨甲酰化人血清白蛋白包被的受体(发光微粒),取样测定蛋白浓度,使其工作浓度为0.1μg/ml,保存在2-8℃备用。
[0273]
三、制备生物素化的兔抗氨甲酰化蛋白抗体(第二抗-carp抗体)(试剂ii)
[0274]
1、取0.2mg兔抗氨甲酰化蛋白抗体进行透析,采用1l交联透析缓冲液(na2co31.54g、nahco32.94g,纯化水定容至1l,调节ph值9.0
±
0.05)在2-8℃条件下进行透析,透析时间不少于5h,每2h更换一次透析液,换液2-3次。
[0275]
2、将步骤1中透析好的兔抗氨甲酰化蛋白抗体吸出转移至干净离心管中,并取样测定蛋白浓度,蛋白浓度的测定方法为紫外光谱吸收法或采用bca蛋白定量分析试剂盒。
[0276]
3、准确称取5mg生物素,溶解于dmso中,终浓度为5mg/ml。
[0277]
4、取0.1mg的兔抗氨甲酰化蛋白抗体至离心管中,加入3μl步骤3中的生物素溶液(两者之间标记的分子质量比约为1:30),加入生物素溶液后迅速混匀,补充一定体积的交
联透析缓冲液使总体积为200μl。随后将离心管置于2-8℃垂直旋转混合器上25-40rpm过夜反应。
[0278]
5、将步骤4中标记完成的生物素化兔抗氨甲酰化蛋白抗体进行透析,采用1l交联透析缓冲液在2-8℃条件下进行透析,透析时间不少于5h,每2h更换一次透析液,换液2-3次。
[0279]
6、将步骤5中生物素化兔抗氨甲酰化蛋白抗体转移至干净离心管中,取样测定蛋白浓度,使其工作浓度为0.1μg/ml,取样测定蛋白浓度后保存在2-8℃备用。
[0280]
四、制备样本稀释液
[0281]
采用精密天平精确称量2.90g na2hpo4·
12h2o、0.296g nah2po4·
2h2o、添加纯化水800ml混匀30min,调节ph值至7.2
±
0.2,继续添加8.5g nacl、5g吐温-20及20g牛血清白蛋白片段5,搅拌30min后添加纯化水定容至1l,复测ph值后,2-8℃备用。
[0282]
五、制备供体(感光液)
[0283]
(1)供体(感光微球)混悬液处理
[0284]
吸取一定量的感光微球于高速冷冻离心机中离心,弃去上清,加入一定量mes缓冲液,超声细胞破碎仪上超声至微粒重新悬浮,加入mes缓冲液调节感光微球浓度至100mg/ml。
[0285]
(2)链霉亲和素溶液配制
[0286]
称量一定量链霉亲和素,加mes缓冲液溶解至8mg/ml。
[0287]
(3)混合
[0288]
将处理好的感光微球(供体)混悬液、8mg/ml的avidin以及mes缓冲液,以2∶5∶1的体积比进行混合,迅速混匀,得到反应液。
[0289]
(4)反应
[0290]
mes缓冲液配制25mg/ml的nabh3cn溶液,按照与反应液1∶25的体积比加入,迅速混匀。37℃旋转反应48小时。
[0291]
(5)封闭
[0292]
mes缓冲液配制75mg/ml的gly溶液以及25mg/ml的nabh3cn溶液,按
[0293]
照与反应液2∶1∶10的体积比加入上述溶液中,混匀,37℃旋转反应2小时。再加入200mg/ml的bsa溶液(mes缓冲液),其与反应液体积比为5∶8,迅速混匀,37℃旋转反应16小时。
[0294]
(6)清洗
[0295]
向反应好的溶液中加入mes缓冲液,高速冷冻离心机离心,弃上清,加入新鲜mes缓冲液超声法重新悬浮,再次离心,如此清洗3次,最后用少量的感光试剂缓冲液进行悬浮,测定固含量,用感光试剂缓冲液调节工作浓度至20μg/ml,作为通用液使用。
[0296]
六、半成品及成品组成
[0297]
将上述步骤所得产品分装即为半成品,经抽检合格后组装为成品,2-8℃保存。
[0298]
七、临床血清样本测试
[0299]
血清收集:于四川tj及吉林kz收集临床血清anti-carp ab水平升高的病例共419例,其中包括已确诊为ra患者177例,非ra患者242例。以受试者工作特征曲线来确定阴阳判断标准。
[0300]
应用本实施例制备的试剂盒于全自动光激化学发光免疫分析仪lica500(上海博阳制造)上的检测步骤。
[0301]
1)样本在预稀释孔位按照1:10进行稀释,并混匀20秒;
[0302]
2)样本加样tip头吸取10μl已稀释样本或校准品至反应微孔板中;
[0303]
3)试剂加样tip头吸取25μl氨甲酰化人血清白蛋白包被受体(发光微粒)至反应微孔板中;
[0304]
4)试剂加样tip头吸取25μl生物素化的兔抗氨甲酰化蛋白抗体至反应微孔板中;
[0305]
5)混匀20秒后37℃孵育17min;
[0306]
6)试剂加样tip头吸取175μl供体(感光液,工作浓度为20μg/ml)至反应微孔板中;
[0307]
7)混匀20秒后37℃孵育15min;
[0308]
8)在仪器产生激发光照射下,供体中的感光微粒被诱导激活,并释放高能态的活性氧离子。该高能态的活性氧离子在近距离被受体(发光微粒)俘获,从而传递能量以激活受体(发光微粒)中的发光化合物。数微秒后,受体(发光微粒)中的发光化合物将释放出高能级红光,用单光子计数器测定这些高能级光子;
[0309]
9)按照上述步骤1)-8)分别测试不同浓度标准品的发光值,按照五参数拟合方法绘制标准曲线,得出发光值与anti-carp ab浓度之间的关系式;再按照步骤1)-8)分别测试待测样本的发光值,由上述关系式计算得出待测样本中anti-carp ab的浓度。
[0310]
检测结果
[0311]
校准曲线:
[0312]
表2
[0313]
浓度点发光值0u/ml1214071u/ml1040392.5u/ml821538u/ml7011920u/ml4501240u/ml21513
[0314]
结论:标准曲线度拟合方程r2>0.99,满足临床定量测定需求。
[0315]
血清测试:以123.5u/ml为临界值,本实施例1试剂盒诊断anti-carp ab水平升高为ra的敏感度和特异性分别为52%、96.3%,如图3所示:
[0316]
对于所有的血清anti-carp ab浓度升高的患者,计算取临界值为123.5u/ml时,其用于ra诊断的真阴性率为73.27%,真阳性率为91.09%,总准确率为77.56%,如表3和图4所示:
[0317]
表3
[0318]
[0319][0320]
实施例2
[0321]
与实施例1不同的是,试剂i中的氨甲酰化抗原为氨甲酰化合成多肽-bsa,试剂i为:氨甲酰化合成多肽-bsa包被受体(发光微粒)。
[0322]
一、制备氨甲酰化合成多肽-bsa
[0323]
1、取5mg的4-(n-马来酰亚胺甲基)环己烷-1-羧酸磺酸基琥珀酰亚胺酯钠盐(sulfo-smcc)溶解于800μl二甲基亚砜(dmso)中,使其终浓度为20mm。
[0324]
2、准确量取3mg干粉状的合成多肽溶解于600μl纯化水中,使其终浓度为5mg/ml。
[0325]
3、准确量取40mg bsa溶解于800μl纯化水中,使其终浓度为50mg/ml。
[0326]
4、将合成多肽溶液与bsa溶液按照质量比1:1(各2mg)充分混合溶解于2.25ml的0.01m pbs缓冲液中,室温静置1h。
[0327]
5、在上述混合溶液中加入100μl sulfo-smcc溶液,室温条件下过夜反应。
[0328]
6、将上述反应完成的反应液转移至交联透析缓冲液(0.1m pbs ph7.4)透析去除游离多肽,纯化获得氨甲酰化合成多肽-bsa保存在2-8℃备用。
[0329]
二、氨甲酰化合成多肽-bsa包被受体(发光微粒)(试剂i)
[0330]
1、取0.2mg氨甲酰化合成多肽-bsa进行透析,采用1l交联透析缓冲液1在2-8℃条件下进行透析,透析时间不少于5h,每2h更换一次透析液,换液2-3次。
[0331]
2、将步骤1中透析完成的氨甲酰化合成多肽-bsa吸出转移至干净离心管中,并取样测定蛋白浓度,蛋白浓度的测定方法为紫外光谱吸收法或采用bca蛋白定量分析试剂盒。
[0332]
3、取2mg的受体(发光微粒)加入离心管中,并对受体(发光微粒)进行洗涤。洗涤方法为12000rpm离心10min,弃上清,向离心管中加入200μl的交联透析缓冲液,采用超声波清洗5min。再次离心弃上清,重复以上清洗步骤2次。
[0333]
4、将步骤3中洗涤完毕的受体(发光微粒)置于分析天平上进行调零,取步骤1中透析后的0.1mg氨甲酰化合成多肽-bsa全部加入至装有受体(发光微粒)的离心管中并计算体积(密度按1g/ml计算),补充一定体积的交联透析缓冲液至受体(发光微粒)中,使总体积为200μl,其中微粒的浓度为10mg/ml。将离心管中两者充分混匀后置于37℃垂直旋转混合器上25-40rpm过夜反应。
[0334]
5、准确称取8mg的kbh4,溶解于标记缓冲液中,终浓度为8mg/ml。
[0335]
6、将步骤4中反应完成的离心管置于2-8℃条件下冷却10min,取4μl的步骤5中的nabh4溶液,加入至离心管中并混匀,随后将离心管置于2-8℃垂直旋转混合器上25-40rpm
反应2小时。
[0336]
7、在步骤6中反应完成的离心管中加入32μl的75mg/ml甘氨酸溶液(准确称取75mg甘氨酸,溶解于纯化水中,终浓度为75mg/ml),室温条件下垂直旋转混合器上25-40rpm反应1小时。
[0337]
8、洗涤步骤7中氨甲酰化合成多肽-bsa包被的受体(发光微粒),清洗方法为12000rpm离心10min,弃上清,向离心管中加入200μl的清洗缓冲液,并采用超声波清洗5min。再次离心弃上清,重复以上清洗步骤2次,最后使用微粒保存液清洗一次。
[0338]
9、加入微粒保存液(2.5g hepes、17.5g nacl、1.0g吐温-20、10g牛血清白蛋白片段5,添加纯化水定容至100ml)保存氨甲酰化合成多肽-bsa包被的受体(发光微粒),使其工作浓度为0.1μg/ml,保存在2-8℃备用。
[0339]
其他同实施例1
[0340]
检测结果
[0341]
校准曲线:
[0342]
表4
[0343]
浓度点发光值0u/ml1307431u/ml1101672.5u/ml986718u/ml7685420u/ml4267840u/ml19963
[0344]
结论:标准曲线度拟合方程r2>0.99,满足临床定量测定需求。
[0345]
血清测试:以123.5u/ml为临界值,本实施例2试剂盒诊断anti-carp ab水平升高为ra的敏感度和特异性分别为52%、96.3%,如图5所示:
[0346]
对于所有的血清anti-carp ab浓度升高的患者,计算取临界值为123.5u/ml时,其用于ra诊断的真阴性率为73.27%,真阳性率为91.09%,总准确率为77.56%,如表5和图6所示:
[0347]
表5
[0348]
ra样本(例)177非ra样本(例)242检出阴性(例)318真阴性(例)233真阴性率(%)73.27检出阳性(例)101真阳性(例)92真阳性率(%)91.09总准确率(%)77.56
[0349]
以上检测结果表明,实施例2制备的试剂盒的临床应用效果与实施例1制备的试剂盒处于同一水平。
[0350]
通过对串联形成多肽的氨甲酰化肽段的量进行考察实验,结果表明,对于由至少2个单一氨甲酰化肽段合成在一条肽链上形成的多肽,多个不同肽段相互之间的摩尔比相同时,所制得的多肽的活性最高。
[0351]
对比例1
[0352]
将本发明中的实施例1和实施例2制备的anti-carp ab试剂盒与现有公开的专利文献中报道的anti-carp ab的检测试剂的性能进行对比,结果如图7。
[0353]
从图7可以看出,专利wo2012/105838a1以氨甲酰化胎牛血清(ca-fcs)为抗原,采用elisa间接法检测anti-carp ab的敏感度和特异性分别为31.3%、98.8%;在专利文献wo2016/014612a2中以氨甲酰化人α1抗胰蛋白酶(ca-a1at)为抗原,采用elisa间接法检测anti-carp ab的敏感度和特异性分别为35%、98.8%。其用于ra诊断的特异性与本实施例1及实施例2中方法检测ra诊断的特异性的差距较小,而敏感度则明显低于本实施例1和实施例2。表明本发明中制备的anti-carp ab试剂盒在用于ra的诊断上相比专利wo2012/105838a1及wo2016/014612a2中制备的anti-carp ab试剂盒在敏感度这一指标上具有明显的优势。
[0354]
通过对形成氨甲酰化肽段混合物的单一氨甲酰化肽段的量进行考察实验,结果表明,对于含有至少2个单一氨甲酰化肽段的氨甲酰化肽段混合物,多个不同肽段相互之间的质量比相同时,所制得的氨甲酰化肽段混合物的活性最高。
[0355]
将上述氨甲酰化肽段混合物偶联bsa后制成本发明的试剂盒用于临床血清样本测试,检测结果表明,该试剂盒的临床应用效果与实施例1制备的试剂盒处于同一水平。
[0356]
采用按照专利pct/us2010/025433中记载的实施例中的制备方法来制备的抗原包被的受体,其结构为氨甲酰化人血清白蛋白-bsa-(二甲基噻吩)-(bhhct),其为非粒子形式,且在含水介质中可溶。利用该抗原包被的受体以及与实施例1中其他相应的试剂制备的试剂盒用于临床血清样本测试,检测结果表明,该试剂盒的临床应用效果与实施例1制备的试剂盒处于同一水平甚至更好。
[0357]
应当注意的是,以上所述的实施例仅用于解释本发明,并不构成对本发明的任何限制。通过参照典型实施例对本发明进行了描述,但应当理解为其中所用的词语为描述性和解释性词汇,而不是限定性词汇。可以按规定在本发明权利要求的范围内对本发明作出修改,以及在不背离本发明的范围和精神内对本发明进行修订。尽管其中描述的本发明涉及特定的方法、材料和实施例,但是并不意味着本发明限于其中公开的特定例,相反,本发明可扩展至其他所有具有相同功能的方法和应用。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。