1.本发明涉及微流控技术领域,特别是涉及一种微流控芯片、检测试剂盒和外泌体的检测方法。
背景技术:
2.外泌体是细胞来源的纳米级膜囊泡,在细胞间通讯中起关键作用。由于体液中的外泌体与疾病发展密切相关,因此越来越多的疾病将外泌体作为诊断生物标志物。
3.为了更好地识别外泌体,一些基于亲和力的技术,例如酶联免疫吸附测定(elisa)、纳米级流式细胞术(nanofcm),已被用于量化体液中的外泌体。elisa是一种在固-液界面上具有缓慢结合动力学的异质反应。elisa通过使用针对cd63(外泌体上富集的标记物)的捕获抗体来实现外泌体的特定定量。但elisa操作费时、繁琐的缺点使其不适合临床实施。nanofcm为外泌体的精确定量和表型分析提供了强大的工具,然而其临床应用受到定制设备和专业化操作的阻碍,并且在用nanofcm检测之前,外泌体必须先用荧光抗体预先标记,然后反复洗涤以去除多余的抗体,这导致下游外泌体分析操作繁琐和不便。
4.近年来发现,量子点具有很好的光稳定性、宽的激发光谱和窄的发射光谱及发光效率高等光学特性,是很好的外泌体荧光标记材料。因此,量子点作为外泌体的标记材料在外泌体的检测中也开始应用。目前一般是通过抗体/适配体修饰的固相载体(例如基体或磁珠)对量子点标记后的外泌体进行固定后清洗,以去除游离量子点,但这种方式得到的外泌体含量往往比实际量低,容易造成假阴性。
技术实现要素:
5.基于此,有必要提供一种微流控芯片,该微流控芯片能够改善采用量子点作为荧光标记材料时检测结果较实际量偏低的问题。
6.此外,本技术还提供了一种外泌体的检测方法。
7.包括基体、滤膜、第一电极和第二电极,所述基体上设置有分离室,所述滤膜将所述分离室分隔为第一腔和第二腔,所述第一电极位于所述第一腔内,所述第二电极位于所述第二腔内,所述第一电极与所述第二电极用于在所述分离室内形成电场,所述基体上还设置有第一进样口、第二进样口、第一出样口和第二出样口,所述第一进样口和所述第一出样口分别与所述第一腔连通,所述第二进样口和所述第二出样口分别与所述第二腔连通。
8.上述微流控芯将电场和滤膜集成到芯片,通过电场和滤膜的作用,带有负电荷的游离量子点和游离量子点标记抗体从第一腔向电源正极运动并在过滤膜后从第二出样口流出,量子点标记外泌体滤膜的拦截无法进入第二腔,并在缓冲液的带动下从第一出样口后流出,从而实现了去除游离量子点和游离量子点标记抗体的同时量子点标记外泌体均能够被检测到,被检测到的外泌体的含量更接近其真实值,不容易出现假阴性。
9.在其中一个实施例中,所述第一电极上和/或所述第二电极上设置有多孔水凝胶保护层。
10.在其中一个实施例中,所述基体包括第一基板和第二基板,所述滤膜固定于所述第一基板与所述第二基板之间,所述第一进样口和所述第一出样口均位于所述第一基板上,所述第一基板上设置有第一凹槽,所述第一凹槽与所述第一进样口连通,所述第一凹槽还与所述第一出样口连通,所述第一凹槽的槽口朝向滤膜,所述第一基板与所述滤膜围成所述第一腔,所述第一电极位于所述第一凹槽内;
11.所述第二进样口和所述第二出样口均位于所述第二基板上,所述第二基板上设置有第二凹槽,所述第二凹槽与所述第二进样口连通,所述第二凹槽还与所述第一出样口连通,所述第一凹槽的槽口朝向滤膜,所述第二基板与所述滤膜围成所述第二腔,所述第二电极位于所述第二凹槽内。
12.在其中一个实施例中,所述第一电极、所述第二电极、所述第一凹槽的槽底和所述第二凹槽的槽底在所述滤膜上的正投影重合。
13.在其中一个实施例中,所述第一电极和所述第二电极之间相距150μm~1500μm。
14.在其中一个实施例中,所述滤膜的孔径为20nm~50nm。
15.一种外泌体的检测方法,所述检测方法包括以下步骤:
16.将量子点与外泌体标志物抗体混合,制备量子点标记的外泌体标志物抗体;
17.将待检物与所述量子点标记的外泌体标志物抗体混合后孵育,制备上样液;
18.将上述的微流控芯片的第一电极与电源的负极电连接、第二电极与电源的正极电连接,将所述上样液从所述微流控芯片的第一进样口进样,缓冲液从所述微流控芯片的第二进样口进样,收集从所述微流控芯片的第一出样口的流出的液体,得到收集液;及
19.检测所述收集液中的荧光信号强度,确定所述待检物中外泌体的量。
20.在其中一个实施例中,所述电源为直流电源,所述电源的电压为2v~20v。
21.在其中一个实施例中,所述上样液的流速为5μl/min~40μl/min,所述缓冲液的流速为5μl/min~40μl/min。
22.在其中一个实施例中,所述外泌体标志物为cd63、cd81、cd9、tsg101、hsp70或alix。
23.一种检测试剂盒,包括上述的微流控芯片、缓冲剂和标记材料,所述标记材料包含量子点。
附图说明
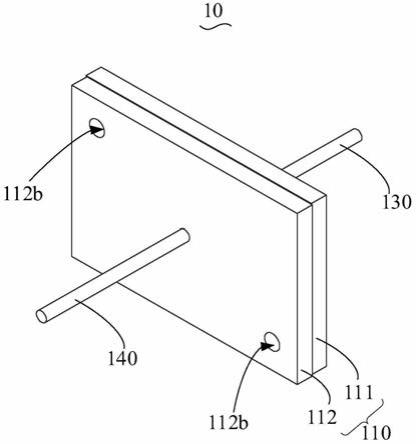
24.图1为一实施例的微流控芯片的立体图;
25.图2为图1所示的微流控芯片的爆炸图;
26.图3为图1所示的微流控芯片的剖面图;
27.图4和图5为实施例1中步骤(3)的荧光信号强度检测结果;
28.图6为实施例1中步骤(4)的第一出样口收集的溶液的电镜图;
29.图7为实施例1中步骤(4)的第二出样口收集的溶液的电镜图;
30.图8和图9为实施例1中步骤(5)的荧光信号强度检测结果;
31.图10和图11为实施例1中步骤(6)的荧光信号强度检测结果。
32.附图标记:
33.10、微流控芯片;110、基体;120、滤膜;130、第一电极;140、第二电极;111、第一基
板;112、第二基板;111a、第一进样口;111b、第一出样口;112a、第二进样口;112b、第二出样口;131、第一电极部;132、第一连接部;141、第二电极部;142、第二连接部;111c、第一凹槽;112c、第二凹槽。
具体实施方式
34.为了便于理解本发明,下面将对本发明进行更全面的描述,本发明可以以许多不同的形式来实现,并不限于本文所描述的实施例。相反地,提供这些实施例的目的是使本发明公开内容更加透彻全面。
35.需要说明的是,当元件被表述“固定于”另一个元件,它可以直接在另一个元件上、或者其间可以存在一个或多个居中的元件。当一个元件被表述“连接”另一个元件,它可以是直接连接到另一个元件、或者其间可以存在一个或多个居中的元件。当使用术语“垂直的”、“水平的”、“左”、“右”、“上”、“下”、“内”、“外”、“底部”等指示方位或位置关系时,是为基于附图所示的方位或位置关系,仅为了便于描述,而不是指示或暗示所指的装置或元件必须具有特定的方位、以特定的方位构造和操作,因此不能理解为对本技术的限制。此外,术语“第一”、“第二”等仅用于描述目的,而不能理解为指示或暗示相对重要性。术语“和/或”包括一个或多个相关的所列项目的任意的和所有的组合。
36.除非另有定义,本文所使用的所有的技术和科学术语与属于本发明的技术领域的技术人员通常理解的含义相同。本文中在本发明的说明书中所使用的术语只是为了描述具体的实施例的目的,不是旨在于限制本发明。
37.请参阅图1~图3,本技术一实施方式提供了一种微流控芯片10,该微流控芯片10包括基体110、滤膜120、第一电极130和第二电极140,基体110上设置有分离室,滤膜120将分离室分隔为第一腔和第二腔,第一电极130位于第一腔内,第二电极140位于第二腔内,第一电极130与第二电极140用于在分离室内形成电场,基体110上还设有第一进样口111a、第二进样口112a、第一出样口111b和第二出样口112b,第一进样口111a和第一出样口111b均与第一腔连通,第二进样口112a和第二出样口112b均与第二腔连通。
38.在通过抗体/适配体修饰的固相载体(例如基体110或磁珠)对量子点标记后的外泌体进行固定后清洗以去除游离量子点的方法中,由于量子点标记后的外泌体的固定依赖于外泌体与固相载体上的抗体/适配体的特异性结合,然而,在实际过程中,所挑选的抗体/适配体往往不适用于所有的外泌体。因此,部分量子点标记外泌体在清洗过程中会被洗掉,从而使得被检测的外泌体的量往往低于实际量,从而容易出现假阴性。
39.而上述微流控芯将电场和滤膜120集成到芯片,通过电场和滤膜120的作用,带有负电荷的游离量子点标记抗体和游离量子点从第一腔向正极运动并过滤膜120后从第二出样口112b流出,量子点标记外泌体因滤膜120的拦截并在缓冲液的带动下从第一出样口111b后流出,从而实现了快速去除游离量子点和游离量子点标记抗体的同时量子点标记外泌体均能够被检测到。采用上述微流控芯片10检测外泌体时不必采用抗原/抗体或配体/受体这类特异性结合的方式固定量子点标记外泌体以去除游离量子点和游离量子点标记抗体,避免了部分量子点标记外泌体被损失而被检测到的外泌体量减少的情况,不容易出现假阴性,准确性高。此外,通过控制电场大小、缓冲液的流速,可以使得无法通过滤膜120的物质能够及时被清理出电场,能通过滤膜120的物质能够及时离开滤膜120,避免滤膜120堵
塞。另外,采用上述微流控芯片10去除游离量子点和游离量子点标记抗体得到的量子点标记外泌体溶液可以直接用于检测,而传统的过滤无法直接得到检测所用的含有量子点标记外泌体溶液,无法实现实时在先检测。
40.在本实施方式中,基体110作为微流控芯片10的基体110;滤膜120的孔径为20nm~50nm,用于拦截量子点标记外泌体并允许游离量子点和游离量子点标记抗体;第一电极130作为负极,第二电极140作为正极,第一电极130与第二电极140用于在分离室内形成电场;第一进样口111a用于含有待检物、量子点和量子点标记抗体的混合物的进样;第二进样口112a用于缓冲液进样;第一出样口111b用于量子点标记外泌体的流出;第二出样口112b用于游离量子点和游离量子点标记抗体的流出。当然,在第一电极130作为正极,第二电极140作为负极时,第一进样口111a用于缓冲液进样,第二进样口112a用于含有待检物、量子点和量子点标记抗体的混合物进样;第一出样口111b用于游离量子点和游离量子点标记抗体流出;第二出样口112b用于量子点标记外泌体流出。
41.在一个可选地具体示例中,滤膜120的孔径为30nm。采用滤膜120孔径为30nm的上述微流控芯片10进行外泌体提取时,游离量子点标记抗体的分离效率可以达到95%以上。在另一个可选地具体示例中,滤膜120的孔径为20nm。采用滤膜120孔径为20nm的上述微流控芯片10进行外泌体提取时,游离量子点标记抗体的分离效率可以达85%。在另一个可选地具体示例中,滤膜120的孔径为50nm。采用滤膜120的孔径为50nm的上述微流控芯片10进行外泌体提取时,游离量子点标记抗体的分离效率可以达大量98%;另外,虽然此时外泌体有小部分损失,但损失的这部分的量仍然比传统的采用抗原/抗体或配体/受体这类特异性结合的方式少。当然,在上述微流控芯片10并非用于去除游离量子点和游离量子点标记抗体而是其他物质时,滤膜120的孔径可以根据需要过滤的物质进行调整。
42.在一些实施例中,基体110包括第一基板111和第二基板112,滤膜120固定于第一基板111与第二基板112之间。在其中一个实施例中,第一进样口111a和第一出样口111b均位于第一基板111上,第一基板111上设置有第一凹槽111c,第一凹槽111c与第一进样口111a连通,第一凹槽111c还与第一出样口111b连通,第一凹槽111c的槽口朝向滤膜120,第一基板111与滤膜120围成第一腔,第一电极130位于第一凹槽111c内。第二进样口112a和第二出样口112b均位于第二基板112上,第二基板112上设置有第二凹槽112c,第二凹槽112c与第二进样口112a连通,第二凹槽112c还与第一出样口111b连通,第一凹槽111c的槽口朝向滤膜120,第二基板112与滤膜120围成第二腔,第二电极140位于第二凹槽112c内。
43.进一步地,第一电极130、第二电极140、第一凹槽111c的槽底和第二凹槽112c的槽底在滤膜120上的正投影重合。通过将第一电极130、第二电极140、第一凹槽111c的槽底和第二凹槽112c的槽底在滤膜120上的正投影设置为重合,使得第一电极130和第二电极140形成的电场能作用于分离室的所有流体,提高分离效率。
44.在一些实施例中,第一基板111上还设置有第一流道和第二流道,第一进样口111a通过第一流道与第一凹槽111c连通,第一出样口111b通过第二流道与第一凹槽111c连通。第二基板112上还设置有第三流道和第四流道,第二进样口112a通过第三流道与第二凹槽112c连通,第二出样口112b通过第四流道与第二凹槽112c连通。
45.在图示的实施例中,第一基板111为方块状,第二基板112为方块状;第一凹槽111c为圆柱形,第二凹槽112c呈圆柱形,可以理解的是,在其他实施例中,第一基板111、第二基
板112、第一凹槽111c和第二凹槽112c的形状均不限于上述,还可以是其他形状。
46.在一些实施例中,第一电极130包括第一电极部131和第一连接部132。第一电极部131位于第一腔内,用于与第二电极140形成电场;第一连接部132与第一电极部131连接,用于与外部电源连接。第二电极140包括第二电极部141和第二连接部142。第二电极部141位于第二腔内并与第一电极部131相对,用于与第一电极130形成电场;第二连接部142与第二电极部141连接,用于与外部电源连接。进一步地,第一电极部131、第一凹槽111c的底部、第二电极部141和第二凹槽112c的底部在滤膜120上的正投影重合。
47.在图示的实施例中,第一电极部131呈圆盘状,第一连接部132呈圆柱状,第一连接部132自第一凹槽111c的底部凸出第一基板111向远离滤膜120的方向延伸。第二电极部141呈圆盘状,第二连接部142呈圆柱状,第二连接部142自第二凹槽112c的底部凸出第二基板112向远离滤膜120的方向延伸。可以理解的是,在其他实施例中,第一电极部131、第一连接部132、第二电极部141和第二连接部142的形状不限于上述,还可以是其他形状。另外,第一连接部132也不必凸出第一基板111;第二连接部142也不必凸出第二基板112。
48.在一些实施例中,第一电极130上设置有多孔水凝胶保护层。通过多孔水凝胶保护层的设置,使得电极材料隔绝流体的同时保持高电场输出。进一步地,位于第一凹槽111c中的第一电极130的表面覆盖有多孔水凝胶保护层。
49.在一些实施例中,第二电极140上设置有多孔水凝胶保护层。进一步地,位于第二凹槽112c中的第二电极140的表面覆盖有多孔水凝胶保护层。
50.在一些实施例中,第一电极130和第二电极140之间相距150μm~1500μm。在一个可选地具体示例中,第一电极130和第二电极140之间相距150μm、300μm、600μm或1200μm。进一步地,第一电极130和第二电极140之间相距150μm~1500μm。需要说明的是,第一电极130和第二电极140相距的距离是指第一电极130的靠近滤膜120的表面与第二电极140的靠近滤膜120的表面之间的距离。
51.另外,本技术一实施方式还提供了一种外泌体的检测方法,该检测方法包括采用上述滤膜120孔径为20nm~50nm的微流控芯片10去除游离量子点和游离量子点标记抗体的步骤。具体地,该检测方法包括以下步骤:
52.步骤s1:将量子点与外泌体标志物抗体混合,制备含有量子点标记的外泌体标志物抗体的混合溶液。
53.外泌体标志物抗体是指能与外泌体标志物特异性结合的抗体。将量子点与外泌体标志物抗体混合后孵育,使得外泌体标志物抗体上标记量子点,形成量子点标记的外泌体标志物抗体。量子点标记的外泌体标志物抗体用于与外泌体特异性结合,从而形成量子点标记外泌体,进而用于检测外泌体。
54.在一些实施例中,将量子点活化后与外泌体标志物抗体混合,制备含有量子点标记的外泌体标志物抗体的混合溶液。其中一个实施例中,量子点活化剂为1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(edc)。在edc的作用下,抗体与量子点形成酰胺键,从而将抗体共价固定在量子点的表面。可选地,量子点与edc和抗体的氨基的摩尔之比为(0.8~1.5):(80~110):(5~20)。在一个可选地具体示例中,量子点与edc和抗体的氨基的摩尔之比为1:100:5。可以理解的是,量子点活化剂不限于上述。
55.在其中一个实施例中,外泌体标志物为cd63、cd81、cd9、tsg101、hsp70或alix。
56.可以理解的是,在一些实施例中,还可以将混合液中未反应的物质去除后进行后续步骤。例如采用离心的方式将未与外泌体标志物抗体结合的量子点去除。
57.步骤s2:将待检物与步骤s1得到的混合溶液混合后孵育,制备上样液。
58.在其中一个实施例中,孵育的温度为2℃~6℃。例如,4℃。
59.步骤s3:将上述微流控芯片10的第一电极130与电源的负极电连接、第二电极140与电源的正极电连接,将上样液从微流控芯片10的第一进样口111a进样,缓冲液从微流控芯片10的第二进样口112a进样,收集从微流控芯片10的第一出样口111b的流出的液体,得到收集液。
60.在一些实施例中,电源为直流电源,电源的电压为2v~20v。在一个可选地具体示例中,电源的电压为2.5v、5v、10v或20v。进一步地,电源的电压为2v~20v。
61.在一些实施例中,上样液的流速为5μl/min~40μl/min,缓冲液的流速为5μl/min~40μl/min。进一步地,上样液的流速为5μl/min~40μl/min,缓冲液的流速为5μl/min~40μl/min。在一个可选地具体示例中,上样液的流速为5μl/min,缓冲液的流速为10μl/min。
62.在其中一个实施例中,缓冲液为pbs缓冲液。可以理解的是,缓冲液不限于上述,还可以是其他缓冲液。
63.在一个可选地具体示例中,滤膜120的孔径为20nm、30nm、40nm或50nm。
64.步骤s4:检测步骤s3的收集液中的荧光信号强度,确定待检物中外泌体的量。
65.具体地,根据外泌体浓度与荧光信号强度的关系曲线、收集液中荧光信号强度和收集液的体积,从而确定待检物中外泌体的量。
66.上述外泌体的检测方法,采用上述微流控芯片10分离游离量子点、游离量子点标记抗体和量子点标记外泌体,分离效率高,可以达到95%以上。并且上述外泌体的检测方法由于采用了上述微流控芯片10,直接可以检测外泌体含量,操作简便。
67.此外,基于上述,本技术一实施方式还提供了一种检测试剂盒,该检测试剂盒包括上述任一实施例的微流控芯片、缓冲剂和标记材料,其中,标记材料包含量子点。上述检测试剂盒可应用于检测生物标志物的含量。
68.在其中一个实施例中,缓冲剂为缓冲液。可选地缓冲剂为pbs缓冲液。
69.在其中一个实施例中,标记材料为量子点标记抗体。量子点标记抗体用于与待测标志物结合。
70.在另一个实施例中,标记材料包括量子点和待标记抗体。在使用时,需将量子点标记待标记抗体制成量子点标记抗体。
71.在其中一个实施例中,上述检测试剂盒用于检测外泌体。可选地,外泌体标志物为cd63、cd81、cd9、tsg101、hsp70或alix。在另一些实施例中,上述检测试剂盒用于检测癌症(例如肺癌或胰腺癌)标志物。可选地,标志物选自pd-l1、her 2、cea、ca125和cd151中的一种。可以理解的是,在检测不同物质时,滤膜的孔径需要根据试剂情况进行调整。
72.上述检测试剂盒包括上述微流控芯片,具有其相应的优点。
73.具体实施例
74.以下结合具体实施例进行详细说明。以下实施例如未特殊说明,则不包括除不可避免的杂质外的其他组分。实施例中采用试剂和仪器如非特别说明,均为本领域常规选择。实施例中未注明具体条件的实验方法,按照常规条件,例如文献、书本中所述的条件或者生
产厂家推荐的方法实现。
75.实施例1
76.(1)抗体(cd63、cd81)与量子点(qds)的偶联:本实施例中所使用的qds富含羧基官能团,在活化剂1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(edc)作用下,与抗体的氨基反应形成稳定的酰胺键,从而将抗体共价固定在量子点表面。具体地,在硼酸盐缓冲液溶液中加入edc活化qds的羧基1h,然后将量子点重悬于mes缓冲液中并加入抗体,室温反应2h,其中qds:edc:抗体的-nh2摩尔之比为1:100:5然后13000rpm 1min离心,制备得到量子点标记的cd63抗体和量子点标记的cd81抗体;将量子点标记的cd63抗体和量子点标记的cd81抗体分别重悬在封闭液中,4℃储存,制备量子点标记的cd63抗体溶液和量子点标记的cd81抗体溶液。
77.(2)通过超离法提取a549细胞上清外泌体,并将1μl的量子点标记的cd63抗体溶液和量子点标记的cd81抗体溶液分别与30μl外泌体溶液,在4℃混匀孵育过夜。
78.(3)在结构如图1所示且滤膜孔径为30nm的微流控芯片的第一电极接电源负电极,第二电极接电源正电极,直流稳压电源电压设置为10v。从第一进样口(上层进样口)进步骤(1)制备的量子点标记的cd63抗体溶液,流速为5μl/min;从第二进样口(下层进样口)进pbs溶液,流速为10μl/min,分离30min,分别收集第一出样口和第二出样口的溶液,通过多功能酶标仪测定其荧光强度,计算量子点标记的cd63抗体的分离效率。
79.通过酶标仪检测微流控芯片对量子点标记的cd63抗体的分离情况,结果如图4和图5所示。由图4和图5可知,微流控芯片对量子点标记的cd63抗体有这很好的分离效果,分离效率大于95%(分离效率的计算包括:绘制量子点的浓度与荧光信号强度之间的关系曲线,然后测定进样游离量子点溶液、分离后正、负电极处收集溶液的荧光强度,计算出对应的量子点含量,分离效率(%)=正电极处收集溶液量子点/总进样量子点
×
100)。
80.(4)在结构如图1所示且滤膜孔径为30nm的微流控芯片的第一电极接电源负电极,第二电极接电源正电极,直流稳压电源电压设置为10v。从第一进样口进量子点标记的cd63抗体溶液与外泌体溶液孵育过夜后的混合溶液,流速为5μl/min;从第二进样口进pbs溶液,流速为10μl/min,分离30min,分别收集第一出样口和第二出样口的溶液,并通过多功能酶标仪测定其荧光信号强度,使用透射扫描电子显微镜观察正负极收集液的形貌。其中透射电镜结果如图6和图7所示。
81.由图6和图7可知,可见游离的量子点标记的cd63抗体成功被分离,且量子点标记的外泌体被很好的保留。
82.(5)在结构如图1所示且滤膜孔径为30nm的微流控芯片的第一电极接电源负电极,第二电极接电源正电极,直流稳压电源电压设置为10v。从第一进样口分别进量子点标记的cd63抗体与不同浓度的外泌体溶液孵育过夜后的混合溶液,流速为5μl/min;从第二进样口进pbs溶液,流速为10μl/min,分离30min,分别收集第一出样口和第二出样口的溶液,通过多功能酶标仪测定其荧光信号强度,结果如图8和图9所示。
83.(6)在结构如图1所示且滤膜孔径为30nm的微流控芯片的第一电极接电源负电极,第二电极接电源正电极,直流稳压电源电压设置为10v。从第一进样口分别进量子点标记的cd81抗体与不同浓度的外泌体溶液孵育过夜后的混合溶液,流速为5μl/min;从第二进样口进pbs溶液,流速为10μl/min,分离30min,分别收集第一出样口和第二出样口的溶液,通过
多功能酶标仪测定其荧光信号强度,结果如图10和图11所示。
84.由图8~11可知,外泌体浓度与荧光信号强度相关性好,检测限可以达到2.52
×
103particles/ml。
85.以上所述实施例的各技术特征可以进行任意的组合,为使描述简洁,未对上述实施例中的各个技术特征所有可能的组合都进行描述,然而,只要这些技术特征的组合不存在矛盾,都应当认为是本说明书记载的范围。
86.以上所述实施例仅表达了本发明的几种实施方式,便于具体和详细地理解本发明的技术方案,但并不能因此而理解为对发明专利保护范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。应当理解的是,在本领域技术人员在本发明提供的技术方案的基础上,通过合乎逻辑的分析、推理或有限的试验得到的技术方案,均在本发明所附权利要求的保护范围内。因此,本发明专利的保护范围应以所附权利要求的内容为准,说明书及附图可以用于解释权利要求的内容。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。