1.本发明属于生物医药技术领域,涉及一种治疗勃起功能障碍的药物及其应用。
背景技术:
2.勃起功能障碍(ed)的发病过程主要分为早期海绵体功能性障碍,和晚期海绵体结构性变化两个阶段。前者阴茎海绵体的形态结构未发生明显变化,可使用5型磷酸二酯酶抑制剂(pde5i),如西地那非或他达拉非等药物通过改善平滑肌的舒张状态进行有效治疗;后者主要病理表现为海绵体组织纤维化,包括内皮细胞损伤,平滑肌纤维化和成纤维细胞增生,目前认为转化生长因子-β(transforming growth factor-β,tgfβ)是导致这一过程最重要的上游信号,但目前在ed治疗领域缺乏针对这一信号的有效干预措施,导致晚期ed病人通常通过人工海绵体植入术等有创操作进行治疗。
3.开发治疗海绵体组织纤维化的药物是本领域研究重点之一,如cn112245414a公开了姜黄素或其载药体系在制备治疗阴茎勃起功能障碍的药物中的用途,实验证明,姜黄素及姜黄素缓释药膜能够可通过上调gap-43和map-2的表达来促进神经轴突的生长,通过上调oct-6和krox-20的表达来促进施万细胞合成分泌髓鞘相关蛋白,促进神经轴突髓鞘的形成。同时,其还能够有效促进大鼠海绵体神经损伤后的修复再生,恢复海绵体神经通路连续性,增加阴茎组织神经末梢nnos mrna和蛋白的表达;其还可以进一步改善海绵体神经损伤大鼠的阴茎勃起功能,同时降低阴茎组织纤维化程度,有效促进海绵体神经损伤后的阴茎康复,然而,目前针对ed患者海绵体纤维化的有效药物仍较少。
4.yes相关蛋白1(yes-associatedprotein 1,yap1)是hippo信号通路(hippo pathway)中的一个分子,在hippo信号通路正常的情况下,yap1处于非激活状态,当hippo信号通路中的某些分子出现突变时,yap1处于超激活状态,此时,超激活状态下的yap1可以促进细胞增殖、转移、生存以及维持干细胞活性,由于yap1的超激活可以促进肿瘤的发生与发展,因此,yap1被定义为一种癌蛋白。
5.现有技术中,yap1蛋白与勃起功能障碍的关系还未见报道。
技术实现要素:
6.针对现有技术的不足和实际需求,本发明提供一种治疗勃起功能障碍的药物及其应用,所述治疗勃起功能障碍的药物包括yes相关蛋白1的抑制剂,本发明首次发现抑制yes相关蛋白1(yap1蛋白)可抑制tgfβ介导的人阴茎内皮细胞损伤和海绵体纤维化,为开发治疗勃起功能障碍的药物提供新思路。
7.为达上述目的,本发明采用以下技术方案:
8.第一方面,本发明提供一种治疗勃起功能障碍的药物,所述药物包括yes相关蛋白1的抑制剂。
9.本发明中,通过单细胞测序技术检测了正常人和勃起功能障碍(ed)病人阴茎海绵体,首次发现yap1蛋白的异常激活是转化生长因子-β(transforming growth factor-β,
tgfβ)促进海绵体内皮细胞损伤和平滑肌纤维化的主要辅助因素,并在体外细胞实验中,证明了抑制yap1蛋白可抑制tgfβ导致的人阴茎海绵体内皮细胞损伤;在体外组织培养实验中,证明了抑制yap1蛋白可延缓tgfβ介导的人阴茎海绵体纤维化,即,首次发现yap1蛋白的抑制剂具有作为治疗勃起功能障碍的药物的潜力,为开发治疗勃起功能障碍的药物提供新思路。
10.根据本发明,能够抑制yap1蛋白活性的抑制剂均具有作为治疗勃起功能障碍的药物的潜力。
11.优选地,所述yes相关蛋白1的抑制剂包括yap-tead inhibitor 1(peptide17)、ted-347或维替泊芬(verteporfin)中的任意一种或至少两种的组合,优选为yap-tead inhibitor 1。
12.本发明中,yap-tead inhibitor 1(peptide17),化学式为c
93h144
cln
23o21
s2,能够有效抑制yap蛋白和tead蛋白间相互作用;ted-347是一种有效,不可逆且共价的yap-tead蛋白质-蛋白质相互作用变构抑制剂;verteporfin,化学式为c41h42n4o8,是一种yap抑制剂,可破坏yap-tead相互作用。
13.优选地,所述治疗勃起功能障碍的药物还包括辅料。
14.优选地,所述辅料包括药学可接受的载体、赋形剂或稀释剂中的任意一种或至少两种的组合。
15.优选地,所述治疗勃起功能障碍的药物的剂型包括混悬剂、颗粒剂、胶囊剂、散剂、片剂、乳剂、溶液剂、滴丸剂、注射剂、栓剂、灌肠剂、气雾剂、贴剂或滴剂中的任意一种。
16.优选地,所述治疗勃起功能障碍的药物抑制海绵体组织纤维化。
17.第二方面,本发明提供yes相关蛋白1的抑制剂在制备治疗勃起功能障碍的药物中的应用。
18.优选地,所述yes相关蛋白1的抑制剂包括yap-tead inhibitor 1(peptide17)、ted-347或维替泊芬(verteporfin)中的任意一种或至少两种的组合。
19.第三方面,本发明提供yes相关蛋白1的抑制剂在制备抑制海绵体组织纤维化的药物中的应用。
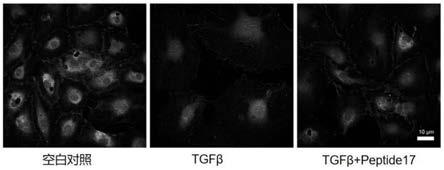
20.优选地,所述yes相关蛋白1的抑制剂包括yap-tead inhibitor 1(peptide17)、ted-347或维替泊芬(verteporfin)中的任意一种或至少两种的组合。
21.第四方面,本发明提供yes相关蛋白1的抑制剂在制备以非疾病诊断为目的的抑制海绵体组织纤维化的产品中的应用。
22.优选地,所述yes相关蛋白1的抑制剂包括yap-tead inhibitor 1(peptide17)、ted-347或维替泊芬(verteporfin)中的任意一种或至少两种的组合。
23.本发明中,首次发现yes相关蛋白1的抑制剂能够抑制tgfβ导致的人阴茎海绵体内皮细胞损伤及延缓tgfβ介导的人阴茎海绵体纤维化,证明yes相关蛋白1的抑制剂可应用于制备以非疾病诊断为目的的抑制海绵体组织纤维化的产品,所述抑制海绵体组织纤维化的产品可进一步应用于海绵体纤维化机制的研究等领域。
24.与现有技术相比,本发明具有以下有益效果:
25.本发明中,首次发现yap1蛋白的异常激活是tgfβ促进海绵体内皮细胞损伤和平滑肌纤维化的主要辅助因素,并证明了抑制yap1蛋白可抑制tgfβ导致的人阴茎海绵体内皮细
胞损伤以及tgfβ介导的人阴茎海绵体纤维化,即,首次发现yap1蛋白的抑制剂具有作为治疗勃起功能障碍的药物的潜力,为开发治疗勃起功能障碍的药物提供新思路。
附图说明
26.图1为人海绵体内皮细胞标志物cd31和vwf的免疫荧光染色图,比例尺为10μm;
27.图2为使用peptide17处理内皮细胞72小时后,内皮细胞标志物cd31和vwf的免疫荧光染色图;
28.图3为人海绵体组织masson染色结果图,比例尺为100μm;
29.图4为海绵体组织中平滑肌与胶原白含量比图。
具体实施方式
30.为进一步阐述本发明所采取的技术手段及其效果,以下结合实施例和附图对本发明作进一步地说明。可以理解的是,此处所描述的具体实施方式仅仅用于解释本发明,而非对本发明的限定。
31.实施例中未注明具体技术或条件者,按照本领域内的文献所描述的技术或条件,或者按照产品说明书进行。所用试剂或仪器未注明生产厂商者,均为可通过正规渠道商购获得的常规产品。
32.本发明实施例中,peptide17购买于、ted-347购买于和维替泊芬(verteporfin)购买于selleck,转化生长因子-β(tgfβ)购买于阿拉丁试剂。
33.实施例1
34.本实施例分离人海绵体内皮细胞并进行体外培养,包括:
35.手术获取的新鲜海绵体组织,使用消化酶(4mg/ml的iv型胶原酶、4mg/ml的i型胶原酶、3mg/ml的透明质酸酶和1.5mg/ml的胰酶)消化30min,然后使用组织滤网去除成块组织,离心保留细胞成分,使用内皮细胞培养基(lonza,egm-2)重悬后进行培养,待生长3天内皮集落形成后,加入成纤维细胞抑制剂(齐氏生物,fibrout 11),期间每3天换液,获取的内皮细胞。
36.实施例2
37.本实施例分离人海绵体组织并进行体外培养,包括:
38.手术获取的新鲜海绵体组织,切割成2mm
×
2mm左右大小,使用10%fbs的低糖dmem培养基,37℃培养箱中放置一台振荡摇床,将组织放置在摇床上进行培养。
39.实施例3
40.本实施例利用实施例1培养的人海绵体内皮细胞测试yap1蛋白的抑制剂(peptide17、ted-347和维替泊芬)治疗人海绵体内皮细胞损伤的效果。
41.取实施例1培养的人海绵体内皮细胞(5000个/96孔板单孔),分别使用下列条件进行处理72小时,a:不进行处理作为空白对照;b:加入100ng/ml的tgfβ处理(阴性对照);c:加入100ng/ml tgfβ和10μm peptide17处理(实验组),处理完毕后,使用内皮细胞标志物vwf和cd31免疫荧光染色检测内皮细胞的生物学特征,结果如图1所示。
42.由图1可知,空白对照组海绵体内皮细胞特征维持稳定,tgfβ处理组海绵体内皮细胞由相互邻近生长变为分散生长,细胞体积变大,海绵体内皮细胞标志物丢失,表现为明显
的内皮损伤状态,表明tgfβ能够引起海绵体内皮细胞损伤,而tgfβ和peptide17处理组的海绵体内皮损伤情况明显较tgfβ处理组轻微,表明peptide17可显著改善tgfβ诱导的海绵体内皮细胞损伤。
43.实施例4
44.本实施例检测peptide17安全性。
45.取实施例1培养的人海绵体内皮细胞,分别使用下列条件进行处理72小时,a:不进行处理作为空白对照,b:加入10μm peptide17,并检测内皮细胞生长状态,结果如图2所示,结果表明peptide17并不影响海绵体内皮细胞的生长状态,表明peptide17对于内皮细胞具有安全性。
46.实施例5
47.本实施例利用实施例2培养的人海绵体组织测试yap1蛋白的抑制剂(peptide17、ted-347和维替泊芬)治疗人海绵体组织纤维化的效果。
48.取实施例2培养的人海绵体组织,使用100ng/ml tgfβ处理后,分别使用3种yap1抑制剂(peptide17、verteporfin和ted-347)进行处理,以未处理人海绵体组织作为空白对照(nc),以仅使用tgfβ处理的人海绵体组织为阴性对照,分别于处理第3天和第7天收样,使用masson染色判断平滑肌和胶原蛋白(纤维化的主要成分)所占比例,染色结果图如图3所示,平滑肌和胶原蛋白比结果图如图4所示,由图3和图4可知,单独tgfβ处理后,海绵体组织中胶原蛋白比例明显升高,明显发生纤维化,而在tgfβ处理后继续使用yap1抑制剂处理后,海绵体中平滑肌维持较高比例,纤维化被明显抑制,且与verteporfin和ted-347相比,peptide17维持平滑肌和抑制胶原蛋白形成的效果最佳,综和上述,表明yap1抑制剂能够治疗人海绵体组织纤维化。
49.综上所述,本发明首次发现yap1蛋白的异常激活是转化生长因子-β(transforming growth factor-β,tgfβ)促进海绵体内皮细胞损伤和平滑肌纤维化的主要辅助因素,并在体外细胞实验中,证明了抑制yap1蛋白可抑制tgfβ导致的人阴茎海绵体内皮细胞损伤;在体外组织培养实验中,证明了抑制yap1蛋白可延缓tgfβ介导的人阴茎海绵体纤维化,即,首次发现yap1蛋白的抑制剂具有作为治疗勃起功能障碍的药物的潜力,为开发治疗勃起功能障碍的药物提供新思路。
50.申请人声明,本发明通过上述实施例来说明本发明的详细方法,但本发明并不局限于上述详细方法,即不意味着本发明必须依赖上述详细方法才能实施。所属技术领域的技术人员应该明了,对本发明的任何改进,对本发明产品各原料的等效替换及辅助成分的添加、具体方式的选择等,均落在本发明的保护范围和公开范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
