用于在癫痫或癫痫发作中使用的作为kv7钾通道开放剂的醇衍生物
技术领域
1.本发明涉及激活kv7钾通道的新颖的化合物在治疗癫痫或癫痫发作中的用途。
背景技术:
2.电压依赖性钾(kv)通道响应于膜电位的变化引导钾离子(k
)跨过细胞膜,并且可以因此通过调节(增加或降低)细胞的电活性来调节细胞的兴奋性。功能kv通道作为由四个α亚基和四个β亚基缔合所形成的多聚体结构而存在。α亚基包含六个跨膜结构域、一个成孔环和一个电压感受器,并且围绕中心孔对称排列。β亚基或辅助亚基与α亚基相互作用,并且可以修饰通道复合体的特性以包括但不限于在通道的电生理学或生物物理学特性、表达水平或表达模式方面的改变。
3.已经鉴定了九种kv通道α亚单位家族并称作kv1-kv9。因此,kv通道功能存在巨大的多样性,该巨大的多样性的产生是由于亚家族的多重性、亚家族中同聚亚基和异聚亚基二者的形成以及与β亚基缔合的附加效应(christie,25clinical and experimental pharmacology and physiology[临床和实验药理学与生理学],1995,22,944-951)。
[0004]
kv7通道家族由至少五个成员组成,这些成员包括以下哺乳动物通道中的一种或多种:kv7.1、kv7.2、kv7.3、kv7.4、kv7.5以及其任何哺乳动物或非哺乳动物等价物或变体(包括剪接变体)。可替代地,该家族的这些成员分别由基因名称kcnq1、kcnq2、kcnq3、kcnq4和kcnq5来命名(dalby-brown等人,current topics in medicinal chemistry[医药化学当前论题],2006,6,9991023)。
[0005]
如以上提及的,神经元的kv7钾通道在控制神经元兴奋方面发挥作用。kv7通道(特别是kv7.2/kv7.3异二聚体)是m电流的基础(wang等人science.[科学]1998年12月4日;282(5395):1890-3)。m电流具有特征性的时间和电压依赖性,导致响应于多个兴奋性刺激的膜电位的稳定化。
[0006]
以此方式,m电流参与控制神经元兴奋性(delmas和brown,nature[自然],2005,6,850-862)。m电流是在许多神经元细胞类型中发现的非失活性钾电流。在每种细胞类型中,通过作为在动作电位起始范围内唯一的持续电流,m电流在控制膜兴奋性方面占据优势(marrion,annual review physiology[生理学年评]1997,59,483-504)。
[0007]
瑞替加滨(n-(2-氨基-4-(4-氟苄基氨基)-苯基)氨基甲酸乙基酯)是结合至kv7钾通道的化合物(wuttke等人,molecular pharmacology[分子药理学],2005,67,1009-1017)。瑞替加滨激活神经元细胞中的k
电流,并且这种诱发电流的药理学显示与m-通道的已公开的药理学相一致,该m-通道的已公开的药理学与kv7.2/3k
通道异源多聚体相关,这表明kv7.2/3通道的激活是该药剂的至少一些抗惊厥活性的原因(wickenden等人,molecular pharmacology[分子药理学]2000,58,591-600);gunthorpe等人epilepsia.[癫痫]2012年3月;53(3):412-24)。瑞替加滨可有效降低癫痫患者癫痫发作的发病率(bialer等人,epilepsy research[癫痫研究]2002,51,31-71)。瑞替加滨具有广谱和有效的抗惊厥
特性。在一系列抗惊厥测试中,瑞替加滨在大鼠和小鼠中经口和腹膜内施用后是有活性的(rostock等人,epilepsy research[癫痫研究]1996,23,211-223)。
[0008]
此家族的五个成员在它们的表达模式方面存在不同。kv7.1的表达限于心脏、外周上皮和平滑肌,然而kv7.2、kv7.3、kv7.4和kv7.5的表达似乎在包括海马体、皮质、腹侧被盖区、和背根神经节神经元的神经系统中占优势(针对评论,参见greene和hoshi,cellular and molecular life sciences[细胞和分子生命科学],2017,74(3),495-508)。
[0009]
kcnq2和kcnq3基因似乎在被称为良性家族性新生儿惊厥的癫痫遗传形式中发生突变(rogawski,trends in neurosciences[神经科学趋势]2000,23,393-398)。由kcnq2和kcnq3基因编码的蛋白质定位于人皮层和海马的锥体神经元,与癫痫发作产生和增殖相关的脑区域(cooper等人,proceedings national academy of science u s a[美国国家科学院院刊]2000,97,4914-4919)。
[0010]
此外,除了kv7.2的mrna之外,kv7.3和5的mrna在星形胶质细胞和神经胶质细胞中表达。因此kv7.2、kv7.3和kv7.5通道可以帮助调节cns中的突触活动,并有助于kcnq通道开放剂的神经保护作用(noda等人,society for neuroscience abstracts[神经科学学会摘要]2003,53.9),这些kcnq通道开放剂将与神经退行性障碍(如但不限于阿尔茨海默病、帕金森病和亨廷顿舞蹈症)的治疗有关。
[0011]
在与焦虑和情感行为(如抑郁和双相型障碍)相关的大脑区域(如海马体、腹侧被盖区和杏仁核)中发现kv7.2和kv7.3亚基的mrna(saganich等人journal of neuroscience[神经科学杂志]2001,21,4609-4624;friedman等人,nat commun.[自然通讯]2016;7:11671.),并且据报道瑞替加滨在焦虑样行为的动物模型中有活性(korsgaard等人j pharmacol exp ther.[药理学和实验治疗学杂志]2005年7月;314(1):282-92.epub 2005年4月6日。)。因此,kv7通道与治疗情感相关的障碍有关,这些情感相关的障碍如但不限于双相型抑郁、重型抑郁、焦虑、自杀、恐慌症、社交恐惧症。
[0012]
还已经报道了kv7.2/3通道在神经性疼痛模型中是上调的(wickenden等人,society for neuroscience abstracts[神经科学学会摘要]2002,454.7),并且已经假定钾通道调节剂在神经性疼痛和癫痫二者中是有活性的(schroder等人,neuropharmacology[神经药理学]2001,40,888-898)。除了在神经性疼痛中的作用之外,在三叉神经和背根神经节以及在三叉神经尾核中的kv7.2-5的mrna表达意味着这些通道的开放剂也可以影响偏头痛的感觉加工(goldstein等人society for neuroscience abstracts[神经科学学会摘要]2003,53.8)。综合起来,这个证据表明用于治疗慢性疼痛和神经病相关障碍的kcnq通道开放剂的相关性。
[0013]
wo 07/90409涉及kv7通道开放剂用于治疗精神分裂症的用途。kv7通道开放剂调节多巴胺能系统的功能(friedman等人,nat commun.[自然通讯]2016;scotty等人j pharmacol exp ther.[药理学与实验治疗学杂志]2009年3月;328(3):951-62.doi:10.1124/jpet.108.146944.epub 2008年12月19日;koyama等人,j neurophysiol.[神经生理学杂志]2006年8月;96(2):535-43.epub 2006年1月4日;li等人br j pharmacol.[英国药理学杂志]2017年12月;174(23):4277-4294.doi:10.1111/bph.14026.epub 2017年10月19日;hansen等人j pharmacol exp ther.[药理学与实验治疗学杂志]2006年9月;318(3):1006-19.epub 2006年6月14日),这与精神障碍(如但不限于精神病、躁狂症、应激相关的障
碍、急性应激反应、注意力缺陷/多动障碍、创伤后应激障碍、强迫症、冲动型障碍、人格障碍、分裂型障碍、攻击行为、自闭症谱系障碍)的治疗相关。wo 01/96540披露了通过表达kcnq2和kcnq3基因形成的m电流调节剂用于失眠的用途,而wo 01/092526披露了可以将kv7.5的调节剂用于治疗睡眠障碍。wo 09/015667披露了kv7开放剂在治疗性功能障碍方面的用途。
[0014]
虽然患有上述障碍的患者可能有可用的治疗选择,但这些选择中的许多选择缺乏所希望的功效并且伴随有不希望的副作用。因此,对于用于治疗癫痫和癫痫发作的新颖疗法的需求未得到满足。
[0015]
为了鉴定新的疗法,诸位发明人已经鉴定了一系列由式i表示的新颖化合物,这些化合物作为kv7.2、kv7.3、kv7.4和kv7.5通道开放剂,作为药物用于治疗剂癫痫、癫痫综合征和症状以及癫痫发作。
技术实现要素:
[0016]
本发明涉及具有式i的化合物
[0017][0018]
其中
[0019]
r1选自由以下组成的组:c
1-c6烷基、cf3、ch2cf3、cf2chf2、c
3-c8环烷基,其中所述c
3-c8环烷基可以被1个或2个f、chf2或cf3取代,并且r2是h、c
1-c6烷基或cf3;
[0020]
或者
[0021]
r1和r2结合以形成任选地被f、chf2或cf3取代的c
3-c5环烷基;
[0022]
r3是任选地被f取代的c
1-c3烷基或ch2o-c
1-3
烷基;
[0023]
r4选自由以下组成的组:ocf3、och2cf3或ochf2,或其药学上可接受的盐,该化合物用于在治疗癫痫、癫痫综合征、癫痫症状、治疗抵抗性或难治性癫痫或癫痫发作中使用。
[0024]
本发明还涉及包含根据本发明的化合物以及药学上可接受的载体或赋形剂的药物组合物。
[0025]
此外,本发明涉及对如在权利要求和实施例中所描述的治疗患者的方法,并且包括治疗患有癫痫、癫痫综合征、癫痫症状、治疗抵抗性或难治性癫痫或癫痫发作的患者,该方法包括向该受试者施用治疗有效量的根据本发明的化合物。
附图说明
[0026]
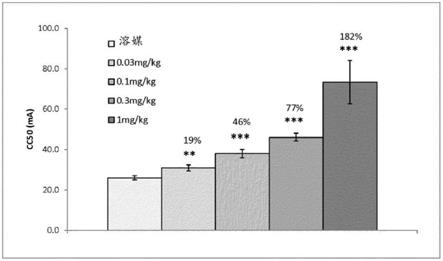
图1在大鼠mest测定中,(s)-2-(3,3-二氟-1-羟基环丁基)-n-(1-(3-(三氟甲氧基)苯基)乙基)乙酰胺的急性施用证明抗惊厥功效。
[0027]
相对于溶媒,在测试前30min以所有测试剂量(0.03-1mg/kg)向大鼠口服施用(s)-2-(3,3-二氟-1-羟基环丁基)-n-(1-(3-(三氟甲氧基)苯基)乙基)乙酰胺均显著增加了癫痫发作阈值cc50(即施加于动物的在50%的动物中产生强直性后肢伸肌癫痫发作的电流
(以ma计量))。**《0.01,***:p《0.001。
具体实施方式
[0028]
根据本发明的实施例,r4是ocf3或ochf2,并且根据另一个实施例,r2是h或ch3。
[0029]
在一个实施例中,r1是任选地被1个或2个f、chf2或cf3取代的c
3-c4环烷基。
[0030]
根据具体的实施例,r1是叔丁基,并且r2是h,并且r4是ocf3、och2cf3或ochf2之一。
[0031]
根据另一个具体的实施例,r1和r2合并以形成任选地被1个或2个f取代的环丁基,并且r4是ocf3、och2cf3或ochf2之一。
[0032]
根据本发明的具体的实施例,根据本发明所述的化合物选自由以下组成的组:
[0033]
(s)-3-羟基-4,4-二甲基-n-[(1s)-1-[3-(三氟甲氧基)苯基]乙基]戊酰胺,
[0034]
(r)-3-羟基-4,4-二甲基-n-[(1s)-1-[3-(三氟甲氧基)苯基]乙基]戊酰胺,
[0035]
(s)-3-羟基-4,4-二甲基-n-((s)-1-(3-(2,2,2-三氟乙氧基)苯基)乙基)戊酰胺,
[0036]
(r)-3-羟基-4,4-二甲基-n-((s)-1-(3-(2,2,2-三氟乙氧基)苯基)乙基)戊酰胺,
[0037]
(s)-n-((s)-1-(3-(二氟甲氧基)苯基)乙基)-3-羟基-4,4-二甲基戊酰胺,
[0038]
(r)-n-((s)-1-(3-(二氟甲氧基)苯基)乙基)-3-羟基-4,4-二甲基戊酰胺,
[0039]
(s)-3-羟基-4,4-二甲基-n-((s)-1-(3-(三氟甲基)苯基)乙基)戊酰胺,
[0040]
(r)-3-羟基-4,4-二甲基-n-((s)-1-(3-(三氟甲基)苯基)乙基)戊酰胺,
[0041]
(s)-3-羟基-4,4-二甲基-n-((s)-1-(3-(三氟甲氧基)苯基)丙基)戊酰胺,
[0042]
(r)-3-羟基-4,4-二甲基-n-((s)-1-(3-(三氟甲氧基)苯基)丙基)戊酰胺,
[0043]
(s)-3-(3,3-二氟环丁基)-3-羟基-n-((s)-1-(3-(三氟甲氧基)苯基)乙基)丙酰胺,
[0044]
(r)-3-(3,3-二氟环丁基)-3-羟基-n-((s)-1-(3-(三氟甲氧基)苯基)乙基)丙酰胺,
[0045]
(s)-3-羟基-4-甲基-n-((s)-1-(3-(2,2,2-三氟乙氧基)苯基)乙基)戊酰胺,
[0046]
(r)-3-羟基-4-甲基-n-((s)-1-(3-(2,2,2-三氟乙氧基)苯基)乙基)戊酰胺,
[0047]
(s)-3-(1-(二氟甲基)环丙基)-3-羟基-n-((s)-1-(3-(三氟-甲氧基)苯基)乙基)丙酰胺,
[0048]
(r)-3-(1-(二氟甲基)环丙基)-3-羟基-n-((s)-1-(3-(三氟甲氧基)苯基)乙基)丙酰胺,
[0049]
(r)-3-羟基-n-((s)-1-(3-(三氟甲氧基)苯基)乙基)-3-(1-(三氟甲基)环丙基)丙酰胺,
[0050]
(s)-3-羟基-n-((s)-1-(3-(三氟甲氧基)苯基)乙基)-3-(1-(三氟甲基)环丙基)丙酰胺,
[0051]
(s)-3-羟基-4-甲基-n-((s)-1-(3-(三氟甲氧基)苯基)乙基)戊酰胺,
[0052]
(r)-3-羟基-4-甲基-n-((s)-1-(3-(三氟甲氧基)苯基)乙基)戊酰胺,
[0053]
n-((r)-2-(二氟甲氧基)-1-(3-(三氟甲氧基)苯基)乙基)-3-(r)-羟基-4,4-二甲基戊酰胺,
[0054]
n-((r)-2-(二氟甲氧基)-1-(3-(三氟甲氧基)苯基)乙基)-3-(s)-羟基-4,4-二甲基戊酰胺,
[0055]
(s)-3-羟基-n-((r)-2-甲氧基-1-(3-(三氟甲氧基)苯基)乙基)-4,4-二甲基戊酰胺,(r)-3-羟基-n-((r)-2-甲氧基-1-(3-(三氟甲氧基)苯基)乙基)-4,4-二甲基戊酰胺,
[0056]
(s)-2-(3,3-二氟-1-羟基环丁基)-n-(1-(3-(三氟甲氧基)苯基)乙基)乙酰胺,
[0057]
(s)-2-(1-羟基环丁基)-n-(1-(3-(2,2,2-三氟乙氧基)苯基)乙基)乙酰胺,
[0058]
(3r)-3-羟基-4-甲基-n-[(1s)-1-[3-(2,2,2-三氟乙氧基)苯基]乙基]-3-(三氟甲基)戊酰胺,
[0059]
(3s)-3-羟基-4-甲基-n-[(1s)-1-[3-(2,2,2-三氟乙氧基)苯基]乙基]-3-(三氟甲基)戊酰胺,
[0060]
4,4,4-三氟-3-羟基-n-[(1s)-1-[3-(三氟甲氧基)苯基]乙基]-3-(三氟甲基)丁酰胺,
[0061]
(r)-4,4,5,5-四氟-3-羟基-3-甲基-n-((s)-1-(3-(三氟甲氧基)苯基)乙基)戊酰胺,
[0062]
(s)-4,4,5,5-四氟-3-羟基-3-甲基-n-((s)-1-(3-(三氟甲氧基)苯基)乙基)戊酰胺,
[0063]
(r)-5,5,5-三氟-3-羟基-3-甲基-n-((s)-1-(3-(三氟甲氧基)苯基)乙基)戊酰胺,
[0064]
(s)-5,5,5-三氟-3-羟基-3-甲基-n-((s)-1-(3-(三氟甲氧基)苯基)乙基)戊酰胺,
[0065]
(r)-3-(1-氟环丙基)-3-羟基-n-((s)-1-(3-(三氟甲氧基)苯基)乙基)丁酰胺,
[0066]
(s)-3-(1-氟环丙基)-3-羟基-n-((s)-1-(3-(三氟-甲氧基)苯基)乙基)丁酰胺,
[0067]
(r)-2-(1-羟基环戊基)-n-(2-甲氧基-1-(3-(三氟甲氧基)苯基)乙基)乙酰胺,
[0068]
(r)-3-环丙基-3-羟基-n-((s)-1-(3-(2,2,2-三氟乙氧基)苯基)乙基)丁酰胺,
[0069]
(s)-3-环丙基-3-羟基-n-((s)-1-(3-(2,2,2-三氟乙氧基)苯基)乙基)丁酰胺,
[0070]
(s)-4,4,4-三氟-3-羟基-3-甲基-n-((s)-1-(3-(2,2,2-三氟乙氧基苯基)乙基)丁酰胺,以及
[0071]
(r)-4,4,4-三氟-3-羟基-3-甲基-n-((s)-1-(3-(2,2,2-三氟乙氧基)苯基)乙基)丁酰胺
[0072]
或这些化合物中任一种的药学上可接受的盐。
[0073]
提及的本发明所涵盖的化合物包括这些化合物的外消旋混合物,与其相关化合物的光学异构体,以及本发明化合物的多晶型和非晶型形式,以及与其相关的化合物的互变异构形式。此外,本发明的化合物可能以未溶剂化形式存在以及以与药学上可接受的溶剂如水、乙醇等的溶剂化形式存在。本发明涵盖这些化合物的溶剂化形式和非溶剂化形式两者。
[0074]
根据本发明所述的化合物可以在包含该化合物以及药学上可接受的赋形剂或载体的药物组合物中。
[0075]
在另一个实施例中,本发明涉及治疗有需要的患者的方法,该患者患有癫痫、癫痫综合征、癫痫症状、治疗抵抗性或难治性癫痫、或癫痫发作,该方法包括向受试者施用治疗有效量的根据本发明的化合物。
[0076]
在又另一个实施例中,本发明涉及治疗有需要的患者或用于在治疗作为神经退行
性障碍(如阿尔茨海默病、路易体病、少年型亨廷顿病、额颞叶变性)的一部分的癫痫症状中使用的方法,该患者患有局灶性(部分性)癫痫伴简单部分性癫痫发作、局灶性(部分性)癫痫伴复杂部分性癫痫发作、特发性全身性癫痫、癫痫大发作、癫痫持续状态、新生儿癫痫发作、kcnq癫痫性脑病(kcnq2ee)和良性家族性新生儿惊厥以及其他癫痫综合征(如婴儿严重肌阵挛性癫痫、癫痫伴慢波睡眠期持续棘波、韦斯特综合征、伦诺克斯-加斯托综合征、德拉韦综合征和早期肌阵挛脑病大田原综合征),或与压力、激素的变化、药物(如安非他命或可卡因)、醇、感染或代谢紊乱(如低钠血症)相关的癫痫发作,该方法包括向受试者施用治疗有效量的本发明的化合物。
[0077]
根据本发明的化合物的用途是用于治疗癫痫,包括在治疗局灶性(部分性)癫痫伴简单部分性癫痫发作、局灶性(部分性)癫痫伴复杂部分性癫痫发作、特发性全身性癫痫、癫痫大发作、癫痫持续状态、新生儿癫痫发作、kcnq癫痫性脑病(kcnq2ee)和良性家族性新生儿惊厥以及其他癫痫综合征(如婴儿严重肌阵挛性癫痫、癫痫伴慢波睡眠期持续棘波、韦斯特综合征、伦诺克斯-加斯托综合征、德拉韦综合征和早期肌阵挛脑病大田原综合征),或与压力、激素的变化、药物、醇、感染、创伤性脑损伤、中风、脑癌、自闭症谱系障碍或代谢紊乱(如低钠血症)相关的癫痫发作中使用,或用于在作为神经退行性障碍(如阿尔茨海默病、路易体病、少年型亨廷顿病、额颞叶变性)的一部分的癫痫症状中使用。
[0078]
用于根据本发明使用的化合物是用于治疗癫痫,包括在治疗局灶性(部分性)癫痫伴简单部分性癫痫发作、局灶性(部分性)癫痫伴复杂部分性癫痫发作、特发性全身性癫痫、癫痫大发作、癫痫持续状态、新生儿癫痫发作、kcnq癫痫性脑病(kcnq2ee)和良性家族性新生儿惊厥以及其他癫痫综合征(如婴儿严重肌阵挛性癫痫、癫痫伴慢波睡眠期持续棘波、韦斯特综合征、伦诺克斯-加斯托综合征、德拉韦综合征和早期肌阵挛脑病大田原综合征),或与压力、激素的变化、药物、醇、感染、创伤性脑损伤、中风、脑癌、自闭症谱系障碍或代谢紊乱(如低钠血症)相关的癫痫发作中使用,或用于在作为神经退行性障碍(如阿尔茨海默病、路易体病、少年型亨廷顿病、额颞叶变性)的一部分的癫痫症状中使用。
[0079]
在另一个实施例中,本发明的化合物用于在制造药物中使用,该药物用于治疗以下疾病:癫痫、癫痫综合征、癫痫症状、治疗抵抗性或难治性癫痫、或癫痫发作(包括局灶性(部分性)癫痫伴简单部分性癫痫发作、局灶性(部分性)癫痫伴复杂部分性癫痫发作、特发性全身性癫痫、癫痫大发作、癫痫持续状态、新生儿癫痫发作、kcnq癫痫性脑病(kcnq2ee)和良性家族性新生儿惊厥以及其他癫痫综合征(如婴儿严重肌阵挛性癫痫、癫痫伴慢波睡眠期持续棘波、韦斯特综合征、伦诺克斯-加斯托综合征、德拉韦综合征和早期肌阵挛脑病大田原综合征),或与压力、激素的变化、药物、醇、感染、创伤性脑损伤、中风、脑癌、自闭症谱系障碍或代谢紊乱(如低钠血症)相关的癫痫发作),或用于制造用于在治疗作为神经退行性障碍(如阿尔茨海默病、路易体病、少年型亨廷顿病、额颞叶变性)的一部分的癫痫症状中使用。
[0080]
在本发明上下文中,“任选地被取代”意指,所指示的部分可以被取代或可以不被取代,并且当被取代时是单取代的或二取代的。应理解,当针对“任选地被取代”部分指示无取代基时,则该位置被氢原子占据。
[0081]
可用
“‑”
(短横线)或“至”互换地指示给定的范围,例如术语“c
1-3
烷基”等同于“c1至c3烷基”。
[0082]
术语“c
1-c3烷基”和“c
1-c6烷基”是指具有从一个至多达六个碳原子(包括端值)的无支链的或支链饱和烃。此类基团的实例包括但不限于,甲基、乙基、1-丙基、2-丙基、1-丁基、2-丁基和叔丁基。
[0083]
术语“c
1-c3烷氧基”是指具有式
–
or的部分,其中r表示如上所定义的c
1-c3烷基。
[0084]
术语“c
3-c6环烷基”、“c
3-c5环烷基”或“c
3-c8环烷基”是指饱和单环。此类基团的实例包括环丙基、环丁基、环戊基、环己基、环庚基和环辛基。
[0085]
施用途径:
[0086]
包含以上定义的本发明的化合物的药物组合物可以被具体配制以通过任何合适途径施用,合适途径如口服、经直肠、经鼻、经颊、舌下、经皮和肠胃外(例如皮下、肌内和静脉内)途径;口服途径是优选的。
[0087]
将领会的是,该途径将取决于待治疗的受试者的一般状况和年龄、待治疗的病症的性质以及活性成分。
[0088]
药物制剂和赋形剂:
[0089]
在下文中,术语“赋形剂”或“药物上可接受的赋形剂”是指药物赋形剂,包括但不限于填充剂、抗粘合剂、粘合剂、包衣、着色剂、崩解剂、调味剂、助流剂、润滑剂、防腐剂、吸着剂、甜味剂、溶剂、溶媒和辅助剂。
[0090]
本发明还提供了包含根据本发明的化合物(如在本文实验部分中所披露的化合物之一)的药物组合物。本发明还提供了用于制造包含根据本发明的化合物的药物组合物的方法。根据本发明的药物组合物可以用药学上可接受的赋形剂根据常规技术进行配制,这些常规技术如在以下中披露的那些:remington,“the science and practice of pharmacy[药学科学与实践]”,第22版(2012),由allen,loyd v.,jr.编辑。
[0091]
用于口服施用的药物组合物包括固体口服剂型,如片剂、胶囊、粉剂以及颗粒剂;和液体口服剂型,如溶液、乳剂、悬浮液和糖浆剂以及待溶解或悬浮在合适液体中的粉剂和颗粒剂。
[0092]
固体口服剂型可以离散单位形式呈现(例如片剂或硬胶囊或者软胶囊),各自含有预定量的活性成分,和优选地一种或多种适合的赋形剂。适当时,根据本领域中熟知的方法,这些固体剂型可以制备为具有包衣,如肠溶衣,或着它们可以被配制以提供活性成分的改进释放,如延迟或延长释放。适当时,固体剂型可以是在唾液中崩解的剂型,如例如口腔分散片剂。
[0093]
适于固体口服制剂的赋形剂的实例包括但不限于:微晶纤维素、玉米淀粉、乳糖、甘露醇、聚维酮、交联羧甲纤维素钠、蔗糖、环糊精、滑石、明胶、果胶、硬脂酸镁、硬脂酸和纤维素的低级烷基醚。类似地,固体制剂可以包括本领域已知的用于延迟或延长释放制剂的赋形剂,如单硬脂酸甘油酯或羟丙甲纤维素。如果将固体材料用于口服施用,则该制剂可以例如通过将活性成分与固体赋形剂混合,并且随后在常规压片机中压缩该混合物来制备;或可以例如将该制剂以例如粉剂、丸剂或微型片剂形式置于硬胶囊中。固体赋形剂的量将广泛变化,但将典型地在每剂量单位从约25mg至约1g的范围。
[0094]
液体口服剂型能以例如酏剂、糖浆剂、口服滴剂或充液胶囊呈现。液体口服剂型还能以用于在水性或非水性液体中的溶液或悬浮液的粉剂呈现。适合于液体口服制剂的赋形剂的实例包括,但不限于乙醇、丙二醇、甘油、聚乙二醇、泊洛沙姆、山梨醇、聚山梨醇酯、甘
油单酯和甘油二酯、环糊精、椰子油、棕榈油和水。液体口服剂型可以例如通过将活性成分溶解或悬浮在水性或非水性液体中,或通过将活性成分掺入水包油或油包水液体乳液中来制备。
[0095]
可以将另外的赋形剂(如着色剂、调味剂和防腐剂等)用于固体和液体口服制剂中。
[0096]
用于肠胃外施用的药物组合物包括:用于注射或输注的无菌水性及非水性溶液、分散液、悬浮液或乳液,用于注射或输注的浓缩物以及欲在使用之前在用于注射或输注的无菌溶液或分散液中复水的无菌粉剂。适合于肠胃外制剂的赋形剂的实例包括,但不限于水、椰子油、棕榈油和环糊精溶液。必要时应该适当缓冲水性制剂,并且用足够盐水或葡萄糖使水性制剂变得等张。
[0097]
其他类型的药物组合物包括栓剂、吸入剂、乳膏剂、凝胶剂、皮肤贴片、植入物和用于经颊或舌下施用的制剂。
[0098]
用于任何药物制剂的赋形剂必须符合预期的施用途径并且与活性成分相容。
[0099]
剂量:
[0100]
在一个实施例中,每天以从约0.001mg/kg体重至约100mg/kg体重的量施用本发明的化合物。具体而言,每日剂量可以处于每天0.01mg/kg体重至约50mg/kg体重的范围内。确切剂量将取决于施用频率及方式,待治疗的受试者的性别、年龄、体重及一般状况,待治疗的病症、任何待治疗的伴发疾病的性质及严重程度,所希望的治疗效果以及本领域技术人员已知的其他因素。
[0101]
针对成人的典型口服剂量将在以下范围内:0.1-1000mg/天的本发明的化合物,如1-500mg/天,如1-100mg/天或1-50mg/天。方便地,将本发明的化合物以单位剂型施用,该单位剂型以约0.1至500mg,诸如10mg、50mg、100mg、150mg、200mg或250mg的本发明的化合物的量含有所述化合物。
[0102]
同分异构形式和互变异构形式:
[0103]
当本发明的化合物含有一个或多个手性中心时,除非另外说明,否则提及这些化合物中的任一个将涵盖对映异构体纯的或非对映异构体纯的化合物以及呈任何比率的对映异构体或非对映异构体的混合物。
[0104]
mdl增强的立体代表用于描述本发明化合物的未知的立体化学。因此,手性碳原子上的标签“or1”用于表示在该原子的绝对立体构型是未知的;例如,该碳原子的立体构象是(s)或(r)。
[0105]
此外,使用向上楔形或向下楔形的来自碳原子标记“or1”的手性键是相同的代表;例如,两个图具有相同的含义,该含义是在“or1”标记的碳原子上的绝对立体构象是未知的,并且可以是(s)或(r)。
[0106]
因此,使用来自标记为“or1”的原子的向上楔形键和向下楔形键仅仅旨在提供视觉提示,即附图代表不同的立体异构体,其中“or1”标记的碳原子的构象是未知的。
[0107]
此外,本发明的一些化合物可以不同的互变异构形式存在并且这些化合物能够形成的任何互变异构形式都旨在被包括在本发明的范围内。
[0108]
治疗有效量:
[0109]
在本发明上下文中,术语化合物的“治疗有效量”意指在包括施用所述化合物的治
疗性干预中足以缓解、阻滞、部分阻滞、除去或延迟给定疾病及其并发症的临床表现的量。将足以实现以上的量定义为“治疗有效量”。用于各目的有效量将取决于疾病或损伤的严重程度以及受试者的体重及一般状态。应理解的是,确定适当剂量可以使用常规实验通过构建值矩阵并且测试矩阵中的不同点来实现,这全部在受过培训的医师的普通技术范围内。
[0110]
治疗(treatment和treating):
[0111]
在本发明上下文中,“治疗(treatment或treating)”旨在指示出于缓解、阻滞、部分阻滞、除去疾病的临床表现或延迟其进展的目的而管理并且护理患者。待治疗的患者优选是哺乳动物,特别是人类。
[0112]
本文所引用的所有文献(包括出版物、专利申请和专利)均通过引用以其全文特此并入,并且引用的程度如同每个文献被单独地并且明确地指示通过引用并入并且以其全文在此阐述(至法律允许的最大程度)。
[0113]
治疗癫痫
[0114]
癫痫的分类可以基于icd-10(2016,who发布)并且描述于g40和g41部分,并且包括在根据本发明的癫痫的治疗中
[0115]
g40.0局部相关性(局灶性)(部分性)特发性癫痫和癫痫综合征伴局部发作性癫痫发作
[0116]
g40.1局部相关性(局灶性)(部分性)症状性癫痫和癫痫综合征伴简单部分性癫痫发作
[0117]
g40.2局部相关性(局灶性)(部分性)症状性癫痫和癫痫综合征伴复杂部分性癫痫发作
[0118]
g40.3特发性全身性癫痫和癫痫综合征
[0119]
g40.4其他全身性癫痫和癫痫综合征
[0120]
g40.5特殊癫痫综合征
[0121]
g40.6癫痫大发作,未指定(具有或不具有小发作)
[0122]
g40.7小发作,未指定,不具有癫痫大发作
[0123]
g40.8其他癫痫
[0124]
g40.9癫痫,未指定
[0125]
g41癫痫持续状态
[0126]
治疗癫痫发作
[0127]
癫痫发作是大脑中突然的、不受控制的电干扰。它可以引起行为、动作或感觉、以及意识水平的改变。如果一个人有两次或更多次癫痫发作或有反复癫痫发作的倾向,则其被诊断为癫痫。
[0128]
癫痫发作有多种类型,其严重程度不同。癫痫发作的类型因其在大脑何处开始以及如何开始而不同。大多数癫痫发作持续30秒到2分钟。癫痫发作持续超过5分钟是医疗紧急情况。
[0129]
局灶性癫痫发作
[0130]
局灶性癫痫发作是由大脑的一个区域中的异常电活动引起的。局灶性癫痫发作可伴有或不伴有意识丧失:
[0131]
·
认知受损的局灶性癫痫发作。这些癫痫发作涉及意识或认知的改变或丧失。人
可能凝视空间,对环境没有正常响应或进行重复动作,如搓手、咀嚼、吞咽或绕圈行走。
[0132]
·
无意识丧失的局灶性癫痫发作。这些癫痫发作可能改变情绪或改变事物查看、闻、感觉、品尝或听的方式,但人不会丧失意识。这些癫痫发作还可能导致身体部位(如胳膊或腿)的不自主抽搐,以及自发的感觉症状(如麻刺感、头晕和闪光)。
[0133]
全身性癫痫发作
[0134]
似乎涉及大脑所有区域的癫痫发作被称为全身性癫痫发作。不同类型的全身性癫痫发作包括:
[0135]
·
失神性癫痫发作。失神性癫痫发作,先前称为癫痫小发作,常发生于儿童中,其特征为凝视空间或细微的身体动作,如眨眼或咂嘴。这些癫痫发作可能会成群发生,并引起短暂的认知丧失。
[0136]
·
强直性癫痫发作。强直性癫痫发作会引起肌肉僵硬。这些癫痫发作通常影响背部、手臂和腿的肌肉。
[0137]
·
失张力性癫痫发作。失张力性癫痫发作,也称为跌倒性癫痫发作,会引起肌肉失去控制,这可能引起突然的晕倒或跌倒。
[0138]
·
阵挛性癫痫发作。阵挛性癫痫发作与反复的或有节奏的肌肉抽搐运动有关。这些癫痫发作通常影响颈部、面部和手臂。
[0139]
·
肌阵挛性癫痫发作。肌阵挛性癫痫发作通常表现为手臂和腿的突然短暂抽搐或颤搐。
[0140]
·
强直性阵挛性癫痫发作。强直性阵挛性癫痫发作,先前称为癫痫大发作,是最剧烈的癫痫发作类型,并可能引起意识的突然丧失、身体僵硬和颤动,并且有时引起膀胱失控或咬舌头。
[0141]
很多时候,癫痫发作可能与以下有关或由以下引起:
[0142]
高烧,这可能与感染(如脑膜炎)有关
[0143]
缺少睡眠
[0144]
低血钠(低钠血症),这可能伴随利尿治疗而发生
[0145]
降低癫痫发作阈值的药物,如某些止痛药、抗抑郁药或戒烟疗法
[0146]
产生脑部出血区的头部创伤
[0147]
中风
[0148]
脑肿瘤
[0149]
药物,如安非他命或可卡因
[0150]
醇
[0151]
标题和副标题在本文中仅为方便而使用,并且不应以任何方式被解释为限制本发明。
[0152]
除非另外指示,否则在本说明书中使用的任何及所有实例或示例性语言(包括“例如”(for instance、for example、e.g.)、“如”(such as)及“照此(as such)”均仅意欲更好地阐明本发明,并且不会对发明的范围造成限制。
[0153]
在本文中引用及并入专利文件仅是为了便利,并且不反映此类专利文件的有效性、专利性和/或可执行性的任何观点。
[0154]
如适用的法律所允许,本发明包括随附在此的权利要求书中所述的主题的所有修
饰方案及等同方案。
[0155]
实验部分
[0156]
生物学评估:
[0157]
细胞培养
[0158]
使用bamhi和xhoi限制位点,将由p2a序列分离的编码人kv7.3和人kv7.2的合成的cdna片段插入pcdna5/frt/to载体中。然后使用lipofectamine2000,将构建体转染到hek flp-in 293细胞中。使经转染的细胞在含有10%(v/v)fbs和1%penstrep的dmem中生长48小时,并随后在含有10%(v/v)fbs、1%penstrep和200ug/ml潮霉素b的dmem中在37℃在5%co2的湿润气氛中在选择下维持。将所生成的稳定hkv7.2/hkv7.3细胞系(hek-hkv7.2/hkv7.3)用自动化全细胞膜片钳进行功能测试,并显示出典型的kv7电流,该电流对xe991是敏感的并通过瑞替加滨增强。
[0159]
铊通量测定
[0160]
与公开的程序(c.d.weaver等人,j biomol screen[生物分子筛选杂志]2004,9,671-677)类似,使用flipr钾测定试剂盒(分子装置)进行针对钾通道激活的铊通量测定。将hek-hkv7.2/hkv7.3细胞以80,000个细胞/孔(100μl/孔)(如果在第二天测定这些细胞)或40,000个细胞/孔(100μl/孔)(如果在接种后两天测定这些细胞)的密度铺于96孔、黑壁、透明底部的培养平板上(康宁公司(corning),阿克顿,马萨诸塞州,美国)。
[0161]
在测定日,去除培养基,之后将50ul/孔的测试化合物稀释至在含有20mm hepes的hbss中2x终浓度,并且添加50ul/孔的2x染料加载缓冲液。然后将这些细胞在室温下在黑暗中孵育60min。在孵育过程中制备5x终浓度(在两种情况下5x浓度:5mm)的含有tl
和k
的无氯化物的刺激缓冲液和1x终浓度的测试化合物。然后将这些细胞在fdss7000ex功能性药物筛选系统(滨松公司(hamamatsu))中进行测定。在0.1hz持续60sec和在1hz持续10sec基线荧光信号读数后,添加25ul/孔的刺激缓冲液,并且在1hz处将荧光连续测定50sec,之后在0.1hz处持续4min。使用auc作为读数对化合物作用进行定量,并将其归一化为每个平板上包含的参考化合物。
[0162]
化合物作用
[0163]
在以上描述的测定中,本发明的化合物具有以下生物学活性:
[0164][0165][0166]
本发明的化合物的合成:
[0167]
一般方法:
[0168]
在bruker avance iii 400仪器上在400.13mhz下或在bruker avance 300仪器上在300.13mhz下记录1h nmr波谱。使用氘化的二甲亚砜或氘化的氯仿作为溶剂。使用四甲基
硅烷作为内参考标准品。以ppm值表示相对于四甲基硅烷的化学位移值。以下缩写用于nmr信号的多重性:s=单峰、d=双重峰、t=三重峰、q=四重峰、qui=五重峰、h=七重峰、dd=双重双峰、ddd=双重二倍双峰、dt=双重三峰、dq=双重四峰、tt=三重三峰、m=多重峰并且brs=宽单峰。
[0169]
将评价化学纯度(lcms方法)和手性纯度(sfc和hplc方法)的色谱系统和方法在下文中进行描述。
[0170]
lcms方法1:装置:具有els检测器的agilent 1200lcms系统。
[0171][0172][0173]
lcms方法2:装置:具有els检测器的agilent 1200lcms系统
[0174][0175]
lcms方法3:装置:具有els检测器的agilent 1200lcms系统
[0176][0177]
lcms方法4:仪器:具有els检测器的agilent 1200lcms系统
[0178][0179][0180]
lcms方法5:装置:具有els检测器的agilent 1200lcms系统
[0181][0182]
lcms方法6:装置:具有els检测器的agilent 1200lcms系统
[0183][0184]
sfc方法1:装置:具有dad检测器的agilent 1260
[0185]
[0186][0187]
sfc方法2:装置:waters upc2
[0188][0189]
sfc方法3:装置:waters upc2
[0190][0191]
sfc方法4:装置:agilent 1260
[0192][0193][0194]
sfc方法5:装置:agilent 1260
[0195][0196]
sfc方法6:装置:waters upc2
[0197][0198]
sfc方法7:装置:waters upc2
[0199][0200][0201]
sfc方法8:装置:agilent 1260
[0202][0203]
sfc方法9:装置:agilent 1260
[0204][0205]
sfc方法10:装置:agilent 1260
[0206][0207][0208]
sfc方法11:装置:waters upc2
[0209][0210]
sfc方法12:装置:agilent 1260
[0211][0212]
sfc方法13:装置:agilent 1260
[0213][0214][0215]
sfc方法14:装置:agilent 1260
[0216][0217]
sfc方法15:装置:agilent 1260
[0218][0219]
sfc方法16:装置:agilent 1260
[0220][0221]
手性hplc方法1:装置:shimadzu lc-20ab
[0222][0223][0224]
手性hplc方法2:装置:shimadzu lc-20ab
[0225][0226]
将用于合成中间体和具有通式i的化合物的一般程序描述于反应方案1中,并且在制备和实例中具体说明。在本发明范围内的是本领域技术人员已知的所述程序的变型。
[0227]
如方案1中所描述的制备本发明的化合物。具有通式i的化合物中的几种包含两个手性碳原子,并且形成为非对映异构体的混合物。当在这种情况下时,可以分离非对映异构体,以产出单一的立体异构体ia和ib。
[0228]
方案1:
[0229][0230]
方案i描绘了通过两个通用路径的具有通式i的化合物的制备。第一路线是通过本领域已知的用于将酸和胺转化成酰胺的方法,通过将具有通式ii的对映异构体纯的胺和具有通式iii的酸的反应合成具有式i的化合物。此方法包括形成具有式iii的酸的反应性衍生物(包括但不限于活性酯)和反应性混合酐,随后与具有通式ii的胺缩合。一种这样的方法是在hatu((1-[双(二甲基氨基)亚甲基]-1h-1,2,3-三唑并[4,5-b]吡啶鎓3-氧化物六氟磷酸酯)和合适的碱(如dipea(二异丙基乙胺))的存在下,在溶剂(如二氯甲烷)中进行缩合。
[0231]
可替代地,当r2是h时,具有通式i的化合物可以经第二通用路径制备,其中将具有通式v的中间体用合适的还原剂(如nabh4),在合适的溶剂(如甲醇)中进行处理。具有式v的中间体可以获得自具有通式ii的对映异构体纯的胺和具有通式iv的羧酸(r =h)。该转化可以使用与上述针对ii和iii缩合以形成i相似的反应条件进行。
[0232]
此程序的变型是具有通式ii的手性胺和具有通式iv的羧酸酯(r=me,et)之间的直接偶联反应。在合适的溶剂(如甲苯)中,在合适的碱(如dipea)的存在下和在催化量的合适的催化剂(如dmap(4-二甲基氨基吡啶))的存在下,可以通过将反应物加热至回流进行此反应。
[0233]
如在方案2中所概述的可以制备具有通式ii的任选的活性胺:
[0234]
方案2
[0235][0236]
在合适的溶剂(如二氯乙烷)中,在干燥剂(如异丙氧化钛(iv),或硫酸铜)存在下,
可以将具有通式vi的醛与(r)-2-甲基丙烷-2-亚磺酰胺缩合。在合适的惰性溶剂(如thf)中,用r3mgbr处理所形成的亚磺酰基亚胺,以产出对应的经取代的(r)-2-甲基-n-((s)-1-芳基-烷基)丙烷-2-亚磺酰胺vii,将其通过用适合的酸,在适合的溶剂(如在meoh中的hcl)中进行处理,转化为具有通式ii的化合物。
[0237]
用于制备本发明化合物的具有式vi的醛是可商购的,或可以如例如在文献(参见journal of medicinal chemistry[药物化学杂志],45(18),3891-3904;2002)中所描述的进行制备。
[0238]
在此程序的变型中,通过中间体亚磺酰基亚胺与试剂(如三仲丁基硼氢化锂)的氢化物还原,具有式ii的手性胺可以获得自芳基酮,如在方案3中所示。
[0239]
方案3
[0240][0241]
用于制备本发明化合物的酮是可商购的或可以通过本领域技术人员已知的方法进行制备。
[0242]
此程序的另一种变型,如在方案4中的概述,特别适合于获得具有通式ii的手性胺(其中r3是羟基亚甲基衍生物)。
[0243]
方案4:
[0244][0245]
在此程序中,使用合适的催化剂(如双(乙腈)(1,5-环辛二烯)四氟硼酸铑(i))在合适的溶剂(如二噁烷)中,如在jp 2017/095366a中所描述的,可以将在乙醛酸酯和(r)-2-甲基丙烷-2-亚磺酰胺之间的缩合反应中形成的乙醛酸亚磺酰基亚胺与合适取代的硼酸反应。可以将所得中间体viii水解并再保护,以产出具有通式ix的中间体,可以将其进一步衍生以获得所希望的r3取代基。在本发明的化合物中,可以将ix的羧酸酯基团使用lah(氢化铝锂)还原为羟基亚甲基,并且使用适合的试剂(如2,2-二氟-2-(氟磺酰基)乙酸),在以下
条件下,如cui催化,在适合的溶剂(如乙腈)中进行二氟甲基化。
[0246]
本领域的技术人员将认识到从具有通式ix的中间体的其他转化是可能的;本发明旨在包括这样的可替代的转化。
[0247]
如在方案5中所概述的可以制备具有通式iii的羧酸:
[0248]
方案5
[0249][0250]
将具有通式x的酮与被例如zn和碘激活的溴乙酸的烷基酯反应,以产出对应的羟醛加合物。在可替代的程序中,使用zn和tmscl(三甲基甲硅烷基氯化物)可以将溴乙酸酯激活。在最后的步骤中,通过用适合的碱(如naoh或lioh)在适合的溶剂(如水,或在水中的醇)中进行处理完成烷基酯的水解,并随后用适合的酸进行酸化,以产出具有式iii的化合物。
[0251]
中间体的制备:
[0252]
iia:(s)-1-(3-(三氟甲氧基)苯基)乙烷胺盐酸盐
[0253][0254]
步骤1:(r)-2-甲基-n-(3-(三氟甲氧基)苯亚甲基)丙烷-2-亚磺酰胺的制备
[0255][0256]
在55℃,将3-(三氟甲氧基)苯甲醛(24.8g,130.4mmol)、(r)-2-甲基丙烷-2-亚磺酰胺(19g,156.5mmol)和cuso4(31.2g,195.7mmol)在dce(1,2-二氯乙烷)(500ml)中的混合物搅拌24小时。将该混合物过滤并将滤饼用dcm(二氯甲烷)(200ml)洗涤。将有机相合并并且浓缩。将残余物通过快速硅胶色谱法(其中洗脱液为0-15%乙酸乙酯/石油醚(梯度))进行纯化,以产出产物(33g,86%产率)。
[0257]1h nmr(cdcl
3 400mhz):δ8.59(s,1h),7.79-7.71(m,2h),7.53(t,j=8.0hz,1h),7.38(d,j=8.0hz,1h),1.28(s,9h)。
[0258]
步骤2:(r)-2-甲基-n-((s)-1-(3-(三氟甲氧基)苯基)乙基)丙烷-2-亚磺酰胺的制备
[0259][0260]
在0℃,向(r)-2-甲基-n-[[3-(三氟甲氧基)苯基]亚甲基]丙烷-2-亚磺酰胺(17.6g,59.8mmol)在dcm(250ml)中的溶液中滴加memgbr(在et2o中3m,40ml)。将所得混合物在0℃搅拌1小时并且在15℃搅拌16小时。将该混合物冷却至0℃,并且添加nh4cl饱和溶液。将所得混合物用dcm(100ml
×
2)萃取。将有机相用盐水(200ml)洗涤,经na2so4干燥并浓
缩。将残余物通过快速硅胶色谱法(其中洗脱液为0-50%乙酸乙酯/石油醚(梯度))进行纯化,以给出产物(10.3g,56%产率)。
[0261]1h nmr(cdcl
3 400mhz):δ7.37(t,j=8.0hz,1h),7.27-7.24(m,1h),7.21(s,1h),7.13(br d,j=8.0hz,1h),4.65-7.59(m,1h),3.32(br d,j=2.4hz,1h),1.54(d,j=6.4hz,3h),1.22(s,9h)。
[0262]
步骤3:(s)-1-(3-(三氟甲氧基)苯基)乙烷胺盐酸盐的制备
[0263][0264]
将在meoh(75ml)中的(r)-2-甲基-n-[(1s)-1-[3-(三氟甲氧基)苯基]乙基]丙烷-2-亚磺酰胺(10g,32.3mmol)用hcl/meoh(75ml)处理并在15℃搅拌16小时。将该混合物浓缩以给出(s)-1-(3-(三氟甲氧基)苯基)乙烷胺盐酸盐(9g,粗品),将其不经进一步纯化而直接使用。
[0265]
iib:(1s)-1-[3-(2,2,2-三氟乙氧基)苯基]乙烷胺盐酸盐
[0266][0267]
步骤1:3-(2,2,2-三氟乙氧基)苯甲醛的制备
[0268][0269]
在20℃,将3-羟基苯甲醛(5g,40.9mmol)、2,2,2-三氟乙基三氟甲磺酸酯(10.5g,45mmol)和cs2co3(26.7g,81.9mmol)在dmf(60ml)中的混合物搅拌2小时。将该混合物过滤并将滤饼用乙酸乙酯(200ml)洗涤。将滤液用水(100ml x 2)和盐水(100ml x 2)洗涤,经na2so4干燥并浓缩。将粗品在硅胶上通过柱色谱法(在石油醚中20%乙酸乙酯)进行纯化,以给出产物(8.0g,95%产率)。
[0270]1hnmr(cdcl
3 400mhz):δ7.58-7.51(m,2h),7.42(s,1h),7.27-7.25(m,1h),4.42(q,j=12.0hz,j=8.0hz,2h)。
[0271]
步骤2:(r)-2-甲基-n-[[3-(2,2,2-三氟-乙氧基)苯基]亚甲基]丙烷-2-亚磺酰胺的制备
[0272][0273]
在55℃,将3-(2,2,2-三氟乙氧基)苯甲醛(8.0g,39.2mmol)、(r)-2-甲基丙烷-2-亚磺酰胺(5.2g,43.1mmol)和cuso4(9.4g,58.8mmol)在dce(70ml)中的混合物搅拌20小时。将该混合物过滤并将滤饼用dcm(100ml)洗涤。将这些有机相浓缩并在硅胶上通过柱色谱法
(在石油醚中11%乙酸乙酯)进行纯化,以产出产物(10.0g,83%产率)。
[0274]1h nmr(cdcl
3 400mhz):δ8.55(s,1h),7.50-7.42(m,3h),7.13(d,j=5.2hz,1h),4.41(q,j=12.0hz,j=8.0hz,2h),1.27(s,9h)。
[0275]
步骤3:(r)-2-甲基-n-((s)-1-(3-(2,2,2-三氟乙氧基)苯基)乙基)丙烷-2-亚磺酰胺的制备
[0276][0277]
在0℃,向(r)-2-甲基-n-[[3-(2,2,2-三氟乙氧基)苯基]亚甲基]丙烷-2-亚磺酰胺(10g,32.5mmol)在dcm(100ml)中的溶液中滴加memgbr(3m,43ml)。将所得混合物在0℃搅拌1小时并且在20℃搅拌3小时。将该混合物冷却至0℃,并且添加nh4cl饱和溶液。将所得混合物用dcm(100ml x 2)萃取。将有机相用盐水(200ml)洗涤,经na2so4干燥并浓缩。将粗品在硅胶上通过柱色谱法(石油醚:乙酸乙酯=1:1)进行纯化,以给出产物(9g,79%产率)。
[0278]1h nmr(cdcl
3 400mhz):δ7.27(d,j=8.4hz,1h),7.01(d,j=8.4hz,1h),6.93(d,j=2.4hz,1h),6.83(dd,j=8.4hz,j=2.4hz,1h),4.56-4.54(m,1h),4.34(dd,j=16.4hz,j=8.4hz,1h),3.30(br s,1h),1.51(d,j=8.4hz,3h),1.20(s,9h)。未观察到nh。
[0279]
步骤4:(1s)-1-[3-(2,2,2-三氟乙氧基)苯基]乙烷胺盐酸盐的制备
[0280][0281]
向(r)-2-甲基-n-[(1s)-1-[3-(2,2,2-三氟乙氧基)苯基]乙基]丙烷-2-亚磺酰胺(9g,27.8mmol)在meoh(100ml)中的溶液中添加hcl/meoh(80ml,4m)。将所得混合物在20℃搅拌4小时,并且浓缩以给出粗产物(8g),将其不经进一步纯化而直接使用。
[0282]
iic:(s)-1-(3-(二氟甲氧基)苯基)乙-1-胺盐酸盐
[0283][0284]
步骤1:(r)-n-(3-(二氟甲氧基)苯亚甲基)-2-甲基丙烷-2-亚磺酰胺的制备
[0285][0286]
在55℃,在n2下,向3-(二氟甲氧基)苯甲醛(2g,11.6mmol)和2-甲基丙烷-2-亚磺酰胺(1.7g,13.9mmol)在dce(60ml)中的混合物中添加cuso4(9.3g,58.1mmol)。将该混合物在55℃搅拌12小时,过滤并将滤液浓缩。将粗产物通过硅胶柱(用石油醚/乙酸乙酯=20:1-10:1洗脱)进行纯化以给出(r)-n-(3-(二氟甲氧基)苯亚甲基)-2-甲基丙烷-2-亚磺酰胺(2.5g,70%产率)。
[0287]
步骤2:(r)-n-((s)-1-(3-(二氟甲氧基)苯基)乙基)-2-甲基丙烷-2-亚磺酰胺的制备
[0288][0289]
在0℃,向(r)-n-(3-(二氟甲氧基)苯亚甲基)-2-甲基丙烷-2-亚磺酰胺(2g,7.3mmol)在dcm(30ml)中的溶液中滴加溴(甲基)镁(在et2o中3m,4.8ml)。将所得混合物在0℃搅拌1小时并且在20℃搅拌16小时。将该反应用nh4cl(饱和水溶液,10ml)淬灭,并将水相用乙酸乙酯(30ml
×
3)萃取。将合并的有机相用盐水(40ml
×
2)洗涤,用无水na2so4干燥,过滤,浓缩,并且通过硅胶色谱法(石油醚/乙酸乙酯=5:1-1:1)进行纯化,以提供(r)-n-((s)-1-(3-(二氟甲氧基)苯基))-2-甲基丙烷-2-亚磺酰胺(960mg,45.4%产率)。
[0290]
步骤3:(s)-1-(3-(二氟甲氧基)苯基)乙烷胺盐酸盐的制备
[0291][0292]
向(r)-n-((s)-1-(3-(二氟甲氧基)苯基)乙基)-2-甲基丙烷-2-亚磺酰胺(0.8g,2.8mmol)在meoh(4ml)中的溶液中添加hcl/meoh(4m,2ml)。在25℃,将所得混合物搅拌3小时,并且将该反应物浓缩以提供1.6g粗品产量的(s)-1-(3-(二氟甲氧基)苯基)乙烷胺,将其不经进一步纯化而直接使用。
[0293]
iid:(s)-1-(3-(三氟甲基)苯基)乙-1-胺盐酸盐
[0294][0295]
步骤1:(r)-2-甲基-n-(3-(三氟甲基)苯亚甲基)丙烷-2-亚磺酰胺的制备
[0296][0297]
在55℃,将3-(三氟甲基)苯甲醛(4.5g,25.8mmol)、(r)-2-甲基丙烷-2-亚磺酰胺(3.8g,31mmol)和cuso4(6.2g,38.8mmol)在dce(20ml)中的混合物搅拌24小时。将该混合物过滤并将滤液用dcm(100ml)洗涤。将滤液浓缩,并且将残余物通过柱色谱法(sio2,石油醚/乙酸乙酯)进行纯化,以提供4.6g产量(58%)的产物。
[0298]1h nmr(cdcl
3,
400mhz):δ8.60(s,1h),8.09(s,1h),7.98(d,j=7.6hz,1h),7.73(d,j=7.6hz,1h),7.59(t,j=7.6hz,1h),1.25(s,9h)。
[0299]
步骤2:(r)-2-甲基-n-((s)-1-(3-三氟-甲基)苯基)乙基)丙烷-2-亚磺酰胺的制备
[0300][0301]
在0℃,向(r)-2-甲基-n-(3-(三氟甲基)苯亚甲基)丙烷-2-亚磺酰胺(2g,
7.2mmol)在dcm(50ml)中的溶液中滴加memgbr(在et2o中3m,9.6ml)。将所得混合物在0℃搅拌1小时并且在25℃搅拌3小时。将该反应混合物冷却至0℃,并且添加nh4cl饱和水溶液。将该混合物用dcm(50ml
×
3)萃取。将合并的有机相用盐水(50ml
×
2)洗涤,经na2so4干燥并浓缩。将残余物通过柱色谱法(sio2,石油醚/乙酸乙酯)进行纯化,以提供所希望的产物(1.3g,61%产率)。
[0302]1h nmr(cdcl
3,
400mhz):δ7.40-7.65(4h),4.11-4.06(m,1h),1.51(d,j=6.8hz,3h),1.17(s,9h)。未观察到nh。
[0303]
步骤3:(s)-1-[3-(三氟甲基)苯基]乙烷胺盐酸盐的制备
[0304][0305]
向(r)-2-甲基-n-((s)-1-(3-(三氟甲基)苯基)乙基)丙烷-2-磺酰胺(1.3g,4.4mmol)在meoh(20ml)中的溶液中添加hcl/meoh(4m,20ml)。将所得混合物在25℃搅拌20小时,并且然后浓缩以提供850mg产量的产物。将粗品不经进一步纯化而直接使用。
[0306]
iie:(s)-1-(3-(三氟甲氧基)苯基)丙-1-胺盐酸盐
[0307][0308]
步骤1:(r)-2-甲基-n-(3-(三氟甲氧基)苯亚甲基)丙烷-2-亚磺酰胺的制备:
[0309][0310]
在55℃,将3-(三氟甲氧基)苯甲醛(10.0g,52.60mmol)、(r)-2-甲基丙烷-2-亚磺酰胺(7.7g,63.1mmol)和cuso4(12.6g,78.9mmol)在dce(200ml)中的混合物搅拌16小时。将该混合物过滤并将滤饼用dcm(200ml)洗涤。将滤液浓缩。将残余物在硅胶上通过快速色谱法(洗脱液为0-10%乙酸乙酯/石油醚梯度)进行纯化,以给出产量为12.6g(81.7%)的(r)-2-甲基-n-[[3-(三氟甲氧基)苯基]亚甲基]丙烷-2-亚磺酰胺。
[0311]
步骤2:(r)-2-甲基-n-((s)-1-(3-(三氟-甲氧基)苯基)丙基)丙烷-2-亚磺酰胺的制备
[0312][0313]
在0℃,向(r)-2-甲基-n-(3-(三氟甲氧基)苯亚甲基)丙烷-2-亚磺酰胺(2.0g,6.8mmol)在dcm(40ml)中的溶液中滴加etmgbr(在et2o中3m,9.1ml)。将所得混合物在0℃搅拌1小时并且在20℃搅拌3小时。将该混合物冷却至0℃,并且添加nh4cl饱和水溶液(100ml)。将该混合物用dcm(100ml
×
2)萃取,分离各相,并且将有机层用盐水(200ml)洗涤,经na2so4干燥并浓缩。将残余物通过快速硅胶色谱法(洗脱液为0-50%乙酸乙酯/石油醚梯
亚磺酰胺的制备
[0327][0328]
在0℃,向(r)-n-(2-甲氧基-1-(3-(三氟甲氧基)苯基)亚乙基)-2-甲基丙烷-2-亚磺酰胺(160mg,0.5mmol)在thf(5ml)中的溶液中添加三仲丁基硼氢化锂(在thf中1m,1.42mmol,1.42ml)。将该混合物在20℃搅拌16小时。将该反应混合物用甲醇(20ml)稀释,并然后过滤并浓缩。将残余物通过柱色谱法(sio2,洗脱液为0-10%乙酸乙酯/石油醚)进行纯化,以给出所希望的产物(100mg,59%产率)。
[0329]1h nmr(400mhz,dmso-d6)δ7.46-7.40(m,3h),7.27-7.25(m,1h),5.86(d,j=8.8hz,1h),5.25(d,j=5.6hz,2h),4.84-4.72(m,1h),3.25(s,3h),1.09(s,9h)。
[0330]
步骤4:(r)-2-甲氧基-1-(3-(三氟甲氧基)苯基)乙烷胺的制备
[0331][0332]
在20℃,将在hcl/meoh(10ml,4m)中的(r)-n-((r)-2-甲氧基-1-(3-(三氟甲氧基)苯基)乙基)-2-甲基丙烷-2-亚磺酰胺(280mg,0.8mmol)搅拌14小时。将该反应混合物浓缩,并将残余物用水(30ml)稀释,添加氢氧化铵至ph=8-9,并且用乙酸乙酯(30ml
×
2)萃取。将合并的有机萃取物经mgso4干燥,过滤并浓缩以给出呈黄色油状物的产物(170mg,88%产率)。将该产物不经进一步纯化而直接使用。iig:(1r)-2-(二氟甲氧基)-1-[3-(三氟甲氧基)苯基]乙烷胺
[0333][0334]
步骤1:2-[(r)-叔丁基亚磺酰基]亚氨基乙酸乙酯的制备
[0335][0336]
向2-氧代乙酸乙酯(7.5g,36.7mmol)和(r)-2-甲基丙烷-2-亚磺酰胺(4.9g,40.4mmol)在dcm(150ml)中的溶液中添加cuso4(12.9g,80.8mmol),并且将该反应混合物在25℃搅拌24小时。将固体过滤出,用乙酸乙酯(50ml)洗涤,并将有机相合并并且浓缩。将所得残余物通过柱色谱法(硅胶,石油醚/乙酸乙酯,5/1)进行纯化,以产出所希望的产物
(5.1g,67.6%产率)。
[0337]
步骤2:(2r)-2-[[(r)-叔丁基亚磺酰基]氨基]-2-[3-(三氟甲氧基)苯基]乙酸乙酯的制备
[0338][0339]
向2-[(r)-叔丁基亚磺酰基]亚氨基乙酸乙酯(7g,34.1mmol)和[3-(三氟甲氧基)苯基]硼酸(8.4g,40.9mmol)在二噁烷(100ml)中的溶液中添加[rh(cod)(mecn)2]bf4(1.3g,3.4mmol),并将此混合物在80℃搅拌16小时。将该产物通过硅胶色谱法(石油醚:乙酸乙酯=5:1)进行纯化,以产出9.8g(78%)。
[0340]
步骤3:(2r)-2-氨基-2-[3-(三氟-甲氧基)苯基]乙酸乙酯盐酸盐的制备
[0341][0342]
向(2r)-2-[[(r)-叔丁基亚磺酰基]氨基]-2-[3-(三氟甲氧基)苯基]乙酸乙酯(9.8g,26.7mmol)在meoh(100ml)中的溶液中添加hcl/meoh(4m,100ml),并将此混合物在25℃搅拌2小时,并然后浓缩以提供(2r)-2-氨基-2-[3-(三氟甲氧基)苯基]乙酸乙酯(7.8g,粗品)。
[0343]
步骤4:(2r)-2-(叔丁氧基羰基氨基)-2-[3-(三氟甲氧基)苯基]乙酸乙酯的制备
[0344][0345]
向(2r)-2-氨基-2-[3-(三氟甲氧基)苯基]乙酸乙酯盐酸盐(6g,20mmol)在thf(150ml)中的混合物中添加boc2o(8.7g,40mmol)。然后将nahco3(1.7g,20mmol)添加至此溶液中并在25℃搅拌16小时。将此混合物浓缩并在硅胶上通过色谱法(石油醚:乙酸乙酯=10:1)进行纯化,以提供产物(7.2g,99%产率)。
[0346]
步骤5:n-[(1r)-2-羟基-1-[3-(三氟甲氧基)苯基]乙基]氨基甲酸叔丁酯的制备
[0347][0348]
向lialh4(1.7g,44mmol)在thf(200ml)中的悬浮液中添加在thf(25ml)中的(2r)-2-(叔丁氧基羰基氨基)-2-[3-(三氟-甲氧基)苯基]乙酸乙酯(4g,11mmol),同时冰冷却。添加后,允许反应物加热至25℃并搅拌2小时。添加无水硫酸镁,并然后依次添加一滴水和乙酸乙酯。通过硅藻土垫将不可溶的物质过滤出。将滤液浓缩并且在硅胶上通过色谱法(sio2;石油醚:乙酸乙酯=5:1)进行纯化(2.1g,59%产率)。
[0349]
步骤6:n-[(1r)-2-(二氟甲氧基)-1-[3-(三氟甲氧基)苯基]乙基]氨基甲酸叔丁酯的制备
[0350][0351]
向n-[(1r)-2-羟基-1-[3-(三氟-甲氧基)苯基]乙基]氨基甲酸叔丁酯(1.5g,4.7mmol)在mecn(20ml)中的溶液中添加cui(360mg,1.9mmol),并且在25℃,在n2气氛下搅拌30分钟。随后,在45℃经30分钟,添加2,2-二氟-2-氟磺酰基-乙酸(1.7g,9.3mmol)在mecn(5ml)中的溶液,并且将该反应物在45℃搅拌1小时。将此混合物浓缩,并然后由乙酸乙酯(100ml)稀释,过滤并浓缩以提供所希望的产物(1.5g,粗品)。
[0352]
步骤7:(1r)-2-(二氟甲氧基)-1-[3-(三氟甲氧基)苯基]乙烷胺的制备
[0353][0354]
在25℃,向n-[(1r)-2-(二氟甲氧基)-1-[3-(三氟甲氧基)苯基]乙基]氨基甲酸叔丁酯(1.5g,4mmol)在meoh(15ml)中的溶液中添加hcl/meoh(在meoh中4m,30ml),并且将该反应物在25℃搅拌30分钟。添加氢氧化铵(30%)至ph=9,并将此溶液浓缩并在硅胶上通过色谱法(sio2;石油醚:乙酸乙酯=2:1)进行纯化,以提供(1r)-2-(二氟甲氧基)-1-[3-(三氟甲氧基)苯基]乙烷胺(700mg,64%产率)。
[0355]
iiia:2-(1-羟基环丁基)乙酸
[0356]
[0357]
步骤1:乙基2-(1-羟基环丁基)乙酸酯的制备
[0358][0359]
向在thf(20ml)中的zn(14.9g,228.3mmol)中分批添加tmscl(1.9g,17.1mmol)。在20℃,将所得混合物搅拌15min并然后回流。将反应混合物冷却至室温,并且以使得反应慢慢沸腾的速率滴加2-溴乙酸乙酯(28.6g,171.2mmol)。将所得混合物在70℃搅拌1小时,并且然后在20℃搅拌1小时,然后添加环丁酮(10g,142.7mmol)在thf(5ml)中的溶液。在20℃,将该混合物再搅拌2小时。将该混合物倒入在冰上的nh3.h2o(150ml,25%)中并用乙酸乙酯(100ml x 2)萃取。将有机层用水(200ml x 2)和盐水(100ml x 2)洗涤,经na2so4干燥并浓缩以给出产物(12g,粗品)。
[0360]1h nmr(cdcl
3 400mhz):δ4.20-4.14(m,2h),3.69(s,1h),2.65(s,2h),2.17-2.12(m,2h),2.03-2.00(m,2h),1.78(m,1h),1.58(m,1h),1.27(t,j=7.6hz,3h)。
[0361]
步骤2:2-(1-羟基环丁基)乙酸的制备
[0362][0363]
将naoh(6.3g,158.05mmol)溶解于meoh(150ml)和h2o(50ml)中,并且添加2-(1-羟基环丁基)乙酸乙酯(10g,63.2mmol)。将该混合物在20℃搅拌16小时,并且然后浓缩,并且通过2n hcl溶液将残余物酸化至ph=2-3,并且用乙酸乙酯(200ml x 2)萃取。将有机萃取物用水(100ml x 2)和盐水(100ml x 2)洗涤,经na2so4干燥,并且浓缩以给出粗产物(6g,粗品)。
[0364]1h nmr(cdcl
3 400mhz):δ2.74(s,2h),2.23-2.05(m,4h),1.81(m,1h),1.63-1.58(m,1h)。
[0365]
iiib:2-(3,3-二氟-1-羟基环丁基)乙酸
[0366][0367]
步骤1:2-(3,3-二氟-1-羟基-环丁基)乙酸乙酯的制备
[0368][0369]
在n2下,向3,3-二氟环丁酮(0.2g,1.9mmol)、zn(198mg,3mmol)和i2(10mg,0.04mmol)在thf(13ml)中的溶液中滴加2-溴乙酸乙酯(378mg,2.3mmol)。将该混合物在55℃搅拌6小时。在0℃,将h2so4(10%,10ml)小心添加至反应混合物中,并且将该混合物用乙酸乙酯(20ml
×
3)萃取。将有机萃取物用nahco3(饱和水溶液,10ml)洗涤,经na2so4干燥并浓缩。将粗产物(0.26g)不经进一步纯化而直接使用。
[0370]
步骤2:2-(3,3-二氟-1-羟基-环丁基)乙酸的制备
[0371][0372]
在0℃,向2-(3,3-二氟-1-羟基-环丁基)乙酸乙酯(0.26g,1.3mmol)在meoh(10ml)和h2o(2ml)中的溶液中添加naoh(107mg,2.7mmol)。将该混合物在20℃搅拌8小时。将反应溶液冷却至0℃,并且将1n hcl添加至该溶液直到ph达到1-2。将残余物用盐水(10ml)稀释并且用甲基-叔丁基醚(30ml
×
5)萃取。将合并的有机萃取物经na2so4干燥,过滤并浓缩。将粗产物(0.24g)不经进一步纯化而使用。iiic:3-羟基-4-甲基-3-(三氟甲基)戊酸
[0373][0374]
步骤1:3-羟基-4-甲基-3-(三氟-甲基)戊酸乙酯的制备
[0375][0376]
在15℃,向zn(560mg,8.6mmol)、i2(7mg,0.03mmol)在thf(5ml)中的混合物中添加2-溴乙酸乙酯(524mg,3.1mmol)和1,1,1-三氟-3-甲基-丁-2-酮(0.4g,2.9mmol)。将该混合物在60℃搅拌6小时。添加h2so4(10%水溶液,4ml),并且将该混合物用乙酸乙酯(10ml x 4)萃取。将合并的有机相用盐水(30ml)洗涤,经na2so4干燥,过滤并浓缩,以给出3-羟基-4-甲基-3-(三氟甲基)戊酸乙酯(1g,粗品)。
[0377]
步骤2:3-羟基-4-甲基-3-(三氟甲基)戊酸的制备
[0378][0379]
在15℃,将3-羟基-4-甲基-3-(三氟-甲基)戊酸乙酯(1.5g,粗品)和lioh.h2o(552mg,13.2mmol)在thf(20ml)和h2o(10ml)中的混合物搅拌16小时。用2m hcl将ph调节至约3,并且将混合物用乙酸乙酯(5ml x 4)萃取。将合并的有机萃取物用盐水(15ml)洗涤,经na2so4干燥,过滤并浓缩以给出呈黄色固体的3-羟基-4-甲基-3-(三氟甲基)戊酸(1.1g,粗品),将其不经进一步纯化直接用于下一步骤。
[0380]
iiid:4,4,5,5-四氟-3-羟基-3-甲基戊酸
[0381][0382]
步骤1:4,4,5,5-四氟-3-羟基-3-甲基戊酸乙酯的制备
[0383][0384]
在n2下,在20℃,向3,3,4,4-四氟丁-2-酮(2.00g,13.88mmol)、zn(1.0g,15.7mmol)和i2(35.2mg,0.14mmol)在thf(20ml)中的溶液中滴加2-溴乙酸乙酯(2.4g,
14.3mmol)。将该混合物在60℃搅拌6小时。将反应混合物冷却至0℃,并且小心添加h2so4(15ml,10%水溶液)。将该混合物用乙酸乙酯(80ml
×
3)萃取,并且将合并的有机萃取物用nahco3饱和水溶液(30ml)洗涤,经na2so4干燥并且浓缩。获得标题化合物(2.5g,粗品)并且不经进一步纯化用于下一步骤。
[0385]
步骤2:4,4,5,5-四氟-3-羟基-3-甲基戊酸的制备
[0386][0387]
在0℃,向4,4,5,5-四氟-3-羟基-3-甲基-戊酸乙酯(2.5g,10.8mmol)在meoh(80ml)和h2o(25ml)中的溶液中添加naoh(1.1g,26.9mmol)。在20℃将该混合物搅拌8小时并且浓缩。将水层用1n hcl水溶液酸化至ph=1-2,并且用甲基-叔丁基醚(30ml
×
5)萃取。将合并的有机萃取物经na2so4干燥并且浓缩。获得标题化合物(2.10g,粗品)并且不经进一步纯化而使用。
[0388]
iiie:5,5,5-三氟-3-羟基-3-甲基戊酸
[0389][0390]
步骤1:5,5,5-三氟-3-羟基-3-甲基戊酸乙酯的制备
[0391][0392]
在15℃,向zn(6.9g,104.7mmol)和i2(89mg,0.35mmol)在thf(80ml)中的混合物中添加4,4,4-三氟丁-2-酮(4.4g,34.9mmol)和2-溴乙酸乙酯(6.4g,38.4mmol)。将该混合物在60℃搅拌6小时。将该反应混合物冷却至0℃,并用h2so4(100ml,10%水溶液)淬灭。将该混合物用乙酸乙酯(15ml
×
3)萃取。将合并的有机萃取物用盐水(15ml)洗涤,并经na2so4干燥,过滤并浓缩。获得产物(11.00g,粗品)并且不经进一步纯化而直接使用。
[0393]
步骤2:5,5,5-三氟-3-羟基-3-甲基戊酸的制备
[0394][0395]
在15℃,将5,5,5-三氟-3-羟基-3-甲基-戊酸乙酯(11g,粗品)和naoh(4.1g,102.7mmol)在h2o(150ml)中的混合物搅拌16小时。在0℃用饱和khso4将ph调节至约2,并且将混合物用乙酸乙酯(200ml
×
3)萃取。将合并的有机萃取物用盐水(300ml)洗涤,经na2so4干燥,过滤并浓缩以提供产物(10g,粗品)。
[0396]
iiif:3-(1-氟环丙基)-3-羟基丁酸
[0397][0398]
步骤1:3-(1-氟环丙基)-3-羟基丁酸乙酯的制备
[0399][0400]
在15℃,向1-(1-氟环丙基)乙酮(0.8g,7.8mmol)、zn(1.5g,23.5mmol)和i2(20mg,0.8mmol)在thf(15ml)中的混合物中滴加2-溴乙酸乙酯(1.4g,8.6mmol)。将该混合物在65℃搅拌6小时。将该反应混合物冷却至0℃,并滴加h2so4(10%水溶液,10ml)。向该混合物中添加水(30ml)并用乙酸乙酯(20ml
×
3)萃取。将合并的有机萃取物用盐水(30ml)洗涤,经na2so4干燥,过滤并浓缩。将获得的产物不经进一步纯化而使用。产量:1.6g,粗品。
[0401]
步骤2:3-(1-氟环丙基)-3-羟基丁酸的制备
[0402][0403]
在15℃,将3-(1-氟环丙基)-3-羟基-丁酸乙酯(1.6g,粗品)和naoh(670mg,16.8mmol)在h2o(30ml)中的混合物搅拌16小时。用10%hcl(水溶液)将ph调节至约2。将该混合物用乙酸乙酯(20ml
×
4)萃取,并将合并的有机萃取物用盐水(40ml)洗涤,经na2so4干燥,过滤并浓缩以产出粗产物,将其不经进一步纯化而直接使用。(1.50g,粗品)。
[0404]
iiig:3-环丙基-3-羟基丁酸
[0405][0406]
步骤1:3-环丙基-3-羟基丁酸甲酯的制备
[0407][0408]
向在thf(150ml)中的zn(12.4g,190.2mmol)中添加tmscl(1.3g,11.9mmol),并将该所得混合物在20℃搅拌15分钟,并然后加热至70℃。停止加热,并且将2-溴乙酸甲酯(21.8g,142.7mmol)以使得醚慢慢沸腾的速率滴加。将所得混合物在70℃搅拌1小时,并在20℃搅拌1小时,并然后添加1-环丙基乙酮(10g,118.9mmol)在thf(50ml)中的溶液。将反应在20℃搅拌16小时。将该混合物倒入在冰上的nh
3.
h2o(100ml,28%)中,并用乙酸乙酯(150ml x 2)萃取。将有机萃取物用水(150ml)和盐水(150ml)洗涤,经na2so4干燥并浓缩以给出所希望的产物(8.9g,粗品)。
[0409]
步骤2:3-环丙基-3-羟基丁酸的制备
[0410][0411]
在20℃,将粗品3-环丙基-3-羟基丁酸甲酯(8.9g,56.3mmol)和lioh
.
h2o(11.8g,281.3mmol)在thf(100ml)和h2o(50ml)中的混合物搅拌16小时。添加h2o(50ml)并且用乙酸乙酯(100ml x 2)萃取。将有机萃取物丢弃。将水层的ph用2n hcl调节至约5,用乙酸乙酯(100ml x 3)萃取,并且将合并的有机级分用盐水(100ml x 10)洗涤,经na2so4干燥,过滤并
浓缩以给出30%总产率(5.1g)的所希望的产物。
[0412]1h nmr(400mhz,cdcl3)δ2.67-2.51(m,2h),1.25(s,3h),0.90-1.00(m,1h),0.33-0.50(m,4h)。
[0413]
iva:3-[1-(二氟甲基)环丙基]-3-氧代-丙酸乙酯
[0414][0415]
步骤1:3-[1-(二氟甲基)环丙基]-3-氧代-丙酸乙酯的制备
[0416][0417]
将et3n(2.34g,23.5mmol)和mgcl2(1.8g,18.4mmol)添加至(3-乙氧基-3-氧代-丙酰基)氧基钾盐(2.6g,15.4mmol)在mecn(30ml)中的悬浮液里,并在20℃搅拌2小时。在0℃,添加cdi(羰基-二咪唑)(1.4g,8.8mmol)和1-(二氟甲基)环丙烷羧酸(1g,7.4mmol)在mecn(20ml)中的预搅拌的混合物,并在20℃搅拌14小时。将该反应混合物用h2o(30ml)稀释,并用乙酸乙酯(80ml
×
2)萃取。将合并的有机萃取物用盐水(30ml)洗涤,经na2so4干燥,过滤并浓缩。将残余物在硅胶上通过快速色谱法(洗脱液为0-10%乙酸乙酯/石油醚梯度)进行纯化。获得0.98g(65%)产量的产物。
[0418]
ivb:3-氧代-3-[1-(三氟甲基)环丙基]丙酸乙酯
[0419][0420]
步骤1:3-氧代-3-[1-(三氟甲基)环丙基]丙酸乙酯的制备
[0421][0422]
将et3n(6.3g,62.3mmol)和mgcl2(4.6g,48.7mmol)添加至3-乙氧基-3-氧代-丙酸钾(6.9g,40.5mmol)在ch3cn(25ml)中的悬浮液中,并在20℃搅拌2小时。在0℃添加羰基二咪唑(cdi)(3.8g,23.3mmol)和1-(三氟甲基)环丙烷羧酸(3g,19.5mmol)在ch3cn(25ml)中的预搅拌的混合物,并在20℃搅拌14小时。将该混合物倒入水(20ml)中。将水相用乙酸乙酯(30ml
×
3)萃取。将合并的有机相用盐水(40ml
×
2)洗涤,用无水na2so4干燥,过滤并浓缩。将残余物在硅胶上通过柱色谱法(石油醚/乙酸乙酯=30:1-10:1)进行纯化,以提供3.5g(80%)产量的产物。
[0423]
va:4,4-二甲基-3-氧代-n-[(1s)-1-[3-(三氟甲氧基)苯基]乙基]戊酰胺
[0424][0425]
在25℃,将(1s)-1-[3-(三氟甲氧基)苯基]乙烷胺盐酸盐(iia)(5g,20.69mmol)、4,4-二甲基-3-氧代-戊酸(3.28g,22.76mmol)、hatu(9.44g,24.83mmol)和dipea(8g,62.1mmol)在dcm(250ml)中的溶液搅拌16小时。将所得混合物用水(500ml)洗涤,并用dcm(500ml
×
2)萃取。将有机层用盐水(350ml
×
2)洗涤,经na2so4干燥并浓缩。将残余物通过色谱法(sio2,石油醚/乙酸乙酯=1:0至3:1)进行纯化,以提供4,4-二甲基-3-氧代-n-[(1s)-1-[3-(三氟甲氧基)苯基]乙基]戊酰胺(11.2g,粗品)。
[0426]
通过与va类似的方法,使用相关的中间体制备以下中间体:
[0427]
vb:4,4-二甲基-3-氧代-n-[(1s)-1-[3-(2,2,2-三氟乙氧基)苯基]乙基]戊酰胺
[0428][0429]
从iib(2.6g,10.1mmol)和4,4-二甲基-3-氧代-戊酸(1.6g,11.1mmol)制备。
[0430]
产量:2.6g(75%)。
[0431]
vc:(s)-n-(1-(3-(二氟甲氧基)苯基)乙基)-4,4-二甲基-3-氧代戊酰胺
[0432][0433]
从iic(0.8g,4.3mmol)和4,4-二甲基-3-氧代-戊酸(616mg,4.3mmol)制备
[0434]
产量:1.3g粗品
[0435]
vd:(s)-4,4-二甲基-3-氧代-n-(1-(3-(三氟甲基)苯基)乙基)戊酰胺
[0436][0437]
从iid(850mg,3.77mmol)和4,4-二甲基-3-氧代-戊酸(597mg,4.14mmol)制备。
[0438]
产量:1.12g(94%)
[0439]
ve:(s)-4,4-二甲基-3-氧代-n-(1-(3-(三氟甲氧基)苯基)丙基)戊酰胺
[0440][0441]
从iie(1.04g,4.07mmol)和4,4-二甲基-3-氧代-戊酸(645mg,4.47mmol)制备。
[0442]
产量:1.28g(91%)。
[0443]
vf:(s)-4-甲基-3-氧代-n-(1-(3-(2,2,2-三氟乙氧基)苯基)乙基)戊酰胺
[0444][0445]
从iib(2.89g,11.32mmol)和4-甲基-3-氧代-戊酸(1.62g)制备。
[0446]
产量:2.6g(69%)。
[0447]
vi:(s)-4-甲基-3-氧代-n-(1-(3-(三氟甲氧基)苯基)乙基)戊酰胺
[0448][0449]
从iia(2.7g,13.16mmol)和4-甲基-3-氧代-戊酸(1.60g)制备
[0450]
产量:2.00g(47%)。
[0451]
vj:n-[(1r)-2-(二氟甲氧基)-1-[3-(三氟甲氧基)苯基]乙基]-4,4-二甲基-3-氧代-戊酰胺
[0452][0453]
从iig(600mg,2.21mmol)和4,4-二甲基-3-氧代-戊酸(382mg,2.66mmol)制备
[0454]
产量:520mg(51%)。
[0455]
vk:n-[(1r)-2-甲氧基-1-[3-(三氟甲氧基)苯基]乙基]-4,4-二甲基-3-氧代-戊酰胺
[0456][0457]
从iif(40mg,0.15mmol)和4,4-二甲基-3-氧代-戊酸(25mg,0.17mmol)制备
[0458]
产量:100mg,(94%)。
[0459]
vg:3-[1-(二氟甲基)环丙基]-3-氧代-n-[(1s)-1-[3-(三氟甲氧基)苯基]乙基]丙酰胺
[0460][0461]
将iia(557mg,2.30mmol)、iva(0.95g,4.61mmol)、dmap(57mg,0.46mmol)和et3n(2.33g,23.04mmol)在甲苯(30ml)中的混合物脱气,并用n2吹扫3次,然后在n2下将该混合物在110℃搅拌12小时。将该混合物浓缩,并且将残余物在硅胶上通过快速色谱法(洗脱液为0-35%乙酸乙酯/石油醚梯度)进行纯化,以产出所希望的产物(0.61g,72%产率)。
[0462]
通过如针对vg所描述类似的方法,使用相关的中间体制备以下项:
[0463]
vh:3-氧代-n-[(1s)-1-[3-(三氟甲氧基)苯基]乙基]-3-[1-(三氟甲基)环丙基]丙酰胺
[0464][0465]
从ivb(2g,8.9mmol)和iia(915.3mg,4.5mmol)制备
[0466]
产量:1.7g(97%)。
[0467]
vl:(s)-3-(3,3-二氟环丁基)-3-氧代-n-(1-(3-(三氟甲氧基)苯基)乙基)丙酰胺
[0468][0469]
从3-(3,3-二氟环丁基)-3-氧代丙酸甲酯(600mg,3.12mmol)和iia(377mg,1.56mmol)制备。
[0470]
产量:470mg,(82%)。
[0471]1h nmr(cdcl
3,
400mhz)δ7.39-7.35(m,1h),7.26-7.23(m,1h),7.15-7.11(m,2h),5.16-5.08(m,1h),3.44(d,j=2.4hz,2h),2.86-2.71(m,5h),1.51(d,j=7.2hz,3h)。
[0472]
实例:
[0473]
实例1a:
[0474]
(s)-3-羟基-4,4-二甲基-n-((s)-1-(3-(三氟甲氧基)苯基)乙基)戊酰胺
[0475][0476]
和实例1b:
[0477]
(r)-3-羟基-4,4-二甲基-n-[(1s)-1-[3-(三氟甲氧基)苯基]乙基]戊酰胺
[0478][0479]
步骤1:3-羟基-4,4-二甲基-n-[(1s)-1-[3-(三氟甲氧基)苯基]乙基]戊酰胺的制备
[0480][0481]
在0℃,向4,4-二甲基-3-氧代-n-[(1s)-1-[3-(三氟甲氧基)苯基]乙基]戊酰胺(va)(5.6g,16.90mmol)在meoh(50ml)中的混合物中分批添加nabh4(1.28g,33.8mmol)。将该混合物在0℃搅拌1小时。在0℃分批添加水(50ml)。在相同的尺度上将此反应重复两次,并将来自三次单独反应的粗产物合并并处理如下:
[0482]
将该混合物进行浓缩以去除meoh,并然后用乙酸乙酯(100ml
×
4)萃取。将合并的有机萃取物用盐水(50ml
×
3)洗涤,经na2so4干燥,过滤并浓缩以提供3-羟基-4,4-二甲基-n-[(1s)-1-[3-(三氟甲氧基)苯基]乙基]戊酰胺(16.5g,粗品)。
[0483]
步骤2:(s)-3-羟基-4,4-二甲基-n-[(1s)-1-[3-(三氟甲氧基)苯基]乙基]戊酰胺和(r)-3-羟基-4,4-二甲基-n-[(1s)-1-[3-(三氟甲氧基)苯基]乙基]戊酰胺的分离
[0484][0485]
通过色谱法分离3-羟基-4,4-二甲基-n-[(1s)-1-[3-(三氟甲氧基)苯基]乙基]戊酰胺(27g,83mmol)。
[0486]
实例1a:
[0487]
产量:10.5g
[0488]1h nmr(cdcl
3 400mhz):δ7.33(t,j=8.0hz,1h),7.22(d,j=8.0hz,1h),7.05-7.20(2h),6.40(br,1h),5.15(m,1h),3.64(dd,j=2.0hz,8.4hz,1h),3.05(br,1h),2.15-2.40(m,2h),1.45(d,j=7.2hz,3h),0.88(s,9h)。
[0489]
lc-ms:tr=2.548min(lcms方法1),m/z=334.0[m h]
。
[0490]
sfc:tr=1.89min(sfc方法4),de=95%,[α]
d20
=-71.7(c=0.72g/100ml,meoh)。
[0491]
实例1b:
[0492]
产量:10.5g
[0493]1h nmr(cdcl
3 400mhz):δ7.32(t,j=8.0hz,1h),7.22(d,j=7.6hz,1h),7.13(s,1h),7.10-7.07(m,1h),6.52(d,j=7.6hz,1h),5.13-5.06(m,1h),3.62(dd,j=2.0hz,8.4hz,1h),3.45-3.33(m,1h),2.38-2.33(m,1h),2.23-2.17(m,1h),1.44(d,j=7.2hz,3h),0.88(s,9h)。lc-ms:tr=2.553min(lcms方法1),m/z=334.0[m h]
。
[0494]
sfc:tr=1.87min(sfc方法5),de=100%,[α]
d20
=-42.3(c=0.61g/100ml,meoh)。
[0495]
通过如针对1a和1b所描述类似的方法,使用相关的中间体制备以下实例:
[0496]
实例2a:
[0497]
3-羟基-4,4-二甲基-n-((s)-1-(3-(2,2,2-三氟乙氧基)苯基)乙基)戊酰胺
[0498][0499]
和实例2b:
[0500]
3-羟基-4,4-二甲基-n-((s)-1-(3-(2,2,2-三氟乙氧基)苯基)乙基)戊酰胺
[0501][0502]
步骤1:3-羟基-4,4-二甲基-n-((s)-1-(3-(2,2,2-三氟乙氧基)苯基)乙基)戊酰胺的制备
[0503][0504]
将3-羟基-4,4-二甲基-n-((s)-1-(3-(2,2,2-三氟乙氧基)苯基)乙基)戊酰胺以84%产率从vb制备。
[0505]
步骤2:(s)-3-羟基-4,4-二甲基-n-((s)-1-(3-(2,2,2-三氟乙氧基)苯基)乙基)戊酰胺和(r)-3-羟基-4,4-二甲基-n-((s)-1-(3-(2,2,2-三氟乙氧基)苯基)乙基)戊酰胺的分离
[0506][0507]
将3-羟基-4,4-二甲基-n-[(1s)-1-[3-(2,2,2-三氟乙氧基)苯基]乙基]戊酰胺(0.84g,2.52mmol)通过手性sfc进行分离。
[0508]
实例2a:
[0509]
产量:0.25g
[0510]1h nmr(cdcl3,400mhz)δ7.30(t,j=7.6hz,1h),7.01(d,j=7.6hz,1h),6.93(s,1h),6.85(dd,j=8.4hz,2.8hz,1h),6.08(br d,j=5.2hz,1h),5.13(m,1h),4.36(q,j=16.0hz,8.0hz,2h),3.68(dd,j=10.4hz,3.0hz,1h),3.24(d,j=3.2hz,1h),2.39-2.23(m,2h),1.49(d,j=6.8hz,3h),0.93(s,9h)
[0511]
lc-ms:tr=2.68min(lcms方法2),m/z=348.0[m h]
。
[0512]
sfc:tr=1.78min(sfc方法1),de=98.3%,[α]
d20
=-68.0(c=0.25,meoh)。
[0513]
实例2b:
[0514]
产量:0.37g
[0515]1h nmr(cdcl3,400mhz)δ7.29(t,j=8.0hz,1h),7.01(d,j=8.0hz,1h),6.94(s,1h),6.84(dd,j=8.0,2.4hz,1h),6.04(m,1h),5.13(m,1h),4.36(q,j=16.0hz,8.0hz,2h),3.70-3.67(m,1h),3.15(d,j=2.8hz,1h),2.40-1.96(m,2h),1.50(d,j=7.2hz,3h),0.93(s,9h)lc-ms:tr=2.543min(lcms方法2),m/z=348.0[m h]
。
[0516]
sfc:tr=1.87min(sfc方法1),de=92.0%,[α]
d20
=-53.3(c=0.21,meoh)。
[0517]
实例3a:n-((s)-1-(3-(二氟甲氧基)苯基)乙基)-3-羟基-4,4-二甲基戊酰胺
[0518][0519]
和
[0520]
实例3b:n-((s)-1-(3-(二氟甲氧基)苯基)乙基)-3-羟基-4,4-二甲基戊酰胺
[0521][0522]
步骤1:n-((s)-1-(3-(二氟甲氧基)苯基)乙基)-3-羟基-4,4-二甲基戊酰胺的制备
[0523][0524]
从vc制备,84%产率。
[0525]
步骤2:(s)-n-((s)-1-(3-(二氟甲氧基)苯基)乙基)-3-羟基-4,4-二甲基戊酰胺和(r)-n-((s)-1-(3-(二氟甲氧基)苯基)乙基)-3-羟基-4,4-二甲基戊酰胺的分离
[0526]
[0527]
将n-((s)-1-(3-(二氟甲氧基)苯基)乙基)-3-羟基-4,4-二甲基戊酰胺(450mg)通过手性sfc进行分离。
[0528]
实例3a:
[0529]
产量:168mg
[0530]1h nmr(cdcl
3 400mhz):δ7.31-7.29(m,1h),7.26-7.24(m,1h),7.16-7.14(m,1h),7.10-6.98(m,1h),6.49(t,j=76hz,1h),6.14(brs,1h),5.14-5.07(m,1h),3.66(d,j=10.4hz,1h),3.17(s,1h),2.38-2.34(m,1h),2.28-2.18(m,1h),1.47-1.40(m,3h),0.98(s,9h)。
[0531]
lc-ms:tr=2.161min(lcms方法3),m/z=316.1[m h]
。
[0532]
sfc:tr=2.15min(sfc方法2),de=96.6%,[α]
d20
=-16(c=0.25,meoh)。
[0533]
实例3b:
[0534]
产量:126mg
[0535]1h nmr(cdcl
3 400mhz):δ7.34-7.30(m,1h),7.16-7.12(m,1h),7.04-6.97(m,2h),6.31(t,j=76hz,1h),6.14(brs,1h),5.12-5.06(m,1h),3.67-3.62(m,1h),3.29(s,1h),2.37-2.31(m,1h),2.26-2.19(m,1h),1.47-1.43(m,3h),0.98(s,9h)。
[0536]
lc-ms:tr=2.16min(lcms方法3),m/z=316.1[m h]
。
[0537]
sfc:tr=2.42min(sfc方法2),de=100%,[α]
d20
=-57.6(c=0.5,meoh)。
[0538]
实例4a:3-羟基-4,4-二甲基-n-((s)-1-(3-(三氟-甲基)苯基)乙基)戊酰胺
[0539][0540]
和
[0541]
实例4b:3-羟基-4,4-二甲基-n-((s)-1-(3-(三氟-甲基)苯基)乙基)戊酰胺
[0542][0543]
步骤1:3-羟基-4,4-二甲基-n-((s)-1-(3-(三氟甲基)苯基)乙基)戊酰胺的制备
[0544][0545]
从vd制备(980mg,87%产率)。
[0546]
步骤2:(s)-3-羟基-4,4-二甲基-n-((s)-1-(3-(三氟甲基)苯基)乙基)戊酰胺和(r)-3-羟基-4,4-二甲基-n-((s)-1-(3-(三氟甲基)苯基)乙基)戊酰胺的分离
[0547][0548]
将3-羟基-4,4-二甲基-n-((s)-1-(3-(三氟甲基)苯基)乙基)戊酰胺在硅胶上通过通过色谱法(石油醚:乙酸乙酯=3:1)进行分离。
[0549]
实例4a:产量:220mg
[0550]1h nmr(cdcl
3 400mhz):δ7.56(s,1h),7.52-7.43(m,3h),6.22-6.21(m,1h),5.21-5.14(m,1h),3.68-3.64(m,1h),3.14(d,j=3.2hz,1h),2.40-2.36(m,1h),2.26-2.20(m,1h),1.50(d,j=7.2hz,3h),0.91(s,9h)。
[0551]
lc-ms:tr=2.48min(lcms方法1),m/z=318.0[m h]
。
[0552]
sfc:tr=1.56min(sfc方法3),de=100%,[α]
d20
=-25.5(c=0.19g/100ml,meoh)。
[0553]
实例4b:产量:270mg
[0554]1h nmr(cdcl
3 400mhz):δ7.54-7.45(m,4h),6.25-6.23(m,1h),5.20-5.13(m,1h),3.69-3.65(m,1h),3.24(d,j=3.2hz,1h),2.39-2.35(m,1h),2.27-2.21(m,1h),1.49(d,j=6.8hz,3h),0.91(s,9h)。
[0555]
lc-ms:tr=2.48min(lcms方法1),m/z=318.0[m h]
。
[0556]
sfc:tr=1.93min(sfc方法3),de=100%,[α]
d20
=-61.4(c=0.57g/100ml,meoh)。
[0557]
实例8a:3-羟基-4,4-二甲基-n-((s)-1-(3-(三氟-甲氧基)苯基)丙基)戊酰胺
[0558][0559]
和
[0560]
实例8b:3-羟基-4,4-二甲基-n-((s)-1-(3-(三氟-甲氧基)苯基)丙基)戊酰胺
[0561][0562]
步骤1:3-羟基-4,4-二甲基-n-((s)-1-(3-(三氟甲氧基)苯基)丙基)戊酰胺的制备
[0563][0564]
从ve制备,产量:1.22g
[0565]
步骤2:(s)-3-羟基-4,4-二甲基-n-((s)-1-(3-(三氟甲氧基)苯基)丙基)戊酰胺和(r)-3-羟基-4,4-二甲基-n-((s)-1-(3-(三氟甲氧基)苯基)丙基)戊酰胺的分离
[0566][0567]
将3-羟基-4,4-二甲基-n-((s)-1-(3-(三氟甲氧基)苯基)丙基)戊酰胺在硅胶上通过快速色谱法(洗脱液为0-30%乙酸乙酯/石油醚梯度)进行分离。
[0568]
实例8a:产量:0.51g
[0569]1h nmr(cdcl
3 400mhz):δ7.40-7.34(m,1h),7.25-7.21(m,1h),7.14-7.10(m,2h),6.22-6.15(m,1h),4.92(q,j=7.6hz,1h),3.71-3.65(m,1h),3.21(d,j=2.8hz,1h),2.40-2.23(m,2h),1.82(q,j=7.2hz,2h),0.94-0.90(m,12h)。
[0570]
lc-ms:tr=2.486min(lcms方法5),m/z=348.0[m h]
。
[0571]
sfc:tr=1.775min。(sfc方法3),de=98.7%,[α]
d20
=-80.0(c=0.31g/100ml,meoh)。
[0572]
实例8b:产量:0.59g
[0573]1h nmr(cdcl
3 400mhz):δ7.39-7.33(m,1h),7.25-7.20(m,1h),7.14-7.09(m,2h),6.24(br d,j=8.0hz,1h),4.92(q,j=7.6hz,1h),3.69-3.63(m,1h),3.15(d,j=3.2hz,1h),2.40-2.25(m,2h),1.81(q,j=7.6hz,2h),0.94-0.90(m,12h)。
[0574]
lc-ms:tr=2.506min(lcms方法5),m/z=348.0[m h]
。
[0575]
sfc:tr=1.609min。(sfc方法3)de=98.7%,[α]
d20
=-40.0(c=0.27g/100ml,meoh)。
[0576]
实例11a:3-(3,3-二氟环丁基)-3-羟基-n-((s)-1-(3-(三氟甲氧基)苯基)乙基)丙酰胺
[0577][0578]
和
[0579]
实例11b:3-(3,3-二氟环丁基)-3-羟基-n-((s)-1-(3-(三氟甲氧基)苯基)乙基)丙烯酰胺
[0580][0581]
步骤1:3-(3,3-二氟环丁基)-3-羟基-n-((s)-1-(3-(三氟甲氧基)苯基)乙基)丙酰胺的制备
[0582][0583]
从vl制备。产量:300mg,(60.7%)。
[0584]
步骤2:(s)-3-(3,3-二氟环丁基)-3-羟基-n-((s)-1-(3-(三氟甲氧基)苯基)乙基)丙-酰胺和(r)-3-(3,3-二氟环丁基)-3-羟基-n-((s)-1-(3-(三氟甲氧基)苯基)乙基)丙酰胺的分离
[0585][0586]
通过手性sfc进行分离。
[0587]
实例11a:产量90mg
[0588]1h nmr(400mhz,cdcl3)δ7.42-7.35(m,1h),7.25(d,j=7.6hz,1h),7.17-7.11(m,
2h),5.93(d,j=7.2hz,1h),5.19-5.09(m,1h),4.01-3.93(m,1h),3.86(d,j=3.6hz,1h),2.62-2.48(m,3h),2.46-2.13(m,4h),1.50(d,j=6.8hz,3h)。
[0589]
lc-ms:tr=2.513min(lcms方法2),m/z=368.0[m h]
。
[0590]
sfc:tr=2.169min。(sfc方法3),de=97.4%,[α]
d20
=-42.0(c=2.0mg/ml,meoh)。
[0591]
实例11b:产量90mg
[0592]1h nmr(400mhz,cdcl3)δ7.40-7.36(m,1h),7.25(d,j=7.6hz,1h),7.16-7.11(m,2h),5.99(d,j=7.2hz,1h),5.18-5.09(m,1h),3.98(t,j=7.2hz,1h),3.83(br s,1h),2.61-2.49(m,3h),2.45-2.12(m,4h),1.50(d,j=6.8hz,3h)。
[0593]
lc-ms:tr=2.235min(lcms方法3),m/z=368.0[m h]
。
[0594]
sfc:tr=2.013min。(sfc方法3),de=99.6%,[α]
d20
=-17.0(c=2.0mg/ml,meoh)。
[0595]
实例12a:3-羟基-4-甲基-n-((s)-1-(3-(2,2,2-三氟-乙氧基)苯基)乙基)戊酰胺
[0596][0597]
和
[0598]
实例12b:3-羟基-4-甲基-n-((s)-1-(3-(2,2,2-三氟-乙氧基)苯基)乙基)戊酰胺
[0599][0600]
步骤1:3-羟基-4-甲基-n-((s)-1-(3-(2,2,2-三氟乙氧基)苯基)乙基)戊酰胺的制备
[0601][0602]
从vf制备。
[0603]
产量:0.88g(87%)
[0604]
步骤2:(s)-3-羟基-4-甲基-n-((s)-1-(3-(2,2,2-三氟乙氧基)苯基)乙基)戊酰胺和(r)-3-羟基-4-甲基-n-((s)-1-(3-(2,2,2-三氟乙氧基)苯基)乙基)戊酰胺的分离
[0605]
将3-羟基-4-甲基-n-((s)-1-(3-(2,2,2-三氟乙氧基)苯基)乙基)戊酰胺通过手性sfc进行分离。
[0606]
实例12a:产量:0.362g
[0607]1h nmr(cdcl3,400mhz)δ7.31(t,j=8.0hz,1h),7.01(d,j=7.2hz,1h),6.92(t,j=2.0hz,1h),6.83(dd,j=8.0,2.4hz,1h),6.08(br d,j=7.2hz,1h),5.12(m,1h),4.36(q,j=8.0hz,2h),3.80-3.74(m,1h),3.36(d,j=3.2hz,1h),2.37-2.27(m,2h),1.73-1.70
(m,1h),1.49(d,j=6.8hz,3h),0.94(dd,j=10.4,6.8hz,6h);
[0608]
lc-ms:tr=2.531min(lcms方法2),m/z=334.0[m h]
。
[0609]
sfc:tr=2.864min(sfc方法3),de=99.2%,[α]
d20
=-74.0(c=0.20,meoh)。
[0610]
实例12b:产量:0.245g
[0611]1h nmr(cdcl3,400mhz)δ7.30(t,j=8.0hz,1h),7.00(d,j=8.0hz,1h),6.92(t,j=2.0hz,1h),6.83(dd,j=8.0,2.4hz,1h),6.14(br d,j=6.8hz,1h),5.11(m,1h),4.36(q,j=16.4,8.0hz,2h),3.79-3.75(m,1h),3.34(d,j=3.2hz,1h),2.38-2.25(m,2h),1.73-1.62(m,1h),1.49(d,j=7.2hz,3h),0.94(dd,j=10.0,6.8hz,6h);
[0612]
lc-ms:tr=2.543min(lcms方法2),m/z=334.0[m h]
。
[0613]
sfc:tr=3.071min(sfc方法3),de=99.7%,[α]
d20
=-47.0(c=0.20,meoh)。
[0614]
实例14a:3-(1-(二氟甲基)环丙基)-3-羟基-n-((s)-1-(3-(三氟甲氧基)苯基)乙基)丙酰胺
[0615][0616]
和
[0617]
实例14b:3-(1-(二氟甲基)环丙基)-3-羟基-n-((s)-1-(3-(三氟甲氧基)苯基)乙基)丙酰胺
[0618][0619]
步骤1:3-(1-(二氟甲基)环丙基)-3-羟基-n-((s)-1-(3-(三氟甲氧基)苯基)乙基)丙酰胺的制备
[0620][0621]
从vg制备。
[0622]
产量:0.58g
[0623]
步骤2:(s)-3-(1-(二氟甲基)环丙基)-3-羟基-n-((s)-1-(3-(三氟甲氧基)苯基)乙基)丙酰胺和(r)-3-(1-(二氟甲基)环丙基)-3-羟基-n-((s)-1-(3-(三氟甲氧基)苯基)乙基)丙酰胺的分离
[0624][0625]
将3-(1-(二氟甲基)环丙基)-3-羟基-n-((s)-1-(3-(三氟甲氧基)苯基)乙基)丙酰胺通过快速硅胶色谱法(洗脱液为0-41%乙酸乙酯/石油醚梯度)进行分离。
[0626]
实例14a:0.2g
[0627]1h nmr(cdcl
3 400mhz):δ7.40-7.34(m,1h),7.26-7.22(m,1h),7.16-7.11(m,2h),6.11(br d,j=7.2hz,1h),5.88(t,j=58.4hz,1h),5.12(quin,j=7.2hz,1h),3.91(d,j=
3.2hz,1h),3.81-3.75(m,1h),2.62-2.48(m,2h),1.49(d,j=7.2hz,3h),0.87-0.76(m,2h),0.76-0.62(m,2h)。
[0628]
lc-ms:tr=2.448min(lcms方法1),m/z=368.0[m h]
。
[0629]
sfc:tr=2.282min。(sfc方法3),de=97.9%,[α]
d20
=-62.0(c=0.27g/100ml,meoh)。
[0630]
实例14b:产量:0.18g
[0631]1h nmr(cdcl
3 400mhz):δ7.40-7.34(m,1h),7.24(d,j=7.6hz,1h),7.17-7.10(m,2h),6.06(br d,j=7.6hz,1h),5.84(t,j=58.4hz,1h),5.12(quin,j=7.2hz,1h),3.86-3.79(m,2h),2.55(d,j=5.6hz,2h),1.50(d,j=6.8hz,3h),0.83-0.75(m,2h),0.74-0.66(m,2h)。lc-ms:tr=2.467min(lcms方法1),m/z=368.0[m h]
。
[0632]
sfc tr=1.960min。(sfc方法3),de=96.3%,[α]
d20
=-54.4(c=0.25g/100ml,meoh)。
[0633]
实例16a:3-羟基-n-((s)-1-(3-(三氟甲氧基)苯基)乙基)-3-(1-(三氟甲基)环丙基)丙酰胺
[0634][0635]
和
[0636]
实例16b:3-羟基-n-((s)-1-(3-(三氟甲氧基)苯基)乙基)-3-(1-(三氟甲基)环丙基)丙酰胺
[0637][0638]
步骤1:3-羟基-n-((s)-1-(3-(三氟-甲氧基)苯基)乙基)-3-(1-(三氟甲基)环丙基)丙酰胺的制备
[0639][0640]
从vh制备并直接用于下一步骤。
[0641]
步骤2:(r)-3-羟基-n-((s)-1-(3-(三氟-甲氧基)苯基)乙基)-3-(1-(三氟甲基)环丙基)丙酰胺和(s)-3-羟基-n-((s)-1-(3-(三氟甲氧基)苯基)乙基)-3-(1-(三氟甲基)环丙基)丙酰胺的分离
[0642][0643]
将来自步骤1的粗产物通过手性sfc进行分离,以产出所希望的产物。
[0644]
实例16a:产量:556mg
[0645]1h nmr(dmso-d
6 400mhz):δ8.37(d,j=7.6hz,1h),7.43-7.39(m,1h),7.31-7.29(m,1h),7.23(s,1h),7.18-7.16(m,1h),5.21(d,j=5.2hz,1h),4.96-4.88(m,1h),3.85-3.75(m,1h),2.35-2.25(m,2h),1.30(d,j=7.2hz,3h),0.85-0.77(m,4h)。
[0646]
lc-ms:tr=2.626min(lcms方法2),m/z=386.0[m h]
。
[0647]
sfc:tr=2.010min。(sfc方法3),de=99.9%,[α]
d20
=-56.0(c=0.01g/100ml,meoh)。
[0648]
实例16b:产量:692mg
[0649]1h nmr(dmso-d
6 400mhz):δ8.36(d,j=8.0hz,1h),7.42-7.38(m,1h),7.32(d,j=8.0hz,1h),7.25(s,1h),7.17-7.15(m,1h),5.20(d,j=5.2hz,1h),4.95-4.91(m,1h),3.75-3.85(m,1h),2.25-2.35(m,2h),1.30(d,j=6.8hz,3h),0.80-0.79(m,4h)。
[0650]
lc-ms:tr=2.649min(lcms方法2),m/z=386.0[m h]
。
[0651]
sfc:tr=1.615min。(sfc方法3),de=95.7%,[α]
d20
=-46.0(c=0.01g/100ml,meoh)。
[0652]
实例20a:3-羟基-4-甲基-n-((s)-1-(3-(三氟甲氧基)苯基)乙基)戊酰胺
[0653][0654]
和
[0655]
实例20b:3-羟基-4-甲基-n-((s)-1-(3-(三氟甲氧基)苯基)乙基)戊酰胺
[0656][0657]
步骤1:3-羟基-4-甲基-n-((s)-1-(3-(三氟甲氧基)苯基)乙基)戊酰胺的制备
[0658][0659]
从vi制备。产量:1.80g(72%)
[0660]
步骤2:(s)-3-羟基-4-甲基-n-((s)-1-(3-(三氟甲氧基)苯基)乙基)戊酰胺和(r)-3-羟基-4-甲基-n-((s)-1-(3-(三氟甲氧基)苯基)乙基)戊酰胺的分离
[0661][0662]
将3-羟基-4-甲基-n-((s)-1-(3-(三氟甲氧基)苯基)乙基)戊酰胺通过色谱法(sio2,石油醚/乙酸乙酯=0:1至1:1)进行分离。
[0663]
实例20a:250mg
[0664]1h nmr(cdcl3,400mhz)δ7.37(t,j=8.0hz,1h),7.27-7.21(m,1h),7.16-7.11(m,2h),6.15(d,j=6.8hz,1h),5.16(quin,j=6.8hz,1h),3.83-3.74(m,1h),3.26(d,j=3.2hz,1h),2.37(dd,j=15.2,3.2hz,1h),2.31(dd,j=15.2,8.8hz,1h),1.74-1.68(m,1h),1.50(d,j=6.8hz,3h),0.95(d,j=6.8hz,3h),0.93(d,j=6.8hz,3h)。
[0665]
lc-ms:tr=2.629min(lcms方法2),m/z=320.0[m h]
。
[0666]
sfc:tr=2.404min(sfc方法13),de=98.6%,[α]
d20
=-80.0(c=0.475g/100ml,meoh)。
[0667]
实例20b:产量470mg
[0668]1h nmr(cdcl3,400mhz)δ7.37(t,j=7.6hz,1h),7.28-7.23(m,1h),7.16(s,1h),7.14-7.11(m,1h),6.19(d,j=6.8hz,1h),5.15(quin,j=7.2hz,1h),3.80-3.74(m,1h),3.20(d,j=3.6hz,1h),2.38(dd,j=14.8,2.4hz,1h),2.30(dd,j=14.8,9.2hz,1h),1.73-1.66(m,1h),1.49(d,j=6.8hz,3h),0.95(d,j=6.8hz,3h),0.93(d,j=6.8hz,3h)。
[0669]
lc-ms:tr=2.654min(lcms方法2),m/z=320.0[m h]
。
[0670]
sfc:tr=1.979min(sfc方法13),de=100%,[α]
d20
=-52.0(c=0.53g/100ml,meoh)。
[0671]
实例21a:n-((r)-2-(二氟甲氧基)-1-(3-(三氟-甲氧基)苯基)乙基)-3-羟基-4,4-二甲基戊酰胺
[0672][0673]
和
[0674]
实例21b:n-((r)-2-(二氟甲氧基)-1-(3-(三氟-甲氧基)苯基)乙基)-3-羟基-4,4-二甲基戊酰胺
[0675][0676]
步骤1:n-((r)-2-(二氟甲氧基)-1-(3-(三氟甲氧基)苯基)乙基)-3-羟基-4,4-二甲基戊酰胺的制备
[0677][0678]
从vj制备。产量=350mg,(96%)
[0679]
步骤2:n-((r)-2-(二氟甲氧基)-1-(3-(三氟甲氧基)苯基)乙基)-3-(r)-羟基-4,4-二甲基-戊酰胺和n-((r)-2-(二氟甲氧基)-1-(3-(三氟-甲氧基)苯基)乙基)-3-(s)-羟基-4,4-二甲基戊酰胺的分离
[0680][0681]
将n-((r)-2-(二氟甲氧基)-1-(3-(三氟甲氧基)苯基)乙基)-3-羟基-4,4-二甲基戊酰胺通过手性sfc进行分离。
[0682]
实例21a:产量:98mg
[0683]1h nmr(cdcl
3 400mhz):δ7.39(t,j=8.0hz,1h),7.29-7.26(m,1h),7.20(s,1h),7.16(d,j=8.0hz,1h),6.65(d,j=7.6hz,1h),6.22(t,j=74.0hz,1h),5.34-5.30(m,1h),4.18-4.09(m,2h),3.69(d,j=10.8hz,1h),2.91(s,1h),2.45-2.43(m,1h),2.34-2.27(m,1h),0.93(s,9h)。
[0684]
lc-ms:tr=2.471min(lcms方法5),m/z=400.0[m h]
。
[0685]
sfc:tr=1.935min(sfc方法14),de=98.2%,[α]
d20
=-2.4(c=1.0g/100ml,mecn)。
[0686]
实例21b:160mg
[0687]1h nmr(dmso-d
6 400mhz):δ8.54(d,j=8.4hz,1h),7.49(d,j=8.0hz,1h),7.41(d,j=8.0hz,1h),7.39(s,1h),7.28(d,j=8.0hz,1h),6.67(t,j=76.0hz,1h),5.21-5.18(m,1h),4.67(s,1h),4.04-3.98(m,2h),3.53(d,j=10.2hz,1h),2.31-2.26(m,1h),2.19-2.12(m,1h),0.82(s,9h)。
[0688]
lc-ms:tr=2.496min(lcms方法5),m/z=400.0[m h]
。
[0689]
sfc:tr=2.461min(sfc方法14),de=97.1%,[α]
d20
=-11.2(c=1.0g/100ml,mecn)。
[0690]
实例22a:3-羟基-n-[(1r)-2-甲氧基-1-[3-(三氟-甲氧基)苯基]乙基]-4,4-二甲基-戊酰胺
[0691][0692]
和
[0693]
实例22b:3-羟基-n-[(1r)-2-甲氧基-1-[3-(三氟-甲氧基)苯基]乙基]-4,4-二甲基-戊酰胺
[0694][0695]
步骤1:3-羟基-n-[(1r)-2-甲氧基-1-[3-(三氟甲氧基)苯基]乙基]-4,4-二甲基-戊酰胺的制备
[0696][0697]
从vk制备。产量:84mg,(60%)。
[0698]
步骤2:(s)-3-羟基-n-((r)-2-甲氧基-1-(3-(三氟甲氧基)苯基)乙基)-4,4-二甲基戊酰胺和(r)-3-羟基-n-((r)-2-甲氧基-1-(3-(三氟甲氧基)苯基)乙基)-4,4-二甲基戊酰胺的分离
[0699][0700]
将3-羟基-n-[(1r)-2-甲氧基-1-[3-(三氟甲氧基)苯基]乙基]-4,4-二甲基-戊酰胺通过手性sfc进行分离。
[0701]
实例22a:产量:40mg
[0702]1h nmr(cdcl
3 400mhz):δ7.35(t,j=8.0hz,1h),7.27-7.26(m,1h),7.20(s,1h),7.12(d,j=7.6hz,1h),6.66(d,j=7.2hz,1h),5.18-5.14(m,1h),3.70-3.60(m,3h),3.36(s,3h),2.44(d,j=14.8hz,1h),2.25-2.33(m,1h),0.93(s,9h)。
[0703]
lc-ms:tr=2.410min(lcms方法3),m/z=364.0[m h]
。
[0704]
sfc:tr=1.889min(sfc方法16),de=100%,[α]
d20
=-0.4(c=1.0g/100ml,mecn)。
[0705]
实例22b:产量:38mg
[0706]1h nmr(cdcl
3 400mhz):δ7.36(t,j=8.0hz,1h),7.27-7.25(m,1h),7.18(s,1h),7.12(d,j=7.6hz,1h),6.56(d,j=7.2hz,1h),5.20-5.15(m,1h),3.69-3.60(m,3h),3.40(s,1h),3.36(s,3h),2.44(d,j=14.8hz,1h),2.25-2.33(m,1h),0.93(s,9h)。
[0707]
lc-ms:tr=2.523min(lcms方法1),m/z=364.0[m h]
。
[0708]
sfc:tr=2.106min(sfc方法16),de=98.2%,[α]
d20
=-2.7(c=1.0g/100ml,
mecn)。
[0709]
实例5:(s)-2-(3,3-二氟-1-羟基环丁基)-n-(1-(3-(三氟甲氧基)苯基)乙基)乙酰胺
[0710][0711]
步骤1:
[0712][0713]
在20℃,将(1s)-1-[3-(三氟甲氧基)苯基]乙烷胺盐酸盐(iia)(291mg,1.20mmol)、2-(3,3-二氟-1-羟基-环丁基)乙酸(iiib)(0.22g,1.32mmol)、hatu(549mg,1.44mmol)和dipea(467mg,3.6mmol)在dcm(15ml)中的混合物搅拌16小时。将该混合物用水(40ml
×
2)洗涤并用dcm(40ml)萃取。将有机层用盐水(10ml
×
2)洗涤,经na2so4干燥并浓缩。将残余物在硅胶上通过快速色谱法(洗脱液为0-35%乙酸乙酯/石油醚梯度)进行纯化,以给出产物(0.2g,47%产率)。
[0714]1h nmr(cdcl
3,
400mhz):δ7.41-7.37(m,1h),7.26-7.23(m,1h),7.18-7.13(m,2h),5.93(br d,j=6.8hz,1h),5.15(quin,j=7.2hz,1h),5.01(br s,1h),2.84-2.42(m,6h),1.53(d,j=6.8hz,3h)。
[0715]
lc-ms:tr=2.53min(lcms方法2),m/z=354.0[m h]
。
[0716]
hplc:tr=13.3min。(手性hplc方法1),de=100%。[α]
20d
=-51.1(c=0.23g/100ml,meoh)。
[0717]
通过与实例5类似的方法,使用相关的起始材料制备以下实例:
[0718]
实例6:(s)-2-(1-羟基环丁基)-n-(1-(3-(2,2,2-三氟乙氧基)苯基)乙基)乙酰胺
[0719][0720]
步骤1:(s)-2-(1-羟基环丁基)-n-(1-(3-(2,2,2-三氟乙氧基)苯基)乙基)乙酰胺的制备
[0721][0722]
从iib(5.0g,22.81mmol)和iiia(3.3g,25.09mmol)制备。
[0723]
产量:5.2g,(45%)。
[0724]1h nmr(cdcl
3,
400mhz):δ7.29(t,j=8.0hz,1h),6.99(d,j=7.6hz,1h),6.90(s,1h),6.83(dd,j=8.4hz,j=2.4hz,1h),6.25(d,j=6.8hz,1h),5.14-5.07(m,1h),4.35(q,j=8.0hz,2h),4.14(s,2h),2.53(s,2h),2.15-1.99(m,4h),1.76(m,1h),1.55(m,1h),1.48(d,j=6.8hz,3h)。
[0725]
lc-ms:tr=2.49min(lcms方法2),m/z=332.0[m h]
。
[0726]
sfc:tr=2.67min(sfc方法3),de=96.9%,[α]
d20
=-69.0(c=0.1,meoh)。
[0727]
实例7a:3-羟基-4-甲基-n-((s)-1-(3-(2,2,2-三氟-乙氧基)苯基)乙基)-3-(三氟甲基)戊酰胺
[0728][0729]
和
[0730]
实例7b:3-羟基-4-甲基-n-((s)-1-(3-(2,2,2-三氟-乙氧基)苯基)乙基)-3-(三氟甲基)戊酰胺
[0731][0732]
步骤1:3-羟基-4-甲基-n-((s)-1-(3-(2,2,2-三氟乙氧基)苯基)乙基)-3-(三氟甲基)戊酰胺的制备
[0733][0734]
从iib和iiic制备。产量:0.65g,(粗品)。将粗品不经纯化直接使用。
[0735]
步骤2:(3r)-3-羟基-4-甲基-n-[(1s)-1-[3-(2,2,2-三氟乙氧基)苯基]乙基]-3-(三氟甲基)戊酰胺和(3s)-3-羟基-4-甲基-n-[(1s)-1-[3-(2,2,2-三氟乙氧基)苯基]乙基]-3-(三氟甲基)戊酰胺的分离
[0736][0737]
通过快速硅胶色谱法(洗脱液为0-15%乙酸乙酯/石油醚梯度)进行分离。
[0738]
实例7a:产量:0.29g
[0739]1h nmr(cdcl3,400mhz):δ7.32(t,j=8.0hz,1h),7.00(d,j=7.6hz,1h),6.91(d,j=2.0hz,1h),6.85(dd,j=8.0,2.4hz,1h),6.32(s,1h),5.99(d,j=7.6hz,1h)。5.15-5.07(m,1h),4.36(q,j=8.0hz,2h),2.45(d,j=15.2hz,1h),2.34(d,j=15.2hz,1h),2.13-2.06(m,1h),1.50(d,j=6.8hz,3h),1.03(d,j=6.8hz,3h),0.97(d,j=6.8hz,3h)。
[0740]
lc-ms:tr=2.883min(lcms方法4),m/z=402.0[m h]
。
[0741]
sfc:tr=2.454min。(sfc方法6),de=100%,[α]
d20
=-43.5(c=0.0058g/ml,meoh)。
[0742]
实例7b:产量:0.23g
[0743]1h nmr(cdcl3,400mhz):δ7.32(t,j=8.0hz,1h),7.00(d,j=7.6hz,1h),6.91-6.84(m,2h),6.33(s,1h),5.90(d,j=7.6hz,1h),5.19-5.10(m,1h),4.35(q,j=8.4hz,2h),2.51(d,j=14.8hz,1h),2.35(d,j=14.8hz,1h),2.15-2.06(m,1h),1.52(d,j=7.2hz,3h),1.05(d,j=6.8hz,3h),0.98(d,j=6.8hz,3h)。
[0744]
lc-ms:tr=2.834min(lcms方法6),m/z=402.0[m h]
。
[0745]
sfc:tr=2.262min。(sfc方法7)de=99.8%,[α]
d20
=-37.1(c=0.0034g/ml,meoh)。
[0746]
实例9:4,4,4-三氟-3-羟基-n-[(1s)-1-[3-(三氟-甲氧基)苯基]乙基]-3-(三氟甲基)丁酰胺
[0747][0748]
步骤1:
[0749][0750]
从iia和4,4,4-三氟-3-羟基-3-(三氟甲基)丁酸制备。产量:650mg,(63%)
[0751]1h nmr(dmso-d
6 400mhz):δ9.14(d,j=7.2hz,1h),8.45(s,1h),7.44(t,j=8.0hz,1h),7.32(d,j=7.6hz,1h),7.24(s,1h),7.21(d,j=8.4hz,1h),5.01-4.93(m,1h),2.89(s,2h),1.34(d,j=6.8hz,3h)。
[0752]
lc-ms:tr=2.850min(lcms方法4),m/z=413.9[m h]
。
[0753]
手性hplc:tr=15.61min,(hplc方法2),de=98.4%,[α]
d20
=-41.1(c=0.185g/100ml,meoh)。
[0754]
实例10a:4,4,5,5-四氟-3-羟基-3-甲基-n-((s)-1-(3-(三氟甲氧基)苯基)乙基)戊酰胺
[0755][0756]
和
[0757]
实例10b:4,4,5,5-四氟-3-羟基-3-甲基-n-((s)-1-(3-(三氟甲氧基)苯基)乙基)戊酰胺
[0758][0759]
步骤1:4,4,5,5-四氟-3-羟基-3-甲基-n-((s)-1-(3-(三氟甲氧基)苯基)乙基)戊酰胺的制备
[0760][0761]
从iia和iiid制备。产量:1g(53%)
[0762]
步骤2:(r)-4,4,5,5-四氟-3-羟基-3-甲基-n-((s)-1-(3-(三氟甲氧基)苯基)乙基)戊酰胺和(s)-4,4,5,5-四氟-3-羟基-3-甲基-n-((s)-1-(3-(三氟甲氧基)苯基)乙基)戊酰胺的分离
[0763][0764]
将非对映异构体通过手性sfc进行分离。
[0765]
实例10a:产量=0.268g
[0766]1h nmr(cdcl
3 400mhz):δ7.42-7.36(m,1h),7.24(d,j=7.6hz,1h),7.17-7.12(m,2h),6.28-5.97(m,2h),5.93(br d,j=6.0hz,1h),5.16(quin,j=6.8hz,1h),2.69(d,j=15.2hz,1h),2.37(d,j=15.2hz,1h),1.53(d,j=6.8hz,3h),1.40(s,3h)。
[0767]
lc-ms:tr=2.759min(lcms方法2),m/z=392.0[m h]
。
[0768]
sfc:tr=1.550min。(sfc方法15),de=100%,[α]
d20
=-50.5(c=0.19g/100ml,meoh)。
[0769]
实例10b:产量=0.148g
[0770]1h nmr(cdcl
3 400mhz):δ7.44-7.36(m,1h),7.26(d,j=8.0hz,1h),7.19-7.12(m,2h),6.33-6.01(m,2h),5.91(br d,j=6.8hz,1h),5.16(quin,j=6.8hz,1h),2.70(d,j=15.2hz,1h),2.35(d,j=15.2hz,1h),1.52(d,j=6.8hz,3h),1.35(s,3h)。
[0771]
lc-ms:tr=2.782min(lcms方法2),m/z=392.0[m h]
。
[0772]
sfc:tr=1.329min。(sfc方法15),de=100%,[α]
d20
=-48.6(c=0.21g/100ml,meoh)。
[0773]
实例13a:5,5,5-三氟-3-羟基-3-甲基-n-((s)-1-(3-(三氟甲氧基苯基)乙基)戊酰胺
[0774][0775]
和
[0776]
实例13b:5,5,5-三氟-3-羟基-3-甲基-n-((s)-1-(3-(三氟甲氧基)苯基)乙基)戊酰胺
[0777][0778]
步骤1:5,5,5-三氟-3-羟基-3-甲基-n-((s)-1-(3-(三氟甲氧基)苯基)乙基)戊酰胺的制备
[0779][0780]
从iia和iiie制备。产量:1g,(43%)
[0781]
步骤2:(r)-5,5,5-三氟-3-羟基-3-甲基-n-((s)-1-(3-(三氟甲氧基)苯基)乙基)戊酰胺和(s)-5,5,5-三氟-3-羟基-3-甲基-n-((s)-1-(3-(三氟甲氧基)苯基)乙基)戊酰胺
的分离
[0782]
在硅胶上通过快速色谱法(洗脱液为0-31%乙酸乙酯/石油醚梯度)进行分离。
[0783]
实例13a:产量=0.421g
[0784]1h nmr(cdcl
3 400mhz):δ7.42-7.36(m,1h),7.24(d,j=8.0hz,1h),7.17-7.12(m,2h),5.98(br d,j=6.8hz,1h),5.15(quin,j=6.8hz,1h),5.00(s,1h),2.54-2.44(m,2h),2.44-2.31(m,2h),1.51(d,j=7.2hz,3h),1.38(s,3h)。
[0785]
lc-ms:tr=2.666min(lcms方法2),m/z=374.0[m h]
。
[0786]
sfc:tr=1.277min。(sfc方法8),de=100%,[α]
d20
=-51.3(c=0.23g/100ml,meoh)。
[0787]
实例13b:0.261g
[0788]1h nmr(cdcl
3 400mhz):δ7.42-7.36(m,1h),7.25(d,j=8.0hz,1h),7.17-7.12(m,2h),5.96(br d,j=7.2hz,1h),5.16(quin,j=6.8hz,1h),4.98(s,1h),2.57-2.36(m,4h),1.52(d,j=6.8hz,3h),1.36(s,3h)。
[0789]
lc-ms:tr=2.674min(lcms方法2),m/z=374.0[m h]
。
[0790]
sfc:tr=1.197min。(sfc方法8),de=93.4%,[α]
d20
=-43.2(c=0.19g/100ml,meoh)。
[0791]
实例15a:3-(1-氟环丙基)-3-羟基-n-((s)-1-(3-(三氟甲氧基)苯基)乙基)丁酰胺
[0792][0793]
和
[0794]
实例15b:3-(1-氟环丙基)-3-羟基-n-((s)-1-(3-(三氟甲氧基)苯基)乙基)丁酰胺
[0795][0796]
步骤1:3-(1-氟环丙基)-3-羟基-n-((s)-1-(3-(三氟甲氧基)苯基)乙基)丁酰胺的制备
[0797][0798]
从iia和iiif制备。将粗品直接用于下一步骤
[0799]
步骤2:(r)-3-(1-氟环丙基)-3-羟基-n-((s)-1-(3-(三氟甲氧基)苯基)乙基)丁酰胺和(s)-3-(1-氟环丙基)-3-羟基-n-((s)-1-(3-(三氟-甲氧基)苯基)乙基)丁酰胺的分离
[0800]
在硅胶上通过快速色谱法(洗脱液为0-30%乙酸乙酯/石油醚梯度)进行分离。
[0801]
实例15a:产量=1.05g
[0802]1h nmr(cdcl
3 400mhz):δ7.37(t,j=8.0hz,1h),7.27-7.24(m,1h),7.17-7.12(m,2h),6.11(br s,1h),5.18-5.10(m,1h),5.02(s,1h),2.61(dd,j=14.4,2.4hz,1h),2.46(dd,j=14.4,1.6hz,1h),1.51(d,j=7.2hz,3h),1.33(s,3h),0.78-0.68(m,3h),0.52-0.50(m,1h)。
[0803]
lc-ms:tr=2.359min(lcms方法3),m/z=350.0[m h]
。
[0804]
sfc:tr=2.027min。(sfc方法9),de=93.9%,[α]
d20
=-48.3(c=0.24g/100ml,meoh)。
[0805]
实例15b:产量:0.80g
[0806]1h nmr(cdcl
3 400mhz):δ7.38(t,j=8.0hz,1h),7.27-7.23(m,1h),7.15-7.12(m,2h),6.06(d,j=7.2hz,1h),5.19-5.11(m,1h),4.99(s,1h),2.62(dd,j=14.4,2.0hz,1h),2.47(d,j=1.6hz,1h),2.43(d,j=1.6hz,1h),1.51(d,j=7.2hz,3h),1.33(s,3h),0.97-0.87(m,1h),0.85-0.81(m,3h)。
[0807]
lc-ms:tr=2.655min(lcms方法2),m/z=350.0[m h]
。
[0808]
sfc:tr=1.937min。(sfc方法9),de=98.7%,[α]
d20
=-64.4(c=0.27g/100ml,meoh)。
[0809]
实例17:(r)-2-(1-羟基环戊基)-n-(2-甲氧基-1-(3-(三氟甲氧基)苯基)乙基)乙酰胺
[0810][0811]
从iia和2-(1-羟基环戊基)乙酸制备。产量:30mg,(12.8%)。
[0812]1h nmr(400mhz,cdcl3)δ7.37(t,j=8.0hz,1h),7.26-7.25(m,1h),7.19(s,1h),7.16-7.11(m,1h),6.66(br d,j=7.2hz,1h),5.21-5.15(m,1h),3.82(s,1h),3.70-3.60(m,2h),3.37(s,3h),2.59-2.49(m,2h),1.86-1.81(m,4h),1.59-1.56(m,4h)。
[0813]
lc-ms:tr=2.481min(lcms方法2),m/z=362.0[m h]
,
[0814]
sfc:tr=2.33min。(sfc方法10),de=100%,[α]
d20
=-44.0,(c=1mg/ml,meoh)。
[0815]
实例18a:3-环丙基-3-羟基-n-((s)-1-(3-(2,2,2-三氟乙氧基)苯基)乙基)丁酰胺
[0816][0817]
和
[0818]
实例18b:3-环丙基-3-羟基-n-((s)-1-(3-(2,2,2-三氟乙氧基)苯基)乙基)丁酰胺
[0819][0820]
步骤1:3-环丙基-3-羟基-n-((s)-1-(3-(2,2,2-三氟乙氧基)苯基)乙基)丁酰胺的制备
[0821][0822]
从iib和iiig制备。产量:3.7g,(30.9%)
[0823]
步骤2:(r)-3-环丙基-3-羟基-n-((s)-1-(3-(2,2,2-三氟乙氧基)苯基)乙基)丁酰胺和(s)-3-环丙基-3-羟基-n-((s)-1-(3-(2,2,2-三氟乙氧基)苯基)乙基)丁酰胺的分离
[0824][0825]
通过手性sfc进行分离。
[0826]
实例18a:产量:1.59g
[0827]1h nmr(400mhz,dmso-d6)δ8.32(d,j=8.0hz,1h),7.28(t,j=8.0hz,1h),7.04-6.98(m,2h),6.93-6.90(m,1h),4.97-4.91(m,1h),4.73(q,j=8.8hz,2h),4.61(s,1h),2.37-2.25(m,2h),1.34(d,j=7.2hz,3h),1.10(s,3h),0.87-0.84(m,1h),0.30-0.09(m,4h)。
[0828]
lc-ms:tr=2.629min(lcms方法2),m/z=328.0[m h-18]
。
[0829]
sfc:tr=3.154min(sfc方法11),de=99.7%,[α]
d20
=-62.0(c=2mg/ml,meoh)。
[0830]
实例18b:产量:1.44g
[0831]1h nmr(400mhz,dmso-d6)δ8.19(br d,j=8.0hz,1h),7.12(t,j=8.0hz,1h),6.87-6.79(m,2h),6.77-6.74(m,1h),4.81-4.73(m,1h),4.57(q,j=8.8hz,2h),4.42(s,1h),2.19-2.08(m,2h),1.17(d,j=6.8hz,3h),0.94(s,3h),0.73-0.64(m,1h),0.19-0.00(m,4h)。
[0832]
lc-ms:tr=2.643min(lcms方法2),m/z=328.0[m h-18]
。
[0833]
sfc:tr=2.570min.(sfc方法11),de=97.0%,[α]
d20
=-58.0(c=2mg/ml,meoh)。
[0834]
实例19a:4,4,4-三氟-3-羟基-3-甲基-n-((s)-1-(3-(2,2,2-三氟乙氧基)苯基)乙基)丁酰胺
[0835][0836]
和
[0837]
实例19b:4,4,4-三氟-3-羟基-3-甲基-n-((s)-1-(3-(2,2,2-三氟乙氧基)苯基)乙基)丁酰胺
[0838][0839]
步骤1:4,4,4-三氟-3-羟基-3-甲基-n-((s)-1-(3-(2,2,2-三氟乙氧基)苯基)乙基)丁酰胺的制备
[0840][0841]
从iib和4,4,4-三氟-3-羟基-3-甲基-丁酸制备。产量:6.67g,(73%)
[0842]
步骤2:(r)-4,4,4-三氟-3-羟基-3-甲基-n-((s)-1-(3-(2,2,2-三氟乙氧基))乙基)丁酰胺和(s)-4,4,4-三氟-3-羟基-3-甲基-n-((s)-1-(3-(2,2,2-三氟乙氧基)苯基)乙基)丁酰胺的分离
[0843][0844]
实例19a:2.3g
[0845]1h nmr(cdcl3,400mhz)δ7.32(t,j=8.0hz,1h),6.99(d,j=7.8hz,1h),6.92-6.88(m,1h),6.88-6.83(m,1h),5.99(br d,j=6.8hz,1h),5.84(s,1h),5.12(quin,j=7.2hz,1h),4.35(q,j=8.0hz,2h),2.51(dd,j=53.2,15.2hz,2h),1.51(d,j=7.2hz,3h),1.41(s,3h);lc-ms:tr=2.732min(lcms方法2),m/z=374.0[m h]
。
[0846]
sfc:tr=1.721min(sfc方法12),de=99.6%,[α]
d20
=-51.0(c=0.20,meoh)。
[0847]
实例19b:0.86g
[0848]1h nmr(cdcl3,400mhz)δ7.33(t,j=8.0hz,1h),7.00(d,j=7.2hz,1h),6.93-6.90(m,1h),6.88-6.83(m,1h),5.98-5.91(m,1h),5.91(s,1h),5.12(quin,j=7.2hz,1h),4.36(q,j=8.0hz,2h),2.50(dd,j=57.6,14.8hz,2h),1.51(d,j=6.8hz,3h),1.39(s,3h);
[0849]
lc-ms:tr=2.737min(lcms方法2),m/z=374.0[m h]
。
[0850]
sfc:tr=1.904min(sfc方法12),de=100%,[α]
d20
=-57.1(c=0.21,meoh)。
[0851]
实例:kv7中的癫痫
[0852]
已经描述了kv7通道的基因功能缺失突变在kcnq癫痫性脑病(kcnqee)和良性家族性新生儿惊厥(bfnc)中导致癫痫发作和惊厥(schroeder bc等人nature.[自然]1998年12月17日;396(6712):687-90;kato m等人epilepsya.[癫痫]2013年7月;54(7):1282-7)。
[0853]
瑞替加滨已经被批准用于治疗部分性癫痫发作,并且也有报道称瑞替加滨影响癫痫综合征(如伦诺克斯-加斯托综合征和德拉韦综合征)的癫痫发作。瑞替加滨影响几种药理学靶标,并且已描述可作为kv7激活剂。已经描述了kv7激活阈值和临床有效暴露之间的联系(gunthorpe mj等人,epilepsya.[癫痫]2012年3月;53(3):412-24)。
[0854]
kv7激活剂在针对部分性和全身性癫痫发作的各种啮齿类动物癫痫发作模型中显示出抗惊厥特性(roeloffs r等人j pharmacol exp ther.[药理学与实验治疗学杂志]
2008年9月;326(3):818-28)。这还包括针对特定癫痫综合征(例如德拉韦综合征)的动物模型(reid ca等人brain.[大脑]2014年6月;137(pt 6):1701-15.doi:10.1093/brain/awu077.epub 2014年4月17日)和kcnq癫痫性脑病(kcnqee)(ihara y等人plos one.[公共科学图书馆期刊]2016年2月24日;11(2)。
[0855]
通过使用最大电击癫痫发作阈值测试(mest)(giardina和gasior,curr protocols in pharm[药理学实验室指南],5.22.1-5.22.37,2009年6月)来测试(s)-2-(3,3-二氟-1-羟基环丁基)-n-(1-(3-(三氟甲氧基)苯基)乙基)乙酰胺在小鼠和大鼠中的抗惊厥特性,其中将角膜电极用于引起强直性惊厥。在小鼠中,在诱发电惊厥(即癫痫发作阈值)所需电流上产生剂量依赖性显著增加。在大鼠中,用(s)-2-(3,3-二氟-1-羟基环丁基)-n-(1-(3-(三氟甲氧基)苯基)乙基)乙酰胺单独急性施用和重复施用(每日一次,15天)进行预处理的影响均使癫痫发作阈值显著升高。
[0856]
从n=12-16的治疗组中产生的数据用于计算cc50 s.e.m.值,根据以下方法:kimball等人radiat res.[辐射研究]1957;7(1):1-12。
[0857]
根据以下评估药物治疗的动物与对照物之间的显著差异:litchfield和wilcoxon,pharmacol exp ther.[药理学和实验治疗学杂志]1949;96(1):99-113。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。