用于染色体重排的组合物和方法
1.相关申请的引用
2.本技术要求于2019年8月5日提交的美国临时申请号62/882,854的权益,其通过引用以其整体并入本文。
技术领域
3.本发明涉及农业生物技术领域,更具体地涉及用于评价植物细胞中染色体重排的构建体和方法。
4.序列表的合并
5.在2020年8月4日创建的名为“mons449wo_st25.txt”的36.7千字节(在ms-中测量)的文件中包含的序列表包含48个核酸序列,与本技术一起以电子方式提交,并且其通过引用以其整体并入。
背景技术:
6.所需基因座处的重组具有允许将包含有价值遗传基因座的dna转移到商业种系中的潜力,这对于作物改良可能具有巨大价值。尽管存在使用顺式或反式染色体重排修饰植物基因组的方法,但这些先前已知的方法主要依赖于遗传选择以鉴定对植物基因组的修饰。因此,由于生产和鉴定包含所需基因组修饰的植物所需的大量努力,现有方法效率低且昂贵。因此,需要用于评价顺式或反式染色体重排的效率和鉴定有利的基因组修饰的改进方法。
7.发明概述
8.第一方面,提供了重组dna分子对,其包含:a)第一dna分子,其包含位于第一内含子侧翼的第一报告基因编码序列的n端部分和第二报告基因编码序列的c端部分,其中所述第一内含子包含可被第一重组酶或内切核酸酶识别的第一靶位点;和b)第二dna分子,其包含位于第二内含子侧翼的所述第二报告基因编码序列的n端部分和所述第一报告基因编码序列的c端部分,其中所述第二内含子包含可被第二重组酶或内切核酸酶识别的第二靶位点。在所述靶位点处所述第一和第二dna分子之间重组后,所述第一报告基因编码序列的n端和c端部分形成能够表达所述第一报告基因编码序列的表达盒,并且所述第二报告基因编码序列的n端和c端部分形成能够表达所述第二报告基因编码序列的表达盒。所述第一或所述第二报告基因编码序列可以编码荧光标志物、酶标志物或除草剂耐受性选择标志物,例如绿色荧光蛋白(gfp)、β-葡糖醛酸糖苷酶(gus)或cp4。所述重组酶可以选自下组:cre重组酶、flp重组酶和tale重组酶(taler)。例如,所述重组酶可以是cre重组酶,并且所述靶位点可以是lox位点。所述内切核酸酶可以选自下组:大范围核酸酶、锌指核酸酶、talen和crispr相关(cas)内切核酸酶。例如,所述内切核酸酶可以是cas9或cpf1内切核酸酶。所述第一dna分子还可包含编码cas蛋白的序列,并且所述第二dna分子还可包含编码向导rna的序列。或者,所述第一dna分子还可包含编码向导rna的序列,并且所述第二dna分子还可包含编码cas蛋白的序列。编码重组酶或内切核酸酶的所述序列的表达可以由组成型启动子、
组织特异性启动子或减数分裂启动子驱动。例如,所述启动子可选自下组:at ease启动子、at dmc1启动子、遍在启动子1、水稻肌动蛋白启动子或大豆burp09启动子。
9.另一方面,提供了包含本文所述的重组dna分子对的植物细胞。还提供了包含本文所述的重组dna分子对的转基因植物、植物种子或植物部分。
10.另一方面,提供了用于检测顺式或反式染色体重排系统中的重组的方法,其包括:a)获得用第一dna分子转化的转基因植物,所述第一dna分子包含位于第一内含子侧翼的第一报告基因编码序列的n端部分和第二报告基因编码序列的c端部分;b)获得用第二dna分子转化的转基因植物,所述第二dna分子包含位于第二内含子侧翼的所述第二报告基因编码序列的n端部分和所述第一报告基因编码序列的c端部分;c)将所述第一转基因植物与所述第二转基因植物杂交以产生包含所述第一dna分子和所述第二dna分子的后代植物;d)向包含所述第一dna分子和所述第二dna分子的所述后代植物或其后代的至少第一细胞提供识别所述第一内含子中的靶位点或所述第二内含子中的靶位点的重组酶或内切核酸酶;和e)基于所述第一和第二报告基因编码序列的表达检测在所述靶位点处的所述第一和第二dna分子之间的重组。在一些实施方案中,所述第一dna分子还包含编码cas蛋白的序列,并且所述第二dna分子还包含编码向导rna的序列。或者,所述第一dna分子还包含编码向导rna的序列,并且所述第二dna分子还包含编码cas蛋白的序列。所述第一或所述第二报告基因编码序列可以编码荧光标志物、酶标志物或除草剂耐受性选择标志物。所述第一或所述第二报告基因编码序列可以编码gfp、gus或cp4。所述重组酶可以选自下组:cre重组酶,flp重组酶和tale重组酶(taler)。所述内切核酸酶选自下组:crispr相关(cas)内切核酸酶或cfp1内切核酸酶。
11.另一方面,提供了用于检测顺式或反式染色体重排系统中的重组的方法,其包括:a)获得转基因植物,其包含:i)第一dna分子,其包含位于第一内含子侧翼的第一报告基因编码序列的n端部分和第二报告基因编码序列的c端部分,其中所述第一内含子包含可被第一重组酶或内切核酸酶识别的第一靶位点;和ii)第二dna分子,其包含位于第二内含子侧翼的所述第二报告基因编码序列的n端部分和所述第一报告基因编码序列的c端部分,其中所述第二内含子包含可被第二重组酶或内切核酸酶识别的第二靶位点;并且其中所述第一dna分子或所述第二dna分子进一步包含编码所述第一或所述第二重组酶或内切核酸酶的序列;b)基于所述第一和第二报告基因编码序列的表达检测在所述靶位点处的所述第一和第二dna分子之间的重组。所述第一或所述第二报告基因编码序列可以编码荧光标志物、酶标志物或除草剂耐受性选择标志物。所述第一或所述第二报告基因编码序列可以编码gfp、gus或cp4。所述重组酶可以选自下组:cre重组酶,flp重组酶和taler。所述内切核酸酶选自下组:cas内切核酸酶或cfp1内切核酸酶。
12.附图简要说明
13.图1显示用于测试细胞中重组效率的构建体的示意图。该构建体包含camv启动子、gfp编码序列的n端部分、包含至少一个loxp位点的内含子、crispr相关蛋白的靶位点和cp4编码序列的c端部分。
14.图2显示与图1所示的构建体组合使用的构建体的示意图。第二构建体包含遍在启动子1、cp4编码序列的n端部分、包含至少一个loxp位点的内含子、grna靶位点和gfp编码序列的c端部分。
15.图3显示设计用于检测和优化本文所述的顺式或反式染色体重排系统中的重组的一组构建体(载体a和载体b)的示意图。载体a包含camv启动子、gfp编码序列的n端部分、包含被基因组编辑试剂(如重组酶或内切核酸酶)识别的靶位点的内含子和cp4编码序列的c端部分。载体b包含遍在启动子1、cp4编码序列的n端部分、包含被基因组编辑试剂(如重组酶或内切核酸酶)识别的靶位点的内含子、grna靶位点和gfp编码序列的c端部分。可以使用标准植物转化方法将这些构建体之一或两者转化到植物中。
16.图4显示根据所公开的方法并由编辑试剂(cre或cas9)的表达诱导的质粒重组的示意图。
17.图5显示使用所公开的系统以玉米原生质体中gfp表达细胞的百分比测量的重组效率。
18.图6显示用于测定大豆子叶原生质体中重组效率的cre分裂报告基因系统的构建体的示意图。载体a包含由内含子连接的分裂报告基因,所述内含子包含lox和grna靶序列,具有或不具有由单独的启动子驱动的另外的cre编码序列。载体b包含载体a中的内含子、lox和grna靶序列。载体c是阳性对照。
19.图7显示当将图7的载体a、b和c导入细胞时重组的预期产物。
20.图8显示使用图7所示构建体以大豆原生质体中gfp表达细胞的百分比测量的重组效率。
21.图9显示用于测定大豆子叶原生质体中重组效率的cpf1分裂报告基因系统的构建体的示意图。载体a包含由内含子连接的分裂报告基因,所述内含子包含lox和grna靶序列,具有或不具有由单独的启动子驱动的另外的cpf1编码序列。载体b包含载体a中的内含子、lox和grna靶序列。载体c是阳性对照。
22.图10显示使用图10中所示构建体以大豆原生质体中gfp表达细胞的百分比测量的重组效率。
23.图11显示从玉米植物收获的r1纯合种子中染色体重排的示意图,所述种子包含所公开的分裂报告基因系统。
24.发明详述
25.在特定基因座处的重组对于将含有有价值的遗传物质的dna转移到受体植物系中是极其有用的。但是,以前使用昂贵且劳动密集型的遗传选择方法进行顺式或反式染色体重排的检测。本公开提供了用于评价顺式或反式染色体重排的效率和鉴定有利的基因组修饰的改进方法。
26.之前用于评价染色体重排的系统的缺点在于它们集中在使用单一基因组编辑试剂,并且不能同时评价和比较多种基因组编辑试剂。基因组编辑的评估通常也是针对小分子变化的检测,并且还没有开发出用于评估染色体修饰(如染色体的顺式和反式位置)的有效系统。
27.为了解决这些限制,本公开提供用于鉴定细胞中的基因组编辑的有效且成本效率的系统。在某些实施方案中,本文公开的系统提供了第一dna分子,所述第一dna分子包含通过第一内含子与第二分裂报告基因编码序列的c端部分连接的第一分裂报告基因编码序列的n端部分。在一个实施方案中,内含子包含至少一个被基因组编辑试剂识别的靶位点,如loxp位点或grna靶位点。第二dna分子包含通过第二内含子与第一分裂报告基因编码序列
的c端部分连接的第二分裂报告基因编码序列的n端部分,并且第二内含子还包含至少一个被基因组编辑试剂识别的靶位点,如loxp位点或grna靶位点。重组导致第一报告基因编码序列的n端和c端部分通过第一内含子可操作地连接,并且第二报告基因编码序列的n端和c端部分通过第二内含子可操作地连接。转录和加工所得序列以除去内含子,并且表达一个或两个报告基因编码序列以使其可被检测。
28.所公开的系统在本领域中表现出显著的优势,因为它们允许使用荧光、酶或除草剂耐受性标志物对基因组编辑进行快速且非破坏性的评估。如果交换以顺式或反式发生,则标志物被表达并且编辑可以被测量。在公开的系统中使用除草剂耐受性标记物进一步允许快速选择编辑的基因组。
29.本文所述的系统还允许确定染色体以顺式和反式重排的频率,以及同时评价多种基因组编辑试剂。还可以测试由各种启动子驱动的基因组编辑试剂的效率。使用所公开的系统,可以比较在各种调控元件的控制下由基因组编辑试剂产生的基因组编辑的频率和传递率,以优化植物细胞中的基因编辑。
30.i.用于检测和优化染色体重排的构建体
31.为了允许有效检测染色体重排,本文提供了包含第一和第二分裂报告基因编码序列的方法和构建体。如本文所用,术语“分裂的报告基因”或“分裂的报告基因编码序列”是指报告基因编码序列的n端部分不与报告基因编码序列的c端部分可操作地连接的报告基因。重组事件可操作地将分裂报告基因的n端部分连接到分裂报告基因的c端部分,产生能够表达报告基因的序列。
32.在若干实施方案中,提供了重组dna分子对。第一dna分子可包含位于第一内含子侧翼的第一报告基因编码序列的n端部分和第二报告基因编码序列的c端部分,其中所述第一内含子包含可被第一重组酶或内切核酸酶识别的第一靶位点。第二dna分子可包含位于第二内含子侧翼的所述第二报告基因编码序列的n端部分和所述第一报告基因编码序列的c端部分,其中所述第二内含子包含可被第二重组酶或内切核酸酶识别的第二靶位点。当第一和第二dna分子位于特定的染色体位置时,这些基因座之间发生重组,第一和第二报告基因编码序列的n端和c端部分可操作地连接以形成能够表达第一和第二报告基因编码序列的表达盒。因此,报告基因编码序列的表达可用于确定dna分子所位于的染色体位置之间的重组效率。因此,目前提供的构建体和方法允许快速和非破坏性评估基因组编辑、确定染色体在不同位置或染色体之间的顺式和反式重排的频率,以及测试由各种启动子驱动的基因组编辑机制的效率的方法。
33.报告基因编码序列
34.可用于本发明的报告基因编码序列包括任何可检测的报告基因分子,包括荧光标志物(如绿色荧光蛋白)、酶颜色标志物或除草剂耐受性选择标志物。这些包括编码任何类型的可检测标志物(如荧光标志物、酶标志物或选择性标志物)的序列。也可以使用通常使用的选择性标记基因,其包括提供视觉筛选转化子的能力的标志物,例如,表达有色或荧光蛋白(如荧光素酶或绿色荧光蛋白(gfp))的基因,或表达β-葡糖醛酸糖苷酶的基因或uida基因(gus),对于这些基因已知多种生色底物。赋予对抗生素(如卡那霉素和巴龙霉素(nptii)、潮霉素b(aph iv)、壮观霉素(aada)和庆大霉素(aac3和aacc4))的抗性或对除草剂(如草铵膦(bar或pat)、麦草畏(dmo)和草甘膦(aroa或epsps))的抗性的标志物也可用于
所公开的系统中。在美国专利号us 5,550,318;us 5,633,435;us 5,780,708和us 6,118,047中阐明了此类选择性标志物的实例。
35.分裂报告基因编码序列可以在编码序列内的任何点分裂,只要由重构的n端和c端产生的表达在显著高于单独的n端或c端的水平是可检测的。例如,分裂报告基因序列的n端可包含全长报告基因编码序列的至少约10%、至少约15%、至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约55%、至少约60%、至少约65%、至少约70%、至少约75%、至少约80%、至少约85%或至少约90%。如本文所述,分裂报告基因序列的n端可以在第一特定染色体位置掺入到第一dna分子中,而分裂报告基因序列的c端可以在第二特定染色体位置掺入到第二dna分子中,使得重构的报告基因编码序列的检测指示这两个染色体位置之间的重组。
36.内含子
37.在若干实施方案中,本文提供的dna构建体包含第一dna分子,所述第一dna分子包含通过第一内含子与第二分裂报告基因编码序列的c端部分连接的第一分裂报告基因编码序列的n端部分。内含子包含至少一个被重组酶或内切核酸酶识别的靶位点,如loxp位点或grna靶位点。第二dna分子包含通过第二内含子与第一分裂报告基因编码序列的c端部分连接的第二分裂报告基因编码序列的n端部分。重组导致第一报告基因编码序列的n端和c端部分通过第一内含子可操作地连接,并且第二报告基因编码序列的n端和c端部分通过第二内含子可操作地连接。转录和加工所得序列以除去内含子,重构全长报告基因序列,从而可以检测报告基因的表达。
38.基因组编辑试剂和靶位点
39.本文所述的dna构建体包含内含子序列,所述内含子序列包含用于基因组编辑试剂的一个或多个靶位点。如本文所用,用于基因组编辑试剂的“靶位点”是指被基因组编辑试剂(如内切核酸酶或重组酶)结合和/或切割的多核苷酸序列。靶位点可包含由基因组编辑试剂识别的序列的至少10个、至少11个、至少12个、至少13个、至少14个、至少15个、至少16个、至少17个、至少18个、至少19个、至少20个、至少21个、至少22个、至少23个、至少24个、至少25个、至少26个、至少27个、至少29个或至少30个连续核苷酸。rna引导的核酸酶的靶位点可包含双链核酸(dna)分子的互补链或在靶位点处的染色体的序列。
40.基因组编辑试剂可以例如经由非编码向导核酸(例如crispr rna(crrna)或单向导rna(sgrna))结合靶位点。向导核酸的靶向序列可以与靶位点互补(例如,与双链核酸分子的任一条链或靶位点处的染色体互补)。应当理解,向导核酸的靶向序列与靶位点结合或杂交可能不需要完全的同一性或互补性。例如,在靶位点和向导核酸的靶向序列之间可以允许至少1、至少2、至少3、至少4、至少5、至少6、至少7或至少8个错配(或更多)。“靶位点”还指多核苷酸序列的位置,所述多核苷酸序列被任何其它基因组编辑试剂结合和切割,所述基因组编辑试剂可能不受向导核酸分子(如大范围核酸酶、锌指核酸酶(zfn)、转录激活物样效应物核酸酶(talen)等)的引导,以将双链断裂、单链切口或其它修饰引入多核苷酸序列和/或其互补dna链中。在一些实施方案中,“靶位点”是指重组酶的识别位点,例如lox或frt位点。
41.本文所述的靶位点可被任何基因组编辑试剂识别,包括重组酶和核酸内切酶,如锌指核酸酶,工程化的或天然的大范围核酸酶,tale-核酸内切酶,以及rna引导的核酸内切
酶,包括cas9、cpf1、casx、casy、以及crispr系统中使用的其他核酸内切酶。
42.在若干实施方案中,dna构建体包含由crispr相关核酸酶识别的靶位点(crispr相关核酸酶的非限制性实例包括cas1、cas1b、cas2、cas3、cas4、cas5、cas6、cas7、cas8、cas9(也称为csn1和csx12)、cas10、cpf1(也称为cas12a)、csy1、csy2、csy3、cse1、cse2、csc1、csc2、csa5、csn2、csm2、csm3、csm4、csm5、csm6、cmr1、cmr3、cmr4、cmr5、cmr6、csb1、csb2、csb3、csx17、csx14、csx10、csx16、csax、csx3、csx1、csx15、csf1、csf2、csf3、csf4、casx、casy、casz、mad7、其同系物或其修饰形式。
43.在一些实施方案中,dna构建体包含被重组酶(如cre重组酶、gin重组酶、flp重组酶和tnp1重组酶)识别的靶位点。如果重组酶是cre重组酶,则靶位点可以是lox位点,如loxp、lox 2272、loxn、lox 511、lox 5171、lox71、lox66、m2、m3、m7或m11位点。
44.调控元件
45.构建体还可以包括在表达构建体的宿主细胞中有功能的调控元件。本领域普通技术人员可以选择用于细菌宿主细胞、酵母宿主细胞、植物宿主细胞、昆虫宿主细胞、哺乳动物宿主细胞和人宿主细胞的调控元件。调控元件包括启动子、转录终止序列、翻译终止序列、增强子和聚腺苷酸化元件。如本文所用,术语“构建体”或“表达构建体”是指提供可操作连接的核酸序列的转录的核酸序列的组合。如本文所用,“可操作地连接”是指以一种可以影响另一种的功能的方式连接的两个dna分子。可操作地连接的dna分子可以是单个连续分子的一部分并且可以相邻或可以不相邻。例如,启动子与dna构建体中编码多肽的dna分子可操作地连接,其中两个dna分子如此排列,使得启动子可以影响dna分子的表达。
46.如本文所用,术语“异源的”是指源自不同来源的两个或更多个项目之间的关系,因此在自然界中通常不相关。例如,编码蛋白质的重组dna分子相对于可操作连接的启动子是异源的,如果这种组合在自然界中通常不存在。另外,当特定的重组dna分子在该特定的细胞、种子或生物体中不天然存在时,其对于其所插入的细胞、种子或生物体可以是异源的。
47.ii.用于检测和优化染色体重排的方法
48.若干实施方案涉及包含如本文所述的构建体的植物细胞、植物组织、植物和种子。可以通过本领域已知的任何方法用公开的dna构建体转化植物细胞、植物部分和种子。用于转化宿主植物细胞的合适方法是本领域熟知的,并且实际上包括可以将dna或rna引入细胞中的任何方法(例如,其中将重组dna构建体稳定地整合到植物染色体中或其中将重组dna构建体或rna瞬时提供给植物细胞)。两种有效的细胞转化方法是农杆菌介导的转化和微粒轰击介导的转化。例如,在美国专利号us 5,550,318;us 5,538,880;us 6,160,208;和us 6,399,861中阐明了微粒轰击方法。农杆菌介导的转化方法描述于例如美国专利号us 5,591,616中,其通过引用整体并入本文。植物材料的转化在营养培养基(例如允许细胞体外生长的营养物混合物)上的组织培养中进行。受体细胞靶包括但不限于分生组织细胞、芽尖、下胚轴、愈伤组织、未成熟或成熟胚和配子细胞(如小孢子和花粉)。愈伤组织可以来自组织来源,所述组织来源包括但不限于未成熟或成熟胚、下胚轴、幼苗顶端分生组织、小孢子等。含有转基因核的细胞生长成转基因植物。再生的植物然后可用于繁殖另外的植物。
49.在转化中,在任何一个转化实验中,通常仅将dna引入小百分比的靶植物细胞中。标志物基因用于提供鉴定那些通过接受重组dna分子并将其整合到其基因组中而稳定转化
的细胞的有效系统。优选的标志物基因提供选择性标志物,其赋予对选择性试剂(如抗生素或除草剂)的抗性。本公开的植物可对其具有抗性的任何除草剂是选择性标志物的试剂。将可能转化的细胞暴露于选择性试剂。在存活细胞群中,通常是这样的细胞,其中抗性赋予基因被整合并以足够的水平表达以允许细胞存活。可以进一步测试细胞以证实外源dna的稳定整合。此外,引入植物细胞基因组的遗传物质的位置可通过靶向测序确定。
50.分离构建体上的重组酶或核酸内切酶
51.在若干实施方案中,将如本文所述的包含第一分裂报告基因和第二分裂报告基因的构建体转化到植物细胞中,并从所述细胞再生植物。例如通过靶向测序确定基因组中的转基因位置。鉴定在第一特定染色体位置处包含第一分裂报告基因构建体和在第二特定位置处包含第二分裂报告基因构建体的事件。将包含第一分裂报告基因构建体的植物与包含第二分裂报告基因构建体的植物杂交以产生包含两种构建体的f1植物。将这些f1植物用编码基因组编辑试剂的另外的构建体转化,所述基因组编辑试剂是例如重组酶或内切核酸酶,例如cas9、cpf1或cre蛋白,其对应于第一和/或第二分裂报告基因构建体中的靶位点。通过检测报告基因序列的表达来评价分裂报告基因构建体所位于的特定染色体位置处的重组。
52.分裂报告基因构建体上的重组酶或核酸内切酶
53.在进一步的实施方案中,第一和/或第二分裂报告基因构建体进一步包含在启动子控制下的编码基因组编辑试剂的序列,所述基因组编辑试剂如重组酶或内切核酸酶,例如cas9、cpf1或cre蛋白。将第一和第二分裂报告基因构建体转化到植物细胞中,并从该细胞再生植物。例如通过靶向测序确定转基因在植物基因组中的位置。鉴定在第一特定染色体位置处包含第一分裂报告基因构建体和在第二特定位置处包含第二分裂报告基因构建体的事件。将包含第一分裂报告基因构建体的植物与包含第二分裂报告基因构建体的植物杂交以产生包含两种构建体的f1植物。通过检测报告基因序列的表达来评价分裂报告基因构建体所位于的特定染色体位置处的重组。
54.分裂报告基因构建体上的向导rna
55.在更进一步的实施方案中,第一分裂报告基因构建体进一步包含在启动子控制下的编码基因组编辑试剂的序列,所述基因组编辑试剂如rna引导的核酸酶,例如cas9或cpf1蛋白。第二分裂报告基因构建体还包含编码向导rna(grna)的序列,所述向导rna针对第一分裂报告基因序列的内含子内的靶序列。将第一和第二分裂报告基因构建体转化到植物细胞中,并从该细胞再生植物。例如通过靶向测序确定转基因在植物基因组中的位置。鉴定在第一特定染色体位置处包含第一分裂报告基因构建体和在第二特定位置处包含第二分裂报告基因构建体的事件。将包含第一分裂报告基因构建体的植物与包含第二分裂报告基因构建体的植物杂交以产生包含两种构建体的f1植物。通过检测报告基因序列的表达来评价分裂报告基因构建体所位于的特定染色体位置处的重组。
56.若干实施方案涉及通过本文公开的方法产生的植物细胞、植物组织、植物种子和植物。植物可以是单子叶植物或双子叶植物,并且可以包括例如水稻、小麦、大麦、燕麦、黑麦、高粱、玉米、葡萄、番茄、马铃薯、莴苣、西兰花、黄瓜、花生、甜瓜、韭葱、洋葱、大豆、苜蓿、向日葵、棉花、油菜和甜菜植物。
57.定义
58.除非本文另有定义,否则术语应根据相关领域的普通技术人员的常规用法来理解。描述与本文所用的分子生物学相关的许多术语的资源的实例可以发现于alberts et al.,molecular biology of the cell,5th edition,garland science publishing,inc.:new york,2007;rieger et al.,glossary of genetics:classical and molecular,5th edition,springer-verlag:new york,1991;king et al,a dictionary of genetics,6th ed.,oxford university press:new york,2002;and lewin,genes ix,oxford university press:new york,2007。使用如37c.f.r.
§
1.822所示的dna碱基的命名。
59.本文所用的“构建体”或“dna构建体”或“表达构建体”是指至少包含与第二多核苷酸序列可操作连接的第一多核苷酸序列的多核苷酸序列。
60.本文所用的“供体分子”或“供体dna”或“模板分子”或“模板dna”或“供体dna盒”是指可用作通常在基因组的特定位置修饰基因组的模板的核酸分子。在一个实例中,基因组编辑技术可涉及在特定位置破坏基因组(例如,使用内切核酸酶)并基于供体分子的序列在该位置修饰基因组。“供体dna盒”可以包含同源臂(ha),所述同源臂是供体dna盒的与基因组区域相同的区域,所述基因组区域侧接被靶向用于同源整合的基因组位点的5'和3'侧。供体dna盒可以配置有可操作地连接至供体dna的5'同源臂,所述供体dna可操作地连接至3'同源臂。在一个实例中,同源臂是导致供体dna的定点靶向整合的重组位点。
61.如本文所用的“表达盒”是指包含至少第一多核苷酸序列和任选的转录终止序列的多核苷酸序列,所述第一多核苷酸序列能够启动可操作地连接的第二多核苷酸序列的转录,所述转录终止序列可操作地连接至所述第二多核苷酸序列。
62.本文所用的“基因组编辑”或“基因组修饰”是指通常在基因组中的特定位置修饰生物体基因组的过程。用于将供体多核苷酸引入植物基因组或修饰植物基因组dna的示例性方法包括使用序列特异性核酸酶,如锌指核酸酶、工程化或天然大范围核酸酶、tale-内切核酸酶或rna引导的内切核酸酶,并且实例包括使用crispr/cas9、crispr/cpf1和cre/lox系统用于将供体或模板dna序列引入基因组中的特定位置。
63.本文所用的“向导分子”或“向导rna(grna)”是指用于靶向基因组的至少一个区域以使用基因组编辑技术进行修饰的核酸分子。
[0064]“回文序列”是相同的核酸序列,无论在一条链上从5'读至3'或在与其形成双螺旋的互补链上从3'读至5'。如果核苷酸序列与其反向互补序列相同,则它是回文序列。回文序列可形成发夹。
[0065]“百分比同一性”或“%同一性”是指两个最佳比对的dna或蛋白质片段在组分(例如核苷酸序列或氨基酸序列)的比对窗口中不变的程度。测试序列和参考序列的比对片段的“同一性分数”是两个比对片段的序列共有的相同组分的数目除以比对窗口上参考片段中序列组分的总数,该比对窗口是完整测试序列或完整参考序列中较小的一个。
[0066]“植物”是指完整植物,其任何部分,或来源于植物的细胞或组织培养物,其包含以下中的任一种:完整植物、植物组分或器官(例如叶、茎、根等)、植物组织、种子、植物细胞和/或其后代。植物细胞是植物的生物细胞,取自植物或从取自植物的细胞通过培养获得。
[0067]
本文所用的“启动子”是指位于基因的开放阅读框(或蛋白质编码区)的翻译起始密码子上游或5'的核酸序列,其参与rna聚合酶i、ii或iii和其它蛋白质(反式作用转录因
子)的识别和结合以起始转录。“植物启动子”是在植物细胞中起作用的天然或非天然启动子。组成型启动子在植物发育过程中在植物的大部分或所有组织中起作用。组织、器官或细胞特异性启动子分别仅或主要在特定组织、器官或细胞类型中表达。启动子不是在给定的组织、植物部分或细胞类型中“特异性地”表达,而是与植物的其它部分相比,在植物的一种细胞类型、组织或植物部分中显示“增强的”表达,即更高的表达水平。时间调节的启动子仅或主要在植物发育的某些时期或在一天的某些时间起作用,例如在与昼夜节律相关的基因的情况下。诱导型启动子响应于内源性或外源性刺激(例如通过化合物(化学诱导剂))的存在或响应于环境、激素、化学和/或发育信号而选择性地表达可操作地连接的dna序列。
[0068]
关于核酸或多肽的“重组”是指材料(例如重组核酸、基因、多核苷酸、多肽等)已经通过人为干预而改变。术语重组体也可以指含有重组体材料的生物体,例如,含有重组核酸的植物被认为是重组植物。
[0069]“转基因植物”是指在其细胞内包含异源多核苷酸的植物。通常,异源多核苷酸被稳定地整合到基因组中,使得多核苷酸被传递到连续世代。异源多核苷酸可以单独或作为重组表达盒的一部分整合到基因组中。“转基因的”在本文中用于指任何细胞、细胞系、愈伤组织、组织、植物部分或植物,其基因型已通过异源核酸的存在而改变,包括最初如此改变的那些转基因生物体或细胞,以及由最初转基因生物体或细胞的杂交或无性繁殖产生的那些。本文所用的术语“转基因”不涵盖通过常规植物育种方法(例如杂交)或通过天然发生的事件(如随机异体受精、非重组病毒感染、非重组细菌转化、非重组转座或自发突变)改变基因组(染色体或染色体外)。
[0070]“载体”是在细胞之间转移核酸的多核苷酸或其它分子。载体通常来源于质粒、噬菌体或病毒,并且任选地包含介导载体维持并使其能够用于预期用途的部分。如本文所用的术语“表达载体”是指包含可操作地连接的多核苷酸序列的载体,所述多核苷酸序列促进编码序列在特定宿主生物体中的表达(例如,细菌表达载体或植物表达载体)。
[0071]
在一些实施方案中,用于描述和要求保护本公开的某些实施方案的表示成分的量、性质(如分子量、反应条件等)的数目应理解为在一些情况下被术语“约”修饰。在一些实施方案中,术语“约”用于表示值包括用于确定该值的装置或方法的平均值的标准偏差。在一些实施方案中,在书面说明书和所附权利要求中阐述的数值参数是近似值,其可以根据特定实施方案寻求获得的所需性质而变化。在一些实施方案中,应根据所报告的有效数字的数目且通过应用常规舍入技术来解释数值参数。尽管阐述本公开的一些实施方案的宽范围的数值范围和参数是近似值,但在具体实施例中阐述的数值尽可能精确地报告。在本公开的一些实施方案中呈现的数值可以包含由在它们各自的测试测量中发现的标准偏差必然产生的某些误差。本文中数值范围的记载仅旨在用作单独提及落入该范围内的每个单独值的速记方法。除非本文另有说明,每个单独的值并入说明书中,如同其在本文中单独记载一样。
[0072]
除非另有明确说明,在一些实施方案中,在描述特定实施方案的上下文中(尤其在以下权利要求中的某些的上下文中)使用的术语“一”和“一个”和“所述”以及类似参考可被解释为涵盖单数和复数两者。在一些实施方案中,如本文(包括权利要求)所使用,术语“或”用于表示“和/或”,除非明确指出仅指替代方案或者替代方案是互相排斥的。
[0073]
术语“包含”、“具有”和“包括”是开放式连接动词。这些动词中的一个或多个的任
何形式或时态(诸如“包含”(“comprises”、“comprising”)、“具有”(“has”、“having”)和“包括”(“includes”、“including”))也是开放式的。例如,“包含”、“具有”和“包括”一个或多个步骤的任何方法不限于仅拥有那些一个或多个步骤,并且还可以涵盖其他未列出的步骤。类似地,“包含”、“具有”或“包括”一个或多个特征的任何组合物或装置不限于仅拥有那些一个或多个特征,并且可涵盖其它未列出的特征。
[0074]
本文所述的所有方法可以任何合适的顺序进行,除非本文另有说明或与上下文明显矛盾。关于本文中的某些实施方案提供的任何和所有实例或示例性语言(例如,“诸如”)的使用仅旨在更好地阐明本公开,而不对本公开另外要求保护的范围造成限制。说明书中的任何语言都不应被解释为指示对于本公开的实践而言必不可少的任何未要求保护的元件。
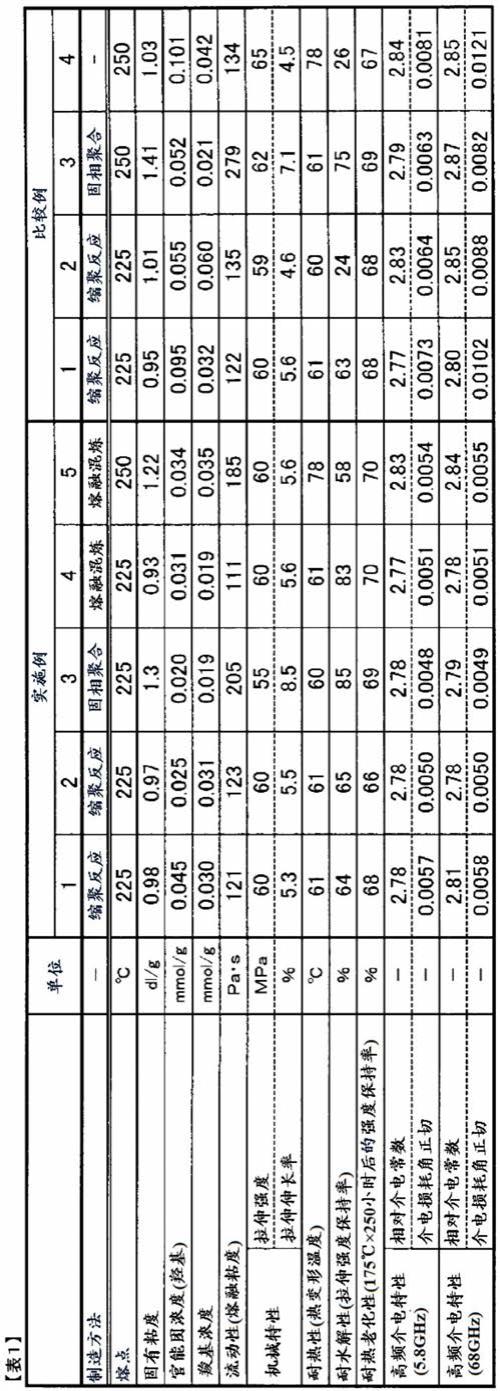
[0075]
本文公开的本公开的替代元件或实施方案的分组不应被解释为限制。每组成员可以单独地或以与该组的其他成员或本文中发现的其他元件的任何组合来提及和要求保护。出于方便或专利性的原因,组的一个或多个成员可包括于组中或从组中删除。
[0076]
已经详细描述了本公开,显而易见的是,在不脱离所附权利要求中限定的本公开的范围的情况下,修改、变化和等效实施方案是可能的。此外,应当理解,本公开中的所有实施例都作为非限制性实施例而提供。
具体实施方式
[0077]
实施例1:用于检测和优化包括反式染色体臂交换和反式片段靶向的染色体重排的构建体
[0078]
设计了检测植物细胞中顺式或反式染色体重排效率的系统。在若干实施方案中,系统使用嵌合报告基因构建体,每个构建体包含位于内含子侧翼的报告基因编码序列的n端部分和报告基因编码序列的c端部分。内含子序列包含至少一个可被重组酶或内切核酸酶识别的靶位点。在靶位点处的嵌合报告基因构建体之间重组后,报告基因编码序列的n端和c端部分各自形成能够表达报告基因编码序列的表达盒。可用于这些构建体的报告基因编码序列编码包括荧光标志物(例如gfp、yfp、bfp、cyp),酶颜色标志物(例如gus)或除草剂耐受性选择标志物(例如cp4)的报告基因。
[0079]
在一个实施方案中,第一dna分子包含通过第一内含子与第二分裂报告基因编码序列的c端部分连接的第一分裂报告基因编码序列的n端部分。内含子包含至少一个可由基因组编辑试剂识别的靶位点,例如loxp位点或crispr相关蛋白/指导系统的靶位点。第二dna分子包含通过第二内含子与第一分裂报告基因编码序列的c端部分连接的第二分裂报告基因编码序列的n端部分,并且第二内含子还包含至少一个可被基因组编辑试剂识别的靶位点,例如loxp位点或crispr相关蛋白/向导系统的靶位点。重组导致第一报告基因编码序列的n端和c端部分通过第一内含子可操作地连接,并且第二报告基因编码序列的n端和c端部分通过第二内含子可操作地连接。转录和加工所得序列以除去内含子,并且至少一种报告基因编码序列被表达以使其可以被检测到。
[0080]
在某些实施方案中,重组位点(如天然和合成的loxp和crispr相关蛋白/向导系统的靶位点)包含在内含子内以避免由于易错的非同源末端连接(nhej)而导致的潜在移码。如果小的插入删除发生在内含子内的靶位点处,则将发生内含子的正确剪接,并且报告基
因仍将被表达。
[0081]
用于测试植物细胞中顺式和反式染色体交换效率的示例性构建体设计如图1和2所示。图1显示第一构建体,其包含camv启动子、gfp编码序列的n端部分、包含至少一个loxp位点的嵌合内含子、crispr相关蛋白/向导系统的靶位点和cp4编码序列的c端部分。
[0082]
图2显示在用于测试顺式或反式染色体重排效率的系统中与图1的构建体组合使用的第二构建体。第二构建体包含遍在启动子1、cp4编码序列的n端部分、包含至少一个loxp位点的嵌合内含子、crispr相关蛋白/向导系统的靶位点和gfp编码序列的c端部分。
[0083]
图1和2所示的构建体可用于通过选择gfp和cp4的表达来检测植物或植物细胞中的重组。
[0084]
实施例2:检测和优化顺式或反式染色体交换的方法
[0085]
分裂报告基因系统可以与任何基因编辑系统一起使用,例如与cpf1/grna或cas9/grna和cre/lox系统一起使用,以研究和优化植物中的精确染色体修饰。特别地,本文公开的系统提供快速和非破坏性评估用于编辑的基因组的细胞、用于确定染色体以顺式和反式重排的频率的方法、以及用于测试由各种启动子驱动的基因组编辑机制的效率的选项。
[0086]
图3显示了使用实施例1中所述和图1和2中所示的构建体检测和优化本文所述染色体重排的方法。可以使用标准植物转化方法将这些构建体之一或两者转化到植物中。产生含有载体a或载体b的转化事件,并且例如使用靶向测序方法确定基因组中的转基因位置。然后,载体a和载体b独立事件文库用于研究引导的染色体重排。
[0087]
如图3所示,将在特定染色体位置处包含载体a的植物与在不同染色体位置处包含载体b的植物杂交。将来自杂交的f1植物用编码基因组编辑试剂(如重组酶或内切核酸酶,例如cas9/grna、cpf1/grna或cre的序列)转化。在cas9/grna或cpf1/grna系统的情况下在crispr相关蛋白/向导系统的靶位点处的重组,或在cre的情况下在loxp位点处的重组,将产生gfp和cp4标志物的表达。报告基因(如gfp、gus或cp4)的表达可用于鉴定顺式或反式染色体交换。
[0088]
在进一步的实施方案中,编码重组酶或内切核酸酶(例如cas、cpf1或cre)的序列可以在启动子的控制下可操作地连接到包含分裂报告基因的dna构建体和靶序列之一或两者。该方法还消除了将cre/cas9引入细胞或植物的第二转化步骤。可以使用具有所需表达模式的启动子,例如遍在启动子1、osact、atease 35smin和atdmc1。
[0089]
编码向导rna(grna)的序列也可以在启动子的控制下可操作地连接到包含分裂报告基因的dna构建体和靶序列之一或两者。在某些实施方案中,载体a和载体b包含不同的靶位点,并且载体a可以进一步包含编码识别载体b的靶位点的grna的序列,而载体b可以进一步包含编码识别载体a的靶位点的grna的序列。将grna及其靶位点定位在不同的载体中,并且因此定位在不同的亲本植物中,防止了内切核酸酶切割grna靶位点,直到产生了包含cas内切核酸酶、靶位点及其向导rna的f1后代。
[0090]
实施例3:玉米原生质体中分裂报告基因构建体的设计和验证
[0091]
在分离的玉米原生质体中测试并证实了使用分裂报告基因鉴定顺式或反式染色体交换的方法。图4显示了由编辑试剂(cre或cas9)的表达诱导的质粒重组的示意图。由cas9或cpf1引入的双链断裂导致质粒线性化,随后在内含子处连锁、表达和剪接修复的报告基因mrna。cre的表达引起loxp位点处两个质粒之间的重组。
[0092]
如图4所示设计分裂报告基因构建体,以使用表1所示的组分测试玉米原生质体中的重组效率。在一个实施例中,报告基因a包含n端gfp(seq id no:1)、grna(seq id no:23)、loxp(seq id no:6)和c-gus(seq id no:4)序列。报告基因a还可以包含本文公开的或本领域已知的启动子、内含子和终止子序列。报道分子b包含n-gus(seq id no:3)、grna(seq id no:23)、loxp(seq id no:6)和c-gfp(seq id no:2)序列。报道分子b还可以包含本文公开的或本领域已知的启动子、内含子和终止子序列。cre构建体,例如包含cre_启动子(seq id no:14)、cre_5'_内含子(seq id no:15)、cre编码序列(seq id no:13)和cre_终止子(seq id no:16),或cas构建体,例如包含cas9_启动子(seq id no:19)、cas_9_5'_内含子(seq id no:20)、cas9编码序列(seq id no:17)和cas9_终止子(seq id no:18),可以与报告基因a或b一起包含,或转化到包含报告基因a或b的植物中。使用本文公开的或本领域已知的组分组装报告基因构建体将完全在本领域技术人员的能力范围内。
[0093]
表1.分裂报告基因构建体的组分
[0094]
[0095][0096]
在玉米原生质体中测量的重组效率以表达gfp的细胞百分比表示在图5中。这些原生质体分析结果证明在两个不同实验中存在cre表达或玉米密码子优化的cas9(seq id no:17)时载体a和载体b质粒之间的重组。通过gfp表达细胞的数目或gfp表达细胞的百分比检测重组活性,所述百分比表示发生重组的细胞的数目或百分比。重组是质粒浓度依赖性的,对于cre-驱动的重组,在0.4/0.4pmole的载体a/载体b浓度下观察到最高重组水平。对于cas9-驱动的重组,在0.8/0.8pmole的浓度下观察到最高重组水平。
[0097]
实施例4.大豆原生质体中cre分裂报告基因构建体的设计和验证
[0098]
用于确定大豆子叶原生质体中重组效率的cre分裂报告基因系统的载体如图6所示。载体a包含由内含子连接的分裂报告基因,所述内含子包含lox和grna序列,具有或不具有由单独的启动子驱动的另外的cre编码序列。载体b包含载体a中的内含子、lox和grna靶序列。载体c是阳性对照。图7显示了细胞中重组的预期产物。
[0099]
如图6所示设计分裂报告基因构建体,以使用表2所示的组分测试大豆原生质体中的重组效率。在一个实施例中,报告基因a包含启动子(seq id no:23)、前导序列(seq id no:24)、n端gfp(seq id no:25)、n端ls1内含子(seq id no:26)、loxp(seq id no:27)、
grna靶位点(seq id no:28)、pam位点(seq id no:29)、c端act7内含子(seq id no:30)、c端cp4(seq id no:31)和终止子(seq id no:32)序列。报告基因a还可以包含本文公开的或本领域已知的启动子、内含子和终止子序列。报告基因b包含启动子(seq id no:33)、前导序列(seq id no:34)、启动子内含子(seq id no:35)、转运肽(seq id no:36)、n端cp4(seq id no:37)、n端内含子(seq id no:38)、loxp(seq id no:39)、grna靶位点(seq id no:40)、pam位点(seq id no:41),c端内含子(seq id no:42)、c端gfp(seq id no:43)和终止子(seq id no:45)。报道分子b还可以包含本文公开的或本领域已知的启动子、内含子和终止子序列。例如包含启动子(seq id no:45)、一个或多个cpf1重复非编码rna(seq id no:46)和grna靶位点(seq id no:47)的cpf1构建体可以与报告基因a或b一起包含。使用本文公开的或本领域已知的组分组装报告基因构建体将完全在本领域技术人员的能力范围内。
[0100]
表2.分裂报告基因构建体的示例性组分
[0101]
[0102][0103]
开发了评估gfp表达作为大豆原生质体中重组效率的量度的大豆子叶测定。从40-60天龄的子叶上除去种皮,将组织切成1mm并在26℃进行质壁分离1小时,在26℃消化2小时并释放5分钟。将原生质体转移到96孔板中并通过peg介导的转化进行转化。
[0104]
将载体a /-cre与载体b共转染到大豆原生质体中。在转染后48和72小时评估通过lox位点处载体a和载体b的重组发生的gfp表达。图8显示了gfp平均百分比的operetta分析,表明在大豆子叶原生质体中检测到了反式交换。这些结果证实了cre分裂报告基因系统在大豆原生质体中的用途,表明在lox位点处载体a cre和载体b之间发生重组。
[0105]
实施例5:大豆子叶原生质体中大豆cpf1分裂报告基因系统的验证
[0106]
用于测定大豆子叶原生质体中重组效率的cpf1分裂报告基因系统的载体示于图9。载体a包含由内含子连接的分裂报告基因,所述内含子包含lox和grna序列,具有或不具有由单独的启动子驱动的另外的cpf1编码序列。载体b包含载体a中的内含子、lox和grna序列。载体c是阳性对照。
[0107]
根据实施例4中所述的测定,将载体a /-cpf1与载体b共转染到大豆原生质体中。在转染后48和72小时评估通过载体a到载体b的nhej发生的gfp表达。图10显示阳性gfp细胞百分比和nhej百分比。这些结果证明了cfp1分裂报告基因系统在大豆原生质体中的用途。
[0108]
实施例6:转化植物和细胞的产生
[0109]
将如图4所示的包含第一分裂报告基因和第二分裂报告基因的构建体(报告基因a和报告基因b)转化到玉米植物中。通过靶向测序(scip)确定玉米基因组中的转基因位置。其中报告基因a或报告基因b转基因随机整合到基因组中被明确定义的7个事件用于进一步测试。将这些事件自交以产生r1纯合转基因事件。将独立的纯合报告基因a和报告基因b事件杂交以产生包含图11所示的两种构建体的f1植物的半合子群体。此外,将每种报告基因事件的6个半合子中的3个自交以产生f2代,其中每种转基因(报告基因a和报告基因b)是纯合的。收获这些f1和f2材料并评价染色体重排。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。