1.本发明涉及药学技术领域,更具体地说,本发明涉及一种雷贝拉唑钠肠溶微丸片及其制备方法。
背景技术:
2.溃疡性疾病是常见的一类疾病,且临床上易反复发作,常伴有严重的并发症,最主要致病因素为胃酸浓度过高、黏膜保护作用减弱和幽门螺旋杆菌感染等。因此,消化道溃疡的治疗需要运用抑制胃酸分泌、保护消化道黏膜和抗幽门螺旋杆菌的药物。胃酸分泌的最后步骤是胃壁细胞内质子泵驱动细胞内h 与小管内k 交换。质子泵抑制剂是目前所公认的治疗消化道溃疡的首选药物,它阻断了胃酸分泌的最后通道,因此,能抑制基础胃酸的分泌及组胺、乙酰胆碱、胃泌素和食物刺激引起的酸分泌。雷贝拉唑钠是继奥美拉唑、兰索拉唑后的新一代苯并咪唑类化合物,是一种新型的质子泵抑制剂,多用于治疗因胃酸分泌过多而导致的胃肠道疾病,如消化性溃疡、胃食管反流性疾病、卓艾氏综合征等。雷贝拉唑钠口服吸收迅速,能有效抑制胃酸分泌,快速缓解症状,临床效果确切,耐受性良好。雷贝拉唑钠的稳定性与ph值有关,在酸性介质中快速降解,但在碱性条件下相对稳定,临床上通常需要将其制备成肠溶制剂,此类制剂经口服给药后,在肠道内肠溶衣膜发生溶解,释放出的活性成分雷贝拉唑钠开始被吸收。
3.根据“无酸,便无溃疡”理论,抑酸剂成为治疗消化性溃疡的主要药物,特别是质子泵抑制剂,如奥美拉唑、雷贝拉唑钠、洋托拉唑等,质子泵抑制剂的抑酸作用更强大持久。雷贝拉唑钠的化学名称为2-{[4-(3-甲氧基丙氧基)-3甲基吡啶2-基]甲亚磺酰基}-1h-苯丙咪唑钠,遇热、光、酸容易变质。雷贝拉唑钠是一种新型的质子泵抑制剂,为细胞尖端分泌膜内质子泵的强抑制剂,对基础胃酸和由刺激引起的胃酸分泌具有抑制作用,与奥美拉唑相比雷贝拉唑钠的起效速度快。
[0004]
目前技术提供的雷贝拉唑钠包衣片或肠溶片的片芯溶出度较差,导致雷贝拉唑钠的生物利用率低,长时间放置容易导致球片出现不稳定的情况,进而导致球片崩解。
技术实现要素:
[0005]
为了克服现有技术的上述缺陷,本发明提供了一种雷贝拉唑钠肠溶微丸片及其制备方法,本发明所要解决的技术问题是:目前技术提供的雷贝拉唑钠包衣片或肠溶片的片芯溶出度较差,导致雷贝拉唑钠的生物利用率低,长时间放置容易导致球片稳定性出现不稳定的情况,进而导致球片崩解的问题。
[0006]
为实现上述目的,本发明提供如下技术方案:一种雷贝拉唑钠肠溶微丸片的制备方法,其特征在于,包括以下制备步骤:
[0007]
1)片芯制备工艺:将泮托拉唑钠20.7%、甘露醇200sd32.8%、无水碳酸钠30.0%、pvpp.xl15%、pvp.301%、硬脂酸镁0.5%,对上述原料通过粉碎机进行粉碎处理,粉碎完毕后果80目筛备用,称取上述质量比的甘露醇200sd、无水碳酸钠、pvpp.xl、pvp.k30、硬脂酸
镁充分混合均匀后备用,而后通过压片定型。
[0008]
2)隔离层制备工艺:称取一定量水备用,缓缓加入hpmc.e5持续搅拌至溶胀完全后加入二氧化钛、滑石粉、磷酸三钠充分混合均匀,其中hpmc.e5 的占比为82.1%、二氧化钛的占比为8.2%、滑石粉的占比为5.6%、磷酸三钠的占比为4.1%,混合完毕后采用包衣机对隔离层进行加工。
[0009]
3)肠溶层制备工艺:称取处方量水备用,加入柠檬酸三乙酯、吐温80、 sds持续搅拌1h后加入丙烯酸树脂继续搅拌1h。
[0010]
作为本发明的进一步方案:所述步骤2)中高效包衣机运转时风机转速 1600rpm、主机转速为8rpm、雾化压力为0.07mpa,且需要保障其内部物料温度为35℃—40℃。
[0011]
作为本发明的进一步方案:所述步骤3)中丙烯酸树脂的质量占比为 48.6%,所述柠檬酸三乙酯的质量占比为1.5%、吐温80的质量占比为0.8%、 sds的质量占比为0.6%、水的质量占比为48.6%。
[0012]
作为本发明的进一步方案:所述步骤1)中选择5mm球型冲头,所述加工后的片芯片重设定为70mg,其硬度为38n-43n。
[0013]
种雷贝拉唑钠肠溶微丸片的制备方法,包括以下步骤:
[0014]
片芯制备:将泮托拉唑钠20.7%、甘露醇200sd37.8%、无水碳酸钠30.0%、 pvpp.xl10%、pvp.301%、硬脂酸镁0.5%,对上述原料通过粉碎机进行粉碎处理,粉碎完毕后果80目筛备用,称取上述质量比的甘露醇200sd、无水碳酸钠、pvpp.xl、pvp.k30、硬脂酸镁充分混合均匀后备用,而后通过压片定型。
[0015]
隔离层制备工艺:称取一定量水备用,缓缓加入hpmc.e5持续搅拌至溶胀完全后加入二氧化钛、滑石粉、磷酸三钠充分混合均匀,其中hpmc.e5的占比为82.1%、二氧化钛的占比为8.2%、滑石粉的占比为5.6%、磷酸三钠的占比为4.1%,混合完毕后采用包衣机对隔离层进行加工。
[0016]
肠溶层制备工艺:称取处方量水备用,加入柠檬酸三乙酯、吐温80、sds 持续搅拌1h后加入丙烯酸树脂继续搅拌1h,其中丙烯酸树脂的质量占比为 48.6%,所述柠檬酸三乙酯的质量占比为1.5%、吐温80的质量占比为0.8%、 sds的质量占比为0.6%、水的质量占比为48.6%。
[0017]
作为本发明的进一步方案:所述“180717-1”和“180724-1”,所述“180727-1”为重复“180717-1”批次,所述“180727-2”为重复“180724-2”批次,所述180724为实验药剂编号,
“‑
1”或
“‑
2”为实验批次。
[0018]
进一步的,一种雷贝拉唑钠肠溶微丸片的制备方法,包括以下检测方法:
[0019]
溶出曲线测定(ph6.8)
[0020]
溶出条件
[0021]
选择转篮法、转速100rpm、水温37℃、900ml溶出介质。
[0022]
测定方法
[0023]
将样品经120min0.1mol/lhcl后检测耐酸溶液。
[0024]
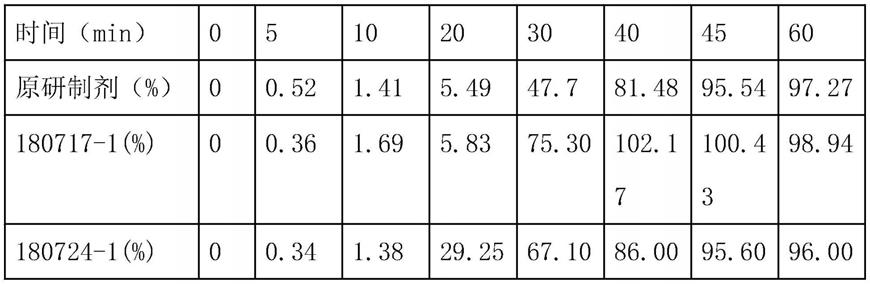
将耐酸后样品转入ph6.8溶出介质中,于5min、10min、20min、30min、 40min、45min、60min取样后稀释一倍进行紫外测定,与原研制剂对比溶出曲线。
[0025]
测定结果
[0026][0027]
结论:180717-1通过调整肠溶层增重来控制开始溶出时间,开始溶出时间与原研制剂一致,因自制球片比表面积比原研制剂大,溶出终点比原研更快则更有可能达到be一致.
[0028]
180724-1考虑到比表面积问题,开始释放时间及释放速度快于原研,终点与原研一致,溶出曲线与原研制剂更接近。
[0029]
常规项目检测
[0030]
批号含量(%)含量均匀度(%)耐酸力180727-199.8a 2.2s=14.1未检出180727-299.9a 2.2s=14.3未检出
[0031]
结论:重复批次与此前处方批次检验结果基本一致。
[0032]
重复批次溶出曲线检测
[0033]
检测结果:
[0034][0035][0036]
结论:两批次处方,工艺重现性良好。
[0037]
将原研制剂除去肠溶层,测定硬度为60n,崩解时限为6分30秒。
[0038]
预实验将片芯硬度定位60n,崩解剂用量为10%,崩解时限为7分与原研较接近,处方及工艺完成后,在ph6.8中60min观察溶出现象并未完全溶解,推测为压力过大或崩解剂不够,分析后认为自制球片为5mm直径<原研片,崩解时限应小于原研制剂,重新制定2个处方,压力为40n,崩解剂用量分别为15%与20%。
[0039]
再次测定崩解时限:
[0040]
崩解剂用量处方1(15%pvpp)处方2(15%pvpp)处方3(20%pvpp)硬度(n)604040崩解时限7分0秒4分45秒4分30秒
溶出现象60分钟未溶完40min溶完30min溶完
[0041]
结论:崩解时限对本处方崩解剂区分力度不大,硬度会影响溶出。
[0042]
ph值研究
[0043]
因api有ph依赖,在碱性条件下稳定,故调节片芯及隔离层为碱性。
[0044]
将原研制剂去除肠溶层后溶解于100ml水中,测定ph值为10.3,将片芯中无水碳酸钠用量增加至30%,ph值为10.9。
[0045]
结论:可用无水碳酸钠将ph调至可保持api稳定的高ph值。
[0046]
隔离层与此前微丸包衣处方一致,10%能有效隔离片芯与肠溶层。
[0047]
肠溶层在包衣过程中取增重5%、10%及20%分别进行耐酸试验。
[0048]
肠溶层增重5%10%15%20%耐酸试验溶解并变色未检出未检出未检出
[0049]
结论:肠溶层增重10%能满足耐酸需求。
[0050]
本发明的有益效果在于:
[0051]
1、本发明通过对加工完毕的雷贝拉唑钠肠溶微丸片进行常规项目检测、溶出曲线判断以及溶出条件检测从而对制成的雷贝拉唑钠肠溶微丸片稳定性进行检测判定,且通过数据检测后得出,样品放样中,球片30天结果显示,杂质几乎无增长,此工艺稳定性较好,且在溶出检测中可得出结论,通过调整肠溶层增重来控制开始溶出时间,开始溶出时间与原研制剂一致,因自制球片比表面积比原研制剂大,溶出终点比原研更快则更有可能达到be一致,且两种处方均具备重现性良好以及溶出状态好的特点,同时,在长时间的放置后可以保障雷贝拉唑钠肠溶微丸片的稳定性,降低了雷贝拉唑钠肠溶微丸片出现崩解的可能。
附图说明
[0052]
图1为本发明第一溶出曲线示意图;
[0053]
图2为本发明第二溶出曲线示意图。
具体实施方式
[0054]
下面将对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
[0055]
由上表中的对比可知:
[0056]
实施例1:
[0057]
一种雷贝拉唑钠肠溶微丸片的制备方法,包括以下制备步骤:
[0058]
1)片芯制备工艺:将泮托拉唑钠20.7%、甘露醇200sd32.8%、无水碳酸钠30.0%、pvpp.xl15%、pvp.301%、硬脂酸镁0.5%,对上述原料通过粉碎机进行粉碎处理,粉碎完毕后果80目筛备用,称取上述质量比的甘露醇200sd、无水碳酸钠、pvpp.xl、pvp.k30、硬脂酸镁充分混合均匀后备用,而后通过压片定型。
[0059]
2)隔离层制备工艺:称取一定量水备用,缓缓加入hpmc.e5持续搅拌至溶胀完全后加入二氧化钛、滑石粉、磷酸三钠充分混合均匀,其中hpmc.e5 的占比为82.1%、二氧化钛
的占比为8.2%、滑石粉的占比为5.6%、磷酸三钠的占比为4.1%,混合完毕后采用包衣机对隔离层进行加工。
[0060]
3)肠溶层制备工艺:称取处方量水备用,加入柠檬酸三乙酯、吐温80、 sds持续搅拌1h后加入丙烯酸树脂继续搅拌1h。
[0061]
所述步骤2)中高效包衣机运转时风机转速1600rpm、主机转速为8rpm、雾化压力为0.07mpa,且需要保障其内部物料温度为35℃—40℃。
[0062]
所述步骤3)中丙烯酸树脂的质量占比为48.6%,所述柠檬酸三乙酯的质量占比为1.5%、吐温80的质量占比为0.8%、sds的质量占比为0.6%、水的质量占比为48.6%。
[0063]
所述步骤1)中选择5mm球型冲头,所述加工后的片芯片重设定为70mg,其硬度为38n-43n。
[0064]
实施例2:
[0065]
一种雷贝拉唑钠肠溶微丸片与实施例1中区别仅为,包括以下步骤:
[0066]
片芯制备:将泮托拉唑钠20.7%、甘露醇200sd37.8%、无水碳酸钠30.0%、 pvpp.xl10%、pvp.301%、硬脂酸镁0.5%,对上述原料通过粉碎机进行粉碎处理,粉碎完毕后果80目筛备用,称取上述质量比的甘露醇200sd、无水碳酸钠、pvpp.xl、pvp.k30、硬脂酸镁充分混合均匀后备用,而后通过压片定型。
[0067]
隔离层制备工艺:称取一定量水备用,缓缓加入hpmc.e5持续搅拌至溶胀完全后加入二氧化钛、滑石粉、磷酸三钠充分混合均匀,其中hpmc.e5的占比为82.1%、二氧化钛的占比为8.2%、滑石粉的占比为5.6%、磷酸三钠的占比为4.1%,混合完毕后采用包衣机对隔离层进行加工。
[0068]
肠溶层制备工艺:称取处方量水备用,加入柠檬酸三乙酯、吐温80、sds 持续搅拌1h后加入丙烯酸树脂继续搅拌1h,其中丙烯酸树脂的质量占比为 48.6%,所述柠檬酸三乙酯的质量占比为1.5%、吐温80的质量占比为0.8%、 sds的质量占比为0.6%、水的质量占比为48.6%。
[0069]
实施例1中提出的药剂步骤得出的药剂以及实施例2中提出的药剂进行编号,分别为“180717-1”和“180724-1”,所述“180727-1”为重复“180717-1”批次,所述“180727-2”为重复“180724-2”批次,所述180724为实验药剂编号,
“‑
1”或
“‑
2”为实验批次。
[0070]
一种雷贝拉唑钠肠溶微丸片的制备方法,包括以下检测方法:
[0071]
溶出曲线测定(ph6.8)
[0072]
溶出条件
[0073]
选择转篮法、转速100rpm、水温37℃、900ml溶出介质。
[0074]
测定方法
[0075]
将样品经120min0.1mol/lhcl后检测耐酸溶液。
[0076]
将耐酸后样品转入ph6.8溶出介质中,于5min、10min、20min、30min、40min、45min、60min取样后稀释一倍进行紫外测定,与原研制剂对比溶出曲线。
[0077]
测定结果
[0078][0079][0080]
结论:180717-1通过调整肠溶层增重来控制开始溶出时间,开始溶出时间与原研制剂一致,因自制球片比表面积比原研制剂大,溶出终点比原研更快则更有可能达到be一致.
[0081]
180724-1考虑到比表面积问题,开始释放时间及释放速度快于原研,终点与原研一致,溶出曲线与原研制剂更接近。
[0082]
常规项目检测
[0083]
批号含量(%)含量均匀度(%)耐酸力180727-199.8a 2.2s=14.1未检出180727-299.9a 2.2s=14.3未检出
[0084]
结论:重复批次与此前处方批次检验结果基本一致。
[0085]
重复批次溶出曲线检测
[0086]
检测结果:
[0087]
时间(min)05102030404560180717-1(%)00.361.695.8375.3102.17100.4398.94180727-1(%)00.442.385.5070.4699.5499.8999.73180724-2(%)00.341.3829.2567.1086.0095.6096.00180727-2(%)00.381.8825.9665.3385.5096.6097.3
[0088]
结论:两批次处方,工艺重现性良好。
[0089]
将原研制剂除去肠溶层,测定硬度为60n,崩解时限为6分30秒。
[0090]
预实验将片芯硬度定位60n,崩解剂用量为10%,崩解时限为7分与原研较接近,处方及工艺完成后,在ph6.8中60min观察溶出现象并未完全溶解,推测为压力过大或崩解剂不够,分析后认为自制球片为5mm直径<原研片,崩解时限应小于原研制剂,重新制定2个处方,压力为40n,崩解剂用量分别为15%与20%。
[0091]
再次测定崩解时限:
[0092][0093]
结论:崩解时限对本处方崩解剂区分力度不大,硬度会影响溶出。
[0094]
ph值研究
[0095]
因api有ph依赖,在碱性条件下稳定,故调节片芯及隔离层为碱性。
[0096]
将原研制剂去除肠溶层后溶解于100ml水中,测定ph值为10.3,将片芯中无水碳酸钠用量增加至30%,ph值为10.9。
[0097]
结论:可用无水碳酸钠将ph调至可保持api稳定的高ph值。
[0098]
隔离层与此前微丸包衣处方一致,10%能有效隔离片芯与肠溶层。
[0099]
肠溶层在包衣过程中取增重5%、10%及20%分别进行耐酸试验。
[0100]
肠溶层增重5%10%15%20%耐酸试验溶解并变色未检出未检出未检出
[0101]
结论:肠溶层增重10%能满足耐酸需求。
[0102]
球片稳定性数据测试
[0103]
加速试验:40℃、75%rh
[0104]
[0105][0106]
结论:样品放样中,球片30天结果显示,杂质几乎无增长,此工艺稳定性较好。
[0107]
通过对加工完毕的雷贝拉唑钠肠溶微丸片进行常规项目检测、溶出曲线判断以及溶出条件检测从而对制成的雷贝拉唑钠肠溶微丸片稳定性进行检测判定,且通过数据检测后得出,样品放样中,球片30天结果显示,杂质几乎无增长,此工艺稳定性较好,且在溶出检测中可得出结论,通过调整肠溶层增重来控制开始溶出时间,开始溶出时间与原研制剂一致,因自制球片比表面积比原研制剂大,溶出终点比原研更快则更有可能达到be一致,且两种处方均具备重现性良好以及溶出状态好的特点,同时,在长时间的放置后可以保障雷贝拉唑钠肠溶微丸片的稳定性,降低了雷贝拉唑钠肠溶微丸片出现崩解的可能。
[0108]
最后应说明的几点是:虽然,上文中已经用一般性说明及具体实施例对本发明作了详尽的描述,但在本发明的基础上,以上各实施例仅用以说明本发明的技术方案,而非对
其限制;尽管参照前述各实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分或者全部技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的范围。。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。