1.本发明属于生物检测领域,涉及一种双信号探针、检测大肠杆菌的试纸条及应用,具体涉及一种亚甲基蓝嵌入的锆基金属-有机骨架(uio@mb)捕获待测细菌实现双信号识别的探针,使用了该探针的试纸条,及其用于快速检测大肠杆菌o157:h7的应用。
背景技术:
2.大肠杆菌o157:h7是大肠杆菌的代表菌株,是引起食物感染和食物中毒的最重要食源性致病菌之一。该种病菌常见于受污染的水源或未熟透的食物中,误食进入人类或动物体内会释放一种强烈的毒素,并可能导致严重的水状腹泻、带血腹泻、发烧、腹绞痛及呕吐等症状。大肠杆菌o157:h7是我国大部分食品标准中的检测项目,且要求不得检出。快速、准确、灵敏、简便地检测出大肠杆菌o157:h7,在医疗卫生、食品卫生、动物疫病监测等方面具有重要的意义。迄今为止,已经报道了检测大肠杆菌o157:h7 的几种可行方法,包括仪器分析法,酶联免疫吸附测定,聚合酶链反应和电化学生物传感器。但是,这些方法需要依靠复杂的样本前处理过程和昂贵的检测仪器,难以实现现场快速检测应用。因此,开展有效的大肠杆菌o157:h7即时检测,并加强相关环节的监管,仍是食品安全领域中面临的巨大挑战。
3.由于免疫层析试纸条具有简单、快速、灵敏、特异性、低成本和用户友好性等特点,成为确保食品安全和公共卫生的最流行策略之一。不幸地是,免疫层析试纸条在食源性致病菌检测中的适用性仍受到许多无法控制的因素阻碍:(1)抗体和信号载体之间需要复杂而严格的交联过程;(2)标记抗体的生物活性在分析过程中容易受到恶劣的化学环境的影响,例如有机溶剂或复杂的样品基质;(3)在复杂的外部条件下,单一信号识别模式不能保证检测结果的灵敏度和准确性。因此,有必要克服这些缺陷,为免疫层析试纸条的应用准备具有无抗体标记和多种信号识别模式的出色替代传感器载体。
4.发光金属有机骨架(lmof)是一种通过金属离子(或簇)和多功能有机粘合剂配位合成的新型晶体材料。lmof强大的吸附富集能力、永久的孔结构、丰富的功能位点和特殊的荧光特性赋予其在细菌中意想不到的应用潜力捕获。值得注意地是,lmof 经常作为荧光传感器通过荧光增强模式检测各种分析物,而这种方法在免疫层析试纸条上的潜在应用仍然在很大程度上被忽视,值得探索。此外,有机染料作为一种重要的发光材料,可以封装在具有超高孔隙率和可调孔径的lmof中,有效改善lmof难以区分的视觉颜色。为了进一步符合细菌吸附和多模式传感的要求,lmof与染料分子的完美结合有利于为免疫层析试纸条的高灵敏度和准确检测提供高效的免抗体标记和双信号识别载体。
技术实现要素:
5.针对现有技术中的缺陷和不足,本发明的目的是提供一种双信号探针、检测大肠杆菌的试纸条及应用。该探针具有优异的颜色信号,不仅能够免除抗体标记直接捕获细菌,而且在al
3
辅助下产生强烈的荧光响应。实现饮用水和卷心菜样品中大肠杆菌灵敏,精确,
快速的监测。
6.为达到上述技术效果,本发明采取的技术方案为:
7.一种双信号探针,包括锆基金属-有机骨架及嵌入其内的亚甲基蓝;所述的双信号探针的粒径为184~217nm;锆基金属-有机骨架和亚甲基蓝的质量比为8:1,且亚甲基蓝的吸收容量计算为2.28
×
10
16
molecules/mg锆基金属-有机骨架。
8.可选的,制备方法包括:
9.(1)制备锆基金属-有机骨架:物质的量比为4:5的锆盐与2,5-二羟基对苯二甲酸于80℃反应12h,收集沉淀干燥备用;
10.(2)制备双信号探针:质量比为8:1的锆基金属-有机骨架和亚甲基蓝于水中孵育并在4℃下储存。
11.可选的,制备方法具体包括:
12.(1)制备锆基金属-有机骨架:1.2mmol zrcl4溶解于30ml n,n'-甲基甲酰胺中,再加入1.5mmol 2,5-二羟基对苯二甲酸,80℃反应12h,收集沉淀干燥备用;
13.(2)制备双信号探针:80mg的锆基金属-有机骨架和10mg的亚甲基蓝加入到10ml 超纯水剧烈搅拌并在4℃下储存。
14.本发明所述的双信号探针用于制备生物检测试纸条的应用。
15.本发明所述的双信号探针用于制备检测大肠杆菌试纸条的应用。
16.本发明所述的双信号探针用于制备检测饮用水或卷心菜中大肠杆菌试纸条的应用。
17.一种检测大肠杆菌的试纸条,所述的试纸条上的检测线包被有大肠杆菌单克隆抗体,无质控线;
18.所述的试纸条的检测液中含有本发明所述的双信号探针。
19.可选的,所述的检测液的制备包括:将双信号探针溶液加入到待检测大肠杆菌样品液中进行孵育,孵育时间为15min;双信号探针溶液的浓度为8mg/ml,双信号探针溶液与待检测大肠杆菌样品液的体积比为1:10;所述的试纸条检测大肠杆菌的最低浓度为 103cfu/ml。
20.一种大肠杆菌检测液,所述的检测液中含有本发明所述的双信号探针;所述的检测液的制备包括:将双信号探针溶液加入到待检测大肠杆菌样品液中进行孵育,孵育时间为15min;双信号探针溶液的浓度为8mg/ml,双信号探针溶液与待检测大肠杆菌样品液的体积比为1:10。
21.一种食品中大肠杆菌的检测方法,利用本发明所述的双信号探针与待检样品制备成检测液;
22.用检测线包被有大肠杆菌单克隆抗体的试纸条进行显色检测,检测响应时间为 20min;
23.可见光下显示出蓝色线条带或经过al
3
激发后在紫外光下显示为黄绿色荧光条带时,判为阳性。
24.与现有技术相比,其优点与积极效果在于:
25.(1)免除抗体标记:该发明通过亚甲基蓝嵌入锆基金属-有机骨架制备新型双信号探针直接吸附捕获细菌,避免了抗体和信号载体之间需要复杂而严格的交联过程。
26.(2)新型双信号探针:首次在免疫层析试纸条检测中通过亚甲基蓝嵌入锆基金属
‑ꢀ
有机骨架制备新型双信号探针,该探针具有优异的颜色信号,不仅能够免除抗体标记直接捕获细菌,而且在al
3
辅助下产生强烈的荧光响应,增加另一种检测信号。避免了繁琐的修饰程序或恶劣条件,从而显着保留了抗体的生物活性,并增强了检测的灵敏度和准确性。
27.(3)灵敏度高:本发明提供的试纸条对大肠杆菌在比色和荧光模式下的最低检测限均为103cfu/ml,比传统的基于金纳米颗粒的免疫层析试纸条灵敏度高100倍。可作为通用方法快速、便携检测食品中致病菌的残留。
28.(4)特异性强:该发明试纸条对大肠杆菌具有高度特异性,对其他致病菌均无特异性;
29.(5)良好的实际应用:本发明可以检测饮用水和卷心菜中的大肠杆菌,具有很好的应用前景,可以作为检测各种致病菌的通用检测方法。
附图说明
30.附图是用来提供对本公开的进一步理解,并且构成说明书的一部分,与下面的具体实施方式一起用于解释本公开,但并不构成对本公开的限制。在附图中:
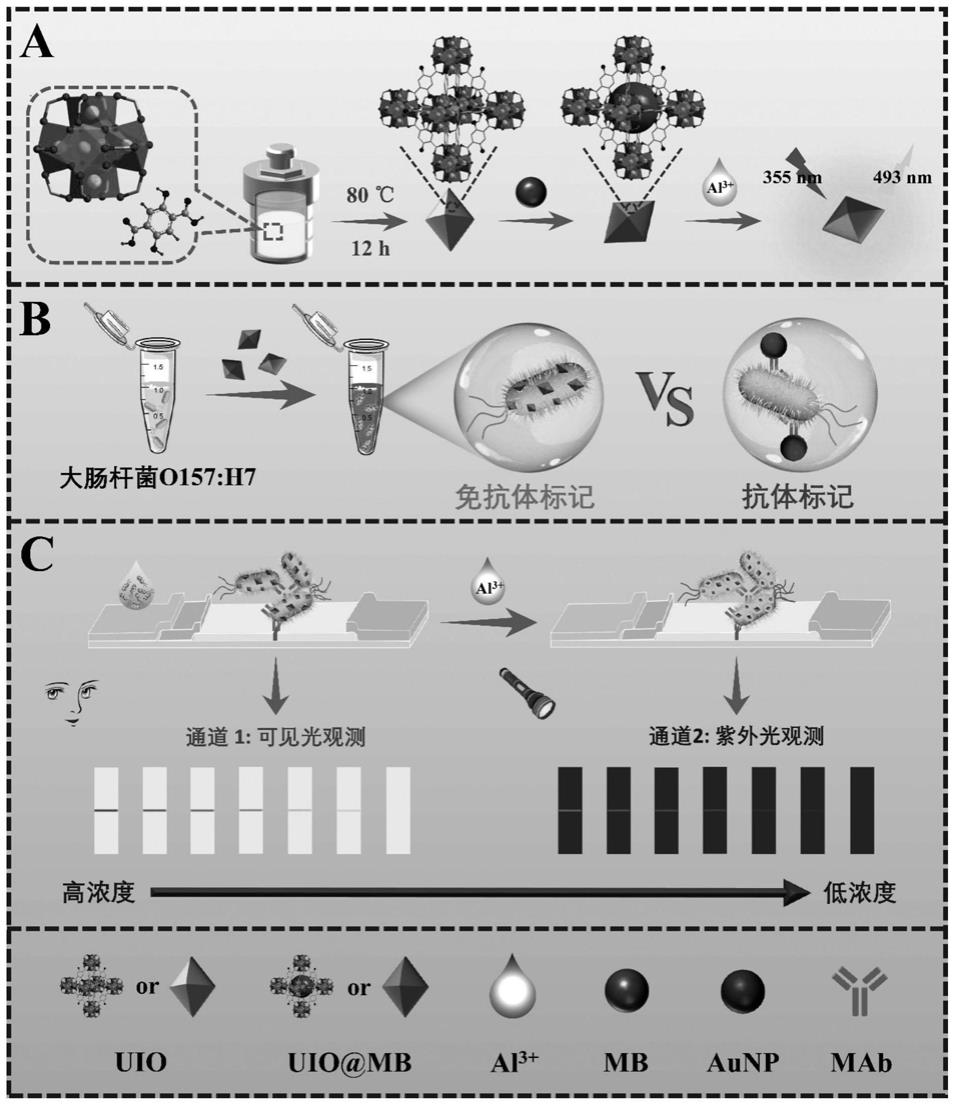
31.图1是本发明新型双信号探针uio@mb的制备示意图和本发明免疫层析试纸条的检测原理图;
32.图2为实施例1制备的双信号探针uio@mb的材料验证;
33.图3为双信号探针uio@mb显色效率优化结果图;
34.图4为uio浓度、不同体积的uio@mb探针、孵育时间及t线响应的研究结果图;
35.图5为本发明制备的免疫层析试纸条检测灵敏度;
36.图6为本发明制备的免疫层析试纸条的特异性;
37.图7为本发明制备的免疫层析试纸条检测的实际应用;
38.以下结合说明书附图和具体实施方式对本发明做具体说明。
具体实施方式
39.以下将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述。显然,以下所描述的实施例仅是本发明的一部分实施例,并非全部实施例,也并未对本发明做任何形式上的限制,凡是利用本实施例的技术方案,包括对本实施例做了简单的变化,均属于本发明保护的范围。
40.双信号探针,uio@mb既作为捕获载体又作为信号指示剂,无需抗体标记;通过引入al
3
激发uio@mb的高强度荧光响应实现双信号识别。具体的,uio@mb的平均粒径为200nm。
41.详细的,uio@mb的制备方法包括:
42.(1)制备uio:将1.2mmol zrcl4溶解在30ml n,n'-甲基甲酰胺(dmf)中,然后加入2ml hcl进行超声处理直至完全溶解。然后,在上述溶液中加入1.5mmol 2,5-二羟基对苯二甲酸,超声溶液处理10min。将混合物转移到不锈钢teflon内衬高压釜中,并在80℃下加热12h。自然冷却至室温后,离心(10375
×
g,5min)收集黄色沉淀,用dmf和乙醇洗涤3次。最后在60℃真空干燥,研磨成粉末,干燥备用。
43.(2)制备uio@mb:将uio和亚甲基蓝(mb)加入10ml超纯水中,剧烈搅拌 16h。离心
(10375
×
g,5min)后弃去上清液,然后用磷酸缓冲盐溶液(pbs)洗涤沉淀物数次以去除物理吸附的mb。最后,将合成的uio@mb分散在10ml超纯水中并在4℃下储存。
44.进一步的,步骤(2)中,uio和mb的质量比为8:1,且mb的吸收容量计算为 2.28
×
10
16
molecules/mg uio。
45.本发明所述的双信号探针用于制备生物检测试纸条的应用,免疫层析试纸条,原则上,在检测线上包覆何种抗体,就可以对应检测其抗原,只要抗原能够被本发明的双信号探针孵育就可以。作为一种广泛适用性双信号探针,除了能特异性检测大肠杆菌外,还可以特异性检测与包覆抗体对应的各种致病菌,例如沙门氏菌、志贺氏菌、李斯特氏菌等。
46.具体的,试纸条包含衬板,衬板上贴有硝酸纤维素膜,硝酸纤维素膜的一端覆盖吸水垫,硝酸纤维素膜的另一端依次覆盖样品垫和结合垫,硝酸纤维素膜的非覆盖面上沿横向设置检测线,结合垫和样品垫用封闭液封闭处理。试纸条的检测线包被有大肠杆菌单克隆抗体,且试纸条上无质控线。检测线包被有大肠杆菌单克隆抗体的制备方法包括:大肠杆菌单克隆抗体溶于包被液配制成1mg/ml的抗体包被溶液,将抗体包被溶液以 0.8μl/cm的速率包被到硝酸纤维素膜的检测线上,然后在室温下干燥2h。
47.双信号探针用于检测饮用水或卷心菜中的大肠杆菌的应用。检测大肠杆菌的试纸条用于检测饮用水或卷心菜中的大肠杆菌的应用。
48.结合图1,在本发明中,单克隆抗体选用e.colio157:h7单克隆抗体(mab),最终包被在试纸条t线上特异性识别e.colio157:h7。单克隆抗体是由单一b细胞克隆产生的高度均一、仅针对某一特定抗原表位的抗体。通常采用杂交瘤技术来制备,杂交瘤抗体技术是在细胞融合技术的基础上,将具有分泌特异性抗体能力的致敏b细胞和具有无限繁殖能力的骨髓瘤细胞融合为b细胞杂交瘤。用具备这种特性的单个杂交瘤细胞培养成细胞群,可制备针对一种抗原表位的特异性抗体,即单克隆抗体。
49.图1中的a,本发明基于亚甲基蓝嵌入锆基金属-有机骨架制备新型双信号探针 uio@mb。进一步在uio@mb中添加al
3
,呈现出强烈的黄绿色荧光响应,从而提供了具有优异光学和荧光特性的蓝色双信号探针。与其他常规探针相比,uio@mb信号探针具有较强的细菌吸附能力,可直接形成uio@mb-细菌结合物,避免了传统探针抗体和信号载体之间复杂的交联过程,从而显著保留了抗体的生物活性,并增强了检测的灵敏度。
50.得到新型的定向探针,再制备出免疫层析试纸条。见图1中的b和c,试纸条由五部分构成,依次将硝酸纤维素膜、结合垫、样品垫和吸收垫粘在衬板上,其中硝酸纤维素上划线包被有e.colio157:h7的单克隆抗体做检测线。
51.该试纸条的工作原理为:基于直接检测原理,使用uio@mb作为标记探针,在与 e.colio157:h7的共孵育过程中,uio@mb被大量吸附在细菌表面。将 uio@mb-ldicts的样品垫浸入混合物中,uio@mb-细菌结合物立即通过毛细作用向t线迁移。对于阳性样品,uio@mb-细菌结合物被包被在t线的特异性检测mab 捕获,在可见光下观察到的蓝色条带。随着结合物的不断积累,颜色逐渐加深。随后,将完全干燥的用于比色分析的uio@mb-ldicts浸入al
3
溶液中,激发uio@mb的荧光信号,通过分析t-line的黄绿色荧光强度,实现e.colio157:h7的双信号检测。相比之下,阴性样本在t线上没有条带。本发明的免疫分析仅使用一种抗体,打破了同时采用测试抗体和捕获抗体的夹心试纸条的形式,大大降低了成本并实现高度灵敏的检测。
52.为了获得最佳的测定性能,发明人优化了uio的浓度,mb和uio的结合时间,新型双信号探针uio@mb的体积,探针和待测样品的孵育时间以及免疫层析分析的时间。最终制得的试纸条用于检测食品中的e.colio157:h7,该方法已成功应用于饮用水和卷心菜中e.colio157:h7的检测,验证了其实用性,灵敏性和准确性。
53.实施例1:新型双信号探针uio@mb的制备方法
54.见图1a,基于亚甲基蓝嵌入锆基金属-有机骨架的双信号探针采用改进的溶剂热法合成。具体步骤如下:
55.(1)制备uio:将1.2mmol zrcl4溶解在30ml n,n'-甲基甲酰胺(dmf)中,然后加入2ml hcl进行超声处理直至完全溶解。然后,在上述溶液中加入1.5mmol 2,5-二羟基对苯二甲酸,超声溶液处理10min。将混合物转移到不锈钢teflon内衬高压釜中,并在80℃下加热12h。自然冷却至室温后,离心(10375
×
g,5min)收集黄色沉淀,用dmf和乙醇洗涤3次。最后在60℃真空干燥,研磨成粉末,干燥备用。
56.(2)制备uio@mb:将80mguio和10mg亚甲基蓝(mb)加入10ml超纯水中,剧烈搅拌16h。离心(10375
×
g,5min)后弃去上清液,然后用磷酸缓冲盐溶液(pbs) 洗涤沉淀物数次以去除物理吸附的mb。最后,将合成的uio@mb分散在10ml超纯水中并在4℃下储存。
57.双信号探针uio@mb材料表征:
58.见图2a,扫描电子显微镜表明,uio@mb的平均粒径约为200nm,具有特征性的立方密堆积结构和对称形态。
59.见图2b和2c,n2吸附-解吸分析再次证实了uio中引入了mb。显然,原始uio 符合i型吸附等温线,表明存在微孔结构。与uio相比,uio@mb的 brunauer-emmett-teller表面积从424.67cm3/g减小到24.15cm3/g,孔径从0.175cm3/g 减小到0.093cm3/g,但孔径尺寸分布几乎保持不变,表明mb分子稳定封装在uio 中。
60.见图2d,uio@mb的傅里叶变换红外光谱(ft-ir)进一步证明mb被封装在 uio中。zr-o键的特征吸收信号出现在789、665和559cm-1
附近,1450-1550cm-1
附近的带可归因于苯环的伸缩振动,而在1599cm-1
和1387cm-1
附近的特征吸收峰被鉴定为与金属中心o-配位的对称和不对称的去质子化羧酸(coo-)。然而,与uio的 ft-ir光谱相比,uio@mb的光谱中coo-特征峰的位置出现了一定的红移,这可能归因于静电相互作用、氢键相互作用和π-π*堆叠。因此,上述分析表明成功合成了具有丰富羧基和氨基的uio@mb。
61.见图2e,紫外-可见吸收光谱(uv-vis)证实uio@mb具有uio和mb的光学特性。uio的特征吸收峰出现在365nm处,而mb的特征吸收峰出现在292和664nm 处,表明mb分子被包裹在uio中。在自然光下,uio溶液呈现黄色,而uio@mb 呈现更接近mb的蓝色。
62.见图2f,uio@mb与al
3
反应后的荧光光谱表明它在493nm处具有非凡的荧光性质(黄绿色)。
63.见图2g和2h,通过x射线衍射(xrd)和x射线光电子能谱(xps)分析了uio@mb 的结构。在xrd图中(图2g),uio和uio@mb的所有衍射峰与文献报道的一致,表明其晶体和拓扑结构uio没有被mb分子的包封破坏。xps分析结果如图2h所示,证实uio@mb的同源光电子峰为zr 3d(183.2ev)、c 1s(285.3ev)、o 1s(532.7ev) 和n1s(399.5ev)。
64.从图2i中可以看出,uio、mb和uio@mb的zeta电位分别为-5.68、2.19和
ꢀ‑
2.67mv,这证明带正电荷的mb通过静电力加载到带负电荷的uio周围,表明 uio@mb的成功合成。
65.双信号探针uio@mb显色效率优化:
66.通过调整mb在uio上的吸附时间,优化uio@mb探针的显色效率。见图3a, mb浓度与uv-vis吸光度之间拟合的标准曲线。见图3b,上清液中mb的量在搅拌16 h后达到最低程度,几乎不再下降。因此,设mb对uio的反应时间为16h,并计算 mb的吸附量为2.28
×
10
16
分子/mg uio。
67.实施例2:快速检测大肠杆菌o157:h7的高灵敏度免疫层析试纸条的制备
68.见图1c,本实施例给出了快速检测大肠杆菌o157:h7的高灵敏度免疫层析试纸条,包括衬板,衬板上贴有硝酸纤维素膜,硝酸纤维素膜的一端覆盖吸水垫,硝酸纤维素膜的另一端依次覆盖样品垫和结合垫,硝酸纤维素膜的非覆盖面上沿横向设置检测线和控制线,结合垫及样品垫用封闭液封闭处理。
69.(1)硝酸纤维素膜的制备
70.检测线的包被:将e.colio157:h7单克隆抗体溶于包被液配制成1mg/ml的溶液;用划线方式将包被液以0.8μl/cm的速度横向包被于距硝酸纤维素膜上沿40mm的位置 (即检测线上),然后于37℃条件下干燥30分钟。所述的包被液为:0.02g叠氮化钠, 0.8g氯化钠,0.29g十二水磷酸氢二钠,0.02g氯化钾,磷酸二氢钾0.02g加水定容至 100ml所得。
71.样品垫与结合垫的制备方法包括:将玻璃纤维膜放入封闭液中浸湿,于36~37℃条件下干燥8~10小时。具体为:
72.样品垫的制备:将玻璃纤维膜剪裁成长15mm宽3mm的规格,放入封闭液(2% bsa)中浸湿,于37℃条件下干燥8h,得样品垫,然后置4℃冰箱中保存。
73.结合垫的制备:将玻璃纤维膜剪裁成长8mm宽3mm的规格,放入封闭液(2%bsa) 中浸湿,取出,于37℃条件下干燥8h,得样品垫,然后置4℃冰箱中保存。
74.将吸水纸剪裁成长18mm宽3mm的规格,即得吸水垫。
75.(5)所述的微生物培养为:大肠杆菌o157:h7活化后分别接种于lb培养基,静置37℃培养24小时;挑取单菌落接种于250ml lb肉汤培养基中,150r/min摇床37℃培养24小时;将菌液以4000r/min离心15分钟,收集菌体;分别用浓度为0.01mol/l 的磷酸盐缓冲溶液(ph=7.4)洗涤菌体3次,以10ml的磷酸盐缓冲溶液(0.01mol/l) 重悬;加0.5%福尔马林溶液,室温下放置24小时灭活;灭活结束后,分别用0.01mol/l 的磷酸盐缓冲溶液洗涤3次后,用0.01mol/l的pbs调节大肠杆菌o157:h7的浓度为 107cfu/ml,于-20℃保存备用。
76.(6)试纸条的组装:首先将硝酸纤维素膜贴附于衬板上,然后样品垫压住结合垫1-3mm,结合垫压硝酸纤维素膜1-3mm,吸水垫压硝酸纤维素膜1-3mm依次贴附于衬板上,即得快速检测大肠杆菌o157:h7的免疫层析试纸条。
77.实施例3:快速检测大肠杆菌o157:h7的试纸条检测条件的优化
78.为提高大肠杆菌o157:h7定量检测的性能,优化了试纸条检测的相关参数。
79.见图4a,随着uio浓度的增加,t线强度逐渐增加,在uio浓度为8mg/ml时达到峰值。可能过量的uio@mb-bacteria容易积聚和沉淀,导致样品溶液色谱移动困难。因此,uio的最佳浓度为8mg/ml。
80.将不同体积(1.25、2.5、5、10和20μl)的uio@mb探针分别分散在100μl 10
7 cfu/ml的大肠杆菌o157:h7悬浮液中,评价t信号强度。见图4b,t线信号随着探针体积的增加而增强,在10μl时达到最大值。这说明探针与细菌的结合趋于饱和,探针过多导致背景色明显。
因此,选择10μl探针作为最佳条件。
81.优化uio@mb探针与大肠杆菌o157:h7的孵育时间,扩大联用效果。见图4c,吸附剂与细菌之间的反应时间过长,可能会导致共轭物下沉,从而使样品溶液难以通过色谱。综合考虑后,选择15min为最佳孵育时间。
82.见图4d,t线响应在20min达到最高,说明反应已经达到饱和。长时间的反应会造成严重的背景干扰颜色。因此,最终将20min定义为免疫反应时间。
83.实施例4:快速检测大肠杆菌o157:h7的试纸条的灵敏度测定
84.检测过程:将100μl不同浓度(0至107cfu/ml)的大肠杆菌o157:h7分别与 10μl uio@mb(8mg/ml)孵育20分钟。再逐滴加入试纸条的样品垫,同时取100μl 0.01m磷酸盐缓冲液作为阴性对照液,操作与上述相同,逐滴加入另一试纸条的样品垫,20分钟后读取结果。为了进一步获得荧光检测信号,将之前用于比色分析的 uio@mb-ldlfa在室温下干燥,并将样品垫浸入200μl alcl3(1mg/ml)溶液中,直到试纸条自然干燥。然后在暗室中用365nm紫外光源读取检测结果。
85.检测结果:(1)阳性:当试纸条的检测线在可见光下显示出蓝色线条带以及经过 al
3
激发后在紫外光下显示为黄绿色荧光条带时,判为阳性,表明待测样品中的大肠杆菌o157:h7的浓度高于或等于103cfu/ml。(2)阴性:当试纸条的检测线在可见光和紫外光下观察不到颜色时,判为阴性,表明待测样品中的大肠杆菌o157:h7低于10
3 cfu/ml。
86.见图5a,随着大肠杆菌o157:h7浓度的降低,试纸条t线在可见光下的信号强度越来越弱,当浓度降低为102cfu/ml时,t线消失不见,因此,本发明的试纸条比色信号可以检测到大肠杆菌o157:h7的最低浓度为103cfu/ml。图5d,并且检测结果在 107~103cfu/ml范围内具有良好的线性关系,回归方程为y=2148.01x-5648.56(x=log [大肠杆菌o157:h7的浓度]),具有良好的拟合关系(相关系数(r2)=0.991)。
[0087]
见图5b,随着大肠杆菌o157:h7浓度的降低,试纸条t线在紫外光下的信号强度越来越弱,当浓度降低为102cfu/ml时,t线消失不见,因此,本发明的试纸条荧光信号可以检测到大肠杆菌o157:h7的最低浓度为103cfu/ml。图5e,并且检测结果在 107~103cfu/ml范围内具有良好的线性关系,回归方程为y=676.33x-1489.86(x=log [大肠杆菌o157:h7的浓度]),具有良好的拟合关系(相关系数(r2)=0.994)。
[0088]
见图5c,传统胶体金标准曲线检测大肠杆菌o157:h7的灵敏度为105cfu/ml。 uio@mb-ldicts是传统胶体金免疫层析试纸条灵敏度的100倍。图5f,传统胶体金标准曲线,因此,该方法能高灵敏度检测大肠杆菌o157:h7,可作为通用方法快速、便捷检测食品中致病菌的残留。
[0089]
实施例5:快速检测大肠杆菌o157:h7的试纸条的特异性测定
[0090]
本实施例的检测过程为:分别将大肠杆菌、金黄色葡萄球菌、肠炎沙门氏菌、鼠伤寒沙门氏菌、单核细胞增生李斯特菌、空肠弯曲杆菌、蜡样芽孢杆菌和副溶血性弧菌的菌液用0.01m磷酸盐缓冲液稀释成107cfu/ml的浓度,每种菌分别取100μl作为检测液,与10μl uio@mb(8mg/ml)孵育20分钟,再逐滴加入试纸条的样品垫,同时取100μl 0.01m磷酸盐缓冲液作为阴性对照液,操作与上述相同,逐滴加入另一试纸条的样品垫,20分钟后读取结果。为了进一步获得荧光检测信号,将之前用于比色分析的uio@mb-ldlfa在室温下干燥,并将样品垫浸入200μl alcl3(1mg/ml)溶液中,直到试纸条自然干燥。然后在暗室中用365nm紫
外光源读取检测结果。
[0091]
检测结果:(1)阳性:当试纸条的检测线在可见光下显示出蓝色线条带以及经过 al
3
激发后在紫外光下显示为黄绿色荧光条带时,判为阳性。(2)阴性:当试纸条的检测线在可见光和紫外光下观察不到颜色时,判为阴性。
[0092]
见图6,字母a-j分别表示107cfu/ml的不同的菌种,依次为大肠杆菌o157:h7、大肠杆菌、金黄色葡萄球菌、肠炎沙门氏菌、鼠伤寒沙门氏菌、单核细胞增生李斯特菌、空肠弯曲杆菌、蜡样芽孢杆菌、副溶血性弧菌和阴性对照(0.01m磷酸盐缓冲液)。除了检测大肠杆菌o157:h7的试纸条t线在可见光下呈现明亮的蓝色,紫外光下呈现黄绿色荧光外,检测其他细菌的试纸条t线都没有颜色,说明该发明能高度特异性识别大肠杆菌o157:h7,有特别高的特异性。
[0093]
实施例6:快速检测大肠杆菌o157:h7的试纸条的应用
[0094]
本实施例评价了快速检测大肠杆菌o157:h7的免疫层析试纸条的性能。检测过程为:首先,将5g压碎的卷心菜样品与50ml pbs在烧瓶中混合。超声5分钟和剧烈摇动30分钟后,将混合物在4℃下孵育过夜,然后通过离心(5840
×
g,10分钟)收集上清液。之后,饮用水和卷心菜上清液经过高温灭菌和过滤(0.22μm无菌过滤器)。
[0095]
将上述处理好的实际样品溶液,通过平板计数法确认每个样品的无菌状态,然后加入不同浓度的大肠杆菌o157:h7(0-107cfu/ml)。各浓度分别取100μl溶液作为检测液,与10μl uio@mb(8mg/ml)孵育20分钟后,再逐滴加入试纸条的样品垫,同时取100μl的无菌饮用水和卷心菜提取液作为阴性对照液,操作与上述相同,逐滴加入另一试纸条的样品垫,20分钟后读取结果。为了进一步获得荧光检测信号,将之前用于比色分析的uio@mb-ldlfa在室温下干燥,并将样品垫浸入200μl alcl3(1 mg/ml)溶液中,直到试纸条自然干燥。然后在暗室中用365nm紫外光源读取检测结果。
[0096]
检测结果:(1)阳性:当试纸条的检测线在可见光下显示出蓝色线条带以及经过 al
3
激发后在紫外光下显示为黄绿色荧光条带时,判为阳性,表明待测样品中的大肠杆菌o157:h7的浓度高于或等于103cfu/ml。(2)阴性:当试纸条的检测线在可见光和紫外光下观察不到颜色时,判为阴性,表明待测样品中的大肠杆菌o157:h7低于10
3 cfu/ml。
[0097]
见图7a,对于饮用水样品而言,随着大肠杆菌o157:h7浓度的降低,试纸条t线在可见光下和紫外光下的信号强度越来越弱,当浓度降低为102cfu/ml时,t线消失不见,因此,本发明的试纸条比色和荧光信号可以检测到大肠杆菌o157:h7的最低浓度为103cfu/ml。
[0098]
见图7b,对于卷心菜样品而言,随着大肠杆菌o157:h7浓度的降低,试纸条t线在可见光和紫外光下的信号强度越来越弱,当浓度分别降低为103cfu/ml(可见光) 102cfu/ml(紫外光)时,t线消失不见,因此,本发明的试纸条可以检测到大肠杆菌 o157:h7的最低浓度为104cfu/ml(比色)和103cfu/ml(荧光),反映了其良好的实际应用价值。
[0099]
以上结合附图详细描述了本公开的优选实施方式,但是,本公开并不限于上述实施方式中的具体细节,在本公开的技术构思范围内,可以对本公开的技术方案进行多种简单变型,这些简单变型均属于本公开的保护范围。
[0100]
另外需要说明的是,在上述具体实施方式中所描述的各个具体技术特征,在不矛盾的情况下,可以通过任何合适的方式进行组合,为了避免不必要的重复,本公开对各种可能的组合方式不再另行说明。
[0101]
此外,本公开的各种不同的实施方式之间也可以进行任意组合,只要其不违背本公开的思想,其同样应当视为本公开所公开的内容。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。