雄黄微生物浸出液在制备降低蛋白激酶b磷酸化水平药物中的应用
技术领域
1.本发明属于生物医药领域,涉及一种雄黄微生物浸出液的新用途,具体涉及一种雄黄微生物浸出液在制备降低蛋白激酶b磷酸化水平的药物中的应用。
背景技术:
2.蛋白激酶b,又称为akt,是一种分子量约为60kda的丝/苏氨酸蛋白激酶,akt可分为3种亚型(akt1、akt2、akt3),3种亚型的功能各异,但也有重叠。akt1广泛地分布在组织中,akt2主要分布在肌肉和脂肪细胞中,而akt3则在睾丸和大脑中表达。akt调控多个生物过程,包括细胞存活、增殖、生长和糖原代谢,已经发现akt信号通路与糖尿病、癌症等疾病的发生发展密切相关。
3.蛋白质磷酸化是调节和控制蛋白质活力和功能的最基本、最普遍,也是最重要的机制。蛋白质磷酸化主要发生在两种氨基酸上,一种是丝氨酸(包括苏氨酸),另一种是酪氨酸。丝氨酸磷酸化的主要作用是变构蛋白质以激活蛋白质的活力,主要是指酶活力。因此药物通过降低akt信号通路中akt的磷酸化水平可以反应出药物对糖尿病、癌症等疾病产生影响,进而可以认为其具有治疗糖尿病、癌症等疾病的潜力。
4.本发明意外发现雄黄微生物浸出液(rts)可以高效降低akt的磷酸化水平,能够用于糖尿病和癌症的治疗。
技术实现要素:
5.本发明的目的在于发现一种雄黄微生物浸出液的新用途。具体是雄黄微生物浸出液在制备降低蛋白激酶b磷酸化(p-akt)水平药物中的应用。进一步的,所述降低蛋白激酶b磷酸化(p-akt)水平的药物为治疗糖尿病或癌症的药物。
6.本发明的另一个目的是提供一种雄黄微生物浸出液(rts),所述雄黄微生物浸出液通过以下制备方法获得:
7.将雄黄粉末和氧化亚铁硫杆菌液分别加入到浸出培养基中,雄黄粉末和氧化亚铁硫杆菌液质量体积比为1:10,浸出培养基与氧化亚铁硫杆菌液体积比为1000:9000,于30℃恒温振荡浸出25-30天,转速150-200rpm,浸出后去除浸出液中的菌体,得到雄黄微生物浸出液。
8.优选的,所述浸出培养基为1k液体培养基(g/l):(nh4)2so43.0g,k2hpo40.5g,kcl 0.1g,mgso4·
7h2o 0.5g,ca(no3)20.01g,feso4·
7h2o 4.98g,用蒸馏水定容至1l。
9.优选的,所述去除浸出液中的菌体的方法是过滤除菌或离心除菌。
10.优选的,所述氧化亚铁硫杆菌液浓度为3
×
107个/ml。
11.另外上述所用到的氧化亚铁硫杆菌也可以为驯化的氧化亚铁硫杆菌。
12.所述驯化的氧化亚铁硫杆菌驯化流程为:取氧化亚铁硫杆菌,用200μg亚砷酸钠/100ml 9k培养基、400μg亚砷酸钠/100ml 9k培养基、600μg亚砷酸钠/100ml 9k培养基、800μ
g亚砷酸钠/100ml 9k培养基、1600μg亚砷酸钠/100ml 9k培养基梯度驯化,然后再取0.1g雄黄/100ml9k培养基、0.2g雄黄/100ml 9k培养基、0.3g雄黄/100ml9k培养基、0.5g雄黄/100ml 9k培养基、1.0g雄黄/100ml 9k培养基梯度驯化氧化亚铁硫杆菌,上述驯化流程每步5天,共50天后得驯化的氧化亚铁硫杆菌。
13.本发明的有益效果是:雄黄微生物浸出液可以明显降低细胞中蛋白激酶b的磷酸化水平,能够用于糖尿病和癌症的治疗。
附图说明
14.图1不同砷浓度的rts对p-akt/akt含量的影响。a为蛋白印迹结果,b为蛋白印迹结果统计,ck为对照组,*表示与对照组(rts的浓度为0μg/ml)相比具有显著性差异(p《0.05)。
具体实施方式
15.为进一步理解本发明,下面结合具体实例,对本发明实施例中的技术方案进行完整、清楚的描述,但是下述实施例并不限定本发明的保护范围。
16.下列实施例中未注明具体条件的实验方法,通常按照常规条件,所用的试剂均可以在市场上购买。
17.1.生物材料
18.氧化亚铁硫杆菌(thiobacillusferrooxidans by3)于2003年9月22日保藏于中国典型培养物保藏中心,保藏编号:cctcc no:m 203071,保藏名称:氧化亚铁硫杆菌(thiobacillus ferrooxidans by3),保藏单位地址:中国武汉武汉大学。
19.结肠癌细胞sw480(k-ras突变型)购自上海奥陆生物科技有限公司。
20.2.药品
21.9k液体培养基(g/l):(nh4)2so43.0g,k2hpo40.5g,kcl 0.1g,mgso4·
7h2o 0.5g,ca(no3)20.01g,feso4·
7h2o 44.78g,用蒸馏水定容至1l。
22.1k液体培养基(g/l):(nh4)2so43.0g,k2hpo40.5g,kcl 0.1g,mgso4·
7h2o 0.5g,ca(no3)20.01g,feso4·
7h2o 4.98g,用蒸馏水定容至1l。
23.实施例1雄黄微生物浸出液的制备
24.雄黄微生物浸出液可以直接由保藏的氧化亚铁硫杆菌浸出得到,也可以由驯化后的氧化亚铁硫杆菌浸出得到。
25.氧化亚铁硫杆菌驯化流程为:取氧化亚铁硫杆菌,用200μg亚砷酸钠/100ml 9k培养基、400μg亚砷酸钠/100ml 9k培养基、600μg亚砷酸钠/100ml 9k培养基、800μg亚砷酸钠/100ml9k培养基、1600μg亚砷酸钠/100ml 9k培养基梯度驯化,然后再取0.1g雄黄/100ml 9k培养基、0.2g雄黄/100ml 9k培养基、0.3g雄黄/100ml9k培养基、0.5g雄黄/100ml 9k培养基、1.0g雄黄/100ml 9k培养基梯度驯化氧化亚铁硫杆菌,上述驯化流程每步5天,共50天后得驯化氧化亚铁硫杆菌。
26.将雄黄粉末和驯化后的氧化亚铁硫杆菌液分别加入到1k液体培养基中,雄黄粉末和氧化亚铁硫杆菌液质量体积比为1:10,浸出培养基与氧化亚铁硫杆菌液体积比为1000:9000,氧化亚铁硫杆菌液浓度为3
×
107个/ml,于30℃恒温振荡浸出25-30天,转速150-200rpm,浸出后过滤除菌,得到雄黄微生物浸出液。
27.雄黄微生物浸出液中砷含量为最重要的质量标准,在实施例2、实施例3中,雄黄微生物浸出液浓度皆为砷含量,砷含量采用毛细管电泳间接紫外检测方法进行测定。
28.实施例2雄黄微生物浸出液对p-akt/akt含量的影响
29.1.细胞培养:用rpmi1640培养基,加10%胎牛血清、青霉素100u/ml、链霉素100u/ml,置37℃、5%co2条件下培养。每1天换一次培养液。
30.2.免疫蛋白印迹实验
31.(1)蛋白样品的制备。
32.sw480细胞培养在10%胎牛血清、青霉素链霉素各含100u/ml的rpmi 1640培养液中,培养至对数生长期后将细胞铺于六孔板,孵育4h,对上述实施例1制得的rts进行稀释,使其砷浓度为0.625μg/ml(1/4ic50),1.25μg/ml(1/2ic50)后加样,对照组不加药,只加培养基,加药完成后摇匀,培养。培养48h之后收取细胞,各组细胞加ripa裂解液,于冰上裂解30rnin,13000rpm离心后弃沉淀。
33.(2)sds-page分离蛋白。
34.将上述提取的蛋白进行sds-page的分离,蛋白上样量设为每孔30μg。上样前将每组样品与loadingbuffer混匀,100℃热变性10min。sds-page采用5%浓缩胶,10%分离胶,以浓缩胶80v,分离胶120v进行蛋白电泳实验。
35.(3)转膜。
36.根据sds-page凝胶的大小剪取合适大小的pvdf膜和4张滤纸,将滤纸和纤维垫浸泡至转印缓冲液进行活化。按照说明书,将pvdf膜先放入甲醇中15s至膜变为半透明状,然后放入已备好的转印缓冲液中。按照2层纤维垫、2层滤纸、pvdf膜、凝胶、2层滤纸、2层纤维垫的顺序,制作好转印“三明治”结构,然后装入转印电泳槽进行转印。转印条件采用恒压100v 2h。
37.(4)免疫结合。
38.用tbst配制5%的脱脂奶粉作为封闭液,将膜浸入封闭液,室温封闭2h。以封闭液为稀释剂,按1:1000的比例稀释bcr-abl、β-actin抗体,据marker标示的位置,将膜剪开,分别孵育bcr-abl、β-actin抗体,4℃孵育过夜,用tbst洗膜三次,每次10min。用封闭液按1:5000的比例稀释羊抗兔和羊抗鼠hrp-igg抗体,放入膜,室温孵育2h,用tbst洗膜,洗三次,每次10min。
39.(5)化学曝光法检测。
40.将配制好的显色液均匀滴加于pvdf膜表面,于化学发光系统进行曝光并拍照保存。
41.结果与结论:如图1所示rts对akt的磷酸化水平产生较大影响,在rts的浓度为1/2ic50(1.250μg/ml)时,p-akt含量显著降低(p《0.05),而akt含量变化不大。说明rts可以降低细胞中akt的磷酸化水平,能够应用于制备降低蛋白激酶b磷酸化水平的药物。
42.实施例3雄黄微生物浸出液对结肠癌细胞sw480的作用
43.1.细胞培养:用rpmi1640培养基,加10%胎牛血清、青霉素100u/ml、链霉素100u/ml,置37℃、5%co2条件下培养。每1天换一次培养液。
44.2.annexin v-fitc/pi双染实验检测细胞凋亡
45.sw480细胞培养在10%胎牛血清、青霉素链霉素各含100u/ml的rpmi1640培养液
中,培养至对数生长期后将细胞铺于六孔板,孵育4h,对上述实施例1制得的rts进行稀释,使其砷浓度为0.625μg/ml(1/4ic50),1.25μg/ml(1/2ic50)后加样,对照组不加药,只加培养基,加药完成后摇匀,培养。培养48h之后收取细胞,使用bd双染试剂盒染色,pbs洗3遍细胞,进行流式细胞仪分析。
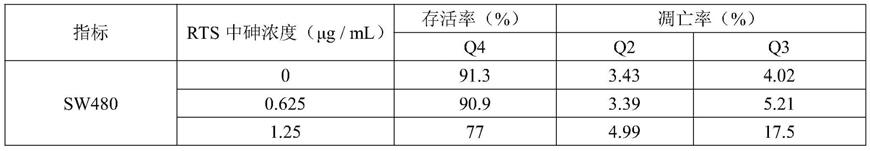
46.结果与结论:表1实验结果显示当rts浓度为1/4ic50(0.625μg/ml)时,对sw480细胞的凋亡影响较小;而当浓度上升至1/2ic50(1.250μg/ml)时,对sw480细胞的凋亡影响开始增大,与对照组差异显著(p《0.05)。整体实验对比中,sw480细胞的凋亡率与所用rts的浓度呈正相关。推断出rts可以促进结肠癌细胞的凋亡。
47.表1不同砷浓度的rts对sw480细胞凋亡的影响
[0048][0049]
以上详细描述了本发明的基本原理、主要特征和本发明的优点,应当指出,以上具体实施例只是作为范例,本发明并不等同于以上描述的具体实施例。对于本领域的普通技术人员而言,在不脱离本发明的原理和精神的情况下可以对本发明进行若干修饰和改进,这些改进和修饰也应视为本发明的保护范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。