1.本发明涉及生物技术领域,具体涉及一种使用专属性肽段组鉴别三文鱼的方法。
背景技术:
2.三文鱼(鲑科,salmonidae)肉质鲜美,富含dha、epa和虾青素等生物活性物质,深受广大消费者喜爱。三文鱼是鲑科鱼类的商品名,属硬骨鱼纲、鲑形目、鲑属,最常见的是鲑鱼(大西洋鲑鱼、太平洋鲑鱼、银鲑)和鳟鱼(虹鳟、金鳟)。其中,大西洋鲑鱼(salmo salar)被视为品质最好,多进口于挪威、丹麦、智利等高纬度海洋寒冷区域。太平洋鲑鱼(oncorhynchus keta)洄游进入我国黑龙江、图们江等水域,乌苏里江较多。同为太平洋鲑鱼属(oncorhynchus)的虹鳟鱼原产于北美洲的太平洋沿海,我国于1959年引进,现在是我国主要的淡水养殖鱼类之一。相较于大西洋鲑鱼,太平洋鲑鱼和虹鳟鱼口感较差,生产成本及营养价值较低,但消费者仅凭鱼肉外观很难辨别。受利益驱使,不法商家用廉价的太平洋鲑鱼和虹鳟鱼冒充大西洋鲑鱼,这些欺诈行为不仅危害水产品行业的公信度外,还损害了三文鱼产品质量诚信度和消费者利益。因此,有必要对三文鱼的物种进行鉴定。
3.目前三文鱼物种鉴别技术主要是基于dna的分子生物学技术和蛋白质组学技术。其中,以pca为主的dna检测技术,操作步骤繁琐,耗时长。
技术实现要素:
4.据此,本发明提供了一种使用专属性肽段组鉴别三文鱼的方法,该方法采用特征多肽的方法鉴别不同三文鱼种属,不受蛋白稳定性和深加工技术的影响,是一种能高效准确鉴别三文鱼种属的方法。
5.本发明首先涉及一组特征肽段在鉴定鲑科(salmonidae)鱼类亚种中的应用,
6.所述的鲑科鱼类亚种为:大西洋鲑鱼(salmo salar)、太平洋鲑鱼(oncorhynchus keta)和虹鳟鱼(oncorhynchus mykiss);
7.具体的,所述的特征肽段为:
8.(1)来自大西洋鲑鱼(salmo salar)的如下蛋白的特征肽段:
9.序列如seq id no.1所示的肽段来自于,蛋白glycogen phosphorylase,muscle form(gi|213515556);
10.序列如seq id no.2所示的肽段来自于,蛋白myosin-binding protein c,fast-type-like(gi|929275161);
11.序列如seq id no.3所示的肽段来自于,蛋白sarcoplasmic/endoplasmic reticulum calcium atpase 1isoform x2(gi|929274646);
12.序列如seq id no.4所示的肽段来自于,蛋白myosin,light polypeptide 3-1(gi|213514656);
13.序列如seq id no.5所示的肽段来自于,蛋白phosphoglycerate kinase(gi|929235375);
14.序列如seq id no.6所示的肽段来自于,蛋白myosin binding protein h-like(gi|213511568);
15.序列如seq id no.7所示的肽段来自于,蛋白sarcalumenin-like isoform x2(gi|929094737);
16.序列如seq id no.8所示的肽段来自于,蛋白l-lactate dehydrogenase a chain(gi|213510970);
17.序列如seq id no.9所示的肽段来自于,蛋白myoglobin(gi|221221136);
18.(2)来自大太平洋鲑鱼(oncorhynchus keta)的如下蛋白的特征肽段:
19.序列如seq id no.10所示的肽段来自于,蛋白triosephosphate isomerase b-like(gi|1695879275);
20.序列如seq id no.11所示的肽段来自于,蛋白myomesin-2-like isoform x2(gi|1695910459);
21.(3)来自虹鳟鱼(oncorhynchus mykiss)的如下蛋白的特征肽段:
22.序列如seq id no.12所示的肽段来自于,蛋白isocitrate dehydrogenase[nadp](gi|642108671);
[0023]
序列如seq id no.13所示的肽段来自于,蛋白myomesin-2-like isoform x2(gi|1211256714);
[0024]
序列如seq id no.14所示的肽段来自于,蛋白myomesin-2-like isoform x2(gi|1211256714);
[0025]
更具体的,所述各个特征肽段的质谱法检测的质荷比(m/z)数据为:
[0026]
seq id no.1所示特征肽段的质荷比(m/z)为582.266;
[0027]
seq id no.2所示特征肽段的质荷比(m/z)为617.856;
[0028]
seq id no.3所示特征肽段的质荷比(m/z)为934.439;
[0029]
seq id no.4所示特征肽段的质荷比(m/z)为803.441;
[0030]
seq id no.5所示特征肽段的质荷比(m/z)为991.462;
[0031]
seq id no.6所示特征肽段的质荷比(m/z)为541.263;
[0032]
seq id no.7所示特征肽段的质荷比(m/z)为772.894;
[0033]
seq id no.8所示特征肽段的质荷比(m/z)为492.956;
[0034]
seq id no.9所示特征肽段的质荷比(m/z)为548.299;
[0035]
seq id no.10所示特征肽段的质荷比(m/z)为620.326;
[0036]
seq id no.11所示特征肽段的质荷比(m/z)为706.430;
[0037]
seq id no.12所示特征肽段的质荷比(m/z)为466.254;
[0038]
seq id no.13所示特征肽段的质荷比(m/z)为746.412;
[0039]
seq id no.14所示特征肽段的质荷比(m/z)为591.275。
[0040]
本发明还涉及一种使用质谱检测方法,通过所述特征肽段,鉴定鲑科(salmonidae)鱼类亚种的方法,所述的鲑科鱼类亚种为:大西洋鲑鱼(salmo salar)、太平洋鲑鱼(oncorhynchus keta)和虹鳟鱼(oncorhynchus mykiss),其特征在于,所述的方法包括如下步骤:
[0041]
(1)样本预处理
[0042]
1)称取研磨成粉的待测鲑科鱼类样品,加入蛋白提取液(8m尿素和50mm nh4hco3)提取蛋白,高速低温离心,收集上清液;
[0043]
2)加入dtt(1mol/l)至上述蛋白上清液中,60℃反应1小时;
[0044]
3)取iaa(1mol/l)加入冷却到室温的上述溶液中,室温避光反应1小时;
[0045]
4)使用10kda分子量截留超滤离心管离心,取碳酸氢铵溶液重复冲洗膜上蛋白3次;
[0046]
5)取trypsin酶溶液加入上述蛋白溶液中,37℃酶解16小时;
[0047]
6)采用10kda分子量截留超滤离心管离心收集下层肽段滤液,待上机检测;
[0048]
(2)质谱检测,并将检测结果与seq id no.1~14的特征肽段的标准谱图进行匹配,从而得出待测样本的种属信息。
[0049]
所述的质谱检测的步骤为:
[0050]
1)采用ab sciex tripletof质谱系统,
[0051]
流动相a:0.1%甲酸-水,流动相b:0.1%甲酸-乙腈;
[0052]
流速0.25ml/min;
[0053]
洗脱梯度:0~2min,5%b;2~27min,5~20%b;27~37min,20~35%b;37~39min,35~80%b;39~42min,80%b;42~46min,5%b;
[0054]
tof扫描范围:350~1500da,正离子模式,gs1:35,gs2:45,curtain gas:35,isvf:5500,tem:500,dp:100,ce:10。
[0055]
或2)采用ab sciex 5500三重四极杆检测系统,
[0056]
流动相a:0.1%甲酸-水,流动相b:0.1%甲酸-乙腈;
[0057]
流速0.35ml/min;
[0058]
洗脱梯度:0~10min,10~10.5%b;10~10.5min,10.5~45%b;10.5~13min,45~95%b;13~13.1min,95~10%b;13.1~15min,10%;
[0059]
电喷雾离子源,正离子反应模式,检测方式:mrm,喷雾电压:5500v,离子传输管温度:575℃;雾化气压力:60psi,辅助加热气压力:50psi,气帘压力:35psi。
[0060]
本发明还涉及所述的特征肽段组在制备鉴定鲑科(salmonidae)鱼类亚种检测试剂盒中的应用,所述的特征肽段组为seq id no.1-14任一或任意组合后的组,优选的,所述的试剂盒是基于质谱检测的试剂盒。
附图说明
[0061]
图1,大西洋鲑鱼特征肽段seq id no.1veevdamdagk质谱图。
[0062]
图2,大西洋鲑鱼特征肽段seq id no.2iveapgppevvk质谱图。
[0063]
图3,大西洋鲑鱼特征肽段seq id no.3efddlpsfelqsdavr质谱图。
[0064]
图4,大西洋鲑鱼特征肽段seq id no.4aaapapapepevvaapppldlstvk质谱图。
[0065]
图5,大西洋鲑鱼特征肽段seq id no.5vlnnmeignslyddegak质谱图。
[0066]
图6,大西洋鲑鱼特征肽段seq id no.6tgdwfnilehyar质谱图。
[0067]
图7,大西洋鲑鱼特征肽段seq id no.7eeevedvlsnilr质谱图。
[0068]
图8,大西洋鲑鱼特征肽段seq id no.8lithvlvgepvgsr质谱图。
[0069]
图9,大西洋鲑鱼特征肽段seq id no.9lfaehpetltlfpk质谱图。
[0070]
图10,太平洋鲑鱼特征肽段seq id no.10ahvseavansvr质谱图。
[0071]
图11,太平洋鲑鱼特征肽段seq id no.11vgggtatltlpllak质谱图。
[0072]
图12,虹鳟鱼特征肽段seq id no.12atdfvvskpgtfk质谱图。
[0073]
图13,虹鳟鱼特征肽段seq id no.13daapavagapgapisvk质谱图。
[0074]
图14,虹鳟鱼特征肽段seq id no.14sageieeyqr质谱图。
[0075]
图15,随机选取的一个三文鱼样本的检测结果图。
[0076]
图1~15中,纵坐标为intensity(峰强度),单位cps(每秒的计数);横坐标为retention time(保留时间),单位为min(分钟)。
具体实施方式
[0077]
实施例1,三文鱼特征肽段的筛选
[0078]
1、dda采集和质谱库的建立
[0079]
三组三文鱼样本在95%的置信水平上共鉴定到912条蛋白质,13615条肽段,该搜库结果用于构建swath相对定量的质谱库。大西洋鲑鱼鉴定蛋白682条;太平洋鲑鱼鉴定蛋白549条;虹鳟鱼鉴定蛋白513条。其中,大西洋鲑鱼独有蛋白395条;太平洋鲑鱼独有蛋白269条;虹鳟鱼独有蛋白218条。
[0080]
2、swath数据采集
[0081]
使用peakview分析swath数据,查看独有蛋白对应肽段信息,重点关注每条多肽的提取离子流图、实际碎片与谱图碎片比对和肽段在样品中的丰度分布,筛选得到具有检测特异性的肽段。
[0082]
3、物种特征肽段的筛选
[0083]
基于上述备选肽段,在ncbi进行blastp检索,当肽段氨基酸序列100%匹配且具有唯一性时,则认为该肽段具有生物特异性。
[0084]
4、mrm方法优化及检测分析
[0085]
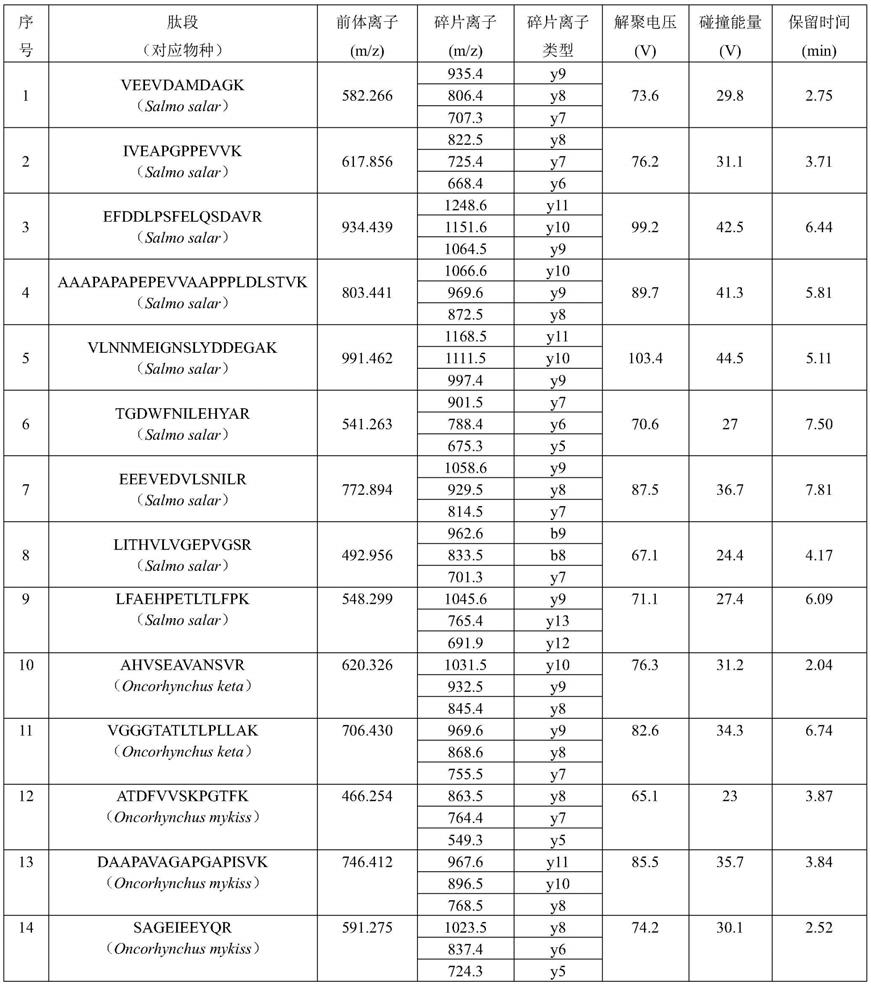
采用skyline计算肽段传输离子对,并根据谱图结果优化梯度洗脱程序。确定mrm采集方法的最佳目标肽段碰撞能量、解聚电压及保留时间等,建立实验室日常快速检测方法,见表1。
[0086]
表1特征肽段mrm质谱参数
[0087][0088]
实施例2,大西洋鲑鱼(salmo salar)特异性多肽的序列来源和比对信息
[0089]
经过质谱分析,多肽seq id no.1~9在大西洋鲑鱼(salmo salar)中有独立响应,且峰形好,强度高,在太平洋鲑鱼(oncorhynchus keta)和虹鳟鱼(oncorhynchus mykiss)中无响应。具体的:
[0090]
图1是多肽veevdamdagk在大西洋鲑鱼中的质谱图,其m/z为582.266。
[0091]
图2是多肽iveapgppevvk在大西洋鲑鱼中的质谱图,其m/z为617.856。
[0092]
图3是多肽efddlpsfelqsdavr在大西洋鲑鱼中的质谱图,其m/z为934.439。
[0093]
图4是多肽aaapapapepevvaapppldlstvk在大西洋鲑鱼中质谱图,其m/z为803.441。
[0094]
图5是多肽vlnnmeignslyddegak在大西洋鲑鱼中质谱图,其m/z为991.462。
[0095]
图6是多肽tgdwfnilehyar在大西洋鲑鱼中质谱图,其m/z为541.263。
[0096]
图7是多肽eeevedvlsnilr在大西洋鲑鱼中质谱图,其m/z为772.894。
[0097]
图8是多肽lithvlvgepvgsr在大西洋鲑鱼中质谱图,其m/z为492.956。
[0098]
图9是多肽lfaehpetltlfpk在大西洋鲑鱼中质谱图,其m/z为548.299。
[0099]
实施例3,太平洋鲑鱼(oncorhynchus keta)和虹鳟鱼(oncorhynchus mykiss)特异性多肽的序列来源和比对信息
[0100]
经过质谱分析,多肽seq id no.10~11在太平洋鲑鱼(oncorhynchus keta)中有独立响应,且峰形好,强度高,在大西洋鲑鱼(salmo salar)和虹鳟鱼(oncorhynchus mykiss)中无响应。具体得,
[0101]
图10是多肽ahvseavansvr在太平洋鲑鱼中质谱图,其m/z为620.326。
[0102]
图11是多肽vgggtatltlpllak在太平洋鲑鱼中质谱图,其m/z为706.430。
[0103]
经过质谱分析,多肽seq id no.12~14在虹鳟鱼(oncorhynchus mykiss)中有独立响应,且峰形好,强度高,在大西洋鲑鱼(salmo salar)和太平洋鲑鱼(oncorhynchus keta)中无响应。具体的,
[0104]
图12是多肽atdfvvskpgtfk在虹鳟鱼中质谱图,其m/z为466.254。
[0105]
图13是多肽daapavagapgapisvk在虹鳟鱼中质谱图,其m/z为746.412。
[0106]
图14是多肽sageieeyqr在虹鳟鱼中质谱图,其m/z为591.275。
[0107]
实施例4,三文鱼样本处理及检测步骤
[0108]
1、样本前处理步骤:
[0109]
(1)取2g待测样品,加入20ml蛋白提取液(8m尿素 50mm碳酸氢铵)垂直震荡,离心取上清得蛋白粗提液。
[0110]
(2)取400μl上清液,加入8μl ddt(二硫苏糖醇,dithiothreitol),在60℃下反应1h。
[0111]
(3)待温度降至室温后,加入40μl现配的iaa(碘代乙酰胺,iodoacetamide),室温避光反应1小时。
[0112]
(4)选用10kda截留超滤离心管,12000r/min离心20min。取nh4hco3溶液冲洗膜上蛋白,重复3次。
[0113]
(5)按照酶的质量酶/底物质量比1:50加酶,37℃下酶解16h。
[0114]
(6)采用10kda滤膜12000r/min离心20min,收集下层肽段滤液于液相小瓶待测
[0115]
2、上机检测
[0116]
(1)采用ab sciex tripletof系统,具体的;
[0117]
流动相a:0.1%甲酸-水,
[0118]
流动相b:0.1%甲酸-乙腈,
[0119]
流速0.25ml/min,
[0120]
洗脱梯度:0~2min,5%b;2~27min,5~20%b;27~37min,20~35%b;37~39min,35~80%b;39~42min,80%b;42~46min,5%b。
[0121]
tof扫描范围:350~1500da,正离子模式,gs1:35,gs2:45,curtain gas:35,isvf:5500,tem:500,dp:100,ce:10。
[0122]
或(2)采用ab sciex 5500三重四极杆检测,具体的,
[0123]
流动相a:0.1%甲酸-水,
[0124]
流动相b:0.1%甲酸-乙腈,
[0125]
流速0.35ml/min。
[0126]
洗脱梯度:0~10min,10~10.5%b;10~10.5min,10.5~45%b;10.5~13min,45~95%b;13~13.1min,95~10%b;13.1~15min,10%。
[0127]
电喷雾离子源,正离子反应模式,检测方式:mrm,喷雾电压:5500v,离子传输管温度:575℃;雾化气压力:60psi,辅助加热气压力:50psi,气帘压力:35psi。
[0128]
质谱检测结果对比实施例2-4中的各条特异性多肽的质谱图谱图,出现响应实施例2-4任一所述质谱检测谱图时,即可判断该组织样本为相应种属三文鱼样本。
[0129]
经进一步鉴定,随机选取的一个三文鱼样本中,样品质谱分析符合虹鳟鱼特征肽段质谱图,在大西洋鲑鱼和太平洋鲑鱼中无响应,见图15,故样品为虹鳟鱼样品。
[0130]
经核实,上述鉴定结果与送样样本的种属一致。
[0131]
最后需要说明的的是,以上实施例仅用于帮助本领域技术人员理解本发明的实质,不用于限定本发明的保护范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。