可磁驱动的微型机器人及其制造方法
1.交叉参考相关引用
2.本技术要求2020年07月24日递交的申请号为no.63/055,963的美国临时专利申请的优先权和2020年12月21日递交的申请号为no.17/128,345的美国专利申请的优先权,其全部内容通过引用结合在本技术中。
技术领域
3.本发明涉及可磁驱动的微型机器人以及制造该可磁驱动的微型机器人的方法。
背景技术:
4.微型机器人通常被用于体内和体外环境中的生物医学应用,因为它们很小并且可以相对容易地控制。一些现有的生物医学微型机器人是不可降解的,而其它的生物医学微型机器人是可降解的。不可降解的微型机器人相对难以从它们所处的环境中移除,因此不是特别适于体内应用。另一方面,可降解的微型机器人可能具有相对薄弱的结构,致使它们不适于承载细胞等。
技术实现要素:
5.在第一方面,本发明提供了一种制造可磁驱动的微型机器人的方法。该微型机器人被用于承载和递送细胞、药品、药剂等。所述方法包括以下步骤:对光固化材料组合物进行光固化以形成可磁驱动的微型机器人的主体。光固化材料组合物包括:可降解组分、结构性组分、磁性组分以及包括光引发剂组分和光敏剂组分的光固化促进组合物。可以将可降解组分用作材料基质。可以将结构性组分用于向主体提供强度或结构性完整性。磁性组分使主体可磁驱动。可以将光引发剂组分和光敏剂组分用于交联光固化材料组合物的各种组分。
6.光固化材料组合物可以包括一种或更多种附加组分。另选地,光固化材料组合物基本上包括:可降解组分、结构性组分、磁性组分以及具有光引发剂组分和光敏剂组分的光固化促进组合物。
7.可降解组分可以包括聚(乙二醇)二丙烯酸酯(pegda)或类似的聚(乙二醇)(peg)衍生物。在一个示例中,可降解组分包括74vol%或者约74vol%的pedga(相对于光固化材料组合物)。
8.结构性组分可以包括季戊四醇三丙烯酸酯(peta)。结构性组分可以包括至少20vol%、至少24vol%或者至少25vol%的peta(相对于光固化材料组合物)。
9.可选地,pegda的vol%与peta的vol%的比介于约2:1到约4:1之间,约3:1或者3:1。
10.磁性组分可以包括fe3o4颗粒。fe3o4颗粒可以包括fe3o4颗粒纳米颗粒。fe3o4颗粒可以不超过2vol%(相对于光固化材料组合物)。
11.光引发剂组分可以包括对羟基苯甲酸酯。光敏剂组分可以包括2-异丙基-9h-噻
吨-9-酮(2-isopropyl-9h-thioxanthen-9-one)。
12.在一个实施方式中,光固化材料组合物基本上包括:pegda、peta、fe3o4颗粒、光引发剂以及光敏剂。在一个示例中,光固化材料组合物包括:约74vol%的pegda、约24vol%的peta、约2vol%的fe3o4颗粒以及微量的光引发剂和光敏剂。
13.可选地,光固化(例如,激光写入)是使用诸如3d激光光刻法或多光子光刻法的光刻技术选择性地执行的。
14.可选地,所述方法还包括以下步骤:在主体的至少一部分上涂覆或涂敷造影剂。造影剂可以包括使微型机器人容易通过成像装置成像的材料。
15.可选地,所述方法还包括以下步骤:在主体的至少一部分上涂覆或者以其它方式涂敷光声成像造影剂。光声成像造影剂可以包括金。在其中光声成像造影剂形成涂层的实施方式中,涂层可以包括一个或更多个层。在一个示例中,涂层可以具有纳米级(例如,10nm)的厚度。
16.可选地,所述方法还包括以下步骤:通过以下步骤形成光固化材料组合物:基于第一比例混合可降解组分和结构性组分以形成第一混合物,以及基于第二比例将第一混合物与磁性组分混合以形成第二混合物。所述方法还可以包括以下步骤:在形成光固化材料组合物之前,确定或优化光固化材料组合物的组成,特别是第一比例和第二比例。该确定或优化(由此确定第一比例和第二比例)取决于微型机器人的所需特性或应用。
17.可选地,所述方法还包括以下步骤:在进行光固化之前混合光固化材料组合物。可以使用混合器或摇动机器来执行混合。
18.可选地,所述方法还包括以下步骤:在进行光固化之前显影所形成的主体。显影可以包括使主体干燥、使主体冷却、向主体吹风等。
19.所形成的主体可以包括具有三维结构的多孔主体,该三维结构具有毛刺构件。该三维结构可以是任何形状,例如,大体球形。
20.可选地,光固化材料组合物的光固化形成多个可磁驱动的微型机器人的相应主体。这些主体可以按顺序地(一个接一个)或者大致同时形成。相邻的主体可以利用直接材料连接或者在没有直接材料连接的情况下重叠,例如机械接合。在一个示例中,在没有直接材料连接的情况下机械接合可以包括两个或更多个互连的金属圈或环。
21.可选地,所述方法还包括以下步骤,将细胞、药品、药剂等附着或加载至主体和/或涂层。
22.在第二方面,本发明提供了至少利用第一方面的方法制造的一个或更多个可磁驱动的微型机器人。所述一个或更多个微型机器人适于生物医学应用。
23.在第三方面,本发明提供了操纵诸如第二方面的可磁驱动的微型机器人的方法。所述方法包括以下步骤:使用光声成像设备对环境中的可磁驱动的微型机器人进行成像,并且基于该成像,向可磁驱动的微型机器人施加磁场,以使该环境中的可磁驱动的微型机器人移动。该环境可以是体内环境,诸如血管。光声成像设备可以包括探针、光纤等。
24.可选地,当可磁驱动的微型机器人因磁场而移动时,实时地(例如动态地或连续地)执行成像,以便对移动的可磁驱动的微型机器人进行成像并因此对其进行跟踪。磁场可以是梯度磁场。
25.在第四方面,本发明提供了操纵诸如第二方面的可磁驱动的微型机器人的系统。
该系统包括:光声成像设备,该光声成像设备用于对环境中的可磁驱动微型机器人进行成像;以及磁场发生器;该磁场发生器由一个或更多个线圈形成,该磁场发生器用于提供磁场以使环境中的可磁驱动的微型机器人移动。该环境可以是体内环境,诸如血管。光声成像设备可以包括探针、光纤等。
26.可选地,该系统还包括控制器,该控制器与磁场发生器可操作地连接,以基于来自光声成像设备的反馈和/或用户输入来控制磁场发生器的运行。磁场发生器可以是梯度磁场发生器。
27.可选地,将光声成像设备设置成,当可磁驱动的微型机器人因磁场而移动时,实时地(例如动态地或连续地)对可磁驱动的微型机器人进行成像。以便对移动的可磁驱动的微型机器人进行成像并因此对其进行跟踪。
28.通过考虑详细的描述以及附图,本发明的其它特征和方面将变得显而易见。在本文中关于一个方面或实施方式描述的任何特征均可以在适当和适用时,与本文中关于任何其它方面或实施方式描述的任何其它特征相组合。
附图说明
29.参照附图,通过示例的方式对本发明的实施方式进行描述,其中:
30.图1是例示在本发明的一个实施方式中制造可磁驱动的微型机器人的方法的示意图;
31.图2是例示在本发明的一个实施方式中的用于操作使用图1的方法制造的可磁驱动的微型机器人的系统的示意图;
32.图3是示出由pegda(vol%)与peta(vol%)的不同比例制造的微型机器人的降解测试结果的图形;
33.图4是示出由pegda(vol%)与peta(vol%)的不同比例制造的微型机器人的机械测试结果的图形;
34.图5a是使用90vol%pegda:10vol%peta制造的微型机器人的扫描电子显微镜图像,示出了微型机器人结构形变和坍陷;
35.图5b是使用85vol%pegda:15vol%peta制造的微型机器人的扫描电子显微镜图像,示出了微型机器人网格形变和毛刺断裂;
36.图5c是使用80vol%pegda:20vol%peta制造的微型机器人的扫描电子显微镜图像,示出了毛刺断裂;
37.图5d是使用75vol%pegda:25vol%peta制造的微型机器人的扫描电子显微镜图像,示出了微型机器人结构完整;
38.图5e是使用70vol%pegda:30vol%peta制造的微型机器人的扫描电子显微镜图像,示出了微型机器人结构完整;
39.图5f是使用65vol%pegda:35vol%peta制造的微型机器人的扫描电子显微镜图像,示出了微型机器人结构完整;
40.图6是示出利用不同百分比的fe3o4纳米颗粒制造的微型机器人的磁驱动能力的图形;
41.图7a是使用2.5vol%fe3o4纳米颗粒制造的微型机器人的扫描电子显微图像;
42.图7b是图7a中的虚线矩形中的微型机器人的放大扫描电子显微图像;
43.图7c是图7b中的微型机器人的处于虚线矩形中的一部分的放大扫描电子显微图像,示出毛刺不见了;
44.图8是示出使用不同比率的pegda与peta制造的微型机器人在naoh中的荧光信号的图形;
45.图9是示出使用不同比率的pegda与peta制造的微型机器人在pbs中的荧光信号的图形;
46.图10a是微型机器人最初在naoh中的图像;
47.图10b是图10a的微型机器人在2小时后的图像;
48.图10c是图10a的微型机器人在3小时后的图像;
49.图10d是图10a的微型机器人在7小时后的图像;
50.图11a是最初在pbs中的微型机器人的图像;
51.图11b是图11a的微型机器人在20天后的图像;
52.图12a是示出植入有使用75vol%pegda和25vol%peta制造的微型机器人的组织在第2周的组织切片的共聚焦扫描图像;
53.图12b是植入有图12a的微型机器人的组织的组织切片的荧光图像;
54.图12c是示出植入有使用100vol%peta制造的微型机器人的组织在第2周的组织切片的共聚焦扫描图像;
55.图12d是植入有图12c的微型机器人的组织的组织切片的荧光图像;
56.图13a是示出植入有以75vol%pegda和25vol%peta制造的微型机器人的组织在第4周的组织切片的共聚焦扫描图像;
57.图13b是植入有图13a的微型机器人的组织的组织切片的荧光图像;
58.图13c是示出植入有使用100vol%peta制造的微型机器人的组织在第4周的组织切片的共聚焦扫描图像;
59.图13d是植入有图13c的微型机器人的组织的组织切片的荧光图像;
60.图14是示出在体内的以不同比率的pegda与peta制造的微型机器人的荧光强度的图形;
61.图15a是示出具有不同浓度的微型机器人降解产品的不同细胞培养基(miha、msc、mncc97l)在第1天的细胞存活率的图形;
62.图15b是示出具有不同浓度的微型机器人降解产品的不同细胞培养基(miha、msc、mncc97l)在第3天的细胞存活率的图形;
63.图15c是示出具有不同浓度的微型机器人降解产品的不同细胞培养基(miha、msc、mncc97l)在第5天的细胞存活率的图形;
64.图16a是示出不同数量的10nm镀金和未镀金微型机器人的光声量值的对比的图形;
65.图16b是示出10nm镀金和未镀金微型机器人在不同组织厚度下的光声量值的对比的图形;
66.图17a是预先注射了200个微型机器人的左侧叶的超声图像;
67.图17b是图17a中的左侧叶的光声图像,箭头指示预先注射的200个微型机器人;
68.图17c是图17a中的左侧叶的合并超声-光声图像;
69.图18a是没有微型机器人的左侧叶的超声图像;
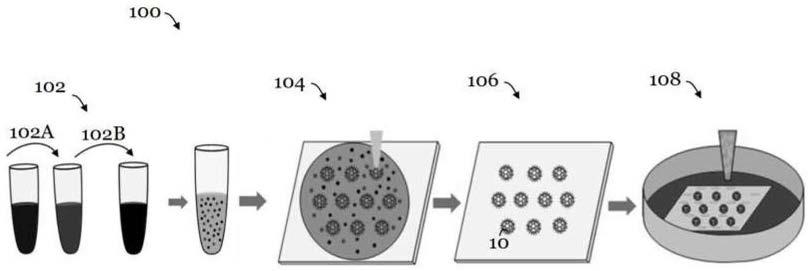
70.图18b是图18a中的左侧叶的光声图像,箭头指示背景信号;
71.图18c是图18a中的左侧叶的合并超声-光声图像;
72.图19a是在裸小鼠下腔静脉的位置a处进行的载有细胞的微型机器人的体内导航的光声图像;
73.图19b是图19a中的位置b处的体内导航的光声图像;
74.图19c是图19a中的位置c处的体内导航的光声图像;以及
75.图20是示出图19a至图19c中的下腔静脉中的不同位置处的载有细胞的微型机器人的位置误差的图形。
具体实施方式
76.图1示出了在本发明的一个实施方式中的制造用于承载和递送细胞的可磁驱动微型机器人10的方法100。微型机器人可以载有细胞等。在一个示例性应用中,在血管组织的路径期间,可以使用实时光声(pa)成像和超声(us)成像技术在该组织内部引导微型机器人,从而可使以高分辨率检测光学吸附。
77.微型机器人10是使用优化的光固化复合材料制造的,该光固化复合材料包括:被设置成提供微型机器人的可降解性的可降解组分、被设置成提供微型机器人的机械强度或支承的机械或结构性组分、以及被设置成提供磁驱动能力(可使微型机器人响应磁操纵)的磁性组分。微型机器人材料的组成可以基于应用,尤其考虑到可降解性、机械强度(用于承载细胞、药品等)以及磁驱动能力等因素,来优化微型机器人材料的组成。该组合物还包括光固化促进组合物,该光固化促进组合物包括被用于交联组合物中的组分的光引发剂和光敏剂。可降解组分可以包括聚乙二醇(peg)的衍生物,诸如聚(乙二醇)二丙烯酸酯(pegda),其被用于药品递送和基于组织工程的应用。结构性组分可以包括丙烯酸酯的衍生物,诸如季戊四醇三丙烯酸酯(peta)。磁性组分可以包括磁性或铁磁性颗粒,诸如fe3o4颗粒,特别是fe3o4纳米颗粒。光引发剂和光敏剂可以分别包括对羟基苯甲酸酯和2-异丙基-9h-噻吨-9-酮(2-isopropyl-9h-thioxanthen-9-one)。
78.制造微型机器人的方法100开始于步骤102。在步骤102的102a中,首先将被用作材料基质的可降解组分与结构性组分以第一比例进行组合以形成第一混合物,并且向微型机器人提供机械强度。然后,在步骤102的102b中,将磁性组分与可降解组分和结构性组分的第一混合物以第二比例进行混合,以获得第二混合物,从而提供具有磁驱动能力的材料组合物。步骤102的102a和102b中的混合可以使用混合器或摇动器来执行。光固化材料组合物的组成,特别是第一比例和第二比例可以在步骤102之前加以确定或优化,以根据所需的应用来实现优化的可降解性和机械强度。具体地,第一比例可以基于负担细胞张力的结构完整性来进行确定。第二比例可以基于驱动能力要求和制造约束来进行确定。
79.在步骤102之后,在步骤104中,使用光刻法(诸如3d激光光刻法或多光子光刻法)对优化的材料组合物进行光固化,以定义多个微型机器人。在所例示的实施方式中,将多个微型机器人10定义为没有材料连接的单独微型机器人。
80.随后,在步骤106中,将经光固化的组合物进行显影,以形成用于加载细胞等的多
个微型机器人10。在所例示的实施方式中,所形成的微型机器人10包括具有三维结构的多孔主体,该三维结构为大体球形并且具有多个毛刺构件。毛刺构件相对于多孔主体的外表面大致正交地延伸。
81.在一个实施方式中,方法100可以包括以下步骤:在所形成的主体的至少一部分上涂覆或涂敷造影剂,例如金。造影剂可以是促进光声成像或基于光声成像的主体跟踪的光声成像造影剂。涂层可以具有纳米级(例如,10nm)的厚度。
82.在步骤106之后,在步骤108中,将细胞加载到微型机器人10上,以使可以将载有细胞的微型机器人应用于环境以承载和/或递送细胞。将细胞加载或附着至主体或光声成像造影剂的涂层。可以将细胞加载或附着在同一微型机器人的相邻毛刺构件之间或者相邻微型机器人的不同毛刺构件之间。
83.图2示出了用于在活小鼠体内操纵载有细胞的可磁驱动的微型机器人20的系统200。可磁驱动的微型机器人20可以是基于本发明的一个实施方式中的方法100制造的微型机器人。在该实施方式中,将载有细胞的微型机器人簇递送到小鼠的血管中。微型机器人20被设计有光吸收材料,以确保在可见光谱中针对血红蛋白分子的高光吸收系数和高对比度。
84.系统200包括具有探针202和光纤204的光声成像设备,该光声成像设备用于对小鼠血管(例如,下腔静脉)中的微型机器人20进行成像。系统200还包括尖针206和覆盖有尖针206的导管208,该尖针206用于刺穿并将载有细胞的微型机器人20递送到血管中。系统200还包括磁场发生器210,该磁场发生器在本实施方式中由一个或更多个线圈形成,并且该磁场发生器用于提供磁场以与小鼠中的微型机器人20相互作用并由此使该微型机器人移动。磁场发生器210可以是梯度磁场发生器。可以将光声成像设备用于当微型机器人20因磁场而发生移动或以其它方式进行操纵时,实时地(例如,动态地或连续地)对微型机器人20进行成像。同样地,可以通过成像来跟踪可磁驱动的微型机器人20的移动。系统200还可以包括控制器(未示出),该控制器与磁场发生器210可操作地连接,以基于来自光声成像设备的反馈和/或用户输入来控制磁场发生器210的运行。
85.可磁驱动的微型机器人的制造
86.在一项实验中,使用包括以下的光固化材料组合物来制造微型机器人:pegda(sigma,437441)、peta(sigma,246794)、磁性纳米颗粒溶液(100nm大小、260mg/ml悬浮于γ(gamma)-丁内酯(gbl)中,由chemicell gmbh定制的)、光引发剂(对羟基苯甲酸酯,easepi edb,curease chemical,china)、以及光敏剂(2-异丙基-9h-噻吨-9-酮(2-isopropyl-9h-thioxanthen-9-one),easepi itx,curease chemical,china)。在使用光刻法形成微型机器人之前,使用涡旋摇动器混合预聚物溶液(光固化材料组合物)。然后,将复合材料滴铸在干净的玻璃基板上并加载到nanoscribe,这是一种用于利用63x油浸物镜(zeiss的1.4数值孔径)编写的结构的商用双光子直写系统(gmbh,德国)。然后将基板在甲苯(sigma,179965)和异丙醇(ipa,sigma,67-63-0)中进行显影,并且在通风橱中经由气流进行干燥。
87.然后将细胞加载到所形成的微型机器人上。将所形成的微型机器人使用uv照射以进行杀菌,并在等离子清洁器中处理30秒钟。human ipsc10 msc-gpx3被胰蛋白酶化并且以105个细胞/ml的浓度重新悬浮。然后,将这种细胞溶液滴铸在微型机器人上,并且在37℃下,在具有用于细胞附着的5%co2的加湿培养箱中孵育15分钟。然后,添加另外的2ml培养
基。在经过一夜的培养之后,细胞稳定地附着至微型机器人。使微型机器人在临界点干燥机(leica em cpd300)中进行脱水,并且在sem(fesem,fei nova 450)下对具有细胞的微型机器人的形态进行观察,如下更详细讨论的。
88.另外,还为光声断层扫描(pat)实验准备了微型机器人簇。在该示例中,微型机器人一个接一个地制造出来。为了避免微型机器人的散布,所制造的微型机器人通过毛刺构件与相邻的微型机器人具有小的重叠(例如,机械接合、具有或没有直接连接),并且所连接的微型机器人的阵列形成了正方形。在该示例中,在四条生产线上建立了十个微型机器人的微型机器人簇:前三条生产线各包含三个微型机器人,而最后一条生产线仅包含一个微型机器人。
89.光固化材料组合物的优化
90.为了确定或优化用于特定应用的光固化材料组合物(特别是参照图1的方法100描述的第一比例和第二比例),考虑了微型机器人的可降解性和机械强度要求。
91.图3至图5f示出了由pegda(vol%)和peta(vol%)的不同比例制造的微型机器人的降解和机械测试结果。所测试的比率包括:90:10、75:25、50:50、25:75以及0:100。在测试下的微型机器人的制造期间,不同比例的材料掺杂有相同量的巯基聚乙二醇罗丹明(rhodamine b-peg-thiol,rb-peg-sh)。
92.对于降解测试,将所制造的微型机器人浸入pbs环境中。在不同的时刻,捕获微型机器人图像(zeiss荧光显微镜),并且利用imagej软件对微型机器人的荧光强度进行分析。根据图3,可以看到,具有高pegda比率的微型机器人的荧光强度衰减得更快,表明具有高pegda比率的微型机器人有利于其可降解性。
93.对于机械测试,将所制造的微型机器人在hysitron ti950双头纳米压痕系统中进行了测试。图4示出了这样确定的微型机器人的机械强度,其中,插图示出了微型机器人在75vol%pegda:25vol%peta中的机械测试。如从表4看到,微型机器人的机械强度随着peta的比例的增加而增加,并且具有较高peta组成的材料在微型机器人制造中需要较少的激光功率。这些表明较高的peta组成可以有利于微型机器人的结构完整性。
94.为了确定微型机器人制造所需的最小peta组成,基于结构完整性来测试具有pegda和peta的不同比例的材料。发现需要10vol%peta的最少组成才能形成适当构造的微型机器人。
95.然后,根据基于承载间充质干细胞(msc)的机械强度进一步评估具有pegda和peta的不同比例的微型机器人。图5a、图5b、图5c图5d和图5f表明,具有低于25vol%的peta的微型机器人在加载细胞之后可能相对容易坍陷,而具有25vol%或更高的peta的微型机器人在加载细胞时可以保持稳定和完整。在该示例中,为了提供最佳的可降解性和结构完整性,在微型机器人材料的组合物中使用75vol%pegda和25vol%peta可能是有利的。
96.图6至图7c例示了基于磁驱动能力和制造约束,确定参照图1的方法100描述的第二比例。对利用pegda(vol%)与peta(vol%)的75:25比例、加上不同比例(1vol%、1.5vol%以及2vol%)的fe3o4纳米颗粒制造的微型机器人进行测试。结果表明,随着纳米颗粒的比例从1vol%增加到2vol%,微型机器人可以实现更高的驱动速度。在该示例中,将磁性组分的比例限制在2vol%内,因为组合物中较高的比例可能会降低或阻挡激光穿透,潜在地使微型机器人有缺陷。
97.图7a、图7b和图7c示出了利用2.5vol%磁性含量制造的微型机器人。由于复合材料中过多的磁性组分在光固化期间阻挡了激光写入,因此,在扫描电子显微镜(sem)图像中发现了缺陷。因此,在一个示例中,将2vol%磁性纳米颗粒掺入75vol%pegda和25vol%peta的微型机器人材料,用于微型机器人磁驱动。在该示例中,鉴于上述实验结果,使用了74vol%pegda、24vol%peta以及2vol%fe3o4纳米颗粒组合物溶液。
98.可磁驱动微型机器人的可降解性和生物相容性
99.对所设计的微型机器人的可降解性和生物相容性进行评估。图8和图9分别例示了由可降解的75vol%pegda:25vol%peta水凝胶制造的微型机器人以及由难以降解的100vol%peta水凝胶制造的微型机器人在naoh溶液和pbs环境中的荧光信号。结果表明,可降解的75vol%pegda:25vol%peta微型机器人的荧光强度在naoh溶液中24小时内下降92%,而难以降解的100vol%peta微型机器人仅降低了13%(图8)。在pbs环境中,可降解的微型机器人的荧光强度在培养两周之后下降了40%,而难以降解的微型机器人几乎保持不变(图9)。这些结果表明所制造的微型机器人可以通过水解降解,并且在碱性环境中的降解比在pbs中的降解快得多。
100.图10a、图10b图10c和图10d示出了微型机器人在naoh溶液中的降解,图11a和图11b示出了微型机器人在pbs环境中的降解。基于pegda的水凝胶将经历批量降解模式。在批量降解中,聚合物网络的物理尺寸不会发生显著变化,直到该聚合物网络几乎完全降解,但是保留在水凝胶中的聚合物的比例部分会随着时间的推移而降低。
101.局部组织环境、酶促氧化以及巨噬细胞活性可能会影响水凝胶降解。在裸小鼠的皮下(sc)组织中执行了微型机器人可降解性的体内测试。将可降解的75vol%pegda:25vol%peta微型机器人以及难以降解的100vol%peta微型机器人经皮下植入各只小鼠的左右两侧。所有微型机器人均是使用包含1mg/ml rb-peg-sh的预聚物溶液制造的,并且在植入之前进行了冲洗和干燥。在第2周和第4周处死小鼠。切下植入区域处的大小约1
×
1cm2的皮肤片段并利用甲醛溶液进行固定。然后将固定的皮肤组织包埋在低温基质冷冻介质中,并且使用低温恒温器竖直切割至50μm的厚度。
102.图12a、图12b、图12c、图12d、图13a、图13b、图13c和图13d示出了植入有微型机器人的组织的组织切片。共聚焦扫描图像示出微型机器人没有被冲走。罗丹明b的荧光信号仅存在于微型机器人内部或附近。大面积中无罗丹明b泄漏。罗丹明b的释放过程与微型机器人的降解相关。罗丹明b在微型机器人上的荧光信号已经被表征。图14示出可降解的75vol%pegda:25vol%peta微型机器人的荧光强度在植入之后2周降低了约65%,并且在植入之后4周降低了82%。难以降解的100vol%peta微型机器人分别降低了19%和30%。这些实验结果证实了微型机器人的体内可降解性。
103.考虑到微型机器人的降解产品会在体内停留某一时段,随后执行了存活率测试以检查完全降解的产品的生物相容性。mtt化验是在第1天、第3天以及第5天,利用在补充有不同浓度的降解产品的培养基中培养的细胞来执行的。图15a、图15b和图15c示出:即使将800ppm的降解产品添加至培养基中(相当于在1ul溶液中降解10k个微型机器人),细胞存活率也未受到实质性损害。即使在超高浓度的降解产品下,所有细胞类型的存活率均在80%以上。
104.可磁驱动的微型机器人的体内成像
105.为了促进使用微型机器人的体内实验,可以在几毫米到几厘米的深度对微型机器人进行实时成像。在一个示例中,微型机器人是经过设计的,并且pa断层扫描(pat)是为体内微型机器人成像量身定制的。微型机器人被设计有光吸收材料,以确保在可见光谱中针对血红蛋白分子的高光吸收系数和高对比度。通过调谐光学激发波长,优化了血液中的微型机器人的对比度,同时对血液和微型机器人进行了量化。为了可视化组织环境,同时获取经共同配准的pa和us图像。
106.在该示例中,为了增强微型机器人的pa信号并且提高微型机器人与血液的对比度,选择1064nm进行体内成像。微型机器人涂敷有10nm厚的金层(光声成像造影剂),以进一步增强吸收,同时确保良好的生物相容性。为了向患病部位递送更多的治疗细胞,在一次治疗中使用了微型机器人簇(从几个到数百个微型机器人)。大量微型机器人增加了pa信号。图16a例示了pa量值与微型机器人的数量呈正相关,均处于1064nm激光波长下。与相同激励下的无涂层微型机器人相比,镀金微型机器人产生的信号强度是其五倍。
107.为了演示深层组织中的微型机器人成像,将两个微型机器人簇在鸡组织中进行成像,如图16b所示。一个簇由10个镀金微型机器人组成,而另一个簇由10个无涂层微型机器人组成。与无涂层微型机器人簇相比,有涂层微型机器人在各种组织厚度下表现出更强的pa信号。镀金微型机器人簇可以在2cm深度得到清晰成像,而无涂层簇在2cm深度几乎无法检测到。该实验示出,工程微型机器人在深pa成像中具有良好的对比度。
108.在小鼠肝脏中进一步测试了微型机器人的成像。将200个微型机器人经由门静脉注射到左侧叶(lll),这些微型机器人然后被收集并固定在多聚甲醛(pfa)中,并且利用us和pat进行成像。图17a、图17b、图17c、图18a、图18b和图18c示出了成像结果。us图像示出了lll的形态,并且pa图像示出了微型机器人对肝脏组织的吸收对比度。经合并的us和pa图像示出了微型机器人在lll中的分布位置。具有200个注射的微型机器人的lll的信号量值是对照物的2.8倍。
109.可磁驱动的微型机器人在小鼠模型中的体内导航
110.由pa成像引导的载有细胞的微型机器人的体内导航是在裸小鼠(雄性,6周到8周)的下腔静脉中的6mm深度进行的。设置类似于图2中的设置。微型机器人簇由五个镀金微型机器人组成。使用经尖针覆盖的导管,将承载细胞的微型机器人簇递送到裸小鼠的下腔静脉中。通过实时pa和us成像(每成像模式每秒钟20帧)进行引导,通过使用静脉中的梯度磁场激活导管内部的微型机器人。将比例积分微分(pid)控制器用于运动控制,并且通过对pa图像进行视觉处理来获得位置反馈。在微型机器人导航期间,设定了两个目标位置并且标记为b和c(分别为图19b和图19c)。具有细胞的微型机器人簇从起始位置a(图19a)移动至目标位置b,然后从b移动至目标位置c,总位移为5.1mm。如图20所示,微型机器人的位置误差表明,具有细胞的微型机器人可以准确地在血管环境中进行导航以运输治疗细胞。
111.本发明的上述实施方式提供了一种制造可加载细胞的可磁驱动和/或可降解微型机器人的方法,这促进用于精确治疗疾病的无线和微创方法。在一个示例中,可以将微型机器人用于在人类或其它动物的活体中(例如,在血管组织中)进行精确的细胞递送。微型机器人可以通过体内光声成像来进行导航和跟踪,以进行靶向治疗。微型机器人特别是在体内执行任务(例如,递送细胞或药品)之后会发生降解,并且副作用相对较少。本发明的上述实施方式还提供了一种用于引导微型机器人在体内或体外移动的成像方法。光声成像可以
使能实现实时导航并提供特别是在毫米到厘米的组织处的高分辨率图像,潜在地促进了微型机器人的手术和/或治疗应用。
112.本领域技术人员应意识到,在不脱离本发明的范围的情况下,可以对所例示的实施方式进行多种变化和/或修改。因此,本发明的所述描述的施方式在所有方面都应被视为例示性的、无限制的。
113.制造微型机器人的所例示的方法可以被用于制造具有不同的结构、形状、形式、尺寸等的微型机器人。而且,可以使用未例示的方法或系统在不同的环境中操纵所例示的微型机器人。例如,制造微型机器人的方法可以与所例示的方法不同。可以将不同的光固化技术(包括但不限于光刻法)用于形成微型机器人。所述方法可以被用于形成一个或更多个微型机器人。光固化材料组合物可以包括:一种或更多种可降解组分;一种或更多种结构性组分;一种或更多种磁性组分;以及一种或更多种光固化促进组合物(包括一种或更多种光引发剂组分以及一种或更多种光敏剂组分)。可降解组分不必是pegda。结构性组分不必是peta。磁性组分不必是fe3o4颗粒,而可以是其它铁磁或磁性材料。可以将造影剂涂覆或涂敷至身体的至少一部分。光固化材料组合物可以使用除光刻法以外的其它技术来进行光固化。多个微型机器人可以一个接一个地或者大致同时地形成(例如,光固化和显影)。相邻的微型机器人主体可以利用直接材料连接或者在没有直接材料连接的情况下重叠,例如机械接合。例如,微型机器人可以与所例示的微型机器人不同。微型机器人可以具有实心主体而不是多孔主体。微型机器人可以具有非球形形状。微型机器人的主体上的毛刺构件可以具有不同的取向、形式、尺寸、长度等。在一些实施方式中,微型机器人的主体可以没有处于该主体上的任何毛刺构件。在一些实施方式中,微型机器人的主体可以包括表面凹陷部分。可以将微型机器人用于承载和递送细胞、药品等。用于操纵微型机器人的所例示的方法和系统可以针对不同的控制应用进行修改。所例示的方法和系统可以进行修改以用于其它的体内或体外环境。用于操纵微型机器人的系统可以包括用于将微型机器人递送至环境或递送到环境中的附加或另选装置(代替尖针和导管)。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。