1.本发明属于干细胞与再生医学技术领域,主要涉及过表达linc5657的人脐带间充质干细胞株在一种含有诱导剂hgf、egf、bfgf和osm的培养基中高效分化为肝细胞的方法。
背景技术:
2.各种终末期肝病常常导致肝功能衰竭,给人类健康造成极大危害,是当今世界范围内死亡的主要原因之一。目前肝细胞移植被认为是治疗急慢性肝衰的重要手段之一,但因缺乏足够的供体限制了其在临床上广泛应用。
3.近年来随着干细胞技术的飞速发展,成人干细胞为体外研究提供了无限制的原代细胞来源。成人干细胞中以间充质干细胞最具应用前景,其具有来源充足、免疫原性低、可塑性好等优点。因此,间充质干细胞体外向肝细胞诱导分化逐渐成为国内外研究的热点,研究证实,在体外添加生长因子及细胞因子可以诱导人脐带间充质干细胞分化为肝细胞,使其成为理想的替代肝细胞来源,充满应用前景。但是现阶段上述方法诱导分化来的肝细胞功能不成熟、目标细胞得率低下,而且临床应用移植细胞需要尽可能缩短诱导周期,上述诱导的方法往往至少需要1个月的时间,因此现有诱导方法难以满足临床需要,因此开发新的能够在短时间内将humscs高效地诱导为成熟肝细胞的方法意义重大。
4.最近几年,越来越多的学者发现长链非编码rna(lncrna)在细胞增殖、细胞凋亡、细胞分化等过程中均扮演着重要角色,并通过干预lncrna的表达达到了促进细胞分化的目的。因此,我们希望可以将lncrna用于诱导人脐带间充质干细胞分化为肝细胞的过程中。
技术实现要素:
5.本发明的首要目的是克服现有技术的缺点和不足,提供一种高效诱导人脐带间充质干细胞分化为肝细胞的方法,通过慢病毒转染构建的稳定表达长链非编码rna linc5657的人脐带间充质干细胞株,并且使用一种含有诱导剂hgf、egf、bfgf和osm的培养基进行干细胞的诱导分化。与目前普遍的诱导方法相比,极大提高了诱导效率。
6.为了实现上述发明目的,本发明采用如下技术方案:高效诱导人脐带间充质干细胞分化为肝细胞的方法,通过慢病毒转染构建过表达长链非编码rnalinc5657基因的humscs系,以及含有hgf,bfgf,egf及osm的imdm培养基。
7.具体的包括以下步骤:(1)人脐带间充质干细胞的获取:新鲜脐带获取后置入无菌生理盐水中,至超净台内将脐带华通胶分离置入培养瓶底部贴壁培养,加入含10% 胎牛血清的l
‑
dmem培养基,置于5%co2、37 ℃培养箱中,4
‑
5天后观察组织块周围有梭形细胞生长移除组织块继续加入培养基培养,待细胞达70
‑
80%汇合后进行传代;(2)分化前准备:第4代humscs接种于培养瓶中,细胞浓度为1
×
10
8 /l,培养瓶内是含10% 胎牛血清的l
‑
dmem培养基,置于5%co2、37 ℃培养箱中;(3)慢病毒转染:待细胞达到50%
‑
60%汇合时去除原培养基,加入不含胎牛血清的
l
‑
dmem培养基以及linc5657慢病毒,挑选单克隆细胞进行扩增,最终得到稳定转染的细胞株;(4)humsc向肝细胞分化:去除原生长培养基,更换为含有hgf,bfgf,egf及osm的肝细胞诱导imdm培养基,置于5%co2、37 ℃培养箱中;(5)肝细胞诱导分化培养基每3天更换一次,诱导分化21天后,收获诱导后的细胞。
8.本发明进一步限定,所述人脐带间充质干细胞为从成人脐带中获得的间充质干细胞。
9.本发明进一步限定,hgf浓度为20ng/ml,bfgf的浓度为10ng/ml,egf浓度为20ng/ml,osm的浓度为10ng/ml。
10.imdm培养基中不含有胎牛血清。
11.本发明进一步限定,所述人脐带间充质干细胞的细胞表面标志分子通过流式细胞技术方法进行检测,人脐带间充质干细胞不表达或低表达cd14、cd19、cd34、cd45和hla
‑
dr,而强表达间充质干细胞表面特异性抗原cd44、cd73、cd90、cd105。
12.我们课题组在前期研究中通过细胞测序发现脐带间充质干细胞在向肝细胞分化前后linc5657表达具有显著差异,其表达量显著增加,并且通过qrt
‑
pcr进行了进一步的验证。而且发现分化前脐带间充质干细胞过表达linc5657后可以显著促进脐带间充质干细胞向肝细胞分化。课题组通过核质分离试验发现neat1主要位于细胞质中,提示其具有通过吸附mirna发挥作用的可能性,而文献报道lncrna发挥调控细胞分化功能大部分也是以充当cerna来完成的。课题组通过三种生物信息软件预测发现,linc5657可与7种mirna结合,进一步通过rt
‑
pcr验证发现,在这7种mirna中只有mirna18a的表达受到linc5657调节(linc5657过表达后下调了mirna18a、linc5657干扰后上调了mirna18a的表达)。为验证linc5657在细胞中是否可以与mirna18a结合,课题组通过在humsc中进行荧光素酶实验,结果证实了两者的结合。hnf4a被认为是决定肝细胞功能、形态及分化的主要调节因子。课题组在研究humsc向肝细胞分化过程中发现hnf4a表达呈进行性升高,与之前的报道结果相符,而过表达hnf4a的表达显著促进了humsc向肝细胞分化。生物信息学分析显示hnf4a是mirna18a的靶基因,申请人通过荧光素酶实验验证了mirna18a与hnf4a的结合,过表达mirna18a可以显著抑制hnf4a的表达,进一步通过拯救实验验证了linc5657/mirna18a/hnf4a轴的存在。因此linc5657可能充当cerna,通过竞争性结合mirna18a促进了hnf4a的表达、最终促进了humsc向肝细胞分化。
13.本发明的另一目的在于提供一种通过慢病毒转染构建的稳定表达长链非编码rna linc5657的人脐带间充质干细胞分化成肝细胞。
14.本发明的再一目的在于获得通过慢病毒转染构建的稳定表达长链非编码rna linc5657的人脐带间充质干细胞分化成肝细胞用于肝细胞移植。
15.本发明相对于现有技术具有如下优点和效果:(1)人脐带间充质干细胞具有免疫原性低、来源丰富,作为医疗废物因而不存在伦理问题的影响等优点,作为组织工程的种子细胞非常合适。
16.(2)整个诱导时间仅为21天,且只需每3天更换一次培养基,充分体现了诱导效率高、工作量低、流程简单等优势。
17.(3)通过慢病毒转染构建的稳定表达linc5657的人脐带间充质干细胞株,在添加
肝细胞分化培养基中分化后获取的肝细胞较常规诱导方法相比,细胞功能更加成熟。
附图说明
18.图1是原代humsc(
×
200倍)电镜形态图;图2是第4代humsc(
×
200倍)电镜形态图;图3是细胞测序发现linc5657差异表达;图4是qrt
‑
pcr验证了分化过程中linc5657表达量逐渐增加;图5是免疫荧光法检测分化3周后humsc呈肝细胞形态变化;图6是qrt
‑
pcr检测分化3周后肝细胞特异性基因alb的表达;图7是本发明诱导3周肝细胞特异性蛋白alb表达(
×
200倍);图8是对照组诱导3周肝细胞特异性蛋白alb表达(
×
200倍);图9 是qrt
‑
pcr检测本发明与对照组humsc分化后特异性基因的表达;图10是本发明诱导21天alb表达(
×
200倍);图11是对照组常规诱导28天alb表达(
×
200倍)。
具体实施方式
19.下面结合图1
‑
图11对本发明的相关步骤及技术优势进行进一步详细说明。
20.一、人脐带间充质干细胞的获取新鲜脐带获取后置入无菌生理盐水中,至超净台内将脐带华通胶分离置入培养瓶底部贴壁培养,加入含10% 胎牛血清的l
‑
dmem培养基,置于5%co2、37 ℃培养箱中,4
‑
5天后观察组织块周围有梭形细胞生长移除组织块继续加入培养基培养,待细胞达70
‑
80%汇合后进行传代。
21.二、分化细胞的制备第4代人脐带间充质干细胞接种于培养瓶中,细胞浓度为1
×
10
8 /l,培养瓶内为含体积分数为10%胎牛血清的l
‑
dmem培养基,置于含体积分数为5%co2、37 ℃培养箱中,次日换液。
22.三、慢病毒转染待细胞达到50%
‑
60%汇合时去除原培养基,pbs洗涤2次,每孔加入2 ml不含胎牛血清的l
‑
dmem培养基以及4 ul 1
×
10
8 tu/ml的linc5657慢病毒,同时加入聚凝胺,使得终质量浓度达到5 mg/l,转染24 h换液,之后每隔2 d换液1次,转染后使用嘌呤霉素筛选至少7天,挑选单克隆细胞进行扩增,最终得到稳定转染的细胞株。
23.三、向肝细胞分化去除原培养基,pbs洗涤2遍后更换培养基。,在含20ng/ml的egf,10ng/ml的bfgf、20ng/ml的hgf、和20 ng/ml的osm的imdm培养。肝分化培养基每3天更换一次。以未经过病毒转染的人脐带间充质干细胞的分化组为对照组(诱导培养条件与转染组相同)。
24.四、免疫荧光法检测alb蛋白的表达细胞分化3周后,用胰酶消化,预先在六孔板中放入无菌玻璃片,待细胞收集离心后将细胞悬液均匀滴在玻璃片上,放入培养箱中4
‑
6h,加入2ml的培养基继续培养过夜,次日用冷的pbs洗涤两次,然后将玻璃片取出并用4%的多聚甲醛固定30min,再用0.1%的
triton x
‑
100破膜20min,样本接下来用一抗小鼠抗人alb孵育过夜,二抗使用dylight 594与alexa 488山羊抗小鼠igg,细胞使用dapi复染,采用荧光显微镜观察细胞并拍照。
25.五、qrt
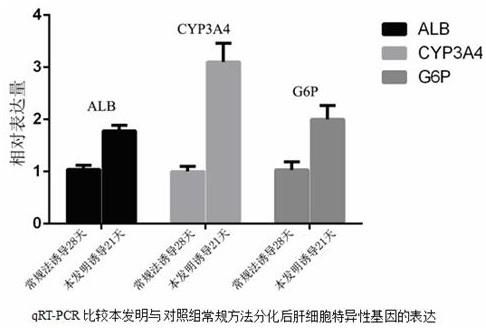
‑
pcr实验检测alb、cyp3a4、g6p的mrna表达诱导分化3周,收集细胞后采用trizol方法提取总rna,根据takara反转录说明书将rna反转录为cdna,应用abi7900系统进行pcr扩增,95 ℃ 5 min,95 ℃ 10 s, 60 ℃ 30 s, 72 ℃ 30 s,共40个循环。基因表达的相对倍数变化通过2
‑∆∆
ct
方法进行评估。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。