1.本发明涉及细胞检测技术领域,具体涉及数字同轴全息流式细胞检测方法、装置和存储设备。
背景技术:
2.虾青素是一种具有超强抗氧化能力的高价值化合物,为了获得较高的产量,有必要对雨生红球藻的生长特性(生物量、形态和大小)进行检测。现有的检测方法和装置存在当将角谱法直接移植到线阵传感器记录的样品全息图像重建时,样品细胞流速和线阵传感器采集速度的不同步会导致全息图在轴向方向(样品细胞流动方向)上失真的缺点,且操作费时、检测系统复杂。因此目前迫切需要探索一种简便、经济有效的雨生红球菌检测方法。
技术实现要素:
3.本发明解决的一个主要问题是样品细胞流速和线阵传感器采集速度的不同步会导致全息图在轴向方向(样品细胞流动方向)上失真。
4.根据本发明的一个方面,本发明提供一种数字同轴全息流式细胞检测方法,包括:
5.发射激光照射样品细胞微粒流体,采集细胞全息图;
6.裁剪所述细胞全息图;
7.对裁剪后的细胞全息图去噪,获得去噪全息图;
8.提取所述去噪全息图的同心椭圆的轴长比;
9.改变再现距离,引入所述同心椭圆的轴长比,利用所述同心椭圆的轴长比补偿去噪后的细胞全息图的相位畸变,并对补偿相位畸变后的细胞全息图进行全息重建;
10.使用绝对梯度算子从重建后的细胞全息图中挑选出清晰的细胞全息重建图。
11.进一步地,所述利用所述同心椭圆的轴长比补偿去噪后的细胞全息图的相位畸变,并对补偿相位畸变后的细胞全息图进行全息重建还包括:
12.在角谱法中引入椭圆轴长比s,得到第一公式:
[0013][0014]
其中,g
h
(f
x
,f
y
)为全息图光场频谱分布,fx和fy分别为x和y方向的频域分量,z为再现距离,λ表示入射平面光波长,j表示虚数单位;
[0015]
对所述第一公式作傅里叶变换,得到第二公式:
[0016][0017]
利用所述第二公式补偿去噪后的细胞全息图的相位畸变,并利用所述第二公式对补偿相位畸变后的细胞全息图进行全息重建,其中,f和f
‑1分别表示二维傅里叶正逆变换,u0和u分别表示全息面和再现面上的光场复振幅。
[0018]
进一步地,所述裁剪所述细胞全息图包括:
[0019]
沿细胞样品流动方向对所述细胞全息图进行降维处理。
[0020]
进一步地,所述沿细胞样品流动方向对所述细胞全息图进行降维处理,包括:
[0021]
将所述细胞全息图的灰度值沿垂直于细胞样品的流动方向进行积分并归一化处理。
[0022]
进一步地,所述对裁剪后的细胞全息图去噪,获得去噪全息图,包括:
[0023]
获取裁剪后的细胞全息图的频谱图,通过陷波滤波器将所述频谱图原点横向亮条纹进行过滤;
[0024]
通过高斯低通滤波器对过滤后的全息图进行滤波,获得去噪全息图。
[0025]
进一步地,所述提取所述去噪全息图的同心椭圆的轴长比包括:
[0026]
对去噪后的细胞全息图进行横向和纵向扫描,通过图像椭圆上横向和纵向的波谷间距比得到所述轴长比。
[0027]
根据本发明的另一个方面,还公开一种数字同轴全息流式细胞检测装置,所述数字同轴全息流式细胞检测装置用于实现如前任一所述的一种数字同轴全息流式细胞检测方法,所述数字同轴全息流式细胞检测装置包括:
[0028]
图像采集模块和计算机设备;
[0029]
所述图像采集模块用于采集细胞全息图,所述图像采集模块由依次同轴设置的激光器、微流控芯片、显微物镜、透镜、显微目镜和线阵相机组成;
[0030]
所述计算机设备与所述线阵相机连接;
[0031]
所述计算机设备,用于对采集的所述细胞全息图进行处理,得到清晰的细胞全息图。
[0032]
根据本发明的另一个方面,还公开一种存储介质,所述存储介质为计算机可读存储介质,其上存储有如前任一所述的一种数字同轴全息流式细胞检测方法。
[0033]
本发明提出的一种数字同轴全息流式细胞检测方法、装置存储介质,考虑到微流控流体典型流速(1cm/s
‑
1m/s),低帧率的面阵相机无法采集到的清晰的全息图,而高速相机经济成本太大,因此使用低成本的线阵相机作为记录元件;采用二维水动力聚焦微流控芯片对雨生红球藻进行松散水动力聚焦以提高系统通量,防止细胞在微通道中堵塞;角谱法可用于微通道中在不同高度流动的细胞全息图重建,但由于微通道内的速度场呈抛物线分布,细胞的速度与线阵传感器的采集速度不匹配导致细胞图像畸变,因此基于改进角谱再现方法,对线性阵列传感器采集速度和采样速度不同步引起的畸变全息图进行了校正和重构。总之,本发明公开的检测方法和检测装置能够纠正细胞全息图失真,重建得到清晰、聚焦的细胞图片,本方法在多种微藻的表征中也具有一定的应用前景。
附图说明
[0034]
本发明构成说明书的一部分附图描述了本发明的实施例,并且连同说明书一起用于解释本发明的原理。
[0035]
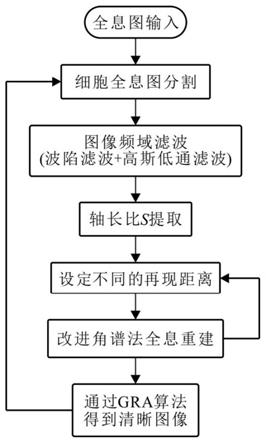
图1为本发明实施例中细胞全息图重建步骤流程图示意图。
[0036]
图2为本发明实施例中数字同轴全息显微光路示意图。
[0037]
图3为本发明实施例中二维水动力聚焦芯片示意图。
[0038]
图4为本发明实施例中圆形微粒欠采样示意图。
[0039]
图5为本发明实施例中球形粒子的模拟欠采样全息图及重建图。
[0040]
图6为本发明实施例中雨生红球藻生长特性示意图。
[0041]
图2中,1
‑
激光器(msl
‑
fn
‑
671
‑
100mw),2
‑
水动力聚焦微流控芯片(结构见图2),3
‑
样品藻细胞,4
‑
显微物镜(gco
‑
2133mo,40
×
,na 0.6),5
‑
薄透镜(gcl
‑
010204,ф=25.4mm),6
‑
显微目镜(szn10x,10
×
),7
‑
线阵相机(la
‑
gm
‑
04k08a,80000lps)。
具体实施方式
[0042]
下面将结合附图来详细描述本发明的各种示例性实施例。应注意到:除非另外具体说明,否则在这些实施例中阐述的部件和步骤的相对布置、数字表达式和数值不限制本发明的范围。
[0043]
同时,应当明白,为了便于描述,附图中所示出的各个部分的尺寸并不是按照实际的比例关系绘制的。
[0044]
以下对至少一个示例性实施例的描述实际上仅仅是说明性的,决不作为对本发明及其应用或使用的任何限制。
[0045]
为使本发明的目的、技术方案和优点更加清楚明白,以下结合具体实施例,并参照附图,对本发明进一步详细说明。
[0046]
对于相关领域普通技术人员已知的技术、方法和设备可能不作详细讨论,但在适当情况下,所述技术、方法和设备应当被视为授权说明书的一部分。
[0047]
在这里示出和讨论的所有示例中,任何具体值应被解释为仅仅是示例性的,而不是作为限制。因此,示例性实施例的其它示例可以具有不同的值。
[0048]
应注意到:相似的标号和字母在下面的附图中表示类似项,因此,一旦某一项在一个附图中被定义,则在随后的附图中不需要对其进行进一步讨论。
[0049]
本发明实施例一公开一种基于线阵传感器的数字同轴全息流式细胞检测装置,如图2所示,该检测装置主要由微流控水动力聚焦芯片2和基于线阵相机的数字同轴全息显微系统组成,具体包括依次同轴设置的单纵模激光器1、微流控芯片2、显微物镜4、透镜5、显微目镜6和线阵相机7,以及用于输送细胞液体的注射泵和与所述线阵相机电连接的计算机设备组成;在注射泵的驱动下,待检测样品进入微流控芯片并在水动力作用下完成聚焦控制,被聚焦的样品细胞在流道中流经光学检测区域时,由全息显微系统记录样品的全息图。
[0050]
单纵模激光器1发射的激光照射到由微流控芯片2通过二维水动力聚焦的样品细胞3,在光与物质相互作用下,部分光波被样品细胞扰动,作为物波,未扰动部分光波作为参考波;前述两波耦合进显微镜物镜4后,再通过透镜5和目镜6,形成干涉图样;线阵相机7垂直放置于微通道后方,在注射泵的作用下,通过样品在芯片通道内平移运动连续记录细胞二维全息图。
[0051]
二维水动力聚焦的原理是使一个低流量的芯层样品流在更高流量流动的外部包层内流动,从而在水平方向压缩样品流,对样品细胞进行二维聚焦。
[0052]
待测芯片为pdms在硅片上倒模制成的微流控芯片,该芯片采用二维水动力聚焦芯片操控样品流,芯片有两个入口和一个出口组成,分别作为鞘流入口、样品流入口和废液出口;鞘流通过鞘流入口进入微流控芯片,在经过第一个分岔口后,分为两道流体,并在十字
型通道位置与由样品流入口注入的样品悬浮液接触,并在水平方向上对其进行挤压,使样品流在外部包层内流动形成二维鞘流;前述所有微通道的深度都设定为125μm,探测区域所在长直通道的宽度为200μm。如图3所示,图中x、y和z方向分别表示直通道的横向方向、样品流动方向和通道深度方向。
[0053]
如图1所示,为本发明实施例二公开的一种数字同轴全息流式细胞检测方法的具体流程步骤图,基于线阵传感器的所述数字同轴全息流式细胞检测方法存储于计算机可读存储介质上,并在计算机运行时能够被执行:
[0054]
(1)采集细胞原始全息图并进行剪裁。由于线阵相机的像素为1
×
4096,而光学检测区域的微通道经过显微放大后并未将整个相机工作区域占满,因此需要先将采集到的原始全息图输入计算机设备并沿着通道壁进行裁剪,这样既能减少图片占用的空间,还可以降低后续图像处理的运算时间。为了加快图片处理速度,沿样品流动方向对裁剪全息图进行降维处理,即,将裁剪全息图的灰度值沿垂直于样品流动方向进行积分并归一化处理。此时,在裁剪全息图中出现微粒的地方会出现明显的波谷。据此,就可以将微粒全息图全部分割出来。
[0055]
(2)对剪裁后的细胞全息图进行去噪。由于线阵相机固有的缺陷,全息图中存在大量的竖条纹噪声,因此在重建前对需要对微粒全息图进行去噪处理。由信息理论可知,图像在经过二维傅里叶变换后,其空域中横向周期变化会在频谱图纵向上反映,而空域中纵向周期变化会在在频谱图横向中上反映。因此,全息图中的竖条纹噪声在频率内表现为横向亮条纹,首先使用陷波滤波器将频谱图原点横向亮条纹滤掉,再使用高斯低通滤波器对图像进行滤波。
[0056]
(3)提取去噪后的细胞全息图的轴长比s。如上文所述,该细胞全息图在样品流动方向上是被压缩或拉伸的,其衍射条纹呈椭圆形,因此,全息重建前还需要提取该细胞全息图的轴长比s。对图像进行横向和纵向扫描,通过对应椭圆上横向和纵向的波谷间距比,得到细胞全息图的轴长比。
[0057]
(4)提取轴长比后,按改进的角谱重建方法进行处理,得到清晰聚焦的微粒图像。具体来说,就是以一定的步长(δz
b
=2mm)设定不同的再现距离,在这些设定的再现距离下使用改进角谱再现法对其进行全息重建,得到多张全息重建图,通过绝对梯度算子(gra)计算图像的总的绝对一阶导数来量化图片清晰程度,找出清晰聚焦的细胞全息重建图。对下一个剪裁分割出的细胞全息图进行前述相同的步骤,如此反复,得到所有的清晰的细胞全息图。
[0058]
改进的角谱再现法原理:
[0059]
角谱再现算法(asm)基于衍射角谱理论,将平面波的传播用角谱传播来描述,asm没有任何限制,是对衍射在频域的精确描述,其数学描述如下:
[0060][0061]
式中,f和f
‑1分别表示二维傅里叶正逆变换,u0和u分别表示全息面和再现面上的光场复振幅,z表示再现距离,λ表示入射平面光波长,fx和fy分别表示x和y方向的频域分量。
[0062]
当将角谱法直接移植到线阵传感器记录的样品全息图像重建时,会出现一个问
题,即样品细胞流速和线阵传感器采集速度的不同步会导致全息图在轴向方向(样品细胞流动方向)上失真,因此需要对角谱法进行改进以解决该问题。
[0063]
在微流控通道中由于速度梯度的存在,在微通道中心线上的流体流动速度最快,而沿横向方向(垂直于微通道方向)上的流体流动速度逐渐降低,这会导致流体中的样品细胞在微通道横向方向上出现较大的速度分布。
[0064]
在这种情况下,仅通过调节线阵传感器的帧速率,是无法做到将线阵传感器的采集速度与样品细胞流速匹配的。
[0065]
线阵传感器采集速度为v
acq
可以由以下公式计算得到:
[0066]
v
acq
=δpgf
r
,
[0067]
式中,δp为线阵传感器像元大小,f
r
为线阵相机的帧(线)速率。当细胞流动速度vs与线阵相机采样速率相当,即v
s
=v
acq
时,样品细胞被充分采样,在全息图上显示的是同心圆条纹,然而,当v
s
>v
acq
或者v
s
<v
acq
时,样品细胞被欠采样或者过采样,畸变全息图将在轴向方向上呈现挤压或拉长的现象,表现出同心椭圆条纹。
[0068]
如图4所示为当样品流动速度大于线阵相机采样速率时的圆形微粒欠采样示意图,其中x和y方向分别表示横向方向和轴向方向,rx和ry表示椭圆在横向方向和轴向方向的轴长。需要注意的是,此时图像只在轴向方向上发生失真,横向方向是没有问题的。而过采样时的情况正好相反,即图像只在横向方向上发生失真,轴向方向是没有问题的。
[0069]
由于角谱重建法的核函数为各向同性圆对称函数,因此无法重建由速度不同步引起的全息图失真。
[0070]
需要指出,这个问题并不是角谱法独有的,其他重建方法如菲涅尔傅里叶变换再现法、卷积法也会出现该问题。
[0071]
如图5显示为当样品流速大于采集速度的情况下,在671nm激光照射下10μm球形微粒的模拟欠采样全息图,再现距离z设为2cm,全息图中的同心椭圆条纹的轴长比s=1.5。直接使用角谱法对图5(a)中的全息图进行全息重建,其结果如图5(b)所示,可以看到微粒重建图在横向方向有着较明显的微粒边界,横向方向上有着较好的聚焦,而在轴向方向上看到的仍然是一圈圈的条纹图样,因此轴向方向上没有聚焦,该微粒重建图只在一个方向上聚焦了,无法得到清晰的重建图像。
[0072]
由于微粒全息图只在轴向方向上发生畸变,未在横向方向上发生畸变,因此微粒全息图的横向和轴向分辨率满足如下关系:
[0073][0074]
其中,横向分辨率为fu,轴向分辨率为fv,m表示光学系统的总放大倍数;
[0075]
全息图光场频谱分布g
h
(f
x
,f
y
)中x和y方向的频域分量fx和fy也会发生相应变化,为了补偿这种由分辨率引起的全息图像失真,本发明的一个实施例在传统角谱法中引入椭圆轴长比s,得到全息图光场频谱分布为:
[0076][0077]
对式(3)作傅里叶变换,得到用于重建线阵传感器下采集速度不同步导致的畸变全息图的改进角谱法:
[0078][0079]
图5(c)为采用改进角谱法对微粒模拟欠采样全息图重建的结果,可以看到预期的椭圆形状,在2cm的重建距离下聚焦良好,边缘锐利。
[0080]
图5(d)为图5(b)和图5(c)中相应颜色直线上的强度分布图,与补偿前截面轮廓线相比,补偿后截面轮廓线在p1点和p2点处呈现近乎垂直的陡坡,两点之间的距离表明了该球形微粒的大小。
[0081]
为了证明前述实施例中的方法的良好效果,使用该种检测方法对雨生红球藻在不同培养环境和时间下的生物量、形态和大小进行了统计检测(观察时间为100秒)。
[0082]
如图6(a)为新接种藻类的增殖曲线。经过一段时间的停滞后,藻类迅速增殖,在第7天达到最高浓度(计数室测定)4.10
×
105cell/ml和4.32
×
105cell/ml(按本方法测定),随后浓度下降,表明海藻细胞的生长受到环境(ph升高和培养基中营养元素耗竭)的胁迫。
[0083]
培养条件改为强光照诱导(12000lx),检测未诱导的藻类细胞和8小时诱导的细胞形态,结果如图6(b)所示:散点图显示形态参数(长轴和短轴长度),大多数细胞呈椭圆形,轴向长度的比例很大,非诱导细胞的平均大小(截面的等效面积直径)为10.90
±
2.95μm,在强光诱导8小时后,大部分细胞呈球形(如图插图(ⅱ)所示),形态参数分布的散点图大多围绕45线排列,诱导细胞的平均大小为15.46
±
4.12μm。
[0084]
本发明实施例提出一种具有成本效益的数字同轴全息流式细胞检测方法来表征雨虹菌在细胞培养过程中的特性。考虑到微流控流体典型流速(1cm/s
‑
1m/s),低帧率的面阵相机无法采集到的清晰的全息图,而高速相机经济成本太大,因此使用低成本的线阵相机作为记录元件;采用二维水动力聚焦微流控芯片对雨生红球藻进行松散水动力聚焦以提高系统通量,防止细胞在微通道中堵塞;角谱法可用于微通道中在不同高度流动的细胞全息图重建,但由于微通道内的速度场呈抛物线分布,细胞的速度与线阵传感器的采集速度不匹配导致细胞图像畸变,因此通过修正角谱法傅立叶变换中的频率因子,纠正细胞全息图失真,重建得到清晰、聚焦的细胞图片。
[0085]
由于虾青素的的产量与雨生红球藻的生物量、形态和大小有关,培养条件包括培养基类型、温度、ph值和光照强度都是实现虾青素高积累的重要条件。可以预见,本实施例中的方法在其他微藻的表征中也具有一定的应用前景。
[0086]
以上所述仅为本发明的较佳实施例而已,并不用于限制本发明,凡在本发明的精神和原则范围之内所作的任何修改、等同替换以及改进等,均应包含在本发明的保护范围之内。
[0087]
还需要说明的是,术语“包括”、“包含”或者其任何其他变体意在涵盖非排他性的包含,从而使得包括一系列要素的过程、方法、商品或者设备不仅包括那些要素,而且还包括没有明确列出的其他要素,或者是还包括为这种过程、方法、商品或者设备所固有的要素。在没有更多限制的情况下,由语句“包括一个
……”
限定的要素,并不排除在包括要素的过程、方法、商品或者设备中还存在另外的相同要素。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。