1.本发明属于生命科学和医药领域技术领域,特别涉及香青兰提取物在治疗血管内皮损伤药物中的应用。
背景技术:
2.随着医疗质量和诊疗能力的提升,癌症患者生存率呈现逐渐上升趋势,但其治疗过程中引起的心脏毒性已引起社会的广泛关注。阿霉素(doxorubicin,dox)是一种蒽环类抗癌药物,但因其剂量依赖性的心脏毒性限制了其临床应用。
3.内皮细胞形成血管的内壁,是血管管腔内血液及其他血管壁(单层鳞状上皮)的接口。内皮细胞是沿着整个循环系统,由心脏直至最小的微血管。dox所致心脏毒性小鼠可见冠状动脉微血管微血管损伤,心脏毛细血管面积显著减少,使内皮功能抑制,造成心肌损伤。因此,研究内皮功能障碍在dox心脏毒性中的作用及机制,为防治阿霉素心脏毒性提供新的方向和靶点。
4.血管内皮生长因子b(vascular endothelial growth factor
‑
b,vegf
‑
b)是血管内皮生长因子家族成员之一,在心脏中的表达最为丰富,vegf
‑
b对病理条件下对血管存活至关重要。有研究报道,vegf
‑
b可促进冠状动脉生成、缺血抵抗,抑制dox诱导的心肌萎缩,保护内皮细胞免受细胞凋亡,维持心肌毛细血管网络,是预防dox所致心脏毒性和充血性心力衰竭的有意义的候选指标。
5.香青兰又名巴迪然吉布亚,为唇形科野芝麻亚科青兰属植物香青兰dracocephalum moldavica l.的干燥地上部分,在新疆地区资源尤其丰富,常用于心、脑血管疾病的治疗,但其对内皮细胞的保护作用尚未研究。
技术实现要素:
6.有鉴于背景技术中存在的问题,本发明的目的在于提供一种香青兰提取物在治疗血管内皮损伤药物中的应用。
7.本发明提供了一种香青兰提取物在治疗血管内皮损伤的药物中的应用。
8.优选地,所述血管内皮损伤包括心血管内皮损伤、脑血管内皮损伤、肺血管内皮损伤。
9.优选地,所述血管内皮损伤为阿霉素诱导的血管内皮损伤。
10.优选地,所述治疗血管内皮损伤的药物包括香青兰提取物和辅料。
11.优选地,所述香青兰提取物含有以下质量百分含量的有效组分:
12.木犀草素
‑7‑
o
‑
β
‑
d
‑
葡萄糖醛酸苷8.0%~9.0%;芹菜素
‑7‑
o
‑
β
‑
d
‑
葡萄糖醛酸苷2.0%~3.0%;迷迭香酸8.0%~11.3%;香叶木素
‑7‑
o
‑
β
‑
d
‑
葡萄糖醛酸苷7.0%~8.6%;田蓟苷13.0%~17.0%;刺槐素
‑7‑
o
‑
β
‑
d
‑
葡萄糖醛酸苷10.0%~13.5%;总黄酮50.3%~58.5%。
13.有益技术效果:本发明提供了一种香青兰提取物在治疗血管内皮损伤的药物中的
应用,本发明研究发现,香青兰提取物可以增强内皮细胞的活力,改善内皮细胞形态学变化;促进内皮细胞膜电位升高,稳定线粒体功能,发挥内皮细胞保护作用;抑制内皮屏障功能破坏,维持血管张力和血管稳态,通过增加vegf
‑
b及其受体nrp1、vegfr1的表达有效抵抗内皮细胞损伤。
附图说明
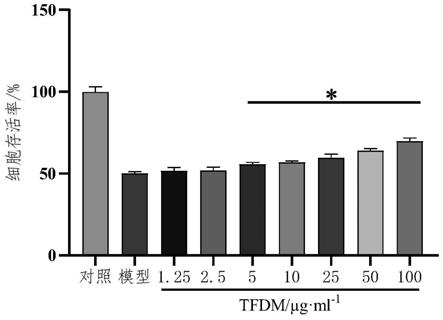
14.图1为不同浓度的香青兰提取物对人脐静脉内皮细胞毒性的影响;
15.图2为对照组、模型组和不同浓度的香青兰提取物给药组中人脐静脉内皮细胞活力;
16.图3为对照组、模型组和不同浓度香青兰提取物给药组中人脐静脉内皮细胞形态;
17.其中,图3
‑
a为未经过阿霉素诱导的对照组人脐静脉内皮细胞形态;图3
‑
b为经过阿霉素诱导的模型组人脐静脉内皮细胞形态;图3
‑
c为浓度为25μg
·
ml
‑1的香青兰提取物给药组中阿霉素诱导的人脐静脉内皮细胞形态;图3
‑
d为浓度为50μg
·
ml
‑1的香青兰提取物给药组中阿霉素诱导的人脐静脉内皮细胞形态;图3
‑
e为浓度为100μg
·
ml
‑1的香青兰提取物给药组中阿霉素诱导的人脐静脉内皮细胞形态;
18.图4为对照组、模型组和不同浓度的香青兰提取物给药组中人脐静脉内皮细胞的ldh水平;
19.图5为对照组、模型组和不同浓度的香青兰提取物给药组中人脐静脉内皮细胞细胞的sod水平;
20.图6为对照组、模型组和不同浓度香青兰提取物给药组中人脐静脉内皮细胞中红绿荧光的荧光强度;
21.图7为对照组、模型组和不同浓度香青兰提取物给药组中人脐静脉内皮细胞线粒体膜电位水平;
22.图8为对照组、模型组和不同浓度香青兰提取物给药组中小室底膜上下室侧附着的细胞情况;其中a为对照组,b为模型组,c、d、e分别为香青兰浓度为25μg
·
ml
‑1、50μg
·
ml
‑1、100μg
·
ml
‑1的香青兰提取物给药组;
23.图9为对照组、模型组和不同浓度香青兰提取物给药组中人脐静脉内皮细胞迁移数量;
24.图10为对照组、模型组和不同浓度香青兰提取物给药组中人脐静脉内皮细胞et
‑
1蛋白表达水平;
25.图11为对照组、模型组和不同浓度香青兰提取物给药组中人脐静脉内皮细胞p
‑
enos蛋白表达水平;
26.图12为对照组、模型组和不同浓度香青兰提取物给药组中人脐静脉内皮细胞fak蛋白表达水平;
27.图13为对照组、模型组和不同浓度香青兰提取物给药组中人脐静脉内皮细胞src蛋白表达水平;
28.图14为对照组、模型组和不同浓度香青兰提取物给药组中et
‑
1、fak、src和p
‑
enos蛋白表达情况;
29.图15为对照组、模型组和不同浓度香青兰提取物给药组中人脐静脉内皮细胞
vegfr1蛋白表达水平;
30.图16为对照组、模型组和不同浓度香青兰提取物给药组中人脐静脉内皮细胞vegf
‑
b蛋白表达水平;
31.图17为对照组、模型组和不同浓度香青兰提取物给药组中人脐静脉内皮细胞p
‑
ampkα蛋白表达水平;
32.图18为对照组、模型组和不同浓度香青兰提取物给药组中人脐静脉内皮细胞nrp1蛋白表达水平;
33.图19为对照组、模型组和不同浓度香青兰提取物给药组中vegf
‑
b、nrp1、vegfr1、和p
‑
ampkα蛋白表达情况。
具体实施方式
34.本发明提供了一种香青兰提取物在治疗血管内皮损伤的药物中的应用。
35.在本发明中,所述血管内皮损伤优选包括心血管内皮损伤、脑血管内皮损伤、肺血管内皮损伤,更优选为心血管内皮损伤或脑血管内皮损伤。
36.在本发明中,所述血管内皮损伤优选为阿霉素诱导的血管内皮损伤,更优选为阿霉素诱导的心血管内皮损伤、脑血管内皮损伤、肺血管内皮损伤,最优选为阿霉素诱导的心血管内皮损伤。
37.在本发明中,所述治疗血管内皮损伤的药物包括香青兰提取物和辅料。
38.在本发明中,所述香青兰提取物含有以下质量百分含量的有效组分:
39.木犀草素
‑7‑
o
‑
β
‑
d
‑
葡萄糖醛酸苷8.0%~9.0%;芹菜素
‑7‑
o
‑
β
‑
d
‑
葡萄糖醛酸苷2.0%~3.0%;迷迭香酸8.0%~11.3%;香叶木素
‑7‑
o
‑
β
‑
d
‑
葡萄糖醛酸苷7.0%~8.6%;田蓟苷13.0%~17.0%;刺槐素
‑7‑
o
‑
β
‑
d
‑
葡萄糖醛酸苷10.0%~13.5%;总黄酮50.3%~58.5%。
40.在本发明中,所述香青兰提取物优选按照专利授权公告文本cn105250366b中权利要求1的制备方法制备得到,更优选为实施例10中的制备方法制备得到的香青兰提取物。
41.本发明对所述辅料的种类和用量不作特别限定,根据不同剂型要求常规添加即可。在本发明中,所述药物的剂型优选包括注射用药剂或口服用药剂,更优选为口服用药剂,最优选为口服水溶液。
42.为了更好地理解本发明,下面结合实施例进一步阐明本发明的内容,但本发明的内容不仅仅局限于下面的实施例。
43.实施例1
44.1实验材料
45.1.1药物与试剂
46.香青兰提取物按照按照专利授权公告文本cn 105250366 b中实施例10的制备方法制备得到;无糖dmem培养基、胎牛血清(fetal bovine serum,fbs)购自gibco公司;0.25%胰酶,dmem高糖培养基购自美国hyclone公司;cck
‑
8试剂盒、广谱磷酸酶抑制剂,美国博士德生物;乳酸脱氢酶(lactate dehydrogenase,ldh)和超氧化物歧化酶(superoxide dismutase,sod)试剂盒,南京建成生物工程研究所;sds
‑
page凝胶快速配制试剂盒,中国碧云天生物技术有限公司;bca蛋白定量试剂盒购自美国pierce;ripa强裂解液、苯甲基黄酰
氟化物pmsf试剂、线粒体膜电位检测试剂盒(jc
‑
1)购自北京索莱宝科技有限公司;彩色蛋白marker,美国thermo fisher;vegf
‑
b抗体(ab185696)、vegf receptor 1抗体(ab32152)、neuropilin 1抗体(ab81321)、p
‑
enos抗体(ab215717)、src抗体(ab40660)、et
‑
1抗体(ab2786)购自英国abcam;ampkα抗体(cst2532)、p
‑
ampkα抗体(cst2535)、enos抗体(cst32027s)、fak抗体(3285s)、购自美国cell signaling technology;gapdh抗体、山羊抗小鼠igg/辣根酶标记和山羊抗兔igg/辣根酶标记二抗,中国中杉金桥;ecl发光液,美国millipore。
47.1.2主要仪器
48.细胞培养箱,美国thermo fisher;多功能微孔板检测仪,瑞士tecan spark;多功能成像系统,法国vilber;电泳仪和电泳槽,美国bio
‑
rad;台式高速冷冻离心机tgl
‑
16k,湖南湘仪实验室仪器开发有限公司。
49.1.3细胞株及细胞培养
50.人脐静脉内皮细胞(huvec)购自深圳市豪地华拓生物科技有限公司,培养于含10%fbs的dmem高糖培养基中。当内皮细胞生长至融合度达85%
‑
90%时,用胰酶
‑
edta(0.25%)溶液消化细胞,并将其置于细胞培养箱中(37℃、5%co2)进行传代培养,在对数生长期进行实验。
51.1.4dox损伤细胞模型建立及分组给药
52.huvec细胞随机分为对照组、模型组和tfdm各浓度组(25、50、100μg/ml)。tfdm预处理12h后用1μm的dox诱导24h,模拟dox损伤内皮细胞的病理变化。
53.2方法
54.2.1细胞活力检测
55.将huvec细胞(5x104个/ml)接种于96孔板中,每组6个复孔,分组及处理,按照cck
‑
8试剂盒说明书方法检测细胞活力,多功能微孔板检测仪在450nm波长处测定各组吸光度值(optical density,od)。
56.细胞存活率(%)=(od
实验组
‑
od
空白组
)/(od
对照组
‑
od
空白组
)
×
100%
57.2.2huvec细胞形态学观察
58.取对数生长期huvec细胞,制备成细胞悬液,计数,调整细胞密度为2.5
×
105个/ml,每孔2ml,将细胞接种于6孔培养板。分组及处理,倒置显微镜下观察huvec形态改变。
59.2.3细胞内ldh和sod检测
60.将huvec细胞(5x104个/ml)接种于96孔板,分组和给药造模,按照检测试剂盒说明书测定细胞损伤后释放的乳酸脱氢酶(ldh)和超氧化物歧化酶(sod)的水平。
61.2.4线粒体膜电位检测
62.取对数生长期huvec细胞,将细胞接种于6孔培养板,细胞分组和给药造模。去除培养基,pbs清洗2次,加入1ml培养基和1ml配制好的jc
‑
1染色工作液,混匀,置于细胞培养箱(37℃、5%co2)中于孵育20分钟。孵育结束后,jc
‑
1染色缓冲液清洗2次,加入细胞培养液,在荧光显微镜下观察、拍照。
63.2.5huvec细胞迁移能力检测
64.消化、重悬各组待测细胞,以无糖培养基调整细胞密度为1
×
106个/ml,取200μl接种至transwell小室上室,下室中则加入500μl含10%fbs的高糖培养基。孵育适当时间后将
小室取出,pbs清洗,4%中性甲醛固定20min,苏木素染色30min。最后在光学显微镜200倍视野下观察,随机取5个视野进行计数,统计分析。
65.2.6免疫印迹法(western blot)检测相关蛋白表达
66.取对数生长期huvec细胞,接种于6孔板,分组和给药造模。弃去细胞上清,用预冷的pbs洗涤3遍,加入ripa(强)裂解液(含1%蛋白磷酸酶抑制剂和1%pmsf),冰上裂解30min。低温离心(12000r
·
min
‑1、10min),使用bca试剂盒测定蛋白样品浓度,按比例加入蛋白上样缓冲液,金属浴煮蛋白(95℃、5min)使其变性,
‑
20℃冷冻保存。配制sds
‑
多聚丙烯酰胺凝胶,上样,电泳,转膜至pvdf膜,5%脱脂奶粉封闭。加入一抗孵育过夜(4℃)、二抗孵育(常温)、ecl显影。多功能成像系统采集显影后的图像,使用image j软件分析条带灰度。
67.2.7数据处理
68.采用graphpad prism 8.0软件进行数据处理和作图,结果均以表示,采用单因素方差anova进行多组数据间比较分析,认为p<0.05差异具有统计学意义。
69.3结果
70.3.1tfdm对dox损伤的huvec细胞活力的影响
71.图1为不同浓度的香青兰提取物对人脐静脉内皮细胞毒性的影响;如图1所示,1.25、2.5、5、10、25、50和100μg
·
ml
‑1tfdm作用huvec细胞36h,对细胞存活率均无明显影响,均为无毒浓度。为确定tfdm对dox损伤是否具有改善作用,本研究采用相应浓度tfdm干预,测定细胞活力。图2为对照组、模型组和不同浓度的香青兰提取物给药组中人脐静脉内皮细胞存活率。如图2所示,与对照组相比较,模型组细胞活力明显下降;与模型组比较,tfdm的质量浓度分别为5、10、25、50和100μg
·
ml
‑1时,细胞存活率明显升高(*代表与模型组相比p<0.05)。上述结果说明,tfdm可改善dox损伤,使huvec细胞活力增强。因此,后续实验选用的tfdm质量浓度分别为25、50和100μg
·
ml
‑1。
72.3.2huvec细胞形态学观察
73.图3为对照组、模型组和不同浓度香青兰提取物给药组中人脐静脉内皮细胞形态,如图3
‑
a所示,对照组huvec细胞生长状态良好,细胞呈长梭形、扁平型、多角形,排列紧密;如图3
‑
b所示,模型组huvec生长停滞,细胞数量减少,体积缩小,胞浆中有暗色颗粒,部分变圆,脱落;如图3
‑
c、图3
‑
d和图3
‑
e所示,tfdm低、中、高剂量组细胞多呈长梭形、扁平型、多角形,收缩变圆细胞明显减少。tfdm能够显著改善dox引起的内皮细胞形态学变化。
74.3.3tfdm对dox损伤的huvec细胞ldh和sod水平的影响
75.采用ldh和sod试剂盒检测细胞损伤程度。结果如图4和图5所示,由图4可知,与对照组比较,模型组细胞ldh释放显著升高;与模型组比,tfdm低、中、高剂量给药组则显著降低ldh水平(#代表与对照组相比p<0.05,*代表与模型组相比p<0.05),由图5可知,与对照组比,模型组细胞sod活性显著降低;与模型组比较,tfdm干预后呈剂量依赖性地升高dox损伤细胞内sod活性(#代表与对照组相比p<0.05,*代表与模型组相比p<0.05)。由此说明tfdm能够减轻或恢复dox引起的huvec细胞损伤;
76.3.4tfdm对dox损伤的huvec细胞线粒体膜电位的影响
77.图6为对照组、模型组和不同浓度香青兰提取物给药组中人脐静脉内皮细胞中荧光迁移水平,图7为对照组、模型组和不同浓度香青兰提取物给药组中人脐静脉内皮细胞细胞膜电位水平。由图6和图7可知,与对照组相比较,模型组细胞红色荧光向绿色荧光转移,
线粒体膜电位显著降低,tfdm组与模型组相比,可减少红色荧光向绿色荧光转移;tfdm组细胞膜电位升高,稳定线粒体功能,发挥细胞保护作用(#代表与对照组相比p<0.05,*代表与模型组相比p<0.05)。
78.3.5tfdm对dox损伤的huvec细胞迁移能力的影响
79.transwell小室实验检测结果如图8和图9所示,与对照组相比,模型组穿膜细胞数量减少,模型组细胞迁移能力减弱;与模型组相比,tfdm中、高剂量处理组穿模细胞数量增多,细胞迁移能力增强;tfdm低剂量处理组与模型组穿膜细胞数量相比差异没有统计学意义(#代表与对照组相比p<0.05,*代表与模型组相比p<0.05)。
80.3.6tfdm对dox损伤的huvec细胞内皮功能障碍的影响
81.非受体酪氨酸激酶(src)和粘着斑激酶(focal adhesion kinase,fak)是血管内皮屏障功能的主要调控因素,内皮素
‑
1(endothelin 1,et
‑
1)是维持血管张力和血管稳态中其重要作用,内皮型一氧化氮合酶(endothelial nitric oxide synthase,enos)是内皮细胞产生的最重要的舒血管因子,可以维持血管平衡稳态。本研究通过蛋白免疫印迹(western blotting)方法对et
‑
1、fak、src和p
‑
enos的表达进行了检测。结果如图10~图14所示,与对照组比,dox处理后的huvec细胞et
‑
1蛋白水平明显升高,fak、src、p
‑
enos蛋白水平降低;但与模型组比,tfdm保护可显著下调et
‑
1蛋白水平,升高fak、src和p
‑
enos的蛋白表达(#代表与对照组相比p<0.05,*代表与模型组相比p<0.05)。为说明tfdm可以抑制内皮屏障功能破坏,维持血管张力和血管稳态,从而发挥抑制dox损伤huvec细胞内皮功能障碍的作用。
82.3.7tfdm对dox损伤的huvec细胞vegf
‑
b/ampkα通路相关蛋白表达的影响
83.结果如图15~图19所示,与对照组比较,dox损伤后huvec细胞ampkα蛋白磷酸化水平降低,vegf
‑
b、nrp1、vegfr1表达水平降低。而tfdm干预后使vegf
‑
b、nrp1、vegfr1和p
‑
ampkα蛋白表达水平升高(#代表与对照组相比p<0.05,*代表与模型组相比p<0.05),提示,tfdm通过增加vegf
‑
b及其受体nrp1、vegfr1的表达有效抵抗阿霉素造成的内皮细胞损伤。
84.综上所述,tfdm可明显抑制dox引起的内皮细胞损伤,不仅可以促进内皮细胞生存和增殖,改善细胞形态,还可以抑制线粒体功能障碍,从而发挥抑制dox损伤的huvec细胞的作用。其涉及的机制可能与增强了vegf
‑
b/ampkα信号通路活性有关。
85.以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。

