1.本发明属于蛋白通道结构和功能研究领域,具体地涉及一种基于荧光染料摄取的批量半通道功能水平检测方法。
背景技术:
2.动物细胞在由独立通讯途径形成的复杂网络中相互作用,包括直接(细胞间)细胞接触和旁分泌/自分泌(细胞外)信号系统[evanswh,e.devuyst,leybaert l(2006).the gap junction cellular internet:connexin hemichannels enter the signalling limelight.biochem j 397:1
–
14.]。这一系统主要由广泛表达于体内多种细胞的间隙连接蛋白的特定功能实现。间隙连接蛋白六聚体可以在细胞膜上形成一种通道形式的结构,相邻两个细胞的间隙连接蛋白六具体相连就构成了细胞间隙连接通讯(gap junction intercellular communication,gjic),选择性允许小于1kd的分子或物质通过(如atp、adp、葡萄糖、谷氨酸、谷氨酰胺、第二信使如camp和三磷酸肌醇等),在细胞代谢偶联和电偶联中具有重要作用[saez j c,berthoud v m,branes m c,et al.plasma membrane channels formed by connexins:their regulation and functions[j].physiol rev.2003,83(4):1359
‑
400.]。相对于gjic这种“全通道”,间隙连接蛋白六聚体在未对接的质膜上可以作为独立的功能性通道存在,介导细胞内与细胞外间隙的物质交换(物质种类与gjic相同),与传统的gjic的功能明显不同[许洛伊,汪敬业,罗本燕,et al.pannexins通道蛋白特性及研究方法进展[j].生理科学进展.2010,41(06):423
‑
8.],一般将这种通道结构称之为半通道(hemichannel)。
[0003]
脊椎动物中的通道蛋白有connexin和pannexin两类,一般认为后者仅可以构成半通道而无形成间隙连接通讯的功能。connexin和pannexin没有序列同源性,但其蛋白在拓扑结构上具有很高的相似性(见图1a和图1b,分别为connexins和pannexins间隙连接蛋白拓扑结构图,两种连接蛋白的分子量分别为connexin43:43kd,pannexin 1:48.1kd)。这三个间隙连接蛋白家族均具有四个跨膜亲水片段,两个胞外环和一个胞内环。连接蛋白的羧基末端与氨基末端均位于胞内,氨基末端较为保守,羧基末端则差别较大,羧基末端对间隙连接的形成及调控有很大影响。
[0004]
在生理条件下,细胞膜表面的半通道通常表现为较低开放活性,主要起到自分泌和旁分泌调节的作用,但当细胞受到刺激或细胞内外环境发生改变时,半通道的活性可能明显增加[price gw,chadjichristos ce,kavvadas p,tang scw,yiu wh,green cr,potter ja,siamantouras e,squires pe,hills ce.blocking connexin
‑
43mediated hemichannel activity protects against early tubular injury in experimental chronic kidney disease.cell commun signal.2020may 25;18(1):79.]。半通道的开放可以介导细胞内atp释放、细胞间钙波传递,参与多种生理病理反应。半通道具有对刺激响应快速、阈值低的特点,针对许多外界刺激特别是低剂量的(环境相关剂量)刺激都可以展现出一定的开放水平变化,特别是对纳米污染物类对细胞膜的机械刺激尤为敏感[fan j,
chen y,yang d,shen j,guo x.multi
‑
walled carbon nanotubes induce il
‑
1βsecretion by activating hemichannels
‑
mediated atp release in thp
‑
1macrophages.nanotoxicology.2020sep;14(7):929
‑
946.yang d,shen j,fan j,chen y,guo x.paracellular permeability changes induced by multi
‑
walled carbon nanotubes in brain endothelial cells and associated roles of hemichannels.toxicology.2020jul;440:152491.yang d,xu j h,deng f r,et al.[effects of silver nanoparticle on hemichannel activation and anti
‑
proliferation in hacat cells][j].beijing da xue xue bao yi xue ban,2017,49(3):371
‑
5.wei h,deng f,chen y,et al.ultrafine carbon black induces glutamate and atp release by activating connexin and pannexin hemichannels in cultured astrocytes[j].toxicology,2014,323(32
‑
41.],因此半通道检测具有很大的价值,可以作为评价环境纳米污染物危害的一种技术手段。
[0005]
目前针对半通道功能状态的检测方法主要包括两大类,其中一类旨在识别和表征半通道蛋白的相对表达量,包括表面蛋白的生物素化与相关的免疫印迹分析、质膜部分的相对蛋白质含量的测量、荧光可视化(例如,免疫荧光、结合细胞外的荧光肽,半通道结构域,或用荧光蛋白标记的连接蛋白)、电子显微镜和原子力显微镜成像。另一类方法则基于半通道功能的检测和表征,主要包括荧光染料摄取法和全细胞膜片钳法。
[0006]
第一类检测方法虽然可以相对准确的对细胞表面的半通道蛋白量进行半定量评价,然而半通道在生理状态下大多处于低开放活性状态,一些时间较短和强度较弱的刺激往往仅能影响其开放状态而不能对其表达量造成显著改变,因此仅仅从表达量方面的评价并不能客观的评估其真正的功能状态,可能会产生假阴性结果。此外,由于构成半通道和间隙连接通讯通道的蛋白结构基础是一样的,单纯的对通道蛋白表达量的表征难以确定其中用于构成半通道蛋白的比例,导致评价的针对性较差。最后,无论是生物素化检测还是免疫印迹分析、免疫荧光乃至电子显微镜检测都具有检测成本高,预处理繁琐,检测时间长的缺点。
[0007]
针对半通道功能的检测可以有效弥补第一类检测方法对半通道开放水平评价能力的短板,还可以通过使用特异性的通道抑制剂来单独抑制半通道和间隙连接通讯通道功能,从而准确评价半通道功能水平变化。其中全细胞膜片钳技术通过膜片电极接触细胞膜,对膜片上的离子通道的离子电流进行监测,根据跨膜离子电流的膜电导(膜电阻倒数)对膜通透性进行评估的方法。但膜片钳技术也存在一定的局限性,一方面其膜片电极的配置可能会导致细胞内的某些因子和代谢物的析出从而影响半通道功能,另一方面,其检测的通透性变化涉及配体门控性、电压门控性、第二信使介导的离子通道、机械敏感性离子通道以及间隙连接通道等等的变化的集合,并非仅仅反映半通道功能水平。
[0008]
荧光染料摄取法也是一类广泛用于半通道检测和研究的方法,最早由ross johnson及其合作者在哺乳动物细胞中使用[li h,liu tf,lazrak a,peracchia c,goldberg gs,lampe pd,johnson rg(1996).properties and regulation of gap junctional hemichannels in the plasma membranes of cultured cells.j cell biol 134:1019
–
1030.]。荧光染料摄取法主要通过将细胞暴露于具有特定分子量(可以通过半通道孔径)的细胞外荧光渗透性示踪剂(例如阴离子染料荧光黄、5,6
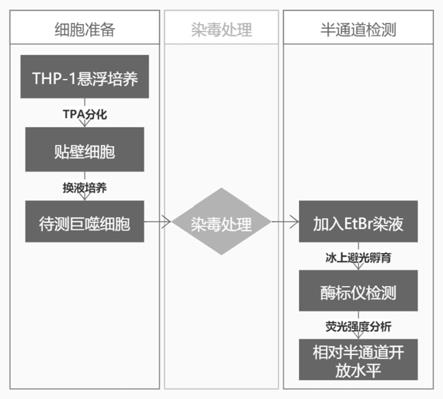
‑
羧基荧光素和阳离子探
针溴化乙锭、碘化丙啶和dapi等)[johnson rg,le hc,evenson k,loberg sw,myslajek tm,prabhu a,manley am,o'shea c,grunenwald h,haddican m,fitzgerald pm,robinson t,cisterna ba,s
á
ez jc,liu tf,laird dw,sheridan jd.connexin hemichannels:methods for dye uptake and leakage.j membr biol.2016dec;249(6):713
‑
741.doi:10.1007/s00232
‑
016
‑
9925
‑
y.epub 2016sep 1.pmid:27586664.],细胞外染料经过一段时间后通过半通道进入细胞内,洗掉细胞外染料后于荧光显微镜下对细胞进行观察拍照,通过图像处理软件量化每个细胞中的荧光强度从而评价其半通道功能水平。
[0009]
荧光染料摄取半通道检测方法的通常操作步骤如下:
[0010]
(1)以适合的浓度接种细胞于培养皿,经染毒或实验设计暴露操作后,于显微镜下对细胞进行观察,选择适宜进行半通道荧光染料摄取检测的“目标区域”(细胞密度较低,有大量单个存在状态细胞的区域),这步的目的是通过将这些不与其它细胞相接触的个体作为观察对象以排除观察到的染料摄取现象受到细胞间隙连接通讯(gjic)所产生的影响(避免出现细胞间染料传递的情况)。
[0011]
(2)使用适宜浓度的钙黄绿素乙酰氧基甲酯(calcein am)标记所有细胞,该步骤的目的是识别出所有活细胞,以进一步划定后续荧光强度分析的评价细胞范围;部分研究者还会合并使用碘化丙啶(propidium iodide,pi)染料,由于pi不能穿透活细胞的细胞膜,因此被用来识别死亡和细胞膜完整性受损的细胞(以排除出后续检测)。
[0012]
(3)配置荧光摄取染料至工作浓度和ph,通常使用的包括罗丹明(rhodamine)、5(6)
‑
羧基荧光素(5,6
‑
carboxyfluorescein)、溴化乙锭(ethidium bromide,etbr)等。
[0013]
(4)机械及化学刺激半通道开放,去除细胞培养上清液,使用不含钙离子的缓冲液润洗细胞3次(其作用是通过创造低钙环境诱导细胞表面的半通道开放);将固定体积的荧光染液使用微量移液器以固定高度(2
‑
10厘米不等)滴加于细胞表面(其作用是通过染液坠落的势能带来的机械冲击进一步刺激细胞表面半通道的开放),加入染液后将细胞置于黑暗环境中5
‑
10分钟让荧光染料进入细胞。
[0014]
(5)使用含钙例子的缓冲液彻底清洗细胞表面的残余染料,该步骤的目的一是去除多余的荧光染料以确保荧光强度观察期间背景保持低信号强度,二是通过高钙环境诱导细胞表面的半通道关闭,以确保先前摄取的染料在观察期间保留在细胞内。
[0015]
(6)使用荧光显微镜对目标区域细胞进行观察并拍摄照片,随后使用图像分析软件对细胞的荧光强度进行定量分析,根据荧光强度计算其相对半通道数量。
[0016]
现有的荧光染料摄取法在检测半通道功能水平方面存在一定的缺陷和不足:
[0017]
(1)难以反映半通道功能水平真实情况
[0018]
传统检测方法的一些关键步骤如添加荧光染料前使用低钙缓冲液润洗细胞和通过移液器从一定高度滴加染料施加的机械力刺激都是通过外部干涉手段使细胞表面的半通道全部开放,由此通过摄取染料的荧光强度检测出的结果反映的是细胞表面的半通道的相对数量,但这样的检测忽略了半通道具有选择开放性的关键特性,难以反映所检测的目标刺激对细胞半通道功能水平的真实影响。
[0019]
(2)难以解决细胞间隙通讯连接造成的混杂
[0020]
传统的荧光染料摄取法并未对适用的细胞种类进行限定,大部分人体组织细胞在培养皿中是成片生长的,细胞间通过细胞间隙连接(gjic)相互交流细胞必须的信号因子等
物质是其正常生长并表达功能的前提条件,但由于gjic在构成单元和物质输送功能方面和半通道有很大的重叠,因此对于荧光染料摄取法来说是一个非常大的混杂因素,传统检测的解决方法是通过调整细胞接种密度,形成细胞单独生长的区域,并对这些细胞的半通道水平进行检测。然而这一方案却存在很大的检测偏倚,首先单独生长的细胞的生理状态和功能和正常成片生长的细胞具有一定的区别,可能对于刺激更为敏感,另外由于与其它细胞不相接,细胞表面原本用于形成gjic的通道蛋白可能也会被当作半通道检测出来,导致实验结果的失准。
[0021]
(3)操作复杂
[0022]
由于荧光染料摄取法问世已久,部分操作步骤设置的初衷是针对早期使用的荧光染料特性,但随着方法和染料的演进已不再必要,但仍由于传统而保留下来,此外检测还需要使用荧光显微镜拍摄照片并使用图像处理软件分析,整体操作过程非常繁琐费时。
技术实现要素:
[0023]
本发明的目的在于提供一种基于荧光染料摄取的批量半通道功能水平检测方法。
[0024]
为实现上述目的,本发明提供的基于荧光染料摄取的批量半通道功能水平检测方法,主要包括细胞培养和荧光染料摄取检测两部分:
[0025]
(1)悬浮培养
[0026]
取悬浮培养细胞系的thp
‑
1细胞,使用添加β巯基乙醇的标准rpmi1640培养液,日常维持培养通过定期添加或替换培养液来保障细胞的生存环境稳态,换液周期2
‑
3天;监测细胞悬液浓度不超过1
×
106个/ml;
[0027]
细胞悬液调整浓度为4
×
105个/ml,添加十四烷酰佛波醇乙酸酯,将细胞悬液接种于96孔板,24小时后换液去除未贴壁细胞,即完成巨噬细胞形态分化;
[0028]
使用空白rpmi1640培养液维持培养一段时间以去除十四烷酰佛波醇乙酸酯的作用效应,细胞做好染毒处理准备;
[0029]
(2)荧光染料摄取检测半通道活性
[0030]
细胞染毒处理后,采用溴化乙锭为荧光染料,使用标准rpmi1640培养液配置浓度为25μm的溴化乙锭荧光染色储备液,将溴化乙锭染色储备液加入96孔板中,添加荧光染液后将96孔板置于冰上,避光孵育,将96孔板置入荧光酶标仪检测荧光强度结果。
[0031]
所述基于荧光染料摄取的批量半通道功能水平检测方法,其中,标准rpmi1640培养液中添加的β巯基乙醇为5μm。
[0032]
所述基于荧光染料摄取的批量半通道功能水平检测方法,其中,添加十四烷酰佛波醇乙酸酯至终浓度为15ng/ml。
[0033]
所述基于荧光染料摄取的批量半通道功能水平检测方法,其中,使用空白rpmi1640培养液维持培养24小时以去除十四烷酰佛波醇乙酸酯的作用效应。
[0034]
所述基于荧光染料摄取的批量半通道功能水平检测方法,其中,96孔板规格为100μl/孔,采用全黑培养板或黑色底透培养板类型,且细胞接种孔周围需要至少间隔1
‑
2个空白孔。
[0035]
所述基于荧光染料摄取的批量半通道功能水平检测方法,其中,溴化乙锭染色储备液按10μl/孔加入96孔板中,并在孔中稀释成2.5μm的染色工作液。
[0036]
所述基于荧光染料摄取的批量半通道功能水平检测方法,其中,将添加溴化乙锭染色储备液的96孔板置于4℃避光孵育5
‑
10分钟。
[0037]
所述基于荧光染料摄取的批量半通道功能水平检测方法,其中,荧光酶标仪的激发波长508nm,发射波长605nm。
[0038]
本发明的检测方法是在传统荧光染料摄取法基础上优化形成,从半通道功能水平检测角度出发,对每个操作步骤进行原理分析,仅保留必须步骤,精简操作流程的同时确保检测可反映真实情况下的半通道开放生理状态;通过摸索多孔板
‑
酶标仪荧光强度检测条件避开了荧光显微镜 图像处理软件的实验结果分析方法,有效简化实验操作难度;提出使用人外周血单核细胞(thp
‑
1)转化巨噬细胞作为检测细胞模型,由于巨噬细胞具有高表达通道蛋白且不互相形成gjic的特性,使得其天然适合这项检测方法,可有效降低使用普通组织细胞带来的实验结果失准问题。
附图说明
[0039]
图1a和1b为背景技术中connexins和pannexins间隙连接蛋白拓扑结构图。
[0040]
图2是本发明流程示意图。
[0041]
图3和图4a、图4b、图4c为本发明具体实施例的结果图。
[0042]
图5为本发明与传统技术的结果比较示意图。
具体实施方式
[0043]
本发明改进了传统荧光染料摄取半通道检测方法,使其更为方便快捷并能够反映真实的半通道功能水平,突破必须通过荧光显微镜观察拍照通过对图片进行分析处理才能获得实验结果的技术瓶颈,通过规定检测所使用细胞种类规避半通道检测易受到细胞间隙连接通讯影响的传统难题。
[0044]
请参阅图2,为本发明的流程示意图。
[0045]
本发明的具体技术方案分为细胞培养和荧光染料摄取检测两部分:
[0046]
thp
‑
1细胞培养及分化
[0047]
(1)悬浮培养
[0048]
thp
‑
1细胞为悬浮培养细胞系,使用添加5μmβ巯基乙醇的标准rpmi1640培养液,日常维持培养通过定期添加或替换培养液来保障thp
‑
1的生存环境稳态,换液周期2
‑
3天。培养过程中应定期监测细胞悬液浓度,不得超过1
×
106个/ml;细胞悬液达到8
×
105个/ml时达到传代要求,对悬液进行离心重悬调整细胞浓度为2
×
105个/ml接种于新培养瓶。
[0049]
(2)巨噬细胞形态分化
[0050]
thp
‑
1细胞悬液调整浓度为4
×
105个/ml,添加十四烷酰佛波醇乙酸酯(tpa)至终浓度为15ng/ml,将细胞悬液接种于96孔板(100μl/孔),24小时后换液去除未贴壁细胞,即完成了thp
‑
1细胞的巨噬细胞形态分化。再使用空白rpmi1640培养液维持培养24小时以去除tpa的作用效应,至此thp
‑
1分化的巨噬细胞可以用于染毒检测。
[0051]
需注意的是96孔板应采用全黑培养板或黑色底透培养板类型,且细胞接种孔周围需要至少间隔1
‑
2个空白孔,以避免荧光逸出带来的检测误差。
[0052]
本发明采用thp
‑
1转化巨噬细胞作为检测方法细胞模型有多方面考虑:首先巨噬
细胞具有高表达通道蛋白且不互相形成gjic的特性,使得其天然适合这项检测方法,可有效降低使用普通组织细胞带来的实验结果失准问题;其次thp
‑
1人外周血单核细胞为成熟的体外悬浮培养细胞系,易于获取且培养难度低;第三是thp
‑
1为人类细胞,所测得的结果具有人体健康相关性。
[0053]
半通道活性测定
[0054]
96孔板接种的细胞处理结束后,采用溴化乙锭(etbr)作为荧光染料进行摄取实验测定thp
‑
1巨噬细胞的半通道功能,具体步骤如下:
[0055]
(1)使用标准rpmi1640培养液配置浓度为25μm的染色储备液;
[0056]
(2)使用多通道移液器将etbr储备液按10μl/孔加入96孔板中(在孔中稀释成2.5μm的染色工作液)。这步需要注意操作的轻柔,尽量不要对96孔板产生机械震动影响,移液器在添加染液的过程中应做到枪头贴壁,缓慢轻柔加入染液,各排孔的染液添加时间间隔应尽量小;
[0057]
(3)添加荧光染液后将96孔板置于冰上(约4℃),避光孵育5
‑
10分钟;
[0058]
(4)将96孔板置入荧光酶标仪检测荧光强度结果(激发波长508nm,发射波长605nm),可使用固定时常检测模式(染料摄取固定时间后检测,以单次的检测荧光强度作为评价半通道开放水平依据)或定时检测模式(每隔30秒或1分钟检测一次,连续监测10
‑
15分钟,绘制散点图,直线回归,计算其斜率作为评价半通道开放水平依据)。操作时应注意取消酶标仪检测前的摇板步骤,以防机械力刺激对半通道开放水平产生影响,此外可根据所用96孔板特性选取检测模式,全黑96孔板需选取顶读模式,底透黑96孔板可在顶读和底读模式间选取(具体如何取舍可视预实验结果而定,由于细胞贴底生长,如所用底透96孔板的底板透光率高的情况下使用底读可能比顶读所得数据更为准确)。
[0059]
本发明去除了传统荧光染料摄取法中的多个步骤,包括:calcein am染色、细胞上清液去除和清洗、荧光染液滴加机械刺激和荧光染料清洗步骤,并使用酶标仪荧光强度检测替代荧光显微镜拍照图片分析处理的结果表征方法。
[0060]
其中细胞上清液去除和清洗及荧光染液滴加机械刺激步骤的去除是在无外部作用干涉的状况下观察半通道功能水平的真实情况,使荧光染料摄取法可以对目标刺激处理后的细胞半通道开放水平和状态进行描述。
[0061]
去除荧光染料清洗步骤是因为选取了etbr作为荧光染料,其具有独特的理化性质,属于一种细胞膜不可渗透的阳离子探针,etbr通过半通道进入细胞后可以与细胞中的dna碱基紧密结合形成复合物,失去自由流动的能力,且在紫外线激发下发出红色荧光。由于dna复合物中的溴化乙锭发出的荧光比游离态的溴化乙锭发出的荧光强大10余倍,因此不需要洗净背景中的染料即可直接上机观测。
[0062]
取消calcein am染色步骤是因为本发明的新方法使用酶标仪对多孔板中的总荧光强度进行评估,不再需要拍摄荧光显微镜照片和图像处理,因此不需要该染料确定细胞轮廓和图像分析范围。
[0063]
值得注意的是半通道功能仅在细胞整体结构和活力没有受到显著损伤的情况下(特别是细胞膜的完整性没有被破坏)才能被本发明评测,由于不再于荧光显微镜下进行观察,因此无法通过pi染色排除细胞膜破裂情况,检测所用染毒剂量和相关刺激先经过细胞活力检测(cck
‑
8、mtt类检测评价细胞活性;ldh检测评价细胞膜完整性)确定无细胞膜损伤
后再行荧光染料摄取检测。
[0064]
本发明克服了传统的荧光染料摄取法在检测半通道功能水平方面存在一定的缺陷和不足,主要表现在上述的:难以反映半通道功能水平真实情况、难以解决细胞间隙通讯连接造成的混杂和操作复杂三个方面。本发明的检测方法针对这三个方面在传统荧光染料摄取法基础进行了优化:
[0065]
(1)难以反映半通道功能水平真实情况
[0066]
针对这一问题,首先通过从半通道功能水平检测角度出发,对每个操作步骤进行原理分析,发现传统方法中的细胞培养上清液去除、润洗、荧光染料滴落机械力刺激步骤的设置都是为了通过外力使细胞表面的半通道全部开放,虽然可以增加荧光染料的摄取量并从某种程度上评价细胞表面半通道的相对数量,但无法反映真实情况下的半通道开放状态。通过研究直接添加荧光染料检测方法,发现使用etbr作为荧光染料在一定浓度下可以实现直接摄取和检测(具体分析请第三条中关于荧光染料选取的讨论),有效简化实验操作难度,同时实现了对半通道真实开放水平的检测。
[0067]
(2)难以解决细胞间隙通讯连接造成的混杂
[0068]
针对这一问题本发明采用thp
‑
1转化巨噬细胞作为检测方法细胞模型,一方面巨噬细胞具有高表达通道蛋白且不互相形成gjic的特性,因此使用该细胞系进行的荧光染料摄取检测结果理论上都使得其天然适合这项检测方法,可有效降低使用普通组织细胞带来的实验结果失准问题;另一方面thp
‑
1人外周血单核细胞为成熟的体外悬浮培养细胞系,所测得的结果具有人体健康相关性且易于获取培养难度低。
[0069]
(3)操作复杂
[0070]
针对传统荧光染料摄取法操作繁复的问题,对每个操作步骤进行原理分析,仅保留必须步骤,本发明去除了传统荧光染料摄取法中的多个步骤,包括:calcein am染色、细胞上清液去除和清洗、荧光染液滴加机械刺激和荧光染料清洗步骤,并使用酶标仪荧光强度检测替代荧光显微镜拍照图片分析处理的结果表征方法。
[0071]
其中细胞上清液去除和清洗及荧光染液滴加机械刺激步骤的目的上面第一条中已经叙述,去除这两个步骤是欲在无外部作用干涉的状况下观察半通道功能水平的真实情况,使荧光染料摄取法可以对目标刺激处理后的细胞半通道开放水平和状态进行描述。在发现直接添加染液也可观察到差异性的荧光染料摄取后遂去除此两步操作。
[0072]
去除荧光染料清洗步骤是因为选取了etbr作为荧光染料,传统法早期使用的部分染料如罗丹明等虽可通过半通道进入细胞内,也可从半通道逸出,为了防止细胞内染料的非特异性释放以及背景的高荧光强度,设置了洗去荧光染料的步骤,并在洗涤液中加入半通道阻滞剂(高钙离子浓度),操作颇为繁琐。而现在广泛使用的etbr染料具有独特的理化性质,属于一种细胞膜不可渗透的阳离子探针,etbr通过半通道进入细胞后可以与细胞中的dna碱基紧密结合形成复合物,失去自由流动的能力,且在紫外线激发下发出红色荧光。由于dna复合物中的溴化乙锭发出的荧光比游离态的溴化乙锭发出的荧光强大10余倍,因此不需要洗净背景中的染料即可直接上机观测(同时将染料的工作浓度从传统的5μm调整到2.5μm以进一步降低背景值,可通过适当延长染料摄取时间来提升细胞内的染料浓度和荧光信号强度),综上去除荧光染料清洗步骤。
[0073]
取消calcein am染色步骤是因为本发明的方法使用酶标仪对多孔板中的总荧光
强度进行评估,不再需要拍摄荧光显微镜照片和图像处理,因此不需要该染料确定细胞轮廓和图像分析范围。
[0074]
使用酶标仪荧光强度检测替代荧光显微镜拍照图片分析处理的结果表征方法一方面大幅减少了荧光染料摄取法的检测工作量,同时也提高了检测的通量,实现了不同组别大量样品半通道功能水平的同时检测。
[0075]
综上所述,本发明的方法在传统的荧光染料摄取法的基础上进行了一定的优化,有效提升了该方法对于半通道功能水平的评价准确度并显著降低了其操作的繁琐度。
[0076]
实施例
[0077]
以下结合一具体实施例和附图对本发明作进一步的描述。
[0078]
使用本发明的方法对多壁碳纳米管染毒后的thp
‑
1巨噬细胞半通道功能水平进行检测:
[0079]
thp
‑
1细胞准备
[0080]
取对数生长期thp
‑
1细胞悬液调整浓度为4
×
105个/ml,添加十四烷酰佛波醇乙酸酯(tpa)至终浓度为15ng/ml,将细胞悬液接种于底透黑96孔板(corning 3603)(100μl/孔,间隔2孔接种),24小时后换液去除未贴壁细胞,使用空白rpmi1640培养液维持培养24小时,染毒备用。
[0081]
多壁碳纳米管染毒
[0082]
thp
‑
1巨噬细胞接种48小时后(接种24小时后换液空白培养24小时以去除tpa影响),加入rpmi1640培养液稀释且超声分散的多壁碳纳米管悬液处理细胞。染毒终浓度为0(对照组)、0.1、1、10μg/ml(所用剂量经预实验cck
‑
8及ldh检测验证无细胞损害效应),处理24小时。
[0083]
半通道活性测定
[0084]
96孔板接种的细胞处理结束后,使用多通道移液器将etbr储备液按10μl/孔轻柔快速地加入96孔板中(在孔中稀释成终浓度2.5μm的染色工作液,移液器在添加染液的过程中应做到枪头贴壁,缓慢轻柔加入染液,各排孔的染液添加时间间隔应尽量小)。后将96孔板置于冰上(约4℃),避光孵育。
[0085]
接下来对细胞摄取的荧光染料量进行检测分析,此处产生两种检测变形:
[0086]
(1)避光孵育15分钟后取出,置入荧光酶标仪检测荧光强度结果(激发波长508nm,发射波长605nm,底读,取消摇板),检测3次,以检测的平均荧光强度作为评价半通道开放水平依据。
[0087]
将酶标仪检测到的不同处理组细胞的平均荧光强度作为细胞摄取荧光染料量的评价指标,用以代表细胞表面半通道开放情况,以对照组为基准,各处理组相对于对照组荧光染料摄取的倍数进行绘图,可以发现多壁碳纳米管染毒在造成了剂量依赖性的半通道开放水平提升,检测结果如图3所示。
[0088]
(2)避光孵育5分钟后取出,置入荧光酶标仪检测荧光强度结果(激发波长508nm,发射波长605nm,底读,取消摇板),使用定时检测模式(每隔1分钟检测一次,连续监测20分钟)所得数据绘制散点图,使用直线回归分析,通过计算拟合曲线的线性部分的斜率作为评价半通道开放水平依据。
[0089]
对照组和10μg/ml多壁碳纳米管处理组细胞的荧光强度散点图,经预实验摸索发
现,荧光染料摄取早期阶段(5分钟以内)摄取速率并不稳定,可能犹豫加入的荧光染料并未均匀分布所致,5分钟后进入线性增加阶段,根据细胞表面半通道开放数量差异,荧光染料会在10
‑
20分钟不等的时间后达到饱和,从散点图上来看荧光强度表现为平台期。通过对荧光染料线性摄取阶段的散点进行直线回归,可以拟合直线的斜率来评价细胞表面半通道的相对功能水平。实验结果显示10μg/ml多壁碳纳米管处理24小时后细胞表面半通道功能水平较对照组显著提升,结果如图4a、4b、4c所示。
[0090]
(3)为便于进行本发明与传统技术的比较,这里同时附上使用传统荧光染料摄取法检测的多壁碳纳米管对thp
‑
1巨噬细胞半通道的影响结果。检测方法:
[0091]
取对数生长期thp
‑
1细胞悬液调整浓度为4
×
105个/ml,添加十四烷酰佛波醇乙酸酯(tpa)至终浓度为15ng/ml,将细胞悬液接种于共聚焦小皿(35mm,玻底,每皿在中心的观察孔处接种800μl),24小时后换液去除未贴壁细胞,使用空白rpmi1640培养液维持培养24小时,染毒备用。
[0092]
加入rpmi1640培养液稀释且超声分散的多壁碳纳米管悬液处理细胞。染毒终浓度为0(对照组)、0.1、1、10μg/ml(所用剂量经预实验cck
‑
8及ldh检测验证无细胞损害效应),处理24小时。
[0093]
共聚焦小皿接种的细胞处理结束后,采用etbr摄取实验测定thp
‑
1巨噬细胞的半通道功能,具体步骤如下:
[0094]
(1)吸弃上清,hbss缓冲液(无ca
2
)洗涤三次。
[0095]
(2)将etbr储备液稀释成2.5μm的染色工作液,并将其加入培养皿中。
[0096]
(3)4℃,避光孵育15分钟。
[0097]
(4)吸弃染色液,hbss
‑
ca
2
缓冲液洗涤三次。
[0098]
(5)使用4%多聚甲醛固定细胞15分钟。每皿添加200μl固定液,足够覆盖共聚焦小皿中心的观察孔即可。
[0099]
(6)加入适量hbss
‑
ca
2
缓冲液覆盖细胞。
[0100]
(7)荧光显微镜下观察观察结果(激发波长508nm,发射波长605nm),拍照保存结果。
[0101]
(8)image j软件分析etbr平均荧光强度,以与对照组荧光强度的相对百分值为最终结果。
[0102]
将荧光显微镜拍摄照片使用图像软件分析后获得的不同处理组细胞的平均荧光强度作为细胞摄取荧光染料量的评价指标,用以代表细胞表面半通道数量情况,以对照组为基准,各处理组相对于对照组荧光染料摄取的倍数进行绘图,可以发现多壁碳纳米管染毒在造成了剂量依赖性的半通道开放水平提升,结果如图5所示。
[0103]
通过比对本发明和传统方法的检测结果可以发现,两种方法均检测到了半通道功能水平变化,且检测出的变化趋势是一致的。
[0104]
总体来说,本发明实现了对于半通道实际功能水平的评价,并且显著简化了传统检测方法的操作步骤,实现了多孔板批量检测,有效提高了检测效率,降低了检测门槛,具有一定的应用前景。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。