一种紫外光谱和圆二色光谱联合检测
γ
‑
聚谷氨酸絮凝过程的方法
技术领域
1.本发明涉及检测与分析领域,具体涉及一种紫外光谱和圆二色光谱联合检测γ
‑
聚谷氨酸絮凝过程的方法,能够获得γ
‑
pga与重金属离子絮凝过程中络合物
‑
絮凝体法的转变点。
背景技术:
2.微生物絮凝剂是微生物在生长过程中产生的一类具有絮凝能力的大分子物质,相比传统的无机絮凝剂和有机合成高分子絮凝剂,具有生物可降解、对环境和人体健康无害的优点,符合更严格的环境法规,逐渐成为传统絮凝剂的替代品,在食品和发酵工业、废水和水处理、生物修复等领域应用。微生物絮凝剂的絮凝过程和机理,即由溶液状态转变为絮体状态的过程和机理,影响到微生物絮凝剂的絮凝效率、絮凝成本、设备工艺设计等。为了优化絮凝效率、降低成本、促进微生物絮凝剂在各领域内的实际应用,有必要对微生物絮凝剂的絮凝过程进行监测。
3.γ
‑
聚谷氨酸(γ
‑
pga)是一种阴离子微生物絮凝剂,可在水处理和生物修复系统中用于去除重金属。γ
‑
pga的二级结构变化在重金属离子的絮凝机制中起到关键作用。目前尚未有对检测方法对γ
‑
pga絮凝重金属的过程和二级结构变化进行监测的相关报道。
技术实现要素:
4.为了监测微生物絮凝剂γ
‑
pga的絮凝过程,提高絮凝效率、节约成本、指导其实际应用及设备工艺设计,本发明根据γ
‑
pga絮凝重金属离子过程中形成的γ
‑
pga
‑
重金属离子络合物紫外(uv)和圆二色谱(cd)光谱特性,提出了一种紫外光谱和圆二色光谱联合检测γ
‑
聚谷氨酸絮凝过程的方法。
5.本发明的紫外光谱和圆二色光谱联合检测γ
‑
聚谷氨酸絮凝过程的方法,包括以下步骤:
6.a.在不同ph和离子强度条件下,配制包含不同浓度(呈梯度设置)微生物絮凝剂γ
‑
聚谷氨酸和重金属离子的混合溶液,形成含有γ
‑
pga
‑
重金属离子络合物的混合溶液。
7.b.将混合溶液过滤,过滤液加入石英比色皿中,在光谱仪上同时采集190~260nm的紫外(uv)和圆二色谱(cd)光谱,用cd光谱软件计算混合溶液过滤液的二级结构α
‑
螺旋、β
‑
折叠、β
‑
转角和无规线团含量。
8.在一优选例中,所述重金属离子为铅离子。
9.在另一优选例中,所述将混合溶液过滤是用0.22μm亲水性聚四氟乙烯滤头过滤,所述在光谱仪上同时采集是在25℃时采集。
10.在另一优选例中,所述混合溶液的ph值为3~6.7。
11.在另一优选例中,所述混合溶液的离子强度为0~50mm。
12.在另一优选例中,所用的微生物絮凝剂γ
‑
pga为地衣芽孢杆菌
(bacillus.licheniformis)atcc 9945a发酵生产的。所述γ
‑
pga的分子量范围为98~1000kda。
13.在另一优选例中,所述混合溶液中的γ
‑
pga浓度范围为10~100mg/l,铅离子的浓度范围为0~0.5mm。
14.在另一优选例中,加入石英比色皿的过滤液体积为0.1~2.5ml,石英比色皿光程为1~10mm。
15.在另一优选例中,γ
‑
pga和铅离子形成的γ
‑
pga
‑
pb络合物在230~250nm范围内有紫外吸收峰,用cd光谱软件计算的cd信号范围为200~260nm。
16.与现有技术相比,本发明具有以下有益效果:本发明提供的检测方法,能够同时检测微生物絮凝剂γ
‑
pga絮凝重金属铅离子过程中形成的络合物紫外(uv)和圆二色谱(cd)光谱特性,获得γ
‑
pga絮凝重金属铅离子的絮凝过程和二级结构α
‑
螺旋、β
‑
折叠、β
‑
转角和无规线团含量变化,结合uv和cd的数据可用于分析γ
‑
pga与重金属离子絮凝过程中溶液
‑
絮体转变点,为γ
‑
pga在实际应用中的絮凝效率优化、成本降低、絮凝机理解析提供指导。
附图说明
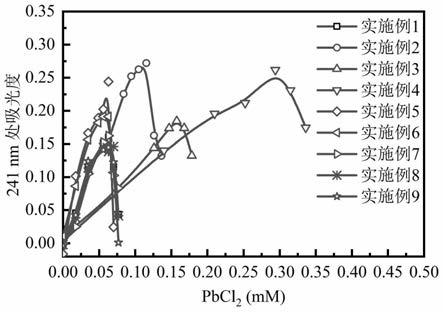
17.图1为实施例1
‑
9在γ
‑
pga絮凝铅离子过程中,过滤液的241nm处uv光谱吸光度;
18.图2为实施例1
‑
9在γ
‑
pga絮凝铅离子过程中,过滤液二级结构中的α
‑
螺旋含量;
19.图3为实施例1
‑
9在γ
‑
pga絮凝铅离子过程中,过滤液二级结构中的β
‑
折叠含量;
20.图4为实施例1
‑
9在γ
‑
pga絮凝铅离子过程中,过滤液二级结构中的β
‑
转角含量;
21.图5为实施例1
‑
9在γ
‑
pga絮凝铅离子过程中,过滤液二级结构中的无规线团含量。
具体实施方式
22.以下实施例是对本发明的进一步说明,而不是对本发明的限制。
23.以下实施例中所使用的微生物絮凝剂γ
‑
pga为地衣芽孢杆菌(bacillus.licheniformis)atcc 9945a发酵生产的,分子量范围为98~1000kda。
24.实施例1
25.分别配制10ml浓度为1000mg/l的γ
‑
pga、200ml浓度为2mm的pbcl2和200ml浓度为100mm的naf溶液备用。取0.08mlγ
‑
pga(分子量为241kda)溶液和0.8mlnaf溶液混合,并设置7组,每组分别加入7.120、7.046、6.973、6.884、6.855、6.825、6.796ml去离子水,350rpm搅拌条件下分别滴加0、0.074、0.147、0.236、0.265、0.295、0.324ml pbcl2溶液,使用0.1m的hcl和0.1m的naoh调节溶液ph至5.0,离子强度naf浓度为10mm。获得的混合溶液中γ
‑
pga终浓度为10mg/l,pbcl2终浓度分别为0、0.018、0.035、0.056、0.063、0.070、0.077mm。将混合溶液以350rpm转速搅拌10分钟,随后在室温条件下放置2小时,使其形成γ
‑
pga
‑
pb络合物。将混合溶液放置于4℃冰箱18小时,使其进一步络合平衡。将混合溶液从冰箱中取出,放置至室温,使用0.22μm亲水性聚四氟乙烯滤头过滤后取2.5ml过滤液于10mm光程石英比色皿中,使用chirascan光谱仪同时测量混合溶液在190
‑
260nm波段的uv和cd信号,样品池温度平衡在25℃。γ
‑
pga
‑
pb络合物的uv特征吸收峰在241nm,使用cd光谱软件cdnn2.1计算200~260nm范围内的cd信号,获得混合溶液过滤液的二级结构α
‑
螺旋、β
‑
折叠、β
‑
转角和无
规线团含量。当pbcl2浓度为0.063mm时,混合溶液中的γ
‑
pga
‑
pb络合物在uv光谱241nm处吸光度达到最大(图1),此后由于絮体产生,过滤液中γ
‑
pga
‑
pb络合物减少,241nm处吸光度开始降低,同时过滤液二级结构α
‑
螺旋(图2)、β
‑
折叠(图3)、β
‑
转角(图4)和无规线团(图5)含量亦出现转折。
26.实施例2
27.分别配制10ml浓度为1000mg/l的γ
‑
pga、200ml浓度为2mm的pbcl2和200ml浓度为100mm的naf溶液备用。取0.24mlγ
‑
pga(分子量为241kda)溶液和0.8mlnaf溶液混合,并设置7组,每组分别加入6.695、6.606、6.562、6.518、6.474、6.429、6.385ml去离子水,350rpm搅拌条件下分别滴加0.265、0.354、0.398、0.442、0.486、0.531、0.575ml pbcl2溶液,调节溶液ph至5.0,离子强度naf浓度为10mm。获得的混合溶液中γ
‑
pga终浓度为30mg/l,pbcl2终浓度分别为0.063、0.084、0.095、0.105、0.116、0.126、0.137mm;后续测量uv信号是取1ml过滤液于5mm光程石英比色皿中,其余步骤与实施例1相同。当pbcl2浓度为0.116mm时,混合溶液中的γ
‑
pga
‑
pb络合物在uv光谱241nm处吸光度达到最大(图1),此后由于絮体产生,过滤液中γ
‑
pga
‑
pb络合物减少,241nm处吸光度开始降低,同时过滤液二级结构α
‑
螺旋(图2)、β
‑
折叠(图3)、β
‑
转角(图4)和无规线团(图5)含量亦出现转折。
28.实施例3
29.分别配制10ml浓度为1000mg/l的γ
‑
pga、200ml浓度为2mm的pbcl2和200ml浓度为100mm的naf溶液备用。取0.4mlγ
‑
pga(分子量为241kda)溶液和0.8mlnaf溶液混合,并设置7组,每组分别加入6.800、6.505、6.269、6.181、6.137、6.093、6.048ml去离子水,350rpm搅拌条件下分别滴加0、0.295、0.531、0.619、0.663、0.707、0.752ml pbcl2溶液,调节溶液ph至5.0,离子强度naf浓度为10mm。获得的混合溶液中γ
‑
pga终浓度为50mg/l,pbcl2终浓度分别为0、0.070、0.126、0.147、0.158、0.168、0.179mm。后续测量uv信号是取0.5ml过滤液于2mm光程石英比色皿中,其余步骤与实施例1相同。当pbcl2浓度为0.158mm时,混合溶液中的γ
‑
pga
‑
pb络合物在uv光谱241nm处吸光度达到最大(图1),此后由于絮体产生,过滤液中γ
‑
pga
‑
pb络合物减少,241nm处吸光度开始降低,同时过滤液二级结构α
‑
螺旋(图2)、β
‑
折叠(图3)、β
‑
转角(图4)和无规线团(图5)含量亦出现转折。
30.实施例4
31.分别配制10ml浓度为1000mg/l的γ
‑
pga、200ml浓度为2mm的pbcl2和200ml浓度为100mm的naf溶液备用。取0.8mlγ
‑
pga(分子量为241kda)溶液和0.8mlnaf溶液混合,并设置7组,每组分别加入6.400、5.811、5.516、5.339、5.162、5.074、4.985ml去离子水,350rpm搅拌条件下分别滴加0、0.589、0.884、1.061、1.238、1.326、1.415ml pbcl2溶液,调节溶液ph至5.0,离子强度naf浓度为10mm。获得的混合溶液中γ
‑
pga终浓度为100mg/l,pbcl2终浓度分别为0、0.140、0.210、0.252、0.294、0.315、0.336mm。后续测量uv信号是取0.5ml过滤液于2mm光程石英比色皿中,其余步骤与实施例1相同。当pbcl2浓度为0.294mm时,混合溶液中的γ
‑
pga
‑
pb络合物在uv光谱241nm处吸光度达到最大(图1),此后由于絮体产生,过滤液中γ
‑
pga
‑
pb络合物减少,241nm处吸光度开始降低,同时过滤液二级结构α
‑
螺旋(图2)、β
‑
折叠(图3)、β
‑
转角(图4)和无规线团(图5)含量亦出现转折。
32.实施例5
33.分别配制10ml浓度为1000mg/l的γ
‑
pga、200ml浓度为2mm的pbcl2和200ml浓度为
100mm的naf溶液备用。取0.08mlγ
‑
pga(分子量为241kda)溶液和0.8mlnaf溶液混合,并设置7组,每组分别加入7.120、7.046、6.973、6.914、6.884、6.855、6.825ml去离子水,350rpm搅拌条件下分别滴加0、0.074、0.147、0.206、0.236、0.265、0.295ml pbcl2溶液,调节溶液ph至6.2,离子强度naf浓度为10mm。获得的混合溶液中γ
‑
pga终浓度为10mg/l,pbcl2终浓度分别为0、0.018、0.035、0.049、0.056、0.063、0.070mm,其余步骤与实施例1相同。当pbcl2浓度为0.063mm时,混合溶液中的γ
‑
pga
‑
pb络合物在uv光谱241nm处吸光度达到最大(图1),此后由于絮体产生,过滤液中γ
‑
pga
‑
pb络合物减少,241nm处吸光度开始降低,同时过滤液二级结构α
‑
螺旋(图2)、β
‑
折叠(图3)、β
‑
转角(图4)和无规线团(图5)含量亦出现转折。
34.实施例6
35.分别配制10ml浓度为1000mg/l的γ
‑
pga、200ml浓度为2mm的pbcl2和200ml浓度为100mm的naf溶液备用。取0.08mlγ
‑
pga(分子量为241kda)溶液,设置7组,每组分别加入7.120、7.046、6.973、6.914、6.884、6.855、6.825ml去离子水,350rpm搅拌条件下分别滴加0、0.074、0.147、0.206、0.236、0.265、0.295ml pbcl2溶液,调节溶液ph至5.0,离子强度naf浓度为0mm。获得的混合溶液中γ
‑
pga终浓度为10mg/l,pbcl2终浓度分别为0、0.018、0.035、0.049、0.056、0.063、0.070mm,其余步骤与实施例1相同。当pbcl2浓度为0.056mm时,混合溶液中的γ
‑
pga
‑
pb络合物在uv光谱241nm处吸光度达到最大(图1),此后由于絮体产生,过滤液中γ
‑
pga
‑
pb络合物减少,241nm处吸光度开始降低,同时过滤液二级结构α
‑
螺旋(图2)、β
‑
折叠(图3)、β
‑
转角(图4)和无规线团(图5)含量亦出现转折。
36.实施例7
37.分别配制10ml浓度为1000mg/l的γ
‑
pga、200ml浓度为2mm的pbcl2和200ml浓度为100mm的naf溶液备用。取0.08mlγ
‑
pga(分子量为98kda)溶液和0.8ml naf溶液混合,设置7组,每组分别加入7.120、7.046、6.973、6.884、6.855、6.825、6.796ml去离子水,350rpm搅拌条件下分别滴加0、0.074、0.147、0.236、0.265、0.295、0.324ml pbcl2溶液,调节溶液ph至5.0,离子强度naf浓度为10mm。获得的混合溶液中γ
‑
pga终浓度为10mg/l,pbcl2终浓度分别为0、0.018、0.035、0.056、0.063、0.070、0.077mm,其余步骤与实施例1相同。当pbcl2浓度为0.063mm时,混合溶液中的γ
‑
pga
‑
pb络合物在uv光谱241nm处吸光度达到最大(图1),此后由于絮体产生,过滤液中γ
‑
pga
‑
pb络合物减少,241nm处吸光度开始降低,同时过滤液二级结构α
‑
螺旋(图2)、β
‑
折叠(图3)、β
‑
转角(图4)和无规线团(图5)含量亦出现转折。
38.实施例8
39.分别配制10ml浓度为1000mg/l的γ
‑
pga、200ml浓度为2mm的pbcl2和200ml浓度为100mm的naf溶液备用。取0.08mlγ
‑
pga(分子量为493kda)溶液和0.8ml naf溶液混合,设置7组,每组分别加入7.120、7.046、6.973、6.884、6.855、6.825、6.796ml去离子水,350rpm搅拌条件下分别滴加0、0.074、0.147、0.236、0.265、0.295、0.324ml pbcl2溶液,调节溶液ph至5.0,离子强度naf浓度为10mm。获得的混合溶液中γ
‑
pga终浓度为10mg/l,pbcl2终浓度分别为0、0.018、0.035、0.056、0.063、0.070、0.077mm,其余步骤与实施例1相同。当pbcl2浓度为0.070mm时,混合溶液中的γ
‑
pga
‑
pb络合物在uv光谱241nm处吸光度达到最大(图1),此后由于絮体产生,过滤液中γ
‑
pga
‑
pb络合物减少,241nm处吸光度开始降低,同时过滤液二级结构α
‑
螺旋(图2)、β
‑
折叠(图3)、β
‑
转角(图4)和无规线团(图5)含量亦出现转折。
40.实施例9
41.分别配制10ml浓度为1000mg/l的γ
‑
pga、200ml浓度为2mm的pbcl2和200ml浓度为100mm的naf溶液备用。取0.08mlγ
‑
pga(分子量为684kda)溶液和0.8ml naf溶液混合,设置7组,每组分别加入7.120、7.046、6.973、6.884、6.855、6.825、6.796ml去离子水,350rpm搅拌条件下分别滴加0、0.074、0.147、0.236、0.265、0.295、0.324ml pbcl2溶液,调节溶液ph至5.0,离子强度naf浓度为10mm。获得的混合溶液中γ
‑
pga终浓度为10mg/l,pbcl2终浓度分别为0、0.018、0.035、0.056、0.063、0.070、0.077mm,其余步骤与实施例1相同。当pbcl2浓度为0.063mm时,混合溶液中的γ
‑
pga
‑
pb络合物在uv光谱241nm处吸光度达到最大(图1),此后由于絮体产生,过滤液中γ
‑
pga
‑
pb络合物减少,241nm处吸光度开始降低,同时过滤液二级结构α
‑
螺旋(图2)、β
‑
折叠(图3)、β
‑
转角(图4)和无规线团(图5)含量亦出现转折。
42.由此可见,紫外光谱和圆二色光谱联合检测能够实时且精确检测到γ
‑
pga与铅离子絮凝过程中溶液
‑
絮体转变点。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。