1.本发明涉及十字花科属间杂种的苗的生产方法和抑制十字花科属间杂种不定芽的水浸状化的方法。
背景技术:
2.近年,市场需要的是具有新的价值的蔬菜。专利文献1中公开了十字花科(brassicaceae)植物的新芽,例如西兰花芽。该新芽中包含大量萝卜硫素硫代葡萄糖苷(以下,称为“sgs”)。sgs被代谢时,变成萝卜硫素。专利文献2中公开了一种羽衣甘蓝“haiparu(
ハイパール
)”(注册商标,农林水产省品种注册第20555号)。该羽衣甘蓝包含大量硫代葡萄糖苷类。如上所述,硫代葡萄糖苷类是萝卜硫素的前体。专利文献3中公开了萝卜硫素的作用,具体而言是解毒作用、抗氧化作用等。
3.十字花科蔬菜是新型蔬菜开发中的候补之一。将十字花科蔬菜作为一个候补的原因是其中存在很多具有食用经验的蔬菜。十字花科蔬菜中包含:芸薹属的蔬菜(例如,白菜、芜菁、卷心菜、西兰花、羽衣甘蓝等)、萝卜属的蔬菜(例如,萝卜等)、豆瓣菜属的蔬菜(例如,水田芥等)、芝麻菜属的蔬菜(例如,芝麻菜等)、山嵛菜属的蔬菜(例如,山葵等)。
4.开发十字花科的蔬菜的方法各种各样,例如,种间杂交、属间杂交等。十字花科的种间杂种广泛普及,例如,甘蓝型油菜等。例如,专利文献4中公开了十字花科的种间杂种“petit vert”。另一方面,十字花科的属间杂种并不普及。
5.十字花科的属间杂种不普及的原因是表现出不稔性。表现出不稔性的植物很难使其繁殖。解决该问题的方法之一是进行组织培养。十字花科蔬菜的组织培养比较少见。这是因为开发的十字花科蔬菜大多是种间杂种。换而言之,繁殖十字花科蔬菜的常见方法为种子繁殖。如果非要举出组织培养的例子,则专利文献5中公开了山嵛菜幼苗的增殖方法。专利文献6中还公开了山嵛菜的培养法。
6.现有技术文献
7.专利文献
8.专利文献1:国际公开wo97/09889
9.专利文献2:国际公开wo2015/163442
10.专利文献3:日本特开2009
‑
148240号
11.专利文献4:日本特开2009
‑
213451号
12.专利文献5:日本特开平5
‑
130815号
13.专利文献6:日本专利第2632631号
技术实现要素:
14.发明所解决的技术问题
15.本发明所要解决的技术问题是抑制十字花科属间杂种的不定芽的水浸状化。在通
过组织培养使植物增殖,而生产苗的情况下,抑制不定芽的水浸状化是非常重要的。这是因为,水浸状化的不定芽会停止生长,不能用作苗。即,不定芽的水浸状化会使不定芽的增殖效率恶化。不定芽的增殖效率的恶化与苗的生产效率的恶化直接相关。
16.解决问题的技术手段
17.基于以上内容,本技术发明人进行深入研究而发现了,通过调整细胞分裂素类的浓度来抑制不定芽的水浸状化。即,提高细胞分裂素类的浓度时,不定芽水浸状化的比例提高,水浸状化的不定芽不生长发育,因此增殖效率恶化。从该观点出发,如下定义本发明。
18.本发明的十字花科属间杂种的苗的生产方法至少包含调整步骤。在调整中,对培养基中的细胞分裂素类的浓度进行调整,由此,抑制培养的不定芽的水浸状化。
19.本发明的十字花科属间杂种的苗的生产方法至少包含传代培养步骤。在传代培养中,使不定芽置床,并且,对传代培养基中的细胞分裂素类的浓度进行调整,由此,抑制不定芽的水浸状化。
20.本发明的抑制十字花科属间杂种的不定芽的水浸状化的方法至少包含传代培养步骤。传代培养中,使不定芽置床,并且,对传代培养基中的细胞分裂素类的浓度进行调整。
21.发明效果
22.本发明能够抑制十字花科属间杂种的不定芽的水浸状化。即,能够提高十字花科属间杂种的不定芽的增殖效率。
附图说明
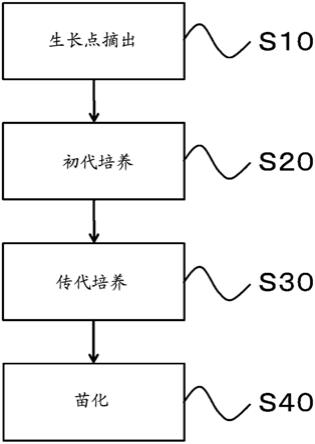
23.[图1]本实施方式的生产方法的流程图
具体实施方式
[0024]
<十字花科属间杂种>
[0025]
十字花科属间杂种是指属于十字花科(brassicacear)而彼此属于不同的属的植物相互杂交而产生的植物。属于十字花科的植物,例如可举出:芸薹属植物(白菜、芜菁、青梗菜、小松菜、高菜、水菜、卷心菜、西兰花、花椰菜、孢子甘蓝、球茎甘蓝、羽衣甘蓝等)、萝卜属植物(萝卜等)、豆瓣菜属植物(水田芥等)、白芥属植物(白芥等)、芝麻菜属植物(芝麻菜等)、辣根属植物(辣根等)、山嵛菜属植物(山嵛菜等)。优选为芸薹属植物与萝卜属植物的属间杂种,进一步优选为羽衣甘蓝与萝卜的属间杂种。最优选为农林水产省品种注册申请编号第33291号(申请品种的名称:santevert 48)。
[0026]
<多芽体>
[0027]
多芽体是指具有多个芽的植物组织。获得多芽体的手段,例如可举出:切取并培养在植物的茎的顶端形成的顶芽、在植物的叶腋形成的腋芽(腋芽)或在其它位置形成的不定芽等。
[0028]
<不定芽>
[0029]
不定芽是指生长在植物的茎的顶端、叶腋以外的位置的芽。本发明中,特别是指多芽体所具有的各个芽。这是因为,通过培养得到的多芽体没有茎、叶腋。
[0030]
<该苗的生产方法>
[0031]
图1表示该苗的生产方法(以下,称为“本生产方法”)的流程。本生产方法主要包
含:摘出生长点(s10)、初代培养(s20)、传代培养(s30)、苗化(s40)。此处,本说明书为了参照而适宜纳入“蔬菜的组织
·
细胞培养与增殖”(最新生物技术全书编委会版)的内容。
[0032]
<摘出生长点(s10)>
[0033]
从包含生长点的组织中摘出生长点。摘出生长点的目的是简化多芽体的形成。由于生长点包含细胞分裂活跃的组织,因此能够容易地形成多芽体。生长点优选为茎尖分生组织。包含生长点的组织没有特别限定。包含生长点的组织,例如可举出:在茎的顶端形成的顶芽、在叶腋形成的腋芽(也称为侧芽)、多芽体具有的不定芽等。包含生长点的组织,根据需要通过公知的方法进行灭菌。灭菌的具体的方法,例如可举出浸渍在乙醇、次氯酸等的灭菌剂中。适宜地设定灭菌剂的浓度、浸渍时间,以适当地进行包含生长点的组织的灭菌。灭菌剂可以单独使用一种。灭菌剂也可以组合使用多种。在对包含生长点的组织进行灭菌的情况下,优选在灭菌后,用灭菌水等进行清洗。生长点的摘出优选在无菌条件下进行。就要摘出的组织的大小而言,只要包含生长点即可。要摘出的组织的大小优选为0.1mm~1.0mm。
[0034]
<初代培养(s20)>
[0035]
在无菌条件下,将摘出的生长点置床于初代培养基中并进行培养。由培养的生长点形成多芽体。初代培养的目的是由生长点获得多芽体。初代培养基使用公知的植物培养用的培养基即可。例如可举出:ms培养基、b5培养基、白色培养基、ls培养基等。初代培养基可以直接使用公知的植物培养用的培养基组成。初代培养基,可以适宜稀释公知的植物培养用的培养基以改变浓度。此外,初代培养基可以是固体培养基或液体培养基。优选如下。初代培养基至少包含糖类、固化材料、植物激素。进一步优选如下。糖类为蔗糖,其浓度为10g/l~100g/l。固化材料为琼脂,其浓度为5g/l~15g/l。植物激素为细胞分裂素类和/或生长素类,细胞分裂素类的浓度为0.016mg/l~12.000mg/l,生长素类的浓度为2.000mg/l以下。可以不包含生长素类。就培养条件而言,只要能形成多芽体即可。优选温度为20℃~30℃,照度为2000勒克斯~15000勒克斯,日照时间长度为12小时~16小时。在无菌条件下切出多芽体具有的不定芽。
[0036]
<传代培养(s30)>
[0037]
在无菌条件下,将切出的不定芽置床于传代培养基中并进行培养。由培养的不定芽形成多芽体。传代培养的目的是使不定芽增殖。传代培养基使用公知的植物培养用的培养基即可。例如可举出:ms培养基、b5培养基、白色培养基、ls培养基等。传代培养基可以直接使用公知的植物培养用的培养基组成。传代培养基,可以适宜稀释公知的植物培养用的培养基以改变浓度。此外,传代培养基可以是固体培养基或液体培养基。传代培养基包含细胞分裂素类。
[0038]
此处调整的是传代培养基中的细胞分裂素类的浓度。其目的是抑制不定芽的水浸状化。细胞分裂素类的浓度的调整范围,在抑制不定芽的水浸状化的范围内进行即可。优选为0.016mg/l~12.000mg/l。更优选为0.016mg/l~6.000mg/l。进一步优选为0.016mg/l~4.000mg/l。最优选为0.100mg/l~2.500mg/l。
[0039]
此外,此处可以进行第2调整。通过第2调整调整的是要置床的不定芽的大小。其目的是抑制不定芽的水浸状化。不定芽的大小的调整范围,在抑制不定芽的水浸状化的范围内进行即可。优选为2.5cm以下。进一步优选为0.5cm以上2.5cm以下。
[0040]
传代培养基除了细胞分裂素类之外,还可以包含糖类、固化材料、细胞分裂素类以外的植物激素。优选如下。糖类为蔗糖,其浓度为10g/l~100g/l。固化材料为琼脂,其浓度为5g/l~15g/l。细胞分裂素类以外的植物激素为生长素类,其浓度为2.000mg/l以下。可以不包含生长素类。就培养条件而言,只要能形成多芽体即可。优选温度为20℃~30℃,照度为2000勒克斯~15000勒克斯,日照时间长度为12小时~16小时。在无菌条件下切出多芽体具有的不定芽。可以重复传代培养的步骤,直至获得需要数量的不定芽。
[0041]
<水浸状化率>
[0042]
水浸状化率是指置床于传代培养基的不定芽中,发生水浸状化而停止生长发育的比例。水浸状化(vitrification)是指组织半透明化的现象(也称为玻璃化)。水浸状化的组织由于缺乏正常组织中存在的组织等,因此经常导致生长发育不良。组织一旦发生水浸状化,在培养条件下几乎不能恢复至正常的状态。在基于植物组织培养的增殖中,如何抑制该水浸状化特别重要。
[0043]
本技术发明中水浸状化率优选小于30%。如果水浸状化率小于30%,则可期待进行实用化。即,水浸状化得到抑制是指水浸状化率小于30%。
[0044]
<增殖效率>
[0045]
增殖效率是将通过传代培养形成的多芽体所具有的不定芽的数量除以置床于传代培养基的不定芽的数量而得到的值。即,表示在传代培养中一个不定芽增殖了几倍。增殖效率优选为2倍以上。如果增殖效率为2倍以上,则可期待进行实用化。即,增殖效率较高是指增殖效率为2倍以上。
[0046]
<苗化(s40)>
[0047]
使切出的不定芽长成苗。苗化的目的是使其生长至即使在外部环境下也能够生长发育的状态。苗化可以为1个步骤。苗化也可以为两个步骤以上。优选如下。
[0048]
首先,在无菌条件下,在苗化培养基中培养切出的不定芽。使培养的不定芽生长至一定程度的大小。苗化培养基使用公知的植物培养用的培养基即可。例如可举出:ms培养基、b5培养基、白色培养基、ls培养基等。苗化培养基可以直接使用公知的植物培养用的培养基组成。就苗化培养基而言,可以适宜稀释公知的植物培养用的培养基以改变浓度。此外,苗化培养基可以是固体培养基或液体培养基。优选如下。苗化培养基至少包含糖类、固化材料、植物激素。进一步优选如下。糖类为蔗糖,其浓度为10g/l~100g/l。固化材料为琼脂,其浓度为5g/l~15g/l。植物激素为生长素类,其浓度为2.000mg/l以下。可以不包含生长素类。就培养条件而言,只要不定芽能生长即可。优选温度为20℃~30℃,照度为2000勒克斯~15000勒克斯,日照时间长度为12小时~16小时。此外,也可以使不定芽在苗化培养基中生根。
[0049]
接下来,从苗化培养基中取出不定芽。将取出的不定芽移植至填充有栽培用土的栽培容器中,使其生长。栽培用土可以是有机质或无机质。例如可举出:赤玉土、黑土、烧制赤玉土、蛭石、沸石、蒙脱石等。这些栽培用土可以单独使用一种。也可以混合使用多种。使其生长的手段可以是公知的方法。例如,适宜调整温度、湿度、照度等,根据需要施肥。使不定芽生长至即使在外部环境下也能够生长发育的状态。
[0050]
<无机成分>
[0051]
无机成分是植物的生长所需要的成分。无机成分被配比在培养基中。例如可举出:
氮、磷、钾、钠、钙、镁、硼、锰、锌、碘、钼、铜、钴、铁、氯、硫等。可以混合使用各无机成分。也可以使用市售的混合盐类。
[0052]
<糖类>
[0053]
糖类是植物的生长所需要的成分。糖类被配比在培养基中。例如可举出:蔗糖、葡萄糖、果糖、麦芽糖、海藻糖、乳糖、半乳糖、木糖、甘露醇、山梨糖醇、木糖醇、赤藓醇等。优选为蔗糖、葡萄糖、果糖、麦芽糖,进一步优选为蔗糖。糖类可以使用单一糖类。糖类也可以组合使用多种。此外,也可以使用包含这些糖类的果汁、蔬菜汁、提取物类。
[0054]
<固化材料>
[0055]
固化材料是为了使培养基固化而配比在培养基中的。例如可举出:琼脂、结冷胶,植物凝胶等。优选为琼脂。固化材料可以单独使用一种。也可以组合使用多种。不一定必须配比固化材料。
[0056]
<植物激素>
[0057]
植物激素是指具有植物的生长调节功能的天然成分或合成物。例如可举出细胞分裂素类、生长素类等。作为细胞分裂素类,可举出:苄氨基嘌呤(苄基腺嘌呤)、激动素、玉米素、异戊烯基氨基嘌呤、噻苯隆、异戊烯基腺嘌呤、玉米素核甙、二氢玉米素等。优选为苄氨基嘌呤、激动素、玉米素,进一步优选为苄氨基嘌呤、激动素。作为生长素类,可举出:吲哚
‑3‑
乙酸、吲哚
‑3‑
丁酸、1
‑
萘乙酸、2,4
‑
二氯苯氧基乙酸、吲哚丙酸、氯苯氧基乙酸、萘氧基乙酸、苯乙酸、2,4,5
‑
三氯苯氧基乙酸、对氯苯氧基乙酸、2
‑
甲基
‑4‑
氯苯氧基乙酸、4
‑
氟苯氧基乙酸、2
‑
甲氧基
‑
3,6
‑
二氯苯甲酸、2
‑
苯酸、氨氯吡啶酸、2
‑
吡啶甲酸等。优选为吲哚
‑3‑
乙酸、吲哚
‑3‑
丁酸、1
‑
萘乙酸、2,4
‑
二氯苯氧基乙酸,进一步优选为1
‑
萘乙酸。
[0058]
<ph>
[0059]
该生产方法中使用的培养基的ph为植物能够生长发育的ph。优选为4.0~10.0。进一步优选为5.0~7.0。
[0060]
实施例
[0061]
<不定芽的大小和水浸状化率的关系>
[0062]
<摘出生长点>
[0063]
从以羽衣甘蓝为花粉亲本、以萝卜为柱头亲本的属间杂种(日本品种注册申请编号第33291号,申请品种的名称:santevert 48)的植物体,收集顶芽。为了对顶芽进行灭菌,将收集的顶芽浸渍在70%乙醇中5秒。接着,浸渍在0.2%次氯酸钠溶液中5分钟。在超净工作台内,摘出已灭菌的顶芽的尖端(生长点)约0.5mm。
[0064]
<初代培养>
[0065]
将摘出的生长点置床于初代培养基中。在无菌条件下培养置床于初代培养基的生长点。初代培养基的组成设为包含蔗糖60g/l、琼脂8g/l、苄氨基嘌呤1.000mg/l、萘乙酸0.020mg/l的ph5.8的ms培养基。培养条件设为,温度25℃、照度12500勒克斯、日照时间长度16小时。将生长点培养一个月,形成多芽体。在无菌条件下从该多芽体中逐个切出不定芽。
[0066]
<传代培养>
[0067]
在切出的不定芽中,将不定芽的大小为2.5cm以下的不定芽和2.6cm以上的不定芽分开,分别置床于传代培养基中。在无菌条件下培养置床于传代培养基的不定芽。传代培养基的组成设为包含蔗糖20g/l、琼脂12g/l、萘乙酸0.050mg/l的ph5.8的ms培养基。传代培养
基的细胞分裂素类的浓度设为0.500mg/l。培养条件设为温度25℃、照度12500勒克斯、日照时间长度16小时。将不定芽培养3周,形成多芽体。
[0068]
<不定芽的大小和水浸状化率>
[0069]
不定芽的大小和水浸状化率的关系如表1所示。从表1可以看出,水浸状化率根据置床于传代培养基的不定芽的大小而变化。即,较大的不定芽的水浸状化率较高,较小的不定芽的水浸状化率较低。即,通过调整置床于传代培养基的不定芽的大小,能够抑制不定芽的水浸状化。
[0070]
[表1]
[0071][0072]
<细胞分裂素类的浓度和水浸状化率的关系>
[0073]
<初代培养>
[0074]
以与上述同样的方法进行。
[0075]
<传代培养>
[0076]
将切出的不定芽中的、不定芽的大小为2.5cm以下的不定芽置床于传代培养基中。在无菌条件下培养置床于传代培养基的不定芽。传代培养基的组成设为包含蔗糖20g/l、琼脂12g/l、萘乙酸0.050mg/l的ph5.8的ms培养基。类别1~类别9中的细胞分裂素类的浓度设为表2表示的浓度。培养条件设为,温度25℃、照度12500勒克斯、日照时间长度16小时。将不定芽培养3周,形成多芽体。在无菌条件下从该多芽体中逐个切出不定芽。
[0077]
[表2]
[0078][0079]
<水浸状化率和增殖效率>
[0080]
表2表示各细胞分裂素类的浓度下的水浸状化率和增殖效率。从表2可以看出,细胞分裂素类的浓度为12.000mg/l以下时,水浸状化率较低。相反,细胞分裂素类的浓度大于12.000mg/l时,水浸状化率急剧提高,其结果,增殖效率变低。此外,细胞分裂素类的浓度为0.016mg/l以上时,增殖效率较高。另一方面,细胞分裂素类的浓度为0.002mg/l以下时,水浸状化率较低,但是传代培养中形成的多芽体所具有的不定芽的数量本身变少,因此结果增殖效率变低。
[0081]
由上可知,在传代培养中,通过将细胞分裂素类的浓度设为0.016mg/l以上12.000mg/l以下,能够提高不定芽的增殖效率,从而实现高效的苗的生产。
[0082]
<传代培养的重复>
[0083]
对于类别3~类别5中传代培养的不定芽,进一步重复进行两次(合计3次)传代培养。各类别的培养条件设为与第1次的传代培养相同的条件。重复实施传代培养的类别中的水浸状化率和增殖效率示于表3。从表3可看出,即使重复传代培养,也能够抑制水浸状化。
[0084]
<激动素>
[0085]
类别10~类别12使用激动素作为细胞分裂素类。对于类别10~类别12,确认了重复3次传代培养的情况下的水浸状化率和增殖效率。各类别的激动素浓度示于表3。初代培养以与上述同样的方法进行。就传代培养而言,除了细胞分裂素类的种类和浓度的条件之外,以与类别1~9相同的条件进行。类别10~类别12中的水浸状化率和增殖效率示于表3。从表3可以看出,不限于细胞分裂素类的种类,都能够抑制水浸状化。
[0086]
[表3]
[0087][0088]
<苗化>
[0089]
将一部分的不定芽置床于苗化培养基中。在无菌条件下培养置床于苗化培养基的不定芽。苗化培养基的组成设为包含蔗糖30g/l、琼脂10g/l、萘乙酸0.500mg/l的ph5.8的ms培养基。培养条件设为温度25℃、照度12500勒克斯、日照时间长度16小时。将不定芽培养2周,使其生根。将生根的不定芽移植至填充有蛭石的细胞托盘。将稀释了的hyponex适宜施肥于移植有不定芽的细胞托盘中,同时在温室内使其苗化。通过使其苗化一个月,能够生产能够定植的苗。
[0090]
工业实用性
[0091]
本发明有用的领域是种苗的生产。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。