1.本发明涉及一种具有抗乙型肝炎病毒活性的医药组合物及筛选抑制乙型肝炎病毒蛋白产生的物质的方法。
背景技术:
2.乙型肝炎病毒(hepatitis b virus、hbv)为属于肝炎病毒属的病毒且直径约42nm的球状dna病毒。病毒本身为包含外被(外膜、envelope)、不完整双链的dna、dna聚合酶及反转录酶等的由直径27nm的芯(core)组成的dna病毒,称为dane粒子。形成双重结构,外侧由hbs抗原(hepatitis bsurface antigen、hbsag)组成,内侧由hbc抗原(hepatitis b core antigen、hbcag)及基因dna组成(非专利文献1)。
3.hbs抗原除了dane粒子以外,以中空粒子、小型球形粒子或杆状粒子的形式存在。
4.hbv的基因组dna中具有pre
‑
s/s基因区域、p基因区域、x基因区域、pre
‑
c/c基因区域该4种开读框(open reading frame、orf)、3个启动子及2个增强子(enhancer、enh)区域。x基因区域的core promoter、c基因区域的precore区域与hbe抗原(hepatitis b envelope antigen、hbeag)构成蛋白的产生有关,通过该区域的point mutation而不会产生hbe抗原构成蛋白,成为hbe抗原阴性。
5.并且,2个增强子区域称为增强子i(enhancer i、enhi)及增强子ii(enhancer ii、enhii),均能够使3个所有启动子活性增大(专利文献1)。
6.若hbv侵入肝细胞,则不完整环状双链dna进入肝细胞的核内,并转化为共价闭合环状dna(covalenty closed circular dna、cccdna)。在hbv的慢性感染状态下,cccdna在每一个肝细胞中为5~50个,并且以微型染色体的形式存在。从肝细胞核内的cccdna转录4种rna,由这些作为结构蛋白的hbs抗原、hbc抗原及hbe抗原、x蛋白以及包含反转录酶的聚合酶被翻译。rna之一作为pregenomic rna进入核粒子中,通过反转录酶的作用合成负链dna,接着成为合成正链dna的不完整环状双链dna。另外,包裹于由hbs抗原形成的外膜中,成为病毒粒子(dane粒子)而释放到血中。通过rna翻译的包含hbs抗原、hbc抗原及p22cr抗原的中空粒子(没有dna的核的粒子)或通过肝细胞膜的hbe抗原等与dane粒子的血中释放路径无关地大量释放且分泌到血中。该作用认为是hbv感染中避免了宿主免疫机构的攻击的作用。hbe抗原、hbc抗原及p22cr抗原能够作为hbcr抗原(hepatitis b core
‑
related antigen、hbcrag)而测定,用作病毒复制的标记(非专利文献1)。
7.乙型肝炎是通过感染hbv而发病的病毒性肝炎之一,在全世界感染人数为约2亿4000万人。如上所述,若感染hbv,则dane粒子释放到血中并且除了dane粒子的释放路径以外病毒蛋白大量分泌到血中。指出有在病毒蛋白中,尤其hbs抗原干扰基于作为宿主的人体的免疫机构的感染细胞的排除的可能性(非专利文献2、3)。然而,认为乙型肝炎的治疗中重要的是减少dane粒子、即抑制病毒的增殖、并且减少包含hbs抗原的病毒蛋白。
8.乙型肝炎的第一选择药中使用恩替卡韦或替诺福韦等核酸类似物。核酸类似物制剂抑制hbv聚合酶蛋白的活性并且抑制不完整环状双链dna的产生,由此能够减少血中的
dane粒子、即抑制病毒的增殖。然而,核酸类似物制剂无法减少hbs抗原,因此难以实现基于宿主免疫机构的感染细胞的排除。因此,期望开发能够实现减少hbs抗原的医药品。
9.近年来,通过rna干扰(rnai)的原理与hbv rna结合而进行了将其分解的双链rna(dsrna)的研究开发。报告有这些双链rna在hbv感染细胞等中使hbs抗原减少(非专利文献4)。双链rna为了在其性质上与hbv rna结合而发挥效果,必须与hbv rna具有高的序列同源性。然而,hbv中存在8种基因型并且rna的序列因基因突变等而产生变化等,因此顾虑无法期待与hbv rna结合的双链rna的效果的例。实际上,分析了从乙型肝炎患者采取的hbv的结果,报告有在同一患者中存在基因序列不同的多个克隆的情况及存在对hbv rna的双链rna的效果减弱的克隆的情况(非专利文献5)。因此,需要能够通过新的作用机制实现hbs抗原的减少的医药品的开发。
10.hbv不具有为了从本身的基因转录rna而所需的分子组及为了从rna产生病毒蛋白而所需的分子组。因此,hbv的增殖或病毒蛋白的产生时必须利用所感染的人类肝细胞所具有的分子组。因此,hbv以所利用的人类蛋白为目标,开始关注抑制hbv的增殖或病毒蛋白的产生的新的方法。
11.例如,尝试了使用与hbv基因组dna中的增强子i结合的核酸分子来控制从hbv基因组dna向hbv rna的转录并且调节hbv的复制(专利文献2)。并且,尝试了通过控制作用于hbv基因组dna中的增强子区域的转录因子的表达来控制向hbv rna的转录并且控制hbv的增殖(专利文献3~5)。
12.然而,尚未充分说明hbv的增殖或病毒蛋白的产生中需要作为宿主的人类的哪个因子或通过控制这些来起到哪种抗hbv效果。
13.现有技术文献
14.专利文献
15.专利文献1:国际公开第2005
‑
059138号小册子
16.专利文献2:美国专利申请公开第2003/0148985a1号说明书
17.专利文献3:日本特表2018
‑
526332号公报
18.专利文献4:日本特表2007
‑
520461号公报
19.专利文献5:日本特表2005
‑
532052号公报
20.非专利文献
21.非专利文献1:田中等、modern media、54卷、12号、347~352页、2008年
22.非专利文献2:brouw等、immunology、126卷、280~289页、2008年
23.非专利文献3:vanlandschoot等、journal of general virology、83卷、1281~1289页、2002年
24.非专利文献4:wooddell等、molecular therapy、21卷、5号、973~985页、2013年
25.非专利文献5:wu等、gastroenterology、128卷、708~716页、2005年
技术实现要素:
26.发明要解决的技术课题
27.本发明的课题在于提供一种以作为宿主因子的人类蛋白为目标并且具有抗乙型肝炎病毒(hbv)活性的新型医药组合物。并且,本发明的课题在于提供一种以人类蛋白为目
标并且抑制hbv蛋白产生的医药组合物。另外,本发明的课题在于提供一种以宿主因子为目标并且筛选抑制hbv蛋白产生的物质的方法。
28.用于解决技术课题的手段
29.本发明人等对上述课题进行了深入研究的结果发现了,抑制与相当于乙型肝炎病毒基因组dna(hbv基因组dna)上的增强子i(enhancer i、enhi)区域序列及增强子ii(enhancer ii、enhii)区域序列的乙型肝炎病毒rna(hbv rna)序列中的至少一种区域结合的人类蛋白的医药组合物具有hbv蛋白产生抑制能力,从而完成了本发明。
30.即本发明提供以下。
31.<1>一种医药组合物,其抑制乙型肝炎病毒蛋白(hbv蛋白)的产生,所述医药组合物的特征在于,对选自相当于hbv基因组dna上的增强子(enh)i区域序列的hbv rna序列及相当于hbv基因组dna上的增强子(enh)ii区域序列的hbv rna序列中的至少一种序列抑制所结合的rna结合蛋白的表达或功能。
32.<2>根据<1>所述的医药组合物,其中相当于hbv基因组dna上的增强子(enh)i区域序列的hbv rna序列为与序列编号1具有80%以上的序列同源性的序列,相当于hbv基因组dna上的增强子(enh)ii区域序列的hbv rna序列为与序列编号2具有80%以上的序列同源性的序列。
33.<3>根据<1>或<2>所述的医药组合物,其中相当于hbv基因组dna上的增强子(enh)i区域序列的hbv rna序列为与序列编号1具有90%以上的序列同源性的序列,相当于hbv基因组dna上的增强子(enh)ii区域序列的hbv rna序列为与序列编号2具有90%以上的序列同源性的序列。
34.<4>根据<1>至<3>中任一项所述的医药组合物,其中hbv蛋白为hbs抗原蛋白。
35.<5>根据<1>至<4>中任一项所述的医药组合物,其特征在于还降低hbv基因组dna的表达量。
36.<6>根据<1>至<5>中任一项所述的医药组合物,其特征在于还降低共价闭合环状dna(cccdna)的表达量。
37.<7>根据<1>至<6>中任一项所述的医药组合物,其中rna结合蛋白为选自rbfox1、elavl2、mbnl1、rbmx、srsf9、srsf10、snrpa、elavl1、pum2、ythdc1、srsf1、khdrbs3及eif4b中的至少一种蛋白。
38.<8>一种筛选方法,其筛选抑制hbv蛋白产生的物质,其特征在于,
39.确认对选自相当于hbv基因组dna上的增强子(enh)i区域序列的hbv rna序列及相当于hbv基因组dna上的增强子(enh)ii区域序列的hbv rna序列中的至少一种序列抑制所结合的rna结合蛋白的表达或功能的物质。
40.<9>根据<8>所述的筛选方法,其中相当于hbv基因组dna上的增强子(enh)i区域序列的hbv rna序列为与序列编号1具有80%以上的序列同源性的序列,相当于hbv基因组dna上的增强子(enh)ii区域序列的hbv rna序列为与序列编号2具有80%以上的序列同源性的序列。
41.<10>根据<8>或<9>所述的筛选方法,其中hbv蛋白为hbs抗原蛋白。
42.<11>一种方法,其筛选抑制乙型肝炎病毒(hbv)蛋白的产生的物质,所述方法包
括:
43.(a)对选自相当于hbv基因组dna上的增强子(enh)i区域序列的hbv rna序列及相当于hbv基因组dna上的增强子(enh)ii区域序列的hbv rna序列中的至少一种序列确认所结合的rna结合蛋白的工序;
44.(b)使所确认的抑制rna结合蛋白的功能或活性的被验物质或降低所述蛋白的表达量的被验物质与感染了hbv的细胞或表达hbv的细胞接触的工序;
45.(c)测定感染了hbv的细胞或表达hbv的细胞中的hbv蛋白产生能力的工序;及
46.(d)选择具有抑制(c)的hbv蛋白产生的活性的物质的工序。
47.<12>根据<11>所述的方法,其中(a)包括使用rna结合蛋白序列数据库的工序。
48.<13>根据<11>所述的方法,其中(b)的被验物质为抗体、肽酶、蛋白、非肽酶性化合物、合成化合物、反义核酸、双链rna、腺相关病毒载体或crispr
‑
cas载体系。
49.<14>根据<11>所述的方法,其中(c)包括测定感染了hbv的细胞或表达hbv的细胞的培养上清液中的hbv蛋白的工序。
50.<15>根据<11>所述的方法,其中(d)的物质为抗体、肽酶、蛋白、非肽酶性化合物、合成化合物、反义核酸、双链rna、腺相关病毒载体或crispr
‑
cas载体系。
51.并且,本发明提供以下。
52.<a>一种处置方法,其包括将<1>至<7>中任一项所述的医药组合物给药于感染hbv或患有与hbv感染相关的疾病的对象的工序。
53.<b>根据<a>所述的处置方法,其中与hbv感染相关的疾病为乙型肝炎、因这些而引起的肝硬化或因这些而引起的肝癌。
54.<c>根据与hbv感染相关的疾病的处置用试剂盒,其包括:<1>至<7>中任一项所述的医药组合物;及记载有与hbv感染相关的疾病的处置方法的说明书。
55.<d>根据<c>所述的与hbv感染相关的疾病的处置用试剂盒,其中与所述hbv感染相关的疾病的处置方法包括将所述医药组合物给药于感染hbv或患有与hbv感染相关的疾病的对象的工序。
56.<e>一种物质,其用于处置抑制乙型肝炎病毒蛋白(hbv蛋白)的产生、对选自相当于hbv基因组dna上的增强子(enh)i区域序列的hbv rna序列及相当于hbv基因组dna上的增强子(enh)ii区域序列的hbv rna序列中的至少一种序列抑制所结合的rna结合蛋白的表达或功能。
57.<f>一种物质的使用,其用于制造抑制乙型肝炎病毒蛋白(hbv蛋白)的产生的医药组合物、对选自相当于hbv基因组dna上的增强子(enh)i区域序列的hbv rna序列及相当于hbv基因组dna上的增强子(enh)ii区域序列的hbv rna序列中的至少一种序列抑制所结合的rna结合蛋白的表达或功能。
58.发明效果
59.本发明的医药组合物具有优异的抗hbv活性,作为抗hbv剂而有用。并且,本发明的筛选方法有用于抑制hbv蛋白产生的物质的筛选。
附图说明
60.图1表示使用来自于基因型c的enhi/enhii区域缺陷构成的基因试验中的萤火虫荧光素酶的相对发光量(%)。
61.图2表示使用来自于基因型c的enhi/enhii区域缺陷构成的基因试验中的萤火虫荧光素酶rna的相对表达量(%)。
62.图3表示在hbs抗原(hbsag)中各dsrna添加孔与各浓度的阴性对照dsrna添加孔的相对值(%)。
63.图4表示在细胞生存率中各dsrna添加孔与各浓度的阴性对照dsrna添加孔的相对值(%)。
64.图5表示使用来自于各种基因型的enhi/enhii区域缺陷构成的基因试验中的萤火虫荧光素酶rna的相对表达量(%)及萤火虫荧光素酶的相对发光量(%)。
具体实施方式
65.以下,对本发明进行详细说明。
66.本说明书中,只要没有特别说明,各术语具有以下含义。
67.预防是指发病的抑制、发病风险的降低或发病的延迟等。
68.治疗是指成为对象的疾病或状态的改善或进行的抑制等。
69.处置是指对各种疾病的预防或治疗等。
70.有效量是指治疗有效量或预防有效量等。
71.治疗有效量是指足以对所感染的对象中的hbv感染的稳定化、hbv感染的降低或hbv感染的根除的量。并且,预防有效量是指足以对具有感染的危险的对象中的hbv感染的预防的量。
72.对象是指包括人类的哺乳动物。
73.<乙型肝炎病毒(hbv)>
74.乙型肝炎病毒(hbv)是指具有使乙型肝炎发病的能力的病毒。hbv通过来自于基因突变的碱基序列的差异目前分类成a型~h型的8个基因型(genotype)。作为成为本发明的医药组合物中的预防或治疗的对象的hbv,包括所有基因型。
75.本发明中,作为与hbv感染相关的疾病,可举出乙型肝炎,可举出急性肝炎、慢性肝炎及猛爆性肝炎。并且,只要为因包括人类的生体中的hbv的感染而引起的疾病,则也包括肝硬化、肝线维化、肝细胞癌等肝癌。
76.<乙型肝炎病毒蛋白(hbv蛋白)>
77.乙型肝炎病毒蛋白(hbv蛋白)为构成hbv的蛋白,可举出hbs抗原、hbc抗原、hbe抗原等。
78.本发明中,hbv蛋白并无特别限定,但是优选为hbs抗原。
79.<相当于hbv基因组dna上的enhi区域序列及enhii区域序列的hbv rna序列>
80.已知在hbv基因组dna上具有2个增强子区域(enhi及enhii),enhi及enhii促进从hbv基因组dna向hbv rna的转录。
81.本发明中,相当于hbv基因组dna上的enhi区域序列及enhii区域序列的hbv rna序列是指,处于hbv rna序列中的编码hbv蛋白的rna的3’非翻译区域(以下也称为3’utr)内的
相当于hbv基因组dna上的enhi的区域的碱基序列或处于编码hbv蛋白的rna的3’utr内的相当于hbv基因组dna上的enhii的区域的碱基序列。
82.本发明中,相当于hbv基因组dna上的enhi区域序列及enhii区域序列的hbv rna序列是指,优选处于hbv rna序列中的编码hbs抗原的rna的3’utr内的相当于hbv基因组dna上的enhi的区域的碱基序列或处于编码hbs抗原的rna的3’utr内的相当于hbv基因组dna上的enhii的区域的碱基序列。
83.本发明中,相当于hbv基因组dna上的enhi区域序列的hbv rna序列可举出与序列编号1具有80%以上的序列同源性的序列,相当于hbv基因组dna上的enhii区域序列的hbv rna序列可举出与序列编号2具有80%以上的序列同源性的序列。
84.上述hbv rna为编码hbv蛋白的rna,优选为编码hbs抗原的rna。
85.上述hbv rna序列例如可举出序列编号1或序列编号2的序列。上述序列优选与序列编号1或序列编号2的序列具有80%以上的序列同源性,更优选具有85%、进一步优选90%、更进一步优选95%、更进一步优选98%、尤其优选具有100%的序列同源性。
86.序列编号1:
87.uuauaugcauguauacaaucuaagcaggcuuucacuuucucgccaacuuacaaggccuuucuguguaaacaauaucugaaccuuuaccccguugcccggcaacggucaggucucugccaaguguuugcugacgcaacccccacuggauggggcuuggcuaucggccaucgccgcaugcguggaaccuuuguggcuccgcug
88.序列编号2:
89.uugcccaaggucuuauauaagaggacucuuggacucucagcgaugucaacgaccgaccuugaggcaua cuucaaagacuguuuguuuaaggacugggaggaguugggggaggagauuagguuaaagauuuuugu
90.<rna结合蛋白>
91.已知rna结合蛋白(rna binding protein)以序列特异性与特定的目标rna结合,并且在rna剪接、聚腺苷酸化、封顶、修饰、输送、局部化、翻译、代谢旋转等、转录后及转录后的蛋白表达中控制各种细胞功能(ray等、nature、499卷、11号、2013年)。
92.本发明中,推测rna结合蛋白与hbv rna上的特定的序列结合,由此控制hbv蛋白的表达(产生)。
93.上述hbv rna优选为编码hbs抗原的rna。
94.上述hbv rna上的特定的序列例如可举出序列编号1或序列编号2的序列。上述序列优选对序列编号1或序列编号2的序列,具有80%以上的序列同源性,更优选85%、进一步优选90%、更进一步优选95%、更进一步优选98%、尤其优选具有100%的序列同源性。
95.本发明中,rna结合蛋白优选识别并结合上述序列上的4~9碱基,例如可举出rbfox1(rna binding protein,fox
‑
1homolog)、elavl2(elav like rna binding protein 2)、mbnl1(muscleblind
‑
like protein 1)、rbmx(rna
‑
binding motif protein,x chromosome)、srsf9(serine and arginine rich splicing factor 9)、srsf10(serine and arginine rich splicing factor 10)、snrpa(small nuclear ribonucleoprotein polypeptide a)、elavl1(elav like rna binding protein 1)、pum2(pumilio homolog 2)、ythdc1(yth domain containing 1)、srsf1(serine and arginine rich splicing factor 1)、khdrbs3(kh rna binding domain containing,signal transduction associated 3)或eif4b(eukaryotic translation initiation factor 4b)等。
96.本发明的rna结合蛋白优选为选自rbfox1、elavl2、mbnl1、rbmx、srsf9、srsf10、snrpa、elavl1、pum2、ythdc1、srsf1、khdrbs3及eif4b中的至少一种蛋白。
97.<医药组合物>
98.本发明的医药组合物为“物质”、具体而言为包含“抑制hbv蛋白产生的物质”及药学上允许的载体的医药组合物。
99.本发明的医药组合物中,作为抑制hbv蛋白产生的物质,包含对选自相当于hbv基因组dna上的增强子(enh)i区域序列的hbv rna序列及相当于hbv基因组dna上的增强子(enh)ii区域序列的hbv rna序列中的至少一种序列抑制所结合的rna结合蛋白的表达或功能的物质。
100.本发明的医药组合物优选抑制hbv蛋白产生的物质,更优选抑制hbs抗原的产生的物质。
101.作为“物质”,可举出抗体、肽酶、蛋白、非肽酶性化合物、合成化合物、反义核酸、双链rna、腺相关病毒载体、crispr
‑
cas载体系等。
[0102]“反义核酸”是指编码任意蛋白的“有义”核酸,例如为包含与双链cdna分子的编码链、mrna序列或基因的编码链的碱基序列互补或者实质上互补的碱基序列或其一部分的核酸,与作为目标的碱基序列形成特异性且稳定的双链而结合,由此具有抑制蛋白合成的功能。
[0103]“rnai核酸”包含通过短干扰rna(sirna)、短发夹rna(shrna)或rna干扰(rnai)干扰或抑制目标基因的表达的核酸,但是并不限定于这些。
[0104]“双链rna”包含通过短干扰rna(sirna)、短发夹rna(shrna)或rna干扰(rnai)干扰或抑制目标基因的表达的核酸,但是并不限定于这些。
[0105]“rna干扰剂”为经由rna干扰而干扰或抑制目标基因的表达的核酸。
[0106]
rna干扰为使用双链rna(dsrna)分解包含与dsrna相同的序列的mrna的转录后目标基因沉默技术(sharp等、science、287卷,2431~2432页、2000年;zamore等、cell、101卷、25~33页、2000年;tuschl等、genes&development、13卷、3191~3197、1999年)。切割内源性核糖核酸酶长的dsrna,在产生称为更短的21或22核苷酸长度的短干扰rna(sirna)的rna的情况下产生。该sirna介导目标mrna的分解。用于合成rnai的试剂盒例如能够从new england biolabs及ambion商业化获得。一个方式中,能够使用用于反义rna的上述化学中的一个以上。
[0107]
作为本发明的医药组合物中所包含的物质,优选反义核酸或双链rna,更优选双链rna。
[0108]
并且,双链rna的情况下,尤其优选rna干扰剂。
[0109]“腺相关病毒”为由属于小病毒科的约4700碱基组成的单链dna病毒,没有外膜且具有直径20~30nm的正二十面体结构的蛋白壳,识别细胞膜的普遍成分的硫酸乙酰肝素蛋白聚醣而感染,因此宿主区域广。
[0110]
能够在腺相关病毒的基因组内插入任意基因、核酸。然而,通过使进行基因改造的腺相关病毒感染作为目标的细胞,能够导入目标基因、核酸,因此腺相关病毒能够用作用于导入基因的载体。另外,“腺相关病毒载体”没有病原性且最后分化的非分裂细胞也能够进行基因导入,因此期待应用于基因治疗中。
[0111]
已知腺相关病毒因血清型的差异而与组织及细胞中的感染指向性不同(小泽等、drug delivery system、22卷、6号、643~650页、2007年)。
[0112]
作为本发明的医药组合物中所包含的物质,优选腺相关病毒5型、腺相关病毒7型、腺相关病毒8型或腺相关病毒9型,更优选腺相关病毒8型。
[0113]“crispr
‑
cas系”为将真性细菌或古细菌所具有的作为获得免疫而发现的clustered regulatory interspaced short palindromic repeats(常间回文重复序列丛集)/crispr
‑
associated protein(crispr/cas)系统转用于基因组编集的系统(jinek等、science、337卷、816~821页、2012年)。具体而言,称为上述细菌的crispr区域的基因组区域中,重复多个片段化的外源dna(20bp)所进入的卡匣,不同的外源dna进入各卡匣中。
[0114]
认为各卡匣中外来生物(例如,噬菌体等)的dna进入细胞内的情况下将其片段化而渗入到crispr区域而产生。
[0115]
各卡匣编码crispr rna(crrna)。crrna具有原间隔序列、后述的trans
‑
crrna(tracrrna)及互补的序列。原间隔序列为20核苷酸长度,并且具有作为目标的dna序列及互补的序列。原间隔序列无需与目标序列具有100%的互补性,在5’末端至6核苷酸的区域内允许错误配对。crrna经由互补部分与另行转录的trans
‑
crrna(tracrrna)形成复合体。crrna与tracrrna的复合体进一步与cas9核酸内切酶形成复合体。crrna中的原间隔部分与外源dna互补而进行杂交形成,由此将cas9核酸内切酶引导到外源dna的目标序列。外源dna在目标序列的部位通过cas9核酸内切酶切断,crispr
‑
cas9系统从外源dna防御宿主。
[0116]
如上所述,crispr
‑
cas9系统为通过真性细菌或古细菌作为对新的外源dna的获得免疫而发挥功能来发现,但是设计由外源dna组成的原间隔,由此能够序列依赖性切断哺乳动物的基因组或由此能够编辑哺乳动物的基因组。
[0117]“crispr
‑
cas载体系”是指包含crrna、tracrrna序列或具备crrna及tracrrna的功能的导引rna(grna)及cas基因序列而成的载体系。目前主要使用的系统为来自于化脓链球菌(s.pyogenes)的第2种crispr
‑
cas9系统,但是并不限定于此。
[0118]
并且,药学上能够允许的载体可举出赋形剂、稀释剂、增量剂、崩散剂、稳定剂、保存剂、缓冲剂、乳化剂、芳香剂、着色剂、甜味剂、粘稠剂、矫味剂、助溶剂或其他添加剂等。通过使用这些载体的一个以上,能够制备片剂、胶囊剂、粉末剂、糖浆、颗粒剂、丸剂、悬浮剂、乳剂、粉末制剂、栓剂、滴眼剂、滴鼻剂、滴耳剂、贴剂、软膏剂、注射剂、液剂、锭剂或酏剂等形态的医药组合物。
[0119]
这些医药组合物能够以口服或非口服的形式给药。作为用于非口服给药的其他形态,包含1个或其以上的活性物质,还包含通过常规方法配制的外用液剂、用于肠溶内给药的栓剂等。
[0120]
并且,本发明的医药组合物的给药量及给药次数能够根据患者的性别、体重、年龄、重症度及症状等而适当选择。通常,对于成人,通过口服或非口服(例如,注射、静脉滴注及直肠部位中的给药等)给药,分成1次至数次每日给药0.01~1000mg/kg即可。
[0121]
本发明的医药组合物还优选降低hbv dna的表达量。
[0122]
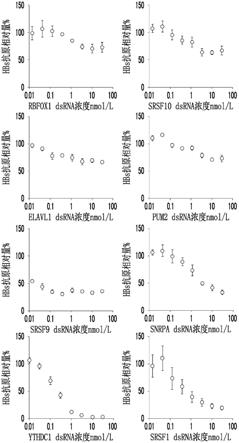
本发明的医药组合物还优选降低共价闭合环状dna(cccdna)的表达量。
[0123]
本发明的医药组合物作为用于对相当于hbv基因组dna上的enhi区域序列的hbv rna序列及相当于hbv基因组dna上的enhii区域序列的hbvrna序列中的至少一种序列抑制
所结合的rna结合蛋白的表达或功能的医药品而有用或作为用于抑制并抑制与上述rna结合蛋白相关的疾病的发病或进行而治疗或预防上述疾病的医药品而有用。
[0124]
<筛选方法>
[0125]
本发明的筛选方法有用于筛选抑制hbv蛋白产生的物质的方法。
[0126]
本发明的筛选方法有用于筛选方法,其筛选抑制hbv蛋白产生的物质,所述方法的特征在于,确认对选自相当于hbv基因组dna上的增强子i区域序列的hbv rna序列及相当于hbv基因组dna上的增强子ii区域序列的hbv rna序列中的至少一种序列抑制所结合的rna结合蛋白的表达或功能的物质。
[0127]
本发明的筛选方法中,相当于乙型肝炎病毒基因组dna上的增强子i区域序列的hbv rna序列为与序列编号1具有80%以上的序列同源性的序列,优选相当于乙型肝炎病毒基因组dna上的增强子ii区域序列的hbv rna序列为与序列编号2具有80%以上的序列同源性的序列。
[0128]
并且,本发明的筛选方法中,优选作为乙型肝炎病毒蛋白确认抑制hbs抗原的产生的物质。
[0129]
作为本发明的筛选方法,可举出包括如下的方法:
[0130]
(a)对选自相当于hbv基因组dna上的enhi区域序列的hbv rna序列及相当于hbv基因组dna上的enhii区域序列的hbv rna序列中的至少一种序列确认所结合的rna结合蛋白的工序;
[0131]
(b)使所确认的抑制rna结合蛋白的功能或活性的被验物质或降低所述蛋白的表达量的被验物质与感染了hbv的细胞或表达hbv的细胞接触的工序;
[0132]
(c)测定感染了hbv的细胞或表达hbv的细胞中的hbv蛋白产生能力的工序;及
[0133]
(d)选择具有抑制(c)的hbv蛋白产生的活性的物质的工序。
[0134]
(a)对选自相当于hbv基因组dna上的enhi区域序列的hbv rna序列及相当于hbv基因组dna上的enhii区域序列的hbv rna序列中的至少一种序列确认所结合的rna结合蛋白的工序
[0135]
例如,可举出利用如rna
‑
binding protein database、rbpdb的公共rna结合蛋白序列数据库。作为所利用的公共rna结合蛋白序列数据库并无特别限定。通过对rbpdb或按照此的数据库输入相当于hbv基因组dna上的enhi区域序列或enhii区域序列的hbv rna序列,能够提取与这些区域序列结合的rna结合蛋白。
[0136]
并且,例如可举出使用来自于hepg2.2.15细胞的细胞提取液和具有在试验管内转录的相当于hbv基因组dna上的enhi区域序列或enhii区域序列的序列的rna进行拉下试验并且通过质量分析装置特定所得到的结合蛋白的方法或按照这些的方法。
[0137]
本发明的筛选方法优选为(a)包括使用rna结合蛋白序列数据库的工序的方法。
[0138]
并且,作为另一方式,优选为(a)包括使用具有相当于hbv基因组dna上的enhi区域序列或enhii区域序列的序列的rna进行拉下试验的工序的方法。
[0139]
(b)使所确认的抑制rna结合蛋白的功能或活性的被验物质或降低所述蛋白的表达量的被验物质与感染了hbv的细胞或表达hbv的细胞接触的工序
[0140]
作为感染了hbv的细胞,例如为感染了hbv克隆c_jpnat(genbank:ab246345.1)的原代培养肝细胞或强制表达sodium taurocholate cotransporting polypeptide(ntcp)
的hepg2细胞,可举出感染了hbv克隆c_jpnat(genbank:ab246345.1)的细胞。关于上述hbv克隆与细胞的组合,并无特别限定。
[0141]
作为表达hbv的细胞,例如可举出hepg2.2.15细胞或强制表达包含使hbv克隆c_jpnat(genbank:ab246345.1)的基因组序列延长1.24倍的序列而成的质体的hepg2细胞、huh
‑
7细胞、heparg细胞或原代培养肝细胞。关于上述hbv克隆,并无特别限定。并且,关于插入包含上述hbv克隆的基因组序列而成的质体的来自于hbv基因组的序列的长度,只要为hbv克隆的基因组序列的1.24倍长度以上,则并无特别限定。
[0142]
作为被验物质,例如可举出选自抗体、肽酶、蛋白、非肽酶性化合物、合成化合物、反义核酸、双链rna、腺相关病毒载体、crispr
‑
cas载体系等的物质。
[0143]
作为用于本发明的筛选方法的被验物质,优选反义核酸或双链rna,更优选双链rna。
[0144]
并且,双链rna的情况下,尤其优选为rna干扰剂。
[0145]
感染了hbv的细胞或表达hbv的细胞与被验物质的接触能够通过例如向培养培养基添加测试物质而培养一定期间来实施。所添加的被验物质的浓度根据物质的种类(溶解度、毒性等)而不同,但是例如在约0.1nmol/l~约100nmol/l的范围内适当选择。作为培养时间,例如可举出约24小时~约120小时。
[0146]
(c)测定感染了hbv的细胞或表达hbv的细胞中的hbv蛋白产生能力的工序
[0147]
作为测定hbv蛋白产生能力的工序,可举出测定感染了hbv的细胞或者表达hbv的细胞的培养上清液中的hbv蛋白的方法。
[0148]
例如,能够使用所回收的培养上清液并且通过化学发光酶免疫测定法(cleia法)或酵素免疫测定法(elisa法)等方法或按照这些的方法测定hbv蛋白。
[0149]
(d)选择具有抑制(c)的hbv蛋白产生的活性的物质的工序
[0150]
例如,通过使(c)中被验物质作用,与阴性对照相比,能够选择抑制30%以上、优选为50%以上、进一步优选为70%以上、更进一步优选为90%以上的hbv蛋白产生的物质。
[0151]
<医药组合物的用途>
[0152]
本发明的医药组合物有用于hbv感染的治疗或预防。
[0153]
本发明的医药组合物能够抑制hbv蛋白产生、尤其抑制hbs抗原的产生。并且,能够抑制hbv基因表达(hbv的dna产生)。然而,本发明的医药组合物为了hbv感染的治疗或预防而有用。
[0154]
本发明是关于一种用于抑制hbs抗原的产生的本发明的医药组合物的使用。
[0155]
本发明是关于一种用于抑制hbv的dna产生的本发明的医药组合物的使用。
[0156]
本发明是关于一种用于抑制hbv的基因表达的本发明的医药组合物的使用。
[0157]
本发明是关于一种用于hbv感染的治疗或预防的本发明的医药组合物的使用。
[0158]
与hbv感染涉及的疾病中包括进行性肝线维症、炎症及坏死,这些发展为肝硬化、终末期肝疾病及肝细胞癌。
[0159]
接着,举出试验例对本发明进行说明,但是本发明并不限定于这些。
[0160]
实施例
[0161]
[试验例1]
[0162]
(使用enhi/enhii区域缺陷构成的基因试验)
[0163]
pcr反应在包含1xprimestar max dna polymerase(takara公司制)、0.2μmol/l引子的反应液中进行。以hbv基因组dna(genbank:ab246345.1;以下也称为“基因型c”)为铸模,对包含pres2/s启动子的区域410bp使用由序列编号3的碱基序列组成的引子及由序列编号4的碱基序列组成的引子的组合在重复35次的条件下进行98℃10秒钟、58℃5秒钟、72℃15秒钟的pcr,由此得到了导入kpni及hindiii限制酶部位的扩增片段。同样地,对包含编码hbs抗原的基因的3’非翻译区域(以下也称为“3’utr”)的序列的区域1086bp使用由序列编号5的碱基序列组成的引子及由序列编号6的碱基序列组成的引子的组合在重复35次的条件下进行98℃10秒钟、58℃5秒钟、72℃15秒钟的pcr,由此得到了导入xbai及sali的限制酶部位的扩增片段。用kpni(takara公司制)、hindiii(takara公司制)的组合或xbai(takara公司制)、sali(takara公司制)的组合处理各个断片,得到了插入pgl3(promega公司制)的kpni、hindiii的部位或xbai、sali的部位而连结的质体。以下,将该质体也称为“pres2/s
‑
luc
‑3’
utr”。另外,在后述的试验例4中,为了明确基因型的差异,也称为“pres2/s
‑
luc
‑3’
utr(基因型c)”。以pres2/s
‑
luc
‑3’
utr质体为铸模,使用由序列编号7的碱基序列组成的引子及由序列编号8的碱基序列组成的引子的组合及由序列编号9的碱基序列组成的引子及由序列编号10的碱基序列组成的引子的组合在重复35次的条件下进行98℃10秒钟、58℃5秒钟、72℃30秒钟的pcr,由此得到了用于制造缺少enhi区域的质体的扩增片段。使用in
‑
fusion hd cloning kit(takara公司制)连结这些断片,得到了缺少pres2/s
‑
luc
‑3’
utr质体中的enhi区域的质体。以下,将该质体也称为“pres2/s
‑
luc
‑3’
utr denhi”。以pres2/s
‑
luc
‑3’
utr质体为铸模,使用由序列编号7的碱基序列组成的引子及由序列编号11的碱基序列组成的引子的组合及由序列编号10的碱基序列组成的引子及由序列编号12的碱基序列组成的引子的组合在重复35次的条件下进行98℃10秒钟、58℃5秒钟、72℃30秒钟的pcr,由此得到了用于制造缺少enhii区域的质体的扩增片段。使用in
‑
fusion hd cloning kit(takara公司制)连结这些断片,得到了缺少pres2/s
‑
luc
‑3’
utr质体中的enhii区域的质体。以下,将该质体也称为“pres2/s
‑
luc
‑3’
utr denhii”。
[0164]
[表1]
[0165]
序列编号序列(5
’→3’
)3gtcaggtacccaaacaatccagattgggac4tgacaagcttgttcggtgcagggtcc5tgactctagaaccctaataaaaccaaacgt6tgacgtcgactttatacgggtcaatgtcca7cgcggggcatgactatcgtc8aggcattaaggcaggatagc9cctgccttaatgcctccgatccatactgcg10gacgatagtcatgccccgcg11gacctggtgggcgttcacgg12aacgcccaccaggtcactaggaggctgtag
[0166]
使用hbv基因组导入到肝生殖细胞瘤(hepatoblastoma)细胞株hepg2中的作为持续产生病毒的细胞的hepg2.2.15细胞(proc natl acad sci usa 84卷1005页~1009页1987年),按以下的顺序实施了基因试验。
[0167]
作为细胞培养用培养基,使用了以下。
[0168]
dmem/f
‑
12、glutamax(invitrogen公司制) 5μg/ml胰岛素(wako公司制) 1%青霉素/链霉素(sigma公司制) 10mmol/l hepes(sigma公司制) 50μmol/l氢皮质酮(sigma公司制) 10%fbs(equitech
‑
bio公司制)
[0169]
将hepg2.2.15细胞悬浮于上述培养基中,以每1孔成为1
×
104cell/100μl的方式播种于96孔微孔盘中,在5%co2恒温箱中在37℃下孵化了24小时。用7.8μl的无血清培养基(thermofisher scientific公司制)稀释0.062μg的pres2/s
‑
luc
‑3’
utr质体、pres2/s
‑
luc
‑3’
utr denhi质体或pres2/s
‑
luc
‑3’
utr denhii质体中的任一种及0.25ng的prl
‑
sv40质体(promega公司制)、0.23μl的transit
‑
x2 transfection reagent(mirus公司制),在室温下孵化了20分钟。将该质体
‑
transit
‑
x2 transfection reagent混合液8μl添加到播种前述hepg2.2.15的孔中,孵化了24小时。接着,用前述细胞培养用培养基100μl/孔更换培养基,在5%co2恒温箱中在37℃下进一步孵化了48小时。孵化之后,用dual
‑
luciferase reporter assay system(promega公司制)检测了基于萤火虫荧光素酶的发光及基于海肾荧光素酶的发光。将对各孔计算了用海肾萤光素酶的发光量校正的萤火虫荧光素酶的发光量的结果示于图1中。并且,将计算了各欠损质体添加孔中的萤光素酶的发光量与pres2/s
‑
luc
‑3’
utr质体添加孔中的萤火虫荧光素酶的发光量的相对值(%)的结果示于图1中。
[0170]
将hepg2.2.15细胞悬浮于上述培养基中,以每1孔成为2
×
105cell/1000μl的方式播种于12孔微孔盘中,在5%co2恒温箱中在37℃下孵化了24小时。用97μl的无血清培养基(thermofisher scientific公司制)稀释1μg的pres2/s
‑
luc
‑3’
utr质体、pres2/s
‑
luc
‑3’
utr denhi质体或pres2/s
‑
luc
‑3’
utr denhii质体中的任一种及3μl的transit
‑
x2 transfection reagent(mirus公司制),在室温下孵化了20分钟。将该质体
‑
transit
‑
x2 transfection reagent混合液100μl添加到播种前述hepg2.2.15的孔中,孵化了24小时。接着,用前述细胞培养用培养基1000μl/孔更换培养基,在5%co2恒温箱中在37℃下进一步孵化了24小时。然后,废弃培养上清液,用磷酸缓冲生理盐水(1000μl/孔、fujifilm wako pure chemical corporation制)清洗细胞,使用rneasy mini kit(qiagen公司制)提取了总rna。使用primescript rt reagent kit with gdna eraser(takara公司制)反转录所提取的总rna1μg,制作了cdna。基于所制作的cdna定量萤火虫荧光素酶rna的表达量,将计算了各质体添加孔中的萤火虫荧光素酶rna的表达量与转染pres2/s
‑
luc
‑3’
utr质体的孔中的萤火虫荧光素酶rna的表达量的相对值(%)的结果示于图2中。
[0171]
通过enhi区域或enhii区域的缺少,来自于萤火虫荧光素酶蛋白的相对发光量减少了70%~80%左右(图1)。因此,认为上述现象为因基于从dna序列缺少enhi区域或enhii区域的转录活性的减少(萤火虫荧光素酶rna表达量的减少)而引起的可能性或因基于从rna序列缺少相当于enhi的区域或相当于enhii的区域的rna的功能变化而引起的可能性。因此,解析了萤火虫荧光素酶rna的相对表达量的结果,通过enhi区域或enhii区域的缺少,萤火虫荧光素酶rna的相对表达量几乎没有变化(图2)。由此可知,基于enhi区域或enhii区域的缺少的相对发光量的减少因基于从rna序列缺少相当于enhi的区域或相当于enhii的区域的rna的功能变化而引起。即,已知相当于hbv基因组dna上的enhi的区域或相当于hbv基因组dna上的enhii的区域在rna上发挥功能,并且控制蛋白的表达量。
[0172]
[试验例2]
[0173]
(rna结合蛋白的in silico确认)
[0174]
由于相当于enhi的区域、相当于enhii的区域在rna上发挥功能,因此尝试了与这些区域结合的rna结合蛋白的确认。推定的rna结合蛋白通过如下来进行了确认:对公共rna结合蛋白序列数据库(rna
‑
binding protein database、rbpdb)输入编码hbs抗原的rna的3’utr内enhi相当区域(genbank:ab246345、由碱基编号1060号~1260号组成的相当于enhi区域的rna序列、序列编号1)或编码hbs抗原的rna的3’utr内enhii相当区域(genbank:ab246345、由碱基编号1638号~1771号组成的相当于enhii区域的rna序列、序列编号2),执行结合蛋白预测程序。rbpdb为存储有从使用人类、小鼠、果蝇等的in vitro及in vivo实验得到的rna结合蛋白及其结合序列涉及的信息的数据库,通过输入rna的碱基序列,能够提取推定为与具有该序列的rna结合的rna结合蛋白(nucleic acids res、39卷、d301页~d308页、2011)。
[0175]
[表2]
[0176]
与编码hbs抗原的rna上的enhi相当区域、enhii相当区域结合的蛋白
[0177][0178]
预想多个rna结合蛋白与编码hbs抗原的rna上的enhi相当区域及enhii相当区域中的至少一种区域结合。
[0179]
[试验例3]
[0180]
(抗hbv检定)
[0181]
使用hbv基因组导入到肝生殖细胞瘤(hepatoblastoma)细胞株hepg2的作为持续产生病毒的细胞的hepg2.2.15细胞(proc natl acad sci usa 84卷1005页~1009页1987
年),按以下顺序评价了基于各分子的抑制的抗hbv效果。
[0182]
作为细胞培养用培养基,使用了以下。
[0183]
dmem/f
‑
12、glutamax(invitrogen公司制) 5μg/ml胰岛素(wako公司制) 1%青霉素/链霉素(sigma公司制) 10mmol/l hepes(sigma公司制) 50μmol/l氢皮质酮(sigma公司制) 10%fbs(equitech
‑
bio公司制)
[0184]
(1)用于转染的dsrna使用了以下(dharmacon公司制)。smartpool:on
‑
targetplus rbfox1 sirna(l
‑
013377
‑
01)、smartpool:on
‑
targetplus elavl1 sirna(l
‑
003773
‑
00)、smartpool:on
‑
targetplus elavl2 sirna(l
‑
019801
‑
00)、smartpool:on
‑
targetplus mbnl1sirna(l
‑
014136
‑
00)、smartpool:on
‑
targetplus rbmx sirna(l
‑
011691
‑
01)、smartpool:on
‑
targetplus pum2 sirna(l
‑
014031
‑
02)、smartpool:on
‑
targetplus ythdc1 sirna(l
‑
015332
‑
02)、smartpool:on
‑
targetplus srsf1 sirna(l
‑
018672
‑
01)、smartpool:on
‑
targetplus srsf9 sirna(l
‑
019529
‑
01)、smartpool:on
‑
targetplus srsf10 sirna(l
‑
007278
‑
00)、smartpool:on
‑
targetplus khdrbs3sirna(l
‑
012748
‑
01)、smartpool:on
‑
targetplus eif4b sirna(l
‑
020179
‑
00)、smartpool:on
‑
targetplus snrpa sirna(l
‑
019435
‑
02)。并且,将on
‑
targetplus non
‑
targeting control pool(dharmacon公司制)用作阴性对照dsrna。
[0185]
(2)将hepg2.2.15细胞悬浮于上述培养基,制备了2
×
105cell/ml的hepg2.2.15细胞悬浮液。使用nuclease
‑
free water(not depc
‑
treated)(thermofisher scientific公司制)稀释dsrna,制备了2.743~2000nmol/l、3倍稀释系列的dsrna溶液。用8.2μl的无血清培养基(thermofisher scientific公司制)稀释1.5μl的已制备的dsrna溶液及0.3μl的lipofectamine rnaimax(thermofisher scientific公司制),在室温下孵化了5分钟。用细胞培养用培养基40μl稀释该dsrna
‑
lipofectamine rnaimax混合液10μl,制得50μl。将其与前述hepg2.2.15细胞悬浮液50μl混合,播种于96孔微孔盘中,在5%co2恒温箱中在37℃下孵化了3天(dsrna的最终浓度:0.91~30nmol/l、3倍稀释系列)。接着,用前述细胞培养用培养基100μl/孔更换培养基,在5%co2恒温箱中在37℃下进一步孵化了3天。然后,回收培养上清液并且使用celltiter96 aqueous one solution cell proliferation assay(promega公司制)测定了细胞生存率。使用alphalisa hepatitis b virus surface antigen(hbsag)kit(perkin elmer公司制)测定了所回收的培养上清液中的hbs抗原量。并且,用buffer al(qiagen公司制)及proteinasek(thermofisher scientific公司制)的混合物处理所回收的培养上清液,通过实时pcr法定量了所得到的溶液中的hbv的dna(hbv dna)。关于各标记,计算了各dsrna添加孔与各浓度的阴性对照dsrna添加孔的相对值(%)(图3及图4)。
[0186]
通过rbfox1、srsf10、elavl1、pum2的减量,hbs抗原减少最大30%左右,通过srsf9、snrpa、ythdc1、srsf1的减量,hbs抗原减少最大70~90%左右(图3)。并且,通过pum2、srsf1的减量,hbv dna减少最大40~50%左右,通过ythdc1的减量,hbv dna减少最大80%左右。另一方面,这些基因的减量并不影响细胞生存率(图4)。由以上已知,通过抑制与编码hbs抗原的rna上的enhi相当区域及enhii相当区域结合的蛋白,可得到hbv蛋白产生抑制或hbv dna表达量的降低等抗hbv效果。
[0187]
[试验例4]
[0188]
(使用enhi/enhii区域缺陷构成的检定、基因型的探讨)
[0189]
pcr反应在包含1xprimestar max dna polymerase(takara公司制)、0.2μmol/l引子的反应液中进行。以hbv基因组dna(genbank:af462041.1;以下也称为“基因型a”)为铸模,对包含编码hbs抗原的基因的3’utr的序列(以下也称为“3’utr(基因型a)”)的区域1086bp使用由序列编号13的碱基序列组成的引子及由序列编号14的碱基序列组成的引子的组合在重复35次的条件下进行98℃10秒钟、58℃5秒钟、72℃10秒钟的pcr,由此得到了导入xbai及sali的限制酶部位的扩增片段。用xbai(takara公司制)、sali(takara公司制)的组合处理该断片,得到了插入到在试验例1中所制作的pres2/s
‑
luc
‑3’
utr(基因型c)的xbai、sali的部位而连结的质体。以下,将该质体也称为“pres2/s
‑
luc
‑3’
utr(基因型a)”。以pres2/s
‑
luc
‑3’
utr(基因型a)质体为铸模,使用由序列编号15的碱基序列组成的引子及由序列编号10的碱基序列组成的引子的组合及由序列编号7的碱基序列组成的引子及由序列编号16的碱基序列组成的引子的组合在重复35次的条件下进行98℃10秒钟、58℃5秒钟、72℃30秒钟的pcr,由此得到了用于制造缺少enhi区域的质体的扩增片段。使用in
‑
fusion hd cloning kit(takara公司制)连结这些断片,得到了缺少pres2/s
‑
luc
‑3’
utr(基因型a)质体中的enhi区域的质体。以下,将该质体也称为“pres2/s
‑
luc
‑3’
utr(基因型a)denhi”。以pres2/s
‑
luc
‑3’
utr(基因型a)质体为铸模,使用由序列编号17的碱基序列组成的引子及由序列编号10的碱基序列组成的引子的组合及由序列编号7的碱基序列组成的引子及由序列编号18的碱基序列组成的引子的组合在重复35次的条件下进行98℃10秒钟、58℃5秒钟、72℃30秒钟的pcr,由此得到了用于制作缺少enhii区域的质体的扩增片段。使用in
‑
fusion hd cloning kit(takara公司制)连结这些断片,得到了缺少pres2/s
‑
luc
‑3’
utr(基因型a)质体中的enhii区域的质体。以下,将该质体也称为“pres2/s
‑
luc
‑3’
utr(基因型a)denhii”。
[0190]
[表3]
[0191]
序列编号序列(5
’→3’
)13tagttctagaaccctaacaaaacaaaaaga14tagtgtcgactttataagggtcaatgtcca15cctgccttaatgcctccgatccatactgcg16aggcattaaggcaggatatc17aacgcccatcagatcattaggaggctgtag18gatctgatgggcgttcacgg
[0192]
以hbv基因组dna(序列编号19、以下也称为“基因型b”)为铸模,对包含编码hbs抗原的基因的3’utr的序列(以下也称为“3’utr(基因型b)”)的区域1095bp使用由序列编号20的碱基序列组成的引子及由序列编号21的碱基序列组成的引子的组合在重复35次的条件下进行98℃10秒钟、58℃5秒钟、72℃10秒钟的pcr,由此得到了导入xbai及sali的限制酶部位的扩增片段。用xbai(takara公司制)、sali(takara公司制)的组合处理该断片,得到了插入到在试验例1中所制作的pres2/s
‑
luc
‑3’
utr(基因型c)的xbai、sali的部位而连结的质体。以下,将该质体也称为“pres2/s
‑
luc
‑3’
utr(基因型b)”。以pres2/s
‑
luc
‑3’
utr(基因型b)质体为铸模,使用由序列编号22的碱基序列组成的引子及由序列编号10的碱基序列组成的引子的组合及由序列编号7的碱基序列组成的引子及由序列编号23的碱基序列组成的引
子的组合在重复35次的条件下进行98℃10秒钟、58℃5秒钟、72℃30秒钟的pcr,由此得到了用于制作缺少enhi区域的质体的扩增片段。使用in
‑
fusion hd cloning kit(takara公司制)连结这些断片,得到了缺少pres2/s
‑
luc
‑3’
utr(基因型b)质体中的enhi区域的质体。以下,将该质体也称为“pres2/s
‑
luc
‑3’
utr(基因型b)denhi”。以pres2/s
‑
luc
‑3’
utr(基因型b)质体为铸模,使用由序列编号24的碱基序列组成的引子及由序列编号10的碱基序列组成的引子的组合及由序列编号7的碱基序列组成的引子及由序列编号25的碱基序列组成的引子的组合在重复35次的条件下进行98℃10秒钟、58℃5秒钟、72℃30秒钟的pcr,由此得到了用于制作缺少enhii区域的质体的扩增片段。使用in
‑
fusion hd cloning kit(takara公司制)连结这些断片,得到了缺少pres2/s
‑
luc
‑3’
utr(基因型b)质体中的enhii区域的质体。以下,将该质体也称为“pres2/s
‑
luc
‑3’
utr(基因型b)denhii”。
[0193]
[表4]
[0194][0195]
[表5]
[0196]
序列编号序列(5
’→3’
)20tagttctagaaccctcacaaaacaaaaaga21tagtgtcgactttatacgggtcaatgtcca22cctgctttaatgcctccgatccatactgcg23aggcattaaagcaggatatc24aagaggactcttggaaggctgtaggcataa25tccaagagtcctcttatgca
[0197]
以hbv基因组dna(genbank:u95551.1;以下也称为“基因型d”)为铸模,对包含编码
hbs抗原的基因的3’utr的序列(以下也称为“3’utr(基因型d)”)的区域1086bp使用由序列编号26的碱基序列组成的引子及由序列编号27的碱基序列组成的引子的组合在重复35次的条件下进行98℃10秒钟、58℃5秒钟、72℃15秒钟的pcr,由此得到了导入xbai及sali的限制酶部位的扩增片段。用xbai(takara公司制)、sali(takara公司制)的组合处理该断片,得到了插入到在试验例1中所制作的pres2/s
‑
luc
‑3’
utr(基因型c)的xbai、sali的部位而连结的质体。以下,将该质体也称为“pres2/s
‑
luc
‑3’
utr(基因型d)”。以pres2/s
‑
luc
‑3’
utr(基因型d)质体为铸模,使用由序列编号28的碱基序列组成的引子及由序列编号10的碱基序列组成的引子的组合及由序列编号7的碱基序列组成的引子及由序列编号29的碱基序列组成的引子的组合在重复35次的条件下进行98℃10秒钟、58℃5秒钟、72℃30秒钟的pcr,由此得到了用于制作缺少enhi区域的质体的扩增片段。使用in
‑
fusion hd cloning kit(takara公司制)连结这些断片,得到了缺少pres2/s
‑
luc
‑3’
utr(基因型d)质体中的enhi区域的质体。以下,将该质体也称为“pres2/s
‑
luc
‑3’
utr(基因型d)denhi”。以pres2/s
‑
luc
‑3’
utr(基因型d)质体为铸模,使用由序列编号30的碱基序列组成的引子及由序列编号10的碱基序列组成的引子的组合及由序列编号7的碱基序列组成的引子及由序列编号31的碱基序列组成的引子的组合在重复35次的条件下进行98℃10秒钟、58℃5秒钟、72℃30秒钟的pcr,由此得到了用于制作缺少enhii区域的质体的扩增片段。使用in
‑
fusion hd cloning kit(takara公司制)连结这些断片,得到了缺少pres2/s
‑
luc
‑3’
utr(基因型d)质体中的enhii区域的质体。以下,将该质体也称为“pres2/s
‑
luc
‑3’
utr(基因型d)denhii”。
[0198]
[表6]
[0199]
序列编号序列(5
’→3’
)26tagttctagaaccctaacaaaacaaagaga27tagtgtcgactttataagggtcgatgtcca28cctgcgttaatgcccccgatccatactgcg29gggcattaacgcaggataac30acgcccaccgaatgtactaggaggctgtag31acattcggtgggcgttcacg
[0200]
使用hepg2.2.15细胞,按以下顺序实施了基因试验。
[0201]
作为细胞培养用培养基,使用了以下。
[0202]
dmem/f
‑
12、glutamax(thermo fisher scientific公司制) 5μg/ml胰岛素(fujifilm wako pure chemical corporation制) 1%青霉素/链霉素(fujifilm wako pure chemical corporation制) 10mmol/l hepes(fujifilm wako pure chemical corporation制) 50μmol/l氢皮质酮(fujifilm wako pure chemical corporation制) 10%fbs(equitech
‑
bio公司制)
[0203]
将hepg2.2.15细胞悬浮于上述培养基中,以每1孔成为1
×
104cell/100μl的方式播种于96孔微孔盘中,在5%co2恒温箱中在37℃下孵化了一晩。用7.8μl的无血清培养基(thermofisher scientific公司制)稀释64ng的各种质体(pres2/s
‑
luc
‑3’
utr(基因型a)、pres2/s
‑
luc
‑3’
utr(基因型a)denhi、pres2/s
‑
luc
‑3’
utr(基因型a)denhii、pres2/s
‑
luc
‑3’
utr(基因型b)、pres2/s
‑
luc
‑3’
utr(基因型b)denhi、pres2/s
‑
luc
‑3’
utr(基因型b)denhii、pres2/s
‑
luc
‑3’
utr(基因型c)、pres2/s
‑
luc
‑3’
utr(基因型c)denhi、pres2/s
‑
luc
‑3’
utr(基因型c)denhii、pres2/s
‑
luc
‑3’
utr(基因型d)、pres2/s
‑
luc
‑3’
utr(基因型d)denhi、pres2/s
‑
luc
‑3’
utr(基因型d)denhii)中的任一种及0.25ng的prl
‑
sv40质体(promega公司制)、0.24μl的transit
‑
x2 transfection reagent(mirus公司制),在室温下孵化了20分钟。将该质体
‑
transit
‑
x2 transfection reagent混合液8μl添加到播种前述hepg2.2.15的孔中,进一步孵化了1天。接着,用前述细胞培养用培养基100μl/孔更换培养基,在5%co2恒温箱中在37℃下进一步孵化了24小时。孵化之后,用dual
‑
luciferase reporter assay system(promega公司制)检测了基于萤火虫荧光素酶的发光及基于海肾荧光素酶的发光。对各孔计算了用海肾荧光素酶的发光量校正的萤火虫荧光素酶的发光量。然后,将计算了各基因型的缺少质体添加孔中的萤光素酶的发光量与pres2/s
‑
luc
‑3’
utr(基因型a)、pres2/s
‑
luc
‑3’
utr(基因型b)、pres2/s
‑
luc
‑3’
utr(基因型c)、pres2/s
‑
luc
‑3’
utr(基因型d)的各质体添加孔中的萤火虫荧光素酶的发光量的相对值(%)的结果示于图5中。
[0204]
将hepg2.2.15细胞悬浮于上述培养基中,以每1孔成为1
×
105cell/500μl的方式播种于24孔微孔盘中,在5%co2恒温箱中在37℃下孵化了一晩。用50μl的无血清培养基(thermofisher scientific公司制)稀释500ng的各种质体(pres2/s
‑
luc
‑3’
utr(基因型a)、pres2/s
‑
luc
‑3’
utr(基因型a)denhi、pres2/s
‑
luc
‑3’
utr(基因型a)denhii、pres2/s
‑
luc
‑3’
utr(基因型b)、pres2/s
‑
luc
‑3’
utr(基因型b)denhi、pres2/s
‑
luc
‑3’
utr(基因型b)denhii、pres2/s
‑
luc
‑3’
utr(基因型c)、pres2/s
‑
luc
‑3’
utr(基因型c)denhi、pres2/s
‑
luc
‑3’
utr(基因型c)denhii、pres2/s
‑
luc
‑3’
utr(基因型d)、pres2/s
‑
luc
‑3’
utr(基因型d)denhi、pres2/s
‑
luc
‑3’
utr(基因型d)denhii)中的任一种及1.5μl的transit
‑
x2 transfection reagent(mirus公司制),在室温下孵化了20分钟。将该质体
‑
transit
‑
x2 transfection reagent混合液52μl添加到播种前述hepg2.2.15的孔中,孵化了一晩。接着,用前述细胞培养用培养基500μl/孔更换培养基,在5%co2恒温箱中在37℃下进一步孵化了1天。然后,废弃培养上清液,用磷酸缓冲生理盐水(1000μl/孔、fujifilm wako pure chemical corporation制)清洗细胞,使用rneasy mini kit(qiagen公司制)提取了总rna。使用primescript rt reagent kit with gdna eraser(takara公司制)反转录所提取的总rna,制作了cdna。基于所制作的cdna定量萤火虫荧光素酶rna的表达量,将计算了各基因型的缺少质体添加孔中的萤光素酶rna表达量与pres2/s
‑
luc
‑3’
utr(基因型a)、pres2/s
‑
luc
‑3’
utr(基因型b)、pres2/s
‑
luc
‑3’
utr(基因型c)、pres2/s
‑
luc
‑3’
utr(基因型d)的各质体添加孔中的萤火虫荧光素酶rna的表达量的相对值(%)的结果示于图5中。
[0205]
基因型a中,通过enhi区域或enhii区域的缺少,来自于萤火虫荧光素酶蛋白的相对发光量减少了87%~90%(图5)。另一方面,通过enhi区域或enhii区域的缺少,萤火虫荧光素酶rna的相对表达量减少了31~49%。
[0206]
基因型b中,通过enhi区域或enhii区域的缺少,来自于萤火虫荧光素酶蛋白的相对发光量减少了65%~80%。另一方面,通过enhi区域或enhii区域的缺少,萤火虫荧光素酶rna的相对表达量减少了39~43%。
[0207]
基因型c中,通过enhi区域或enhii区域的缺少,来自于萤火虫荧光素酶蛋白的相对发光量减少了74%~84%。另一方面,通过enhi区域或enhii区域的缺少,萤火虫荧光素酶rna的相对表达量减少了34~61%。
[0208]
基因型d中,通过enhi区域或enhii区域的缺少,来自于萤火虫荧光素酶蛋白的相对发光量减少了86%~91%。另一方面,通过enhi区域或enhii区域的缺少,萤火虫荧光素酶rna的相对表达量减少了51~52%。
[0209]
以上的结果均示出enhi区域及enhii区域有助于从rna翻译到蛋白的过程。即,已知与hbv的多个的基因型共通,hbv基因组dna上的相当于enhi的区域或相当于enhii的区域在rna上发挥功能,并且控制蛋白的表达量。
[0210]
产业上的可利用性
[0211]
本发明的医药组合物显示优异的抗hbv活性,并且有用于抗乙型肝炎病毒剂。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。