1.本发明涉及一种含有植物经曲霉菌发酵的发酵液作为有效成分的抗老化剂、抗氧化剂、抗炎剂、及美白剂、以及含有所述抗炎剂、所述抗氧化剂、所述抗炎剂、及所述美白剂中的至少任一种的化妆品。
背景技术:
2.近年来,活性氧作为造成生物成分氧化的主要原因而备受关注,其对生物造成的不良影响成为问题。活性氧是在生物细胞内的能量代谢过程中产生,有超氧化物[即,氧分子的单电子还原所产生的超氧阴离子(
·
o2‑
)、过氧化氢(h2o2)、单线态氧(1o2)、羟基自由基(
·
oh)]等。这种活性氧对于吞噬细胞的杀菌机制而言必不可少,对于清除病毒或癌细胞发挥重要作用。
[0003]
但是,所述活性氧的过量生成会攻击构成生物体内的膜和组织的生物体内分子,诱发各种疾病。在生物体内产生并成为其它活性氧的起始物质的超氧化物,通常会由于细胞内包含的超氧化物歧化酶(sod,super oxide dismutase)的催化作用而被逐步清除。但是,当超氧化物过量产生时,或者sod的作用降低时,超氧化物的清除便会不足,导致超氧化物浓度升高。所述情况被认为是引起类风湿性关节炎、白塞病等组织疾病、心肌梗塞、脑中风、白内障、黄褐斑、雀斑、皱纹、糖尿病、动脉硬化、肩酸、怕冷体质、皮肤老化等的原因之一。
[0004]
这些不良情况当中,皮肤由于直接受到紫外线等环境因素的刺激,所以是容易生成超氧化物的器官,因此,随着超氧化物浓度的上升,例如会存在如下问题:使胶原蛋白等生物组织分解、改性、或交联,另外使油脂类氧化而生成对细胞造成损伤的过氧化脂质,形成皮肤皱纹,或者引起皮肤弹性降低等老化、炎症、肌肤色素沉积(参照非专利文献1)。因此,业界认为通过阻碍、抑制活性氧或生物体内自由基的生成,能够预防、治疗或改善皱纹形成或弹力降低等皮肤老化、及类风湿性关节炎或白塞病等组织疾病、心肌梗塞、脑中风、白内障、糖尿病、动脉硬化、肩酸、怕冷体质等与活性氧相关的各种病症。
[0005]
因此,尝试从在安全性方面有利的天然物质获得活性氧清除物质、自由基清除物质、过氧化氢清除物质等,发现十字花科芸苔属植物的提取物(参照专利文献1)、景天科伽蓝菜属植物的提取物(参照专利文献2)、木蝴蝶提取物(参照专利文献3)、甘薯蔓提取物(参照专利文献4)等具有有效性。
[0006]
另外,炎症性疾病、例如接触性皮炎(斑疹)、干癣、寻常型天疱疮、其它伴有肌肤粗糙的各种皮肤疾病等的原因及发病机制多种多样。已知其原因主要在于透明质酸酶的活性亢进。
[0007]
透明质酸酶是透明质酸的水解酶。保持与身体组织亲和性的透明质酸盐在含水体系中由于紫外线、氧气等而分解,使分子量降低,保水效果也随之下降。另外,透明质酸在生物体内以细胞间组织的形式存在,也与血管通透性相关。此外,透明质酸酶存在于肥胖细胞中,其活化引起脱颗粒,因而发生游离,作为炎症系化学介质起作用。因此,通过抑制透明质
酸酶的活性,可期待强化保湿及预防、减轻炎症。
[0008]
作为具有这种透明质酸酶活性抑制作用的物质,例如已知有金锦香属植物的提取物(参照专利文献5)、藤茶提取物(参照专利文献6)等。
[0009]
另外,皮肤中的黑色素也起到保护生物免受紫外线伤害的作用,但过量生成或不均匀的堆积会引起皮肤变黑或黄褐斑产生。通常,认为黑色素是通过在色素细胞中生物合成的酪氨酸酶的作用,从酪氨酸变成多巴,又从多巴变成多巴醌,然后经过5,6
‑
二羟基靛酚等中间物而形成。因此认为,为了预防、治疗或改善皮肤变黑(皮肤色素沉着病)、黄褐斑、雀斑等,就要抑制与产生黑色素相关的酪氨酸酶的活性、或抑制黑色素的产生。
[0010]
以往为了预防、治疗或改善皮肤色素沉着病、黄褐斑、雀斑等,一直采取将以对苯二酚等化学合成品作为有效成分的美白剂外用的措施。然而,人们担忧对苯二酚等化学合成品会产生皮肤刺激、过敏等副作用。
[0011]
因此,业界期待开发出以安全性高的天然原料作为有效成分的美白剂,作为具有酪氨酸酶活性抑制作用的物质,例如已知有藤茶提取物(参照专利文献7)、水蓼提取物(参照专利文献8)等。另外,作为具有黑色素产生抑制作用的物质,例如已知有来自蓖麻根部的提取物(参照专利文献9)、来自属于风毛菊(saussurea)属的植物的提取物(参照专利文献10)等。
[0012]
另外,皮肤的表皮及真皮是由表皮细胞、纤维母细胞及位于这些细胞外部来支持皮肤构造的胶原蛋白等细胞外基质构成。年轻皮肤中,通过使这些皮肤组织的相互作用保持恒常性,而确保保水、柔软性、弹性等,肌肤从外表来看也紧致有力和富有光泽,维持水润的状态。
[0013]
但是,如果皮肤受到紫外线(uv
‑
a、uv
‑
b)照射、空气极度干燥、过度皮肤清洁等某种外因的影响,或者年龄不断增长,则作为细胞外基质主要构成成分的胶原蛋白的产生量便会减少,同时因交联而引起弹力降低。其结果,皮肤的保湿功能和弹性降低,角质开始异常脱落,因此,肌肤会出现松弛、失去光泽、粗糙、皱纹等老化症状。
[0014]
关于如此随皮肤老化而出现的变化,即皱纹、暗沉、肌理消失、弹性降低等,可列举各种成因,例如与胶原蛋白、透明质酸、弹性蛋白等细胞外基质成分的减少及改性有关。因此,认为通过促进胶原蛋白或透明质酸等的产生,能够防止及改善皮肤的老化。
[0015]
因此,基于安全性方面,业界尝试从有利的天然物质获得具有胶原蛋白产生促进作用的物质。作为具有胶原蛋白产生促进作用的物质,例如发现了杨桃叶提取物(参照专利文献11)、粗糠柴提取物(参照专利文献12)等。
[0016]
另外报告了如下内容:作为天然保湿因子(natural moisturizing factors)主成分的氨基酸是来自透明角质颗粒的丝聚蛋白在角质层内被分解而产生。该丝聚蛋白在存在于角质层正下方的颗粒层中的表皮角质形成细胞中表现为丝聚蛋白原。其后立即磷酸化,堆积于透明角质颗粒,经过去磷酸、水解而分解成丝聚蛋白,移动至角质层,从而提高角蛋白纤维的凝集效率,参与角质细胞的内部构建(参照非专利文献2)。
[0017]
近年来,报告了该丝聚蛋白对于皮肤的水分保持而言非常重要而不可或缺,且干燥等条件会使丝聚蛋白的合成力下降,导致角质层中的氨基酸量降低(参照非专利文献3)。
[0018]
因此,期待能够通过促进表皮角质形成细胞中丝聚蛋白原mrna的表达,来促进丝聚蛋白的合成,由此增加角质层内的氨基酸量,从根本上改善角质层的水分环境。
[0019]
作为来自天然物质的丝聚蛋白合成促进剂,例如提出了甘草提取物(参照专利文献13)、已知为天然植物中所含的黄烷酮糖苷的甘草苷(参照专利文献14),另外,作为来自天然物质的丝聚蛋白原及丝聚蛋白的蛋白产生促进剂中的至少任一种,提出了属于柑橘(citrus)属的植物提取物或酵母提取物(参照专利文献15)等。
[0020]
表皮通过角化细胞的分裂和其后的分化而不断形成新的角质细胞,由此具有保护皮肤免受来自外界的各种刺激的防御功能。特别是在角化细胞的分化过程中,外膜蛋白等蛋白质从有棘层向颗粒层表达,在谷氨酰胺转氨酶
‑
1的作用下交联,形成包覆角化细胞的不溶性细胞膜样结构物即角质化包膜(以下简称为“ce”),有助于实现角质细胞的细胞骨架及结构的稳定性。
[0021]
但是,如果因各种因素导致表皮中的谷氨酰胺转氨酶
‑
1的产生量减少,则ce形成处于不完整的状态,不会正常地进行角质化。结果角质屏障功能及皮肤保湿功能降低,会表现出肌肤粗糙或肌肤干燥等皮肤症状。
[0022]
鉴于上述内容认为,通过提高角化细胞在表皮中的谷氨酰胺转氨酶
‑
1的产生,促进ce形成而使角质化正常,能够抑制随着干燥或紫外线等外部刺激带来的皮肤屏障功能的降低,预防、改善肌肤干燥或肌肤粗糙等各种皮肤症状。
[0023]
作为来自天然物质的谷氨酰胺转氨酶
‑
1产生促进剂,提出了诺丽果提取物(参照专利文献16)、蜂王浆提取物(参照专利文献17)等。
[0024]
另外,已知在皮肤细胞中,作为水通道而为人所知的水通道蛋白在细胞膜上表达,承担着将以细胞间隙的水为代表的低分子物质吸收到细胞内的作用。已知在人类中存在13种水通道蛋白(aqp0~aqp12)。在表皮细胞中,主要存在水通道蛋白3(aquaporin 3,aqp3),认为其承担如下作用:除了吸收水以外,还吸收与保水作用相关的甘油或尿素等低分子化合物。
[0025]
然而,aqp3会随着年龄的增长而减少,这提示出该aqp3的减少是保水功能降低的原因之一,因此,认为可通过促进aqp3的表达,来控制随年龄增长而降低的保水功能或屏障功能等(参照非专利文献4)。作为具有aqp3表达促进作用的物质,例如已知有来自杨桃叶部的提取物(参照专利文献18)等。
[0026]
以往,人们认为只有角质层承担皮肤的屏障功能,但如果以基因水平使存在于表皮颗粒层中的紧密连接(tight junction,以下简称为“tj”)的结构蛋白缺损,则皮肤的屏障功能崩溃,因此,近年来,tj也被认为在皮肤的屏障功能中承担着重要作用(参照非专利文献5)。tj是一种连接装置,其不仅使邻接的细胞彼此密接,而且将细胞和细胞的间隙封闭,由此控制物质的透过。构成tj的是细胞膜蛋白的密蛋白(密连蛋白)和紧蛋白(紧连蛋白),认为这些蛋白质构成tj链的骨架,控制tj的屏障功能(参照非专利文献6)。鉴于上述内容预测,当密蛋白或紧蛋白的表达因某种原因减少时,tj结构被破坏,失去作为物质的透过屏障的功能,因此成为引起肌肤干燥、肌肤粗糙、异位性皮炎或各种传染病等皮肤症状的原因。
[0027]
因此,想到通过在表皮中促进密蛋白或紧蛋白的产生,而促进形成表皮角化细胞的tj,由此能够提高皮肤的屏障功能及保水功能,预防或改善所述皮肤症状。基于这种想法,作为经tj形成促进作用来使皮肤屏障功能提升的物质,提出了来自天然物质的黄连提取物(参照专利文献19)、云杉提取物(参照专利文献20)等。
[0028]
另外,近年来,已经指出基质金属蛋白酶(mmps,matrix metalloproteinases)的参与是诱发皮肤老化所伴随的变化的因素。该mmps中,已知基质金属蛋白酶
‑
1(mmp
‑
1)是分解胶原蛋白的酶,该胶原蛋白是皮肤真皮细胞外基质的主要构成成分,但其表达会因紫外线照射而大幅增加,认为这是使胶原蛋白减少、改性的原因之一,是皮肤形成皱纹、弹性降低等的重要原因。因此,抑制mmp
‑
1的活性在预防、改善皮肤老化症状的方面很重要。
[0029]
作为具有这种mmp
‑
1抑制作用的物质,例如已知有高盆樱桃的提取物(参照专利文献21)、姜科卡萨蒙纳姜或桑科森林榕的提取物(参照专利文献22)等。
[0030]
另一方面,已知用曲霉菌使蒿属植物发酵而得的发酵液(参照专利文献23)、或用曲霉菌使百里香发酵而得的发酵液(参照专利文献24),但并未获知这些植物发酵液具有抗老化作用、抗氧化作用、抗炎作用、美白作用等作用。
[0031]
现有技术文献
[0032]
专利文献
[0033]
专利文献1:日本专利特开2003
‑
81848号公报
[0034]
专利文献2:日本专利特开2005
‑
29483号公报
[0035]
专利文献3:日本专利特开2006
‑
321730号公报
[0036]
专利文献4:日本专利特开2007
‑
8902号公报
[0037]
专利文献5:日本专利特开2003
‑
55242号公报
[0038]
专利文献6:日本专利特开2003
‑
12532号公报
[0039]
专利文献7:日本专利特开2002
‑
370962号公报
[0040]
专利文献8:日本专利特开2004
‑
83488号公报
[0041]
专利文献9:日本专利特开2001
‑
213757号公报
[0042]
专利文献10:日本专利特开2002
‑
201122号公报
[0043]
专利文献11:日本专利特开2002
‑
226323号公报
[0044]
专利文献12:日本专利特开2003
‑
146837号公报
[0045]
专利文献13:日本专利特开2002
‑
363054号公报
[0046]
专利文献14:日本专利特开2003
‑
146886号公报
[0047]
专利文献15:日本专利特开2001
‑
261568号公报
[0048]
专利文献16:日本专利特开2010
‑
090093号公报
[0049]
专利文献17:日本专利特开2009
‑
184955号公报
[0050]
专利文献18:日本专利特开2009
‑
191039号公报
[0051]
专利文献19:日本专利特开2007
‑
176830号公报
[0052]
专利文献20:日本专利特开2007
‑
176835号公报
[0053]
专利文献21:日本专利特开2003
‑
176232号公报
[0054]
专利文献22:日本专利特开2003
‑
176230号公报
[0055]
专利文献23:日本专利特开2011
‑
140453号公报
[0056]
专利文献24:日本专利特开2011
‑
130689号公报
[0057]
非专利文献
[0058]
非专利文献1:“fragrance journal”临时增刊no.14、p156、1995年
[0059]
非专利文献2:fragrance journal临时增刊,vol.17,pp.14
‑
19(2000)
[0060]
非专利文献3:arch.dermatol.res.,vol.288,pp.442
‑
446(1996)
[0061]
非专利文献4:“fragrance journal”,2006年,vol.34,no.10,p.19
‑
23
[0062]
非专利文献5:j.cell biol.,vol.156,pp.1099
‑
1111(2002)
[0063]
非专利文献6:日本香妆品科学会刊,vol.31,pp.296
‑
301(2007)
技术实现要素:
[0064]
[发明所要解决的问题]
[0065]
本发明的课题在于解决以往所述的诸多问题,而达成以下的目的。
[0066]
即,本发明的目的在于提供具有优异的抗老化作用且安全性高的抗老化剂、具有优异的抗氧化作用且安全性高的抗氧化剂、具有优异的抗炎作用且安全性高的抗炎剂、及具有优异的美白作用且安全性高的美白剂。
[0067]
另外,本发明的目的在于提供一种具有优异的选自由抗老化作用、抗氧化作用、抗炎作用、及美白作用所组成的群组中的至少1种作用且安全性高的化妆品。
[0068]
[解决问题的技术手段]
[0069]
解决所述问题的技术手段如下所述。即,
[0070]
<1>一种抗老化剂,其特征在于:含有蒿属植物经曲霉菌发酵的发酵液、百里香经曲霉菌发酵的发酵液、香蜂草经曲霉菌发酵的发酵液、及矢车菊经曲霉菌发酵的发酵液中的至少任一种发酵液作为有效成分。
[0071]
<2>一种抗氧化剂,其特征在于:含有蒿属植物经曲霉菌发酵的发酵液、百里香经曲霉菌发酵的发酵液、香蜂草经曲霉菌发酵的发酵液、及矢车菊经曲霉菌发酵的发酵液中的至少任一种发酵液作为有效成分。
[0072]
<3>一种抗炎剂,其特征在于:含有蒿属植物经曲霉菌发酵的发酵液、及香蜂草经曲霉菌发酵的发酵液中的至少任一种发酵液作为有效成分。
[0073]
<4>一种美白剂,其特征在于:含有蒿属植物经曲霉菌发酵的发酵液、香蜂草经曲霉菌发酵的发酵液、及矢车菊经曲霉菌发酵的发酵液中的至少任一种发酵液作为有效成分。
[0074]
<5>一种化妆品,其特征在于:含有选自由根据所述<1>记载的抗老化剂、根据所述<2>记载的抗氧化剂、根据所述<3>记载的抗炎剂、及根据所述<4>记载的美白剂所组成的群组中的至少1种。
[0075]
[发明的效果]
[0076]
根据本发明,能够解决现有的所述诸多问题,从而达成所述目的,可以提供具有优异的抗老化作用且安全性高的抗老化剂、具有优异的抗氧化作用且安全性高的抗氧化剂、具有优异的抗炎作用且安全性高的抗炎剂、及具有优异的美白作用且安全性高的美白剂。
[0077]
另外,本发明可以提供一种具有优异的选自由抗老化作用、抗氧化作用、抗炎作用、及美白作用所组成的群组中的至少1种作用且安全性高的化妆品。
附图说明
[0078]
图1a是表示测定制造例1的三齿蒿发酵液1的接触角时的液滴的一例的照片。
[0079]
图1b是表示测定制造例2的三齿蒿发酵液2的接触角时的液滴的一例的照片。
[0080]
图1c是表示测定比较制造例1的三齿蒿提取液的接触角时的液滴的一例的照片。
[0081]
图2a是表示测定制造例3的茵陈蒿发酵液1的接触角时的液滴的一例的照片。
[0082]
图2b是表示测定制造例4的茵陈蒿发酵液2的接触角时的液滴的一例的照片。
[0083]
图2c是表示测定比较制造例2的茵陈蒿提取液的接触角时的液滴的一例的照片。
[0084]
图3a是表示测定制造例5的百里香发酵液1的接触角时的液滴的一例的照片。
[0085]
图3b是表示测定制造例6的百里香发酵液2的接触角时的液滴的一例的照片。
[0086]
图3c是表示测定比较制造例3的百里香提取液的接触角时的液滴的一例的照片。
[0087]
图4a是表示测定制造例7的香蜂草发酵液1的接触角时的液滴的一例的照片。
[0088]
图4b是表示测定制造例8的香蜂草发酵液2的接触角时的液滴的一例的照片。
[0089]
图4c是表示测定比较制造例4的香蜂草提取液的接触角时的液滴的一例的照片。
[0090]
图5a是表示测定制造例9的矢车菊发酵液1的接触角时的液滴的一例的照片。
[0091]
图5b是表示测定制造例10的矢车菊发酵液2的接触角时的液滴的一例的照片。
[0092]
图5c是表示测定比较制造例5的矢车菊提取液的接触角时的液滴的一例的照片。
具体实施方式
[0093]
(抗老化剂、抗氧化剂、抗炎剂、及美白剂)
[0094]
<抗老化剂>
[0095]
本发明的抗老化剂含有蒿属植物经曲霉菌发酵的发酵液(以下有时称为“蒿属植物发酵液”)、百里香经曲霉菌发酵的发酵液(以下有时称为“百里香发酵液”)、香蜂草经曲霉菌发酵的发酵液(以下有时称为“香蜂草发酵液”)、及矢车菊经曲霉菌发酵的发酵液(以下有时称为“矢车菊发酵液”)中的至少任一种发酵液作为有效成分,还视需要含有其它成分。
[0096]
所述蒿属植物发酵液、所述百里香发酵液、所述香蜂草发酵液、及所述矢车菊发酵液具有选自由基质金属蛋白酶
‑
1(matrix metalloproteinase
‑
1,mmp
‑
1)活性抑制作用、透明质酸合成酶3(hyaluronan synthase 3,has3)mrna表达促进作用、i型胶原蛋白产生促进作用、密蛋白
‑
1 mrna表达促进作用、密蛋白
‑
4mrna表达促进作用、紧蛋白mrna表达促进作用、谷氨酰胺转氨酶
‑
1(transglutaminase
‑
1,tgm
‑
1)mrna表达促进作用、水通道蛋白3(aquaporin 3,aqp3)mrna表达促进作用、及丝聚蛋白mrna表达促进作用所组成的群组中的至少1种作用,能够利用这些作用,用作抗老化剂的有效成分。
[0097]
因此,所述抗老化剂具有选自由mmp
‑
1活性抑制作用、透明质酸合成酶3 mrna表达促进作用、i型胶原蛋白产生促进作用、密蛋白
‑
1 mrna表达促进作用、密蛋白
‑
4mrna表达促进作用、紧蛋白mrna表达促进作用、谷氨酰胺转氨酶
‑
1 mrna表达促进作用、水通道蛋白3 mrna表达促进作用、及丝聚蛋白mrna表达促进作用所组成的群组中的至少1种作用。
[0098]
虽然尚不清楚所述蒿属植物发酵液、所述百里香发酵液、所述香蜂草发酵液、及所述矢车菊发酵液所具有的发挥mmp
‑
1活性抑制作用、透明质酸合成酶3 mrna表达促进作用、i型胶原蛋白产生促进作用、密蛋白
‑
1 mrna表达促进作用、密蛋白
‑
4mrna表达促进作用、紧蛋白mrna表达促进作用、谷氨酰胺转氨酶
‑
1 mrna表达促进作用、水通道蛋白3 mrna表达促进作用、及丝聚蛋白mrna表达促进作用中的至少任一种作用的物质的详细情况,但以往完全不知道所述蒿属植物发酵液、所述百里香发酵液、所述香蜂草发酵液、及所述矢车菊发酵
液具有这种优异的作用,并且可用作抗老化剂,这是本发明者们的新发现。
[0099]
<抗氧化剂>
[0100]
本发明的抗氧化剂是含有蒿属植物经曲霉菌发酵的发酵液(蒿属植物发酵液)、百里香经曲霉菌发酵的发酵液(百里香发酵液)、香蜂草经曲霉菌发酵的发酵液(香蜂草发酵液)、及矢车菊经曲霉菌发酵的发酵液(矢车菊发酵液)中的至少任一种发酵液作为有效成分,还视需要含有其它成分而成的。
[0101]
所述蒿属植物发酵液、所述百里香发酵液、所述香蜂草发酵液、及所述矢车菊发酵液具有二苯基对苦基肼(dpph,dipheny
‑
p
‑
picrylhydrazyl)自由基清除作用,能够利用该作用而将其用作抗氧化剂的有效成分。
[0102]
因此,所述抗氧化剂具有dpph自由基清除作用。
[0103]
虽然尚不清楚所述蒿属植物发酵液、所述百里香发酵液、所述香蜂草发酵液、及所述矢车菊发酵液所具有的发挥dpph自由基清除作用的物质的详细情况,但以往完全不知道所述蒿属植物发酵液、所述百里香发酵液、所述香蜂草发酵液、及所述矢车菊发酵液具有这种优异的作用,并且可用作抗氧化剂,这是本发明者们的新发现。
[0104]
<抗炎剂>
[0105]
本发明的抗炎剂是含有蒿属植物经曲霉菌发酵的发酵液(蒿属植物发酵液)、及香蜂草经曲霉菌发酵的发酵液(香蜂草发酵液)中的至少任一种发酵液作为有效成分,还视需要含有其它成分而成的。
[0106]
所述蒿属植物发酵液及所述香蜂草发酵液具有透明质酸酶活性抑制作用,能够利用该作用而将其用作抗炎剂的有效成分。
[0107]
因此,所述抗炎剂具有透明质酸酶活性抑制作用。
[0108]
虽然尚不清楚所述蒿属植物发酵液及所述香蜂草发酵液所具有的发挥透明质酸酶活性抑制作用的物质的详细情况,但以往完全不知道所述蒿属植物发酵液及所述香蜂草发酵液具有这种优异的作用,并且可用作抗炎剂,这是本发明者们的新发现。
[0109]
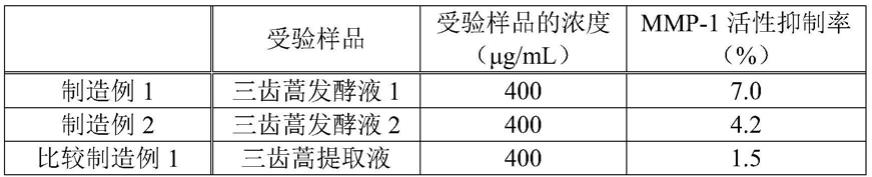
<美白剂>
[0110]
本发明的美白剂是含有蒿属植物经曲霉菌发酵的发酵液(蒿属植物发酵液)、香蜂草经曲霉菌发酵的发酵液(香蜂草发酵液)、及矢车菊经曲霉菌发酵的发酵液(矢车菊发酵液)中的至少任一种发酵液作为有效成分,还视需要含有其它成分而成的。
[0111]
所述蒿属植物发酵液、香蜂草发酵液、及所述矢车菊发酵液具有酪氨酸酶活性抑制作用及黑色素产生抑制作用中的至少1种作用,能够利用该作用而将其用作美白剂的有效成分。
[0112]
因此,所述美白剂具有酪氨酸酶活性抑制作用及黑色素产生抑制作用中的至少1种作用。
[0113]
虽然尚不清楚所述蒿属植物发酵液、所述香蜂草发酵液、及所述矢车菊发酵液所具有的发挥酪氨酸酶活性抑制作用及黑色素产生抑制作用中的至少任一种作用的物质的详细情况,但以往完全不知道所述蒿属植物发酵液、所述香蜂草发酵液、及所述矢车菊发酵液具有这种优异的作用,并且可用作美白剂,这是本发明者们的新发现。
[0114]
<<蒿属植物发酵液>>
[0115]
所述蒿属植物发酵液是属于蒿属的植物(以下有时称为“蒿属植物”)利用曲霉菌
发酵而得的发酵液。
[0116]
‑
蒿属植物
‑
[0117]
用作所述发酵原料的所述蒿属植物是属于菊科(compositae)蒿属(artemisia)的多年生草本植物,自古以来一直被用作食品或药用的原料。在北海道、本州、四国、九州等日本国内广泛地自然生长或种植,能够从这些地区容易获取。
[0118]
所述蒿属植物的种类没有特别限制,可以根据目的适当选择,例如可列举:山地蒿(artemisia montana(nakai)pamp.)、茵陈蒿(artemisia capillaris thunbergii)、魁蒿(artemisia princeps pampan.)、牡蒿(artemisia japonica thunb.)、中亚苦蒿(artemisia absinthium l.)、白苞蒿(artemisia lactiflora wall.)、海岸蛔蒿(artemisia maritima l.)、猪毛蒿(artemisia scoparia waldst.et kit.)等。这些可以单独使用1种,也可以并用2种以上。
[0119]
所述蒿属植物的获取方法没有特别限制,可以根据目的适当选择,可以从自然界采集,也可以使用市售品。
[0120]
用作所述发酵原料的所述蒿属植物的使用部位没有特别限制,可以根据目的适当选择,例如可列举:花、花蕾、果实、果皮、种子、种皮、茎、叶、秆、枝叶等地上部分;根、根茎等地下部分等。这些可以单独使用1种,也可以并用2种以上。这些部位当中,所述蒿属植物的使用部位优选为地上部分。
[0121]
关于用作所述发酵原料的所述蒿属植物的大小,只要是能够培养所述曲霉菌的大小,便没有特别限制,可以根据目的适当选择,例如可列举:所采集的原本大小、切断成所需的大小、经微粉(粉末)化的大小等。
[0122]
关于用作所述发酵原料的所述蒿属植物的状态,只要是能够培养所述曲霉菌的状态,便没有特别限制,可以根据目的适当选择,例如可列举:所采集的原本状态、干燥状态、粉碎状态、榨汁状态、提取物的状态等。这些状态当中,从所述曲霉菌容易起作用的方面来说,优选所采集的原本状态、粉碎状态、榨汁状态、提取物的状态,更优选所采集的原本状态、粉碎状态。
[0123]
使所述蒿属植物为干燥状态的方法没有特别限制,可以根据目的适当选择,例如可列举:日晒干燥的方法、利用常用的干燥机进行干燥的方法等。
[0124]
使所述蒿属植物为所述粉碎状态的方法没有特别限制,可以根据目的适当选择,例如可列举利用搅拌机、榨糖机、电力磨机、喷射式磨机、冲击式粉碎机等进行粉碎的方法等。
[0125]
使所述蒿属植物为所述榨汁状态的方法没有特别限制,可以根据目的适当选择,例如可列举压榨等。
[0126]
使所述蒿属植物为所述提取物状态的方法没有特别限制,可以根据目的适当选择植物提取中常用的方法。
[0127]
用作所述发酵原料的所述蒿属植物优选在接种所述曲霉菌之前进行杀菌。对所述蒿属植物进行杀菌的方法没有特别限制,可以从公知的方法中适当选择。
[0128]
‑
曲霉菌
‑
[0129]
使所述蒿属植物发酵的所述曲霉菌没有特别限制,可以根据目的适当选择,例如可列举:米曲霉(aspergillus oryzae)、酱油曲霉(aspergillus sojae)等黄曲霉菌;琉球
曲霉(aspergillus luchuensis)等黑曲霉菌;河内白曲霉(aspergillus kawauchii)等白曲霉菌;这些的变异株等。这些可以单独使用1种,也可以并用2种以上。这些曲霉菌当中,作为所述曲霉菌,从抗老化作用、抗氧化作用、抗炎作用、及美白作用中的至少任一种作用优异的方面来说,优选米曲霉(aspergillus oryzae)。
[0130]
所述曲霉菌的获取方法没有特别限制,可以根据目的适当选择,可以从自然界采集,也可以使用市售品。另外,作为所述曲霉菌,可以使用以米等为原料的种曲,也可以使用下述蒿属植物种曲,还可以使用经培养基(琼脂培养基、液体培养基等)培养的曲霉菌。这些曲霉菌当中,从抗老化作用、抗氧化作用、抗炎作用、及美白作用中的至少任一种作用优异的方面,优选使用所述蒿属植物种曲。
[0131]
关于所述曲霉菌在用作所述发酵原料的所述蒿属植物上的接种量,只要是能使所述蒿属植物发酵的量,便没有特别限制,可以根据目的适当选择,在所述发酵原料为液体状态的情况下,优选为1
×
103个/ml~1
×
108个/ml,在所述发酵原料为固体状态的情况下,优选为1
×
103个/g~1
×
108个/g。
[0132]
在对所述蒿属植物接种所述曲霉菌时,优选添加水。所述水的添加量没有特别限制,可以根据目的适当选择,相对于所述蒿属植物100质量份,优选添加500质量份~5,000质量份,更优选添加1,000质量份~4,000质量份,特别优选添加1,500质量份~3,000质量份。
[0133]
所述发酵(培养)温度只要是能够利用所述曲霉菌进行发酵的温度范围内,便没有特别限制,可以根据目的适当选择,优选为20℃~40℃,更优选为25℃~35℃。如果所述发酵温度低于20℃,则存在1法使所述蒿属植物充分发酵,抗老化作用、抗氧化作用、抗炎作用、及美白作用中的至少任一种作用不足的情况。此外,如果超过50℃,则存在无法使所述曲霉菌增殖的情况。
[0134]
所述发酵(培养)时间没有特别限制,可以根据目的适当选择,优选为10小时~40小时,更优选为20小时~30小时。如果所述发酵时间少于10小时,则存在无法使所述蒿属植物充分发酵,抗老化作用、抗氧化作用、抗炎作用、及美白作用中的至少任一种作用不足的情况。
[0135]
停止所述发酵(培养)的方法没有特别限制,可以根据目的适当选择,例如可列举进行加热的方法等。
[0136]
用来停止所述发酵的加热温度只要是所述曲霉菌无法再生长的温度,便没有特别限制,可以根据目的适当选择,优选为50℃以上,更优选为70℃以上,特别优选为100℃~130℃。如果所述加热温度低于50℃,则存在无法停止所述发酵的情况,如果超过30℃,则存在抗老化作用、抗氧化作用、抗炎作用、及美白作用中的至少任一种作用不足的情况。
[0137]
用来停止所述发酵的加热时间只要是可使所述曲霉菌成为无法生长的状态,便没有特别限制,可以根据目的适当选择,优选为5分钟以上,更优选为10分钟~20分钟。如果所述加热时间少于5分钟,则存在无法停止所述发酵的情况,如果超过20分钟,则存在抗老化作用、抗氧化作用、抗炎作用、及美白作用中的至少任一种作用不足的情况。
[0138]
此外,停止所述发酵后的所述蒿属植物发酵液优选进行冷却。冷却方法没有特别限制,可以根据目的适当选择,例如可列举于常温下静置、于冷藏库中静置等的方法等。
[0139]
所述蒿属植物利用所述曲霉菌进行发酵的次数没有特别限制,可以根据目的适当
选择,可以是1次,也可以是多次。
[0140]
在进行多次所述发酵的情况下,所述曲霉菌可以仅在初次接种,可以仅接种数次,也可以每次发酵时都接种,优选仅在初次接种。
[0141]
在进行多次所述发酵的情况下,发酵温度及发酵时间可以分别不同,也可以相同。
[0142]
‑‑
蒿属植物种曲
‑‑
[0143]
所述蒿属植物种曲是使用所述蒿属植物作为种曲原料,对该种曲原料接种曲霉菌,使足量的孢子附着在该蒿属植物上生长而获得。通过在所述发酵中使用所述种曲,能够更高效率且容易地获得肌肤亲和性优异的蒿属植物发酵液,从该方面来说是有利的。
[0144]
用作所述种曲原料的所述蒿属植物可以同样使用所述
‑
蒿属植物
‑
中记载的植物,关于所述蒿属植物的使用部位、大小、状态等形态也相同。
[0145]
作为用于制作所述蒿属植物种曲的所述曲霉菌,可以同样使用所述
‑
曲霉菌
‑
中记载的菌。
[0146]
所述曲霉菌在用作所述种曲原料的所述蒿属植物上的接种量没有特别限制,可以根据目的适当选择,相对于所述蒿属植物100质量份,优选接种5质量份~100质量份的悬浮在杀菌水中的曲霉菌(1
×
103个/ml~1
×
108个/ml),更优选接种10质量份~50质量份,特别优选接种20质量份~30质量份。如果相对于所述蒿属植物100质量份,所述曲霉菌的接种量少于5质量份,则存在无法使足量的孢子附着于所述蒿属植物上生长的情况,如果超过100质量份,则存在因水分过多而导致异常繁殖的情况。
[0147]
在对用作所述种曲原料的所述蒿属植物接种所述曲霉菌时,优选添加水。所述水的添加量没有特别限制,可以根据目的适当选择,相对于所述蒿属植物100质量份,优选添加10质量份~250质量份,更优选添加20质量份~200质量份,特别优选添加30质量份~150质量份。如果相对于所述蒿属植物100质量份,所述水的添加量少于10质量份,则存在无法使足量的孢子附着于所述蒿属植物上生长的情况。
[0148]
所述培养温度只要是能使所述曲霉菌生长的温度范围内,便没有特别限制,可以根据目的适当选择,优选为20℃~40℃,更优选为25℃~35℃。如果所述培养温度低于20℃,则存在无法使足量的孢子附着于所述蒿属植物上生长的情况。此外,如果超过50℃,则存在无法使所述曲霉菌增殖的情况。
[0149]
所述培养时间没有特别限制,可以根据目的适当选择,优选为80小时~210小时,更优选为100小时~190小时,特别优选为120小时~170小时。如果所述培养时间少于80小时,则存在无法使足量的孢子附着于所述蒿属植物上生长的情况,如果超过210小时,则存在孢子的出芽率降低的情况。
[0150]
所述蒿属植物发酵液可以含有所述曲霉菌的菌体,也可以是去除所述曲霉菌的菌体后的发酵液,优选为去除所述曲霉菌的菌体后的发酵液。
[0151]
所述蒿属植物发酵液的状态没有特别限制,可以根据目的适当选择,例如可为所述蒿属植物发酵液本身,也可为所述蒿属植物发酵液的纯化物、所述蒿属植物发酵液的浓缩物、所述蒿属植物发酵液的稀释物等。另外,所述蒿属植物发酵液也可为使该蒿属植物发酵液的干燥物再次混合或溶解于水或亲水性溶剂等溶剂中而得的液体。
[0152]
所述蒿属植物发酵液的纯化物没有特别限制,可以根据目的适当选择,例如可列举将所述蒿属植物发酵液中的固体成分(例如所述蒿属植物的植物体、曲霉菌的菌体、沉淀
物等)去除后的物质等。
[0153]
所述去除方法没有特别限制,可以根据目的适当选择,例如可列举过滤等。
[0154]
所述过滤方法没有特别限制,可以根据目的从公知的方法中适当选择。
[0155]
所述蒿属植物发酵液的稀释物及所述蒿属植物发酵液的浓缩物没有特别限制,可以根据目的适当选择,例如可列举将蒿属植物发酵液制备为所需浓度的物质等。
[0156]
所述稀释方法没有特别限制,可以根据目的从公知的方法中适当选择。
[0157]
所述浓缩方法没有特别限制,可以根据目的适当选择,例如可列举减压浓缩等。
[0158]
述蒿属植物发酵液的干燥物没有特别限制,可以根据目的适当选择,例如可列举将蒿属植物发酵液干燥所得的物质等。
[0159]
所述干燥方法没有特别限制,可以根据目的适当选择,例如可列举冷冻干燥等。
[0160]
所述蒿属植物发酵液只要是蒿属植物经曲霉菌发酵的发酵液,便没有特别限制,可以根据目的适当选择,从肌肤亲和性良好的方面来说,优选为接触角81
°
以下的蒿属植物发酵液,更优选为接触角78
°
以下的蒿属植物发酵液。
[0161]
本说明书中,接触角表示如下值,该值是使用动态接触角/表面张力测定装置(fta1000 falcon,first ten angstroms公司制造),将测定样品3μl滴到所述装置的样品台,在温度22℃、相对湿度20%的条件下,利用液滴法进行测定,用θ/2法求出1,000ms的接触角θ(
°
)所得的值。
[0162]
所述接触角是用作表示“润湿”的指标,其被定义为“在静止液体的自由表面与固体壁面接触的位置处,液面与固体面所成的角(取位于液体内部的角)”(参照《理化学辞典》第4版,岩波书店股份有限公司)。所述接触角取决于液体分子间的内聚力和固体壁面间的附着力的大小关系,当液体润湿固体(附着力大)时为锐角,当未润湿时为钝角。因此,接触角越小,越容易润湿,即,表明肌肤亲和性越好,因此,所述蒿属植物发酵液的接触角的下限没有特别限制,可以根据目的适当选择。
[0163]
<<百里香发酵液>>
[0164]
所述百里香发酵液是百里香经曲霉菌发酵的发酵液。
[0165]
‑
百里香
‑
[0166]
用作所述发酵原料的百里香(thymus vulgaris linne)是属于唇形科(labiatae)地椒(thymus)属的多年生木本植物,是草药的一种,自古以来一直被用作食用或药用的原料。别名有普通百里香等。原产地为地中海沿岸,但也在日本国内自然生长或种植,能够从这些地区容易获取。
[0167]
所述百里香的获取方法没有特别限制,可以根据目的适当选择,可以从自然界采集,也可以使用市售品。
[0168]
用作所述发酵原料的所述百里香的使用部位没有特别限制,可以根据目的适当选择,例如可列举:花、花蕾、果实、果皮、种子、种皮、茎、叶、枝、树皮、秆、枝叶等地上部分;根、根茎等地下部分等。这些部位可以单独使用1种,也可以并用2种以上。这些部位当中,所述百里香的使用部位优选为地上部分。
[0169]
关于用作所述发酵原料的所述百里香的大小,只要是能够培养所述曲霉菌的大小,便没有特别限制,可以根据目的适当选择,例如可列举:所采集的原本大小、切断成所需的大小、经微粉(粉末)化的大小等。
[0170]
关于用作所述发酵原料的所述百里香的状态,只要是能够培养所述曲霉菌的状态,便没有特别限制,可以根据目的适当选择,例如可列举所采集的原本状态、干燥状态、粉碎状态、榨汁状态、提取物的状态等。这些状态当中,从所述曲霉菌容易起作用的方面来说,优选所采集的原本状态、粉碎状态、榨汁状态、提取物的状态,更优选所采集的原本状态、粉碎状态。
[0171]
使所述百里香为干燥状态的方法没有特别限制,可以根据目的适当选择,例如可列举:日晒干燥的方法、利用常用的干燥机进行干燥的方法等。
[0172]
使所述百里香为所述粉碎状态的方法没有特别限制,可以根据目的适当选择,例如可列举利用搅拌机、榨糖机、电力磨机、喷射式磨机、冲击式粉碎机等进行粉碎的方法等。
[0173]
使所述百里香为所述榨汁状态的方法没有特别限制,可以根据目的适当选择,例如可列举压榨等。
[0174]
使所述百里香为所述提取物状态的方法没有特别限制,可以根据目的适当选择植物提取中常用的方法。
[0175]
用作所述发酵原料的所述百里香优选在接种所述曲霉菌之前进行杀菌。对所述百里香进行杀菌的方法没有特别限制,可以从公知的方法中适当选择。
[0176]
‑
曲霉菌
‑
[0177]
使所述百里香发酵的所述曲霉菌没有特别限制,可以根据目的适当选择,例如可列举所述<<蒿属植物发酵液>>中记载的曲霉菌等。这些曲霉菌可以单独使用1种,也可以并用2种以上。这些曲霉菌当中,作为所述曲霉菌,从抗老化作用及抗氧化作用中的至少任一种作用优异的方面来说,优选米曲霉(aspergillus oryzae)。
[0178]
所述曲霉菌的获取方法没有特别限制,可以根据目的适当选择,可以从自然界采集,也可以使用市售品。另外,作为所述曲霉菌,可以使用以米等为原料的种曲,也可以使用下述百里香种曲,还可以使用经培养基(琼脂培养基、液体培养基等)培养的曲霉菌。这些曲霉菌当中,从抗老化作用及抗氧化作用中的至少任一种作用优异的方面来说,优选使用所述百里香种曲。
[0179]
关于所述曲霉菌在用作所述发酵原料的所述百里香上的接种量,只要是可使所述百里香发酵的量,便没有特别限制,可以根据目的适当选择,在所述发酵原料为液体状态的情况下,优选为1
×
103个/ml~1
×
108个/ml,在所述发酵原料为固体状态的情况下,优选为1
×
103个/g~1
×
108个/g。
[0180]
在对所述百里香接种所述曲霉菌时,优选添加水。所述水的添加量没有特别限制,可以根据目的适当选择,相对于所述百里香100质量份,优选添加500质量份~5,000质量份,更优选添加1,000质量份~4,000质量份,特别优选添加1,500质量份~3,000质量份。
[0181]
所述发酵(培养)温度只要是能够利用所述曲霉菌进行发酵的温度范围内,便没有特别限制,可以根据目的适当选择,优选为20℃~40℃,更优选为25℃~35℃。如果所述发酵温度低于20℃,则存在无法使所述百里香充分地发酵,抗老化作用及抗氧化作用中的至少任一种作用不足的情况。
[0182]
所述发酵(培养)时间没有特别限制,可以根据目的适当选择,优选为10小时~40小时,更优选为20小时~30小时。如果所述发酵时间少于10小时,则存在无法使所述百里香充分地发酵,抗老化作用及抗氧化作用中的至少任一种作用不足的情况。
[0183]
停止所述发酵(培养)的方法没有特别限制,可以根据目的适当选择,例如可列举进行加热的方法等。
[0184]
用来停止所述发酵的加热温度只要是所述曲霉菌无法再生长的温度,便没有特别限制,可以根据目的适当选择,优选为50℃以上,更优选为70℃以上,特别优选为100℃~130℃。如果所述加热温度低于50℃,则存在无法停止所述发酵的情况,如果超过130℃,则存在抗老化作用及抗氧化作用中的至少任一种作用不足的情况。
[0185]
用来停止所述发酵的加热时间只要是可使所述曲霉菌成为无法生长的状态,便没有特别限制,可以根据目的适当选择,优选为5分钟以上,更优选为10分钟~20分钟。如果所述加热时间少于5分钟,则存在无法停止所述发酵的情况,如果超过20分钟,则存在抗老化作用及抗氧化作用中的至少任一种作用不足的情况。
[0186]
此外,停止所述发酵后的所述百里香发酵液优选进行冷却。冷却方法没有特别限制,可以根据目的适当选择,例如可列举静置于常温、冷藏库等的方法等。
[0187]
所述百里香利用所述曲霉菌进行发酵的次数没有特别限制,可以根据目的适当选择,可以是1次,也可以是多次。
[0188]
在进行多次所述发酵的情况下,所述曲霉菌可以仅在初次接种,可以仅接种数次,也可以每次发酵时都接种,优选仅在初次接种。
[0189]
在进行多次所述发酵的情况下,发酵温度及发酵时间可以分别不同,也可以相同。
[0190]
‑‑
百里香种曲
‑‑
[0191]
所述百里香种曲是使用所述百里香作为种曲原料,对该种曲原料接种曲霉菌,使足量的孢子附着于该百里香上生长而得。通过在所述发酵中使用所述种曲,能够更高效率且容易地获得肌肤亲和性优异的百里香发酵液,从该方面来说是有利的。
[0192]
用作所述种曲原料的所述百里香可以同样使用所述
‑
百里香
‑
中记载的植物,关于所述百里香的使用部位、大小、状态等形态也相同。
[0193]
作为用于制作所述百里香种曲的所述曲霉菌,可以同样使用所述
‑
曲霉菌
‑
中记载的菌。
[0194]
所述曲霉菌在用作所述种曲原料的所述百里香上的接种量没有特别限制,可以根据目的适当选择,相对于所述百里香100质量份,优选接种5质量份~100质量份的悬浮在杀菌水中的曲霉菌(1
×
103个/ml~1
×
108个/ml),更优选接种10质量份~50质量份,特别优选接种20质量份~30质量份。如果相对于所述百里香100质量份,所述曲霉菌的接种量少于5质量份,则存在无法使足量的孢子附着于所述百里香上生长的情况,如果超过100质量份,则存在因水分过多导致异常繁殖的情况。
[0195]
在对用作所述种曲原料的所述百里香接种所述曲霉菌时,优选添加水。所述水的添加量没有特别限制,可以根据目的适当选择,相对于所述百里香100质量份,优选添加10质量份~250质量份,更优选添加20质量份~200质量份,特别优选添加30质量份~150质量份。如果相对于所述百里香100质量份,所述水的添加量少于10质量份,则存在无法使足量的孢子附着于所述百里香上生长的情况。
[0196]
所述培养温度只要是能使所述曲霉菌生长的温度范围内,便没有特别限制,可以根据目的适当选择,优选为20℃~40℃,更优选为25℃~35℃。如果所述培养温度低于20℃,则存在无法使足量的孢子附着于所述百里香上生长的情况。此外,如果超过50℃,则存
在无法使所述曲霉菌增殖的情况。
[0197]
所述培养时间没有特别限制,可以根据目的适当选择,优选为80小时~210小时,更优选为100小时~190小时,特别优选为120小时~170小时。如果所述培养时间少于80小时,则存在无法使足量的孢子附着于所述百里香上生长的情况,如果超过210小时,则存在孢子的出芽率下降的情况。
[0198]
所述百里香发酵液可以含有所述曲霉菌的菌体,也可以是去除所述曲霉菌的菌体后的发酵液,优选为去除所述曲霉菌的菌体后的发酵液。
[0199]
所述百里香发酵液的状态没有特别限制,可以根据目的适当选择,例如可为所述百里香发酵液本身,也可为所述百里香发酵液的纯化物、所述百里香发酵液的浓缩物、所述百里香发酵液的稀释物等。另外,所述百里香发酵液也可为使该百里香发酵液的干燥物再次混合或溶解于水或亲水性溶剂等溶剂中而得的液体。
[0200]
所述百里香发酵液的纯化物没有特别限制,可以根据目的适当选择,例如可列举将所述百里香发酵液中的固体成分(例如所述百里香的植物体、曲霉菌的菌体、沉淀物等)去除后的物质等。
[0201]
所述去除方法没有特别限制,可以根据目的适当选择,例如可列举过滤等。
[0202]
所述过滤方法没有特别限制,可以根据目的从公知的方法中适当选择。
[0203]
所述百里香发酵液的稀释物及所述百里香发酵液的浓缩物没有特别限制,可以根据目的适当选择,例如可列举将百里香发酵液制备为所需浓度的物质等。
[0204]
所述稀释方法没有特别限制,可以根据目的从公知的方法中适当选择。
[0205]
所述浓缩方法没有特别限制,可以根据目的适当选择,例如可列举减压浓缩等。
[0206]
所述百里香发酵液的干燥物没有特别限制,可以根据目的适当选择,例如可列举将百里香发酵液干燥所得的物质等。
[0207]
所述干燥方法没有特别限制,可以根据目的适当选择,例如可列举冷冻干燥等。
[0208]
所述百里香发酵液只要是百里香经曲霉菌发酵的发酵液,便没有特别限制,可以根据目的适当选择,从肌肤亲和性良好的方面来说,优选为接触角87
°
以下的百里香发酵液,更优选为接触角81
°
以下的百里香发酵液。
[0209]
<<香蜂草发酵液>>
[0210]
所述香蜂草发酵液是香蜂草经曲霉菌发酵的发酵液。
[0211]
‑
香蜂草
‑
[0212]
用作所述发酵原料的香蜂草(melissa officinalis linne)是属于唇形科(labiatae)蜜蜂花(melissa)属的多年生草本植物。其是草药的一种,自古以来一直被用作食用或药用的原料。别名有柠檬香蜂草(lemon balm)、香蜂花(garden balm)等。原产地为南欧,但也在日本国内自然生长或种植,能够从这些地区容易获取。
[0213]
所述香蜂草的获取方法没有特别限制,可以根据目的适当选择,可以从自然界采集,也可以使用市售品。
[0214]
用作所述发酵原料的所述香蜂草的使用部位没有特别限制,可以根据目的适当选择,例如可列举:花、花蕾、果实、果皮、种子、种皮、茎、叶、秆、枝叶等地上部分;根、根茎等地下部分等。这些部位可以单独使用1种,也可以并用2种以上。这些部位当中,所述香蜂草的使用部位优选为地上部分。
[0215]
关于用作所述发酵原料的所述香蜂草的大小,只要是能够培养所述曲霉菌的大小,便没有特别限制,可以根据目的适当选择,例如可列举:所采集的原本大小、切断成所需的大小、经微粉(粉末)化的大小等。
[0216]
关于用作所述发酵原料的所述香蜂草的状态,只要是能够培养所述曲霉菌的状态,便没有特别限制,可以根据目的适当选择,例如可列举:所采集的原本状态、干燥状态、粉碎状态、榨汁状态、提取物的状态等。这些状态当中,从所述曲霉菌容易起作用的方面来说,优选所采集的原本状态、粉碎状态、榨汁状态、提取物的状态,更优选所采集的原本状态、粉碎状态。
[0217]
使所述香蜂草为干燥状态的方法没有特别限制,可以根据目的适当选择,例如可列举:日晒干燥的方法、利用常用的干燥机进行干燥的方法等。
[0218]
使所述香蜂草为所述粉碎状态的方法没有特别限制,可以根据目的适当选择,例如可列举利用搅拌机、榨糖机、电力磨机、喷射式磨机、冲击式粉碎机等进行粉碎的方法等。
[0219]
使所述香蜂草为所述榨汁状态的方法没有特别限制,可以根据目的适当选择,例如可列举压榨等。
[0220]
使所述香蜂草为所述提取物状态的方法没有特别限制,可以根据目的适当选择植物提取中常用的方法。
[0221]
关于用作所述发酵原料的所述香蜂草优选在接种所述曲霉菌之前进行杀菌。对所述香蜂草进行杀菌的方法没有特别限制,可以从公知的方法中适当选择。
[0222]
‑
曲霉菌
‑
[0223]
使所述香蜂草发酵的所述曲霉菌没有特别限制,可以根据目的适当选择,例如可列举所述<<蒿属植物发酵液>>中记载的曲霉菌等。这些曲霉菌可以单独使用1种,也可以并用2种以上。这些曲霉菌当中,作为所述曲霉菌,从抗老化作用、抗氧化作用、抗炎作用、及美白作用中的至少任一种作用优异的方面来说,优选米曲霉(aspergillus oryzae)。
[0224]
所述曲霉菌的获取方法没有特别限制,可以根据目的适当选择,可以从自然界采集,也可以使用市售品。另外,作为所述曲霉菌,可以使用以米等为原料的种曲,也可以使用下述香蜂草种曲,还可以使用经培养基(琼脂培养基、液体培养基等)培养的曲霉菌。这些曲霉菌当中,从抗老化作用、抗氧化作用、抗炎作用、及美白作用中的至少任一种作用优异的方面来说,优选使用所述香蜂草种曲。
[0225]
关于所述曲霉菌在用作所述发酵原料的所述香蜂草上的接种量,只要是能使所述香蜂草发酵的量,便没有特别限制,可以根据目的适当选择,在所述发酵原料为液体状态的情况下,优选为1
×
103个/ml~1
×
108个/ml,在所述发酵原料为固体状态的情况下,优选为1
×
103个/g~1
×
108个/g。
[0226]
在对所述香蜂草接种所述曲霉菌时,优选添加水。所述水的添加量没有特别限制,可以根据目的适当选择,相对于所述香蜂草100质量份,优选添加500质量份~5,000质量份,更优选添加1,000质量份~4,000质量份,特别优选添加1,500质量份~3,000质量份。
[0227]
所述发酵(培养)温度只要是能够利用所述曲霉菌进行发酵的温度范围内,便没有特别限制,可以根据目的适当选择,优选为20℃~40℃,更优选为25℃~35℃。如果所述发酵温度低于20℃,则存在无法使所述香蜂草充分发酵,抗老化作用、抗氧化作用、抗炎作用、及美白作用中的至少任一种作用不足的情况。
[0228]
所述发酵(培养)时间没有特别限制,可以根据目的适当选择,优选为10小时~40小时,更优选为20小时~30小时。如果所述发酵时间少于10小时,则存在无法使所述香蜂草充分发酵,抗老化作用、抗氧化作用、抗炎作用、及美白作用中的至少任一种作用不足的情况。
[0229]
停止所述发酵(培养)的方法没有特别限制,可以根据目的适当选择,例如可列举进行加热的方法等。
[0230]
用来停止所述发酵的加热温度只要是所述曲霉菌无法再生长的温度,便没有特别限制,可以根据目的适当选择,优选为50℃以上,更优选为70℃以上,特别优选为100℃~130℃。如果所述加热温度低于50℃,则存在无法停止所述发酵的情况,如果超过130℃,则存在抗老化作用、抗氧化作用、抗炎作用、及美白作用中的至少任一种作用不足的情况。
[0231]
用来停止所述发酵的加热时间只要是可使所述曲霉菌成为无法生长的状态,便没有特别限制,可以根据目的适当选择,优选为5分钟以上,更优选为10分钟~20分钟。如果所述加热时间少于5分钟,则存在无法停止所述发酵的情况,如果超过20分钟,则存在抗老化作用、抗氧化作用、抗炎作用、及美白作用中的至少任一种作用不足的情况。
[0232]
此外,停止所述发酵后的所述香蜂草发酵液优选进行冷却。冷却方法没有特别限制,可以根据目的适当选择,例如可列举静置于常温、冷藏库等的方法等。
[0233]
所述香蜂草利用所述曲霉菌进行发酵的次数没有特别限制,可以根据目的适当选择,可以是1次,也可以是多次。
[0234]
在进行多次所述发酵的情况下,所述曲霉菌可以仅在初次接种,可以仅接种数次,也可以每次发酵时都接种,优选仅在初次接种。
[0235]
在进行多次所述发酵的情况下,发酵温度及发酵时间可以分别不同,也可以相同。
[0236]
‑‑
香蜂草种曲
‑‑
[0237]
所述香蜂草种曲是使用所述香蜂草作为种曲原料,对该种曲原料接种曲霉菌,使足量的孢子附着于该香蜂草上生长而得。通过在所述发酵中使用所述种曲,能够更高效率且容易地获得肌肤亲和性优异的香蜂草发酵液,从该方面来说是有利的。
[0238]
用作所述种曲原料的所述香蜂草可以同样使用所述
‑
香蜂草
‑
中记载的植物,所述香蜂草的使用部位、大小、状态等形态也相同。
[0239]
作为用于制作所述香蜂草种曲的所述曲霉菌,可以同样使用所述
‑
曲霉菌
‑
中记载的菌。
[0240]
所述曲霉菌在用作所述种曲原料的所述香蜂草上的接种量没有特别限制,可以根据目的适当选择,相对于所述香蜂草100质量份,优选接种5质量份~100质量份的悬浮在杀菌水中的曲霉菌(1
×
103个/ml~1
×
108个/ml),更优选接种10质量份~50质量份,特别优选接种20质量份~30质量份。如果相对于所述香蜂草100质量份,所述曲霉菌的接种量低于5质量份,则存在无法使足量的孢子附着于所述香蜂草上生长的情况,如果超过100质量份,则存在因水分过多导致异常繁殖的情况。
[0241]
在对用作所述种曲原料的所述香蜂草接种所述曲霉菌时,优选添加水。所述水的添加量没有特别限制,可以根据目的适当选择,相对于所述香蜂草100质量份,优选添加10质量份~250质量份,更优选添加20质量份~200质量份,特别优选添加30质量份~150质量份。如果相对于所述香蜂草100质量份,所述水的添加量少于10质量份,则存在无法使足量
的孢子附着于所述香蜂草上生长的情况。
[0242]
所述培养温度只要是能使所述曲霉菌生长的温度范围内,便没有特别限制,可以根据目的适当选择,优选为20℃~40℃,更优选为25℃~35℃。如果所述培养温度低于20℃,则存在无法使足量的孢子附着于所述香蜂草上生长的情况。此外,如果超过50℃,则存在无法使所述曲霉菌增殖的情况。
[0243]
所述培养时间没有特别限制,可以根据目的适当选择,优选为80小时~210小时,更优选为100小时~190小时,特别优选为120小时~170小时。如果所述培养时间低于80小时,则存在无法使足量的孢子附着于所述香蜂草上生长的情况,如果超过210小时,则存在孢子的出芽率下降的情况。
[0244]
所述香蜂草发酵液可以含有所述曲霉菌的菌体,也可以是去除所述曲霉菌的菌体后的发酵液,优选为去除所述曲霉菌的菌体后的发酵液。
[0245]
所述香蜂草发酵液的状态没有特别限制,可以根据目的适当选择,例如可为所述香蜂草发酵液本身,也可为所述香蜂草发酵液的纯化物、所述香蜂草发酵液的浓缩物、所述香蜂草发酵液的稀释物等。另外,所述香蜂草发酵液也可为使该香蜂草发酵液的干燥物再次混合或溶解于水或亲水性溶剂等溶剂中而得的液体。
[0246]
所述香蜂草发酵液的纯化物没有特别限制,可以根据目的适当选择,例如可列举将所述香蜂草发酵液中的固体成分(例如所述香蜂草的植物体、曲霉菌的菌体、沉淀物等)去除后的物质等。
[0247]
所述去除方法没有特别限制,可以根据目的适当选择,例如可列举过滤等。
[0248]
所述过滤方法没有特别限制,可以根据目的从公知的方法中适当选择。
[0249]
所述香蜂草发酵液的稀释物及所述香蜂草发酵液的浓缩物没有特别限制,可以根据目的适当选择,例如可列举将香蜂草发酵液制备为所需浓度的物质等。
[0250]
所述稀释方法没有特别限制,可以根据目的从公知的方法中适当选择。
[0251]
所述浓缩方法没有特别限制,可以根据目的适当选择,例如可列举减压浓缩等。
[0252]
所述香蜂草发酵液的干燥物没有特别限制,可以根据目的适当选择,例如可列举将香蜂草发酵液干燥所得的物质等。
[0253]
所述干燥方法没有特别限制,可以根据目的适当选择,例如可列举冷冻干燥等。
[0254]
所述香蜂草发酵液只要是香蜂草经曲霉菌发酵的发酵液,便没有特别限制,可以根据目的适当选择,从肌肤亲和性良好的方面来说,优选为接触角85
°
以下的香蜂草发酵液,更优选为接触角79
°
以下的香蜂草发酵液。
[0255]
<<矢车菊发酵液>>
[0256]
所述矢车菊发酵液是矢车菊经曲霉菌发酵的发酵液。
[0257]
‑
矢车菊
‑
[0258]
用作所述发酵原料的矢车菊(centaurea cyanus linne)是属于菊科(compositae)矢车菊属(centaurea)的一年生草本植物,自古以来一直被用作食用或药用的原料。别名有鬼灯檠、兰芙蓉(centaurea)、车轮花(centaurea)等。原产地为欧洲,但也在日本国内自然生长或种植,能够从这些地区容易获取。
[0259]
所述矢车菊的获取方法没有特别限制,可以根据目的适当选择,可以从自然界采集,也可以使用市售品。
[0260]
关于用作所述发酵原料的所述矢车菊的使用部位没有特别限制,可以根据目的适当选择,例如可列举:花、花蕾、果实、果皮、种子、种皮、茎、叶、秆、枝叶等地上部分;根、根茎等地下部分等。这些部位可以单独使用1种,也可以并用2种以上。这些部位当中,所述矢车菊的使用部位优选为地上部分。
[0261]
关于用作所述发酵原料的所述矢车菊的大小,只要是能够培养所述曲霉菌的大小,便没有特别限制,可以根据目的适当选择,例如可列举:所采集的原本大小、切断成所需的大小、经微粉(粉末)化的大小等。
[0262]
关于用作所述发酵原料的所述矢车菊的状态,只要是能够培养所述曲霉菌的状态,便没有特别限制,可以根据目的适当选择,例如可列举:所采集的原本状态、干燥状态、粉碎状态、榨汁状态、提取物的状态等。这些状态当中,从所述曲霉菌容易起作用的方面来说,优选所采集的原本状态、粉碎状态、榨汁状态、提取物的状态,更优选所采集的原本状态、粉碎状态。
[0263]
使所述矢车菊为干燥状态的方法没有特别限制,可以根据目的适当选择,例如可列举:日晒干燥的方法、利用常用的干燥机进行干燥的方法等。
[0264]
使所述矢车菊为所述粉碎状态的方法没有特别限制,可以根据目的适当选择,例如可列举利用搅拌机、榨糖机、电力磨机、喷射式磨机、冲击式粉碎机等进行粉碎的方法等。
[0265]
使所述矢车菊为所述榨汁状态的方法没有特别限制,可以根据目的适当选择,例如可列举压榨等。
[0266]
使所述矢车菊为所述提取物状态的方法没有特别限制,可以根据目的适当选择植物提取中常用的方法。
[0267]
用作所述发酵原料的所述矢车菊优选在接种所述曲霉菌之前进行杀菌。对所述矢车菊进行杀菌的方法没有特别限制,可以从公知的方法中适当选择。
[0268]
‑
曲霉菌
‑
[0269]
使所述矢车菊发酵的所述曲霉菌没有特别限制,可以根据目的适当选择,例如可列举所述<<蒿属植物发酵液>>中记载的曲霉菌等。这些曲霉菌可以单独使用1种,也可以并用2种以上。这些曲霉菌当中,作为所述曲霉菌,从抗老化作用、抗氧化作用、及美白作用中的至少任一种作用优异的方面来说,优选米曲霉(aspergillus oryzae)。
[0270]
所述曲霉菌的获取方法没有特别限制,可以根据目的适当选择,可以从自然界采集,也可以使用市售品。另外,作为所述曲霉菌,可以使用以米等为原料的种曲,也可以使用下述矢车菊种曲,还可以使用经培养基(琼脂培养基、液体培养基等)培养的曲霉菌。这些曲霉菌当中,从抗老化作用、抗氧化作用、及美白作用中的至少任一种作用优异的方面来说,优选使用所述矢车菊种曲。
[0271]
关于所述曲霉菌在用作所述发酵原料的所述矢车菊上的接种量,只要是能使所述矢车菊发酵的量,便没有特别限制,可以根据目的适当选择,在所述发酵原料为液体状态的情况下,优选为1
×
103个/ml~1
×
108个/ml,在所述发酵原料为固体状态的情况下,优选为1
×
103个/g~1
×
108个/g。
[0272]
在对所述矢车菊接种所述曲霉菌时,优选添加水。所述水的添加量没有特别限制,可以根据目的适当选择,相对于所述矢车菊100质量份,优选添加500质量份~5,000质量份,更优选添加1,000质量份~4,000质量份,特别优选添加1,500质量份~3,000质量份。
[0273]
所述发酵(培养)温度只要是能够利用所述曲霉菌进行发酵的温度范围内,便没有特别限制,可以根据目的适当选择,优选为20℃~40℃,更优选为25℃~35℃。如果所述发酵温度低于20℃,则存在无法使所述矢车菊充分发酵,抗老化作用、抗氧化作用、及美白作用中的至少任一种作用不足的情况。
[0274]
所述发酵(培养)时间没有特别限制,可以根据目的适当选择,优选为10小时~40小时,更优选为20小时~30小时。如果所述发酵时间少于10小时,则存在无法使所述矢车菊充分发酵,抗老化作用、抗氧化作用、及美白作用中的至少任一种作用不足的情况。
[0275]
停止所述发酵(培养)的方法没有特别限制,可以根据目的适当选择,例如可列举进行加热的方法等。
[0276]
用来停止所述发酵的加热温度只要是所述曲霉菌无法再生长的温度,便没有特别限制,可以根据目的适当选择,优选为50℃以上,更优选为70℃以上,特别优选为100℃~130℃。如果所述加热温度低于50℃,则存在无法停止所述发酵的情况,如果超过130℃,则存在抗老化作用、抗氧化作用、及美白作用中的至少任一种作用不足的情况。
[0277]
用来停止所述发酵的加热时间只要是可使所述曲霉菌成为无法生长的状态,便没有特别限制,可以根据目的适当选择,优选为5分钟以上,更优选为10分钟~20分钟。如果所述加热时间低于5分钟,则存在无法停止所述发酵的情况,如果超过20分钟,则存在抗老化作用、抗氧化作用、及美白作用中的至少任一种作用不足的情况。
[0278]
此外,停止所述发酵后的所述矢车菊发酵液优选进行冷却。冷却方法没有特别限制,可以根据目的适当选择,例如可列举静置于常温、冷藏库等的方法等。
[0279]
所述矢车菊利用所述曲霉菌进行发酵的次数没有特别限制,可以根据目的适当选择,可以是1次,也可以是多次。
[0280]
在进行多次所述发酵的情况下,所述曲霉菌可以仅在初次接种,可以仅接种数次,也可以每次发酵时都接种,优选仅在初次接种。
[0281]
在进行多次所述发酵的情况下,发酵温度及发酵时间可以分别不同,也可以相同。
[0282]
‑‑
矢车菊种曲
‑‑
[0283]
所述矢车菊种曲是使用所述矢车菊作为种曲原料,对该种曲原料接种曲霉菌,使足量的孢子附着于该矢车菊上生长而得。通过在所述发酵中使用所述种曲,能够更高效率且容易地获得肌肤亲和性优异的矢车菊发酵液,从该方面来说是有利的。
[0284]
用作所述种曲原料的所述矢车菊可以同样使用所述
‑
矢车菊
‑
中记载的植物,所述矢车菊的使用部位、大小、状态等形态也相同。
[0285]
作为用于制作所述矢车菊种曲的所述曲霉菌,可以同样使用所述
‑
曲霉菌
‑
中记载的菌。
[0286]
所述曲霉菌在用作所述种曲原料的所述矢车菊上的接种量没有特别限制,可以根据目的适当选择,相对于所述矢车菊100质量份,优选接种5质量份~100质量份的悬浮在杀菌水中的曲霉菌(1
×
103个/ml~1
×
108个/ml),更优选接种10质量份~50质量份,特别优选接种20质量份~30质量份。如果相对于所述矢车菊100质量份,所述曲霉菌的接种量少于5质量份,则存在无法使足量的孢子附着于所述矢车菊上生长的情况,如果超过100质量份,则存在因水分过多导致异常繁殖的情况。
[0287]
在对用作所述种曲原料的所述矢车菊接种所述曲霉菌时,优选添加水。所述水的
添加量没有特别限制,可以根据目的适当选择,相对于所述矢车菊100质量份,优选添加10质量份~250质量份,更优选添加20质量份~200质量份,特别优选添加30质量份~150质量份。如果相对于所述矢车菊100质量份,所述水的添加量少于10质量份,则存在无法使足量的孢子附着于所述矢车菊上生长的情况。
[0288]
所述培养温度只要是能使所述曲霉菌生长的温度范围内,便没有特别限制,可以根据目的适当选择,优选为20℃~40℃,更优选为25℃~35℃。如果所述培养温度低于20℃,则存在无法使足量的孢子附着于所述矢车菊上生长的情况。此外,如果超过50℃,则存在无法使所述曲霉菌增殖的情况。
[0289]
所述培养时间没有特别限制,可以根据目的适当选择,优选为80小时~210小时,更优选为100小时~190小时,特别优选为120小时~170小时。如果所述培养时间低于80小时,则存在无法使足量的孢子附着于所述矢车菊上生长的情况,如果超过210小时,则存在孢子的出芽率下降的情况。
[0290]
所述矢车菊发酵液可以含有所述曲霉菌的菌体,也可以是去除所述曲霉菌的菌体后的发酵液,优选为去除所述曲霉菌的菌体后的发酵液。
[0291]
所述矢车菊发酵液的状态没有特别限制,可以根据目的适当选择,例如可为所述矢车菊发酵液本身,还可为所述矢车菊发酵液的纯化物、所述矢车菊发酵液的浓缩物、所述矢车菊发酵液的稀释物等。另外,所述矢车菊发酵液也可为使该矢车菊发酵液的干燥物再次混合或溶解于水或亲水性溶剂等溶剂中而得的液体。
[0292]
所述矢车菊发酵液的纯化物没有特别限制,可以根据目的适当选择,例如可列举将所述矢车菊发酵液中的固体成分(例如所述矢车菊的植物体、曲霉菌的菌体、沉淀物等)去除后的物质等。
[0293]
所述去除方法没有特别限制,可以根据目的适当选择,例如可列举过滤等。
[0294]
所述过滤方法没有特别限制,可以根据目的从公知的方法中适当选择。
[0295]
所述矢车菊发酵液的稀释物及所述矢车菊发酵液的浓缩物没有特别限制,可以根据目的适当选择,例如可列举将矢车菊发酵液制备为所需浓度的物质等。
[0296]
所述稀释方法没有特别限制,可以根据目的从公知的方法中适当选择。
[0297]
所述浓缩方法没有特别限制,可以根据目的适当选择,例如可列举减压浓缩等。
[0298]
所述矢车菊发酵液的干燥物没有特别限制,可以根据目的适当选择,例如可列举将矢车菊发酵液干燥所得的物质等。
[0299]
所述干燥方法没有特别限制,可以根据目的适当选择,例如可列举冷冻干燥等。
[0300]
所述矢车菊发酵液只要是矢车菊经曲霉菌发酵的发酵液,便没有特别限制,可以根据目的适当选择,从肌肤亲和性良好的方面来说,优选为接触角85
°
以下的矢车菊发酵液,更优选为接触角79
°
以下的矢车菊发酵液。
[0301]
<<其它成分>>
[0302]
所述抗老化剂、抗氧化剂、抗炎剂、及美白剂中的所述其它成分没有特别限制,可以根据目的适当选择,例如可列举:赋形剂、防潮剂、防腐剂、强化剂、增稠剂、乳化剂、抗氧化剂、甜味剂、酸味剂、调味料、着色剂、香料、美白剂、保湿剂、油性成分、紫外线吸收剂、表面活性剂、增稠剂、醇类、粉末成分、着色材料、水性成分、水、皮肤营养剂等。这些可以单独使用1种,也可以并用2种以上。
[0303]
所述其它成分的含量没有特别限制,可以根据目的适当选择。
[0304]
‑
用途
‑
[0305]
本发明的抗老化剂、抗氧化剂、抗炎剂、及美白剂由于具有优异的抗老化作用、抗氧化作用、抗炎作用、及美白作用中的至少任一种作用,所以例如适合用作医药品、准药品、化妆品、饮食品等,其调配量、用法、及剂型可根据其使用目的适当选择。
[0306]
所述调配量可以根据所述发酵液的生理活性等适当调整。另外,所述抗老化剂、所述抗氧化剂、所述抗炎剂、及所述美白剂还可以是所述发酵液本身。
[0307]
所述用法没有特别限制,可以根据目的适当选择,例如可列举:口服用、非口服用、外用等用法。这些用法中,优选外用。
[0308]
所述剂型没有特别限制,可以根据目的适当选择,例如可列举:片剂、粉剂、胶囊剂、颗粒剂、浸膏剂、及糖浆剂等口服给药剂;注射剂、滴剂、及栓剂等非口服给药剂;化妆水、乳液、乳霜、软膏、精华液、润肤乳、面膜、胶冻、唇膏、口红、粉饼、沐浴剂、肥皂、沐浴露、收敛水、养发露、发乳、整发液、润发油、洗发精、护发素等外用剂等。
[0309]
另外,本发明的抗老化剂、抗氧化剂、抗炎剂、及美白剂也可以用作抗老化作用、抗氧化作用、抗炎作用、或美白作用的作用机制相关研究的试剂。
[0310]
本发明的抗老化剂、抗氧化剂、抗炎剂、及美白剂适用于人,只要发挥各自的作用效果,还可以用于人以外的动物(例如小鼠、大鼠、仓鼠、狗、猫、牛、猪、猴等)。
[0311]
(化妆品)
[0312]
本发明的化妆品含有选自由本发明的抗老化剂、抗氧化剂、抗炎剂、及美白剂所组成的群组中的至少1种,视需要还含有其它成分。
[0313]
<抗老化剂、抗氧化剂、抗炎剂、美白剂>
[0314]
所述化妆品中的选自由所述抗老化剂、所述抗氧化剂、所述抗炎剂、及所述美白剂所组成的群组中的至少1种的含量没有特别限制,可以根据目的适当选择,相对于所述化妆品的总量,优选为5体积%以上,更优选为20体积%以上。如果选自由所述抗老化剂、所述抗氧化剂、所述抗炎剂、及所述美白剂所组成的群组中的至少1种的含量低于5体积%,则存在抗老化作用、抗氧化作用、抗炎作用、及美白作用中的至少任一种作用不足的情况。此外,选自由所述抗老化剂、所述抗氧化剂、所述抗炎剂、及所述美白剂所组成的群组中的至少1种的含量越多越好,其上限没有特别限制,可以根据目的适当选择。另外,所述化妆品还可以是选自由所述抗老化剂、所述抗氧化剂、所述抗炎剂、及所述美白剂所组成的群组中的至少1种物质本身。
[0315]
<其它成分>
[0316]
所述化妆品还可以在无损本发明的目的及作用效果的范围内,视需要进一步添加通常用于制造化妆品的各种主剂、助剂、其它成分。
[0317]
所述其它成分没有特别限制,可以根据目的适当选择,例如可列举:收敛剂、杀菌剂、抗菌剂、紫外线吸收剂、细胞活化剂、油脂类、蜡类、烃类、脂肪酸类、醇类、酯类、表面活性剂、香料等。这些成分可以单独使用1种,也可以并用2种以上。在这些成分和选自由所述抗老化剂、所述抗氧化剂、所述抗炎剂、及所述美白剂所组成的群组中的至少1种并用的情况下,有时会协同地作用,带来超出预期的优异的作用效果。
[0318]
关于所述化妆品中的所述其它成分的含量,只要无损本发明的效果,便没有特别
限制,可以根据目的适当选择。
[0319]
<用途>
[0320]
所述化妆品的用途没有特别限制,可从通常的化妆品中适当选择,例如可列举:化妆水、乳液、乳霜、软膏、精华液、润肤乳、面膜、胶冻、唇膏、口红、粉饼、沐浴剂、肥皂、沐浴露等皮肤化妆品;收敛水、养发露、发乳、整发液、润发油、洗发精、护发素等头皮头发化妆品等。
[0321]
所述化妆品可以将选自由所述抗老化剂、所述抗氧化剂、所述抗炎剂、及所述美白剂所组成的群组中的至少1种在不妨碍其活性的情况下调配到任意的化妆品中而成,也可以是以选自由所述抗老化剂、所述抗氧化剂、所述抗炎剂、及所述美白剂所组成的群组中的至少1种为主成分的化妆品。另外,所述化妆品还可以是选自由所述抗老化剂、所述抗氧化剂、所述抗炎剂、及所述美白剂所组成的群组中的至少1种物质本身。
[0322]
本发明的化妆品适合用于人,但只要发挥各自的作用效果,还可以用于人以外的动物(例如小鼠、大鼠、仓鼠、狗、猫、牛、猪、猴等)。
[0323]
本发明的化妆品由于含有选自由所述抗老化剂、所述抗氧化剂、所述抗炎剂、及所述美白剂所组成的群组中的至少1种,所以当用于皮肤时,发挥优异的抗老化作用、抗氧化作用、抗炎作用、及美白作用中的至少任一种作用,从该方面来说很有用。
[0324]
实施例
[0325]
以下列举制造例及试验例来具体地说明本发明,但本发明不受这些试验例的任何限定。
[0326]
<制造例1:三齿蒿发酵液1的制备>
[0327]
‑
种曲制备步骤
‑
[0328]
用白金环(platinum loop)取曲霉菌(米曲霉(aspergillus oryzae),菌株名:aok1714,秋田今野商店股份有限公司制造),使之悬浮在杀菌水50ml中,制作曲霉菌溶液。使用thoma血细胞计数板(ekds制造),估算所述曲霉菌溶液的菌数,结果为1.0
×
105个/ml。
[0329]
然后,将切成0.5cm~5cm的三齿蒿(albion股份有限公司制造)10g放入锥形烧瓶中,进行加压杀菌,对该三齿蒿接种所述曲霉菌溶液2ml,在30℃下静置培养168小时。培养结束后,在45℃下干燥24小时,获得“三齿蒿种曲”。
[0330]
‑
发酵步骤
‑
[0331]
使用粉碎机(榨糖机)将三齿蒿(albion股份有限公司制造)粉碎,并使之通过2mm的网筛,获得三齿蒿粉碎物。对该三齿蒿粉碎物50g添加水1,000ml并进行混合,其后接种所述种曲制备步骤中获得的三齿蒿种曲(菌数:约1.0
×
106个/ml)20ml。然后,在25℃下预培养22小时。使用硅藻土对获得的发酵液进行过滤,获得“三齿蒿发酵液1”。
[0332]
<制造例2:三齿蒿发酵液2的制备>
[0333]
所述制造例1中,将三齿蒿种曲变更为以米为原料的种曲(米曲霉(aspergillus oryzae),白神亮白曲霉,秋田今野商店股份有限公司制造)(以下有时称作“米种曲”),除此以外,利用与所述制造例1相同的方法获得“三齿蒿发酵液2”。
[0334]
<比较制造例1:三齿蒿提取液的制备>
[0335]
使用粉碎机(榨糖机)将三齿蒿(albion股份有限公司制造)粉碎,并使之通过2mm的网筛,获得三齿蒿粉碎物。对该三齿蒿粉碎物50g添加水1,000ml并进行混合,其后在25℃
下搅拌22小时。然后,使用硅藻土对获得的搅拌物进行过滤,获得“三齿蒿提取液”。
[0336]
(试验例α
‑
1:接触角的测定)
[0337]
将制造例1中获得的三齿蒿发酵液1、制造例2中获得的三齿蒿发酵液2、及比较制造例1中获得的三齿蒿提取液作为试验样品,利用以下的方法测定接触角。
[0338]
具体来说,使用动态接触角/表面张力测定装置(fta1000 falcon,first ten angstroms公司制造),将各试验样品3μl分别滴到所述装置的样品台(铝制),在温度22℃、相对湿度20%的条件下,利用液滴法进行测定。用θ/2法求出1,000ms的接触角θ(
°
)。测定3次接触角,求出其平均值。将结果示于下述表1。另外,将测定各试验样品接触角时的液滴的一例示于图1a~图1c。
[0339]
[表1]
[0340]
试验样品发酵曲霉菌接触角θ(
°
)制造例1三齿蒿发酵液1有三齿蒿种曲77.44制造例2三齿蒿发酵液2有米种曲80.02比较制造例1三齿蒿提取液无
‑
81.57
[0341]
相比于比较制造例1中获得的三齿蒿提取液,制造例1中获得的三齿蒿发酵液1及制造例2中获得的三齿蒿发酵液2的接触角都小,为81
°
以下,肌肤亲和性优异。此外,制造例1中获得的三齿蒿发酵液1的接触角为78
°
以下,肌肤亲和性更优异。
[0342]
(试验例1
‑
1:基质金属蛋白酶
‑
1(mmp
‑
1)活性抑制作用试验)
[0343]
使用制造例1中获得的三齿蒿发酵液1、制造例2中获得的三齿蒿发酵液2、及比较制造例1中获得的三齿蒿提取液作为受验样品,利用改变了一部分翁施和海德里希(wunsch and heidrich)法的下述试验方法,进行基质金属蛋白酶
‑
1(mmp
‑
1)活性抑制作用的试验。
[0344]
在带盖的试管中,将各受验样品溶解于含20mmol/l氯化钙的0.1mol/l tris(tris(hydroxymethyl)aminomethane,三羟甲基氨基甲烷)
‑
hcl缓冲液(ph值7.1)中。然后,将所述受验样品的溶解液50μl、mmp
‑
1(来自溶组织梭菌的胶原酶iv(collagenase type iv from clostridium histolyticum),sigma公司制造)溶液50μl、及pz
‑
peptide(pz
‑
pro
‑
leu
‑
gly
‑
pro
‑
d
‑
arg
‑
oh,bachem feinchemikalien ag公司制造)溶液400μl进行混合,在3℃下反应30分钟后,添加25mmol/l柠檬酸溶液1ml以使反应停止。此外,此时所述受验样品的最终浓度为下述表2所示的浓度。然后,添加乙酸乙酯5ml,并剧烈地振荡。将其以1,600
×
g进行10分钟离心分离,测定乙酸乙酯层在波长320nm下的吸光度。
[0345]
另外,作为空白样品,将mmp
‑
1溶液(酶溶液)变更为0.1mol/l tris
‑
hcl缓冲液(ph值7.1),除此以外,进行与上述相同的操作并测定吸光度。
[0346]
此外,作为对照,将受验样品的溶解液变更为不含受验样品的含20mmol/l氯化钙的0.1mol/l tris
‑
hcl缓冲液(ph值7.1),除此以外,进行与上述相同的操作并测定吸光度。
[0347]
根据所获得的吸光度的测定值,基于下述式1算出mmp
‑
1活性抑制率。将结果示于下述表2。
[0348]
<式1>
[0349]
mmp
‑
1活性抑制率(%)={1-(c-d)/(α-b)}
×
100
[0350]
所述式1中,a~d分别表示以下内容。
[0351]
a:未添加受验样品且添加了酶时,在波长320nm下的吸光度
[0352]
b:未添加受验样品且未添加酶时,在波长320nm下的吸光度
[0353]
c:添加了受验样品且添加了酶时,在波长320nm下的吸光度
[0354]
d:添加了受验样品且未添加酶时,在波长320nm下的吸光度
[0355]
[表2]
[0356][0357]
(试验例1
‑
2:透明质酸合成酶3(has3)mrna表达促进作用试验)
[0358]
使用制造例1中获得的三齿蒿发酵液1、制造例2中获得的三齿蒿发酵液2、及比较制造例1中获得的三齿蒿提取液作为受验样品,通过下述试验方法,进行透明质酸合成酶3(has3)mrna表达促进作用的试验。
[0359]
将各受验样品以最终浓度成为下述表3所示的浓度的方式溶解于正常人表皮角化细胞基础培养基(humedia
‑
kb2,仓敷纺织股份有限公司制造)中,制备添加了受验样品的培养基。
[0360]
使用正常人表皮角化细胞增殖用培养基(humedia
‑
kg2,仓敷纺织股份有限公司制造),在37℃、5%co2的条件下,培养正常人新生儿表皮角化细胞(normal human epidermal keratinocytes,nhek,仓敷纺织股份有限公司制造)直至融合,其后,利用胰蛋白酶处理来回收细胞。将所回收的细胞利用正常人表皮角化细胞增殖用培养基(humedia
‑
kg2)调整为1.5
×
105细胞/ml。
[0361]
然后,将所述nhek(1.5
×
105细胞/ml)2ml接种到35mm培养皿,在37℃、5%co2的条件下培养一夜。培养结束后,将培养基更换为正常人表皮角化细胞基础培养基(humedia
‑
kb2),进一步培养24小时。培养结束后,将培养基更换为所述添加了受验样品的培养基2ml,在37℃、5%co2的条件下培养24小时。培养结束后去除培养液,利用rna提取用试剂(isogen ii(目录号:311
‑
07361),nippongene股份有限公司制造)提取总rna,通过分光光度计测定各rna量,使用纯化水以成为200ng/μl的方式制备总rna。
[0362]
另外,作为对照,将所述添加了受验样品的培养基2ml变更为不含受验样品的正常人表皮角化细胞基础培养基(humedia
‑
kb2)2ml,除此以外,进行与所述相同的操作并测定吸光度,利用与上述相同的方法以成为200ng/μl的方式制备总rna。
[0363]
以所述各总rna为模板,测定透明质酸合成酶3(has3)mrna及作为内部标准的甘油醛
‑3‑
磷酸脱氢酶(gapdh)mrna表达量。mrna的检测是通过使用实时pcr(polymerase chain reaction,聚合酶链反应)装置(thermal cycler dice(注册商标)实时系统iii(real time system iii),takara bio股份有限公司制造)、及sybr(注册商标)primescript(注册商标)rt
‑
pcr试剂盒(perfect real time(目录号:rr063a),takara bio股份有限公司制造)的两步法rt
‑
pcr反应来进行。
[0364]
未添加受验样品及添加了受验样品的has3 mrna的表达量由gapdh mrna的表达量进行了修正。根据该修正值,基于下述式2算出has3 mrna表达促进率。将结果示于下述表3。
[0365]
<式2>
[0366]
has3 mrna表达促进率(%)=a/b
×
100
[0367]
所述式2中,a及b分别表示以下内容。
[0368]
a:添加了受验样品时的修正值
[0369]
b:未添加受验样品时的修正值
[0370]
[表3]
[0371][0372]
(试验例1
‑
3:dpph自由基清除作用试验)
[0373]
使用制造例1中获得的三齿蒿发酵液1、制造例2中获得的三齿蒿发酵液2、及比较制造例1中获得的三齿蒿提取液作为受验样品,通过下述试验方法,进行dpph自由基清除作用的试验。
[0374]
将各受验样品溶解于乙醇溶液(富士胶片和光纯药股份有限公司制造)中,制备受验样品溶液。
[0375]
向150μmol/l dpph(diphenyl
‑
p
‑
picrylhydrazyl,二苯基对苦基肼)乙醇溶液3ml中添加所述受验样品溶液3ml,立即将容器塞紧进行振荡混合,静置30分钟后,测定波长520nm的吸光度。此外,此时所述受验样品的最终浓度为下述表4所示的浓度。
[0376]
另外,作为空白样品,将dpph乙醇溶液变更为不含dpph的乙醇溶液,除此以外,进行与上述相同的操作并测定吸光度。
[0377]
此外,作为对照,将受验样品溶液变更为不含受验样品的乙醇溶液(富士胶片和光纯药股份有限公司制造),除此以外,进行与上述相同的操作并测定吸光度。
[0378]
根据所获得的吸光度的测定值,基于下述式3算出dpph自由基清除率。将结果示于下述表4。
[0379]
<式3>
[0380]
dpph自由基清除率(%)={α-(b-c)}/a
×
100
[0381]
所述式3中,a~c分别表示以下内容。
[0382]
a:未添加受验样品且添加了dpph时,波长520nm下的吸光度
[0383]
b:添加了受验样品且添加了dpph时,波长520nm下的吸光度
[0384]
c:未添加受验样品且未添加dpph时,波长520nm下的吸光度
[0385]
[表4]
[0386][0387]
(试验例1
‑
4:透明质酸酶活性抑制作用试验)
[0388]
使用制造例1中获得的三齿蒿发酵液1、制造例2中获得的三齿蒿发酵液2、及比较制造例1中获得的三齿蒿提取液作为受验样品,通过下述试验方法,进行透明质酸酶活性抑制作用的试验。
[0389]
将各受验样品溶解于0.1mol/l乙酸缓冲液(ph值3.5)中,制备受验样品溶液。
[0390]
向所述受验样品溶液0.2ml中添加透明质酸酶溶液(iv
‑
s型(来自牛睾丸)、400nf units/ml,sigma公司制造)0.1ml,在37℃下反应20分钟。然后,添加作为活化剂的2.5mmol/l氯化钙0.2ml,在37℃下进一步反应20分钟。向其中添加0.8mg/ml透明质酸钠溶液(来自鸡冠)(富士胶片和光纯药股份有限公司制造)0.5ml,在37℃下反应40分钟。此外,此时所述受验样品的最终浓度为下述表5所示的浓度。然后,加入0.4mol/l氢氧化钠0.2ml以使反应停止,冷却后,向各反应溶液中加入硼酸溶液0.2ml,煮沸3分钟。水冷后,加入p
‑
daba试剂(使对二甲氨基苯甲醛10g溶解于10n盐酸12.5ml和乙酸87.5ml的混合液中,并用乙酸稀释成10倍而成的试剂)6ml,在37℃下反应20分钟。然后,测定波长585nm下的吸光度。
[0391]
另外,作为空白样品,将透明质酸酶溶液(酶溶液)变更为0.1mol/l乙酸缓冲液(ph值3.5),除此以外,进行与上述相同的操作并测定吸光度。
[0392]
此外,作为对照,将受验样品溶液变更为不含受验样品的0.1mol/l乙酸缓冲液(ph值3.5),除此以外,进行与上述相同的操作并测定吸光度。
[0393]
根据所获得的吸光度的测定值,基于下述式4算出透明质酸酶活性抑制率。将结果示于下述表5。
[0394]
<式4>
[0395]
透明质酸酶活性抑制率(%)={1-(c-d)/(α-b)}
×
100
[0396]
所述式4中,a~d分别表示以下内容。
[0397]
a:未添加受验样品且添加了酶时,在波长585nm下的吸光度
[0398]
b:未添加受验样品且未添加酶时,在波长585nm下的吸光度
[0399]
c:添加了受验样品且添加了酶时,在波长585nm下的吸光度
[0400]
d:添加了受验样品且未添加酶时,在波长585nm下的吸光度
[0401]
[表5]
[0402][0403]
(试验例1
‑
5:酪氨酸酶活性抑制作用试验)
[0404]
使用制造例1中获得的三齿蒿发酵液1、制造例2中获得的三齿蒿发酵液2、及比较制造例1中获得的三齿蒿提取液作为受验样品,通过下述试验方法,进行酪氨酸酶活性抑制作用的试验。
[0405]
将各受验样品溶解于25%dmso(dimethyl sulfoxide,二甲基亚砜)溶液,制备受验样品溶液。向48孔板中添加mcllvaine缓冲液(ph值6.8)0.2ml、0.3 mg/ml酪氨酸溶液0.06ml、及所述受验样品溶液0.18ml,在37℃下静置10分钟。向其中添加800unit/ml酪氨酸酶溶液(sigma公司制造)0.02ml,在37℃下进一步反应15分钟。反应结束后,测定波长475nm
下的吸光度。此外,此时所述受验样品的最终浓度为下述表6所示的浓度。
[0406]
另外,作为空白样品,将酪氨酸酶溶液(酶溶液)变更为mcllvaine缓冲液(ph值6.8),除此以外,进行与上述相同的操作并测定吸光度。
[0407]
此外,作为对照,将受验样品溶液变更为不含受验样品的25%dmso溶液,除此以外,进行与上述相同的操作并测定吸光度。
[0408]
根据所获得的吸光度的测定值,基于下述式5算出酪氨酸酶活性抑制率。将结果示于下述表6。
[0409]
<式5>
[0410]
酪氨酸酶活性抑制率(%)={1-(c-d)/(α-b)}
×
100
[0411]
所述式5中,a~d分别表示以下内容。
[0412]
a:未添加受验样品且添加了酶时,在波长475nm下的吸光度
[0413]
b:未添加受验样品且未添加酶时,在波长475nm下的吸光度
[0414]
c:添加了受验样品且添加了酶时,在波长475nm下的吸光度
[0415]
d:添加了受验样品且未添加酶时,在波长475nm下的吸光度
[0416]
[表6]
[0417][0418]
<制造例3:茵陈蒿发酵液1的制备>
[0419]
在所述制造例1的种曲制备步骤中,将三齿蒿变更为茵陈蒿(artemisia capillaris thunbergii)(albion股份有限公司制造),除此以外,利用与所述制造例1的种曲制备步骤相同的方法制备“茵陈蒿种曲”。
[0420]
另外,在所述制造例1的发酵步骤中,将三齿蒿变更为茵陈蒿(artemisia capillaris thunbergii)(albion股份有限公司制造),除此以外,利用与所述制造例1的发酵步骤相同的方法获得“茵陈蒿发酵液1”。
[0421]
<制造例4:茵陈蒿发酵液2的制备>
[0422]
所述制造例3中,将茵陈蒿种曲变更为米种曲(aspergillus oryzae,白神亮白曲霉,秋田今野商店股份有限公司制造),除此以外,利用与所述制造例3相同的方法获得“茵陈蒿发酵液2”。
[0423]
<比较制造例2:茵陈蒿提取液的制备>
[0424]
所述比较制造例1中,将三齿蒿变更为茵陈蒿(artemisia capillaris thunbergii)(albion股份有限公司制造),除此以外,利用与所述比较制造例1相同的方法获得“茵陈蒿提取液”。
[0425]
(试验例α
‑
2:接触角的测定)
[0426]
所述试验例α
‑
1中,将试验样品变更为制造例3中获得的茵陈蒿发酵液1、制造例4中获得的茵陈蒿发酵液2、及比较制造例2中获得的茵陈蒿提取液,除此以外,利用与所述试验例α
‑
1相同的方法测定接触角。将结果示于下述表7。另外,将测定各试验样品接触角时
的液滴的一例示于图2a~图2c。
[0427]
[表7]
[0428] 试验样品发酵曲霉菌接触角θ(
°
)制造例3茵陈蒿发酵液1有茵陈蒿种曲77.50制造例4茵陈蒿发酵液2有米种曲79.58比较制造例2茵陈蒿提取液无
‑
87.75
[0429]
相比于比较制造例2中获得的茵陈蒿提取液,制造例3中获得的茵陈蒿发酵液1及制造例4中获得的茵陈蒿发酵液2的接触角都小,为81
°
以下,肌肤亲和性优异。此外,制造例3中获得的茵陈蒿发酵液1的接触角为78
°
以下,肌肤亲和性更优异。
[0430]
(试验例2
‑
1:透明质酸合成酶3(has3)mrna表达促进作用试验)
[0431]
试验例1
‑
2中,将受验样品变更为制造例3中获得的茵陈蒿发酵液1、制造例4中获得的茵陈蒿发酵液2、及比较制造例2中获得的茵陈蒿提取液,将受验样品的最终浓度变更为下述表8所示的浓度,除此以外,利用与试验例1
‑
2相同的方法进行透明质酸合成酶3(has3)mrna表达促进作用的试验。将结果示于下述表8。
[0432]
[表8]
[0433][0434]
(试验例2
‑
2:i型胶原蛋白产生促进作用试验)
[0435]
使用制造例3中获得的茵陈蒿发酵液1、制造例4中获得的茵陈蒿发酵液2、及比较制造例2中获得的茵陈蒿提取液作为受验样品,通过下述试验方法,进行i型胶原蛋白产生促进作用的试验。
[0436]
将各受验样品以最终浓度成为下述表9所示的浓度的方式溶解于含0.25%胎牛血清(fetal bovine serum,fbs,biosera公司制造)的杜尔贝科mem(modified eagle
′
s medium,改良伊格尔培养基)(日水制药股份有限公司制造)中,制备添加了受验样品的培养基。
[0437]
使用含10%fbs的dmem,在37℃、5%co2的条件下培养正常人纤维母细胞(nb1rgb,从riken brc购入)直至融合,其后,利用胰蛋白酶处理来回收细胞。将所回收的细胞用含10%fbs的dmem调整为1.6
×
105细胞/ml。
[0438]
然后,将所述nb1rgb(1.6
×
105细胞/ml)以每孔100μl接种到96孔微板,在37℃、5%co2的条件下培养一夜。培养结束后,将培养基更换为添加了受验样品的培养基100μl,在37℃、5%co2的条件下培养3天。培养结束后,利用elisa(enzyme linked immunosorbent assay,酶联免疫吸附测定)法测定各孔的培养基中的i型胶原蛋白量。
[0439]
具体来说,将培养上清液90ml移至elisa板,在4℃下持续一夜在培养板上的吸附后,丢弃溶液,利用含0.05%tween
‑
20的磷酸生理盐水缓冲液(pbs
‑
t)洗净。其后,利用含1%fbs的磷酸生理盐水缓冲液进行封闭操作。丢弃溶液,利用含0.05%tween
‑
20的磷酸生理盐水缓冲液(pbs
‑
t)洗净,与抗人胶原蛋白i型抗体(兔igg,chemicon公司制造)反应。丢
弃溶液,利用含0.05%tween
‑
20的磷酸生理盐水缓冲液(pbs
‑
t)洗净,与hrp标记抗兔igg抗体反应后,采取同样的洗净操作,进行显色反应。
[0440]
i型胶原蛋白量是使用标准品进行所述elisa,制作校准曲线而算出。
[0441]
另外,作为对照,将受验样品溶液变更为不含受验样品的含0.25%fbs的dmem,除此以外,进行所述相同的操作并利用elisa法进行测定。
[0442]
根据所获得的测定值,基于下述式6算出i型胶原蛋白产生促进率。将结果示于下述表9。
[0443]
<式6>
[0444]
i型胶原蛋白产生促进率(%)=a/b
×
100
[0445]
所述式6中,a及b分别表示以下内容。
[0446]
a:添加了受验样品时的i型胶原蛋白量
[0447]
b:未添加受验样品时的i型胶原蛋白量
[0448]
[表9]
[0449][0450]
(试验例2
‑
3:密蛋白
‑
1 mrna表达促进作用试验)
[0451]
使用制造例3中获得的茵陈蒿发酵液1、制造例4中获得的茵陈蒿发酵液2、及比较制造例2中获得的茵陈蒿提取液作为受验样品,通过下述试验方法,进行密蛋白
‑
1 mrna表达促进作用的试验。
[0452]
将各受验样品以最终浓度成为下述表10所示的浓度的方式溶解于正常人表皮角化细胞基础培养基(humedia
‑
kb2,仓敷纺织股份有限公司制造)中,制备添加了受验样品的培养基。
[0453]
使用正常人表皮角化细胞增殖用培养基(humedia
‑
kg2,仓敷纺织股份有限公司制造),在37℃、5%co2的条件下培养正常人新生儿表皮角化细胞(nhek,仓敷纺织股份有限公司制造)直至融合,其后利用胰蛋白酶处理来回收细胞。将所回收的细胞利用正常人表皮角化细胞增殖用培养基(humedia
‑
kg2)调整为1.5
×
105细胞/ml。
[0454]
然后,将所述nhek(1.5
×
105细胞/ml)2ml接种到35mm培养皿,在37℃、5%co2条件下培养一夜。培养结束后,将培养基更换为正常人表皮角化细胞基础培养基(humedia
‑
kb2),进一步培养24小时。培养结束后,将培养基更换为所述添加了受验样品的培养基2ml,在37℃、5%co2的条件下培养24小时。培养结束后去除培养液,利用rna提取用试剂(isogen ii(目录号:311
‑
07361),nippongene股份有限公司制造)提取总rna,通过分光光度计测定各rna量,使用纯化水以成为200ng/μl的方式制备总rna。
[0455]
另外,作为对照,将所述添加了受验样品的培养基2ml变更为不含受验样品的正常人表皮角化细胞基础培养基(humedia
‑
kb2)2ml,除此以外,进行与所述相同的操作并测定吸光度,利用与上述相同的方法以成为200ng/μl的方式制备总rna。
[0456]
以所述各总rna为模板,测定密蛋白
‑
1 mrna及作为内部标准的gapdh mrna表达
量。mrna的检测是通过使用实时pcr装置(thermal cycler dice(注册商标)实时系统iii,takara bio股份有限公司制造)、及sybr(注册商标)primescript(注册商标)rt
‑
pcr试剂盒(perfect real time(目录号:rr063a),takara bio股份有限公司制造)的两步法实时pcr反应来进行。
[0457]
未添加受验样品及添加了受验样品的密蛋白
‑
1 mrna表达量由gapdh mrna的表达量进行了修正。根据该修正值,基于下述式7算出密蛋白
‑
1mrna表达促进率。将结果示于下述表10。
[0458]
<式7>
[0459]
密蛋白
‑
1 mrna表达促进率(%)=a/b
×
100
[0460]
所述式7中,a及b分别表示以下内容。
[0461]
a:添加了受验样品时的修正值
[0462]
b:未添加受验样品时的修正值
[0463]
[表10]
[0464][0465]
(试验例2
‑
4:密蛋白
‑
4mrna表达促进作用试验)
[0466]
将制造例3中获得的茵陈蒿发酵液1、制造例4中获得的茵陈蒿发酵液2、及比较制造例2中获得的茵陈蒿提取液作为受验样品,通过下述试验方法,进行密蛋白
‑
4mrna表达促进作用的试验。
[0467]
将各受验样品以最终浓度成为下述表11所示的浓度的方式溶解于正常人表皮角化细胞基础培养基(humedia
‑
kb2,仓敷纺织股份有限公司制造)中,制备添加了受验样品的培养基。
[0468]
使用正常人表皮角化细胞增殖用培养基(humedia
‑
kg2,仓敷纺织股份有限公司制造),在37℃、5%co2的条件下培养正常人新生儿表皮角化细胞(nhek,仓敷纺织股份有限公司制造)直至融合,其后利用胰蛋白酶处理来回收细胞。将所回收的细胞利用正常人表皮角化细胞增殖用培养基(humedia
‑
kg2)调整为1.5
×
105细胞/ml。
[0469]
然后,将所述nhek(1.5
×
105细胞/ml)2ml接种到35mm培养皿,在37℃、5%co2条件下培养一夜。培养结束后,将培养基更换为正常人表皮角化细胞基础培养基(humedia
‑
kb2),进一步培养24小时。培养结束后,将培养基更换为所述添加了受验样品的培养基2ml,在37℃、5%co2的条件下培养24小时。培养结束后去除培养液,利用rna提取用试剂(isogen ii(目录号:311
‑
07361),nippongene股份有限公司制造)提取总rna,通过分光光度计测定各rna量,使用纯化水以成为200ng/μl的方式制备总rna。
[0470]
另外,作为对照,将所述添加了受验样品的培养基2ml变更为不含受验样品的正常人表皮角化细胞基础培养基(humedia
‑
kb2)2ml,除此以外,进行与所述相同的操作并测定吸光度,利用与所述相同的方法以成为200ng/μl的方式制备总rna。
[0471]
以所述各总rna为模板,测定密蛋白
‑
4mrna及作为内部标准的gapdh mrna表达量。
mrna的检测是通过使用实时pcr装置(thermal cycler dice(注册商标)实时系统iii,takara bio股份有限公司制造)、及sybr(注册商标)primescript(注册商标)rt
‑
pcr试剂盒(perfect real time(目录号:rr063a),takara bio股份有限公司制造)的两步法实时pcr反应来进行。
[0472]
未添加受验样品及添加了受验样品的密蛋白
‑
4mrna表达量由gapdh mrna的表达量进行了修正。根据该修正值,基于下述式8算出密蛋白
‑
4mrna表达促进率。将结果示于下述表11。
[0473]
<式8>
[0474]
密蛋白
‑
4mrna表达促进率(%)=a/b
×
100
[0475]
所述式8中,a及b分别表示以下内容。
[0476]
a:添加了受验样品时的修正值
[0477]
b:未添加受验样品时的修正值
[0478]
[表11]
[0479][0480]
(试验例2
‑
5:紧蛋白mrna表达促进作用试验)
[0481]
将制造例3中获得的茵陈蒿发酵液1、制造例4中获得的茵陈蒿发酵液2、及比较制造例2中获得的茵陈蒿提取液作为受验样品,通过下述试验方法,进行紧蛋白mrna表达促进作用的试验。
[0482]
将各受验样品以最终浓度成为下述表12所示的浓度的方式溶解于正常人表皮角化细胞基础培养基(humedia
‑
kb2,仓敷纺织股份有限公司制造)中,制备添加了受验样品的培养基。
[0483]
使用正常人表皮角化细胞增殖用培养基(humedia
‑
kg2,仓敷纺织股份有限公司制造),在37℃、5%co2的条件下培养正常人新生儿表皮角化细胞(nhek,仓敷纺织股份有限公司制造)直至融合,其后利用胰蛋白酶处理来回收细胞。将所回收的细胞利用正常人表皮角化细胞增殖用培养基(humedia
‑
kg2)调整为1.5
×
105细胞/ml。
[0484]
然后,将所述nhek(1.5
×
105细胞/ml)2ml接种到35mm培养皿,在37℃、5%co2条件下培养一夜。培养结束后,将培养基更换为正常人表皮角化细胞基础培养基(humedia
‑
kb2),进一步培养24小时。培养结束后去除培养液,利用rna提取用试剂(isogen ii(目录号:311
‑
07361),nippongene股份有限公司制造)提取总rna,通过分光光度计测定各rna量,使用纯化水以成为200ng/μl的方式制备总rna。
[0485]
另外,作为对照,将所述添加了受验样品的培养基2ml变更为不含受验样品的正常人表皮角化细胞基础培养基(humedia
‑
kb2)2ml,除此以外,进行与所述相同的操作并测定吸光度,利用与所述相同的方法以成为200ng/μl的方式制备总rna。
[0486]
以所述各总rna为模板,测定紧蛋白mrna及作为内部标准的gapdh mrna表达量。mrna的检测是通过使用实时pcr装置(thermal cycler dice(注册商标)实时系统iii,
takara bio股份有限公司制造)、及sybr(注册商标)primescript(注册商标)rt
‑
pcr试剂盒(perfect real time(目录号:rr063a),takara bio股份有限公司制造)的两步法实时pcr反应来进行。
[0487]
未添加受验样品及添加了受验样品的紧蛋白mrna表达量由gapdh mrna表达量进行了修正。根据该修正值,基于下述式9算出紧蛋白mrna表达促进率。将结果示于下述表12。
[0488]
<式9>
[0489]
紧蛋白mrna表达促进率(%)=a/b
×
100
[0490]
所述式9中,a及b分别表示以下内容。
[0491]
a:添加了受验样品时的修正值
[0492]
b:未添加受验样品时的修正值
[0493]
[表12]
[0494][0495]
<制造例5:百里香发酵液1的制备>
[0496]
在所述制造例1的种曲制备步骤中,将三齿蒿变更为百里香(thymus vulgaris linne)(albion股份有限公司制造),除此以外,利用与所述制造例1的种曲制备步骤相同的方法制备“百里香种曲”。
[0497]
另外,在所述制造例1的发酵步骤中,将三齿蒿变更为百里香(thymus vulgaris linne)(albion股份有限公司制造),除此以外,利用与所述制造例1的发酵步骤相同的方法获得“百里香发酵液1”。
[0498]
<制造例6:百里香发酵液2的制备>
[0499]
所述制造例5中,将百里香种曲变更为米种曲(aspergillus oryzae,白神亮白曲霉,秋田今野商店股份有限公司制造),除此以外,利用与所述制造例5相同的方法获得“百里香发酵液2”。
[0500]
<比较制造例3:百里香提取液的制备>
[0501]
所述比较制造例1中,将三齿蒿变更为百里香(thymus vulgaris linne)(albion股份有限公司制造),除此以外,利用与所述比较制造例1相同的方法获得“百里香提取液”。
[0502]
(试验例a
‑
3:接触角的测定)
[0503]
所述试验例a
‑
1中,将试验样品变更为制造例5中获得的百里香发酵液1、制造例6中获得的百里香发酵液2、及比较制造例3中获得的百里香提取液,除此以外,利用与所述试验例a
‑
1相同的方法测定接触角。将结果示于下述表13。另外,将测定各试验样品接触角时的液滴的一例示于图3a~图3c。
[0504]
[表13]
[0505]
试验样品发酵曲霉菌接触角θ(
°
)制造例5百里香发酵液1有百里香种曲78.32制造例6百里香发酵液2有米种曲82.77
比较制造例3百里香提取液无
‑
88.59
[0506]
相比于比较制造例3中获得的百里香提取液,制造例5中获得的百里香发酵液1及制造例6中获得的百里香发酵液2的接触角都小,为87
°
以下,肌肤亲和性优异。此外,制造例5中获得的百里香发酵液1的接触角为81
°
以下,肌肤亲和性更优异。
[0507]
(试验例3
‑
1:谷氨酰胺转氨酶
‑
1(tgm
‑
1)mrna表达促进作用试验)
[0508]
使用制造例5中获得的百里香发酵液1、制造例6中获得的百里香发酵液2、及比较制造例3中获得的百里香提取液作为受验样品,通过下述试验方法,进行谷氨酰胺转氨酶
‑
1(tgm
‑
1)mrna表达促进作用的试验。
[0509]
将各受验样品以最终浓度成为下述表14所示的浓度的方式溶解于正常人表皮角化细胞基础培养基(humedia
‑
kb2,仓敷纺织股份有限公司制造)中,制备添加了受验样品的培养基。
[0510]
使用正常人表皮角化细胞增殖用培养基(humedia
‑
kg2,仓敷纺织股份有限公司制造),在37℃、5%co2的条件下培养正常人新生儿表皮角化细胞(nhek,仓敷纺织股份有限公司制造)直至融合,其后利用胰蛋白酶处理来回收细胞。将所回收的细胞利用正常人表皮角化细胞增殖用培养基(humedia
‑
kg2)调整为1.5
×
105细胞/ml。
[0511]
然后,将所述nhek(1.5
×
105细胞/ml)2ml接种到35mm培养皿,在37℃、5%co2条件下培养一夜。培养结束后,将培养基更换为正常人表皮角化细胞基础培养基(humedia
‑
kb2),进一步培养24小时。培养结束后,将培养基更换为所述添加了受验样品的培养基2ml,在37℃、5%co2的条件下培养24小时。培养结束后去除培养液,利用rna提取用试剂(isogen ii(目录号:311
‑
07361),nippongene股份有限公司制造)提取总rna,通过分光光度计测定各rna量,使用纯化水以成为200ng/μl的方式制备总rna。
[0512]
另外,作为对照,将所述添加了受验样品的培养基2ml变更为不含受验样品的正常人表皮角化细胞基础培养基(humedia
‑
kb2)2ml,除此以外,进行与所述相同的操作并测定吸光度,利用与上述相同的方法以成为200ng/μl的方式制备总rna。
[0513]
以所述各总rna为模板,测定谷氨酰胺转氨酶
‑
1(tgm
‑
1)mrna及作为内部标准的gapdh mrna表达量。mrna的检测是通过使用实时pcr装置(thermal cycler dice(注册商标)实时系统iii,takara bio股份有限公司制造)、及sybr(注册商标)primescript(注册商标)rt
‑
pcr试剂盒(perfect real time(目录号:rr063a),takara bio股份有限公司制造)的两步法实时pcr反应来进行。
[0514]
未添加受验样品及添加了受验样品的tgm
‑
1 mrna表达量由gapdh mrna表达量进行了修正。根据该修正值,基于下述式10算出tgm
‑
1 mrna表达促进率。将结果示于下述表14。
[0515]
<式10>
[0516]
tgm
‑
1 mrna表达促进率(%)=a/b
×
100
[0517]
所述式10中,a及b分别表示以下内容。
[0518]
a:添加了受验样品时的修正值
[0519]
b:未添加受验样品时的修正值
[0520]
[表14]
[0521][0522]
(试验例3
‑
2:水通道蛋白3(aqp3)mrna表达促进作用试验)
[0523]
使用制造例5中获得的百里香发酵液1、制造例6中获得的百里香发酵液2、及比较制造例3中获得的百里香提取液作为受验样品,通过下述试验方法,进行水通道蛋白3(aqp3)mrna表达促进作用的试验。
[0524]
将各受验样品以最终浓度成为下述表15所示的浓度的方式溶解于正常人表皮角化细胞基础培养基(humedia
‑
kb2,仓敷纺织股份有限公司制造)中,制备添加了受验样品的培养基。
[0525]
使用正常人表皮角化细胞增殖用培养基(humedia
‑
kg2,仓敷纺织股份有限公司制造),在37℃、5%co2的条件下培养正常人新生儿表皮角化细胞(nhek,仓敷纺织股份有限公司制造)直至融合,其后利用胰蛋白酶处理来回收细胞。将所回收的细胞利用正常人表皮角化细胞增殖用培养基(humedia
‑
kg2)调整为1.5
×
105细胞/ml。
[0526]
然后,将所述nhek(1.5
×
105细胞/ml)2ml接种到35mm培养皿,在37℃、5%co2条件下培养一夜。培养结束后,将培养基更换为正常人表皮角化细胞基础培养基(humedia
‑
kb2),进一步培养24小时。培养结束后,将培养基更换为所述添加了受验样品的培养基2ml,在37℃、5%co2的条件下培养24小时。培养结束后去除培养液,利用rna提取用试剂(isogen ii(目录号:311
‑
07361),nippongene股份有限公司制造)提取总rna,通过分光光度计测定各rna量,使用纯化水以成为200ng/μl的方式制备总rna。
[0527]
另外,作为对照,将所述添加了受验样品的培养基2ml变更为不含受验样品的正常人表皮角化细胞基础培养基(humedia
‑
kb2)2ml,除此以外,进行与所述相同的操作并测定吸光度,利用与上述相同的方法以成为200ng/μl的方式制备总rna。
[0528]
以所述各总rna为模板,测定水通道蛋白3(aqp3)mrna及作为内部标准的gapdh mrna表达量。mrna的检测是通过使用实时pcr装置(thermal cycler dice(注册商标)实时系统iii,takara bio股份有限公司制造)、及sybr(注册商标)primescript(注册商标)rt
‑
pcr试剂盒(perfect real time(目录号:rr063a),takara bio股份有限公司制造)的两步法实时pcr反应来进行。
[0529]
未添加受验样品及添加了受验样品的aqp3 mrna表达量由gapdh mrna表达量进行了修正。根据该修正值,基于下述式11算出aqp3 mrna表达促进率。将结果示于下述表15。
[0530]
<式11>
[0531]
aqp3 mrna表达促进率(%)=a/b
×
100
[0532]
所述式11中,a及b分别表示以下内容。
[0533]
a:添加了受验样品时的修正值
[0534]
b:未添加受验样品时的修正值
[0535]
[表15]
[0536][0537]
(试验例3
‑
3:紧蛋白mrna表达促进作用试验)
[0538]
试验例2
‑
5中,将受验样品变更为制造例5中获得的百里香发酵液1、制造例6中获得的百里香发酵液2、及比较制造例3中获得的百里香提取液,将受验样品的最终浓度变更为下述表16所示的浓度,除此以外,利用与试验例2
‑
5相同的方法进行紧蛋白mrna表达促进作用的试验。将结果示于下述表16。
[0539]
[表16]
[0540][0541]
(试验例3
‑
4:dpph自由基清除作用试验)
[0542]
试验例1
‑
3中,将受验样品变更为制造例5中获得的百里香发酵液1、制造例6中获得的百里香发酵液2、及比较制造例3中获得的百里香提取液,将受验样品的最终浓度变更为下述表17所示的浓度,除此以外,利用与试验例1
‑
3相同的方法进行dpph自由基清除作用的试验。将结果示于下述表17。
[0543]
[表17]
[0544][0545]
<制造例7:香蜂草发酵液1的制备>
[0546]
在所述制造例1的种曲制备步骤中,将三齿蒿变更为香蜂草(melissa officinalis linne)(albion股份有限公司制造),除此以外,利用与所述制造例1的种曲制备步骤相同的方法制备“香蜂草种曲”。
[0547]
另外,在所述制造例1的发酵步骤中,将三齿蒿变更为香蜂草(melissa officinalis linne)(albion股份有限公司制造),除此以外,利用与所述制造例1的发酵步骤相同的方法获得“香蜂草发酵液1”。
[0548]
<制造例8:香蜂草发酵液2的制备>
[0549]
所述制造例7中,将香蜂草种曲变更为米种曲(aspergillus oryzae,白神亮白曲霉,秋田今野商店股份有限公司制造),除此以外,利用与所述制造例7相同的方法获得“香蜂草发酵液2”。
[0550]
<比较制造例4:香蜂草提取液的制备>
[0551]
所述比较制造例1中,将三齿蒿变更为香蜂草(melissa officinalis linne)(albion股份有限公司制造),除此以外,利用与所述比较制造例1相同的方法获得“香蜂草提取液”。
[0552]
(试验例a
‑
4:接触角的测定)
[0553]
所述试验例a
‑
1中,将试验样品变更为制造例7中获得的香蜂草发酵液1、制造例8中获得的香蜂草发酵液2、及比较制造例4中获得的香蜂草提取液,除此以外,利用与所述试验例a
‑
1相同的方法测定接触角。将结果示于下述表18。另外,将测定各试验样品接触角时的液滴的一例示于图4a~图4c。
[0554]
[表18]
[0555] 试验样品发酵曲霉菌接触角θ(
°
)制造例7香蜂草发酵液1有香蜂草种曲77.09制造例8香蜂草发酵液2有米种曲80.16比较制造例4香蜂草提取液无
‑
86.53
[0556]
相比于比较制造例4中获得的香蜂草提取液,制造例7中获得的香蜂草发酵液1及制造例8中获得的香蜂草发酵液2的接触角都小,为85
°
以下,肌肤亲和性优异。此外,制造例7中获得的香蜂草发酵液1的接触角为79
°
以下,肌肤亲和性更优异。
[0557]
(试验例4
‑
1:i型胶原蛋白产生促进作用试验)
[0558]
试验例2
‑
2中,将受验样品变更为制造例7中获得的香蜂草发酵液1、制造例8中获得的香蜂草发酵液2、及比较制造例4中获得的香蜂草提取液,将受验样品的最终浓度变更为下述表19所示的浓度,除此以外,利用与试验例2
‑
2相同的方法进行i型胶原蛋白产生促进作用的试验。将结果示于下述表19。
[0559]
[表19]
[0560][0561]
(试验例4
‑
2:水通道蛋白3(aqp3)mrna表达促进作用试验)
[0562]
试验例3
‑
2中,将受验样品变更为制造例7中获得的香蜂草发酵液1、制造例8中获得的香蜂草发酵液2、及比较制造例4中获得的香蜂草提取液,将受验样品的最终浓度变更为下述表20所示的浓度,除此以外,利用与试验例3
‑
2相同的方法进行水通道蛋白3(aqp3)mrna表达促进作用的试验。将结果示于下述表20。
[0563]
[表20]
[0564][0565]
(试验例4
‑
3:dpph自由基清除作用试验)
[0566]
试验例1
‑
3中,将受验样品变更为制造例7中获得的香蜂草发酵液1、制造例8中获得的香蜂草发酵液2、及比较制造例4中获得的香蜂草提取液,将受验样品的最终浓度变更为下述表21所示的浓度,除此以外,利用与试验例1
‑
3相同的方法进行dpph自由基清除作用的试验。将结果示于下述表21。
[0567]
[表21]
[0568][0569]
(试验例4
‑
4:透明质酸酶活性抑制作用试验)
[0570]
试验例1
‑
4中,将受验样品变更为制造例7中获得的香蜂草发酵液1、制造例8中获得的香蜂草发酵液2、及比较制造例4中获得的香蜂草提取液,将受验样品的最终浓度变更为下述表22所示的浓度,除此以外,利用与试验例1
‑
4相同的方法进行透明质酸酶活性抑制作用的试验。将结果示于下述表22。
[0571]
[表22]
[0572][0573]
(试验例4
‑
5:酪氨酸酶活性抑制作用试验)
[0574]
试验例1
‑
5中,将受验样品变更为制造例7中获得的香蜂草发酵液1、制造例8中获得的香蜂草发酵液2、及比较制造例4中获得的香蜂草提取液,将受验样品的最终浓度变更为下述表23所示的浓度,除此以外,利用与试验例1
‑
5相同的方法进行酪氨酸酶活性抑制作用的试验。将结果示于下述表23。
[0575]
[表23]
[0576][0577]
<制造例9:矢车菊发酵液1的制备>
[0578]
在所述制造例1的种曲制备步骤中,将三齿蒿变更为矢车菊(centaurea cyanus linne)(albion股份有限公司制造),除此以外,利用与所述制造例1的种曲制备步骤相同的方法制备“矢车菊种曲”。
[0579]
另外,在所述制造例1的发酵步骤中,将三齿蒿变更为矢车菊(centaurea cyanus linne)(albion股份有限公司制造),除此以外,利用与所述制造例1的发酵步骤相同的方法获得“矢车菊发酵液1”。
[0580]
<制造例10:矢车菊发酵液2的制备>
[0581]
所述制造例9中,将矢车菊种曲变更为米种曲(aspergillus oryzae,白神亮白曲霉,秋田今野商店股份有限公司制造),除此以外,利用与所述制造例9相同的方法获得“矢车菊发酵液2”。
[0582]
<比较制造例5:矢车菊提取液的制备>
[0583]
所述比较制造例1中,将三齿蒿变更为矢车菊(centaurea cyanus linne)(albion股份有限公司制造),除此以外,利用与所述比较制造例1相同的方法获得“矢车菊提取液”。
[0584]
(试验例a
‑
5:接触角的测定)
[0585]
所述试验例a
‑
1中,将试验样品变更为制造例9中获得的矢车菊发酵液1、制造例10中获得的矢车菊发酵液2、及比较制造例5中获得的矢车菊提取液,除此以外,利用与所述试验例a
‑
1相同的方法测定接触角。将结果示于下述表24。另外,将测定各试验样品接触角时的液滴的一例示于图5a~图5c。
[0586]
[表24]
[0587]
试验样品发酵曲霉菌接触角θ(
°
)制造例9矢车菊发酵液1有矢车菊种曲78.52制造例10矢车菊发酵液2有米种曲80.83比较制造例5矢车菊提取液无
‑
86.96
[0588]
相比于比较制造例5中获得的矢车菊提取液,制造例9中获得的矢车菊发酵液1及制造例10中获得的矢车菊发酵液2的接触角都小,为85
°
以下,肌肤亲和性优异。此外,制造例9中获得的矢车菊发酵液1的接触角为79
°
以下,肌肤亲和性更优异。
[0589]
(试验例5
‑
1:i型胶原蛋白产生促进作用试验)
[0590]
试验例2
‑
2中,将受验样品变更为制造例9中获得的矢车菊发酵液1、制造例10中获得的矢车菊发酵液2、及比较制造例5中获得的矢车菊提取液,将受验样品的最终浓度变更为下述表25所示的浓度,除此以外,利用与试验例2
‑
2相同的方法进行i型胶原蛋白产生促进作用的试验。将结果示于下述表25。
[0591]
[表25]
[0592][0593]
(试验例5
‑
2:谷氨酰胺转氨酶
‑
1 mrna表达促进作用试验)
[0594]
试验例3
‑
1中,将受验样品变更为制造例9中获得的矢车菊发酵液1、制造例10中获得的矢车菊发酵液2、及比较制造例5中获得的矢车菊提取液,将受验样品的最终浓度变更为下述表26所示的浓度,除此以外,利用与试验例3
‑
1相同的方法进行谷氨酰胺转氨酶
‑
1 mrna表达促进作用的试验。将结果示于下述表26。
[0595]
[表26]
[0596][0597]
(试验例5
‑
3:丝聚蛋白mrna表达促进作用试验)
[0598]
将制造例9中获得的矢车菊发酵液1、制造例10中获得的矢车菊发酵液2、及比较制造例5中获得的矢车菊提取液作为受验样品,通过下述试验方法,进行丝聚蛋白mrna表达促进作用的试验。
[0599]
将各受验样品以最终浓度成为下述表27所示的浓度的方式溶解于正常人表皮角化细胞基础培养基(humedia
‑
kb2,仓敷纺织股份有限公司制造),制备添加了受验样品的培养基。
[0600]
使用正常人表皮角化细胞增殖用培养基(humedia
‑
kg2,仓敷纺织股份有限公司制造),在37℃、5%co2的条件下培养正常人新生儿表皮角化细胞(nhek,仓敷纺织股份有限公司制造)直至融合,其后利用胰蛋白酶处理来回收细胞。将所回收的细胞利用正常人表皮角化细胞增殖用培养基(humedia
‑
kg2)调整为1.5
×
105细胞/ml。
[0601]
然后,将所述nhek(1.5
×
105细胞/ml)2ml接种到35mm培养皿,在37℃、5%co2条件下培养一夜。培养结束后,将培养基更换为正常人表皮角化细胞基础培养基(humedia
‑
kb2),进一步培养24小时。培养结束后,将培养基更换为所述添加了受验样品的培养基2ml,在37℃、5%co2的条件下培养24小时。培养结束后去除培养液,利用rna提取用试剂(isogen ii(目录号:311
‑
07361),nippongene股份有限公司制造)提取总rna,通过分光光度计测定各rna量,使用纯化水以成为200ng/μl的方式制备总rna。
[0602]
另外,作为对照,将所述添加了受验样品的培养基2ml变更为不含受验样品的正常人表皮角化细胞基础培养基(humedia
‑
kb2)2ml,除此以外,进行与所述相同的操作并测定吸光度,利用与上述相同的方法以成为200ng/μl的方式制备总rna。
[0603]
以所述各总rna为模板,测定丝聚蛋白mrna及作为内部标准的gapdh mrna表达量。mrna的检测是通过使用实时pcr装置(thermal cycler dice(注册商标)实时系统iii,takara bio股份有限公司制造)、及sybr(注册商标)primescript(注册商标)rt
‑
pcr试剂盒(perfect real time(目录号:rr063a),takara bio股份有限公司制造)的两步法实时pcr反应来进行。
[0604]
未添加受验样品及添加了受验样品的丝聚蛋白mrna表达量由gapdh mrna表达量进行了修正。根据该修正值,基于下述式12算出丝聚蛋白mrna表达促进率。将结果示于下述表27。
[0605]
<式12>
[0606]
丝聚蛋白mrna表达促进率(%)=a/b
×
100
[0607]
所述式12中,a及b分别表示以下内容。
[0608]
a:添加了受验样品时的修正值
[0609]
b:未添加受验样品时的修正值
[0610]
[表27]
[0611][0612]
(试验例5
‑
4:水通道蛋白3(aqp3)mrna表达促进作用试验)
[0613]
试验例3
‑
2中,将受验样品变更为制造例9中获得的矢车菊发酵液1、制造例10中获得的矢车菊发酵液2、及比较制造例5中获得的矢车菊提取液,将受验样品的最终浓度变更为下述表28所示的浓度,除此以外,利用与试验例3
‑
2相同的方法进行水通道蛋白3(aqp3)mrna表达促进作用的试验。将结果示于下述表28。
[0614]
[表28]
[0615][0616]
(试验例5
‑
5:透明质酸合成酶3(has3)mrna表达促进作用试验)
[0617]
试验例1
‑
2中,将受验样品变更为制造例9中获得的矢车菊发酵液1、制造例10中获得的矢车菊发酵液2、及比较制造例5中获得的矢车菊提取液,将受验样品的最终浓度变更为下述表29所示的浓度,除此以外,利用与试验例1
‑
2相同的方法进行透明质酸合成酶3(has3)mrna表达促进作用的试验。将结果示于下述表29。
[0618]
[表29]
[0619][0620]
(试验例5
‑
6:密蛋白
‑
1 mrna表达促进作用试验)
[0621]
试验例2
‑
3中,将受验样品变更为制造例9中获得的矢车菊发酵液1、制造例10中获得的矢车菊发酵液2、及比较制造例5中获得的矢车菊提取液,将受验样品的最终浓度变更为下述表30所示的浓度,除此以外,利用与试验例2
‑
3相同的方法进行密蛋白
‑
1 mrna表达促进作用的试验。将结果示于下述表30。
[0622]
[表30]
[0623][0624]
(试验例5
‑
7:密蛋白
‑
4mrna表达促进作用试验)
[0625]
试验例2
‑
4中,将受验样品变更为制造例9中获得的矢车菊发酵液1、制造例10中获得的矢车菊发酵液2、及比较制造例5中获得的矢车菊提取液,将受验样品的最终浓度变更为下述表31所示的浓度,除此以外,利用与试验例2
‑
4相同的方法进行密蛋白
‑
4mrna表达促进作用的试验。将结果示于下述表31。
[0626]
[表31]
[0627][0628]
(试验例5
‑
8:紧蛋白mrna表达促进作用试验)
[0629]
试验例2
‑
5中,将受验样品变更为制造例9中获得的矢车菊发酵液1、制造例10中获得的矢车菊发酵液2、及比较制造例5中获得的矢车菊提取液,将受验样品的最终浓度变更为下述表32所示的浓度,除此以外,利用与试验例2
‑
5相同的方法进行紧蛋白mrna表达促进作用的试验。将结果示于下述表32。
[0630]
[表32]
[0631][0632]
(试验例5
‑
9:dpph自由基清除作用试验)
[0633]
试验例1
‑
3中,将受验样品变更为制造例9中获得的矢车菊发酵液1、制造例10中获得的矢车菊发酵液2、及比较制造例5中获得的矢车菊提取液,将受验样品的最终浓度变更为下述表33所示的浓度,除此以外,利用与试验例1
‑
3相同的方法进行dpph自由基清除作用的试验。将结果示于下述表33。
[0634]
[表33]
[0635][0636]
(试验例5
‑
10:对于b16黑色素瘤细胞的黑色素产生抑制作用试验)
[0637]
将制造例9中获得的矢车菊发酵液1、制造例10中获得的矢车菊发酵液2、及比较制造例5中获得的矢车菊提取液作为受验样品,通过下述试验方法,进行针对b16黑色素瘤细胞的黑色素产生抑制作用的试验。
[0638]
将各受验样品溶解于含10%fbs(biosera公司制造)及1mmol/l茶碱(富士胶片和光纯药股份有限公司制造)的dmem(日水制药股份有限公司制造)中,制备添加了受验样品的培养基。
[0639]
使用含10%fbs的dmem,在37℃、5%co2的条件下培养b16黑色素瘤细胞直至融合,其后利用胰蛋白酶处理来回收细胞。将所回收的细胞利用含10%fbs及1mmol/l茶碱的dmem调整为2.4
×
105细胞/ml。
[0640]
然后,将所述b16黑色素瘤细胞(2.4
×
105细胞/ml)以每孔300μl接种到48孔板,在37℃、5%co2的条件下培养6小时。培养结束后,将培养基更换为添加了受验样品的培养基100μl,在37℃、5%co2的条件下培养3天。培养结束后,分别以每孔300μl添加所述添加了受验样品的培养基,在37℃、5%co2的条件下培养4天。此外,此时所述受验样品的最终浓度为下述表34所示的浓度。
[0641]
培养结束后,从各孔中去除培养基,添加2mol/l氢氧化钠溶液200μl,利用超声波破碎仪来破坏细胞,测定波长475nm下的吸光度。
[0642]
根据测得的吸光度值,基于使用合成黑色素(sigma公司制造)所制作的校准曲线算出黑色素量。
[0643]
另外,为了测定细胞存活率,利用与所述方法相同的方法,使用所述添加了受验样品的培养基培养b16黑色素瘤细胞后,去除培养基,并用400μl的pbs缓冲液洗净。然后,将中性红以最终浓度0.05mg/ml溶解于含10%fbs的dmem中,将所得的溶液向各孔中逐一添加200μl,培养2.5小时。培养结束后去除中性红溶液,将乙醇
‑
乙酸溶液(乙醇:乙酸:水=50:1:49(体积比))向各孔中逐一添加200μl,来提取色素。提取后,测定波长540nm下的吸光度。
[0644]
另外,作为对照,将受验样品溶液变更为不含受验样品的含10%fbs及1mmol/l茶碱的dmem,除此以外,进行与上述相同的操作并测定吸光度。
[0645]
根据所获得的测定值,基于下述式13算出细胞存活率,并基于下述式14算出经该细胞存活率修正的黑色素产生抑制率(%)。将结果示于下述表34。
[0646]
<式13>
[0647]
细胞存活率(%)=(d/c)
×
100
[0648]
所述式13中,将c及d分别表示以下内容。
[0649]
c:未添加受验样品时,波长540nm下的吸光度
[0650]
d:添加了受验样品时,波长540nm下的吸光度
[0651]
<式14>
[0652]
黑色素产生抑制率(%)={1-(b/d)/(a/c)}
×
100
[0653]
所述式14中,a~d分别表示以下内容。
[0654]
a:未添加受验样品时的黑色素量
[0655]
b:添加了受验样品时的黑色素量
[0656]
c:未添加受验样品时,波长540nm下的吸光度
[0657]
d:添加了受验样品时,波长540nm下的吸光度
[0658]
[表34]
[0659][0660]
产业上的可利用性
[0661]
本发明的抗老化剂、抗氧化剂、抗炎剂、及美白剂是具有优异的抗老化作用、抗氧化作用、抗炎作用、及美白作用中的至少任一种作用,且安全性高的天然物质系产品,因此,不论化妆品、食品、医药品等领域,均能够利用。
[0662]
本发明的化妆品由于含有选自由本发明的所述抗老化剂、所述抗氧化剂、所述抗炎剂、及所述美白剂所组成的群组中的至少1种,所以适合用于化妆水、乳液、乳霜、软膏、精华液、润肤乳、面膜、胶冻、唇膏、口红、粉饼、沐浴剂、肥皂、沐浴露等皮肤化妆品;收敛水、养发露、发乳、整发液、润发油、洗发精、护发素等头皮头发化妆品等。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。