1.本发明涉及特定细菌提取物的新的给药方法和途径,所述细菌提取物可通过革兰阳性或革兰阴性细菌种(bacterial species)的碱性裂解获得,以及涉及用于在人类受试者中治疗和/或预防哮喘、哮喘恶化、过敏性哮喘和/或喘鸣(wheezing)相关症状和/或与呼吸系统病症相关的微生物群相关的病症的递送装置,哮喘受试者中保护性微生物群的重组以及健康受试者中微生物群向保护性免疫的重组。
2.发明背景
3.哮喘、过敏性哮喘和其他喘鸣疾病等慢性气道疾病是主要的医疗保健问题之一,特别是在儿童中。哮喘是肺部和支气管气道的炎性疾病,会导致气道暂时发炎、收缩和变窄。哮喘可由原发感染、吸入肺部的过敏原或刺激物引起。症状包括呼吸困难,粘液和痰产生过多,喘鸣,咳嗽和胸闷。哮喘的内在原因是遗传和环境因素的复杂产物,导致疾病的显著异质性(heterogeneity)。最近几十年来,西方国家的哮喘患病率急剧增加,这可能是由于环境暴露的变化。
4.此外,最近的证据支持了微生物群在哮喘和喘鸣疾病的发展中的作用,表明微生物群的变化与慢性气道疾病症状有关,特别是与哮喘和喘鸣性哮喘有关。该假说为,生命早期的暴露可破坏微生物群的组成,从而以过敏性疾病的形式促进免疫失调。
5.健康的微生物组可为宿主提供多种益处,包括抵抗广谱病原体的定殖、必需营养素的生物合成和吸收,以及维持健康的肠道上皮和适当控制的全身免疫的免疫防御和刺激。因此,肺气道和肠道微生物群在多种疾病和病症(包括各种肠道病原体感染)的发病机制中起重要作用。
6.在失衡的情况下,微生物群功能可能会丧失或紊乱,导致对病原体的易感性增加、代谢特征改变,或诱导可引起局部或全身炎症或自身免疫的促炎信号。特别是,微生物群的变化与多种慢性气道疾病和症状(如哮喘和喘鸣)有关。因此,当正常肠道微生物群已由于使用广谱抗生素而受到干扰时,患者变得更易遭受病原体感染。许多这些疾病和病症是慢性病,它们显著降低患者的生活质量并且最终可能是致命的。
7.本发明是基于令人惊讶的发现——可通过革兰阳性或革兰阴性细菌种的碱性裂解获得的特定细菌提取物的给药提供了一种用于预防气道中的过敏性炎症的有效且安全的方法,同时在患有明显与微生物群失衡有关的哮喘和过敏引起的恶化的宿主中恢复健康的微生物组。
技术实现要素:
8.本发明涉及细菌提取物的新的给药途径和剂量,所述细菌提取物用于在有需要的受试者中治疗和/或预防哮喘、哮喘恶化、过敏性哮喘病症、喘鸣以及相关微生物群相关的病症的方法中。使用类似或各种气道炎症诱导剂的不同实验已经记载于附图中。
9.本发明还涉及一种监测测试受试者的疾病或异常或失衡微生物组的治疗或预防
的方法:(a)用治疗有效量的可通过革兰阳性和/或革兰阴性细菌种的碱性裂解获得的纯化细菌提取物治疗测试受试者,(b)分析测试受试者的微生物组特征(signature);和(c)将测试受试者的所述微生物组特征或模式与健康受试者的微生物组特征或模式进行比较,其中与治疗前测试受试者的微生物组特征与健康受试者的微生物组特征的相似性相比,使用治疗有效量的稳定纯化细菌提取物治疗后,测试受试者的微生物组特征与健康受试者的微生物组特征的相似性增加,表明了治疗有效。还提供了不同的附图,所述附图旨在描述基因相关性和变化,以及测试受试者的区别性、相关性和分类学变化。
附图说明
10.图1:示出了第一项研究中使用的方案,用于评估bv细菌提取物(bv)在使用balb/c品系小鼠的经典过敏原驱动的实验哮喘小鼠模型中的作用。
11.图2:(a)示出了bv对支气管肺泡灌洗(bal)嗜酸性粒细胞增多(eosinophilia)的作用,以第二项研究中获得的bal液体中细胞含量的百分比表示。该研究使用图1的方案进行,不同之处在于bv剂量。使用1mg剂量的bv给药14次获得了对嗜酸性粒细胞增多的显著抑制。(b)示出了bv功效的另一个代表性实例,证明了使用不同剂量的哮喘模型中bal嗜酸性粒细胞增多的剂量依赖性降低。
12.图3:(a)示出了bv对如图2所示的但源自不同实验的支气管肺泡灌洗(bal)嗜酸性粒细胞增多的作用,并且其中来自bal的嗜酸性粒细胞增多含量表示为细胞总数。(b)示出了bv如何抑制哮喘诱导的肺部炎症的主要分子表型:il
‑
5和il
‑
13的bal蛋白水平,以pg/ml计。
13.图4:示出了本文阐明的图2和图3中描绘的功能功效相关性的代表性实例,以肺功能作为读数。bv显著预防了气道高反应性(ahr),其中在先前研究的所有测试点中,1mg剂量的功效最佳。ahr的显著降低表示为相对于ova。
14.图5:示出了另外的实例,证明了bv如何抑制哮喘诱导的肺部炎症的主要细胞和分子表型,此处示出了通过在bv处理的动物中的pas*染色检测到的分泌粘液的杯形细胞的强烈显著减少。*pas=高碘酸希夫染色。
15.图6:示出了用于评估bv在由链格孢(alternaria alternata)驱动的过敏性哮喘模型中的保护作用的方案。
16.图7:示出了鼻内给药后bv在链格孢过敏性哮喘模型中的保护作用的代表性实例。对bv功效的监测是基于bal差异细胞含量,并证明了约40%的嗜酸性粒细胞增多的抑制,此处表示为按照实施例5中描述的实验方案获得的bal液体中细胞的百分比。
17.图8:示出了i.n.bv在链格孢属(alternaria)模型中的作用:呼吸系统阻力(rrs)
‑
最大响应(代表总气道阻力)。bv显著地预防了rrs反应,其中在先前研究的所有测试点中,1mg剂量的功效最佳。ahr的显著降低表示为相对于链格孢属。
18.图9:示出了bv对人支气管上皮细胞(16hbe14o细胞系)中应激(stress)和链格孢属诱导的屏障功能损伤(测量为teer,经上皮的电阻)的体外预防。
19.图10:示出了ova诱导哮喘的较短方案(与图1相比,19天而不是39天,以及8次而不是14次处理)。
20.图11:示出了bv对bal嗜酸性粒细胞增多的阻断,但源自图10中描绘的修改的ova
诱导方案,此处表示为百分比(左)和细胞计数(右)。
21.图12:示出了用于c57bl6品系小鼠的ova诱导哮喘的另外的方案,并如先前所述,使用鼻内递送1mg剂量/天/小鼠的14次处理而以bv进行测试。
22.图13:示出了bv细菌提取物在bal中诱导嗜酸性粒细胞增多的保护性减少以及嗜中性粒细胞增多的保护性增加,表示为细胞百分比。
23.图14:wgcna
‑
鉴定受ova和/或bv调节并与如图1中处理的小鼠肺部的主要哮喘表型相关的基因组(模块),并通过rna
‑
seq进行分析。每个框示出了每个模块特征基因(eigengene)(模块标准化基因表达谱的第一个主成分,即标准化模块基因表达数据的汇总)和性状(bal嗜酸性粒细胞百分比、ahr z分数)之间关系的皮尔逊相关系数(r)和/或感兴趣的比较(ova对比pbs、ova bv对比ova)。显著性水平示出为每个框内括号中的q值。每个模块内的基因数量在每个模块名称旁边的括号中。颜色的强度反映了关联的强度。
24.图15:对来自与嗜酸性粒细胞增多、ahr和ova/bv处理高度相关的wgcna
‑
鉴定的模块的一个核心的基因的组的独创性通路分析(ingenuity pathway analysis)(ipa)表明,这些基因不仅如预期的那样聚类于与ahr和嗜酸性粒细胞运动相关的通路中,还聚类于与th2细胞的迁移和分化以及树突状细胞趋化性相关的通路中。鉴定一个核心的基因的组的策略示于左侧。右侧的图示出了在该核心的基因组(符号)的成员中富集的选定生物功能(矩形)。基因使用来自差异表达分析的ova bv和ova处理的小鼠之间的log2(倍数变化)值进行注释。每个通路的富集(p值)和预测激活值(z分数)写在每个矩形上。符号形状和颜色对应于模块成员:青绿色:灰色:菱形,褐色:灰色圆,蓝色:空心圆,以及黄色:空心方块。
25.图16:是三个实验(#100、101、113)中未加权unifrac beta多样性的pcoa图,示出了来自用bv(使用或不使用ova)(1或2.25mg/小鼠x 14次处理)、或单独的ova、或pbs鼻内处理的小鼠肠道微生物群样本的聚类。所有的处理彼此显著不同(q<0.05;permanova)。
26.图17:左侧示出了图16中所示的所有组和样本在门级别的分类学图,这证明了群落的差异;右侧示出了图16中所示的所有组和样本的alpha多样性,通过观察到的esv和香农多样性指数(shannon diversity index)来衡量,其中方框代表25
‑
75%的四分位数,而条代表95%的置信区间。
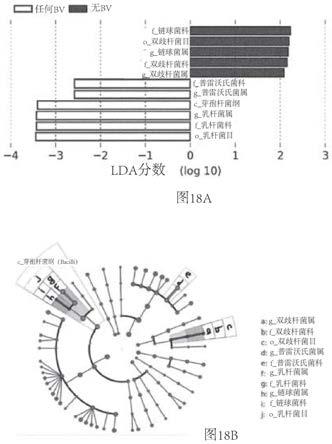
27.图18:在(a)中示出了来自图16和17中的样本的线性判别分析效应大小(lefse),分为两组:任何bv(仅bv/ova和bv)和无bv(仅ova和仅pbs),示出了每个组中富集的分类群,如通过颜色所示的。该分析使用q<0.05和lda分数>2的截止值(cutoff)揭示了多个分类学级别之间的差异特征。(b)每个差异分类群的系统发育表示。(g,属;f,科;o,目;c,纲)。
具体实施方式
28.因此,本发明提供了一种在有需要或有患哮喘、哮喘恶化、过敏性哮喘病症、喘鸣相关症状以及微生物群相关疾病的风险的受试者中治疗和/或预防此类疾病的方法,包括给予治疗有效量的bv细菌提取物,所述细菌提取物可通过革兰阳性或革兰阴性细菌种的碱性裂解获得。所述细菌提取物可通过口服、鼻内或气管内途径给药。特别优选的给药途径包括鼻内和气管内途径。
29.哮喘病症可为激素抵抗型哮喘、嗜中性哮喘或非过敏性哮喘。过敏性疾病或病症可为嗜酸性粒细胞疾病或病症,特别是选自结节、嗜酸性粒细胞增多、嗜酸性粒细胞性风湿
病、皮炎和肿胀(nerds)的疾病或病症。
30.已证明根据本发明的bv细菌提取物的鼻内和气管内给药途径特别有利于用于在有需要的受试者中用于治疗和/或预防和/或减轻哮喘、哮喘恶化、过敏性哮喘病症、喘鸣以及相关微生物群相关呼吸疾病的方法中。
31.申请人在下文的实施例中证明,以较低剂量给药bv细菌提取物提供了针对过敏性哮喘的有效保护,并且在赋予针对过敏原驱动的气道高反应性(ahr)和气道炎症的完全保护方面是有效的,在提供使用不同的肺气道炎症模型的嗜酸性粒细胞增多完全消除和中性粒细胞的保护作用增加方面是有效的。此外,申请人证明了,与经口服相比,通过鼻内或气管内途径的较低剂量的bv细菌提取物导致完全消除肺bal中嗜酸性粒细胞增多,并且显著降低几种th2细胞因子(其中包括il13和il5)水平。
32.特别地,鼻内或气管内给药允许使用较低剂量的bv细菌提取物,并且即使在所述较低剂量下,也已证明可诱导肠道微生物组内容物的有效重组,并提供针对过敏性哮喘的保护作用以及通过微生物组的变化显著减少过敏反应。
[0033]“bv细菌提取物”是指可通过一种或多种选自以下的病原体的碱性裂解获得的细菌提取物:卡他莫拉菌(moraxella catarrhalis)、流感嗜血菌(haemophilus influenzae)、肺炎克雷伯菌(klebsiella pneumoniae)、金黄色葡萄球菌(staphylococcus aureus)、肺炎链球菌(streptococcus pneumoniae)、酿脓链球菌(streptococcus pyogenes)和/或血链球菌(streptococcus sanguinis),如国际公开wo2008/109669所记载的。国际公开wo2008/109669中还记载了通过碱性裂解(优选ph大于10)制备的bv细菌提取物的制备方法。优选地,所述bv细菌提取物可包含用于治疗呼吸系统病症的以商标broncho
‑
市售的上文列出的所有病原体的组合。
[0034]
通常,bv细菌提取物是通过发酵、然后热灭活以及碱性裂解和过滤来制备。发酵、碱性裂解和过滤现在是本领域公知的,并且如尤其是在国际公开wo2008/109669中记载的。
[0035]
发酵通常是通过在培养基中使每个菌株生长至合适的光密度来进行。对于每个菌株,为了获得足够量的材料,发酵培养可从工作种子批(working seed lot)起始,然后接种到更大的发酵容器中。例如,发酵可从小规模培养(例如0.1至1.0升)起始,在30至40℃(例如37℃)下培育约3至6小时,以获得在700nm下的3.0至5.0的光密度(od)。在小规模培养步骤之后,可在一个或一系列更大的发酵罐中在30℃至40℃下进行另外的培养,持续3小时至20小时,例如3
‑
10小时或8小时。
[0036]
培养基优选地为不造成朊病毒相关疾病(即,疯牛病、绵羊疯痒病(scrapie)和克雅氏病(creutzfeld
‑
jacob disease))或其他疾病风险的培养基,因此不包含基于动物的材料,例如取自动物(如牛或绵羊)或任何其他可传播基于朊病毒的疾病的动物的血清或肉提取物。例如,可使用非动物培养基,例如基于植物的培养基,例如基于大豆的培养基,或合成或半合成培养基。替代地,可使用采用马血清的培养基或包含取自不传播朊病毒疾病的动物物种的材料的培养基。培养基还可包括生物提取物,例如酵母提取物和马血清,它们也不会造成所述疾病风险。还可引入补充生长因子以促进某些细菌种的生长。
[0037]
发酵后,来自每个菌株或组合菌株的生物质通常通过热处理灭活、浓缩和冷冻。
[0038]
碱性裂解用于在碱性条件下裂解细菌细胞,并且通常使用有机或无机碱进行。碱性裂解可在碱性条件下对单一细菌生物质或细菌生物质或发酵批次的混合物进行,通常使
用(例如来自naoh的)氢氧根离子的浓缩溶液。碱性裂解可优选地在大于约10的ph值下进行,其中ph值的变化为
±
0.1。裂解的持续时间可由本领域技术人员评估,并且取决于初始细菌生物质的量。裂解可在30至60℃(例如30
‑
40℃),或35
‑
40℃(例如37℃)的温度范围内进行。通常,当根据目视观察,细菌细胞似乎全部已被破坏时,停止裂解,因为这是本领域技术人员公知的。当使用同一细菌属的一种以上菌株时,这些菌株可一起裂解或单独裂解。因此,可在裂解之前或之后混合所述菌株。
[0039]
然后,通过离心和/或过滤来纯化裂解产物,以除去大的细胞碎片或任何未充分降解的组分、任何不溶性或颗粒物质,从而获得可溶性细菌提取物。纯化(包括离心和过滤)是本领域中公知的,以从提取物中除去颗粒物质。例如,裂解产物可在9000g下离心,然后进行一轮或多轮过滤。通常,过滤可包括使提取物或提取物的混合物通过一个或多个过滤器,例如微过滤器(即微滤)或超滤器(即超滤),其可在数次通过或循环中重复。例如,可在较大孔过滤器上进行连续多轮过滤,然后使用较小孔过滤器(例如0.2微米过滤器)进行微滤。也可采用超滤以有助于从提取物中提取可溶性物质,例如,再循环超滤渗透物以进一步微滤。切向流过滤(tff)方法可用于过滤提取物并从较大的细胞碎片中提取溶解的分子。这在本领域中是公知的,并且特别记载于wayne p.olson(separations technology,pharmaceutical and biotechnology applications,interpharm press,inc.,buffalo grove,il,u.s.a.,第126
‑
135页)中。
[0040]
迄今为止,已将bv细菌提取物经口服给药至患者,以预防成人和儿童的呼吸道感染。几项临床试验已经证明,bv细菌提取物的肠内给药(经口服)能够预防儿童急性呼吸道疾病引起的过敏性哮喘和喘鸣发作。所述bv细菌提取物已经以商品名broncho
‑
商业化。bv细菌提取物药物为固体形式,一般为胶囊剂,其经口服给予患者,剂量方案为用于成人治疗的每天一粒胶囊的7mg冻干细菌提取物,用于儿童的每天一粒胶囊的3.5mg冻干细菌提取物。
[0041]
根据一个优选的实施方案,本发明涉及在有需要的受试者中治疗和/或预防哮喘、哮喘恶化、过敏性哮喘病症、喘鸣相关症状、微生物群相关病症的方法,包括通过鼻内或气管内途径给予治疗有效量的bv细菌提取物。本发明还涉及bv细菌提取物,其用于在有需要的受试者中治疗和/或预防哮喘、哮喘恶化、过敏性哮喘病症、喘鸣相关症状、微生物群相关病症的方法中,其中所述bv细菌提取物通过鼻内或气管内途径给予所述受试者。
[0042]
bv细菌提取物的鼻内或气管内给药特别适用于在人类受试者中治疗和/或预防哮喘、哮喘恶化、过敏性哮喘病症和/或喘鸣相关症状和/或与微生物群相关病症相关的病症,哮喘受试者中保护性微生物群的重组,以及健康受试者中微生物群向保护性免疫的组织(oragnization)。
[0043]
术语“微生物群”是指共栖、共生和/或病原微生物的群落。微生物(microbes或micro
‑
organisms)实际上生活在生态圈的各个部分中,并且遍布人的体内和体表,包括鼻腔、口腔、阴道、皮肤、胃肠道和泌尿生殖道的粘膜内衬。术语“微生物组”是指宿主特定身体区域(“栖息地”)内微生物的完整集合以及这些微生物的遗传信息。每种类型的微生物可在微生物生存的环境中产生不同作用。例如,可存在于哺乳动物生物体表和体内的微生物群的组成可影响免疫功能、营养处理和生理学的其他方面。微生物群的组成可随时间而变化,并且可受到年龄、饮食、抗生素暴露和其他环境影响的影响。当不同的微生物种产生大致相
同的作用时,认为微生物群具有一定的功能冗余。产生类似作用的微生物种的增加或减少对于微生物群对哺乳动物系统的生理学的整体作用可几乎没有影响。然而,某些微生物种(即使少量存在)的增加或减少可对哺乳动物生理学产生显著影响。
[0044]
术语“微生物组失衡”或“生态失调”是指其中系统的有益和有害微生物失衡的状态。当有益微生物种的多样性较低和/或微生物群中缺乏有益微生物的功能冗余时,会发生生态失调。当被认为对系统产生有益作用的微生物物种至少不等于被认为对系统产生有害作用的微生物物种时,就说已经产生了微生物失衡。通常,在生态失调的情况下,微生物组特征显示改变的微生物组的重组和乳酸菌(lactobacillus)分类群的增加。
[0045]
本发明还涉及一种治疗和预防此类疾病的方法,以及所述疾病与人类受试者中微生物群相关病症的经证实的联系,限于哮喘受试者中保护性微生物群的重组以及健康受试者中其向保护性免疫的组织。
[0046]
在过去几年中,一项大型国际计划——由国立卫生研究院(national institutes of health)称为人类微生物组计划(hmp)并更广泛地称为国际人类微生物组联盟(international human microbiome consortium)(ihmc)——旨在表征生活在人体内和体表的微生物(参见http://hmpdacc.org/data_browser.php)。在大肠中,估计有100万亿微生物存在,这些微生物在代谢食物、药物和不被上胃肠道(gi)吸收的膳食补充剂方面发挥着重要作用。此外,其中这些微生物中的一些制造维持健康所必需的必需营养素和维生素。肠道环境中的这些微生物相互作用在人类宿主的代谢调节、行为调节和免疫调节系统的信号传导中发挥着关键作用。
[0047]
微生物组包括共栖、共生和致病细菌、真菌和病毒,它们形成一个生态实体,并与自身及其特定宿主相互作用。长期以来,认为微生物群定殖仅限于诸如皮肤和胃肠道的体表。然而,近年来,明确了微生物存在于几乎所有人体组织中,包括乳腺、卵巢、子宫、胎盘和肺。因此,人体定殖有数以万亿计的微生物居住者。它们构成多样化且个体不同的生态群落,其还随着年龄而变化。
[0048]
多种微生物组与多种病理状态的发病机理直接相关,如哮喘、哮喘恶化、过敏性哮喘病症和喘鸣相关症状。
[0049]
因此,上述实施方案中描述的bv细菌提取物有益于恢复天然微生物组,并且特别适用于治疗和/或哮喘、哮喘恶化、过敏性哮喘病症、喘鸣相关症状、微生物群相关疾病。
[0050]
所提供的治疗有效量的bv细菌提取物使得受试者的微生物组的特征或模式与健康受试者的微生物组的特征或模式更相似,从而治疗和/或预防与微生物组失衡相关的任何病理状态。可通过限制有害微生物同时促进有益微生物的发育来建立或重建被认为更健康的系统。在这种情况下,促进了生态平衡状态,其中系统内的有益微生物具有主导作用,因为系统中有益微生物物种具有高度多样性和/或功能冗余。
[0051]
bv细菌提取物可以以任何适于口服给药的形式存在,例如固体或液体形式,并且可配制为丸剂、片剂、薄膜片剂、包衣片剂、胶囊剂、糖浆剂、粉剂和/或沉积物剂(deposit)。
[0052]
根据一个优选的实施方案,bv细菌提取物可以以适于鼻内和气管内给药的任何形式(液体、气体或固体形式)存在。当bv细菌提取物以液体或气雾剂形式存在时,它们可配制成喷雾剂(spray)、滴剂、胶体剂、薄雾剂(mist)、喷雾剂(nebulae)或雾化蒸气剂。替代地,它们可以以固体形式存在,然后配制成粉剂或可压碎的片剂。
[0053]
当bv细菌提取物制品是通过鼻内途径给药时,它们优选地为选自乳剂、悬液剂、胶体形式、薄雾剂、喷雾剂(nebulae)、雾化蒸气剂或喷雾剂(spray)、滴剂、胶体剂、薄雾剂、喷雾剂(nebulae)、雾化蒸气剂的形式、鼻塞剂、鼻乳剂、粉剂、软膏剂(ointment)、乳膏(cream)、洗剂、凝胶剂、糊剂、油膏剂(salve)、溶液剂、酊剂、贴剂(patch)、生物粘附条。
[0054]
当bv细菌提取物制剂是通过气管内途径给药时,递送需要将固体或液体雾化,并将气雾剂通过口和喉递送至肺。bv细菌提取物的颗粒可以以干粉气雾剂或液体气雾剂形式给药至肺。干粉气雾剂通常使用干粉吸入器(dpi)吸入装置给药至肺。干粉吸入器可包括呼吸驱动的干粉吸入器,例如在美国专利7,434,579中记载的。定量吸入器包含在密实的加压气雾剂分配器中悬于推进剂、推进剂混合物,或溶剂、推进剂和/或其他赋形剂的混合物中的药物。mdi产品可排放最高达数百个计量剂量的bv细菌提取物。每次致动可包含几微克(mcg)至最高达几毫克(mg)的活性成分,其递送体积通常为25至140微升。
[0055]
另一种类型的液体气雾剂分散装置为喷雾器(nebulizer),其使用喷射器(jet)、振动网或其他装置来雾化含有bv细菌提取物颗粒的悬液。
[0056]
在液体、半固体、固体和喷雾药物的制备中,如果需要,bv细菌提取物可与任何添加剂一起配制,例如赋形剂、粘合剂、香料、调味剂、甜味剂、着色剂、防腐剂、抗氧化剂、稳定剂和表面活性剂。
[0057]
为了制备上述药物制剂,可根据常规药物配制技术将bv细菌提取物与药学上可接受的载体、佐剂和/或赋形剂混合。可用于本组合物的药学上可接受的载体包括任何标准药学载体,例如磷酸盐缓冲盐水溶液、水和乳剂(例如油/水或水/油乳剂),以及各种类型的润湿剂。该组合物还可含有固体药物赋形剂,例如淀粉、纤维素、滑石、葡萄糖、乳糖、蔗糖、明胶、麦芽、稻、面粉、白垩、硅胶、硬脂酸镁、硬脂酸钠、单硬脂酸甘油酯、氯化钠、脱脂乳粉等。液体和半固体赋形剂可选自丙三醇、丙二醇、水、乙醇,以及各种油,包括石油、动物、植物或合成来源的油,例如花生油、大豆油、矿物油、芝麻油等。液体载体、特别是可注射溶液,包括水、盐水、葡萄糖水溶液和二醇。对于载体、稳定剂和佐剂的实例,参见由e.w.martin编辑的remington's pharmaceutical sciences(mack publishing company,第18版,1990)。细菌提取物制剂还可包括稳定剂和防腐剂。
[0058]
在某些实施方案中,需要延长在鼻腔中的停留时间,例如以增强吸收。因此,bv细菌提取物可任选地与以下组分一起配制:生物粘附聚合物、树胶(例如黄原胶)、壳聚糖(例如,高度纯化的阳离子多糖)、果胶或任何在施用于鼻粘膜时增稠(如凝胶)或乳化的碳水化合物、微球(例如淀粉、白蛋白、葡聚糖、环糊精,或其衍生物)、明胶、脂质体、卡波姆(carbamer)、聚乙烯醇、藻酸盐、阿拉伯胶、壳聚糖和/或纤维素(例如,甲基或丙基;羟基或羧基;羧甲基或羟丙基)。
[0059]
替代地,bv细菌提取物制剂可配制成可压碎的片剂。片剂可整个给药,或轻压碎(例如用手指按压),然后撒在适当的载体上。可使用直接压制方法和赋形剂制备可压碎的片剂,在该方法中要小心以避免损坏单个亚单位(subunit)的包衣。制备可压碎的片剂的合适赋形剂包括通常用于咀嚼片剂的那些,包括单糖和二糖、糖多元醇等,或其组合。示例性的赋形剂包括甘露糖醇、山梨糖醇、木糖醇、麦芽糖醇、乳糖、蔗糖、麦芽糖或其组合。任选的药物赋形剂(例如稀释剂、润滑剂、助流剂、调味剂、着色剂等或包含至少一种前述物质的组合)也可包含在压制基质中。可使用制药领域已知的片剂制造方法制备可压碎的片剂。
[0060]
bv细菌提取物制剂还可以以胶体的形式存在,其包含例如金属卤化物,最优选卤化银。bv细菌提取物和佐剂可掺入胶体颗粒内或被胶体颗粒包封。替代地,或另外地,一种或多种细菌提取物和佐剂可附着至胶体颗粒的表面。例如,蛋白质容易通过与疏水性颗粒表面的疏水相互作用吸附或附着在颗粒上,并取代一些中性乳化剂。
[0061]
bv细菌提取物的合适剂量将根据受试者的健康状况、年龄和物种而变化,并且本领域技术人员可容易地确定。然而,根据本发明,总的日剂量可为0.005至2mg,优选0.05至1mg,最优选0.5至1mg,并且这些可以单次或分次剂量形式给药,此外,当发现有指征时,上限也可超过2mg。
[0062]
bv细菌提取物可通过以下装置鼻内给药:鼻吹入装置、鼻内吸入器、鼻内喷雾装置、雾化器(atomizer)、鼻喷雾瓶、单位剂量容器、泵、滴管、挤压瓶、喷雾器(nebulizer)、定量吸入器(mdi)、加压剂量吸入器、吹入器、双向装置、剂量安瓿、鼻垫、鼻海绵和鼻胶囊。还提供了一种递送装置,其用于在有需要的受试者中治疗和/或预防哮喘、哮喘恶化、过敏性哮喘病症、喘鸣相关症状、微生物群相关病症的方法中。
[0063]
此类递送装置可选自鼻吹入装置、鼻内吸入器、鼻内喷雾装置、雾化器、鼻喷雾瓶、单位剂量容器、泵、滴管、挤压瓶、喷雾器、定量吸入器(mdi)、加压剂量吸入器、吹入器、双向装置、剂量安瓿、鼻垫、鼻海绵、鼻胶囊等。
[0064]
鼻喷雾剂可为液体、固体鼻喷雾剂,用于以气雾剂或非气雾剂形式给药。鼻递送装置可进行计量,以将准确有效剂量的bv细菌提取物给药至鼻腔。鼻递送装置可用于单个单位递送或多个单位递送。治疗有效量的如以上发明定义的bv细菌可通过管、导管、注射器、包尾(packtail)、拭子、鼻塞或通过粘膜下输注递送,如美国专利公开us 2009/0326275、2009/0291894、2009/0281522和2009/0317377中所描述的。
[0065]
当用气雾剂进行鼻内或气管内给药时,气雾剂喷雾可例如从具有合适推进剂的加压容器产生,所述推进剂为例如二氯二氟甲烷、三氯氟甲烷、二氯四氟乙烷、碳氢化合物、压缩空气、氮气、二氧化碳或其他合适的气体。剂量单位可通过提供阀门以递送计量的量来确定。泵式喷雾分配器可分配计量的剂量或具有特定颗粒或液滴尺寸的剂量。如本文所用,术语“气雾剂”可是指液滴或固体粉剂在空气(或气体)中的悬液或分散液。液滴可由药物在液体(例如水或非水溶剂)中的溶液、悬液和分散液形成。气溶胶可吹入或通过鼻子吸入。气雾剂可在任何合适的装置中产生,例如mdi、喷雾器或弥雾机(mist sprayer)。
[0066]
通常,可使用合适的机械设备吹入气雾剂。在一些实施方案中,装置可包括储存器和喷雾器,其为经改造适于以喷雾的形式排出药物剂量的装置。若干剂量的待给药的bv细菌提取物可包含在储存器中,任选地在液体溶液或悬液中或在固体颗粒制剂(例如固体颗粒混合物)中。
[0067]
替代地,可使用喷雾器装置。这些装置产生高速空气流,使bv细菌提取物以液体形式给药,以薄雾剂(例如微粉化颗粒)形式喷雾,其中90%或更多的颗粒具有小于约10的直径。
[0068]
根据本发明的用于鼻内或气管内给予bv细菌提取物的另一种递送装置可为dpi装置,其通常以自由流动的粉剂形式给予治疗有效量,所述粉剂可在吸气期间分散在患者的气流中。在本发明中还可使用采用外部能源的dpi装置。为了获得自由流动的粉剂,bv细菌提取物可与合适的赋形剂(例如乳糖)一起配制。干粉制剂可例如通过将粒度为约1μm至100
μm的干乳糖与bv细菌提取物的微粉化颗粒组合并干混来制备。替代地,可在不使用赋形剂的情况下配制bv细菌提取物。将制剂装入干粉分配器,或装入与干粉递送装置一起使用的吸入药筒或胶囊中。商业提供的dpi装置的实例包括diskhaler(glaxosmith line,research triangle park,n.c.)(美国专利5,035,237)、diskus(美国专利6,378,519;turbuhaler(美国专利4,524,769)和rotahaler(美国专利4,353,365)。合适的dpi装置的其他实例记载在美国专利5,415,162;5,239,993和5,715,810中。
[0069]
mdi装置通常使用压缩推进剂气体排放治疗有效量的bv细菌提取物。用于mdi给药的制剂包括活性成分在液化推进剂中的溶液或悬液。将制剂装入气溶胶罐中,所述气溶胶罐构成mdi装置的一部分。推进剂的实例包括氢氟烷烃(hfa),例如1,1,1,2
‑
四氟乙烷(hfa 134a)和1,1,1,2,3,3,3
‑
七氟正丙烷(hfa 227),和氯氟烃,如cc13f。用于mdi给药的hfa制剂的其他组分包括共溶剂(例如乙醇、戊烷、水);和表面活性剂(如脱水山梨糖醇三油酸酯、油酸、卵磷脂和丙三醇)。mdi装置已记载于特别是美国专利5,225,183和国际公开wo92/22286中。
[0070]
当bv细菌提取物为粉剂形式时,其可使用鼻吹入器通过根据本发明的鼻内或气管内途径给药。通常,其还可吸附至固体表面,例如载体,并从而以粉剂形式(如微球)递送至鼻腔。粉剂或微球可储存在吹入器的容器中,然后可以以干燥的、可空气分配的形式给药。替代地,可将粉剂或微球填充至胶囊(例如明胶胶囊)或其他适于鼻腔给药的单剂量单元。
[0071]
当本发明的bv细菌提取物是通过鼻喷雾施药器(applicator)递送时,它们可放置在鼻内喷雾给药装置或雾化器中,并且可通过将其喷入受试者的鼻孔中以递送至鼻孔粘膜来施用。对于鼻内喷雾剂,可施用最高达约200微升、约50至约150微升,或约75至约120微升。可对一个或多个鼻孔给药,并且可根据需要或如果必要以一定频率施用。可向鼻孔中给药第一剂量,以微升计。在一定量的液体已被吸收的适当时间后,可将第二剂量依次给药至同一鼻孔或可给药至不同的鼻孔。可交替向鼻孔施用另外的计量喷雾剂,直到对患者给予全部目标治疗剂量。在将苯二氮杂卓(benzodiazepine)药物施用到同一鼻孔之间,可有几秒至5分钟的时间增量,优选约10秒至约1分钟。这使药物有时间穿过鼻粘膜并进入血流。对每个鼻孔多次施用计量喷雾剂——任选地以一定时间间隔分开——允许以足够小的增量给药全部治疗剂量,以允许组合物完全吸收到血流中并避免药物在喉咙后部损失。
[0072]
bv细菌提取物还可包含佐剂、药学上可接受的溶剂和渗透促进剂。例如,对于鼻内递送,渗透促进剂可增强组合物渗透通过鼻粘膜。在一些实施方案中,含有一个或多于一个羟基的化合物可用作渗透促进剂。这些含羟基化合物中的一些也可用作组合物中的溶剂。可用作渗透促进剂的含羟基化合物的非限制性实例包括醇(例如乙醇)、二醇(例如丙二醇,也称为1,2
‑
丙二醇、1,3
‑
丙二醇;丁二醇,包括1,3
‑
丁二醇、1,2
‑
丁二醇、2,3
‑
丁二醇和1,4
‑
丁二醇;己二醇(hexylene glycol);二丙二醇、1,5
‑
戊二醇、1,2
‑
戊二醇、1,8
‑
辛二醇、己二醇(etohexadiol)、对薄荷烷
‑
3,8二醇、2
‑
甲基
‑
2,4
‑
戊二醇)、三醇(例如丙三醇)、多元醇(例如含有多个羟基的合适聚合物,包括聚乙二醇或peg、聚丙二醇、聚山梨醇酯和脱水山梨糖醇酯;和合适的糖醇)、环醇(例如松醇、肌醇)、环二醇(例如环己二醇)、芳族二醇(例如对苯二酚、双酚a、间苯二酚和儿茶酚)。
[0073]
本领域普通技术人员将认识到,本教导也适用于其他渗透促进剂。这些可包括简单的脂族不饱和或饱和酯。所述酯的非限制性实例包括肉豆蔻酸异丙酯、肉豆蔻酸肉豆蔻
酯、棕榈酸辛酯等。其他渗透促进剂的非限制性实例包括醇(例如,短链和长链醇)、多元醇、胺和酰胺、脲、氨基酸及其酯、酰胺、氮酮或吡咯烷酮及其衍生物、萜烯、脂肪酸及其酯、大环化合物、亚砜、表面活性剂、苄基二甲基氯化铵、十六烷基三甲基溴化铵、桉叶素(cineole)、椰油酰胺丙基甜菜碱、椰油酰胺丙基羟基磺基甜菜碱、十二烷基氯化吡啶鎓、十二烷基胺、十六烷基三甲基氨丙烷磺酸盐、柠檬烯、亚油酸(oa)、亚麻酸(la)、薄荷醇、月桂酸甲酯、甲基吡咯烷酮、n
‑
癸基
‑2‑
吡咯烷酮、nls、硫酸烟碱、壬基
‑
l,3
‑
二氧戊环、辛基三甲基溴化铵、油基甜菜碱、pp、聚乙二醇十二烷基醚、聚氧乙烯脱水山梨糖醇单月桂酸酯(tween 20或聚山梨醇酯20)、sla、油酸钠、月桂基硫酸钠、辛基硫酸钠(sos)、脱水山梨糖醇单月桂酸酯(s20)、丁卡因和triton x
‑
100。
[0074]
可用于本发明的药学上可接受的溶剂的实例可在参考书中找到,例如handbook of pharmaceutical excipients(fifth edition,pharmaceutical press,london and american pharmacists association,washington,2006)。可用于本组合物的药学上可接受的溶剂的非限制性实例包括但不限于丙二醇(例如1,2
‑
二羟基丙烷、2
‑
羟基丙醇、甲基乙二醇、甲基乙二醇或丙烷
‑
1,2
‑
二醇)、乙醇、甲醇、丙醇、异丙醇、丁醇、丙三醇、聚乙二醇(peg)、乙二醇、cremophor el或任何形式的聚乙氧基化蓖麻油、二丙二醇、二甲基异山梨醇、碳酸丙烯酯、n
‑
甲基吡咯烷酮、糖原质、四乙二醇、丙二醇脂肪酸酯及其混合物。
[0075]
本发明还提供包含如上文所述的bv细菌提取物的试剂盒,或用于包含bv细菌提取物的递送装置,以及包含使用说明书的药品说明书(package insert)。
[0076]
第一组实验:哮喘保护
[0077]
实施例1
[0078]
不同剂量的bv细菌提取物对ova诱导的哮喘模型的作用
[0079]
在两个单独的实验(研究1和2)中,在麻醉后使用鼻内途径测试了4只小鼠/组,其中6种剂量的bv细菌提取物(或下文中称为bv):
[0080]
‑
研究1:5
‑
50
‑
1000微克/处理x 14次处理。
[0081]
‑
研究2:1
‑
10
‑
100
‑
1000
‑
2250微克/bv处理x 14次处理。
[0082]
方案选自在建立卵清蛋白诱导的(ova)哮喘模型期间进行的先前研究,使用不同的amish dust疗程(stein et al.,n engl j med 2016;375:411
‑
421)。bv的剂量源自先前使用病毒感染模型的优化研究,并在此实验方案中扩大至最高达1和2.2mg/剂量。
[0083]
为此,第1阶段设计了剂量反应实验,其中从第0天至第32天每2
‑
3天通过鼻内/吸入(i.n.)途径处理ova免疫的小鼠(总共14次),其中增加bv细菌提取物的剂量(1、5、10、50、100或1000微克/小鼠/处理)。在一个探索容量(exploratory capacity)实验中,推荐1mg/小鼠的剂量。
[0084]
在第2阶段,采用相同的方案以进一步测试具有最佳效果的bv浓度(1000微克/小鼠/处理),并添加更高剂量(2250微克/小鼠/处理)以评估是否可达到最大保护的平台期。
[0085]
ova诱导的哮喘动物模型
[0086]7‑
8周龄雄性balb/c小鼠购自envigo(united states),并在bio5研究所(bio5 institute)动物设施中保持在无特定病原体的条件下。喂给动物标准的低过敏性饮食。
[0087]
在图1的方案实施例中,bv细菌提取物浓缩物在0.9%盐水中稀释。ova模型改编自stein m等人的参考文献。简而言之,从第0天至第32天,将bv细菌提取物(1、5、10、50、100、
1000微克/小鼠/处理于25μl(微升)盐水中)在轻度异氟醚麻醉下每2
‑
3天(共14次)鼻内(i.n.)均匀滴入7
‑
8周龄balb/c小鼠(envigo)的两个鼻孔,在第0天和第14天将所述小鼠用卵清蛋白(ova:v级,sigma,20微克)
‑
alum(pierce)通过腹膜注射(i.p.)致敏,并在第28天和第38天使用ova(50微克)i.n.激发。一组小鼠在处理、致敏和激发时接受盐水。在实验3中,对一组小鼠进行假处理(sham treat)。
[0088]
第39天的终末评估包括使用非详尽的读数:1)ahr的侵入性测量;2)差异的支气管肺泡灌洗(bal)细胞构成;3)肺细胞因子rna和蛋白质水平;4)分析选定的肺细胞群;5)测定血清ova特异性ige。
[0089]
在最初的探索性实验(研究1和研究2)中,在用氯胺酮和甲苯噻嗪(分别为100和10mg/kg)麻醉并用泮库溴铵(4μg/g)麻痹的动物中评估了气道阻力对雾化乙酰甲胆碱浓度增加(0
‑
40和0
‑
60mg/ml)的响应。自由解剖气管,并用20号套管(bd)插管,并用单扎线(single tie suture)固定就位。然后将小鼠连接至小型呼吸机(flexivent fx,scireq,inc.),并以10ml/kg的潮气量、66.67%的吸气/呼气比、150/min的呼吸频率和30cm h2o的最大压力进行通气。在使用最佳bv细菌提取物浓度(1,000微克/小鼠/处理,研究3)的最终实验中,测量响应于静脉内给药的乙酰胆碱的剂量增加(0
‑
1微克/小鼠)的气道阻力。bal是通过气管插管将溶于pbs中的冷1%bsa(2ml)中递送到气道中并轻轻吸出液体获得。使用countess ii fl自动细胞计数器(thermo fisher scientific)对细胞进行计数,并在用hema 3(fischer)染色并检查至少400个细胞/载玻片后,由对小鼠id/分组不知情的操作员确定差异。bal细胞因子(il
‑
5、il
‑
13、il
‑
17)是通过elisa(r&d)进行测量。统计学分析:
[0090]
使用非配对的、双尾学生t检验评估所有参数的统计学差异。p值<0.05具有统计学意义。
[0091]
实施例2
[0092]
在ova哮喘模型中鼻内给药bv细菌提取物的作用的说明性实施例。
[0093]
根据实施例1中描述的实验方案监测基于bal嗜酸性粒细胞增多的功效,以百分比表示。为了评估bv细菌提取物在减少与肺气道高反应性(ahr)保护相关的嗜酸性粒细胞增多方面的功效,使用各种剂量的bv进行两个单独的实验。达到了减少嗜酸性粒细胞增多(y轴)的最佳功效,其中在1mg bv的剂量下具有显著抑制。无论使用何种剂量,安慰剂组中完全没有嗜酸性粒细胞增多作用也证实了bv在非患病动物中的安全使用。bv的鼻内/吸入递送抑制了哮喘诱导的肺部炎症的主要细胞表型。
[0094]
实施例3
[0095]
与实施例2中相同的数据组,但源自不同的实验,并且其中来自bal的嗜酸性粒细胞增多含量表示为细胞含量(图3a)和分子含量(图3b)。如在实施例2中那样,bv细菌提取物诱导了bal嗜酸性粒细胞增多的抑制,其中在1mg剂量下具有显著抑制。考虑到在bal中在细胞数量方面ova的高嗜酸性粒细胞增多诱导(>800’000个细胞),对于此类产品种类而言,嗜酸性粒细胞增多的几乎完全且非常显著的(p=0.005)消除是预料不到的。
[0096]
实施例4
[0097]
图4中所示的两组实验的代表性实例,并且证明了bv细菌提取物对ahr的保护,其中在1mg剂量下获得最佳的保护作用。图2和图3中所示的嗜酸性粒细胞增多的伴随消除以及肺ahr的功能关闭证明并验证了鼻内给药的bv细菌提取物在已明确建立的过敏性哮喘模
型中提供保护的能力,并证明1mg/天/小鼠x 14次处理的剂量足以赋予针对过敏原驱动的ahr和气道炎症的最佳保护。即使将bv给药至成年小鼠,而不是新生小鼠或幼鼠,并且其给药开始于暴露于过敏原的同时而不是之前,使用该方案实现的保护作用仍是显著的。此外,在用bv(ova/bv)处理的ova组中,肺组织中几乎没有气道炎症杯形细胞示出于图5a中并在图5b中量化为高碘酸希夫(pas)
粘液分泌细胞的高度显著的降低(p=0.00003),在功能上证实了图4中对ahr的保护。
[0098]
实施例5
[0099]
方案(图6)代表在链格孢属过敏性哮喘模型中鼻内(i.n.)bv细菌提取物的实验设定,使用每天1mg剂量遵循14次给药方案,如所示出的。
[0100]
实施例6
[0101]
使用bal差异监测在链格孢属过敏性哮喘模型中鼻内给予bv细菌提取物的作用。
[0102]
在图7中,通过使用的1mg剂量(14次)的bv细菌提取物,对bal内容物中嗜酸性粒细胞增多的抑制达到约40%,如图6所示。考虑到这种人可转化的哮喘模型的高度相关性(相同的鼻内致敏和激发途径,不使用佐剂),这些结果清楚地示出了bv细菌提取物在过敏引起的哮喘中赋予保护的能力。
[0103]
balb/c小鼠(4
‑
6只/组)使用链格孢属(greer实验室:50μg干重,溶于50μl pbs中的10μg蛋白质)在第0天和第1天鼻内致敏,并在第17、18和19天使用链格孢属(25μg干重,溶于50μg中的5μg蛋白质)鼻内激发。
[0104]
从第
‑
10天起每2天给药bv(浓缩物,溶于50μl中的1mg(每个鼻孔25μl),持续14次。在第20天进行终末评估。bal液体是通过气管插管将溶于pbs(2ml)中的冷1%bsa递送到气道中并轻轻吸出液体获得。使用countess ii fl自动细胞计数器(thermo fisher scientific)对细胞进行计数,并在用hema 3(fischer)染色并检查至少400个细胞/载玻片后,由对小鼠id/分组不知情的操作员确定差异。
[0105]
实施例7
[0106]
示出了图8中所示的功能功效相关性的代表性实例,其中肺功能作为读数。bv细菌提取物显著地预防了呼吸系统阻力(rrs)反应,其中在所有测试点中,1mg剂量的功效最佳。ahr的显著降低表示为相对于链格孢属。
[0107]
在用氯胺酮和甲苯噻嗪(分别为100和10mg/kg)麻醉的动物中评估了响应于乙酰甲胆碱浓度增加(0
‑
2μg/g小鼠)的气道阻力。将小鼠切开气管,并将18号金属套管插入气管,并通过牢固系紧的缝合线防止漏气。气管插管连接到计算机控制的用于小型动物的呼吸机(flexivent,scireq inc.,canada),并以150次呼吸/min的呼吸频率、10ml/kg的潮气量和3cmh2o的呼气末正压(positive end expiratory pressure,peep)进行机械通气。将动物置于暖垫上以保持体温,并用泮库溴铵(1mg/kg,腹膜注射)使动物麻痹。为了标准化肺体积历史,将肺充气两次至30cmh2o的压力(肺复张方法(recruitment maneuver))。在室温下用盐水稀释的氯乙酰胆碱(ach)通过右颈静脉以0.25、0.5、1.0和2.0μg/g体重递增的剂量推注注射。盐水用作对照。每次ach给药后,立即开始测量,在5min内每30秒进行一次测量。测定每次给药ach后的峰值反应。使用恒定相位模型评估呼吸力学,该模型能够将呼吸特性划分为中枢和外周气道,并区分不同的组织特性。评估的参数是牛顿阻力(rn)和组织阻尼(g),其中牛顿阻力(rn)是近端传导气道阻力的相当准确的近似值,组织阻尼(g)与肺
组织阻力相关并反映了肺泡中的能量耗散。在恒定相模型中仅使用等于或大于0.9的决定系数(cod)。
[0108]
如图7所示出的,bal中嗜酸性粒细胞增多减少30
‑
40%与肺的功能读数完全相关,其中bv证实了在这种极度急性过敏性哮喘模型中对ahr的几乎完全保护。
[0109]
此外,bv对上皮细胞层紧密度的保护作用的监测——表示为teer(经上皮的电阻),屏障功能的量度——表明,bv可预防人支气管上皮细胞中应激和链格孢属诱导的损伤。这在图9中的气道细胞体外模型中得到证实,该模型使得能够使用16hbe14o
‑
细胞系研究药物转运(参考:forbes b,int j pharm.2003,257(1
‑
2),161
‑
167)。
[0110]
实施例8
[0111]
图10示出了图1中使用的方案但ova诱导的哮喘变化的代表性实例。该模型再次使用bv的预防方案——在此减少至8次给药(处理t1到t8),然后是两次连续的ova诱导的致敏和激发,其中时间减少(在第19天而不是第39天进行终末评估)。这种是使用较少处理的新设定也证实了bv对嗜酸性粒细胞增多的显著阻断。
[0112]
实施例9
[0113]
示出了bv对如图2所示的支气管肺泡灌洗(bal)嗜酸性粒细胞增多的作用,但源自图10中描述的修改的ova诱导方案,此处表示为百分比(左)和细胞计数(右)。图11示出了bv细菌提取物显著抑制嗜酸性粒细胞增多,同时显著增加bal中的嗜中性粒细胞募集。小鼠数量(n=4只小鼠/组),使用1mg/50μl。
[0114]
实施例10
[0115]
不同小鼠品系(c57bl6)中ova诱导的哮喘的评估。图12示出了图1中使用的方案但ova诱导的哮喘变化的代表性实例。该模型再次使用bv细菌提取物的预防方案——使用14次给药(处理t1至t14),然后是两次连续的ova诱导的致敏和三次ova激发。终末评估在第30天进行。
[0116]
实施例11
[0117]
实施例举例说明了在使用图12中描述并经修改以适用于c57bl6小鼠的方案的ova诱导的哮喘模型中,鼻内给药bv细菌提取物的作用。功效的监测是基于图13中表示为总bal细胞含量的百分比(y轴)的bal嗜酸性粒细胞增多。结果证明了,bv在减少与肺气道高反应性(ahr)的保护相关的嗜酸性粒细胞增多方面的功效。在1mg bv的剂量下,达到了减少嗜酸性粒细胞增多的最佳功效。
[0118]
实施例12
[0119]
在用ova和/或bv处理的小鼠中,与主要哮喘表型(ahr和bal嗜酸性粒细胞增多)密切相关的核心的肺表达基因在与th2和树突细胞迁移负相关的通路中聚类,如图14所示。
[0120]
从如图1所示的用pb、bv、ova或ova bv处理的27只balb/c小鼠收集未分级的肺组织,分离rna,并进行rna测序(rna
‑
seq)。估计了24,538个基因的表达数据,并过滤,以仅包括在20%的样本中具有至少一个读数的基因,这保留了总共19,613个基因。对所有19,613个基因的全肺表达数据进行加权基因共表达分析(wgcna),并使用签名网络算法构建共调节基因网络(模块)。使用模块特征基因(eigengene)载体(即模块的第一主要成分)总结每个模块内的表达数据,并使用皮尔逊相关性评估与保护相关的气道和免疫表型的相关性。独创性通路分析用于确定差异表达功能中关键生物学项(term)或功能的富集,其中负值对
应于预测的抑制,正值对应于预测的激活。
[0121]
图15中示出的wgcna确定了总共16个共调节基因网络(模块),其中仅4个与嗜酸性粒细胞增多和ahr紧密且显著相关(|皮尔逊相关系数r|>0.5,p≤0.001)。青绿色和褐色模块与ahr和嗜酸性粒细胞增多呈正相关,与bv ova治疗呈负相关(相对于ova),而蓝色和黄色模块与ahr和嗜酸性粒细胞增多呈负相关,与bv ova治疗呈正相关。对来自与嗜酸性粒细胞增多和ahr高度相关的褐色、青绿色、蓝色、绿色和黄色模块(n=333,图15左)的一个核心的基因的组进行的独创性通路分析(ipa)表明,受到bv ova干扰的基因不仅如预期的那样在与ahr和嗜酸性粒细胞运动相关的通路中聚类,还在与th2细胞和树突细胞迁移相关的通路中聚类。ipa预测了这些通路中的每一个均被下调。
[0122]
rna
‑
seq鉴定的dc相关的bv诱导的转录特征促使本发明人研究bv提取物体外给药对骨髓衍生dc(bmdc)的作用。ii类mhc和共刺激分子(cd40、cd80和cd86)的表达在bv处理的bmdc中受到强烈抑制。因此,本发明人想知道dc重新编程是否足以解释bv细菌提取物对过敏性哮喘的抑制作用。为此,将在体外用ova脉冲(pulse)2天的bmdc(进行或不进行使用bv提取物的2天预处理)通过鼻内转移至首次接受试验(naive)的balb/c小鼠,然后在10天后使用ova连续激发三天。ova脉冲的bmdc在这些动物中有效地诱发了实验性哮喘,如通过ahr所显示的,增加的bal嗜酸性粒细胞增多,以及肺和气道引流淋巴结中增加的2型细胞因子的表达。引人注目的是,使用bv细菌提取物预培养的bmdc足以强烈且显著地抑制所有这些过敏原驱动的反应,将dc确定为该模型中bv诱导的哮喘保护的主要目标。
[0123]
第二组实验:微生物群的变化
[0124]
实施例13:鼻内或气管内bv细菌提取物对鼠肠道微生物组的作用。
[0125]
在这些实验中,证明了bv细菌提取物直接诱导的保护作用。该保护作用通过受试小鼠肠道微生物群的变化介导。表明了在哮喘小鼠模型中bv细菌提取物的鼻内和气管内给药诱导肠道微生物群的变化,并认为有助于减少过敏反应。
[0126]
用bv细菌提取物(5、50、1000或2500微克/处理,每2天一次)或pbs鼻内处理小鼠,并用ova或pbs致敏和激发。收集粪便样本用于微生物组分析。
[0127]
与仅使用pbs的对照相比,在接受1000或2500微克/处理的bv细菌提取物(使用ova或pbs)(即任何高剂量的bv细菌提取物)的小鼠中观察到肠道微生物群落结构的显著变化,如通过beta多样性分析所示的(未加权的unifrac)(图16)。此外,与仅使用pbs处理的小鼠相比,任何高剂量的bv细菌提取物均使乳杆菌(lactobacillus)显著富集。
[0128]
这些数据清楚地表明,bv细菌提取物诱导了鼠肠道微生物群的显著变化。
[0129]
实施例14:使用高和低剂量bv细菌提取物鼻内处理的小鼠的肠道微生物组谱的影响。
[0130]
向小鼠给药14次鼻内剂量(1mg或2.25mg)的bv细菌提取物。ova致敏在第0天和第15天进行,ova激发在第28、38和39天进行。对照小鼠给药pbs而不是ova。在实验结束时(第39天),收集粪便颗粒(pellet)。用bv1000=1mg剂量或bv2250=2.25mg剂量处理pbs或ova激发的小鼠。从粪便颗粒中提取dna,其代表肠道微生物组。提取的dna送到argonne national laboratory,在illumina miseq上进行16s rrna扩增子测序。使用qiime2和r分析序列数据。进行线性判别分析效应大小(lefse)以揭示多个分类水平上的差异特征。该分析使用q<0.05且lda分数>2的截止值比较了两组样本:实验100、101和113中的任何bv(bv/
ova,以及仅bv,无论bv处理剂量如何)和无bv(仅ova和仅pbs)(图18)。不同特征之间的系统发育关系(g,属;f,科;o,目;c,类)在图17中表征。
[0131]
这些数据清楚地证明,鼻内bv细菌提取物能够保护抵御嗜酸性粒细胞增多和ahr,并且还使得受保护的小鼠的肠道微生物组的显著重组,其中增加了已知产生短链脂肪酸并与调节免疫/耐受有关的分类群(尤其是乳杆菌,图18a和图18b)。事实上,认为这些细菌的扩增有助于诱导t调节细胞,如本发明人在bv处理的、哮喘保护的小鼠中发现的。此外,16s rrna测序实验的结果清楚地证明了bv细菌提取物鼻内或气管内给药与免疫调节之间的联系。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。